Ссылки на родственную заявку
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США № 61/794906, поданной 15 марта 2013 г., раскрытие которой включено в настоящий документ во всей полноте посредством отсылки.
Область техники
Настоящее изобретение относится к фармацевтической дозированной лекарственной форме в виде мягкой желатиновой капсулы, предназначенной для введения во влагалище фармацевтического активного действующего вещества, содержащегося в наполнителе с улучшенными мукоадгезионными свойствами. Дозированная лекарственная форма в виде мягкой желатиновой капсулы согласно настоящему изобретению сохраняет целостность оболочки (твердость) и вязкость наполнителя на протяжении всего периода хранения.
Уровень техники
Мягкие желатиновые фармацевтические составы обладают несколькими преимуществами: например, их легко глотать, они скрывают запах и неприятный вкус и после проглатывания они обеспечивают быстрое высвобождение своего содержимого. Однако известно, что способность мягких желатиновых капсул к растворению во время хранения уменьшается, что, в конечном итоге, приводит к замедлению высвобождения лекарственного средства или к отрицательному воздействию на него. Уменьшение способности к растворению обычно объясняется образованием поперечных связей между молекулами желатина в оболочке капсулы, что приводит к образованию тонкой пленки. Образование тонкой пленки можно уменьшить с помощью различных методик, например, добавляя в наполнитель капсулы вспомогательные вещества, содержащие пероксиды и альдегиды низкого качества, или используя виды желатина, которые менее подвержены образованию тонкой пленки, таким образом максимально уменьшая образование веществ, создающих поперечные связи между молекулами. Процесс изготовления также можно оптимизировать, например, обеспечивая хранение наполнителя в азотной среде, контролируя температуру и влажность производственной среды, снижая температуру и время воздействия тепла в процессе нагревания, проверяя уровни формальдегида или низкомолекулярных альдегидов во вспомогательных веществах, а также используя влагостойкую и/или светонепроницаемую упаковку.
Заявители установили, что меры, направленные на ограничение образования тонкой пленки, не могут полностью гарантировать получение по истечении периода хранения стабильных профилей растворения мягких желатиновых капсул, наполнитель которых содержит такие ионные компоненты, как полиакриловая кислота. Если не вдаваться в теорию, считается, что полиакриловая кислота, содержащаяся в наполнителе мягкой желатиновой капсулы, взаимодействует с желатином, содержащимся в оболочке, препятствуя разрывам и тем самым меняя профиль растворения. Таким образом, предоставление дозированной лекарственной формы в виде мягкой желатиновой капсулы, наполнитель которой содержит неионные компоненты, обеспечивающие стабильный профиль растворения по истечении периода хранения, может быть преимущественным.
Для введения фармацевтического активного действующего вещества во влагалище с помощью мягкой желатиновой капсулы необходимо обеспечивать не только профиль растворения, сохраняющий стабильность на протяжении всего периода хранения, но также необходим наполнитель, содержащий фармацевтически активное действующее вещество, которое с течением времени сохраняет соответствующую вязкость и мукоадгезионные свойства, гарантирующие правильное и эффективное воздействие активным действующим вещество на слизистую оболочку стенки полости влагалища.
Соответственно, предоставление фармацевтической дозированной лекарственной формы в виде мягкой желатиновой капсулы, в которой не содержатся ионные компоненты, но которая способна обеспечить доставку малой дозы лекарственного средства, например эстрогена, помещенного в наполнитель с улучшенными мукоадгезионными свойствами, при этом сохраняя целостность (твердость) оболочки и вязкость наполнителя, даже после одного года, предпочтительно 18 месяцев, более предпочтительно двух лет хранения капсулы, является предпочтительным.
Сущность изобретения
Настоящее изобретение относится к фармацевтической дозированной лекарственной форме в виде мягкой желатиновой капсулы, содержащей: (а) оболочку, содержащую желатин и пластификатор; и (b) наполнитель, содержащий по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и модифицированную гуаровую камедь. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы сохраняет целостность (твердость) оболочки в течение периода хранения и содержит преимущественный наполнитель на основе гель-матрицы, который сохраняет свою вязкость в течение периода хранения.
В соответствии с одним вариантом осуществления фармацевтическую дозированную лекарственную форму в виде мягкой желатиновой капсулы согласно настоящему изобретению применяют для введения во влагалище. В соответствии с другим вариантом осуществления модифицированная гуаровая камедь представляет собой гидроксипропил гуаровую камедь.
В соответствии с другим вариантом осуществления настоящего изобретения предлагается фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы, содержащей: (а) оболочку, содержащую желатин и пластификатор; и (b) наполнитель, содержащий по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и модифицированную гуаровую камедь, причем логарифмическое число вязкости наполнителя после капсулирования превышает приблизительно в 1-2 раза логарифмическое число вязкости наполнителя до капсулирования в диапазоне скорости сдвига в логарифмических координатах от приблизительно -1,0 до приблизительно 1,0. В соответствии с одним вариантом осуществления наполнитель имеет форму гидрофильного геля, а гидрофильный гель образуется in situ после капсулирования наполнителя.
Краткое описание чертежей
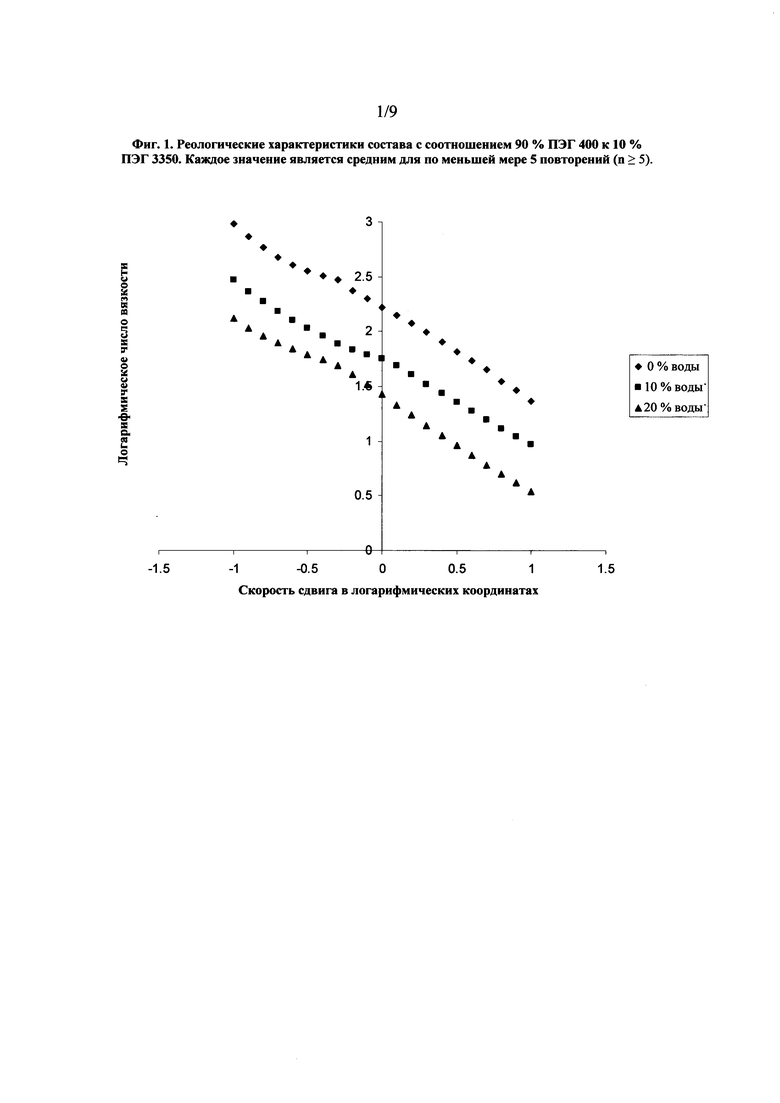
На фиг. 1 показан график, представляющий реологические характеристики состава с соотношением 90 % ПЭГ 400 к 10 % ПЭГ 3350 при добавлении к наполнителю 10 % и 20 % воды.
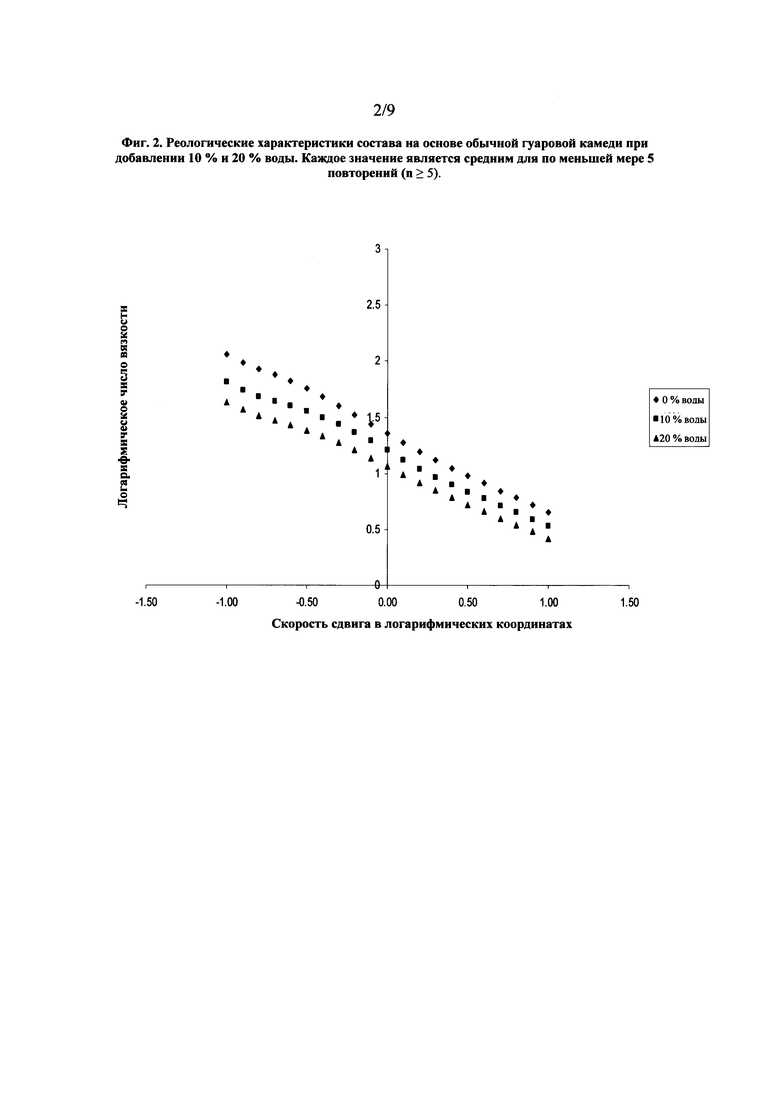
На фиг. 2 показан график, представляющий реологические характеристики состава на основе обычной гуаровой камеди при добавлении к наполнителю 10 % и 20 % воды.
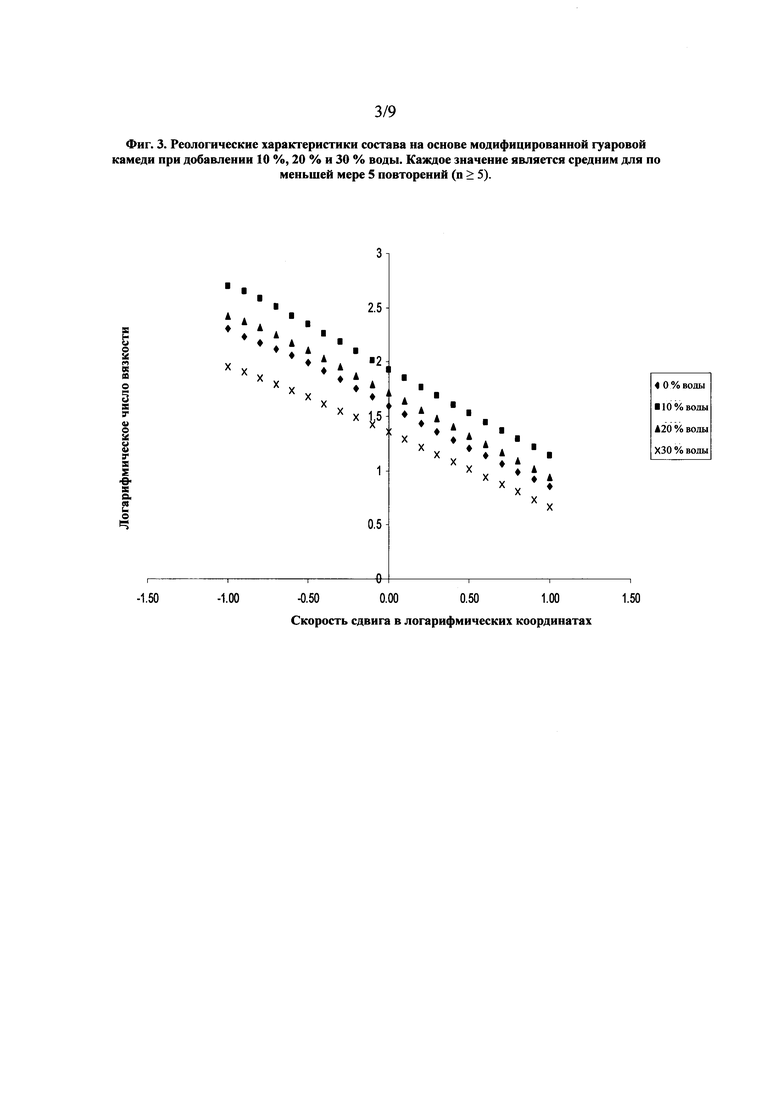
На фиг. 3 показан график, представляющий реологические характеристики состава на основе обычной гуаровой камеди при добавлении к наполнителю 10%, 20% и 30% воды.
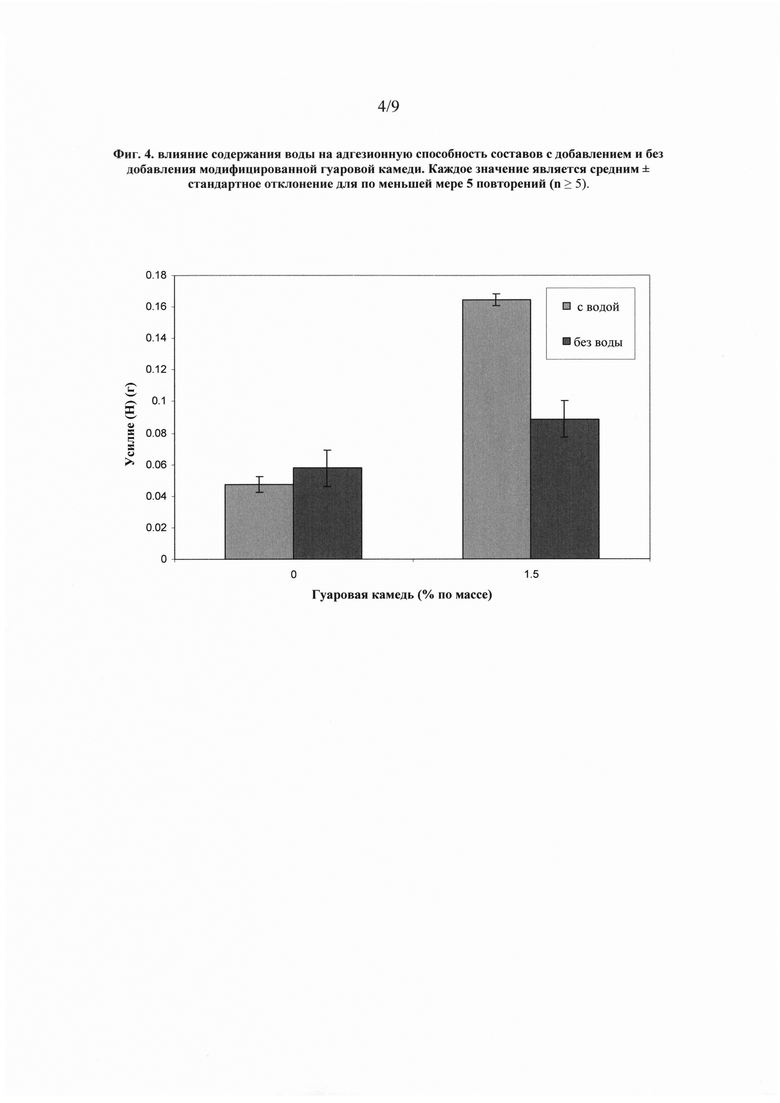
На фиг. 4 показан график, характеризующий влияние содержания воды на адгезионную способность составов с добавлением и без добавления модифицированной гуаровой камеди.
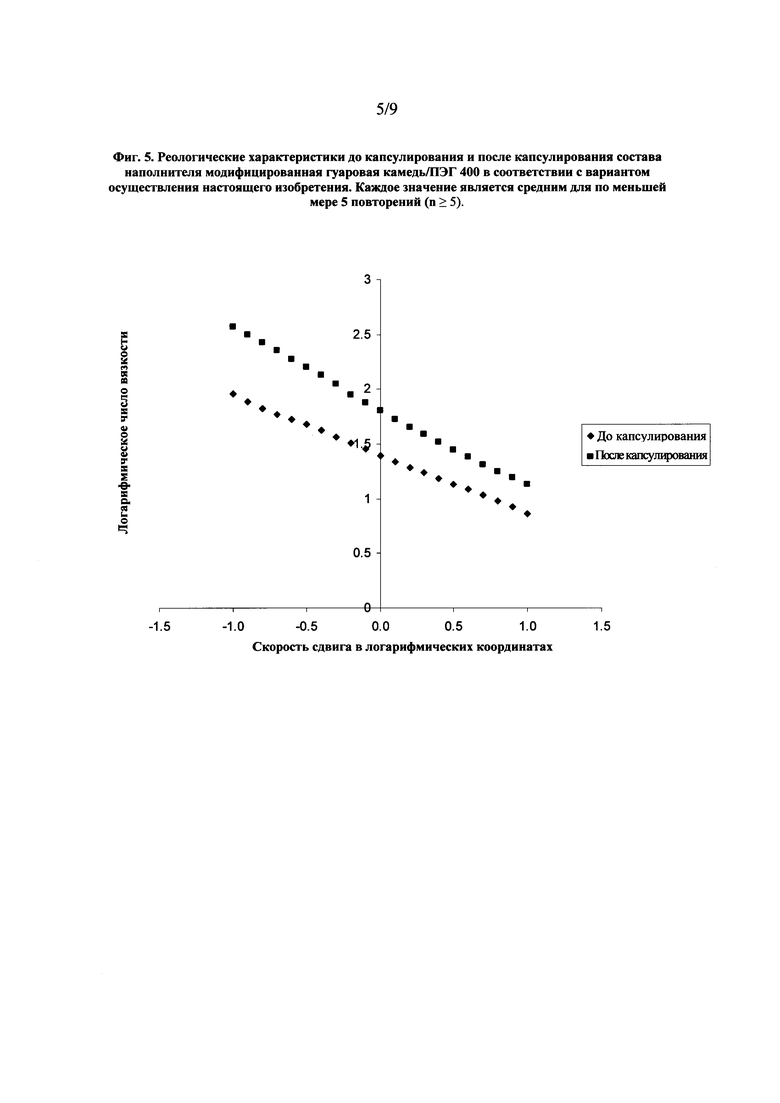
На фиг. 5 показан график, представляющий реологические характеристики перед капсулированием и после капсулирования наполнителя дозированной лекарственной формы в виде мягкой желатиновой капсулы в соответствии с вариантом осуществления настоящего изобретения.
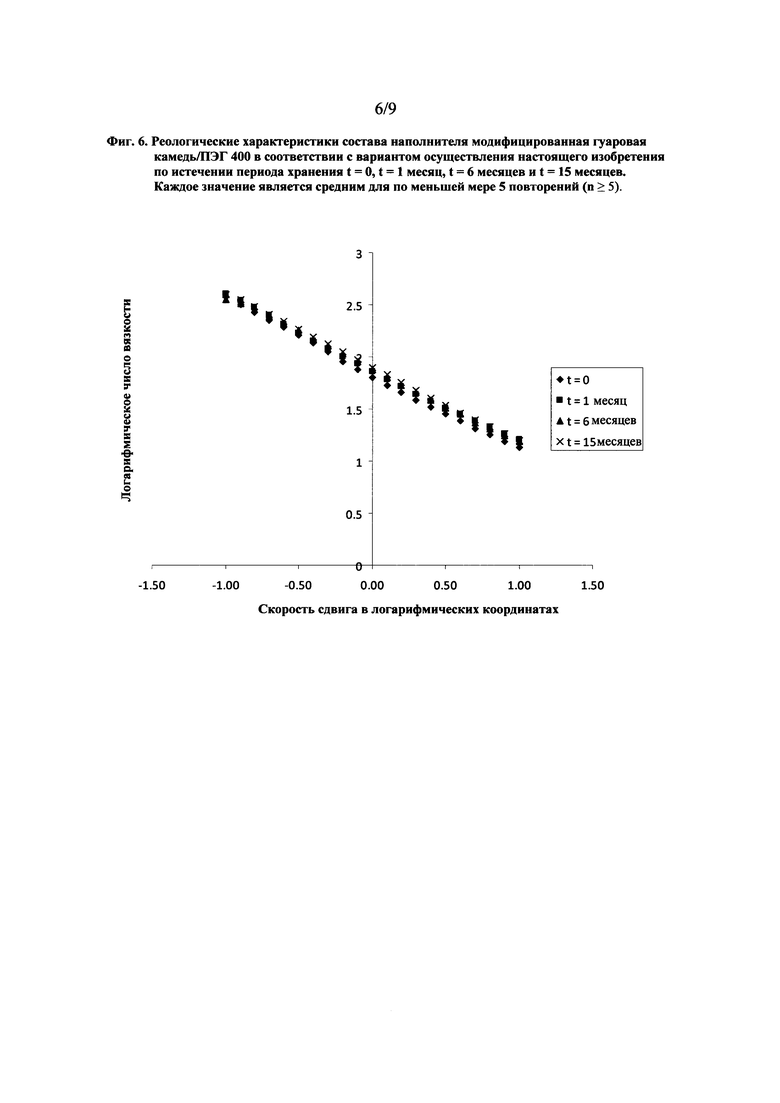
На фиг. 6 показан график, представляющий реологические характеристики состава наполнителя модифицированная гуаровая камедь/ПЭГ 400 в соответствии с вариантом осуществления настоящего изобретения по истечении периода хранения t = 0, t = 1 месяц, t = 6 месяцев и t = 15 месяцев.
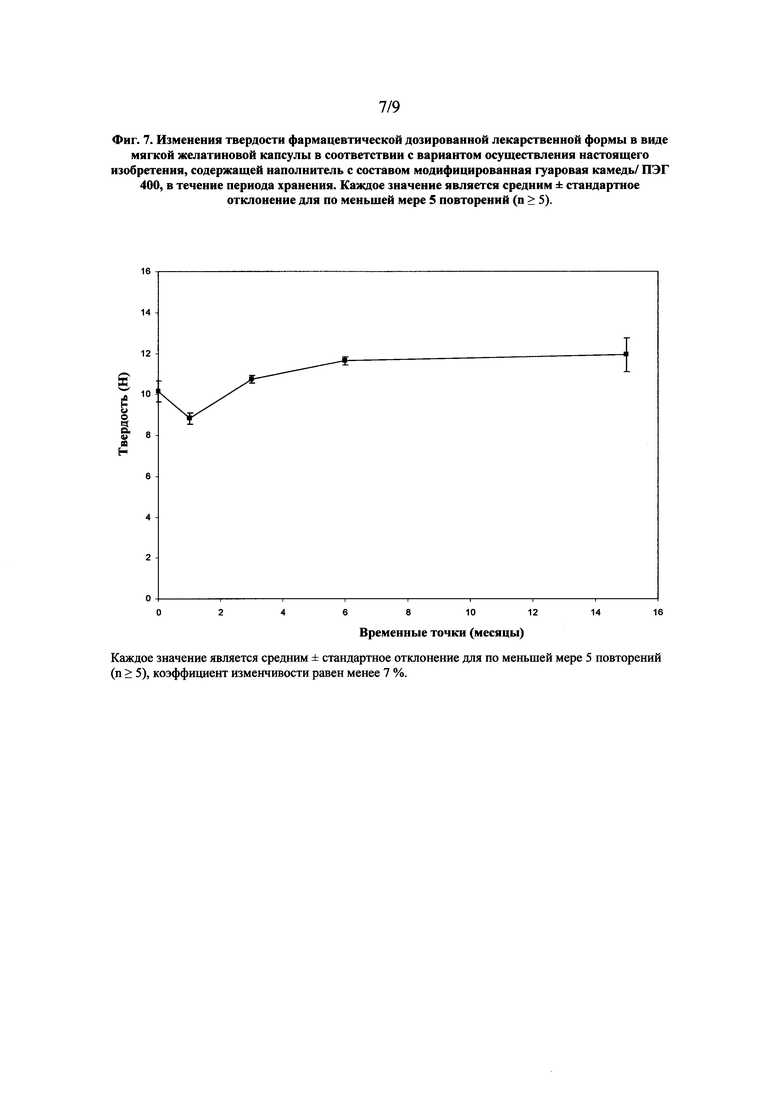
На фиг. 7 показан график, характеризующий изменения твердости фармацевтической дозированной лекарственной формы в виде мягкой желатиновой капсулы в соответствии с вариантом осуществления настоящего изобретения, содержащей наполнитель с составом модифицированная гуаровая камедь/ ПЭГ 400, в течение периода хранения.
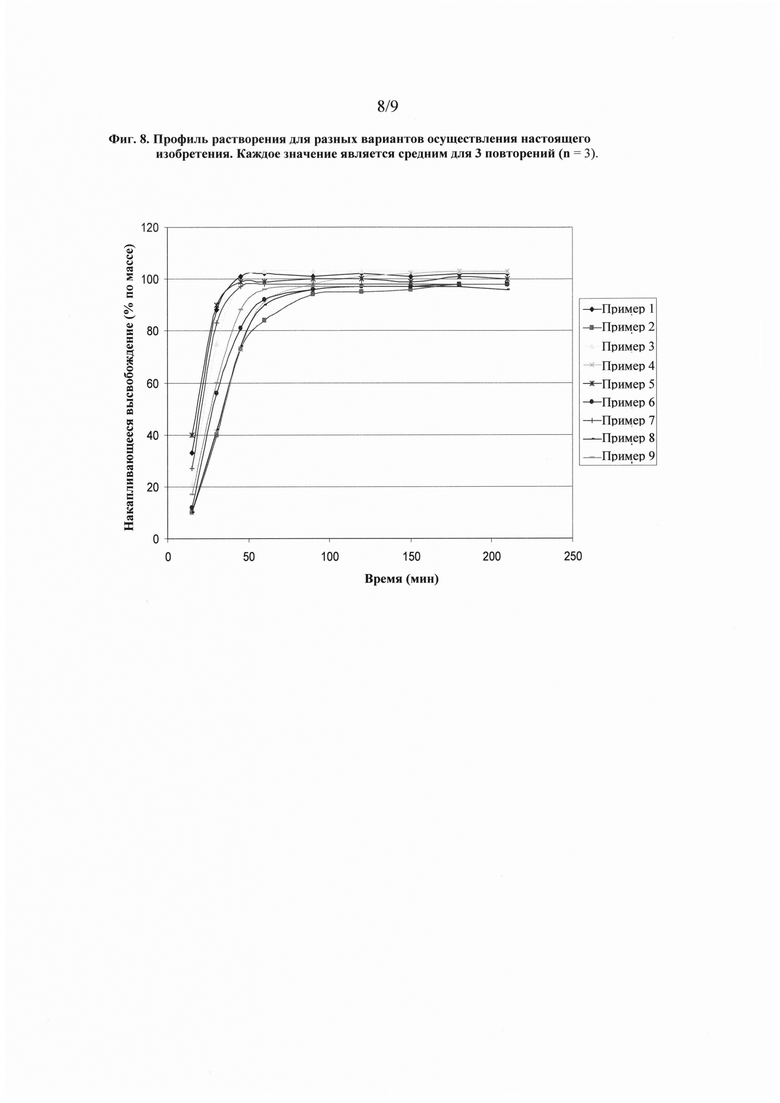
На фиг. 8 показан профиль растворения для разных вариантов осуществления настоящего изобретения.
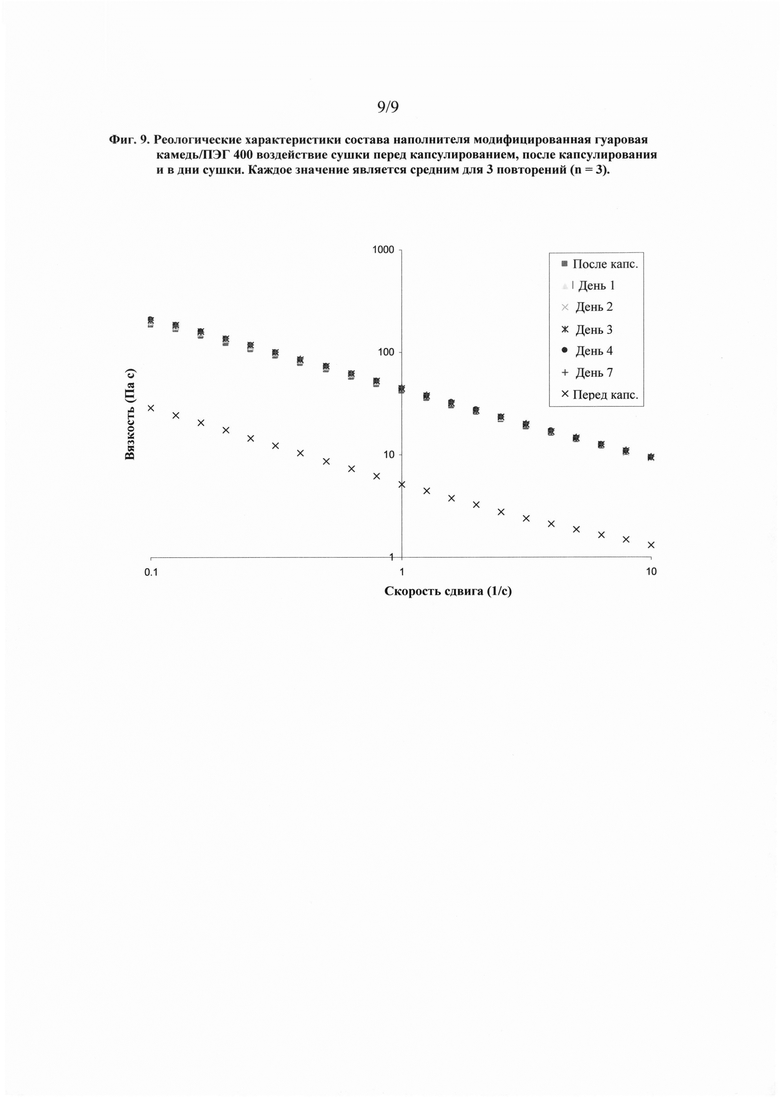
На фиг. 9 показан график, представляющий реологические характеристики и показывающий воздействие сушки на один вариант осуществления настоящего изобретения перед капсулированием, после капсулирования и в дни сушки.
Подробное описание изобретения
В соответствии с вариантом осуществления настоящего изобретения предлагается фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы, содержащая: (а) оболочку, содержащую желатин и пластификатор; и (b) наполнитель, содержащий по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и модифицированную гуаровую камедь.
Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы согласно настоящему изобретению может вводиться перорально или во влагалище, но наиболее эффективное действие обеспечивается при введении во влагалище. Характерный вариант осуществления предусматривает фармацевтическую дозированную лекарственную форму в виде мягкой желатиновой капсулы, в которой фармацевтически активным действующим веществом является эстроген и которую вводят во влагалище.
Используемый в настоящем документе термин «фармацевтически приемлемый» означает, что компонент приемлем для перорального введения или введения во влагалище человека. В соответствии с одним вариантом осуществления компонент должен быть приемлемым для воздействия на среду влагалища.
Мягкие желатиновые капсулы хорошо известны и часто описываются как мягкие капсулы. Они образованы цельной герметичной оболочкой на основе желатина, в которой содержится раствор, суспензия или мягкая лекарственная форма, которая называется составом наполнителя, материалом наполнителя или наполнителем. Прочность студня желатина по Блуму в мягкой желатиновой капсуле, как правило, составляет приблизительно от 150 до приблизительно 200 единиц по шкале Блума (или грамм). В качестве примера можно указать некоторых производителей мягких капсул, среди которых: Catalent Pharma Solutions, Сомерсет, Нью-Джерси, Pharmagel Engineering spa, Лоди, Италия и Soft Gel Technologies Inc., Коммерс, Калифорния. Мягкая желатиновая капсула согласно настоящему изобретению представляет собой фармацевтическую дозированную лекарственную форму, которая содержит оболочку на основе желатина и наполнитель.
В соответствии с вариантом осуществления настоящего изобретения оболочка может содержать желатин и пластификатор. Необязательно оболочка может содержать замутнитель и/или красители. Желатин получают частичным гидролизом коллагена, полученного из кожи, соединительных тканей и костей животных, включая рогатый скот, свиней и рыб. В основном он состоит из растворимых в воде белков (84-90 % по массе), а также минеральных солей (1-2 % по массе) и воды (8-15 % по массе). Белковая фракция содержит аминокислоты, связанные посредством амидных связей с образованием полипептидной цепи.
Коллаген представляет собой фибриллярный белок и является основной составляющей кожи, костей и соединительных тканей животных. Он содержит тройную спираль, образованную тремя полипептидными цепями с молекулярной массой, равной приблизительно 300000 дальтон (Da). Денатурирование предполагает разрушение водородных связей для дестабилизации спирали коллагена, приводящей к значительному уменьшению молекулярной массы и характеристической вязкости. Гидролиз коллагена, достигаемый путем варки костей или кожи в воде, дает низкий выход нечистого желатина, характеризующегося слабыми физическими свойствами. Поэтому в целях коммерческого производства желатина перед проведением денатурирования с помощью термической обработки первым делом необходимо удалить загрязняющие примеси: для этого используют либо разбавленную кислоту и получают желатин типа А, либо разбавленную щелочь и получают желатин типа В. Желатин амфотерный по своей природе, а его изоэлектрические точки находятся в диапазоне от 6,0 до 9,0 для желатина типа А и от 4,7 до 5,3 для желатина типа В. Считается, что щелочной гидролиз приводит к более эффективному дезамидированию аспарагиновой и глутаминовой аминокислоты в коллагене, что обеспечивает большее количество свободной карбоновой кислоты по сравнению с кислотным гидролизом. К примерам подходящего желатина типа А можно отнести, кроме прочего, костный желатин, полученный кислотным способом. К примерам подходящего желатина типа В можно отнести, кроме прочего, костный желатин, полученный с применением извести.
Содержание воды в мягкой капсуле на основе желатина после капсулирования наполнителя и перемещения воды из капсулы в наполнитель в целом будет составлять от приблизительно 1% до приблизительно 25%, более предпочтительно от приблизительно 1% до приблизительно 15%, более предпочтительно от приблизительно 5% до приблизительно 10% по массе желатиновой оболочки. Не вдаваясь в теорию, считается, что вода в желатиновой капсуле, например от 20% до 50% по массе, перед наполнением, перемещается, по меньшей мере, частично, способствуя гелированию наполнителя и увеличивая его вязкость.
В соответствии с предпочтительным вариантом осуществления желатин присутствует в количестве от приблизительно 35% до приблизительно 85%, более предпочтительно от приблизительно 40% до приблизительно 80% по массе желатиновой оболочки.
В соответствии с вариантом осуществления настоящего изобретения может быть использован любой фармацевтически приемлемый пластификатор. К неограничивающим примерам подходящего пластификатора относятся многоатомные спирты, такие как сорбит, глицерин, маннит, ксилит и сорбитан; диалкилфталаты; низшие алкилцитраты, причем низший алкил содержит 1-6 атомов углерода; гликоли и полигликоли, включая полиэтиленгликоли с молекулярной массой в диапазоне от приблизительно 200 до приблизительно 2000, метоксил-пропиленгликоль и 1,2-пропиленгликоль; сложные эфиры многоатомных спиртов, такие как моно-, ди- и триацетат глицерола; рицинолеиновая кислота и ее сложные эфиры; а также их смеси.
В соответствии с предпочтительным вариантом осуществления пластификатор присутствует в количестве от приблизительно 10% до приблизительно 60%, более предпочтительно от приблизительно 20% до приблизительно 55%, более предпочтительно от приблизительно 30% до приблизительно 50% по массе желатиновой оболочки.
В соответствии с вариантом осуществления настоящего изобретения наполнитель содержит по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и модифицированную гуаровую камедь. Наполнитель не содержит ингредиенты в количестве, которое не считается фармацевтически приемлемым для перорального введения или введения во влагалище.
Неограничивающие примеры подходящего фармацевтически активного действующего вещества включают стероиды и нестероидные соединения в малой дозе, их фармацевтически приемлемые соли, сложные эфиры, гидраты, пролекарства и производные. Неограничивающие примеры подходящих нестероидных соединений в малой дозе включают дарифенацин, уденафил и бифосфонатные соединения, такие как ризедронат, алендронат, этидронат, ибандронат, клодронат и золедронат. Предпочтительно активным действующим веществом является соединение с эстрогенным или прогестагенным действием, такое как эстрадиол, этинилэстрадиол, эстетрол, норэтиндрон ацетат, этоногестрел, их фармацевтически приемлемые соли, сложные эфиры, гидраты, пролекарства и производные, а также их смеси.
Под используемым в настоящем документе выражении «фармацевтически приемлемая соль» соединения следует понимать соль, которая является фармацевтически приемлемой и которая характеризуется требуемой фармакологической активностью исходного соединения. К фармацевтически приемлемым солям относятся соли кислотных или основных групп, присутствующих в соединении согласно настоящему изобретению. К фармацевтически приемлемым солям присоединения кислот относятся, кроме прочего, соли соляной кислоты, соли бромистоводородной кислоты, соли иодоводородной кислоты, соли азотной кислоты, соли серной кислоты, кислые сернокислые соли, соли фосфорной кислоты, кислые соли фосфорной кислоты, соли изоникотината, соли уксусной кислоты, соли молочной кислоты, соли салициловой кислоты, соли лимонной кислоты, соли винной кислоты, соли пантотеновой кислоты, кислые соли винной кислоты, соли аскорбиновой кислоты, соли янтарной кислоты, соли малеиновой кислоты, соли гентизината, соли фумаровой кислоты, соли глюконовой кислоты, соли глюкуроновой кислоты, соли сахарной кислоты, соли муравьиной кислоты, соли бензойной кислоты, соли глутаминовой кислоты, соли метансульфоновой кислоты, соли этансульфоновой кислоты, соли бензолсульфоновой кислоты, соли п-толуолсульфоновой кислоты и соли памоевой кислоты (т.е. соли 1,1'-метилен-бис-(2-гидрокси-3-нафтойной кислоты)). Подходящие основные соли включают, кроме прочего, соли алюминия, кальция, лития, магния, калия, натрия, цинка и соли диэтаноламина.
Под используемым в настоящем документе термином «сложный эфир» следует понимать органическое соединение, полученное в результате замещения водорода в кислоте алкилом, например C1 на С6 алкил, или другой органической группой. В уровне технике хорошо известны различные сложные эфиры. К неограничивающим примерам сложных эфиров относятся сложные эфиры муравьиной, уксусной, пропионовой, масляной кислоты и ацетил гликоляты.
Под используемым в настоящем документе термином «гидрат» следует понимать соединение, образованное в результате добавления воды. Гидраты могут быть получены любым известным в уровне техники способом посредством растворения соединений в воде и их рекристаллизации для введения воды в кристаллическую структуру. К неограничивающим примерам гидратов относятся полугидрат, моногидрат, дегидрат, тригидрат и пентагидрат.
Под используемым в настоящем документе термином «пролекарство» следует понимать пассивное вещество-предшественник лекарственного средства, которое становится активным в организме под воздействием обычных обменных процессов. В уровне технике хорошо известны различные формы пролекарств.
В соответствии с одним вариантом осуществления фармацевтически активное действующее вещество находится в мягкой желатиновой капсуле в соответствии с настоящим изобретением в количестве от приблизительно 0,01 мкг до приблизительно 500 мг в зависимости от требуемой дозировки активного действующего вещества.
В соответствии с вариантом осуществления, если фармацевтически активным действующим веществом является эстроген, его количество в фармацевтической дозированной лекарственной форме в виде мягкой желатиновой капсулы в соответствии с настоящим изобретением находится в диапазоне от приблизительно 0,00001 % до приблизительно 2%, более предпочтительно от приблизительно 0,00015% до приблизительно 0,0075 %, более предпочтительно приблизительно 0,003 % по массе фармацевтического наполнителя капсулы.
В соответствии с вариантом осуществления по меньшей мере одно активное действующее вещество является эстрогеном. В соответствии с предпочтительным вариантом осуществления эстроген является 17β-эстрадиолом, местранолом, конъюгированными эстрогенами согласно фармакопеи США, эстроном, эстетролом или этинилэстрадиолом или их солями, сложными эфирами или про лекарствами. Другие подходящие эстрогены включают эстрогены, описанные в патентах США №№7067504, 7067505 и 7795241, а также в публикации заявки на выдачу патента США №№2007/0015741 и 2007/0004694. Раскрытие каждого из этих документов включено в настоящий документ во всей полноте посредством ссылки.
В соответствии с предпочтительным вариантом осуществления по меньшей мере одно активное действующее вещество выбрано из группы, состоящей из эстрадиола, его солей, сложных эфиров, гидратов, пролекарств и его производных. В соответствии с предпочтительным вариантом осуществления эстроген является 17β-эстрадиолом. Фармацевтически приемлемые соли 17β-эстрадиола хорошо известны и включают, кроме прочего, соль 17β-эстрадиол гидрохлорида, соль β-эстрадиол 17-(β-D-глюкуронид) натрия и соль β-эстрадиол 3-(β-D-глюкуронид) 17-сульфат дикалия. Сложные эфиры 17β-эстрадиола также хорошо известны и включают, кроме прочего, эстрадиол-3-ацетат, эстрадиол-17-ацетат, эстрадиол-3,17-диацетат, эстрадиол-3,17-валерат, эстрадиол-3-валерат, эстрадиол-17-валерат, эстрадиол 3-бензоат, эстрадиол ципионат, эстрадиол дипропионат и эстрадиол энантат. Гидраты 17β-эстрадиола также хорошо известны и включают, кроме прочего, полугидрат. Пролекарства 17β-эстрадиола также хорошо известны и включают, кроме прочего, пролекарство, описанное в патенте США №7067505. В соответствии с предпочтительным вариантом осуществления 17β-эстрадиол является 17β-эстрадиол полугидратом. В соответствии с другим предпочтительным вариантом осуществления активным действующим веществом является эстетрол.
Под используемым в настоящем документе выражении «модифицированная гуаровая камедь» следует понимать гуаровую камедь, которая была химически модифицирована с помощью реакционноспособных функциональных групп для замещения свободных гидроксильных групп вдоль основной цепи макромолекулы. Модифицированная гуаровая камедь, используемая в настоящем изобретении, предполагает смесь модифицированных гуаровых камедей. Предпочтительно модифицированная гуаровая камедь является гидроксипропил гуаровой камедью (например, доступной в продаже под торговым наименованием Jaguar® HP 120 (Rhodia)). Предпочтительно уровень замещения превышает приблизительно 0,6, более предпочтительно составляет от приблизительно 1,0 до приблизительно 1,5 и наиболее предпочтительно составляет приблизительно 1,2. В соответствии с вариантом осуществления настоящего изобретения модифицированная гуаровая камедь присутствует в наполнителе в количестве от приблизительно 0,5% до приблизительно 3,0 %, более предпочтительно от приблизительно 0,5% до приблизительно 1,5% по массе от общей массы наполнителя. Было установлено, что добавление полиэтиленгликоля, например ПЭГ 3350, позволило решить проблемы, связанные с эластичностью, в том числе проблемы, описанные далее в примерах, при более низких уровнях содержания модифицированной гуаровой камеди.
Наполнитель содержит один или несколько полиэтиленгликолей. В соответствии с вариантом осуществления настоящего изобретения молекулярная масса полиэтиленгликоля находится в диапазоне от приблизительно 200 до приблизительно 900. В соответствии с предпочтительным вариантом осуществления молекулярная масса полиэтиленгликоля составляет менее 900. В соответствии с вариантом осуществления настоящего изобретения наполнитель содержит по меньшей мере один дополнительный полиэтиленгликоль с молекулярной массой, которая превышает 900. В соответствии с вариантом осуществления настоящего изобретения наполнитель содержит два полиэтиленгликоля, причем молекулярная масса второго полиэтиленгликоля больше 900, а массовое соотношение первого и второго полиэтиленгликолей находится в диапазоне от приблизительно 99:1 до приблизительно 1:99. В соответствии с предпочтительным вариантом осуществления массовое соотношение ПЭГ 400 и ПЭГ 3350 находится в диапазоне от 60:40 до 95:5, более предпочтительно массовое соотношение ПЭГ 400 и ПЭГ 3350 находится в диапазоне от 90:10 до 95:5.
В соответствии с вариантом осуществления настоящего изобретения наполнитель необязательно может содержать растворитель. Неограничивающие примеры подходящих растворителей включают пропиленгликоль, ацетон, этанол, бутиленгликоль, моноэтиловый эфир диэтиленгликоля, дипропиленгликоль, глицерин, полиэтиленгликоль, минеральное масло, арахисовое масло, кунжутное масло. В соответствии с предпочтительным вариантом осуществления растворителем является пропиленгликоль. В соответствии с вариантом осуществления настоящего изобретения растворитель присутствует в наполнителе в количестве от приблизительно 1% до 20%, более предпочтительно от приблизительно 5% до приблизительно 15%, более предпочтительно приблизительно 5% по массе от общей массы наполнителя.
В соответствии с вариантом осуществления настоящего изобретения наполнитель также содержит противоокислитель. Неограничивающие примеры подходящих противоокислителей включают токоферол, бутилгидрокситолуол, бутилгидроксианизол, додецилгаллат, октилгаллат, пропилгаллат, аскорбилпальмитат, аскорбат натрия и тимол. В соответствии с предпочтительным вариантом осуществления противоокислителем является токоферол.
Авторы настоящего изобретения обнаружили, что мягкие желатиновые капсулы, содержащие ионные компоненты, такие как полиакриловая кислота, меньше способны к растворению в течение периода хранения. Однако различные известные методики, описанные выше, направленные на уменьшение образования тонкой пленки, не уменьшили проблему. В результате авторы изобретения пришли к выводу, что уменьшение способности к растворению не было вызвано образованием тонкой пленки, и предположили, что это могло быть вызвано взаимодействием желатина с анионным полимером в наполнителе.
Как было отмечено ранее, не вдаваясь в теорию, было установлено, что, поскольку полиакриловая кислота, такая как поликарбофил, в наполнителе является анионным полимером, она вступает в реакцию с желатином, приводя к образованию нерастворимой массы, которая уменьшает стабильность растворения дозированной лекарственной формы в виде мягкой желатиновой капсулы. Другие анионные полимеры в наполнителе, помимо полиакриловой кислоты, также взаимодействуют с желатином, приводя к образованию нерастворимой массы. Неограничивающие примеры таких анионных полимеров включают поли(метилвиниловый эфир/малеиновый ангидрид) (Gantrez™)№, карбомер, кальций-карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу и альгинаты, такие как альгинат кальция, альгинат калия, альгинат натрия, и альгиновую кислоту.
Для использования в качестве подходящего альтернативного варианта полиакриловым кислотам в наполнителе, например поликарбофила, были исследованы различные полимеры. Для исследования свойств текучести, в частности для определения вязкости и характера ее изменения в течение дальнейшего хранения при 25°С/60 % относительной влажности, был проведен анализ реологических свойств состава наполнителя. В соответствии с вариантом осуществления настоящего изобретения фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по существу не содержит полиакриловую кислоту, способна доставлять лекарственное средство, например эстроген, в малой дозе и сохранять твердость и вязкость наполнителя даже после хранения капсулы в течение одного года или более предпочтительно двух лет. Используемый в настоящем документе термин «по существу не содержит» означает полное отсутствие полиакриловой кислоты или ее количество, которое не приводит к нарушению стабильности растворения, например менее 1 % по массе наполнителя.
Вязкость является важным показателем качества наполнителя мягких капсул, поскольку она может существенно влиять на удержание in vivo и, следовательно, на клиническую пользу конечного продукта в виде мягкой капсулы. Вязкость состава наполнителя образцов, исследованная и описанная далее в Примерах, была измерена в ходе определения реологических свойств непрерывного потока при 25°С с использованием реометра с системой конус-плита. Содержимое двух овальных мягких капсул размером 20 или эквивалентное количество предварительно капсулированного наполнителя испытывали для каждого повторения испытания. Образцы размещали на нижней пластине реометра и до начала испытания выжидали 5 минут для приведения образцов в уравновешенное состояние. Скорость сдвига увеличивали от 0,1 до 10 с-1 для 10 образцов за одну декаду. В соответствии с вариантом осуществления настоящего изобретения после капсулирования логарифмическое число вязкости наполнителя, измеренной в соответствии с приведенным выше описанием, при скорости сдвига в логарифмических координатах, равной нулю, будет составлять от приблизительно 1 до приблизительно 5.
Целостность оболочки (твердость) мягкой капсулы является другим важным показателем качества, поскольку все образцы должны сохранять соответствующую твердость, обеспечивающую возможность их введения и обращения с ними пациентом. Твердость образцов была исследована и описана далее в Примерах, все измерения проводили с применением твердомера от компании Bareiss. В таком приборе мягкую капсулу сжимают между плунжером, прикрепленным к тензодатчику, и платформой, которая автоматически поднимается. Мягкую капсулу располагают на платформе горизонтально таким образом, чтобы линия ее шва была параллельна платформе. Платформа поднимается автоматически, а на тензодатчике отображается значение сопротивления мягкой капсулы сжимающему усилию. Это значение отображается в Ньютонах (Н) и описывает твердость мягкой капсулы, определенной в ходе испытания.
Далее будут описаны характерные варианты осуществления настоящего изобретения со ссылкой на описанные примеры. Следует понимать, что эти примеры являются иллюстративными и не должны рассматриваться как такие, которые ограничивают объем настоящего изобретения.
Примеры
Для того чтобы найти альтернативу для анионных полимеров, например поликарбофил, и оценить его пригодность для введения в гидрофильные составы наполнителя, были исследованы различные полимеры. Изученными полимерами были гипромеллоза, каррагинан, обычная гуаровая камедь, гидроксипропил гуаровая камедь и гидроксиэтилцеллюлоза (ГЭЦ). Вязкость состава наполнителя измеряли в ходе определения реологических свойств непрерывного потока, как описано выше. Вначале состав, содержащий поликарбофил, подготавливали для визуального сравнения с гелями, изготовленными с применением альтернативного полимера. Наполнитель представлял собой прозрачный однородный гель, который стекал под действием силы тяжести. В результате добавления гипромеллозы вместо поликарбофила полученный гель не был однородным, скорее была получена уплотненная масса наполнителя. Каррагинан и ГЭЦ на уровне исследования не обеспечили образование геля. С другой стороны, модифицированная гуаровая камедь (например, гидроксипропил гуаровая камедь) позволила получить вязкий гель, вязкость которого существенно увеличивалась при увеличении количества полимера. Составы, содержащие 2 % и 3 % гидроксипропил гуаровой камеди, характеризовались высокой вязкостью по сравнению с поликарбофильным гелем, поэтому также были рассмотрены более низкие количества гидроксипропил гуаровой камеди - 1,5 % и 1,75 %. При таких более низких количествах наблюдались улучшенные свойства текучести геля, однако было замечено, что составы очень эластичны, что может препятствовать капсулированию и эффективной герметизации.
Воздействие полиэтиленгликоля на вязкость наполнителя было изучено в составах, содержащих ПЭГ 400 и ПЭГ 3350. Были изучены различные соотношения ПЭГ 400 : ПЭГ 3350, начиная от 60:40, заканчивая 90:10. Было обнаружено, что увеличение содержания ПЭГ 400 приводит к снижению вязкости состава, и состав с соотношением 90:10 способен течь под действием силы тяжести. Также было установлено, что добавление в такие системы воды в увеличивающихся количествах приводит к потере вязкости, как показано на графике с реологическими характеристиками на фиг. 1 для состава с соотношением 90% ПЭГ 400 : 10% ПЭГ 3350, и к показателям вязкости при скорости сдвига в логарифмических координатах, равной нулю, приведенным в Таблице 1. Перед тем как смеси охладили до комнатной температуры, к наполнителю добавили 10%, 20% и 30% по массе воды при 60°С. В результате добавления к наполнителю 30 % по массе воды вязкость была полностью потеряна, при этом наблюдалось образование осадка, что сделало проведение испытания на реометре невозможным.
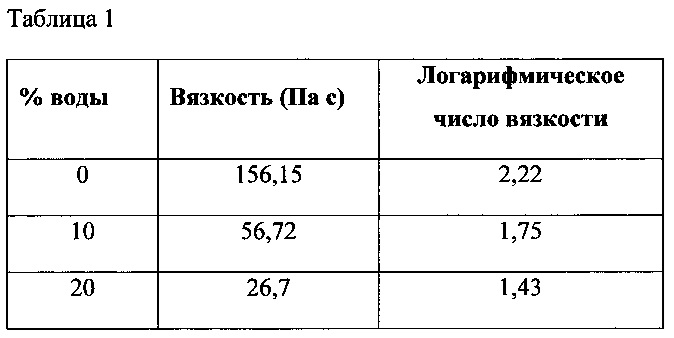
В состав (90 % ПЭГ 400 : 10 % ПЭГ 3350) был введен целый ряд гидрофильных полимеров с целью обеспечить сопротивление состава изменениям вязкости. К ним относятся ГЭЦ, гидроксипропилцеллюлоза (ГПЦ), обычная гуаровая камедь и модифицированная гуаровая камедь. ГЭЦ, ГПЦ и обычная гуаровая камедь не обеспечили сохранение вязкости состава, как показано на графике с реологическими характеристиками на фиг. 2 в сравнении с данными согласно фиг. 1, соответственно при увеличении содержания воды наблюдается статистически значимое (p<0,5) уменьшение вязкости. Значения вязкости при скорости сдвига в логарифмических координатах, равной нулю, для состава на основе обычной гуаровой камеди приведены в Таблице 2.
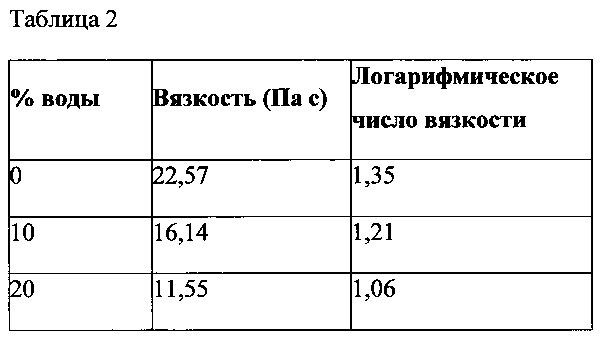
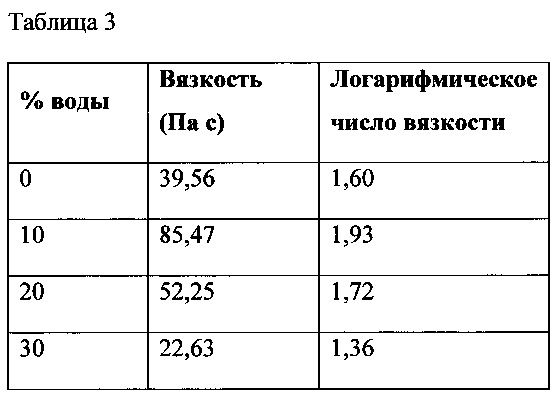
Замена обычной гуаровой камеди гидроксипропил гуаровой камедью обеспечила сохранение вязкости состава при добавлении к наполнителю 10 % и 20 % по массе воды, как показано на фиг. 3, по сравнению с данными, показанными на фиг. 1. Также, в отличие от других образцов, состав остался неизменным при добавлении к наполнителю 30 % воды, и образование осадка не наблюдалось. Гидроксипропил гуаровая камедь обеспечила более быструю гидратацию, что привело к гелированию состава при добавлении воды, а не его растворению. Значения вязкости при скорости сдвига в логарифмических координатах, равной нулю, для состава на основе гидроксипропил гуаровой камеди приведены в Таблице 3.
Воздействие модифицированной гуаровой камеди на мукоадгезионную способность составов как с добавлением, так и без добавления воды изучали посредством измерения усилия, необходимого для снятия гидратированного муцинового диска с поверхности наполнителя. В стеклянный лабораторный стакан помещали приблизительно 15 г материала, а усилие, необходимое для снятия предварительно гидратированного муцинового диска с поверхности образца, измеряли с помощью анализатора текстуры TA.XTplus. Муциновый диск содержал 2 г муцина и вспомогательное вещество Avicel PH105 в соотношении 1:1, и его сжимали с помощью инструмента с плоским торцом диаметром 25 мм с усилием сжатия 7 тонн на одной прессовой установке. Диск предварительно гидратировали 5 % по массе муцинового раствора, затем промакивали для удаления излишков раствора и прикрепляли к щупу тензодатчика, расположенного на анализаторе текстуры. Щуп опускали вручную для обеспечения равномерного контакта с исследуемым материалом. После 30 секунд начинали само испытание, отрывая щупом диск от образца со скоростью 0,5 мм/с и с максимальным усилием, нанося результаты на график зависимости усилие-расстояние. Для каждого образца испытания повторяли три раза, каждый раз используя новые диски и новые образцы. Материал наполнителя испытывали до и после добавления 6 % по массе воды, моделирующего попадание влаги из материала оболочки капсулы и гелеобразование.
Результаты, показанные на фиг. 4, свидетельствуют о том, что введение модифицированной гуаровой камеди обеспечивает значительное увеличение адгезионной способности образца. Также они показывают существенное увеличение адгезионной способности материала наполнителя в результате гелеобразования.
Пример состава наполнителя в соответствии с настоящим изобретением, который был изучен, описан в Таблице 4.
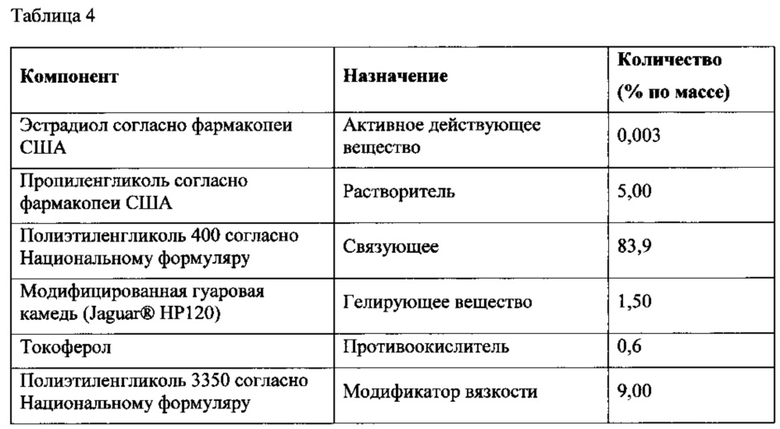
Была изучена физическая стойкость фармацевтической дозированной лекарственной формы в виде мягкой желатиновой капсулы согласно варианту осуществления в соответствии с настоящим изобретением, содержащей состав наполнителя ПЭГ/модифицированная гуаровая камедь. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы с композициями наполнителя и оболочки согласно Таблице 5 и Таблице 6 соответственно была упакована в блистерную упаковку ACLAR® с мембраной из фольги.
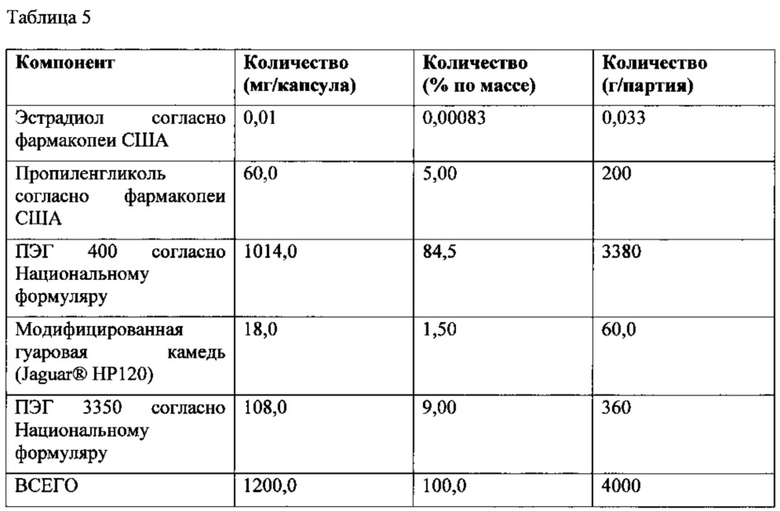
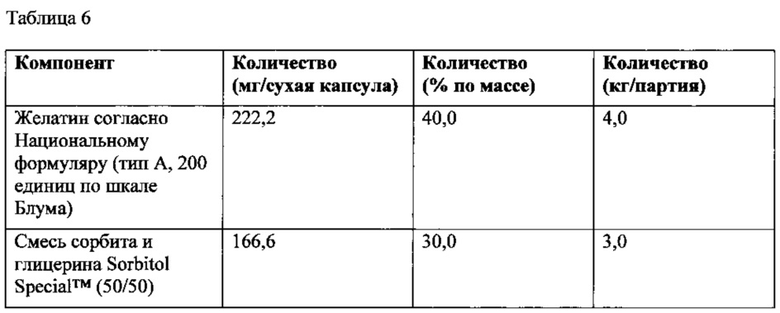

Влияние капсулирования на вязкость состава наполнителя модифицированная гуаровая камедь/ПЭГ 400 показано на фиг. 5. Результаты свидетельствуют о существенном увеличении вязкости наполнителя после капсулировании. После капсулирования наполнитель имеет форму гидрофильного геля и его логарифмическое число вязкости приблизительно в 1-2 раз больше, чем логарифмическое число вязкости наполнителя до капсулирования в диапазоне скорости сдвига в логарифмических координатах от приблизительно -1,0 до приблизительно 1,0. Такой эффект обеспечивается гидратацией наполнителя с составом модифицированная гуаровая камедь/ПЭГ 400 водой из оболочки капсулы и приводит к образованию вязкого гелевого материала. Содержание воды в материале наполнителя до капсулирования, как правило, менее 1,0 % по массе, увеличиваясь до приблизительно 6,0-11,0% по массе после капсулирования. Капсулирование высоковязкого наполнителя с помощью стандартных методик изготовления мягких капсул является сложной задачей, поэтому способность геля образовываться in situ после капсулирования позволяет устранить такую проблему и является значительным преимуществом. Значения вязкости при скорости сдвига в логарифмических координатах, равной нулю, для наполнителя до и после капсулирования приведены в Таблице 7.

Описанная выше фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы, упакованная в блистерную упаковку ACLAR® с мембраной из фольги, хранилась при постоянных условиях 25°С/60 % относительной влажности в течение 15 месяцев. Твердость и вязкость наполнителя мягких капсул проверяли в самом начале, а затем через t = 1, 3, 6 и 15 месяцев. Твердость мягкой капсулы измеряли с помощью твердомера от компании Bareiss, описанного выше. Вязкость наполнителя измеряли в ходе определения реологических свойств непрерывного потока, как описано выше.
Влияние хранения на вязкость состава наполнителя модифицированная гуаровая камедь/ПЭГ 400 показано на фиг. 6. Эти результаты свидетельствуют в пользу сохранения этими системами вязкости в течение 15 месяцев хранения при постоянных условиях 25°С/60 % относительной влажности.
Влияние хранения на твердость мягких капсул показано на фиг. 7. Результаты показывают, что мягкие капсулы сохраняют свою твердость на протяжении 15 месяцев хранения при постоянных условиях 25°С/60% относительной влажности, т.е. очевидное уменьшение твердости, способное отрицательно сказаться на возможности введения и обращения пациента с дозированной лекарственной формой, не наблюдается.
Как видно из результатов, показанных на фиг. 6 и фиг. 7, дозированные лекарственные формы в виде фармацевтической мягкой желатиновой капсулы, содержащие состав наполнителя модифицированная гуаровая камедь/ПЭГ 400, характеризуются физической стойкостью на протяжении 15 месяцев хранения при постоянных условиях 25°С/60 % относительной влажности.
Были изучены свойства растворения фармацевтической дозированной лекарственной формы в виде мягкой желатиновой капсулы согласно варианту осуществления в соответствии с настоящим изобретением, содержащей состав наполнителя ПЭГ/модифицированная гуаровая камедь. 500 мг состава наполнителя были капсулированы в гелевый материал, состоящий из костного желатина, полученного кислотным способом, и смеси сорбита и глицерина Sorbitol Special™ А810, которая представляет собой смесь 1,4-сорбитана, сорбита и маннита (раствор на основе сорбит сорбитана согласно Национальному формуляру) и глицерина согласно фармакопеи США. Воду для получения гелевого материала используют в количестве до приблизительно 40% по массе от раствора на основе влажной массы геля, однако к концу процесса изготовления капсулы, который предусматривает несколько стадий сушки, содержание воды в капсулах, как правило, составляет приблизительно от 2% до 15% воды по массе мягкой желатиновой капсулы. В целях этого исследования были выбраны восемь разных наполнителей. Исследованные композиции составов наполнителей в соответствии с разными вариантами осуществления настоящего изобретения представлены в Таблице 8.
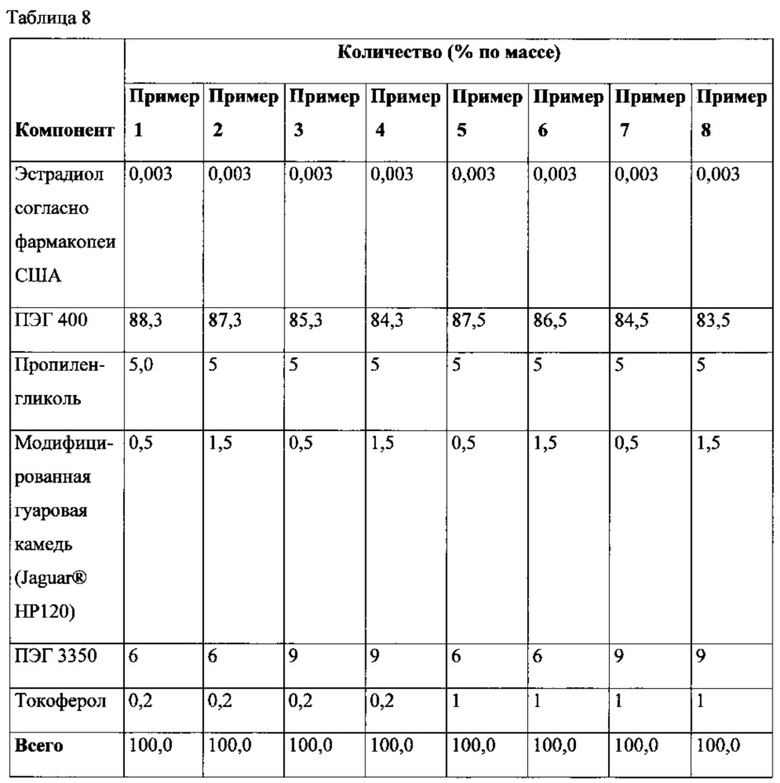
Растворение фармацевтической дозированной лекарственной формы в виде мягкой желатиновой капсулы измеряли посредством следующего способа растворения. Растворение измеряли с помощью мешалки лопастного типа Apparatus 2 согласно фармакопеи США, в качестве среды растворения был ацетатный буфер объемом 500 мл с pH 4,5; скорость вращения лопасти составляла 50 об/мин, а температура - 37±0,5°С. Профили растворения показаны на фиг. 8. Эти результаты показывают фармацевтически приемлемое высвобождение лекарственного средства для составов наполнителей, описанных в настоящем изобретении.
Влияние сушки на вязкость наполнителя показано на фиг. 9. Состав наполнителя согласно Таблице 9 был изготовлен и исследован на вязкость до капсулирования, после капсулирования и в дни сушки. Капсулы равномерно размещали на лотках и помещали в сушильный шкаф. Капсулы сушили в умеренных условиях сушки при температуре 21-24°С и относительной влажности 20-30 %. Эти результаты свидетельствуют о достижении увеличенной вязкости после капсулирования наполнителя и ее сохранения в ходе всего процесса сушки.
Хотя настоящее изобретение было подробно описано на основе конкретных вариантов его осуществления, специалисту в области техники, к которой относится настоящее изобретение, будут понятны различные модификации и изменения, не выходящие за пределы объема и сути настоящего изобретения. Соответственно, оно охватывает все такие альтернативы, модификации и изменения, которые подпадают под сущность и объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, указанные в настоящем документе, включены в него во всей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАПСУЛЫ С РАСТВОРИМЫМ ЭСТРАДИОЛОМ ДЛЯ ИНТРАВАГИНАЛЬНОГО ВВЕДЕНИЯ | 2013 |
|
RU2740059C2 |
| КОМПОЗИЦИИ ДЛЯ НАНЕСЕНИЯ ПОКРЫТИЯ СПОСОБОМ ПОГРУЖЕНИЯ, ВКЛЮЧАЮЩИЕ КРАХМАЛ С ВЫСОКИМ СОДЕРЖАНИЕМ АМИЛОЗЫ | 2009 |
|
RU2486917C2 |
| НОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ТАМСУЛОЗИНА И ДУТАСТЕРИДА | 2019 |
|
RU2795928C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ВОДОРАСТВОРИМОЙ СОЛИ ВИНОРЕЛБИНА | 2008 |
|
RU2476208C2 |
| ТВЕРДЫЕ ИЛИ ПОЛУЖИДКИЕ ДОЗИРОВАННЫЕ ФОРМЫ С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ | 2008 |
|
RU2471480C2 |
| КАПСУЛЫ ЗАДЕРЖАННОГО ВЫСВОБОЖДЕНИЯ ИЗ МЯГКОГО ЖЕЛАТИНА | 2020 |
|
RU2822392C2 |
| КАПСУЛЫ ЗАДЕРЖАННОГО ВЫСВОБОЖДЕНИЯ ИЗ МЯГКОГО ЖЕЛАТИНА В СРЕДЕ С БОЛЕЕ ВЫСОКИМ ЗНАЧЕНИЕМ pH | 2020 |
|
RU2828673C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЗАПОЛНЕННЫХ ЖИДКОСТЬЮ КАПСУЛ | 1999 |
|
RU2219911C2 |
| БЫСТРО ДИСПЕРГИРУЮЩИЕСЯ ТАБЛЕТКИ С ЖЕЛАТИНОВЫМ ПОКРЫТИЕМ | 2005 |
|
RU2367413C2 |
| КАПСУЛЫ, СОДЕРЖАЩИЕ ВОДНЫЕ НАПОЛНЯЮЩИЕ КОМПОЗИЦИИ, СТАБИЛИЗИРОВАННЫЕ ПРОИЗВОДНЫМ ЦИКЛОДЕКСТРИНА | 2003 |
|
RU2359698C2 |
Изобретение относится к фармацевтической дозированной лекарственной форме в виде мягкой желатиновой капсулы, содержащей: оболочку, содержащую желатин и пластификатор; и наполнитель, инкапсулированный в оболочку. Причем наполнитель содержит менее 1,0% по массе воды до инкапсулирования и дополнительно содержит по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и гидроксипропил гуаровую камедь. Где по меньшей мере одно фармацевтически активное действующее вещество выбрано из группы, состоящей из эстрадиола, его фармацевтически приемлемых солей, сложных эфиров, гидратов, пролекарств и производных. 17 з.п. ф-лы, 9 ил., 9 табл.
1. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы, содержащая:
оболочку, содержащую желатин и пластификатор; и
наполнитель, инкапсулированный в оболочку, причем наполнитель содержит менее 1,0% по массе воды до инкапсулирования и дополнительно содержит по меньшей мере одно фармацевтически активное действующее вещество, один или несколько полиэтиленгликолей и гидроксипропил гуаровую камедь;
причем по меньшей мере одно фармацевтически активное действующее вещество выбрано из группы, состоящей из эстрадиола, его фармацевтически приемлемых солей, сложных эфиров, гидратов, пролекарств и производных.
2. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 1, предназначенная для перорального введения или введения во влагалище.
3. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 2, предназначенная для введения во влагалище.
4. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 3, причем количество гидроксипропил гуаровой камеди составляет от приблизительно 0,5% до приблизительно 3,0% по массе наполнителя.
5. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 1, причем молекулярная масса полиэтиленгликоля составляет менее 900.
6. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 5, дополнительно содержащая по меньшей мере один дополнительный полиэтиленгликоль с молекулярной массой свыше 900.
7. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 6, причем полиэтиленгликоль представляет собой комбинацию ПЭГ 400 и ПЭГ 3350.
8. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 7, причем массовое соотношение ПЭГ 400 и ПЭГ 3350 составляет от 90:10 до 95:5.
9. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 1, причем наполнитель дополнительно содержит противоокислитель.
10. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 9, причем противоокислитель представляет собой токоферол.
11. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 1, причем наполнитель дополнительно содержит растворитель.
12. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 11, причем растворитель представляет собой пропиленгликоль.
13. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 12, причем пропиленгликоль присутствует в количестве приблизительно 5% по массе от общей массы наполнителя.
14. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 4, причем гидроксипропил гуаровая камедь присутствует в количестве приблизительно 1,5% по массе от общей массы наполнителя.
15. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 1, причем гидроксипропил гуаровая камедь составляет от приблизительно 0,5% до приблизительно 3,0% по массе наполнителя.
16. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 15, причем уровень замещения гидроксипропил гуаровой камеди составляет более 0,6.
17. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 16, причем уровень замещения гидроксипропил гуаровой камеди составляет от приблизительно 1,0 до приблизительно 1,5.
18. Фармацевтическая дозированная лекарственная форма в виде мягкой желатиновой капсулы по п. 17, причем уровень замещения гидроксипропил гуаровой камеди составляет приблизительно 1,2.
| US 2007098783 А1, 03.05.2007 | |||
| US 2007098783 А1, 03.05.2007 | |||
| US 2007098783 А1, 03.05.2007 | |||
| ЕР 0770384 А1, 02.05.1997 | |||
| KR 20050030281 A, 30.03.2005 | |||
| CN 101474167 A, 08.07.2009. |
Авторы
Даты
2018-12-29—Публикация
2014-03-14—Подача