РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США №62/856601, поданной 3 июня 2019 г., которая во всей ее полноте включена в настоящее изобретение в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к капсулам задержанного высвобождения из мягкого желатина, где композиции оболочек на основе желатина обладают характеристиками задержанного высвобождения при отсутствии необходимости нанесения зависящих рН покрытий или добавления обычных зависящих от рН синтетических полимеров.
УРОВЕНЬ ТЕХНИКИ
Мягкие капсулы, в частности, капсулы из мягкого желатина (или мягкие желатиновые капсулы), представляют собой дозированную форму, которую охотно принимают пациенты, поскольку капсулы легко проглатывать и них не нужно ароматизировать для маскирования неприятного вкуса активного ингредиента. Капсулирование лекарственных средств в мягкие капсулы дополнительно обеспечивает возможность улучшения биологической доступности фармацевтических средств. Так, например, активные ингредиенты могут легко высвобождаться в жидкой форме после разрушения желатиновой оболочки.
Были предприняты попытки создания дозированных форм задержанного высвобождения. Дозированные формы задержанного высвобождения предназначены для обеспечения защиты содержимого дозированных форм от воздействия желудочного сока. Так, например, дозированные формы задержанного высвобождения можно изготовить путем нанесения зависящего от рН покрытия на поверхность изготовленной дозированной формы, такой как таблетка или капсула. Такие покрытия можно нанести путем его распыления на дозированную форму и последующей сушки дозированной формы, обычно при повышенных температурах. Эта методика нанесения зависящего от рН покрытия на капсулу может привести к таким недостаткам, как ухудшение действия и внешнего вида. Так, например, капсула может выглядеть шершавой, покрытие может быть нанесено неравномерно и/или покрытие может быть склонно к растрескиванию или отшелушиванию от дозированной формы. Кроме того, методика нанесения зависящего от рН покрытия является чрезвычайно неэффективной.
Были разработаны другие дозированные формы задержанного высвобождения, в которых в оболочку капсулы добавляли обычные зависящие от рН полимеры (т.е. нерастворимые в кислоте полимеры). Однако добавление обычных зависящих от рН полимеров может привести к получению капсул, которые склонны к протеканию вследствие недостаточной герметичности.
В соответствии с этим, в настоящее время необходима капсула задержанного высвобождения из мягкого желатина, для которой не требуется ни нанесение зависящего от рН покрытия, ни добавление в оболочку обычных зависящих от рН полимеров.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к капсулам задержанного высвобождения из мягкого желатина. Капсулы задержанного высвобождения из мягкого желатина содержат (а) наполняющий материал и (b) композицию зависящей от рН оболочки. Для капсул задержанного высвобождения из мягкого желатина, предлагаемых в настоящем изобретении, не требуется ни зависящее от рН покрытие, ни добавленный обычный зависящий от рН полимер. Соответственно, с помощью композиции зависящей от рН оболочки исключена необходимость нанесения зависящего от рН покрытия, что также уменьшает вероятность повреждения капсул во время процедуры нанесения покрытия.
В одном варианте осуществления композиция зависящей от рН оболочки содержит: (а) желатин, (b) декстрозу, (с) пектин, такой как низкометоксилированный пектин, и необязательно (d) пластификатор. Состав композиции зависящей от рН оболочки (например, количество пектина, количество декстрозы, отношение количества желатина к количеству пектина) и способ ее получения (например, продолжительность отверждения, толщина ленты) можно регулировать/изменять/модифицировать для обеспечения целевого зависящего от рН профиля растворения композиции оболочки в средах, обладающих различными значениями рН (например, времени разрушения/растворения/распада в кислой среде и в буферной среде). Настоящее изобретение также относится к способу изготовления капсул задержанного высвобождения из мягкого желатина.
Настоящее изобретение также относится к способу лечения патологического состояния, проводимому путем введения субъекту любой из композиций капсул задержанного высвобождения из мягкого желатина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенные выше и другие особенности настоящего изобретения, их сущность и различные преимущества станут понятнее при рассмотрении представленного ниже подробного описания совместно с прилагаемыми чертежами, где:
на фиг. 1 представлена зависимость вязкости композиций оболочек, содержащих амидированный пектин и не содержащих амидированный пектин, от продолжительности состаривания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении улучшен предшествующий уровень техники путем разработки предназначенных для перорального введения дозированных форм задержанного высвобождения, в частности, капсул задержанного высвобождения из мягкого желатина, которые обладают преимуществами, характерными для обычных дозированных форм задержанного высвобождения, при отсутствии необходимости нанесения зависящего от рН покрытия или добавления в оболочку капсулы обычного зависящего от рН синтетического полимера. Капсулы задержанного высвобождения из мягкого желатина, предлагаемые в настоящем изобретении, не растворяются в желудочном соке, а растворяются при значении рН, которое равно примерно 3,5 или более (например, в области двенадцатиперстной кишки и/или в кишках). Профиль растворения капсул задержанного высвобождения из мягкого желатина, описанных в настоящем изобретении, можно регулировать путем изменения состава композиций оболочек капсул из мягкого желатина.
Такой механизм является благоприятным для доставки активных ингредиентов, которые могут вызвать раздражение желудка или являются чувствительными к кислой среде желудочного сока. Такой механизм также является благоприятным для уменьшения отрыжки после употребления капсул, в которые капсулированы наполняющие материалы, которые склонны способствовать отрыжке. Так, например, отрыжка часто возникает после употребления витаминов, минералов, пищевых добавок и/или фармацевтических продуктов, которые приготовлены в виде дозированных форм, отличающимся некоторым вытеканием (даже чрезвычайно небольшого количества) в желудке до попадания в кишечник. Вытекание может представлять особое затруднение, если отрыжка связана с веществами, которые вызывают неприятное ощущение, такими как рыбий жир и чеснок, доставку которых обычно обеспечивают с помощью капсул из мягкого желатина. Капсулы задержанного высвобождения из мягкого желатина, описанные в настоящем изобретении, можно изготовить таким образом, чтобы свести к минимуму и/или исключить преждевременное протекание (и соответственно преждевременное высвобождение наполняющего материала капсулы) в желудочном соке.
При использовании в настоящем изобретении термин "зависящий от рН" означает такую характеристику устойчивости соединения к растворению или распаду, что не происходит или в основном не происходит растворение или распад вещества в желудочном соке, например, в течение промежутка времени, равного не менее примерно 15 мин, не менее примерно 30 мин, не менее примерно 1 ч, не менее примерно 2 ч, не менее примерно 3 ч, не менее примерно 4 ч или не менее примерно 5 ч. В некоторых вариантах осуществления в настоящем изобретении желудочный сок можно моделировать с помощью 0,1 н. раствора HCl и необязательно с добавлением пепсина. Следует отметить, что в фармакопейных методиках не используют пепсин, однако в некоторых исследованиях растворения/распадаемости, описанных в настоящем изобретении, пепсин добавляют для лучшего моделирования/имитации условий in vivo. Поэтому, без наложения ограничений, в некоторых вариантах осуществления композиции, описанные в настоящем изобретении, являются устойчивыми и не растворяются/распадаются в течение промежутков времени, описанных выше, даже в средах 0,1 н. раствора HCl, которые содержат пепсин (которые считаются более агрессивными средами, чем 0,1 н. раствор HCl без добавления пепсина).
Так, например, варианты осуществления, описанные в настоящем изобретении, включают композицию зависящей от рН оболочки, которая предпочтительно растворяется при значении рН, равном примерно 3,5 или более (например, в биологической, синтетической или искусственной среде двенадцатиперстной кишки и/или биологическом, синтетическом или искусственном кишечном соке), а не в биологическом, синтетическом или искусственном желудочном соке. В некоторых вариантах осуществления в настоящем изобретении кишечный сок можно моделировать с помощью фосфатного буфера, обладающего значением рН, равным 6,8, с добавлением или без добавления панкреатина. Так, например, композиция зависящей от рН оболочки, описанная в настоящем изобретении, растворяется при значении рН, равном примерно 3,5 или более (например, в биологической, синтетической или искусственной среде двенадцатиперстной кишки и/или биологическом, синтетическом или искусственном кишечном соке, например в фосфатном буфере, обладающем значением рН, равным 6,8, необязательно с добавлением панкреатина), в течение менее примерно 60 мин, в течение менее примерно 45 мин, в течение менее примерно 30 мин, в течение менее примерно 20 мин, в течение менее примерно 10 мин или в течение менее примерно 5 мин. Следует отметить, что в фармакопейных методиках не используют панкреатин, однако в некоторых исследованиях растворения/распадаемости, описанных в настоящем изобретении, панкреатин добавляют для лучшего моделирования/имитации условий in vivo. Поэтому, без наложения ограничений, в некоторых вариантах осуществления композиции, описанные в настоящем изобретении, обладают сходными профилями растворения/распадаемости в буферных средах, обладающих значением рН, равным 6,8, которые содержат панкреатин (которые считаются более агрессивными средами, чем буферная среда, обладающая значением рН, равным 6,8, без добавления панкреатина).
При использовании в настоящем изобретении термины "фармацевтически активный ингредиент", "активные средства" означают лекарственное средство или соединение, которое можно использовать для диагностики, излечивания, облегчения, лечения или предупреждения патологического состояния. В некоторых вариантах осуществления подходящие "активные средства" включают нутрицевтики, такие как, витамины, минералы и пищевые добавки (ВМПД). Типичные капсулы задержанного высвобождения из мягкого желатина могут включать, без наложения ограничений, капсулы, содержащие молочно-кислые бактерии, пробиотики, капсулы, содержащие рыбий жир, вальпроевую кислоту, чеснок, масло мяты перечной, полиэтиленгликоль, раствор или суспензию ибупрофена, ингибиторы протонного насоса, аспирин, и аналогичные продукты.
Термин "патологическое состояние" или "патологические состояния" означает такие патологические состояния, которые можно лечить или предупреждать путем введения субъекту активного средства в эффективном количестве.
При использовании в настоящем изобретении термин "активный ингредиент" означает любое вещество, которое предназначено для обеспечения терапевтического, профилактического или другого искомого воздействия, независимо от того, утверждено ли оно правительственным органом для использования с этой целью. Этот термин при использовании в отношении конкретного средства включает фармацевтически активное средство и все его фармацевтически приемлемые соли, сольваты и кристаллические формы, где соли, сольваты и кристаллические формы являются фармацевтически активными.
Для задач настоящего изобретения можно использовать любой фармацевтически активный ингредиент, включая такие, которые растворимы в воде, и такие, которые слабо растворимы в воде. Подходящие фармацевтически активные ингредиенты включают, но не ограничиваются только ими, анальгетики и противовоспалительные средства (например, ибупрофен, напроксен натрия, аспирин), антациды, противоглистные средства, противоаритмические средства, бактерицидные средства, антикоагулянты, антидепрессанты, противодиабетические средства, противодиарейные средства, противоэпилептические средства, противогрибковые средства, средства против подагры, гипотензивные средства, противомалярийные средства, средства для борьбы с мигренью, антимускариновые средства, противоопухолевые средства и иммуносупрессанты, противопротозойные средства, противоревматические средства, антитиреоидные средства, противовирусные средства, транквилизаторы, успокаивающие средства, снотворные средства и нейролептические средства, бета-блокаторы, сердечные инотропные средства, кортикостероиды, средства подавления кашля, цитотоксические средства, противоотечные средства, диуретики, ферменты, противопаркинсонические средства, желудочно-кишечные средства, антагонисты гистаминового рецептора, средства, регулирующие содержание липидов, местные анестетики, нейромышечные средства, нитраты и антиангинальные средства, питательные вещества, опиоидные анальгетики, противосудорожные средства (например, вальпроевая кислота), пероральные вакцины, белки, пептиды и рекомбинантные лекарственные средства, половые гормоны и контрацептивы, спермициды, стимуляторы и их комбинации.
В некоторых вариантах осуществления активный фармацевтический ингредиент без наложения ограничений может быть выбран из группы, состоящей из следующих: дабигатран, дронедарон, тикагрелор, илоперидон, ивакафтор, мидостаурин, азимадолин, беклометазон, апремиласт, сапацитабин, линситиниб, абиратерон, аналоги витамина D (например, кальцифедиол, кальцитриол, парикальцитол, доксеркальциферол), ингибиторы СОХ-2 (например, целекоксиб, валдекоксиб, рофекоксиб), такролимус, тестостерон, лубипростон, их фармацевтически приемлемые соли и их комбинации.
В некоторых вариантах осуществления липиды, содержащиеся в дозированной форме, без наложения ограничений могут быть выбраны из группы, состоящей из следующих: миндальное масло, аргановое масло, масло авокадо, масло семян бораго, масло канолы, масло из ореха кешью, касторовое масло, гидрированное касторовое масло, масло какао, кокосовое масло, сурепное масло, кукурузное масло, хлопковое масло, масло из виноградных косточек, масло лесного ореха, конопляное масло, гидроксилированный лецитин, лецитин, льняное масло, масло австралийского ореха, масло манго, масло из манильской пеньки, масло из ореха монгонго, оливковое масло, пальмоядровое масло, пальмовое масло, арахисовое масло, масло из ореха пекан, перилловое масло, масло из кедрового ореха, фисташковое масло, маковое масло, тыквенное масло, масло мяты перечной, рисовое масло, сафлоровое масло, кунжутное масло, масло ши, соевое масло, подсолнечное масло, гидрированное растительное масло, ореховое масло и арбузное масло. Другие масла и жиры могут включать, но не ограничиваются только ими, рыбий жир (омега-3), масло криля, животные или растительные жиры, например, находящиеся в их гидрированной форме, свободные жирные кислоты и моно-, ди- и триглицериды жирных кислот С8, С10, C12, С14, C16, C16, C20 и C22, эфиры жирных кислот, таких как ЭПК (эйкозапентаеновая кислота) и ДГК (докозагексаеновая кислота), и их комбинации.
В некоторых вариантах осуществления активные средства могут включать средства, уменьшающие содержание липидов, включая, но не ограничиваясь только ими, статины (например, ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин и питавастатин), фибраты (например, клофибрат, ципрофибрат, безафибрат, фенофибрат и гемфиброзил), ниацин, средства, усиливающие экскрецию желчных кислот, эзетимиб, ломитапид, фитостеролы и их фармацевтически приемлемые соли, гидраты, сольваты и пролекарства, смеси любых из перечисленных выше веществ и т.п.
Подходящие питательные активные средства могут включать, но не ограничиваются только ими, 5-гидрокситриптофан, ацетил-L-карнитин, альфа-липоевую кислоту, альфа-кетоглутараты, продукты пчеловодства, бетаингидрохлорид, бычий хрящ, кофеин, цетилмиристолеат, древесный уголь, хитозан, холин, хондроитинсульфат, кофермент Q10, коллаген, колострум, креатин, цианокобаламин (витамин В12), диметиламиноэтанол, фумаровую кислоту, сесквиоксид германия, полученные из желез продукты, глюкозамин-HCI, глюкозаминсульфат, гидроксиметилбутират, иммуноглобулин, молочную кислоту, L-карнитин, полученные из печени продукты, яблочную кислоту, безводную мальтозу, маннозу (d-маннозу), метилсульфонилметан, фитостеролы, пиколиновую кислоту, пируват, экстракт красных дрожжей, S-аденозилметионин, содержащие селен дрожжи, акулий хрящ, теобромин, ванадилсульфат и дрожжи.
Подходящие являющиеся питательными добавками активные средства могут включать витамины, минералы, волокно, жирные кислоты, аминокислоты, фитопрепараты или их комбинацию.
Подходящие являющиеся витаминами активные средства могут включать, но не ограничиваются только ими, следующие: аскорбиновая кислота (витамин С), витамины В, биотин, растворимые в жирах витамины, фолиевая кислота, гидроксилимонная кислота, инозит, минеральные аскорбаты, смешанные токоферолы, ниацин (витамин В3), оротовая кислота, пара-аминобензойная кислота, пантотенаты, пантотеновая кислота (витамин В5), пиридоксингидрохлорид (витамин В6), рибофлавин (витамин В2), синтетические витамины, тиамин (витамин В1), токотриенолы, витамин А, витамин D, витамин Е, витамин F, витамин K, содержащие витамин масла и растворимые в маслах витамины.
Подходящие являющиеся фитопрепаратами активные средства могут включать, но не ограничиваются только ими, следующие: арника, черника, клопогон кистевидный, кошачий коготь, ромашка, эхинацея, масло примулы вечерней, пажитник, льняное семя, пиретрум девичий, чесночное масло, корень имбиря, гинкго билоба, женьшень, золотарник, боярышник, кава-кава, лакричник, молочный чертополох, подорожник, раувольфия, сенна, соевые бобы, зверобой обыкновенный, пальма сереноа, куркума, валериана.
Являющиеся минералами активные средства могут включать, но не ограничиваются только ими, следующие: бор, кальций, хелатообразующие минералы, хлорид, хром, минералы с покрытием, кобальт, медь, доломит, йод, железо, магний, марганец, минеральные премиксы, продукты минерального происхождения, молибден, фосфор, калий, селен, натрий, ванадий, яблочная кислота, пируват, цинк и другие минералы.
Примеры других возможных активных средств включают, но не ограничиваются только ими, антигистамины (например, ранитидин, дименгидринат, дифенгидрамин, хлорфенирамин и дексхлорфенираминмалеат), нестероидные противовоспалительные средства (например, аспирин, целекоксиб, ингибиторы Сох-2, диклофенак, беноксапрофен, флурбипрофен, фенопрофен, флубуфен, индопрофен, пиропрофен, карпрофен, оксапрозин, прамопрофен, муропрофен, триоксапрофен, супрофен, аминопрофен, флупрофен, булоксиновая кислота, индометацин, сулиндак, зомепирак, тиопинак, зидометацин, ацеметацин, фентиазак, клиданак, окспинак, меклофенаминовая кислота, флуфенамовая кислота, нифлумовая кислота, толфенамовая кислота, дифлунисал, флуфенисал, пироксикам, судоксикам, изоксикам, ацеклофенак, алоксиприн, азапропазон, бенорилат, бромфенак, карпрофен, салицилат холина и магния, дифлунизал, этодолак, эторикоксиб, фаисламин, фенбуфен, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, лорноксикам, локсопрофен, мелоксикам, мефенаминовая кислота, метамизол, метилсалицилат, салицилат магния, набуметон, напроксен, нимесулид, оксифенбутазон, парекоксиб, фенилбутазон, салицилсалицилат, сулиндак, сульфинпиразон, теноксикам, тиапрофеновая кислота, толметин, их фармацевтически приемлемые соли и их смеси) и ацетаминофен, противорвотные средства (например, метоклопрамид, метилналтрексон), противоэпилептические средства (например, фенитоин, мепробамат и нитразепам), сосудорасширяющие средства (например, нифедипин, папаверин, дилтиазем и никардипин), противокашлевые средства и отхаркивающие средства (например, кодеинфосфат), противоастматические средства (например, теофиллин), антациды, противоспазматические средства (например, атропин, скополамин), противодиабетические средства (например, инсулин), диуретики (например, этакриновая кислота, бендрофлутиазид), гипотензивные средства, (например, пропранолол, клонидин), гипертензивные средства (например, клонидин, метилдопа), бронхорасширяющие средства (например, албутерол), стероиды (например, гидрокортизон, триамцинолон, преднизон), антибиотики (например, тетрациклин), противогеморроидальные средства, снотворные средства, психотропные средства, противодиарейные средства, муколитические средства, успокаивающие средства, противоотечные средства (например, псевдоэфедрин), слабительные, витамины, стимуляторы (включая средства для подавления аппетита, такие как фенилпропаноламин) и каннабиноиды, а также их фармацевтически приемлемые соли, гидраты, сольваты и пролекарства.
Активным средством также может являться бензодиазепин, барбитурат, стимуляторы или их смеси. Термин "бензодиазепины" означает бензодиазепин и лекарственные средства, которые являются производными бензодиазепина, которые обладают способностью подавлять функции центральной нервной системы. Бензодиазепины включают, но не ограничиваются только ими, алпразолам, бромазепам, хлордиазепоксид, клоразепат, диазепам, эстазолам, флуразепам, галазепам, кетазолам, лоразепам, нитразепам, оксазепам, празепам, квазепам, темазепам, триазолам, а также их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства и их смеси. Антагонисты бензодиазепина, которые можно использовать в качестве активного средства, включают, но не ограничиваются только ими, флумазенил, а также его фармацевтически приемлемые соли, гидраты, сольваты и их смеси.
Термин "барбитураты" означает успокаивающие-снотворные лекарственные средства, образованные из барбитуровой кислоты (2,4,6-триоксогексагидропиримидин). Барбитураты включают, но не ограничиваются только ими, амобарбитал, апробарбитал, бутабарбитал, буталбитал, метогекситал, мефобарбитал, метарбитал, пентобарбитал, фенобарбитал, секобарбитал, а также их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства и их смеси. Антагонисты барбитурата, которые можно использовать в качестве активного средства, включают, но не ограничиваются только ими, амфетамины, а также их фармацевтически приемлемые соли, гидраты, сольваты и их смеси.
Термин "стимуляторы" включает, но не ограничивается только ими, амфетамины, такие как комплекс декстроамфетамина со смолой, декстроамфетамин, метамфетамин, метилфенидат, а также их фармацевтически приемлемые соли, гидраты и сольваты, и их смеси. Антагонисты стимулятора, которые можно использовать в качестве активного средства, включают, но не ограничиваются только ими, бензодиазепины, а также их фармацевтически приемлемые соли, гидраты, сольваты и их смеси.
Дозированные формы, предлагаемые в настоящем изобретении, включают различные активные средства и их фармацевтически приемлемые соли. Фармацевтически приемлемые соли включают, но не ограничиваются только ими, соли, полученные из неорганических кислот, такие как гидрохлорид, гидробромид, сульфат, фосфат и т.п.; соли, полученные из органических кислот, такие как формиат, ацетат, трифторацетат, малеат, тартрат и т.п.; сульфонаты, такие как метансульфонат, бензолсульфонат, п-толуолсульфонат и т.п.; соли, полученные из аминокислот, такие как аргинат, аспаргинат, глутамат и т.п., и соли металлов, такие как натриевая соль, калиевая соль, цезиевая соль и т.п.; соли щелочноземельных металлов, такие как кальциевая соль, магниевая соль и т.п.; соли органического амина, такие как соль триэтиламина, соль пиридина, соль пиколина, соль этаноламина, соль триэтаноламина, соль дихлоргексиламина, соль N,N'-дибензилэтилендиамина и т.п.
При использовании в настоящем изобретении термины "терапевтически эффективное" и "эффективное количество" означают количество активного средства или скорость его введения, которые необходимы для обеспечения необходимого терапевтического результата.
При использовании в настоящем изобретении "оболочка" или "композиция оболочки" означает оболочку капсулы из мягкого желатина, в которую капсулирован наполняющий материал.
При использовании в настоящем изобретении термин "обычные зависящие от рН полимеры" означает, но не ограничиваются только ими, полимеры акриловой и метакриловой кислоты, которые выпускаются под торговым названием EUDRAGIT®, и другие обычные нерастворимые в кислоте полимеры, например, сополимеры метилакрилата с метакриловой кислотой. Другие обычные нерастворимые в кислоте полимеры включают, но не ограничиваются только ими, ацетат-сукцинат целлюлозы, ацетат-фталат целлюлозы, ацетат -бутират целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы (ацетат-сукцинат гипромеллозы), поливинилацетатфталат (ПВАФ), соли альгиновой кислоты, такие как альгинат натрия и альгинат калия, стеариновую кислоту и шеллак. Пектин и производные пектина не считаются обычными зависящими от рН полимерами. В некоторых вариантах осуществления композиция зависящей от рН оболочки, предлагаемая в настоящем изобретении, не содержит нерастворимый в кислоте полимер. Другими словами, в некоторых вариантах осуществления композиция зависящей от рН оболочки и зависящая от рН капсула из мягкого желатина "не содержат или в основном не содержат обычные зависящие от рН полимеры".
При использовании в настоящем изобретении "не содержит или в основном не содержит" означает, что композиция содержит менее примерно 1 мас. %, менее примерно 0,5 мас. %, менее примерно 0,25 мас. %, менее примерно 0,1 мас. %, менее примерно 0,05 мас. %, менее примерно 0,01 мас. % или 0 мас. % указанного компонента.
Во всем настоящем описании и в формуле изобретения все указанные в мас. % значения означают массу компонента в пересчете на массу всей композиции и они также могут быть обозначены, как мас./мас.
При использовании в настоящем изобретении термин "наполняющий материал" или "материал для наполнения" означает композицию, которую капсулируют в зависящую от рН оболочку капсулы, и она содержит по меньшей мере один фармацевтически активный ингредиент.
При использовании в настоящем изобретении термины "капсулы задержанного высвобождения" или "капсулы задержанного высвобождения из мягкого желатина", или "зависящие от рН капсулы", или "зависящие от рН капсулы из мягкого желатина" означают капсулы, которые обладают характеристиками задержанного высвобождения или зависящими от рН характеристиками после того, как наполняющий материал капсулируют в оболочку и капсулы сушат. В некоторых вариантах осуществления эти термины могут означать капсулы, которые после сушки также отверждают. В некоторых вариантах осуществления после сушки дополнительные стадии обработки не требуются. В некоторых вариантах осуществления после отверждения дополнительные стадии обработки не требуются.
При использовании в настоящем изобретении термин "примерно" означает любые значения, равные этому значению с отклонением на ±10%, таким образом, значение, равное "примерно 10", включает значения, равные от 9 до 11. При использовании в настоящем изобретении термины в единственном или во множественном числе означают один или большее количество, если не указано иное. Так, например, указание на "инертный наполнитель" включает указание на один наполнитель, а также на смесь двух или большего количества разных инертных наполнителей и т.п.
Указание диапазонов значений в настоящем изобретении используется лишь для краткого специального указания на все отдельные значения, находящиеся в этом диапазоне, если в настоящем изобретении не указано иное, и каждое отдельное значение включено в описание, как если бы оно было специально указано в настоящем изобретении. Все методики, описанные в настоящем изобретении, можно проводить в любом подходящем порядке, если в настоящем изобретении не указано иное и если это явно не противоречит контексту.
Использование любого и всех примеров или указаний на типичные значения (например, "такой как") в настоящем изобретении предназначено лишь для описания определенных материалов и способов и не налагает ограничения на объем настоящего изобретения. Никакое выражение в описании не следует рассматривать, как указывающее на какой-либо незаявленный элемент, важный для практического применения раскрытых материалов и способов.
В первом варианте осуществления зависящая от рН капсула из мягкого желатина содержит (а) наполняющий материал и (b) композицию зависящей от рН оболочки, где наполняющий материал содержит по меньшей мере один фармацевтически активный ингредиент, где композиция зависящей от рН оболочки содержит желатин, декстрозу, зависящий от рН материал (например, низкометоксилированный пектин) и необязательно пластификатор. Предпочтительно, если композиция зависящей от рН не содержит дополнительные зависящие от рН полимеры.
Подходящие наполняющие материалы содержат по меньшей мере один фармацевтически активный ингредиент и их можно получить по известным методикам. В дополнение по меньшей мере к одному фармацевтически активному ингредиенту подходящие наполняющие материалы могут содержать дополнительные наполняющие компоненты, такие как вкусовые агенты, подсластители, окрашивающие агенты и наполнители, или другие фармацевтически приемлемые инертные наполнители или добавки, такие как синтетические красители и неорганические оксиды. Специалист с общей подготовкой в данной области техники может легко определить подходящие количества фармацевтически активного ингредиента и фармацевтически приемлемых инертных наполнителей.
В одном варианте осуществления желатин, содержащийся в композиции зависящей от рН оболочки, может включать желатин типа А, желатин типа В, шкурный или кожный желатин (например, из телячьей шкуры, свиной кожи) и/или костный желатин (например, из телячьей кости, свиной кости), использующиеся по отдельности или в комбинации. В одном варианте осуществления желатином является желатин, обладающий прочностью по Блуму, равной 250 градусов. В другом варианте осуществления содержится желатин только одного типа. В еще одном варианте осуществления желатин представляет собой комбинацию желатинов по меньшей мере двух типов. В одном варианте осуществления количество желатина, содержащегося в композиции зависящей от рН оболочки, составляет от примерно 30 до примерно 85 мас. %, от примерно 30 до примерно 75 мас. %, от примерно 30 до примерно 65 мас. %, от примерно 30 до примерно 55 мас. %, от примерно 30 до примерно 40 мас. %, от примерно 40 до примерно 80 мас. %, от примерно 45 до примерно 65 мас. %, от примерно 45 до примерно 75 мас. % или от примерно 50 до примерно 70 мас. % в пересчете на полную массу сухой композиции оболочки капсулы, или оно представляет собой любое отдельное значение количества или количество, находящееся в любом субдиапазоне, указанном в настоящем изобретении.
В одном варианте осуществления композиция зависящей от рН оболочки капсулы содержит декстрозу. В одном варианте осуществления количество декстрозы, содержащееся в композиции зависящей от рН оболочки капсулы, составляет от примерно 0,001 до примерно 1,0 мас. %, от примерно 0,002 до примерно 0,008 мас. %, от примерно 0,005 или от примерно 0,01 до примерно 4 мас. %, от примерно 0,1 или от примерно 0,15 до примерно 3 мас. %, от примерно 0,1 до примерно 1 мас. %, от примерно 0,1 или от примерно 0,15, или от примерно 0,2, или от примерно 0,25 до примерно 2 мас. %, от примерно 0,1 до примерно 0,2 мас. %, от примерно 0,1 до примерно 0,4 мас. % в пересчете на полную массу сухой композиции оболочки капсулы, или оно представляет собой любое отдельное значение количества или количество, находящееся в любом субдиапазоне, указанном в настоящем изобретении. Декстрозу можно добавить в оболочку капсулы задержанного высвобождения для обеспечения ослабления возможного уменьшения прочности геля. Без наложения ограничений можно предположить, что в композиции оболочки декстроза взаимодействует с желатином и вызывает сшивку желатина. Влияние количества декстрозы на характеристики растворения композиции оболочки дополнительно проиллюстрировано в примерах. Концентрация декстрозы, содержащейся в композиции зависящей от рН оболочки, может являться эффективной для улучшения прочности геля, но не настолько высокой, чтобы происходило ухудшение герметичности капсулы или обрабатываемости или рабочих характеристик продукта.
В некоторых вариантах осуществления композиция зависящей от рН оболочки может содержать пектин, например, низкометоксилированный пектин. В одном варианте осуществления пектином является низкометоксилированный (НМ) пектин, обладающий степенью этерификации, составляющей менее 50. В некоторых вариантах осуществления пектином является амидированный пектин.
В других вариантах осуществления низкометоксилированным (НМ) пектином является неамидированный пектин. В некоторых вариантах осуществления пектин представляет собой комбинацию амидированного пектина и неамидированного пектина. Добавление пектина способствует обеспечению зависящих от рН характеристик дозированной формы.
Чрезмерное количество пектина, содержащегося в дозированной форме, может уменьшить прочность геля капсулы из мягкого желатина, что, в свою очередь, может оказывать неблагоприятное воздействие на герметизируемость капсулы из мягкого желатина. Чрезмерное количество пектина, содержащегося в композиции зависящей от рН оболочки, также может привести к увеличению вязкости композиции оболочки, это делает затруднительным или невозможным проведение обработки при изготовлении.
Поэтому, пектин можно добавлять в дозированную форму при концентрации, которая является достаточно высокой для получения дозированной формы задержанного высвобождения, и в то же время достаточно низкой для обеспечения ослабления уменьшения прочности геля и обеспечения ослабления увеличения вязкости.
В одном варианте осуществления количество пектина, содержащегося в композиции зависящей от рН оболочки, составляет от примерно 2 до примерно 20 мас. %, от примерно 3 до примерно 15 мас. %, от примерно 3 до примерно 5,5 мас. %, от примерно 4 до примерно 11 мас. %, от примерно 7 до примерно 12 мас. %, от примерно 8 до примерно 13 мас. % или от примерно 5 до примерно 10 мас. % в пересчете на полную массу сухой композиции оболочки капсулы, или оно представляет собой любое отдельное значение количества или количество, находящееся в любом субдиапазоне, указанном в настоящем изобретении.
Степень этерификации пектина, содержащегося в композиции зависящей от рН оболочки, может составлять менее примерно 50% или она может находиться в диапазоне от примерно 10 до примерно 50%, от примерно 20 до примерно 40% или от примерно 25 до примерно 35%. Кроме того, пектин может являться амидированный или неамидированным.
В некоторых вариантах осуществления композиция зависящей от рН оболочки содержит стабилизатор и/или связующее, включающее геллановую камедь. В некоторых вариантах осуществления отношение количества пектина к количеству стабилизатора и/или связующего (например, геллановой камеди) составляет от примерно 1:10 до примерно 50:1; от примерно 1:5 до примерно 40:1; от примерно 1:1 до примерно 25:1 или от примерно 10:1 до примерно 24:1.
В некоторых вариантах осуществления количество стабилизатора и/или связующего (например, геллановой камеди), содержащегося в композиции зависящей от рН оболочки, составляет от примерно 0,05 до примерно 5 мас. %, от примерно 0,1 до примерно 3 мас. % или от примерно 0,2 до примерно 2 мас. % стабилизатора и/или связующего (например, геллановой камеди) в пересчете на полную массу сухой композиции оболочки капсулы, или оно представляет собой любое отдельное значение количества или количество, находящееся в любом субдиапазоне, указанном в настоящем изобретении.
В некоторых вариантах осуществления композиция зависящей от рН оболочки может обладать вязкостью, находящейся в диапазоне, составляющем от любого значения, равного примерно 20000 сПз, примерно 30000 сПз, примерно 40000 сПз, примерно 50000 сПз, примерно 60000 сПз или примерно 70000 сПз, до любого значения, равного примерно 80000 сПз, примерно 90000 сПз, примерно 100000 сПз, примерно 110000 сПз, примерно 120000 сПз, примерно 130000 сПз, примерно 140000 сПз или примерно 150000 сПз, или значением вязкости, находящимся в любом субдиапазоне, или любым отдельным значением вязкости, указанным в настоящем изобретении. В одном варианте осуществления композиция зависящей от рН оболочки обладает вязкостью, находящейся в диапазоне от примерно 100000 до примерно 130000 сПз или от примерно 110000 до примерно 125000 сПз, или составляющим примерно 115000 сПз или примерно 120000 сПз. Вязкость определяют с использованием реометра при 60°С, как это более подробно описано в примерах при рассмотрении фиг. 1. Образец гелевой массы (например, любой из композиций зависящих от рН оболочек, описанных в настоящем изобретении) помещают на платформу реометра, температуру которой поддерживают равной 60°С. Диск вращается с определенной скоростью и обеспечивается постоянная скорость сдвига. Вязкость определяют путем измерения напряжения сдвига и скорости сдвига.
В некоторых вариантах осуществления композиция зависящей от рН оболочки может сохранять вязкость, которая является подходящей для обрабатываемости, даже после состаривания при нагревании в течение вплоть до примерно 24 ч, вплоть до примерно 48 ч, вплоть до примерно 72 ч, вплоть до примерно 96 ч или вплоть до примерно 1 недели. В некоторых вариантах осуществления вязкость композиции зависящей от рН оболочки после состаривания при нагревании (в течение вплоть до примерно 24 ч, вплоть до примерно 48 ч, вплоть до примерно 72 ч, вплоть до примерно 96 ч или вплоть до примерно 1 недели) может уменьшиться (по сравнению со значением вязкости композиции до состаривания) на вплоть до примерно 80%, вплоть до примерно 70%, вплоть до примерно 60%, вплоть до примерно 50%, вплоть до примерно 40%, вплоть до примерно 35% или вплоть до примерно 30%.
В одном варианте осуществления пластификатор, содержащийся в композиции зависящей от рН оболочки, может включать глицерол, глицерин, сорбит и их комбинации. Другие подходящие пластификаторы могут включать, но не ограничиваются только ими, пластификатор на основе гидроксисахара, такого как изомальт, мальтит, ксилит, эритрит, адонит, дульцит, пентаэритрит или маннит; или пластификатор на основе полиола, такого как диглицерин, этиленгликоль, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль, дипропиленгликоль, полиэтиленгликоль, обладающий ММ (молекулярная масса), равной вплоть до 10000, неопентилгликоль, пропиленгликоль, 1,3-пропандиол, 2-метил-1,3-пропандиол, триметилолпропан, простой полиэфирполиол, этаноламины; и их смеси. Другие типичные пластификаторы также могут включать, но не ограничиваются только ими, обладающие низкой молекулярной массой полимеры, олигомеры, сополимеры, масла, небольшие органические молекулы, обладающие низкой молекулярной массой полиолы, содержащие алифатические гидроксигруппы, сложноэфирные пластификаторы, простые эфиры гликолей, поли(пропиленгликоль), полиблок-сополимеры, моноблочные полимеры, сложноэфирные пластификаторы - цитраты и триацетин. Такие пластификаторы могут включать 1,2-бутиленгликоль, 2,3-бутиленгликоль, стиролгликоль, моноизопропиловый эфир монопропиленгликоля, моноэтиловый эфир пропиленгликоля, моноэтиловый эфир этиленгликоля, моноэтиловый эфир диэтиленгликоля, сорбитлактат, этиллактат, бутиллактат, этилгликолят, дибутилсебацинат, ацетилтрибутилцитрат, триэтилцитрат, глицерилмоностеарат, полисорбат 80, ацетилтриэтилцитрат, трибутилцитрат и аллилгликолят, и их смеси В одном варианте осуществления количество пластификатора, содержащегося в композиции зависящей от рН оболочки, составляет от примерно 15 до примерно 45 мас. %, от примерно 15 до примерно 40 мас. %, от примерно 18 до примерно 45 мас. %, от примерно 18 до примерно 42 мас. %, от примерно 20 до примерно 35 мас. %, от примерно 25 до примерно 30 мас. % в пересчете на полную массу сухой композиции оболочки капсулы, или оно представляет собой любое отдельное значение количества или количество, находящееся в любом субдиапазоне, указанном в настоящем изобретении.
В некоторых вариантах осуществления количества различных компонентов (например, пектина, декстрозы, желатина, пластификатора) и значения отношений количеств различных компонентов регулируют с целью регулирования характеристик растворения и/или распада капсулы из мягкого желатина в различных диапазонах значений рН.
Так, например, отношение массы желатина к массе пектина в композиции зависящей от рН оболочки может находиться в диапазоне от любого значения, равного примерно 2:1, примерно 3:1, примерно 4:1, примерно 5:1, примерно 6:1, примерно 7:1, примерно 8:1 или примерно 9:1, до любого значения, равного примерно 10:1, примерно 11:1, примерно 12:1, примерно 13:1, примерно 14:1, примерно 15:1, примерно 16:1, примерно 17:1, примерно 18:1, примерно 19:1 или примерно 20:1, или оно может находиться в любом субдиапазоне, или представлять собой любое отдельное значение, указанное в настоящем изобретении. В некоторых вариантах осуществления более низкие значения отношения массы желатина к массе пектина обеспечивают получение композиции зависящей от рН оболочки, которая является более стабильной (растворяется медленнее, если она вообще растворяется) в кислой среде (например, в 0,1 н. растворе HCl необязательно с добавлением пепсина), тогда как более высокие значения отношения массы желатина к массе пектина обеспечивают получение композиции зависящей от рН оболочки, которая является менее стабильной (растворяется быстрее) в кислой среде (например, в 0,1 н. растворе HCl необязательно с добавлением пепсина). Значение отношения массы желатина к массе пектина можно регулировать для обеспечения определенного времени растворения капсулы из мягкого желатина в кислой среде (например, примерно 10 мин, примерно 15 мин, примерно 30 мин, примерно 45 мин, примерно 60 мин, примерно 90 мин и т.д.).
Отношение массы желатина к массе пластификатора в композиции зависящей от рН оболочки также можно регулировать для обеспечения определенной твердости капсулы и оно может находиться в диапазоне от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 3:1 до примерно 1:3, от примерно 2:1 до примерно 1:2, примерно 1:1, или оно представляет собой любое отдельное значение отношения или значение отношения, находящееся в любом субдиапазоне, указанном в настоящем изобретении.
В некоторых вариантах осуществления композиции зависящих от рН оболочек, описанные в настоящем изобретении, могут обладать твердостью, находящейся в диапазоне, составляющем от любого значения, равного примерно 5 Н, примерно 6 Н, примерно 7 Н, примерно 8 Н, примерно 9 Н или примерно 10 Н, до любого значения, равного примерно 11 Н, примерно 12 Н, примерно 13 Н, примерно 14 Н или примерно 15 Н. Твердость капсулы определяют с использованием устройства для определения твердости. Сила, выраженная в Ньютонах, необходимая для сжатия капсулы на 2,0 мм, определена, как твердость капсулы.
В некоторых вариантах осуществления композиции зависящих от рН оболочек, описанные в настоящем изобретении, могут обладать содержанием влаги в оболочке, находящимся в диапазоне, составляющем от любого значения, равного примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9% или примерно 10%, до любого значения, равного примерно 11%, примерно 12%, примерно 13%, примерно 14% или примерно 15%. Содержание влаги в оболочке определяют по методике определения потерь при сушке. Образец композиции зависящей от рН оболочки капсулы массой от 1 до 2 г выдерживают в сушильном шкафу при 105°С в течение 17 ч. Регистрируют начальную массу образца. После сушки образца в сушильном шкафу при 105°С в течение 17 ч регистрируют конечную массу образца. Выраженная в процентах потеря массы, рассчитанная в соответствии с приведенным ниже уравнением, определена, как содержание влаги в оболочке:
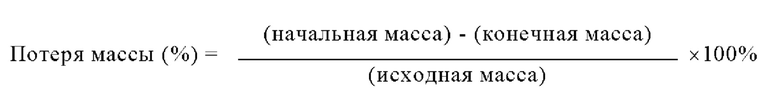
В некоторых вариантах осуществления композиции зависящих от рН оболочек, описанные в настоящем изобретении, могут характеризоваться равновесной относительной влажностью, находящейся в диапазоне, составляющем от любого значения, равного примерно 25%, примерно 28%, примерно 30%, примерно 32%, примерно 34% или примерно 35%, до любого значения, равного примерно 38%, примерно 40%, примерно 42%, примерно 45% или примерно 50%. Равновесная относительная влажность (%) определена, как влажность, при которой капсула сохраняет постоянную полную массу. Ее определяют с использованием камер искусственного климата, в которых с использованием насыщенных растворов солей поддерживают постоянную влажность.
В некоторых вариантах осуществления композиции зависящих от рН оболочек, описанные в настоящем изобретении, могут обладать прочностью на раздавливание, находящейся в диапазоне, составляющем от любого значения, равного примерно 50 кг, примерно 60 кг, примерно 70 кг, примерно 80 кг или примерно 90 кг, до любого значения, равного примерно 100 кг, примерно 110 кг, примерно 120 кг, примерно 130 кг, примерно 140 кг или примерно 150 кг. Прочность на раздавливание определяют с использованием Texture Analyzer. С помощью Texture Analyzer капсулу сжимают до тех пор, пока она не разрушается. Сила, выраженная в килограммах, необходимая для разрушения капсулы, определена, как прочность на раздавливание.
В одном варианте осуществления композиция зависящей от рН оболочки и зависящая от рН капсула из мягкого желатина может не содержать или в основном не содержать обычные зависящие рН полимеры и/или может не содержать зависящее от рН наружное покрытие, нанесенное на оболочку из мягкого желатина.
В одном варианте осуществления композиция зависящей от рН оболочки и зависящая от рН капсула из мягкого желатина может содержать соли, образованные с двухвалентными катионами, такими как Са++ (например, CaCl2) или Mg++ (например, MgCl2). В другом варианте осуществления композиция зависящей от рН оболочки и зависящая от рН капсула из мягкого желатина может не содержать или в основном не содержать соли, образованные с двухвалентными катионами, такими как Са++ (например, CaCl2) или Mg++ (например, MgCl2). В другом варианте осуществления получение композиции зависящей от рН оболочки может не включать стадию добавления солей, образованных с двухвалентными катионами, такими как Са++ (например, CaCl2) или Mg++ (например, MgCl2), отличающихся от солей образованных с двухвалентными катионами, которые в определенном количестве могут содержаться в других компонентах.
В одном варианте осуществления композиция зависящей от рН оболочки необязательно может содержать дополнительные агенты, такие как стабилизаторы или связующие (например, геллановая камедь), окрашивающие агенты, вкусовые агенты, подсластители, наполнители, антиоксиданты, разбавители, модификаторы рН или другие фармацевтически приемлемые инертные наполнители или добавки, такие как синтетические красители и неорганические оксиды.
Типичные подходящие окрашивающие агенты могут включать, но не ограничиваются только ими, обеспечивающие такие цвета, как например, белый, черный, желтый, синий, зеленый, розовый, красный, оранжевый, фиолетовый, темно-синий и коричневый. В предпочтительных вариантах осуществления цвет дозированной формы может указывать на содержащиеся в ней компоненты (например, один или большее количество активных ингредиентов).
Типичные подходящие вкусовые агенты могут включать, но не ограничиваются только ими, "ароматический экстракт", полученный путем экстракции части исходного материала, например, материала животного или растительного происхождения, часто путем использования растворителя, такого как этанол или вода; натуральные эссенции, полученные путем экстракции эфирных масел из цветков, плодов, корней и т.п., или из цельных растений.
Дополнительные типичные вкусовые агенты, которые могут содержаться в дозированной форме, могут включать, но не ограничиваются только ими, освежающие дыхание соединения, такие как ментол, мяту и корицу, кофейные зерна, другие вкусовые добавки или отдушки, такие как фруктовые вкусовые добавки (например, придающие вкус вишни, апельсина, винограда и т.п.), в особенности такие, которые используют для гигиена полости рта, а также активные вещества, использующиеся для чистки зубов и очистки полости рта, такие как четвертичные аммониевые основания. Эффект вкусовых добавок можно усилить с использованием усилителей вкуса, таких как винная кислота, лимонная кислота, ванилин и т.п.
Типичные подсластители могут включать, но не ограничиваются только ими, один или большее количество искусственных подсластителей, один или большее количество натуральных подсластителей, или их комбинацию. Искусственные подсластители включают, например, ацесульфам и его различные соли, такие как калиевая соль (продается под названием Sunett®), алитам, аспартам (продается под названием NutraSweet® и Equal®), соль аспартама-ацесульфама (продается под названием Twinsweet®), неогесперидиндигидрохалькон, нарингиндигидрохалькон, соединения дигидрохалькона, неотам, цикламат натрия, сахарин и его различные соли, такие как натриевая соль (продается под названием Sweet'N Low®), стевию, хлорпроизводные сахарозы, такие как сукралоза (продается под названием Kaltame® и Splenda®), и могрозиды. Натуральные подсластители включают, например, глюкозу, декстрозу, инвертный сахар, фруктозу, сахарозу, глицирризин; моноаммонийглициризинат (продается под торговым названием MagnaSweet®); стевию медовую (стевиозид), натуральные интенсивные подсластители, такие как архат, полиолы, такие как сорбит, маннит, ксилит, эритрит и т.п.
В некоторых вариантах осуществления композицию зависящей от рН оболочки и/или зависящую от рН капсулу из мягкого желатина можно исследовать с помощью испытания на растворение/распадаемость, проводимого с использованием аппарата ФСША (Фармакопея США) II с лопастями при скорости перемешивания, равной 50 об/мин, в кислой среде (рН=1,2 (0,1 н. раствор HCl), необязательно с добавлением пепсина) и затем в буферной среде (рН=6,8, фосфатный буфер, необязательно с добавлением панкреатина). В этом варианте осуществления зависящая от рН капсула из мягкого желатина может оставаться неповрежденной в кислой среде в течение не менее примерно 10 мин, не менее примерно 15 мин, не менее примерно 30 мин, не менее примерно 1 ч, не менее примерно 2 ч, не менее примерно 3 ч, не менее примерно 4 ч или не менеепримерно 5 ч, и может распадаться в буферной среде в течение примерно 60 мин или менее, в течение примерно 45 мин или менее, в течение примерно 30 мин или менее, в течение примерно 20 мин или менее, в течение примерно 15 мин или менее, в течение примерно 10 мин или менее, или в течение примерно 5 мин или менее.
Хотя буферная среда, использующаяся для испытания на растворение/распадаемость в двух фазах, обладает значением рН, равным 6,8, следует отметить, что сходный профиль растворения/распадаемости можно обеспечить при использовании буферной среды, обладающей значением рН, равным примерно 3,5 или более (необязательно с добавлением панкреатина). Также следует отметить, что в соответствии с фармакопейными методиками наличие пепсина (в кислой среде) и панкреатина (в буферной среде) не является необходимым, однако их используют в настоящем изобретении в некоторых случаях для моделирования более агрессивных сред, которые лучше имитируют условия in vivo.
В некоторых вариантах осуществления проводимое испытание на растворение/распадаемость в двух фазах (включая и кислую среду, и буферную среду) можно проводить в течение всего примерно 420 мин, примерно 360 мин, примерно 300 мин, примерно 240 мин, примерно 210 мин, примерно 180 мин, примерно 150 мин, примерно 120 мин, примерно 105 мин, примерно 90 мин, примерно 75 мин, примерно 60 мин, примерно 45 мин, примерно 30 мин, примерно 15 мин, примерно 10 мин или примерно 5 мин.
Капсулирование наполняющего материала можно провести по любой обычной методике. Так, например, можно использовать капсулирование с помощью ротационного штампа.
В одном варианте осуществления зависящую от рН капсулу из мягкого желатина изготавливают способом, включающим стадии: (а) получения наполняющего материала, указанный наполняющий материал содержит по меньшей мере один фармацевтически активный ингредиент; и (b) капсулирования наполняющего материала, полученного на стадии (а), с использованием композиции зависящей от рН оболочки. Процедура капсулирования, проводимая на стадии (b), может дополнительно включать подстадию получения композиции зависящей от рН оболочки путем, например, смешивания желатина, декстрозы, пектина и необязательно пластификатора. Предпочтительно, если композиция зависящей от рН оболочки не содержит дополнительные зависящие от рН полимеры (такие как обычные зависящие от рН синтетические полимеры).
Толщину ленты из композиции зависящей от рН оболочки (использующейся, например, при капсулировании с помощью ротационного штампа) также можно регулировать с целью регулирования зависящего от рН профиля растворения готовой зависящей от рН капсулы из мягкого желатина. Толщина ленты из композиции зависящей от рН оболочки, без наложения ограничений, может находиться в диапазоне, составляющем от любого значения, равного примерно 0,02 дюйма, примерно 0,022 дюйма, примерно 0,024 дюйма, примерно 0,026 дюйма, примерно 0,028 дюйма или примерно 0,030 дюйма, до любого значения, равного примерно 0,032 дюйма, примерно 0,034 дюйма, примерно 0,036 дюйма, примерно 0,038 дюйма, примерно 0,04 дюйма, примерно 0,042 дюйма, примерно 0,044 дюйма или примерно 0,050 дюйма, или она может находится в любом субдиапазоне, или обладать любым отдельным значением, указанным в настоящем изобретении.
В некоторых вариантах осуществления зависящую от рН капсулу из мягкого желатина (например, после капсулирования) можно сушить и необязательно отверждать. Отверждение капсулы из мягкого желатина можно провести при температуре, находящейся в диапазоне от примерно 25 до примерно 75°С, от примерно 25 до примерно 70°С, от примерно 30 до примерно 60°С или примерно от 35 до 50°С. Температура отверждения должна являться достаточно высокой для улучшения характеристик задержанного высвобождения капсул из мягкого желатина, но не такой высокой, чтобы капсулы из мягкого желатина плавились.
Продолжительность отверждения может находиться в диапазоне от примерно 12 до примерно 168 ч, от примерно 18 до примерно 120 ч, от примерно 24 до примерно 72 ч, составлять примерно 24 ч, примерно 48 ч, примерно 72 ч, или она может находится в любом субдиапазоне, или обладать любым отдельным значением, указанным в настоящем изобретении. В одном варианте осуществления отверждение капсулы из мягкого желатина можно провести при температуре, равной примерно 40°С, в течение примерно 24 ч. В одном варианте осуществления отверждение капсулы из мягкого желатина можно провести при температуре, равной примерно 40°С, в течение примерно 48 ч. В одном варианте осуществления отверждение капсулы из мягкого желатина можно провести при температуре, равной примерно 40°С, в течение примерно 72 ч. В некоторых вариантах осуществления отверждение можно провести на воздухе (без проведения какого-либо особого регулирования содержания азота или кислорода, или влажности). В некоторых вариантах осуществления отверждение можно провести в условиях инертной среды (например, в атмосфере азота).
В одном варианте осуществления способ изготовления зависящей от рН капсулы из мягкого желатина включает следующие стадии, в основном состоит или состоит из следующих стадий: а) получение любого из наполняющих материалов, описанных в настоящем изобретении; b) капсулирование наполняющего материала, полученного на стадии (а), с использованием любой из композиций зависящих от рН оболочек, описанных в настоящем изобретении (например, путем капсулирования с помощью ротационного штампа); с) сушка полученных после капсулирования зависящих от рН капсул из мягкого желатина (например, путем сушки с переворачиванием или путем обычной сушки в корзинке без переворачивания); и необязательно d) отверждение зависящих от рН капсул из мягкого желатина в соответствии с любыми условиями проведения отверждения, описанными в настоящем изобретении.
В некоторых вариантах осуществления сушку проводят при температуре, равной от примерно 10 до примерно 50°С, от примерно 15 до примерно 40°С или от примерно 20 до примерно 35°С, при относительной влажности, равной от примерно 5 до примерно 40%, от примерно 10 до примерно 30% или от примерно 15 до примерно 25%.
В некоторых вариантах осуществления в настоящем изобретении следует различать сушку и отверждение. Задачей сушки капсул задержанного высвобождения из мягкого желатина, описанных в настоящем изобретении, является удаление избытка воды из капсулы задержанного высвобождения из мягкого желатина сразу после капсулирования. Таким образом капсулы становятся физически стабильными. Задачей отверждения капсул задержанного высвобождения из мягкого желатина, описанных в настоящем изобретении, является улучшение характеристик задержанного высвобождения капсулы задержанного высвобождения из мягкого желатина. Поэтому наличие стадии сушки не означает то же самое, что и наличие стадии отверждения, и, аналогичным образом, наличие стадии отверждения не означает то же самое, что и наличие стадии сушки.
В некоторых вариантах осуществления капсулы задержанного высвобождения из мягкого желатин, содержащие композиции зависящих от рН оболочек, описанные в настоящем изобретении, являются химически и физически стабильными.
Так, например, их химическую стабильность можно подтвердить путем определения содержания активного средства, содержащегося в наполняющем материале (например, содержание компонентов рыбьего жира, если наполняющий материал включает рыбий жир). В некоторых вариантах осуществления содержание компонентов наполняющего материала является в основном таким же (или соответствует техническим требованиям) после хранения в течение вплоть до 12 месяцев, вплоть до 6 месяцев, вплоть до 3 месяцев или вплоть до 1 месяца (при условиях окружающей среды или при использовании жестких условий - при 40°С и относительной влажности, равной 75%, в течение любого из этих промежутков времени), как содержание в исходном материале до хранения.
В некоторых вариантах осуществления физическую стабильность капсул задержанного высвобождения из мягкого желатина можно подтвердить путем определения профиля растворения капсулы в кислой среде и в буферной среде. Так, например, профиль растворения капсулы в кислой среде и в буферной среде является в основном таким же (или соответствует техническим требованиям) после хранения в течение вплоть до 12 месяцев, вплоть до 6 месяцев, вплоть до 3 месяцев или вплоть до 1 месяца (при условиях окружающей среды или при использовании жестких условий - при 40°С и относительной влажности, равной 75%, в течение любого из этих промежутков времени), как профиль растворения капсулы до хранения.
Термин "в основном такой же" может означать конкретное значение, отличающееся от соответствующего сравнительного значения примерно на 30%, примерно на 25%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%. Выраженные в процентах значения рассчитывают в пересчете на номинальное значение сравнительного значения. Так, например, значение продолжительности растворения, находящееся в диапазоне, составляющем от 27 до 33 мин, может считаться отличающимся на 10% от сравнительного значения продолжительности растворения, составляющего 30 мин.
В некоторых вариантах осуществления настоящее изобретение также может относиться к способу стабилизации любой из капсул задержанного высвобождения из мягкого желатина, описанной в настоящем изобретении. Способ может включать защиту (например, от окисления или другой возможной причины химического разложения) любого из наполняющих материалов, описанных в настоящем изобретении, обеспечиваемую путем капсулирования любого из наполняющих материалов, описанных в настоящем изобретении (включая по меньшей мере одно активное средство), с использованием любой из композиций зависящих от рН оболочек, описанных в настоящем изобретении.
В некоторых вариантах осуществления композиция зависящей от рН оболочки, описанная в настоящем изобретении, обеспечивает получение прочной капсулы задержанного высвобождения из мягкого желатина, которая отличается преждевременным высвобождением незначительного количества или не отличается преждевременным высвобождением наполняющего материала в кислой среде (например, в среде желудочного сока). Так, например, капсулы задержанного высвобождения из мягкого желатина, описанные в настоящем изобретении, могут высвобождать в кислой среде вплоть до примерно 10 мас. %, вплоть до примерно 9 мас. %, вплоть до примерно 8 мас. %, вплоть до примерно 7 мас. %, вплоть до примерно 6 мас. %, вплоть до примерно 5 мас. %, вплоть до примерно 4 мас. %, вплоть до примерно 3 мас. %, вплоть до примерно 1 мас. % или 0 мас. % наполняющего материала в пересчете на полную массу наполняющего материала после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин.
В некоторых вариантах осуществления отверждение капсул задержанного высвобождения из мягкого желатина, описанных в настоящем изобретении (т.е. которые капсулированы с использованием композиции зависящей от рН оболочки), может обеспечить уменьшение количества капсул, которые отличаются преждевременным высвобождением любого количества в кислой среде, или отсутствие таких капсулы. Так, например, количество отвержденных капсул, отличающихся преждевременным высвобождением в кислой среде (после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин), может составлять вплоть до примерно 30%, вплоть до примерно 25%, вплоть до примерно 20%, вплоть до примерно 15%, вплоть до примерно 10%, вплоть до примерно 5%, вплоть до примерно 3%, вплоть до примерно 2%, вплоть до примерно 1% или 0% в пересчете на полное количество капсул в партии.
В отличие от этого, без проведения отверждения количество капсул (обладающих таким же составом), отличающихся преждевременным высвобождением в кислой среде (после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин), может составлять более примерно 2%, более примерно 5%, более примерно 10%, более примерно 15%, более примерно 20%, более примерно 30%, более примерно 40%, более примерно 50%, более примерно 60%, более примерно 70%, более примерно 80% или более примерно 90% в пересчете на полное количество капсул в партии.
В некоторых вариантах осуществления отверждение капсул задержанного высвобождения из мягкого желатина, описанных в настоящем изобретении (т.е. которые капсулированы с использованием композиции зависящей от рН оболочки), может обеспечить уменьшение количества наполняющего материала, высвобождающегося из капсул, которые отличаются преждевременным высвобождением некоторого количества в кислой среде, или отсутствие такого высвобождения (например, после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин).
Так, например, количество наполняющего материала, высвобождающегося из отвержденных капсул, отличающихся преждевременным высвобождением некоторого количества в кислой среде (например, после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин), может составлять вплоть до примерно 5 мас. %, вплоть до примерно 4 мас. %, вплоть до примерно 3 мас. %, вплоть до примерно 2 мас. %, вплоть до примерно 1 мас. % или 0% в пересчете на полную массу наполняющего материала, содержащегося в капсуле.
В отличие от этого, без проведения отверждения количество наполняющего материала, высвобождающегося из капсул (обладающих таким же составом), отличающихся преждевременным высвобождением в кислой среде (например, после выдерживания в кислой среде в течение вплоть до примерно 150 мин, вплоть до примерно 120 мин, вплоть до примерно 105 мин, вплоть до примерно 90 мин, вплоть до примерно 75 мин, вплоть до примерно 60 мин, вплоть до примерно 45 мин, вплоть до примерно 30 мин, вплоть до примерно 15 мин, вплоть до примерно 10 мин или вплоть до примерно 5 мин), может составлять более примерно 1 мас. %, более примерно 2 мас. %, более примерно 3 мас. %, более примерно 4 мас. %, более примерно 5 мас. %, более примерно 6 мас. %, более примерно 7 мас. %, более примерно 8 мас. %, более примерно 9 мас. %, более примерно 10 мас. %, более примерно 15 мас. % или более примерно 20 мас. % в пересчете на полную массу наполняющего материала, содержащегося в капсуле.
В некоторых вариантах осуществления композиция зависящей от рН оболочки, описанная в настоящем изобретении, обеспечивает получение прочной капсулы задержанного высвобождения из мягкого желатина, которая остается неповрежденной в кислой среде (например, в среде желудочного сока или искусственной среде желудочного сока, такой как искусственный желудочный сок, 0,1 н. раствор HCl, необязательно с добавлением пепсина) в течение не менее примерно 10 мин, не менее примерно 15 мин, не менее примерно 30 мин, не менее примерно 1 ч, не менее примерно 2 ч, не менее примерно 3 ч, не менее примерно 4 ч или не менее примерно 5 ч, однако высвобождает не менее примерно 50 мас. %, не менее примерно 60 мас. %, не менее примерно 70 мас. %, не менее примерно 80 мас. %, не менее примерно 90 мас. %, не менее примерно 95 мас. %, не менее примерно 96 мас. %, не менее примерно 97 мас. %, не менее примерно 98 мас. % или не менее примерно 98 мас. % наполняющего материала в пересчете на полную массу наполняющего материала при значении рН, равном примерно 3,5 или более (например, в области двенадцатиперстной кишки и/или в кишках, или в их искусственных средах, таких как буферная среда, обладающая значением рН, равным 6,8, необязательно с добавлением панкреатина) в течение вплоть до примерно 5 мин, вплоть до примерно 10 мин, вплоть до примерно 15 мин, вплоть до примерно 20 мин, вплоть до примерно 25 мин, вплоть до примерно 30 мин, вплоть до примерно 35 мин, вплоть до примерно 40 мин, вплоть до примерно 45 мин или вплоть до примерно 60 мин.
В одном варианте осуществления композиция зависящей от рН оболочки содержит: (а) желатин, (b) декстрозу, (с) зависящий от рН полимер (например, пектин, такой как низкометоксилированный пектин), (d) пластификатор (например, глицерин, сорбит и их комбинации), и необязательно (е) стабилизатор и/или связующее (например, геллановую камедь). Количества и отношения масс этих компонентов могут соответствовать любому из значений или диапазонов, описанных выше в настоящем изобретении.
В одном варианте осуществления композиция зависящей от рН оболочки в основном состоит из: (а) желатина, (b) декстрозы, (с) зависящего от рН полимера (например, пектина, такого как низкометоксилированный пектин), (d) пластификатора (например, глицерина, сорбита, геллановой камеди и их комбинаций), и необязательно (е) стабилизатора и/или связующего (например, геллановой камеди). Количества и отношения масс этих компонентов могут соответствовать любому из значений или диапазонов, описанных выше в настоящем изобретении.
В одном варианте осуществления композиция зависящей от рН оболочки состоит из: (а) желатина, (b) декстрозы, (с) зависящего от рН полимера (например, пектина, такого как низкометоксилированный пектин), (d) пластификатора (например, глицерина, сорбита, геллановой камеди и их комбинаций), и необязательно (е) стабилизатора и/или связующего (например, геллановой камеди). Количества и отношения масс этих компонентов могут соответствовать любому из значений или диапазонов, описанных выше в настоящем изобретении.
В одном варианте осуществления композиция зависящей от рН оболочки содержит: (а) от примерно 30 до примерно 85 мас. %, от примерно 30 до примерно 75 мас. %, от примерно 30 до примерно 65 мас. %, от примерно 30 до примерно 55 мас. %, от примерно 30 до примерно 40 мас. %, от примерно 40 до примерно 80 мас. %, от примерно 45 до примерно 65 мас. %, от примерно 45 до примерно 75 мас. % или от примерно 50 до примерно 70 мас. % желатина, (b) от примерно 0,01 до примерно 4 мас. % или от примерно 0,1 до примерно 3 мас. %, от примерно 0,2 до примерно 2 мас. % или от примерно 0,01 до примерно 0,1 мас. %, или от примерно 0,05 до примерно 0,5 мас. %, или от примерно 0,1 до примерно 0,2 мас. % декстрозы, (с) от примерно 2 до примерно 20 мас. %, от примерно 3 до примерно 15 мас. %, от примерно 7 до примерно 15 мас. %, от примерно 3 до примерно 5,5 мас. % или от примерно 7 до примерно 12 мас. % зависящего от рН полимера (например, пектина, такого как низкометоксилированный пектин), (d) от примерно 15 до примерно 45 мас. %, от примерно 15 до примерно 40 мас. %, от примерно 20 до примерно 35 мас. % или от примерно 25 до примерно 30 мас. % пластификатора, и необязательно (е) от примерно 0,05 до примерно 5 мас. %, примерно 0,1 до примерно 3 мас. % или от примерно 0,2 до примерно 2 мас. % стабилизатора и/или связующего (например, геллановой камеди). Все выраженные в мас. % значения приведены в пересчете на полную массу сухой композиции зависящей от рН оболочки.
В одном варианте осуществления композиция зависящей от рН оболочки в основном состоит из: (а) от примерно 30 до примерно 85 мас. %, от примерно 30 до примерно 75 мас. %, от примерно 30 до примерно 65 мас. %, от примерно 30 до примерно 55 мас. %, от примерно 30 до примерно 40 мас. %, от примерно 40 до примерно 80 мас. %, от примерно 45 до примерно 65 мас. %, от примерно 45 до примерно 75 мас. % или от примерно 50 до примерно 70 мас. % желатина, (b) от примерно 0,01 до примерно 4 мас. % или от примерно 0,1 до примерно 3 мас. %, или от примерно 0,2 до примерно 2 мас. %, или от примерно 0,01 до примерно 0,1 мас. %, или от примерно 0,05 до примерно 0,5 мас. %, или от примерно 0,1 до примерно 0,2 мас. % декстрозы, (с) от примерно 2 до примерно 20 мас. %, от примерно 3 до примерно 15 мас. %, от примерно 7 до примерно 15 мас. % или от примерно 3 до примерно 5,5 мас. %, или от примерно 7 до примерно 12 мас. % зависящего от рН полимера (например, пектина, такого какнизкометоксилированный пектин), (d) от примерно 15 до примерно 45 мас. %, от примерно 15 до примерно 40 мас. %, от примерно 20 до примерно 35 мас. % или от примерно 25 до примерно 30 мас. % пластификатора, и необязательно (е) от примерно 0,05 до примерно 5 мас. %, от примерно 0,1 до примерно 3 мас. % или от примерно 0,2 до примерно 2 мас. % стабилизатора и/или связующего (например, геллановой камеди). Все выраженные в мас. % значения приведены в пересчете на полную массу сухой композиции зависящей от рН оболочки.
В одном варианте осуществления композиция зависящей от рН оболочки состоит из: (а) от примерно 30 до примерно 85 мас. %, от примерно 30 до примерно 75 мас. %, от примерно 30 до примерно 65 мас. %, от примерно 30 до примерно 55 мас. %, от примерно 30 до примерно 40 мас. %, от примерно 40 до примерно 80 мас. %, от примерно 45 до примерно 65 мас. %, от примерно 45 до примерно 75 мас. % или от примерно 50 до примерно 70 мас. % желатина, (b) от примерно 0,01 до примерно 4 мас. % или от примерно 0,1 до примерно 3 мас. %, или от примерно 0,2 до примерно 2 мас. %, или от примерно 0,01 до примерно 0,1 мас. %, или от примерно 0,05 до примерно 0,5 мас. %, или от примерно 0,1 до примерно 0,2 мас. % декстрозы, (с) от примерно 2 до примерно 20 мас. %, от примерно 3 до примерно 15 мас. %, от примерно 7 до примерно 15 мас. % или от примерно 3 до примерно 5,5 мас. %, или от примерно 7 до примерно 12 мас. % зависящего от рН полимера (например, пектина, такого как низкометоксилированный пектин), (d) от примерно 15 до примерно 45 мас. %, от примерно 15 до примерно 40 мас. %, от примерно 20 до примерно 35 мас. % или от примерно 25 до примерно 30 мас. % пластификатора, и необязательно (е) от примерно 0,05 до примерно 5 мас. %, от примерно 0,1 до примерно 3 мас. % или от примерно 0,2 до примерно 2 мас. % стабилизатора и/или связующего (например, геллановой камеди). Все выраженные в мас. % значения приведены в пересчете на полную массу сухой композиции зависящей от рН оболочки.
ПРИМЕРЫ
Конкретные варианты осуществления настоящего изобретения будут описаны со ссылкой на приведенные ниже примеры. Следует понимать, что эти примеры приведены исключительно для иллюстрации настоящего изобретения и их не следует рассматривать в качестве каким-либо образом ограничивающих объем настоящего изобретения.
ПРИМЕР 1 - Влияние концентрации декстрозы на обрабатываемость композиции
Композиции зависящих от рН оболочек получали для исследования влияния концентрации декстрозы на обрабатываемость композиции. Композиции зависящих от рН оболочек приведены в таблице 1.
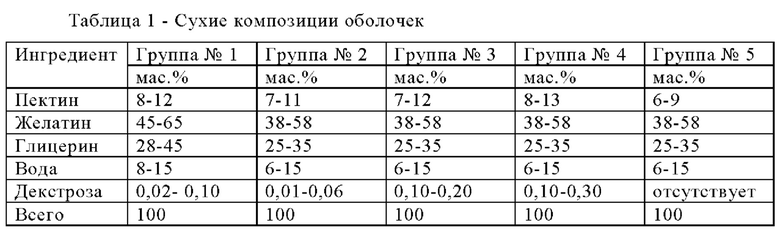
Влияние изменения количества декстрозы, содержащейся в композиции зависящей от рН оболочки, на время разрушения при значении рН, равном 6,8, представлено в таблице 2.
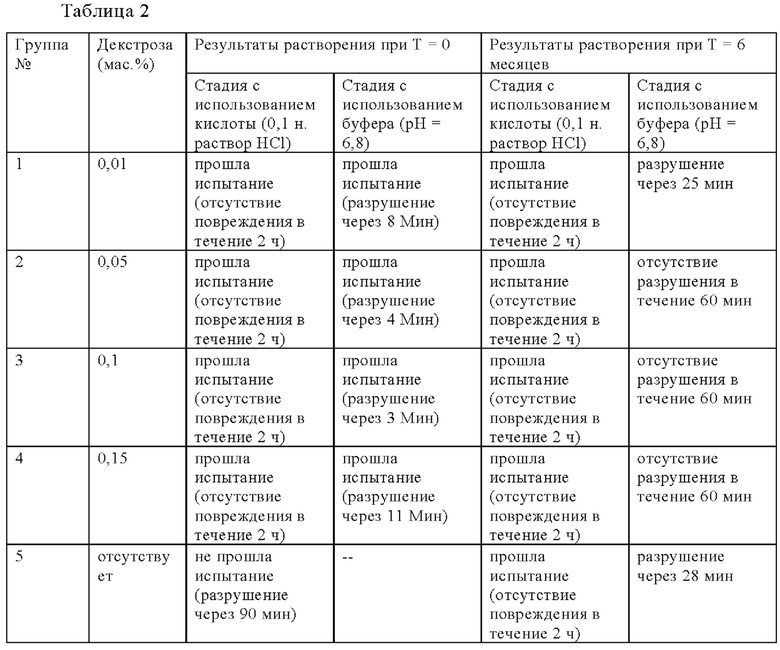
Декстроза является восстанавливающим сахаром и полагают, что она взаимодействует с желатином и вызывает сшивку желатина. Если желатин является сшитым, то его растворимость уменьшена. Показано, что декстроза стабилизирует (т.е. уменьшает протекание) содержащей пектин капсулы из мягкого желатина в кислой среде. Декстроза также может влиять на количество активного средства (витаминов, минералов, пищевых добавок или фармацевтических ингредиентов), высвобождающегося в фосфатном буфере, обладающем значением рН, равным 6,8. Как показано в таблице 2, некоторые капсулы (например, относящиеся к группам 2, 3 и 4) не разрушаются в фосфатном буфере, обладающем значением рН, равным 6,8, в течение 60 мин.
ПРИМЕР 2 - Влияние отверждения на характеристики высвобождения капсулы
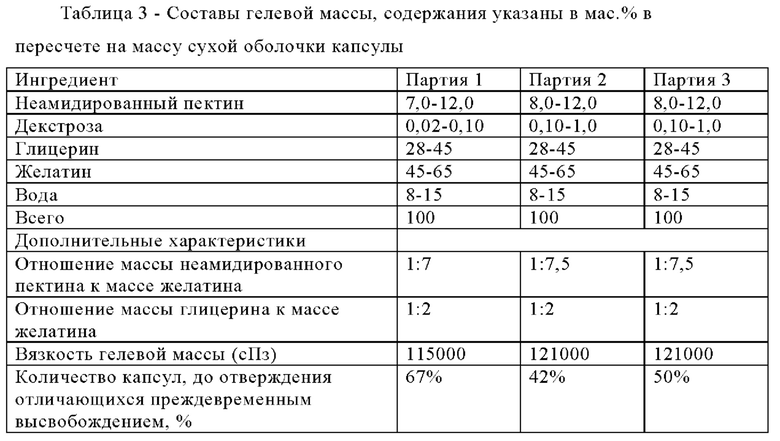
Композиции зависящих от рН оболочек получали для исследования влияния отверждения на характеристики высвобождения капсул. Композиции зависящих от рН оболочек приведены в таблице 3.
В случае существующих имеющихся в продаже продуктов большое количество капсул отличается преждевременным высвобождением, преждевременно высвобождаются увеличенные количества наполняющего материала и в некоторых случаях почти 100 мас. % наполняющего материала высвобождается в кислой среде в течение 10 мин.
Рассматривали капсулы из мягкого желатина, содержащие покрытие, однако они не растворялись в буферной среде в течение продолжительного времени (в течение более примерно 60 мин и в некоторых случаях в течение вплоть до 120 мин). Полагали, что длительное растворение в буферной среде указывает на то, что капсулы из мягкого желатина, содержащие покрытие, не обеспечивают биологическую доступность. Этот факт, а также вызывающий затруднения двухстадийный способ изготовления способствовал проведению исследований композиций зависящих от рН оболочек, предназначенных для изготовления капсул задержанного высвобождения из мягкого желатина, без нанесения отдельного покрытия.
Композиции зависящих от рН оболочек, приведенные в таблице 3, использовали для изготовления содержащих пектин капсул из мягкого желатина, которые обеспечивают уменьшение количества случаев преждевременного высвобождения наполняющего материала и в некоторой степени уменьшение количества наполняющего материала, которое преждевременно высвобождается (по сравнению с существующими имеющимися в продаже продуктами).
Однако до отверждения в каждой партии существенная доля капсул из мягкого желатина все еще отличалась преждевременным высвобождением некоторого количества наполняющего материала в кислой среде (например, в 0,1 н. растворе HCl), как это показано в таблице 3 в столбце "количество капсул, до отверждения отличающихся преждевременным высвобождением, %". Для определения выраженного в % количества капсул, до отверждения отличающихся преждевременным высвобождением, исследовали от примерно 60 до примерно 72 капсул каждой партии.
В некоторых вариантах осуществления из капсул, до отверждения отличающихся преждевременным высвобождением, высвобождалось примерно 10 мас. % наполняющего материала. В некоторых вариантах осуществления из капсул, до отверждения отличающихся преждевременным высвобождением, высвобождалось более 10 мас. % наполняющего материала или менее 10 мас. % наполняющего материала.
Как показано в последующих примерах, отверждение обеспечивает уменьшение количества случаев преждевременного высвобождения, уменьшение количества высвобождающегося наполняющего материала, если происходит преждевременное высвобождение, и в некоторых случаях полное отсутствие преждевременного высвобождения.
Содержащие пектин капсулы из мягкого желатина отверждали для улучшения их стабильности в кислой среде (например, в 0,1 н. растворе HCl). Содержащие пектин капсулы из мягкого желатина упаковывали в картонные коробки (в случае большого количества) или в бутыли из полиэтилена высокой плотности (ПЭВП) и помещали в сушильный шкаф, нагретый до 40°С. Регулирование влажности не использовали. Единственным изменяемым параметром для образцов являлась продолжительность отверждения. Результаты исследований отверждения капсул партий 1, 2 и 3 приведены в представленной ниже таблице 4.
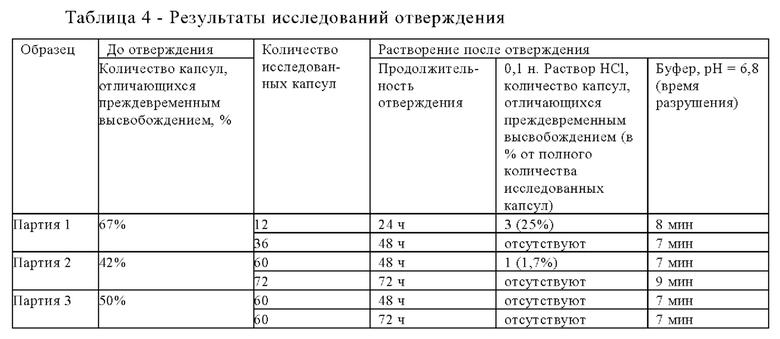
Растворение после отверждения исследовали в соответствии с методикой исследования ФСША для энтеросолюбильных материалов с использованием двухстадийного исследования растворения энтеросолюбильных материалов, применимого для энтеросолюбильных капсул из мягкого желатина, не содержащих покрытие. Если не указано иное, во всем настоящем описании кислая среда, буферная среда, прибор и условия исследования растворения, использующиеся для получения всех результатов растворения/распадаемости/разрушения и/или характеристик, являлись такими, как описано в настоящем изобретении в отношении двухстадийного исследования растворения энтеросолюбильных материалов.
Использовали аппарат ФСША II с лопастями при скорости вращения лопастей, равной 50 об/мин, и температуру, равную 37°С. На стадии с использованием кислоты средой являлся 0,1 н. раствор HCl. На стадии с использованием буфера средой являлся фосфатный буфер, обладающий значением рН, равным 6,8. В случае витамина, минерала, пищевых добавок и/или нутрицевтиков для того, чтобы энтеросолюбильные капсулы прошли испытание на первой стадии, они должны оставаться неповрежденными в кислой среде в течение не менее 60 мин, и для того, чтобы они прошли испытание на второй стадии, они должны разрушаться в буферной среде в течение 45 мин. В случае фармацевтических продуктов для того, чтобы энтеросолюбильные капсулы прошли испытание на первой стадии, они должны оставаться неповрежденными в кислой среде в течение не менее 120 мин, и для того, чтобы они прошли испытание на второй стадии, они должны разрушаться в буферной среде в течение 45 мин.
Исследовали капсулы из мягкого желатина, отвержденные в течение 24 ч, 48 ч, 72 ч, 120 ч, 168 ч и 288 ч. Однако в настоящем изобретении представлены результаты, полученные при отверждении в течение только вплоть до 72 ч.
В таблице 5 приведены результаты для количества наполняющего материала, преждевременно высвободившегося из содержащих пектин капсул из мягкого желатина партии 3 в кислой среде до отверждения и после отверждения, полученные в соответствии с критериями исследования ФСША для энтеросолюбильных материалов, по истечении 2 ч. Максимальное количество высвободившегося наполняющего материала составляло 5%. В состав наполняющего материала для содержащих пектин капсул из мягкого желатина партии 3 входил рыбий жир (который содержит докозагексаеновую кислоту (ДГК) и эйкозапентаеновую кислоту (ЭПК)).
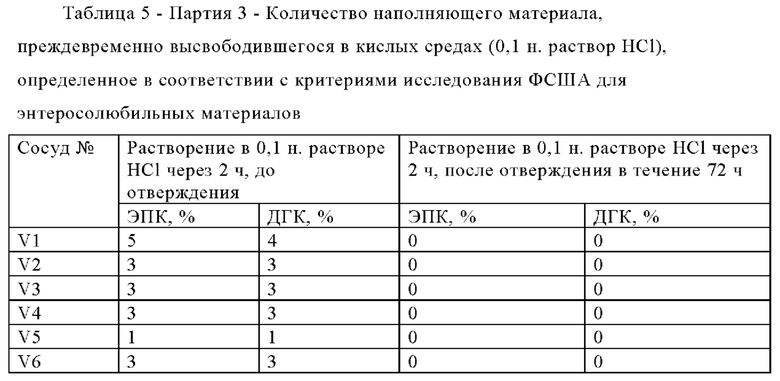
Результаты исследования отверждения показывают, что отверждение обеспечивает существенное уменьшение количества преждевременного высвобождающегося наполняющего материала из содержащих пектин капсул в кислой среде или обеспечивает отсутствие преждевременного высвобождения, и обеспечивает получение капсул, обладающих стабильными энтеросолюбильными характеристиками, и получение обладающего высоким качеством энтеросолюбильного продукта.
Следует отметить, что все приведенные в таблице 5 содержащие пектин капсулы из мягкого желатина растворялись в буфере, обладающем значением рН, равным 6,8, в течение 15 мин.
ПРИМЕР 3 - Результаты исследования растворения энтеросолюбильных капсул в искусственном желудочном соке (ИЖС) с добавлением пепсина
Проводили исследование разрушения энтеросолюбильных отвержденных содержащих пектин капсул, обладающих составами гелевой массы, приведенными в таблице 6А, с использованием ИЖС (0,1 н. раствор HCl) с добавлением пепсина (для моделирования условий in vivo у людей) с целью проведения двухстадийного исследования растворения энтеросолюбильного материала.


Пепсин не оказывает влияния на растворение содержащих пектин оболочек в среде 0,1 н. раствора HCl, если используют подходящий состав композиции оболочки, например, подходящее значение отношения массы желатина к массе пектина. В капсулах партий 4 и 5, представленных в таблицах 6А и 6В, отношение массы желатина к массе пектина составляло 7:1. Без наложения ограничений можно предположить, что содержащие пектин капсулы из мягкого желатина являются прочными, и что сетки желатин-пектин являются достаточно прочными для сопротивления воздействию пепсина, это подтверждено тем, что содержащие пектин капсулы из мягкого желатина остаются неповрежденными в течение 120 мин в 0,1 н. растворе HCl даже в присутствии пепсина, эта среда является биорелевантной средой, в отличие от среды, использующейся в фармакопейной методике, которая не содержит фермент. Таким образом, можно предположить, что содержащие пектин капсулы из мягкого желатина также будут достаточно прочными in vivo.
ПРИМЕР 4 - Модулирование времени разрушения содержащих пектин капсул в желудочном соке путем изменения значения отношения массы желатина к массе пектина
Изготавливали содержащие пектин капсулы из мягкого желатина, обладающие разными значениями отношения массы желатина к массе пектина. Составы капсул разных партий приведены в представленной ниже таблице 7В. Время разрушения содержащих пектин капсул в ИЖС (0,1 н. раствор HCl) с добавлением пепсина изменялось при изменении значения отношения массы желатина к массе пектина, как это показано в представленной ниже таблице 7А.
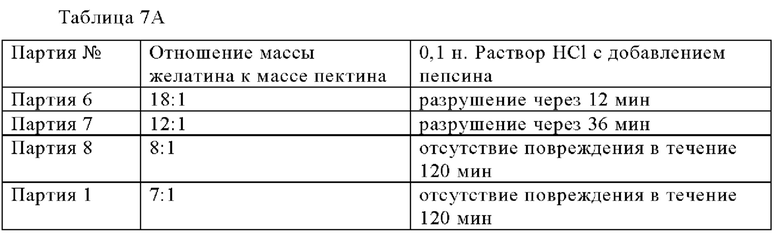
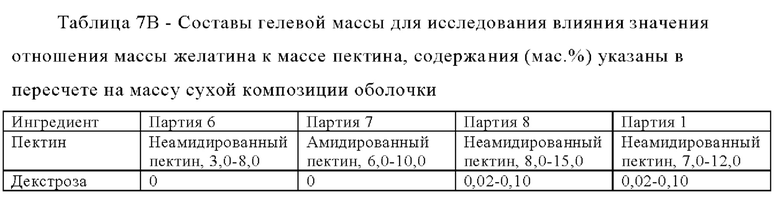

Все содержащие пектин капсулы из мягкого желатина, приведенные в таблице 7А, разрушались в буфере, обладающем значением рН, равным 6,8, в течение 45 мин. В таблице 7А показано, что время разрушения содержащих пектин капсул из мягкого желатина в кислой среде можно модулировать путем изменения значения отношения массы желатина к массе пектина.
ПРИМЕР 5 - Влияние толщины ленты из мягкого желатина на энтеросолюбильные характеристики содержащих пектин капсул из мягкого желатина
Изготавливали содержащие пектин капсулы из мягкого желатина с использованием лент различной толщины. Составы сухих композиций зависящих от рН оболочек, предназначенных для изготовления партий капсул с использованием лент разной толщины, приведены в представленной ниже таблице 8А. Исследовали растворение содержащие пектин капсул, изготовленных с использованием лент разной толщины, после отверждения в течение примерно от 72 до 96 ч, в ИЖС (0,1 н. раствор HCl) и буфере, обладающем значением рН, равным 6,8. результаты приведены в представленной ниже таблице 8В.
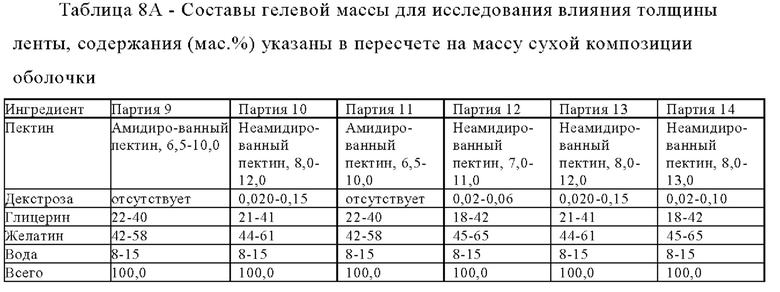
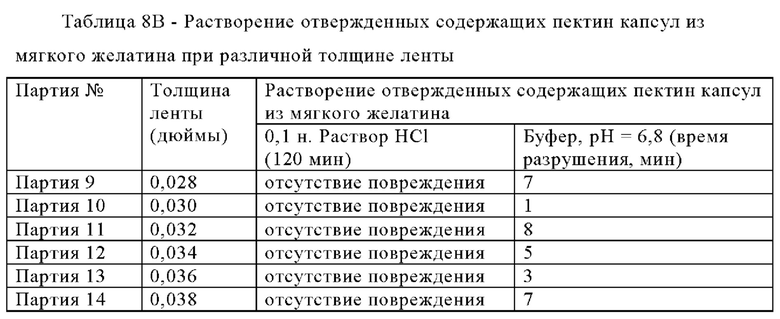
Результаты исследования растворения, представленные в таблице 8В, показывают, что содержащие пектин капсулы из мягкого желатина, изготовленные из ленты, обладающей толщиной, находящейся в диапазоне от 0,028 до 0,038 дюйма, после отверждения являются прочными и соответствуют требованиям, предъявляемым к энтеросолюбильным фармацевтическим продуктам и продуктам ВМПД (витамин, минерал, пищевые добавки). Этот диапазон толщины не следует рассматривать, как ограничивающий. В некоторых вариантах осуществления также можно использовать более толстые ленты или более тонкие ленты.
ПРИМЕР 6 - Вязкость композиции зависящей рН оболочки после состаривания
Пектин и желатин взаимодействуют друг с другом с образованием сеток, которые способствуют существенному увеличению вязкости гелевой массы, как это показано на фиг. 1. Можно предположить, что взаимодействие между пектином и желатином вносит вклад в характеристики задержанного высвобождения композиции оболочки капсулы. Однако, как видно из фиг. 1, вязкость гелевой массы композиции зависящей от рН оболочки уменьшается с течением времени. Значения вязкости и выраженное в % уменьшение представлены в приведенной ниже таблице 9.
Вязкость этого образца и во всех случаях в настоящем описании определяли с использованием реометра (Theostress 6000, выпускающийся фирмой Thermo Fisher) при 60°С. Исследования проводили при условиях окружающей среды. Образцы гелевой массы помещали на платформу реометра, температуру которой поддерживали равной 60°С. Обеспечивали колебания диска диаметром 40 мм при частоте, равной 0,1 Гц, и обеспечивали постоянную скорость сдвига. Вязкость определяли путем измерения напряжения сдвига и скорости сдвига.
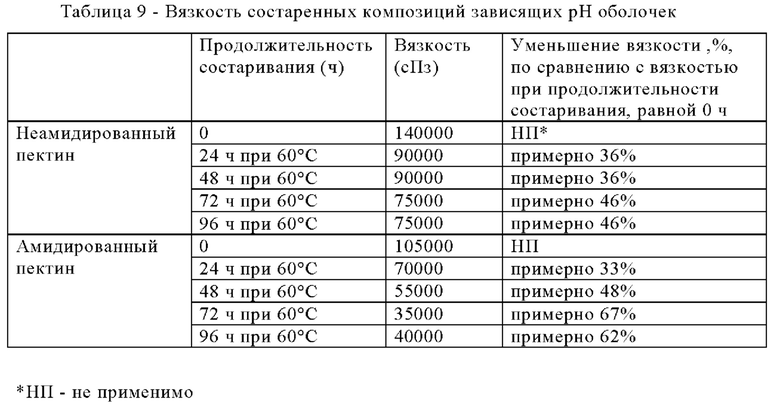
Как можно видеть из таблицы 9, после состаривания при 60°С в течение 48 ч, после состаривания при 60°С в течение 72 ч и после состаривания при 60°С в течение 96 ч в случае использования неамидированного пектина происходит меньшее выраженное в процентах уменьшение вязкости, чем в случае использования амидированного пектина.
Можно предположить, что уменьшение вязкости вызвано термическим разложением длинных молекулярных цепей пектина и желатина. Несмотря на это уменьшение вязкости гелевые массы композиций зависящих от рН оболочек сохраняют вязкость, подходящую для обрабатываемости, даже после выдерживания композиции при нагревании при 60°С в течение 4 дней. Кроме того, капсулы из мягкого желатина, изготовленные с использованием состаренного геля, все же обладают удовлетворительными характеристиками зависящего от рН задержанного высвобождения.
ПРИМЕР 7 - Химическая стабильность содержащей пектин капсулы из мягкого желатина
В приведенной ниже таблице 10 приведены результаты исследования химической стабильности капсул, содержащих рыбий жир, капсулированный с использованием содержащей пектин композиции зависящей от рН оболочки, соответствующей вариантам осуществления, описанным в настоящем изобретении, после хранения в течение 6 месяцев при условиях окружающей среды и при 40°С и при относительной влажности (ОВ), равной 75%. Приемлемые капсулы должны обладать следующими характеристиками: ЭПК-ТГ (триглицериды)≥160 мг/г, ДГК-ТГ≥100 мг/г, пероксид ≤5 мг-экв. О2/кг, п-анизидин ≤20, время растворения в 0,1 н. растворе HCl (рН=1,2): более 120 мин, и время растворения в буферной среде (фосфатный буфер, рН=6,8): вплоть до 45 мин. Значения этих параметров приведены в таблице 10 для контрольного образца (исходный материал - рыбий жир), для содержащей пектин капсулы задержанного высвобождения из мягкого желатина, которую хранили при условиях окружающей среды в течение 6 месяцев, и для содержащей пектин капсулы задержанного высвобождения из мягкого желатина, которую хранили при 40°С и ОВ, равной 75%, в течение 6 месяцев.
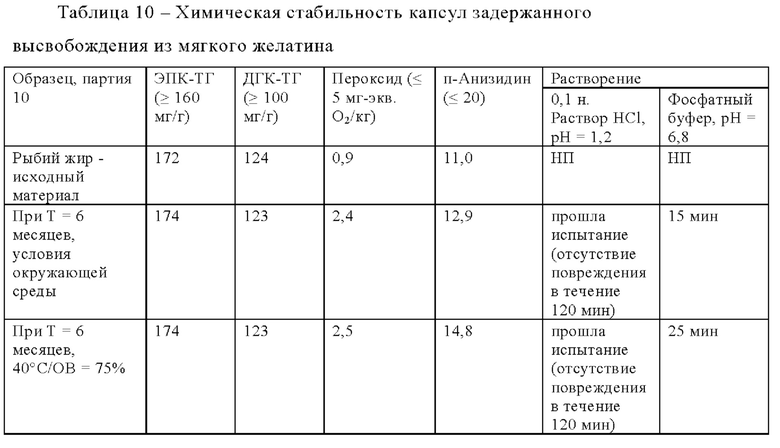
Результаты ускоренного исследования стабильности (приведены в таблице 10) показывают, что содержащая пектин устойчивая к рН композиция оболочки, соответствующая вариантам осуществления, обеспечивает защиту наполняющего материала (например, компонентов рыбьего жира) от окисления, как это видно из незначительного отличия/существенного сходства значений для пероксида и п-анизидина, и результатов анализа ЭПК и ДГК, полученных через 6 месяцев (после хранения при условиях окружающей среды, а также при использовании жестких условий - при 40°С и при ОВ, равной 75%), при сопоставлении с результатами, полученными для исходного материала.
ПРИМЕР 8 - Содержащая пектин капсула из мягкого желатина с включенной вальпроевой кислотой
В представленной ниже таблице 11А проиллюстрирована стабильность профиля растворения капсул, содержащих вальпроевую кислоту, капсулированную с использованием содержащей пектин композиции зависящей от рН оболочки (состав геля при содержаниях, указанных в пересчете на массу сухой композиции оболочки, представлен в таблице 11В), соответствующей вариантам осуществления, описанным в настоящем изобретении, при Т=О, после хранения в течение 3 месяцев (Т=3 месяца) при 40°С и при относительной влажности (ОВ), равной 75%, и после хранения в течение 6 месяцев (Т=6 месяцев) при 40°С и при ОВ, равной 75%. Как видно из таблицы 11А, профиль растворения композиции зависящей от рН оболочки после хранения в течение 3 месяцев при 40°С и при ОВ, равной 75%, и после хранения в течение 6 месяцев при 40°С и при ОВ, равной 75%, остается в основном таким же, как профиль растворения при Т=0.


ПРИМЕР 9 - Физические характеристики капсул из мягкого желатина, содержащих пектин
Капсулы задержанного высвобождения из мягкого желатина, содержащие композицию зависящей от рН оболочки, описанную в настоящем изобретении, являются прочными, как это подтверждено с помощью их физических характеристик, приведенных в представленной ниже таблице 12.

Содержанием влаги в оболочке определяли по методике определения потерь при сушке. Образец композиции зависящей от рН оболочки капсулы массой от 1 до 2 г выдерживали в сушильном шкафу при 105°С в течение 17 ч. Регистрировали начальную массу образца. После сушки образца в сушильном шкафу при 105°С в течение 17 ч регистрировали конечную массу образца. Выраженную в процентах потерю массы, рассчитанную в соответствии с приведенным ниже уравнением, определяли, как содержание влаги в оболочке:
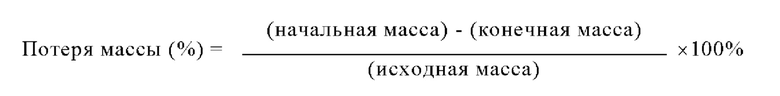
Твердость капсулы определяли с использованием устройства для определения твердости. Силу, выраженную в Ньютонах, необходимую для сжатия капсулы на 2,0 мм, определяли, как твердость капсулы.
Равновесную относительную влажность (%) определяли, как влажность, при которой капсула сохраняет постоянную полную массу. Ее определяли с использованием камер искусственного климата, в которых с использованием насыщенных растворов солей поддерживали постоянную влажность.
Прочность на раздавливание определяли с использованием Texture Analyzer. С помощью Texture Analyzer капсулу сжимали до тех пор, пока она не разрушалась. Силу, выраженную в килограммах, необходимую для разрушения капсулы, определяли, как прочность на раздавливание.
ПРИМЕР 10 - Иллюстративная композиция капсулы задержанного высвобождения из мягкого желатина, содержащая пектин и геллановую камедь
Изготавливали капсулу задержанного высвобождения из мягкого желатина, которая содержала комбинацию пектина и геллановой камеди. Состав приведен в представленной ниже таблице 13, содержания компонентов приведены в пересчете на массу сухой композиции оболочки.
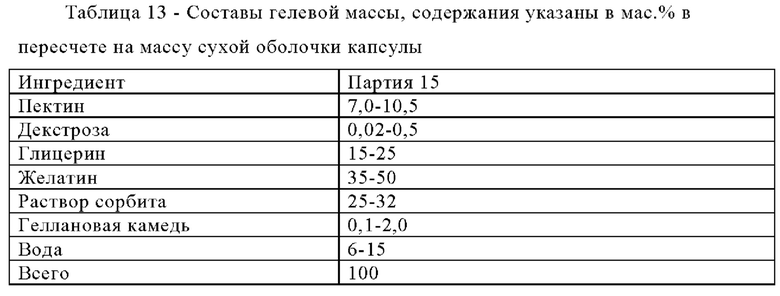
Для простоты объяснения варианты осуществления и способы, предлагаемые в настоящем изобретении, представлены и описаны в виде последовательностей действий. Однако действия, предлагаемые в настоящем изобретения, можно осуществлять в любом порядке и/или одновременно и вместе с другими действиями, не представленными и не описанными в настоящем изобретении. Кроме того, не все проиллюстрированные события могут потребоваться для выполнения способов, соответствующих заявленному объекту. Кроме того, для специалистов в данной области техники должно быть понятно и очевидно, что способы можно альтернативно представить в виде последовательности взаимосвязанных состояний в виде диаграммы состояний или событий.
Для обеспечения полного понимания настоящего изобретения в приведенном выше описании указаны многочисленные конкретные особенности, такие как конкретные материалы, размеры, параметры проведения способов и т.п. Конкретные особенности, структуры, материалы или характеристики можно объединить любым подходящим образом в одном или больших количествах вариантов осуществления. Слова "пример" или "типичный" используются в настоящем изобретении для указания на пример, частный случай или иллюстрацию. Любая особенность или схема, описанная в настоящем изобретении, как "пример" или "типичная" необязательно является предпочтительной или обладает преимуществом по сравнению с другими особенностями или схемами. Использование слов "пример" или "типичный" скорее предназначено для описания представлений определенным образом. При использовании в настоящей заявке, термин "или" означает включающий "или", а не исключающий "или". Это означает, что, если не указано иное или не очевидно из контекста, то "X включает А или В" означает любую обычную включающую перестановку. Это означает, что, если X включает А; X включает В; или X включает и А, и В, то "X включает А или В" означает любой из приведенных выше случаев. В настоящем изобретении указание на выражения "вариант осуществления", "некоторые варианты осуществления" или "один вариант осуществления" означает, что конкретная особенность, структура или характеристика, описанная применительно к варианту осуществления, включена по меньшей мере в один вариант осуществления. Таким образом, все выражения "вариант осуществления", "некоторые варианты осуществления" или "один вариант осуществления" в разных частях настоящего описания необязательно означают один и тот же вариант осуществления.
Настоящее изобретение описано со ссылкой на конкретные типичные варианты его осуществления. Соответственно, описание и чертежи следует рассматривать, как иллюстративные, а не ограничивающие. Различные модификации настоящего изобретения в дополнение к представленным и описанным в настоящем изобретении должны быть очевидны для специалистов в данной области техники и подразумевается, что они входят в объем прилагаемой формулы изобретения.
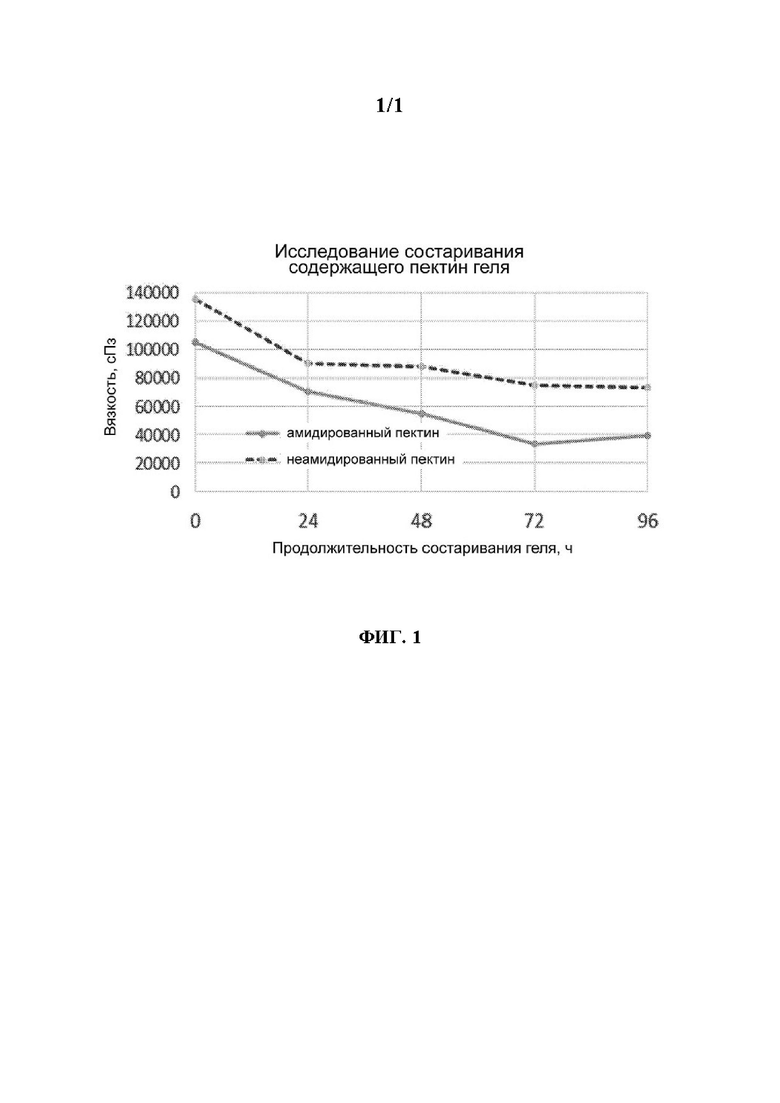
Группа изобретений относится к области фармацевтики и медицины. Первый и шестой объекты представляют собой капсулу задержанного высвобождения из мягкого желатина, где композиция зависящей от pH оболочки содержит желатин, зависящий от pH полимер, такой как пектин, и декстрозу. Второй объект – способ изготовления капсулы задержанного высвобождения из мягкого желатина. Третий объект – способ регулирования зависящего от pH профиля растворения капсулы задержанного высвобождения из мягкого желатина. Четвертый и пятый объекты – способы лечения патологического состояния и уменьшения количества случаев отрыжки. Седьмой и восьмой объекты – способы улучшения характеристик задержанного высвобождения капсулы из мягкого желатина и стабилизации капсулы из мягкого желатина задержанного высвобождения. Технический результат заключается в стабилизации и уменьшении протекания содержащей зависящий от pH полимер, такой как пектин, капсулы из мягкого желатина в кислой среде при содержании декстрозы. 8 н. и 39 з.п. ф-лы, 1 ил., 13 табл., 10 пр.
1. Капсула задержанного высвобождения из мягкого желатина, содержащая:
(a) наполняющий материал и
(b) композицию зависящей от pH оболочки,
где наполняющий материал содержит по меньшей мере один фармацевтически активный ингредиент,
где композиция зависящей от pH оболочки содержит желатин, пектин и декстрозу,
композиция зависящей от pH оболочки содержит от примерно 40 до примерно 80 мас.% желатина в пересчете на массу сухой композиции зависящей от pH оболочки,
композиция зависящей от pH оболочки содержит от примерно 2 до примерно 20 мас.% пектина в пересчете на массу сухой композиции зависящей от pH оболочки и
где композиция зависящей от pH оболочки содержит от примерно 0,01 до примерно 4 мас.% декстрозы в пересчете на массу сухой композиции зависящей от pH оболочки.
2. Капсула задержанного высвобождения из мягкого желатина по п. 1, где композиция зависящей от pH оболочки дополнительно содержит пластификатор.
3. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где пектином является низкометоксилированный пектин.
4. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где пектин выбран из группы, состоящей из следующих: амидированный пектин, неамидированный пектин и их комбинации.
5. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 2-4, где композиция зависящей от рН оболочки содержит от примерно 15 до примерно 40 мас.% пластификатора в пересчете на массу сухой композиции зависящей от pH оболочки.
6. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где желатин выбран из группы, состоящей из следующих: желатин типа A, желатин типа B и их смеси.
7. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где желатин выбран из группы, состоящей из следующих: рыбный желатин, шкурный желатин, костный желатин и их смеси.
8. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где пектином является неамидированный пектин.
9. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 2-8, где пластификатор выбран из группы, состоящей из следующих: глицерин, сорбит и их комбинации.
10. Капсула задержанного высвобождения из мягкого желатина по п. 9, где пластификатором является глицерин.
11. Капсула задержанного высвобождения из мягкого желатина по п. 1, где композиция зависящей от рН оболочки содержит от примерно 45 до примерно 75 мас.% желатина в пересчете на полную массу сухой композиции зависящей от pH оболочки.
12. Капсула задержанного высвобождения из мягкого желатина по п. 11, где композиция зависящей от рН оболочки содержит от примерно 45 до примерно 65 мас.% желатина в пересчете на полную массу сухой композиции зависящей от pH оболочки.
13. Капсула задержанного высвобождения из мягкого желатина по п. 1, где композиция зависящей от рН оболочки содержит от примерно 3 до примерно 15 мас.% пектина в пересчете на полную массу сухой композиции зависящей от pH оболочки.
14. Капсула задержанного высвобождения из мягкого желатина по п. 13, где композиция зависящей от рН оболочки содержит от примерно 7 до примерно 15 мас.% пектина в пересчете на полную массу сухой композиции зависящей от pH оболочки.
15. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 2-14, где композиция зависящей от рН оболочки содержит от примерно 20 до примерно 35 мас.% пластификатора в пересчете на полную массу сухой композиции зависящей от pH оболочки.
16. Капсула задержанного высвобождения из мягкого желатина по п. 15, где композиция зависящей от pH оболочки содержит от примерно 25 до примерно 30 мас.% пластификатора в пересчете на полную массу сухой композиции зависящей от pH оболочки.
17. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 1-16, где композиция зависящей от рН оболочки содержит от примерно 0,05 до примерно 0,5 мас.% декстрозы в пересчете на полную массу сухой композиции зависящей от pH оболочки.
18. Капсула задержанного высвобождения из мягкого желатина по п. 17, где композиция зависящей от pH оболочки содержит от примерно 0,1 до примерно 0,2 мас.% декстрозы в пересчете на полную массу сухой композиции зависящей от pH оболочки.
19. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 1-18, где по данным испытания на растворение/распадаемость, проводимого с использованием аппарата ФСША (Фармакопея США) II с лопастями при скорости перемешивания, равной 50 об/мин, в фосфатном буфере, обладающем значением pH, равным 6,8, необязательно с добавлением панкреатина, капсула растворяется/распадается в кишечном соке в течение менее примерно 60 мин, менее примерно 45 мин, менее примерно 30 мин, менее примерно 20 мин, менее примерно 10 мин или менее примерно 5 мин.
20. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 1-19, где по данным испытания на растворение/распадаемость, проводимого с использованием аппарата ФСША II с лопастями при скорости перемешивания, равной 50 об/мин, в 0,1 н. растворе НСl, необязательно с добавлением пепсина, капсула растворяется/распадается в кислой среде в течение не менее примерно 15 мин, не менее примерно 30 мин, не менее примерно 1 ч, не менее примерно 2 ч, не менее примерно 3 ч, не менее примерно 4 ч или не менее примерно 5 ч.
21. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, которая не содержит дополнительные зависящие от pH полимеры.
22. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где композиция зависящей от pH оболочки обладает вязкостью, находящейся в диапазоне от примерно 110000 до примерно 125000 сП.
23. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где композиция зависящей от рН оболочки обладает отношением массы желатина к массе пектина, находящимся в диапазоне от примерно 2:1 до примерно 20:1 или от примерно 6:1 до примерно 18:1.
24. Капсула задержанного высвобождения из мягкого желатина по любому из предыдущих пунктов, где композиция зависящей от рН оболочки обладает отношением массы пластификатора к массе желатина, находящимся в диапазоне от примерно 5:1 до примерно 1:5.
25. Способ изготовления капсулы задержанного высвобождения из мягкого желатина по любому из пп. 1-24, включающий стадии:
(a) получение наполняющего материала, содержащего активное средство; и
(b) капсулирование наполняющего материала с использованием композиции зависящей от pH оболочки.
26. Способ по п. 25, дополнительно включающий сушку капсулированной капсулы задержанного высвобождения из мягкого желатина.
27. Способ по любому из пп. 25 и 26, дополнительно включающий отверждение капсулы задержанного высвобождения из мягкого желатина.
28. Способ по п. 27, в котором отверждение проводят при температуре, находящейся в диапазоне от примерно 25 до примерно 75°С, от примерно 30 до примерно 60°С или от примерно 35 до примерно 60°С.
29. Способ по любому из пп. 27 и 28, в котором отверждение проводят в течение промежутка времени, находящегося в диапазоне от примерно 12 до примерно 168 ч, от примерно 18 до примерно 120 ч, от примерно 24 до примерно 72 ч, составляющего примерно 24 ч, примерно 48 ч или примерно 72 ч.
30. Способ по любому из пп. 25-29, дополнительно включающий получение композиции зависящей от pH оболочки.
31. Способ по п. 30, где получение включает смешивание желатина, декстрозы, пектина и необязательно пластификатора с получением ленты из композиции зависящей от pH оболочки.
32. Способ по п. 31, где лента из композиции зависящей от pH оболочки обладает толщиной, находящейся в диапазоне от примерно 0,020 до примерно 0,050 дюйма.
33. Способ регулирования зависящего от pH профиля растворения капсулы задержанного высвобождения из мягкого желатина по п. 1, содержащей наполняющий материал, капсулированный с использованием композиции зависящей от рН оболочки, способ включает регулирование количества пектина, содержащегося в композиции зависящей от pH оболочки, для обеспечения целевого зависящего от pH профиля растворения в кислой среде и/или в буферной среде.
34. Способ по п. 33, дополнительно включающий регулирование продолжительности отверждения капсулы задержанного высвобождения из мягкого желатина.
35. Способ по любому из пп. 33 и 34, дополнительно включающий регулирование значения отношения массы желатина к массе пектина в композиции зависящей от pH оболочки.
36. Способ по любому из пп. 33-35, дополнительно включающий регулирование количества декстрозы в композиции зависящей от pH оболочки.
37. Способ по любому из пп. 33-36, дополнительно включающий регулирование толщины ленты из композиции зависящей от pH оболочки.
38. Способ лечения патологического состояния, включающий введение нуждающемуся в нем субъекту капсулы задержанного высвобождения из мягкого желатина по любому из пп. 1-24.
39. Способ уменьшения количества случаев отрыжки, включающий введение нуждающемуся в нем субъекту капсулы задержанного высвобождения из мягкого желатина содержащей:
(а) наполняющий материал и
(b) композицию зависящей от рН оболочки,
где наполняющий материал содержит по меньшей мере один фармацевтически активный ингредиент,
где композиция зависящей от рН оболочки содержит желатин, пектин и декстрозу,
композиция зависящей от pH оболочки содержит от примерно 40 до примерно 80 мас.% желатина в пересчете на массу сухой композиции зависящей от pH оболочки,
композиция зависящей от pH оболочки содержит от примерно 2 до примерно 20 мас.% пектина в пересчете на массу сухой композиции зависящей от pH оболочки и
где композиция зависящей от pH оболочки содержит от примерно 0,01 до примерно 4 мас.% декстрозы в пересчете на массу сухой композиции зависящей от pH оболочки.
40. Способ по п. 39, где наполняющий материал включает рыбий жир, масло криля, чесночное масло или их комбинацию.
41. Способ по любому из пп. 39 и 40, где по данным испытания на растворение/распадаемость, проводимого с использованием аппарата ФСША II с лопастями при скорости перемешивания, равной 50 об/мин, в 0,1 н. растворе НСl, необязательно с добавлением пепсина, капсула задержанного высвобождения из мягкого желатина растворяется/распадается в кислой среде в течение не менее примерно 15 мин, не менее примерно 30 мин, не менее примерно 1 ч, не менее примерно 2 ч, не менее примерно 3 ч, не менее примерно 4 ч или не менее примерно 5 ч.
42. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 1-24, дополнительно содержащая зависящий от рН полимер.
43. Капсула задержанного высвобождения из мягкого желатина по любому из пп. 1-24, где капсула задержанного высвобождения из мягкого желатина в основном не содержит или не содержит зависящие от рН полимеры, что означает, что капсула содержит менее 1 мас.% зависящего от pH полимера.
44. Капсула задержанного высвобождения из мягкого желатина, содержащая:
(a) наполняющий материал и
(b) композицию зависящей от рН оболочки,
где наполняющий материал содержит по меньшей мере один фармацевтически активный ингредиент, и
где композиция зависящей от рН оболочки содержит желатин, зависящий от pH полимер и декстрозу,
композиция зависящей от pH оболочки содержит от примерно 40 до примерно 80 мас.% желатина в пересчете на массу сухой композиции зависящей от pH оболочки, и
где композиция зависящей от pH оболочки содержит от примерно 0,01 до примерно 4 мас.% декстрозы в пересчете на массу сухой композиции зависящей от pH оболочки.
45. Способ улучшения характеристик задержанного высвобождения капсулы из мягкого желатина по п. 44, включающий
капсулирование наполняющего материала, содержащего по меньшей мере одно активное средство, с использованием композиции зависящей от pH оболочки, содержащей желатин, зависящий от рН полимер и декстрозу; и отверждение капсулы из мягкого желатина.
46. Способ по п. 45, где улучшение характеристик задержанного высвобождения включает уменьшение количества случаев преждевременного вытекания наполняющего материала, уменьшение количества вытекающего наполняющего материала или их комбинацию.
47. Способ стабилизации капсулы из мягкого желатина задержанного высвобождения по п. 44, включающий
защиту наполняющего материала, содержащего по меньшей мере одно активное средство, от окисления, обеспечиваемую путем капсулирования наполняющего материала с использованием композиции зависящей от pH оболочки, содержащей желатин, зависящий от pH полимер и декстрозу; и отверждение капсулы из мягкого желатина.
| US 2017119711 A1, 04.05.2017 | |||
| CN 104644609 A, 27.05.2015 | |||
| CN 105534945 A, 04.05.2016 | |||
| US 2017119680 A1, 04.05.2017 | |||
| WO 2014150343 A1, 25.09.2014 | |||
| УСТРОЙСТВО ТОРМОЖЕНИЯ КОЛЕС ШАССИ ВЕРТОЛЕТА | 2019 |
|
RU2710993C1 |
| US 2013122085 A1, 16.05.2013 | |||
| US 2013011470 A1, 10.01.2013. | |||
Авторы
Даты
2024-07-04—Публикация
2020-06-02—Подача