Изобретение относится к онколитическим вирусам для приготовления лекарственных средств, используемых в терапии онкологических заболеваний, в том числе при раке молочной железы, и может быть использовано в биотехнологии, в частности, в генетической инженерии, медицине.
Рак молочной железы является одной из основных причин смерти среди женщин (Lal et al., 2017).
В 2012 году рак молочной железы был наиболее часто диагностированным онкологическим заболеванием у женщин во всем мире и составлял 25 % или 1,7 миллиона от количества новых случаев заболевания, причем 53 % зарегистрированных случаев приходилось на экономически развитые страны. Ожидается, что к 2030 году общее число случаев рака молочной железы в мире достигнет 2,4 млн (Coleman, 2017).
В настоящее время для лечения рака молочной железы применяются в основном следующие методы: хирургическое удаление опухоли, радиотерапия, иммунотерапия (trastuzumab, pertuzumab, T-DM1), гормонотерапия (тамоксифен, фаслодекс, аримидекс, аромазин, фемара) и др. (Murawa et al., 2014). Не смотря на совершенствование каждого из этих методов лечения, активное развитие получают и другие перспективные направления в онкотерапии, например такие как виротерапия.
Интерес к использованию вирусов в качестве противоопухолевых средств в первую очередь был обусловлен тропностью некоторых вирусов к опухолевым клеткам. Было показано, что концентрация вирусных частиц в опухолевых тканях может превышать концентрацию вирусных частиц в нормальных тканях на 4 порядка (Li et al., 2001, Nakamura, 2002). Противоопухолевый эффект вируса может быть обусловлен следующими фактами:
- прямым литическим действием, в результате вирусной репликации в малигнизированных клетках;
- индукцией синтеза белков (в результате вирусного заражения клетки), обладающих цитотоксическими свойствами в отношении малигнизированных клеток;
- индукцией неспецифического и специфического противоопухолевого иммунитета (Kirn, 1996) и др.
Публикации последних лет свидетельствуют о том, что высокая эффективность и безопасность онколитических вирусов привлекает все большее внимание исследователей. На данный момент в базе ClinicalTrials.gov зарегистрировано 107 клинических испытаний препаратов онколитической виротерапии. 44 клинических испытания завершены, и для 5 из них результаты опубликованы, 9 испытаний было остановлено, в основном из-за нехватки добровольцев (Непомнящих и др., 2017).
Одним из наиболее перспективных вирусов на роль онколитического агента является вирус осповакцины (ВОВ). Поскольку он является ДНК-содержащим вирусом с высокой емкостью генома, что упрощает манипуляции с вирусным геномом и позволяет в довольно короткие сроки получать рекомбинантные варианты вируса. ВОВ имеет самую длинную историю клинической практики на человеке, чем любой другой вирус, что обеспечивает его безопасность при применении, кроме того жизненный цикл ВОВ протекает в цитоплазме клетки, что исключает возможность рекомбинации вирусной и клеточной ДНК (Максютов и др., 2013).
Ранее было показано, что создание онколитических вирусов на основе ВОВ, экспрессирущих иммуностимулирующие и противораковые терапевтические молекулы является перспективным направление в области терапии онкологических заболеваний. Большое количество публикаций посвящено изучению онколитического потенциала штаммов ВОВ с нарушенными генами, кодирующими тимидинкиназу и вирусный фактор роста (McCart et al., 2001). Еще одной распространенной модификацией генома онколитических вирусов является инсерция гена, кодирующего гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), что позволяет лучше представлять раковые антигены иммунной системе организма (de Vries et al., 2015).
Таким образом, литературные и полученные нами (авторами) данные в экспериментах in vitro позволяют рассматривать рекомбинантные ВОВ с удаленными генами, кодирующими тимидинкиназу и вирусный фактор роста и экспрессирующие ГМ-КСФ, как основу для создания терапевтических средств, направленных на лечение онкологических заболеваний. Однако опухоли обладают низкой иммуногенностью и активируют механизмы, позволяющие злокачественным клеткам избегать иммунной атаки. Течение многих онкологических заболеваний связано с развитием опухоль-ассоциированной иммуносупрессии, на фоне которой злокачественные клетки «ускользают» от иммунного надзора (Schreiber et al., 2010). Для решения этой проблемы нами был использован подход, нацеленный на активацию опухоль-ассоциированного иммунного ответа через стимуляцию CD4+ и CD8+ Т-клеток, путем введения в геном ВОВ искусственной полиэпитопной конструкции, состоящей из эпитопов антигенов, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы.
При этом остается основная проблема применения виротерапии: возникновение иммунитета у пациента к терапевтическому вирусу, поскольку вирусы проявляют естественные антигенные эффекты. Для решения столь важной проблемы мы модифицировали ген A34R, кодирующий мембранный гликопротеин наружной мембраны EEV-формы (внеклеточная оболочечная форма вирионов) ВОВ. EEV-форма ВОВ обеспечивает более эффективный транспорт вируса в тканях инфицируемого организма и защиту от иммунной системы организма. Известно, что штамм IHD-J ВОВ производит в 40 раз большее количество EEV-форм вируса, чем штамм WR ВОВ (Blasco et al., 1993). Связано это с различием в 151-ом и 110-ом аминокислотных остатках белков A34 ВОВ этих двух штаммов (белок A34 ВОВ штамма IHD-J содержит глутаминовую кислоту (151) и аспарагин (110), белок A34 ВОВ штамма WR - лизин (151), аспарагиновую кислоту (110)). Белок A34, закодированный в геноме клонового варианта штамма Л-ИВП ВОВ (данный штамм использовался нами в качестве основы для получения онколитического вируса) содержит на 151-ой позиции аминокислоту лизин, на месте 110-ой позиции аспарагиновую кислоту. Для увеличения онколитического потенциала рекомбинантного ВОВ нами была произведена замена гена A34R, на ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N и K151E.
Авторами получен рекомбинантный вирус ВОВ с нарушенными генами, кодирующими тимидинкиназу и вирусный фактор роста. В область гена, кодирующего тимидинкиназу, произведена встройка гена, кодирующего ГМ-КСФ, в область гена, кодирующего вирусный фактор роста, произведена встройка гена, кодирующего полиэпитопную конструкцию, состоящую из эпитопов антигенов гиперэкспрессирующихся опухолевыми клетками при раке молочной железы. Кроме того ген A34R ВОВ заменен на ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N и K151E для увеличения доли внеклеточных оболочечных вирионов при размножении вируса.
Наиболее близкими техническими решениями (аналогами) являются следующие.
Известны рекомбинантная плазмидная ДНК pGEM-Puro-DS-Apo, содержащая ген апоптина и штамм рекомбинантного ВОВ VVdGF-ApoS24/2, полученный с помощью указанной рекомбинантной плазмидной ДНК pGEM-Puro-DS-Apo, депонированный в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-585, обладающий повышенной и адресной онколитической активностью (патент РФ №2492238, МПК С12N 15/39, опубл. 10.09.2013 г.).
Известен рекомбинантный не реплицирующийся в клетках человека поксвирус птиц для доставки ГМ-КСФ, усиливающего иммунный ответ на специфический антиген, который доставляется другим рекомбинантным вирусом (международная заявка №WO0195919, МПК А61K 35/12, опубл. 20.12.2001 г.). Однако доставка ГМ-КСФ, и антигена в разных векторах усложняет технологию дальнейшего их использования (по месту введения), а также может существенно снизить эффективность иммуностимуляции.
Известны рекомбинантный штамм вируса ВОВ, секретирующий ГМ-КСФ (патент США №6548068, опубл. 2003 г. и заявка на патент США №20050186180, опубл. 2005 г.). В данных изобретениях рекомбинантные штаммы получали на основе штамма Wyeth ВОВ, который использовался в качестве вакцинного в США. Для усиления иммунного ответа использована смесь исходного и рекомбинантного штаммов вируса, что повышает вероятность возникновения поствакцинальных осложнений. Также для встройки антигена и иммуномодулирующей молекулы авторы используют два разных рекомбинантных вируса, что представляет дополнительные трудности при вакцинации и колоколизации продуктов трансгенов в организме для индукции эффективного иммунного ответа. Для экспрессии трансгенов в данном аналоге использован сверхранний промотор, который обеспечивает продукцию трансгенов только на самых ранних этапах вирусной инфекции. Кроме того, в данных публикациях не показана экспрессия гена ГМ-КСФ и его секреция в культуральную среду. Для селекции рекомбинантов ВОВ используют дополнительную встройку и экспрессию бактериального гена бета-галактозидазы, что может иметь негативные последствия при вакцинации.
Известен рекомбинантный вариант ВОВ, полученный на основе американского вакцинного штамма Wyeth ВОВ и несущий ген ГМ-КСФ человека в структурной части гена, кодирующего тимидинкиназу, под контролем ранне-позднего синтетического промотора ВОВ (патент США №6093700, опубл. 25.07.2000 г.; аналоги: международная заявка №WO2008113078; заявка США №2020303714; заявка США №2013183271; заявка США №2015037355). Кроме гена ГМ-КСФ в структурную часть TK-гена данного штамма встроен также ген β-галактозидазы E.coli под контролем природного промотора ВОВ р7,5К. Штамм получил название JX-594 (от Jennerex Biotherapeutics, Inc.) и в настоящее время проходит клинические испытания в качестве противоопухолевого препарата. Препарат JX-594 указанной американской компании Jennerex Biotherapeutics Inc. продемонстрировал обнадеживающий результат на II фазе клинических испытаний для терапии гепатоцеллюлярной карциномы. Кроме того, данный препарат показал возможность стимулирования у пациента собственного иммунного ответа на опухоль.
Известны два рекомбинантных штамма ВОВ компании Jennerex Biotherapeutics Inc. проходящие клинические испытания в качестве противоопухолевых препаратов (патент ЕПВ №2269618, опубл. 05.01.2011). Первый штамм - JX-963, содержал дополнительную делецию гена, кодирующего вирусный фактор роста, второй штамм JX-929 имеет делеции генов ТК и VGF и вместо последнего встроен ген цитозиндезаминазы. Этот фермент катализирует превращение пролекарства 5-фторцитозина в 5-фторурацил, который токсичен для активно реплицирующихся клеток и широко используется при лечении многочисленных форм рака. Пролекарство 5-фторцитозин не оказывает нежелательных побочных токсических проявлений в нормальных тканях человека. На двух моделях рака яичника (карциномы мыши MOSEC и карциномы человека A2780) была показана эффективность этого подхода с использованием указанного варианта ВОВ. В настоящее время онколитический вирус JX-929 проходит I фазу клинических испытаний для лечения рака яичников на стадии метастазов (Lee et al., 2010). Штамм JX-594 успешно прошел I и II стадии клинических испытаний против первичного рака печени и меланомы;
Известен рекомбинантный штамм ВОВ, продуцирующий секретируемую форму ГМ-КСФ человека с эффективностью не ниже, чем 1 мкг/мл культуральной среды и пригодный для конструирования на его основе онколитических препаратов и поливалентных вакцин. Штамм рекомбинантного вируса осповакцины VV-GMCSF-S1/3 содержит ген ГМ-КСФ человека, продуцирующий секретируемую форму белка ГМ-КСФ человека в клетках млекопитающих на уровне 1-40 мкг/мл культуральной среды, и депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-631 (патент РФ №2565544, опубл. 20.10.2015 г.).
Наиболее близким аналогом (прототипом) является рекомбинантный штамм VV-GMCSF-Lact, сконструированный на основе умеренно патогенного российского штамма Л-ИВП ВОВ (патент РФ №2604187, МПК C12N 7/01, опубл. 10.12.2016 г.) содержащего делеции фрагментов генов вирусной тимидинкиназы и ростового фактора, в районы которых встроены: ген гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека, в центральной части гена вирусной тимидинкиназы между позициями 81277 и 81308 п.н. (GenBank Acc. KP233807.1); ген ГМ-КСФ человека экспрессируется под контролем природного промотора P7.5K ВОВ и продуцирует секретируемую форму биологически активного ГМ-КСФ человека в клетках млекопитающих; ген лактаптина, кодирующий фрагмент каппа-казеина человека 23-134 а.о., в левом концевом районе вирусного генома между позициями 7770 и 8071 п.н. (GenBank Acc. KP233807.1); ген лактаптина экспрессируется под контролем синтетического промотора ВОВ р7.5К и продуцирует онкотоксический рекомбинантный белок лактаптин. Штамм VV-GMCSF-Lact обладает высокой онколитической активностью в отношении клеток рака молочной железы человека и депонирован в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-688.
Общим недостатком выше приведенных аналогов и прототипа является недостаточно высокий уровень иммунного ответа на субдоминантные эпитопы антигенов, гиперэкспрессирующиеся опухолевыми клетками.
Техническим результатом заявляемого изобретения является создание такого рекомбинантного онколитического штамма ВОВ, используя который при создании средств противоопухолевой терапии можно будет добиться высокого уровня иммунного ответа не только на доминантные, но и на субдоминантные эпитопы антигенов, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы.
Указанный технический результат достигается получением рекомбинантного онколитического штамма вируса осповакцины Л-ИВП_oncoB путем замены гена A34R, кодирующего мембранный гликопротеин наружной мембраны EEV-формы на ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N_K151E и путем инсерций генов, кодирующих гранулоцитарно-макрофагальный колониестимулирующий фактор и полиэпитопный иммуноген в области вирусных генов, кодирующих тимидинкиназу и вирусный фактор роста. Полиэпитопный иммуноген, имеющий нуклеотидную последовательность SEQ ID NO:1 (фиг. 4 и приложение) состоит из эпитопов антигенов HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы.
Полученный рекомбинантный штамм ВОВ депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, регистрационный номер V-796 (справка о депонировании прилагается).
Для создания штамма осповакцины Л-ИВП_oncoB авторами был предложен подход последовательного введения в состав генома ВОВ штамм Л-ИВП выбранных генов:
- гена, кодирующего ГМ-КСФ;
- гена, кодирующего полиэпитопный иммуноген, состоящий из эпитопов антигенов, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы;
- гена A34R, кодирующего мембранный гликопротеин наружной мембраны EEV-формы с двумя аминокислотными заменами D110N и K151E.
Для получения технического результата использована методика временной доминантной селекции (Falkner et al.,1990). Для этого создана рекомбинантная плазмида, которая содержит ген gpt, кодирующий ксантин-гуанин-фосфорибозилтрансферазу E.coli под контролем 7,5К-промотора ВОВ, расположенный вне протяженных областей гомологии с ДНК вируса. Также плазмида содержит последовательности генома ВОВ, фланкирующие область вирусного генома, в которую будет произведена инсерция необходимого гена. Бактериальный фермент ксантин-гуанин-фосфорибозилтрансфераза, восстанавливает метаболизм пуриновых нуклеотидов, блокируемый микофеноловой кислотой. В результате единичного кроссинговера между плазмидой интеграции и вирусной ДНК образуется рекомбинантный вирусный геном, содержащий как ген gpt, так и последовательности, представляющие собой фрагменты вирусного генома с целевой инсерцией гена и этот же фрагмент без инсерции. Такая генетическая конструкция является нестабильной и при снятии селективных условий происходит внутримолекулярная рекомбинация по областям гомологии, в результате которой образуется два вида вирусов - с инсерцией и без нее, причем выщепляется вся плазмидная часть (фиг. 1), что позволяет проводить последующие встройки генов в геном ВОВ с использованием этого же метода.
Указанный технический результат достигается путем решения технической задачи по созданию рекомбинантных плазмидных ДНК: pMGCgpt-TK-GM-CSF, pMGCgpt-VGF-UB_BC, pMGCgpt-A34R(D110N_K151E). Выполнение задачи обеспечено при помощи стандартных генно-инженерных методов: полимеразной цепной реакции, гидролиза эндонуклеазами рестрикции, лигирования, трансформации компетентных клеток E.coli (Sambrook et al., 1989).
Полученные авторами плазмиды интеграции pMGCgpt-TK-GM-CSF, pMGCgpt-VGF-UB_BC, pMGCgpt-A34R(D110N_K151E) использовались для решения следующей технической задачи - получения рекомбинантных вариантов ВОВ штамма Л-ИВП с направленно-встроенными генами в соответствующих областях вирусного генома.
В качестве основы для получения рекомбинатного штамма Л-ИВП_oncoB ВОВ использован ВОВ штамм Л-ИВП (инв. № V-401 из коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора). Далее проводили клонирование исходного штамма методом бляшек на монослое клеток CV-1 (клетки почки африканской зеленой мартышки). В дальнейшей работе использовали клон №5.
На первом этапе работы проводили встройку гена, кодирующего ГМ-КСФ в геном ВОВ штамм Л-ИВП в область гена, кодирующего тимидинкиназу. Для этого использовали метод временной доминантной селекции. Культуру клеток CV-1 заражали вирусом ВОВ штамм Л-ИВП (клон №5), после чего трансфецировали зараженные клетки плазмидой pMGCgpt-TK-GM-CSF. После четырех пассажей в условиях селекции вирус клонировали под агарозным покрытием методом бляшек. После двух пассажей клоновых вариантов вируса в неселективных условиях проводили выделение вирусной ДНК. Затем отбирали клоновые варианты вируса со встройкой гена, кодирующего ГМ-КСФ, при помощи ПЦР-анализа с использованием специфических праймеров, комплементарных району генома, фланкирующему ген-мишень:
5'- AACACTTTCTACACACCGATTGA -3'
5'- CGGACATATTCAGTTGATAATCG -3'
Для отобранного на основе ПЦР-анализа клонового варианта вируса была секвенирована область вирусного генома, содержащего ген, кодирующий ГМ-КСФ, с целью подтверждения правильности структуры встроенного в вирусный геном гена.
Далее в полученном ВОВ с инсерцией гена, кодирующего ГМ-КСФ, в область вирусного гена, кодирующего тимидинкиназу, произвели замену гена A34R на ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N_K151E. Вирус получали при помощи метода временной доминантной селекции по методике, описанной выше. Проводили отбор клоновых вариантов вируса при помощи ПЦР и последующего секвенирования полученных ПЦР-продуктов, что является единственным способом скрининга, так как после культивирования вируса в неселективных условиях возможны два варианта вируса: с исходным геном A34R и геном A34R c двумя нуклеотидными заменами. ПЦР-анализ проводили при помощи праймеров:
5'- CAAGATTCTGATGTATCACAAGAA -3'
5'- GTTATACGCTTCTATGATTGTAGC -3'
Таким образом, был отобран клоновый вариант вируса, содержащий в геноме ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N_K151E.
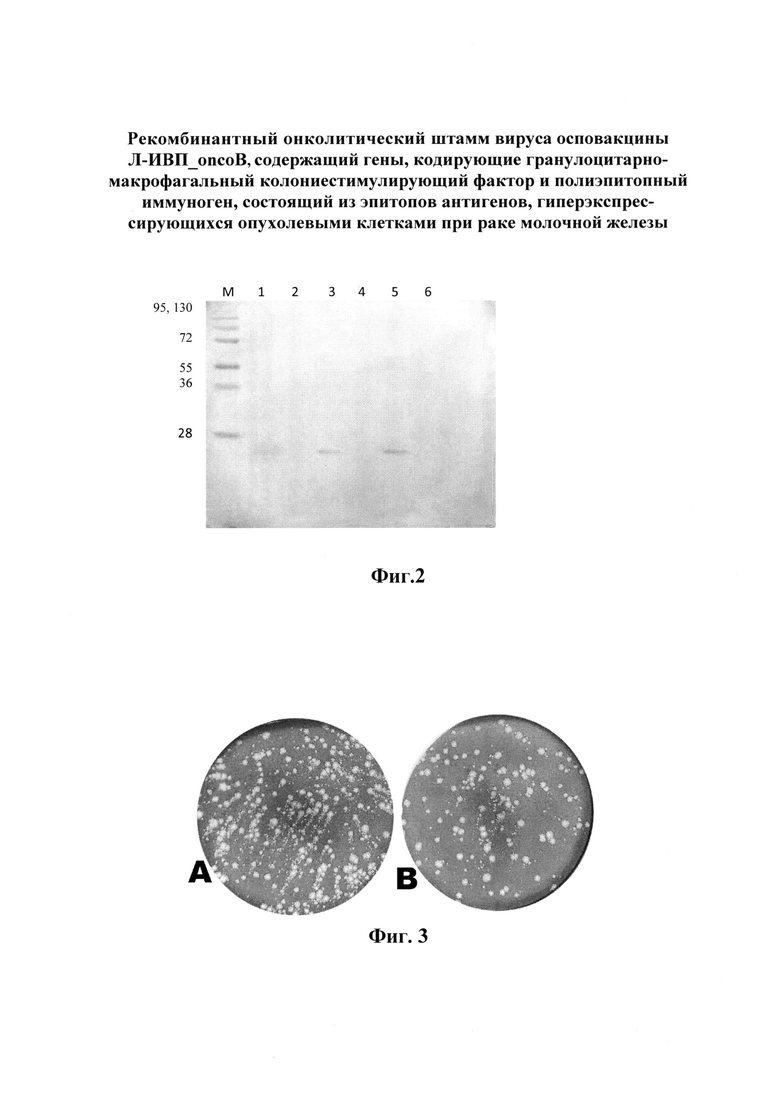
Авторами была оценена способность полученного ВОВ с инсерцией гена, кодирующего ГМ-КСФ, в район гена тимидинкиназы и с мутантным вариантом гена A34R продуцировать белок ГМ-КСФ. Продукция ГМ-КСФ в составе вирусного генома подтверждена вестерн-блот анализом (фиг. 2).
Кроме того, авторами показано, что после введения двух точечных нуклеотидных замен в последовательность гена A34R ВОВ полученный рекомбинантный ВОВ, содержащий аминокислотные замены К151Е и D110N в составе белка A34, отличаются от исходного варианта вируса эффективностью формирования кометообразных бляшек (фиг. 3).
Мембранный гликопротеин наружной мембраны EEV-формы (EEV) выходит из клетки до того, как произойдет лизис первично зараженной клетки, и все антигенные формы вируса окажутся в межклеточном пространстве. Для проверки увеличения продукции именно EEV был поставлен эксперимент: монослой клеток CV-1 заражали полученным вирусом, с множественностью заражения 10 БОЕ/лунку, после чего каждые 3 ч в течение 1 сут отбирали аликвоты надклеточной жидкости, а оставшиеся клетки вместе с надклеточной жидкостью подвергали двум циклам размораживания и оттаивания. Каждая точка отбора была сделана в трех повторах. После чего определяли титр вируса в надклеточной жидкости и в суспензии лизированных клеток. В качестве контроля для сравнения был взят исходный вариант вируса, не содержащий аминокислотные замены в белке A34, с которым провели идентичные операции.
Показано, что замены D110N, K151E в составе мембранного гликопротеина A34 вируса осповакцины обеспечили более ранний выход EEV из клеток, а также повышение титра данных форм вируса.
Для того чтобы подтвердить увеличение продукции именно внеклеточных вирионов, а не усиление продукции вируса в целом, был подсчитан титр всех образцов клеточных лизатов, которые отбирались каждые 3 ч в течение 1 сут. Данные пробы содержали все образовавшиеся частицы вируса. Титры исходного и полученного вируса значимо не отличаются, соответственно можно сделать вывод, что авторам удалось усилить продукцию преимущественно внеклеточных оболочечных вирионов.
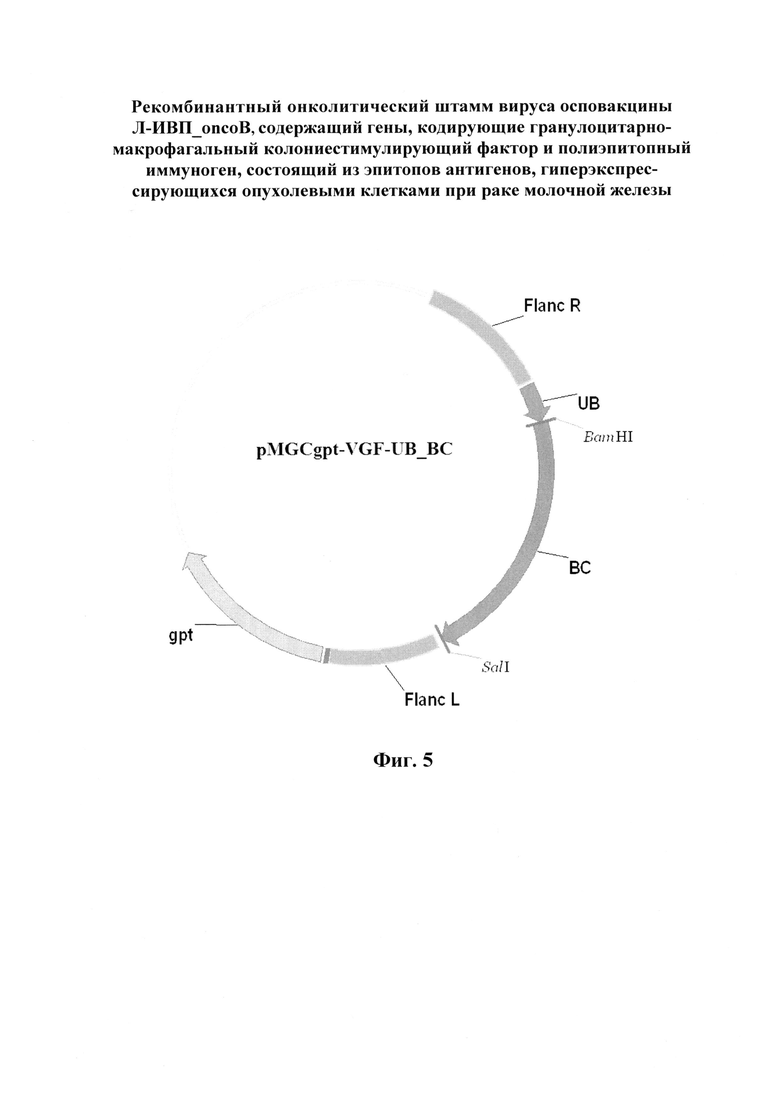
Далее в геном полученного вируса производили встройку гена, кодирующего полиэпитопный иммуноген, имеющий нуклеотидную последовательность SEQ ID NO:1 (фиг. 4 и приложение) и состоящий из эпитопов антигенов (HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1), гиперэкспрессирующихся опухолевыми клетками при раке молочной железы. На первом этапе работы авторами был проведен выбор независимых наборов опухоль-ассоциированных антигенов с гиперэкспрессией для рака молочной железы. Проведен дизайн полиэпитопной конструкции, обеспечивающий высокий уровень ответа опухоль-специфических CD8+ Т-лимфоцитов (цитотоксических Т-лимфоцитов, ЦТЛ) на выбранные опухоль-ассоциированные антигены. Для улучшения протеосомальной деградации полиэпитопных конструкций и дополнительной стимуляции цитотоксического ответа на все включенные в состав конструкции антигенные детерминанты на N-конец полиэпитопной конструкций добавлен убиквитин с замененной C-концевой аминокислотой {Gly76-Val} (UbV76). Далее при помощи стандартных генно-инженерных методов получали плазмиду интеграции pMGCgpt-VGF-UB_BC (фиг. 5).
Затем получали рекомбинантный вирус по описанной выше методике временной доминантной селекции. После проведенных процедур селекции и клонирования вируса с предполагаемым мутантным генотипом, выделяли ДНК и проводили их анализ методом ПЦР с использованием специфических праймеров комплементарных району генома, фланкирующему ген-мишень:
5'-AGGAAGGAGGCATGGAACTC-3'
5'-CTGATAAAAATGGAAAAGAGTTATG-3'
Для отобранного на основе ПЦР-анализа клонового варианта вируса была секвенирована область вирусного генома, содержащего ген, кодирующий полиэпитопный иммуноген, с целью подтверждения правильности структуры встроенного в вирусный геном гена.
Таким образом, авторами получен Л-ИВП с повышенной способностью образовывать внеклеточные оболочечные вирионы, содержащий ген, кодирующий гранулоцитарно-макрофагальный колониестимулирующий фактор, и ген, кодирующий полиэпитопный иммуноген, состоящий из эпитопов антигенов (HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1), гиперэкспрессирующихся опухолевыми клетками при раке молочной железы
Штамм депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор», регистрационный номер V- 796.
Изобретение иллюстрируется следующими фигурами графических изображений:
Фиг. 1. Общая схема получения рекомбинантных ВОВ, с направленной инсерцией генов в вирусный геном при применении метода временной доминантной селекции. L и R - области генома ВОВ, гомологичные соответствующим фрагментам L' и R' гибридной плазмиды интеграции.
Фиг. 2. Результат вестерн-блот анализа лизата клеток линии CV-1, зараженных ВОВ, содержащих в своем геноме последовательности гена, кодирующего ГМ-КСФ и гена A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N и K151E (ВОВ_TK(-)_GM-CSF(+)_A34R_(D110N_K151E)).
М: маркер мол. веса белков 10 кДа, 17 кДа, 28 кДа, 36 кДа, 55 кДа, 72 кДа, 95 кДа, 130 кДа, 250 кДа («Thermoscintific», Литва).
1: лизат клеток CV-1, зараженных ВОВ_TK(-)_GM-CSF(+)_A34R_(D110N_K151E) через 1 сутки после заражения;
2: супернатант клеток CV-1, зараженных ВОВ_TK(-)_GM-CSF(+)_A34R_(D110N_K151E) через 1 сутки после заражения;
3: лизат клеток CV-1, зараженных ВОВ_TK(-)_GM-CSF(+)_A34R_(D110N_K151E) через 2 суток после заражения;
4: супернатант клеток CV-1, зараженных полученным рекомбинантным ВОВ через 2 суток после заражения;
5: белок ГМ-КСФ (положительный контроль);
6: лизат клеток CV-1, зараженных контрольным ВОВ, не содержащем в геноме гена, кодирующего ГМ-КСФ.
Фиг. 3. Монослой клеток CV-1, окрашенный кристалвиолетом после заражения следующими вирусами (72 ч инкубации с вирусным материалом):
А) ВОВ_TK(-)_GM-CSF(+)_A34R_(D110N_K151E);
В) ВОВ_TK(-)_GM-CSF(+)_A34R.
После введения двух точечных нуклеотидных замен в последовательность гена A34R ВОВ_TK(-)_GM-CSF(+) было выявлено, что полученный рекомбинантный вирус осповакцины, содержащий аминокислотные замены К151Е и D110N в составе белка A34, отличается от исходного варианта вируса эффективностью формирования кометообразных бляшек.
Фиг. 4. Нуклеотидная последовательность (SEQ ID NO:1), кодирующая полиэпитопный иммуноген, состоящий из эпитопов антигенов (HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1), гиперэкспрессирующихся опухолевыми клетками при раке молочной железы.
Фиг. 5. Схематическое изображение плазмиды pMGCgpt-VGF-UB_BC, содержащей следующие генно-инженерные элементы:
gpt - нуклеотидную последовательность, кодирующую ген ксантин-гуанин-фосфорибозилтрансферазы E.coli под контролем промотора p7.5K вируса осповакцины;
Ub - нуклеотидная последовательность, кодирующая убиквитин;
BC - нуклеотидная последовательность, кодирующая, полиэпитопный иммуноген, состоящий из эпитопов антигенов, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы;
Flanc L, Flanc R - нуклеотидные последовательности, гомологичные участку вирусного генома (области гена, кодирующего вирусный фактор роста).
Для лучшего понимания сущности изобретения ниже приведены примеры его осуществления.
Пример 1. Выделение вирусной ДНК
Вирусную ДНК выделяют путем заражения монослоя клеток CV-1 клоновыми вариантами вируса с множественностью 0,1 БОЕ/клетка с последующей инкубацией в среде ДМЕМ с 2 % эмбриональной сыворотки коров (ЭСК), в течение 48 ч при 37 °C и 5 % CO2. При достижении 90 % цитопатического действия (ЦПД), зараженные клетки разрушают путем трех серий замораживания-оттаивания. Далее вирусная ДНК выделяют с помощью набора «АмплиПрайм ДНК-сорб-В» (Россия):
В пробирки с 300 мкл лизирующего раствора вносят 100 мкл проб, после чего пробы тщательно перемешивают на вортексе и прогревают 5 мин при 65°C. Затем вносят 25 мкл предварительно ресуспендированного сорбента универсального и перемешивают на вортексе, инкубируют 5 мин. Далее сорбент осаждают центрифугированием при 3000 g, 30 с, надосадочную жидкость удаляют. После чего сорбент ресуспендируют в 300 мкл раствора для промывки 1, затем сорбент осаждают центрифугированием при 3000 g, 30 сек, надосадочную жидкость удаляют. Сорбент ресуспендируют в 500 мкл раствора для промывки 2 и центрифугируют при 12000 g, 30 с. Супернатант удаляют и повторно добавляют 500 мкл раствора для промывки 2, центрифугируют при 12000 g, 30 сек. Затем помещают пробирки в термостат, инкубируют при 65°C, 5 мин. Добавляют в пробирки по 50 мкл буфера TE для элюции ДНК и перемешивают на вортексе. Помещают пробирки в термостат при температуре 65°C на 5 мин, периодически встряхивая на вортексе. Далее центрифугируют при 13000 g в течение 1 мин. Надосадочная жидкость содержит ДНК, ее используют при дальнейшей работе.
Пример 2. Получение плазмиды интеграции pMGCgpt-TK-GM-CSF
Получают плазмиду интеграции для встройки гена, кодирующего гранулоцитарно-макрофагальный колониестимулирующий фактор, путем рестриктазно-лигазного метода. Для этого в качестве основы для создания плазмиды интеграции используют плазмиду pMGCgpt_TK, содержащую селективный ген gpt, кодирующий ксантин-гуанин-форсфорибозил трансферазу, под контролем 7,5К промотора ВОВ, рекомбинантные плечи, гомологичные участкам вирусного генома ВОВ в районе гена ТК, полилинкер с множественными сайтами, узнаваемыми эндонуклеазами рестрикции, сильный синтетический ранне-поздний промотор (PE/L) и сигнал терминации (TTTTNT).
Искусственно синтезированную последовательность, кодирующую ГМ-КСФ и содержащую сайты, узнаваемые эндонуклеазами рестрикции BamHI, SalI, и векторную плазмиду pMGCgpt_TK гидролизуют эндонуклеазами рестрикции BamHI, SalI. Реакционная смесь, объемом 20 мкл, при гидролизе содержит 2 мкг ДНК, эндонуклеазы рестрикции BamHI, SalI (3 ед.а.), 2 мкл буфера 10-кратной концентрации, оптимального для данных эндонуклеаз рестрикции («СибЭнзим», Россия). Гидролиз проводят при 37°C, 2 ч.
Далее полученные гидролизованные фрагменты ДНК электрофоретически разделяют в 1,5% агарозном геле и затем элюируют ДНК из геля набором фирмы «Qiagen» (Германия) согласно инструкции фирмы производителя. Проводят реакцию лигирования. Реакционная смесь содержит 0,2 мкг вектора, гидролизованного эндонуклеазами рестрикции, 0,2 мкг амплифицированного фрагмента (предварительно гидролизованного соответствующими эндонуклеазами рестрикции), 5 е.а. ДНК-лигазы фага Т4 («Invitrogen», США), однократный буфер для ДНК-лигазы фага T4. Реакцию проводят при температуре 22°C, 5 ч. Полученной лигазной смесью трансформируют компетентные клетки E.coli XL2-blue. Для этого компетентные клетки размораживают во льду, добавляют смесь после лигирования, аккуратно перемешивают и инкубируют 30 мин во льду, после чего проводят инкубацию при температуре 42°C, 2 мин и переносят пробирки в лед на 5 мин. Клетки высевают при помощи шпателя Дригальского на чашку Петри с селективной агаризованной средой, содержащей 100 мкг/мл ампициллина. После 12 часовой инкубации пересевают индивидуальные колонии в среду LB и инкубируют при 37°C до стационарной фазы роста. Рекомбинантную плазмидную ДНК выделяют по стандартной методике и анализируют с помощью эндонуклеаз рестрикции BamHI, SalI. Затем проводят анализ фрагментов ДНК, встроенных в структуру плазмиды pMGCgpt_TK, на наличие нуклеотидных замен. Определение нуклеотидной последовательности проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США). Полученную таким образом целевую плазмиду обозначают pMGCgpt-TK-GM-CSF.
Пример 3. Получение рекомбинантного ВОВ, содержащего ген, кодирующий ГМ-КСФ, в районе вирусного гена, кодирующего тимидинкиназу.
Для встройки гена, кодирующего ГМ-КСФ, в состав вирусного генома, монослой клеток CV-1 заражают рекомбинантным вирусом ВОВ_TK(-)_VGF(-) с множественностью заражения 0,1 БОЕ/клетка. Далее проводят трансфекцию клеток CV-1 плазмидой интеграции pMGCgpt-TK-GM-CSF. Для этого монослой клеток CV-1 отмывают средой без сыворотки. Инфицируют вирусом ВОВ_TK(-)_VGF(-) с множественностью заражения 0.1 БОЕ/клетка и выдерживают 1 ч при 37°C. Затем дважды отмывают средой без сыворотки и проводят трансфекцию рекомбинантной плазмидой интеграции с использованием липофектамина («Invitrogen», США). Для этого 5 мкл плазмиды в концентрации 1 мкг/мкл смешивают с 15 мкл липофектамина в концентрации 1 мг/мл, добавляют 1 мл среды DMEM («Биолот», Россия), оставляют на 15 мин при комнатной температуре и наносят на монослой клеток CV-1. Через 5 ч к клеткам добавляют селективную среду DMEM с 2 % ЭСК («HyClone», США) и с ксантином (250 мкг/мл), гипоксантином (15 мкг/мл) и микофеноловой кислотой (25 мкг/мл). После чего ведут серию пассажей под селективным давлением до полного прекращения инфицирования клеток исходным вирусом (контролем). Затем получают независимые клоновые варианты вируса клонированием под агарозой.
Пример 4. ПЦР анализ ДНК ВОВ на наличие в геноме гена, кодирующего ГМ-КСФ
Клоновые варианты вируса анализируют методом ПЦР на наличие встройки в геноме гена, кодирующего ГМ-КСФ, с использованием соответствующей пары праймеров:
5'-AACACTTTCTACACACCGATTGA-3'
5'-CGGACATATTCAGTTGATAATCG-3'
ПЦР проводят в тонкостенных микропробирках типа «Eppendorf» в амплификаторе «GeneAmp PCR System 9700» (Applied Biosystems, США). Используют реактивы для реакции производства фирмы «СибЭнзим» (Россия). Смесь компонентов из расчета на одну пробу:
SE-буфер для Taq ДНК-полимеразы (pH 8,5 при 25°C: 60 мM Tris-HCl, 25 мM KCl, 1,5 мM MgCl2, 10 мM 2-меркаптоэтанол, 0,1% Тритон Х-100), смесь трифосфатов (по 0,2 мМ каждого dNTP), по 0,7 мкМ прямого и обратного праймеров, 2,5 ед. Taq ДНК-полимеразы, около 2-10 нг ДНК-матрицы, вода стерильная деионизованная (H2O) до 25 мкл.
Затем пробирки переносят в амплификатор и производят ПЦР по программе, включающей следующие этапы:
предварительная денатурация ДНК при 94°C,90 с;
30 циклов, состоящих из:
денатурации ДНК при температуре 94°C, 20 с,
отжига праймеров при 50°C в течение 30 с,
синтеза комплементарной цепи при 72°C, время элонгации рассчитывалось исходя из скорости синтеза ДНК термостабильной ДНК-полимеразы (1000 п.н./мин).
далее пробирки прогревают в течение180 мин при 72°C.
Продукты амплификации хранят при температуре 4°C до проведения электрофоретического анализа. Анализ фрагментов проводят с помощью электрофоретического разделения ПЦР-продуктов в 1,5% агарозном геле в трис-ацетатном буфере. Для контроля длины полученных фрагментов используют ДНК-маркер 1 kb («СибЭнзим», Россия). Электрофорез проводят при напряжении из расчета 10 В/см в течение 60 мин. После чего гель переносят в раствор бромистого этидия 0,2 мкг/мл и гель-документирующей системой визуализации изображений Image Station 440CF (Kodak, США) производят детекцию результатов электрофоретического разделения ПЦР-фрагментов.
Пример 5. Подтверждение наличия экспрессии гена, кодирующего ГМ-КСФ, включенного в состав вирусного генома
Клетки CV-1 в лунках 6-го луночного планшета заражают рекомбинантным вирусом, с множественностью заражения 0,1 БОЕ/клетка и инкубируют при температуре 37°C. На 1-ые и 2-ые сутки после заражения вирусом снимают контрольные точки, удаляя содержимое лунок. Затем методом Вестерн-блот анализа детектируют наличие целевого белка в клеточном лизате. На первые и вторые сутки после заражения рекомбинантным вирусом, наблюдается продукция ГМ-КСФ (фиг. 2).
Пример 6. Титрование вируса
Титрование вируса проводят на 90-100% суточном монослое клеток CV-1, используя разведения вируса 10-1-10-6 и сорбируя его в течение 1 ч при 37°C. Затем вирусную суспензию отбирают и добавляют среду ДМЕМ с 2% ЭСК. После инкубации в течение 72 ч при 37°C и 5% содержании CO2 поддерживающую среду удаляют, а монослой клеток окрашивают, используя 0,2% краситель кристаллический фиолетовый, разведенный в смеси 10% этанола и 2% формальдегида. Подсчитывают число бляшек и рассчитывают титр вируса (БОЕ/мл).
Пример 7. Получение плазмиды интеграции pMGCgpt-A34R(D110N_K151E)
Вводят аминокислотные замены (D110N, K151E) в состав белка A34 путем метода сайт направленного ПЦР-мутагенеза. Для этого расчитывают олигонуклеотидные праймеры при помощи программы Oligo 6.31 («Molecular Biology Insights», США):
5'-TTACATACTGTTTCAACCAGTTTT-3'
5'-CTGGAAAACTGGTTGAAACAG-3'
5'-CATTTATTATTGGTCTTTTTTAAAC-3'
5'-AAGTTTAAAAAAGACCAATAATAAAT-3'
5'-GAGCTCTTGTACATTAATAAATGAAATCGC-3'
5'-AAGCTTGAATAGATAAAATGGCTGATGTTT-3'
В ходе ПЦР получают три частично комплементарные нуклеотидные последовательности. Затем три ПЦР-продукта объединяют в одну пробирку, предварительно избавившись от исходной вирусной ДНК путем их элюции из 1,2 % агарозного геля, и проводят ПЦР с добавлением пары праймеров:
5'-GAGCTCTTGTACATTAATAAATGAAATCGC-3'
5'-AAGCTTGAATAGATAAAATGGCTGATGTTT-3
В ходе дальнейшей работы полученный ПЦР-продукт лигируют с вектором pJet («Thermo Scientific», Литва). Реакционная смесь, объемом 20 мкл, содержит 0,1 мкг векторной плазмидной ДНК pJet, 0,5 мкг ПЦР-продукта, 5 ед.а. ДНК-лигазы фага Т4, 2 мкл лигазного буфера 10-кратной концентрации («Thermo Scientific», Литва). Реакцию лигирования проводят 60 мин при 22°C.
После реакции лигирования ПЦР-продукта с векторной плазмидой проводят трансформацию компетентных клеток E.coli: клетки рассевают на твердую агаризованную среду, содержащую 100 мкг/мл ампициллина, инкубируют при 37°C, 12 ч. Затем отбирают одиночные колонии и засевают ночную культуру в 3 мл питательной среды, которая содержит 100 мкг/мл ампициллина. Далее выделяют плазмидную ДНК при помощи набора QIAprep Spin Miniprep Kit («Qiagen», Германия). Ресуспендируют E.coli в 250 мкл буфера Р1 , куда предварительно добавляют RNase A и реагент LyseBlue. Затем добавляют 250 мкл буфера Р2 и инкубируют 5 мин. Далее добавляют 350 мкл буфера N3. Центрифугируют в течение 10 мин при скорости 12000 g. Наносят 800 мкл супернатанта в колонку QIAprep 2.0, содержащую сорбирующую мембрану, центрифугируют в течение 30-60 с на скорости 12000 g. Промывают колонку QIAprep 2.0 путем добавления 0,5 мл буфера PB и центрифугируют при 12000 g, 30-60 с. Промывают колонку QIAprep 2.0 путем добавления 0,75 мл буфера РЕ и центрифугируют при 12000 g, 30-60 с. Помещают колонку QIAprep 2.0 в чистую микроцентрифужную пробирку объемом 1,5 мл и элюируют плазмидную ДНК в 50 мкл буфера EB (10 мМ Tris Cl, pH 8,5) в течение 1 мин, 12000 g.
После выделения плазмидной ДНК проводят рестрикционный анализ для подтверждения встройки целевой последовательности в вектор pJet. Реакционная смесь, объемом 10 мкл, содержит 0,2 мкг ДНК, 2 ед.а. эндонуклеазы рестрикции BglII, 1 мкл десятикратного буфера, оптимального для данной лигазы («СибЭнзим», Россия), гидролиз проводят при 37°C в течение 2 ч.
Для дальнейшей работы выбирают один клоновый вариант плазмиды со встройкой гена A34R ВОВ.
Измененный ген A34R ВОВ с введенными двумя нуклеотидными заменами получают путем гидролиза плазмиды pJet_A34R(D110N_K151E) эндонуклеазами рестрикции SacI и HindIII по описанной выше методике. После чего гидролизованный фрагмент лигируют с плазмидой pMGCgpt-ТК, гидролизованной по тем же сайтам узнавания эндонуклеаз рестрикции. Затем трансформируют компетентные клетки E.coli и выделяют одиночные колонии, анализируя полученные плазмиды интеграции на наличие инсерции участка гена ВОВ A34R с двумя точечными нуклеотидными заменами. Далее проводят анализ полученной плазмиды интеграции на наличие нуклеотидных замен. Нуклеотидную последовательность определяют на автоматическом секвенаторе 310 Genetic Analyzer («BioSystems», США) с использованием реагента «BigDye-v.3.1.» («BioSystems», США).
Среди нескольких клонов с целевой встройкой выбирают один, содержащий две нуклеотидные замены (приводящие к аминокислотным заменам K151E, D110N).
Далее полученную плазмиду нарабатывают и очищают от эндотокинов при помощи набора Endo Free Plasmid Maxi Kit («Qiagen», Германия) Концентрация наработанной плазмиды pMGC_A34R_(K151E_D110N) составила 1,04 мкг/мл.
Пример 8. Получение ВОВ, содержащего в геноме ген A34R с двумя точечными нуклеотидными заменами, приводящими к аминокислотным заменам D110N, K151E в составе мембранного гликопротеина A34.
Для замены в геноме ВОВ гена A34R на ген A34R с двумя нуклеотидными заменами, приводящими к аминокислотным заменам D110N, K151E, монослой клеток CV-1 заражают рекомбинантным вирусом ВОВ_TK(-)_GM-CSF(+)_VGF(-) (см. пример 3) с множественностью заражения 0,1 БОЕ/клетка. Далее проводят трансфекцию клеток CV-1 плазмидой интеграции pMGC_A34R_(K151E_D110N). После чего ведут серию пассажей под селективным давлением до полного прекращения инфицирования клеток исходным вирусом (контролем). Затем получают независимые клоновые варианты вируса методом клонирования под агарозой. Геномную ДНК независимых клоновых вариантов вируса анализируют при помощи ПЦР и последующего секвенирования полученных ПЦР-продуктов.
Определение нуклеотидной последовательности проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США) с использованием праймеров:
5'-CAAGATTCTGATGTATCACAAGAA-3'
5'-GTTATACGCTTCTATGATTGTAGC-3'
Полученный вирус, содержащий в ОРТ A34R две нуклеотидные замены, приводящие к аминокислотным заменам K151E, D110N, обозначают ВОВ_TK(-)_GM-CSF(+)_VGF(-)_A34R_(K151E_D110N).
Пример 9. Получение плазмиды интеграции pMGCgpt-VGF-UB_BC.
Фрагмент ДНК, кодирующий убиквитин, получали путем полимеразной цепной реакции с использованием праймеров:
5'-AGATCTCACCATGCAGATTTTC GTAAAG-3'
5'-GCATGCGGATCCAACGCCCCTGAG CCTC-3'
Полученный ПЦР-продукт клонируют в вектор pJet («Thermo Scientific», Литва). После реакции лигирования ПЦР-продукта с векторной плазмидой проводят трансформацию компетентных клеток E.coli. Далее клетки рассевают на твердую агаризованную среду, содержащую 100 мкг/мл ампициллина и оставляют в термостате при 37°C на 12 ч. Затем отбирают одиночные колонии и засевают ночную культуру в 3 мл питательной среды, содержащей 100 мкг/мл ампициллина. Далее выделяют плазмидную ДНК и проводят рестрикционный анализ для подтверждения встройки необходимого фрагмента в вектор pJet, используя эндонуклеазу рестрикции BglII. Полученную плазмиду обозначают pJet_UB.
Для получения целевой плазмиды интеграции плазмиду pJet_UB гидролизуют по сайтам узнавания эндонуклеазами рестрикции BglII и SphI. Гидролизованный фрагмент ДНК (250 п.н.) элюируют из геля и лигируют с предварительно гидролизованным по тем же сайтам эндонуклеаз рестрикции вектором pMGCgpt-VGF. Затем целевую встройку в плазмиде подтверждают рестрикционным анализом с использованием эндонуклеаз рестрикции BglII и SphI. Полученную плазмиду обозначают pMGCgpt-VGF_UB.
Затем гидролизуют pInt_VGF(-)_UB и искусственно синтезированную полиэпитопную конструкцию по сайтам, узнаваемым эндонуклеазами рестрикции BamHI и SalI, после чего проводят реакцию лигирования полученных фрагментов ДНК. Затем трансформируют клетки E.coli и получают независимые клоновые варианты плазмид, которые подвергают рестрикционному анализу с использованием эндонуклеаз рестрикции BamHI и SalI.
Определение нуклеотидной последовательности проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США) и праймеров:
5'-GCTGTCTGTTGGCAGATAGG-3'
5'-CCAGGCGCTGATGTAGTC -3'
5'-CTGGAGGTCTTGGCCGAT-3'
5'-GGCCAACAAGGCAGACAT-3'
5'-CAAATTGGTATTGCGTACACAA-3'
5'-CCACCCACTGTATTCATTTTCA-3'
Полученную плазмидную ДНК обозначают pMGCgpt-VGF-UB_BC (фиг. 5).
Пример 10. Получение ВОВ, содержащего полиэпитопный иммуноген, состоящий из эпитопов антигенов (HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1), гиперэкспрессирующихся при раке молочной железы
Для введения искусственного иммуногена против рака молочной железы в район гена, кодирующего вирусный фактор роста, ВОВ_TK(-)_GM-CSF(+)_VGF(-)_A34R_(K151E_D110N), монослой клеток CV-1 заражают рекомбинантным вирусом ВОВ_TK(-)_GM-CSF(+)_VGF(-)_A34R_(K151E_D110N) (см. пример 8) с множественностью заражения 0,1 БОЕ/клетка. Далее проводят трансфекцию клеток CV-1 плазмидой интеграции pMGCgpt-VGF-UB_BC. После чего ведут серию пассажей под селективным давлением до полного прекращения инфицирования клеток исходным вирусом (контролем). Затем получают независимые клоновые варианты вируса клонированием под агарозой. Геномную ДНК независимых клоновых вариантов вируса анализируют при помощи ПЦР и последующего секвенирования, полученных ПЦР-продуктов.
Определение нуклеотидной последовательности SEQ ID NO:1 (фиг. 4 и приложение) проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США) и праймеров:
5'-GCTGTCTGTTGGCAGATAGG-3'
5'-CCAGGCGCTGATGTAGTC -3'
5'-CTGGAGGTCTTGGCCGAT-3'
5'-GGCCAACAAGGCAGACAT-3'
5'-CAAATTGGTATTGCGTACACAA-3'
5'-CCACCCACTGTATTCATTTTCA-3'
Полученный вирус обозначают Л-ИВП_oncoB.
Пример 11. Наработка и очистка вируса Л-ИВП_oncoB
Монослой культуры клеток CV-1, выращенный на культуральных флаконах, инфицируют ВОВ штамм Л-ИВП_oncoB с множественностью заражения 1,0 БОЕ/клетка, добавляют среду ДМЕМ содержащую 2% ЭСК. Инкубируют 48 ч при 37°C до образования полного ЦПД и получают криолизат инфицированных клеток путем трехкратного цикла замораживания-оттаивания. Полученный лизат обрабатывают на ультразвуковом дезинтеграторе типа "MSE 500" мощностью 22 кГц импульсно 2-3 раза по 10-15 с. Клеточный дебрис осаждают центрифугированием 10-15 мин при 3000 об/мин (центрифуга J2-HS «Beckman»). Супернатант переносят в новые центрифужные и центрифугируют при 14000 об/мин., 2 ч (центрифуга J2-HS «Beckman»). Осадок ресуспендируют в физиологическом растворе, трижды обрабатывают с помощью ультразвукового дезинтегратора при условиях, описанных выше, расфасовывают и хранят при -70°C.
Титр образца определяют методом бляшек (см. пример 6) в монослое клеток CV-1. Титр составляет 6*105 БОЕ/мл.
Источники научно-технической и патентной информации
1. Blasco R., Sisler J. R., Moss B. Dissociation of progeny vaccinia virus from the cell membrane is regulated by a viral envelope glycoprotein: effect of a point mutation in the lectin homology domain of the A34R gene // Virol. - 1993. - P. 3319-3325.
2. Coleman C. Early detection and screening for breast cancer // Seminars in Oncology Nursing. - 2017. - V. 33. - P. 141-155.
3. De Vries C.R., Monken C.E., Lattime E.C. The addition of recombinant vaccinia HER2/neu to oncolytic vaccinia - GMCSF given into the tumor microenvironment overcomes MDSC-mediated immune escape and systemic anergy // Cancer Gene Ther. 2015. P. 154-162.
4. Falkner F.G., Moss В. Transient dominant selection of recombinant vaccinia viruses // Journal of Virology - 1990. - V. 64. - P. 3108-3111.
5. Kirn D. Replicating oncolytic viruses: an overview //Expert Opin Investig Drugs. - 1996. - Vol. 5. - P. 753-762.
6. Lal S., McCart Reed A.E., de Luca X.M., Simpson P.T. Molecular signatures in breast cancer. - 2017. - doi: 10.1016/j.ymeth.2017.06.032. Epub 2017.
7. Lee J., Roh M.S., Lee Y.K., Kim M.K., Han J.Y., Park B.H., Trown P., Kirn D.H., Hwang T.H. Oncolytic and immunostimulatory efficacy of a targeted oncolytic poxvirus expressing human GM-CSF following intravenous administration in a rabbit tumor model // Cancer Gene Therapy - 2010 - V. 17 - P. 73-79.
8. Li Y., Yu D.C., Chen Y., Amin P., Zhang H., Nguyen N., Henderson D.R. A hepatocellular carcinoma-specific adenovirus variant, CV890, eliminates distant human liver tumors in combination with doxorubicin. //Cancer.Res. - 2001. - V. 61. - P. 6428-6436.
9. Mc Cart J.A., Ward J.M., Lee J., Hu Y., Alexander H.R., Libutti S.K., Moss B., Bartlett D.L. Systemic cancer therapy with a tumor-selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factorgenes // Cancer Res. - 2001. - V. 61. - P. 8751-8757.
10. Murawa P., Murawa D., Adamczyk B, Polom K. Breast cancer: Actual methods of treatment and future trends // Rep Pract Oncol Radiother. - 2014. - V. 19. - P. 165-172.
11. Nakamura H. Regulation of herpes simplex virus gamma(1)34.5 expression and oncolysis of diffuse liver metastases by Myb34.5 //J. Clin. Invest. - 2002. - V. 109. - P. 871-882.
12. Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning. 2nd ed. - Cold Spring Harbor Laboratory Press., 1989.
13. Schreiber T.H., Raez L., Rosenblatt J.D., Podack E.R. Tumor immunogenicity and responsiveness to cancer vaccine therapy: The state of the art // Seminars in immunology. - 2010. - V. 22. - P. 105-112.
14. Максютов Р.А., Трегубчак Т.В., Денисова Н.И., Максютов А.З., Гаврилова Е.В. Создание современной платформы, содержащей набор онколитических вирусов с иммуностимулирующими свойствами // Российский Иммунологический Журнал. - 2013. - Т. 7. - № 4. - С. 456-459., http://elibrary.ru/item.asp?id=22390946.
15. Непомнящих Т.С., Антонец Д.В., Максютов Р.А. Краткий обзор клинических испытаний средств иммунотерапии онкологических заболеваний // Медицинская иммунология. - 2017. - Т.19. - С.127-144.
Приложение
<110> Федеральное бюджетное учреждение науки «Государственный научный центр ви-русологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора)
<120> Рекомбинантный онколитический штамм вируса осповакцины Л-ИВП_oncoB, содержащий гены, кодирующие гранулоцитарно-макрофагальный колониестимулирующий фактор и полиэпитопный иммуноген, состоящий из эпитопов антигенов, гиперэкспрессирующихся опухолевыми клетками при раке молочной железы.
<160> SEQ ID NO 1
<210> SEQ ID NO:1
<211> 1535
<212> DNA
<213> Artificial Sequence
<220>
<223> Нуклеотидная последовательность искусственного гена, кодирующего полиэпитопный иммуноген, состоящий из эпитопов антигенов, гиперэкспрес-сирующихся опухолевыми клетками при раке молочной железы.
<400> 1
TATCTGGAAGAGATCACAGGCTACCTCGCAGACAAAATCTTCGGCTCACTTGCCTTCCTGGCTGATAGCATCATTTCTGCCGTGGTTGGCATTGCCGATCAGCTGTTCGAGGACAACTATGCACTGGCCGACTACATGATCATGGTGAAGTGCTGGATGATCGCCGACAGCATCATCAGTGCCGTTGTTGGTATTCTTTTGGTGGTGGTGCTGGGAGTCGTGTTTGGAATCGCTGATCAACTGATGCCCTATGGCTGTCTGTTGGCAGATAGGTTGCTCCAGGAGACCGAACTGGTTGCCGACTACATCAGCGCCTGGCCTGACAGCCTGGCCGACAAACTGCTCATGGTGCTGATGCTTGCAGCTCTGGCCGACTTCCTGAACCAGACTGATGAGACACTGGCTGACACCATCAATCCTCAGGTGAGCAAGACAGCTGACATGCAGCTGATCTACGACTCAAGCCTGTGTGACCTTGCCGACAAGCTGCTTATGGTCTTGATGTTGGCTGCACTGGCAGACCTCCTCAGCCACGGTGCCGTGATCGAAGTTGCTGACAGCCTGAGCAAGATCCTGGACACCGTGGCCGACTATCTTTTGCACGAGAACTGCATGTTGGCAGACTCTCTGGACCAGAAGCTGTTCCAACTGGCTGATAGCCTGTTCGAGAGCTCAGCAAAGATCGCCGATGCCGTGTACAGCGAGATTCTGAGCGTGGCCGACAAGGTGATGGAGATCAACAGAGAGGTTGCCGACGGCCTGATGGAGGAAATGTCAGCTCTGCTGGCCGACTTTGCCAGTGCCATGATGCACGCCCTGGAGGTCTTGGCCGATGGACTTGCTGCTGCCATCGCAGGAGCAGCAGATTTGATGGAAGAGATGTCTGCCTTGTTGGCCGATCGGCTGTTCTTTTACAGGAAGAGCGTTGCCGACTACCTCTTTTTCTACCGCAAGTCTGTGGCAGACTATCTCCAGGTGAACAGCTTGCAGACTGTGGCCGACAGACTTGTGGATGACTTCCTGCTGGTTGCTGACTTGCTCGCTAGGTGTGCCTTGTTCGTGGCTGACTTGCTTGACACCAGGACCCTGGAAGTGGCCGACATTCTGGCCAAGTTTCTGCACTGGCTTGCCGATGCACTGGGCAGCACCGCCCCTCCAGTGCACAACGTGGCCGACGCCCTGTGGGGACAAGACGTGACCAGTGTGGCTGACTTCCTTCTGTTGCTCTTGACAGTGCTGACCGTTGCCGACTTCCTGAGCTTCCACATCAGCAACCTTGCCGACTTCTTGCTGCTGCTTCTCACTGTGCTGACTGTCGTTGCTGACAGCCTGAGCTACACCAATCCTGCCGTGGCAGATGCCTTGCTTGTGCTGGTGTGCGTGCTTGTTGCACTGGCTGACGCCAGGTACCAGTACATCAAAGCCAACAGCAAGTTCATCGGCATCACCGAACTTGCCGACGCTCGGTATGCCAAGTTTGTTGCTGCCTGGACACTGAAGGCAGCAGCCTGATAATAG


Изобретение относится к области биотехнологии и касается рекомбинантного онколитического вируса осповакцины Л-ИВП_oncoB депонированного в государственной коллекции возбудителей вирусных инфекций и реккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-796. Предлагаемый штамм содержит: ген A34R с двумя нуклеотидными заменами; в области вирусного гена тимидинкиназы ген, кодирующий гранулоцитарно-макрофагальный колониестимулирующий фактор; в области вирусного гена, кодирующего вирусный фактор роста, ген, кодирующий полиэпитопный иммуноген. Полиэпитопный иммуноген состоит из эпитопов антигенов HER2, mammoglobin-A, NY-BR-1, hMena, hTERT, MUC-1. Представленный штамм может быть использован для приготовления лекарственных средств, используемых в терапии рака молочной железы. 5 ил., 11 пр.
Рекомбинантный онколитический штамм вируса осповакцины Л-ИВП_oncoB депонированный в государственной коллекции возбудителей вирусных инфекций и реккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-796 для применения при лечении рака молочной железы.
| РЕКОМБИНАНТНЫЙ ШТАММ VV-GMCSF-Lact ВИРУСА ОСПОВАКЦИНЫ, ОБЛАДАЮЩИЙ ОНКОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ И ПРОДУЦИРУЮЩИЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ЧЕЛОВЕКА И ОНКОТОКСИЧЕСКИЙ БЕЛОК ЛАКТАПТИН | 2015 |
|
RU2604187C1 |
| Максютов Р | |||
| А | |||
| и др | |||
| Создание современной платформы, содержащей набор онколитических вирусов с иммуностимулирующими свойствами | |||
| Российский иммунологический журнал, 2013, том 7(16), N4, с.456-459. | |||
Авторы
Даты
2019-01-22—Публикация
2017-12-11—Подача