Изобретение относится к рекомбинантному аттенуированному штамму вируса осповакцины (VACΔ6) с нарушенными генами C3L, N1L, J2R, A35R, A56R и B8R на основе клонированного вируса осповакцины штамм Л-ИВП, который может быть использован в медицине, биотехнологии, в частности в генной инженерии, для получения живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека.
Вирус натуральной оспы (ВНО) вместе с такими патогенными для человека видами, как вирусы оспы обезьян (ВОО), оспы коров (ВОК), оспы буйволов (ВОБ) и осповакцины (ВОВ), принадлежит к роду Ortopoxvirus семейства Poxviridae [Moss B. Poxviridae: the viruses and their replication. In Fields Virology / edited by D. M. Knipe. – Philadelphia: Lippincott Williams & Wilkins. – 2007. – 5th edn. – P. 2905-2946]. ВНО вызывает натуральную оспу – одно из наиболее опасных и смертоносных высоко контагиозных инфекционных заболеваний человека со смертностью 20-30%, унесшее только в 20 веке сотни миллионов жизней и являющееся одной из основных причин слепоты у людей того времени. При этом натуральная оспа – единственное заболевание человека, которое было ликвидировано в результате кампании глобальной вакцинации. Это достижение остается одним из величайших триумфов медицинской науки. Учитывая тяжелые поствакцинальные осложнения при использовании классической живой вакцины и подтверждение ликвидации натуральной оспы, в 1980 г. вакцинацию против данной инфекции Всемирная организация здравоохранения рекомендовала в дальнейшем не проводить [Wiser I., Balicer R.D., Cohena D. An update on smallpox vaccine candidates and their role in bioterrorism related vaccination strategies. // Vaccine. – 2007. – V. 25. – P. 976-984], хотя угроза возвращения этого заболевания существует и в настоящее время.
В результате отказа более 30 лет назад от повсеместной вакцинации против натуральной оспы в человеческой популяции с каждым годом увеличивается доля населения, утратившая специфический иммунитет против данного заболевания. Это делает человечество все беззащитнее не только перед возможным инфицированием ВНО, но и другими близкородственными ортопоксвирусами, природным резервуаром которых являются различные животные, в первую очередь, грызуны [Monkeypox. Official site of World Health Organization. – 2011. Fact sheet № 161. http://www.who.int/mediacentre/factsheets/fs161/en/]. К таким вирусам относятся ВОО, ВОК и ВОБ, вызывающие оспоподобные заболевания животных. Распространение этих вирусов в человеческой популяции потенциально может привести к их адаптации к иммунной системе организма человека и появлению вирусных вариантов эпидемически опасных для людей. Кроме того, большую опасность представляет потенциальная возможность использования ВНО в качестве агента биотеррористических атак, которые могут иметь катастрофические последствия для всего населения Земли.
В последние годы в различных регионах мира стали регистрировать необычно многочисленные вспышки ортопоксвирусных инфекций среди людей, например в Демократической Республике Конго с 1980-х годов в 20 раз увеличилось количество случаев заражения людей ВОО, а в западной Африке регулярно регистрируются вспышки этого заболевания, смертность которого составляет 1-8%. Также в разных районах Индии участились случаи заражения людей ВОБ [Shchelkunov S. N. An increasing danger of zoonotic orthopoxvirus infections. // PLoS Pathog. – 2013. – V. 9. – e1003756]. Кроме этого, в 2009 в северо-западном регионе Индии впервые были зафиксированы случаи заражения людей близким родственником ВНО – вирусом оспы верблюдов, во время вспышки этой инфекции среди животных [Bera B.C., Shanmugasundaram K., Barua S., Venkatesan G., Virmani N., Riyesh T., et al. Zoonotic cases of camelpox infection in India. // Vet Microbiol. – 2011. – V. 152. – P. 29-38]. Учитывая растущие масштабы транспортных сообщений по всему миру, вероятность распространения этих зоонозных ортопоксвирусов становится крайне высокой, что подтверждается случаем завоза оспы обезьян в США [Ninove L., Domart Y., Vervel C., Voinot C., Salez N., Raoult D., et al. Cowpox Virus Transmission from Pet Rats to Humans, France. // Emerging Infectious Diseases. – 2009. – V. 15 – P. 781-784].
Потенциальное появление и возрождение заболеваний человека, вызываемых ортопоксвирусами, требует разработки адекватных контрмер. Единственным методом борьбы с натуральной оспой, доказавшим свою эффективность, является вакцинопрофилактика. Но использование классических живых вакцин на основе ВОВ для вакцинации населения сейчас может привести к еще большому числу побочных реакций и более тяжелым их проявлениям, чем во время кампании ликвидации натуральной оспы. Примерно 25% населения планеты противопоказана вакцинация ВОВ. В первую очередь это беременные женщины и люди с супрессивным состоянием иммунитета, вызванным раком, трансплантацией органов, ВИЧ-инфекцией и т. п., а также лица с заболеваниями сердца, экземой и атопическим дерматитом [Eckart R. E., Love S. S., Atwood J. E., Arness M. K., Cassimatis D. C., Campbell C. L., et al. Incidence and follow-up of inflammatory cardiac complications after smallpox vaccination. // J Am Coll Cardiol. – 2004. – V. 44. – P. 201–205; Kemper A. R., Davis M. M., Freed G. L. Expected adverse events in a mass smallpox vaccination campaign. // Effective Clinical Practice. – 2002. – V. 5. – P. 84-90]. Следовательно, один из каждых 450 вакцинированных человек будет иметь серьезный побочный эффект, приводящий к госпитализации [Casey C. G., Iskander J. K., Roper M. H., Mast E. E., Wen X. J., Torok T. J., et al. Adverse events associated with smallpox vaccination in the United States, January-October 2003. // JAMA. – 2005. – V. 294. – P. 2734–2743]. Поэтому, в идеале современные вакцины должны быть более безопасны и высокоиммуногены, обеспечивая быструю локализацию и ликвидацию возникающей инфекции. Также необходим поиск более совершенных схем вакцинации для достижения как можно более быстрой защиты. Создание подобных современных вакцин является одной из основных задач современного здравоохранения [Verardi P. H., Titong A. and Hagen C. J. A vaccinia virus renaissance. New vaccine and immunotherapeutic uses after smallpox eradication. // Hum Vaccin Immunother. – 2012. – V. 8. – P. 961–970].
Так как структурные белки ортопоксвирусов имеют высоко консервативную природы, то иммунизация ВОВ обеспечивает перекрестную защиту против натуральной оспы и других представителей этого рода, индуцируя выработку родоспецифичных антител. Поэтому в течение почти двух столетий штаммы ВОВ использовались в качестве вакцины, вплоть до ликвидации натуральной оспы в конце 1970х годов [Wiser I., Balicer R.D., Cohena D. An update on smallpox vaccine candidates and their role in bioterrorism related vaccination strategies. // Vaccine. – 2007. – V. 25. – P. 976-984]. Эти вакцины, особенно первого поколения, приводили к редким, но тяжелым поствакцинальным осложнениям, основными из которых являются: поствакцинальный энцефалит, прогрессирующая и генерализованная вакцинии, вакцинальная экзема, миоперикардит. Хотя серьезные осложнения и наблюдались редко, но при этом становились инвалидами, а иногда и погибали, здоровые до прививки люди [Jacobs B. L., Langland J. O., Kibler K. V., Denzler K. L., White S. D., Holechek S. A., et al. Vaccinia virus vaccines: past, present and future. // Antiviral Res. – 2009. – V. 84. – P. 1-13].
Начиная с конца 19 века, проводилось активное создание ряда модифицированных вакцин на основе ВОВ с улучшенными характеристиками безопасности. Аттенуация достигалась использованием различных стратегий: последовательные пассажи через альтернативных хозяев, использование генетической инженерии: либо делеция иммуномодулирующих и жизненно важных генов вируса, либо вставка хозяйских иммуномодулирующих генов в геном вируса [Wiser I., Balicer R.D., Cohena D. An update on smallpox vaccine candidates and their role in bioterrorism related vaccination strategies. // Vaccine. – 2007. – V. 25. – P. 976-984].
Во время кампании по ликвидации оспы предпринимались попытки создать аттенуированный штамм ВОВ, который отличался бы протективной эффективностью при незначительной выраженности побочных эффектов [Fenner F., Henderson D. A., Arita I., Jezek Z., Ladnyi I. D. Smallpox and its eradication. Geneva: World Health Organization. – 1988. – 1460 pp.]. Первые аттенуированные штаммы ВОВ были получены в результате множественных пассажей вируса, например, на культуре фибробластов куриных эмбрионов – штамм MVA [McCurdy L. H., Larkin B. D., Martin J. E., Graham B. S. Modified vaccinia Ankara: potential as an alternative smallpox vaccine. // Clin. Infect. Dis. – 2004. – V. 38. – P. 1749–1753], или на культуре эпителиальных клеток почки кролика при низкой температуре (30°С) – штамм LC16m8 [Kenner J., Cameron F., Empig C., Jobes D. V., Gurwith M. LC16m8: an attenuated smallpox vaccine. // Vaccine. – 2006. – V. 24. – P. 7009–7022]. В этих случаях аттенуация вируса обусловлена спонтанными протяженными делециями и мутациями в вирусном геноме. При этом кроме генов вирулентности могут затрагиваться и гены, функции которых определяют репликативные свойства вируса, круг его чувствительных и т. д. Например, MVA характеризуется низкой реактогенностью, но при этом мутации затронули и гены круга хозяев, что привело к репликативной дефектности вируса в большинстве клеток млекопитающих, в том числе и человека. Следовательно, для формирования достаточного уровня иммунной защиты необходимо либо неоднократное введение или введение больших доз вирусая. Штамм LC16m8 же менее аттенуирован, чем MVA, и из-за нарушения гена одного из оболочечных белков внеклеточной формы вируса (B5R) может быть менее эффективным в плане формирования иммунитета против ортопоксвирусов, так как не способен индуцировать выработку антител на поверхностный антиген B5 [Jacobs B. L., Langland J. O., Kibler K. V., Denzler K. L., White S. D., Holechek S. A., et al. Vaccinia virus vaccines: past, present and future. // Antiviral Res. – 2009. – V. 84. – P. 1-13].
С развитием методов молекулярной биологии стало возможным создавать модифицированные варианты ВОВ с помощью введения целевых последовательностей в вирусный геном, либо удаления или нарушения конкретных генов самого вируса [Jacobs B. L., Langland J. O., Kibler K. V., Denzler K. L., White S. D., Holechek S. A., et al. Vaccinia virus vaccines: past, present and future. // Antiviral Res. – 2009. – V. 84. – P. 1-13]. Получение аттенуированного ВОВ может быть достигнуто нарушением генов, кодирующих различные молекулярные факторы вирулентности, такие как, ингибиторы действия интерферонов, апоптоза инфицированных клеток, воспалительных реакций организма, а также генов: круга хозяев, белков оболочки внеклеточного вириона, вирусных факторов роста, белков, участвующих в метаболизме нуклеиновых кислот, kelch-подобных и ankyrin-подобных белков ВОВ и др. [Маренникова С. С., Щелкунов С. Н. Патогенные для человека ортопоксвирусы. М.: KMK Scientific Press Ltd. – 1988. – 386 с]. Примером может служить штамм NYVAC ВОВ – один из наиболее хорошо охарактеризованных генетически аттенуированных нереплицирующихся мутантов ВОВ. NYVAC получен из штамма Copenhagen ВОВ путем селективной делеции 18 генов/открытых рамок трансляции. В эксперименте на иммунодефицитных макаках NYVAC показал безопасность, но не смог обеспечить защиту от последующей летальной инфекции ВОО [Edghill-Smith Y., Bray M., Whitehouse C. A., Miller D., Mucker E., Manischewitz J., et al. Smallpox vaccine does not protect macaques with AIDS from a lethal monkeypox virus challenge. // J. Infect. Dis. – 2005. – V. 191. – P. 372-381].
Таким образом, выключение генов вирулентности способно существенно снизить патогенные свойства ВОВ. Одним из наиболее перспективных направлений таких работ является создание методами генетической инженерии высокоаттенуированных вариантов ВОВ, обладающих иммуногенностью и протективностью на уровне классической противооспенной вакцины, но при этом характеризующиеся меньшей патогенностью.
Известен рекомбинантный штамм Copenhagen ВОВ (международная заявка №WO92/15672, МПК C12N7/00, опубл. 17.09.1992 г.), разработанный компанией Virogenetics Corporation (США). В этот штамм ВОВ были введены делеции по шести областям генома патогена через рекомбинацию специально созданных плазмид с вирусным геномом. Однако в рекомбинантном штамме, наряду с делециями индивидуальных генов, произошло нарушение еще 12 генов вируса, что привело к снижению способности ВОВ реплицироваться на разных линиях человеческих клеток, снижая, тем самым, его технологические возможности при производстве вакцины. В итоге, комбинация генов вирулентности в рекомбинантном штамме отличается от заявляемого технического решения. Кроме того, этот мутантный штамм ВОВ не аттестован и не используется в России для производства классической противооспенной вакцины.
Наиболее близким аналогом (прототипом) является штамм 1421ABJCN, полученным из клонового варианта штамма Л-ИВП ВОВ (14Л-ИВП) последовательным нарушением пяти генов: C3L, N1L, J2R, A56R и B8R, который продемонстрировал значительное сниженные показатели реактогенности и нейровирулентности по сравнению с родительским штаммом Л-ИВП на фоне сохранения им иммуногенных и протективных свойств исходного штамма [Якубицкий С. Н., Колосова И. В., Максютов Р. А., Щелкунов С. Н. Аттенуация вируса осповакцины. // Acta Naturae. – 2015. – № 27. – С. 125-134].
Однако указанный штамм имеет недостаточно высокую иммуногенную и протективную активность
С целью повышения иммуногенной и протективной активностей полученного рекомбинантного штамма ВОВ было предложено авторами настоящей заявки на изобретение введение в геном вируса нарушения по гену белка A35, обладающего иммуносупрессивными свойствами [Rehm K. E. and Roper R. L. Deletion of the A35 Gene from Modified Vaccinia Virus Ankara Increases Immunogenicity and Isotype Switching. // Vaccine. – 2011. – V. 29. – P. 3276–3283].
Таким образом, техническим результатом предлагаемого изобретения является создание с использованием шести плазмид интеграции высоко аттенуированного рекомбинантного штамма ВОВ для получения более безопасной живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека с более высокой иммуногенной и протективной активностью.
Указанный технический результат достигается получением рекомбинантного штамма VACΔ6 ВОВ с нарушенными генами C3L, N1L, J2R, A35R, A56R и B8R, предназначенного для получения живой культуральной аттенуированной вакцины против вируса натуральной оспы и других ортопоксвирусных инфекций человека и депонированного в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» с регистрационным № V-696 (справка о депонировании прилагается).
Для создания высоко аттенуированного варианта ВОВ штамма Л-ИВП был использован подход последовательного нарушения ключевых генов различных молекулярных факторов вирулентности этого вируса. Используя литературные данные о нарушении генов различных штаммов ВОВ, приводящих к аттенуации вирусов, нами были выбраны наиболее перспективные из них для этой цели: C3L, N1L, J2R, A35R, A56R и B8R.
Ген C3L кодирует комплемент-связывающий белок (КСБ), секретируемый инфицированной клеткой [Kotwal G. J., Isaacs S. N, McKenzie R., Frank M. M. and Moss B. Inhibition of the complement cascade by the major secretory protein of vaccinia virus. // Science. – 1990. – V. 250. – P. 827-830] и ингибирующий активность системы комплемента через ферментативную инактивацию C3b и C4b фактором I, ускоряя их распад и препятствуя инициированию классического и альтернативного путей конвертации C3 [Sahu A., Isaacs S. N., Soulika A. M. and Lambris J. D. Interaction of vaccinia virus complement control protein with human complement proteins: factor I-mediated degradation of C3b to iC3b1 inactivates the alternative complement pathway. // J. Immunol. – 1998. – V. 160. – P. 5596-5604]. Таким образом, КСБ ингибирует антитело-зависимую, усиленную комплементом нейтрализацию вирионов ВОВ. В опытах на животных мутанты, лишенные КСБ, обладали сниженной вирулентностью [Isaacs S. N., Argyropoulos E., Sfyroera G., Mohammad S. and Lambris J. D. Restoration of complement-enhanced neutralization of vaccinia virus virions by novel monoclonal antibodies raised against the vaccinia virus complement control protein. // Journal of Virology. – 2003. – V. 77. – P. 8256-8262].
Продуктом гена N1L является белок N1 – внутриклеточный гомодимер, относящийся к семейству Bcl-2-антиапоптических белков [Cooray S., Bahar M. W., Abrescia N. G., McVey C. E., Bartlett N. W., Chen R.A., et al. Functional and structural studies of the vaccinia virus virulence factor N1 reveal a Bcl-2-like anti-apoptotic protein. // J. Gen. Virol. – 2007. – V. 88. – P. 1656-1666] и ингибирующий как апоптоз, так и сигнал от рецептора интерлейкина-1, приводящий к активации NF-κB-пути (nuclear factor kappa-light-chain-enhancer of activated B cells – универсальный фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла). Несмотря на расположение этого гена в терминальной (вариабельной) области генома (близко к левому концу генома у штамма WR), он сохранен у многих представителей рода Orthopoxvirus [Bartlett N., Symons J. A., Tscharke D. C. and Smith G. L. The vaccinia virus N1L protein is an intracellular homodimer that promotes virulence. // J. Gen. Virol. – 2002. – V. 83. – P. 1965-1976].
В исследовании с использованием интраназальной модели заражения мышей вирусом, утратившим ген N1L, было показано, что такой мутант ВОВ индуцирует усиленную локальную активность натуральных киллеров между 4 и 6 днями после заражения [Jacobs N., Bartlett N. W., Clark R. H. and Smith G. L. Vaccinia virus lacking the Bcl-2-like protein N1 induces a stronger natural killer cell response to infection. // Journal of General Virology. – 2008. – V. 89. – P. 2877-2881]. В других работах, во внутрикожной модели заражения мышей делеционный мутант по этому гену индуцировал поражения меньшего размера, чем в контролях с диким типом и ревертантом [Jacobs N., Chen R. A., Gubser C., Najarro P. and Smith G. L. Intradermal immune response after infection with vaccinia virus. // J. Gen. Virol. – 2006. – V. 87. – P. 1157-1161], а также меньше инфекционного вируса было получено из зараженной ткани [Bartlett N., Symons J. A., Tscharke D. C. and Smith G. L. The vaccinia virus N1L protein is an intracellular homodimer that promotes virulence. // J. Gen. Virol. – 2002. – V. 83. – P. 1965-1976]. В исследовании [Ren H., Ferguson B. J., Maluquer de Motes C., Sumner R. P., Harman L. E., Smith G. L. Enhancement of CD8(+) T-cell memory by removal of a vaccinia virus nuclear factor-κB inhibitor. // Immunology. – 2015. – V. 145. – P. 34-49] было продемонстрировано, что нарушение экспрессии белка N1 в штамме WR ВОВ приводит к усилению CD8+ Т-клеточной иммуногенности при одновременном снижении вирулентности.
Ген J2R кодирует фермент тимидинкиназу (ТК), участвующую в регулировании уровня дезоксирибонуклеозидтрифосфатного пула, а именно, катализирует реакцию тимин→тимидинмонофосфат [Маренникова С. С., Щелкунов С. Н. Патогенные для человека ортопоксвирусы. М.: KMK Scientific Press Ltd. – 1988. – 386 с]. В работе [Lee M. S., Roos J. M., McGuigan L. C., Smith K. A., Cormier N., Cohen L. K., et al. Molecular attenuation of vaccinia virus: mutant generation and animal characterization. // Journal of Virology. – 1992. – V. 66. – P. 2617-2630] было показано, что ТК–-мутант штамма Wyeth-M ВОВ имеет фенотипические свойства потенциального вакцинного субстрата – внутричерепная вирулентность ниже уровней обнаружения (>8,0 lg), но при этом вирус способен к росту в мышиной коже и вызывать иммунитет подобно штамму дикого типа.
В другом исследовании было установлено, что инактивация J2R-гена встройкой в него чужеродной нуклеотидной последовательности в штамме WR ВОВ приводит к значительному снижению нейровирулентности и вирусных титров в различных органах мышей, зараженных этим мутантом, по сравнению с вирусом дикого типа [Zhang Q., Liang C., Yu Y. A., Chen N., Dandekar T., Szalay A. A. The highly attenuated oncolytic recombinant vaccinia virus GLV-1h68: comparative genomic features and the contribution of F14.5L inactivation. // Mol. Genet. Genomics. – 2009. – V. 282. – P. 417-435]. При дополнительном нарушении в геноме этого мутантного варианта ВОВ генов F14.5L и A56R была продемонстрирована опухолеспецифическая репликация полученного штамма, а также его способность ликвидировать опухоли в купе с практическим отсутствием вирулентности у мышей [Chen N. G., Yu Y. A., Zhang Q., Szalay A. A. Replication efficiency of oncolytic vaccinia virus in cell cultures prognosticates the virulence and antitumor efficacy in mice. // Journal of Translational Medicine. – 2011. – V. 9. – P. 1-11].
В структуре гена A35R ВОВ закодирован высоко консервативный мембранный белок А35, ингибирующий антигенную презентацию, ограниченную MHC класса II, иммунное примирование T-лимфоцитов и последующий синтез хемокинов и цитокинов [Rehm K. E., Connor R. F., Jones G. J. B., Yimbu K., and Roper R. L. Vaccinia Virus A35R Inhibits MHC Class II Antigen Presentation. // Virology. – 2010. – V. 397. – P. 176]. В работе [Roper R. L. Characterization of the Vaccinia Virus A35R Protein and Its Role in Virulence. // Journal of Virology. – 2006. – V. 80. – P. 306–313] была продемонстрирована аттенуация А35--мутанта штамма WR ВОВ на модели интраназального заражения мышей по сравнению с вирусом дикого типа и ревертантом, сохраняя при этом нормальный рост и морфогенез в системе in vitro.
В другом исследовании также было показано сохранение репродуктивных способностей штаммом MVA ВОВ при делеции гена A35R на фоне улучшения его иммуногенности: увеличение продукции ВОВ-специфических иммуноглобулинов и вирус-специфических спленоцитов, секретирующих γ-интерферон, а также отсутствие ингибирования «переключения» класса иммуноглобулинов на изотип IgG и подклассы IgG1 и IgG2a. При этом рекомбинантный вариант ВОВ на мышиной модели продемонстрировал отличную защитную эффективность против 500ЛД50 WR ВОВ [Rehm K. E. and Roper R. L. Deletion of the A35 Gene from Modified Vaccinia Virus Ankara Increases Immunogenicity and Isotype Switching. // Vaccine. – 2011. – V. 29. – P. 3276–3283]. Схожие данные были получены при использовании А35--мутанта штамма WR ВОВ на модели внутрибрюшинного заражения мышей [Rehm K. E., Jones G. J. B., Tripp A. A., Metcalf M. W., and Roper R. L. The Poxvirus A35 Protein Is an Immunoregulator // Journal of Virology. – 2010. – V. 84. – P. 418–425], где также было показано улучшение цитотоксического ответа, опосредованного Т-лимфоцитами, у животных, зараженных рекомбинантным штаммом ВОВ, по сравнению с вирусом дикого типа.
Трансмембранный гликопротеин А56 кодируется геном A56R ВОВ и выполняет как гемагглютинирующую функцию, обеспечивая способность вируса присоединяться к клетке хозяина, так и функцию «якоря» на поверхности зараженных клеток для двух других секретируемых белков ВОВ: ингибитора сериновой протеазы (К2) и КСБ. Комплекс А56-К2 уменьшает суперинфекцию уже зараженных клеток и ингибирует формирование синцития инфицированными клетками, а А56-КСБ комплекс защищает зараженные клетки от атак системы комплемента [Dehaven B. C., Gupta K., Isaacs S. N. The vaccinia virus A56 protein: a multifunctional transmembrane glycoprotein that anchors two secreted viral proteins. // Journal of General Virology. – 2011. V. 92. – P. 1971–1980].
На мышиной модели, делецией гена A56R у штамма NYCBH ВОВ было показано снижение внутричерепного и интраназального ЛД50 приблизительно на 4 lg по сравнению с родительским штаммом. Это сопровождалось исчезновением оспенных образований на скарифицированной коже мышей, несмотря на уровень репликации вируса близкий к дикому типу [Lee M. S., Roos J. M., McGuigan L. C., Smith K. A., Cormier N., Cohen L. K., et al. Molecular attenuation of vaccinia virus: mutant generation and animal characterization. // Journal of Virology. – 1992. – V. 66. – P. 2617-2630]. В другом исследовании был использован штамм WR ВОВ, изменения в A56R-гене которого также привели к сильной аттенуации вируса [Zhang Q., Yu Y. A., Wang E., Chen N., Danner R. L., Munson P. J., et al A. A. Eradication of solid human breast tumors in nude mice with an intravenously injected light-emitting oncolytic vaccinia virus. // Cancer. Res. – 2007. – V. 67. – P. 10038-10046].
Ген B8R ВОВ кодирует секретируемый гликопротеин γ-интерферон-связывающий белок, имеющий сходство по аминокислотной последовательности с внеклеточным доменом клеточного рецептора γ-интерферона, вследствие чего связывает и ингибирует этот плейотропный цитокин у широкого круга видов [Alcamı A. and Smith G. L. Vaccinia, cowpox, and camelpox viruses encode soluble gamma interferon receptors with novel broad species specificity. // J. Virol. – 1995. – V. 69. – P. 4633-4639].
В различных исследованиях было установлено, что удаление гена B8R приводит к аттенуации вируса на мышиной модели без сопутствующего уменьшения в иммуногенности [Verardi P. H., Jones L. A., Aziz F. H., Ahmad S. and Yilma T. D. Vaccinia virus vectors with an inactivated gamma interferon receptor homolog gene (B8R) are attenuated in vivo without a concomitant reduction in immunogenicity. // Journal of Virology. – 2001. – V. 75. – P. 11-18], вызывая меньшую заболеваемость даже при высоких дозах [Denes B., Gridley D. S., Fodor N., Takatsy Z., Timiryasova T. M., Fodor I. Attenuation of a vaccine strain of vaccinia virus via inactivation of interferon viroceptor. // J. Gene Med. – 2006. – V. 8. – P. 814-823]. В экспериментах с внутрикожным инфицированием кроликов, ВОВ, лишенный гена γ-интерферон-связывающего белка, вызывал поражения с гистологическими различиями по сравнению с вирусом дикого типа (меньше по размеру и тенденция к более быстрому исчезновению) [Symons J. A., Tscharke D. C., Price N. and Smith G. L. A study of the vaccinia virus interferon-γ receptor and its contribution to virus virulence. // Journal of General Virology. – 2002. – V. 83. – P. 1953–1964; Huang W., Liu Y., Duan D. L., Li H. S., Liu Y., Hong K. X., et al. The construction of attenuated Tiantan recombinant vaccinia virus vector with IFN-gamma receptor gene deletion. // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. – 2004. – V. 18. – P 43-46].
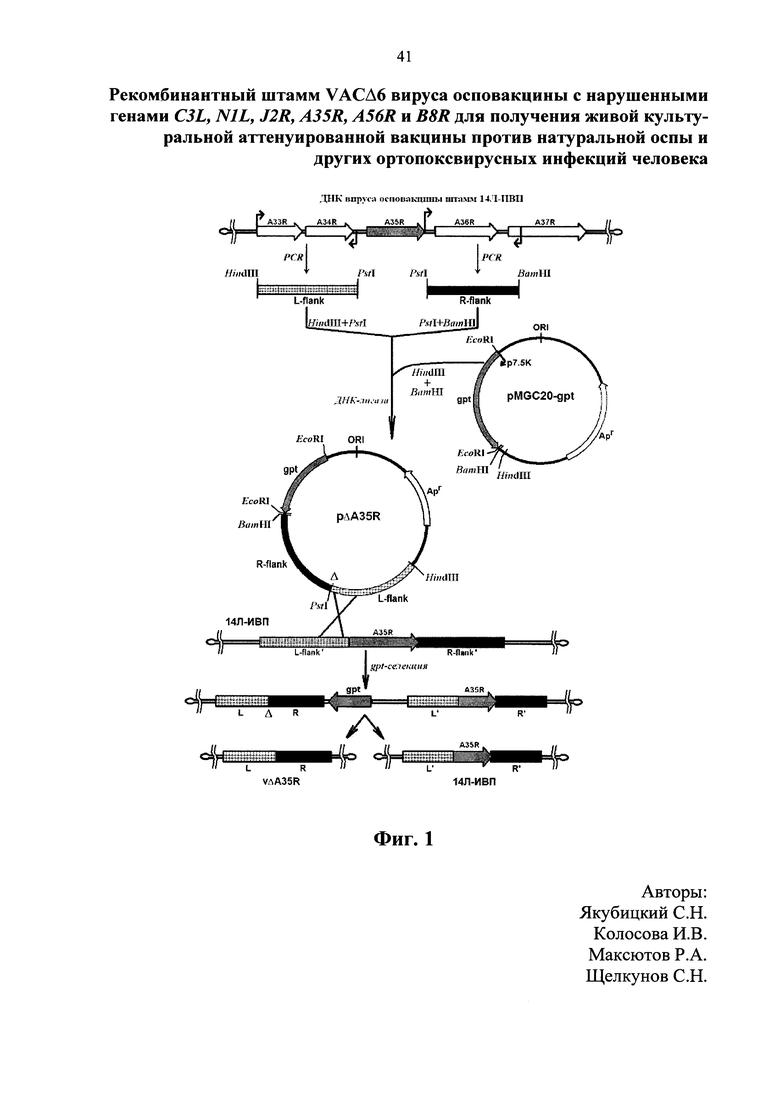
Изобретение поясняется следующими графическими материалами. На фигуре 1 показана общая схема конструирования плазмид интеграции и получения рекомбинантных вариантов вируса осповакцины с делецией генов (на примере гена A35R). На фиг. 2 приведены данные ПЦР (полимеразная цепная реакция) анализа клона рекомбинантного ВОВ с делецией шести генов вирулентности – VACΔ6 в сравнении с полученным ранее 1421ABJCN и исходным 14Л-ИВП, а именно электрофореграмма фрагментов ДНК, полученных в результате ПЦР с праймерами: A – на ген A56R, B – на ген B8R, C – на ген C3L, N – на ген N1L, J – на ген J2R, A' – на ген A35R, М – 1 kb ДНК-маркер.
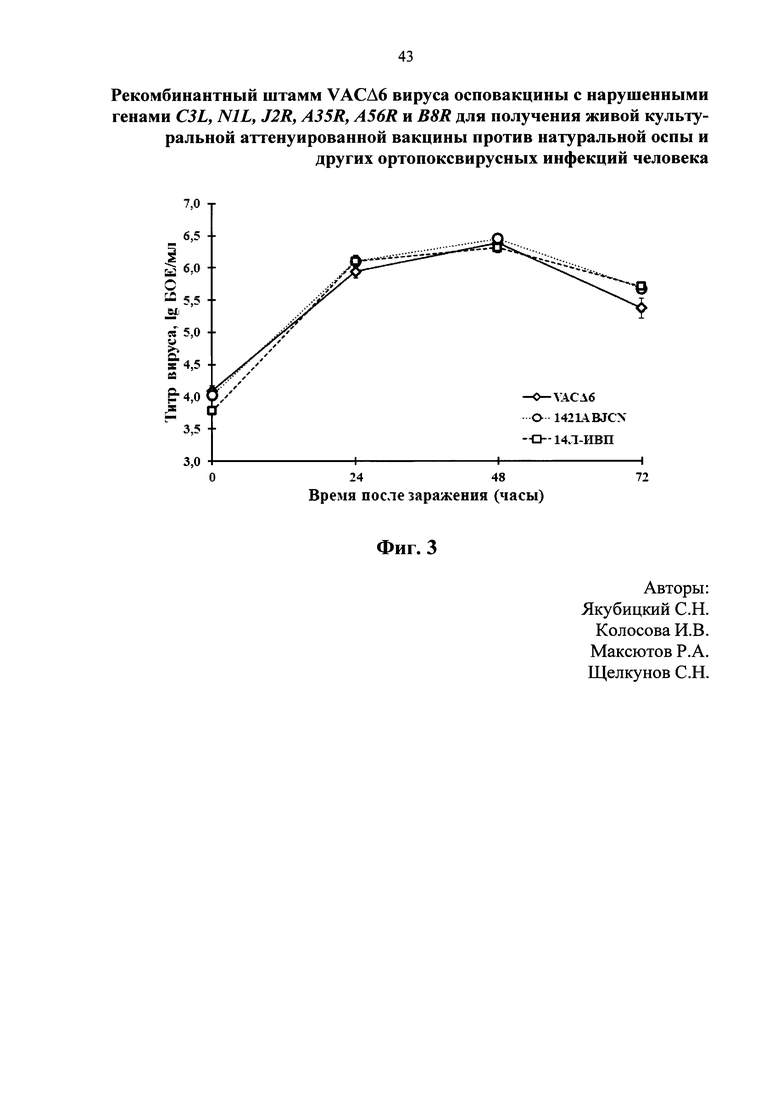
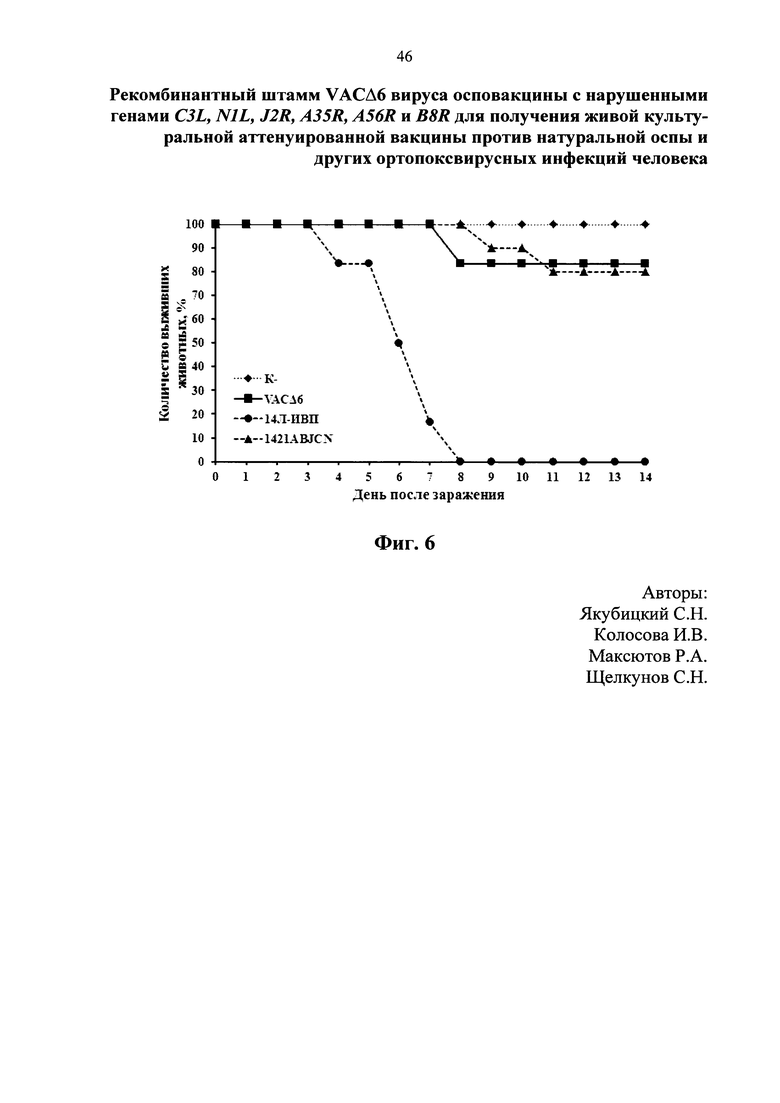
На фиг. 3 представлен сравнительный анализ динамики роста штаммов ВОВ (1421ABJCN и VACΔ6 в сравнении с исходным 14Л-ИВП) на культуре клеток CV-1. На фиг. 4 изображен график динамики гибели мышей, дважды иммунизированных штаммами VACΔ6, 1421ABJCN и 14Л-ИВП ВОВ в количестве 107 бляшкообразующих единиц (БОЕ)/мышь, после заражения их вирусом эктромелии (ВЭ) в дозе 100 ЛД50. На фиг. 5 представлены уровни вируснейтрализующих антител, определяемые методом нейтрализации ВОВ на культуре клеток 4647. Антитела получены после двойной подкожной иммунизации мышей линии BALB/c штаммами VACΔ6 и 1421ABJCN наряду с родительским штаммом 14Л-ИВП ВОВ в дозе 107 БОЕ/животное. Представлены данные в виде среднегеометрических значений, рассчитанных как –lg от наибольшего разведения сыворотки, при котором достигается 50 % нейтрализация ВОВ, ± стандартное отклонение. На фиг. 6 показана динамика гибели мышей-сосунков после интрацеребрального введения штаммов 1421ABJCN и VACΔ6 в сравнении с исходным 14Л-ИВП ВОВ в дозе 102 БОЕ/мышь. На фиг. 7 изображена гистограмма среднеарифметических значений титров вакцинных штаммов VACΔ6, 1421ABJCN и 14Л-ИВП в виде lg БОЕ/г органа ± стандартное отклонение, определенных методом бляшек в гомогенате головного мозга инфицированных новорожденных мышей после интрацеребрального заражения.
Для получения технического результата используют методику временной доминантной селекции [Falkner F.G., Moss B. Transient dominant selection of recombinant vaccinia viruses. // Journal of Virology. – 1990. – V. 64. – P. 3108-3111]. Для реализации этой методики создается рекомбинантная плазмида, которая несет как доминантный селективный маркер (ген gpt E.coli под контролем 7.5К-промотора ВОВ), расположенный вне протяженных областей гомологии с ДНК вируса, так и последовательности генома ВОВ, фланкирующие делетируемый ген. Бактериальный фермент ксантин-гуанин-фосфорибозилтрансфераза, синтезируемый в клетках млекопитающих, способен восстанавливать синтез гуанозинмонофосфата, блокируемый микофеноловой кислотой (МФК). В результате единичного кроссинговера плазмиды интеграции и вирусной ДНК образуется рекомбинантный вирусный геном, содержащий как ген gpt, так и последовательности, представляющие собой фрагмент вирусного генома с целевой делецией гена и этот же фрагмент без делеции. Такая генетическая конструкция нестабильна и может существовать лишь под селективным давлением. При снятии селективных условий происходит внутримолекулярная рекомбинация по областям гомологии, в результате которой образуется два варианта вируса – с делецией и без нее, причем выщепляется вся плазмидная часть (фиг. 1). Следует отметить, что в результате внутримолекулярной рекомбинации, удаляются из генома вируса все чужеродные последовательности, что очень важно при создании направленно аттенуированного ВОВ.
Конструирование плазмид.
Для получения плазмид интеграции на основе плазмиды pMGC20-gpt была использована ранее разработанная схема (фиг. 1). Выполнение этой технической задачи обеспечивалось применением метода ПЦР, ферментативного гидролиза, последующей лигазной сшивки и трансформации клеток E.coli штамм XL2-blue [Sambrook J., Fritsch E. F., Maniatis T. Molecular cloning: A laboratory manual. 2nd ed. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press. – 1989. – 1626 pp.]. В итоге были получены шесть плазмид интеграции – pΔC3L, pΔN1L, pΔJ2R, pΔA35R, pΔA56R и pΔB8R, предназначенных для нарушения выбранных генов ВОВ. Сконструированные плазмиды были использованы на следующем этапе работы для решения технической задачи – получения вариантов ВОВ с направленно нарушенными генами молекулярных факторов вирулентности вируса.
Конструирование мутантного варианта ВОВ.
В работе был использован ранее полученный штамм 1421ABJCN ВОВ с последовательно нарушенными пятью генами (C3L, N1L, J2R, A56R и B8R), что было достигнуто использованием плазмид интеграции pΔC3L, pΔN1L, pΔJ2R, pΔA56R и pΔB8R и применением методики временной доминантной селекции [Якубицкий С. Н., Колосова И. В., Максютов Р. А., Щелкунов С. Н. Аттенуация вируса осповакцины. // Acta Naturae. – 2015. – № 27. – С. 125-134].
Для получения варианта ВОВ с делецией дополнительного, шестого гена A35R также была использована методика временной доминантной селекции. Для этого была проведена серия экспериментов по трансфекции зараженных ВОВ штамм 1421ABJCN клеток CV-1 плазмидой интеграции pΔA35R. После четырех пассажей в условиях селекции, вирус был клонирован под агарозным покрытием методом бляшек. Далее выделенные клоны предполагаемых делеционных мутантов были подращены в неселективных условиях и реклонированы. После проведенных процедур была выделена ДНК реклонов и проводен их анализ методом ПЦР с использованием внутренних праймеров. Были выявлены реклоны, полученные фрагменты которых показали соответствие длин теоретически расчетным. По результатам ПЦР-анализа были отобраны стабильно реплицирующиеся реклоны, наработаны, расфасованы на отдельные аликвоты, оттитрованы методом бляшек, заморожены и использованы для дальнейшей работы.
Таким образом, был получен аттенуированный вирус осповакцины штамм Л-ИВП с шестью нарушенными генами вирулентности: делеции генов В8R, С3L, A35R, A56R, N1L и встройка в ген J2R – VACΔ6 (ПЦР-анализ на фиг. 2). Штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» регистрационный номер V-696 от 26.10.2015 г.
Морфологические признаки заявляемого штамма.
Подлинность была подтверждена в соответствии с требованиями Европейской фармакопеи 7.0 (с. 1152) методами ПЦР и титрованием на культуре клеток 4647 (перевиваемая линия культуры клеток; посевной и рабочий банки клеток этой линии на уровне 108-го и 128-го пассажей рекомендованы для производства вакцины против натуральной оспы [Скарнович М. О., Радаева И. Ф., Вдовиченко Г. В., Нечаева Е. А., Сергеев А. А., Петрищенко В. А., и др. Культура клеток 4647 для производства рекомбинантной бивакцины против натуральной оспы и гепатита В. // Вопросы вирусологии. – 2007. – № 2. – С. 37-40]). Было определено, что при титровании в монослое культуры клеток 4647 вакцинный штамм ВОВ VACΔ6 продуцирует однотипные бляшки диаметром от 0.5 до 1.0 мм. Длины фрагментов, полученные в результате ПЦР анализа вакцинного штамма ВОВ, соответствуют расчетным данным, приведенным в таблице 1 и на фиг. 2.
Таблица 1
Длины ПЦР-продуктов для исходного и рекомбинантного вариантов ВОВ
При исследовании свойств полученного штамма были изучены его основные свойства: подлинность, стерильность, безвредность, иммуногенная активность, специфическая безопасность, нейровирулентность, остаточная вирулентность. Установлено, что при титровании в монослое культуры клеток 4647 концентрация (титр) вируса составляет не менее 107 БОЕ/мл.
Результаты испытаний репликативных свойств варианта VACΔ6 в сравнении с 1421ABJCN и исходным 14Л-ИВП ВОВ в культуре клеток 4647 показали, что кривые развития вирусов достоверно не различаются (фиг. 3). Это указывает на то, что нарушение выбранных генов С3L, N1L, J2R, A35R, A56R, и В8R не влияет на репродуктивные функции вируса в изученной культуре клеток, что важно с точки зрения технологии наработки вакцины на клеточных культурах.
Штамм стерилен и безвреден при подкожном введении для морских свинок и при внутрибрюшинном заражении для белых мышей.
Был показан 100 % защитный эффект всех трех вариантов ВОВ (VACΔ6, 1421ABJCN и 14Л-ИВП ВОВ) после двукратной иммунизации мышей линии BALB/c в дозе 107 БОЕ/мышь против высоковирулентного для мышей ВЭ в дозе 10 ЛД50/мышь. С целью выявления различий между исследуемыми штаммами ВОВ в дальнейшем была выбрана принципиально большая разрешающая доза ВЭ в размере 100 ЛД50/мышь. В итоге, для вакцинирующей дозы 107 БОЕ/мышь, после двукратной подкожной иммунизации, VACΔ6 ВОВ продемонстрировал 100 % защитный эффект, тогда как для исходных штаммов 1421ABJCN и 14Л-ИВП этот показатель был снижен и составил на конец эксперимента (14 день) только 50 % и 67 % иммунизированных животных соответственно (фиг. 4). В дальнейшем при исследовании протективности в качестве разрешающего агента могут быть использованы либо штамм WR ВОВ, либо более гомологичный для ВОВ ВОК.
Также были определены титры вируснейтрализующих антител в сыворотках крови мышей, полученных после двойной иммунизации животных штаммами VACΔ6 и 1421ABJCN в сравнении с исходным 14Л-ИВП ВОВ в дозе 107 БОЕ/мышь. Для иммунизации был использован способ, которым препарат предлагается вводить человеку, т.е. подкожный. В результате проведенных экспериментов было установлено, что подкожная иммунизация мышей линии BALB/c всеми вирусными препаратами вызывает наработку вируснейтрализующих антител. При этом достоверно (p<0.01) наибольшие титры наблюдались для группы, иммунизированной штаммом VACΔ6, тогда как для групп животных, инфицированных исходными варианты 1421ABJCN и 14Л-ИВП ВОВ, уровни титров ВОВ-нейтрализующих антител были ниже и достоверно не различались (фиг. 5).
Кроме этого были проведены лабораторные эксперименты по изучению остаточной вирулентности вакцинного штамма VACΔ6 в сравнении с 1421ABJCN и 14Л-ИВП ВОВ. Для этого мышам линии BALB/c с массой тела 14-16 г вводили препараты вакцинных штаммов подкожно или внутрибрюшинно в дозе 107 БОЕ/мышь, что соответствует иммунизирующей дозе вакцины. Животные контрольной группы получали инъекцию физиологического раствора. В дальнейшем, на различные сутки после заражения осуществляли забор тканей мозга, легких, печени, селезенки и крови для определения титра вируса в приготовленных из них 10 % тканевых гомогенатах, проводя три последовательных пассажа на культуре клеток 4647. В результате было установлено, что при подкожной и внутрибрюшинной иммунизации мышей на 3, 7 и 14-е сутки после инъекции все исследуемые вирусы не размножаются, не распространяются и не задерживаются в организме животных в исследуемых органах.
Было показано снижение нейровирулентности у вариантов VACΔ6 и 1421ABJCN по сравнению с исходным штаммом 14Л-ИВП ВОВ, которую изучали после интрацеребрального заражения новорожденных мышах исследуемыми штаммами ВОВ в дозе 102 БОЕ/мышь. В группе, инфицированной 14Л-ИВП ВОВ, гибель животных началась с 4-х суток, а смертность уже на 8-й день эксперимента составила 100 %. В группах мышей, которым вводили штаммы VACΔ6 и 1421ABJCN ВОВ, гибель животных за время эксперимента (14 дней) достоверно не различалась, не превышая 20 % (фиг. 6).
Полученные результаты подтверждаются уровнями вирусной нагрузки, выявленными после титрования на культуре клеток 4647 10 % тканевых гомогенатов тканей головного мозга, изъятых на 3 сутки после интрацеребрального инфицирования мышей-сосунков исследуемыми вирусами в дозе 102 БОЕ/мышь. Для вариантов VACΔ6 и 1421ABJCN получены сравнимые индексы нейровирулентности, а для родительского штамма 14Л-ИВП ВОВ показаны более высокие титры вирусного материала (фиг. 7).
Также была выявлена более низкая реактогенность штамма VACΔ6 наряду с вариантом 1421ABJCN по сравнению с исходным 14Л-ИВП ВОВ, которую оценивали по воспалительно-некротическим проявлениям на эпилированной коже кроликов после внутрикожного введения вирусных препаратов в дозе 102-107 БОЕ/0.05 мл/инъекцию. Штаммы VACΔ6 и 1421ABJCN вызывали воспалительную реакцию, лишь начиная с дозы 105 БОЕ/инъекцию, в то время как родительский вариант 14Л-ИВП ВОВ – с наименьшей использованной дозы 102 БОЕ/инъекцию (табл. 2). Воспалительно-некротические проявления от VACΔ6, как и от 1421ABJCN, были менее выражены по сравнению с 14Л-ИВП ВОВ. При этом не наблюдали различий по воспалительно-некротическим показателям между двумя исследуемыми штаммами VACΔ6 и 1421ABJCN ВОВ.
Таблица 2.
Сравнение воспалительно-некротических показателей штаммов ВОВ при внутрикожном инфицировании кроликов
Примечание: В – воспаление, Н – некроз
Таким образом, в экспериментах на животных по сравнительному изучению безвредности было установлено, что штамм VACΔ6 не отличается от 1421ABJCN, то есть не имеет остаточной вирулентности, а также характеризуется сниженной нейровирулентностью и реактогенностью по сравнению с исходным штаммом 14Л-ИВП ВОВ. При этом, в системе in vitro вариант VACΔ6 нарабатывался с той же эффективностью, что и родительский штамм 14Л-ИВП.
Кроме этого, в экспериментах по сравнительному изучению специфической активности вирусов было установлено, что вариант VACΔ6 индуцирует наработку достоверно более высоких титров ВОВ-нейтрализующих антител, чем прототипы: вакцинный штамм 14Л-ИВП и рекомбинантный вариант 1421ABJCN ВОВ. А также рекомбинантный вариант VACΔ6 ВОВ обеспечивает полную защиту животных против летальной дозы 100 ЛД50/мышь высокопатогенного для них ВЭ в отличие от исходных штаммов 1421ABJCN и 14Л-ИВП.
Условия хранения штамма:
– хранение при температуре от -70°С до -18°С.
Штаммы бактерий и вирусов, культуры клеток, животные, используемые для получения заявляемого штамма VACΔ6 ВОВ.
В работе были использованы клоновый вариант штамма Л-ИВП ВОВ (рег. № V-401 из коллекции ФБУН ГНЦ ВБ «Вектор») – 14Л-ИВП, полученный на его основе аттенуированный вариант 1421ABJCN с пятью нарушенными генами вирулентности (A56R, B8R, J2R, N1L, C3L) (рег. № V-653 в коллекции ФБУН ГНЦ ВБ «Вектор») и штамм VACΔ6 с делецией дополнительного, шестого гена вирулентности A35R на базе варианта 1421ABJCN (штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» рег. № V-696 от 26.10.2015 г.). В экспериментах по изучению протективных свойств штаммов ВОВ также был использован штамм К-1 ВЭ из коллекции ФБУН ГНЦ ВБ «Вектор».
В опытах по конструированию плазмиды интеграции pΔA35R был использован штамм XL2-blue E.coli {recA1 endA1 gyrA96 thi-1 hsdR17(rK-,mK+) supE44 relA1 lac[F’ proAB lacqZSYMBOL 68 \f "Symbol" \s 12DM15 Tn10(Tetr) Amy Camr]c,d} из коллекции ГНЦ ВБ «Вектор».
Для получения рекомбинантного варианта штамма VACΔ6 ВОВ была использована перевиваемая культура клеток почки зеленой мартышки CV-1. Для наработки штаммов ВОВ и ВЭ, построения кривых роста штаммов ВОВ, а также определения титров вирусов и уровней вируснейтрализующих антител была использована культура клеток 4647 – перевиваемая линия клеток почки африканской зеленой мартышки. Культура клеток 4647 аттестована ГИСК им. Л. А. Тарасевича в соответствии с требованиями РД 42-28-10-89 и рекомендована для производства профилактических медицинских иммунобиологических препаратов (МИБП) (протокол № 14 от 28.10.03 г. заседания Ученого Совета ГИСК им. Л. А. Тарасевича; протокол № 9 от 20.11.03 г. Комитета МИБП), в том числе, и для производства вакцины против натуральной оспы [Скарнович М. О., Радаева И. Ф., Вдовиченко Г. В., Нечаева Е. А., Сергеев А. А., Петрищенко В. А., и др. Культура клеток 4647 для производства рекомбинантной бивакцины против натуральной оспы и гепатита В. // Вопросы вирусологии. – 2007. – № 2. – С. 37-40]. Обе клеточные культуры были получены из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». Клеточные культуры культивировали на питательной среде ДМЕМ с добавлением 10 % эмбриональной сыворотки коров в присутствии 5 % СО2 при 37°С.
В зависимости от задач эксперимента для изучения различных биологических свойств VACΔ6 ВОВ в работе были использованы лабораторные животные из питомника ФБУН ГНЦ ВБ «Вектор»: мыши линии Balb/c, самки весом 20-22 г (возраст 10-12 недель) или весом 14-16 г (возраст 4-5 недель), а также 1-2 суточные сосунки этой же линии весом 5-6 г; кролики породы Шиншилла весом 1.5-2.0 кг. Все эксперименты с животными осуществляли с соблюдением «Правил проведения работ с использованием экспериментальных животных».
Нуклеотидная последовательность ДНК ВОВ штамм Л-ИВП была получена из базы данных с идентификационным номером DQ121394 (http://www.poxvirus.org).
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Получение плазмид интеграции. Методом ПЦР были получены по два фрагмента генома ВОВ, фланкирующие каждый нарушаемый ген слева (L-flank) и справа (R-flank). Олигонуклеотидные праймеры для ПЦР были рассчитаны таким образом, чтобы делеция целевого гена не приводила к нарушению прилегающих к нему генов. Расчет праймеров для ПЦР и подбор условий реакции был выполнен с помощью программы «Vector NTI Suite 7» фирмы InforMax, США. Праймеры были синтезированы на автоматическом синтезаторе ABI-394 (Applied Biosystems, США) в Институте химической биологии и фундаментальной медицины СО РАН (Новосибирск):
Для делеции гена C3L:
L-flank:
5'-TAGTTTATCGAGATCTGATCTG 3'-(BglII),
5'-GGGGGGGTGACCAAAATTATACAATGGTTTATGTC-3' (BstEII);
R-flank:
5'-GGGGGGGTCACCATTTATTTATCCGTAAAAATGTT-3' (BstEII),
5'-GGGGAAGCTTATATAATGCGTCGATGTCAG-3' (HindIII).
Для делеции гена N1L:
L-flank:
5'-GGGTTGGATCCTTTACACATAGATCTACTACAGGCGGAACA-3' (BamHI),
5'-CCGAAGGTGACCTCTTTAGGATGATTGAAACATATTTTGATGA-3' (BstEII);
R-flank:
5'-GCCAAGGTCACCGATCGTTGTCATTTCTCCAAAGAATATATCTA-3' (BstEII),
5'-GGGAAAGCTTAATTTGTGAAGATGCCATGTACTACGCT-3' (HindIII).
Для делеции гена J2R:
L-flank:
5'-GAGCTCATGGATCACAACCAGTATCTCT-3' (SacI),
5'-AGATCTGGATCCAACAATGTCTGGAAAGAACTGT-3' (BglII);
R-flank:
5'-AGATCTGTCGACGAATTCTGTGAGCGTATGGC-3' (BglII),
5'-AAGCTTTGGATCTTACATCAGAAATTAAAA-3' (HindIII).
Для делеции гена A35R:
L-flank:
5'-GGGGAAGCTTTCATGATGACACCAGAAAACGACGAA-3' (HindIII),
5'-GCAACTGCAGATGGCGGCGTACGTTAACGACTTATT-3' (PstI);
R-flank:
5'-GGGGCTGCAGATCATAAAAGTTGTAAAGTAAATAATAAAA-3' (PstI),
5'-GGCAAAGGATCCTCAGATATAATTTTTTGATGTTCTGT-3' (BamHI).
Для делеции гена A56R:
L-flank:
5'-GGGAAAGCTTATAAAAAATGAGGATTTCGCCCCA-3' (HindIII),
5'-CCGAAGGTGACCTTAGATGTCTGAGGAAAAGGTGTAGCGT-3' (BstEII);
R-flank:
5'-GCCAAGGTCACCGTTCACGTAAATACAAAACAGAGAACAA-3'(BstEII),
5'-GGGAAGGATCCAAATGGAACATGTTCGCCATTAGACA-3' (BamHI).
Для делеции гена B8R:
L-flank:
5'-CCCAGATCTTGCTACCGTGAATATAAATCCGTT-3' (BglII),
5'-CCCCCGGTGACCATCTCATGGTGTTGTTTGTTATTTGACT-3' (BstEII);
R-flank:
5'-CCCCCGGTCACCTGATACAAAAACGAAATAAAACTGCATA-3' (BstEII),
5'-CCCCAAGCTTCGAACTAGTGAAATTTTTTCTGACCTTA-3' (HindIII).
Участки узнавания эндонуклеаз рестрикции, названия которых указаны в скобках справа, подчеркнуты.
Были клонированы одновременно обе фланкирующие области каждого гена в векторную плазмиду pMGC20-gpt, несущую ген устойчивости к ампициллину для селекции в прокариотической системе. Для этого ПЦР-фрагменты и векторная плазмида были обработаны необходимыми ферментами рестрикции, указанными выше, в соответствии с рекомендациями производителя ферментов (СибЭнзим, Россия). Далее фрагменты ДНК и плазмида были выделены и очищены из 1 % агарозного геля (Медиген, Россия) с помощью набора Gel Extraction Kit (QIAGEN, Германия) в соответствии с инструкцией фирмы-производителя. Затем было проведено лигирование двух фрагментов вирусной ДНК и векторной плазмиды, взятых в соотношении 5:5:1 соответственно, следуя рекомендациям производителя фермента ДНК-лигазы фага Т4 (СибЭнзим, Россия). Полученные лигазные смеси были использованы для химической трансформации компетентных клеток E.coli штамм XL2-blue [Методы генетической инженерии. Молекулярное клонирование: Пер. с англ. / Маниатис Т., Фритч Э., Сэмбрук Дж. – М.: Мир. – 1984. – 480 с]. Затем была наработана биомасса из выросших индивидуальных колоний в присутствии ампициллина. Плазмидная ДНК из клеточных биомасс была выделена методом щелочного лизиса [Lee S. Y., Rasheed S. A simple procedure for maximum yield of high-quality plasmid DNA. // Biotechniques. – 1990. – V. 9. – P. 676-679] и очищена с помощью набора PCR Purification Kit (QIAGEN, Германия). Образцы негидролизованной плазмидной ДНК были проанализированы в 1 % агарозном геле на трис-ацетатном буфере. По результатам анализа были отобраны нужные варианты и дополнительно проанализированы гидролизом соответствующими эндонуклеазами рестрикции, а также ПЦР-анализом, используя «внешние» праймеры для каждого гена, например для A35R-гена:
5'-GGGGAAGCTTTCATGATGACACCAGAAAACGACGAA-3',
5'-GGCAAAGGATCCTCAGATATAATTTTTTGATGTTCTGT-3'.
Пример 2. Получение рекомбинантных вариантов ВОВ.
Рекомбинантный ВОВ был получен на культуре клеток CV-1 с помощью катионоактивной липид-опосредованной трансфекции, используя Lipofectin Reagent (Invitrogen, США) и селективную среду, содержащую МФК, ксантин и гипоксантин (Sigma, США). Для этого суточный монослой клеток CV-1 был заражен ВОВ штамм 1421ABJCN с множественностью заражения 0.1 БОЕ/клетку с последующей инкубацией в течение 1.5 ч при 37°C. Затем монослой клеток был отмыт средой без сыворотки, и была добавлена смесь из 2 мкг рекомбинантной плазмиды pΔA35R с 20 мкг трансфецирующего агента в среде ДМЕМ (БиолоТ, Россия), содержащей 25 мкг/мл МФК, 250 мкг/мл ксантина и 15 мкг/мл гипоксантина, с последующей инкубацией при 37°C и 5 % CO2. Через 24 ч среда была заменена на селективную поддерживающую (с 2 % эмбриональной сыворотки коров (ЭСК) (HyClone, США)), которая содержала МФК, ксантин и гипоксантин, и инкубация продолжалась при тех же условиях еще сутки. После четырех-пяти пассажей в условиях селекции (до получения цитопатичекского действия (ЦПД)) вирус был клонирован.
Перед клонированием вирусная суспензия была обработана ультразвуком и оттитрована на культуре клеток CV-1. Клонирование вируса было проведено методом бляшек под агарозным покрытием. Для этого монослой клеток CV-1 был заражен вирусом в разведении 10-20 БОЕ/лунку с последующей адсорбцией в течение 1 ч при 37°С. Затем несорбированный вирус был удален, а на монослой добавлена смесь из среды ДМЕМ с 2 % ЭСК и 1 % легкоплавкой агарозы (Sigma, США). После застывания агарозы монослой клеток инкубировали в термостате при 37°С и 5 % CO2 в течение 48 ч. Далее в лунку был добавлен водный раствор нейтрального красного, разведенный в среде ДMEM, содержащей 1 % легкоплавкую агарозу, с последующей инкубацией в течение 5 ч при 37°С. После этого индивидуальные бляшки были осторожно перенесены на монослой клеток CV-1. В последующем эти клоны были подращены в неселективных условиях и реклонированы как указано выше. По результатам ПЦР-анализа были отобраны стабильно реплицирующиеся реклоны, наработаны, расфасованы на отдельные аликвоты, оттитрованы методом бляшек, заморожены для использования в дальнейшей работе.
Пример 3. Выделение вирусной ДНК.
Для выделения вирусной ДНК монослой клеток CV-1 был заражен вирусными клонами с множественностью 0.1 БОЕ/клетку с последующей инкубацией под средой ДМЕМ с 2 % ЭСК, в течение 48 ч при 37°C и 5 % CO2. При достижении 90 % ЦПД вирус был высвобожден из клеток путем двукратной заморозки-оттаивания. Далее вирусная ДНК была выделена с помощью набора QIAamp DNA Mini Kit (QIAGEN, Германия) в соответствии с рекомендациями производителя.
Пример 4. ПЦР анализ ДНК мутантных штаммов ВОВ.
Клоны были проанализированы методом ПЦР на наличие нарушений в их ДНК генов с использованием соответствующих пар праймеров, которые были синтезированы на автоматическом синтезаторе ABI-394 (Applied Biosystems, США) в Институте химической биологии и фундаментальной медицины СО РАН (Новосибирск):
Для делеции гена C3L:
5'-TCGCGCTTTACATTCTCGAATCT-3',
5'-TGTTCGTGTGTTCTTGCGGTGA-3';
Для делеции гена N1L:
5'-GGGTTGGATCCTTTACACATAGATCTACTACAGGCGGAACA-3',
5'-GGGAAAGCTTAATTTGTGAAGATGCCATGTACTACGCT-3';
Для встройки в ген J2R:
5'-ATATGTTCTTCATGCCTAAACGA-3',
5'-ATGAAGGAGCAAAAGGTTGTAAC-3';
Для делеции гена A35R:
5'-ACGACGGATGCTGAAGCGTGTTATA-3',
5'-AAACGATGTTACCAATCGTTTGCTAGGT-3';
Для делеции гена A56R:
5'-GTGGTATGGGACACCACAAATCCAA-3',
5'-ATTAAACATTCCTAGAATTAATCCCGCTC-3';
Для делеции гена В8R:
5'-TCACAAATATGATGGTGATGAGCGA-3',
5'-CGTGATATACCCTAGCCATAGGCAT-3'.
ПЦР была проведена в тонкостенных микропробирках типа «Eppendorf» в амплификаторе «GeneAmp PCR System 9700» (Applied Biosystems, США). Реактивы для реакции производства фирмы «СибЭнзим» (Россия). Смесь компонентов тест-системы из расчета на одну пробу:
- SE-буфер для Taq ДНК-полимеразы (pH 8.5 при 25°С: 60 мM Tris-HCl, 25 мM KCl, 1.5 мM MgCl2, 10 мM 2-меркаптоэтанол, 0.1 % Тритон Х-100);
- смесь трифосфатов (по 0.2 мМ каждого dNTP);
- по 0.7 мкМ прямого и обратного праймеров;
- 2.5 ед. Taq ДНК-полимеразы;
- около 2-10 нг ДНК-матрицы;
- вода стерильная деионизованная (H2Oди) до 25 мкл.
Затем пробирки были перенесены в амплификатор и проведена ПЦР по программе, включающей следующие этапы:
- предварительная денатурация ДНК при 94°C, 1 мин 30 с;
- 20 циклов, состоящих из:
1. денатурации ДНК при температуре 94°C, 20 с,
2. отжига праймеров при 60°C в течение 30 с,
3. синтеза комплементарной цепи при 72°С, 1 мин.
- после последнего цикла пробирки прогревали в течение 3 мин при 72°С.
Продукты амплификации хранили при температуре 4°C до проведения электрофоретического анализа.
Анализ фрагментов был проведен с помощью электрофореза в 1,5 % агарозном геле в трис-ацетатном буфере с бромистым этидием в концентрации 0.2 мкг/мл. Для контроля размера полученного амплифицированного фрагмента вносили ДНК-маркер 1 kb (СибЭнзим, Россия). Электрофорез был проведен при градиенте напряжения 10 В/см в течение 60 мин. Для фотографирования геля была использована система визуализации изображений Image Station 440CF (Kodak, США).
Пример 5. Титрование вируса.
Вирусная суспензия была предварительно дважды обработана с помощью ультразвукового дезинтегратора. Титрование вируса было проведено на 90-100 % суточном монослое культуры клеток 4647, используя разведения вируса 10-1-10-6 и сорбируя его в течение 1 ч при 37°С. Затем вирусная суспензия была отобрана и добавлена среды ДМЕМ с 2 % ЭСК. После инкубации в течение 72 ч при 37°С и 5 % CO2 поддерживающая среда была удалена, а монослой клеток был окрашен, используя 0.2 % краситель кристаллический фиолетовый, разведенный в смеси 10 % этанола и 2 % формальдегида. Подсчитывали число бляшек и рассчитывали титр вируса на мл.
Пример 6. Наработка и очистка вирусов:
- монослой культуры клеток 4647, выращенный на культуральных флаконах, инфицировали исследуемыми вариантами ВОВ, используя множественность 1.0 БОЕ/клетку и среду ДМЕМ с 2 % ЭСК;
- монослой инкубировали 48 ч при 37 0С до образования полного ЦПД и получали криолизат инфицированных клеток двумя циклами замораживания-оттаивания;
- криолизат дважды обрабатывали с помощью ультразвукового дезинтегратора и осаждали клеточный дебрис центрифугированием при 5000 об/мин и 4°С в течение 15 мин;
- надосадочную жидкость сохраняли, а осадок растворяли в среде ДМЕМ и дважды обрабатывали с помощью ультразвукового дезинтегратора, затем вновь осаждали клеточный дебрис центрифугированием при 5000 об/мин и 4°С в течение 15 мин – по этой схеме проводили еще два цикла;
- вирус осаждали из объединенного супернатанта центрифугированием при 14000 об/мин и 4°С в течение 120 мин;
- осадок ресуспендировали в физиологическом растворе, трижды обрабатывали с помощью ультразвукового дезинтегратора, расфасовывали и хранили при -70°C.
Титр всех образцов был определен методом бляшек в монослое клеток 4647. Было показано, что все выбранные варианты ВОВ нарабатываются с помощью описанной выше методики в достаточном для иммунизации животных количестве.
Пример 7. Определение динамики роста мутантных вариантов ВОВ.
Для изучения динамики развития исходного 14Л-ИВП ВОВ и мутантных вариантов 1421ABJCN и VACΔ6 был использован 90-100 % суточный монослой культуры клеток 4647, инфицированный вирусами с множественностью заражения 0.1 БОЕ/клетку, с последующей адсорбцией в течение 1 ч при 37°С. После сорбции несорбированные вирусные частицы были удалены, а инкубация была проведена под средой ДМЕМ с 2 % ЭСК при 37°С и 5 % CO2. Время после инфекции составляло 24, 48 и 72 ч. На каждом временном этапе методом бляшек, как описано выше, был определен титр вируса в культуральной суспензии после двукратной заморозки-оттаивания.
Пример 8. Оценка протективного иммунного ответа.
Для определения протективного иммунного ответа группы мышей линии BALB/c, самки весом 14-16 г, были инфицированы подкожно родительским штаммом 14Л-ИВП ВОВ и рекомбинантными вариантами 1421ABJCN и VACΔ6 в дозе 107 БОЕ/0.1 мл/мышь. Животным контрольной группы была введена инъекция физиологического раствора (БиолоТ, Россия) в том же объеме. Иммунизация была проведена дважды с интервалом в 28 день. Спустя 28 день после второй иммунизации животные были подвергнуты интраназальной инокуляции высокопатогенным для мышей ВЭ с целью заражения через дыхательные пути. Для этого животных вводили в состояние легкого наркоза с помощью диэтилового эфира (Кузбассоргхим, Россия). В этом состоянии мышам было введено по 15 мкл суспензии ВЭ в каждую ноздрю с помощью микропипетки, согласно методике [Martinez M. J., Bray M. P., Huggins J. W. A mouse model of aerosol-transmitted orthopoxviral disease: morphology of experimental aerosol-transmitted orthopoxviral disease in a cowpox virus-BALB/c mouse system. // Arch. Pathol. Lab. Med. – 2000. – V. 124. – P. 362-377]. Суммарный титр вируса, вводимого животному, составлял 10 или 100 ЛД50/0.02 мл/мышь. Наблюдение за мышами вели в течение 14 дней, регистрируя количество выживших и погибших животных.
Для определения ЛД50 ВЭ самки мышей линии BALB/c весом 20-22 г. были заражены интраназально, как описано выше, четырьмя десятикратными разведениями ВЭ в дозе 10-104 БОЕ/0.02 мл/мышь. Контрольной группе был введен равный объем физиологического раствора, на котором были приготовлены вирусные разведения. Наблюдение за животными вели в течение двух недель, учитывая количество выживших и погибших.
Пример 9. Измерение титра вируснейтрализующих антител.
Титры вируснейтрализующих антител были определены в сыворотках крови самок мышей линии BALB/c весом 14-16 г, зараженных подкожно мутантными вариантами 1421ABJCN и VACΔ6 в сравнении с исходным штаммом 14Л-ИВП ВОВ в дозе 107 БОЕ/0.1 мл/мышь. Контрольной группе был введен равный объем физиологического раствора. Иммунизация была проведена дважды с интервалом в 28 день. Спустя 28 день после второй иммунизации у животных, предварительно наркотизированных диметиловым эфиром, были взяты пробы крови из ретробульбарного венозного сплетения и проинкубированы при 4°С в течение 24 ч для формирования фибринового сгустка. Сыворотка была получена последующим центрифугированием в течение 10 мин при 5000 g. Препараты сывороток были подвергнуты инактивации при 56°С в течение 30 мин. Титр вируснейтрализующих антител был определен на 90-100 % монослое культуры клеток 4647 по общепринятой методике [Leparc-Goffart I., Poirier B., Garin D., Tissier M-H, Fuchs F., Crance J-M. Standartization of a neutralizing anti-vaccinia antibodies titration method: an essential step for titration of vaccinia immunoglobulins and smallpox vaccines evaluation. // Journal of Clinical Virology. – 2005.– V. 32. – P. 47-52], используя при этом разведения исследуемых сывороток 1:5, 1:25, 1:125. Эффективность нейтрализации была рассчитана относительно числа бляшек в лунках без сывороток (рабочим разведением вируса считали такое его разведение, которое при подсчете БОЕ давало от 40-60 бляшек/лунку).
Пример 10. Исследование остаточной вирулентности штаммов ВОВ.
Исследование остаточной вирулентности вакцинного штамма VACΔ6 в сравнении с 1421ABJCN и 14Л-ИВП ВОВ было проведено на самках мышей линии BALB/c с массой тела 14-16 г, которым были введены препараты ВОВ подкожно или внутрибрюшинно в дозе 107 БОЕ/0.1 мл/мышь. Животные контрольной группы были инъецированы физиологическим раствором в объеме 0.1 мл. Через 3, 7 и 14 суток после заражения у мышей, предварительно эвтанизированных методом цервикальной дислокации, были стерильно извлечены пробы крови и тканей мозга, легких, печени и селезенки, из которых затем были приготовлены 10 % тканевые гомогенаты на среде ДМЕМ по схеме, описанной в [Vijaysri S., Jentarra G., Heck M. C., Mercer A. A., McInnes C. J., Jacobs B. L. Vaccinia viruses with mutations in the E3L gene as potential replicationcompetent, attenuated vaccines: intra-nasal vaccination. // Vaccine. – 2008. – V. 26. – P. 664-676]. В приготовленных тканевых гомогенатах, а также в образцах, полученных после трех последовательных пассажей этих суспензий на культуре клеток 4647, были определены концентрации вирусов методом бляшек, описанным выше, используя монослой культуры клеток 4647.
Пример 11. Методы исследования нейровирулентности вариантов ВОВ.
Для изучения нейровирулентности исследуемых штаммов ВОВ были использованы 1-2 суточные мыши-сосунки линии BALB/c, интрацеребрально зараженные вирусами в дозе 102 БОЕ/0.01 мл/мышь. Животным из контрольной группы был введен равный объем физиологического раствора. Наблюдение за мышами вели в течение 14 дней, регистрируя количество выживших и погибших животных. Кроме этого, в каждой группе у части животных, предварительно эвтанизированных методом цервикальной дислокации, на 3 сут после заражения были стерильно извлечены пробы головного мозга. Из полученных проб были приготовлены 10 % тканевые суспензии на среде ДМЕМ по методике, описанной в [Vijaysri S., Jentarra G., Heck M. C., Mercer A. A., McInnes C. J., Jacobs B. L. Vaccinia viruses with mutations in the E3L gene as potential replicationcompetent, attenuated vaccines: intra-nasal vaccination. // Vaccine. – 2008. – V. 26. – P. 664-676], для дальнейшего определения в них титров вирусов методом бляшек в монослое культуры клеток 4647.
Пример 12. Сравнение реактогенности штаммов ВОВ.
Изучение реактогенности рекомбинантного варианта VACΔ6 в сравнении с исходными штаммами 1421ABJCN и 14Л-ИВП ВОВ было проведено на кроликах породы Шиншилла весом 1.5-2.0 кг, которым, которым предварительно эпилировали бока. Для выполнения эксперимента было сделано шесть десятикратных разведений штаммов ВОВ на физиологическом растворе до содержания 102-107 БОЕ/0.05 мл. Разведения были введены животным в указанном выше объеме внутрикожно, каждое разведение – двукратно. Наблюдение за животными проводили в течение 14 суток, регистрируя время появления и заживления воспалительно-некротических инфильтратов в зависимости от титра и исследуемого вирусного штамма.
Пример 13. Анализ данных.
Статистическая обработка экспериментальных данных была проведена с помощью программы Excel из пакета Microsoft Office 2010 (Microsoft Corp., США). C использованием t-критерия Стьюдента были оценены обнаруженные межгрупповые различия. Статистически значимыми результатами эксперимента считали значения при уровне значимости P<0.05 [Ашмарин И. П., Воробьев А. А. Статистические методы в микробиологических исследованиях. Л.: Гос. изд. мед. лит. – 1962. – 186 с.].
Расчет летальной дозы ВЭ, вызывающей гибель 50 % животных (ЛД50), был осуществлен по методу Кербера. Титры антител были рассчитаны как среднее геометрическое в предположении, что элементы выборки распределены по логнормальному закону, и определены как -lg от наибольшего разведения сыворотки, при котором достигается 50 % нейтрализация ВОВ, ± стандартное отклонение.
Таким образом, результаты приведенных выше исследований демонстрируют возможность улучшения специфической активности (в частности, иммуногенной и протективной активностей) ранее полученного нами рекомбинантного варианта 1421ABJCN ВОВ. А также возможность создания безопасной вакцины третьего поколения против натуральной оспы, предсказывая высокую вероятность защиты населения от возможных актов биотерроризма, связанных с применением вируса натуральной оспы, а также от вспышек заболеваний, обусловленных зоонозными ортопоксвирусами, используя кандидатную живую вакцину на основе заявляемого аттенуированного вируса осповакцины штамм Л-ИВП с шестью нарушенными генами вирулентности (VACΔ6).
В материалах заявки показано, что:
- штамм может быть использован в качестве живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека;
- штамм получен с помощью сконструированных авторами шести плазмид интеграции – pΔC3L, pΔN1L, pΔJ2R, pΔA35R, pΔA56R и pΔB8R, используя метод временной доминантной селекции;
- в исследованиях для сравнения использованы штаммы ВОВ:
1421ABJCN – ранее полученный авторами штамм-прототип ВОВ с пятью нарушенными генами вирулентности,
14Л-ИВП – клон исходного штамма Л-ИВП ВОВ, принятого в России для производства классической противооспенной вакцины первого поколения;
- проведено изучение репликативных свойств полученного варианта ВОВ в культуре клеток 4647 путем определения динамики роста вируса. Полученные результаты позволяют заключить, что нарушение выбранных генов C3L, N1L, J2R, A35R, A56R и B8R не влияет на продуктивные свойства ВОВ на данной культуре клеток, что важно с точки зрения технологии наработки высокоаттенуированной противооспенной вакцины нового поколения;
- в экспериментах на животных авторами было установлено, что:
препарат рекомбинантного штамма VACΔ6 индуцирует достоверно более высокие титры ВОВ-нейтрализующих антител по сравнению с исходным вариантом 1421ABJCN и с клоном вакцинного штамма Л-ИВП ВОВ;
мутантный вариант ВОВ VACΔ6 наравне с исходными штаммами 1421ABJCN и 14Л-ИВП обеспечивают полную защиту мышей против 10 ЛД50 высокопатогенного для них ВЭ. А при десятикратном увеличении количества ВЭ на животное (100 ЛД50), VACΔ6 демонстрирует 100 % защитный эффект по сравнению с 50 % для 1421ABJCN и 67 % для 14Л-ИВП ВОВ;
VACΔ6 ВОВ отсутствует в исследуемых органах инфицированных мышей на 3, 7 и 14 сут после как подкожной, так и внутрибрюшинной инъекций;
нейровирулентные и реактогенные свойства рекомбинантного штамма VACΔ6 ВОВ достоверно не отличаются от таковых исходного варианта 1421ABJCN, и ниже по сравнению с показателями клона вакцинного штамма Л-ИВП ВОВ.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНЫЙ ШТАММ Л-ИВП 1421ABJCN ВИРУСА ОСПОВАКЦИНЫ С НАРУШЕННЫМИ ГЕНАМИ ВИРУЛЕНТНОСТИ A56R, B8R, J2R, C3L, N1L ДЛЯ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ АТТЕНУИРОВАННОЙ ВАКЦИНЫ ПРОТИВ НАТУРАЛЬНОЙ ОСПЫ И ДРУГИХ ОРТОПОКСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2015 |
|
RU2588388C1 |
| Живая аттенуированная культуральная вакцина для профилактики натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины и способы ее получения и применения | 2022 |
|
RU2781070C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ VV-GMCSF-Lact ВИРУСА ОСПОВАКЦИНЫ, ОБЛАДАЮЩИЙ ОНКОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ И ПРОДУЦИРУЮЩИЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ЧЕЛОВЕКА И ОНКОТОКСИЧЕСКИЙ БЕЛОК ЛАКТАПТИН | 2015 |
|
RU2604187C1 |
| Рекомбинантный штамм VV-NS1-dGF вируса осповакцины, продуцирующий белок NS1 парвовируса H-1 и обладающий онколитической активностью в отношении глиобластомы человека | 2018 |
|
RU2692628C1 |
| Рекомбинантный штамм VV-GMCSF-S-Lact вируса осповакцины, обладающий онколитической активностью и продуцирующий гранулоцитарно-макрофагальный колониестимулирующий фактор человека и секретируемую форму онкотоксического белка лактаптина | 2016 |
|
RU2621861C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ VV-GMCSF-S1/3 ВИРУСА ОСПОВАКЦИНЫ, ПРОДУЦИРУЮЩИЙ СЕКРЕТИРУЕМЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ЧЕЛОВЕКА | 2013 |
|
RU2565544C2 |
| Рекомбинантный штамм VV-mNIS-NS1 вируса осповакцины, продуцирующий симпортер йодида натрия мышей mNIS и белок NS1 парвовируса крыс H-1 для тераностики злокачественных опухолей | 2023 |
|
RU2819082C1 |
| Рекомбинантный штамм VV-GMCSF/lact-dGF вируса осповакцины, обладающий онколитической активностью и продуцирующий секретируемый химерный белок, состоящий из гранулоцитарно-макрофагального колониестимулирующего фактора человека и онкотоксического белка лактаптина | 2016 |
|
RU2630672C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pGEM-Puro-DS-Apo, СОДЕРЖАЩАЯ СИНТЕТИЧЕСКИЙ ГЕН АПОПТИНА, ФЛАНКИРОВАННЫЙ ПОСЛЕДОВАТЕЛЬНОСТЯМИ ГЕНОМА ВИРУСА ОСПОВАКЦИНЫ ИЗ РАЙОНА C10L-C12L, И РЕКОМБИНАНТНЫЙ ШТАММ VVdGF-ApoS24/2 ВИРУСА ОСПОВАКЦИНЫ, ПРОДУЦИРУЮЩИЙ АПОПТИН | 2012 |
|
RU2492238C1 |
| ПОКСВИРУСНЫЕ ОНКОЛИТИЧЕСКИЕ ВЕКТОРЫ | 2008 |
|
RU2557312C2 |

Изобретение относится к биотехнологии. Предложен рекомбинантный штамм VACΔ6 вируса осповакцины с нарушенными генами C3L, N1L, J2R, A35R, A56R, B8R на основе клонированного вируса осповакцины (штамм Л-ИВП). Предложенный штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» с регистрационным № V-696 и предназначен для получения безлопастной живой культуральной аттенуированной вакцины против вируса натуральной оспы и других ортопоксвирусов, обладающей повышенной иммуногенной и протективной активностью. Предложенный рекомбинантный штамм может быть использован в медицине для получения вакцины против натуральной оспы и других ортопоксвирусных инфекций человека. 7 ил., 2 табл., 13 пр.
Рекомбинантный штамм VAC∆6 вируса осповакцины с нарушенными генами C3L, N1L, J2R, A35R, A56R и B8R, предназначенный для получения живой культуральной аттенуированной вакцины против вируса натуральной оспы и других ортопоксвирусных инфекций человека и депонированный в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» c регистрационным № V-696.
| ЯКУБИЦКИЙ С.Н | |||
| и др | |||
| Аттенуация вируса осповакцины | |||
| ACTA NATURAE, 2015, V.7, No.4 (27), Р.125-134 | |||
| REHM K.E | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Vaccine | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| US 20120308484 A1, 06.12.2012 | |||
| MORIKAWA Sh | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Journal of virology | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2017-06-07—Публикация
2016-06-24—Подача