Изобретение относится к медицине, а именно к молекулярной онкологии, и касается способа дифференцировки аденокарциномы G3 и перстневидноклеточного рака с помощью сравнительного определения копийности локусов GSTP1, NFKB1 и HV2 в опухолевой и условно здоровой ткани желудка.
Своевременность выявления рака желудка, занимающего пятое место в мире по распространенности среди онкологических заболеваний, играет существенную роль в формировании прогноза течения заболевания. Рак желудка, являясь гетерогенным заболеванием, классифицируется в зависимости от гистологических, анатомических, эпидемиологических и молекулярных особенностей. Разные молекулярные первопричины малигнизации и биология опухоли подразумевают разные молекулярные мишени и прогностические биомаркеры для каждого подтипа рака желудка. Тем не менее в литературе недостаточно данных о корреляции между клинико-морфологическими классификациями и молекулярно-генетическими изменениями, характерными для каждого подтипа.
Изменение числа копий гена является одним из основных механизмов контроля раковой клеткой генов, ключевых для выживания и малигнизации, так как результатом этого генетического полиморфизма может стать снижение или повышение экспрессии продукта гена - белка или не кодирующей РНК. Таким образом, изменение копийности генов может представлять инициаторную точку генетических изменений при малигнизации тканей и прогрессии злокачественных новообразований.
Ген GSTP1 кодирует глутатион-S-трансферазу пи, один из ферментов второй фазы системы детоксикации гидрофобных и электрофильных ксенобиотиков и канцерогенов, который осуществляет их превращение из активных метаболитов в нетоксичные водорастворимые компоненты и предотвращает, таким образом, повреждение ДНК. Клиническая роль этого фермента при раке до сих пор неясна, в литературе имеются данные о снижении его экспрессии при плоскоклеточном раке полости рта и данные об увеличении количества копий этого гена в клеточных линиях рака головы и шеи (см. Ma et al. Decreased expression of glutathione S-transferase pi correlates with poorly differentiated grade in patients with oral squamous cell carcinoma// J of Oral Pathology&Medicine. 2015. V. 44, p. 193-200). Кроме того, показано, что потеря экспрессии GSTP1 преимущественно отмечается в случае Эпштейн-Барр-ассоциированного рака желудка, причем эффект глушения осуществляется путем метилирования промотора гена GSTP1 (Kim J. et al. Silencing and CpG Island Methylation of GSTP1 is Rare in Ordinary Gastric Carcinomas but Common in Epstein-Barr Virus-associated Gastric Carcinomas // Anticancer Research 2005. V. 25. N. 6B. P. 4013-4019.
NFKB1 кодирует транскрипционный фактор NF-κBI (ядерный фактор «каппа-би») - универсальный фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла. В норме активность сигнального пути NF-κВ в клетке находится под строгим контролем, однако мутации различных генов могут стать причиной его конститутивной активации. Это имеет место при лимфомах и аденокарциномах различного происхождения, а также множественной миеломе (см. Staudt L.M. Oncogenic activation of NF-kappaB // Cold Sprin Harb Perspect Biol. 2010. B.6. N.2. C.a0001098. DOL10.1101/cshperspect.a000109 - PMID 20516126).
HV2 - локус D-петли митохондриальной ДНК (мтДНК) относится к регуляторным не кодирующим элементам и обладает высокой мутабельностью. Уровень мтДНК в лейкоцитах крови определяли во многих исследованиях различных видов рака, хотя вопрос о ценности показателя копийности мтДНК в лейкоцитах для диагностики и прогноза лечения опухолей желудка остается дискуссионным. Так, в широкомасштабном исследовании, включавшем группы пациентов с раком желудка на различных стадиях и условно здоровых доноров, не было обнаружено значимой ассоциации между числом копий мтДНК в лейкоцитах и риском развития рака желудка, но тем не менее была показана достоверная корреляция данного показателя и прогрессии заболевания (Liao L.M. et al. Mitochondrial DNA Copy Number and Risk of Gastric Cancer: a Report from the Shanghai Women's Health Study // Cancer Epidemiol Biomarkers Prev; 2011, 20(9); 1944-9). Результаты другого исследования продемонстрировали достоверную ассоциацию копийности мтДНК с риском малигнизации тканей желудка (Fernfndes J. et al. Circulating Mitochondrial DNA Level, a Noninvasive Biomarker for the Early Detection of Gastric Cancer // Cancer Epidemiol Biomarkers Prev; 2014. 23(11); 2430-8).
Изобретение «Способ дифференциальной диагностики рака желудка различных гистологических типов» является новым, так как не известна корреляция копийности генов GSTP1, NFKB1 и митохондриального локуса HV2 с классификацией опухоли при диагностике рака желудка.
Целью заявляемого изобретения является создание нового, простого в исполнении, недорогостоящего способа предварительной идентификации типов и стадии рака желудка.
Сущность заявляемого способа заключается в том, что осуществляют амплификацию фрагментов локусов GSTP1, NFKB1 и HV2 методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с помощью набора высокоспецифичных праймеров на матрице выделенной ДНК, проводят количественную интерпретацию результатов амплификации и расчет коэффициентов копийности генов по формуле K=rCcancer/rCnormal, где
K - коэффициент относительной копийности,
rCcancer - относительная копийность гена в опухолевой ткани,
rCnormal - относительная копийность гена в условно нормальной ткани, сравнивают полученные значения со стандартными коэффициентами копийности, при значении KGSTP1=0,85±0,11, KNFKB1=0,82±0,09 и KHV2=0,53±0,06 диагностируют аденокарциному G3, при значении KGSTP=1,21±0,02, KNFKB1=0,96±0,04 и KHV2=0,34±0,10 диагностируют перстневидноклеточный рак желудка.
Заявленный анализ основан на определении показателей относительной копийности генов (rC), нормализованных относительно референтного локуса гена В2М (β-2 микроглобин), и последующем вычислении коэффициента копийности генов (К) в опухолевой ткани по отношению к копийности генов в нормальной ткани.
Заявленный способ включает следующие приемы:
- выделение тотальной ДНК из тканевых проб с помощью метода фенол-хлороформной экстракции;
- определение относительной копийности генетических локусов методом ПЦР-РВ в присутствии красителя EVA-Green и специфичных праймеров на матрице выделенной ДНК;
- анализ первичных данных с помощью программного продукта амплификатора;
- расчет относительной копийности гена (rC) на основании соотношения сигналов, продуцируемых амплификатами изучаемой и референсной последовательностей,
- статистическая обработка данных и расчет коэффициентов копийности (Kобразец) с последующим сравнением со значениями коэффициентов копийности (Kстандарт), определенных для разных стадий и типов рака желудка.
Заявляемый способ осуществляется следующим образом.
На первом этапе отбираются образцы тканей - опухолевые и условно здоровые, из операционного или биопсийного материала. Для транспортировки в лабораторию и хранения образцы замораживаются в жидком азоте.
Фрагменты ткани измельчаются скальпелем и/или ножницами, затем растираются в фарфоровых ступках в присутствии лизирующего SDS-содержащего буфера. К лизатам добавляется протеиназа К и инкубируется при t=56°C в течение 1 часа.
ДНК выделяется из прозрачного лизата тканей с использованием фенол-хлороформной экстракции (см. Корниенко И.В., Водолажский Д.И., Вейко В.П. и др. Подготовка биологического материала для молекулярно-генетических идентификационных исследований при массовом поступлении неопознанных тел. - Ростов-н/Д : ООО Ростиздат, 2001).
Концентрация полученных препаратов ДНК измеряется на флюориметре. Для проведения ПЦР-РВ концентрацию ДНК в каждом образце нормализовывают до 2нг/мкл.
Анализируемые последовательности генетических локусов амплифицируют в 25 мкл ПЦР-смеси, содержащей 10 нг геномной ДНК, 0,2 мМ dNTPs, 2,5 мМ MgCl2, 1x-ый ПЦР-буфер, 0,1 е.а. ДНК-полимеразы Thermus aquaticus («Синтол», Россия), краситель SYBR@Green I (Invitrogen, США) и по 100 нМ прямого и обратного праймеров для референтного гена (β-2 микроглобин) или гена-мишени. Прямые и обратные праймеры были разработаны для нуклеотидных последовательностей, содержащих интронные и экзонные участки генетических локусов, с использованием данных NCBI GenBank (таблица 1).
Для оптимизации ПЦР использовали только праймеры, которые обеспечивали специфичную амплификацию необходимого количества продукта и не образовывали между собой высокоэнергетических внутренних структур: шпилек и дуплексов. Оптимизировали такие параметры ПЦР, как концентрация MgCl2 и праймеров в ПЦР-смеси, соотношение прямых и обратных праймеров, количество циклов амплификации, время элонгации, денатурации и отжига праймеров. В результате оптимизации подобрали одинаковую температуру отжига праймеров для всех локусов.
В таблице 1 представлены выбранные последовательности прямого и обратного праймеров для ПЦР-РВ.
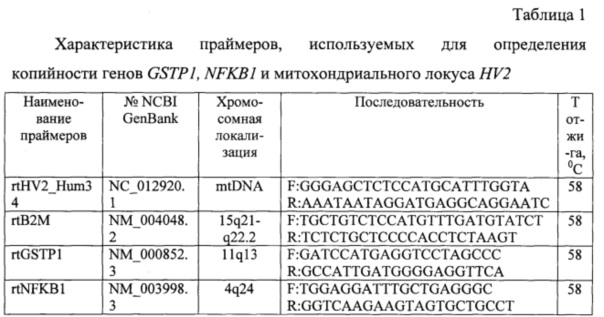
Количественную ПЦР-РВ амплификацию проводят на термоциклере, например, Bio-Rad CFX96 (USA), в соответствии с инструкциями производителя по следующей программе. Первичная денатурация: t=95°C в течение 3 мин. 40 циклов: t=95°C в течение 10 с, t=58°C в течение 30с, t=72°C в течение 15с. В одной постановке в качестве матрицы используют одновременно ДНК опытной (опухоль) и контрольной (условно здоровая ткань) пробы для определения сигналов, продуцируемых амплификатами локусов GSTP1, NFKB1, HV2 и референсного В2М; каждый вариант в трех повторностях.
Относительную копийность генетических локусов определяют, последовательно рассчитывая среднее значение сигналов флюоресценции (Ct) по трем повторам и уровень копийности исследуемого локуса относительно референсного гена В2М, по формуле rC=2-ΔCt, где rC - относительная копийность гена, ΔCt - разность среднего Ct гена мишени и среднего Ct референтного гена: ΔCt=Ct(ген мишень) - Ct(B2M).
Расчет коэффициентов копийности проводят по формуле K=rCcancer/rCnormal (где K - коэффициент относительной копийности, rCcancer - относительная копийность в опухолевой ткани, rCnormal - относительная копийность в условно нормальной ткани). Характеристика копийности генов GSTP1, NFKB1 и митохондриального локуса HV2 для разных гистологических типов рака желудка представлена в таблице 2.
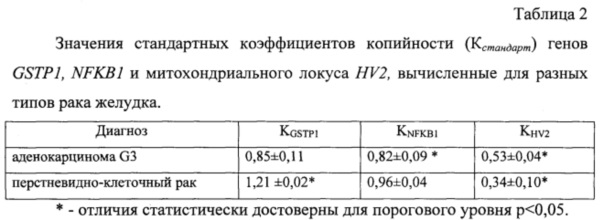
Идентификацию стадий и типов рака проводят согласно значениям коэффициентов копийности, составляющими для аденокарциномы G3 KGSTP1=0,85±0,11; KNFKB1=0,82±0,09 и KHV2=0,53±0,06; а для перстневидноклеточного рака желудка KGSTP1=1,21±0,02; KNFKB1=0,96±0,04 и KHV2=0,34±0,10.
Работоспособность заявляемого способа подтверждается следующими клиническими примерами:
Пример №1.
Больной Д., 1951 г.р., обратился в ФГБУ «РНИОИ» МЗ РФ с жалобами на периодические боли в эпигастрии, подреберьях, тошноту, периодическую рвоту, слабость, похудание на 15 кг, отечность нижних конечностей, одышку при нагрузке. Считает себя больным более года, ухудшение с весны 2013, когда в течение месяца был черный стул, повторно черный стул был в сентябре 2013 в течение 10 дней. Трижды терял сознание, чему предшествовало жжение в эпигастрии, выраженная слабость. Находился на стационарном обследовании и лечении по месту жительства, при ФГС выявлена опухоль желудка.
При обследовании в поликлинике РНИОИ была выявлена инфильтративно-язвенная опухоль тела желудка (ФГС №30/68672 от 14.01.2014 г.). Гистоанализ 632-35/14: диагноз колеблется между аденокарциномой и перстневидноклеточным раком. СРКТ от 14.01.2014 г. - многоузловая опухоль желудка 9,5×6,7×4,5 см с внутрипросветным ростом, парагастральные лимфоузлы до 1,5 см. МРТ головного мозга 15.01.2014: метастазов нет.15.01.2014 консультация невролога: ДЭП. Больному был поставлен предварительный диагноз: рак тела желудка, T3-4N1M0, стадия 3, гр. 2.
В связи с неуточненным гистогенезом опухоли, больному было выполнено определение уровня копийности локусов GSTP1, NFKB1 и HV2 в биоптатах опухоли и условно здоровой ткани желудка. Результаты исследования (KGSTP1=0,74; KNFKB1=0,79 и KHV2=0,48) свидетельствовали о наличии у больного G3 аденокарциномы желудка.
В связи с высокой чувствительностью G3 аденокарциномы желудка к полихимиотерапии и местнораспространенным характером опухоли у пациента, консилиумом врачей решено начать специальное лечение с курсов полихимиотерапии. Проведено 3 курса полихимиотерапии по схеме: карбоплатин, фторурацил, лейковарин, с интервалом 21 день. При контрольном СРКТ-исследовании отмечалось уменьшение размеров опухоли желудка до 7,5×5,0×3,2 см, парагастральных лимфоузлов до 0,8 см.
15.04.2014 г. больному выполнена лапаротомия, при которой выявлено: опухоль тела желудка размером 7,5×5×3,5 см, плотная, регинарные лимфоузлы до 1 см, отдаленных метастазов нет. Выполнена гастрэктомия с расширенной лимфаденэктомией.
Препарат: желудок с опухолью, поражающей тело желудка, экзофитной, с папиллярными разрастаниями, на разрезе грязно-серого цвета, большой и малый сальники, регионарные лимфоузлы до 1 см; дистальная линия резекции в 5 см от опухоли, проксимальная линия резекции в 6 см от опухоли.
Послеоперационный гистоанализ 4541-54/14 подтвердил наличие у больного низкодифференцированной аденокарциномы желудка: G3 аденокарцинома желудка, инвазия всей толщи стенки желудка, в 3 лимфоузлах - метастазы рака, по линиям резекции опухоли нет.
Послеоперационный диагноз: рак тела желудка, T3N1M0, стадия 3, гр.2. Больному было проведено еще 3 курса полихимиотерапии по прежней схеме. Динамическое наблюдение за больным (ФЭС, СРКТ, УЗИ) свидетельствует об отсутствии у больного рецидива и метастазов опухоли.
Анализ представленного клинического случая свидетельствует о важности установления гистогенеза опухоли желудка для определения правильной тактики лечения.
Пример №2.
Больная Ш., 1956 г. р. обратилась в ФГБУ «РНИОИ» МЗ РФ с жалобами на боли в эпигастрии, отрыжку, слабость, небольшое похудание.
Считает себя больной с ноября 2013 г, когда впервые стала отмечать периодические боли в эпигастрии. Обратилась в декабре 2013 г. по месту жительства, где на ФГС выявлена опухоль желудка. На СРКТ в РНИОИ - утолщение стенки желудка, отдаленных метастазов нет, лимфоузлы перигастральные до 1,0 см. Гистологический анализ №82128-30: диагноз колеблется между аденокарциномой и перстневидноклеточным раком. Консультация гинеколога: онкогинекологической патологии не выявлено. Больной был установлен диагноз: рак тела желудка, T3N1M0, стадия 3, гр.2.
В связи с неуточненным гистогенезом опухоли, больной было выполнено определение уровня копийности генов GSTP1, NFKB1 и HV2 в биоптатах опухоли и условно здоровой ткани желудка. Результаты исследования (KGSTP1=1,22; KNFKB1=0,98 и KHV2=0,29) свидетельствовали о наличии у больной перстневидноклеточного рака желудка.
В связи с низкой чувствительностью перстневидноклеточного рака желудка к полихимиотерапии, несмотря на местнораспространенный характер опухоли у пациентки, консилиумом врачей решено начать специальное лечение с оперативного вмешательства.
20.01.2014 больной выполнена лапаротомия, при которой выявлено: инфильтративная опухоль кардиального отдела желудка по малой кривизне и задней стенке размерами до 6×5×3 см, не прорастающая серозную оболочку, регионарные лимфоузлы до 0,8 см, отдаленных метастазов нет. Больной выполнена гастрэктомия с расширенной лимфодиссекцией D2.
Препарат: 1) единым блоком - желудок с инфильтративной опухолью кардиального отдела желудка, размерами 6×5×3 см, не прорастает серозную оболочку, плотной консистенции, на разрезе грязно-серого цвета, большой и малый сальники; 2) 12 лимфоузлов сальников и области чревного ствола до 0,5-1.0 см в диаметре.
Гистологический анализ 3074-98/14-перстневидноклеточный и слизистый рак с инвазией всех слоев, по линиям резекции опухоли нет, в 13 регионарных лимфоузлах метастазов рака нет. Послеоперационный гистоанализ подтвердил наличие у больной перстневидноклеточного рака желудка и правильность тактики лечения больной.
Больная консультирована химиотерапевтом: учитывая гистологию рака желудка, больной адъювантная химиотерапия не показана.
Послеоперационный диагноз: рак тела желудка, T3N0M0, стадия 2, гр.3. Динамическое наблюдение за больной (ФЭС, СРКТ, УЗИ) свидетельствует об отсутствии у больной рецидива и метастазов опухоли.
Анализ представленного клинического случая также свидетельствует о важности установления гистогенеза опухоли желудка для определения правильной тактики лечения, которая отличается при разных гистологических формах рака желудка.
Технико-экономическая эффективность изобретения «Способ дифференциальной диагностики рака желудка различных гистологических типов» позволяет дифференцировать аденокарциному и перстневидноклеточный рак желудка. Заявляемый способ является экономически оправданным для уточнения предоперационного диагноза, дает возможность своевременной дифференцировки вида опухоли желудка; принятия правильной тактики лечения больных и улучшению результатов лечения больных раком желудка; осуществляется в условиях стандартной лаборатории молекулярной биологии (ПЦР), без использования специального дорогостоящего оборудования; отбор материала для его осуществления возможно совместить с гастроскопической биопсией, способ занимает менее 10 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК | 2017 |
|
RU2683571C1 |
| Способ прогнозирования развития метастазов у больных раком желудка | 2016 |
|
RU2624505C1 |
| Способ прогнозирования развития метастазов в регионарные лимфоузлы у пациентов с аденокарциномой желудка | 2017 |
|
RU2661600C1 |
| МАЛОИНВАЗИВНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ ПРЯМОЙ КИШКИ К ЛУЧЕВОЙ ТЕРАПИИ НА ОСНОВАНИИ ИЗМЕНЕНИЯ КОПИЙНОСТИ ГЕНОВ Н2АХ И RBBP8 | 2019 |
|
RU2740576C1 |
| Малоинвазивный способ диагностики рака легкого на основании изменения копийности локуса мтДНК HV2 | 2018 |
|
RU2678227C1 |
| Способ диагностики метастазов рака толстой кишки | 2016 |
|
RU2647470C2 |
| СПОСОБ ПРОГНОЗА МЕТАСТАЗИРОВАНИЯ ОПУХОЛЕЙ РАКА ЖЕЛУДКА | 2021 |
|
RU2806432C2 |
| Малоинвазивный способ диагностики метастатического поражения регионарных лимфатических узлов у больных раком шейки матки на основании показателя копийности генов CCND1 и PPARGC1A | 2021 |
|
RU2766774C1 |
| Способ дифференциальной диагностики плоскоклеточного рака языка и доброкачественного новообразования языка | 2024 |
|
RU2841122C1 |
| Тест-система "ESSC-tipe-1" для молекулярно-генетического типирования плоскоклеточного рака пищевода | 2020 |
|
RU2742468C1 |
Изобретение относится к области молекулярной онкологии и может быть использовано для дифференциальной диагностики рака желудка различных гистологических типов. Способ включает получение ДНК, выделенной из биопсийного материала; амплификацию фрагментов локусов GSTP1, NFKB1 и HV2 методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с помощью набора высокоспецифичных праймеров; количественную интерпретацию результатов амплификации. Осуществление способа возможно с операционным материалом и тканевыми биоптатами, полученными во время гастроскопии; регистрацию результатов производят однократно в конце исследования, способ занимает менее 10 часов. Способ позволяет эффективно и своевременно идентифицировать аденокарциному G3 и перстневидноклеточный рак желудка, дает возможность уточнения предоперационного прогноза, что способствует принятию правильной тактики лечения и улучшению его результатов. 2 табл., 2 пр.
Способ дифференциальной диагностики рака желудка различных гистологических типов, включающий получение ДНК из биопсийного, операционного материала опухоли и условно здоровой ткани пациента, отличающийся тем, что осуществляют амплификацию фрагментов локусов GSTP1, NFKB1 и HV2 методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с помощью набора высокоспецифичных праймеров на матрице выделенной ДНК, проводят количественную интерпретацию результатов амплификации и расчет коэффициентов копийности генов по формуле K=rCcancer/rCnormal, где
K - коэффициент относительной копийности,
rCcancer - относительная копийность гена в опухолевой ткани,
rCnormal - относительная копийность гена в условно нормальной ткани, сравнивают полученные значения со стандартными коэффициентами копийности, при значении KGSTP1=0,85±0,11, KNFKB1=0,82±0,09 и KHV2=0,53±0,06 диагностируют аденокарциному G3, при значении KGSTP1=1,21±0,02, KNFKB1=0,96±0,04 и KHV2=0,34±0,10 диагностируют перстневидноклеточный рак желудка.
| ДИАГНОСТИКА РАКА ЖЕЛУДКА НА РАННЕЙ СТАДИИ | 1998 |
|
RU2204835C2 |
| RU 1585921 C, 10.04.1995 | |||
| Кит О | |||
| И | |||
| и др | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ундаментальные исследования | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Электрический терморегулятор для термостатов | 1924 |
|
SU671A1 |
| Cheng Y | |||
| et al | |||
| Analysis of DNA methylation patterns associated with the gastric cancer genome | |||
| Oncol Lett | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| PMID: 24944662 | |||
| Chen G | |||
| et al | |||
| Role of microRNAs in diagnosis and treatment of the pathogenesis of gastric cancer | |||
| Int J Clin Exp Med | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| PMID: 25664140. | |||
Авторы
Даты
2017-03-15—Публикация
2015-10-12—Подача