Область техники
Изобретение представляет собой группу изобретений и относится к области медицины, а именно к средствам и способам лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis.
Предшествующий уровень техники
На сегодняшний день одним из часто выявляемых условно - патогенных микроорганизмов в органах мочеполовой системы организма человека являются урогенитальные микоплазмы Mycoplasma hominis. Интерес исследователей и практикующих врачей к изучению их роли в этиологии воспалительных заболеваний органов мочеполовой системы обусловлен не только широким распространением в популяции, но и неоднозначным отношением к участию в развитии патологических процессов. Mycoplasma hominis присутствует в уретре, влагалище, прямой кишке у 20-75% здоровых людей [Немченко О.И., Уварова Е.В. Урогенитальный микоплазмоз (обзор литературы) // Consilium Medicum. 2007, №1, с. 45-51].
В случае урогенитальной формы заболевания страдают слизистые оболочки органов воспроизводства и развиваются такие недуги:
- у мужчин простатит, уретрит, эпидидимит, цистит, разнообразные нарушения работы почек, а также мочевыделительных путей,
- у женщин уретрит, аднексит, вульвовагинит, сальпингит, эндометрит, отек и воспаление яичников - оофорит.
Известны антибактериальные препараты, которые назначаются при урогенитальных инфекциях, вызванных микроорганизмами Mycoplasma hominis, это антибиотики: тетрациклины, макролиды, азалиды, фторхинолоны. Чувствительность микоплазм к антибиотикам лежит в очень широких пределах (Обзор статей в журнале Antimicrob. Agents Chemother, за 1992-2003 гг.). Все микоплазмы устойчивы к цефалоспоринам, пенициллинам, рифампицину, налидиксовой кислоте. В настоящее время в акушерско-гинекологической практике, особенно в лечении беременных, наиболее часто используется джозамицин (Вильпрафен), который назначается беременным женщинам с отягощенным акушерским анамнезом, если у них установлена массивная микоплазменная колонизация влагалища. При этом Вильпрафен назначается внутрь в дозе 500 мг 3 раза в день в течение 10 дней. Небеременным женщинам, а также мужчинам назначают тетрациклины, в том числе доксициклин (Юнидокс Солютаб) внутрь в дозе 100 мг 2 раза в день в течение 10 дней, препаратом выбора являются азитромицин, назначаемый в дозе 1 г однократно.
Однако применение антибиотиков сопровождается побочными действиями, наносящими зачастую существенный вред организму человека.
Наиболее близким аналогом заявленного изобретения является антибиотик - доксициклин, наиболее часто применяющийся в отношении этих микроорганизмов для лечения урогенитальных инфекций. [Макаров О.В. Инфекции в акушерстве и гинекологии, О.В. Макаров, В.А. Алешкин, Т.Н. Савченко. М.: «МЕДпресс-информ», 2007, 464 с.]
Доксициклин - полусинтетический антибиотик группы тетрациклинов широкого спектра действия. Оказывает бактериостатическое действие за счет подавления синтеза белка возбудителей. После приема внутрь быстро и практически полностью абсорбируется из желудочно-кишечного тракта. Однако доксициклин также как и другие антибиотики, обладает гепатотоксичностью и может оказывать негативное действие на кровь, вызывая тромбоцитопению и нейропению. Он вызывает аллергические реакции, потенцирует эффект непрямых антикоагулянтов. Доксициклин противопоказан к применению при беременности и в период лактации, т.к. он проникает через плацентарный барьер. Он может вызывать необратимое изменение цвета зубов, гипоплазию эмали, подавление роста костей и хрупкость скелета плода, а также развитие жировой инфильтрации печени. В связи с подавлением кишечной микрофлоры доксициклин снижает протромбиновый индекс, что требует коррекции дозы непрямых антикоагулянтов. Прием доксициклина снижает надежность контрацепции и повышает частоту кровотечений на фоне приема эстрогенсодержащих пероральных контрацептивов. Одновременное применение доксициклина и ретинола способствует повышению внутричерепного давления. При церебральных поражениях уреаплазменной этиологии у недоношенных детей применение доксициклина не оказывает клинически выраженного эффекта.
На сегодняшний день надежного антибиотика для лечения инфекций урогенитального тракта, хронического простатита и других заболеваний, ассоциированных с микоплазмами нет. В последние годы лечение микоплазмоза и его ассоциатов стало более сложным из-за появления штаммов, обладающих устойчивостью к антибиотикам и полирезистентностью к лекарственным средствам. Обосновано положение о том, что хроническая урогенитальная инфекция (уретрит, цервит, бактериальный вульвовагинит) протекает как смешанная инвазия микоплазм и служит показателем нарушения иммунорезистентности человека, поэтому приходится прибегать дополнительно к назначению антиоксидантов, иммуностимуляторов и препаратов, восстанавливающих нормальную микрофлору влагалища и кишечника (пре- и пробиотиков).
Способы лечения заболеваний урогенитального тракта, вызванного микоплазмами, в этих случаях являются комплексными, поэтапными и включают лечение препаратами не только подавляющими рост микоплазм, но и восстанавливающими микрофлору и иммунорезистентность организма. В этиотропную терапию включают массу лекарств и методов. Лечение, дополняющее антибиотикотерапию, включает иммунотерапию, общеукрепляющие препараты, физиотерапию, бактериальные препараты, восстанавливающие микрофлору (молочнокислые бактерии, лактобактерин, колибактерин). Также применяют пребиотики, содержащие лактулозу, такие как Лактусан, Дюфалак, Нормазе и пребиотик инулин, которые усиливают размножение физиологически нормальной микрофлоры влагалища и кишечника. Существующие в данное время общепринятые схемы лечения далеко не всегда дают должный эффект из-за того, что не учитывают индивидуальные особенности организма пациента: наличие сопутствующих заболеваний, изменения иммунной системы, а также особенности возбудителя (состояние его биологической активности, резистентность к антибиотикам).
Недостатками вышеописанных способов лечения являются: незначительный результат, невозможность полностью подавить рост микроорганизмов и справиться с инфекцией, так как появилось много полирезистентных к антибиотикам штаммов, а также специфичность этих «мембранных паразитов», которые проникая внутрь клетки, не находят препятствий со стороны иммунной системы человека и приводят к распространению инфекции.
Раскрытие изобретения
Целью создания настоящего изобретения является создание нового лекарственного средства растительного происхождения, новой фармацевтической композиции растительного происхождения, обладающих антибактериальной и антиоксидантной активностью, способных подавлять очаги инфекции, рост сопутствующей патогенной микрофлоры, обладающих минимальным побочным эффектом и усиливающих иммунный ответ организма, а также нового способа лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis.
Для достижения поставленной цели авторами было предложено: Лекарственное средство для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, представляющее собой хвойный хлорофилло-каротиновый комплекс, полученный из хвои на основе Pinus Sylvestris и Picea abies (L.) Karst, взятых в соотношении 55:45. Хвойный хлорофилло-каротиновый комплекс содержит воду в количестве 38-42 масс %, сумму эстрактивных веществ 55-61 масс %, сумму производных хлорофилла 0,6-1,2 масс %, причем сумма экстрактивных веществ содержит: 42-47 масс % свободных кислот, включая пинифиловую кислоту в количестве 16,5-21,4 масс % от суммы свободных кислот, 53-58 масс % нейтральных компонентов, включая в масс % от суммы нейтральных компонентов: изоабиенол в количестве 19,3-24,4; сумму каротиноидов, выбранных из лютеина, зеаксантина, β-каротина, 0,3-0,5; воски 1,7-3,1; эфирные масла 0,6-0,9.
Фармацевтическая композиция для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis содержит упомянутый выше хвойный хлорофилло-каротиновый комплекс в терапевтически эффективном количестве и фармацевтически приемлемые носители и/или растворители, при этом фармацевтическая композиция выполнена в виде раствора, суспензии, капсулы, таблетки, гранулы, суппозитория.
Применение упомянутого выше хвойного хлорофилло-каротинового комплекса для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis.
Способ лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, включает введение эффективного количества упомянутого выше хвойного хлорофилло-каротинового комплекса в суточной дозе для человека от 100 до 1280 мг.
Осуществление изобретения
Авторами были проведены исследования заявляемого лекарственного средства растительного происхождения, обладающего антибактериальной активностью в отношении микроорганизмов вида Mycoplasma hominis. Средство представляет собой хвойный хлорофилло-каротиновый комплекс растительного происхождения (CGNC), который содержит биологически активные природные соединения. Это густая темно-зеленая паста с запахом хвои.
Хвойный хлорофилло-каротиновый комплекс можно использовать как в виде самостоятельного средства, так и в составе фармацевтических композиций в сочетании с фармацевтически приемлемыми носителями, растворителями и вспомогательными средствами.
В своем составе средство содержит натриевые соли высших жирных и смоляных кислот, хлорофилл и его производные, каротиноиды, терпеноиды и их производные (соли, эфиры, ди- и трициклические терпеновые кислоты, а также их соли и эфиры, в том числе лабданового типа - пинифоловая кислота), терпеноидные спирты, в том числе изоабиенол, полипренолы и их ацетаты.
Хвойный хлорофилло-каротиновый комплекс содержит воду в количестве 38-42 масс %, сумму эстрактивных веществ 55-61 масс %, сумму производных хлорофилла 0,6-1,2 масс %, причем сумма экстрактивных веществ содержит: 42-47 масс % свободных кислот, включая пинифиловую кислоту в количестве 16,5-21,4 масс % от суммы свободных кислот, 53-58 масс % нейтральных компонентов, включая изоабиенол в количестве 19,3-24,4 масс % от суммы нейтральных компонентов, а нейтральные компоненты содержат: сумму каротиноидов 0,3-0,5 масс % (лютеин, зеаксантин, β-каротин), воски 1,7-3,1 масс %, нерастворимые в воде летучие вещества - эфирные масла 0,6-0,9 масс %.
Получают хвойный комплекс CGNC из строго регламентированного сырья - хвои, состоящей из 55% Pinus Sylvestris и 45% Picea abies (L.) Karst.
Авторами были проведены исследования и изучена антибактериальная активность хвойного хлорофилло-каротинового комплекса на микроорганизмы вида Mycoplasma hominis. Были проведены исследования антибактериального действия CGNC в различных концентрациях - 100, 200, 300 мг/мл. CGNC растворяли в горячей (56°С) стерильной дистиллированной воде, готовили исходный раствор в концентрации 1000 мг/мл и далее использовали его для получения растворов с заданными концентрациями. Результаты исследований проведены в несколько этапов, которые показаны на примерах.
В НИЭМ им. Пастера (Санкт-Петербург), в лаборатории иммунологии были обследованы пациенты с заболеваниями урогенитального тракта, от которых выделены жизнеспособные штаммы вида Mycoplasma hominis, которые апробировали на чувствительность к препаратам: хвойный хлорофилло-каротиновый комплекс и доксициклину. Работа была проведена при обследовании 180 пациентов в возрасте от 21-51 года с заболеваниями урогенитального тракта, от которых были выделены 20 жизнеспособных штаммов. Пациенты обследовались амбулаторно: некоторые пациенты первично обратились к врачу по поводу беременности, бесплодия, хронического цистита, нарушения менструального цикла; другие обратились вторично с диагнозом хронический вагинальный кандидоз (ХВБ), трихомоноз, микоплазмоз, хронический простатит; некоторые имели в анамнезе сопутствующие инфекции, такие как генитальный герпес, гарднереллез, хламидиоз. У большинства этих пациентов были обнаружены штаммы микроорганизмов вида Mycoplasma hominis, (Приложение 1 Таблица 1).
Для Mycoplasma hominis препаратом сравнения был выбран доксициклин. Чувствительность к доксициклину определяли на среде S.I.R. MYCOPLASMA (BIO-RAD Laboratories) в соответствии с инструкцией к тест-системе. Для постановки теста антибиотикорезистентности концентрация возбудителя была не ниже 104 КОЕ/мл, микроорганизмы тестировали в логарифмической фазе роста. Доксициклин присутствовал в питательной среде в концентрациях 4 мг/л и 8 мг/л. Изменение цвета в пробах с обеими концентрациями доксициклина позволяла оценивать штамм как резистентный, изменение цвета в пробе, содержащей 8 мг/л антибиотика - как умеренно резистентный. Отсутствие изменения цвета в обеих пробах, как чувствительный штамм.
Для работы были отобраны 10 клинических, хорошо воспроизводящихся штаммов -Mycoplasma hominis. После отбора штаммов, сделанных на основе тестирования анкет больных и типирования изолятов методом ПЦР-РТ, все выделенные культуры испытывали на чувствительность к хвойному хлорофилло-каротиновому комплексу (Таблица 2).
Пример 1. Подавление роста и размножения микроорганизмов вида Mycoplasma hominis на клинических штаммах, взятых у больных с заболеваниями урогенитального тракта в сравнении с препаратом доксициклином.
Тестирование препарата хвойный хлорофилло-каротиновый комплекс в отношении микроорганизмов вида Mycoplasma hominis приведено в таблице 2.
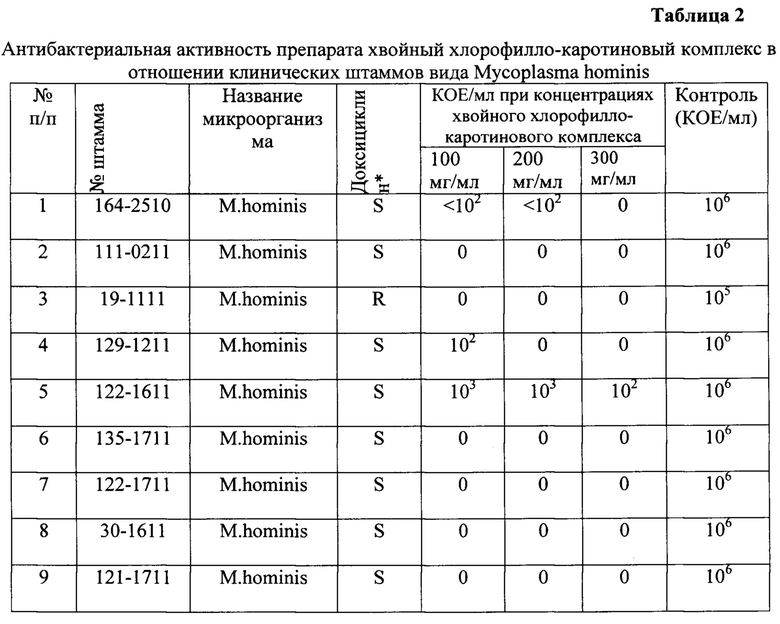

Обозначения: I - относительно резистентный, R - резистентный, S - чувствительный. *- концентрация доксициклина 8 мг/л
Из 10 штаммов Mycoplasma hominis хвойный хлорофилло-каротиновый комплекс подавлял рост 9 штаммов Mycoplasma hominis в концентрации 300 мг/мл, из них на 6 штаммов хвойный хлорофилло-каротиновый комплекс действовал, начиная с минимальной концентрации - 100 мг/мл. К действию хвойного хлорофилло-каротинового комплекса был устойчив 1 штамм (№122-1611). Среди 10 штаммов Mycoplasma hominis 8 были чувствительны к препарату сравнения - доксициклину. Важно отметить, что 2 резистентных к доксициклину штамма были чувствительны к действию хвойного хлорофилло-каротиновый комплекса в минимальной концентрации 100 мг/мл.
Штаммы Mycoplasma hominis продемонстрировали хорошую чувствительность к препарату хвойный хлорофилло-каротиновый комплекс, сопоставимую с чувствительностью к доксициклину (Таблица 3).

Пример 2. Подавление роста и размножения микроорганизмов вида Mycoplasma hominis, устойчивых к доксициклину.
Исследования были продолжены на клинических штаммах микоплазмы с целью установить будет ли препарат хвойный хлорофилло-каротиновый комплекс подавлять рост микроорганизмов, устойчивых к доксициклину. Это было сделано за счет отбора у группы больных с урогенитальной инфекцией клинического штамма Mycoplasma hominis, у пациентов, прошедших по несколько курсов антибиотикотерапии (в том числе, и доксициклином), но не добившихся успеха в лечении. (Приложение 2 Таблица 4). Было обследовано 220 пациентов (95 мужчин и 125 женщин) с хроническими воспалительными заболеваниями урогенитального тракта. При этом 60% пациентов предъявляли различные жалобы в области гениталий на дискомфорт, выделения, жжение, зуд, а 40% пациентов жалоб не предъявляли и проходили обследование.
Было выделено 10 штаммов Mycoplasma hominis, устойчивых к антибиотику - доксициклину. Все пациенты указывали на многократное (2-3 курса) и длительное лечение (до 5 курсов) антибиотиками в анамнезе, которое не принесло положительного эффекта при лечении основного заболевания, связанного с инфекцией урогенитального тракта. (Приложение 2 Таблица 4).
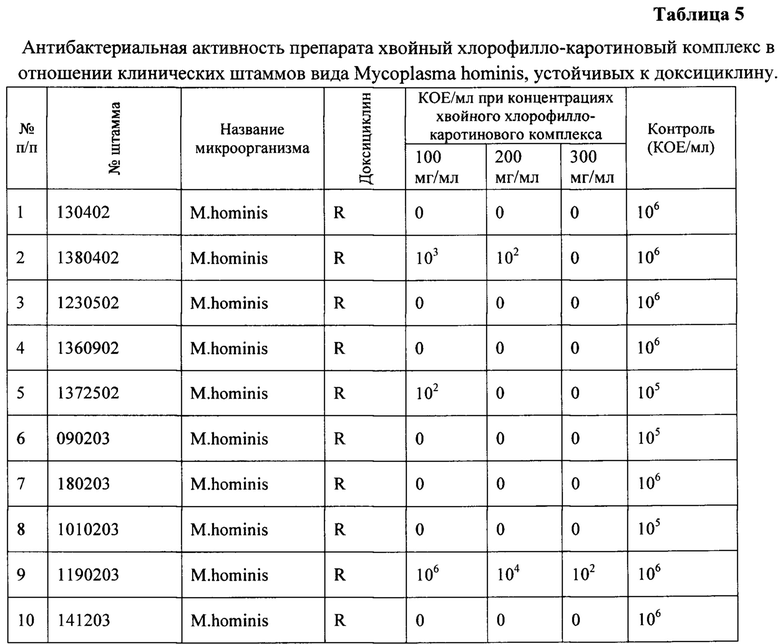
Обозначения: R - резистентный
Как видно из таблицы 5, из 10 выделенных штаммов Mycoplasma hominis, устойчивых к доксициклину, 7 были чувствительны к действию препарата - хвойный хлорофилло-каротиновый комплекс во всех изученных концентрациях, даже при 100 мг/мл. Штамм 1190203, изолированный от пациентки с диагнозом цервицит был устойчив к хвойному хлорофилло-каротиновому комплексу во всех концентрациях, штамм 1380402 показал чувствительность к этому препарату в концентрации 300 мг/мл, а штамм 1372502 - в концентрациях 200 и 300 мг/мл.

Таким образом, в отношении Mycoplasma hominis в 70% случаях хвойный хлорофилло-каротиновый комплекс начиная с концентрации 100 мг/мл подавлял рост микроорганизмов, а в 20% случаях потребовалось повышение концентрации препарата до 300 мг/мл. В 90% случаях препарат хвойный хлорофилло-каротиновый комплекс в максимальной концентрации подавлял рост и размножение микроорганизмов вида Mycoplasma hominis в то время как антибиотик доксициклин не действовал на этот штамм. Полученные данные демонстрируют новые свойства и специфическое действие препарата в отношении этого микроорганизма, на которые не действует антибиотик, и показывают возможность использования хвойного хлорофилло-каротинового комплекса даже в тех случаях, когда антибиотикотерапия не оказывает эффекта.
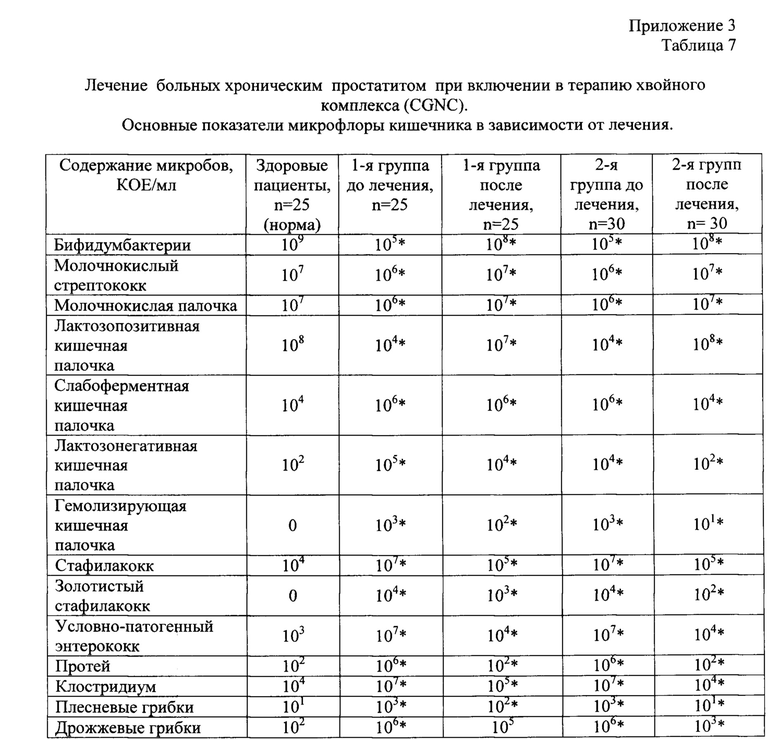
Пример 3. Способ лечения больных хроническим простатитом при включении в терапию хвойного хлорофилло-каротинового комплекса в виде «хвойных таблеток».
Исследование было проведено в Центре дисбактериоза и микроэкологии человека на базе 1-ой инфекционной больницы г. Казани. Под наблюдением находилось 55 мужчин в возрасте 35-65 лет с хроническим простатитом и дисбактериозом кишечника с давностью заболевания от 2-15 лет. В анамнезе у больных наблюдались сопутствующие заболевания: гастрит, цистит, гастро дуоденит, холецистит, микоплазмоз, рецидивирующая крапивница и лямблиоз. Количественные показатели микрофлоры больных проводились в динамике (до- и после 30 дней) и сравнивались с общепринятыми нормами. У больных хроническим простатитом отмечается достоверное снижение бифидум бактерий до 105 КОЕ/мл, при норме - 109 КОЕ/мл, лактозапозитивной кишечной палочки до 104 КОЕ/мл, при норме 108 КОЕ/мл (Р<0,05) и снижение молочно-кислых бактерий.
Кроме того, у больных хроническим простатитом был выявлен обильный рост условно-патогенной флоры. В зависимости от получаемой терапии больные были поделены на 2 группы: 1 - группа - 25 человек получала общепринятую терапию - сначала назначались специфические фаги, затем комбинация эубиотиков и пробиотиков; 2-я группа - 30 человек, на фоне приема эубиотиков дополнительно получала CGNC в виде «хвойных таблеток» в дозе 320 мг в сутки в течение 30 дней. При сравнении показателей микробиоценоза после проведенного лечения выявили, что у больных 2-й группы отмечается восстановление по облигатной флоре. Так, количественные показатели бифидум флоры во 2-ой группе до лечения - 105 КОЕ/мл, а после лечения составили 108 КОЕ/мл при норме - 109 КОЕ/мл у здоровых лиц. Содержание лактозопозитивной кишечной палочки составило до лечения 104 КОЕ/мл, а после - 108 КОЕ/мл, что соответствует норме, а у больных 1-й группы -ниже нормы - 107 КОЕ/мл. Зарегистрировано восстановление количественных показателей молочнокислых бактерий и молочнокислого стрептококка до показателей здоровых лиц 107 КОЕ/мл. Уменьшение количественных показателей дрожжевых грибов рода Candida и плесневых грибов в 1-й группе больных были незначительны, тогда как в группе больных, принимавших «хвойные таблетки» количество грибов рода Candida уменьшилось с 106 КОЕ/мл до 103 КОЕ/мл, а плесневых грибов с 103 КОЕ/мл до 101 КОЕ/мл. При сравнении количественных показателей условно-патогенной флоры (стафилококк, протей, клостридиум, гемолизирующая кишечная палочка) отмечается четкое их снижение по сравнению с аналогичными показателями у больных 1-ой группы (Приложение 3, Таблица 7). При исследовании клинических показателей четко зарегистрировано у 2-ой группы после лечения исчезновение метеоризма, восстановление регулярности и кратности стула, появление чувства «бодрости», исчезновение симптомов авитаминоза.
В результате клинических испытаний было установлено, что способ лечения хронического простатита с дисбиозом кишечника по общепринятым методикам с включением эубиотиков и пробиотиков, не приводит к выздоровлению больных и полному восстановлению микрофлоры кишечника.
Включение в терапию препарата - хвойный хлорофилло-каротиновый комплекс в виде «хвойных таблеток» приводит к клинически достоверному снижению условно-патогенной флоры (золотистого стафилококка, гемолизирующей кишечной палочки, протея, клостридиума, дрожжевых грибов рода Candida и плесневых грибов), а также способствует восстановлению микрофлоры кишечника при дисбактериозе: бифидум бактерий, молочно-кислых бактерий и полноценной кишечной палочки.
Таким образом, впервые были выявлены и исследованы новые свойства препарата - хвойный хлорофилло-каротиновый комплекс в отношении мельчайших паразитов рода микоплазмы Mycoplasma hominis, которые вызывают различные заболевания урогенитального тракта, хронические простатиты, дисбактериозы кишечника, устойчивые к действию антибиотиков, в результате чего вызывают не только точечное поражение органов и тканей, способствуя распространению генерализованной инфекции со снижением иммунного статуса всего организма. Включение препарата - хвойный хлорофилло-каротиновый комплекс с антибактериальными и антиоксидантными свойствами в комплексную терапию заболеваний, ассоциированных с микроорганизмами вида Mycoplasma hominis, позволит ускорить процесс лечения больных, добиться не только подавления роста этих микроорганизмов и сопутствующей патогенной микрофлоры, но и добиться восстановления полезной микрофлоры. Это позволит достичь успеха в лечении и профилактике урогенитальных инфекций, вызванных микоплазмами, устойчивыми к действию антибиотиков, когда антибиотикотерапия не помогает достичь положительного результата. А также в тех случаях, когда антибиотикотерапия противопоказана, а именно, в период беременности и кормления грудью.
Использование препарата - хвойный хлорофилло-каротиновый комплекс с профилактической целью позволит бороться с микоплазменной урогенитальной инфекцией в случае невынашивания ребенка, бесплодия, связанного с ростом и размножением этих микроорганизмов. В случае лечения хронического простатита с сопутствующим дисбактериозом кишечника или нарушением микрофлоры кишечника в виду токсического действия свинца. Включение препарата - хвойный хлорофилло-каротиновый комплекс в терапию снижает рост патогенной и условно патогенной микрофлоры, восстанавливает полезную микрофлору, нормализует микробный биоценоз кишечника, а также повышает общую иммунорезистентность всего организма. Способ лечения урогенитальных инфекций влагалища и кишечника, ассоциированных с микроорганизмами рода Mycoplasma hominis, с помощью препарата препарата - хвойный хлорофилло-каротиновый комплекс является наиболее бережным методом лечения с минимальными побочными явлениями по сравнению с антибиотиками.
Активный ингредиент препарата - хвойный хлорофилло-каротиновый комплекс можно использовать как в виде самостоятельного средства, так и в составе фармацевтических композиций в сочетании с фармацевтически приемлемыми носителями, растворителями и вспомогательными средствами.
Эффективное количество находится в пределах от 1,0 до 1500 мг в сутки и может вводиться в виде одной дозы или нескольких доз. Более конкретные количества зависят от вида патологии, состояния больного, наличия выделенных штаммов микроорганизмов, поскольку выбор доз и длительность лечения строго индивидуальны.
Примеры фармацевтических композиций включают любые твердые (капсулы, таблетки, гранулы, порошки и т.д.) или жидкие (растворы, суспензии, эмульсии) лекарственные формы для приема внутрь, полутвердые формы для наружного применения (крема, гели, мази) или традиционные формы для ректального и вагинального введения (суппозитории).
Композиции для приема внутрь могут содержать традиционные для них вспомогательные вещества/ингредиенты, их можно изготовить в твердой или жидкой форме: в виде капсул, таблеток, раствора, суспензии или сиропа. Они могут содержать любые приемлемые эксципиенты, такие как связующие агенты (например, сахар, желатин, сорбитол, каррагинин или поливинилпирролидон), наполнители (лактоза, соевое масло, крахмал, фосфат кальция, сорбитол), таблетирующие лабриканты (например, стеарат магния, диоксид кремния), дезинтеграторы (например, гидроксипропилкрахмал, глицерин, поливинилпирролидон (ПВП), микрокристаллическую целлюлозу, карбоксиметилцеллюлозу), добавки повышающие текучесть (например, коллоидная двуокись кремния; тальк), увлажнители (например, натрия лаурил сульфат), поверхностно-активные или диспергирующие вещества.
Жидкие формы для приема внутрь могут включать растворители (вода, растительные или животные масла, минеральное масло), декстрозу, иные растворы сахаридов, гликоли и поверхностно-активные или диспергирующие вещества (ПАВ), красители и вкусовые добавки.
Указанные композиции готовят известными общепринятыми методами, включающими смешивание активного ингредиента с носителем, который может содержать один или более вспомогательных ингредиентов, использование влажного или сухого процесса получения из смеси готового к продаже продукта.
Таблетки можно получать прессованием на соответствующем оборудовании, при этом активный ингредиент в форме пасты, порошка или гранул в случае необходимости смешивается с наполнителями (например, с лактозой, фосфатом кальция, сахарами, сорбитолом, микрокристаллической целлюлозой), связующими добавками (например, повидоном, крахмалом, желатином, гидроксипропилметилцеллюлозой), лубрикантами (например, стеариновой кислотой, стеаратом магния), добавками повышающими текучесть (например, коллоидная двуокись кремния; тальк), инертными растворителями, дезинтеграторами (такими как производные целлюлозы, крахмал, поперечно-связанный повидон, натрия карбоксиметилцеллюлоза), поверхностно-активными или диспергирующими веществами. Таблетки, полученные формованием на соответствующем оборудовании, содержат смесь увлажненного порошка хвойного комплекса с инертными жидкими растворителями.
Фармацевтическую композицию можно производить в форме сухих гранул или порошка, либо в виде сырья для процесса таблетирования, либо в виде гранул, сформированных во время процесса производства таблеток с помощью процесса грануляции, в котором CGNC и носители гранулируются с помощью раствора подходящих связующих веществ (например, водного раствора ПВП, крахмальных паст, и т.д.).
В случае необходимости таблетки можно получать с различной оболочкой: для маскирования вкуса или для лучшей сохранности, или для замедленного или контролируемого высвобождения активного ингредиента.
Оболочка таблеток обычно включает формирователь пленки, такой как метилцеллюлоза, гидроксипропилметилцеллюлоза, ПВП, и пластификаторы, такие как триацетин, полиэтиленгликоль, или глицерол, омутители (например, тальк), красители, и иногда глянец, как например, пчелиный воск или карнауба воск. Энтеральные покрытия включают энтеральные полимеры, такие как акрилаты (Eudragits), эфиры фталатов (например, фталат ацетатацеллюлозы, фталат гидроксипропилметилцеллюлозы).
Оболочка капсул обычно включает формирователь пленки (желатин, каррагенин, и т.д.), пластификатор (глицерин, триацетин, вода) и другие вспомогательные вещества, такие как буферные системы, консерванты, красители. Оболочки можно получать, например, из гидроксипропилкрахмала, 2-х основного фосфата натрия, глицерина, или гидроксипропилметилцеллюлозы или ее смеси с желирующими веществами (каррагинин, желатин, воски) в разных соотношениях для обеспечения желательного профиля высвобождения.
Композиции для парентерального введения можно готовить как традиционными в фармации методами (растворы, суспензии), так и в виде водных микроэмульсий согласно патенту RU 2189231 на основе раствора Хенкса с 10% раствором этанола или другими методами. Они могут включать воду, фармацевтически приемлемые жиры или масла, спирты или другие органические растворители, поверхностно-активные вещества и/или антиоксиданты, консерванты. Обычные концентрации хвойного комплекса находятся в диапазоне от 0,01% до 80%. Готовые составы могут содержать разовую дозу или выполняться в виде флаконов, содержащих несколько разовых доз. Готовые лекарственные формы в случае необходимости могут содержать стабилизаторы, буферные системы, и иные вспомогательные средства.
Ректальные или вагинальные суппозитории могут включать известные в индустрии традиционные ингредиенты такие как гидрофобные или гидрофильные основания (например, твердые жиры, масло какао и/или его производные, полусинтетические глицериды (Novata, Wittespol, Suppocire или Ovucire серии), полиэтилен гликоли, глицерин, желатин), вещества повышающие вязкость (стеариновая кислота, коллоидная двуокись кремния), механические усилители (касторовое масло, глицерин, полисорбаты), эмульгаторы (лецитин, полисорбаты, цетостеариловый спирт), и другие вещества, такие как консерванты и буферные системы. Вагинальные суппозитории также можно сформировать в форме таблеток, и даже с некоторой степенью пузырения. Они обычно производятся в результате процесса грануляции и часто используют водорастворимый разбавитель, такой как лактоза.
Композиции для наружного применения готовят традиционными в фармации методами, смешивая жировую основу с помощью эмульгатора с водной основой, в которую вводят хвойный комплекс.
Примеры фармацевтических композиций:
Пример №1. Жидкая водорастворимая пероральная форма суспензия.
Смешивают хвойный хлорофилло-каротиновый комплекс с Твином-80 и этанолом до получения однородной массы при перемешивании и температуре 50-80°С, затем небольшими порциями постепенно добавляют очищенную (апирогенную воду) до получения коллоидного раствора, разливают во флаконы, стерилизуют.
Пример №2. Жидкая жирорастворимая пероральная форма.
Смешивают хвойный хлорофилло-каротиновый комплекс, лецитин и растительное масло в указанной пропорции, нагревают смесь до 50-60°С, перемешивают и разливают во флаконы с дозатором, стерилизуют.
Пример №3. Пероральная форма в виде хвойных таблеток.
Пример №4. Мягкие пищевые капсулы.
Содержимое капсулы.
Оболочка капсулы.
Указанные ингредиенты смешивают, помещают в капсулы, которые упаковывают в блистеры.
Пример №5. Ректальные или вагинальные суппозитории
Пример №6. Вагинальные суппозитории.
Они обычно весят 2-4 г, и примеры указывают на то, что содержание активных веществ (твердых) обычно бывает около 10-25%.
Пример №7. Мазь для наружного применения 10%.
1 г мази содержит 300 мг хвойного хлорофилло-каротинового комплекса и вспомогательные вещества: натрия бикарбонат, макрогол 400, макрогол 4000, макрогол 1000, вода очищенная; мазь расфасовывают в тубы алюминиевые по 20 г и помещают в картонную упаковку.
Пример №8. Гель вагинальный.
Промышленная применимость
Проведенные исследования и испытания показали, что использование CGNC (как в виде самостоятельного средства, так и в составе фармацевтических композиций в сочетании с фармацевтически приемлемыми носителями, растворителями и вспомогательными средствами) при лечении урогенитальных инфекций, ассоциированных с микроорганизмами вида Mycoplasma hominis, является бережным методом лечения и найдет широкое применение в медицине. Полученные данные демонстрируют новые свойства и специфическое действие препарата в отношении штаммов этих микроорганизмов, в том числе устойчивых к доксициклину.
Так на сегодняшний день средства, выпускаемые в капсулах с хвойным хлорофилло-каротиновым комплексом зарекомендовали себя препаратами, обладающим минимальными побочными явлениями (индивидуальная непереносимость) по сравнению с антибиотиками. Технология изготовления препарата включает в себя известные общепринятые методы и не требует дорогостоящего оборудования.
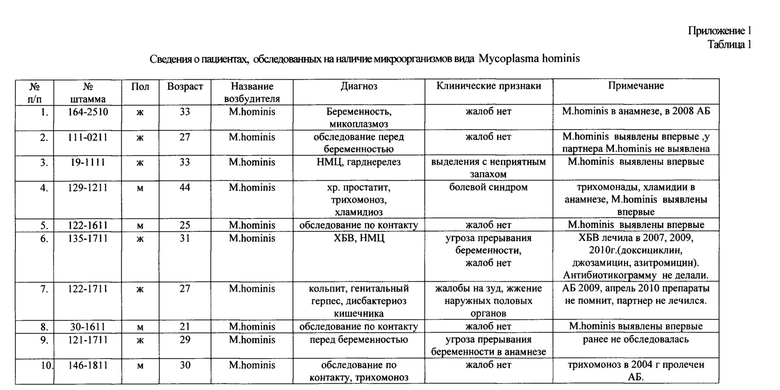
Обозначения: АБ - антибиотикотерапия, НМЦ - нарушение менструального цикла, ХБВ - хронический бактериальный вагиноз.
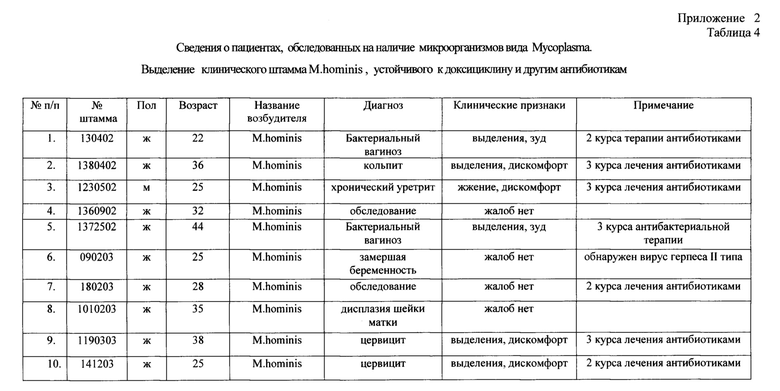
* - Р<0.05
| название | год | авторы | номер документа |
|---|---|---|---|
| Лекарственное средство, фармацевтическая композиция, способ лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Ureaplasma urealyticum | 2017 |
|
RU2677686C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИТОР РОСТА HELICOBACTER PYLORI И СПОСОБ ПРОВЕДЕНИЯ АНТИХЕЛИКОБАКТЕРНОЙ ТЕРАПИИ | 2007 |
|
RU2367458C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОПРОТОЗОЙНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRICHOMONAS VAGINALIS В МОДЕЛЬНОЙ СИСТЕМЕ IN VITRO | 2008 |
|
RU2366442C1 |
| ВИРУЛИЦИДНОЕ, БАКТЕРИЦИДНОЕ, ФУНГИЦИДНОЕ СРЕДСТВО | 2000 |
|
RU2196596C2 |
| НАБОР ДЛЯ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ИНФЕКЦИЙ, ВЫЗЫВАЕМЫХ MYCOPLASMA HOMINIS И UREAPLASMA UREALYTICUM | 2014 |
|
RU2553548C1 |
| РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ ЧАСТИЦА, ПРОДУЦИРУЮЩАЯ МОДИФИЦИРОВАННЫЕ НАНОАНТИТЕЛА, УЗНАЮЩИЕ МИКОПЛАЗМУ M.HOMINIS, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ ДЛЯ ТЕРАПИИ МИКОПЛАЗМОЗОВ | 2013 |
|
RU2562158C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ БАКТЕРИЙ ПО ГЕНУ РИБОСОМАЛЬНОЙ РНК | 2008 |
|
RU2386695C1 |
| Активный ингредиент лекарственного средства, лекарственное средство, фармацевтическая композиция и способ лечения демиелинизирующих заболеваний живого организма, включая профилактику заболевания | 2015 |
|
RU2631887C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ БАКТЕРИЙ Mycoplasma hominis ПО ГЕНУ РИБОСОМАЛЬНОЙ РНК | 2008 |
|
RU2386699C2 |
| ИНГИБИТОРЫ МОНОАМИНООКСИДАЗЫ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2007 |
|
RU2366430C2 |
Изобретение относится к фармацевтической промышленности, а именно к лекарственному средству для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis. Предлагается лекарственное средство для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, которое представляет собой хвойный хлорофилло-каротиновый комплекс, полученный из хвои на основе Pinus Sylvestris и Picea abies (L.) Karst; фармацевтическая композиция для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis; применение хвойного хлорофилло-каротинового комплекса для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis; способ лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis. Вышеописанное средство является эффективным для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis. 4 н. и 1 з.п. ф-лы, 7 табл., 11 пр.
1. Лекарственное средство для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, отличающееся тем, что оно представляет собой хвойный хлорофилло-каротиновый комплекс, полученный из хвои на основе Pinus Sylvestris и Picea abies (L.) Karst, взятых в соотношении 55:45, хвойный хлорофилло-каротиновый комплекс содержит воду в количестве 38-42 масс. %, сумму эстрактивных веществ 55-61 масс. %, сумму производных хлорофилла 0,6-1,2 масс. %, причем сумма экстрактивных веществ содержит: 42-47 масс. % свободных кислот, включая пинифиловую кислоту в количестве 16,5-21,4 масс. % от суммы свободных кислот, 53-58 масс. % нейтральных компонентов, включая, масс. % от суммы нейтральных компонентов: изоабиенол в количестве 19,3-24,4; сумму каротиноидов, выбранных из лютеина, зеаксантина, β-каротина, 0,3-0,5; воски 1,7-3,1; эфирные масла 0,6-0,9.
2. Фармацевтическая композиция для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, отличающаяся тем, что она содержит хвойный хлорофилло-каротиновый комплекс по п. 1 в терапевтически эффективном количестве и фармацевтически приемлемые носители и/или растворители.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в виде раствора, суспензии, капсулы, таблетки, гранулы, суппозитория.
4. Применение хвойного хлорофилло-каротинового комплекса по п. 1 для лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis.
5. Способ лечения урогенитальных заболеваний организма человека, вызванных микроорганизмами вида Mycoplasma hominis, отличающийся тем, что вводят эффективное количество хвойного хлорофилло-каротинового комплекса по п. 1 в суточной дозе для человека от 100 до 1280 мг.
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОПРОТОЗОЙНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRICHOMONAS VAGINALIS В МОДЕЛЬНОЙ СИСТЕМЕ IN VITRO | 2008 |
|
RU2366442C1 |
| СПОСОБ ПЕРЕРАБОТКИ ДРЕВЕСНОЙ ЗЕЛЕНИ СОСНЫ ОБЫКНОВЕННОЙ | 2008 |
|
RU2364409C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИТОР РОСТА HELICOBACTER PYLORI И СПОСОБ ПРОВЕДЕНИЯ АНТИХЕЛИКОБАКТЕРНОЙ ТЕРАПИИ | 2007 |
|
RU2367458C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ ИЗ ДРЕВЕСНОЙ ЗЕЛЕНИ СОСНЫ | 2004 |
|
RU2252769C1 |
Авторы
Даты
2019-02-05—Публикация
2017-11-30—Подача