Область техники, к которой относится изобретение
Настоящее изобретение относится к стабильным фармацевтическим композициям, которые содержат полипептиды, имеющие по меньшей мере два антигенсвязывающих домена и особенно пригодные для подкожного введения. Изобретение обеспечивает жидкие композиции, которые минимизируют образование нежелательных полипептидных агрегатов (димеры и/или мультимеры). Настоящее изобретение дополнительно обеспечивает способ минимизации агрегации полипептидов, имеющих антигенсвязывающие домены, в жидких композициях.
Уровень техники
Из уровня техники известна потребность стабилизации антител в растворе, то есть для предотвращения образования димеров и мультимеров (известных как высокомолекулярные или HMW агрегаты), для поддержания постоянной терапевтической эффективности. В WO 2011061712 описаны стабилизированные препараты антитела, которые, дополнительно к 25-250 мг/мл антитела, содержат 10-30 мМ буфера (предпочтительно ацетат, сукцинат, фосфат, гистидин или их комбинации), 1-15% полиола и также 0,001-0,05% смачивающего реагента. Значение рН композиций находится в диапазоне 5-7,5.
В WO 2010148337 (A1) ("Лиофилизированный препарат для мелкомодульных иммунологических фармацевтических средств") описаны композиции, которые известны как иммунофармацевтические средства на основе модульного белка малого размера (SMIP). Они представляют собой конструкции, состоящие из множественных слитых доменов, например, антигенсвязывающего домена, шарнирной области иммуноглобулина и CH2 или CH3 участка Ig молекулы или участка, имеющего происхождение из этих областей. Домены SMIP состоят из полипептидов, которые представляют собой продукты генных последовательностей, которые могут иметь происхождение от людей, отличающееся от людей или искусственное (созданные с помощью методов генной инженерии). Несмотря на то, что SMIP белки предпочтительно являются моноспецифическими, в заявке также описаны мультиспецифические варианты, например, молекулы Скорпиона. Они содержат SMIP белки, имеющие дополнительный С-концевой связывающий домен. Связывающие домены молекул Скорпиона связываются предпочтительно с различными целевыми структурами и, таким образом, пригодны в качестве иммуноспецифических терапевтических средств. В WO 2010148337 (A1) описаны стабильные препараты лиофилизированных композиций, содержащие SMIP, где меньше 7% SMIP присутствует в агрегированной форме. Указанные препараты дополнительно могут содержать буферные агенты, стабилизаторы, объемообразующие агенты, смачивающие реагенты и дополнительные наполнители. В WO 2009070642 А1 описаны различные препараты BiTE молекулы МТ103, первый связывающий домен которых связывается специфически с Т-клеточным рецепторным антигеном CD3, тогда как второй связывается специфически с В-клеточным антигеном CD19. BiTE молекулы являются стабильными в описанных композициях вплоть до максимальной концентрации 300 мкг/мл, при рН 7,0. Используемый буфер представляет собой цитрат. Препараты пригодны для внутривенного и подкожного введения. Биодоступность после подкожного введения составляет 10-50%.
IgG антитела имеют большие константные области (CH1-3/CL области), которые ответственны за большинство физико-химических свойств. IgG антитела, имеющие варьирующие специфичности, отличаются структурно главным образом в участке гипервариабельных антигенсвязывающих участков антителах (CDR1-CDR3) в пределах VL и VH участков. Структурные и физико-химические отличия между индивидуальными IgG вариантами относительно редко обуславливаются большими константными областями. Аналогично IgG антителам, SMIP молекулы, описанные WO 2010148337 (А1), содержат части константных доменов антитела.
В отличие от этого, BiTE молекулы, имеющие варьирующие специфичности, значительно отличающиеся по их физико-химическим свойствам. Как слитый белок, состоящий из двух одноцепочечных вариабельных фрагментов (scFv) из, как правило, различных иммуноглобулинов, в них отсутствуют постоянные CH1-3/CL области, и такие отличия в антигенсвязывающих доменах охватывают значительно большие участки BiTE молекул по сравнению с IgG или SMIP антителами. Аналогично, BiTE молекула МТ103 и BiTE молекулы, которые используются в настоящем изобретении, отличаются принципиально по их молекулярной структуре. В то время как домены в МТ103 упорядочены в последовательности VL-VH-VH-VL, расположение для BiTE молекул, которые предпочтительно используются в настоящем изобретении, представлено в форме VH-VL-VH-VL. Кроме того, последовательности обоих молекул отличаются в многочисленных положениях.
Эти свойства BiTE молекул и их небольшие размеры обуславливают отличительные свойства в физико-химическом поведении различных BiTE молекул. Это приводит к необходимости разработки индивидуальных препаратов (для повышения физико-химической стабильности) для каждого индивидуального применения, поскольку препараты индивидуальных BiTE или сходных молекул нельзя использовать, или можно использовать только с ограничениями, для альтернативных применений.
В одном варианте осуществления, полипептиды, представленные в композициях, представляют собой те, которые известны как биспецифические активаторы Т-клеток (Биспецифические активаторы Т-клеток (BiTE)). В специфическом варианте осуществления, BiTE имеют первый связывающий домен, который связывается специфически с 8 цепью Т-клеточного рецептор-CD3 комплекса, и второй связывающий домен, который связывается специфически с простатическим специфическим мембранным антигеном (PSMA). PSMA представляет собой интегральный мембранный белок II типа, которые экспрессируется в эпителиальных клетках предстательной железы с высокой специфичностью и, в случае рака предстательной железы, с повышенной интенсивностью. Кроме того, PSMA экспрессируется во вновь образованных кровеносных сосудах солидных опухолей. Таких образом, PSMA-BiTE опосредуют непосредственный контакт между цитотоксическими Т-клетками и их целевыми клетками.
Образование агрегатов в белках, например, BiTE молекулах, является нежелательным при применении в фармацевтике, например, вследствие образования агрегата может изменяться эффективность или доступность биологически активного компонента.
Это приводит к задаче обеспечения препарата, который предоставляет возможность стабилизировать BiTE молекулы таким образом, что подавляется образование нежелательных агрегатов.
В настоящей заявке и в пунктах формулы заявляется раствор и охватывается BiTE препарат, содержащий TRIS и фосфат. В его предпочтительном варианте осуществления, препарат содержит 50 мМ фосфата, 100 мМ TRIS, 0,04% полисорбата 80 и 4% дигидрата трегалозы при рН 6,0 и способен стабилизировать препараты с PSMA-BiTE1 молекулами относительно образования агрегатов. Это касается как низких концентраций в диапазоне ниже мкг/мл, так и высоких концентраций >2 мг/мл. Стабилизирующий эффект является неожиданным для квалифицированного специалиста в данной области техники, поскольку, например, цитрат, используемый в WO 2009070642 А1, даже в виде комбинации 50 мМ цитрат и 100 мМ TRIS при рН 6,0, не проявляет этого эффекта. Например, измеренная димерная фракция в сравнительной композиции, которая содержит только цитрат вместо фосфата, составляет 7,0%. В отличие от этого, композиция в соответствии с изобретением ограничивает димерную фракцию до 0,8% (ср. таблицы 6 и 7). Комбинированное применение TRIS и фосфата отвечает за стабилизирующий эффект композиций. Для стабилизации BiTE молекул относительно усилий сдвига также необходим смачивающий реагент, такой как полисорбат 80, в концентрации по меньшей мере 0,04%, поскольку без этого димерная фракция будет слишком большая (около 7,5%, см. таблицу 15). Для предотвращения абсорбции PSMA-BiTE1 молекулы на стенки сосудов шприцов для инъекций, инфузионных мешков, и др., достаточно иметь всего лишь 0,002% полисорбата 80.
Определения
Термин "антитело", используемый в настоящей заявке, относится к молекулам иммуноглобулинов, где каждая содержит две тяжелых (Н) и две легких (L) полипептидных цепи, которые связаны друг с другом с помощью дисульфидных связей. Каждая тяжелая цепь состоит из вариабельной области (VH) и константной области, которые в свою очередь состоят из трех доменов (CH1, CH2 и CH3). Каждая из легких цепей состоит из вариабельной области (VL) и константной области (CL). Вариабельные области как легких, так и тяжелых цепей (VH и VL) дополнительно подразделяются, в каждом случае, на три гипервариабельные связывающие области антитела (CDR1-CDR3) и в целом четыре консервативные области между CDR (FR1-FR4).
Термин "моноклональное антитело" описывает антитело, имеющее происхождение из популяции антител, которые являются идентичными за исключением относительно небольших, встречающихся в природе мутаций или пост-трансляционных модификаций. В отличие от поликлональных антител, как проявляется в виде части иммунной ответной реакции, моноклональные антитела нацелены на специфический эпитоп.
"Биспецифическое" или "бифункциональное антитело" представляет собой искусственное, гибридное антитело, имеющее две различных пары тяжелой и легкой цепи и также два различных антигенсвязывающих сайта.
Обработка антител папаином приводит к двум идентичным, антигенсвязывающим Fab фрагментам и к кристаллизуемому Fc фрагменту. "Fab фрагмент" состоит из целой VL цепи и части тяжелой цепи, то есть VH домена, содержащего вариабельную область и первый константный домен CH1. Таким образом, Fab фрагмент имеет индивидуальный антигенсвязывающий сайт. "Fc фрагмент" содержит карбокси-концевые части обеих тяжелых цепей, связанные с помощью дисульфидных связей. Части Fc фрагмента распознаются Fc рецепторами других клеток и определяются с помощью этих эффекторных функций антител.
Пепсин расщепляет антитела ниже дисульфидных связей, и таки образом два Fab фрагмента остаются связанными посредством шарнирной области и образуется одиночный "F(ab')2 фрагмент". Он имеет оба антигенсвязывающих сайта и, следовательно, способен, как и полное антитело, перекрестно связывать антиген.
Термин "домен" описывает сферический участок белка, имеющий определенную и независимо складчатую структуру. Легкие цепи IgG антитела состоят из двух доменов (в каждом случае, константный и вариабельный домен); тяжелые цепи состоят из четырех доменов (в каждом случае, три константных и одни вариабельный домен). Две вариабельные области каждая состоит из одного домена тяжелой цепи и одного домена легкой цепи.
Термин "эпитоп" или "антигенная детерминанта" описывает участок антигена, с которым специфически связывается антитело (или его антигенсвязывающий фрагмент). Эпитопы могут состоять из последовательных аминокислот, или непоследовательных аминокислот, которые находятся в непосредственной близости друг с другом в результате третичной укладки белка.
"Антиген" представляет собой молекулу (например, белок, полипептид, пептид, углевод), имеющий "антигенную детерминанту", с которой может связываться антитело.
Термин "конформация" относится к третичной структуре белка или полипептида, например, антитела, цепи антитела, домена или его части.
Антитело, которое "специфически связывается" с конкретным полипептидом или эпитопом на конкретном полипептиде, или является "специфическим для" этой структуры, связывание с альтернативными структурами значительно менее эффективно.
Термин "scFv антитело" в настоящей заявке относится к искусственно полученным фрагментам антитела, состоящим из ковалентно связанных VH и VL доменов антитела. Оба домена присутствуют в единичной полипептидной цепи и связаны друг с другом с помощью полипептидного линкера, состоящего из множества аминокислот. За исключением Fc-опосредованных эффекторных функций, scFv антитела сохраняют все функции антитела, более предпочтительно его селективность и аффиность.
Молекулы "биспецифических активаторов Т-клеток" (BiTE) представляют собой рекомбинантные белковые конструкции, состоящие из двух гибко связанных одноцепочечных антител (scFv). Одно из указанных scFv антител связывается специфически с выбранным, нацеленным клеточно-экспрессируемым опухолевым антигеном, а второе связывается специфически с CD3, субъединицей Т-клеточного рецепторного комплекса на Т-клетках. BiTE антитела способны связывать Т-клетки временно к клеткам-мишеням и, в то же время, активировать цитолитическую активность Т-клеток. Для BiTE-опосредованной активации Т-клеток нет необходимости в специфических Т-клеточных рецепторах на Т-клетках, ни в МНС I молекулах, пептидных антигенах или ко-стимулирующих молекулах на клетке-мишени.
Термины "стабильность" и "стабильный" в контексте соединений, содержащих BiTE молекулы, описывают устойчивость антител или их фрагментов к агрегации, деградации или фрагментации в заданных условиях относительно их продукции, приготовления, хранения, использования или транспортировки. "Стабильные" препараты в соответствии с настоящим изобретением сохраняют их биологическую активность при заданных условиях получения, приготовления, транспортировки, использования и хранения.
Белки, присутствующие в растворе (например, BiTE молекулы), чувствительны к механическому движению, как происходит при получении, заполнении контейнера и транспортировке. Выше определенной интенсивности движения, молекулы агрегируют и/или денатурируют. Таким образом, жидкие, содержащие белок композиции подвергаются процессу, который известен как встряхивающий стресс при механическом движении. Во "встряхивающем стрессовом тесте", контролированное применение механических (встряхивание) сил на жидких, содержащих белок композициях, используют для анализа агрегационного и денатурирующего поведения растворенного белка в различных композициях.
Поведение белка во встряхивающем стрессовом тесте является индикатором его физической стабильности относительно усилии сдвига, как происходит, например, при аспирации и инъекции раствором с помощью канюли.
"Лиофилизация" описывает способ сушки, который основывается на принципе сублимации. Вещество, подлежащее высушиванию, сначала охлаждают приблизительно до -45°С, после этого применяют вакуум и вещество нагревают приблизительно до -20°С. В результате этого, кристаллы льда сублимируют непосредственно в газообразное состояние, не проходя через промежуточную стадию жидкости. Вещество, высушенное таким образом, содержит, после второй стадии высушивания (все еще в вакууме) приблизительно при 25°С, меньше, чем 5% его исходной влажности и обозначается как "лиофилизат".
Перед введением пациенту, лиофилизат "восстанавливают", то есть растворяют в фармацевтически приемлемом разбавителе. "Восстановленный препарат" в контексте настоящего изобретения образовывается путем растворения лиофилизированного препарата антитела в таком разбавителе. После этого антитело в растворенной форме вводят пациенту.
"Полиолы" описывают группу органических соединений, которые содержат множественные гидроксильные группы (-ОН) (полиспирт, многоатомный спирт). Полиолы, такие как сахароза или трегалоза, представляют собой сахара, которые способны стабилизировать антитела и/или оказывать влияние на осмолярность композиции.
Для предотвращения нежелательной деградации или агрегации белков в процессе лиофилизации, добавляют так называемые "лиопротекторы". Они представляют собой, например, сахара или сахароспирты, такие как сахароза, манноза, трегалоза, глюкоза, сорбит, маннит. В контексте настоящего изобретения, трегалоза представляет собой лиопротектор, который используют предпочтительно.
Термин "смачивающий реагент" в настоящей заявке относится к любому детергенту, имеющему гидрофильный и гидрофобный участок, и включает неионные, катионные, анионные и цвиттерионные детергенты. Пригодные детергенты охватывают, например, полиоксиэтилен сорбитан моноолеат (также известен как полисорбат 80 или TWEEN 80), полиоксиэтилен сорбитан монолаурат (также известен как полисорбат 20 или TWEEN 20), или N-лаурилсаркозин. Для композиций, описанных в настоящей заявке, предпочтительным является неионный смачивающий реагент. Особенно предпочтительным является применение полисорбата 80 для композиций согласно настоящему изобретению. Смачивающий реагент можно использовать в концентрации от 0,002% до 0,1%.
Термин "буфер" описывает в настоящей заявке буферный раствор, рН которого изменяется только незначительно после добавления кислотных или щелочных веществ. Буферные растворы содержат смесь слабой кислоты и ее соответствующего основания или слабого основания и его соответствующей кислоты.
Термин "пациент" относится к (человеку или животному) индивидуумам, получающим профилактическое или терапевтическое лечение.
Термин "лечение" в настоящей заявке относится к применению или введению терапевтического вещества на /в пациента, или к применению или введению терапевтического вещества на /в изолированную ткань или на/в клеточную линию пациента, который страдает от заболевания, проявляет симптом заболевания, или имеет предрасположенность к заболеванию, с целью излечения, улучшения, влияния, остановки или облегчения заболевания, его симптомов или предрасположенности к заболеванию.
"Эффективная доза" описывает в настоящей заявке количество активного компонента, с которым можно достичь, по меньшей мере частично, желательного эффекта. Таким образом, "терапевтически эффективная доза" определяется как количество активного компонента, которого достаточно для по меньшей мере частичного излечения заболевания, или для по меньшей мере частичного устранения неблагоприятных эффектов у пациента, вызываемых заболеванием. Количества, действительно необходимые для этой цели, зависят от тяжести заболевания и общего иммунного статуса пациента.
Термин "биодоступность", как используется в настоящей заявке, описывает процент активного соединения или дозы медицинского продукта, который остается неизмененным в большом круге кровообращения. Таким образом, биодоступность представляет собой фактическое значение, указывающее на то, насколько быстро и до какой степени активный компонент абсорбируется и доступен в том участке действия. Согласно определению, медицинские продукты, которые вводят внутривенно, имеют биодоступность 100%.
Абсолютная биодоступность описывает биодоступность вещества, вводимого любым желательным (невнутривенным) образом по сравнению с внутривенным введением, в то время как относительную биодоступность получают путем сравнения биодоступностей для конкретных дозированных форм (например, пероральных относительно подкожных).
"Изотоническое соединение" имеет по существу такое же осмотическое давление, что и кровь человека. Таким образом, изотонические соединения имеют в целом осмотическое давление приблизительно от 250 до 350 мОсм. Термин "гипотонические" описывает композиции, которые имеют осмотическое давление ниже такого давления крови человека, в то время как "гипертонические" композиции имеют осмотическое давление выше такого давления крови человека.
Термин "высокомолекулярные агрегаты" (синоним: "HMW") описывает агрегаты, которые состоят из по меньшей мере двух белковых мономеров.
Термин "фосфаты", используемый в настоящей заявке, относится к водорастворимым, фармакологически безопасным солям трехосновной ортофосфорной кислоты (Н3РО4), предпочтительными является первичные (гидро-) и вторичные (дигидро-) фосфаты. Композиции в соответствии с изобретением содержат предпочтительно фосфаты натрия, особенно предпочтительно фосфорнокислый натрий двузамещенный (Na2HPO4).
Подробное описание
Изобретение относится к фармацевтическому препарату молекулы биспецифического активатора Т-клеток (BiTE), отличающегося тем, что он содержит трис(гидроксиметил)аминометан (TRIS) и фосфат.
BiTE молекулы известны из уровня техники. BiTE молекулы создают таким образом, чтобы они кратковременно привлекают цитотоксические Т-клетки для лизиса предпочтительных клеток-мишеней (см.  et al. Curr Opin Mol Ther. 2009 Feb; 11(1): 22-30.). Они в особенности пригодны для лечения злокачественного новообразования.
et al. Curr Opin Mol Ther. 2009 Feb; 11(1): 22-30.). Они в особенности пригодны для лечения злокачественного новообразования.
BiTE молекула представляет собой полипептид, который содержит два scFv связывающих домена антитела, где первый scFv связывающий домен способен связывать CD3 эпсилон человека и второй scFv связывающий домен связывать второй, другой поверхностный антиген. Предпочтительными являются поверхностные антигены раковых клеток человека. Особенно предпочтительными антигенами являются поверхностные белки раковых клеток человека. scFv связывающие домены могут содержать химерные, гуманизированные или человеческие фрагменты антитела. Предпочтительно, scFv связывающие домены содержат человеческие или гуманизированные фрагменты антитела.
BiTE молекулы, используемые в настоящем изобретении, отличаются от BiTE молекул (например, МТ103), как описано, например, в WO 2009070642 А1, тем, что первый связывающий домен может связываться с эпитопом человека и Callithrix jacchus, Saguinus oedipus или Saimiri sciureus CD3 эпсилон цепью, где эпитоп является частью аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 1, 2, 3 и 4 и эпитоп содержит по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu. Это предоставляет то преимущество, что облегчаются доклинические исследования, поскольку, например, фармакокинетические или токсикологические исследования можно осуществлять на вышеуказанных тестируемых животных, иммунная система которых сходна с иммунной системой человека. BiTE молекулы, имеющие эти характеристики, описаны, например, в WO 2008119566 А2 или WO 2008119567 А2.
Таким образом, в одном варианте осуществления, композиция в соответствии с изобретением содержит BiTE молекулы, первый связывающий домен которых может связываться с эпитопом человека и Callithrix jacchus, Saguinus oedipus или Saimiri sciureus CD3 эпсилон цепью, где эпитоп является частью аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 1, 2, 3 и 4 и эпитоп содержит по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu.
В SEQ ID NO: 5 представлена аминокислотная последовательность scFV связывающего домена, который соответствует вышеуказанным критериям.
В предпочтительном варианте осуществления, первый связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 5.
scFV содержит аминокислоты вариабельной легкой (VL) и вариабельной тяжелой (VH) цепи антитела. BITE молекулы могут быть сконструированы в различной ориентации. BiTE молекула МТ103 имеет, например, (VL-VH) связывающий домен 2 - (VH-VL) связывающий домен 1 расположение scFVs.
Другие ориентации также возможны, например, (VH-VL) связывающий домен 2 - (VH-VL) связывающий домен 1.
В предпочтительном варианте осуществления, полипептид имеет расположение (VH-VL) связывающий домен 2 - (VH-VL) связывающий домен 1.
В особенно предпочтительном варианте осуществления, полипептид имеет расположение (VH-VL) связывающий домен 2 - (VH-VL) связывающий домен 1, с (VH-VL) связывающим доменом 1, содержащим аминокислотную последовательность, представленную в SEQ ID NO: 5.
Один вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, отличающуюся тем, что второй связывающий домен может связываться с антигеном клеточной поверхности. Антиген клеточной поверхности представляет собой антиген, который может связываться связывающим белком, например, антителом или scFv, без лизирования клетки.
Один вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, отличающуюся тем, что второй связывающий домен полипептида может связываться с поверхностным антигеном злокачественной клетки.
В дальнейшем варианте осуществления, второй связывающий домен полипептида связывается с поверхностным антигеном простатическим специфическим мембранным антигеном человека (PSMA, SWISS-PROT: FOLH1_HUMAN, рег. №: Q04609). Такие BiTE молекулы описаны, например, в WO 2010037836 А2.
В SEQ ID NO: 6 описан связывающий домен, который связывается с PSMA.
В предпочтительном варианте осуществления, второй связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 6.
Один вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, содержащую полипептид, который содержит первый и второй scFv связывающий домен, где первый связывающий домен содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, отличающуюся тем, что композиция дополнительно содержит TRIS и фосфат.
Один вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, отличающуюся тем, что связывающие домены полипептида содержат человеческие или гуманизированные scFv фрагменты антитела.
Один вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, отличающуюся тем, что второй PSMA-связывающий связывающий домен содержит аминокислотную последовательность, представленную в SEQ ID NO: 6.
В одном варианте осуществления, полипептид содержит аминокислотные последовательности первого и второго связывающего домена, кодируемые последовательностями, представленными в SEQ ID NO: 5 и SEQ ID NO: 6.
Полипептид, который содержит последовательности, представленные в SEQ ID NO: 5 и SEQ ID NO: 6 представленные в SEQ ID NO: 7 или SEQ ID NO: 8.
Предпочтительный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 7.
Особенно предпочтительный полипептид представляет собой PSMA-BiTE 1 молекулу, которая кодируется аминокислотной последовательностью, представленной в SEQ ID NO: 8.
Предпочтительный вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, содержащую полипептид, TRIS и фосфат, с полипептидом, содержащим аминокислотную последовательность, представленную в SEQ ID NO: 7.
Особенно предпочтительный вариант осуществления настоящего изобретения представляет собой жидкую фармацевтическую композицию, содержащую полипептид, TRIS и фосфат, с полипептидом, содержащим аминокислотную последовательность, представленную в SEQ ID NO: 8.
В одном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 0,5 мкг/мл, приблизительно 0,7 мкг/мл, приблизительно 1 мкг/мл, приблизительно 2 мкг/мл, приблизительно 5 мкг/мл, приблизительно 6 мкг/мл, приблизительно 10 мкг/мл, приблизительно 15 мкг/мл, приблизительно 18 мкг/мл, приблизительно 20 мкг/мл, приблизительно 25 мкг/мл, приблизительно 30 мкг/мл, приблизительно 30 мкг/мл, приблизительно 35 мкг/мл, приблизительно 40 мкг/мл, приблизительно 45 мкг/мл, приблизительно 50 мкг/мл, приблизительно 55 мкг/мл, приблизительно 60 мкг/мл, приблизительно 70 мкг/мл, приблизительно 80 мкг/мл, приблизительно 90 мкг/мл, приблизительно 100 мкг/мл, приблизительно 110 мкг/мл, приблизительно 120 мкг/мл, приблизительно 130 мкг/мл, приблизительно 140 мкг/мл, приблизительно 150 мкг/мл, приблизительно 160 мкг/мл, приблизительно 170 мкг/мл, приблизительно 180 мкг/мл, приблизительно 190 мкг/мл, приблизительно 200 мкг/мл, приблизительно 225 мкг/мл, приблизительно 275 мкг/мл, приблизительно 300 мкг/мл, приблизительно 325 мкг/мл, приблизительно 350 мкг/мл, приблизительно 375 мкг/мл, приблизительно 400 мкг/мл, приблизительно 500 мкг/мл, приблизительно 700 мкг/мл, приблизительно 900 мкг/мл, или приблизительно 1000 мкг/мл вышеуказанных полипептидов.
В одном варианте осуществления, композиция в соответствии с изобретением содержит 0,5 мкг/мл, 0,7 мкг/мл, 1 мкг/мл, 2 мкг/мл, 5 мкг/мл, 6 мкг/мл, 10 мкг/мл, 15 мкг/мл, 18 мкг/мл, 20 мкг/мл, 25 мкг/мл, 30 мкг/мл, 30 мкг/мл, 35 мкг/мл, 40 мкг/мл, 45 мкг/мл, 50 мкг/мл, 55 мкг/мл, 60 мкг/мл, 70 мкг/мл, 80 мкг/мл, 90 мкг/мл, 100 мкг/мл, 110 мкг/мл, 120 мкг/мл, 130 мкг/мл, 140 мкг/мл, 150 мкг/мл, 160 мкг/мл, 170 мкг/мл, 180 мкг/мл, 190 мкг/мл, 200 мкг/мл, 225 мкг/мл, 275 мкг/мл, 300 мкг/мл, 325 мкг/мл, 350 мкг/мл, 375 мкг/мл, 400 мкг/мл, 500 мкг/мл, 700 мкг/мл, 900 мкг/мл, или 1000 мкг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 1 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,8 мг/мл, приблизительно 2 мг/мл, приблизительно 2,3 мг/мл, приблизительно 2,5 мг/мл, приблизительно 2,8 мг/мл, приблизительно 3 мг/мл, приблизительно 3,5 мг/мл, приблизительно 4 мг/мл, приблизительно 5 мг/мл, приблизительно 6 мг/мл, приблизительно 7 мг/мл, приблизительно 8 мг/мл, приблизительно 9 мг/мл или приблизительно 10 мг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит 1 мг/мл, 1,3 мг/мл, 1,5 мг/мл, 1,8 мг/мл, 2 мг/мл, 2,3 мг/мл, 2,5 мг/мл, 2,8 мг/мл, 3 мг/мл, 3,5 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл или 10 мг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 1 мкг/мл, от приблизительно 1 мкг/мл до приблизительно 5 мкг/мл, от приблизительно 5 мкг/мл до приблизительно 10 мкг/мл, от приблизительно 10 мкг/мл до приблизительно 20 мкг/мл, от приблизительно 20 мкг/мл до приблизительно 50 мкг/мл, от приблизительно 50 мкг/мл до приблизительно 90 мкг/мл, от приблизительно 90 мкг/мл до приблизительно 120 мкг/мл, от приблизительно 120 мкг/мл до приблизительно 150 мкг/мл, от приблизительно 150 мкг/мл до приблизительно 180 мкг/мл, от приблизительно 180 мкг/мл до приблизительно 200 мкг/мл, от приблизительно 200 мкг/мл до приблизительно 250 мкг/мл, от приблизительно 250 мкг/мл до приблизительно 280 мкг/мл, от приблизительно 280 мкг/мл до приблизительно 300 мкг/мл, или от приблизительно 300 мкг/мл до приблизительно 350 мкг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от 0,5 мкг/мл до 1 мкг/мл, от 1 мкг/мл до 5 мкг/мл, от 5 мкг/мл до 10 мкг/мл, от 10 мкг/мл до 20 мкг/мл, от 20 мкг/мл до 50 мкг/мл, от 50 мкг/мл до 90 мкг/мл, от 90 мкг/мл до 120 мкг/мл, от 120 мкг/мл до 150 мкг/мл, от 150 мкг/мл до 180 мкг/мл, от 180 мкг/мл до 200 мкг/мл, от 200 мкг/мл до 250 мкг/мл, от 250 мкг/мл до 280 мкг/мл, от 280 мкг/мл до 300 мкг/мл, или from 300 мкг/мл до 350 мкг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от приблизительно 350 мкг/мл до приблизительно 1 мг/мл, от приблизительно 350 мкг/мл до приблизительно 1,3 мг/мл, от приблизительно 350 мкг/мл до приблизительно 1,5 мг/мл, от приблизительно 350 мкг/мл до приблизительно 1,8 мг/мл, от приблизительно 350 мкг/мл до приблизительно 2 мг/мл, от приблизительно 350 мкг/мл до приблизительно 2,3 мг/мл, от приблизительно 350 мкг/мл до приблизительно 2,5 мг/мл, от приблизительно 350 мкг/мл до приблизительно 2,8 мг/мл, от приблизительно 350 мкг/мл до приблизительно 3,0 мг/мл, от приблизительно 350 мкг/мл до приблизительно 3,5 мг/мл, от приблизительно 350 мкг/мл до приблизительно 5 мг/мл, или от приблизительно 350 мкг/мл до приблизительно 10 мг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от 350 мкг/мл до 1 мг/мл, от 350 мкг/мл до 1,3 мг/мл, от 350 мкг/мл до 1,5 мг/мл, от 350 мкг/мл до 1,8 мг/мл, от 350 мкг/мл до 2 мг/мл, от 350 мкг/мл до 2,3 мг/мл, от 350 мкг/мл до 2,5 мг/мл, от 350 мкг/мл до 2,8 мг/мл, от 350 мкг/мл до 3,0 мг/мл, от 350 мкг/мл до 3,5 мг/мл, от 350 мкг/мл до 5 мг/мл, или from 350 мкг/мл до 10 мг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от 0,5 мкг/мл до 10 мг/мл, от 0,5 мкг/мл до 5 мг/мл, от 0,5 мкг/мл до 3,5 мг/мл, от 0,5 мкг/мл до 3,0 мг/мл, от 0,5 мкг/мл до 2,8 мг/мл, от 0,5 мкг/мл до 2,5 мг/мл, от 0,5 мкг/мл до 2,3 мг/мл, от 0,5 мкг/мл до 2,0 мг/мл, от 0,5 мкг/мл до 1,8 мг/мл, от 0,5 мкг/мл до 1,5 мг/мл, от 0,5 мкг/мл до 1,3 мг/мл, от 0,5 мкг/мл до 1,0 мг/мл, от 0,5 мкг/мл до 350 мкг/мл, от 0,5 мкг/мл до 300 мкг/мл, от 0,5 мкг/мл до 250 мкг/мл BiTE молекул.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 3,0 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 2,8 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 2,5 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 2,3 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 2,0 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 1,3 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 1,0 мг/мл, от приблизительно 0,5 мкг/мл до приблизительно 350 мкг/мл, от приблизительно 0,5 мкг/мл до приблизительно 300 мкг/мл, от приблизительно 0,5 мкг/мл до приблизительно 250 мкг/мл BiTE молекул.
В особенно предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит комбинацию трис(гидроксиметил)аминометана (TRIS) и фосфата в качестве забуферивающих, влияющих на рН агентов.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит TRIS в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 150 мМ, или приблизительно 200 мМ, или приблизительно 250 мМ, или приблизительно 300 мМ и фосфат в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 150 мМ, или приблизительно 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит TRIS в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ, или 250 мМ, или 300 мМ и фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит фосфат в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 110 мМ, или приблизительно 120 мМ, или приблизительно 130 мМ, или приблизительно 140 мМ, или приблизительно 150 мМ, или приблизительно 160 мМ, или приблизительно 170 мМ, или приблизительно 180 мМ, или приблизительно 190 мМ, или приблизительно 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 110 мМ, или 120 мМ, или 130 мМ, или 140 мМ, или 150 мМ, или 160 мМ, или 170 мМ, или 180 мМ, или 190 мМ, или 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и TRIS в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ, или 250 мМ, или 300 мМ и фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и фосфат в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 110 мМ, или приблизительно 120 мМ, или приблизительно 130 мМ, или приблизительно 140 мМ, или приблизительно 150 мМ, или приблизительно 160 мМ, или приблизительно 170 мМ, или приблизительно 180 мМ, или приблизительно 190 мМ, или приблизительно 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 110 мМ, или 120 мМ, или 130 мМ, или 140 мМ, или 150 мМ, или 160 мМ, или 170 мМ, или 180 мМ, или 190 мМ, или 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и TRIS в концентрации приблизительно 100 мМ и фосфат в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 110 мМ, или приблизительно 120 мМ, или приблизительно 130 мМ, или приблизительно 140 мМ, или приблизительно 150 мМ, или приблизительно 160 мМ, или приблизительно 170 мМ, или приблизительно 180 мМ, или приблизительно 190 мМ, или приблизительно 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и TRIS в концентрации приблизительно 100 мМ и фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 110 мМ, или 120 мМ, или 130 мМ, или 140 мМ, или 150 мМ, или 160 мМ, или 170 мМ, или 180 мМ, или 190 мМ, или 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и фосфат в концентрации приблизительно 50 мМ и TRIS в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 150 мМ, или приблизительно 200 мМ, или приблизительно 250 мМ, или приблизительно 300 мМ и фосфат в концентрации приблизительно 10 мМ, или приблизительно 20 мМ, или приблизительно 30 мМ, или приблизительно 40 мМ, или приблизительно 50 мМ, или приблизительно 60 мМ, или приблизительно 70 мМ, или приблизительно 80 мМ, или приблизительно 90 мМ, или приблизительно 100 мМ, или приблизительно 150 мМ, или приблизительно 200 мМ.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл полипептидов в соответствии с изобретением и фосфат в концентрации приблизительно 50 мМ и TRIS в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ, или 250 мМ, или 300 мМ и фосфат в концентрации 10 мМ, или 20 мМ, или 30 мМ, или 40 мМ, или 50 мМ, или 60 мМ, или 70 мМ, или 80 мМ, или 90 мМ, или 100 мМ, или 150 мМ, или 200 мМ.
В предпочтительном варианте осуществления, рН композиции в соответствии с изобретением находится в диапазоне от приблизительно 5,0 до приблизительно 7,0, или в диапазоне от приблизительно 5,0 до приблизительно 6,5. Особенно предпочтительно, рН композиции в соответствии с изобретением составляет 6,0. Предпочтительно, рН композиции в соответствии с изобретением доводят с помощью HCl.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением дополнительно содержит смачивающий реагент. Примерами смачивающих реагентов являются неионные смачивающие реагенты, такие как полисорбаты (например, полисорбат 20 или 80); полоксамеры (например, полоксамер 188); Тритон; натрий октил гликозид; лаурил, миристил, линолеил, или стеарил сульфобетаин; лауросаркозин, миристоилсаркозин, линолеоилсаркозин, или стеароилсаркозин; линолеил, миристил, или цетил бетаин; лауроамидопропил, кокамидопропил, линолеамидопропил, миристамидопропил, пальмитамидопропил, или изостеарамидопропил бетаин; полиэтилен гликоль; полипропилен гликоль; и сополимеры этилен и пропилен гликоля (например, Pluronics, PF68). В предпочтительном варианте осуществления, смачивающий реагент представляет собой полисорбат 80.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением содержит смачивающий реагент в концентрации от 0,002% до 0,1%, предпочтительно от 0,04% до 0,1%.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит полисорбат 80 в концентрации от 0,002% до 0,1%, предпочтительно от 0,04% до 0,1%. Особенно предпочтительно, композиция в соответствии с изобретением содержит полисорбат 80 в концентрации 0,04%.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением дополнительно содержит лиопротектор. В дальнейшем варианте осуществления, композиция в соответствии с изобретением дополнительно содержит сахар или сахароспирт в качестве лиопротектора. Лиопротектор предпочтительно представляет собой трегалозу или дигидрат трегалозы. В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит лиопротектор в концентрации от 2% до 10%, особенно предпочтительно 4%.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит трегалозу в концентрации от 2% до 10%, особенно предпочтительно 4%.
В особенно предпочтительном варианте осуществления, композиция в соответствии с изобретением содержит дигидрат трегалозы в концентрации от 2% до 10%, особенно предпочтительно 4%.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ, фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 50 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 50 мкг/мл до приблизительно 1 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 100 мкг/мл до приблизительно 500 мкг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Особенно предпочтительно, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, Na2HPO4 в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и дигидрат трегалозы в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ, фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 0,5 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 50 мкг/мл до приблизительно 2 мг/мл PSMA-BiTE 1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 50 мкг/мл до приблизительно 1 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит от приблизительно 100 мкг/мл до приблизительно 500 мкг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, фосфат в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Предпочтительно, композиция в соответствии с изобретением содержит приблизительно 2 мг/мл PSMA-BiTE1 молекул и TRIS в концентрации приблизительно 100 мМ, Na2HPO4 в концентрации приблизительно 50 мМ, полисорбат 80 в концентрации 0,04% и трегалозу в концентрации 4%, и рН равно 6,0.
Указанные концентрации в процентах (%) относятся к концентрации по массе (масс/объем).
Дополнительно, композиции в соответствии с изобретением могут содержать еще другие фармацевтически приемлемые добавки (Remington's Pharmaceutical Sciences; 18-ое изд., Mack Publishing Co., Easton, PA, USA). Такие добавки представляют собой, например, консерванты или антиоксиданты. Антиоксиданты, которые можно использовать, представляют собой, например, аскорбат, метионин, витамин Е, или метабисульфит натрия. Консерванты представляют собой, например, вещества, которые подавляют или замедляют рост микроорганизмов. Такое вещество представляет собой, например, тиомерсал.
Один вариант осуществления настоящего изобретения представляет собой твердую смесь, которую получают путем лиофилизации композиции в соответствии с изобретением, или может быть получена по меньшей мере путем лиофилизации указанной композиции.
Предпочтительный вариант осуществления настоящего изобретения представляет собой лиофилизат, получаемый путем сушки вымораживанием композиции в соответствии с изобретением.
Предпочтительный вариант осуществления настоящего изобретения представляет собой лиофилизат, полученный путем сушки вымораживанием композиции в соответствии с изобретением, как указано в протоколе, описанном в примере 16.
В дальнейшем варианте осуществления, композиция в соответствии с изобретением обеспечивают путем восстановления лиофилизированной твердой смеси путем растворения в подходящей жидкой среде.
В предпочтительном варианте осуществления, композиция в соответствии с изобретением обеспечивают путем восстановления лиофилизированной твердой смеси путем растворения в воде, предпочтительно стерильной воде.
Изобретение дополнительно обеспечивает продукт, который содержит одну из композиций в соответствии с изобретением и предпочтительно также инструкции по применению. В одном варианте осуществления, продукт содержит контейнер, который содержит одну из вышеперечисленных композиций. Пригодные контейнеры представляют собой, например, флаконы, ампулы, пробирки или шприцы. Контейнеры могут быть, например, из стекла или пластика. Шприцы могут содержать иглу для инъекций, изготовленную, например, из металла.
В одном варианте осуществления, контейнер представляет собой шприц. В дальнейшем варианте осуществления, шприц содержится в устройстве для инъекции. В предпочтительном варианте осуществления, устройство для инъекции представляет собой автоматический медицинский шприц. Автоматический медицинский шприц может быть описан как прибор для инъекций, который, после активации, вводит свое содержимое без дополнительных манипуляций пациенту или другому лицу. В настоящем изобретении, введение предпочтительно является подкожным.
Композиции в соответствии с изобретением проявляют повышенную стабильность и значительно повышенную биодоступность по сравнению с препаратами, доступными из уровня техники для BiTE молекул. Благодаря этому профилю свойств, композиции в соответствии с изобретением чрезвычайно пригодны для парентерального введения. Парентеральное введение включает, в частности, внутривенную инъекцию или инфузию, внутриартериальную инъекцию или инфузию (в артерию), внутримышечную инъекцию, интратекальную инъекцию, подкожную инъекцию, внутрибрюшинную инъекцию или инфузию, внутрикостное введение или инъекцию в ткань. Композиции в соответствии с изобретением особенно пригодны для подкожного введения. Один вариант осуществления композиции в соответствии с изобретением отличается тем, что биодоступность полипептида после подкожного введения композиции составляет >60%; предпочтительно, то есть биодоступность в макак-крабоедов.
Композиции в соответствии с изобретением обладают ценными фармакологическими свойствами и могут использоваться для предотвращения и лечения заболеваний у людей и животных.
Композиции в соответствии с изобретением пригодны в целом для лечения гиперпролиферативных заболеваний у людей и млекопитающих. Гиперпролиферативные заболевания, для лечения которых возможно использовать композиции в соответствии с изобретением, принадлежат, в частности, к группе злокачественных новообразований и опухолевых заболеваний. В контексте настоящего изобретения, под ними подразумеваются, в особенности, следующие заболевания, но не ограничиваясь только ими: карциномы молочной железы и опухоли молочной железы (протоковые и дольковые формы, также in situ), опухоли дыхательной системы (мелкоклеточные и немелкоклеточные карциномы, бронхиальная карцинома), опухоли головного мозга (например, ствола мозга и гипоталамуса, астроцитома, медуллобластома, эпендимома и нейро-эктодермальные опухоли и опухоли шишковидного тела), опухоли пищеварительной системы (пищевода, желудка, желчного пузыря, тонкого кишечника, толстого кишечника, прямой кишки), опухоли печени (в частности, печеночно-клеточный рак, холангиокарцинома и смешанная печеночно-клеточная холангиокарцинома), опухоли головы и шеи (гортани, гортаноглотки, носоглотки, ротоглотки, губ и полости рта), опухоли кожи (плоскоклеточный рак, саркома Капоши, злокачественная меланома, рак клеток Меркеля и немеланомный рак кожи), опухоли мягких тканей (в частности, саркомы мягких тканей, остеосаркомы, злокачественные фиброзные гистиоцитомы, лимфосаркомы и рабдомиосаркомы), опухоли глаз (в частности, внутриглазная меланома и ретинобластома), опухоли эндокринных и экзокринных желез (например, щитовидной и паращитовидной желез, поджелудочной железы и слюнных желез), опухоли мочевых путей (опухоли мочевого пузыря, пениса, почек, почечной лоханки и мочеточника) и опухоли репродуктивных органов (карциномы эндометрия, шейки матки, яичников, влагалища, наружных женских половых органов и матки у женщин и карциномы предстательной железы и яичек у мужчин). Они также включают пролиферативные болезни крови в солидной форме и в виде циркулирующих клеток крови, такие как лимфомы, лейкозы и миелопролиферативные заболевания, например, острый миелоидный, острый лимфобластный, хронический лимфоцитарный, хронический миелогенный и волосатоклеточный лейкоз, и связанные со СПИДом лимфомы, ходжкинские лимфомы, не-ходжкинские лимфомы, кожные Т-клеточные лимфомы, лимфомы Беркитта и лимфомы в центральной нервной системе.
Предпочтительными заболеваниями, для лечения которых возможно использовать композиции в соответствии с изобретением, представляют собой карциномы и/или метастазы, которые экспрессируют PSMA антиген.
Особенно предпочтительным заболеванием, для лечения которого возможно использовать композиции в соответствии с изобретением, выбирают из группы, включающей рак предстательной железы, костные метастазы рака предстательной железы и метастазы в мягкие ткани рака предстательной железы.
Другим особенно предпочтительным заболеванием, для лечения которого возможно использовать композиции в соответствии с изобретением, является рак предстательной железы.
Эти хорошо описанные заболевания у людей также могут встречаться со сравнимой этиологией у других животных и их можно лечить с помощью композиций согласно настоящему изобретению.
В контексте настоящего изобретения, термин "лечение" или "лечить" используется в общепринятом значении и обозначает оказание помощи, заботу и уход за пациентом с целью борьбы, уменьшения, ослабления или облегчения заболевания или нарушения состояния здоровья, и улучшения качества жизни, ухудшенного этим заболеванием, как, например, в случае злокачественного новообразования.
Таким образом, настоящее изобретение дополнительно обеспечивает применение композиций в соответствии с изобретением для лечения и/или предотвращения заболеваний, более предпочтительно вышеуказанных заболеваний.
Настоящее изобретение дополнительно обеспечивает применение композиций в соответствии с изобретением для получения лекарственного средства для лечения и/или предотвращения заболеваний, более предпочтительно вышеуказанных заболеваний.
Настоящее изобретение дополнительно обеспечивает применение композиций в соответствии с изобретением в способе лечения и/или предотвращения заболеваний, более предпочтительно вышеуказанных заболеваний.
Настоящее изобретение дополнительно обеспечивает способ лечения и/или предотвращения заболеваний, более предпочтительно вышеуказанных заболеваний, используя эффективное количество одной из композиций в соответствии с изобретением.
В предпочтительном варианте осуществления, лечение и/или предотвращение предусматривает парентеральное введение композиции в соответствии с изобретением. Особенно предпочтительным является подкожное введение.
Композиции в соответствии с изобретением можно использовать отдельно или, при необходимости, в комбинации с одним или несколькими другими фармакологически активными веществами, при условии, что эти комбинации не приводят к нежелательным и неприемлемым побочным эффектам. Следовательно, настоящее изобретение дополнительно обеспечивает лекарственные средства, содержащие по меньшей мере одну из композиций в соответствии с изобретением и один или более других активных компонентов, в особенности для лечения и/или предотвращения вышеуказанных заболеваний. Например, соединения согласно настоящему изобретению можно комбинировать с известными анти-гиперпролиферативными, цитостатическими или цитотоксическими веществами для лечения злокачественных новообразований.
Изобретение дополнительно обеспечивает применение вышеуказанных композиций в терапевтическом способе, где композиция является пригодной для парентеральных форм введения, таких как внутривенная инъекция или инфузия, внутриартериальная инъекция или инфузия (в артерию), внутримышечная инъекция, интратекальная инъекция, подкожная инъекция, внутрибрюшинная инъекция или инфузия, внутрикостное введение или инъекция в ткань.
Изобретение дополнительно обеспечивает применение вышеуказанных композиций в способе для терапевтического лечения пролиферативных заболеваний клеток предстательной железы.
Изобретение дополнительно обеспечивает применение вышеуказанных композиций в способе для терапевтического лечения пролиферативных заболеваний клеток предстательной железы, где композиция является пригодной для подкожного введения.
Изобретение дополнительно обеспечивает применение вышеуказанных композиций в способе для терапевтического лечения пролиферативных заболеваний клеток предстательной железы, где композицию вводят путем подкожного введения.
Изобретение дополнительно обеспечивает способ стабилизации полипептидов, содержащих продукт одной из вышеуказанных композиций, который содержит, дополнительно к полипептидам, по меньшей мере TRIS и фосфат, и имеет рН 6,0.
Изобретение дополнительно обеспечивает набор, который содержит вышеуказанные композиции.
Предпочтительные соединения в контексте настоящего изобретения представляют собой фармацевтические соединения.
Варианты осуществления
Один вариант осуществления настоящего изобретения включает жидкую фармацевтическую композицию, содержащую полипептид, TRIS и фосфат, где полипептид содержит два scFv связывающих домена антитела, первый scFv связывающий домен способен связываться с CD3 эпсилон человека.
В дальнейшем варианте осуществления композиции, второй связывающий домен полипептида может связываться с антигеном клеточной поверхности.
В дальнейшем варианте осуществления композиции, полипептид содержит второй связывающий домен, который может связываться с поверхностным антигеном злокачественной клетки.
В дальнейшем варианте осуществления, поверхностный антиген, с которым может связываться второй связывающий домен полипептида, представляет собой простатический специфический мембранный антиген (PSMA).
В дальнейшем варианте осуществления композиции, полипептид имеет расположение (VH-VL) связывающий домен 2 - (VH-VL) связывающий домен 1.
В дальнейшем варианте осуществления композиции, первый связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 5.
В дальнейшем варианте осуществления композиции, второй, PSMA-связывающий связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 6.
В дальнейшем варианте осуществления, композиция содержит полипептид, TRIS и фосфат, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 7.
В дальнейшем варианте осуществления, композиция содержит полипептид, TRIS и фосфат, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 5 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 3,5 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 3,0 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 2,5 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 2,0 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 1,8 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 1,5 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,35 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,3 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,25 мг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,2 мг/мл.
В дальнейшем варианте осуществления, композиция содержит PSMA-BiTE1 в концентрации от 50 мкг/мл до 1 мг/мл.
В дальнейшем варианте осуществления, композиция содержит PSMA-BiTE1 в концентрации от 50 мкг/мл до 500 мкг/мл.
В дальнейшем варианте осуществления, композиция содержит PSMA-BiTE1 в концентрации от 100 мкг/мл до 500 мкг/мл.
В дальнейшем варианте осуществления, композиция содержит полипептид в концентрации приблизительно 2 мг/мл.
В дальнейшем варианте осуществления, композиция содержит TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ и фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ.
В дальнейшем варианте осуществления, композиция содержит 100 мМ TRIS и 50 мМ фосфат.
В дальнейшем варианте осуществления, рН композиции находится в диапазоне от приблизительно 5,0 до приблизительно 7,0.
В дальнейшем варианте осуществления, рН композиции находится в диапазоне от приблизительно 5,0 до приблизительно 6,5.
В дальнейшем варианте осуществления, рН композиции находится в диапазоне от приблизительно 5,5 до приблизительно 6,5.
В дальнейшем варианте осуществления, рН композиции составляет приблизительно 6,0.
В дальнейшем варианте осуществления, рН композиции доводят с помощью соляной кислоты.
В дальнейшем варианте осуществления, композиция дополнительно содержит смачивающий реагент.
В дальнейшем варианте осуществления, смачивающий реагент представляет собой полисорбат 80.
В дальнейшем варианте осуществления, композиция дополнительно содержит от 0,002% до 0,1% полисорбата 80.
В дальнейшем варианте осуществления, композиция дополнительно содержит от 0,04% до 0,1% полисорбата 80.
В дальнейшем варианте осуществления, композиция дополнительно содержит 0,04% полисорбата 80.
В дальнейшем варианте осуществления, композиция дополнительно содержит лиопротектор.
В дальнейшем варианте осуществления, композиция содержит трегалозу или предпочтительно дигидрат трегалозы в качестве лиопротектора.
В дальнейшем варианте осуществления, композиция дополнительно содержит от 4% до 10% трегалозы или предпочтительно от 4% до 10% дигидрата трегалозы.
В дальнейшем варианте осуществления, композиция дополнительно содержит приблизительно 4% трегалозы или предпочтительно дополнительно приблизительно 4% дигидрата трегалозы.
В предпочтительном варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 1 мг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
В предпочтительном варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 500 мкг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
В предпочтительном варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 500 мкг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ Na2HPO4, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
В дальнейшем варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 1 мг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% трегалозы.
В дальнейшем варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 500 мкг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% трегалозы.
В дальнейшем варианте осуществления, композиция имеет рН 6 и содержит от 50 мкг/мл до 500 мкг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ Na2HPO4, 0,04% полисорбата 80 и 4% трегалозы.
В предпочтительном варианте осуществления композиции, полипептид имеет биоактивность по меньшей мере 90% и предпочтительно по меньшей мере 96% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и дальнейшим восстановлением и хранением (7 дней при 2-8°С и после этого 16 часов при 20°С±5°С, как описано в примере 21).
В предпочтительном варианте осуществления композиции, полипептид имеет биоактивность по меньшей мере 90% и предпочтительно по меньшей мере 96% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и хранением в течение 3 месяцев или 12 месяцев.
В предпочтительном варианте осуществления композиции, полипептид имеет биоактивность по меньшей мере 97% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и хранением в течение 3 месяцев при 6°С или 12 месяцев при 6°С.
В предпочтительном варианте осуществления композиции, полипептид имеет содержание мономера (SEC) более, чем 96% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие инъекции.
В предпочтительном варианте осуществления композиции, полипептид имеет содержание димера и мультимера (SEC) не более чем 4% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие медленной или быстрой инъекции, используя иглу.
В предпочтительном варианте осуществления композиции, полипептид имеет содержание димера и мультимера (SEC) не более чем 4% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие медленной или быстрой инъекции, используя иглу (калибр: 30 G; длина иглы: 13 мм).
Один вариант осуществления настоящего изобретения включает твердую смесь, получаемую путем лиофилизации жидкой композиции.
В дальнейшем варианте осуществления, композицию восстанавливают путем растворения лиофилизированной твердой смеси в соответствии с изобретением в подходящей жидкой среде.
В дальнейшем варианте осуществления, биодоступность полипептида после подкожного введения композиции составляет >60%.
В дальнейшем варианте осуществления, композицию используют в терапевтическом способе.
В дальнейшем варианте осуществления, композицию используют в терапевтическом способе, указанный способ включает парентеральное введение композиции.
В дальнейшем варианте осуществления, композицию используют в способе для терапевтического лечения гиперпролиферативных заболеваний.
В дальнейшем варианте осуществления, композицию используют в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы.
В дальнейшем варианте осуществления, композицию используют в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы, где способ включает подкожное введение композиции.
В дальнейшем варианте осуществления, настоящее изобретение охватывает способ стабилизации полипептидов, включающий получение композиции, которая содержит, дополнительно к полипептидам, по меньшей мере TRIS и фосфат, и имеет рН 6,0.
В дальнейшем варианте осуществления, настоящее изобретение содержит набор, содержащий вышеописанную композицию.
Предпочтительными вариантами осуществления являются
1. Жидкая фармацевтическая композиция, содержащая полипептид, TRIS и фосфат, где полипептид содержит два scFv связывающих домена антитела, первый scFv связывающий домен способен связываться с CD3 эпсилон человека.
2. Композиция в соответствии с вариантом осуществления 1, отличающаяся тем, что второй связывающий домен полипептида может связываться с антигеном клеточной поверхности.
3. Композиция в соответствии с вариантом осуществления 2, отличающаяся тем, что полипептид содержит второй связывающий домен, который может связываться с поверхностным антигеном злокачественной клетки.
4. Композиция в соответствии с вариантами осуществления 2 или 3, отличающаяся тем, что поверхностный антиген представляет собой простатический специфический мембранный антиген (PSMA).
5. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что полипептид имеет расположение (VH-VL)Связывающий домен 2-(VH-VL)Связывающий домен 1.
6. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что первый связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 5.
7. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что второй, PSMA-связывающий связывающий домен полипептида содержит аминокислотную последовательность, представленную в SEQ ID NO: 6.
8. Жидкая фармацевтическая композиция, содержащая полипептид, TRIS и фосфат, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 7.
9. Жидкая фармацевтическая композиция, содержащая полипептид, TRIS и фосфат, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
10. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 5 мг/мл.
11. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 3,5 мг/мл.
12. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 3,0 мг/мл.
13. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 2,5 мг/мл.
14. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 2,0 мг/мл.
15. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 1,8 мг/мл.
16. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 1,5 мг/мл.
17. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,35 мг/мл.
18. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,3 мг/мл.
19. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,25 мг/мл.
20. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 0,2 мг/мл.
21. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит PSMA-BiTE1 в концентрации от 50 мкг/мл до 1 мг/мл.
22. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит PSMA-BiTE1 в концентрации от 50 мкг/мл до 500 мкг/мл.
23. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит PSMA-BiTE1 в концентрации от 100 мкг/мл до 500 мкг/мл.
24. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит полипептид в концентрации приблизительно 2 мг/мл.
25. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит TRIS в концентрации от приблизительно 50 мМ до приблизительно 200 мМ и фосфат в концентрации от приблизительно 20 мМ до приблизительно 100 мМ.
26. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция содержит 100 мМ TRIS и 50 мМ фосфат.
27. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что рН композиции находится в диапазоне от приблизительно 5,0 до приблизительно 7,0.
28. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что рН композиции находится в диапазоне от приблизительно 5,0 до приблизительно 6,5.
29. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что рН композиции находится в диапазоне от приблизительно 5,5 до приблизительно 6,5.
30. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что рН композиции составляет приблизительно 6,0.
31. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что рН композиции доводят с помощью соляной кислоты.
32. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит смачивающий реагент.
33. Композиция в соответствии с вариантом осуществления 32, отличающаяся тем, что смачивающий реагент представляет собой полисорбат 80.
34. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит от 0,002% до 0,1% полисорбата 80.
35. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит от 0,04% до 0,1% полисорбата 80.
36. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит 0,04% полисорбата 80.
37. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит лиопротектор. Композиция содержит предпочтительно 2-10% лиопротектора, особенно предпочтительно 4%.
38. Композиция в соответствии с вариантом осуществления 37, отличающаяся тем, что лиопротектор представляют собой трегалозу. Лиопротектор предпочтительно представляет собой дигидрат трегалозы.
39. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит от 4% до 10% дигидрата трегалозы.
40. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция дополнительно содержит приблизительно 4% дигидрата трегалозы.
41. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция имеет рН 6 и содержит от 50 мкг/мл до 1 мг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
42. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция имеет рН 6 и содержит от 50 мкг/мл до 500 мкг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ фосфата, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
43. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что композиция имеет рН 6 и содержит 2 мг/мл PSMA-BiTE1, 100 мМ TRIS, 50 мМ Na2HPO4, 0,04% полисорбата 80 и 4% дигидрата трегалозы.
44. Твердая смесь, получаемая путем лиофилизации жидкой композиции в соответствии с любым предыдущих вариантов осуществления.
45. Жидкая фармацевтическая композиция, отличающаяся тем, что композицию восстанавливают путем растворения лиофилизированной твердой смеси в соответствии с вариантом осуществления 44 в подходящей жидкой среде.
46. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет биоактивность по меньшей мере 90% и предпочтительно по меньшей мере 96% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и дальнейшим восстановлением и хранением (7 дней при 2-8°С и затем 16 часов при 20°С±5°С, как описано в примере 21).
47. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет биоактивность по меньшей мере 90% и предпочтительно по меньшей мере 96% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и хранением в течение 3 месяцев или 12 месяцев.
48. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет биоактивность по меньшей мере 97% (предпочтительно установленную с помощью анализа клеточной активности, как описано в примере 21), с последующей лиофилизацией и хранением в течение 3 месяцев при 6°С или 12 месяцев при 6°С.
49. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет содержание мономера (SEC) более чем 96% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие инъекции.
50. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет содержание димера и мультимера (SEC) не более чем 4% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие медленной или быстрой инъекции, используя иглу.
51. Композиция в соответствии с любым из предыдущих вариантов осуществления, где полипептид имеет содержание димера и мультимера (SEC) не более, чем 4% (предпочтительно установленное, как описано в примере 18а), с последующим воздействием сдвигового напряжения, возникающего вследствие медленной или быстрой инъекции, используя иглу (калибр: 30 G; длина иглы: 13 мм).
52. Композиция в соответствии с любым из предыдущих вариантов осуществления, отличающаяся тем, что биодоступность полипептида после подкожного введения композиции составляет >60%.
53. Композиция в соответствии с любым из предыдущих вариантов осуществления для применения в терапевтическом способе.
54. Композиция в соответствии с любым из предыдущих вариантов осуществления для применения в терапевтическом способе, указанный способ включает парентеральное введение композиции.
55. Композиция в соответствии с любым из предыдущих вариантов осуществления для применения в способе для терапевтического лечения гиперпролиферативных заболеваний.
56. Композиция в соответствии с любым из предыдущих вариантов осуществления для применения в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы.
57. Композиция в соответствии с любым из предыдущих вариантов осуществления для применения в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы, где способ включает подкожное введение композиции.
58. Способ стабилизации полипептидов в соответствии с по меньшей мере одним из вариантов осуществления 1-9, включающий получение композиции, которая содержит, дополнительно к полипептидам, по меньшей мере TRIS и фосфат и имеет рН 6,0.
59. Набор, содержащий композицию в соответствии с любым из вариантов осуществления 1-57.
60. Композиция в соответствии с любым из предыдущих вариантов осуществления, где жидкая фармацевтическая композиция представляет собой водную фармацевтическую композицию, предпочтительно стерильную водную фармацевтическую композицию.
61. Шприц, содержащий композицию в соответствии с любым из предыдущих вариантов осуществления.
Примеры
Пример 1: Скрининг буфера для улучшения тепловой стабильности PSMA-BiTE1 молекул
Дифференциальную сканирующую флуориметрию (DSF) использовали для измерения средней точки плавления (Tm1) домена PSMA-BiTE1 белка с наиболее низким молекулярным весом в различных системах буферов. Это является критерием стабильности исследуемого белка в различных системах буферов: чем больше значение Tm, тем больше, также, тепловая стабильность белка. Большая тепловая стабильность белка указывает на его лучшую пригодность для получения стабильных фармацевтических препаратов.
Для скрининга буферов, использовали стандартные буферы в диапазоне рН от рН 5,0 до 8,. PSMA-BiTE1 концентрация в полученных препаратах составляла приблизительно 0,2 мг/мл. Среднюю точку плавления устанавливали с помощью DSF метода.
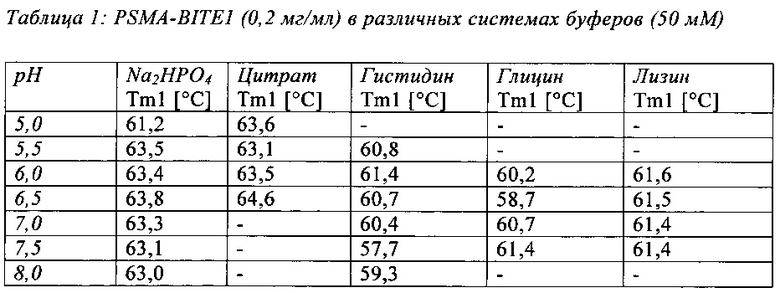
Буферные системы на основе цитрата и Na2HPO4 проявляли положительный эффект по отношению к повышенной точке плавления домена PSMA-BiTE1 белка. Положительные эффекты цитрата и Na2HPO4 прослеживали в дальнейших экспериментах.
Буферы на основе только трис(гидроксиметил)аминометана (TRIS) не приводили к отчетливому повышению точки плавления белка (таблица 2).
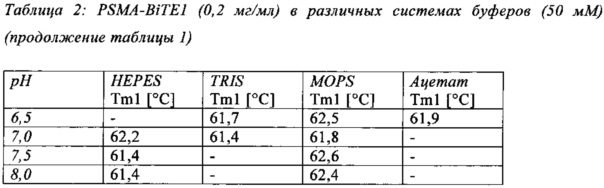
Как и в таблице 1, в таблице 2 также показана средняя точка плавления (Tm), что определяли с помощью дифференциальной сканирующей флуориметрии, домена PSMA-BiTE1 белка с наиболее низким молекулярным весом в различных буферных системах. Значения Tm находились в интервале от 57,7°С до 64,6°С. При комбинировании разных буферных систем, не представляется возможным достичь более высоких значений Tm.
PSMA-BiTE1 препарат в фосфатном буфере при рН 5,5-6,5 и в цитратном буфере при рН 5,0-6,5 проявляет наивысшие точки плавления (Tm>63,0°С в соответствие с DSF методом).
Пример 2: Влияние неионных поверхностно-активных веществ на образование агрегатов PSMA-BiTE1
PSMA-BiTE1 молекулы образовали агрегаты после встряхивающего стрессового теста во всех тестируемых системах буферов. Эффективность, с которой агрегируют PSMA-BiTE1 молекулы, обуславливающая активацию Т-клеток, является непредсказуемой или неконтролируемой, или только предсказуемой или контролируемой в ограниченной степени. Таким образом, чрезвычайно важным является обнаружение стабилизатора, который предотвращает образование агрегатов, возникающие вследствие встряхивающего стресса или действия усилий сдвига. Во встряхивающем стрессовом тесте, становится очевидным, что различные неионные поверхностно-активные вещества (например, полисорбат 80 или 20) стабилизируют PSMA-BiTE1 молекулы и могут предотвращать агрегацию. Концентрации поверхностно-активных веществ в диапазоне от 0,01 до 0,04% (масс/об.) достаточны для стабилизации (см. таблицы 3-7).
Пример 3: Образование PSMA-BiTE1 димера в присутствии поливалентных катионов
Повышение доли PSMA-BiTE1 агрегатов при концентрировании PSMA-BiTE1 препаратов нельзя предотвратить путем добавления неионных поверхностно-активных веществ.
Следовательно, исследовали электростатическую стабилизацию PSMA-BiTE1 молекул в присутствии поливалентных катионов (например, Mg2+ и Са2+). Поливалентные ионы оказывают непосредственное влияние на поверхностный потенциал растворенных белков и, таким образом, могут действовать стабилизирующим или даже дестабилизирующим образом.
PSMA-BiTE1 молекулы могут быть стабилизированы с помощью хлорида магния. Доля PSMA-BiTE1 димеров повышается только незначительно после концентрирования и сохраняется ниже <3% (таблица 3). Пропорции мономеров и димеров измеряли с помощью гель-фильтрационной хроматографии (SEC).
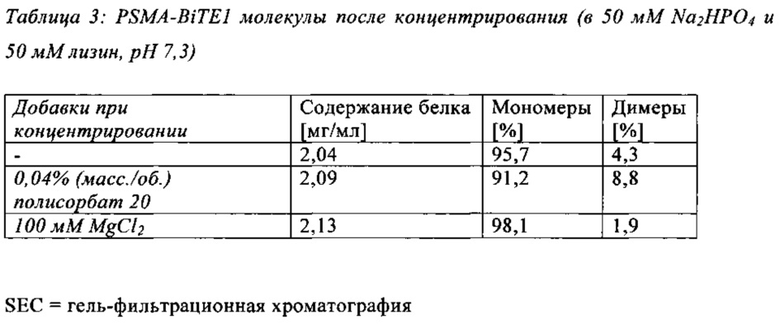
Тем не менее, добавление неорганических солей в более высоких концентрациях не безопасно с фармацевтической точки зрения, и/или указанные добавки усложняют сушку вымораживанием. Из этих соображений, осуществляется поиск альтернативных наполнителей, которые стабилизируют PSMA-BiTE1 молекулы и которые, в то же время, фармацевтически безопасны.
Пример 4: Идентификация альтернативных наполнителей для стабилизации PSMA-BiTE1 мономеров
Случайно, различные аминокислоты и их производные, в частности, включали в тесты для изучения стабилизации PSMA-BiTE1 мономеров в более высоких концентрациях. Аминокислоты и их производные не представляют собой неорганические соли и, следовательно, классифицируются как фармацевтически безопасные. Некоторые их этих веществ (например, лизин) проявляют, неожиданно, положительное влияние на стабильность PSMA-BiTE1 молекул в процессе и после концентрирования (таблица 4).

При добавлении лизина и гистидина в фосфатный буфер, PSMA-BiTE1 молекулы могут концентрироваться без образования неприемлемого относительно содержания димеров (≥5%). Тем не менее, препараты, в которых относительное содержание димеров низкое (<5%), дестабилизируются при встряхивающем стрессовом тесте, и это устанавливают по мутности раствора (тестируемые объемы 1 и 2; "Мутный" указывает на агрегацию, "OK" указывает на незначительную или отсутствие агрегации).
Пример 5: Влияние рН на стабильность PSMA-BiTE1 молекул
Для исследования влияния рН на образование димера, получали препарат, имеющий рН 6,0. Он демонстрирует соотношение димеров, которое сравнимо с таковым препаратов при рН 7,3. Кроме того, соотношение димеров также было стабильным при осуществлении встряхивающего стресса, и это становится очевидным благодаря отсутствию помутнений (таблица 5). Положительное влияние рН 6,0 использовали для дополнительно поиска стабилизаторов и составов.
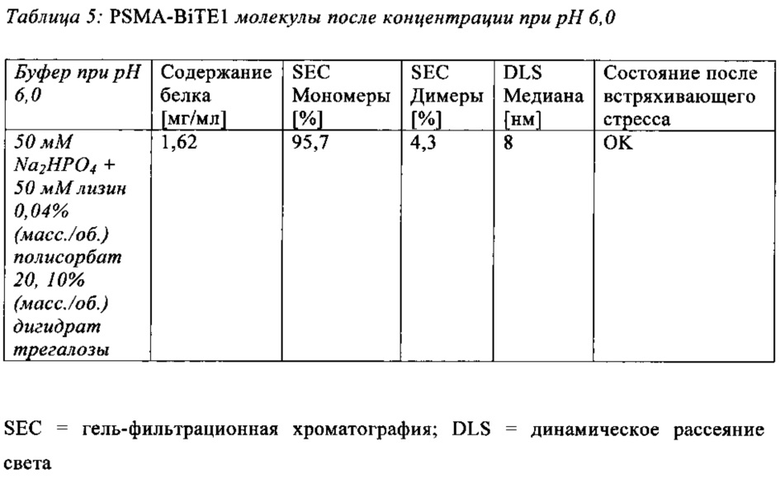
PSMA-BiTE1 стабильность в фосфатном буфере при рН 6,0 была поразительной. Представляется возможным неожиданно концентрировать молекулы до 1,6 мг/мл в препарате, содержащем 50 мМ Na2HPO4, 50 мМ лизин, 0,04% полисорбата 20 и 10% дигидрата трегалозы при рН 6,0, без агрегации, происходящей вследствие встряхивающего стресса.
Пример 6: Исследование комбинаций буферов
В дальнейшем эксперименте, исследовали возможный синергетический эффект по отношению к повышению стабильности PSMA-BiTE1 молекул с помощью добавок, таких как аргинин, TEA или TRIS в комбинации с фосфатом. Наиболее низкое соотношение PSMA-BiTE1 димеров 0,8% наблюдалось в случае комбинации буферов 50 мМ Na2HPO4, 100 мМ TRIS при рН 6,0. Препарат также достаточно стабильный после встряхивающего стресса, и это можно идентифицировать благодаря отсутствию мутности раствора (таблица 6). Стабилизирующий эффект TRIS был неожиданным, поскольку добавление аргинина или TEA, которые оба известны по своему стабилизирующему эффекту (то есть уменьшение агрегации) в случае белков, не имеет стабилизирующего эффекта в случае PSMA-BiTE молекул.
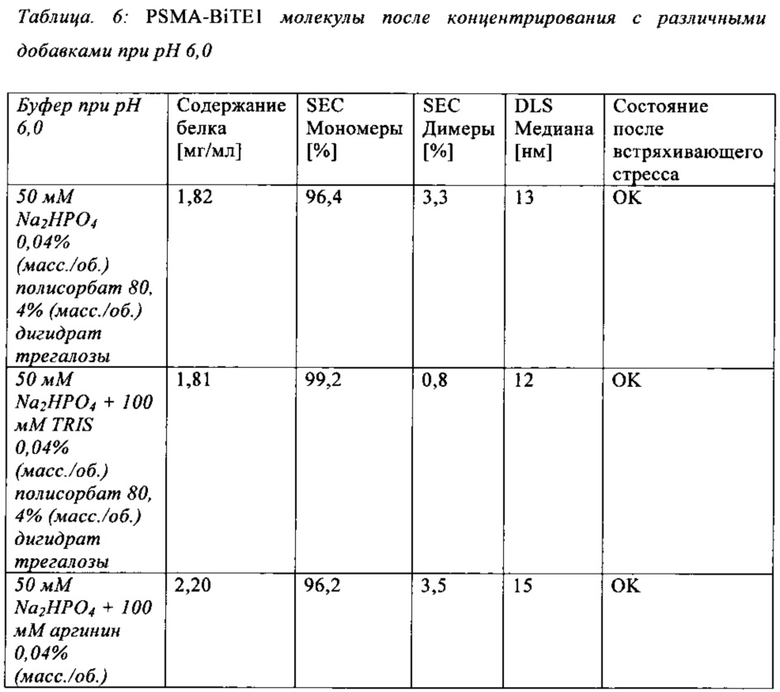
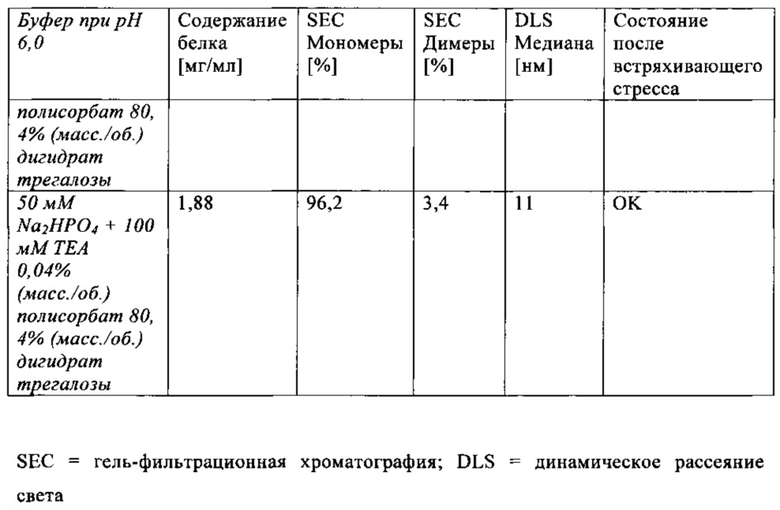
Как показано в примере 1, применение цитратного буфера приводит к повышению тепловой стабильности PSMA-BiTE1 молекул. Тем не менее, после концентрирования тестируемых объемов, количественное соотношение димеров в тестируемых объемах с цитратным буфером было значительно выше, чем в тестируемых объемах с фосфатным буфером (таблица 7 по сравнению с таблицей 6). Фосфатный буфер, следовательно, лучше подходит, чем цитратный буфер, для минимизации образования PSMA-BiTE1 димеров в процессе концентрирования. Также, цитрат в препарате приводит к расслоению стекла и его не следует больше использовать.
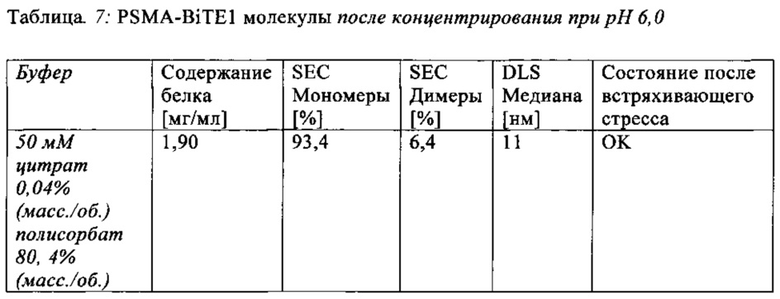
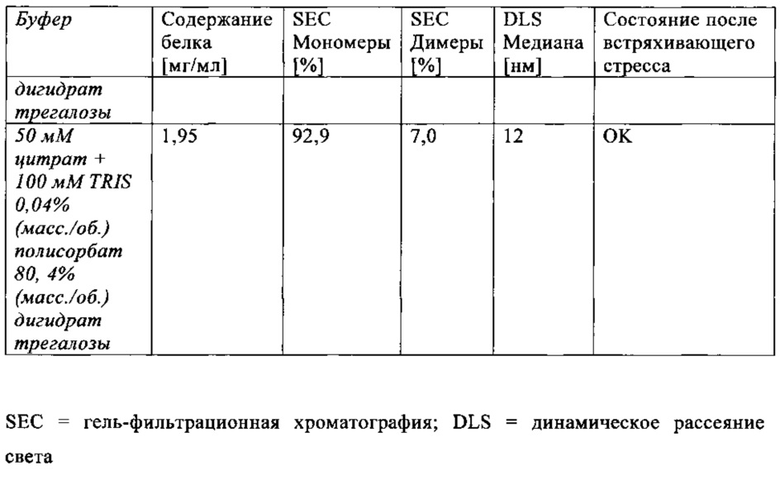
Пример 7: Тепловая стабильность PSMA-BiTE1 молекул в системах с TRIS-фосфатным буфером
Определяли среднюю точку плавления (Tm1) домена PSMA-BiTE1 белка с наиболее низким молекулярным весом следующего препарата:
0,2 мг/мл PSMA BiTE в 50 мМ Na2HPO4, 100 мМ TRIS, 0,04% полисорбата 80, 4% дигидрата трегалозы, рН 6,0 (доводили с помощью HCl). С помощью DSC, измеряли Tm1 61,1°С.
Пример 8: Влияние встряхивающего стресса на PSMA-BiTE1 молекул в препаратах фосфат/TRIS
В целом, BiTE молекулы физические дестабилизируются с помощью встряхивающего стресса, то есть они образуют агрегаты, которые можно определить с помощью динамического рассеяния света (DLS). Образование агрегатов происходит даже при низких BiTE концентрациях приблизительно 0,2 мг/мл. В отличие от этого, в случае содержание белка ниже 0,2 мг/мл, BiTE молекулы усиленно адсорбируются на стенку сосуда.
Путем добавления поверхностно-активного вещества (например, полисорбат 20 или 80), возможно предотвращать адсорбцию PSMA-BiTE1 молекул на стенки сосудов (например, инъекционных шприцов, инфузионных мешков, и т.д.) в некоторых системах буферов (например, в буферах на основе фосфата и лизина), и сходным образом образование агрегатов в состоянии покоя. Полисорбат 80 должен присутствовать в концентрации по меньшей мере 0,002% в композиции для предотвращения адсорбции PSMA-BiTE1 молекул.
Путем растворения PSMA-BiTE1 молекул в фосфатном буфере с добавлением поверхностно-активного вещества при рН 6,0, представляется возможным предотвращать образование агрегатов как в состоянии покоя, так и при воздействии встряхивающего стресса. Вышеуказанный препарат (фосфатный буфер с добавлением поверхностно-активного вещества при рН 6,0) имеет преимущества по сравнению с препаратами с лизином относительно минимизации образования агрегатов.
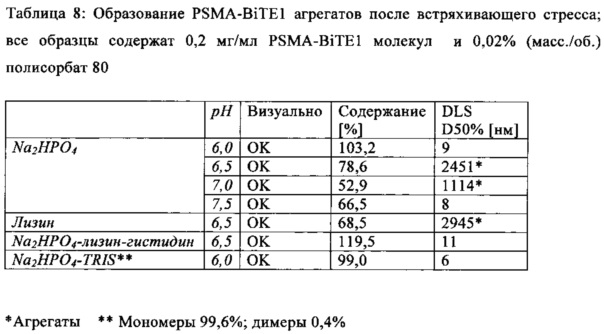
Пример 9: Зависимость PSMA-BiTE1 агрегации от концентрации
В стандартных буферных системах, количественное соотношение димеров и мультимеров повышается при концентрировании PSMA-BiTE1 молекул. Тем не менее, димеры и мультимеры приемлемы только в ограниченном количестве в препаратах для терапевтического применения, поскольку они могут оказывать влияние на эффективность препарата и терапевтического белка и провоцируют нежелательные иммунологические эффекты. Типично, димеры ограничены значением макс. 5% и осуществлялись попытки поддержать их ниже указанного значения в максимально возможной степени. Мультимеры и низкомолекулярные (LMW) фрагменты также должны быть минимизированы, или не присутствовать вообще. Соотношение мономер/димер, а также количественное соотношение мультимеров и низкомолекулярных фрагментов, определяли с помощью гель-фильтрационной хроматографии (SEC).
Используя буферную систему, содержащую 50 мМ Na2HPO4 и 100 мМ TRIS при рН 6,0, представляется возможным в достаточной мере уменьшать образование димеров и мультимеров среди PSMA-BiTE1 молекул при концентрировании.
Эта буферная система предоставляет возможность получать стабильный BiTE препарат, имеющие содержание >2 мг/мл (таблица 9).
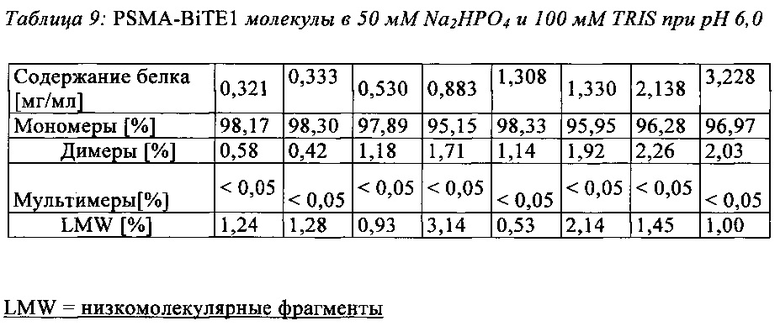
Пример 10: Влияние трегалозы и полисорбата на PSMA-BiTE1 стабильность
Добавление трегалозы и полисорбата не приводит к повышению образования димеров, мультимеров, или LMW фрагментов, как можно определить с помощью SEC измерения.
Пример 10а: Влияние трегалозы и полисорбата на PSMA-BiTE1 стабильность
Добавление дигидрата трегалозы и полисорбата не приводит к повышению образования димеров, мультимеров, или LMW фрагментов (таблица 10).
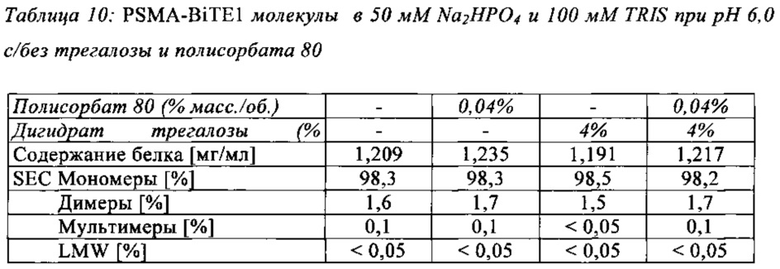
Пример 11: Стабильность при хранении PSMA-BiTE1 молекул
Стабильность при хранении PSMA-BiTE1 молекул можно определить на основании повышения количественного соотношения димеров и/или мультимеров в зависимости от времени хранения. Чем быстрее повышается количественное соотношение этих агрегатов, тем ниже стабильность при хранении.
Может быть экспериментально показано, что PSMA-BiTE1 молекулы в концентрации 90 мкг/мл, 500 мкг/мл и 2 мг/мл являются стабильными в течение периода 9 дней по отношению к образованию димеров и/или мультимеров. Препараты выдерживали в инъекционных шприцах приблизительно при 2-8°С, после начальной фазы от 4 до 16 часов при комнатной температуре (приблизительно 20°С). Композиции содержали, дополнительно к PSMA-BiTE1 молекулам, 50 мМ Na2HPO4, 100 мМ TRIS, 0,04% полисорбата 80 и 4% трегалозы. Количественное соотношение PSMA-BiTE1 мономеров измеряли с помощью SEC-ВЭЖХ и сравнивали с количественным соотношением PSMA-BiTE1 мономеров в начале экспериментов (то есть в день 0).
Пример 11а: Стабильность при хранении PSMA-BiTE1 молекул
Стабильность при хранении PSMA-BiTE1 молекул может быть определена на основе повышения количественного соотношения димеров и/или мультимеров в зависимости от времени хранения. Чем быстрее повышается количественное соотношение этих агрегатов, тем ниже стабильность при хранении.
Может быть экспериментально показано, что PSMA-BiTE1 молекулы в концентрации 90 мкг/мл, 500 мкг/мл и 2 мг/мл являются стабильными в течение периода 9 дней по отношению к образованию димеров и/или мультимеров (таблица 11). Препараты выдерживали в инъекционных шприцах приблизительно при 2-8°С, после начальной фазы от 4 до 16 часов при комнатной температуре (приблизительно 20°С). Композиции содержали, дополнительно к PSMA-BiTE1 молекулам, 50 мМ Na2HPO4, 100 мМ TRIS, 0,04% полисорбата 80 и 4% дигидрата трегалозы. Количественное соотношение PSMA-BiTE1 мономеров измеряли, используя SEC-ВЭЖХ, и сравнивали с количественным соотношением PSMA-BiTE1 мономеров в начале экспериментов (то есть в день 0). Через 9 дней в случае композиций, имеющих PSMA-BiTE1 исходную концентрацию 90 мкг/мл и 500 мкг/мл, ее относительная чистота составляет 100%, то есть количественное соотношение мономеров не снижается в течение этого времени. В случае композиций, имеющих 2 мг/мл PSMA-BiTE1 молекул, относительная чистота составляет 97% через 9 дней, абсолютно соответствуя снижению мономеров приблизительно на 3% (от 97,58% в день 0 до 94,81% в день 9).
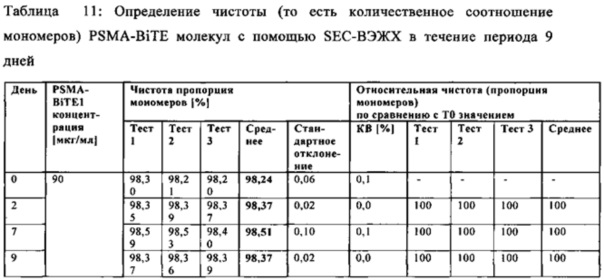
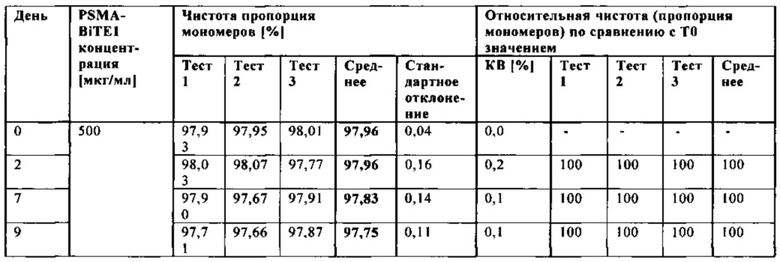
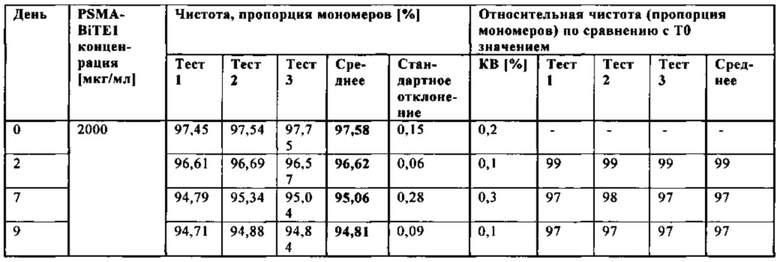
В других экспериментах, в жидком препарате, имеющем PSMA-BiTE1 концентрацию 2 мг/мл при 2-8°С в течение недели, наблюдали умеренное повышение количественного соотношения димеров на 2,5% (от 3% до 5,5%), в сочетании со стабильным соотношением мультимеров (таблица 12). Таким образом, при этой концентрации, PSMA-BiTE1 молекулы были стабильными в течение достаточно длительного времени для обеспечения заполнения контейнера практически без потерь и использования практически без потерь.
Несмотря на это, для длительного хранения (то есть хранения в течение периода, значительно больше одной недели), PSMA-BiTE1 растворы могут быть либо заморожены (-80°С) или лиофилизированы для обеспечения их стабильности. Лиофилизация PSMA-BITE1-содержащих препаратов с сохранением биологической активности возможна, как показано в примере 17.
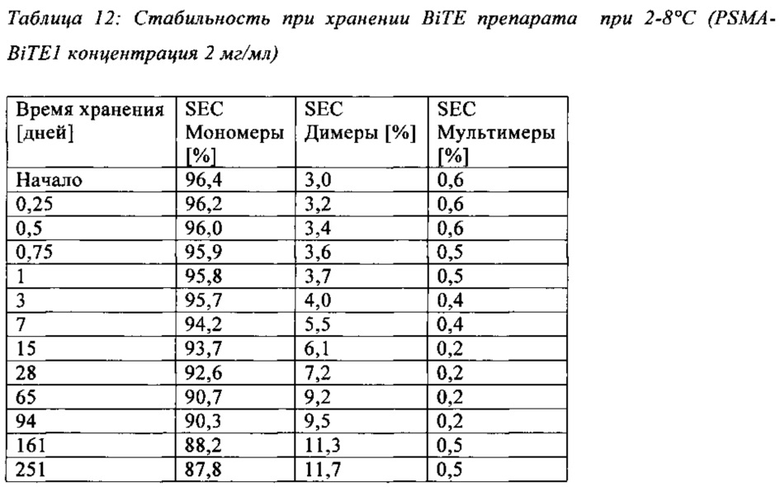
Пример 12: Влияние рН на PSMA-BiTE1 стабильность
В принципе, PSMA-BiTE1 молекулы являются стабильными в выбранном препарате, содержащем TRIS, фосфат (в этом случае: Na2HPO4), трегалозу и полисорбат с рН в диапазоне между рН 5,0 и 7,5. Тем не менее, при рН выше рН 6, количественное соотношение димеров повышается после сдвигового напряжения.
Пример 12а: Влияние рН на PSMA-BiTE1 стабильность
В принципе, PSMA-BiTE1 молекулы являются стабильными в выбранном препарате, содержащем TRIS, фосфат (в этом случае: Na2HPO4), дигидрат трегалозы и полисорбат с рН в диапазоне между рН 5,0 и 7,5. Тем не менее, при рН выше рН 6, количественное соотношение димеров (>2%) повышается после сдвигового напряжения (таблица 13).
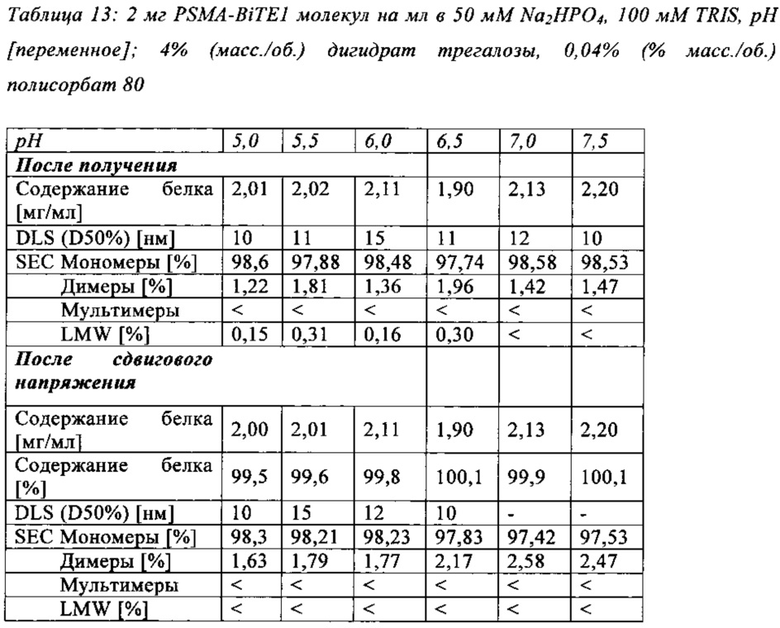
Пример 13: Влияние TRIS и фосфата на PSMA-BiTE1 стабильность
Исследования по отношению к различным буферным силам в препарате указывают на то, что буферные силы в препарате могут изменяться: от 20 до 100 мМ Na2HPO4 и от 50 до 200 мМ TRIS при рН 6,0 пригодны по отношению к минимизации образования PSMA-BiTE1 димеров. Все комбинации предоставляют возможность концентрирования и воздействия сдвигового напряжения.
При отсутствии TRIS, не представляется возможным концентрировать PSMA-BiTE1 молекулы, и при отсутствии Na2HPO4, количественное соотношение димеров возрастает до свыше >2%, с последующим воздействием сдвигового напряжения. Также, фосфатный буфер проявляет хорошее забуферивающее действие при рН 6,0 и поддерживает тепловую стабильность PSMA-BiTE1 молекул.
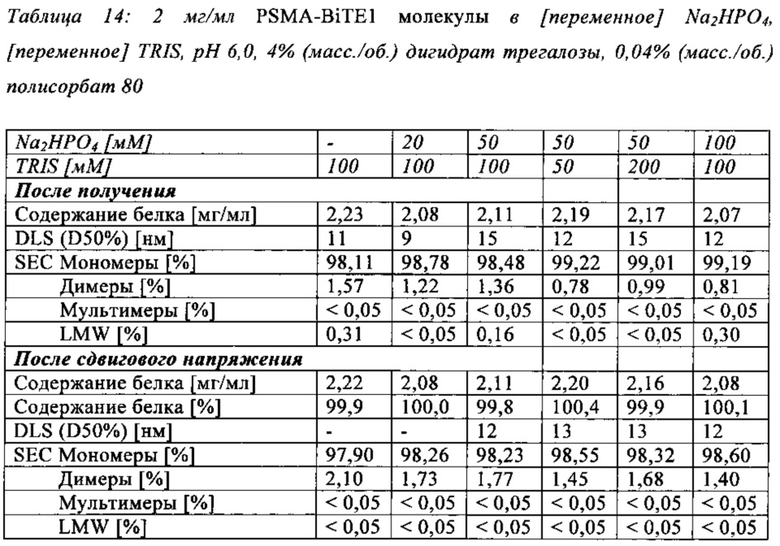
Пример 14: Влияние различных смачивающих реагентов на PSMA-BiTE1 стабильность
Различные полисорбаты могут стабилизировать PSMA-BiTE1 молекулы в препарате по отношению к сдвиговому напряжению. Тем не менее, наилучшие результаты достигают с полисорбатом 80. Другие стабилизаторы, такие как, например, Синпероник F68, также обладают положительными эффектами.
От 0,04% до 0,10% (масс./об.) полисорбата 80 обладает хорошим стабилизирующим эффектом на PSMA-BiTE1 молекулы при сдвиговом напряжении. 0,004% (масс./об.) полисорбат не достаточно в данном случае для предотвращения нежелательного повышения образования димеров, с последующим воздействием сдвигового напряжения.
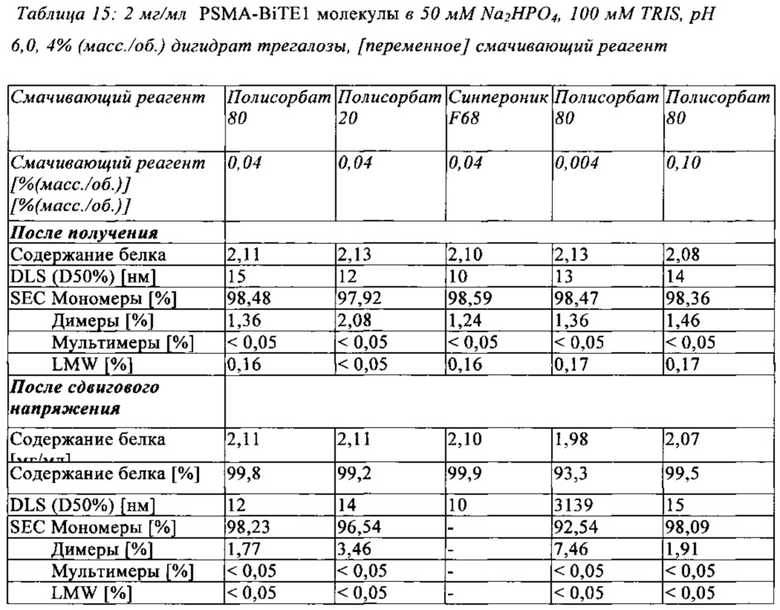
Пример 15: Влияние PSMA-BiTE1 концентрации на стабильность препарата
Используя препарат 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% (масс/об.) трегалозу, 0,04% (масс./об.) полисорбат 80, представляется возможным получать PSMA-BiTE1 концентрации вплоть до 2 мг/мл. При более высоких PSMA-BiTE1 концентрациях, количественное соотношение димеров отчетливо повышается. Тем не менее, неприемлемые значения измеряют только при PSMA-BiTE концентрациях больше, чем 4 мг/мл и после воздействия усилий сдвига (9,25% димеров при PSMA-BiTE концентрации приблизительно 11,2 мг/мл).
Пример 15а: Влияние PSMA-BiTE1 концентрации на стабильность препарата
Используя препарат 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% (масс/об.) дигидрат трегалозы, 0,04% (масс./об.) полисорбат 80, представляется возможным получать PSMA-BiTE1 концентрации вплоть до 2 мг/мл. При более высоких PSMA-BiTE1 концентрациях, количественное соотношение димеров отчетливо повышается. Тем не менее, неприемлемые значения измеряют только при PSMA-BiTE концентрациях больше, чем 4 мг/мл и после воздействия усилий сдвига (9,25% димеров при PSMA-BiTE концентрации приблизительно 11,2 мг/мл).
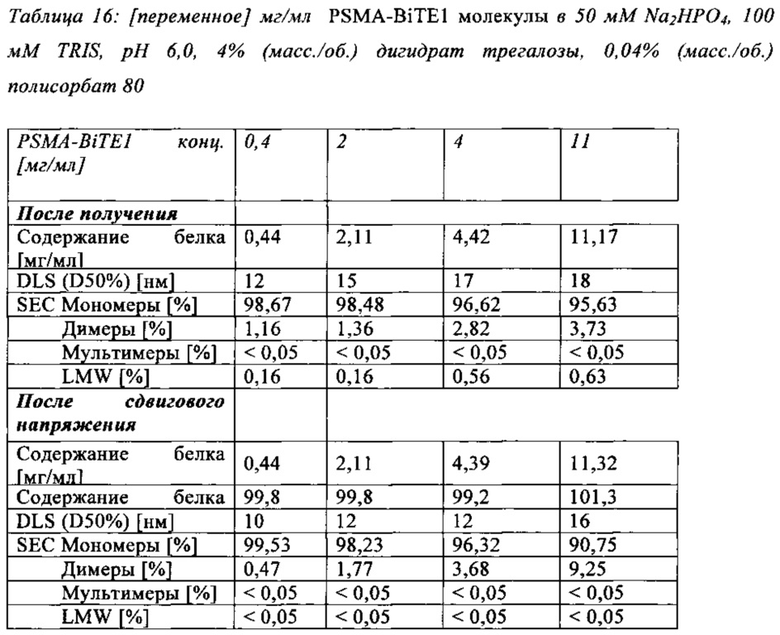
Пример 16: Лиофилизация
После завершения PSMA-BiTE1 композиции, ее лиофилизируют. Для этой цели доступны различные устройства для сушки вымораживанием, например, Genesis Super XL от SP Scientific. Сушку вымораживанием осуществляют путем замораживания вещества и последующей сублимации льда без прохождения через фазу жидкости.
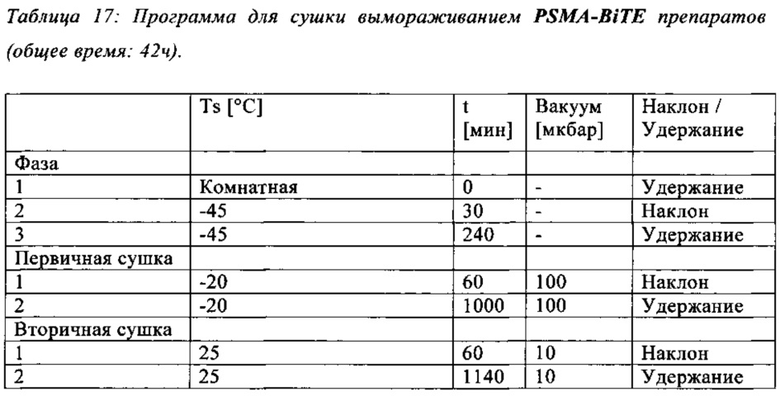
"Наклон " = непрерывное повышение или снижение температуры
В фазе замораживания, продукт охлаждают в "наклоне", то есть непрерывно, в течение 30 минут от комнатной температуры до -45°С. Для полного замораживания раствора продукта, эту температуру поддерживали в течение 240 минут.
После этого осуществляли первичную фазу высушивания. В вакуумной камере 100 мкбар, композицию нагревали в течение 60 минут до -20°С. Эту температуру поддерживали в течение 1000 минут; после этого первичная фаза высушивания завершалась. Для последующего вторичного высушивания, композицию нагревали в вакууме 10 мкбар до 25°С. Эти условия поддерживали в течение 1140 минут для удаления оставшейся воды вплоть до ≤2% (определение с помощью титрования по методу Карла Фишера).
После окончания процесса высушивания, в блоке снижали давление и лиофилизированные сосуды запечатывали.
Пример 17а: Биоактивность PSMA-BiTE1 лиофилизатов после длительного хранения и восстановления
Композиции, содержащие PSMA-BiTE1 молекулы (таблица 18а), хранили в виде лиофилизата вплоть до 12 месяцев при 2-8°С и при 25°С/60% относительной влажности. Через 3 и 12 месяцев, раствор восстанавливали из лиофилизата в каждом случае и анализировали в клеточном анализе активности. Измерения (с помощью анализа цитотоксичности CytoTox-Glo от Promega) определяли неизмененную биоактивность, после хранения в течение 6-ти и 12-ти месяцев в вышеуказанных условиях.
Кроме того, анализировали стабильность при хранении восстановленного PSMA-BiTE1 раствора. После восстановления, раствор сначала хранили в течение 7 дней в холодильнике (2-8°С) и после этого в течение 16 часов при комнатной температуре (+20±5°С). Впоследствии, биоактивность PSMA-BiTE1 молекул также определяли в данном случае с помощью клеточного анализа активности. Она составляла 96% в восстановленном растворе после вышеуказанного дополнительного хранения.
Биоактивность PSMA-BiTE1 молекул в лиофилизированном препарате была, следовательно, стабильной после хранения в течение 6-12 месяцев в вышеуказанных условиях хранения. Аналогичное применимо к раствору, восстановленному из этого лиофилизата, после хранения в течение 7 дней при 2-8°С и в течение 16 часов при комнатной температуре.
Пример 17b: Стабильность двух репрезентативных партий - относительно мономеров (SEC и CGE), биоактивности (клеточный анализ активности) и частиц (HIAC и MFI) - PSMA-BiTE1 лиофилизатов после длительного хранения и восстановления
Композиции, содержащие PSMA-BiTE1 молекулы (таблица 18а), хранили в виде лиофилизата вплоть до 12 месяцев при 2-8°С и при 25°С/60% относительной влажности. Через 3 и 12 месяцев, раствор восстанавливали из лиофилизата в каждом случае и анализировали, в частности, с помощью клеточного анализа активности. В измерениях (с помощью анализа цитотоксичности CytoTox-Glo от Promega) определяли несвязанные активности, и также только незначительные изменения в количественном соотношении мономеров в SEC и CGE, после хранения в течение как в течение 3-х, так и 12-ти месяцев в вышеуказанных условиях (таблица 18b).
Дополнительно, белковые частицы, имеющие размеры в диапазоне от >2 до >25 мкм, измеряли с помощью микроструйной визуализации (MFI) и HIAC (таблица 18 с). Значения сохранялись стабильными в пределах точности измерений для обеих партий в течение времени хранения.
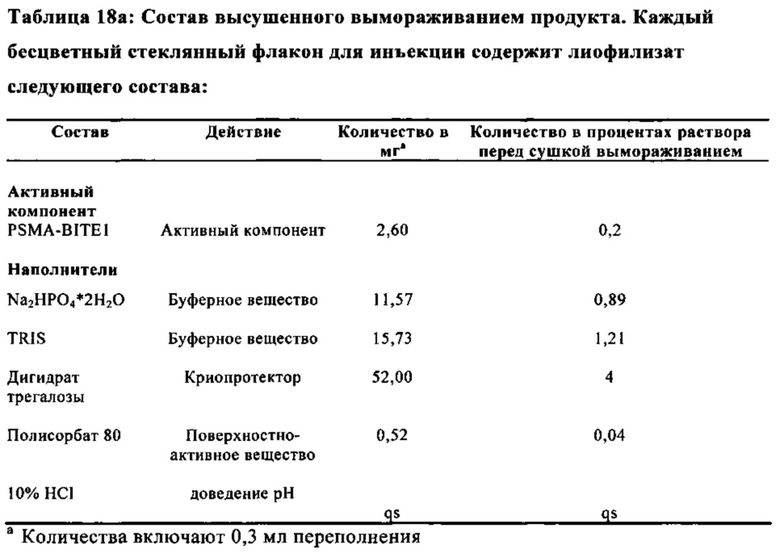
Лиофилизат восстанавливают с помощью 1,2 мл воды для инъекции. Раствор для введения, полученный впоследствии, имеет концентрацию 2 мг/мл. Флакон содержит, вследствие переполнения, 1,3 мл с 2,6 мг PSMA-BITE 1.
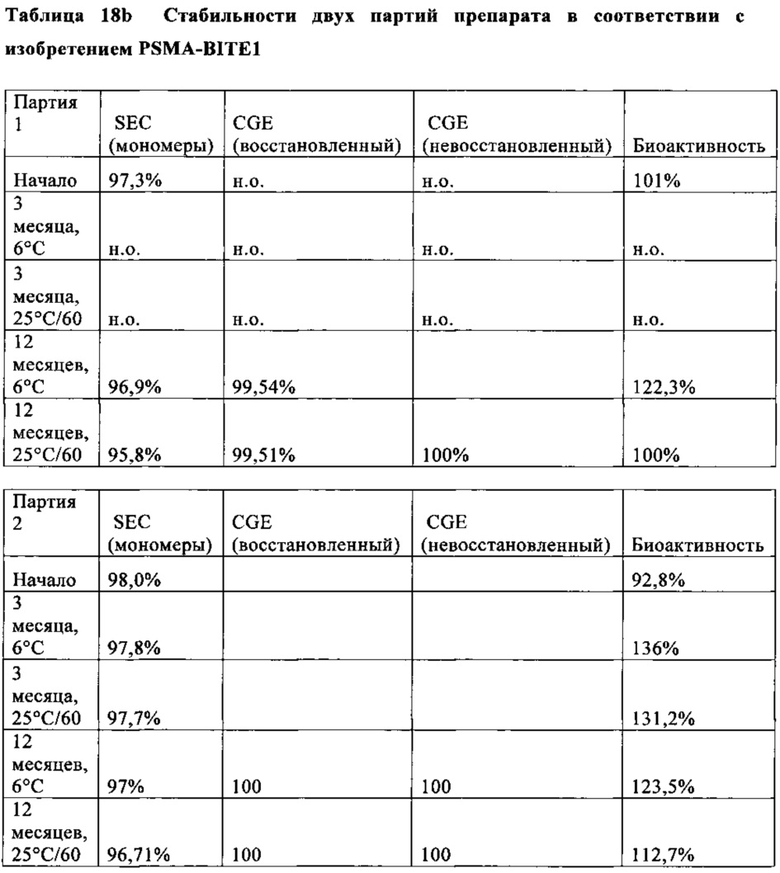
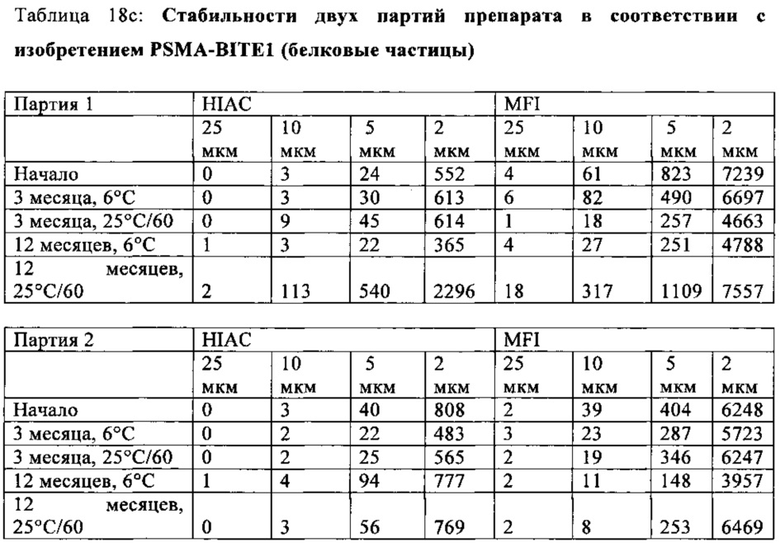
Кроме того, анализировали стабильность при хранении восстановленного PSMA-BiTE1 раствора. После восстановления, раствор сначала хранили в течение 7 дней в холодильнике(2-8°С) и после этого в течение 16 часов при комнатной температуре (+20±5°С). Впоследствии, биоактивность PSMA-BiTE1 молекул также определяли в данном случае с помощью клеточного анализа активности. Она составляла 96% в восстановленном растворе после вышеуказанного дополнительного хранения.
После хранения в течение 3-12 месяцев в вышеуказанных условиях хранения, биоактивность PSMA-BiTE1 молекул в лиофилизированном препарате была, следовательно, стабильной в пределах точности измерений в каждом случае. Другие параметры измерения (SEC, биоактивность, MFI и HIAC данные) также показали этот результат. Аналогичное применимо к раствору, восстановленному из этого лиофилизата, после хранения в течение 7 дней при 2-8°С и в течение 16 часов при комнатной температуре.
Пример 18: Влияние сдвигового напряжения при введении с помощью инъекционного шприца и канюли на образование PSMA-BiTE1 димеров
Состав: 2,17 мг/мл PSMA-BiTE1 молекул, 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% трегалозы, 0,04% полисорбата 80
Материал: Одноразовые шприцы (BD 2 мл), канюли (BD Microlance 30G1/2 (REF: 304000)) и флаконы из коричневого стекла (6R) и CryoTubes.
Процедура:
30 флаконов размораживали. 6 флаконов использовали в качестве исходных значений. Для каждого эксперимента, использовали 6 флаконов, то есть отбирали, используя шприц/канюлю, и все инъецировали в коричневое стекло или CryoTube.
Эксперименты:
1. Медленная инъекция PSMA-BiTE1 композиции в CryoTube (SyS Cryo)
2. Медленная инъекция PSMA-BiTE1 композиции в коричневое стекло (SyS Glass)
3. Быстрая инъекция PSMA-BiTE1 композиции в CryoTube (SyR Cryo)
4. Быстрая инъекция PSMA-BiTE1 композиции в коричневое стекло (SyR Glass)
После этого, измеряли образование димеров с помощью дифференциальной сканирующей флуориметрии (DSF).
Пример 18а: Влияние сдвигового напряжения при введении с помощью инъекционного шприца и канюли на образование PSMA-BiTE1 димеров
Состав: 2,17 мг/мл PSMA-BiTE1 молекул, 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% дигидрата трегалозы, 0,04% полисорбата 80
Материал: Одноразовые шприцы (BD 2 мл), канюли (BD Microlance 30G1/2 (REF: 304000)) и флаконы из коричневого стекла (6R) и CryoTubes.
Процедура: 30 флаконов размораживали. 6 флаконов использовали в качестве исходных значений. Для каждого эксперимента, использовали 6 флаконов, то есть отбирали с помощью шприца/канюли и все инъецировали в коричневое стекло или CryoTube.
Эксперименты:
1. Медленная инъекция PSMA-BiTE1 композиции в CryoTube (SyS Cryo)
2. Медленная инъекция PSMA-BiTE1 композиции в коричневое стекло (SyS Glass)
3. Быстрая инъекция PSMA-BiTE1 композиции в CryoTube (SyR Cryo)
4. Быстрая инъекция PSMA-BiTE1 композиции в коричневое стекло (SyR Glass)
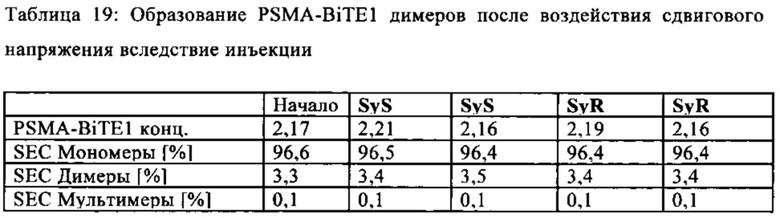
Образование димеров измеряли с помощью дифференциальной сканирующей флуориметрии (DSF). Не представляется возможным описать существенное повышение количественного соотношения димеров после инъекции композиции с помощью инъекционных шприцов и канюль. Этот результат свидетельствует о том, что препарат в соответствии с изобретением во всех случаях, является стабильным по отношению к действию генерируемого усилия сдвига.
Пример 19: Стабильность PSMA-BiTE1 раствора после восстановления (вплоть до 28 часов при 2-8°С) и при 2 разведениях и 1 температуре (25°С) в 0,9% солевом растворе в течение вплоть до 8 часов.
Количественное соотношение мономеров, димеров и мультимеров измеряли с помощью SEC хроматографии.
Состав: 2,0 мг/мл PSMA-BiTE1 молекул, 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% дигидрата трегалозы, 0,04% полисорбата 80
Материал: 0,9% NaCl и вода для инъекций
Процедура: 16 лиофилизированных PSMA-BiTE1 флаконов восстанавливали путем добавления 1,1 мл воды для инъекций (WFI). Из этих флаконов, 8 флаконов хранили при 2-8°С, 4 флакона разводили с помощью 0,9% NaCl раствора до концентрации 0,066 мг/мл, и 4 флакона разводили с помощью 0,9% NaCl раствора до концентрации 0,66 мг/мл. Их инкубировали при 25°С и исследовали через промежутки времени 0 ч, 2 ч, 4 ч и 8 ч с помощью SEC.
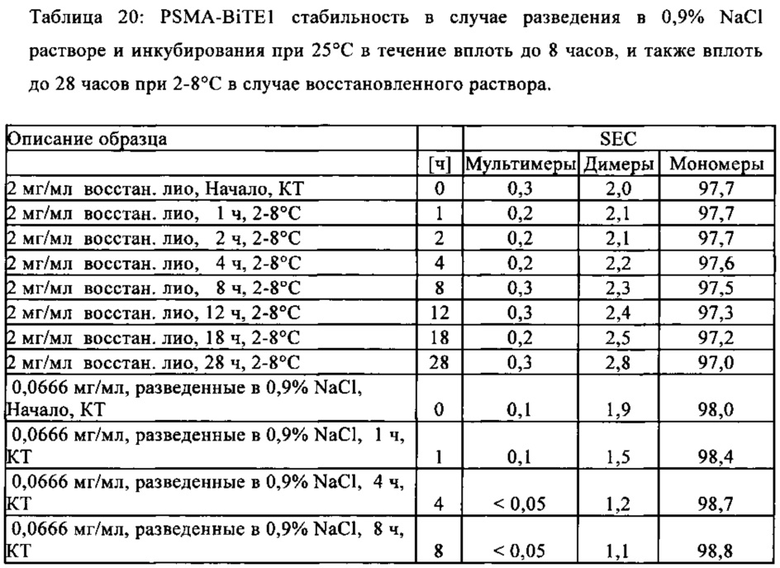
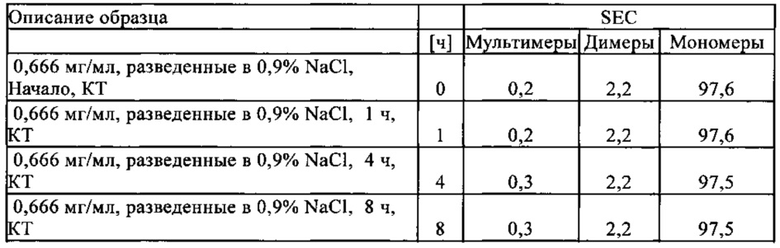
В соответствии с ожидаемым, образцы, восстановленные с использованием WFI, проявили снова повышение димеров, что можно было предполагать для 2 мг/мл раствора в 2-8°С. Снижение мономеров очевидно коррелирует с повышением димеров, и мультимеры не образовывались.
Разведения в 0,9% NaCl растворе проявили результат, сопоставимый с результатом в PBS. В случае 0,666 мг/мл, соотношение мономер /димер остается постоянным, и в случае 0,066 мг/мл, оно, в свою очередь, повышается в сторону мономеров.
Пример 20: Экспериментальная модель на стабильность PSMA-BiTE1 раствора в случае подкожного введения.
Для этого, исследовали восстановленный PSMA-BiTE1 раствор в PBS при 2 разведениях и 2 температурах (25°С и 37°С). Измерения осуществляли относительно количественного соотношения мономеров, димеры и мультимеры, и фрагментов (LMW), с помощью SEC хроматографии, и также невидимых частиц (SVP) с помощью MFI.
Состав: 2,0 мг/мл PSMA-BiTE1 молекул, 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% дигидрата трегалозы, 0,04% полисорбата 80
Материал: PBS
Процедура: Для определения стабильности разведенных PSMA-BITE-1 растворов в условиях подкожного введения, восемь лиофилизированных PSMA-BiTE1 флаконов каждый восстанавливали путем добавления 1,1 мл WFI. Используя PBS, 4 флакона разводили до концентрации 0,066 мг/мл и 4 флакона разводили до концентрации 0,66 мг/мл. Их инкубировали при 25°С (контроль) и 37°С и измеряли в периоды времени 0 ч, 2 ч, 4 ч и 8 ч с помощью SEC и MFI.
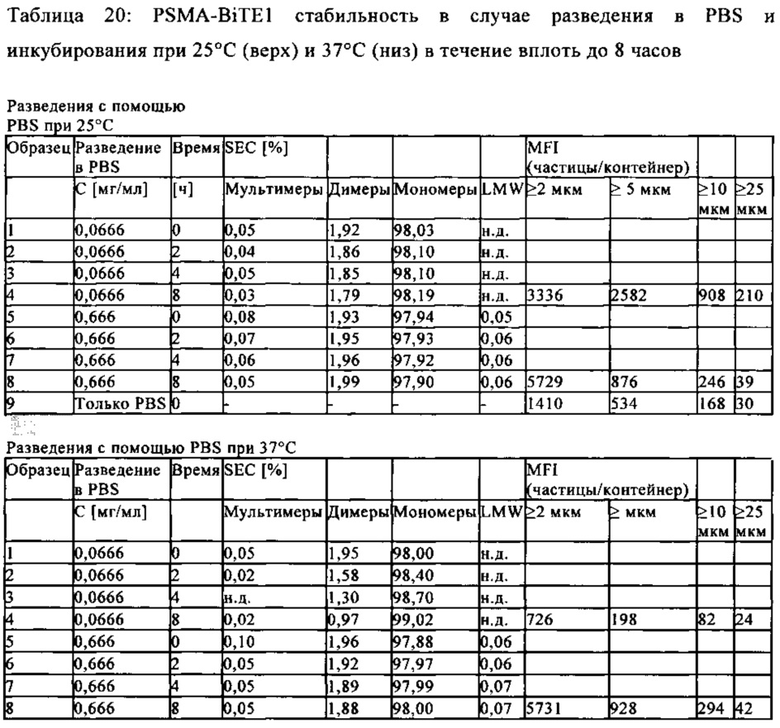
Разведения с помощью PBS и инкубирования в PBS при 37°С свидетельствуют о том, что PSMA-BiTE1 молекула является стабильной в этих моделированных условиях подкожного введения. В случае 0,66 мг/мл, мы имеет стабильное соотношение мономер/димер для инкубирования при обеих температурах. В отличие от этого, в случае 0,066 мг/мл, мы наблюдали эффект, что количественное соотношение димеров снижалось и количественное соотношение мономеров повышалось. Это является эффектом обратимого образования димера, которое зависит от концентрации и от времени. В случае SVP, присутствует тенденция к незначительному образованию SVP в зависимости от концентрации, температуры и времени SVP, что, тем не менее, не является проблемой стабильности. Это свидетельствует о пригодности препарата для подкожного введения.
Пример 21: Стабильность PSMA-BiTE1 разведений в 0,9% NaCl растворах в для исследований определения диапазона доз.
PSMA-BiTE1 лиофилизаты восстанавливали с помощью 1,2 мл WFI и смешивали с 0,9% раствором NaCl, который доводили до содержания полисорбата 80 0,004%. Это необходимо для избежания потерь биоактивности в сильно разведенных растворах. Для этого, получали раствор полисорбата 80 в концентрации 1% в 50 мМ натрий фосфатном буфере (рН 6,5). Этот раствор добавляли к коммерчески доступному раствору 0,9% NaCl (например, Baxter Viaflo 250 мл) для достижения конечной концентрации 0,004%. Используя этот раствор, получали разведения PSMA-BiTE1 в диапазоне от 0,05 мкг/мл до 2000 мкг/мл на следующих этапах:
- 0,05 мкг/мл
- 0,7 мкг/мл
- 2 мкг/мл
- 18 мкг/мл
- 90 мкг/мл
- 500 мг/мл
- 2000 мкг/мл
Для этого использовали стерильные, пустые инфузионные мешки (например, мешки объемом 150 мл от Impromediform GmbH, REF MF 1661)), в которые изначально загружали кондиционированный солевой раствор. К этому раствору добавляли соответствующие количества восстановленного раствора PSMA-BiTE1 и смешивали путем вращения мешка. 1 мл аликвот наполняли в шприцы объемом 2 мл (например, Injekt 2 мл/Luer Lock Solo Braun (REF 46067001V)) и запечатывали пробками Combi от В. Braun (REF 4495101).
Эти шприцы впоследствии хранили в холодильнике при температуре от 2 до 8°С в течение вплоть до 9 дней. Это хранение включало хранение при КТ (20°С±5°С) в течение 4 или 20 часов. Для измерения, инъекционную иглу (BD Microlance 3 30G1/2''' 0,3*13 мм) для подкожного введения присоединяли к шприцу (REF 304000) и раствор таким образом выталкивали во флакон объемом 2 мл (стекло 1 типа).
Биоактивность разведенных растворов исследовали в анализе цитотоксичности. Восстановление (содержание белка) определяли в (электрохемилюминесцентном анализе) ECL анализе.
Вследствие ограниченного диапазона измерений в ECL анализе, необходимо разводить исследуемые растворы в кондиционированном 0,9% солевом растворе перед анализами, следующим образом:
В таблицах 21а и b представлены результаты исследований хранения конечных инъекционных растворов в диапазоне от 0,05 до 18 мкг/мл PSMA-BiTE1 в течение времени хранения 9 дней. Концентрация белка сохранялась стабильной во всех конечных концентрациях. Относительные концентрации (по сравнению со значениями Т0) находились в диапазоне от 79% до 117%. На основании предшествующего опыта с этим классом веществ, устанавливали критерий допустимости ±40% до ±50% отличия от Т0 значения. Измеренные данные находились четко в этом диапазоне приемлемых значений.

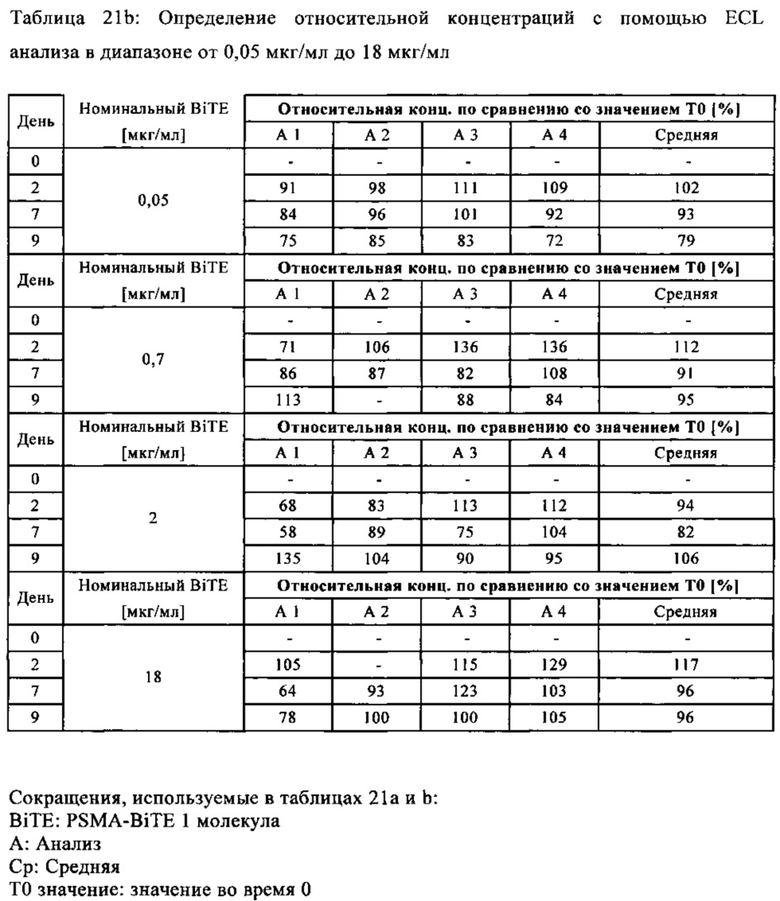
Для применения в анализе цитотоксичности CytoTox-Glo, необходимо развести анализируемые растворы в среде для анализа, как указано ниже:
Биологическую активность исследуемого материала выражали в виде "относительная биоактивность". Ее определяли следующим образом:
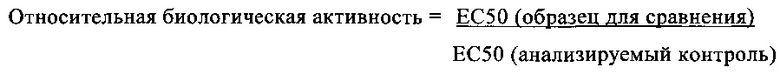
В Таблице 22 показано, что биоактивность конечных инфузионных растворов, содержащих от 18 мкг/мл до 2000 мкг/мл PSMA-BiTE1, сохранялась стабильной в течение периода хранения 9 дней. Относительные биоактивности изменялись в течение времени хранения 9 дней, по сравнению со значением Т0, в пределах диапазона 77% - 132%.
Таким образом, эти результаты хорошо укладываются в ранее определенный диапазон приемлемых значений от 50% до 200% биоактивности.
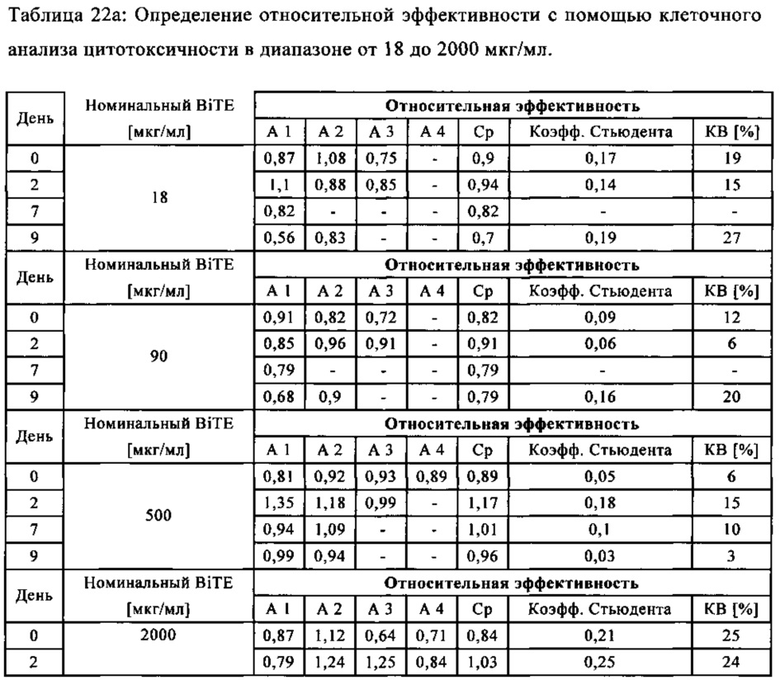

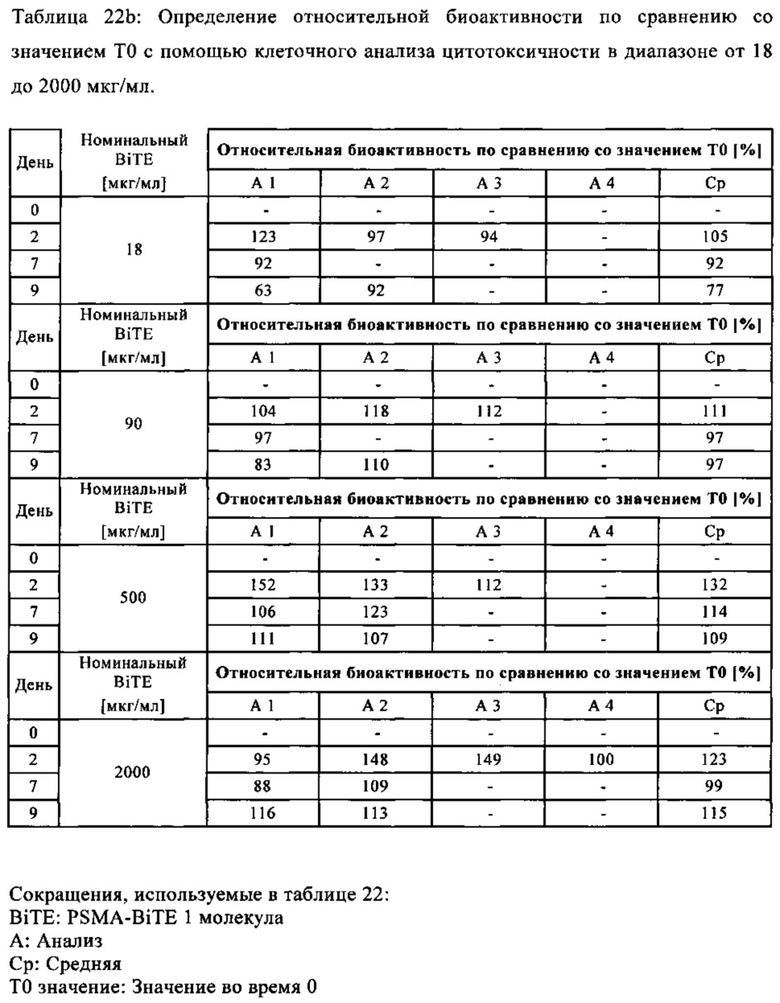
Отличия в биоактивности растворов, разведенных и храненных в течение 9 дней, не были больше, чем ±33% по сравнению со значением Т0. Отсутствует заметная тенденция, указывающая на отличительную потерю биоактивности в течение времени хранения. Анализируемые растворы, содержащие 18 мкг/мл PSMA-BiTE1, проявляли незначительное снижение биоактивности в течение времени хранения, но не представляется возможным подтвердить эту тенденцию, если принимать во внимание анализируемые растворы в более высокой концентрации.
Дополнительно, в ECL анализе, концентрация 18 мкг/мл проявила отсутствие снижения концентрации белка в течение времени хранения.
В заключение, можно сделать вывод о том, что возможно хранение конечных инъекционных растворов PSMA-BiTE1 в диапазоне концентраций 18-2000 мкг/мл, совместимое з используемыми условиями разведения и с хранением и системой для введения, в течение вплоть до 9 дней при температуре +2-8°С, включая период вплоть до 20 часов при +20±5°С.
Пример 22: Биодоступность PSMA-BiTE1 после подкожного введения
Используя препарат 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% трегалозы, 0,04% полисорбата 80, представляется возможным достигать высокую биодоступность после подкожного введения. Подкожную биодоступность PSMA-BiTE1 молекул исследовали на 4 самках Макак-крабоедов. Дозировка составляла 45 мкг/кг для подкожного введения и сравнивали с в/в введением 5 и 15 мкг/кг веса тела (BW). 2 мг/мл маточный раствор разводили физиологическим солевым раствором. Инфузионное время в/в введения составляло 1 час и скорость инфузии составляла 1 мл/кг BW. Выбранным участком инъекции была поверхностная вена (V. saphena parva). Для подкожного введения, тестируемый раствор инъецировали в латеральную область грудной клетки в дозе 0,15 мл/кг BW. Уровни в крови исследовали с помощью ELISA анализа. С этой целью, использовали ECL технологию. Нижний предел количественного определения (LLOQ) способа составил 4 мкг/л.
Пример 22а: Биодоступность PSMA-BiTE1 после подкожного введения
Используя препарат 50 мМ Na2HPO4, 100 мМ TRIS, рН 6,0, 4% дигидрата трегалозы, 0,04% полисорбата 80, представляется возможным достигать 66% биодоступность после подкожного введения. Подкожную биодоступность PSMA-BiTE1 молекул исследовали на 4 самках Макак-крабоедов. Дозировка составляла 45 мкг/кг для подкожного введения и сравнивали с в/в введением 5 и 15 мкг/кг веса тела (BW). 2 мг/мл маточный раствор разводили физиологическим солевым раствором. Инфузионное время в/в введения составляло 1 час и скорость инфузии составляла 1 мл/кг BW. Выбранным участком инъекции была поверхностная вена (V. saphena parva). Для подкожного введения, тестируемый раствор инъецировали в латеральную область грудной клетки в дозе 0,15 мл/кг BW. Уровни в крови исследовали с помощью ELISA анализа. С этой целью, использовали ECL технологию. Нижний предел количественного определения (LLOQ) способа составил 4 мкг/л.
Методы
Получение PSMA-BiTE молекул
Способы получения BiTE молекул, более предпочтительно PSMA-BiTE молекул, описаны, например, в WO 2010037836 А2.
Во-первых, PSMA-BiTE1-кодирующую рекомбинантную BiTE ДНК конструкцию интегрировали в подходящий экспрессионный вектор и с его помощью стабильно интродуцировали в эукариотические СНО (яичник китайского хомячка) клетки. Трансфектированные СНО клетки культивировали в биореакторе с подходящей культуральной средой и секретирумый белок выделяли путем фильтрации клеток. Очистка BiTE молекул включала замену буферных веществ на TRIS и фосфат с помощью гель-фильтрационной хроматографии (SEC) и последующую концентрацию с помощью ультрафильтрации и диафильтрации. Дополнительно, добавляли полиол (предпочтительно трегалоза) и смачивающий реагент (предпочтительно полисорбат 80). Композицию хранили при температуре ниже -60°С.
Дифференциальная сканирующая флуориметрия (DSF)
Определения стабильности PSMA-BiTE1 молекул (например, после сдвигового напряжения) осуществляли с помощью системы ПЦР в реальном времени 7500 Fast (Applied Biosystems). Различные PSMA-BiTE1 концентрации (в диапазоне между 0,15 и 0,005 мг/мл) смешивали с флуоресцентным красителем (например, "Sypro® Orange 5000") в планшетах на 96 лунок (микротитровальные планшеты) и измеряли в ПЦР системе (система ПЦР в реальном времени 7500 Fast, Applied Biosystems). Температуру повышали от 20°С до 90°С. Точки плавления белков определяли с помощью флуоресцентного обнаружения, которое происходило приблизительно в зависимости от температуры, когда флуоресцентный краситель реагировали с гидрофобными участками белка.
Дифференциальная сканирующая калориметрия (DSC)
Термическую температуру разворачивания (Tm) PSMA-BiTE1 молекул определяли с помощью DSC. Для этого, образцы нагревали от 20°С до 105°С и точки плавления полипептидов устанавливали с помощью калориметра. Использовали VP-DSC прибор от GE Healthcare.
Встряхивающий стресс
Образцы подвергали стрессу путем встряхивания на лабораторном встряхивателе (IKA, HS 260) в камере с контролируемой температурой (МММ, FrioCell 200). Критический параметр качества агрегации определяли через 24 часов при 300 об/мин и 20°С.
Визуальный контроль
Стабильность PSMA-BITE растворов визуально проверяли после сдвигового напряжения путем выдерживания растворов на темном фоне и проверки наличия видимых частиц или мутности. Прозрачный раствор после встряхивающего стрессового теста указывал на незначительное или отсутствие образования димеров и/или мультимеров, в то время как видимая мутность раствора коррелирует с высокой долей димеров и/или мультимеров.
Динамическое рассеяние света (DLS)
Динамическое рассеяние света представляет собой метод анализа рассеивания света лазера на растворенном или суспендированном образце. Измеряют гидродинамический радиус, который, в свою очередь, представляет возможным сделать вывод об агрегационном состоянии PSMA-BiTE1 молекул. Гидродинамический радиус измеряют с помощью Horiba LB 550 (Retsch Technology).
Определение содержания белка
Содержание белка измеряли спекрометрически при 280 нм, используя Nanodrop 2000 (Thermo Scientific). Все образцы измеряли относительно соответствующих плацебо или буферных растворов.
Каждый образец раствора пипетировали (2 мкл) 3х в измерительную зону прибора Nanodrop и измеряли в каждом случае в двух повторах; после этого, эти измеренные значения (n=6) усредняли. Содержание белка [мг/мл] рассчитывали на основании средних измеренных значений посредством ранее созданной функции калибровки белка (зависимости абсорбции от содержания белка).
Электрохемилюминесцентное измерение (ECL анализ)
Для этого метода, использовали SULFO-TAG™ метки, которые испускают свет после электрохимической стимуляции. Стимуляцию осуществляли на поверхности электродов так называемых MULTI-ARRAY микропланшет. Испускаемый свет измеряли при прибл. 620 нм с помощью детектора.
Измерение основывается на "сэндвич" методе, в котором PSMA-BiTE1 молекулы в растворе иммобилизировали на микропланшете с помощью поликлональных козьих анти-PSMA-BiTE1 антител. Затем Пента-His-биотин связывали с иммобилизированными BiTE молекулами и обнаруживали с помощью SULFO-TAG™-конъюгированного стрептавидина. Образцы анализировали на Sector Imager 2400.
Гель-фильтрационная хроматография (SEC)
Для определения количественного соотношения мономеров и димеров и также низкомолекулярных (LMW) и высокомолекулярных (HMW) фракций, осуществляли гель-фильтрационную хроматографию, используя ВЭЖХ систему. Измерения осуществляли с помощью детектора флуоресценции и расчет осуществляли с помощью метода площади под кривой. Используемая колонка представляла собой стандартную колонку для SEC белков, например, Tosoh Biosep TSK gel G3000 SWXL 5 мкм, длина 300 мм × внутренний диаметр 7,8 мм или эквивалентный материал.
Обнаружение PSMA-BITE1 концентраций в сыворотке после в/в и п/к введения
Концентрацию PSMA-BITE1 в сыворотке Макак-крабоедов измеряли с помощью ELISA. Обнаружение осуществляли с помощью электрохемилюминесции. Предел обнаружения (LLOQ) составлял 0,98 мкг/л, с точностью от 3 до 28% и достоверностью от 70 до 100%.
Клеточный анализ активности
Клеточный анализ цитотоксичности использовали в качестве общепринятого анализа для определения относительной активности PSMA-BiTE1 образцов. Благодаря биспецифичности связывания PSMA-BiTE1 с человеческими /циномольгус CD3-положительными и человеческими /циномольгус PSMA-положительными клетками, опосредованный Т-клетками лизис целевых клеток происходит после активации Т-клеток (эффекторные клетки).
Цитотоксичность определяли с помощью люминесцентного анализа цитотоксичности CytoTox-Glo от Promega. Измеряемым значением, используемым в данном случае, являлось количество высвобождаемого светового сигнала, которое коррелирует с количеством погибших леток. Дальнейшие анализы активности описаны в WO 2010037836 А2.




Определение концентрации PSMA-BiTE1 полипептидов (УФ/ВИД спектроскопия)
Способ осуществляли в соответствии с Европейской фармакопеей (Ph. Eur., 2.2.25, УФ/ВИД спектроскопия при 280 нм) и он также пригоден для определения концентрации других молекул.
Сначала, экспериментально определяли коэффициент экстинкции PSMA-BiTE1 молекул. С этой целью, определяли поглощающую способность растворов известной PSMA-BiTE1 концентрации, концентрации (в моль/л) устанавливали на основании молярной массы PSMA-BiTE1 молекул (1,8673×105 г/моль). На основании абсорбции, длины пробега и концентрации, можно рассчитать коэффициент экстинкции PSMA-BiTE1 молекул, в соответствии с
е = А / с × d, где
А = поглощающая способность (или абсорбция, не учитывая рассеивание света) при подходящей длине волны (в этом случае, 280 нм)
с = концентрация (моль/л)
d = длина пробега (мм).
После этого значения поглощающей способности графически представляли на Y-оси относительно связанных концентраций на Х-оси для получения стандартной кривой. Используя эти стандартные кривые, впоследствии возможно непосредственно считывать концентрацию PSMA-BiTE1 раствора на основании поглощающей способности.
Для создания вышеуказанных стандартных кривых, следует применить закон Бэра-Ламберта к измеряемому раствору, то есть, в частности, абсорбирующее вещество должно быть гомогенно распределено в растворе, вариации коэффициентов поглощения в пределах измеряемого спектрального диапазона должны быть пренебрежимо малыми, и измеряемый раствор должен быть концентрирован до достаточно низкого уровня, таким образом, чтобы не происходили отклонения, связанные с взаимодействиями.
Используя коэффициент экстинкции молекулы, концентрацию белка (в моль/л) также можно обратно пропорционально рассчитать на основании измеренной поглощающей способности (или абсорбции при 280 нм), в соответствии с:
Концентрация белка [моль/л] = А × V / е × d, где
А = абсорбция при 280 нм
d = длина ячейки в см (стандартная ячейка, 1,00 см)
V = разведение тестируемого раствора
е = коэффициент экстинкции PSMA-BiTE1 при 280 нм = 111315 М-1 × см-1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ АНТИТЕЛ | 2014 |
|
RU2694055C2 |
| СОСТАВЫ НА ОСНОВЕ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ К IL-4/IL-13 | 2014 |
|
RU2690850C2 |
| СОДЕРЖАЩИЕ ФАКТОР ФОН ВИЛЛЕБРАНДА (vWF) ПРЕПАРАТЫ И СПОСОБЫ, НАБОРЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2010 |
|
RU2579977C2 |
| СТАБИЛЬНЫЕ ЖИДКИЕ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ СЛИТОГО БЕЛКА TNFR:Fc | 2012 |
|
RU2614257C2 |
| КОМПОЗИЦИИ АНТИТЕЛ | 2005 |
|
RU2426554C2 |
| ЖИДКИЕ КОМПОЗИЦИИ ДЛИТЕЛЬНО ДЕЙСТВУЮЩЕГО КОНЪЮГАТА ИНТЕРФЕРОНА АЛЬФА | 2011 |
|
RU2613905C2 |
| ЖИДКИЙ СОСТАВ ПОЛИПЕПТИДОВ, СОДЕРЖАЩИХ FC-ДОМЕН ИММУНОГЛОБУЛИНА | 2011 |
|
RU2600847C2 |
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ КОМПОЗИЦИИ АНТИТЕЛ И БЕЛКОВ | 2004 |
|
RU2332986C2 |
| ЖИДКИЙ СОСТАВ ФОЛЛИКУЛОСТИМУЛИРУЮЩЕГО ГОРМОНА | 2011 |
|
RU2553375C2 |
| СОСТАВ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2010 |
|
RU2609658C2 |










Группа изобретений относится к области медицины, а именно к клинической фармакологии, и предназначена для поддержания стабильности жидкой фармацевтической композиции. Жидкая фармацевтическая композиция содержит полипептид, TRIS, фосфат и лиопротектор. Указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 8. pH композиции составляет от 5,0 до 7,5. Компоненты используются в заявленных количествах. Также обеспечена твердая смесь, полученная путем лиофилизации указанной жидкой композиции. Кроме того, обеспечивается восстановленная жидкая фармацевтическая композиция, которую получают путем растворения указанной лиофилизированной твердой смеси в подходящей жидкой среде. Использование группы изобретений позволяет повысить стабильность жидкой фармацевтической композиции за счет предотвращения образования нежелательных полипептидных агрегатов. 3 н. и 9 з.п. ф-лы, 22 табл., 22 пр.
1. Жидкая фармацевтическая композиция, содержащая полипептид, TRIS и фосфат, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, отличающаяся тем,
что композиция содержит полипептид в концентрации от 0,5 мкг/мл до 3,0 мг/мл,
что композиция содержит 100 мМ TRIS и 50 мМ фосфата,
что pH композиции составляет от 5,0 до 7,5 и что композиция содержит 0,04% полисорбата 80,
и где композиция дополнительно содержит лиопротектор.
2. Композиция по п. 1, отличающаяся тем, что композиция содержит 2-10% лиопротектора.
3. Композиция по п. 2, отличающаяся тем, что лиопротектор представляет собой трегалозу или дигидрат трегалозы.
4. Композиция по п. 1, отличающаяся тем, что композиция дополнительно содержит 4% дигидрата трегалозы.
5. Композиция по пп. 1, 2 или 4, отличающаяся тем, что композиция содержит полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 8, в концентрации 2 мг/мл.
6. Твердая смесь, полученная путем лиофилизации жидкой композиции по любому из предыдущих пунктов.
7. Жидкая фармацевтическая композиция, отличающаяся тем, что композицию восстанавливают путем растворения лиофилизированной твердой смеси по п. 6 в подходящей жидкой среде.
8. Композиция по пп. 1, 2, 4 или 7, отличающаяся тем, что биодоступность полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 8, после подкожного введения композиции составляет >60%.
9. Композиция по пп. 1, 2, 4 или 7 для применения в терапевтическом способе.
10. Композиция по пп. 1, 2, 4 или 7 для применения в терапевтическом способе, где указанный способ включает парентеральное введение композиции.
11. Композиция по пп. 1, 2, 4 или 7 для применения в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы.
12. Композиция по пп. 1, 2, 4 или 7 для применения в способе для терапевтического лечения гиперпролиферативных заболеваний предстательной железы, где способ включает подкожное введение композиции.
| WO 2009070642 A1, 04.06.2009 | |||
| WO 2011141926 A2, 17.11.2011 | |||
| WO 2010037836 A2, 08.04.2010. |
Авторы
Даты
2019-02-06—Публикация
2013-11-05—Подача