В настоящей, не являющейся предварительной, заявке, поданной согласно подпункту 1.53(b) пункта 37 Свода федеральных правил, испрашивается приоритет по предварительной заявке 60/620413, поданной 20 октября, 2004, содержание которых включены в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям антител, в том числе к моноклональным антителам, составленным в гистидин-ацетатном буфере, а также к композиции, которая содержит антитело, связывающееся с доменом II HER2 (например, пертузумаб), и к композиции, которая содержит антитело, связывающееся с DR5 (например, апомаб).
УРОВЕНЬ ТЕХНИКИ
В последние десять лет успехи в биотехнологии позволили с использованием способов рекомбинантной ДНК получать множество белков для фармацевтического применения. Поскольку белки являются более крупными и более сложными, чем обычные органические и неорганические лекарственные средства (т.е. обладают многочисленными функциональными группами, в дополнение к сложным трехмерным структурам), то композиция из таких белков создает определенные проблемы. Для того чтобы белок оставался биологически активным, композиция должна сохранять неповрежденной конформационную целостность по меньшей мере каркасной последовательности аминокислот белка, в то же время защищая от разрушения многочисленные функциональные группы белка. Пути разрушения белков могут включать в себя нарушение химической стабильности (т.е. любой процесс, включающий в себя модификацию белка посредством образования связи или расщепления, который приводит к новой химической структуре) или нарушение физической стабильности (т.е. изменения белковой структуры более высокого порядка). Нарушение химической стабильности может происходить в результате дезамидирования, рацемизации, гидролиза, окисления, бета-элиминирования или дисульфидного обмена. Нарушение физической стабильности может происходить, например, в результате денатурации, агрегации, осаждения или поглощения. Три наиболее распространенных пути разрушения белков представляют собой агрегацию, дезамидирование и окисление белков. Cleland et al. Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
КОМПОЗИЦИИ АНТИТЕЛ
В используемые для фармацевтического применения белки включены антитела. Примером эффективного для лечения антитела является антитело, которое связывается с антигеном HER2, такое как пертузумаб.
В патенте США №6339142 описана композиция антитела против HER2, содержащая смесь антитела против HER2 и одного или нескольких его кислых вариантов, где количество кислого варианта(ов) составляет приблизительно менее чем 25%. Примером антитела против HER2 является трастузумаб.
В патентах США №№6267958 и 6685940 (Andya et al.) описаны лиофилизированные композиции антител, в том числе композиции антител против HER2 и IgE. В WO 97/04807 и патенте США 2004/0197326A1 (Fick et al.) описаны способы лечения аллергической астмы с использованием антитела против IgE. WO 99/01556 (Lowman et al.) относится к антителу против IgE с подверженными изомеризации аспартиловыми остатками и к его улучшенным вариантам. В патенте США 2002/0045571 (Liu et al.) представлены концентрированные композиции белка со сниженной вязкостью, примерами которых являются композиции гуманизированного антитела против IgE, rhuMAb E25 и E26. В WO 02/096457 и патенте США 2004/0170623 (Arvinte et al.) описаны стабильные жидкие композиции, содержащие антитело E25 против IgE. См. также патент США 2004/0197324 A1 (Liu и Shire), относящийся к высококонцентрированной композиции антитела против IgE.
В патенте США №6171586 (Lam et al.) описаны стабильные водные композиции антител. F(ab')2 антитела rhuMAb против CD18 составляли в буферах из ацетата натрия и гистидин-HCl. Предпочтительная композиция для rhuMAb против CD18 представляла собой 10 мМ ацетат натрия, 8% трегалозу, 0,01% TWEEN 20TM, pH 5,0. Ацетатные (pH 5,0) композиции rhuMAb против CD20, сохраняемые в течение одного месяца при 40°C, проявляли более высокую стабильность, чем те образцы, которые составляли в гистидине (pH 5,0 или 6,0).
Патент США 2003/0190316 (Kakuta et al.) относится к композиции антитела hPM-1, гуманизированного антитела против рецептора для IL-6. Потеря мономера была наибольшей в цитрате натрия (pH 6,7), за которым в нисходящем порядке следовали фосфат натрия (рН 6,8), Tris-HCl (pH 7,2), гистидин-HCl (pH 7,2) и глицин (pH 7,6). Оценивали эффект фосфата Na (pH 6,5), фосфат-гистидина (pH 6,0 или 6,5), гистидин-HCl (pH 6,5) и фосфата Na (pH 6,0) на стабильность hPM-1.
В WO 2004/071439 (Burke et al.) указано, что в композиции натализумаба (гуманизированного моноклонального антитела против альфа4-интегрина) возникали примеси вследствие разрушения полисорбата-80, вероятно, в результате реакции окисления, включающей ионы металлов и гистидин. Таким образом, был выбран фосфатный буфер.
WO 2000/066160 (эквивалент на английском языке EP 1 174 148 A1) (Okada et al.) относится к композиции гуманизированного антитела C4G1, которое связывается с рецептором для фибриногена, являющимся мембранным гликопротеином тромбоцитов человека GPIIb/IIIa, в буфере из фосфата натрия или цитрата натрия.
WO 2004/019861 (Johnson et al.) относится к CDP870, пегилированному фрагменту Fab против TNFα, составляемому в виде 200 мг/мл в 50 мМ ацетате натрия (pH 5,5) и 125 мМ хлориде натрия.
WO 2004/004639 (Nesta, P.) относится к композиции для huC242-DM1, активируемого опухолью иммунотоксина, в буфере из 50 мМ янтарной кислоты (pH 6,0) и сахарозе (5% масс./об.).
В WO 03/039485 (Kaisheva et al.) открыто, что даклизумаб (гуманизированное антитело против рецептора для IL-2) обладает наибольшей стабильностью в буфере из сукцината натрия при pH 6,0 и быстро теряет эффективность в гистидине по мере окисления буфера.
WO 2004/001007 относится к моноклональному антителу против CD80 в буфере из гистидин-HCl, ацетата натрия или цитрата натрия.
Патент США №6252055 (Relton, J.) относится к антителам против CD4 и против CD23, составляемым в буферах из малеата, сукцината, ацетата натрия или фосфата, где в качестве предпочтительного буфера указан фосфат.
Патент США №5608038 (Eibl et al.) относится к высококонцентрированным поликлональным композициям иммуноглобулина, содержащим иммуноглобулин, глюкозу или сахарозу и хлорид натрия.
WO 03/015894 (Oliver et al.) относится к водной композиции 100 мг/мл SYNAGIS®, 25 мМ гистидин-HCl, 1,6 мМ глицина, pH 6,0, и к лиофилизированному SYNAGIS®, который при получении композиции (перед лиофилизацией) содержит 25 мМ гистидин, 1,6 мМ глицин и 3% масс./об. маннит при pH 6,0.
В патенте США 2004/0191243 A1 (Chen et al.) указана композиция ABX-IL8, антитела IgG2 человека.
Патент США 2003/0113316 A1 (Kaisheva et al.) относится к лиофилизированной композиции антитела против рецептора для IL2.
АНТИТЕЛА ПРОТИВ HER2
Тирозинкиназы рецепторов семейства HER являются важными медиаторами роста, дифференцировки и выживания клеток. Семейство рецепторов включает в себя четыре различных члена, в том числе рецептор эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2).
EGFR, кодируемый геном erbB1, обусловливает развитие злокачественных опухолей человека. В частности, повышенную экспрессию EGFR наблюдали при раке молочной железы, мочевого пузыря, легких, головного мозга, шеи и желудка, а также при глиобластомах. Повышенная экспрессия рецептора для EGFR часто связана с повышенной продукцией теми же опухолевыми клетками лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), что приводит к активации рецептора посредством каскада реакций аутокринной стимуляции. Baselga и Mendelsohn Pharmac. Ther. 64:127-154 (1994). В качестве терапевтических средств в лечении таких злокачественных опухолей оценивали моноклональные антитела против EGFR или его лигандов, TGF-α и EGF. См., например, Baselga и Mendelsohn., выше; Masui et al. Cancer Research 44:1002-1007 (1984); и Wu et al. J. Clin. Invest. 95:1897-1905 (1995).
Второй член семейства HER, p185neu, исходно был выявлен как продукт трансформирующего гена из нейробластом химически обрабатываемых крыс. Активированная форма протоонкогена neu возникает в результате точковой мутации (валин на глутаминовую кислоту) в трансмембранной области кодируемого белка. Амплификацию гомолога neu у человека наблюдают при раке молочной железы и яичника, и она связана с неблагоприятным прогнозом (Slamon et al., Science, 235:177-182 (1987); Slamon et al., Science, 244:707-712 (1989); и патент США №4968603). К настоящему времени для опухолей человека не указана точковая мутация, аналогичная мутации в протоонкогене neu. Также сверхэкспрессию HER2 (часто, но не всегда, обусловленную амплификацией гена) наблюдали и при других карциномах, в том числе карциномах желудка, эндометрия, слюнных желез, легких, почек, толстой кишки, щитовидной железы, поджелудочной железы и мочевого пузыря. См., в числе прочих, King et al., Science, 229:974 (1985); Yokota et al., Lancet: 1:765-767 (1986); Fukushige et al., Mol Cell Biol, 6:955-958 (1986); Guerin et al., Oncogene Res., 3:21-31 (1988); Cohen et al., Oncogene, 4:81-88 (1989); Yonemura et al., Cancer Res., 51:1034 (1991); Borst et al., Gynecol. Oncol, 38:364 (1990); Weiner et al., Cancer Res., 50:421-425 (1990); Kern et al., Cancer Res., 50:5184 (1990); Park et al., Cancer Res., 49:6605 (1989); Zhau et al., Mol Carcinog., 3:254-257 (1990); Aasland et al. Br. J. Cancer 57:358-363 (1988); Williams et al. Pathobiology 59:46-52 (1991); и McCann et al., Cancer, 65:88-92 (1990). HER2 может сверхэкспрессироваться при раке предстательной железы (Gu et al. Cancer Lett. 99:185-9 (1996); Ross et al. Hum. Pathol. 28:827-33 (1997); Ross et al. Cancer 79:2162-70 (1997); и Sadasivan et al. J. Urol. 150:126-31 (1993)).
Описаны антитела против белковых продуктов p185neu крысы и HER2 человека. Drebin и коллеги получили антитела против продукта гена neu крысы, p185neu. См., например, Drebin et al., Cell 41:695-706 (1985); Myers et al., Meth. Enzym. 198:277-290 (1991); и WO 94/22478. В Drebin et al. Oncogene 2:273-277 (1988) описано, что смеси антител, взаимодействующих с двумя различными областями p185neu, приводят к синергичным противоопухолевым эффектам в отношении трансформированных neu клеток NIH-3T3, которые имплантировали голым мышам. См. также патент США №5824311, опубликованный 20 октября, 1998.
В Hudziak et al., Mol Cell. Biol. 9(3): 1165-1172 (1989) описано получение набора антител против HER2, которые характеризовали с использованием линии клеток рака молочной железы человека SK-BR-3. Относительную клеточную пролиферацию клеток SK-BR-3 после воздействия антител определяли посредством окрашивания монослоев кристаллическим фиолетовым через 72 часа. При использовании этого анализа максимального ингибирования достигали с помощью антитела, обозначаемого 4D5, которое ингибировало клеточную пролиферацию на 56%. Другие антитела из набора снижали клеточную пролиферацию в этом анализе в меньшей степени. Кроме того, было открыто, что антитело 4D5 повышает чувствительность линий клеток рака молочной железы, сверхэкспрессирующих HER2, в отношении цитотоксических эффектов TNF-α. См. также патент США №5677171, опубликованный 14 октября 1997. Описанные в Hudziak et al. антитела против HER2 дополнительно охарактеризованы в Fendly et al. Cancer Research 50:1550-1558 (1990); Kotts et al. In Vitro 26(3):59A (1990); Sarup et al. Growth Regulation 1:72-82 (1991); Shepard et al. J. Clin. Immunol. 11(3):117-127 (1991); Kumar et al. Mol. Cell. Biol 11(2):979-986 (1991); Lewis et al. Cancer Immunol Immunother. 37:255-263 (1993); Pietras et al. Oncogene 9:1829-1838 (1994); Vitetta et al. Cancer Research 54:5301-5309 (1994); Sliwkowski et al. J. Biol. Chem. 269(20): 14661-14665 (1994); Scott et al. J. Biol. Chem. 266:14300-5 (1991); D'souza et al. Proc. Natl. Acad. Sci91:7202-7206 (1994); Lewis et al. Cancer Research 56:1457-1465 (1996); и Schaefer et al. Oncogene 15:1385-1394 (1997).
Рекомбинантный гуманизированный вариант мышиного антитела 4D5 против HER2 (huMAb4D5-8, rhuMAb против HER2, трастузумаб или HERCEPTIN®; патент США №5821337) клинически активен у пациентов с вариантами метастазирующего рака молочной железы со сверхэкспрессией HER2, где пациентам перед этим проводили обширное противоопухолевое лечение (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Управление по контролю за пищевыми продуктами и лекарственными средствами 25 сентября, 1998 выдало разрешение на продажу трастузумаба для лечения пациентов с метастазирующим раком молочной железы, у которых опухоли сверхэкспрессируют белок HER2.
Другие антитела против HER2 с различными свойствами были описаны в Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et al. Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); патент США №5783186; и Klapper et al. Oncogene 14:2099-2109 (1997).
В результате скрининга на предмет гомологии были выявлены два других члена семейства рецептора HER; HER3 (патенты США №№5183884 и 5480968, а также Kraus et al. PNAS (USA) 86:9193-9197 (1989)), и HER4 (патентная заявка EP №599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); и Plowman et al., Nature, 366:473-475 (1993)). Для обоих этих рецепторов наблюдают повышенную экспрессию по меньшей мере в некоторых линиях клеток рака молочной железы.
Как правило, в клетках рецепторы HER выявляют в различных сочетаниях, а гетеродимеризация, как предполагают, повышает разнообразие клеточных реакций на различные лиганды HER (Earp et al. Breast Cancer Research and Treatment 35:115-132 (1995)). EGFR связывается шестью различными лигандами; эпидермальным фактором роста (EGF), трансформирующим фактором роста альфа (TGF-α), амфирегулином, связывающим гепарин эпидермальным фактором роста (HB-EGF), бетацеллюлином и эпирегулином (Groenen et al. Growth Factors 11:235-257 (1994)). Семейство белков херегулинов, возникающих в результате альтернативного сплайсинга одного гена, представляет собой лиганды для HER3 и HER4. Семейство херегулинов включает альфа-, бета- и гамма-херегулины (Holmes et al., Science, 256:1205-1210 (1992); патент США №5641869; и Schaefer et al. Oncogene 15:1385-1394 (1997)); факторы дифференцировки neu (NDF), глиальные факторы роста (GGF); вещество, индуцирующее активность ацетилхолинового рецептора (ARIA); а также фактор, происходящий из чувствительных и двигательных нейронов (SMDF). В качестве обзора см. Groenen et al. Growth Factors 11:235-257 (1994); Lemke, G. Molec. & Cell. Neurosci. 7:247-262 (1996) и Lee et al. Pharm. Rev. 47:51-85 (1995). В последнее время были выявлены три дополнительных лиганда HER; нейрегулин-2 (NRG-2), для которого описано связывание с HER3 или HER4 (Chang et al. Nature 387 509-512 (1997); и Carraway et al. Nature 387:512-516 (1997)); нейрегулин-3, связывающий HER4 (Zhang et al. PNAS (USA) 94(18):9562-7 (1997)); и нейрегулин-4, связывающий HER4 (Harari et al. Oncogene 18:2681-89 (1999)). Также с HER4 связываются HB-EGF, бетацеллюлин и эпирегулин.
Хотя EGF и TGFα не связывают HER2, EGF стимулирует EGFR и HER2 к образованию гетеродимера, активирующего EGFR и приводящего к трансфосфорилированию HER2 в гетеродимере. Вероятно, димеризация и/или трансфосфорилирование активирует тирозинкиназу HER2. См. Earp et al., выше. Сходным образом, когда HER3 совместно экспрессируется с HER2, формируется активный сигнальный комплекс, а антитела против HER2 способны разрушать этот комплекс (Sliwkowski et al., J. Biol. Chem., 269(20):14661-14665 (1994)). Кроме того, при совместной экспрессии с HER2 сродство HER3 к херегулину (HRG) повышается. В отношении белкового комплекса HER2-HER3 см. также Levi et al., Journal of Neuroscience 15:1329-1340 (1995); Morrissey et al., Proc. Natl. Acad. Sci USA 92:1431-1435 (1995); и Lewis et al., Cancer Res., 56:1457-1465 (1996). HER4, сходно с HER3, формирует активный сигнальный комплекс с HER2 (Carraway and Cantley, Cell 78:5-8 (1994)).
Для того чтобы направить воздействие на путь передачи сигнала HER, было получено rhuMAb 2C4 (пертузумаб, OMNITARGTM) в качестве гуманизированного антитела, которое ингибирует димеризацию HER2 с другими рецепторами HER, ингибируя тем самым управляемые лигандом фосфорилирование и активацию, а также активацию путей RAS и AKT в нисходящем направлении. На стадии I исследования пертузумаба как отдельного средства для лечения солидных опухолей 3 индивидуумам с прогрессирующим раком яичника проводили лечение пертузумабом. У одного индивидуума наблюдали продолжительную частичную реакцию, а еще у одного индивидуума наблюдали стабильное состояние заболевания в течение 15 недель Agus et al. Proc Am Soc Clin Oncol 22:192, Abstract 771 (2003).
АНТИТЕЛА ПРОТИВ DR5
В данной области были выявлены различные лиганды и рецепторы, относящиеся к суперсемейству фактора некроза опухоли (TNF). В число таких лигандов входят фактор некроза опухоли альфа, ("TNF-альфа"), фактор некроза опухоли бета ("TNF-бета" или "лимфотоксин-альфа"), лимфотоксин-бета ("LT-бета"), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, LIGHT, лиганд Apo-1 (также обозначаемый как лиганд Fas или лиганд CD95), лиганд Apo-2 (также обозначаемый как Apo2L или TRAIL), лиганд Apo-3 (также обозначаемый как TWEAK), APRIL, лиганд OPG (также обозначаемый как лиганд RANK, ODF или TRANCE) и TALL-1 (также обозначаемый как BlyS, BAFF или THANK). (См., например, Ashkenazi, Nature Review, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol, 11:255-260 (2000); Golstein, Curr. Biol, 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, стр. 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol, 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), WO 97/01633, опубликованный 16 января, 1997; WO 97/25428, опубликованный 17 июля, 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426, опубликованный 2 июля, 1998; WO 98/46751, опубликованный 22 октября, 1998; WO/98/18921, опубликованный 7 мая, 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)).
Как правило, индукция различных клеточных реакций, опосредуемая такими лигандами семейства TNF, вызывается их связыванием со специфическими клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF связываются с и индуцируют различную биологическую активность посредством "рецепторов смерти" на поверхности клетки, активируя каспазы или ферменты, приводящие к гибели клетки или осуществляющие каскад реакций апоптоза (Salvesen et al., Cell, 91:443-446 (1997)). В число выявленных к настоящему времени членов суперсемейства рецепторов TNF входят TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также обозначаемый как Apo-1 или CD95), DR4 (также обозначаемый как TRAIL-R1), DR5 (также обозначаемый как Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также обозначаемый как DR3 или TRAMP).
Большинство этих членов семейства рецепторов TNF обладает обычной структурой рецепторов клеточной поверхности, включая внеклеточную, трансмембранную и внутриклеточную области, тогда как у других рецепторов, встречающихся в природе в виде растворимых белков, отсутствуют трансмембранный и внутриклеточный домены. Внеклеточный участок обычных TNFR содержит набор повторяющихся аминокислотных последовательностей из множества богатых цистеином доменов (CRD), начиная с NH2-конца.
Несколько лет назад в качестве члена семейства цитокинов TNF был выявлен лиганд, обозначаемый как Apo-2L или TRAIL (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США №5763223, опубликованный 9 июня 1998; патент США №6284236, опубликованный 4 сентября 2001). Полноразмерная природная последовательность полипептида Apo2L/TRAIL человека представляет собой трансмембранный белок II типа, длиной 281 аминокислота. Некоторые клетки способны продуцировать природную растворимую форму полипептида посредством ферментного расщепления внеклеточной области полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)). В результате кристаллографических исследований растворимых форм Apo2L/TRAIL выявлена гомотримерная структура, сходная со структурами TNF и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1999); Cha et al., Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако было открыто, что в отличие от других членов семейства TNF, Apo2L/TRAIL обладает уникальным структурным свойством в том отношении, что три остатка цистеина (в положении 230 каждой субъединицы в гомотримере) вместе координируют атом цинка, и что связывание цинка важно для устойчивости и биологической активности тримера. (Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
В литературе было описано, что Apo2L/TRAIL может играть роль в регуляции иммунной системы, в том числе при аутоиммунных заболеваниях, таких как ревматоидный артрит (см., например, Thomas et al., J. Immunol, 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)).
Также было описано, что растворимые формы Apo2L/TRAIL индуцируют апоптоз у множества раковых клеток, включая опухоли толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и головного мозга, а также меланому, лейкоз и множественную миелому (см., например, Wiley et al., выше; Pitti et al, выше; патент США №6030945, опубликованный 29 февраля 2000; патент США №6746668, опубликованный 8 июня 2004; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). Исследования на моделях опухолей на мышах in vivo позволили предположить, что Apo2L/TRAIL, отдельно или в сочетании с химиотерапией или лучевой терапией, может оказывать значительные противоопухолевые эффекты (см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); заявка PCT США/00/15512; заявка PCT США/01/23691). В отличие от многих типов раковых клеток, у большинства обычных типов клеток человека наблюдают устойчивость к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al, выше). Jo et al. описывали, что меченная полигистидином растворимая форма Apo2L/TRAIL индуцировала апоптоз in vitro в обычных выделенных гепатоцитах человека, в отличие от не-человеческих гепатоцитов (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Полагают, что определенные композиции рекомбинантного Apo2L/TRAIL могут различаться в аспекте биохимических свойств и биологической активности в отношении патологических клеток в сравнении с нормальными, что зависит, например, от наличия или отсутствия молекулы-метки, содержания цинка и % содержания тримера (см., Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)).
Было открыто, что Apo2L/TRAIL связывает по меньшей мере пять различных рецепторов. По меньшей мере два из рецепторов, связывающихся с Apo2L/TRAIL, содержат функциональный цитоплазматический домен смерти. Один такой рецептор был обозначен как "DR4" (и альтернативно как TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованный 30 июля, 1998; WO 99/37684, опубликованный 29 июля, 1999; WO 00/73349, опубликованный 7 декабря, 2000; патент США №6433147, опубликованный 13 августа, 2002; патент США №6461823, опубликованный 8 октября, 2002 и патент США №6342383, опубликованный 29 января, 2002).
Другой такой рецептор для Apo2L/TRAIL был обозначен как DR5 (также он был альтернативно обозначен как Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER) (см., например, Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO 98/51793, опубликованный 19 ноября, 1998; WO 98/41629, опубликованный 24 сентября, 1998; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа, 1998; EP 870827, опубликованный 14 октября, 1998; WO 98/46643, опубликованный 22 октября, 1998; WO 99/02653, опубликованный 21 января, 1999; WO 99/09165, опубликованный 25 февраля, 1999; WO 99/11791, опубликованный 11 марта, 1999; патент США №2002/0072091, опубликованный 13 августа, 2002; патент США №2002/0098550, опубликованный 7 декабря, 2001; патент США №6313269, опубликованный 6 декабря, 2001; патент США №2001/0010924, опубликованный 2 августа, 2001; патент США №2003/01255540, опубликованный 3 июля, 2003; патент США №2002/0160446, опубликованный 31 октября, 2002; патент США №2002/0048785, опубликованный 25 апреля, 2002; патент США №6342369, опубликованный в феврале, 2002; патент США №6569642, опубликованный 27 мая, 2003; патент США №6072047, опубликованный 6 июня, 2000; патент США №6642358, опубликованный 4 ноября, 2003; патент IS 6743625, опубликованный 1 июня, 2004). Сходно с DR4, описано, что DR5 содержит цитоплазматический домен смерти и способен передавать сигнал апоптоза при связывании лиганда (или при связывании такой молекулы, как антитело-агонист, воспроизводящее активность лиганда). Кристаллическая структура комплекса, формируемого Apo-2L/TRAIL и DR5, описана в Hymowitz et al., Molecular Cell, 4:563-571 (1999).
При связывании лиганда DR4 и DR5 способны запускать апоптоз независимо от вовлечения и активации инициатора апоптоза, каспазы-8, посредством содержащей домен смерти вспомогательной молекулы, которую обозначают как FADD/Mort1 (Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)).
Было описано, что Apo2L/TRAIL также связывает те рецепторы, которые обозначены как DcR1, DcR2 и OPG, функционирующие, как предполагают, в качестве ингибиторов, а не передатчиков сигнала (см., например, DcR1 (также обозначаемый как TRID, LIT или TRAIL-R3) (Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); и Mongkolsapaya et al., J. Immunol, 160:3-6 (1998)); DcR2 (также называемый TRUNDD или TRAIL-R4) (Marsters et al., Curr. Biol., 7: 1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)), а также OPG. В отличие от DR4 и DR5, рецепторы DcR1 и DcR2 не передают сигнал апоптоза.
В литературе были описаны определенные антитела, связывающиеся с рецепторами DR4 и/или DR5. Например, антитела против DR4, направленные к рецептору DR4 и обладающие агонистической или апоптотической активностью, описаны, например, в WO 99/37684, опубликованном 29 июля, 1999; WO 00/73349, опубликованном 12 июля, 2000; WO 03/066661, опубликованном 14 августа, 2003. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); WO 02/097033, опубликованный 2 декабря, 2002; WO 03/042367, опубликованный 22 мая, 2003; WO 03/038043, опубликованный 8 мая, 2003; WO 03/037913, опубликованный 8 мая, 2003. Аналогично были описаны некоторые антитела против DR5, см., например, WO 98/51793, опубликованный 8 ноября, 1998; Griffith et al., J. Immunol, 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опубликованный 8 мая, 2003; WO 03/037913, опубликованный 8 мая, 2003. Кроме того, были описаны некоторые антитела, обладающие перекрестной реактивностью в отношении обоих рецепторов DR4 и DR5 (см., например, патент США №6252050, опубликованный 26 июня, 2001).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по меньшей мере частично, относится к выявлению гистидин-ацетата, pH от 5,5 до 6,5, как особенно эффективного буфера для составления моноклональных антител, особенно полноразмерных антител IgG1, которые чувствительны к дезамидированию и/или агрегации. Композиция замедляет разрушение содержащегося в ней продукта в виде антитела.
Таким образом, в первом аспекте изобретение относится к стабильной фармацевтической композиции, содержащей моноклональное антитело в буфере гистидин-ацетат, pH от 5,5 до 6,5. Предпочтительно моноклональное антитело связывает антиген, выбранный из группы, которая состоит из HER2, CD20, DR5, BR3, IgE и VEGF.
Кроме того, изобретение относится к способу лечения заболевания или нарушения у индивидуума, где способ включает введение индивидууму композиции в количестве, эффективном для лечения заболевания или нарушения.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей: (a) полноразмерное антитело IgG1, чувствительное к дезамидированию или агрегации, в количестве приблизительно от 10 мг/мл до приблизительно 250 мг/мл; (b) буфер гистидин-ацетат, pH от 5,5 до 6,5; (c) сахарид, выбранный из группы, которая состоит из трегалозы и сахарозы, в количестве приблизительно от 60 мМ до приблизительно 250 мМ; и (d) полисорбат-20 в количестве приблизительно от 0,01% до приблизительно 0,1%.
Также изобретение относится к способу снижения дезамидирования или агрегации терапевтического моноклонального антитела, где способ включает составление антитела в буфере гистидин-ацетат, pH от 5,5 до 6,5.
В еще одном аспекте изобретение относится к фармацевтической композици, которая содержит связывающееся с доменом II HER2 антитело в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид и поверхностно-активное вещество.
Также изобретение относится к фармацевтической композиции, содержащей пертузумаб в количестве приблизительно от 20 мг/мл до приблизительно 40 мг/мл, буфер гистидин-ацетат, сахарозу и полисорбат-20, где pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
Также изобретение относится к фармацевтической композиции, содержащей антитело против DR5 в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид и поверхностно-активное вещество.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей апомаб в количестве приблизительно от 10 мг/мл до приблизительно 30 мг/мл, буфер гистидин-ацетат, трегалозу и полисорбат-20, где pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
В еще одном аспекте изобретение относится к способу лечения рака у индивидуума, включающему введение индивидууму фармацевтической композиции в количестве, эффективном для лечения рака.
Также изобретение относится к флакону с пробкой, проницаемой для шприца, или к емкости из нержавеющей стали, содержащим внутри флакона или емкости композицию, необязательно, в замороженном виде.
Кроме того, изобретение относится к способу получения фармацевтической композиции, где способ включает: (a) получение композиции моноклонального антитела; и (b) оценку физической стабильности, химической стабильности или биологической активности моноклонального антитела в композиции.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 представлены домены I-IV (SEQ ID No. 19-22 соответственно) внеклеточного домена HER2.
На фигурах 2A и 2B представлены выравнивания аминокислотных последовательностей вариабельного домена легкой цепи (VL) (фигура 2A) и вариабельного домена тяжелой цепи (VH) (фигура 2B) мышиного моноклонального антитела 2C4 (SEQ ID No. 1 и 2 соответственно); VH и VL домены варианта 574 гуманизированного 2C4 (SEQ ID No. 3 и 4 соответственно), а также консенсусные каркасные области VH и VL человека (hum κ1, подгруппа легкой каппа-цепи; humIII, подгруппа III тяжелой цепи) (SEQ ID No. 5 и 6 соответственно). Звездочками обозначены различия между вариантом 574 гуманизированного 2C4 и мышиным моноклональным антителом 2C4 или между вариантом 574 гуманизированного 2C4 и каркасной областью человека. Гипервариабельные участки (CDR) представлены в квадратных скобках.
На фигурах 3A и 3B представлены аминокислотные последовательности легкой цепи и тяжелой цепи пертузумаба (SEQ ID No. 15 и 16 соответственно). CDR выделены жирным шрифтом. Рассчитанные молекулярные массы легкой цепи и тяжелой цепи составляют 23526,22 Да и 49216,56 Да (цистеины в восстановленной форме). К аспарагину 299 тяжелой цепи присоединена углеводная группа.
На фигурах 4A и 4B представлены аминокислотные последовательности легкой и тяжелой цепей пертузумаба, где каждая содержит целую N-концевую последовательность сигнального пептида (SEQ ID No. 17 и 18 соответственно).
На фигуре 5 схематично представлено связывание 2C4 в участке связывания гетеродимеров HER2, которое тем самым предотвращает гетеродимеризацию с активированным EGFR или HER3.
На фигуре 6 представлена связь HER2/HER3 с каскадами реакций MAPK и Akt.
На фигуре 7 представлено сравнение активности трастузумаба и пертузумаба.
На фигуре 8 представлена стабильность композиции пертузумаба при ионообменных (IEX) анализах.
На фигуре 9 представлена стабильность композиции пертузумаба при анализе посредством гель-фильтрации (SEC).
На фигуре 10 представлена физическая стабильность пертузумаба в различных композициях.
Фигура 11 представлена из исследования перемешивания жидких композиций пертузумаба.
Фигура 12 представлена из другого исследования перемешивания жидких композиций пертузумаба.
Фигура 13 представлена из исследования замораживания-размораживания композиции пертузумаба.
На фигурах 14A и 14B представлены аминокислотные последовательности легкой цепи (SEQ ID No. 13) и тяжелой цепи (SEQ ID No. 14) трастузумаба.
На фигурах 15A и 15B представлен вариант последовательности легкой цепи пертузумаба (SEQ ID No. 23) и вариант последовательности тяжелой цепи пертузумаба (SEQ ID No. 24).
На фигурах 16A и 16B представлены структуры олигосахаридов, обычно наблюдаемых в антителах IgG.
На фигурах 17A и 17B представлены последовательности легкой и тяжелой цепей (SEQ ID No. 37-44) специфических антител E25, E26, HAE1 и Hu-901 против IgE. На фигуре 17A вариабельный домен легкой цепи заканчивается остатками VEIK, остатком 111. На фигуре 17B вариабельный домен тяжелой цепи заканчивается остатками VTVSS, приблизительно остатком 120.
На фигуре 18A представлено выравнивание последовательностей для сравнения аминокислотных последовательностей вариабельного домена легкой цепи (VL) для каждого из мышиного 2H7 (SEQ ID No. 25), варианта гуманизированного 2H7v16 (SEQ ID No. 26) и легкой каппа-цепи человека подгруппы I (SEQ ID No. 27). CDR в VL из 2H7 и hu2H7v16 представляют собой следующие: CDR1 (SEQ ID No. 57), CDR2 (SEQ ID No. 58) и CDR3 (SEQ ID No. 59).
На фигуре 18B представлено выравнивание последовательностей для сравнения аминокислотных последовательностей вариабельного домена тяжелой цепи (VH) для каждого из 2H7 мыши (SEQ ID No. 28), варианта гуманизированного 2H7v16 (SEQ ID No. 29), и консенсусной последовательности тяжелой цепи человека подгруппы III (SEQ ID No. 30). CDR в VH из 2H7 и hu2H7v16 представляют собой следующие: CDR1 (SEQ ID No. 60), CDR2 (SEQ ID No. 61) и CDR3 (SEQ ID No. 62).
На фиг. 18A и фиг. 18B CDR1, CDR2 и CDR3 в каждой цепи заключены в скобки, которые фланкируются каркасными областями, FR1-FR4, как указано. 2H7 относится к антителу 2H7 мыши. Звездочками между двумя рядами последовательностей указаны положения, которые являются различными между двумя последовательностями. Нумерация остатков соответствует Kabat et al. Sequence of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), со вставками, указанными как a, b, c, d и e.
На фигуре 19 представлены последовательности вариабельных доменов трех различных антител против VEGF с SEQ ID No. 31-36.
На фигуре 20 представлен профиль элюирования при гель-фильтрации (SEC) следующих образцов апомаба: (a) контроль и композиции, полученные при (b) pH 4,0, (c) pH 5,0, (d) pH 6,0 и (e) pH 7,0. Перед анализом составленные образцы хранили при 40°C в течение 2 месяцев.
На фигуре 21 представлен профиль значений pH для потери мономера антитела апомаб в процессе хранения. В процессе хранения при 30°C и 40°C проводили мониторинг кинетики мономера посредством SEC и вычисляли константу скорости реакции первого порядка.
На фигуре 22 представлен профиль элюирования при ионообменной хроматографии (IEC) образцов апомаба следующим образом: (a) контроль и композиции, полученные при (b) pH 4,0, (c) pH 5,0, (d) pH 6,0 и (e) pH 7,0. Перед анализом составленные образцы хранили при 40°C в течение 2 месяцев.
На фигуре 23 представлен профиль значений pH для снижения в процессе хранения главного пика при IEC. В процессе хранения при 30°C и 40°C проводили мониторинг кинетики мономера посредством IEC и вычисляли константу скорости реакции первого порядка.
На фигуре 24 представлена нуклеотидная последовательность кДНК лиганда Apo-2 человека (SEQ ID No. 45) и получаемой на ее основе аминокислотной последовательности (SEQ ID No. 46). "N" в положении нуклеотида 447 (в SEQ ID No. 45) используют для указания того, что нуклеотид может представлять собой "T" или "G".
На фигурах 25A и 25B представлена аминокислотная последовательность из 411 аминокислот для рецептора DR5 человека (SEQ ID No. 47), как опубликовано в WO 98/51793 19 ноября, 1998, и кодирующая нуклеотидная последовательность (SEQ ID No. 48).
На фигурах 26A и 26B представлена аминокислотная последовательность из 440 аминокислот для рецептора DR5 человека (SEQ ID No. 49) и кодирующая нуклеотидная последовательность (SEQ ID No. 50), как также опубликовано в WO 98/35986 20 августа, 1998.
На фигуре 27 представлена аминокислотная последовательность тяжелой цепи апомаба 7.3 (SEQ ID No. 51).
На фигуре 28 представлена аминокислотная последовательность легкой цепи апомаба 7.3 (SEQ ID No. 52).
На фигурах 29 представлено выравнивание аминокислотных последовательностей тяжелой цепи 16E2 (SEQ ID No. 53) и тяжелой цепи апомаба 7.3 (SEQ ID No. 51).
На фигуре 30 представлено выравнивание аминокислотных последовательностей легкой цепи 16E2 (SEQ ID No. 54) и легкой цепи апомаба 7.3 (SEQ ID No. 52).
На фигурах 31A и 31B представлены аминокислотная последовательность вариабельного домена тяжелой цепи (фиг. 31A; SEQ ID No. 55) и аминокислотная последовательность вариабельного домена легкой цепи (фиг. 31B; SEQ ID No. 56) апомаба 7.3. Остатки CDR указаны жирным шрифтом.
На фигуре 32 представлено выравнивание легких цепей зрелых 2H7v16 и 2H7v511 (SEQ ID No. 63 и 64 соответственно). Последовательности представлены с помощью нумерации остатков вариабельного домена Kabat и нумерации остатков константного домена Eu.
На фигуре 33 представлено выравнивание тяжелых цепей зрелых 2H7v16 и 2H7v511 (SEQ ID No. 65 и 66 соответственно). Последовательности показаны с помощью нумерации остатков вариабельного домена Kabat и нумерации остатков константного домена Eu.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
I. Определения
Термин "фармацевтическая композиция" относится к композиции, находящейся в такой форме, которая обеспечивает эффективность для биологической активности активного ингредиента, и которая не содержит дополнительных компонентов, которые являются недопустимо токсичными для субъекта, которому намереваются вводить композицию. Такие композиции являются стерильными.
"Стерильная" композиция является асептическим или не содержит каких-либо микроорганизмов и их спор.
Здесь "замороженная" композиция представляет собой композицию, находящуюся при температуре ниже 0°C. Как правило, замороженная композиция не является лиофилизированной, и ее не подвергают ни предварительной, ни последующей лиофилизации. Предпочтительно замороженная композиция содержит замороженное лекарственное вещество для хранения (в емкости из нержавеющей стали) или замороженный лекарственный продукт (в конечной форме во флаконе).
"Стабильная" композиция представляет собой композицию, в которой при хранении белок по существу сохраняет свою физическую стабильность, и/или химическую стабильность, и/или биологическую активность. Предпочтительно при хранении композиция по существу сохраняет свою физическую и химическую стабильность, а также свою биологическую активность. Период хранения, как правило, выбирают исходя из предполагаемого периода хранения композиции. В данной области являются доступными различные аналитические способы измерения стабильности белка, и они рассмотрены, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) и в Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерять при выбранной температуре в течение выбранного периода времени. Предпочтительно композиция является стабильной при приблизительно 40°C в течение по меньшей мере приблизительно 2-4 недель и/или она является стабильной при приблизительно 5°C и/или 15°C в течение по меньшей мере 3 месяцев, и/или она является стабильной при приблизительно -20°C в течение по меньшей мере 3 месяцев или по меньшей мере 1 года. Более того, композиция предпочтительно является стабильной после замораживания (например, до -70°C) и размораживания композиции, например, после 1, 2 или 3 циклов замораживания и размораживания. Стабильность можно оценивать качественно и/или количественно множеством различных способов, в том числе оценкой формирования агрегата (например, с использованием гель-фильтрации, посредством измерения мутности, и/или визуальным исследованием); оценкой гетерогенности заряда с использованием катионообменной хроматографии или капиллярного зонного электрофореза; анализом N-концевой или C-концевой последовательности; масс-спектроскопическим анализом; анализом SDS-PAGE для сравнения уменьшенного и целого антитела; анализом пептидных карт (например, триптических или LYS-C); оценкой биологической активности или функции антитела в отношении связывания антигена; и т.д. Нестабильность может включать в себя любое или несколько из: агрегации, дезамидирования (например, дезамидирования Asn), окисления (например, окисления Met), изомеризации (например, изомеризации Asp), расщепления/гидролиза/фрагментации (например, фрагментации шарнирной области), образования сукцинимида, неспаренного цистеина(ов), N-концевого удлинения, C-концевого процессинга, изменения гликозилирования, и т.д.
Здесь "дезамидированное" моноклональное антитело представляет собой антитело, в котором один или несколько остатков аспарагина представляют собой производные, например, аспарагиновую кислоту или изо-аспарагиновую кислоту.
Антитело, которое является "подверженным дезамидированию" представляет собой антитело, содержащее один или несколько остатков, для которых выявлено, что они подвержены дезамидированию.
Антитело, которое является "подверженным агрегации" представляет собой антитело, для которого выявлено, что оно образует агрегат с другой(ими) молекулой антитела, особенно при замораживании и/или перемешивании.
Антитело, которое является "подверженным фрагментации" представляет собой антитело, для которого было выявлено, что оно расщепляется на два или более фрагментов, например, в его шарнирной области.
Под "снижением дезамидирования, агрегации или фрагментации" подразумевают предотвращение или уменьшение степени дезамидирования, агрегации или фрагментации относительно моноклонального антитела, составленного при другом значении pH или в другом буфере.
Здесь "биологическая активность" моноклонального антитела относится к способности антитела связываться с антигеном и приводить к поддающемуся измерению биологическому ответу, который можно измерять in vitro или in vivo. Такая активность может являться антагонистической (например, где антитело представляет собой антитело против HER2) или агонистической (например, где антитело связывает DR5). В случае пертузумаба, в одном варианте осуществления биологическая активность относится к способности составленного антитела ингибировать пролиферацию клеточной линии рака молочной железы человека MDA-MB-175-VII. В случае, где антитело представляет собой апомаб, биологическая активность может относиться, например, к способности составленного антитела вызывать гибель клеток карциномы кишечника, Colo205.
Под "изотоничным" подразумевают, что представляющая интерес композиция обладает по существу таким же осмотическим давлением, что и кровь человека. Изотонические композиции, как правило, обладают осмотическим давлением приблизительно от 250 до 350 мОсм. Изотоничность можно измерять с использованием осмометра, например, по принципу измерения давления паров или по принципу замораживания льдом.
Здесь "буфер" относится к буферному раствору, который выдерживает изменения pH с помощью его компонентов в виде сопряженных кислот-оснований. Буфер по этому изобретению предпочтительно обладает значением pH, находящимся в диапазоне приблизительно от 5,0 до приблизительно 7,0, предпочтительно приблизительно от 5,5 до приблизительно 6,5, например, приблизительно от 5,8 до приблизительно 6,2 и наиболее предпочтительно обладает значением pH приблизительно 6,0. Примеры буферов, которые охватывают этот диапазон pH, включают в себя ацетатный, сукцинатный, глюконатный, гистидиновый, цитратный, глицилглициновый и другие буферы на основе органических кислот. В рамках настоящей заявки предпочтительным буфером является гистидиновый буфер.
"Гистидиновый буфер" представляет собой буфер, содержащий ионы гистидина. Примеры гистидиновых буферов включают в себя хлорид гистидина, ацетат гистидина, фосфат гистидина, сульфат гистидина. Было обнаружено, что предпочтительным гистидиновым буфером, выявленным в примерах настоящего описания, является ацетат гистидина. В предпочтительном варианте осуществления гистидин-ацетатный буфер получают титрованием L-гистидина (свободное основание, твердое вещество) уксусной кислотой (жидкость). Предпочтительно, значение pH гистидинового буфера или гистидин-ацетатного буфера составляет от 5,5 до 6,5, предпочтительно от 5,8 до 6,2.
Здесь "сахарид" включает в себя общую структуру (CH2O)n и ее производные, в том числе моносахариды, дисахариды, трисахариды, полисахариды, спирты сахаров, редуцирующие сахара, нередуцирующие сахара, и т.д. В рамках настоящей заявки примеры сахаридов включают глюкозу, сахарозу, трегалозу, лактозу, фруктозу, мальтозу, декстран, эритрит, глицерин, арабит, силит, сорбит, маннит, мелибиозу, мелизитозу, рафинозу, маннотриозу, стахиозу, мальтозу, лактулозу, мальтулозу, глюцит, мальтит, лактит, изомальтулозу и т.д. В рамках настоящей заявки предпочтительный сахарид представляет собой нередуцирующий дисахарид, такой как трегалоза или сахароза.
Здесь "поверхностно-активное вещество" относится к поверхностно-активному средству, предпочтительно к неионному поверхностно-активному веществу. В рамках настоящей заявки примеры поверхностно-активных веществ включают в себя полисорбат (например, полисорбат-20 и полисорбат-80); полоксамер (например, полоксамер 188); тритон; додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарил-сульфобетаин; лаурил-, миристил-, линолеил- или стеарил-саркозин; линолеил-, миристил- или цетил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропил-диметиламин; натрий метилкокоил-, или динатрий метилолеил-таурат; и серию MONAQUATTM (Mona Industries, Inc., Paterson, New Jersey); полиэтилгликоль, полипропилгликоль и сополимеры этилена и пропиленгликоля (например, Pluronics, PF68 и т.д.); и т.д. В рамках настоящего описания предпочтительным поверхностно-активным веществом является полисорбат-20.
"Рецептор HER" представляет собой рецепторный белок-тирозинкиназу, который принадлежит семейству рецепторов HER и включает в себя рецепторы EGFR, HER2, HER3 и HER4 и другие члены этого семейства, которые будут обнаружены в будущем. Рецептор HER, как правило, содержит внеклеточный домен, который может связывать лиганд HER; липофильный трансмембранный домен; консервативный внутриклеточный тирозинкиназный домен; и C-концевой сигнальный домен, который содержит несколько остатков тирозина, которые могут быть фосфорилированы. Предпочтительно рецептор HER представляет собой рецептор HER человека с природной последовательностью.
Внеклеточный домен HER2 содержит четыре домена, домен I (аминокислотные остатки приблизительно 1-195), домен II (аминокислотные остатки приблизительно 196-320), домен III (аминокислотные остатки приблизительно 321-488) и домен IV (аминокислотные остатки приблизительно 489-632) (нумерация остатков без сигнального пептида). См. Garrett et al. Mol. Cell. 11: 495-505 (2003), Cho et al. Nature 421: 756-760 (2003), Franklin et al. Cancer Cell 5:317-328 (2004), или Plowman et al Proc. Natl. Acad. Sci 90:1746-1750 (1993). См. также фиг. 1 настоящего описания.
Здесь "ErbB1", "HER1", "рецептор эпидермального фактора роста" и "EGFR" используют взаимозаменяемо, и они относятся к EGFR, как описано, например, в Carpenter et al. Ann. Rev. Biochem. 56:881-914 (1987), включая их природные мутантные формы (например, мутантную форму EGFR с делецией, как в Humphrey et al. PNAS (USA) 87:4207-4211 (1990)). erbB1 относится к гену, кодирующему белковый продукт EGFR.
Здесь "ErbB2" и "HER2" используют взаимозаменяемо, и они относятся к белку HER2 человека, описанному, например, в Semba et al., PNAS (USA) 82:6497-6501 (1985) и Yamamoto et al. Nature 319:230-234 (1986) (регистрационный номер Genebank X03363). Термин "erbB2" относится к гену, кодирующему ErbB2 человека, а "neu" относится к гену, кодирующему p185neu крысы. Предпочтительным HER2 является HER2 человека с природной последовательностью.
"ErbB3" и "HER3" относятся к рецепторному полипептиду, описанному, например, в патентах США №№5183884 и 5480968, а также в Kraus et al. PNAS (USA) 86:9193-9197 (1989).
Здесь "ErbB4" и "HER4" относятся к рецепторному полипептиду, описанному, например, в европейской патентной заявке №599274; Plowman et al., Proc. Natl. Acad. Sci USA, 90:1746-1750 (1993); и Plowman et al., Nature, 366:473-475 (1993), включая его изоформы, например, как описано в WO 99/19488, опубликованном 22 апреля, 1999.
Под термином "лиганд HER" подразумевают полипептид, который связывается с рецептором HER и/или активирует его. Представляющий особый интерес в рамках настоящей заявки лиганд HER представляет собой лиганд HER человека с природной последовательностью, такой как эпидермальный фактор роста (EGF) (Savage et al., J. Biol. Chem. 247:7612-7621 (1972)); трансформирующий фактор роста альфа (TGF-α) (Marquardt et al., Science 223:1079-1082 (1984)); амфирегулин, также известный как аутокринный фактор роста кератиноцитов или шванномы (Shoyab et al. Science 243:1074-1076 (1989); Kimura et al. Nature 348:257-260 (1990); и Cook et al. Mol. Cell Biol 11:2547-2557 (1991)); бетацеллюлин (Shing et al., Science 259:1604-1607 (1993); и Sasada et al. Biochem. Biophys. Res. Commun. 190:1173 (1993)); связывающий гепарин эпидермальный фактор роста (HB-EGF) (Higashiyama et al., Science 251:936-939 (1991)); эпирегулин (Toyoda et al., J. Biol. Chem. 270:7495-7500 (1995); и Komurasaki et al. Oncogene 15:2841-2848 (1997)); херегулин (см. ниже); нейрорегулин-2 (NRG-2) (Carraway et al., Nature 387:512-516 (1997)); нейрорегулин-3 (NRG-3) (Zhang et al., Proc. Natl. Acad. Sci 94:9562-9567 (1997)); нейрорегулин-4 (NRG-4) (Harari et al. Oncogene 18:2681-89 (1999)) или крипто (CR-1) (Kannan et al. J. Biol. Chem. 272(6):3330-3335 (1997)). Лиганды HER, которые связывают EGFR, включают в себя EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лиганды HER, которые связывают HER3, включают херегулины. Лиганды HER, способные связывать HER4, включают бетацеллюлин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и херегулины.
Здесь "херегулин" (HRG) относится к полипептиду, кодируемому продуктом гена херегулина, как описано в патенте США №5641869 или Marchionni et al., Nature, 362:312-318 (1993). Примеры херегулинов включают в себя херегулин-α, херегулин-β1, херегулин-β2 и херегулин-β3 (Holmes et al., Science, 256:1205-1210 (1992); и патент США №5641869); фактор дифференцировки neu (NDF) (Peles et al. Cell 69:205-216 (1992)); вещество, индуцирующее активность ацетилхолинового рецептора (ARIA) (Falls et al. Cell 72:801-815 (1993)); факторы роста глии (GGF) (Marchionni et al., Nature, 362:312-318 (1993)); фактор, происходящий из чувствительных и двигательных нейронов (SMDF) (Ho et al. J. Biol. Chem. 270:14523-14532 (1995)); γ-херегулин (Schaefer et al. Oncogene 15:1385-1394 (1997)). Термин включает в себя биологически активные фрагменты и/или варианты аминокислотных последовательностей полипептида HRG с природной последовательностью, такие как его фрагмент, представляющий собой подобный EGF домен (например, HRGβ1177-244).
Здесь "димер HER" представляет собой не ковалентно связанный димер, содержащий по меньшей мере два различных рецептора HER. Такие комплексы могут образовываться в случае, если клетка, экспрессирующая два или более рецепторов HER, подвергается воздействию лиганда HER, и их можно выделять посредством иммунопреципитации и анализировать посредством SDS-PAGE, как описано, например, в Sliwkowski et al., J. Biol. Chem., 269(20):14661-14665 (1994). Примеры таких димеров HER включают в себя гетеродимеры EGFR-HER2, HER2-HER3 и HER3-HER4. Более того, димер HER может содержать два или более рецепторов HER2, объединенных с отличным от них рецептором HER, таким как HER3, HER4 или EGFR. С димером могут быть связаны другие белки, такие как субъединицы рецепторов цитокинов (например, gp130).
"Гетеродимерный участок связывания" на HER2, относится к участку внеклеточного домена HER2, который контактирует, или связывается, с участком внеклеточного домена EGFR, HER3 или HER4 при формировании вместе с ними димера. Участок выявлен на домене II HER2. Franklin et al. Cancer Cell 5:317-328 (2004).
"Активация HER" или "активация HER2" относится к активации, или фосфорилированию, любого одного или нескольких рецепторов HER, или рецепторов HER2. Как правило, активация HER приводит к передаче сигнала (которую, например, вызывает фосфорилирование внутриклеточным киназным доменом рецептора HER остатков тирозина в рецепторе HER или субстратном полипептиде). Активация HER может быть опосредована связыванием лиганда HER с димером HER, который содержит представляющий интерес рецептор HER. Связывание лиганда HER с димером HER может активировать киназный домен одного или нескольких рецепторов HER в димере, и, таким образом, приводить к фосфорилированию остатков тирозина в одном или нескольких рецепторах HER и/или фосфорилированию остатков тирозина в дополнительном субстратном полипептиде(ах), таком как внутриклеточные киназы Akt или MAPK.
Здесь термин "антитело" используют в наиболее широком смысле и, конкретно, он включает в себя полноразмерные моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), образованные по меньшей мере двумя полноразмерными антителами, и фрагменты антител, при условии, что они проявляют требуемую биологическую активность.
Как используют здесь, термин "моноклональное антитело" относится к антителу, полученному из совокупности по существу гомогенных антител, т.е., отдельные антитела, составляющие совокупность, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые могут возникать в процессе продукции моноклонального антитела, и такие варианты, как привило, представлены в небольших количествах. В отличие от композиций поликлональных антител, которые, как правило, включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела являются предпочтительными в том, что в них отсутствуют примеси других иммуноглобулинов. Определение "моноклональный" указывает на тот признак антитела, что его получают из по существу гомогенной совокупности антител, и не подразумевает того, что антитело должно быть получено каким-либо конкретным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, могут быть получены способом гибридом, впервые описанным Kohler et al., Nature, 256:495 (1975), или они могут быть получены способами рекомбинантных ДНК (см., например, патент США №4816567). "Моноклональные антитела" также могут быть получены из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol, 222:581-597 (1991).
Здесь моноклональные антитела конкретно включают в себя "химерные" антитела, в которых участок тяжелой и/или легкой цепи является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США №4816567; и Morrison et al., Proc. Natl. Acad. Sci USA, 81:6851-6855 (1984)). Представляющие интерес здесь химерные антитела включают в себя "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельного домена, не относящегося к человеку, примата (например, старосветской мартышки, обезьяны и т.д.) и последовательности константного домена человека.
"Фрагменты антител" содержат участок полноразмерного антитела, предпочтительно содержащий его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают в себя фрагменты Fab, Fab', F(ab')2 и Fv; димеры; линейные антитела; одноцепочечные молекулы антител; и полиспецифичные антитела, образованные из фрагмента(ов) антитела.
"Полноразмерное антитело" представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с природной последовательностью (например, константные домены человека с природной последовательностью) или аминокислотные последовательности их вариантов. Предпочтительно, полноразмерное антитело обладает одной или несколькими эффекторными функциями.
Здесь "антитело основного типа" относится к структуре антитела в композиции, которая является количественно преобладающей молекулой антитела в композиции. В одном варианте осуществления антитело основного типа представляет собой антитело против HER2, такое как антитело, которое связывается с доменом II HER2, антитело, которое ингибирует димеризацию HER более эффективно, чем трастузумаб, и/или антитело, которое связывается с гетеродимерным связывающим участком HER2. В рамках настоящей заявки в предпочтительном варианте осуществления антитело против HER2 основного типа представляет собой антитело, содержащее вариабельные аминокислотные последовательности легкой и тяжелой цепей SEQ ID No. 3 и 4, и наиболее предпочтительно, содержащее вариабельные аминокислотные последовательности легкой и тяжелой цепей SEQ ID No. 15 и 16 (пертузумаб).
Здесь "вариант аминокислотной последовательности" антитела представляет собой антитело с аминокислотной последовательностью, которая отличается от антитела основного типа. Как правило, варианты аминокислотных последовательностей обладают по меньшей мере приблизительно 70% гомологией с антителом основного типа, и предпочтительно, они являются по меньшей мере приблизительно на 80%, более предпочтительно по меньшей мере приблизительно на 90% гомологичными антителу основного типа. Варианты аминокислотных последовательностей обладают заменами, делециями и/или вставками в определенных положениях аминокислотной последовательности антитела основного типа или рядом с ней. В рамках настоящей заявки примеры вариантов аминокислотных последовательностей включают в себя кислый вариант (например, дезамидированный вариант антитела), основный вариант, антитело с N-концевым лидерным удлинением (например, VHS-) на одной или двух его легких цепях, антитело с C-концевым остатком лизина на одной или двух его тяжелых цепях и т.д., и включают в себя сочетания вариантов аминокислотных последовательностей тяжелых и/или легких цепей. Представляющий особый интерес в рамках настоящей заявки вариант антитела представляет собой антитело, содержащее N-концевое лидерное удлинение на одной или двух его легких цепях, необязательно дополнительно содержащее другую аминокислотную последовательность и/или обладающее отличиями в гликозилировании относительно антитела основного типа.
"Терапевтическое моноклональное антитело" представляет собой антитело, используемое для лечения субъекта-человека. Терапевтические моноклональные антитела, описанные здесь, включают в себя: антитела против HER2 в случае злокачественной опухоли и различных незлокачественных заболеваний или нарушений; антитела против CD20 или BR3 для лечения B-клеточных злокачественных опухолей, аутоиммунных заболеваний, отторжения трансплантата, или для блокирования иммунного ответа на чужеродный антиген; антитела против IgE для лечения опосредуемых IgE нарушений; антитела против DR5 или VEGF для лечения злокачественной опухоли.
Здесь "вариант по гликозилированию" антитела представляет собой антитело с одной или несколькими присоединенными к нему группами углеводов, которые отличаются от одной или нескольких групп углеводов, присоединенных к антителу основного типа. В рамках настоящей заявки примеры вариантов по гликозилированию включают в себя антитело с олигосахаридной структурой G1 или G2 вместо олигосахаридной структуры G0, присоединенной к его области Fc, антитело с одной или несколькими углеводными группами, присоединенными к одной или двум его легким цепям, антитело, не содержащее углевода, присоединенного к одной или двум тяжелым цепям антитела, и т.д., и сочетание изменений гликозилирования.
В случае, где антитело обладает областью Fc, олигосахаридная структура, такая как представлена на фиг. 16 настоящего описания, может быть присоединена к одной или двум тяжелым цепям антитела, например к остатку 299 (298, нумерация остатков Eu). В случае пертузумаба G0 являлась преобладающей олигосахаридной структурой, а другие олигосахаридные структуры, такие как G0-F, G-1, Man5, Man6, G1-1, G1(1-6), G1(1-3) и G2 находятся в композиции пертузумаба в меньших количествах.
Если нет иных указаний, в рамках настоящей заявки "олигосахаридная структура G1" включает в себя структуры G-1, G1-1, G1(1-6) и G1(1-3).
Здесь "N-концевое лидерное удлинение" относится к одному или нескольким аминокислотным остаткам N-концевой лидерной последовательности, которые находятся на N-конце любой одной или нескольких тяжелых или легких цепей антитела. Иллюстративное N-концевое лидерное удлинение содержит три аминокислотных остатка VHS или состоит из трех аминокислотных остатков VHS, находящихся на одном или обоих концах легких цепей варианта антитела.
"Гомологию" определяют как процентное количество остатков в варианте аминокислотной последовательности, которые являются идентичными после выравнивания последовательностей и внесения разрывов, если необходимо, для достижения максимальной процентной гомологии. Способы и компьютерные программы для выравнивания хорошо известны в данной области. Одной из таких компьютерных программ является "Align 2", разработанная в Genentech, Inc., которая была зарегистрирована с пользовательской документацией в United States Copyright Office, Washington, DC 20559 10 декабря, 1991.
"Эффекторные функции" антитела относятся к таким видам биологической активности, которые являются свойственными Fc-области (природной последовательности Fc-области или варианта аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антитела включают в себя связывание C1q; комплементзависимую цитотоксичность; связывание Fc-рецептора; антителозависимую клеточно-опосредуемую цитотоксичность (ADCC); фагоцитоз; негативную регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора; BCR), и т.д.
В зависимости от аминокислотной последовательности константного домена тяжелых цепей, полноразмерные антитела могут быть отнесены к различным "классам". Существует пять основных классов полноразмерных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее разделены на "подклассы" (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам антител, называются α, δ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Антителозависимая клеточно-опосредуемая цитотоксичность" и "ADCC" относятся к клеточно-опосредуемой реакции, при которой неспецифичные цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, естественные киллерные (NK) клетки, нейтрофилы и макрофаги), распознают связавшееся антитело на клетке-мишени, а затем вызывают лизис клетки-мишени. Основные клетки для осуществления ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на кроветворных клетках представлена в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности представляющей интерес молекулы в отношении ADCC, можно проводить анализ ADCC in vitro, такой как анализ, описанный в патенте США №5500362 или 5821337. Пригодные для таких анализов эффекторные клетки включают в себя мононуклеарные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно, или дополнительно, активность представляющей интерес молекулы в отношении ADCC можно оценивать in vivo, например, в модели на животных, такой как описана в Clynes et al. PNAS (USA) 95:652-656 (1998).
"Эффекторные клетки человека" представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Предпочтительно, клетки экспрессируют меньшей мере FcγRIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые осуществляют ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), естественные киллерные (NK) клетки, моноциты, цитотоксические T-клетки и нейтрофилы; при этом предпочтительными являются PBMC и NK-клетки. Эффекторные клетки можно выделять из их природных источников, например, из крови или PBMC, как описано в настоящей заявке.
Термины "Fc-рецептор" или "FcR" используют для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с природной последовательностью. Более того, предпочтительным FcR является FcR, который связывает антитело IgG (гамма-рецептор) и включает в себя рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и, альтернативно-сплайсированные формы этих рецепторов. Рецепторы FcγRII включают в себя FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые обладают сходными аминокислотными последовательностями, отличающимися, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA в своем цитоплазматическом домене содержит иммунорецепторный тирозин-связывающий активирующий мотив (ITAM). Ингибирующий рецептор FcγRIIB в своем цитоплазматическом домене содержит иммунорецепторный тирозин-связывающий ингибирующий мотив (ITIM), (см. обзор M. в Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассмотрены в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). К термину "FcR" в настоящей заявке относятся другие FcR, том числе FcR, которые будут выявлены в будущем. Термин также включает в себя неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)).
"Комплементзависимая цитотоксичность" или "CDC" относится к способности молекулы вызывать лизис мишени в присутствии комплемента. Каскад активации комплемента начинается со связывания первого компонента системы комплемента (C1q) с молекулой (например, антителом), находящейся в комплексе с распознанным антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
"Природные антитела", как правило, представляют собой гетеротетрамерные гликопротеины с массой приблизительно 150000 дальтон, которые состоят из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, хотя количество дисульфидных связей варьирует среди тяжелых цепей различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также обладает расположенными с равными интервалами дисульфидными мостиками внутри цепи. Каждая тяжелая цепь на одном конце обладает вариабельным доменом (VH), а за ним следует ряд константных доменов. Каждая легкая цепь обладает вариабельным доменом (VL) на одном конце и константным доменом на другом конце. Константный домен легкой цепи расположен параллельно первому константному домену тяжелой цепи, а вариабельный домен легкой цепи расположен параллельно вариабельному домену тяжелой цепи. Полагают, что область контакта между вариабельными доменами легкой цепи и тяжелой цепи формирует конкретные аминокислотные остатки.
Термин "вариабельный" относится к тому факту, что последовательности определенных участков вариабельных доменов значительно отличаются среди антител и они задействованы в связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако вариабельность не является равномерно распределенной на протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями в вариабельных доменах как легких цепей, так и тяжелых цепей. Наиболее высоко консервативные участки вариабельных доменов называются каркасными областями (FR). Все вариабельные домены природных тяжелых и легких цепей содержат четыре FR, главным образом, принимающих конфигурацию β-слоев, соединенных тремя гипервариабельными областями, которые формируют петли, соединяющие структуры β-слоев, и в некоторых случаях формирующие их часть. Гипервариабельные области в каждой цепи расположены вместе в непосредственной близости от FR и, совместно с гипервариабельными областями другой цепи, участвуют в формировании антигенсвязывающего центра антител (см. Kabat et al., Sequences of Protein of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но они проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Здесь термин "гипервариабельная область" относится к аминокислотым остаткам антитела, которые отвечают за связывание антигена. Как правило, гипервариабельная область содержит аминокислотные остатки из "определяющего комплементарность участка" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Protein of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или такие остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Остатки "каркасной области" или "FR" представляют собой такие остатки вариабельного домена, которые отличаются от остатков гипервариабельной области, как определено в настоящем описании.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab"-фрагментами, каждого с отдельным антигенсвязывающим центром, и остающегося "Fc"-фрагмента, название которого отражает способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который обладает двумя антигенсвязывающими центрами и по-прежнему способен перекрестно связывать антиген.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий центр. Этот участок состоит из димера, состоящего из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в прочной нековалентной связи. Именно в данной конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют и определяют антигенсвязывающий центр на поверхности димера VH-VL. В совокупности, шесть гипервариабельных областей обеспечивают антигенсвязывающую специфичность антитела. Однако даже отдельный вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные в отношении антигена) обладает способностью распознавать и связывать антиген, хотя и с меньшей аффинностью, чем полный связывающий участок.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на C-конце тяжелой цепи домена CH1, в том числе одного или нескольких цистеинов из шарнирной области антитела. В рамках настоящей заявки Fab'-SH представляет собой обозначение для Fab', в котором остаток(ки) цистеина константных доменов содержат по меньшей мере одну свободную тиольную группу. F(ab')2-фрагменты антител исходно были получены в качестве пары Fab'-фрагментов, которые имеют между ними шарнирные остатки цистеина. Также известны другие химические соединения фрагментов антител.
"Легкие цепи" антител любого вида позвоночных могут быть отнесены к одному из двух типов, называемых каппа (κ) и лямбда (λ), отчетливо различающихся на основе аминокислотных последовательностей их константных доменов.
"Одноцепочечные Fv" или "scFv" фрагменты антител содержат домены антитела VH и VL, где эти домены находятся в единой полипептидной цепи. Предпочтительно, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает возможность формирования в scFv требуемой для связывания антигена структуры. Для обзора scFv см. Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). scFv-фрагменты антител против HER2 описаны в WO93/16185; патенте США №5571894; и патенте США №5587458.
Термин "димеры" относится к небольшим фрагментам антител с двумя антигенсвязывающими центрами, где фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH - VL). С помощью использования линкера, который является слишком коротким для возможности спаривания двух доменов одной цепи, инициируют спаривание доменов с комплементарными доменами другой цепи и формирование двух антигенсвязывающих центров. Димеры более подробно описаны, например, в европейском патенте 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci USA, 90:6444-6448 (1993).
"Гуманизированные" формы не являющиеся человеческими антителами (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не являющегося человеческим. В основном, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменяют остатками из гипервариабельной области видов, не относящихся к человеку (донорное антитело), таких как мышь, крыса, кролик или приматы, не относящиеся к человеку, которые обладают требуемой специфичностью, аффинностью и активностью. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками, не являющиеся человеческими. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе. Эти модификации проводят для дополнительного улучшения параметров антитела. Как правило, гуманизированное антитело содержит по существу все из по меньшей мере одного, и, как правило, из двух, вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, не являющегося человеческим, и все или по существу все FR представляют собой FR из последовательности иммуноглобулина человека. Также гуманизированное антитело необязательно содержит по меньшей мере участок константного домена (Fc) иммуноглобулина, как правило, константного домена иммуноглобулина человека. Для более подробной информации см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Гуманизированные антитела против HER2 включают в себя huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 или трастузумаб (HERCEPTIN®), как описано в таблице 3 патента США 5821337, включенного в настоящее описание в качестве ссылки в полном объеме; гуманизированные антитела 520C9 (WO93/21319) и гуманизированные антитела 2C4, как описано в настоящей заявке.
Здесь, "трастузумаб", "HERCEPTIN®", и "huMAb4D5-8" относятся к антителу, содержащему аминокислотные последовательности легкой и тяжелой цепей в SEQ ID No. 13 и 14, соответственно.
Здесь "пертузумаб", "rhuMAb 2C4" и "OMNITARGTM" относятся к антителу, содержащему вариабельные аминокислотные последовательности легкой и тяжелой цепей в SEQ ID No. 3 и 4, соответственно. В случае, когда пертузумаб представляет собой полноразмерное антитело, он предпочтительно содержит аминокислотные последовательности легкой и тяжелой цепей в SEQ ID No. 15 и 16, соответственно.
"Голое антитело" представляет собой антитело (как определяют в настоящем описании), которое не является конъюгированным с гетерологичной молекулой, такой как цитотоксическая группа или радиоактивная метка.
"Зрелое в отношении аффинности" антитело представляет собой антитело с одним или несколькими изменениями в одном или нескольких его гипервариабельных областях, которые приводят к повышению аффинности антитела к антигену по сравнению с исходным антителом, которое не обладает таким изменением(ями). Предпочтительные зрелые в отношении аффинности антитела обладают наномалярной или даже пикомолярной аффинностью к антигену-мишени. Зрелые в отношении аффинности антитела получают способами, известными в данной области. В Marks et al. Bio/Technology 10:779-783 (1992) описано созревание аффинности посредством перестановки доменов VH и VL. Случайный мутагенез CDR и/или каркасных остатков описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
"Антитело-агонист" представляет собой антитело, которое связывается с рецептором и активирует его. Как правило, способность антитела-агониста активировать рецептор по меньшей мере качественно сходна (и может быть по существу количественно сходна) со способностью природного лиганда-агониста рецептора. Примером антитела-агониста является антитело, которое связывается с рецептором из суперсемейства рецепторов TNF, таким как DR5, и вызывает апоптоз клеток, экспрессирующих рецептор для TNF (например, DR5). Способы анализа для определения индукции апоптоза описаны в WO 98/51793 и WO 99/37684, оба из которых включены в данное описание в качестве ссылок в полном объеме.
"Выделенное" антитело представляет собой антитело, которое было выявлено и выделено и/или извлечено из компонента его естественных окружающих условий. Загрязняющие компоненты его естественных окружающих условий представляют собой вещества, которые препятствуют применению антитела для диагностики или лечения, и могут включать в себя ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело очищают (1) до более чем 95% масс. антитела, как определяют способом Лоури, и наиболее предпочтительно до более чем 99% масс., (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенности при SDS-PAGE в редуцирующих или нередуцирующих условиях с использованием кумасси голубого или, предпочтительно, окрашивания серебром. Выделенное антитело включает в себя антитело в рекомбинантных клетках in situ, поскольку в этом случае отсутствует по меньшей мере один компонент условий естественного окружения антитела. Однако, как правило, выделенное антитело получают посредством по меньшей мере одной стадии очистки.
Антитело против HER2, которое "ингибирует димеризацию HER более эффективно, чем трастузумаб" представляет собой антитело, которое снижает количество димеров HER или устраняет димеры HER более эффективно (например, по меньшей мере приблизительно в 2 раза более эффективно), чем трастузумаб. Предпочтительно, такое антитело ингибирует димеризацию HER2 по меньшей мере приблизительно настолько же эффективно, как антитело, выбранное из группы, состоящей из моноклонального антитела 2C4 мыши, Fab-фрагмента моноклонального антитела 2C4 мыши, пертузумаба, и Fab-фрагмента пертузумаба. Ингибирование димеризации HER можно оценивать непосредственным исследованием димеров HER, или оценкой активации HER, или нисходящей передачей сигнала, которая возникает вследствие димеризации HER, и/или оценкой участка связывания антитело-HER2, и т.д. Анализ для отбора антител со способностью ингибировать димеризацию HER более эффективно, чем трастузумаб, описан в Agus et al. Cancer Cell 2:127-137 (2002) и WO 01/00245 (Adams et al.). Исключительно в качестве примера, ингибирование димеризации HER можно оценивать посредством оценки, например, ингибирования формирования димеров HER (см., например, фиг. 1A-B в Agus et al. Cancer Cell 2:127-137 (2002); и WO 01/00245); снижения активации лиганда HER в клетках, которые экспрессируют димеры HER (например, WO 01/00245 и фиг. 2A-B в Agus et al. Cancer Cell 2:127-137 (2002)); блокирования связывания лиганда HER с клетками, которые экспрессируют димеры HER (например, WO 01/00245 и фиг. 2E в Agus et al. Cancer Cell 2: 127-137 (2002)); ингибирования роста злокачественных клеток (например, клеток MCF7, MDA-MD-134, ZR-75-1, MD-MB-175, T-47D), которые экспрессируют димеры HER в присутствии (или отсутствии) лиганда HER (например, WO 01/00245 и фиг. 3A-D в Agus et al. Cancer Cell 2: 127-137 (2002)); ингибирования нисходящей передачи сигнала (например, ингибирования HRG-зависимого фосфорилирования AKT или ингибирования HRG- или TGFα-зависимого фосфорилирования MAPK) (см., например, WO 01/00245 и фиг. 2C-D в Agus et al. Cancer Cell 2:127-137 (2002)). Оценивать ингибирование антителом димеризации HER также можно посредством исследования участка связывания антитело-HER2, например, посредством оценки структуры или модели, такой как кристаллическая структура, антитела, связавшегося с HER2 (см., например, Franklin et al. Cancer Cell 5:317-328 (2004)).
Антитело против HER2 может "ингибировать HRG-зависимое фосфорилирование AKT" и/или ингибировать "HRG- или TGFα-зависимое фосфорилирование MAPK" более эффективно (например, по меньшей мере в 2 раза более эффективно), чем трастузумаб (в качестве примера, см. Agus et al. Cancer Cell 2: 127-137 (2002) и WO 01/00245).
Антитело против HER2 может представлять собой антитело, которое "не ингибирует расщепление эктодомена HER2" (Molina et al. Cancer Res. 61:4744-4749 (2001).
Антитело против HER2, которое "связывается с гетеродимерным участком связывания" HER2, связывается с остатками в домене II (а также необязательно связывается с остатками в других доменах внеклеточного домена HER2, таких как домены I и III), и может пространственно затруднять, по меньшей мере в определенной степени, образование гетеродимеров HER2-EGFR, HER2-HER3 или HER2-HER4. В Franklin et al. Cancer Cell 5:317-328 (2004) охарактеризована кристаллическая структура HER2-пертузумаб, хранящаяся в белковой базе данных RCSB (код ID IS78), демонстрирующая иллюстративное антитело, которое связывается с гетеродимерным участком связывания HER2.
Антитело, которое "связывается с доменом II" HER2, связывается с остатками домена II и необязательно с остатками другого домена(ов) HER2, такого как домены I и III. Предпочтительно антитело, которое связывается с доменом II, связывается с областью соединения между доменами I, II и III HER2.
Как используют здесь "ингибирующее рост средство" относится к соединению или композиции, которая ингибирует рост клетки, особенно экспрессирующей HER злокачественной клетки либо in vitro, либо in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, которое значительно снижает процентное количество экспрессирующих HER клеток в S-фазе. Примеры ингибирующих рост средств включают в себя средства, которые блокируют продолжение клеточного цикла (в отличном от S-фазы периоде), такие как средства, которые вызывают арест в G1 и арест в M-фазе. Классические блокаторы M-фазы включают в себя средства на основе барвинка (винкристин и винбластин), таксаны и ингибиторы топо II, такие как доксорубицин, эпирубицин, даунорубицин, этопзид и блеомицин. Действие таких средств, которые вызывают арест в G1, также распространяется на арест в S-фазе, например, действие алкилирующих ДНК средств, таких как тамоксифен, преднизон, декарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., глава 1 под названием "Cell cycle regulation, oncogenes, and antineoplastic drugs" Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13.
Примеры "ингибирующих рост" антител представляют собой антитела, которые связываются с HER2 и ингибируют рост злокачественных клеток, сверхэкспрессирующих HER2. Предпочтительные ингибирующие рост антитела против HER2 ингибируют рост клеток злокачественной опухоли SK-BR-3 в клеточной культуре более чем на 20%, и предпочтительно более чем на 50% (например, приблизительно от 50% до приблизительно 100%) при концентрации антител приблизительно от 0,5 до 30 мкг/мл, где ингибирование роста определяют через шесть дней после воздействия на клетки антител SK-BR-3 (см. патент США №5677171, опубликованный 14 октября, 1997). Анализ ингибирования роста клеток SK-BR-3 более подробно описан в том патенте и в данной заявке ниже. Предпочтительное ингибирующее рост антитело представляет собой гуманизированный вариант моноклонального антитела 4D5 мыши, например, трастузумаб.
Антитело, которое "вызывает апоптоз", представляет собой антитело, которое вызывает запрограммированную гибель клеток, как определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клеток, набуханию эндоплазматической сети, фрагментации клеток и/или формированию мембранных везикул (называемых апоптотическими тельцами). Клетка, как правило, представляет собой клетку, которая экспрессирует антиген, с которым связывается антитело. Предпочтительно клетка представляет собой опухолевую клетку. Например, транслокацию фосфатидилсерина (PS) можно определять по связыванию аннексина; фрагментацию ДНК можно оценивать посредством электрофоретического расщепления ДНК; а конденсацию ядра/хроматина совместно с фрагментацией ДНК можно оценивать по наличию любого повышения гиподиплоидных клеток. Предпочтительно, антитело, которое вызывает апоптоз, представляет собой антитело, которое приводит к приблизительно от 2- до 50-кратной, предпочтительно к приблизительно от 5- до 50-кратной, и наиболее предпочтительно к приблизительно от 10- до 50-кратной индукции связывания аннексина относительно необработанной клетки в анализе связывания аннексина с использованием клеток, которые экспрессируют антиген, с которым связывается антитело. Примерами антител, которые вызывают апоптоз, являются антитела против HER2 7C2 и 7F3, и определенные антитела против DR5.
"Эпитоп 2C4" представляет собой участок во внеклеточном домене HER2, с которым связывается антитело против 2C4. В целях проведения скрининга на антитела, которые связываются с эпитопом 2C4, можно проводить стандартный анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно для оценки наличия связывания антитела с эпитопом 2C4 на HER2 можно проводить картирование эпитопов. Эпитоп 2C4 содержит остатки домена II внеклеточного домена HER2. 2C4 и пертузумаб связываются с внеклеточным доменом HER2 в области соединения доменов I, II и III. Franklin et al. Cancer Cell 5:317-328 (2004).
"Эпитоп 4D5" представляет собой участок внеклеточного домена HER2, с которым связываются антитело против 4D5 (ATCC CRL 10463) и трастузумаб. Этот эпитоп расположен близко к трансмембранному домену HER2, и внутри домена IV HER2. Для скрининга на антитела, которые связываются с эпитопом 4D5, можно проводить стандартный анализ перекрестного блокирования, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно для оценки наличия связывания антитела с эпитопом 4D5 на HER2 (например, с каким-либо одним или несколькими остатками в участке приблизительно от остатка 529 приблизительно до остатка 625, включительно, эпитопа HER2) можно проводить картирование эпитопа.
"Эпитоп 7C2/7F3" представляет собой участок на N-конце, в домене I, внеклеточного домена HER2, с которым связываются антитела против 7C2 и/или 7F3 (все хранятся с помощью ATCC, см. ниже). Для скрининга на антитела, которые связываются с эпитопом 7C2/7F3, можно проводить стандартный анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно для определения наличия связывания антитела с эпитопом 7C2/7F3 на HER2 (например, с каким-либо одним или несколькими остатками в участке приблизительно от остатка 22 приблизительно до остатка 53 HER2) можно проводить картирование эпитопа.
"Лечение" относится как к терапевтическому применению, так и к профилактическим или предупредительным мерам. Нуждающиеся в лечении включают в себя тех, которые уже имеют заболевание, а также тех, кому намереваются проводить профилактику заболевания. Таким образом, в рамках настоящего описания пациенту, которого намереваются лечить, может быть поставлен диагноз, как имеющему заболевание, или он может обладать предрасположенностью или восприимчивостью к заболеванию.
Термины "злокачественная опухоль" и "злокачественный" относятся к физиологическому состоянию или характеризуют физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Примеры злокачественных опухолей включают в себя, но не ограничиваются ими, карциному, лимфому, бластому (в том числе медуллобластому и ретинобластому), саркому (в том числе липосаркому и синовиальноклеточную саркому), нейроэндокринные опухоли (в том числе карциноидные опухоли, гастриному, и злокачественную опухоль островковой ткани), мезотелиому, шванному (в том числе невриному слухового нерва), менингиому, аденокарциному, меланому и лейкоз или лимфолейкоз. Более конкретные примеры таких злокачественных опухолей включают в себя плоскоклеточный рак (например, плоскоклеточный рак эпителия), рак легкого, в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого, злокачественную опухоль брюшины, печеночно-клеточный рак, гастральный рак или рак желудка, в том числе желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, рак прямой кишки, рак ободочной и прямой кишки, карциному эндометрия или матки, карциному слюнной железы, рак почки или ренальный рак, рак предстательной железы, рак наружных половых органов, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, рак яичка, рак пищевода, опухоли желчных протоков, а также рак головы и шеи.
Термин "эффективное количество" относится к количеству лекарственного средства, эффективного в отношении заболевания пациента. В случае, если заболевание представляет собой злокачественную опухоль, эффективное количество лекарственного средства может снижать количество злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять в определенной степени и предпочтительно останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е., замедлять в определенной степени и предпочтительно останавливать) метастазирование опухоли; ингибировать до определенной степени рост опухоли; и/или смягчать до определенной степени один или несколько симптомов, обусловленных злокачественной опухолью. В тех случаях, когда лекарственное средство может предотвращать рост и/или вызывать гибель существующих злокачественных клеток, оно может представлять собой цитостатическое и/или цитотоксическое средство. Эффективное количество может продлевать выживаемость без прогрессирования, приводить к объективному ответу (включая частичный ответ, PR, или полный ответ, CR), повышать общую продолжительность выживания, и/или вызывать улучшение одного или нескольких симптомов злокачественной опухоли.
"Злокачественная опухоль, экспрессирующая HER2" представляет собой опухоль, содержащую клетки, которые обладают белком HER2, находящимся на их клеточной поверхности.
Злокачественная опухоль со "сверхэкспрессией" рецептора HER представляет собой злокачественную опухоль, которая обладает значительно повышенным уровнем рецептора HER, такого как HER2, на своей клеточной поверхности, по сравнению с незлокачественной клеткой того же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или повышением транскрипции или трансляции. Сверхэкспрессию рецептора HER можно определять с помощью диагностического или прогностического анализа посредством оценки повышения уровня белка HER, находящегося на поверхности клетки (например, посредством иммуногистохимического анализа; IHC). Альтернативно, или дополнительно, можно измерять уровень кодирующей HER нуклеиновой кислоты в клетке, например, посредством флуоресцентной in situ гибридизации (FISH; см. WO 98/45479, опубликованный в октябре 1998 года), саузерн-блоттинга или способов полимеразной цепной реакции (ПЦР), таких как количественная ПЦР с детекцией в реальном времени (RT-PCR). Также сверхэкспрессию рецептора HER можно исследовать посредством измерения теряемого антигена (например, внеклеточного домена HER) в биологической жидкости, такой как сыворотка (см., например, патент США №4933294, выданный 12 июня, 1990; WO 91/05264, опубликованный 18 апреля 1991; патент США 5401638, выданный 28 марта, 1995; и Sias et al. J. Immunol. Methods 132:73-80 (1990)). Помимо указанных выше способов анализа, квалифицированному специалисту также доступны различные способы анализа in vivo. Например, можно подвергать клетки в организме пациента воздействию антитела, которое необязательно мечено детектируемой меткой, например радиоактивным изотопом, и связывание антитела с клетками пациента можно оценивать, например, внешним исследованием на наличие радиоактивности или посредством анализа биопсии, взятой у пациента, которого ранее подвергали воздействию антитела.
Напротив, злокачественная опухоль, которая "не сверхэкспрессирует рецептор HER2" представляет собой опухоль, которая не экспрессирует повышенный относительно нормы уровень рецептора HER2 по сравнению с незлокачественной клеткой того же типа ткани.
Злокачественная опухоль, которая "сверхэкспрессирует" лиганд HER представляет собой злокачественную опухоль, которая продуцирует значительно повышенный уровень этого лиганда по сравнению с незлокачественной клеткой того же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или повышением транскрипции или трансляции. Сверхэкспрессию лиганда HER можно определять диагностически посредством оценки уровня лиганда (или кодирующей его нуклеиновой кислоты) у пациента, например, в биопсии опухоли, или посредством различных диагностических способов анализа, таких как IHC, FISH, саузерн-блоттинг, ПЦР или способы анализа in vivo, описанные выше.
Здесь термин "цитотоксическое средство" относится к веществу, которое ингибирует функционирование или препятствует функционированию клеток и/или приводит к разрушению клеток. Подразумевают, что термин включает в себя радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины из бактерий, грибов, растений или животных, включая их фрагменты и/или варианты.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают в себя алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогинины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабиол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополетин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкриастатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, иприт урацила; нитрозомочевина, такая как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно, калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, в том числе динемицин A; эсперамицин; а также хромофор неокарциностатин и сходные хромофоры хромопротеиновых эндииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, декторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (в том числе ADRIAMYCIN®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомную инъекцию доксорубицин-HCl (DOXIL®), липосомальный доксорубицин TLC D-99 (MYOCET®), пегилированный липосомальный доксорубицин (CAELYX®), и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как даноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; антиадреналовые средства, такие как аминоглутетимид, митотан, трилостан; освежающий раствор на основе фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; эллиптиния ацетат; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; декарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепу; таксоид, например, паклитаксел (TAXOL®), сконструированная на основе альбумина композиция из наночастиц паклитаксела (ABRAXANETM) и доцетаксел (TAXOTERE®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; средства на основе платины, такие как цисплатин, оксалиплатин и карбоплатин; средства на основе барвинка, которые предотвращают полимеризацию тубулина при формировании микротрубочек, в том числе винбластин (VELBAN®), винкристин (ONCOVIN®), виндезин (ELDISINE®, FILDESIN®) и винорелбин (NAVELBINE®); этопозид (VP-16); ифосфамид; митоксантрон; лейкововин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, в том числе бексаротен (TARGRETIN®); бифосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов сигнальных путей, вовлеченных в абберантную клеточную пролиферацию, таких как, например, PKC-alpha, Raf, H-Ras, и ген рецептора эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN®, и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURТOTECAN®); rmRH (например, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (Pfizer); перифозин, ингибитор COX-2 (например, целекоксиб или эторикоксиб), ингибитор протеасом (например, PS341); бортезомиб (VELCADE®); CCI-779; типифарниб (R11577); орафениб, ABT510; ингибитор Bcl-2, такой как облимерсен натрия (GENASENSE®); пиксантрон; ингибиторы EGFR (см. определение ниже); ингибиторы тирозинкиназы (см. определение ниже); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или более из указанных выше, такие как CHOP, сокращение для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращение для режима лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейкововином.
Также в это определение включены антигормональные средства, которые действуют посредством регуляции или ингибирования воздействия гормонов на опухоли, такие как антиэстрогены со смешанным профилем агонист/антагонист, в том числе, тамоксифен (NOLVADEX®), 4-гидрокситамоксифен, торемифен (FARESTON®), идоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен, и селективные модуляторы рецепторов эстрогена (SERM), такие как SERM3; полные антиэстрогены без свойств агонистов, такие как (FASLODEX®) и EM800 (такие средства могут блокировать димеризацию рецепторов эстрогенов (ER), ингибировать связывание ДНК, повышать обновление ER, и/или снижать уровень ER); ингибиторы ароматазы, в том числе стероидные ингибиторы ароматазы, такие как форместан и экземестан (AROMASIN®) и нестероидные ингибиторы ароматазы, такие как анастразол (ARIMIDEX®), летрозол (FEMARA®) и аминоглутетимид, и другие ингибиторы ароматазы, в том числе ворозол (RIVISOR®), ацетат магестрола (MEGASE®), фадрозол, имидазол; агонисты лютеинизирующего рилизинг-гормона, в том числе леупролид (LUPRON® и ELIGARD®), гозерелин, бузерелин и триптерелин; половые стероидные гормоны, прогестины, такие как ацетат магестрола и ацетат медроксипрогестерона, эстрогены, такие как диэтилстилбестрол и премарин, и андрогены/ретиноиды, такие как флуоксиместерон, полностью трансретиноевая кислота и фенретинид; онапристон; анти-прогестероны; ингибиторы рецепторов эстрогена (ERD); антиандрогены, такие как флутамид, нилутамид и бикалутамид; тестолактон; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или более из указанных выше.
Здесь термин "направленное против EGFR лекарственное средство" относится к терапевтическому средству, которое связывается с EGFR и, необязательно, ингибирует активацию EGFR. Примеры таких средств включают в себя антитела и молекулы малых размеров, которые связываются с EGFR. Примеры антител, которые связываются с EGFR, включают в себя MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (см., патент США №4943533, Mendelsohn et al.) и их варианты, такие как химерный 225 (C225 или цетуксимаб; ERBUTIX®) и реконструированный 225 человека (H225) (см., WO 96/40210, Imclone Systems Inc.); антитела, которые связывают мутантный EGFR II типа (патент США №5212290); гуманизированные и химерные антитела, которые связывают EGFR, как описано в патенте США №5891996; и антитела человека, которые связывают EGFR, такие как ABX-EGF (см. WO 98/50433, Abgenix). Антитело против EGFR может быть конъюгированым с цитотоксическим средством, таким образом, образуя иммуноконъюгат (см., например, EP659,439A2, Merck Patent GmbH). Примеры молекул малых размеров, которые связываются с EGFR, включают в себя ZD 1839 или гефитиниб (IRESSATM; Astra Zeneca), CP-358774 или эрлотиниб HCL (TARCEVATM; Genentech/OSI) и AG1478, AG1571 (SU 5271; Sugen).
"Ингибитор тирозинкиназы" представляет собой молекулу, которая ингибирует до определенной степени тирозинкиназную активность тирозинкиназы, такой как рецептор для HER. Примеры таких ингибиторов включают в себя направленные против EGFR лекарственные средства, указанные в предыдущем абзаце, а также низкомолекулярные ингибиторы тирозинкиназы HER2, такие как TAK165, доступный в Takeda, двойные ингибиторы HER, такие как EKB-569 (доступный в Wyeth), которые предпочтительно связываются с EGFR, но ингибируют клетки, сверхэкспрессирующие как HER2, так и EGFR, GW572016 (доступный в Glaxo), пероральный ингибитор тирозинкиназ HER2 и EGFR, и PKI-166 (доступный в Novartis); общие ингибиторы HER, такие как канертиниб (CI-1033; Pharmacia); ингибиторы Raf-1, такие как антисмысловое средство ISIS-5132, поставляемое ISIS Pharmaceuticals, которое ингибирует передачу сигнала посредством Raf-1; не направленные против HER ингибиторы TK, такие как мезилат иматиниба (GleevacTM), доступный в Glaxo; ингибитор внеклеточной регулирующей киназы I MAPK CI-1040 (доступный в Pharmacia); хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706; пиразолопиримидины, 4-(фениламино)-7H-пирроло[2,3-d]пиримидины; куркумин (диферулоилметан, 4,5-бис-(4-фторанилино)фталимид); тирфостины, содержащие группы нитротиофена; PD-0183805 (Warner-Lamber); антисмысловые молекулы (например, молекулы, которые связываются с кодирующей HER нуклеиновой кислотой); хиноксалины (патент США №5804396); трифостины (патент США №5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); общие ингибиторы HER, такие как CI-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); иматиниб мезилат (Gleevac; Novartis); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone); или как описано в любой из следующих патентных публикаций: патент США №5804396; WO 99/09016 (American Cyanimid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca); и WO 96/33980 (Zeneca).
"Антиангиогенное средство" относится к соединению, которое блокирует развитие кровеносных сосудов, или до некоторой степени препятствует ему. Антиангиогенный фактор, например, может представлять собой молекулу малых размеров или антитело, которые связываются с фактором роста или с рецептором фактора роста, вовлеченного в стимуляцию ангиогенеза. В рамках настоящей заявки предпочтительный антиангиогенный фактор представляет собой антитело, которое связывается с сосудисто-эндотелиальным фактором роста (VEGF), такое как бевацизумаб (AVASTIN®).
Термин "цитокин" является общим термином для белков, высвобождаемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Цитокины включают в себя гормоны роста, такие как гормон роста человека, гормон роста человека с N-метионилом и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-α и -β; ингибирующее вещество Мюллера; гонадотропин-ассоциированный пептид мыши; ингибин; активин; сосудисто-эндотелиальный фактор роста; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β, и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, в том числе LIF и kit-лиганд (KL). Как используют в рамках настоящей заявки, термин цитокин включает в себя белки из природных источников или из рекомбинантных клеточных культур и биологически активные эквиваленты цитокинов с природной последовательностью.
Составленное антитело предпочтительно является по существу чистым и желательно по существу гомогенным (т.е. не содержащим загрязняющих белков и т.д.). "По существу чистое" антитело означает композицию, содержащую по меньшей мере приблизительно 90% масс. антитела, исходя из общей массы композиции, предпочтительно по меньшей мере приблизительно 95% масс. "По существу гомогенное" антитело означает композицию, содержащую по меньшей мере приблизительно 99% масс. антитела, исходя из общей массы композиции.
Здесь "B-клеточный поверхностный маркер" или "B-клеточный поверхностный антиген" представляет собой антиген, экспрессированный на поверхности B-клетки, против которого может быть направлено антитело, которое с ним связывается. Иллюстративные B-клеточные поверхностные маркеры включают в себя поверхностные маркеры лейкоцитов CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 и CD86 (описание см. в The Leukocyte Antigen Facts Book, 2nd Edition. 1997, ed. Barclay et al. Academic Press, Harcourt Brace & Co., New York). Другие B-клеточные поверхностные маркеры включают в себя RP105, FcRH2, CR2 B-клеток, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA и 239287. Представляющий особый интерес в рамках настоящего описания B-клеточный поверхностный маркер предпочтительно экспрессируется на B-клетках по сравнению с другими, не относящимися к B-клеткам, тканями млекопитающих и он может быть экспрессирован как на B-клетках-предшественниках, так и на зрелых B-клетках. В рамках настоящего описания предпочтительным B-клеточным поверхностным маркером является CD20 или BR3.
Антиген "CD20", или "CD20", представляет собой, негликозилированный фосфопротеин с молекулярной массой 35 кДа, обнаруживаемый на поверхности более 90% B-клеток периферической крови или лимфоидных органов. CD20 представлен как на нормальных B-клетках, так и на злокачественных B-клетках, но он не экспрессируется на стволовых клетках. Другие названия CD20 в литературе включают в себя "связанный с B-лимфоцитами антиген" и "Bp35". Антиген CD20 описан, например, в Clark et al. Proc. Natl Acad. Sci (USA) 82:1766 (1985).
Исключительно для целей настоящей заявки, "гуманизированное 2H7" относится к гуманизированному варианту антитела 2H7, CDR последовательности которого описаны в патенте США №5500362 (фиг. 5 и 6), включенном в настоящее описание в качестве ссылки в полном объеме. В рамках настоящей заявки примеры гуманизированных антител 2H7 включают в себя варианты, описанные в WO 2004/056312, который также полностью включен в настоящее описание в качестве ссылки в полном объеме, а также другие варианты, включая, но не ограничиваясь ими: 2H7v16, 2H7v31, 2H7v73, 2H7v75, 2H7v96, 2H7v114, 2H7v115, 2H7v116, 2H7v138, 2H7v477, 2H7v375 и т.д.
В одном варианте осуществления гуманизированное антитело 2H7 содержит одну, две, три, четыре, пять или шесть из следующих последовательностей CDR:
последовательность CDR L1 RASSSVSYXH, где X представляет собой M или L (SEQ ID No. 67), например, SEQ ID No. 57 (фиг. 18A),
последовательность CDR L2 SEQ ID No. 58 (фиг. 18A),
последовательность CDR L3 QQWXFNPPT, где X представляет собой S или A (SEQ ID No. 68), например, SEQ ID No. 59 (фиг. 18A),
последовательность CDR H1 SEQ ID No. 60 (фиг. 18B),
последовательность CDR H2 AIYPGNGXTSYNQKFKG, где X представляет собой D или A (SEQ ID No. 69), например, SEQ ID No. 61 (фиг. 18B), и
последовательность CDR H3 VVYYSXXYWYFDV, где X в положении 6 представляет собой N, A, Y, W или D, и X в положении 7 представляет собой S или R (SEQ ID No. 70), например, SEQ ID No. 62 (фиг. 18B).
Последовательности CDR, указанные выше, как правило, представлены в каркасных последовательностях вариабельных участков легких и вариабельных участков тяжелых цепей, таких как, главным образом, консесусные остатки FR человека легкой цепи каппа подгруппы I (VL6I) человека, и, главным образом, консенсусные остатки FR человека тяжелой цепи подгруппы III (VHIII) человека. См. также WO 2004/056312 (Lowman et al.).
Вариабельный домен тяжелой цепи может быть соединен с константным доменом цепи IgG человека, где область может представлять собой, например, IgG1 или IgG3, в том числе природную последовательность и альтернативные константные домены.
В предпочтительном варианте осуществления такое антитело содержит последовательность вариабельного домена тяжелой цепи SEQ ID No. 29 (v16, как представлено на фиг. 18B), также оно необязательно содержит последовательность вариабельного домена легкой цепи SEQ ID No. 26 (v16, как представлено на фиг. 18A), которые необязательно содержат одну, или несколько, аминокислотную замену(ы) в положениях 56, 100 и/или 100a, например D56A, N100A или N100Y и/или S100aR, в вариабельном домене тяжелой цепи, и одну, или несколько, аминокислотную замену(ы) в положениях 32 и/или 92, например M32L и/или S92A, в вариабельном домене легкой цепи. Предпочтительно, антитело представляет собой целое антитело, содержащее аминокислотные последовательности легких цепей SEQ ID No. 63 или 64, и аминокислотные последовательности тяжелых цепей SEQ ID No. 65, 66, 71 или 72.
Предпочтительное гуманизированное антитело 2H7 представляет собой окрелизумаб (Genentech).
Здесь антитело может дополнительно содержать по меньшей мере одну аминокислотную замену в области Fc, которая повышает активность ADCC, такую как замена, где аминокислотные замены находятся в положениях 298, 333 и 334, предпочтительно S298A, E333A и K334A, с использованием нумерации Eu для остатков тяжелой цепи. См. также патент США №6737056B1, Presta.
Любые из этих антител могут содержать по меньшей мере одну замену в области Fc, которая повышает связывание FcRn или период полураспада в сыворотке, например, замену в положении 434 тяжелой цепи, такую как N434W. См. также патент США №6737056B1, Presta.
Любые из этих антител могут дополнительно содержать по меньшей мере одну аминокислотную замену в области Fc, которая повышает активность CDC, например, содержат по меньшей мере замену в положении 326, предпочтительно K326A или K326W. См. также патент США №6528624B1 (Idusogie et al.).
Некоторые предпочтительные варианты гуманизированного 2H7 представляют собой варианты, содержащие вариабельный домен легкой цепи SEQ ID No. 26 и вариабельный домен тяжелой цепи SEQ ID No. 29, в том числе домены с заменами или без них в области Fc (если есть), и домены, содержащие вариабельный домен тяжелой цепи с заменой N100A; или D56A и N100A; или D56A, N100Y и S100aR; в SEQ ID No. 29, и вариабельный домен легкой цепи с заменой M32L; или S92A; или M32L и S92A; в SEQ ID No. 26.
M34 в вариабельной области тяжелой цепи 2H7v16 был выявлен в качестве потенциального источника стабильности антител и является другим возможным кандидатом для замещения.
В кратком изложении некоторых различных предпочтительных вариантов осуществления этого изобретения, вариабельная область вариантов на основе 2H7v16 содержит аминокислотные последовательности v16 за исключением положений с аминокислотными заменами, которые указаны ниже в таблице. Если нет иных указаний, варианты 2H7 обладают такой же легкой цепью, что и vl6.
Одно предпочтительное гуманизированное 2H7 содержит последовательность вариабельного легкого домена 2H7v16:

и последовательность вариабельного тяжелого домена 2H7v16:
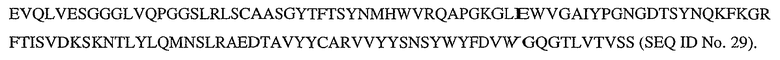
В том случае, когда гуманизированное антитело 2H7v16 представляет собой целое антитело, оно может содержать аминокислотную последовательность легкой цепи:

и аминокислотную последовательность тяжелой цепи SEQ ID No. 65 или:

Другое предпочтительное гуманизированное антитело 2H7 содержит последовательность вариабельного домена легкой цепи 2H7v511:
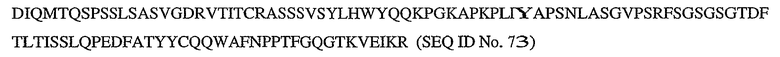
и последовательность вариабельного домена тяжелой цепи 2H7v511:
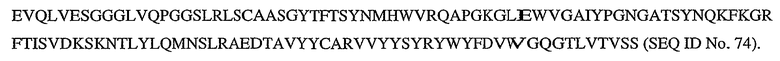
В том случае, когда гуманизированное антитело 2H7v511 представляет собой целое антитело, оно может содержать аминокислотную последовательность легкой цепи:

и аминокислотную последовательность тяжелой цепи SEQ ID No. 66 или:

Здесь "B-клеточная злокачественная опухоль" включает в себя неходжскинскую лимфому (NHL), в том числе низкодифференцированную/фолликулярную NHL, мелколимфоцитарную NHL (SL), промежуточно-дифференцированную/фолликулярную NHL, промежуточно-дифференцированную диффузную NHL, высокодифференцированную иммунобластную NHL, высокодифференцированную лимфобластную NHL, высокодифференцированную мелкоклеточную NHL с нерасщепленными ядрами, NHL с массивным поражением, лимфому из клеток мантийной зоны, ассоциированную со СПИДом лимфому, и макроглобулинемию Вальденстрема; лейкоз, в том числе острый лимфобластный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), волосатоклеточный лейкоз и хронический миелобластный лейкоз; и другие гематологические злокачественные опухоли. Такие злокачественные опухоли можно лечить антителами, направленными против B-клеточных поверхностных маркеров, таких как CD20.
Как используют здесь, термин "неходжскинская лимфома" или "NHL" относится к злокачественной опухоли лимфатической системы, отличной от лимфом Ходжкина. Лимфомы Ходжкина можно отличить от неходжкинских лимфом, главным образом, по наличию клеток Рид-Штернберга при лимфомах Ходжкина и отсутствию указанных клеток при неходжскинских лимфомах. Примеры неходжскинских лимфом, которые охватывает используемый в настоящей заявке термин, включают в себя любые лимфомы, которые специалист в данной области (например, онколог или патолог) может определить как неходжкинскую лимфому в соответствии с системами классификации, известными в данной области, такими как Пересмотренная европейско-американская классификация лимфом (REAL), как описано в Color Atlas of Clinical Hematology, Third Edition; A. Victor Hoffbrand and John E. Pettit (eds.) (Harcourt Publishers Limited 2000) (см., в частности фиг. 11.57, 11.58 и/или 11.59). Более конкретные примеры включают в себя, но не ограничиваются ими, рецидивирующую или резистентную NHL, пограничную низкодифференцированную NHL, NHL стадии III/IV, устойчивую к химиотерапии NHL, лимфобластный лейкоз и/или лимфому предшественников B-клеток, мелколимфоцитарную лимфому, B-клеточный хронический лимфоцитарный лейкоз и/или пролимфоцитарный лейкоз и/или мелколимфоцитарную лимфому, B-клеточную пролимфоцитарную лимфому, иммуноцитому и/или лимфоплазматическую лимфому, B-клеточную лимфому маргинальной зоны, лимфому маргинальной зоны селезенки, экстранодальную MALT-лимфому маргинальной зоны, волосатоклеточный лейкоз, плазмацитому и/или плазмаклеточную миелому, низкодифференцированную/фолликулярную лимфому, промежуточно-дифференцированную/фолликулярную NHL, лимфому из клеток мантийной зоны, лимфому центрального фолликула (фолликулярную), промежуточно-дифференцированную диффузную NHL, диффузную крупноклеточную B-клеточную лимфому, NHL с агрессивным течением (в том числе пограничную NHL с агрессивным течением и рецидивирующую NHL с агрессивным течением), NHL, рецидивировавшую после аутологичной трансплантации стволовых клеток или устойчивую к ней, первичную медиастинальную крупноклеточную B-клеточную лимфому, первичную эффузионную лимфому, высокодифференцированную иммунобластную NHL, высокодифференцированную лимфобластную NHL, высокодифференцированную мелкоклеточную NHL с нерасщепленными ядрами, NHL с массивным поражением, лимфому Беркитта, лимфобластный лейкоз и/или лимфому предшественников T-клеток (периферических), T-клеточную лимфому и/или лейкоз взрослых, T-клеточный хронический лимфоцитарный лейкоз и/или пролимфоцитарный лейкоз, крупногранулярный лимфоцитарный лейкоз, фунгоидный микоз и/или синдром Сезари, эксранодальную лимфому естественных киллеров/T-клеток (назального типа), T-клеточную лимфому по типу энтеропатии, гепатоспленальную T-клеточную лимфому, подкожную подобную панникулиту T-клеточную лимфому, лимфомы кожных покровов (кожные), анапластическую крупноклеточную лимфому, ангиоцентричную лимфому, T-клеточную лимфому кишечника, периферическую T-клеточную (не указанную в другом месте) лимфому и ангиоиммунобластную T-клеточную лимфому.
В рамках настоящего описания "аутоиммунное заболевание" представляет собой заболевание или нарушение, возникающее в собственных тканях индивидуума и направленное против них, или отдельный его признак или его проявление, или состояние, возникающее как его следствие. Примеры аутоиммунных заболеваний или нарушений включают в себя, но не ограничиваются ими, артрит (ревматоидный артрит, юношеский ревматоидный артрит, остеоартрит, псориатический артрит и анкилозирующий спондилит), псориаз, дерматит, в том числе атопический дерматит, хроническую идиопатическую крапивницу, в том числе хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, токсический эпидермальный некролиз, склеродермию (в том числе системную склеродермию), склероз, такой как прогрессирующая системная склеродермия, воспалительное заболевание кишечника (IBD) (например, болезнь Крона, язвенный колит, аутоиммунное воспалительное заболевание кишечника), гангренозную пиодермию, узловатую эритему, первичный склерозирующий холангит, эписклерит), синдром острой дыхательной недостаточности, в том числе синдром острой дыхательной недостаточности взрослых (ARDS), менингит, опосредуемые IgE заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена, увеит или аутоиммунный увеит, колит, такой как микроскопический колит и коллагенозный колит, гломерулонефрит (GN), такой как мембранозный GN (мембранозная нефропатия), идиопатический мембранозный GN, мембранозно-пролиферативный GN (MPGN), в том числе I тип и II тип, и быстро прогрессирующий GN, аллергические состояния, аллергическую реакцию, экзему, астму, состояния, в которые вовлечена инфильтрация T-клеток и хронический воспалительный ответ, атеросклероз, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системную красную волчанку (SLE) такую как кожная SLE, подострую красную волчанку, волчанку (в том числе нефрит, церебрит, детскую, непочечную, дискоидную, алопецию), юношеский сахарный диабет (I типа), в том числе детский инсулинзависимый сахарный диабет (IDDM), сахарный диабет взрослых (диабет II типа), рассеянный склероз (MS), такой как спино-оптический MS, иммунный ответ, ассоциированный с острой и замедленной гиперчувствительностью, опосредуемой цитокинами и T-лимфоцитами, туберкулез, саркоидоз, гранулематоз, в том числе лимфоматоидный гранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулит (в том числе васкулит крупных сосудов (в том числе ревматическую полимиалгию и гигантоклеточный артериит (Такаясу)), васкулит сосудов среднего калибра (в том числе болезнь Кавасаки и узелковый полиартериит), васкулит в ЦНС, системный некротизирующий васкулит, и ассоциированный с ANCA васкулит, такой как васкулит или синдром Черджа-Стросс (CSS), височный артериит, апластическую анемию, Кумбс-положительную анемию, анемию Диамонда-Блэкфана, гемолитическую анемию или иммунную гемолитическую анемию, в том числе аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, истинную эритроцитарную аплазию (PRCA), дефицит фактора VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, в которые вовлечен диапедез лейкоцитов, воспалительные нарушения в ЦНС, синдром множественного поражения органов, заболевания, опосредуемые комплексами антиген-антитело, заболевание, связанное с антителами против клубочковой базальной мембраны, антифосфолипидный синдром, аллергический неврит, болезнь Бечета или Бехчета, синдром Кастельмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид, пемфигус (в том числе обыкновенный, листовидный пемфигус, и пемфигоид слизистой оболочки), аутоиммунные полиэндокринопатии, болезнь Рейтера, иммунокомплексный нефрит, хроническую невропатию, такую как IgM-полиневропатии или опосредуемая IgM невропатия, тромбоцитопению (например, такая как развивается у пациентов с инфарктом миокарда), в том числе тромботическую тромбоцитопеническую пурпуру (TTP) и аутоиммунную или иммунноопосредуемую или тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), в том числе хроническая или острая ITP, аутоиммунное заболевание яичек и яичников, в том числе аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, в том числе тиреоидит, такой как аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоз, болезнь Аддисона, болезнь Грэйва, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, в том числе неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или Итона-Ламберта, синдром "негнущегося человека" или "негнущегося субъекта", энцефаломиелит, такой как аллергический энцефаломиелит, миастанию, церебеллярную дегенерацию, лимбический энцефалит и/или энцефалит ствола мозга, нейромиотонию, опсоклонус или опсоклонус-миоклонус синдром (OMS), и сенсорную невропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (не зависимый от трансплантата) в противоположность NSIP, синдром Гийена-Барре, болезнь Бергера (IgA-нефропатия), первичный биллиарный цирроз, брюшные афты (глютеновую энтеропатию), рефрактерные афты, герпетиформный дерматит, криоглобулинемию, боковой амиотрофический склероз (ALS; болезнь Лу Геринга), болезнь коронарных артерий, аутоиммунное заболевание внутреннего уха (AIED), или аутоиммунную потерю слуха, опсоклонус-миоклонус синдром (OMS), полихондрит, такой как рефрактерный полихондрит, легочно-альвеолярный протеиноз, амилоидоз, гигантоклеточный гепатит, склерит, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает в себя моноклональный B-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неясного значения, MGUS), периферическую невропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, пароксизмальный паралич, и каналопатии ЦНС, аутизм, воспалительную миопатию, фокальный сегментный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, аутоиммунное гепатологическое нарушение, фибромиалгию, множественную эндокринную недостаточность, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, синдром Дресслера, очаговую алопецию, синдром CREST (кальциноз, синдром Рейно, нарушение моторики пищевода, склеродактилия и телеангиэктозия), мужское и женское аутоиммунное бесплодие, анкилозирующий спондилит, смешанное заболевание соединительной ткани, болезнь Чагаса, ревматическую атаку, привычный выкидыш, альвеолит у сельскохозяйственных рабочих, полиформную эритему, посткардиотомический синдром, синдром Кушинга, легочную аллергию птицеловов, синдром Альпорта, альвеолит, такой как аллергический и фиброзный альвеолит, заболевание интерстиция легкого, трансфузионную реакцию, лепру, малярию, лейшманиоз, кипаносомиоз, шистосомоз, аскариоз, аспергиллез, синдром Самптера, синдром Каплана, денге, эндокардит, эндомиокардиальный фиброз, эндофтальмит, возвышенную стойкую эритему, гемолитическую болезнь новорожденных, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филариоз, циклит, такой как хронический циклит, гетерохронический циклит или циклит Фукса, пурпуру Геноха-Шенлейна, инфекцию вирусом иммунодефицита человека (HIV), инфекцию эховирусом, кардиомиопатию, болезнь Альцгеймера, инфекцию парвовирусом, инфекцию вирусом краснухи, поствакцинальный синдром, врожденную инфекцию вирусом краснухи, инфекцию вирусом Эпштейна-Барра, партоит, синдром Эванса, аутоиммунную гонадную недостаточность, хорею Сиденгама, постстрептококковый нефрит, облитерирующий тромбоангиит, тиреотоксикоз, сухотку спинного мозга и гигантоклеточную полимиалгию.
Здесь "суперсемейство рецепторов фактора некроза опухолей" или "суперсемейство рецепторов TNF" относится к рецепторным полипептидам, с которыми связываются цитокины из семейства TNF. Как правило, эти рецепторы представляют собой трансмембранные рецепторы I типа с одной или несколькими богатыми цистеином повторяющимися последовательностями в их внеклеточном домене. Суперсемейство рецепторов TNF можно дополнительно подразделить на (1) рецепторы смерти; (2) рецепторы-приманки; и (3) рецепторы сигнальных путей, которые лишены доменов смерти. "Рецепторы смерти" содержат в своем цитоплазматическом или внутриклеточном участке "домен смерти", т.е., участок, или последовательность, который участвует в передаче в клетке сигналов, которые могут привести к апоптозу или индукции определенных генов. "Рецепторы-приманки" лишены функционального домена смерти и неспособны передавать сигналы, которые приводят к апоптозу. Примеры цитокинов семейства генов TNF включают в себя фактор некроза опухолей-альфа (TNF-альфа), фактор некроза опухолей-бета (TNF-бета или лимфотоксин), CD30 лиганд, CD27 лиганд, CD40 лиганд, OX-40 лиганд, 4-1BB лиганд, Apo-1 лиганд (также обозначаемый как Fas-лиганд или лиганд CD95), Apo-2 лиганд (также обозначаемый как TRAIL), Apo-3 лиганд (также обозначаемый как TWEAK), остеопротегерин (OPG), APRIL, лиганд RANK (также обозначаемый как TRANCE), и TALL-1 (также обозначаемый как BlyS, BAFF или THANK). Примеры рецепторов из суперсемейства рецепторов TNF включают в себя: рецептор фактора некроза опухолей 1 типа (TNFR1), рецептор фактора некроза опухолей 2 типа (TNFR2), рецептор фактора роста нервов p75 (NGFR), B-клеточный поверхностный антиген CD40, T-клеточный антиген OX-40, рецептор Apo-1 (также обозначаемый как Fas или CD95), рецептор Apo-3 (также обозначаемый как DR3, swl-1, TRAMP и LARD), рецептор, называемый "трансмембранным активатором и CAML-посредником" или "TACI", белок BCMA, DR4, DR5 (альтернативно обозначаемый как Apo-2; TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER), DR6, DcR1 (также обозначаемый как TRID, LIT или TRAIL-R3), DcR2 (также обозначаемый как TRAIL-R4 или TRUNDD), OPG, DcR3 (также обозначаемый как TR6 или M68), CAR1, HVEM (также обозначаемый как ATAR или TR2), GITR, ZTNFR-5, NTR-1, TNFL1, CD30, рецептор лимфотоксина-бета (LTBr), рецептор 4-1BB и TR9 (EP988, 371A1).
Здесь "Apo-2 лиганд", "Apo-2L", "Apo2L", Apo-2 лиганд/TRAIL" и "TRAIL" используют взаимозаменяемо для обозначения полипептидной последовательности, которая включает в себя аминокислотные остатки 114-281, включительно, 95-281, включительно, остатки 92-281, включительно, остатки 91-281, включительно, остатки 41-281, включительно, остатки 39-281, включительно, остатки 15-281, включительно, или остатки 1-281, включительно, аминокислотной последовательности, представленной на фиг. 24 (SEQ ID No. 46), а также биологически активные фрагменты, варианты с делециями, вставками и/или заменами указанных выше последовательностей. В одном варианте осуществления полипептидная последовательность содержит остатки 114-281 из фиг. 24 (SEQ ID No. 46). Полипептидная последовательность необязательно содержит остатки 92-281 или остатки 91-281 из фиг. 24 (SEQ ID No. 46). Полипептиды Apo-2L могут кодироваться природной нуклеотидной последовательностью, представленной на фиг. 24 (SEQ ID No. 45). Кодон, который кодирует остаток Pro119 (фиг. 24; SEQ ID No. 45), необязательно может представлять собой "CCT" или "CCG". Фрагменты или варианты необязательно являются биологически активными и обладают по меньшей мере приблизительно 80% идентичностью аминокислотных последовательностей, или по меньшей мере приблизительно 90% идентичностью последовательностей, или по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательностей с одной из указанных выше последовательностей. Определение включает в себя варианты Apo-2 лиганда с заменами, в которых по меньшей мере одна из природных аминокислот заменена другой аминокислотой, такой как остаток аланина. Определение также включает в себя природную последовательность Apo-2 лиганда, выделенного из источника Apo-2 лиганда или полученного рекомбинантными и/или синтетическими способами. Apo-2 лиганд по этому изобретению включает в себя полипептиды, обозначаемые как Apo-2 лиганд или TRAIL, описанные в WO 97/01633, опубликованном 16 января, 1997, WO 97/25428, опубликованном 17 июля, 1997, WO 99/36535, опубликованном 22 июля, 1999, WO 01/00832, опубликованном 4 января, 2001, WO 02/09755, опубликованном 7 февраля, 2002, WO 00/75191, опубликованном 14 декабря, 2000, и в патенте США №6030945, выданном 29 февраля, 2000. Термины применяют, главным образом, для обозначения форм Apo-2 лиганда, которые включают в себя мономер, димер, тример, гексамер или олигомерные формы полипептида более высокого порядка. Если нет иных указаний, для любой нумерации аминокислотных остатков, относящейся к последовательности Apo-2L, используют нумерацию в соответствии с фиг. 24 (SEQ ID No. 46).
"Рецептор Apo-2 лиганда" включает в себя рецепторы, обозначаемые в данной области как "DR4" и "DR5." Pan et al. описали член семейства рецепторов TNF, обозначаемый как "DR4" (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованный 30 июля, 1998; WO 99/37684, опубликованный 29 июля, 1999; WO 00/73349, опубликованный 7 декабря, 2000; патент США 6433147, выданный 13 августа, 2002; патент США 6461823, выданный 8 октября, 2002, и патент США 6342383, выданный 29 января, 2002). В Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) описан другой рецептор для Apo2L/TRAIL (см. также, WO 98/51793, опубликованный 19 ноября, 1998; WO 98/41629, опубликованный 24 сентября, 1998). Этот рецептор обозначают как DR5 (альтернативно рецептор также обозначают как Apo-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER; Screaton et al., Curr. Biol, 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа, 1998; европейский патент 870827, опубликованный 14 октября, 1998; WO98/46643, опубликованный 22 октября, 1998; WO 99/02653, опубликованный 21 января, 1999; WO 99/09165, опубликованный 25 февраля, 1999; WO 99/11791, опубликованный 11 марта, 1999; патент США 2002/0072091, опубликованный 13 августа, 2002; патент США 2002/0098550, опубликованный 7 декабря, 2001; патент США 6313269, выданный 6 декабря, 2001; патент США 2001/0010924, опубликованный 2 августа, 2001; патент США 2003/01255540, опубликованный 3 июля, 2003; патент США 2002/0160446, опубликованный 31 октября, 2002, патент США 2002/0048785, опубликованный 25 апреля, 2002; патент США 6569642, выданный 27 мая, 2003, патент США 6072047, выданный 6 июня, 2000, патент США 6642358, выданный 4 ноября, 2003). Как описано выше, другие рецепторы Apo-2L включают в себя DcR1, DcR2 и OPG. Как используют здесь, термин "рецептор Apo-2L" включает в себя рецептор с природной последовательностью и варианты рецептора. Эти термины включают в себя рецептор Apo-2L, экспрессируемый у множества млекопитающих, в том числе у человека. Рецептор Apo-2L может экспрессироваться эндогенно, как происходит в природных условиях во множестве линий тканей человека, или он может быть экспрессированым рекомбинантными или синтетическими способами. "Рецептор Apo-2L с природной последовательностью" содержит полипептид, обладающий такой же аминокислотной последовательностью, что и рецептор Apo-2L природного происхождения. Таким образом, рецептор Apo-2L с природной последовательностью может обладать аминокислотной последовательностью природного рецептора Apo-2L млекопитающих, в том числе человека. Такой рецептор Apo-2L с природной последовательностью может быть выделенным из природного источника или может быть полученным рекомбинантными или синтетическими способами. Конкретно, термин "рецептор Apo-2L с природной последовательностью" включает в себя природные укороченные или секретируемые формы рецептора (например, растворимую форму, содержащую, например, последовательность внеклеточного домена), формы природных вариантов (например, альтернативно-сплайсированные формы) и природные аллельные варианты. Варианты рецептора могут включать в себя фрагменты рецептора Apo-2L с природной последовательностью или его мутантные формы с делецией. На фиг. 25 A-C представлена последовательность рецептора DR5 человека из 411 аминокислот, совместно с его нуклеотидной последовательностью (SEQ ID No. 47 и 48), как опубликовано в WO 98/51793 19 ноября, 1998. Транскрипционные сплайсированные варианты рецептора DR5 человека известны в данной области. Такие сплайсированные варианты кодируют последовательность рецептора DR5 человека из 440 аминокислот, как представлено на фиг. 26A-C совместно с их нуклеотидной последовательностью (SEQ ID No. 49 и 50), и как опубликовано в WO 98/35986 20 августа, 1998.
Здесь "антитело против рецептора смерти" используют, главным образом, для обозначения антитела или антител, направленных против рецептора, относящегося к суперсемейству рецепторов фактора некроза опухолей и содержащего домен смерти, способный передавать сигнал на совершение апоптоза, и такие антитела включают в себя антитело против DR5 и антитело против DR4.
"Антитело к рецептору DR5", "антитело DR5", или "антитело против DR5" используют в широком смысле для обозначения антител, которые связываются с по меньшей мере одной формой рецептора DR5 или его внеклеточного домена. Антитело против DR5 необязательно является слитым или связанным с гетерологичной последовательностью или молекулой. Предпочтительно, гетерологичная последовательность дает возможность или способствует формированию антителом комплексов более высокого порядка или олигомерных комплексов. Антитело против DR5 необязательно связывается с рецептором DR5, но не связывается или не реагирует перекрестно с каким-либо дополнительным рецептором Apo-2L (например, DR4, DcR1 или DcR2). Антитело необязательно является агонистом активности DR5 в отношении передачи сигнала.
Антитело против DR5 по этому изобретению необязательно связывается с рецептором DR5 в концентрации из диапазона приблизительно от 0,1 нМ до приблизительно 20 мМ, как определяют в анализе связывания BIAcore. Антитела против DR5 по этому изобретению необязательно обладают значением IC50 приблизительно от 0,6 нМ до приблизительно 18 мМ, как определяют в анализе связывания BIAcore.
Исключительно для целей настоящей заявки, термин "апомаб" относится к антителу-агонисту, которое связывается с DR5 и содержит аминокислотные последовательности вариабельных участков легких цепей и вариабельных участков тяжелых цепей SEQ ID No. 55 и 56. Предпочтительно апомаб содержит тяжелые и легкие цепи, представляющие собой SEQ ID No. 51 и 52, соответственно.
II. Получение антител
Способы получения антител, которые можно составлять в соответствии с настоящим изобретением, представлены ниже.
(i) Селекция и получение антигена
Предпочтительно, антиген, с которым связывается антитело, представляет собой биологически значимый гликопротеин, и введение антитела млекопитающему, страдающему заболеванием или нарушением, может приводить у этого млекопитающего к терапевтической пользе. Однако также рассматривают антитела, направленные против неполипептидных антигенов (таких как ассоциированные с опухолью гликолипидные антигены; см. патент США 5091178).
В случае, когда антиген представляет собой полипептид, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как фактор роста. Иллюстративные антигены включают в себя молекулы, такие как ренин; гормон роста, в том числе гормон роста человека и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликуло-стимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VIIIC, фактор IX, тканевой фактор (TF) и фактор фон Виллебранда; противосвертывающие факторы, такие как белок C; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или активатор плазминогена мочи человека или тканевой активатор плазминогена человека (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухолей-альфа и -бета; энкефалиназу; RANTES (регулируемый активацией фактор, экспрессируемый и активируемый нормальными T-клетками); макрофагальный воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; ингибирующее вещество Мюллера; A-цепь релаксина; B-цепь релаксина; прорелаксин; гонадотропин-ассоциированный пептид мыши; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; цитотоксический ассоциированный с T-лимфоцитами антиген (CTLA), такой как CTLA-4; ингибин; активин; сосудисто-эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротрофин-3, -4, - 5, или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нервов, такой как NGF-b; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, в том числе TGF-b1, TGF-b2, TGF-b3, TGF-b4 или TGF-b5; фактор некроза опухолей (TNF), такой как TNF-альфа или TNF-бета; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (IGF-I головного мозга), связывающие инсулиноподобный фактор роста белки; CD-белки, такие как CD3, CD4, CD8, CD19, CD20, CD22 и CD40; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета, и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9 и IL-10; супероксиддисмутазу; T-клеточные рецепторы; поверхностные мембранные белки; стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; хоминг-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; ассоциированный с опухолью антиген, такой как рецептор HER2, HER3 или HER4; и фрагменты любого из перечисленных выше полипептидов.
Иллюстративные молекулярные мишени для антител, охватываемых настоящим изобретением, включают в себя CD-белки, такие как CD3, CD4, CD8, CD19, CD20, CD22, CD34 и CD40; члены семейства рецепторов ErbB, такие как рецептор EGF, рецептор HER2, HER3 или HER4; B-клеточные поверхностные антигены, такие как CD20 или BR3; член суперсемейства рецептора фактора некроза опухолей, в том числе DR5; антиген стволовых клеток простаты (PSCA); молекулы клеточной адгезии, такие как LFA-1, Mac1, p150.95, VLA-4, ICAM-1, VCAM, интегрин альфа 4/бета 7, и интегрин альфа v/бета 3, в том числе как альфа, так или бета их субъединицы (например, антитела против CD11a, против CD18 или против CD11b); факторы роста, такие как VEGF, а также их рецепторы; тканевой фактор (TF); фактор некроза опухолей (TNF), такой как TNF-альфа или TNF-бета, альфа-интерферон (альфа-IFN); интерлейкин, такой как IL-8; IgE; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; белок C и т.д.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, можно использовать для получения антител в качестве иммуногенов. Для трансмембранных молекул, таких как рецепторы, в качестве иммуногена можно использовать их фрагменты (например, внеклеточный домен рецептора). Альтернативно в качестве иммуногена можно использовать клетки, экспрессирующие трансмембранную молекулу. Такие клетки можно получать из природных источников (например, клеточные линии злокачественных опухолей) или они могут представлять собой клетки, трансформированные рекомбинантными способами для экспрессии трансмембранной молекулы. Другие антигены и их формы, пригодные для получения антител, будут понятны специалисту в данной области.
Для получения антител против HER2, антиген HER2, предназначенный для применения при их продукции, может представлять собой, например, растворимую форму внеклеточного домена HER2 или его участок, содержащий требуемый эпитоп. Альтернативно для получения антител можно использовать клетки, экспрессирующие на своей клеточной поверхности HER2 (например, клетки NIH-3T3, трансформированные с целью сверхэкспрессии HER2; или клеточная линия карциномы, такая как клетки SK-BR-3, см. Stancovski et al. PNAS (USA) 88:8691-8695 (1991)).
(ii) Моноклональные антитела
Моноклональные антитела получают из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые появляются в процессе продукции моноклонального антитела. Таким образом, определение "моноклональный" указывает на свойство антитела не представлять собой смесь различных антител.
Например, моноклональные антитела можно получать с использованием способа гибридом, впервые описанного Kohler et al., Nature, 256:495 (1975), или их можно получать способами рекомбинантных ДНК (патент США №4816567).
В способе гибридом, мышь или другого пригодного животного-хозяина, такого как хомяк, иммунизируют, как описано выше, для получения лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфично связываются с белком, используемым для иммунизации. Альтернативно лимфоциты можно иммунизировать in vitro. Затем проводят слияние лимфоцитов с клетками миеломы с использованием пригодного средства, вызывающего слияние клеток, такого как полиэтиленгликоль, с получением клеток гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и выращивают в пригодной культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживаемость не слитых исходных клеток миеломы. Например, если исходные клетки миеломы лишены фермента гипоксантин-гуанин-фосфорибозил-трансферазы (HGPRT или HPRT), культуральная среда для гибридом, как правило, включает в себя вещества гипоксантин, аминоптерин и тимидин (среда HAT), которые препятствуют росту клеток, дефицитных по HGPRT.
Предпочтительные клетки миеломы представляют собой клетки, в которые эффективно происходит слияние, которые поддерживают стабильно высокий уровень продукции антител антителпродуцирующими клетками, прошедшими селекцию, и являются чувствительными к среде, такой как среда HAT. Среди них, предпочтительными клеточными линиями миеломы являются линии миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные в Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные в American Type Culture Collection, Rockville, Maryland USA. Также для продукции моноклональных антител человека описаны клеточные линии миеломы человека и гетеромиеломы мыши-человека (Kozbor, J. Immunol, 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают гибридомные клетки, оценивают на продукцию моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют посредством иммунопреципитации или анализа связывания in vitro, такого как радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно определять, например, посредством анализа Скэтчарда в Munson et al., Anal. Biochem., 107:220 (1980).
После выявления гибридомных клеток, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны можно субклонировать посредством способов лимитирующих разведений и выращивать стандартными способами (Goding, Monoclonal antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Пригодные для этой цели культуральные среды включают в себя, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo у животных в качестве асцитных опухолей.
Моноклональные антитела, секретируемые субклонами пригодным способом, выделяют из культуральной среды, асцитной жидкости, или сыворотки посредством общепринятых способов очистки антител, таких как, например, хроматография с использованием системы белок A-сефароза, хроматография с гидроксилапатитом, гель-электрофорез, диализ, или аффинная хроматография.
ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. Для обеспечения синтеза моноклональных антител в рекомбинантных клетках-хозяевах, после выделения ДНК можно встраивать в экспрессирующие векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок-антитело. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают в себя Skerra et al., Curr. Opinion in Immunol, 5:256-262 (1993) и Pluckthun, Immunol. Revs., 130:151-188 (1992).
В дополнительном варианте осуществления, моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, созданных с использованием способов, описанных в McCafferty et al., Nature, 348:552-554 (1990). В Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol Biol, 222:581-597 (1991) описано выделение антител мыши и человека, соответственно, с использованием фаговых библиотек. В более поздних публикациях описана продукция высокоаффинных (нМ порядок) антител человека посредством перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень крупных фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти способы представляют собой приемлемые альтернативы традиционным способам гибридомных моноклональных антител для выделения моноклональных антител.
Также ДНК можно модифицировать, например, посредством встраивания последовательности, кодирующей константные домены тяжелых цепей и легких цепей человека, вместо гомологичной последовательности мыши (патент США №4816567; и Morrison, et al., Proc. Natl Acad. Sci USA, 81:6851 (1984)), или посредством ковалентного присоединения к кодирующей иммуноглобулин последовательности полной или неполной последовательности, кодирующей полипептид, не являющийся иммуноглобулином.
Как правило, такими полипептидами, не являющимися иммуноглобулинами, заменяют константные домены антитела, или ими заменяют вариабельные области одного антигенсвязывающего центра антитела с получением химерного двухвалентного антитела, содержащего один антигенсвязывающий центр со специфичностью в отношении антигена и другой антигенсвязывающий центр со специфичностью в отношении другого антигена.
(iii) Гуманизированные антитела
Способы гуманизации антител, не являющихся человеческими, описаны в данной области. Предпочтительно, гуманизированное антитело обладает одним или несколькими встроенными в него аминокислотными остатками из источника, который не является человеческим. Такие не являющиеся человеческими аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортной" вариабельной области. Гуманизацию, главным образом, можно проводить в соответствии со способом Winter и коллег (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), посредством замены соответствующих последовательностей антитела человека последовательностями гипервариабельной области. Таким образом, такие "гуманизированные" антитела представляют собой химерные антитела (патент США №4816567), где по существу интактный вариабельный домен человека замещен соответствующей последовательностью вида, не относящегося к человеку. Практически гуманизированные антитела, как правило, представляют собой антитела человека, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR замещены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека как легких, так и тяжелых цепей, для использования при получении гуманизированных антител является очень важным для снижения антигенности. В соответствии с так называемым способом "наилучшего соответствия", последовательность вариабельного домена антитела грызуна анализируют относительно целой библиотеки известных последовательностей вариабельных доменов человека. Затем последовательность человека, которая является наиболее сходной с последовательностью грызуна, принимают в качестве каркасной области (FR) для гуманизированного антитела (Sims et al., J. Immunol, 151:2296 (1993); Chothia et al., J. Mol. Biol, 196:901 (1987)). В другом способе используют конкретную каркасную область, полученную из консенсусной последовательности всех антител человека из конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci USA, 89:4285 (1992); Presta et al., J. Immunol, 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и другими положительными биологическими свойствами. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают с помощью процесса анализа исходных последовательностей и различных предполагаемых гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются широко доступными и известны специалистам в данной области. Доступными являются компьютерные программы, которые иллюстрируют и выводят на экран возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-претендентов. Исследование этих выведенных на экран данных позволяет проводить анализ возможной роли остатков в функционировании предполагаемых последовательностей иммуноглобулинов, т.е., анализ остатков, которые влияют на способность иммуноглобулина-претендента связывать свой антиген. Таким образом, остатки FR можно отобрать и комбинировать из реципиентной и импортной последовательностей таким образом, чтобы были достигнуты требуемые свойства антител, такие как повышенная аффинность к антигену(ам)-мишени. Как правило, непосредственное и наиболее значительное влияние на связывание антигена оказывают остатки гипервариабельной области.
В WO 01/00245 описано получение иллюстративных гуманизированных антител против HER2, которые связываются с HER2 и блокируют активацию лигандом рецептора HER. Представляющее особый интерес в рамках настоящей заявки гуманизированное антитело блокирует опосредуемую EGF, TGF-α и/или HRG активацию MAPK, по существу настолько же эффективно, что и моноклональное антитело 2C4 мыши (или его Fab-фрагмент), и/или связывает HER2 по существу настолько же эффективно, что и моноклональное антитело 2C4 мыши (или его Fab-фрагмент). В рамках настоящей заявки гуманизированное антитело, например, может содержать не являющиеся человеческими остатки гипервариабельной области, встроенные в вариабельный домен тяжелой цепи человека, и может дополнительно содержать замену в каркасной области (FR) в положении, выбранном из группы, состоящей из 69H, 71H и 73H, при использовании системы нумерации вариабельной области, как указано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одном варианте осуществления гуманизированное антитело содержит замены в FR в двух или всех из положений 69H, 71H и 73H.
Представляющее здесь интерес иллюстративное гуманизированное антитело содержит определяющие комплементарность остатки вариабельного домена тяжелой цепи GFTFTDYTMX, где X предпочтительно представляет собой D или S (SEQ ID No. 7); DVNPNSGGSIYNQRFKG (SEQ ID No. 8); и/или NLGPSFYFDY (SEQ ID No. 9), и необязательно содержит модификации аминокислот этих остатков CDR, например, где модификации по существу сохраняют или повышают аффинность антитела. Например, представляющий интерес вариант антитела может обладать приблизительно от одной до приблизительно семи или приблизительно пять аминокислотных замен в указанных выше вариабельных последовательностях CDR тяжелых цепей. Такие варианты антител можно получать, например, посредством созревания аффинности как описано ниже. Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного домена тяжелой цепи в SEQ ID No. 4.
Гуманизированное антитело может содержать определяющие комплементарность остатки вариабельного домена легкой цепи KASQDVSIGVA (SEQ ID No. 10); SASYXXX, где X в положении 5 предпочтительно представляет собой R или L, где X в положении 6 предпочтительно представляет собой Y или E, и X в положении 7 предпочтительно представляет собой T или S (SEQ ID No. 11); и/или QQYYIYPYT (SEQ ID No. 12), например, в дополнение к CDR остаткам вариабельного домена тяжелой цепи, указанным в предыдущем абзаце. Такие гуманизированные антитела необязательно содержат модификации аминокислот указанных выше остатков CDR, например, где модификации по существу сохраняют или повышают аффинность антитела. Например, представляющий интерес вариант антитела может обладать приблизительно одной до приблизительно семи или приблизительно пять аминокислотных замен в указанных выше вариабельных последовательностях CDR легких цепей. Такие варианты антител можно получать, например, посредством созревания аффинности, как описано ниже. Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного тяжелого домена в SEQ ID No. 3.
Также в настоящей заявке рассматривают антитела, полученные в результате созревания аффинности, которые связывают HER2 и блокируют активацию лигандом рецептора HER. Исходное антитело может представлять собой антитело человека или гуманизированное антитело, например, антитело, содержащее вариабельные последовательности легких и/или тяжелых цепей SEQ ID No. 3 и 4, соответственно (т.е. вариант 574). Антитело, полученное в результате созревания аффинности, предпочтительно связывается с рецептором HER2 с аффинностью, превышающей аффинность 2C4 мыши или варианта 574 (например, от приблизительно двух- или приблизительно четырехкратного, до приблизительно 100-кратного или приблизительно 1000-кратного повышения аффинности, например, оцененной с использованием ELISA для внеклеточного домена HER2 (ECD)). Иллюстративные вариабельные остатки CDR тяжелых цепей, подлежащие замене, включают в себя H28, H30, H34, H35, H64, H96, H99 или сочетания двух или более (например, двух, трех, четырех, пяти, шести или семи из этих остатков). Примеры вариабельных остатков CDR легких цепей, подлежащие замене, включают в себя L28, L50, L53, L56, L91, L92, L93, L94, L96, L97 или сочетания двух или более из них (например, от двух до трех, четырех, пяти или вплоть до приблизительно десяти из этих остатков).
Также рассматривают различные формы гуманизированного антитела или антитела, полученного в результате созревания аффинности. Например, гуманизированное антитело или антитело, полученное в результате созревания аффинности, может представлять собой фрагмент антитела, такой как Fab, который в целях получения иммуноконъюгата необязательно конъюгирован с одним или несколькими цитотоксическим средством(ами). Альтернативно гуманизированное антитело или антитело, полученное в результате созревания аффинности, может представлять собой полноразмерное антитело, такое как полноразмерное антитело IgG1.
(iv) Антитела человека
В качестве альтернативы гуманизации, можно получать антитела человека. Например, в настоящее время возможным является получение трансгенных животных (например, мышей), которые способны, при иммунизации, продуцировать полный набор антител человека в отсутствии эндогенной продукции иммуноглобулинов. Например, было описано, что гомозиготная делеция гена участка соединения тяжелых цепей антител (JH) у химерных мышей и мутантных мышей зародышевой линии приводит к полному ингибированию эндогенной продукции антител. Перенос системы генов иммуноглобулинов зародышевой линии человека таким мутантным мышам зародышевой линии приводит к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и патенты США №№5591669, 5589369 и 5545807.
Альтернативно для получения антител человека и фрагментов антител in vitro можно использовать технологию фагового дисплея (McCafferty et al., Nature 348:552-553 (1990)), из наборов генов вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. В соответствии с этим способом, гены V домена антител клонируют в рамку считывания либо главного, либо второстепенного гена оболочки нитевидного бактериофага, такого как M13 или fd, и они воспроизводятся в качестве функциональных фрагментов антител на поверхности частицы фага. Вследствие того, что нитевидная частица содержит одноцепочечную копию ДНК генома фага, селекция на основе функциональных свойств антитела также приведет к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые из свойств B-клетки. Фаговый дисплей можно проводить в различных формах; для ознакомления с ними см., например, Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников сегментов V-генов. Clackson et al., Nature, 352:624-628 (1991), выделили набор разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать набор V-генов из неиммунизированных доноров-людей и антитела против широкого набора антигенов (в том числе против собственных антигенов) можно выделять, главным образом, в соответствии со способами, описанными Marks et al., J. Mol Biol. 222:581-597 (1991), или Griffith et al, EMBO J. 12:725-734 (1993). См., также, патенты США №№ 5565332 и 5573905.
Как рассмотрено выше, антитела человека также можно получать с помощью активированных in vitro B-клеток (см. патенты США 5567610 и 5229275).
Антитела против HER2 человека описаны в патенте США №5772997, выданном 30 июня, 1998, и WO 97/00271, опубликованном 3 января, 1997.
(v) Фрагменты антител
Для получения фрагментов антител были разработаны различные способы. Традиционно, эти фрагменты получали посредством протеолитического расщепления полноразмерных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител можно выделять из фаговых библиотек антител, описанных выше. Альтернативно фрагменты Fab'-SH можно выделять непосредственно из E. coli и химически соединять с получением фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом фрагменты F(ab')2 можно выделять непосредственно из рекомбинантной культуры клеток-хозяев. Другие способы получения фрагментов антител будут очевидны квалифицированному специалисту. В других вариантах осуществления, предпочтительное для выбора антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185; патент США №5571894; и патент США №5587458. Фрагмент антитела также может представлять собой "линейное антитело", как описано, например, в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
(vi) Биспецифичные антитела
Биспецифичные антитела представляют собой антитела, которые обладают специфичностью в отношении связывания по меньшей мере двух различных эпитопов. Иллюстративные биспецифичные антитела могут связываться с двумя различными эпитопами белка HER2. Другие такие антитела могут сочетать в себе центр связывания HER2 и центр(ы) связывания EGFR, HER3 и/или HER4. Альтернативно плечо HER2 можно объединять с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD2 или CD3), или с Fc-рецепторами для IgG (FcγR), такими как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), так чтобы сконцентрировать защитные механизмы клеток на экспрессирующей HER2-клетке. Биспецифичные антитела также можно использовать для локализации цитотоксических средств в клетках, которые экспрессируют HER2. Такие антитела обладают связывающим HER2 плечом и плечом, которое связывает цитотоксическое средство (например, сапонин, антитело против интерферона-α, алкалоид барвинка, A-цепь рицина, метотрексат или гаптен с радиоактивным изотопом). Биспецифичные антитела можно получать в качестве полноразмерных антител или фрагментов антитела (например, биспецифичные антитела F(ab')2).
В WO 96/16673 описано биспецифичное антитело против HER2/FcγRIII, и в патенте США №5837234 описано биспецифичное антитело против HER2/FcγRI IDM1 (Osidem). Биспецифичное антитело против HER2/Fcα представлено в WO 98/02463. В патенте США №5821337 описано биспецифичное антитело против HER2/CD3. MDX-210 представляет собой биспецифичное Аb против HER2-FcγRIII.
Способы получения биспецифичных антител известны в данной области. Общепринятый способ получения полноразмерных биспецифичных антител основан на совместной экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, где две цепи обладают различной специфичностью (Millstein et al., Nature, 305:537-539 (1983)). Вследствие случайной сборки тяжелых и легких цепей иммуноглобулинов, такие гибридомы (квадромы) продуцируют смесь из потенциально 10 различных молекул антител, из которых только одно обладает правильной биспецифичной структурой. Очистка правильных молекул, которую обычно проводят посредством стадий аффинной хроматографии, является довольно трудоемкой, и выход продукта является низким. Аналогичные способы описаны в WO 93/08829, и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом, проводят слияние вариабельных доменов антитела с требуемой специфичностью в отношении связывания (участками связывания антитело-антиген) с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно проводят с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирных областей CH2 и CH3. Предпочтительно, чтобы по меньшей мере один из компонентов, предназначенных для слияния, обладал первым константным доменом тяжелой цепи (CH1), содержащей участок, необходимый для связывания легкой цепи. ДНК, кодирующая предназначенные для слияния компоненты тяжелых цепей иммуноглобулинов и, если желательно, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы, и совместно трансфецируют в пригодный организм-хозяина. Это встраивание обеспечивает значительную гибкость при регулировании соотношений трех полипептидных фрагментов друг с другом в вариантах осуществления, где неравные соотношения трех полипептидных цепей в конструкции обеспечивает оптимальный выход продукта. Однако возможным является встраивание двух или всех трех полипептидных цепей в один экспрессирующий вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высокому выходу продукта или если соотношения не имеют особого значения.
В предпочтительном варианте осуществления этого подхода биспецифичные антитела состоят из тяжелой цепи гибридного иммуноглобулина с одной специфичностью в отношении связывания на одном плече, и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обладающей другой специфичностью в отношении связывания) на другом плече. Было обнаружено, что такая ассиметричная структура облегчает разделение требуемого биспецифичного соединения и нежелательных сочетаний цепей иммуноглобулинов, поскольку наличие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает легкий способ разделения. Этот подход описан в WO 94/04690. Для более подробного описания получения биспецифичных антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом, описанным в патенте США №5731168, для максимального увеличения процентного количества гетеродимеров, которые выделяют из рекомбинантных клеточных культур можно сконструировать область контакта между парой молекул антител. Предпочтительная область контакта содержит по меньшей мере часть CH3-домена константного домена антитела. В этом способе, одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). Компенсирующие "полости" идентичного или сходного с крупной боковой цепью(ями) размера создают в области контакта второй молекулы антитела посредством замены крупных боковых цепей аминокислот на цепи меньших размеров (например, аланин или треонин). Это обеспечивает механизм для повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифичные антитела включают в себя поперечно связанные антитела или "гетероконъюгаты" антител. Например, одно из антител в гетероконъюгате может быть соединено с авидином, а другое - с биотином. Такие антитела, например, были предложены для нацеливания клеток иммунной системы против нежелательных клеток (патент США №4676980), и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373, и европейский патент 03089). Гетероконъюгаты антител можно получать с использованием любого пригодного способа поперечного связывания. Пригодные вещества для поперечного связывания хорошо известны в данной области, и описаны в патенте США №4676980, совместно с рядом способов поперечного связывания.
Способы получения биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела можно получать с использованием образования химических связей. В Brennan et al., Science, 229: 81 (1985) описан способ, где полноразмерные антитела протеолитически расщепляют с получением F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии вещества, образующего комплексы с дитиолами, арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярного дисульфида. Затем полученные Fab'-фрагменты превращают в производные с тионитробензоатом (TNB). Одно из производных Fab'-TNB затем повторно превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
Последние достижения упростили прямое выделение из E. coli фрагментов Fab'-SH, которые можно химически соединять с получением биспецифичных антител. В Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описано получение полностью гуманизированной молекулы F(ab')2 биспецифичного антитела. Осуществляли секрецию из E. coli каждого Fab'-фрагмента по отдельности и их подвергали прямому химическому соединению in vitro с образованием биспецифичного антитела. Биспецифичное антитело, полученное таким образом, обладало способностью связываться с клетками, сверхэкспрессирующими рецептор HER2 и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней, представляющих собой рак молочной железы человека. Также были описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из рекомбинантной клеточной культуры. Например, были получены биспецифичные антитела с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии белков Fos и Jun соединяли с Fab'-участками двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области с получением мономеров, а затем повторно окисляли с получением гетеродимеров антител. Этот способ также можно использовать для получения гомодимеров антител. Способ "димеров", описанный Hollinger et al., Proc. Natl. Acad. Sci USA, 90:6444-6448 (1993) обеспечивает альтернативный механизм получения биспецифичных фрагментов антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом (VL) легкой цепи посредством линкера, который является слишком коротким для возможности образования пары между двумя доменами на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены образовывать пару с комплементарными доменами VL и VH другого фрагмента, таким образом, формируя антигенсвязывающие центры. Также описана другая стратегия для получения фрагментов биспецифичных антител с использованием димеров одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol, 152:5368 (1994).
Также рассматривают антитела более чем c двумя валентностями. Например, можно получать триспецифичные антитела. Tutt et al., J. Immunol. 147: 60 (1991).
(vii) Другие модификации аминокислотной последовательности
Также рассматривают модификацию(и) аминокислотной последовательности антител, описанных в настоящей заявке. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антитела получают внесением соответствующих нуклеотидных замен в нуклеиновую кислоту антитела, или посредством синтеза пептидов. Такие модификации включают в себя, например, делеции из остатков, и/или вставки в остатки и/или замещениями остатков аминокислотной последовательности антитела. Для получения конечной конструкции проводят любое сочетание из делеции, вставки и замещения, при условии, что конечная конструкция обладает требуемыми свойствами. Изменения аминокислот также могут приводить к изменению посттрансляционных процессов антитела, такому как изменение количества или положения участков гликозилирования.
Пригодный способ выявления определенных остатков или участков антитела, которые являются предпочтительными участками для мутагенеза, называют "сканирующим аланином мутагенезом" как описано Cunningham and Wells, Science, 244:1081-1085 (1989). В данной работе выявляют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют на нейтральную или отрицательно заряженную аминокислоту (наиболее предпочтительно аланин или полиаланин) для нарушения взаимодействия аминокислот с антигеном. Те положения аминокислот, для которых показывают функциональную чувствительность к замещению, затем подтверждают посредством введения дополнительных или других вариантов в участки замещения, или вместо них. Таким образом, поскольку участок для введения изменения в аминокислотную последовательность является предопределенным, нет необходимости в непосредственной предопределенности характера мутации. Например, для анализа возможности введения мутации в конкретной области, в кодоне-мишени или участке-мишени проводят сканирование ala или случайный мутагенез, и проводят скрининг экспрессированных вариантов антитела на наличие требуемой активности.
Вставки в аминокислотную последовательность включают в себя предназначенные для слияния на N- и/или C-конце остатки, обладающие длиной, находящейся в диапазоне от одного остатка до полипептидов, содержащих сотни или более остатков, а также вставки внутрь последовательности одного или множества аминокислотных остатков. Примеры концевых вставок включают в себя антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие варианты вставок в молекулу антитела включают в себя слияние N- или C-конца антитела с ферментом (например, для ADEPT) или полипептидом, который повышает период полураспада антитела в сыворотке.
Другим типом варианта является вариант с заменой аминокислоты. Такие варианты обладают по меньшей мере одним остатком аминокислоты в молекуле антитела, который заменен другим остатком. Участки, представляющие наибольший интерес для проведения мутагенеза с замещением, включают в себя гипервариабельные области, но также рассматривают изменения FR или Fc участков. Консервативные замены представлены в таблице 1 под заголовком "предпочтительные замены". Если результатом таких замен является изменение биологической активности, тогда можно вносить более значительные изменения, обозначенные в таблице 1 "иллюстративными заменами", или как описано далее в отношении классов аминокислот, и продукты анализировать.
Значительные модификации биологических свойств антитела проводят, выбирая замены, у которых значительно отличается их эффект на поддержание (a) структуры полипептидного остова в области замены, например, такого как конформация в виде слоя или спирали, (b) заряда или гидрофобности молекулы в участке-мишени, или (c) объема боковой цепи. Аминокислоты можно объединить в группы в соответствии со сходством свойств их боковых цепей (в A. L. Lehninger, в Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислые: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His(H)
Альтернативно природные остатки можно разделить на основе общих свойств их боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приводят к обмену члена одного из этих классов на член из другого класса.
Любой остаток цистеина, не вовлеченный в поддержание должной конформации антитела, также можно заменять, главным образом, на серин, для улучшения устойчивости молекулы к окислению и предотвращения ошибочного поперечного сшивания. Напротив, в антитело можно добавлять цистеиновую связь(и) для повышения его стабильности (в частности, в случае, если антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменой включает в себя одну или несколько замен остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант(ы), отобранный для дальнейшей разработки, обладает улучшенными свойствами относительно исходного антитела, из которого он получен. Удобный способ получения таких вариантов с заменами включает в себя созревание аффинности с использованием фагового дисплея. В кратком изложении, в несколько участков гипервариабельной области (например, в 6-7 участков) вносят мутации для получения всех возможных замен аминокислот в каждом участке. Варианты антитела, полученные таким образом, воспроизводят в моновалентной форме в частицах нитевидных фагов в качестве антител, слитых с продуктом гена III M13, упакованных в каждой частице. Затем проводят скрининг вариантов, воспроизведенных посредством фагов, на их биологическую активность (например, аффинность связывания), как описано в настоящей заявке. В целях выявления участков гипервариабельной области, являющихся кандидатами для модификации, можно проводить сканирующий аланином мутагенез для выявления остатков гипервариабельной области, в значительной степени участвующих в связывании антигена. Альтернативно, или дополнительно, может быть целесообразным проведение анализа кристаллической структуры комплекса антиген-антитело для определения участков контакта между антителом и его антигеном. Такие образующие контакт остатки и соседние остатки являются кандидатами для замены в соответствии с представленными в настоящей заявке способами. После получения таких вариантов, панель вариантов подвергают скринингу, как описано в настоящей заявке, и для дальнейшей разработки могут отбирать антитела с наилучшими свойствами в одном или нескольких подходящих анализов.
Другой тип аминокислотного варианта антитела изменяет исходный характер гликозилирования антитела. Под изменением подразумевают удаление одной или нескольких углеводных групп, находящейся на антителе, и/или добавление одного или нескольких участков гликозилирования, которые не присутствуют в антителе.
Гликозилирование антител, как правило, является либо N-связанным или O-связанным. N-связанное относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности, распознаваемые для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, представляющих собой N-ацетилгалактозамин, галактозу или ксилозу, к гидроксиаминокислоте, обычно, к серину или треонину, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Участки гликозилирования в антитело удобно добавлять посредством изменения аминокислотной последовательности таким образом, чтобы она содержала одну или несколько из описанных выше трипептидных последовательностей (в случае участков N-гликозилирования). Также изменение можно осуществлять добавлением одного или нескольких остатков серина или треонина в последовательность исходного антитела, или заменой на один или несколько остатков серина или треонина в последовательности исходного антитела (в случае участков О-гликозилирования).
В случае, если антитело содержит Fc-участок, можно изменять присоединенный к нему углевод. Например, антитела со зрелой углеводной структурой, которая лишена фукозы, присоединенной к Fc-участку антитела, описаны в патентной заявке США №2003/0157108 A1, Presta, L. См. также патент США 2004/0093621 A1 (Kyowa Hakko Kogyo Co., Ltd). Антитела, разделенные N-ацетилглюкозамином (GlcNAc) в углеводе, присоединенном к Fc-участку антитела, рассмотрены в WO 03/011878, Jean-Mairet et al. и в патенте США №6602684, Umana et al. Антитела c по меньшей мере одним остатком галактозы в олигосахариде, присоединенном к Fc-участку антитела, рассмотрены в WO 97/30087, Patel et al. См., также, WO 98/58964 (Raju, S.) и WO 99/22764 (Raju, S.), касающиеся антител с измененным углеводом, присоединенным к их Fc-участку. В настоящей заявке рассматривают композиции антител, содержащие антитело основного типа с такими углеводными структурами, присоединенными к Fc-участку.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела, получают множеством способов, известных в данной области. Эти способы включают в себя, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение посредством олигонуклеотид-направленного (или сайт-направленного) мутагенеза, мутагенеза посредством ПЦР, и кассетного мутагенеза ранее полученного измененного или не измененного варианта антитела.
(viii) Скрининг на антитела с требуемыми свойствами
Способы получения антител описаны выше. При желании, можно дополнительно отбирать антитела с определенными биологическими свойствами.
Для выявления антитела, которое блокирует активацию лиганда рецептора HER, можно определять способность антитела блокировать связывание лиганда HER с клетками, экспрессирующими рецептор HER (например, при конъюгации с другим рецептором HER, с которым представляющий интерес рецептор HER образует гетеро-олигомер HER). Например, клетки, в природе экспрессирующие рецепторы HER гетеро-олигомера HER, или трансфецированные для экспрессии рецепторов HER гетеро-олигомера, HER можно инкубировать с антителом, а затем подвергать воздействию меченного лиганда HER. Затем можно оценивать способность антитела HER2 блокировать связывание лиганда с рецептором HER в гетеро-олигомере HER.
Например, ингибирование антителами против HER2 связывания HRG с клеточными линиями опухоли молочной железы MCF7 можно осуществить с использованием монослойных культур MCF7 на льду в 24-луночном планшете, главным образом, как описано в WO 01/00245. Моноклональные антитела против HER2 можно добавить в каждую лунку и инкубировать в течение 30 минут. Затем можно добавить меченый посредством 125I rHRGβ1177-224 (25 пм), и инкубацию можно проводить в течение от 4 до 16 часов. Для представляющего интерес антитела можно получать кривые доза-эффект и вычислять значение IC50. В одном варианте осуществления антитело, которое блокирует активацию лигандом рецептора HER, обладает IC50 для ингибирования связывания HRG с клетками MCF7 в этом анализе приблизительно 50 нМ или менее, более предпочтительно 10 нМ или менее. В случае, если антитело представляет собой фрагмент антитела, такой как Fab-фрагмент, IC50 для ингибирования связывания HRG с клетками MCF7 в этом анализе может составлять, например, приблизительно 100 нМ или менее, более предпочтительно 50 нМ или менее.
Альтернативно, или дополнительно, можно оценивать способность антитела против HER2 блокировать стимулируемое лигандом HER фосфорилирование тирозина рецептора HER, находящегося в гетеро-олигомере HER. Например, клетки, эндогенно экспрессирующие рецепторы HER или трансфецированные для их экспрессии, можно инкубировать с антителом, а затем оценивать зависимую от лиганда HER активность в отношении фосфорилирования тирозина с использованием моноклональных антител против фосфотирозина (которые необязательно конъюгируют с детектируемой меткой). Анализ активации киназного рецептора, описанный в патенте США №5766863, также пригоден для определения активации рецептора HER и блокирования этой активности антителом.
В одном варианте осуществления можно проводить скрининг для отбора антитела, которое ингибирует стимуляцию посредством HRG фосфорилирования тирозина p180 в клетках MCF7, главным образом, как описано в WO 01/00245. Например, клетки MCF7 можно высевать в 24-луночных планшетах и в каждую лунку можно добавлять моноклональные антитела против HER2 и инкубировать в течение 30 минут при комнатной температуре; затем в каждую лунку можно добавлять rHRGβ1177-244 до конечной концентрации 0,2 нМ, и можно проводить инкубацию в течение 8 минут. Среду можно удалять из каждой лунки, и реакцию можно останавливать добавлением 100 мкл буфера для образцов SDS (5% SDS, 25 мМ DTT и 25 мМ Tris-HCl, pH 6,8). Можно проводить электрофорез каждого образца (25 мкл) в 4-12% градиентном геле (Novex), а затем электрофоретически переносить на мембрану на основе поливинилидендифторида. Можно получить антифосфотирозиновые иммуноблоты (при 1 мкг/мл), и посредством отражательной денситометрии можно количественно определять интенсивность основной дающей реакцию полосы с Mr ~180000. В этом анализе отобранное антитело предпочтительно значительно ингибирует стимуляцию посредством HRG фосфорилирования тирозина p180 до приблизительно 0-35% от контрольного уровня. Можно получать кривую доза-эффект для ингибирования стимуляции посредством HRG фосфорилирования тирозина p180, как определяют отражательной денситометрией, и для представляющего интерес антитела можно вычислять IC50. В одном варианте осуществления, антитело, которое блокирует активацию лигандом рецептора HER, обладает IC50 для ингибирования стимуляции посредством HRG фосфорилирования тирозина p180 в этом анализе приблизительно 50 нМ или менее, более предпочтительно 10 нМ или менее. В случае, где антитело представляет собой фрагмент антитела, такой как Fab-фрагмент, IC50 для ингибирования стимуляции посредством HRG фосфорилирования тирозина p180 в этом анализе, например, может составлять приблизительно 100 нМ или менее, более предпочтительно 50 нМ или менее.
Также можно оценивать эффекты антитела в отношении ингибирования роста на клетки MDA-MB-175, например, главным образом, как описано в Schaefer et al., Oncogene 15:1385-1394 (1997). В соответствии с этим анализом, клетки MDA-MB-175 можно обрабатывать моноклональным антителом против HER2 (10 мкг/мл) в течение 4 суток и окрашивать кристаллическим фиолетовым. Посредством инкубации с антителом против HER2 можно выявить эффект в отношении ингибирования роста на эту клеточную линию, сходный с эффектом, проявляемым моноклональным антителом 2C4. В дополнительном варианте осуществления экзогенный HRG значительно не изменяет в обратном направлении это ингибирование. Предпочтительно, антитело способно ингибировать клеточную пролиферацию клеток MDA-MB-175 в большей степени, чем моноклональное антитело 4D5 (и необязательно в большей степени, чем моноклональное антитело 7F3) как в присутствии, так и в отсутствии экзогенного HRG.
В одном варианте осуществления представляющее интерес антитело против HER2 может блокировать херегулин-зависимую ассоциацию HER2 с HER3 как в клетках MCF7, так и в клетках SK-BR-3, как определяют в эксперименте по коиммунопреципитации, таком как эксперимент, описанный в WO 01/00245, по существу более эффективно, чем моноклональное антитело 4D5, и предпочтительно по существу более эффективно, чем моноклональное антитело 7F3.
Для выявления антител против HER2, ингибирующих рост, можно провести скрининг для отбора антител, которые ингибируют рост клеток злокачественной опухоли, в которой сверхэкспрессирован HER2. В одном варианте осуществления предпочтительное антитело, ингибирующее рост, способно ингибировать рост клеток SK-BR-3 в клеточной культуре на приблизительно 20-100% и предпочтительно на приблизительно 50-100% при концентрации антитела приблизительно от 0,5 до 30 мкг/мл. Для выявления таких антител можно проводить анализ SK-BR-3, описанный в патенте США №5677171. В соответствии с этим анализом, клетки SK-BR-3 выращивают в смеси 1:1 из среды F12 и DMEM с добавлением 10% эмбриональной телячьей сыворотки, глутамина и пенициллин-стрептомицина. Клетки SK-BR-3 выращивают в количестве 20000 клеток в 35-мм чашке для клеточной культуры (2 мл/35-мм чашка). Добавляют от 0,5 до 30 мкг/мл антитела против HER2 на чашку. Через шесть суток количество клеток, в сравнении с необработанными клетками, подсчитывают с использованием электронного устройства для подсчета клеток COULTERTM. Те антитела, которые ингибируют рост клеток SK-BR-3 на приблизительно 20-100% или приблизительно 50-100%, можно отбирать в качестве антител, ингибирующих рост. Для способов анализа для отбора ингибирующих рост антител, таких как 4D5 и 3E8, см. патент США №5677171.
В целях отбора антител против HER2, которые вызывают апоптоз, пригодным является анализ связывания аннексина с использованием клеток BT474. Клетки BT474 культивируют и высевают на чашки, как описано в предыдущем абзаце. Затем среду удаляют и заменяют свежей средой в чистом виде или средой, содержащей 10 мкг/мл моноклонального антитела. Через трое суток периода инкубации, монослои промывают PBS и отделяют посредством обработки трипсином. Затем клетки центрифугируют, ресуспендируют в Ca2+-связывающем буфере и разделяют на аликвоты в пробирки, как описано выше для анализа клеточной смерти. Затем в пробирки добавляют меченый аннексин (например, аннексин V-FTIC) (1 мкг/мл). Образцы можно анализировать с использованием проточного цитометра FACSCANTM и программного обеспечения FACSCONVERTTM CellQuest (Becton Dickinson). Антитела, которые приводят к статистически значимому уровню связывания аннексина относительно контроля, отбирают в качестве индуцирующих апоптоз антител. В дополнение к анализу связывания аннексина пригодным является анализ с окрашиванием ДНК с использованием клеток BT474. Для проведения этого анализа, клетки BT474, обработанные представляющим интерес антителом, как описано в предыдущих двух абзацах, инкубируют с 9 мкг/мл HOECHST 33342TM в течение 2 ч при 37°C, а затем анализируют на проточном цитометре EPICS ELITETM (Coulter Corporation) с использованием программного обеспечения MODFIT LTTM (Verity Software House). Антитела, которые приводят к 2-кратному или более (и предпочтительно 3-кратному или более) изменению процентного количества апоптотических клеток относительно необработанных клеток (вплоть до 100% апоптотических клеток), с использованием этого анализа можно отбирать в качестве проапоптотических антител. Для способов анализа для отбора антител против HER2, которые вызывают апоптоз, таких как 7C2 и 7F3, см. WO 98/17797.
Для отбора антител, которые связываются с эпитопом на HER2, связывающимся с представляющим интерес антителом, можно проводить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow и David Lane (1988), для оценки наличия перекрестного блокирования антителом связывания антитела, такого как 2C4 или пертузумаб, с HER2. Альтернативно, или дополнительно, для выявления домена(ов) HER2, который связывает антитело, можно проводить картирование эпитопов способами, известными в данной области, и/или можно исследовать структуру антитело-HER2 (Franklin et al. Cancer Cell 5:317-328 (2004)).
(ix) Иммуноконъюгаты
Это изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, низкомолекулярный токсин или фарментативно-активный токсин бактерий, грибов, растений или животных, в том числе их фрагменты и/или варианты), или с радиоактивным изотопом (т.е. радиоконъюгат).
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше. Также здесь рассматривают конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихимицин, майтанзин (патент США №5208020), трихотен и CC1065.
В одном предпочтительном варианте осуществления этого изобретения, антитело конъюгируют с одной или несколькими молекулами майтанзина (например, приблизительно от 1 до приблизительно 10 молекул майтанзина на молекулу антитела). Майтанзин, например, можно превращать в May-SS-Me, который можно восстанавливать до May-SH3, и проводить реакцию с модифицированным антителом (Chari et al. Cancer Research 52: 127-131 (1992)) с получением иммуноконъюгата мантанзиноид-антитело.
Другой представляющий интерес иммуноконъюгат содержит антитело против HER2, конъюгированное с одной или несколькими молекулами калихимицина. Антибиотики из семейства калихимицина способны осуществлять двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Структурные аналоги калихимицина, которые можно использовать, включают в себя, но не ограничиваются ими, γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θ1 I (Hinman et al. Cancer Research 53:3336-3342 (1993) и Lode et al. Cancer Research 58:2925-2928 (1998)). См., также патенты США №№5714586; 5712374; 5264586 и 5773001, включенные в настоящее описание в качестве ссылок в полном объеме.
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, несвязывющие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки-диантаны, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованный 28 октября, 1993.
Кроме того, настоящее изобретение относится к иммуноконъюгату, образованному антителом и соединением, обладающим активностью в отношении расщепления нуклеиновых кислот (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для получения радиоконъюгированных антител против HER2 пригодными являются множество радиоактивных изотопов. Примеры включают в себя At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu.
Конъюгаты антитела и цитотоксического средства можно получать с использованием множество бифункциональных связывающих белки веществ, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола), и вторичные активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al. Science 238: 1098 (1987). Меченая углеродом 14 1-изотиоцианатбензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", который облегчает высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать неустойчивый к действию кислот линкер, чувствительный к пептидазам линкер, диметиловый линкер или содержащий дисульфид линкер (Chari et al. Cancer Research 52:127-131 (1992)).
Альтернативно можно получать слитый белок, содержащий антитело против HER2 и цитотоксическое средство, например, посредством рекомбинантных способов или пептидного синтеза.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном направлении в опухоль, где конъюгат антитело-рецептор вводят пациенту с последующим удалением из циркуляции не связавшегося конъюгата с использованием вещества для удаления, а затем введением "лиганда" (например, авидина), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
(x) Другие модификации антител
Здесь рассматривают другие модификации антитела. Например, антитело можно соединять с одним из множества небелковых полимеров, например, с полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами, или сополимерами полиэтиленгликоля и полипропиленгликоля. Также антитело можно заключать внутрь микрокапсул, полученных, например, способами коацервации или межфазной полимеризации (например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе поли(метилметацилата), соответственно), в коллоидные системы доставки лекарственного средства (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы), или в микроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Может быть желательной модификация антитела по этому изобретению в отношении эффекторной функции, например, чтобы повысить антигензависимую клеточно-опосредуемую цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC) антитела. Этого можно достичь внесением одной или нескольких аминокислотных замен в Fc-участке антитела. Альтернативно, или дополнительно, в Fc-участок можно вводить остаток(и) цистеина, обеспечивая, таким образом, формирование дисульфидной связи между цепями в этом участке. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью в отношении интернализации и/или повышенным комплементзависимым уничтожением клеток и повышенной антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp Med. 176:1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также можно получать с использованием гетеробифункциональных поперечных линкеров, как описано в Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно можно сконструировать антитело, которое обладает дублированными Fc-участками и, таким образом, может обладать повышенной способностью в отношении лизиса комплементом и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
В WO 00/42072 (Presta, L.) описаны антитела с улучшенной функцией ADCC в присутствии эффекторных клеток человека, где антитела содержат аминокислотные замены в своей Fc-области. Предпочтительно, антитело с улучшенной ADCC содержит замены в положениях 298, 333 и/или 334 Fc-области. Предпочтительно измененная Fc-область представляет собой Fc-область IgG1 человека, содержащую замены или состоящую из замен в одном двух или трех из этих положений.
Антитела с измененным связыванием C1q и/или комплементзависимой цитотоксичностью (CDC) описаны в WO 99/51642, патенте США №6194551B1, патенте США №6242195B1, патенте США №6528624B1 и патенте США №6538124 (Idusogie et al.). Антитела содержат аминокислотные замены в одном или нескольких из аминокислотных положений 270, 322, 326, 327, 329, 313, 333 и/или 334 своей Fc-области.
Для повышения периода полураспада антитела в сыворотке, можно встраивать в антитело (особенно в фрагмент антитела) связывающий рецептор спасения эпитоп, как описано, например, в патенте США 5739277. Здесь термин "связывающий рецептор спасения эпитоп" относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за повышение периода полураспада в сыворотке молекулы IgG in vivo. Антитела с заменами в своем Fc-участке и повышенным периодом полураспада в сыворотке также описаны в WO 00/42072 (Presta, L.).
Также рассматривают сконструированные антитела с тремя или более (предпочтительно с четырьмя) функциональными антигенсвязывающими участками (патентная заявка США №US2002/0004587 A1, Miller et al.).
Антитела против HER2, описанные в настоящей заявке, также можно получать в качестве иммунолипосом. Липосомы, содержащие антитело, получают известными в данной области способами, такими как описаны в Epstein et al, Proc. Natl. Acad. Sci USA, 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci USA, 77:4030 (1980); патентах США №№4485045 и 4544545; и WO 97/38731, опубликованном 23 октября, 1997. Липосомы с увеличенным периодом циркуляции описаны в патенте США №5013556.
Особенно пригодные липосомы можно получать способом обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и производное фосфатидилэтаноламина с PEG (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом с требуемым диаметром. Fab'-фрагменты антитела по настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al. J. Biol. Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. В липосоме необязательно содержится химиотерапевтическое средство. См. Gabizon et al. J. National Cancer Inst.81(19)1484 (1989).
(ix) Иллюстративные антитела
Иллюстративные антитела, которые можно составлять в соответствии с настоящим изобретением, включают в себя, но не ограничиваются ими следующие:
антитела против ErbB, в том числе антитела против HER2, такие как антитела, более подробно описанные в настоящей заявке;
антитела, которые связываются с B-клеточным поверхностным маркером, таким как CD19, CD20 (например, ритуксимаб (RITUXAN®) и гуманизированные 2H7), CD22, CD40 или BR3;
антитела, которые связываются с IgE, в том числе омализумаб (XOLAIR®), коммерчески доступный в Genentech, E26 (фиг. 17A-B настоящей заявки), HAE1 (фиг. 17A-B настоящей заявки), антитело против IgE c аминокислотной заменой в положении 265 в его Fc-участке (патент США №2004/0191244 A1), Hu-901 (фиг. 17A-B настоящей заявки), антитело против IgE, как в WO 2004/070011, или антитело (в том числе фрагменты антител и полноразмерные антитела), содержащее вариабельные домены любого из этих антител против IgE. См., также, Presta et al., J. Immunol. 151:2623-2632 (1993); международную публикацию №WO 95/19181; патент США №5714338, выданный 3 февраля, 1998; патент США №5091313, выданный 25 февраля, 1992; WO 93/04173, опубликованный 4 марта, 1993; WO 99/01556, опубликованный 14 января, 1999; и патент США №5714338;
антитела, которые связываются с сосудисто-эндотелиальным фактором роста (VEGF) или с его рецептором, в том числе бевацизумаб (AVASTINTM), коммерчески доступный в Genentech, и ранибизумаб (LUCENTISTM);
антитела против IL-8 (St John et al, Chest, 103:932 (1993), и международная публикация №WO 95/23865);
антитела против PSCA (WO 01/40309);
антитела против CD40, в том числе S2C6 и их гуманизированные варианты (WO 00/75348);
антитела против CD11a, в том числе эфализумаб (RAPTIVA®) (патент США №5622700, WO 98/23761, Steppe et al., Transplant Intl. 4:3-7 (1991), и Hourmant et al., Transplantation 58:377-380 (1994)); антитела против CD18 (патент США №5622700, выданный 22 апреля, 1997, или как в WO 97/26912, опубликованном 31 июля, 1997);
антитело против рецептора Apo-2 (WO 98/51793, опубликованный 19 ноября 1998);
антитела против TNF-альфа, в том числе cA2 (REMICADE®), CDP571 и MAK-195 (см., патент США №5672347, выданный 30 сентября, 1997, Lorenz et al. J. Immunol. 156(4):1646-1653 (1996), и Dhainaut et al. Crit. Care Med. 23(9):1461-1469 (1995));
антитела против тканевого фактора (TF) (европейский патент №0 420 937 B1, выданный 9 ноября, 1994);
антитела против интегрина α4β7 человека (WO 98/06248, опубликованный 19 февраля, 1998);
антитела против EGFR, в том числе химерное или гуманизированное антитело 225, как в WO 96/40210, опубликованном 19 декабря, 1996;
антитела против CD3, такие как OKT3 (патент США №4515893, выданный 7 мая, 1985);
антитела против CD25 или tac, такие как CHI-621 (SIMULECT®) и (ZENAPAX®) (см. патент США №5693762, выданный 2 декабря, 1997);
антитела против CD4, такие как антитело cM-7412 (Choy et al. Arthritis Rheum 39(1):52-56 (1996));
антитела против CD52, такие как КАМПАТ-1H (Riechmann et al. Nature 332:323-337 (1988);
антитела против Fc-рецептора, такие как антитело M22, направленное против FcγRI как в Graziano et al. J. Immunol. 155(10):4996-5002 (1995);
антитела против эмбрионального опухолевого антигена (CEA), такие как hMN-14 (Sharkey et al. Cancer Res. 55(23 Suppl):5935s-5945s (1995);
антитела, направленные против эпителиальных клеток молочной железы, в том числе huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al. Cancer Res. 55(23):5852s-5856s (1995); и Richman et al. Cancer Res. 55(23 Supp):5916s-5920s (1995));
антитела, которые связываются с клетками карциномы толстого кишечника, такие как C242 (Litton et al. Eur J. Immunol. 26(1):1-9 (1996));
антитела против CD38, например, AT 13/5 (Ellis et al. J. Immunol. 155(2):925-937 (1995));
антитела против CD33, такие как Hu M195 (Jurcic et al. Cancer Res 55(23 Suppl):5908s-5910s (1995) и CMA-676 или CDP771;
антитела против CD22, такие как LL2 или LymphoCide (Juweid et al. Cancer Res 55(23 Suppl):5899s-5907s (1995);
антитела против EpCAM, такие как 17-1A (PANOREX®);
антитела против GpIIb/IIIa, такие как абциксимаб или c7E3 Fab (REOPRO®);
антитела против RSV, такие как MEDI-493 (SYNAGIS®);
антитела против CMV, такие как PROTOVIR®;
антитела против HIV, такие как PRO542;
антитела против гепатита, такие как антитело против Hep B OSTAVIR®;
антитело против CA 125 OvaRex;
антиидиотипическое антитело BEC2 против эпитопа GD3;
антитело против αvβ3 VITAXIN®;
антитело против почечноклеточного рака человека, такое как ch-G250; ING-1;
антитело против 17-1A человека (3622W94);
антитело против колоректальной опухоли человека (A33);
антитело R24 против меланомы человека, направленное против ганглиозида GD3;
антитела против плоскоклеточной карциномы человека (SF-25); и
антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10 и антитело против HLA DR Oncolym (Lym-1).
(xi) Композиции вариантов антител
Настоящее изобретение, по меньшей мере в одном аспекте, относится к композициям, содержащим композицию, которая содержит смесь антитела основного типа и одного или нескольких его вариантов. В случае, если антитело основного типа связывает HER2, предпочтительно антитело против HER2 (как любое, так и оба вместе из антитела против HER2 основного типа и его варианта) представляет собой антитело, которое связывается с доменом II HER2, ингибирует димеризацию HER более эффективно, чем трастузумаб, и/или связывается с гетеродимерным участком связывания HER2. В рамках настоящей заявки предпочтительным вариантом осуществления антитела основного типа является антитело, содержащее вариабельные аминокислотные последовательности легких и тяжелых цепей SEQ ID No. 3 и 4, и наиболее предпочтительно, содержащие аминокислотную последовательность легкой цепи, выбранную из SEQ ID No. 15 и 23, и аминокислотную последовательность тяжелой цепи, выбранную из SEQ ID No. 16 и 24.
В одном варианте осуществления составленная композиция антитела против HER2 содержит смесь антитела против HER2 основного типа и вариант его аминокислотной последовательности, содержащий N-концевое лидерное удлинение. Предпочтительно N-концевое лидерное удлинение находится на легкой цепи варианта антитела (например, на одной или двух легких цепях варианта антитела). Антитело против HER2 основного типа или вариант антитела может представлять собой полноразмерное антитело или фрагмент антитела (например, Fab- или F(ab')2-фрагменты), однако предпочтительно оба из них представляют собой полноразмерные антитела. В рамках настоящей заявки вариант антитела может содержать N-концевое лидерное удлинение на любой одной или нескольких из его тяжелых или легких цепей. Предпочтительно N-концевое лидерное удлинение находится на одной или двух легких цепях антитела. N-концевое лидерное удлинение предпочтительно содержит, или состоит из, VHS-. Наличие N-концевого лидерного удлинения в композиции можно определять различными аналитическими способами, включая, но не ограничиваясь ими, анализ N-концевой последовательности, анализ на гетерогенность заряда (например, катионообменную хроматографию или капиллярный зонный электрофорез), масс-спектрометрию, и т.д. Количество варианта антитела в композиции, как правило, находится в диапазоне от количества, которое составляет предел определения какого-либо анализа (предпочтительно анализ N-концевой последовательности), используемого для детекции варианта, до количества, которое меньше количества антитела основного типа. Как правило, приблизительно 20% или менее (например, приблизительно от 1% до приблизительно 15%, например, от 5% до приблизительно 15%) молекул антитела в композиции содержат N-концевое лидерное удлинение. Такие процентные количества предпочтительно определяют с использованием количественного анализа N-концевой последовательности или катионообменного анализа (предпочтительно с использованием колонок со слабыми катионообменными свойствами с высоким разрешением, таких как катионообменная колонка PROPAC WCX-10TM). Также помимо варианта с N-концевым лидерным удлинением, рассматривают дополнительные изменения аминокислотной последовательности антитела основного типа и/или варианта, включая, но не ограничиваясь ими, антитело, содержащее C-концевой остаток лизина на его одной или обеих тяжелых цепях, дазамидированный вариант антитела, и т.д.
Более того, антитело основного типа или вариант может дополнительно содержать изменения в отношении гликозилирования, неограничивающие примеры которых включают в себя антитело против HER2, содержащее олигосахаридную структуру G1 или G2, присоединенную к его Fc-участку, антитело против HER2, содержащее углеводную группу, присоединенную к его легкой цепи (например, одну или две углеводных группы, присоединенных к одной или двум легким цепям антитела), антитело против HER2, содержащее негликозилированную тяжелую цепь.
III. Получение композиции
Настоящее изобретение относится, в первом аспекте, к стабильной фармацевтической композиции, содержащей моноклональное антитело, предпочтительно полноразмерное антитело IgG1 человека или гуманизированное антитело IgG1, в гистидин-ацетатном буфере с pH от 5,5 до 6,5, предпочтительно с pH от 5,8 до 6,2. Однако антитело в композиции может представлять собой фрагмент антитела, содержащий антигенсвязывающий участок, такой как Fab- или F(ab')2-фрагмент.
В другом варианте осуществления это изобретение относится к фармацевтической композиции, содержащей полноразмерное антитело IgG1, подверженное дезамидированию или агрегации, в количестве приблизительно от 10 мг/мл до приблизительно 250 мг/мл; гистидин-ацетатный буфер, pH от 5,5 до 6,5; сахарид, выбранный из группы, состоящей из трегалозы и сахарозы, в количестве приблизительно от 60 мМ до приблизительно 250 мМ; и полисорбат-20 в количестве приблизительно от 0,01% до приблизительно 0,1%, или по существу состоящему из них.
В другом варианте осуществления это изобретение относится к фармацевтической композиции, содержащей антитело, которое связывается с доменом II HER2 в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид и поверхностно-активное вещество. Например, композиция может содержать пертузумаб в количестве приблизительно от 20 мг/мл до приблизительно 40 мг/мл, гистидин-ацетатный буфер, сахарозу и полисорбат-20, где значение pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
В другом аспекте это изобретение относится к фармацевтической композиции, содержащей антитело против DR5 в гистидиновом буфере с pH приблизительно от 5,5 до приблизительно 6,5, сахарид, и поверхностно-активное вещество. Такая композиция, например, может содержать апомаб в количестве приблизительно от 10 мг/мл до приблизительно 30 мг/мл, гистидин-ацетатный буфер, трегалозу и полисорбат-20, где значение pH композиции составляет приблизительно от 5,5 до приблизительно 6,5.
Композиция является особенно пригодной в случае антител, подверженных дезамидированию, и/или агрегации, и/или фрагментации, так как буфер замедляет дезамидирование, и/или агрегацию, и/или фрагментацию антитела, составленного в этой композиции. Кроме того, в отличие от других гистидиновых буферов, получаемых с использованием HCl, в гистидин-ацетатном буфере отсутствуют ионы хлорида, что, как было обнаружено, является преимущественным в рамках настоящей заявки, поскольку этот буфер при объединении с сахаридом оказывал такой же эффект на антитело, что и полисорбат-20, и был стабильным и совместимым с хранением в емкостях из нержавеющей стали. Таким образом, в дополнение к самой композиции, содержащей антитело, подверженное дезамидированию, агрегации и/или фрагментации, это изобретение относится к способу снижения дезамидирования, агрегации и/или фрагментации терапевтического моноклонального антитела (например, по сравнению с композицией, находящейся при другом значении pH или в другом буфере), включающему в себя составление антитела в гистидин-ацетатном буфере, pH от 5,5 до 6,5. В этом варианте осуществления, для составленного антитела, демонстрирующего приемлемое дезамидирование, агрегацию и/или фрагментацию в композиции и при его хранении, можно определять или измерять дезамидирование, агрегацию и/или фрагментацию до и после составления антитела.
Антитело в композиции может связывать антиген, включая, но не ограничиваясь ими: HER2, CD20, IgE, DR5, BR3 и VEGF.
В случае, если составленное антитело связывает HER2, предпочтительным является антитело, которое связывается с доменом II HER2, ингибирует димеризацию HER более эффективно, чем трастузумаб, и/или связывается с гетеродимерным участком связывания HER2. В рамках настоящего описания предпочтительным вариантом осуществления составленного антитела против HER2 является антитело, содержащие вариабельные аминокислотные последовательности легкой и тяжелой цепей в SEQ ID No. 3 и 4, и наиболее предпочтительно содержащие аминокислотные последовательности легкой цепи и тяжелой цепи в SEQ ID No. 15 и 16 (пертузумаб).
Здесь примеры антитела против CD20, которые могут быть включены в композицию, включают в себя: "C2B8", который в настоящее время называют "ритуксимабом" ("RITUXAN®"), коммерчески доступным в Genentech (см. также патент США №5736137, включенный в настоящее описание в качестве ссылки в полном объеме); меченое иттрием-[90] антитело 2B8 мыши, называемое "Y2B8" или "ибритумомабом тиуксетаном", ZEVALIN®, коммерчески доступным в Biogen-Idec (см. также патент США №5736137, включенный в настоящее описание в качестве ссылки в полном объеме); IgG2a "B1" мыши, также называемое "тозитумомабом", необязательно меченое 131I с получением антитела "131I-B1" (иод I131 тозитумомаб, BEXXARTM) (патент США №5595721, включенный в настоящее описание в качестве ссылки в полном объеме); моноклональное антитело "1F5" мыши (Press et al. Blood 69(2):584-591 (1987) и его варианты, в том числе 1F5 "с состоящим из кусков каркасом" или гуманизированное 1F5 (WO 03/002607, Leung, S.); номер ATCC HB-96450); антитело 2H7 мыши и химерное антитело 2H7 (Clark et al. PNAS 82:1766-1770 (1985); патент США №5500362, включенный в настоящее описание в качестве ссылки в полном объеме); гуманизированное 2H7; huMax-CD20 (WO 04/035607, Genmab, Denmark); AME-133 (Applied Molecular Evolution); антитело A20 или его варианты, такие как химерное или гуманизированное антитело A20 (cA20, hA20, соответственно) (патент США №2003/0219433, Immunomedics); и моноклональные антитела L27, G28-2, 93-1B3, B-C1 или NU-B2, доступные в International Leukocyte Typing Workshop (Valentine et al., In: Leukocyte Typing III (McMichael, Ed., p. 440, Oxford University Press (1987)).
В предпочтительном варианте осуществления составленного антитела против CD20, антитело против CD20 представляет собой гуманизированное антитело 2H7. Здесь предпочтительными гуманизированными антителами 2H7 являются 2H7v16 и 2H7v511. Гуманизированное 2H7v16 может представлять собой целое антитело или фрагмент антитела, содержащий вариабельные последовательности легкой и тяжелой цепей, представленные на фиг. 18A-B (SEQ ID No. 26 и 29). В случае, когда гуманизированное антитело 2H7v16 представляет собой полноразмерное антитело, оно предпочтительно содержит аминокислотные последовательности легкой и тяжелой цепей с SEQ ID No. 63 и 65.
В случае, когда антитело связывает VEGF, оно предпочтительно содержит последовательности вариабельных доменов, представленные на фиг. 19. Наиболее предпочтительным антителом против VEGF является полноразмерное гуманизированное антитело IgG1, бевацизумаб (AVASTINTM), коммерчески доступный в Genentech.
В случае, когда составленное антитело связывает IgE, его предпочтительно выбирают из группы, состоящей из: E25, омализумаба (XOLAIR®), коммерчески доступного в Genentech (см. также фиг. 17A-B), E26 (фиг. 17A-B настоящей заявки), HAE1 (фиг. 17A-B настоящей заявки), антитела против IgE с аминокислотной заменой в положении 265 его Fc-области (патент США №2004/0191244 A1), Hu-901 (фиг. 17A-B настоящей заявки), антитела против IgE, как в WO 2004/070011, или антитела (в том числе фрагментов антител и полноразмерных антител), содержащего вариабельные домены любого из этих антител против IgE.
В случае, если антитело связывается с рецептором из суперсемейства фактора некроза опухолей (TNF) или с рецептором смерти, оно предпочтительно связывается с DR5, и предпочтительно оно представляет собой антитело-агонист. Публикации в данной области включают в себя Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO 98/51793, опубликованный 19 ноября, 1998; WO 98/41629, опубликованный 24 сентября, 1998; Screaton et al., Curr. Biol, 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа, 1998; европейский патент 870827, опубликованный 14 октября, 1998; WO 98/46643, опубликованный 22 октября, 1998; WO 99/02653, опубликованный 21 января, 1999; WO 99/09165, опубликованный 25 февраля, 1999; WO 99/11791, опубликованный 11 марта, 1999; патент США 2002/0072091, опубликованный 13 августа, 2002; патент США 2002/0098550, опубликованный 7 декабря, 2001; патент США 6313269, выданный 6 декабря, 2001; патент США 2001/0010924, опубликованный 2 августа, 2001; патент США 2003/01255540, опубликованный 3 июля, 2003; патент США 2002/0160446, опубликованный 31 октября, 2002, патент США 2002/0048785, опубликованный 25 апреля, 2002; патент США 6342369, выданный в феврале 2002 года; патент США 6569642, выданный 27 мая, 2003, патент США 6072047, выданный 6 июня, 2000, патент США 6642358, выданный 4 ноября, 2003; патент США 6743625, выданный 1 июня, 2004. Наиболее предпочтительным антителом против DR5 является апомаб.
Каждая из упомянутых выше композиций содержит буфер, предпочтительно гистидиновый буфер и наиболее предпочтительно гистидин-ацетатный буфер со значением pH от 5,5 до 6,5, предпочтительно от 5,8 до 6,2, например, приблизительно 6,0. Концентрация буфера обусловлена, по меньшей мере отчасти, требуемым значением pH. Иллюстративные концентрации буфера находятся в диапазоне приблизительно от 1 мМ до приблизительно 200 мМ, предпочтительно приблизительно от 10 мМ до приблизительно 40 мМ, наиболее предпочтительно приблизительно 20 мМ.
Концентрация антитела в композиции предпочтительно находится в диапазоне приблизительно от 10 мг/мл до приблизительно 250 мг/мл. Концентрацию антитела можно определить, исходя из предполагаемого применения и способа введения композиции. Например, если композиция предназначена для введения IV (например, антитело HER2), концентрация антитела в композиции составляет предпочтительно приблизительно от 20 мг/мл до приблизительно 40 мг/мл. В иллюстративной композиции пертузумаба, предназначенной для внутривенного (IV) введения, концентрация антитела составляла приблизительно от 20 мг/мл до приблизительно 40 мг/мл, наиболее предпочтительно приблизительно 30 мг/мл.
Если антитело предназначено для введения п/к или в/м (например, антитело против IgE) могут быть желательными более высокие концентрации антитела. Такие по существу высокие концентрации антитела могут составлять приблизительно от 50 мг/мл до приблизительно 250 мг/мл, или приблизительно от 80 мг/мл до приблизительно 250 мг/мл, или приблизительно от 100 мг/мл до приблизительно 200 мг/мл.
Если композиция содержит антитело против DR5, такое как апомаб, иллюстративные концентрации антитела составляют приблизительно от 10 мг/мл до приблизительно 30 мг/мл, например, приблизительно 20 мг/мл антитела против DR5; где такие композиции являются пригодными для внутривенного введения.
Композиции для введения предпочтительно представляют собой водные композиции (не лиофилизированные) и их ранее не подвергали лиофилизации. Несмотря на то, что композиция может быть лиофилизированной, предпочтительно она не является лиофилизированной. Однако, в частности, здесь рассматривают замораживание водной композиции без одновременного высушивания, которое происходит в процессе лиофилизации, что способствует более длительному периоду его хранения, например, в емкости из нержавеющей стали.
Композиция предпочтительно дополнительно содержит сахарид, наиболее предпочтительно дисахарид, такой как трегалоза или сахароза. Сахарид, как правило, добавляют в количестве, которое снижает формирование растворимых агрегатов, таких как агрегаты, которые возникают при замораживании/размораживании. Иллюстративные концентрации сахарида находятся в диапазоне приблизительно от 10 мМ до приблизительно 1 М, например, приблизительно от 60 мМ до приблизительно 250 мМ, и наиболее предпочтительно, приблизительно 120 мМ для композиции антитела против HER2, и приблизительно 240 мМ для композиции антитела против DR5.
Несмотря на то, что здесь было обнаружено, что композиция, содержащая гистидин-ацетатный буфер и сахарид, является стабильной, композиция необязательно дополнительно содержит поверхностно-активное вещество, такое как полисорбат, наиболее предпочтительно полисорбат-20. Поверхностно-активное вещество, как правило, добавляют в количестве, которое снижает образование нерастворимых агрегатов (таких как агрегаты, которые возникают при встряхивании или транспортировке). Концентрация поверхностно-активного вещества предпочтительно составляет приблизительно от 0,0001% до приблизительно 1,0%, наиболее предпочтительно приблизительно от 0,01% до приблизительно 0,1%, например, приблизительно 0,02%.
Необязательно, композиция не содержит изменяющего тоничность количества соли, такой как хлорид натрия.
Композиция, как правило, является стерильной, и этого можно достигать в соответствии с известными специалисту способами получения стерильных фармацевтических композиций, пригодных для введения субъекту-человеку, в том числе фильтрование через стерильные фильтрационные мембраны до или после изготовления композиции.
Более того, композиция желательно представляет собой композицию, для которой было показано, что она является стабильной при хранении. Для подтверждения стабильности композиции квалифицированному специалисту доступны различные способы анализа стабильности. Например, композиция может представлять собой композицию, для которой было выявлено, что она является стабильной при хранении: при приблизительно 40°C в течение по меньшей мере 4 недель; при приблизительно 5°C или приблизительно 15°C в течение по меньшей мере 3 месяцев или по меньшей мере 1 года; и/или при приблизительно -20°C в течение по меньшей мере 3 месяцев. Стабильность можно анализировать посредством оценки физической стабильности, химической стабильности и/или биологической активности антитела в композиции во время составления, а также после хранения при указанных температурах. Физическую и/или химическую стабильность можно оценивать качественно и/или количественно множеством различных способов, в том числе оценкой образования агрегатов (например, с использованием гель-фильтрации, посредством измерения мутности, и/или визуальным исследованием); оценкой гетерогенности заряда с использованием катионообменной хроматографии или капиллярного зонного электрофореза; анализом N-концевой или C-концевой последовательности; масс-спектроскопическим анализом; анализом SDS-PAGE для сравнения уменьшенного и целого антитела; анализом пептидных карт (например, триптических или LYS-C); оценкой биологической активности или антигенсвязывающей функции антитела; и т.д. Нестабильность может приводить к агрегации, дезамидированию (например, дезамидированию Asn), окислению (например, окислению Met), изомеризации (например, изомеризации Asp), расщеплению/гидролизу/фрагментации (например, фрагментации шарнирной области), образованию сукцинимида, неспаренному цистеину(ам), N-концевому удлинению, C-концевому процессингу, изменению гликозилирования, и т.д. Биологическую активность или антигенсвязывающую функцию можно оценивать с использованием различных способов, доступных квалифицированному специалисту.
Как указано выше, здесь, конкретно рассматривают замораживание композиции. Таким образом, можно провести тестирование на стабильность при замораживании и размораживании.
Таким образом, это изобретение также относится к способу получения фармацевтической композиции, включающему в себя получение композиции, как описано в настоящей заявке, и оценку физической стабильности, химической стабильности или биологической активности моноклонального антитела в композиции.
В предпочтительном варианте осуществления композиция представлена внутри флакона с пробкой, поддающейся прокалыванию шприцем, предпочтительно в водной форме. Желательно, чтобы флакон хранили при приблизительно 2-8°C до момента введения субъекту, нуждающемуся в нем. Флакон, например, может представлять собой флакон объемом 20 см3 (например, для дозы 420 мг) или флакон объемом 50 см3 (например, для дозы 1050 мг). В случае антитела против DR5, такого как апомаб, композиция может быть предоставлена в стеклянном флаконе объемом 5 см3 (например, заполненном 5,5 мл).
В другом варианте осуществления композиция представлена внутри емкости из нержавеющей стали. Композиция в емкости из нержавеющей стали является необязательно замороженной и не лиофилизированной.
В композицию можно включать один или несколько других фармацевтически приемлемых носителей, эксципиентов или стабилизаторов, таких как описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), при условии, что они не влияют отрицательно на желательные свойства композиции. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают в себя: дополнительные буферные средства; дополнительные растворители; антиоксиданты, в том числе аскорбиновую кислоту и метионин; хелатирующие агенты, такие как ЭДТА; комплексные соединения металлов (например, комплексы Zn-белок); биологически деградируемые полимеры, такие как полиэфиры; консерванты; и/или солеобразующие противоионы, такие как натрий.
IV. Лечение композицией антитела
В одном варианте осуществления это изобретение относится к способу лечения заболевания или нарушения у субъекта, включающему в себя введение субъекту композиции, описанной в настоящей заявке, в количестве, эффективном для лечения заболевания или нарушения.
В случае, если антитело в композиции связывается с HER2, его предпочтительно используют для лечения злокачественной опухоли. Злокачественная опухоль, как правило, содержит экспрессирующие HER2 клетки, так что антитело против HER2 по настоящему описанию способно связываться со злокачественными клетками. Таким образом, это изобретение в этом варианте осуществления относится к способу лечения у субъекта злокачественных опухолей, экспрессирующих HER2, включающему в себя введение субъекту фармацевтической композиции на основе антитела HER2 в количестве, эффективном для лечения злокачественной опухоли. Различные злокачественные опухоли, которые можно лечить с помощью композиции, перечислены выше в разделе с определениями.
Также предполагается, что композицию антитела против HER2 можно применять для лечения различных незлокачественых заболеваний или нарушений, которые включают в себя аутоиммунное заболевание (например, псориаз); эндометриоз; склеродермию; рестеноз; полипы, такие как полипы толстого кишечника, полипы носовой полости или желудочно-кишечные полипы; фиброаденому; респираторное заболевание (см. определение выше); холецистит; нейрофиброматоз; поликистоз почек; воспалительные заболевания; кожные нарушения, включая псориаз и дерматит; сосудистое заболевание (см. определение выше); состояния, в которые вовлечена аномальная пролиферация эпителиальных клеток сосудов; желудочно-кишечные язвы; болезнь Менетрие, секретирующие аденомы или синдром потери белка; почечные нарушения; ангиогенные нарушения; заболевание глаз, такое как возрастная дегенерация желтого пятна, синдром предполагаемого гистоплазмоза глаз, неоваскуляризацию сетчатки вследствие пролиферативной диабетической ретинопатии, васкуляризацию сетчатки, диабетическую ретинопатию, или возрастную дегенерацию желтого пятна; ассоциированные с костями патологии, такие как остеоартрит, рахит и остеопороз; повреждения после приступа ишемии головного мозга; фиброзные или отечные заболевания, такие как цирроз печени, фиброз легких, саркоидоз, тиреоидит, синдром повышенной вязкости крови, системная болезнь Ослера-Вебера-Рендю, хроническое обтурирующее заболевание легких или отек вследствие ожогов, травмы, облучения, инсульта, гипоксии или ишемии; реакцию гиперчувствительности кожи; диабетическую ретинопатию и диабетическую нефропатию; синдром Гийена-Барре; реакцию "трансплантат против хозяина" или отторжение трансплантата; болезнь Педжета; воспаление кости или сустава; старение кожи от воздействия ультрафиолетовых лучей (например, вызванное УФ-облучением кожи человека); доброкачественную гипертрофию предстательной железы; определенные микробные инфекции, включая микробные патогены, выбранные из аденовируса, хантавирусов, Borrelia burgdorferi, Yersinia spp. и Bordetella pertussis; тромбы, вызванные агрегацией тромбоцитов; состояния, связанные с половой системой, такие как эндометриоз, синдром гиперстимуляции яичников, преэклампсию, дисфункциональное маточное кровотечение или менометроррагия; синовит; атерому; острую и хроническую нефропатии (в том числе пролиферативный гломерулонефрит и индуцируемое диабетом заболевание почек); экзему; формирование гипертрофических рубцов; эндотоксиновый шок и грибковую инфекцию; семейный аденоматоз толстой кишки; нейродегенеративные заболевания (например, болезнь Альцгеймера, обусловленную СПИДом деменцию, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, спинальную мышечную атрофию и мозжечковую дегенерацию); миелодиспластические синдромы; апластическую анемию; ишемическое повреждение; фиброз легких, почек или печени; состояние гиперчувствительности, опосредуемое T-клетками; детский гипертрофический пилоростеноз; обструктивный синдром мочевой системы; псориатический артрит; и тиреоидит Хашимото. В рамках настоящей заявки предпочтительные незлокачественные показания для лечения включают в себя псориаз, эндометриоз, склеродермию, сосудистое заболевание (например, рестеноз, атеросклероз, болезнь коронарных артерий или гипертензию), полипы толстого кишечника, фиброаденому или респираторное заболевание (например, астму, хронический бронхит, бронхоэктаз или кистозный фиброз).
В случае, если антитело в композиции связывается с B-клеточным поверхностным маркером, таким как CD20 или BR3, композицию можно применять для лечения B-клеточной злокачественной опухоли, такой как NHL или CLL, аутоиммунного заболевания, отторжения трансплантата, или для блокирования иммунного ответа на чужеродный антиген, такой как антитело, токсин, вирусный вектор, предназначенный для генной терапии, трансплантат, возбудитель инфекции или аллоантиген (см. WO 01/03734, Grillo-Lopez et al.).
В случае, если антитело в композиции представляет собой антитело против IgE, его можно применять для лечения опосредуемого IgE нарушения (USSN 2004/0197324 A1, Liu and Shire), такого как аллергическая астма, аллергический ринит, атопический дерматит, аллергическая гастроэнтеропатия, гиперчувствительность, экзема, крапивница, аллергический бронхолегочный аспергиллез, паразитарное заболевание, гипер-IgE-синдром, атаксия-телеангиэктазия, синдром Вискотта-Олдрича, тимическая алимфоплазия, IgE-миелома и реакция "трансплантат против хозяина".
Антитела, которые связываются с рецептором из суперсемейства TNF (например, которые связываются с DR5), или которые связываются с VEGF (или его рецептором), можно применять для лечения злокачественной опухоли, различные формы которой описаны выше в разделе с определениями. Предпочтительно, злокачественная опухоль, которую лечат с помощью композиции антител против DR5, представляет собой солидную опухоль или NHL.
В случае, когда показание представляет собой злокачественную опухоль, пациента можно лечить сочетанием композиции антитела и химиотерапевтического средства. Комбинированное введение включает в себя совместное введение или одновременное введение, с использованием отдельных композиций или единой фармацевтической композиции, и последовательное введение в любом порядке, где предпочтительно существует период времени, в течение которого оба (или все) активных средства совместно проявляют свою биологическую активность. Таким образом, химиотерапевтическое средство можно вводить до или после введения композиции. В этом варианте осуществления срок между по меньшей мере одним введением химиотерапевтического средства и по меньшей мере одним введением композиции предпочтительно составляет приблизительно 1 месяц или менее, и наиболее предпочтительно приблизительно 2 недели или менее. Альтернативно химиотерапевтическое средство и композицию вводят пациенту одновременно в единой композиции или в отдельных композициях.
Результатом лечения композицией является улучшение признаков или симптомов злокачественной опухоли или заболевания. Например, в случае если заболевание, подвергаемое лечению, представляет собой злокачественную опухоль, такое лечение может приводить к повышению выживаемости (общей выживаемости и/или выживаемости без прогрессирования) и/или может приводить к объективному клиническому ответу (частичному или полному). Более того, лечение с помощью сочетания химиотерапевтического средства и композиции антитела может приводить к синергичному, или к большему, чем аддитивный, терапевтическому эффекту у пациента.
Предпочтительно, антитело в композиции вводят в качестве простого антитела. Однако вводимое антитело можно конъюгировать с цитотоксическим средством. Предпочтительно, иммуноконъюгат и/или антиген, с которым он связывается, интернализуется клеткой, что приводит к повышенной терапевтической эффективности иммуноконъюгата в отношении уничтожения злокачественной клетки, с которой он связывается. В предпочтительном варианте осуществления цитотоксическое средство воздействует на нуклеиновую кислоту в злокачественной клетке или повреждает ее. Примеры таких цитотоксических средств включают в себя майтанзиноиды, калихимицины, рибонуклеазы и ДНК-эндонуклеазы.
Композицию вводят пациенту-человеку в соответствии с известными способами, такими как внутривенное введение, например, в качестве болюса или постоянной инфузии в течение периода времени, посредством внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, внутрисиновиального, интратекального, перорального, местного или ингаляционного способов. Внутривенное, внутримышечное или подкожное введение композиции антитела является предпочтительным, где внутривенное введение является наиболее предпочтительным.
В случае подкожной доставки, композицию можно вводить с помощью шприца; устройства для инъекции (например, устройства INJECT-EASETM и GENJECTTM); устройства для инъекций карандашного типа (такого как GENPENTM); безыгольного устройства (например, MEDIJECTORTM и BIOJECTORTM); или системы для подкожной доставки в виде пластыря.
Для профилактики или лечения заболевания, приемлемое дозирование антитела зависит от типа заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, от профилактических или терапевтических целей введения антитела, предшествующего лечения, клинического анамнеза пациента и ответа на антитело, и от решения лечащего врача. Антитело целесообразно вводить пациенту однократно или в течение ряда введений. В зависимости от типа и тяжести заболевания, доза приблизительно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела против HER2 или DR5 является исходной возможной дозой для введения пациенту, например, либо посредством одного, либо посредством нескольких отдельных введений, или посредством постоянной инфузии. Доза антитела, как правило, находится в диапазоне приблизительно от 0,05 мг/кг до приблизительно 10 мг/кг. Если вводят химиотерапевтическое средство, то его обычно вводят в известных для него дозах, или необязательно уменьшенных вследствие комбинированного действия лекарственных средств или отрицательных побочных эффектов, вызываемых введением химиотерапевтического средства. Схемы композиций и дозирования для таких химиотерапевтических средств можно использовать в соответствии с инструкциями изготовителя, или как эмпирически определит квалифицированный специалист. Схемы композиций и дозирования для такой химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
С антителом можно комбинировать другие схемы лечения, включая, но не ограничиваясь ими: второе (третье, четвертое, и т.д.) химиотерапевтическое средство(а) (т.е., "коктейли" из различных химиотерапевтических средств); другое моноклональное антитело; средство, ингибирующее рост; цитотоксическое средство; химиотерапевтическое средство; направленное против EGFR лекарственное средство; ингибитор тирозинкиназы; антиангиогенное средство и/или цитокин; и т.д.
В дополнение к указанным выше схемам лечения, пациенту можно проводить хирургическое удаление злокачественных клеток и/или лучевую терапию.
V. Изделия
В другом варианте осуществления этого изобретения, предоставлено изделие, которое содержит фармацевтическую композицию по настоящему изобретению и в котором предусмотрены инструкции по его применению. Изделие содержит контейнер. Пригодные контейнеры включают в себя, например, бутыли, флаконы (например, двухкамерные флаконы), шприцы (такие как двухкамерные шприцы) и пробирки для анализа. Контейнер может быть изготовлен из множества материалов, таких как стекло или пластмасса. Контейнер содержит композицию и инструкции по применению в виде наклейки на контейнере, или сопровождающую контейнер. Контейнер, который содержит композицию, может представлять собой флакон для многократного использования, из которого можно повторно вводить разбавленная композиция (например, от 2-6 введений). Изделие может дополнительно включать в себя другие материалы, необходимые с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши в упаковку совместно с инструкциями по применению, как указано в предыдущем разделе.
Это изобретение станет более понятным на основании следующих примеров. Их, однако, не следует толковать, как ограничивающие объем этого изобретения. Все цитаты из литературы и патентов включены в настоящее описание в качестве ссылок.
ПРИМЕРЫ
Стабильные жидкие композиции пертузумаба
В этих примерах описана разработка и анализ стабильности стабильных жидких композиций, содержащих пертузумаб, с концентрацией белка, находящейся в диапазоне приблизительно 10 мг/мл - 180 мг/мл. Выбранные композиции обладали низкой мутностью и были физически и химически стабильными. Для снижения риска коррозии из композиции удаляли ионы хлорида. Композиция была изотоничной и пригодной для подкожной или внутримышечной доставки. Формирование нерастворимого агрегата вследствие воздействия при перемешивании предотвращали с использованием композиции гистидин-ацетата и сахарозы, без необходимости добавления полисорбата-20.
Способы анализа
Цвет, внешний вид и прозрачность (CAC)
Цвет, внешний вид и прозрачность образцов определяли посредством визуального исследования флаконов на белом и черном фоне под белым флуоресцентным светом при комнатной температуре.
Измерение концентрации с помощью УФ
Аликвоту жидкого продукта сначала разбавляли буфером для композиции, так чтобы значение Amax в области 278 нм находилось в пределах 0,5-1,0 единиц поглощения. УФ-поглощение разбавленных образцов измеряли на спектрофотометре HP 8453 в кварцевой кювете с длиной пути 1 см. Поглощение измеряли при 278 нм и 320 нм. Поглощение при 320 нм использовали для коррекции рассеивания фонового света вследствие более крупных агрегатов, пузырей и частиц. В качестве контрольной пробы при измерениях использовали буфер для композиции. Концентрацию белка определяли использованием коэффициента поглощения 1,50 (мг/мл)-1см-1.
Измерение pH
Значения pH измеряли при комнатной температуре с использованием pH-метра RADIOMETER COPENHAGEN PHM82TM. Используемый электрод представлял собой комбинированный стеклянный/референсный электрод с соединительным элементом для радиометра (Sigma, Cat# E-5759). Для калибровки pH-метра использовали стандартные растворы с pH 4,01 и pH 7,00 (EM Science).
Ионообменная хроматография (IEX)
Катионообменную хроматографию использовали для измерения изменений заряда вариантов. В этом анализе использовали колонку DIONEX PROPAC WCX-10TM на системе ВЭЖХ 1100TM. Образцы разбавляли подвижной фазой A, содержащей 20 мМ MES с pH 6,0 до концентрации 1 мг/мл, 50 мл разбавленных образцов затем помещали в колонку, в которой поддерживали температуру окружающей среды. Соответствующие пикам вещества элюировали с помощью пологого градиента NaCl с использованием подвижной среды B, содержащей 20 мМ MES, 250 мМ NaCl, pH 6,0. Элюент анализировали при 280 нм. Данные анализировали с использованием программного обеспечения HP CHEMSTATIONTM (Rev A08.03).
Капиллярный зонный Электрофорез (CZE)
Степень чистоты Fab- и F(ab')2-фрагментов определяли посредством CZE. Этот анализ проводили в системе для капиллярного электрофореза BIORAD BIOFOCUSTM 3000TM с капиллярами BIOCAP XLTM, при I.D. 50 мкм, общей длине 44,6 см и длине до детектора 40 см.
Гель-фильтрация (SEC)
Гель-фильтрацию использовали для подсчета агрегатов и фрагментов. Для этого анализа использовали колонку TSK G3000 SWXLTM, 7,8×300 мм, и его проводили на системе ВЭЖХ HP 1100TM. Образцы разбавляли с помощью подвижной фазы до концентрации 10 мг/мл, и объем инъекции составлял 20 мкл. Подвижная фаза представляла собой 100 мМ K2HPO4 с pH 6,8, и белок элюировали посредством изократического градиента при 0,5 мл/мин в течение 45 минут. Поглощение в элюенте анализировали при 280 нм. Суммирование результатов проводили с использованием программного обеспечения HP CHEMSTATIONTM (Rev A08,03).
Биологическая активность
Биологическую активность пертузумаба определяли посредством измерения его способности ингибировать пролиферацию клеточной линии рака молочной железы человека MDA-MB-175-VII.
ПРИМЕР 1
Составляли Fab- и F(ab')2-фрагменты антитела пертузумаб с концентрацией белка 1,0 мкг/мл со следующими условиями для буфера:
10 мМ цитрат, 140 мМ NaCl, pH 4,0;
10 мМ сукцинат, 140 мМ NaCl, pH 5,0;
10 мМ сукцинат, 140 мМ NaCl, pH 6,0;
10 мМ гистидин, 140 мМ NaCl, pH 7,0; и
10 мМ глицилглицин, 140 мМ NaCl, pH 8,0.
Каждую композицию фильтровали, затем разделяли на аликвоты во флаконы из стекла I типа USP WHEATONTM объемом 3 см3, закрытые пробками из серого бутилкаучука, покрытыми TEFLONTM. Образцы хранили при 40±2°C. В анализе стабильности лекарственного продукта было показано, что Fab и F(ab')2 являются наиболее стабильными при pH между 5,0 и 6,0.
Эффект pH на деградацию Fab или F(ab')2, хранящихся при 40°C
% основного пика
% основного пика
% основного пика
% основного пика
ПРИМЕР 2
Пертузумаб был составлен в 20 мМ гистидин-ацетатном буфере с 120 мМ сахарозы и 0,02% полисорбата-20. С помощью уксусной кислоты значение pH в композициях доводили до конечных значений pH между 5,0 и 7,0. Концентрация белка составляла 30 мг/мл. Для анализа стабильности каждую композицию помещали во флаконы из стекла I типа USP объемом 3 см3 и хранили при 40°C. Результаты показали, что пертузумаб был наиболее стабилен при pH 6,0.
Эффект pH на деградацию пертузумаба, хранящегося при 40°C
(°С)
% мономера
% основного пика
ПРИМЕР 3
Композиции пертузумаба с концентрацией белка 100 мг/мл получали в следующих эксципиентах:
(1) 10 мМ гистидин-HCl, 240 мМ сахароза, 0,02% полисорбат-20, pH 6,0;
(2) 10 мМ гистидин-ацетат, 240 мМ сахароза, 0,02% полисорбат-20, pH 6,0;
(3) 10 мМ гистидин-фосфат, 240 мМ сахароза, 0,02% полисорбат-20, pH 6,0;
(4) 10 мМ гистидин-сульфат, 240 мМ сахароза, 0,02% полисорбат-20 при pH 6,0.
Каждую композицию помещали во флаконы из стекла I типа USP FORMA VITRUMTM объемом 3 см3, закрытые резиновыми пробками из бутилкаучука, покрытыми FLUROTECTM. Образцы хранили при 30°C и 40°C и стабильность оценивали по качеству (CAC) и чистоте (SEC, IEC). Результаты в отношении стабильности показали, что при хранении при 40°C пертузумаб в гистидин-фосфатном буфере деградирует значительно быстрее, чем в других гистидиновых буферах (фиг. 8 и фиг. 9).
ПРИМЕР 4
Пертузумаб концентрировали посредством ультрафильтрации/диафильтрации до различных концентраций в следующих буферах:
(1) 20 мМ гистидин-ацетат, pH 6,0;
(2) 10 мМ гистидин-HCl, pH 6,0, и
(3) 10 мМ гистидин-сульфат, pH 6,0.
Мутность каждой композиции измеряли перед фильтрованием. Результаты, представленные на фиг. 10, показали, что образцы пертузумаба, составленные в гистидин-ацетате и гистидин-HCl, обладали меньшим количеством нерастворимых агрегатов, чем образцы в гистидин-сульфатном буфере.
ПРИМЕР 5
Пертузумаб составляли в концентрации 30 мг/мл в 20 мМ гистидин-ацетате, 120 мМ сахарозе, 0,02% полисорбате-20, pH 6,0. Пертузумаб помещали в маленькие емкости из нержавеющей стали 316L и HASTELLOYTM. Все образцы хранили при -20°C и 5°C и оценивали по качеству (CAC), чистоте (SEC, IEC) и прочности (UV-Vis). Анализ стабильности показал, что пертузумаб является стабильным в этой композиции при хранении при -20°C и 5°C в течение по меньшей мере 3 месяцев. Не содержащая хлорида композиция является совместимой с емкостью из нержавеющей стали 316L и HASTELLOYTM.
Стабильность пертузумаба в емкостях из нержавеющей стали
(°С)
% мономера
% основного пика
ПРИМЕР 6
Пертузумаб составляли с использованием проточной фильтрации вдоль потока (TFF). Конечная композиция содержал 20 мМ гистидин-ацетат, 120 мМ сахарозу, 0,02% полисорбат-20, pH 6,0, с концентрацией белка 30 мг/мл. Образцы помещали во флаконы из стекла I типа USP FORMA VITRUMTM объемом 20 мл, закрытые 20 мм резиновыми пробками из бутилкаучука, покрытыми FLUROTECTM, и накрытые с помощью алюминиевых крышек с защелкой. Все образцы хранили при -70°C, 5°C, 15°C, и стабильность оценивали по качеству (CAC), чистоте (SEC, IEC), прочности (UV-Vis), и эффективности (биологический анализ). Результаты показали, что пертузумаб является стабильным в этой композиции при хранении при 5°C и 15°C в течение по меньшей мере 3 месяцев.
Стабильность пертузумаба в стеклянных флаконах
(°С)
(% мономера)
(% основного пика)
(% специфичной активности)
ПРИМЕР 7
Пертузумаб составляли в концентрации 100 мг/мл в следующих условиях для буферов:
(1) 10 мМ гистидин-HCl, pH 6,0;
(2) 10 мМ гистидин-HCl, 240 мМ сахароза, pH 6,0;
(3) 20 мМ сукцинат с pH 6,0; и
(4) 20 мМ сукцинат, 240 мМ сахароза с pH 6,0.
В каждую композицию добавляли полисорбат-20 в различных концентрациях. Все образцы помещали во флаконы из стекла I типа USP объемом 3 см3 и горизонтально перемешивали при 70 об/мин при комнатной температуре в течение 7 суток. Стабильность каждого образца оценивали по мутности на 7 сутки. Результаты показали, что применение полисорбата-20 в конечной композиции эффективно предотвращало образование нерастворимых агрегатов. См. фиг. 11.
ПРИМЕР 8
Пертузумаб получали в следующих композициях:
(1) 25 мг/мл пертузумаба, 10 мМ гистидин-HCl, 240 мМ сахароза, pH 6,0;
(2) 50 мг/мл пертузумаба, 10 мМ гистидин-HCl, 240 мМ сахароза, pH 6,0;
(3) 60 мг/мл пертузумаба, 20 мМ гистидин-ацетат, 120 мМ сахароза, pH 6,0.
В каждую композицию добавляли различные количества полисорбата-20. Все образцы помещали во флаконы из стекла I типа USP объемом 3 см3 и горизонтально перемешивали при 70 об/мин при комнатной температуре в течение 7 суток. Физическую стабильность каждого образца оценивали по мутности на 7 сутки. Результаты показали, что применение полисорбата-20 в композиции с гистидин-HCl и сахарозой эффективно предотвращает формирование нерастворимых твердых частиц. Оказалось, что композиция, содержащая гистидин-ацетат и сахарозу, обладает таким же защитным эффектом на белок, что и полисорбат-20. См. фиг. 12.
ПРИМЕР 9
Пертузумаб составляли следующим образом:
(1) 100 мг/мл белка, 10 мМ гистидин-HCl, pH 6,0;
(2) 100 мг/мл белка, 20 мМ сукцинат, pH 6,0;
(3) 60 мг/мл белка, 20 мМ гистидин-ацетат, pH 6,0.
Композицию смешивали с различными количествами сахарозы. Все образцы в стерильных условиях помещали во флаконы из стекла I типа USP объемом 3 см3. Затем их три раза замораживали при -70°C и размораживали при 5°C. Физическую стабильность каждого образца определяли через три цикла замораживания и размораживания. Результаты показали, что сахароза предотвращает образование растворимых агрегатов в процессе замораживания-размораживания. См. фиг. 13.
ПРИМЕР 10
Предпочтительная композиция пертузумаба для терапевтического применения по существу состоит из 30 мг/мл пертузумаба в 20 мМ гистидин-ацетате, 120 мМ сахарозе, 0,02% полисорбате-20 с pH 6,0.
MW=155,16 г/моль
MW=60,05 г/моль
Плотность=1,05 г/см3
MW=342,3 г/моль
Плотность=1,012 г/см3
Форма в виде флакона с дозой 420 мг:
Флакон: Formal Vitrum объемом 20 см3 из стекла I типа
Пробка: 20 мм DAIKYO GREYTM, покрытая фторкаучуком
Крышка: 20 мм алюминиевая крышка с защелкой
Объем наполнения: 14,50 мл
Доставка: 14,0 мл пертузумаба в нормальном мешке с физиологическим раствором для IV введения.
Форма в виде флакона с дозой 1050 мг:
Флакон: Formal Vitrum объемом 50 см3 из стекла I типа
Пробка: 20 мм DAIKYO GREYTM, покрытая фторкаучуком
Крышка: 20 мм алюминиевая крышка с защелкой
Объем наполнения: 36,0 мл
Доставка: 35,0 мл пертузумаба в мешке с нормальным физиологическим раствором для IV введения.
ПРИМЕР 11
Этот пример относится к другой композиции пертузумаба, который использовали в фазе I и в фазе II клинических испытаний. Композиция состоит из 25 мг/мл пертузумаба, 10 мМ буфера Гистидин-HCl, 240 мМ сахарозы, 0,02% полисорбата-20, pH 6,0.
ПРИМЕР 12
Клеточный апоптоз обусловлен внутренними и внешними путями. Химиотерапия может вызывать повреждение клеток и может запускать апоптоз по внутреннему пути в ответ на повреждение клеток. Однако в злокачественных клетках часто развивается устойчивость к химиотерапии вследствие мутаций в гене опухолевой супрессии p53 (Ashkenazi A. Targeting Death and Decoy Receptors of the Tumour-Necrosis Factor Superfamily. Nature Reviews 2:420-430 (2002)). Рецепторы смерти, такие как DR4 и DR5, локализованные на поверхности клеток, запускают апоптоз через внешний путь, в который p53 не вовлечен. Молекулы-агонисты, такие как Apo2L, связываются с рецепторами DR4 и DR5 и активируют каспазы 8 и 10 через ассоциированный с Fas домен смерти. Затем каспазы 8 и 10 активируют каспазы 3, 6 и 7 для индукции апоатоза. Молекулярная передача сигнала рецепторов смерти в клетках опухоли обладает терапевтическим потенциалом для удаления злокачественных клеток, которые являются устойчивыми к общепринятым способам лечения, и для молекул, таких как Apo2L, в настоящее время проводят клиническую оценку.
"Апомаб" представляет собой полноразмерный полученный из CHO гуманизированный IgG1, сконструированный с легкой цепью лямбда. Он представляет собой антитело-агонист против DR5, для которого было показано, что оно вызывает апоптоз различных злокачественных клеточных линий. Доклинические испытания с использованием модели имплантации опухоли на мышах показали, что апомаб вызывает сходное или улучшенное уменьшение опухоли по сравнению с Apo2L. Апомаб оценивают как средство против злокачественной опухоли при показаниях, представляющих собой развернутую стадию солидных опухолей и неходжскинскую лимфому (NHL). Аминокислотные последовательности легкой и тяжелой цепей апомаба, которые использовали в этих экспериментах, представлены на фиг. 27 и 28.
Получение композиций антител
Полученный рекомбинантными способами апомаб обладал очень слабой концентрацией белка и высоким значением pH. Вещество концентрировали до приблизительно 20 мг/мл и переносили в 20 мМ ацетат натрия, буфер с pH 5,0, с использованием системы проточной фильтрации вдоль потока (TFF) Millipore Labscale с 50 см мембраной MILLIPORE PELLICONTTM XL, PLCGC10. Образцы апомаба составляли в различных буферных системах, охватывающих диапазон значений pH от 4,0 до 7,0 с использованием ацетата натрия, ацетата гистидина и фосфата натрия без трегалозы и TWEEN 20® с использованием диализа с мембраной с пределом молекулярной массы 10000 Да (Pierce, Inc). Трегалозу в концентрации 240 мМ добавляли при последнем диализе. После диализа, к композиции добавляли 0,02% TWEEN 20TM и образцы фильтровали с помощью 0,22 мкм фильтров (Millipore, Inc.). Объем апомаба 0,5 мл помещали в стерильные стеклянные флаконы объемом 3 см3 (Forma Vitrum, Inc.) и закрывали 13 мм пробками (Daikyo, Inc). Стабильность белка оценивали при -70°C, 5°C, 30°C и 40°C со сроком хранения вплоть до 3 месяцев.
Стабильность композиции апомаб
Для анализа стабильности лекарственного продукта составляли апомаб, составленный в объеме, заполняющем стеклянные флаконы FORMA VITRUM® объемом 5 см3. Флаконы наполняли 5,5 мл составленного антитела, закрывали 20 мм пробками DAIKYO®, и хранили при -70°C, 5°C, 30°C и 40°C в вертикальном положении.
Для анализа стабильности лекарственного вещества, объем составленного апомаба фильтровали в стерильных условиях через 0,22 мкм фильтр и 10 мл помещали в автоклавированные 316L маленькие емкости из нержавеющей стали объемом 20 см3. Емкости устанавливали вертикально при -20°C и 5°C. Аликвоту объемом 1 мл отбирали в асептических условиях из маленьких емкостей через определенные временные интервалы для оценки качества белка. Контрольные флаконы представляли собой 1 мл аликвоты в стеклянных флаконах объемом 3 см3, хранящиеся при -20°C.
Цвет, внешний вид и прозрачность
Прозрачность, внешний вид и цвет образцов визуально оценивали под белым флуоресцентным светом с использованием устройства для измерения освещенности с черным и белым фоном. Для анализа лекарственного вещества, образцы из маленьких емкостей переносили в стеклянный флакон для исследования объемом 3 см3.
pH
pH измеряли при комнатной температуре с помощью полумикро-pH-электрода THERMO ORION SURE-FLOW ROSSTM для измерения буферов или комбинированного микро-pH-электрода THERMO ORION GLSTM для измерения pH для белка в анализируемых образцах, микроэлектродного зонда Beckman для образцов на токсикологическую стабильность. METERLABTM pHM240 pH-метр/иономер (Radiometer Analytical) калибровали каждые сутки с помощью стандартов буферов (EM Science) с pH 7 и pH 4.
Концентрация
Концентрацию белка определяли посредством абсорбционной спектроскопии в ультрафиолетовом диапазоне с использованием спектрофотометра AGILENT 8453TM. Образцы разбавляли соответствующим контролем в виде буфера для композиции до достижения поглощения от 0,5 до 1,0. В качестве контроля в устройстве использовали раствор разбавителя и проводили сканирование спектров от 240 до 500 нм. Коэффициент поглощения при 320 нм вычитали из коэффициента поглощения при 279 нм для коррекции смещения и рассеивания света. Концентрации белка вычисляли с помощью следующего уравнения:
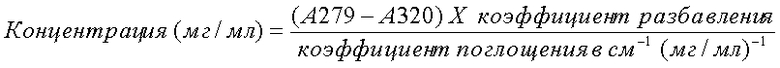
Коэффициент поглощения, исходя из последовательности, изначально определили как 1,32 см-1(мг/мл)-1 и это значение использовали для исследований в отношении анализа pH. Более позднее значение 1,7 см-1(мг/мл)-1 определили способами анализа аминокислот и протеолиза и это значение использовали для анализа стабильности апомаба, используемого в токсикологических исследованиях.
Ионообменная хроматография
Ионообменную хроматографию проводили на системе для ВЭЖХ серии 1100 (Agilent Technologies, Inc.), оборудованной детектором с диодной матрицей. Хроматографию проводили на колонке PROPAC WCX-10TM (Dionex) (4×250 мм) при скорости потока 0,5 мл/мин и с температурой колонки 40°C. Подвижная фаза A представляла собой 25 мМ фосфат натрия, pH 6,5. Подвижная фаза B представляла собой 100 мМ хлорид натрия в том же буфере, что и подвижная фаза A. Колонку уравновешивали 100% подвижной фазой A. Для анализируемых на pH образцов апомаб в количестве 20 мг помещали в колонку и анализировали поглощение при 214 нм. Белок элюировали из колонки посредством следующего градиента:
Для анализа стабильности вещества, используемого в токсикологических исследованиях, апомаб в количестве 30 мг помещали в колонку и анализировали поглощение при 280 нм. Белок элюировали из колонки посредством следующего градиента:
Гель-фильтрация
Гель-фильтрацию проводили на системе ВЭЖХ серии 1100 (Agilent Technologies, Inc.), оборудованной детектором с диодной матрицей. Апомаб в количестве 50 мкг помещали в колонку TSK Gel 3000SWXLTM (7,8×300 мм) и запускали со скоростью потока 0,9 мл/мин в течение 20 минут для образцов для анализа pH и 0,5 мл/мин в течение 30 минут для образцов на токсикологическую стабильность с подвижной фазой, представляющей собой 0,20 М фосфат калия, 0,25 М хлорид калия, pH 6,2. Поглощение анализировали при 280 нм.
Эффективность
Целью биологического анализа эффективности было измерение способности апомаба вызывать гибель клеток Colo 205 с использованием ALAMARBLUETM. Colo 205 представляет собой клеточную линию карциномы кишечника, которая экспрессирует рецепторы смерти как DR5, так и DR4. Этот анализ включает в себя флуорометрический/колориметрический индикатор роста, в основе которого лежит определение метаболической активности. ALAMARBLUETM представляет собой окислительно-восстановительный краситель, который является голубым и нефлуоресцирующим в окисленном состоянии. Внутриклеточное снижение метаболизма приводит к его превращению в красный цвет, который также является флуоресцирующим. Изменение цвета и флуоресценции является пропорциональным метаболической активности и числу живых клеток. Сигнал снижается, когда клетки гибнут. Апомаб разбавляли в среде с антителами против Fc, а затем к образцам апомаба добавляли клетки Colo 205 и инкубировали при 37°C в течение 48 часов. ALAMARBLUETM добавляли в последние 2-3 часа. Считывание с планшета проводили при возбуждении при 530 нм и эмиссии при 590 нм, с получением значения в относительных единицах флуоресценции (RFU). Данные анализировали посредством KALEIDAGRAPHTM. Получали кривую зависимости гибели клеток от разбавления.
РЕЗУЛЬТАТЫ
Исследование для выбора pH композиции
Эффект pH на стабильность антитела исследовали с использованием апомаба, полученного из неамплифицированной стабильной клеточной линии. Для этого анализа апомаб составляли в концентрации 20 мг/мл антитела в 20 мМ натрий-ацетатном буфере с pH 4,0, 4,5, 5,0, 5,5; 20 мМ гистидин-ацетатном буфере с pH 6,0 и 6,5; и 20 мМ натрий-фосфатном буфере с pH 7,0. Все из композиций содержали 240 мМ трегалозу и 0,02% TWEEN 20®. Композиции хранили вплоть до 3 месяцев при температурах -70°C, 5°C, 30°C и 40°C и стабильность белка определяли посредством различных способов анализа, в том числе анализом CAC, pH, концентрации, SEC и IEC. В процессе хранения образцов не было выявлено значительных изменений CAC, pH или концентрации белка.
Анализ образцов посредством SEC показал, что в процессе хранения при 5°C и -70°C значительных изменений не произошло. Однако в процессе хранения при 30°C и 40°C произошла деградация, наблюдаемая в виде формирования фрагментов антител и растворимых агрегатов (фиг. 20). Для сравнения композиций проводили мониторинг кинетики мономера антитела в процессе хранения и вычисляли константы скорости первого порядка. Полученный профиль значений pH в отношении потери мономера антитела представлен на фиг. 21. Оптимальное условие для стабильности мономера антитела получали при составлении в гистидин-ацетатном буфере при pH 6,0.
Мониторинг гетерогенности заряда апомаба проводили посредством IEC. В процессе хранения при 5°C и -70°C значительных изменений профиля IEC не произошло. Однако произошла деградация, выявленная в виде образования кислых или основных вариантов в зависимости от композиции (фиг. 22). Как правило, повышенное количество основных вариантов образовывалось при более низких значениях pH композиции, а более кислые варианты образовывались при более высоких значениях pH композиции. Для сравнения композиций проводили мониторинг кинетики основных пиков IEC в процессе хранения и вычисляли константы скорости первого порядка. Полученные профили значений pH для снижения основного пика IEC представлены на фиг. 23. Константы скорости, определенные посредством IEC, были приблизительно в 10 раз более высокими, чем константы скорости в SEC (фиг. 21). Таким образом, снижение основного пика IEC представляло собой основной вид деградации антитела, который в конечном итоге ограничивает период хранения продукта. Более того, определенная посредством SEC оптимальная для стабилизации основного пика IEC стабильность антитела была получена при составлении в гистидин-ацетатном буфере с pH 6,0.
После анализа данных анализа pH, описанного выше, отобрали композицию апомаба, который содержал 20 мг/мл антитела в 20 мМ ацетате гистидина, 240 мМ трегалозе, 0,02% полисорбате-20, pH 6,0. Для лекарственного продукта форма флакона состояла из флакона 5 объемом см3 с наполнением 5,5 мл FORMA VITRUMTM с 20 мМ пробкой DAIKYOTM West. Апомаб хранили в емкостях из нержавеющей стали.
Стабильность лекарственного продукта апомаба оценивали в форме в виде стеклянного флакона объемом 5 см3, описанного выше. Флаконы хранили при -70°C (контроли), 5°C, 30°C и 40°C. Образцы отбирали через определенные временные интервалы и анализировали посредством следующих анализов: анализа цвета, внешнего вида, прозрачности (CAC), pH, концентрации белка, SEC, IEC, и анализа эффективности. Результаты этих анализов представлены в таблице 6 для образцов, которые хранили при -70°C и 5°C и в таблице 7 для образцов, которые хранили при 30°C и 40°C.
Данные в отношении стабильности апомаба, хранившегося при -70°C и 5°C
тура
(°С)
(% мономера)
(% основного пика)
Данные в отношении стабильности апомаба, хранившегося при 30°C и 40°C
тура
(°С)
(% мономера)
(% основного пика)
Через двенадцать месяцев хранения при -70°C и 5°C не было выявлено изменений качества белка. Например, значение pH оставалась в пределах 6,0±0,3, апомаб имел внешний вид прозрачной и бесцветной жидкости, концентрация белка сохранялась в пределах 20,0±2,0 мг/мл, и % мономера не изменялся. Более того, не было значительных изменений в % основного пика IEC, и % специфичная активность, определяемая в анализе эффективности в отношении уничтожения клеток, находилась в пределах величины погрешности анализа от 60% до 140% специфичной активности. Результаты показали, что апомаб, хранящийся при 5°C в стеклянных флаконах объемом 5 см3, был стабильным в течение по меньшей мере 12 месяцев.
В таблице 7 показано, что при 30°C и 40°C происходили изменения качества белка. С помощью SEC было показано снижение % мономера с увеличением, главным образом, частиц в виде фрагментов. Также при более высокой температуре повышалось количество агрегатов, но величина повышения была значительно ниже. Однако количество агрегатов увеличилось значительно через 6 месяцев при 40°C. % основного пика IEC снижался при соответствующем повышении кислых вариантов. Основные пики снижались незначительно через 2 месяца при 40°C и 9 месяцев при 30°C. Через шесть месяцев хранения при 40°C, деградация происходила в такой степени, что основной пик IEC более не возможно было вычислить. Биологический анализ в отношении уничтожения клеток показал снижение % специфичной активности при более высокой температуре с увеличением длительности хранения. Концентрация белка и pH не изменялись. Раствор становился светло-желтым через 3 месяца при 40°C и через 9 месяцев при 30°C и становился желтым через 9 месяцев при 40°C.
Стабильность лекарственного средства
Данные в отношении стабильности при замораживании-размораживании для лекарственного вещества представлены в таблице 8.
Данные в отношении стабильности при замораживании-размораживании для апомаба,
помещенного в маленькие емкости из нержавеющей стали
размораживание)
(% мономера)
Данные в отношении стабильности для апомаба,
помещенного в маленькие емкости из нержавеющей стали
тура
(°С)
(% мономера)
(% основного пика)
После трехкратного замораживания при -20°C в течение по меньшей мере 15 часов и размораживания при температуре окружающей среды значительных изменений химических свойств белка выявлено не было. Например, апомаб имел внешний вид прозрачной и бесцветной жидкости, значение pH оставалось в пределах 6,0±0,3, и процентная доля пика для мономера в SEC не изменялась.
Стабильность апомаба в контейнерах из нержавеющей стали оценивали при -20°C и 5°C (таблица 9).
Образцы отбирали в асептических условиях из маленьких емкостей через определенные интервалы и анализировали.
Для апомаба не было показано изменение качества белка при 5°C при анализе pH, CAC, концентрации белка и % основного пика в IEC, но было показано снижение 0,1% мономера в SEC каждые 3 месяца. В процессе хранения при 5°C в течение 3 месяцев наблюдали снижение эффективности. Однако эффективность образца вновь повышалась в периоды времени 6 и 9 месяцев. Таким образом, наблюдаемое отличие эффективности в период времени 3 месяца было приписано отклонению при анализе. Для апомаба не было показано изменение качества белка при -20°C при анализе pH, CAC, концентрации белка, % мономера в SEC, % основного пика в IEC, и не было показано значительного изменения эффективности. Данные в отношении стабильности показали, что апомаб является стабильным в течение по меньшей мере 1 года при -20°C и трех месяцев при 5°C.
ЗАКЛЮЧЕНИЕ
Исследования по скринингу композиции проводили для отбора композиции для апомаба. Анализ pH, охватывающий диапазон значений pH от 4,0 до 7,0 с использованием ацетата натрия, ацетата гистидина, и фосфата натрия в качестве буферов с 240 мМ дигидратом трегалозы и 0,02% полисорбатом-20, показал, что апомаб является наиболее стабильным в растворе с pH 6,0. Таким образом, была разработана композиция, состоящая из 20 мМ ацетата гистидина, 240 мМ трегалозы, 0,02% полисорбата-20, pH 6,0 и было экспериментально показано, что он является стабильным. С использованием этой композиции, было показано, что апомаб является стабильным в течение по меньшей мере 12 месяцев при 5°C. Более того, было показано, что апомаб является стабильным в течение по меньшей мере 12 месяцев при -20°C и три месяца при 5°C при хранении в контейнерах из нержавеющей стали 316L. Также было показано, что апомаб является стабильным, если его подвергать воздействию вплоть до 3 циклов замораживания/размораживания.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С ДОМЕНОМ II HER2, И ЕГО КИСЛЫЕ ВАРИАНТЫ | 2009 |
|
RU2543664C2 |
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| ВВЕДЕНИЕ ФИКСИРОВАННЫХ ДОЗ HER-АНТИТЕЛ | 2005 |
|
RU2438705C2 |
| ТЕРАПИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, РЕЗИСТЕНТНОЙ К ПРЕПАРАТАМ НА ОСНОВЕ ПЛАТИНЫ | 2005 |
|
RU2403065C2 |
| ПРЕПАРАТЫ АНТИТЕЛ ПРОТИВ HER2 ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2018 |
|
RU2750821C2 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| ВАРИАНТЫ ПЕРТУЗУМАБА И ИХ АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА | 2014 |
|
RU2737727C2 |
| СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2470941C2 |
| ТРИСПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, КОТОРЫЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЮТ АНТИГЕНЫ МНОЖЕСТВА ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2718692C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD137 И ОПУХОЛЕВЫЕ АНТИГЕНЫ, И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2805648C2 |





























































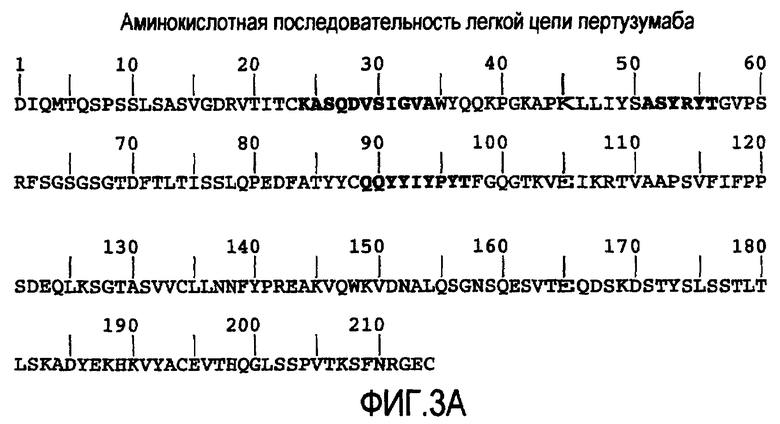
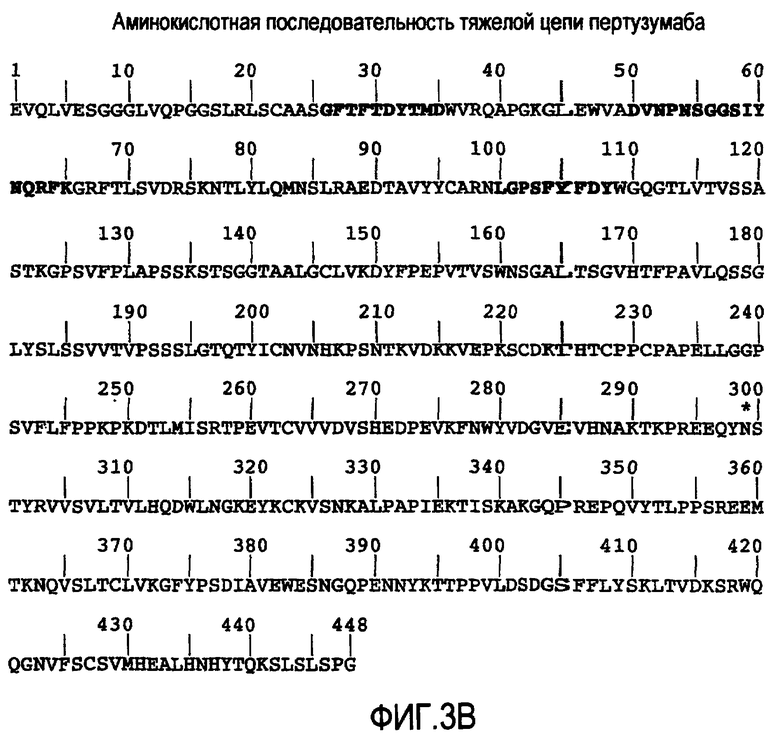


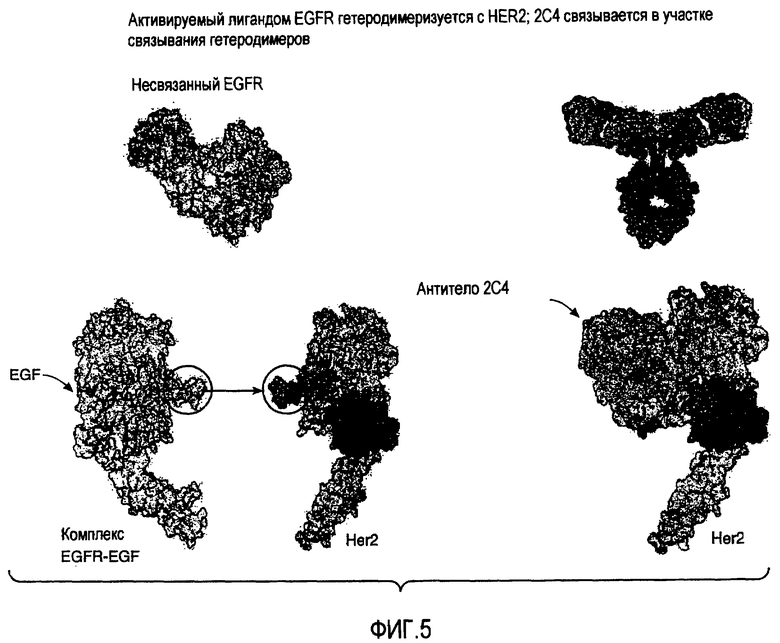
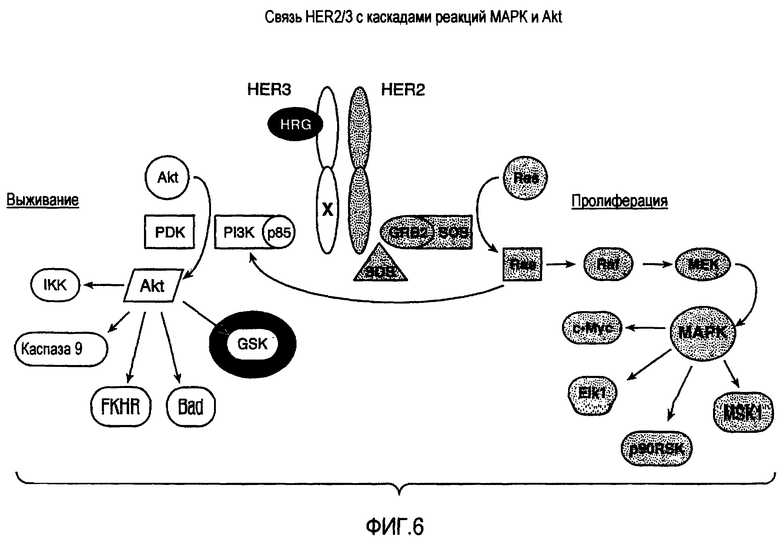
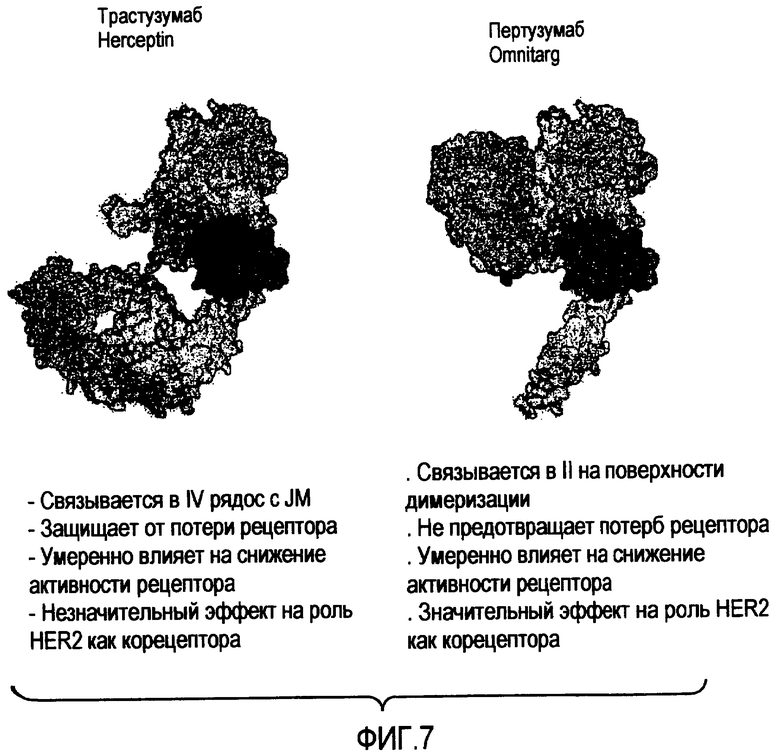
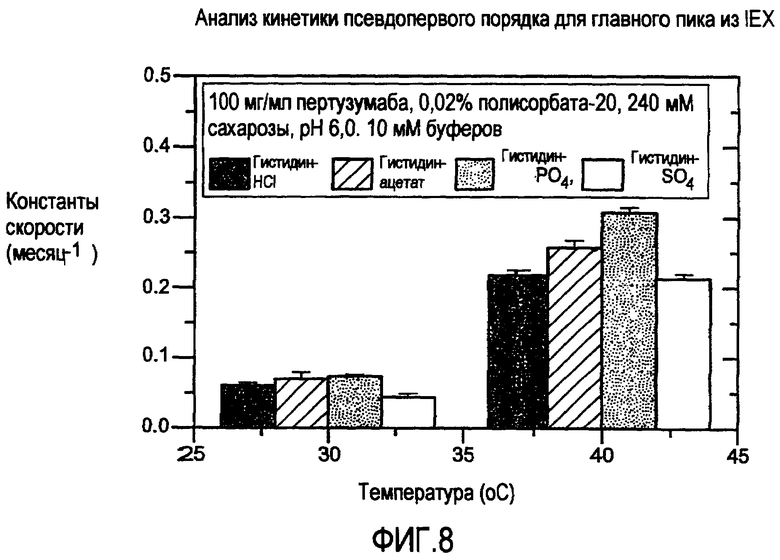
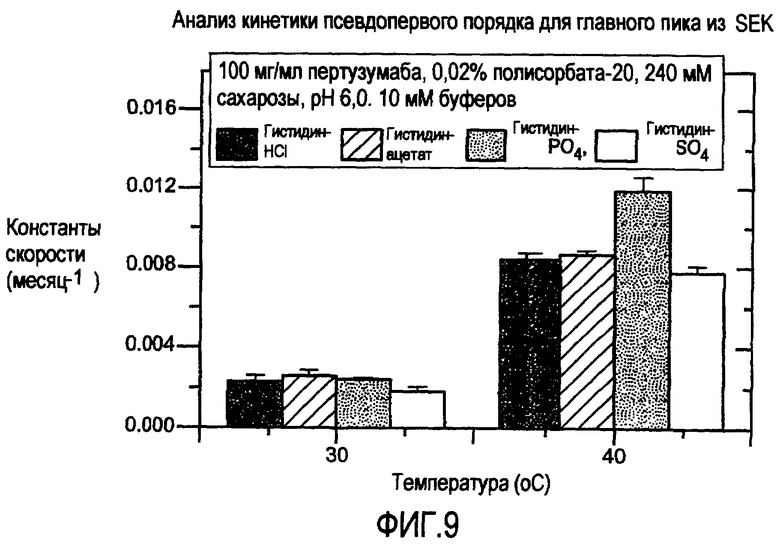
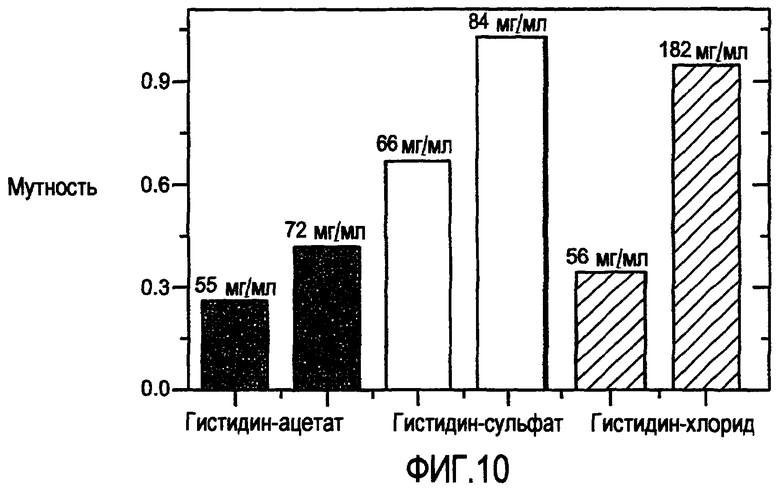

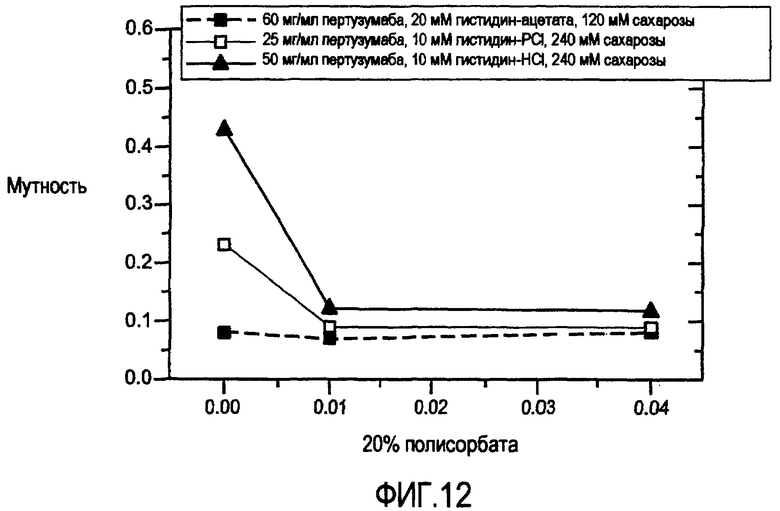
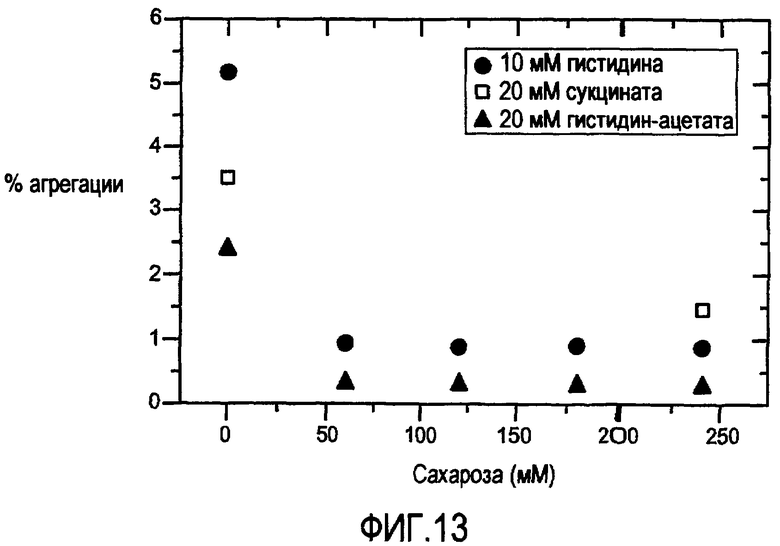




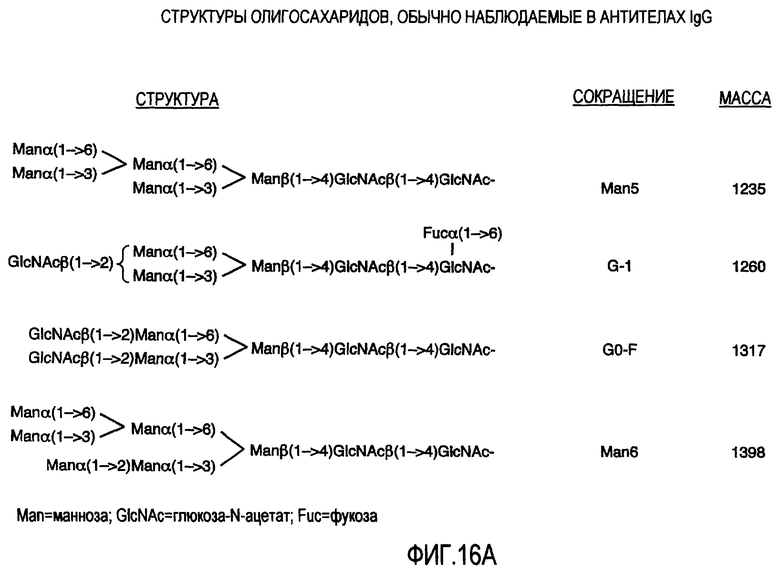


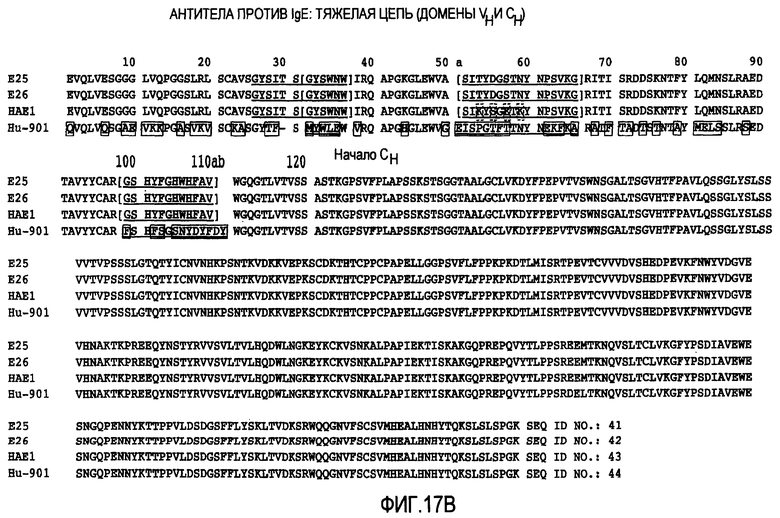
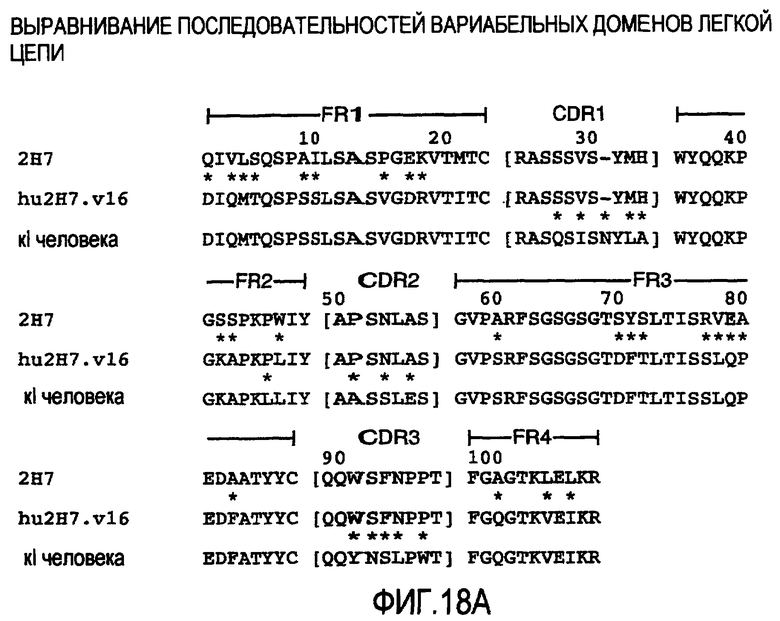




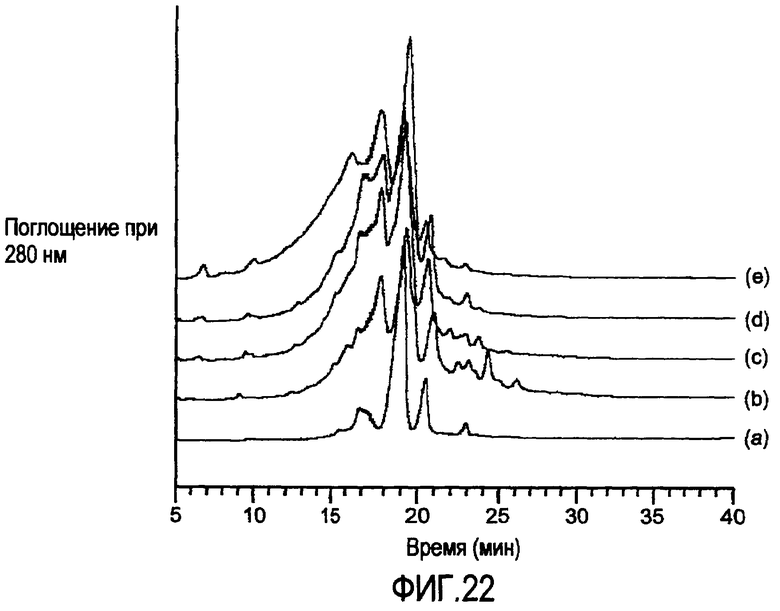
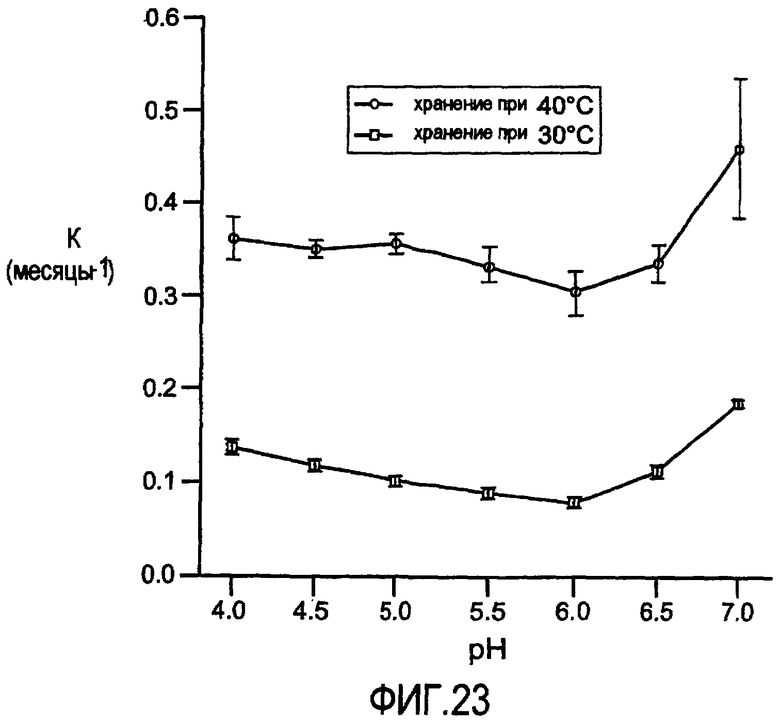
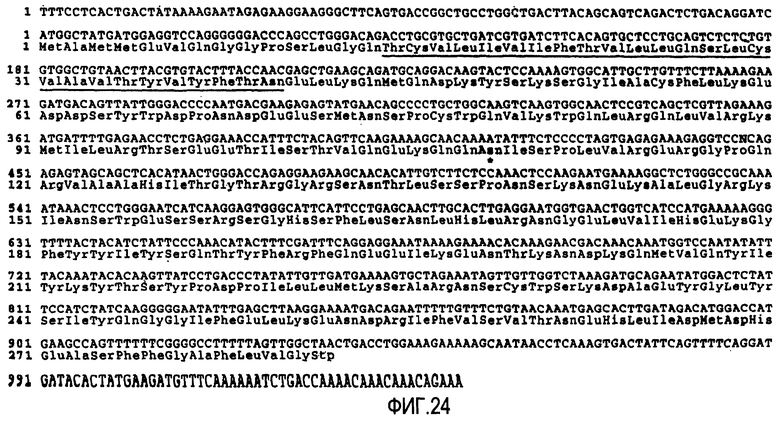


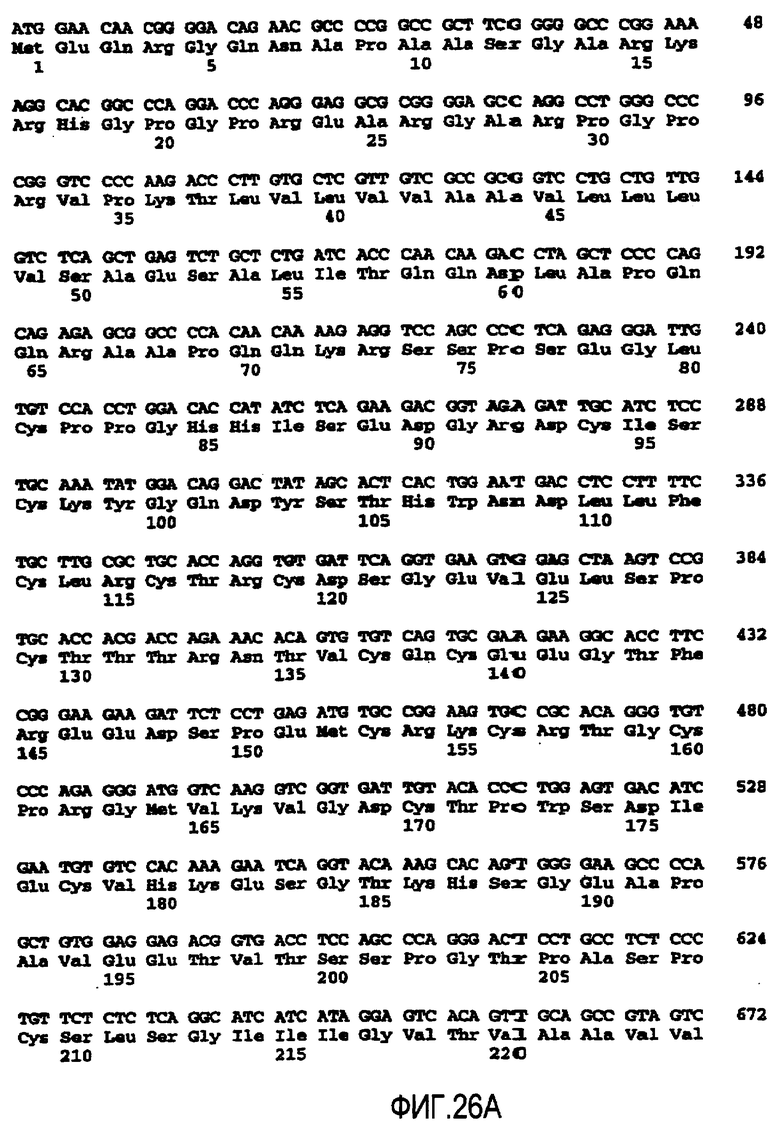









Изобретение относится к области биотехнологии. Предложен состав буфера фармацевтической композиции, содержащей пертузумаб. Буфер на основе гистидин-ацетата, имеющий уровень рН от 5,5 до 6,5, обеспечивает снижение дезаминирования и агрегации пертузумаба в процессе длительного хранения. 4 н. и 40 з.п. ф-лы, 9 табл, 33 ил.
1. Стабильная фармацевтическая композиция, содержащая пертузумаб в гистидин-ацетатном буфере, рН от 5,5 до 6,5.
2. Композиция по п.1, в которой значение рН составляет от 5,8 до 6,2.
3. Композиция по п.1, в которой концентрация гистидин-ацетатного буфера составляет приблизительно от 1 мМ до приблизительно 200 мМ.
4. Композиция по п.3, в которой концентрация гистидин-ацетатного буфера составляет приблизительно от 10 мМ до приблизительно 40 мМ.
5. Композиция по п.1, в которой концентрация антитела составляет приблизительно от 10 мг/мл до приблизительно 250 мг/мл.
6. Композиция по п.5, в которой концентрация моноклонального антитела составляет приблизительно от 20 мг/мл до приблизительно 40 мг/мл.
7. Композиция по п.5, в которой концентрация моноклонального антитела составляет приблизительно от 80 мг/мл до приблизительно 250 мг/мл.
8. Композиция по п.1, дополнительно содержащая сахарид.
9. Композиция по п.8, в которой сахарид представляет собой дисахарид.
10. Композиция по п.8, в которой сахарид представляет собой трегалозу.
11. Композиция по п.8, в которой сахарид представляет собой сахарозу.
12. Композиция по п.8, в которой концентрация сахарида составляет приблизительно от 10 мМ до приблизительно 1 М.
13. Композиция по п.12, в которой концентрация сахарида составляет приблизительно от 60 мМ до приблизительно 250 мМ.
14. Композиция по п.1, дополнительно содержащая поверхностно-активное вещество.
15. Композиция по п.14, в которой поверхностно-активное вещество представляет собой полисорбат.
16. Композиция по п.15, в которой поверхностно-активное вещество представляет собой полисорбат-20.
17. Композиция по п.14, в которой концентрация поверхностно-активного вещества составляет приблизительно от 0,0001% до приблизительно 1,0%.
18. Композиция по п.17, в которой концентрация поверхностно-активного вещества составляет приблизительно от 0,01% до приблизительно 0,1%.
19. Композиция по п.1, в которой пертузумаб является полноразмерным.
20. Композиция по п.19, в которой пертузумаб представляет собой фрагмент, содержащий антигенсвязывающий участок.
21. Композиция по п.22, в которой фрагмент пертузумаба представляет собой Fab-фрагмент или F(аb')2-фрагмент.
22. Композиция по п.1, которая является стерильной.
23. Композиция по п.1, которая является стабильной при хранении при приблизительно 40°С в течение по меньшей мере 4 недель.
24. Композиция по п.1, которая является стабильной при хранении приблизительно при 5°С или приблизительно при 15°С в течение по меньшей мере 3 месяцев.
25. Композиция по п.1, которая является стабильной при хранении приблизительно при -20°С в течение по меньшей мере 3 месяцев.
26. Композиция по п.1, которая является стабильной при замораживании и размораживании.
27. Композиция по п.1, которая является водной.
28. Композиция по п.1, которая является замороженной.
29. Композиция по п.1, которая не является лиофилизированной и которую ранее не подвергали лиофилизации.
30. Композиция по п.29, которая является водной и которую вводят субъекту.
31. Композиция по п.30, которая предназначена для внутривенного (в/в), подкожного (п/к) или внутримышечного (в/м) введения.
32. Композиция по п.31, которая предназначена для в/в введения и в которой концентрация антитела составляет приблизительно от 20 мг/мл до приблизительно 40 мг/мл.
33. Композиция по п.31, которая предназначена для п/к введения и в которой концентрация антитела составляет приблизительно от 80 мг/мл до приблизительно 250 мг/мл.
34. Композиция по п.1, содержащаяся во флаконе с пробкой, поддающейся прокалыванию шприцем.
35. Композиция по п.34, которую хранят приблизительно при 2-8°С.
36. Композиция по п.34, где флакон имеет объем 20 см3 или 50 см3.
37. Композиция по п.1, содержащаяся в емкости из нержавеющей стали.
38. Композиция по п.37, которая является замороженной.
39. Фармацевтическая композиция по п.1, содержащая:
(a) полноразмерный пертузумаб в количестве приблизительно от 10 мг/мл до приблизительно 250 мг/мл;
(b) гистидин-ацетатный буфер, рН от 5,5 до 6,5;
(c) сахарид, выбранный из группы, состоящей из трегалозы и сахарозы, в количестве приблизительно от 60 мМ до приблизительно 250 мМ; и
(d) полисорбат-20 в количестве приблизительно от 0,01% до приблизительно 0,1%.
40. Способ снижения дезамидирования или агрегации пертузумаба, включающий в себя получение композиции пертузумаба в составе гистидин-ацетатного буфера, рН от 5,5 до 6,5.
41. Способ по п.40, включающий в себя оценку дезамидирования или агрегации пертузумаба до и после получения его композиции.
42. Стабильная фармацевтическая композиция, содержащая пертузумаб в количестве приблизительно от 20 мг/мл до приблизительно 40 мг/мл, гистидин-ацетатный буфер, сахарозу и полисорбат-20, где рН композиции составляет приблизительно от 5,5 до приблизительно 6,5.
43. Композиция по п.42, содержащая приблизительно 30 мг/мл пертузумаба, приблизительно 20 мМ гистидин-ацетата, приблизительно 120 мМ сахарозы, и приблизительно 0,02% полисорбата-20, где рН композиции составляет приблизительно 6,0.
44. Способ получения фармацевтической композиции, включающий в себя
(a) получение композиции по п.1; и
(b) оценку физической стабильности, химической стабильности или биологической активности пертузумаба в указанной композиции.
| WO 03105894 А, 24.12.2003 | |||
| BARRIUSO ET AL | |||
| Antibodies against cancer | |||
| Rev | |||
| Clin | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| WO 2003014294 A, 20.02.2003 | |||
| WO 03106644 A2, 24.12.2003 | |||
| WO 03009817 A2, 06.02.2003 | |||
| WO 2004001007 A2, 31.12.2003 | |||
| Вибротрамбовка | 1981 |
|
SU974801A1 |
| CHEN BEI ET AL: "Influence of histidine on the stability and physical properties of a fully | |||
Авторы
Даты
2011-08-20—Публикация
2005-10-19—Подача