ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[001] Изобретение относится к соединениям, которые можно использовать в качестве ингибиторов натриевых каналов. Изобретение также относится к фармацевтически приемлемым композициям, содержащим соединения по изобретению, и к способам использования композиций в лечении различных нарушений, включая боль.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[002] Боль является защитным механизмом, позволяющим здоровым животным избегать повреждения тканей и предотвращать дальнейшее повреждение пораженной ткани. Тем не менее, существует множество состояний, когда боль сохраняется за пределами ее полезности, или когда пациенты могут получать преимущество от подавления боли. Нейропатическая боль является формой хронической боли, вызванной повреждением сенсорных нервов (Dieleman, J.P., et al, Incidence rates and treatment of neuropathic pain conditions in the general population. Pain, 2008. 137(3): p. 681-8). Нейропатическую боль можно разделить на две категории, боль, вызванную генерализованным метаболическим повреждением нерва, и боль, вызванную дискретным повреждением нерва. Метаболические нейропатии включают постгерпетическую нейропатию, диабетическую нейропатию и обусловленную действием лекарственного средства нейропатию. Показатели дискретного повреждения нерва включают боль после ампутации, боль при послеоперационном повреждении нерва и повреждения при защемлении нерва, подобные нейропатической позвоночной боли.
[003] Потенциалозависимые натриевые каналы (NaV) играют критическую роль в передаче сигналов боли. NaV являются ключевыми биологическими медиаторами передачи электрического сигнала, поскольку они являются первичными медиаторами быстрого повышения потенциала действия многих типов возбудимых клеток (например, нейронов, миоцитов скелетных мышц, кардиомиоцитов). Доказательства роли этих каналов в нормальной физиологии, патологические состояния, возникающие из-за мутаций в генах натриевых каналов, доклинические работы на моделях на животных и клиническая фармакология известных средств, модулирующих натриевые каналы, все указывают на центральную роль NaV в ощущении боли (Rush, A.M. and T.R. Cummins, Painful Research: Identification of Small-Molecule Inhibitor that Selectively Targets NaV 1.8 Sodium Channels. Mol Interv, 2007. 7(4): p. 192-5); England, S., Voltage-gated sodium channels: the search for subtype-selective analgesics. Expert Opin Investig Drugs 17 (12), p. 1849-64 (2008); Krafte, D. S. and Bannon, A. W., Sodium channels and nociception: recent concepts and therapeutic opportunities. Curr Opin Pharmacol 8 (1), p. 50-56 (2008)). NaV являются первичными медиаторами быстрого повышения потенциала действия многих типов возбудимых клеток (например, нейронов, миоцитов скелетных мышц, кардиомиоцитов), и таким образом, являются критическими для инициации передачи сигнала в этих клетках (Hille, Bertil, Ion Channels of Excitable Membranes, Third ed. (Sinauer Associates, Inc., Sunderland, MA, 2001)). Из-за роли, которую NaV играют в инициации и распространении нейрональных сигналов, антагонисты, уменьшающие токи в NaV, могут предотвращать или уменьшать передачу сигналов в нервной системе, и NaV каналы долгое время считали возможными мишенями для уменьшения боли в условиях, когда наблюдают гипервозбудимость (Chahine, M., Chatelier, A., Babich, O., and Krupp, J. J., Voltage-gated sodium channels in neurological disorders. CNS Neurol Disord Drug Targets 7 (2), p. 144-58 (2008)). Несколько клинически применимых анальгетиков идентифицировано как ингибиторы каналов NaV. Местные анестетические лекарственные средства, такие как лидокаин, блокируют боль посредством ингибирования каналов NaV, и предположили также, что другие соединения, такие как карбамазепин, ламотригин и трициклические антидепрессанты с доказанной эффективностью в уменьшении боли действуют посредством ингибирования натриевых каналов (Soderpalm, В., Anticonvulsants: aspects of their mechanisms of action. Eur J Pain 6 Suppl A, p. 3-9 (2002); Wang, G. K., Mitchell, J., and Wang, S. Y., Block of persistent late Na+ currents by antidepressant sertraline and paroxetine. JMembr Biol 222 (2), p. 79-90 (2008)).
[004] NaV формируют подсемейство суперсемейства потенциалозависимых ионных каналов и содержат 9 изоформ, обозначенных NaV 1.1–NaV 1.9. Локализация в тканях девяти изоформ сильно варьирует. NaV 1.4 является первичным натриевым каналом скелетных мышц, и NaV 1.5 является первичным натриевым каналом кардиомиоцитов. NaV 1.7, 1.8 и 1.9 преимущественно локализованы в периферической нервной системе, в то время как NaV 1.1, 1.2, 1.3 и 1.6 являются нейрональными каналами, обнаруженными как в центральной, так и в периферической нервных системах. Функциональное поведение девяти изоформ является сходным, но отличается характерными особенностями их потенциалозависимого и кинетического поведения (Catterall, W. A., Goldin, A. L., and Waxman, S. G., InternatiOnal Union of Pharmacology. XLVII. Nomenclature and structure-Function relationships of voltage-gated sodium channels. Pharmacol Rev 57 (4), p. 397 (2005)).
[005] Сразу после их открытия, каналы NaV1.8 идентифицировали как возможные мишени для анальгезии (Akopian, A.N., L. Sivilotti, and J.N. Wood, A tetrodotoxin-resistant voltage-gated sodium channel expressed by sensory neurons. Nature, 1996. 379(6562): p. 257-62). С этого времени показано, что NaV 1.8 является наиболее значительным переносчиком натриевого тока, который поддерживает возбуждение потенциала действия в малых нейронах DRG (Blair, NT. and B.P. Bean, Roles of tetrodotoxin (TTX)-sensitive Na+ current, TTX-resistant Na+ current, and Ca2+ current in the action potentials of nociceptive sensory neurons. JNeurosci., 2002. 22(23): p. 10277-90). NaV 1.8 является необходимым для спонтанного возбуждения поврежденных нейронов, подобных тем, которые обуславливают нейропатическую боль (Roza, C, et al, The tetrodotoxin-resistant Na+ channel Nayl.8 is essential for the expression of spontaneous activity in damaged sensory axons of mice. J. Physiol., 2003. 550(Pt 3): p. 921-6; Jarvis, M.F., et al, A-803467, a potent and selective NaV1.8 sodium channel blocker, attenuates neuropathic and inflammatory pain in the rat. Proc natl Acad Sci. USA, 2007. 104(20): p. 8520-5; Joshi, S.K., et al, Involvement of the TTX-resistant sodium channel NaV1.8 in inflammatory and neuropathic, but not post-operative, pain states. Pain, 2006. 123(1-2): pp. 75-82; Lai, J., et al, Inhibition of neuropathic pain by decreased expression of the tetrodotoxin-resistant sodium channel, NaV1,8. Pain, 2002. 95(1-2): p. 143-52; Dong, X.W., et al, Small interfering RNA-mediated selective knockdown of Na(v)1,8 tetrodotoxin-resistant sodium channel reverses mechanical allodynia in neuropathic rats. Neuroscience, 2007. 146(2): p. 812-21; huang, H.L., et al, Proteomic profiling of neuromas reveals alterations in protein composition and local protein synthesis in hyper-excitable nerves. MolPain, 2008. 4: p. 33; Black, J.A., et al, Multiple sodium channel isoforms and mitogen-activated protein kinases are present in painful Human neuromas. Ann Neurol, 2008. 64(6): p. 644-53; Coward, K., et al, Immunolocalization of SNS/PN3 and NaN/SNS2 sodium channels in human pain states. Pain, 2000. 85(1-2): p. 41-50; Yiangou, Y., et al, SNS/PN3 and SNS2/NaN sodium channel-like immunoreactivity in Human adult and neonate injured sensory nerves. FEBS Lett, 2000. 467(2-3): p. 249-52; Ruangsri, S., et al., Relationship of axonal voltage-gated sodium channel 1.8 (NaV 1.8) mRNA accumulation to sciatic nerve injury-induced painful neuropathy in rats J BiOl Chem. 286(46): p. 39836-47). Малые нейроны DRG, где экспрессирован NaV1.8, включают ноцицепторы, критические для передачи сигнала боли. NaV1.8 является первичным каналом, опосредующим потенциалы действия большой амплитуды в малых нейронах ганглиев дорсального корешка (Blair, NT. and B.P. Bean, Roles of tetrodotoxin (TTX)-sensitive Na+ current, TTX-resistant Na+ current, and Ca2+ current in the action potentials of nociceptive sensory neurons. Jneurosci., 2002. 22(23): p. 10277-90). NaV1.8 является необходимым для быстрых повторяющихся потенциалов действия в ноцицепторах, и для спонтанной активности поврежденных нейронов. (Choi, J.S. and S.G. Waxman, Physiological interactions between NaV1.7 and NaV1.8 sodium channels: a computer simulation study. J Neurophysiol. 106(6): p. 3173-84; Renganathan, M., T.R. Cummins, and S.G. Waxman, Contribution of Na(V)1.8 sodium channels to action potential electrogenesis in DRG neurons. J Neurophysiol., 2001. 86(2): p. 629-40; Roza, C, et al, The tetrodotoxin-resistant Na+ channel NaV1.8 is essential for the expression of spontaneous activity in damaged sensory axons of mice. J Physiol., 2003. 550(Pt 3): p. 921-6). В деполяризованных или поврежденных нейронах DRG, NaV1.8, по-видимому, является первичным стимулятором гипервозбудимости (Rush, A.M., et al, A single sodium channel mutation produces Hyper- or Hypoexcitability in different types of neurons. Proc Natl Acad Sci USA, 2006. 103(21): p. 8245-50). В некоторых моделях боли на животных показано увеличение уровней экспрессии мРНК NaV1.8 в DRG (Sun, W., et al, Reduced conduction failure of the main axon of polymodal nociceptive C-Fibres contributes to painful diabetic neuropathy in rats. Brain. 135(Pt 2): p. 359-75; Strickland, I.T., et al., Changes in the expression of NaV1.7, NaV1.8 and NaV1.9 in a distinct population of dorsal root ganglia innervating the rat knee joint in a model of chronic inflammatory joint pain. Eur J Pain, 2008. 12(5): p. 564-72; Qiu, F., et al, Increased expression of tetrodotoxin-resistant sodium channels NaV1.8 and NaV1.9 within dorsal root ganglia in a rat model of bone cancer pain. Neurosci. Lett. 512(2): p. 61-6).
[006] Первостепенным недостатком известных ингибиторов NaV является их недостаточное терапевтическое окно, и это, по-видимому, является следствием отсутствия у них селективности для изоформ. Поскольку NaV1.8 преимущественно ограничен нейронами, чувствительными к боли, селективные блокаторы NaV1.8 маловероятно индуцируют неблагоприятные события, общераспространенные для неселективных блокаторов NaV. Соответственно, остается необходимость разработки дополнительных антагонистов каналов NaV, предпочтительно, тех, которые являются более селективными для NaV1.8 и более активными с увеличенной метаболической стабильностью и с меньшими побочными эффектами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] В настоящее время обнаружено, что соединения по настоящему изобретению, и их фармацевтически приемлемые соли и композиции, можно использовать в качестве ингибиторов потенциалозависимых натриевых каналов.
[008] Эти соединения обладают общей формулой I:

I;
или представляют собой ее фармацевтически приемлемую соль.
[009] Эти соединения и фармацевтически приемлемые соли и композиции можно использовать для лечения или уменьшения тяжести множества заболеваний, нарушений или состояний, включая, в качестве неограничивающих примеров, хроническую боль, боль в кишечнике, нейропатическую боль, костно-мышечную боль, острую боль, воспалительную боль, боль при злокачественной опухоли, идиопатическую боль, рассеянный склероз, синдром Шарко-Мари-Тута, недержание или аритмию сердца.
Подробное описание изобретения
[0010] В одном из аспектов изобретение относится к соединениям формулы I:

I;
или их фармацевтически приемлемым солям,
где, независимо для каждого появления:
R1 представляет собой H, Cl, CH3, CF3 или циклопропил;
R2 представляет собой H, F, Cl, CN, CH3, CF3 или CHF2;
R3 представляет собой H, F, Cl, CN, CF3, OCF3 или CF2CF3;
R4 представляет собой H;
R5 представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
R5’ представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
R6 представляет собой H, F или Cl;
R6' представляет собой H, F или Cl; и
R7 представляет собой H, F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2,
при условии, что R1, R2 и R3 одновременно не представляют собой водород; и
что R5, R5’, R6, R6’ и R7 одновременно не представляют собой водород.
[0011] Для целей настоящего изобретения, химические элементы обозначены в соответствии с Периодической таблицей элементов, версии CAS, Handbook of chemistry and physics, 75th Ed. Кроме того, общие принципы органической химии описаны в «Organic Chemistry», Thomas Sorrell, University Science Books, Sausalito: 1999, и «March's Advanced Organic Chemistry», 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых, таким образом, включено в качестве ссылки.
[0012] Как описано в настоящем документе, соединения по изобретению могут, необязательно, являться замещенными одним или несколькими заместителями, такими как в общем проиллюстрированы выше, или как проиллюстрировано конкретными классами, подклассами и видами по изобретению. Как описано в настоящем документе, варианты в формуле I включают конкретные группы, например, такие как алкил и циклоалкил. Как понятно специалисту в данной области, комбинациями заместителей, предусмотренными по этому изобретению, являются такие комбинации, которые приводят к формированию стабильных или химически возможных соединений. Термин «стабильный», как используют в настоящем документе, относится к соединениям, которые значительно не изменяются при подвергании условиям, позволяющим их получение, детекцию и предпочтительно, их выделение, очистку, и использование для одной или нескольких целей, описываемых в настоящем документе. В некоторых вариантах осуществления стабильное соединение или химически возможное соединение представляет собой соединение, которое значительно не изменяется при хранении при температуре 40°C или менее, в отсутствие влажности или других химически реакционноспособных условий, в течение по меньшей мере недели.
[0013] Фразу «необязательно, замещенный» можно использовать взаимозаменяемо с фразой «замещенный или незамещенный». Как правило, термин «замещенный», предваряемый термином «необязательно» или нет, относится к замене водородных радикалов в данной структуре на радикал указанного заместителя. Конкретные заместители описаны выше в определениях и ниже в описании соединений и их примеров. Если не указано иначе, необязательно, замещенная группа может обладать заместителем в каждом поддающемся замещению положении группы, и когда более чем одно положение в любой данной структуре может являться замещенным более, чем одним заместителем, выбранным из указанной группы, заместители могут являться одинаковыми или различными в каждом положении. Кольцевой заместитель, такой как гетероциклоалкил, может являться связанным с другим кольцом, таким как циклоалкил, для формирования спиро-бициклической циклической системы, например, оба кольца разделяют один общий атом. Как понятно специалисту в данной области, комбинациями заместителей, предусмотренными по этому изобретению, являются те комбинации, которые приводят к формированию стабильных или химически возможных соединений.
[0014] Фраза «вплоть до», как используют в настоящем документе, относится к нулю или любому целому числу, которое равно или менее, чем количество после фразы. Например, «вплоть до 4» означает любое из 0, 1, 2, 3 и 4.
[0015] Термин «алифатический», «алифатическая группа» или «алкил», как используют в настоящем документе, обозначает обладающую неразветвленной цепью (т.е., неразветвленную) или разветвленную, замещенную или незамещенную углеводородную цепь, которая является полностью насыщенной или которая содержит одну или несколько ненасыщенных единиц. Если не указано иначе, алифатические группы содержат 1-20 алифатических атомов углерода. В некоторых вариантах осуществления алифатические группы содержат 1-10 алифатических атомов углерода. В других вариантах осуществления алифатические группы содержат 1-8 алифатических атомов углерода. В других вариантах осуществления алифатические группы содержат 1-6 алифатических атомов углерода, и в других вариантах осуществления алифатические группы содержат 1-4 алифатических атомов углерода. Подходящие алифатические группы в качестве неограничивающих примеров включают линейные или разветвленные, замещенные или незамещенные группы алкила, алкенила, алкинила.
[0016] Термины «циклоалифатический» или «циклоалкил» обозначает моноциклическое углеводородное кольцо, или полициклическую углеводородную циклическую систему, которая является полностью насыщенной или которая содержит одну или несколько ненасыщенных единиц, но которая не является ароматической и обладает одиночной точкой присоединения к остальной части молекулы.
[0017] Термин «полициклическая циклическая система», как используют в настоящем документе, включает бициклические и трициклические 4- - 12-членные структуры, формирующие по меньшей мере два кольца, где два кольца обладают по меньшей мере одним общим атомом (например, 2 общими атомами), включая конденсированные, соединенные мостиками или спироциклические циклические системы.
[0018] Термин «галоген» или «гало», как используют в настоящем документе, обозначает F, Cl, Br или I.
[0019] Если не указано иначе, термин «гетероцикл», «гетероциклил», «гетероциклоалифатический», «гетероциклоалкил», или «гетероциклический», как используют в настоящем документе, обозначает неароматические, моноциклические, бициклические или трициклические циклические системы, в которых один или несколько атомов кольца в одном или нескольких кольцевых членов представляет собой независимо выбранный гетероатом. Гетероциклическое кольцо может являться насыщенным или может содержать одну или несколько ненасыщенных связей. В некоторых вариантах осуществления «гетероцикл», «гетероциклил», «гетероциклоалифатический», «гетероциклоалкил» или «гетероциклическая» группа обладает тремя – четырнадцатью членами кольца, в которых один или несколько членов кольца представляют собой гетероатом, независимо выбранный из кислорода, серы, азота или фосфора, и каждое кольцо в циклической системе содержит от 3 до 7 членов кольца.
[0020] Термин «гетероатом» обозначает кислород, серу, азот, фосфор или кремний (включая любую окисленную форму азота, серы, фосфора или кремния; кватернизованную форму любого основного азота или; поддающийся замещению атом азота из гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
[0021] Термин «ненасыщенный», как используют в настоящем документе, обозначает, что группа обладает одной или несколькими ненасыщенными единицами, но не является ароматической.
[0022] Термин «алкокси», или «тиоалкил», как используют в настоящем документе, относится к алкильной группе, как определено ранее, присоединенной к главной углеродной цепи посредством атома кислород («алкокси») или сера («тиоалкил»).
[0023] Термин «арил», используемый отдельно или в качестве части более крупной группы, как в «аралкил», «аралкокси», или «арилоксиалкил», относится к моноциклическим, бициклическим и трициклическим циклическим системам, обладающим всего пятью - четырнадцатью атомами углерода кольца, где по меньшей мере одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит 3-7 атомов углерода кольца. Термин «арил» можно использовать взаимозаменяемо с термином «арильное кольцо».
[0024] Термин «гетероарил», используемый отдельно или в качестве части более крупной группы, как в «гетероаралкил» или «гетероарилалкокси», относится к моноциклическим, бициклическим и трициклическим циклическим системам, обладающих пятью - четырнадцатью членами кольца, где по меньшей мере одно кольцо в системе является ароматическим, по меньшей мере одно кольцо в системе содержит один или несколько гетероатомов, и где каждое кольцо в системе содержит 3-7 членов кольца. Термин «гетероарил» можно использовать взаимозаменяемо с термином «гетероарильное кольцо» или термином «гетероароматический».
[0025] Если не указано иначе, подразумевают, что структуры, изображенные в настоящем документе, включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структуры; например, конфигурации R и S для каждого центра ассиметрии, изомеры (Z) и (E) двойной связи, и конформационные изомеры (Z) и (E). Таким образом, отдельные стереохимические изомеры а также энантиомерные, диастереомерные, и геометрические (или конформационные) смеси настоящих соединений включены в объем изобретения. Если не указано иначе, все таутомерные формы соединений по изобретению включены в объем изобретения. Таким образом, в объем изобретения включены таутомеры соединений формулы I. Структуры включают также цвиттер-ионные формы соединений или соли формулы I при необходимости.
[0026] Дополнительно, если не указано иначе, подразумевают также, что структуры, изображенные в настоящем документе, включают соединения, отличающиеся только присутствием одного или нескольких обогащенных изотопами или меченных изотопами атомов. Меченные изотопами соединения могут обладать одним или несколькими атомам, замененными на атомы, обладающие атомной массой или массовым числом, обычно обнаруживаемыми в природе. Примеры изотопов, присутствующих в соединениях формулы I, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как, но без ограничения, 2H, 3H, 13С, 14C, 15N, 18O, 17O, 35S и 18F. Конкретные меченные изотопами соединения формулы I, в дополнение к тому, что их можно использовать в качестве терапевтических средств, можно использовать также в анализах распределения в тканях лекарственного средства и/или субстрата, в качестве аналитических инструментов или в качестве зондов в других биологических анализах. В одном из аспектов настоящего изобретения, меченные тритием (например, 3H) и углеродом-14 (например, 14C) изотопы можно использовать, принимая во внимание простоту их детекции. В другом аспекте настоящего изобретения, замена одного или нескольких атомов водорода на более тяжелые изотопы, такие как дейтерий, (например, 2H), может обеспечивать определенные терапевтические преимущества.
[0027] В одном из вариантов осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R1 представляет собой H. В другом варианте осуществления R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил. В другом варианте осуществления R1 представляет собой H, CF3 или Cl. В другом варианте осуществления R1 представляет собой H или CF3.
[0028] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R2 представляет собой H. В другом варианте осуществления R2 представляет собой F. В другом варианте осуществления R2 представляет собой Cl. В другом варианте осуществления R2 представляет собой CN. В другом варианте осуществления R2 представляет собой CH3. В другом варианте осуществления R2 представляет собой CF3. В другом варианте осуществления R2 представляет собой CHF2. В другом варианте осуществления R2 представляет собой H, CF3 или Cl. В другом варианте осуществления R2 представляет собой H или CF3.
[0029] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R3 представляет собой H. В другом варианте осуществления R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3. В другом варианте осуществления R3 представляет собой H, CF3, Cl или OCF3. В другом варианте осуществления R3 представляет собой H, CF3 или Cl.
[0030] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R5 представляет собой H. В другом варианте осуществления R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0031] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R5 представляет собой H. В другом варианте осуществления R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0032] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R6 представляет собой H. В другом варианте осуществления R6 представляет собой F. В другом варианте осуществления R6 представляет собой Cl. В другом варианте осуществления R6 представляет собой H или F.
[0033] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R6 представляет собой H. В другом варианте осуществления R6 представляет собой F. В другом варианте осуществления R6 представляет собой Cl. В другом варианте осуществления R6 представляет собой H или F.
[0034] В другом варианте осуществления изобретение относится к соединению формулы I и сопутствующим определениям, где R7 представляет собой H. В другом варианте осуществления R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления, R7 представляет собой OCHF2. В другом варианте осуществления R7 представляет собой F, Cl, OCH3 или OCF3. В другом варианте осуществления R7 представляет собой F или OCH3.
[0035] В другом аспекте изобретение относится к соединению формулы I-A:

I-A
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R2 представляет собой F, Cl, CN, CH3, CF3 или CHF2; и
R7 представляет собой F, CI, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0036] В одном из вариантов осуществления изобретение относится к соединению формулы I-A и сопутствующим определениям, где R2 представляет собой F. В другом варианте осуществления R2 представляет собой Cl. В другом варианте осуществления R2 представляет собой CN. В другом варианте осуществления R2 представляет собой CH3. В другом варианте осуществления R2 представляет собой CF3. В другом варианте осуществления R2 представляет собой CHF2.
[0037] В другом варианте осуществления изобретение относится к соединению формулы I-A и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3, В другом варианте осуществления R7 представляет собой ОСH2СН3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0038] В другом аспекте изобретение относится к соединению формулы I-B:

I-B
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0039] В одном из вариантов осуществления изобретение относится к соединению формулы I-B и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0040] В другом варианте осуществления изобретение относится к соединению формулы I-B и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой OCH(CH3)2. В другом варианте осуществления R7 представляет собой F, Cl, OCHF2.
[0041] В другом аспекте изобретение относится к соединению формулы I-C:

I-C
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R1 представляет собой Cl, CH3, CF3 или циклопропил;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; и
R7 представляет собой F, Cl, OCH3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0042] В одном из вариантов осуществления изобретение относится к соединению формулы I-C и сопутствующим определениям, где R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил.
[0043] В другом варианте осуществления изобретение относится к соединению формулы I-C и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления, R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0044] В другом варианте осуществления изобретение относится к соединению формулы I-C и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой OCH(CH3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0045] В другом аспекте изобретение относится к соединению формулы I-D:

I-D
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R2 представляет собой F, Cl, CN, CH3, CF3 или CHF2;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0046] В одном из вариантов осуществления изобретение относится к соединению формулы I-D и сопутствующим определениям, где R2 представляет собой F. В другом варианте осуществления R2 представляет собой Cl. В другом варианте осуществления R2 представляет собой CN. В другом варианте осуществления R2 представляет собой CH3. В другом варианте осуществления R2 представляет собой CF3. В другом варианте осуществления R2 представляет собой CHF2. В другом варианте осуществления R2 представляет собой Cl или CF3.
[0047] В другом варианте осуществления изобретение относится к соединению формулы I-D и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2. В другом варианте осуществления R5 представляет собой F, Cl, CH3 или OCH3.
[0048] В другом варианте осуществления изобретение относится к соединению формулы I-D и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2. В другом варианте осуществления R7 представляет собой F, Cl, OCH3 или OCF3.
[0049] В другом аспекте изобретение относится к соединению формулы I-Е:

I-Е
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0050] В одном из вариантов осуществления изобретение относится к соединению формулы 1-Е и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3. В другом варианте осуществления R3 представляет собой Cl, CF3 или OCF3.
[0051] В другом варианте осуществления изобретение относится к соединению формулы I-Е и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2. В другом варианте осуществления R5 представляет собой F, Cl, CH3 или OCH3.
[0052] В другом варианте осуществления изобретение относится к соединению формулы I-Е и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой OCH(CH3)2. В другом варианте осуществления R7 представляет собой OCHF2. В другом варианте осуществления R7 представляет собой F, Cl, OCH3 или OCF3.
[0053] В другом аспекте изобретение относится к соединению формулы I-F:
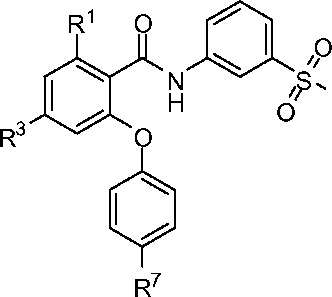
I-F
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R1 представляет собой Cl, CH3, CF3 или циклопропил;
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0054] В одном из вариантов осуществления изобретение относится к соединению формулы I-F и сопутствующим определениям, где R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил.
[0055] В другом варианте осуществления изобретение относится к соединению формулы I-F и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0056] В другом варианте осуществления изобретение относится к соединению формулы I-F и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой OCH(CH3)2. В другом варианте осуществления R7 OCHF2.
[0057] В другом аспекте изобретение относится к соединению формулы I-G:
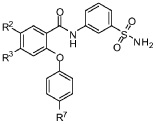
I-G
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R2 представляет собой F, Cl, CN, CH3, CF3 или CHF2;
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0058] В одном из вариантов осуществления изобретение относится к соединению формулы I-G и сопутствующим определениям, где R2 представляет собой F. В другом варианте осуществления R2 представляет собой Cl. В другом варианте осуществления R2 представляет собой CN. В другом варианте осуществления R2 представляет собой CH3. В другом варианте осуществления R2 представляет собой CF3. В другом варианте осуществления R2 представляет собой CHF2.
[0059] В другом варианте осуществления изобретение относится к соединению формулы I-G и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0060] В другом варианте осуществления изобретение относится к соединению формулы I-G и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой OCH(CH3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0061] В другом аспекте изобретение относится к соединению формулы I-H:

I-H
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R1 представляет собой Cl, CH3, CF3 или циклопропил;
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0062] В одном из вариантов осуществления изобретение относится к соединению формулы I-H и сопутствующим определениям, где R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил.
[0063] В другом варианте осуществления изобретение относится к соединению формулы I-H и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0064] В другом варианте осуществления изобретение относится к соединению формулы I-H и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой ОСH2СН3. В другом варианте осуществления R5 представляет собой ОСH2СH2СН3. В другом варианте осуществления R5 представляет собой OCHF2.
[0065] В другом варианте осуществления изобретение относится к соединению формулы I-H и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой ОСH2СН3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0066] В другом аспекте изобретение относится к соединению формулы I-J:
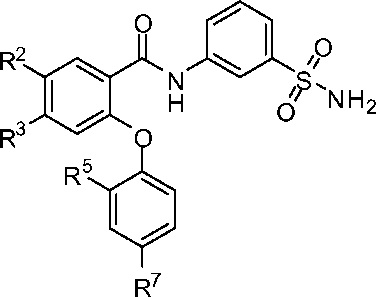
I-J
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R2 представляет собой F, Cl, CN, CH3, CF3 или CHF2;
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0067] В одном из вариантов осуществления изобретение относится к соединению формулы I-J и сопутствующим определениям, где R2 представляет собой F. В другом варианте осуществления R2 представляет собой Cl. В другом варианте осуществления R2 представляет собой CN. В другом варианте осуществления R2 представляет собой CH3. В другом варианте осуществления R2 представляет собой CF3. В другом варианте осуществления R2 представляет собой CHF2.
[0068] В другом варианте осуществления изобретение относится к соединению формулы I-J и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0069] В другом варианте осуществления изобретение относится к соединению формулы I-J и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой ОСH2СН3. В другом варианте осуществления R5 представляет собой ОСH2СH2СН3. В другом варианте осуществления R5 представляет собой OCHF2.
[0070] В другом варианте осуществления изобретение относится к соединению формулы I-J и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой ОСH2СН3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0071] В другом аспекте изобретение относится к соединению формулы I-K
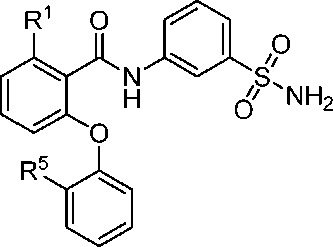
I-K
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R1 представляет собой Cl, CH3, CF3 или циклопропил; и
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
[0072] В другом варианте осуществления изобретение относится к соединению формулы I-K и сопутствующим определениям, где R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил.
[0073] В другом варианте осуществления изобретение относится к соединению формулы I-K и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0074] В другом аспекте изобретение относится к соединению формулы I-L

I-L
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R6 представляет собой F или CI; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0075] В другом варианте осуществления изобретение относится к соединению формулы I-L и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0076] В другом варианте осуществления изобретение относится к соединению формулы I-L и сопутствующим определениям, где R6 представляет собой F. В другом варианте осуществления R6 представляет собой Cl.
[0077] В другом варианте осуществления изобретение относится к соединению формулы I-L и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0078] В другом аспекте изобретение относится к соединению формулы I-M

I-M
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3; и
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2.
[0079] В другом варианте осуществления изобретение относится к соединению формулы I-M и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0080] В другом варианте осуществления изобретение относится к соединению формулы I-M и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0081] В другом аспекте изобретение относится к соединению формулы I-N

I-N
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
и R6 представляет собой F или Cl.
[0082] В другом варианте осуществления изобретение относится к соединению формулы I-N и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0083] В другом варианте осуществления изобретение относится к соединению формулы I-N и сопутствующим определениям, где R5 представляет собой F. В другом варианте осуществления R5 представляет собой Cl. В другом варианте осуществления R5 представляет собой CH3. В другом варианте осуществления R5 представляет собой OCH3. В другом варианте осуществления R5 представляет собой OCH2CH3. В другом варианте осуществления R5 представляет собой OCH2CH2CH3. В другом варианте осуществления R5 представляет собой OCHF2.
[0084] В другом варианте осуществления изобретение относится к соединению формулы I-N и сопутствующим определениям, где R6 представляет собой F. В другом варианте осуществления R6 представляет собой Cl.
[0085] В другом аспекте изобретение относится к соединению формулы I-O

I-O
или его фармацевтически приемлемой соли,
где, независимо для каждого появления:
R1 представляет собой Cl, CH3, CF3 или циклопропил;
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R6 представляет собой F, или CI; и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
[0086] В другом варианте осуществления изобретение относится к соединению формулы I-O и сопутствующим определениям, где R1 представляет собой Cl. В другом варианте осуществления R1 представляет собой CH3. В другом варианте осуществления R1 представляет собой CF3. В другом варианте осуществления R1 представляет собой циклопропил.
[0087] В другом варианте осуществления изобретение относится к соединению формулы I-O и сопутствующим определениям, где R3 представляет собой F. В другом варианте осуществления R3 представляет собой Cl. В другом варианте осуществления R3 представляет собой CN. В другом варианте осуществления R3 представляет собой CF3. В другом варианте осуществления R3 представляет собой OCF3. В другом варианте осуществления R3 представляет собой CF2CF3.
[0088] В другом варианте осуществления изобретение относится к соединению формулы I-O и сопутствующим определениям, где R6 представляет собой F. В другом варианте осуществления R6 представляет собой Cl.
[0089] В другом варианте осуществления изобретение относится к соединению формулы I-O и сопутствующим определениям, где R7 представляет собой F. В другом варианте осуществления R7 представляет собой Cl. В другом варианте осуществления R7 представляет собой OCH3. В другом варианте осуществления R7 представляет собой OCF3. В другом варианте осуществления R7 представляет собой OCH2CH3. В другом варианте осуществления R7 представляет собой ОСН(СН3)2. В другом варианте осуществления R7 представляет собой OCHF2.
[0090] В другом варианте осуществления изобретение относится к соединению формулы I, где соединение или его фармацевтически приемлемая соль выбраны из таблицы 1. Наименования соединений в таблице 1 получали с использованием ChemBioDrawUltra версии 12.0 из Cambridge Soft/Chem office 2010.
Номера, структуры и химические наименования соединений

2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид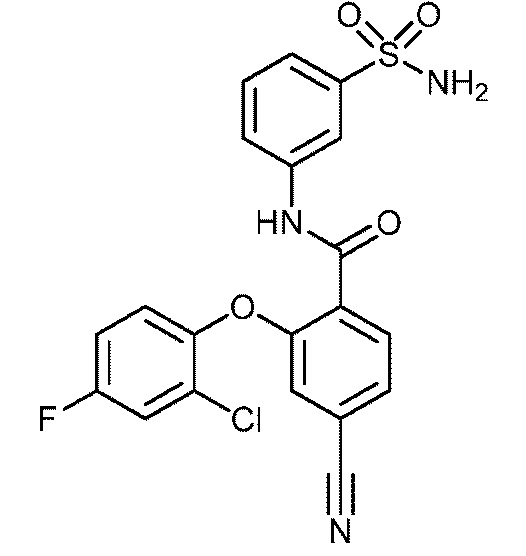
2-(2-хлор-4-фторфенокси)-4-циано-N-(3-сульфамоилфенил)бензамид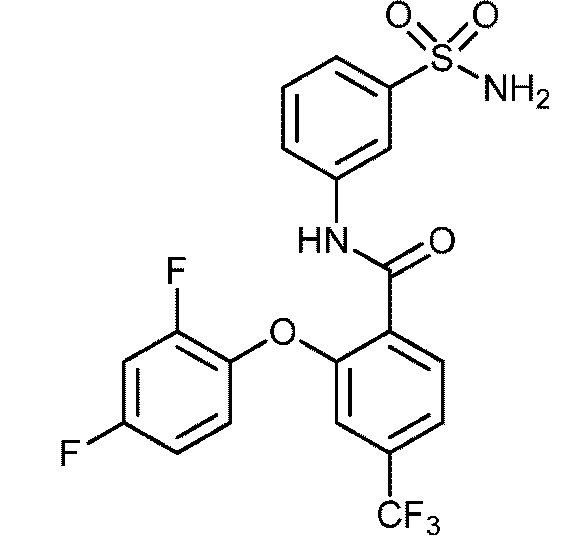
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
5-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид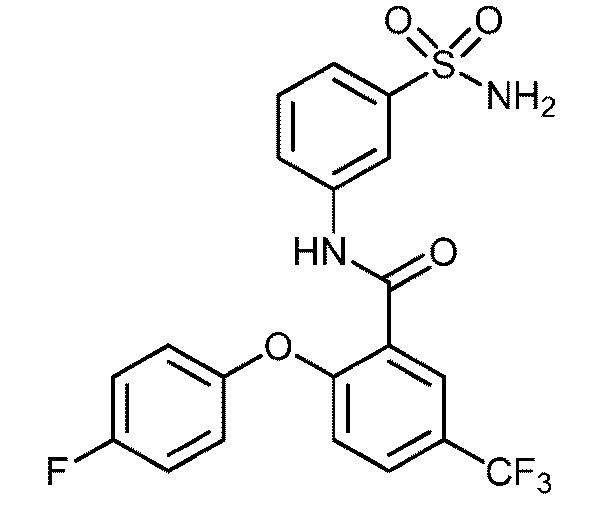
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид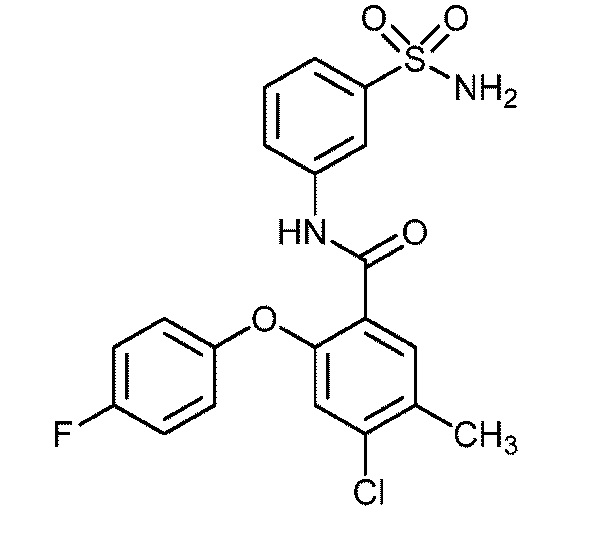
4-хлор-2-(4-фторфенокси)-5-метил-N-(3-сульфамоилфенил)бензамид
4-циано-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
4-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид
2-(2-хлор-4-фторфенокси)-5-циано-N-(3-сульфамоилфенил)бензамид
4-циано-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)-бензамид
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид
5-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
5-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид
4-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид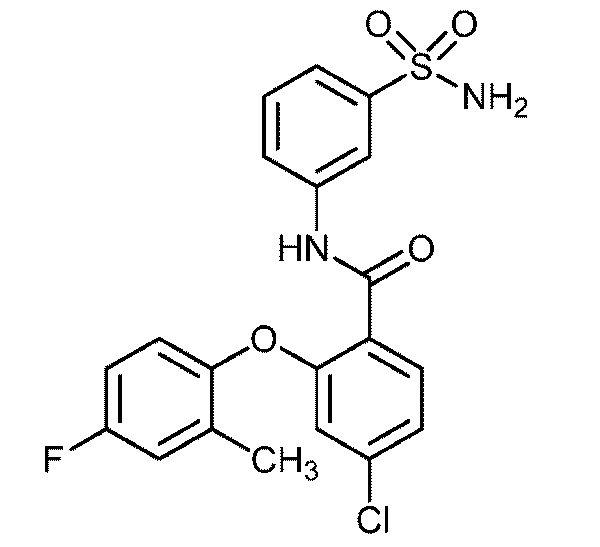
4-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид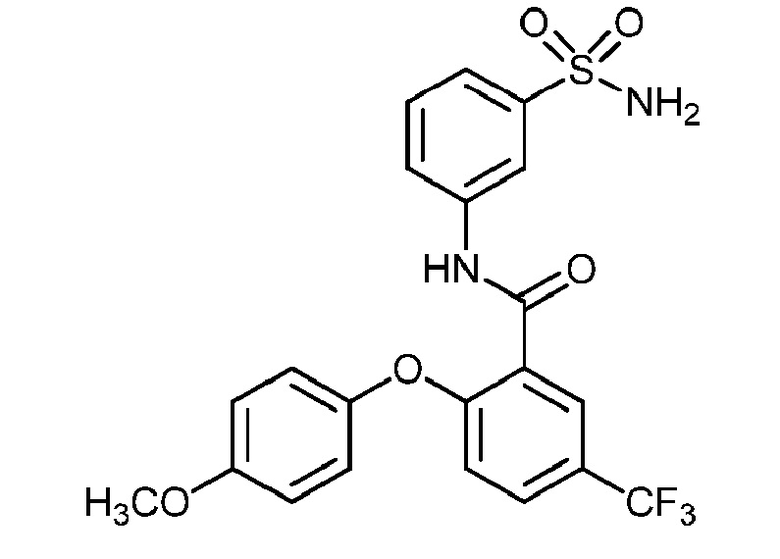
2-(4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
5-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид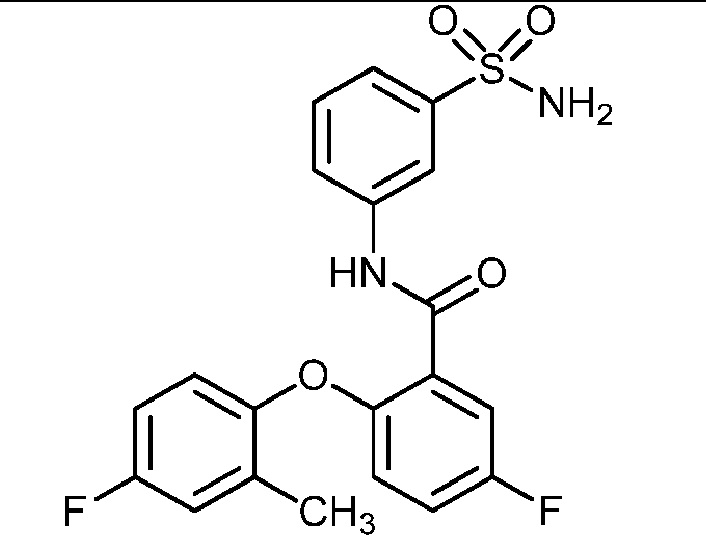
5-фтор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-хлорфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид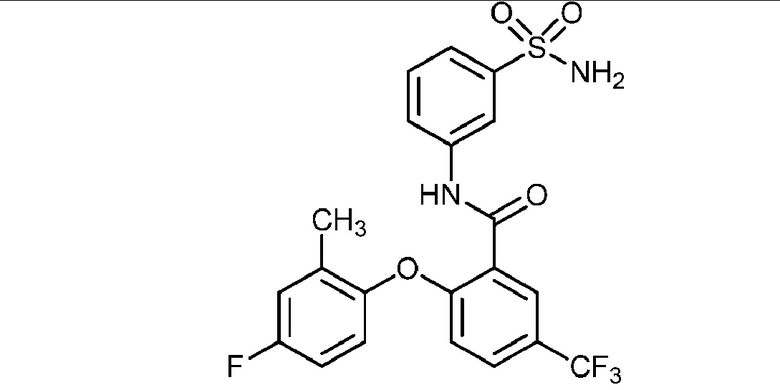
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид

N-(3-сульфамоилфенил)-2-(O-толилокси)-5-(трифторметил)бензамид
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид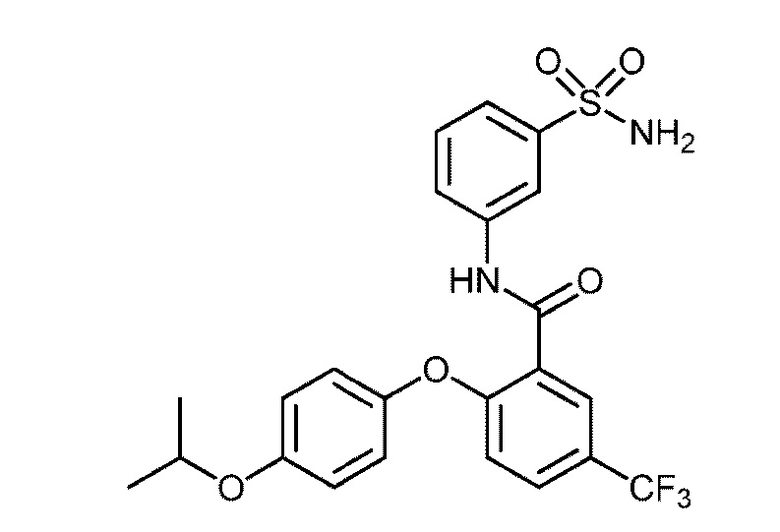
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2-хлор-4-фторфенокси)-6-метил-N-(3-сульфамоилфенил)бензамид

N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-5-(трифторметил)бензамид
2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамид
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(4-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(2-пропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид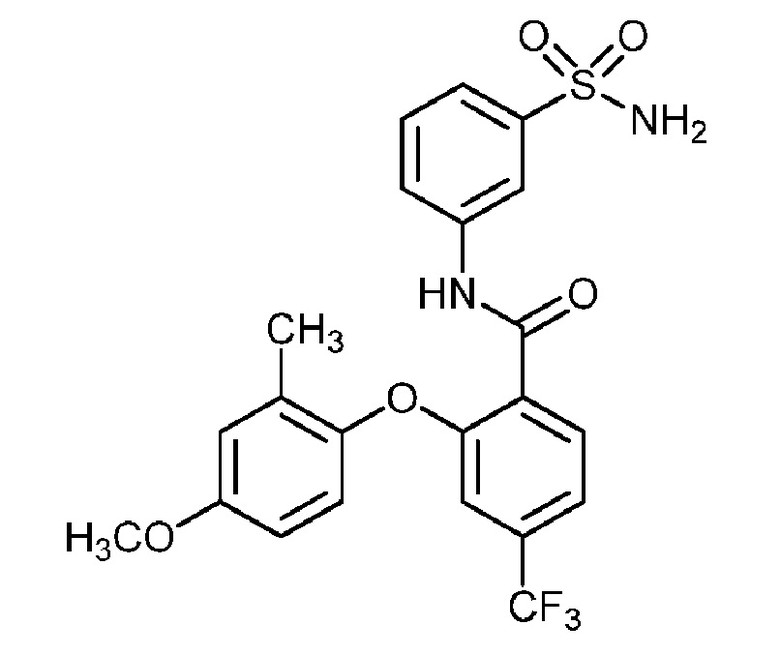
2-(4-метокси-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
N-(3-сульфамоилфенил)-2-(O-толилокси)-4-(трифторметил)бензамид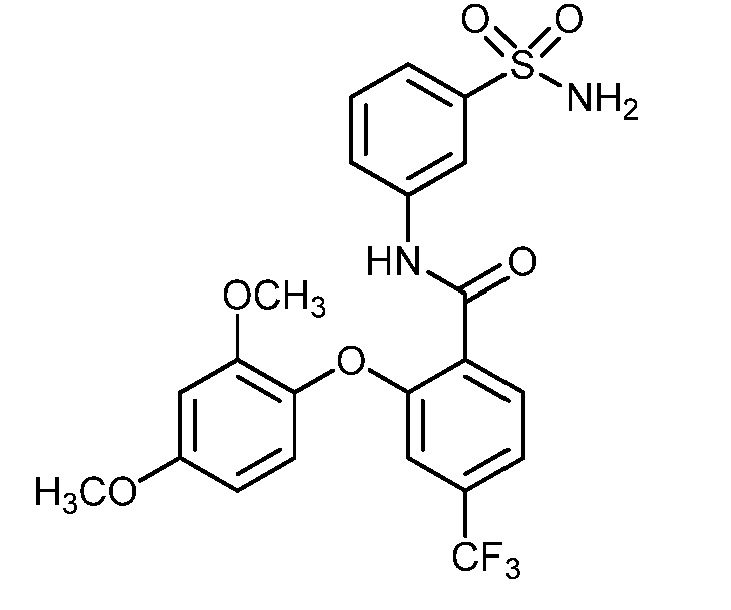
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид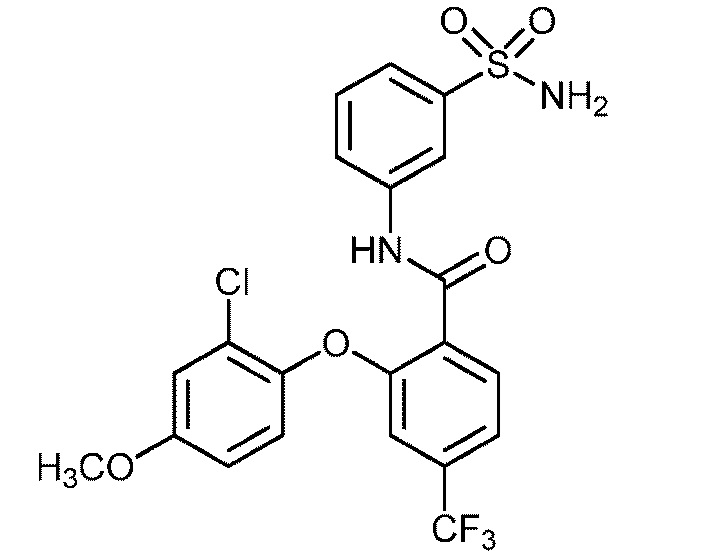
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-4-(трифторметил)бензамид
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид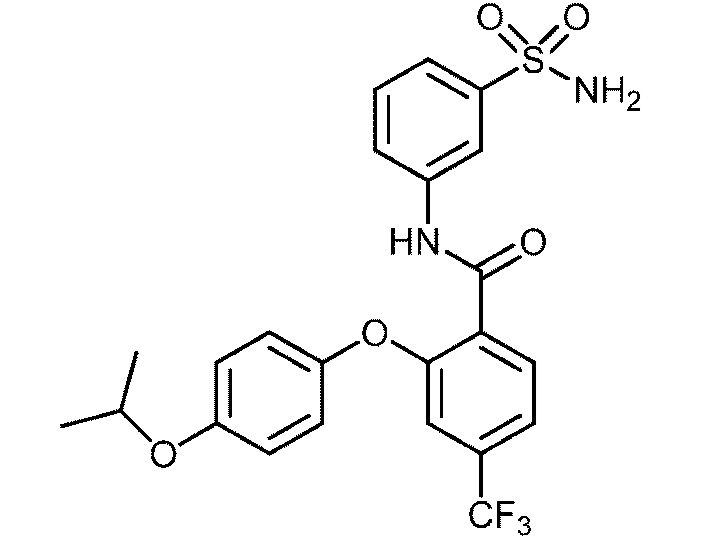
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид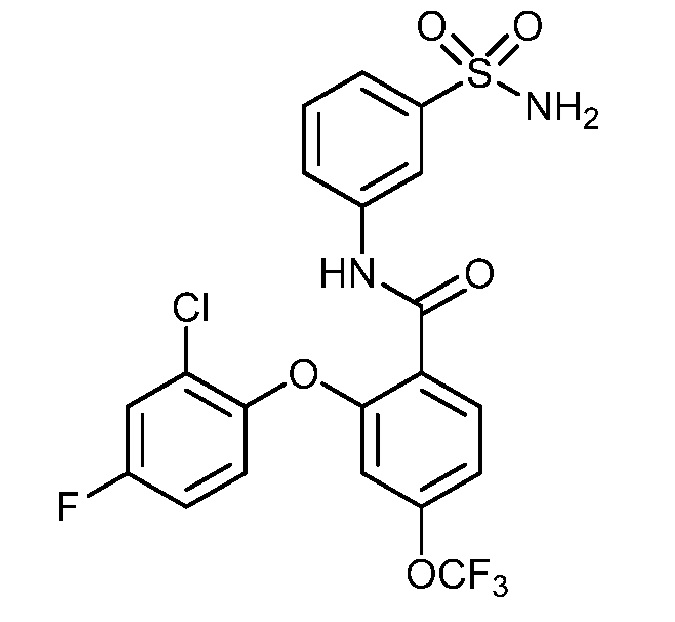
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид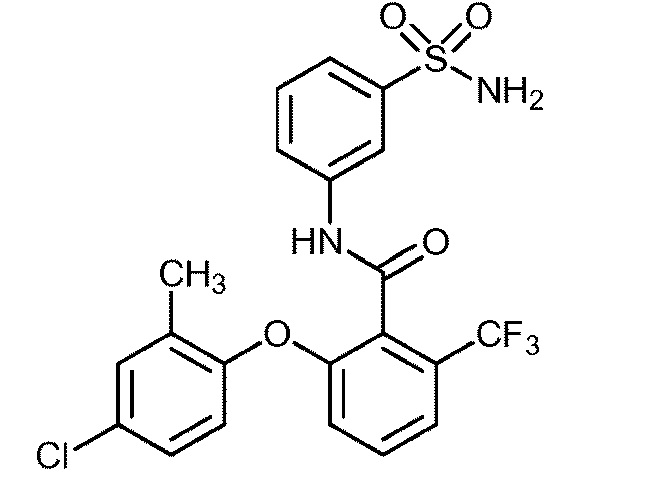
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид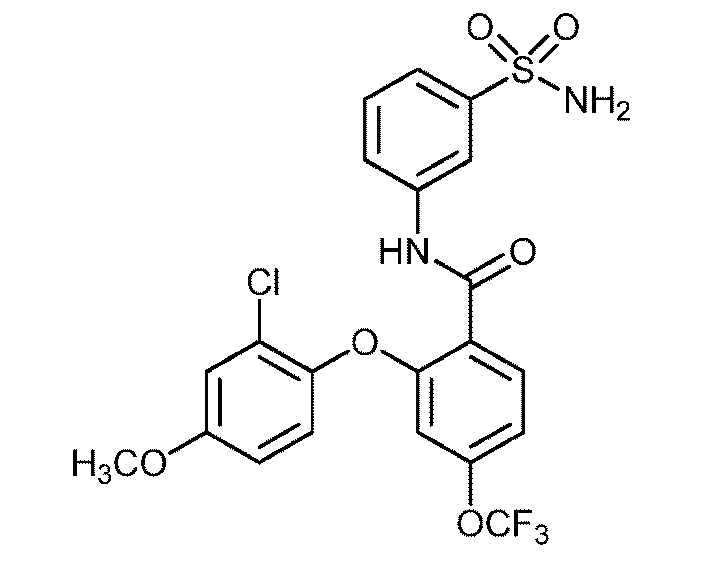
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
2-(3-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид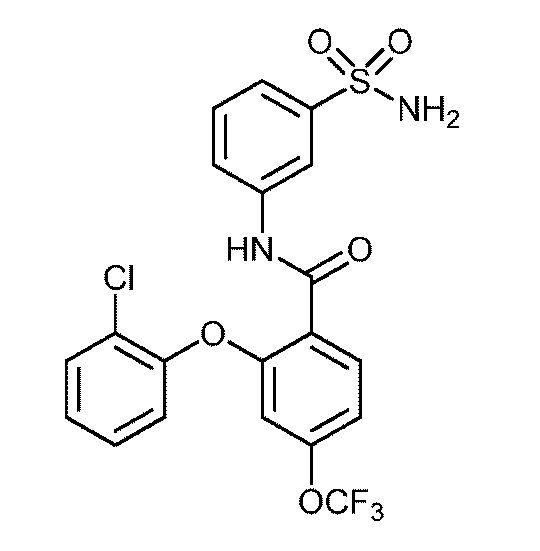
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-6-(трифторметил)бензамид
2-(2-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид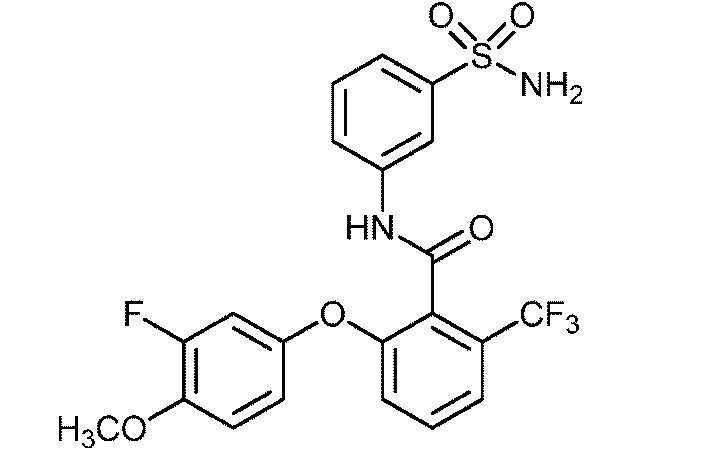
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид
2-(4-фторфенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид
2-(3-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид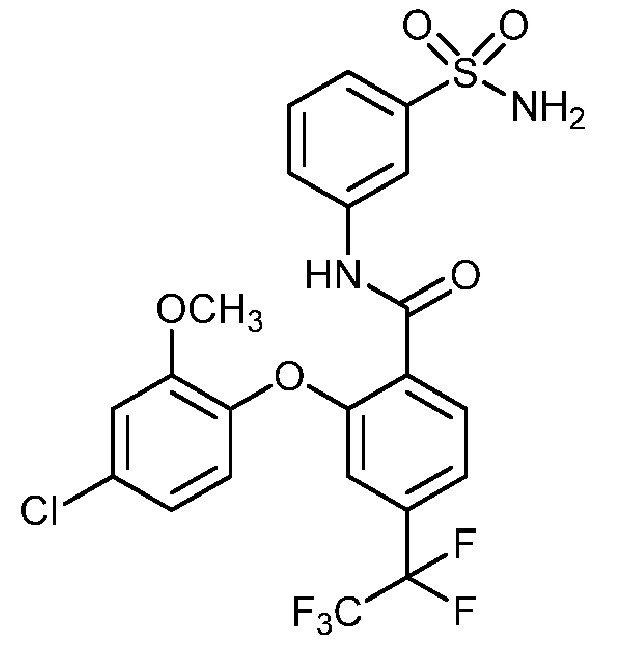
2-(4-хлор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид
2-(2-хлор-4-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид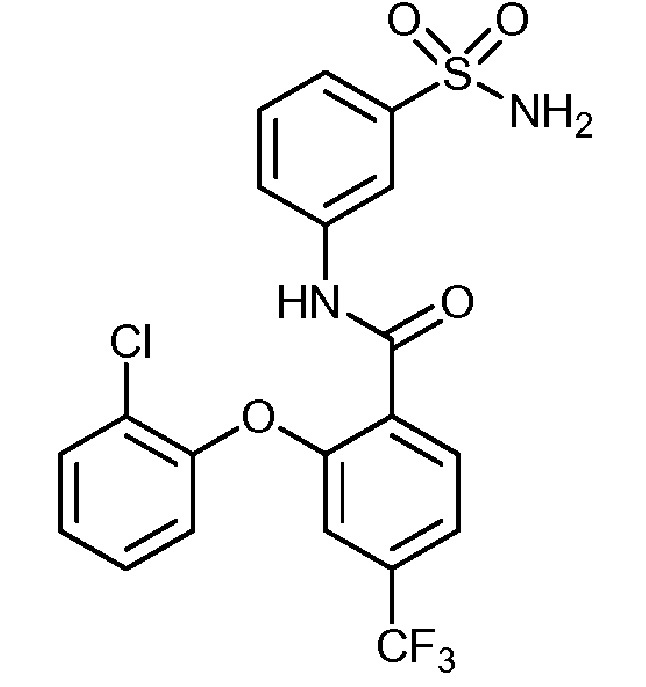
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
4,5-дихлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид
4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид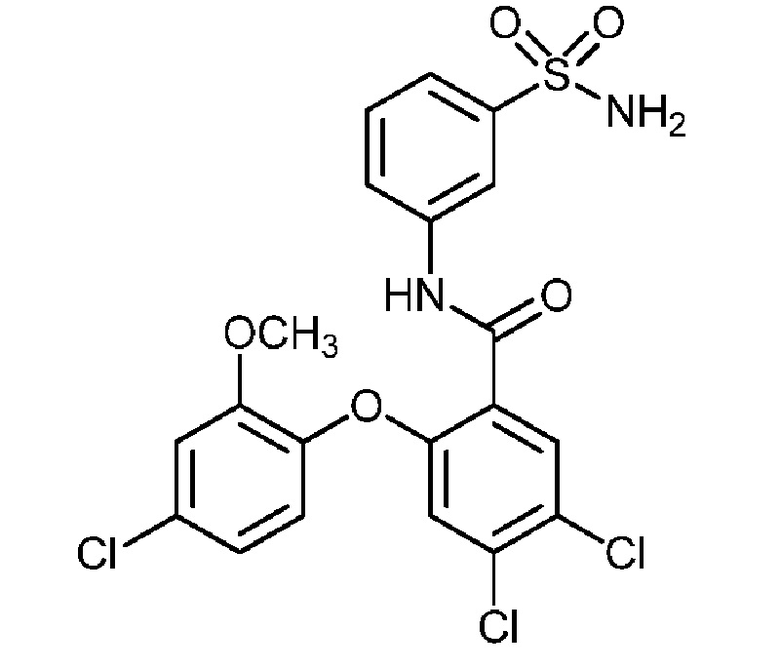
4,5-дихлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид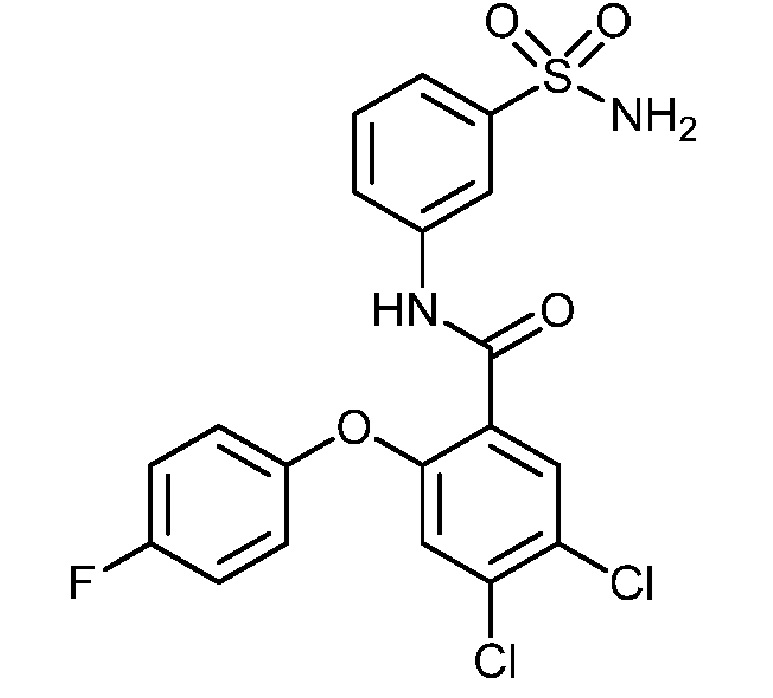
4,5-дихлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид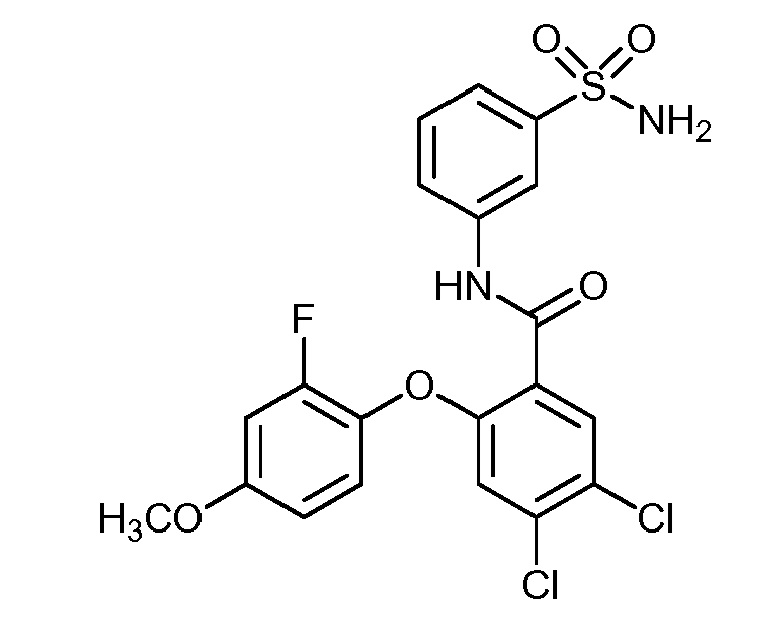
4,5-дихлор-2-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
4,5-дихлор-2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
4,5-дихлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
4,5-дихлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид
4-хлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
4-хлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид
4-хлор-2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)бензамид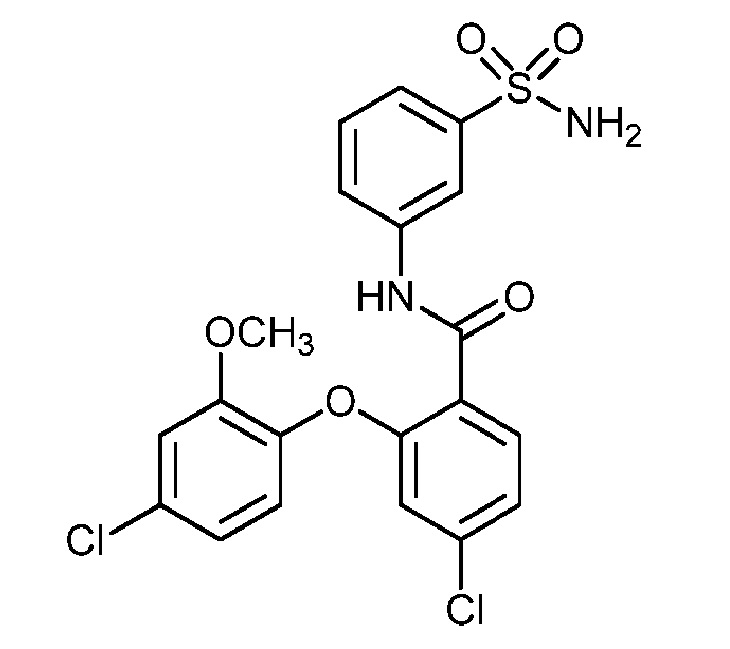
4-хлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид
2-(5-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид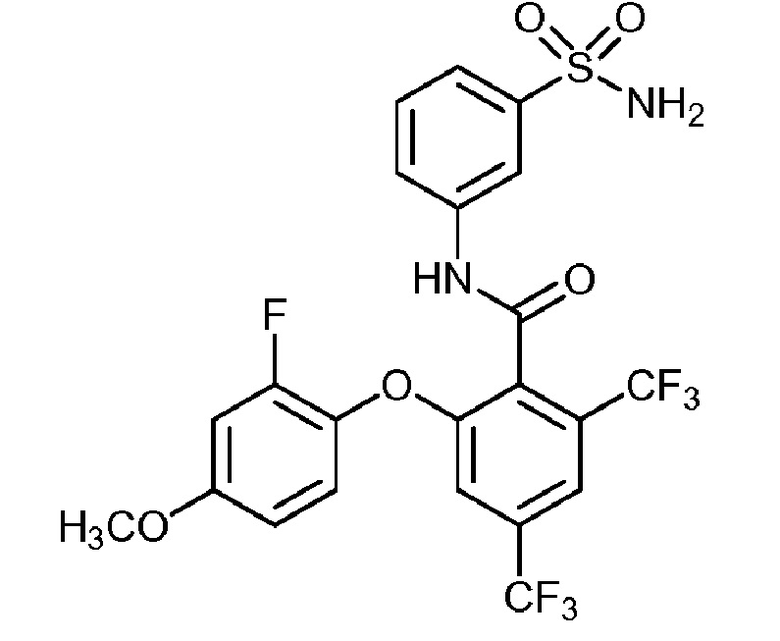
2-(2-фтор-4-метоксифенокси)-
N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид
2,4-дихлор-6-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид
2,4-дихлор-6-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2,4-дихлор-6-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2,4-дихлор-6-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2,4-дихлор-6-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид
2,4-дихлор-N-(3-сульфамоилфенил)-6-(4-(трифторметокси)фенокси)бензамид
2-циклопропил-6-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид
[0092] В одном из вариантов осуществления соединение представляет собой 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[0093] В другом варианте осуществления соединение представляет собой 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[0094] В другом варианте осуществления соединение представляет собой 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[0095] В другом варианте осуществления соединение представляет собой 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[0096] В другом варианте осуществления соединение представляет собой 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[0097] В другом варианте осуществления соединение представляет собой 2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[0098] В другом варианте осуществления соединение представляет собой 2-(4-фторфенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[0099] В другом варианте осуществления соединение представляет собой 2-(4-хлор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00100] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[00101] В другом варианте осуществления соединение представляет собой 5-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00102] В другом варианте осуществления соединение представляет собой 4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00103] В другом варианте осуществления соединение представляет собой 2,4-дихлор-6-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00104] В другом варианте осуществления соединение представляет собой 2,4-дихлор-6-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00105] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид или его фармацевтически приемлемую соль.
[00106] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид или его фармацевтически приемлемую соль.
[00107] В другом варианте осуществления соединение представляет собой 5-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00108] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид или его фармацевтически приемлемую соль.
[00109] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид или его фармацевтически приемлемую соль.
[00110] В другом варианте осуществления соединение представляет собой 4,5-дихлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00111] В другом варианте осуществления соединение представляет собой 2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00112] В другом варианте осуществления соединение представляет собой 5-фтор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00113] В другом варианте осуществления соединение представляет собой 2-(2-хлор-4-фторфенокси)-4-циано-N-(3-сульфамоилфенил)бензамид или его фармацевтически приемлемую соль.
[00114] В другом варианте осуществления соединение представляет собой N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-4-(трифторметил)бензамид.
Соли, композиции, применения, состав, введение и дополнительные средства
Фармацевтически приемлемые соли и композиции
[00115] Как обсуждают в настоящем документе, изобретение относится к соединениям, являющимся ингибиторами потенциалозависимых натриевых каналов, и таким образом, настоящие соединения можно использовать для лечения заболеваний, нарушений и состояний, включая в качестве неограничивающих примеров хроническую боль, боль в кишечнике, нейропатическую боль, костно-мышечную боль, острую боль, воспалительную боль, боль при злокачественной опухоли, идиопатическую боль, рассеянный склероз, синдром Шарко-Мари-Тута, недержание или аритмию сердца. Соответственно, в другом аспекте изобретение относится к фармацевтически приемлемым композициям, где эти композиции содержат любое из соединений, как описано в настоящем документе, и необязательно, содержат фармацевтически приемлемый носитель, вспомогательное средство или связующее. В определенных вариантах осуществления эти композиции, необязательно, дополнительно содержат один или несколько дополнительных терапевтических средств. В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли и один или несколько фармацевтически приемлемых носителей или связующих.
[00116] Следует также понимать, что определенные из соединений по изобретению могут существовать в свободной форме для лечения, или при необходимости, в форме их фармацевтически приемлемого производного. По изобретению, фармацевтически приемлемое производное включает, но без ограничения фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров, или любой другой аддукт или производное, которое при введении нуждающемуся в этом субъекту способно обеспечивать, напрямую или опосредованно, соединение, как иным образом описано в настоящем документе, или его метаболит или остаток.
[00117] Как используют в настоящем документе, термин «фармацевтически приемлемая соль» относится к тем солям, которые, в рамках здравого медицинского суждения, являются пригодными для использования в контакте с тканями человека и низших животных, без чрезмерной токсичности, раздражения, аллергической реакции и т.п., и соразмерными с разумным соотношением польза/риск. «Фармацевтически приемлемая соль» обозначает любую нетоксичную соль или соль сложного эфира соединения по настоящему изобретению, которая, при введении реципиенту способна обеспечивать, напрямую или опосредованно, соединение по настоящему изобретению или его метаболит или остаток с ингибирующей активностью. Как используют в настоящем документе, термин «его метаболит или остаток с ингибирующей активностью» означает, что его метаболит или остаток также является ингибитором потенциалозависимого натриевого канала.
[00118] Фармацевтически приемлемые соли хорошо известны в данной области. Например, S. M. Berge, et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, содержание которого включено в настоящий документ в качестве ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминогруппы, сформированные с помощью неорганических кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с помощью органических кислот, таких как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают соли адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, иодогидрат, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталенсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п. Соли, полученные из подходящих оснований, включают соли щелочного металла, щелочноземельного металла, аммония и N+(C1-4 алкила)4. По этому изобретению предусмотрена также кватернизация любых основных содержащих азот групп из соединений, описываемых в настоящем документе. Растворимые или поддающиеся диспергированию в воде или масле продукты можно получать посредством такой кватернизации. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.п. Дополнительные фармацевтически приемлемые соли включают, при необходимости, нетоксичные катионы аммония, четвертичного аммония, и амина, сформированные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
[00119] Как описано в настоящем документе, фармацевтически приемлемые композиции по изобретению дополнительно содержат фармацевтически приемлемый носитель, вспомогательное средство или связующее, которые, как используют в настоящем документе, включают все без исключения растворители, разбавители, или другие жидкие связующие, облегчающие диспергирование или суспендирование средства, поверхностно-активные средства, средства для придания изотоничности, загустители или эмульгаторы, консерванты, твердые связывающие средства, смазочные средства и т.п., какие подходят для конкретной желательной лекарственной формы. В Remington’s Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Па., 1980) описаны различные носители, используемые для составления фармацевтически приемлемых композиций, и известные способы их получения. За исключением случаев, когда какая-либо общепринятая среда-носитель является несовместимой с соединениями по изобретению, например, из-за оказания какого-либо нежелательного биологического действия или иного взаимодействия неблагоприятным образом с любым другим компонентом(компонентами) фармацевтически приемлемой композиции, предусматривают, что ее использование включено в объем настоящего изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но без ограничения, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, или сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, двузамещенный фосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и растворы фосфатного буфера, а также другие нетоксичные совместимые смазочные средства, такие как лаурилсульфат натрия и стеарат магния, а также красители, средства для высвобождения, покрывающие средства, подсластители, придающие вкус и запах средства, консерванты и антиоксиданты, также могут присутствовать в композиции, в соответствии с суждением составителя.
[00120] В другом аспекте изобретение относится к фармацевтической композиции, содержащей соединение по изобретению и фармацевтически приемлемый носитель.
[00121] В другом аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения или его фармацевтически приемлемой соли из соединений формулы I и одно или несколько фармацевтически приемлемых носителей или связующих.
Применения соединений и фармацевтически приемлемых солей и композиций
[00122] В другом аспекте изобретение относится к способу ингибирования потенциалозависимого натриевого канала у субъекта, включающему введение субъекту соединения формулы I или его фармацевтически приемлемой соли или фармацевтической композиции. В другом аспекте потенциалозависимый натриевый канал представляет собой NaV1.8.
[00123] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, рассеянного склероза, синдрома Шарко-Мари-Тута, недержания или аритмии сердца, включающему введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00124] В другом аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, рассеянного склероза, синдрома Шарко-Мари-Тута, недержания или аритмии сердца, включающему введение эффективного количества соединения или его фармацевтически приемлемой соли, или фармацевтической композиции из соединений формулы I.
[00125] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта боли в кишечнике, где боль в кишечнике включает боль при воспалительном заболевании кишечника, боль при болезни Крона или боль при интерстициальном цистите.
[00126] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта нейропатической боли, где нейропатическая боль включает постгерпетическую невралгию, диабетическую невралгию, болезненную ассоциированную с ВИЧ сенсорную нейропатию, невралгию тройничного нерва, синдром жжения рта, боль после ампутации, фантомную боль, болезненную неврому; травматическую неврому; неврому Мортона; повреждение с защемлением нерва, спинальный стеноз, синдром запястного канала, радикулит, ишиас; повреждение с разрывом нерва, повреждение с разрывом плечевого сплетения; комплексный регионарный болевой синдром, невралгию, индуцированную терапией с использованием лекарственного средства, невралгию, индуцированную химиотерапией злокачественной опухоли, невралгию, индуцированную терапией против ретровирусов; боль после повреждения спинного мозга, идиопатическую нейропатию малых волокон, идиопатическую сенсорную нейропатию или тригеминальную автономную цефалгию.
[00127] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта костно-мышечной боли, где костно-мышечная боль включает боль при остеоартрите, позвоночную боль, вызванную холодом боль, боль при ожоге или зубную боль.
[00128] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта идиопатической боли, где идиопатическая боль включает боль при фибромиалгии.
[00129] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта воспалительной боли, где воспалительная боль включает боль при ревматоидном артрите или вульводинию.
[00130] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, рассеянного склероза, синдрома Шарко-Мари-Тута, недержания или аритмии сердца, включающему введение эффективного количества соединения или его фармацевтически приемлемой соли, или фармацевтической композиции из соединений формулы I с одним или несколькими дополнительными терапевтическими средствами, вводимыми во время, до или после лечения с помощью соединения или фармацевтической композиции.
[00131] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта боли в кишечнике, где боль в кишечнике включает боль при воспалительном заболевании кишечника, боль при болезни Крона или боль при интерстициальном цистите, где указанный способ включает введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00132] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта нейропатической боли, где нейропатическая боль включает постгерпетическую невралгию, диабетическую невралгию, болезненную ассоциированную с ВИЧ сенсорную нейропатию, невралгию тройничного нерва, синдром жжения рта, боль после ампутации, фантомную боль, болезненную неврому; травматическую неврому; неврому Мортона; повреждение с защемлением нерва, спинальный стеноз, синдром запястного канала, радикулит, ишиас; повреждение с разрывом нерва, повреждение с разрывом плечевого сплетения; комплексный регионарный болевой синдром, невралгию, индуцированную терапией с использованием лекарственного средства, невралгию, индуцированную химиотерапией злокачественной опухоли, невралгию, индуцированную терапией против ретровирусов; боль после повреждения спинного мозга, идиопатическую нейропатию малых волокон, идиопатическую сенсорную нейропатию или тригеминальную автономную цефалгию, где указанный способ включает введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00133] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта костно-мышечной боли, где костно-мышечная боль включает боль при остеоартрите, позвоночную боль, вызванную холодом боль, боль при ожоге или зубную боль, где указанный способ включает введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00134] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта воспалительной боли, где воспалительная боль включает боль при ревматоидном артрите или вульводинию, где указанный способ включает введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00135] В еще одном аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта идиопатической боли, где идиопатическая боль включает боль при фибромиалгии, где указанный способ включает введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00136] В еще одном аспекте изобретение относится к способу, где субъекта лечат с помощью одного или нескольких дополнительных терапевтических средств, вводимых во время, до или после лечения с помощью эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00137] В другом аспекте изобретение относится к способу ингибирования потенциалозависимого натриевого канала у субъекта, включающему введение субъекту эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I. В другом аспекте потенциалозависимый натриевый канал представляет собой NaV 1.8.
[00138] В другом аспекте изобретение относится к способу ингибирования потенциалозависимого натриевого канала в биологическом образце, включающему приведение в контакт биологического образца с эффективным количеством соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I. В другом аспекте потенциалозависимый натриевый канал представляет собой NaV1.8.
[00139] В другом аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта острой боли, хронической боли, нейропатической боли, воспалительной боли, артрита, мигрени, кластерных головных болей, невралгии тройничного нерва, герпетической невралгии, общей невралгии, эпилепсии, эпилептических состояний, нейродегенеративных нарушений, психиатрических нарушений, тревожности, депрессии, биполярного расстройства, миотонии, аритмии, двигательных нарушений, нейроэндокринных нарушений, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, боли при остеоартрите, постгерпетической невралгии, диабетической нейропатии, радикулита, ишиаса, позвоночной боли, боли в голове, боли в шее, сильной боли, хронической боли, ноцицептивной боли, внезапной резкой боли, постхирургической боли, боли при злокачественной опухоли, инсульта, ишемии головного мозга, травматического повреждения головного мозга, бокового амиотрофического склероза, вызванной стрессом стенокардии, вызванной физическими нагрузками стенокардии, сильного сердцебиения, гипертензии или аномальной моторики желудочно-кишечного тракта, включающему введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00140] В другом аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта боли из-за злокачественной опухоли бедренной кости; незлокачественной хронической боли в костях; ревматоидного артрита; остеоартрита; спинального стеноза; нейропатической боли в нижней части спины; миофасциального болевого синдрома; фибромиалгии; дисфункционально-болевого синдрома височно-нижнечелюстного сустава; хронической висцеральной боли, боли в животе; боли в поджелудочной железе; боли при IBS; хронической и острой головной боли; мигрени; головной боли напряжения, кластерных головных болей; хронической и острой нейропатической боли, постгерпетической невралгии; диабетической нейропатии; ассоциированной с ВИЧ нейропатии; невралгии тройничного нерва; нейропатии Шарко-Мари-Тута; наследственных сенсорных нейропатий; повреждения периферического нерва; болезненных невром; эктопических проксимальных и дистальных разрядов; радикулопатии; индуцированной химиотерапией нейропатической боли; индуцированной лучевой терапии нейропатической боли; боли после мастэктомии; центральной боли; боли при повреждении спинного мозга; боли после инсульта; таламической боли; комплексного регионарного болевого синдрома; фантомной боли; хронической боли; острой боли, острой послеоперационной боли; острой костно-мышечной боли; боли в суставах; механической боли в нижней части спины; боли в шее; тендинита; боли при травме; боли при физическом напряжении; острой висцеральной боли; пиелонефрита; аппендицита; холецистита; непроходимости кишечника; грыжи; боли в груди, боли в сердце; тазовой боли, боли при почечной колике, острой боли при беременности, родовых схваток; боли при кесаревом сечении; острой боли при воспалении, ожоге и травме; острой периодической боли, эндометриоза; острой боли при опоясывающем лишае; серповидно-клеточной анемии; острого панкреатита; внезапной резкой боли; орофациальной боли, включая боль при синусите, зубной боли; боли при рассеянном склерозе (MS); боли при депрессии; боли при лепре; боли при болезни Бехчета; адипозалгии; боли при флебите; боли при синдроме Гийена-Барре; болезненных движений ног и пальцев; синдрома Хоглунда; боли при эритромелагии; боли при болезни Фабри; заболеваний мочевого пузыря и мочеполовых расстройств, включая недержание мочи; гиперактивности мочевого пузыря; синдрома болезненного мочевого пузыря; интерстициального цистита (IС); простатита; комплексного регионарного болевого синдрома (CRPS), типа I и типа II; генерализованной боли, пароксизмальной боли в конечностях, прурита, тиннитуса или индуцированной стенокардией боли, включающего введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I.
[00141] В другом аспекте изобретение относится к способу лечения или уменьшения тяжести у субъекта нейропатической боли, включающему введение эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции из соединений формулы I. В одном из аспектов нейропатическая боль выбрана из постгерпетической невралгии, диабетической невралгии, болезненной ассоциированной с ВИЧ сенсорной нейропатии, невралгии тройничного нерва, синдрома жжения рта, боли после ампутации, фантомной боли, болезненной невромы, травматической невромы; невромы Мортона, повреждения с защемлением нерва, спинального стеноза, синдрома запястного канала, радикулита, ишиаса, повреждения с разрывом нерва, повреждения с разрывом плечевого сплетения, комплексного регионарного болевого синдрома, невралгии, индуцированной терапией с использованием лекарственного средства, невралгии, индуцированной химиотерапией злокачественной опухоли, невралгии, индуцированной терапией против ретровирусов, боли после повреждения спинного мозга, идиопатической нейропатии малых волокон, идиопатической сенсорной нейропатии или тригеминальной автономной цефалгии.
Изготовление лекарственных средств
[00142] В одном из аспектов изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в ингибировании потенциалозависимого натриевого канала. В другом аспекте потенциалозависимый натриевый канал представляет собой NaV1.8.
[00143] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, рассеянного склероза, синдрома Шарко-Мари-Тута, недержания или аритмии сердца.
[00144] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта боли в кишечнике, где боль в кишечнике включает боль при воспалительном заболевании кишечника, боль при болезни Крона или боль при интерстициальном цистите.
[00145] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта нейропатической боли, где нейропатическая боль включает постгерпетическую невралгию, диабетическую невралгию, болезненную ассоциированную с ВИЧ сенсорную нейропатию, невралгию тройничного нерва, синдром жжения рта, боль после ампутации, фантомную боль, болезненную неврому, травматическую неврому; неврому Мортона; повреждение с защемлением нерва, спинальный стеноз, синдром запястного канала, радикулит, ишиас; повреждение с разрывом нерва, повреждение с разрывом плечевого сплетения; комплексный регионарный болевой синдром, невралгию, индуцированную терапией с использованием лекарственного средства, невралгию, индуцированную химиотерапией злокачественной опухоли, невралгию, индуцированную терапией против ретровирусов; боль после повреждения спинного мозга, идиопатическую нейропатию малых волокон, идиопатическую сенсорную нейропатию или тригеминальную автономную цефалгию.
[00146] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта костно-мышечной боли, где костно-мышечная боль включает боль при остеоартрите, позвоночную боль, вызванную холодом боль, боль при ожоге или зубную боль.
[00147] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта воспалительной боли, где воспалительная боль включает боль при ревматоидном артрите или вульводинию.
[00148] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести у субъекта идиопатической боли, где идиопатическая боль включает боль при фибромиалгии.
[00149] В еще одном аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства в комбинации с одним или несколькими дополнительными терапевтическими средствами, вводимыми во время, до или после лечения с помощью соединения или фармацевтической композиции.
[00150] В другом аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести острой боли, хронической боли, нейропатической боли, воспалительной боли, артрита, мигрени, кластерных головных болей, невралгии тройничного нерва, герпетической невралгии, общей невралгии, эпилепсии, эпилептических состояний, нейродегенеративных нарушений, психиатрических нарушений, тревожности, депрессии, биполярного расстройства, миотонии, аритмии, двигательных нарушений, нейроэндокринных нарушений, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, боли при остеоартрите, постгерпетической невралгии, диабетической нейропатии, радикулита, ишиаса, позвоночной боли, боли в голове, боли в шее, сильной боли, хронической боли, ноцицептивной боли, внезапной резкой боли, постхирургической боли, боли при злокачественной опухоли, инсульта, ишемии головного мозга, травматического повреждения головного мозга, бокового амиотрофического склероза, вызванной стрессом стенокардии, вызванной физическими нагрузками стенокардии, сильного сердцебиения, гипертензии или аномальной моторики желудочно-кишечного тракта.
[00151] В другом аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести боли из-за злокачественной опухоли бедренной кости; незлокачественной хронической боли в костях; ревматоидного артрита; остеоартрита; спинального стеноза; нейропатической боли в нижней части спины; миофасциального болевого синдрома; фибромиалгии; дисфункционально-болевого синдрома височно-нижнечелюстного сустава; хронической висцеральной боли, боли в животе; боли в поджелудочной железе; боли при IBS; хронической и острой головной боли; мигрени; головной боли напряжения, включая кластерные головные боли; хронической и острой нейропатической боли, постгерпетической невралгии; диабетической нейропатии; ассоциированной с ВИЧ нейропатии; невралгии тройничного нерва; нейропатии Шарко-Мари-Тута; наследственных сенсорных нейропатий; повреждения периферического нерва; болезненных невром; эктопических проксимальных и дистальных разрядов; радикулопатии; индуцированной химиотерапией нейропатической боли; индуцированной лучевой терапии нейропатической боли; боли после мастэктомии; центральной боли; боли при повреждении спинного мозга; боли после инсульта; таламической боли; комплексного регионарного болевого синдрома; фантомной боли; хронической боли; острой боли, острой послеоперационной боли; острой костно-мышечной боли; боли в суставах; механической боли в нижней части спины; боли в шее; тендинита; боли при травме/физическом напряжении; острой висцеральной боли; пиелонефрита; аппендицита; холецистита; непроходимости кишечника; грыжи; боли в груди, боли в сердце; тазовой боли, боли при почечной колике, острой боли при беременности, родовых схваток; боли при кесаревом сечении; острой боли при воспалении, ожоге и травме; острой периодической боли, эндометриоза; острой боли при опоясывающем лишае; серповидно-клеточной анемии; острого панкреатита; внезапной резкой боли; орофациальной боли, включая боль при синусите, зубной боли; боли при рассеянном склерозе (MS); боли при депрессии; боли при лепре; боли при болезни Бехчета; адипозалгии; боли при флебите; боли при синдроме Гийена-Барре; болезненных движений ног и пальцев; синдрома Хоглунда; боли при эритромелагии; боли при болезни Фабри; заболеваний мочевого пузыря и мочеполовых расстройств, включая недержание мочи; гиперактивности мочевого пузыря; синдрома болезненного мочевого пузыря; интерстициального цистита (IС); простатита; комплексного регионарного болевого синдрома (CRPS), типа I и типа II; генерализованной боли, пароксизмальной боли в конечностях, прурита, тиннитуса или индуцированной стенокардией боли.
[00152] В другом аспекте изобретение относится к применению соединения или фармацевтической композиции, описываемых в настоящем документе, для получения лекарственного средства для применения в лечении или уменьшении тяжести нейропатической боли. В одном из аспектов нейропатическая боль выбрана из постгерпетической невралгии, диабетической невралгии, болезненной ассоциированной с ВИЧ сенсорной нейропатии, невралгии тройничного нерва, синдрома жжения рта, боли после ампутации, фантомной боли, болезненной невромы, травматической невромы, невромы Мортона, повреждения с защемлением нерва, спинального стеноза, синдрома запястного канала, радикулита, ишиаса, повреждения с разрывом нерва, повреждения с разрывом плечевого сплетения, комплексного регионарного болевого синдрома, невралгии, индуцированной терапией с использованием лекарственного средства, невралгии, индуцированной химиотерапией злокачественной опухоли, невралгии, индуцированной терапией против ретровирусов, боли после повреждения спинного мозга, идиопатической нейропатии малых волокон, идиопатической сенсорной нейропатии или тригеминальной автономной цефалгии.
Введение фармацевтически приемлемых солей и композиций
[00153] В определенных вариантах осуществления «эффективное количество» соединения, его фармацевтически приемлемой соли или фармацевтически приемлемой композиции представляет собой количество, эффективное для лечения или уменьшения тяжести одного или нескольких из хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, рассеянного склероза, синдрома Шарко-Мари-Тута, недержания или аритмии сердца.
[00154] Соединения и композиции, в соответствии со способом по изобретению, можно вводить с использованием любого количества и любого способа введения, эффективных для лечения или уменьшения тяжести одного или нескольких из боли или не относящихся к боли заболеваний, перечисленных в настоящем документе. Точное необходимое количество может меняться от субъекта к субъекту, в зависимости от вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, способа его введения, и т.п. Соединения по изобретению предпочтительно составляют в стандартной лекарственной форме для простоты введения и однородности дозирования. Выражение «стандартная лекарственная форма», как используют в настоящем документе, относится к физически дискретной единице средства, подходящей для субъекта, подлежащего лечению. Однако следует понимать, что об общем ежесуточном использовании соединений и композиций по изобретению принимает решение лечащий врач в рамках здравого медицинского суждения. Конкретный эффективный уровень дозирования для любого конкретного субъекта или организма зависит от множества факторов, включая нарушение, подвергаемое лечению, и тяжесть нарушения; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и диету субъекта; время введения, способ введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или совместно с конкретным применяемым соединением, и подобные факторы, хорошо известные в области медицины. Термин «субъект» или «пациент», как используют в настоящем документе, обозначает животное, предпочтительно млекопитающее, и наиболее предпочтительно, человека.
[00155] Фармацевтически приемлемые композиции по настоящему изобретению можно вводить человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно (как посредством порошков, мазей, или капель), буккально, как посредством перорального или назального спрея или т.п., в зависимости от тяжести инфекции, подвергаемой лечению. В определенных вариантах осуществления соединения по изобретению можно вводить перорально или парентерально на уровнях дозирования от приблизительно 0,01 мг/кг до приблизительно 50 мг/кг и предпочтительно, от приблизительно 1 мг/кг до приблизительно 25 мг/кг массы тела субъекта в сутки, один или несколько раз в сутки, для получения желательного терапевтического эффекта.
[00156] Жидкие лекарственные формы для перорального введения включают, в качестве неограничивающих примеров, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, общепринятые в данной области, например, такие как вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как средства для смачивания, эмльгирующие и суспендирующие средства, подсластители, придающие вкус и запах средства.
[00157] Пригодные для инъекции препараты, например, стерильные пригодные для инъекции водные или масляные суспензии, можно составлять в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный пригодный для инъекции препарат также может представлять собой стерильные пригодные для инъекции раствор, суспензию или эмульсию в нетоксичном пригодном для парентерального введения разбавителе или растворителе, например, такие как раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно применять, присутствуют вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла являются общепринятыми в качестве растворителя или суспендирующей среды. Для этой цели можно применять любое безвкусное нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, используют в получении пригодных для инъекции препаратов.
[00158] Пригодные для инъекции составы можно стерилизовать, например, посредством фильтрации через задерживающий бактерии фильтр или посредством включения стерилизующих средств в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной пригодной для инъекции среде перед использованием.
[00159] Для продления эффекта соединения по изобретению, часто является желательным замедлять абсорбцию соединений из подкожной или внутримышечной инъекции. Это можно осуществлять посредством использования жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Тогда скорость абсорбции соединения зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой формы соединения осуществляют посредством растворения или суспендирования соединения в масляном носителе. Формы инъецируемого депо получают посредством формирования матриц микрокапсул соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения к полимеру и природы конкретного используемого полимера можно контролировать скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Пригодные для инъекции составы депо получают также посредством захвата соединения липосомами или микроэмульсиями, которые совместимы с тканями организма.
[00160] Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получать смешиванием соединений по настоящему изобретению с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и таким образом, плавятся в полости прямой кишки или влагалища и высвобождают активное соединение.
[00161] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах, активное соединение смешано по меньшей мере с одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дифосфат кальция, и/или a) с наполнителями или расширителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) со связывающими средствами, например, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и гуммиарабик, c) с увлажнителями, такими как глицерин, d) с дезинтегрирующими средствами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) с замедляющими растворение средствами, такими как парафин, F) с ускорителями абсорбции, такими как соединения четвертичного аммония, g) со средствами для смачивания, например, такими как цетиловый спирт и глицеринмоностеарат, H) с абсорбентами, такими как каолин и бентонитовая глина, и i) с смазочными средствами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль, лекарственная форма может также содержать забуферивающие средства.
[00162] Твердые композиции сходного типа также можно применять в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как растворимые в кишечнике покрытия и другие покрытия, хорошо известные в области получения фармацевтических составов. Они могут, необязательно, содержать средства, снижающие прозрачность, а также могут обладать таким составом, что они высвобождают активный ингредиент(ы) исключительно или преимущественно в определенном отделе кишечного тракта, необязательно, отсроченным образом. Примеры композиций для встраивания, которые можно использовать, включают полимерные вещества и воски. Твердые композиции сходного типа также можно применять в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
[00163] Активные соединения могут также присутствовать в микроинкапсулированной форме с одним или более наполнителями, как указано выше. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как растворимые в кишечнике покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области получения фармацевтических составов. В таких твердых лекарственных формах активное соединение можно смешивать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут содержать также, как в общепринятой практике, дополнительные вещества, отличные от инертных разбавителей, например, смазочные средства для формования таблеток и другие вспомогательные вещества для формования таблеток, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут также содержать забуферивающие средства. Они могут, необязательно, содержать средства, снижающие прозрачность, а также могут обладать таким составом, что они высвобождают активный ингредиент(ы) исключительно или преимущественно в определенном отделе кишечного тракта, необязательно, отсроченным образом. Примеры композиций для встраивания, которые можно использовать, включают полимерные вещества и воски.
[00164] Лекарственные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляторы или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, какие могут потребоваться. Офтальмологический состав, ушные капли и глазные капли также рассматривают как включенные в объем настоящего изобретения. Кроме того, изобретение относится к применению трансдермальных пластырей, предоставляющих дополнительное преимущество обеспечения контролируемой доставки соединения в организм. Такие лекарственные формы получают посредством растворения или диспергирования соединения в подходящей среде. Усилители абсорбции также можно использовать для увеличения потока соединения через кожу. Скорость можно контролировать либо посредством предоставления контролирующей скорость мембраны, либо посредством диспергирования соединения в полимерной матрице или геле.
[00165] Как в общем описано выше, соединения по изобретению можно использовать в качестве ингибиторов потенциалозависимых натриевых каналов. В одном из вариантов осуществления соединения и композиции по изобретению являются ингибиторами NaV1.8 и таким образом, без желания быть связанным какой-либо конкретной теорией, соединения и композиции является особенно пригодными для лечения или уменьшения тяжести заболевания, состояния или нарушения, где активация или гиперактивность NaV1.8 вовлечены в заболевание, состояние или нарушение. Когда активация или гиперактивность NaV1.8 вовлечены в конкретное заболевание, состояние или нарушение, заболевание, состояние или нарушение также можно обозначать как «опосредованное NaV1.8 заболевание, состояние или нарушение». Соответственно, в другом аспекте изобретение относится к способу лечения или уменьшения тяжести заболевания, состояния или нарушения, когда активация или гиперактивность NaV1.8 вовлечены в состояние заболевания.
[00166] Активность соединения, используемого по настоящему изобретению в качестве ингибитора NaV1.8, можно анализировать способами, описанными в общем в примерах в настоящем документе, или способами, доступными специалисту в данной области.
Дополнительные терапевтические средства
[00167] Следует понимать также, что соединения и фармацевтически приемлемые композиции по изобретению можно применять в способах комбинированной терапии, то есть, соединения и фармацевтически приемлемые композиции можно вводить во время, до или после использования одного или нескольких других желательных терапевтических средств или медицинских процедур. В одном из вариантов осуществления субъекта лечат с помощью одного или нескольких дополнительных терапевтических средств, вводимых во время, до или после лечения с помощью соединения или фармацевтической композиции формулы I по настоящему изобретению. Для применения конкретной комбинации видов терапии (терапевтических средств или процедур) в комбинированной схеме лечения, следует принимать во внимание совместимость желательных терапевтических средств и/или процедур и желательный для достижения терапевтический эффект. Следует понимать также, что применяемые виды терапии могут оказывать желательное действие на то же самое нарушение (например, соединение по изобретению можно вводить одновременно с другим средством, используемым для лечения того же самого нарушения), или они могут оказывать другие эффекты (например, контролировать какие-либо неблагоприятные воздействия). Как используют в настоящем документе, дополнительные терапевтические средства, обычно вводимые для лечения или предотвращения конкретного заболевания или состояния, известны как «подходящие для заболевания или состояния, подвергаемого лечению». Например, иллюстративные дополнительные терапевтические средства включают, в качестве неограничивающих примеров: неопиоидные аналгетики (индолы, такие как этодолак, индометацин, сулиндак, толметин; нафтилалканоны, такие как набуметон; оксикамы, такие как пироксикам; производные пара-аминофенола, такие как ацетаминофен; пропионовых кислот, такие как фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрия, оксапрозин; салицилаты, такие как аспирин, трисалицилат холина магния, дифлунизал; фенаматы, такие как меклофенамовая кислота, мефенамовая кислота; и пиразолы, такие как фенилбутазон); или опиодные (наркотические) агонисты (такие как кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, пропоксифен, бупренорфин, буторфанол, дезоцин, налбуфин и пентазоцин). Кроме того, можно использовать немедикаментозные способы обезболивания в комбинации с введением одного или нескольких соединений по изобретению. Например, анестезиологические (интраспинальная инфузия, нервная блокада), нейрохирургические (невролиз путей в ЦНС), нейростимулирующие (чрескожная электростимуляция нервов, стимуляция заднего столба спинного мозга), физиатрические (физиотерапия, ортопедические устройства, диатермия) или психологические (когнитивные способы - гипноз, биологическая обратная связь или поведенческие способы) способы также можно использовать. Дополнительные подходящие терапевтические средства или способы описаны в общем в The Merck Manual, Nineteenth Edition, Ed. Robert S. Porter and Justin L. Kaplan, Merck Sharp &Dohme Corp., a subsidiary of Merck & Co., Inc., 2011, и на веб-сайте Управления по контролю качества пищевых продуктов и Лекарственных средств, www.Fda.gov, полное содержание которых, таким образом, включено в качестве ссылки.
[00168] В другом варианте осуществления дополнительное терапевтическое средство представляет собой ингибитор NaV 1.7. Оба ионных канала NaV 1.7 и NaV 1.8 высоко экспрессированы в сенсорных нейронах ганглиев дорсального корешка, где возникают болевые сигналы, но различное функциональное поведение двух каналов приводит к исполнению ими различных и взаимодополняющих ролей в нейрональной возбудимости. NaV1.7 контролирует общую чувствительность ноцицептивных нейронов и инициирует болевой сигнал в ноцицепторе. NaV1.8 усиливает и поддерживает болевой сигнал после его инициации. Из-за этих различных ролей, ингибирование обоих каналов должно увеличивать эффективность облегчения боли. Доклинические исследования генетического нокаута на мышах поддерживают эту идею, поскольку двойные нокауты каналов NaV 1.7 и NaV1.8 в сенсорных нейронах DRG неожиданно уменьшают ноцицептивное поведение до большей степени, чем нокаут любого канала отдельно.
[00169] В другом варианте осуществления дополнительные подходящие терапевтические средства выбраны из следующего:
[00170] (1) опиоидного аналгетика, например, морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
[00171] (2) нестероидного противовоспалительного лекарственного средства (NSAID), например, аспирина, диклофенака, дифлунизала, этодолака, фенбуфена, фенопрофена, флуфенисала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, мелоксикама, набуметона, напроксена, нимесулида, нитрофлубипрофена, олсалазина, оксапрозина, фенилбутазона, пироксикама, сульфасалазина, сулиндака, толметина или зомепирака;
[00172] (3) барбитуратного седативного средства, например, амобарбитала, апробарбитала, бутабарбитала, буталбитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, тиамилала или тиопентала;
[00173] (4) бензодиазепина, обладающего седативным действием, например, хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама;
[00174] (5) антагониста гистамина (H1), обладающего седативным действием, например, дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина;
[00175] (6) седативного средства, такого как глютетимид, мепробамат, метаквалон или дихлоралфеназон;
[00176] (7) миорелаксанта для скелетных мышц, например, баклофена, карисопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфенадрина;
[00177] (8) антагониста рецептора NMDA рецептор антагонист, например, декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирролохинолин-хинина, цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты, будипина, EN-3231 (MorpHiDex®), комбинированного состава морфина и декстрометорфана), топирамата, нерамексана или перзинфотела, включая антагонист NR2B, например, ифенпродил, траксопродил или (-)-(R)-6-{2-[4-(3-фторфенил)-4-гидрокси-1-пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1H)-хинолинон;
[00178] (9) альфа-адренергического средства, например, доксазозина, тамсулозина, клонидина, гуанфацина, дексмедетомидина, модафинила или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинолин-2-ил)-5-(2-пиридил)хиназолина;
[00179] (10) трициклического антидепрессанта, например, дезипрамина, имипрамина, амитриптилина или нортриптилина;
[00180] (11) противосудорожного средства, например, карбамазепина (Tegretol®), ламотригина, топирамата, лакозамида (Vimpat®) или вальпроата;
[00181] (12) антагониста тахикининов (NK), особенно антагониста NK-3, NK-2 или NK-1, например, (альфа R,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,l1-тетрагидро-9-метил-5-(4-метилфенил)-7H-[l,4]диазоцино[2,1-g][1,7]-нафтиридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]-метил]-l,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), апрепитанта, ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S);
[00182] (13) мускаринового антагониста, например, оксибутинина, толтеродина, пропиверина, хлорида тропсия, дарифенацина, солифенацина, темиверина и ипратропия;
[00183] (14) селективного ингибитора COX-2, например, целекоксиба, рофекоксиба, парекоксиба, валдекоксиба, деракоксиба, эторикоксиба или люмиракоксиба;
[00184] (15) анальгетика, полученного из каменноугольной смолы, в частности парацетамола;
[00185] (16) нейролептика, такого как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипрасидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, азенапин, лурасидон, амисульприд, балаперидон, палиндор, эпливансерин, осанетант, римонабант, меклинертант, MiraxiOn® или саризотан;
[00186] (17) агониста (например, резинфератоксина или цивамида) или антагониста (например, капсазепина, GRC-15300) ванилоидного рецептора;
[00187] (18) бета-адренергического средства, такого как пропранолол;
[00188] (19) местного анестетика, такого как мексилетин;
[00189] (20) кортикостероида, такого как дексаметазон;
[00190] (21) агониста или антагониста рецептора 5-HT, в частности, агониста 5-HT1B/1D, такого как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан;
[00191] (22) антагониста рецептора 5-HT2a, такого как R(+)-альфа-(2,3-диметоксифенил)-l-[2-(4-фторфенилэтил)]-4-пиперидинметанол (MDL-100907);
[00192] (23) холинэргического (никотинового) анальгетика, такого как изпрониклин (TC-1734), (E)-N-метил-4-(3-пиридинил)-3- бутен-l-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (ABT-594) или никотин;
[00193] (24) трамадола, трамадола ER (Ultram ER®), тапентадола ER (Nucynta®);
[00194] (25) ингибитора PDE5, такого как 5-[2-этокси-5-(4-метил-1-пиперазинил-сульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (силденафил), (6R,12aR)-2,3,6,7,12,12a-гексагидро-2-метил-6-(3,4-метилендиоксифенил)-пиразино[2',1':6,1]-пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил), 2-[2-этокси-5-(4-этил-пиперазин-1-ил-1-сульфонил)-фенил]-5-метил-7-пропил-3H-имидазо[5,l-F][l,2,4]триазин-4-он (варденафил), 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(l-изопропил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, 4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2-илметил)пиримидин-5-карбоксамид, 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1H-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(l-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид;
[00195] (26) альфа-2-дельта лиганда, такого как габапентин (Neurоntin®), габапентин GR (Gralise®), энакарбил габапентина, (Hоrizant®), прегабалин (Lyrica®), 3-метилгабапентин, (l[альфа],3[альфа],5[альфа])(3-аминометилбицикло[3.2.0]гепт-3-ил)-уксусная кислота, (3S,5R)-3-аминометил-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3-хлорфенокси)пролин, (2S,4S)-4-(3-фторбензил)-пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, 3-(1-аминометил-циклогексилметил)-4H-[l,2,4]оксадиазол-5-он, C-[1-(1H-тетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота и (3R,4R,5R)-3-амино-4,5-диметилоктановая кислота;
[00196] (27) каннабиноида, такого как KHK-6188;
[00197] (28) антагониста метаботропных глутаматных рецепторов подтипа 1 (mGluRl);
[00198] (29) ингибитора обратного захвата серотонина, такого как сертралин, метаболит деметилсертралина сертралина, флуоксетина, норфлуоксетин (метаболит десметила флуоксетина), флувоксамин, пароксетин, циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, d,l-фенфлурамин, фемоксетин, ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин и тразодон;
[00199] (30) ингибитор обратного захвата норадреналина (норэпинефрина), такой как мапротилин, лофепрамин, миртазепин, оксапротилин, фезоламин, томоксетин, миансерин, бупропион, метаболит бупропиона гидроксибупроприон, номифензин и вилоксазин (Vivalan®), особенно селективный ингибитор обратного захвата норадреналина, такой как ребоксетин, в частности, (S,S)-ребоксетин;
[00200] (31) двойного ингибитора обратного захвата серотонина-норадреналина, такого как венлафаксин, метаболит венлафаксина O-десметилвенлафаксин, клопирамин, метаболит клопирамина десметилклопирамин, дулоксетин (Cymbalta®), милнаципран и имипрамин;
[00201] (32) ингибитор индуцируемой синтазы оксида азота (iNOS), такой как S-[2-[(l-иминоэтил)амино]этил]-L-гомоцистеин, S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1-иминоэтил)амино]этил]-2-метил-L-цистеин, (2S,5Z)-2-амино-2-метил-7-[(l-иминоэтил)амино]-5-гептеновая кислота, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)-бутил]тио]-S-хлор-S-пиридинкарбонитрил; 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил, (2S,4R)-2-амино-4-[[2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил)-3-пиридинкарбонитрил, 2-[[(lR,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлорбензонитрил, N-[4-[2-(3-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин, NXN-462 или гуанидиноэтилдисульфид;
[00202] (33) ингибитора ацетилхолинэстеразы, такого как донепезил;
[00203] (34) антагониста простагландина E2 подтипа 4 (EP4), такого как N-[({2-[4-(2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-l-ил)фенил]этил}амино)-карбонил]-4-метилбензолсульфонамид или 4-[(15)-l-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойная кислота;
[00204] (35) антагониста лейкотриена B4;, такого как 1-(3-бифенил-4-илметил-4-гидроксихроман-7-ил)-циклопентанкарбоновая кислота (CP-105696), 5-[2-(2-карбоксиэтил)-3-[6-(4-метоксифенил)-5E-гексенил]оксифенокси]-валериановая кислота (ONO-4057) или DPC-11870;
[00205] (36) ингибитора 5-липоксигеназа, такого как зилеутон, 6-[(3-фтор-5-[4-метокси-3,4,5,6-тетрагидро-2H-пиран-4-ил])феноксиметил]-1-метил-2-хинолон (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил)-1,4-бензохинон (CV-6504);
[00206] (37) блокатора натриевых каналов, такого как лидокаин, крем лидокаин плюс тетракаин (ZRS-201) или ацетат эсликарбазепина;
[00207] (38) блокатора NaV1.7, такого как XEN-402 и такого, как описанные в WO2011/140425; WO2012/106499; WO2012/112743; WO2012/125613; WO2013067248 или PCT/US2013/21535, полное содержание каждой заявки, таким образом, включено в качестве ссылки.
[00208] (39) блокатора NaV1.8, такого, как описанные в WO2008/135826 и WO2006/011050, полное содержание каждой заявки таким образом, включено в качестве ссылки.
[00209] (40) комбинированного блокатора NaV1.7 и NaV1.8, такого как DSP-2230 или BL-1021;
[00210] (41) антагониста 5-HT3, такого как ондансетрон;
[00211] (42) агониста рецептора TPRV 1, такого как капсаицин (NeurоgesX®, Qutenza®); и его фармацевтически приемлемых солей и сольватов;
[00212] (43) антагониста никотинового рецептора, такого как варениклин;
[00213] (44) антагониста кальциевого канала N-типа, такого как Z-160;
[00214] (45) антагониста фактора роста нервов, такого как танезумаб;
[00215] (46) стимулятора эндопептидазы, такого как сенреботаза;
[00216] (47) антагониста ангиотеНЗина II, такого как EMA-401;
[00217] В одном из вариантов осуществления дополнительные подходящие терапевтические средства выбраны из V-116517, прегабалина, прегабалина с контролируемым высвобождением, эзогабина (Pоtiga®), местного крема кетамин/амитриптилин (Amiket®), AVP-923, перампанела (E-2007), ралфинамида, трансдермального бупивакаина (Eladur®), CNV1014802, JNJ-10234094 (карисбамата), BMS-954561 или ARC-4558.
[00218] Количество дополнительного терапевтического средства, присутствующего в композициях по настоящему изобретению, может составлять не более, чем количество, которое обычно вводят в композиции, содержащей это терапевтическое средство в качестве единственного активного средства. Количество дополнительного терапевтического средства в описанных в настоящее время композициях может лежать в диапазоне приблизительно от 10% до 100% от количества, обычно присутствующего в композиции, содержащей это средство в качестве единственного активного средства.
[00219] Соединения по настоящему изобретению или их фармацевтически приемлемые композиции также можно включать в композиции для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, изобретение, в другом аспекте относится к композиции для покрытия имплантируемого устройства, содержащей соединение по изобретению, как в общем описано выше, и в классах и подклассах в настоящем документе, и носитель, подходящий для покрытия указанного имплантируемого устройства. В другом аспекте, изобретение относится к имплантируемому устройству, покрытому композицией, содержащей соединение по изобретению, как в общем описано выше, и в классах и подклассах в настоящем документе, и носитель, подходящий для покрытия указанного имплантируемого устройства. Подходящие покрытия и общее получение покрытых имплантируемых устройств описаны в патентах США 6099562; 5886026; и 5304121. Покрытия, как правило, представляют собой биосовместимые полимерные материалы, такие как гидрогель полимер, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия можно, необязательно, дополнительно покрывать подходящим поверхностным покрытием из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания характеристик контролируемого высвобождения композиции.
[00220] Другой аспект изобретения относится к ингибированию активности NaV1.8 в биологическом образце или субъекте, где способ включает введение субъекту соединения формулы I или композиции, содержащей указанное соединение, или приведение указанного биологического образца в контакт с ними. Термин «биологический образец», как используют в настоящем документе, включает, но без ограничения, культуры клеток или их экстракты; материал, полученный при биопсии от млекопитающего или его экстракты; и кровь, слюну, мочу, фекалии, семенную жидкость, слезы или другие жидкости организма или их экстракты.
[00221] Ингибирование активности NaV1.8 в биологическом образце можно использовать для множества целей, известных специалисту в данной области. Такие цели включают, в качестве неограничивающих примеров, исследование натриевых каналов при биологических и патологических феноменах; и сравнительную оценку новых ингибиторов натриевых каналов.
СХЕМЫ И ПРИМЕРЫ
[00222] Следующие определения описывают термины и сокращения, используемые в настоящем документе:
[00223] Соединения по изобретению можно легко получать с использованием следующих способов. Ниже на схемах 1-3 проиллюстрированы общие способы получения соединений по настоящему изобретению.
Схема 1: Общее получение соединений формулы I

(a) 3-аминофенилсульфонамид, связывающее средство (т.е. HATU, EDCI, HOBT), основание (т.е. N-метилморфолин), растворитель (т.е. DMF, дихлорметан); (b) 3-аминофенилсульфонамид, основание (т.е. пиридин, Cs2CO3), растворитель (т.е. дихлорметан, DMF); (c) основание (т.е. NaH, Cs2CO3, Na2CO3, NaHCO3), растворитель (DMF, NMP, диоксан), ΔT; (d) SO2Cl2, DMF в растворителе (т.е. дихлорметан).
Схема 2: Общее получение соединений формулы I

(a) i) основание (т.е. NaH, Cs2CO3, Na2CO3, NaHCO3), растворитель (DMF, NMP, диоксан), ΔT; ii) условия окисления (т.е. KMnO4 или дигидрофосфат натрия, 2-метил-2-бутен и хлорит натрия) в растворителе (вода, tBuOH и ацетонитрил); (b) i) основание (т.е. NaH, Cs2CO3, Na2CO3, NaHCO3), растворитель (DMF, NMP, диоксан), ΔT; ii) условия гидролиза (т.е. водный HBr); (c) 3-аминофенилсульфонамид, связывающее средство (т.е. HATU, EDCI, HOBT), основание (т.е. N-метилморфолин), растворитель (т.е. DMF, дихлорметан).
Схема 3: Общее получение соединений формулы I

(a) R3-B(OH)2 (т.е. MeB(OH)2, катализатор Pd (т.е. (PPH3)4Pd), растворитель (т.е. диметоксиэтан), основание (т.е. Na2CO3).
[00224] Схему 3 выше можно использовать для вставки множества групп R1, R2, R3 и R4, начиная с арилбромида. На схеме выше показано присутствие, например, группы R1 и арилбромида, который вступает в реакцию с подходящей бороновой кислотой в условиях типа Сузуки для замены группы бромида на группу R3. Специалисту в данной области понятно, что множество групп R1-R4 можно вставлять, начиная с арилбромида, посредством этого способа.
ПРИМЕРЫ
[00225] Общие способы. Спектры 1H ЯМР (400 МГц) получали в форме растворов в подходящем дейтерированном растворителе, таком как диметилсульфоксид-d6 (DMSO). Масс-спектры (MS) получали с использованием системы Applied Biosystems API EX LC/MS. Чистоту и время удержания соединения определяли посредством обращеннофазовой ВЭЖХ с использованием колонки Kinetix C18 (50×2,1 мм, частицы 1,7 мкм) от Phenomenex (pn: 00B-4475-AN)) и двойного пропускания градиента 1-99% подвижной фазы B в течение 3 минут. Подвижная фаза A=H2O (0,05% CF3CO2H). Подвижная фаза B=CH3CN (0,05% CF3CO2H). Скорость потока=2 мл/мин, объем впрыска=3 мкл и температура колонки=50°C. Гель-хроматографию на силикагеле проводили с использованием силикагеля-60 с размером частиц 230-400 меш. Пиридин, дихлорметан, тетрагидрофуран, диметилформамид, ацетонитрил, метанол, 1,4-диоксан и другие общепринятые растворители получали, например, из Baker или AldricH, и в некоторых случаях реагенты находились в герметично закрытых бутылках из AldricH, сохраняемых под сухим азотом. Все реакционные смеси перемешивали на магнитной мешалке, если не указано иначе.
ПРИМЕР 1
Получение 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида
[00226] К раствору 3-аминобензолсульфонамида (18,77 г, 109,0 ммоль) и пиридина (88,16 мл, 1,090 моль) в дихлорметане (247,0 мл) при 0°C добавляли по каплям 2-фтор-5-(трифторметил)бензоилхлорид (24,7 г, 109,0 ммоль). Смеси позволяли нагреться до комнатной температуры и перемешивали в течение 18 часов. Реакционную смесь разбавляли дихлорметаном и водой. Слои разделяли, и органический слой промывали водной 1Н HCl (2x). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Осадок растирали с дихлорметаном и фильтровали. Белое твердое вещество промывали простым диэтиловым эфиром и собирали посредством вакуумной фильтрации с получением 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (23,83 г, 60%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 362,03, обнаруженное 363,3 (M+1)+; Время удержания: 1,37 минут (пропускание 3 мин). 1H ЯМР (400 МГц, DMSO-d6) δ 10,91 (s, 1H), 8,30 (s, 1H), 8,15-8,07 (m, 1H), 8,06-7,97 (m, 1H), 7,89-7,83 (m, 1H), 7,64 (t, J=9,2 Гц, 1H), 7,62-7,54 (m, 2H), 7,42 (s, 2H) м.д.
ПРИМЕР 2
Получение 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида
[00227] К раствору 3-аминобензолсульфонамида (3,8 г, 22,07 ммоль) и 2-фтор-4-(трифторметил)бензоилхлорида (5 г, 22,07 ммоль) в дихлорметане (90 мл) добавляли пиридин (10,7 мл, 132,4 ммоль), и смесь перемешивали при комнатной температуре в течение 15 часов. Воду (50 мл) добавляли в реакционную смесь, и продукт быстро выпадал в осадок. Твердое вещество выделяли фильтрацией, промывали водой (2×75 мл) и высушивали в вакууме с получением 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (4,43 г) в виде кремового твердого вещества. Растворитель выпаривали при пониженном давлении. Добавляли воду и смесь отставляли. Через несколько минут, твердое вещество осаждалось. Твердое вещество выделяли фильтрацией, промывали водой (2×30 мл), и высушивали в вакууме с получением второй порции желательного продукта (2,7 г). Две порции объединяли с получением 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (7,13 г, 88%) в виде твердого вещества. Масса/заряд по ESI-MS: расчетное 362,03, обнаруженное 363,3 (M+1)+; Время удержания: 1,63 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,93 (s, 1H), 8,35-8,27 (m, 1H), 7,99-7,88 (m, 2H), 7,88-7,80 (m, 1H), 7,76 (d, J=8,0 Гц, 1H), 7,65-7,51 (m, 2H), 7,43 (s, 2H) м.д.
ПРИМЕР 3
Получение 4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида

[00228] Пиридин (939,0 мкл, 11,61 ммоль) добавляли медленно к раствору 4-хлор-2-фтор-бензоилхлорида (1,1 г, 5,81 ммоль) и 3-аминобензолсульфонамида (1 г, 5,81 ммоль) в дихлорметане (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали, и преципитат промывали дихлорметаном и водой с получением 4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида (1,8 г, 92,2%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 328,01, обнаруженное 329,1 (M+1)+; Время удержания: 1,47 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,78 (s, 1H), 8,31 (s, 1H), 7,84 (d, J=6,8 Гц, 1H), 7,74 (t, J=8,0 Гц, 1H), 7,66 (dd, J=10,0, 1,9 Гц, 1H), 7,57 (m, 2H), 7,46 (dd, J=8,3, 1,9 Гц, 1H), 7,41 (s, 2H) м.д.
ПРИМЕР 4
Получение 5-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида

[00229] Смесь 5-хлор-2-фторбензойной кислоты (349,1 мг, 2,0 ммоль), 3-аминобензолсульфонамида (413,3 мг, 2,4 ммоль), HATU (608,4 мг, 1,6 ммоль) и N-метилморфолина (439,8 мкл, 4,0 ммоль) в DMF (4 мл) перемешивали при 40°C в течение 1 часа. Реакционную смесь выливали в воду, pH доводили до 4, и смесь экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали досуха с получением 5-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида (0,36 г, 55%) в виде бледно-желтого твердого вещества. Масса/заряд по ESI-MS: расчетное 328,01, обнаруженное 329,1 (M+1)+; Время удержания: 1,41 минут (пропускание 3 минуты).
ПРИМЕР 5
Получение 2-фтор-4-метил-N-(3-сульфамоилфенил)бензамида

[00230] Пиридин (1,0 мл, 12,98 ммоль) добавляли по каплям к смеси 2-фтор-4-метил-бензоилхлорида (2,24 г, 12,98 ммоль), 3-аминобензолсульфонамида (2,235 г, 12,98 ммоль) и дихлорметана (40,32 мл) при комнатной температуре. Обеспечивали перемешивание смеси при комнатной температуре в течение 2,5 часов перед добавлением воды (150 мл). Смесь фильтровали, и твердое вещество собирали посредством вакуумной фильтрации. Твердое вещество суспендировали с помощью простого диэтилового эфира (30 мл) и фильтровали (дважды). Твердое вещество помещали в вакуумную печь при 40°C на ночь с получением 2-фтор-4-метил-N-(3-сульфамоилфенил)бензамида (1,81 г, 45%) в виде грязно-белого твердого вещества. Масса/заряд по ESI-MS: расчетное 308,06, обнаруженное 309,5 (M+1)+; Время удержания: 1,42 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,61 (s, 1H), 8,32 (s, 1H), 7,89-7,80 (m, 1H), 7,62-7,51 (m, 3H), 7,39 (s, 2H), 7,24-7,11 (m, 2H), 2,39 (s, 3H) м.д.
ПРИМЕР 6
Получение 4-циано-2-фтор-N-(3-сульфамоилфенил)бензамида
[00231] Раствор 4-циано-2-фтор-бензойной кислоты (495,4 мг, 3,0 ммоль), 3-аминобензолсульфонамид (516,6 мг, 3,0 ммоль), EDCI (575,1 мг, 3,0 ммоль), HOBT (405,4 мг, 3,0 ммоль) и N-метилморфолина (659,7 мкл, 6,0 ммоль) в DMF (4 мл) перемешивали при 25°C в течение 16 часов. Реакционную смесь выливали в 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли и промывали 1Н HCl (3x), водой, насыщенным солевым раствором, высушивали над Na2SO4, фильтровали через короткую пробку из силикагеля и выпаривали досуха с получением 4-циано-2-фтор-N-(3-сульфамоилфенил)бензамида (860 мг, 90%) в виде белого твердого вещества, которое использовали на следующих стадиях без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 319,04, обнаруженное 320,1 (M+1)+; Время удержания: 1,04 минут (пропускание 3 минуты).
ПРИМЕР 7
Получение 5-циано-2-фтор-N-(3-сульфамоилфенил)бензамида

[00232] Раствор 5-циано-2-фтор-бензойной кислоты (165,1 мг, 1,0 ммоль), 3-аминобензолсульфонамида (206,6 мг, 1,20 ммоль), HATU (342,2 мг, 0,90 ммоль) и N-метилморфолина (219,9 мкл, 2,0 ммоль) в DMF (2 мл) перемешивали при 25°C в течение 4 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, подкисляли до pH~4 с помощью 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали с помощью Na2SO4, фильтровали и выпаривали досуха с получением 5-циано-2-фтор-N-(3-сульфамоилфенил)бензамида (150 мг, 47%), который использовали на следующих стадиях без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 319,04, обнаруженное 320,1 (M+1)+; Время удержания: 0,97 минут (пропускание 3 минуты).
ПРИМЕР 8
Получение 2,4-дифтор-N-(3-сульфамоилфенил)бензамида

[00233] К смеси 2,4-дифторбензоилхлорида (2,0 г, 11,33 ммоль), 3-аминобензолсульфонамида (1,95 г, 11,33 ммоль) и дихлорметана (36,0 мл) добавляли пиридин (3,7 мл, 45,32 ммоль) при 25°C. Обеспечивали перемешивание смеси при 25°C в течение 18 час перед ее промывкой 1Н HCl и водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Осадок подвергали хроматографии на колонке (0-100% этилацетат/гексаны) с получением 2,4-дифтор-N-(3-сульфамоилфенил)бензамида (2,0 г, 57%). Масса/заряд по ESI-MS: расчетное 312,04, обнаруженное 313,1 (M+1)+; Время удержания: 1,31 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,73 (s, 1H), 8,31 (s, 1H), 7,89-7,74 (m, 2H), 7,62-7,52 (m, 2H), 7,51-7,42 (m, 1H), 7,41 (s, 2H), 7,26 (td, J=8,4, 2,2 Гц, 1H) м.д.
ПРИМЕР 9
Получение 2,5-дифтор-N-(3-сульфамоилфенил)бензамида

[00234] К раствору 3-аминобензолсульфонамида (1,0 г, 5,81 ммоль) и пиридина (4,7 мл, 58,07 ммоль) в дихлорметане (10,3 мл) при 0°C добавляли по каплям 2,5-дифторбензоилхлорид (719,3 мкл, 5,81 ммоль). Смеси позволяли нагреться до 25°C и перемешивали в течение 72 часов. Реакционную смесь разбавляли этилацетатом и водой. Слои разделяли, и органический слой промывали насыщенным солевым раствором (2x). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением прозрачного масла, которое кристаллизовалось при выстаивании. Твердое вещество повторно растворяли в этилацетате и промывали 1Н HCl (3x). Органический слой сушили с помощью MgSO4, фильтровали и выпаривали с получением 2,5-дифтор-N-(3-сульфамоилфенил)бензамида (1,17 г, 64%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 312,04, обнаруженное 313,3 (M+1)+; Время удержания: 1,31 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,81 (s, 1H), 8,31 (s, 1H), 7,84 (d, J=9,1 Гц, 1H), 7,59-7,54 (m, 3H), 7,50-7,39 (m, 4H) м.д.
ПРИМЕР 10
Получение 2,5-дифтор-4-метил-N-(3-сульфамоилфенил)бензамида

[00235] Раствор 3-аминобензолсульфонамида (413,3 мг, 2,40 ммоль), 2,5-дифтор-4-метилбензойной кислоты (344,3 мг, 2,0 ммоль), HATU (684,4 мг, 1,80 ммоль) и N-метилморфолина (439,8 мкл, 4,0 ммоль) в DMF (2 мл) перемешивали при 40°C в течение 2 часов. Реакционную смесь выливали в 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали с помощью Na2SO4 и выпаривали досуха с получением 2,5-дифтор-4-метил-N-(3-сульфамоилфенил)бензамида (610 мг, 94%) в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 326,05, обнаруженное 327,3 (M+1)+; Время удержания: 1,25 минут (пропускание 3 минуты).
ПРИМЕР 11
Получение 2-фтор-N-(3-сульфамоилфенил)-6-(трифторметил)бензамида
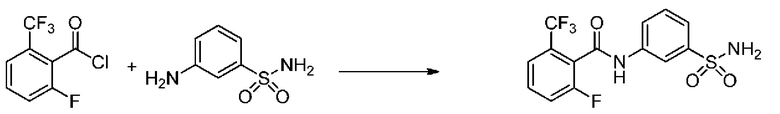
[00236] К раствору 3-аминобензолсульфонамида (760,1 мг, 4,41 ммоль) в дихлорметане (10 мл) добавляли 2-фтор-6-(трифторметил)бензоилхлорид (1 г, 4,41 ммоль), 3-аминобензолсульфонамид (760,1 мг, 4,41 ммоль) и пиридин (1,1 мл, 13,24 ммоль), и смесь перемешивали при 25°C в течение 12 часов. Реакционную смесь разбавляли дихлорметаном и водой. 2 слоя разделяли, и органический слой промывали водой и 1Н HCl. Органические вещества объединяли и выпаривали с получением 2-фтор-N-(3-сульфамоилфенил)-6-(трифторметил)бензамида (600 мг, 37%) в виде светло-розового твердого вещества. Масса/заряд по ESI-MS: расчетное 362,03, обнаруженное 363,3 (M+1)+; Время удержания: 1,39 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, CD3CN) δ 9,18 (s, 1H), 8,31 (t, J=1,9 Гц, 1H), 7,83-7,43 (m, 6H), 5,75 (s, 2H) м.д.
ПРИМЕР 12
Получение 5-(дифторметил)-2-фторбензойной кислоты
[00237] 2-фтор-5-метилбензойную кислоту (2 г, 12,98 ммоль), NBS (6,0 г, 33,75 ммоль) и бензоилпероксид (157,2 мг, 0,65 ммоль) в CCl4 (30 мл) нагревали при кипячении с обратным холодильником в течение 48 часов. Твердые вещества отфильтровывали и промывали дихлорметаном. Растворитель выпаривали и осадок поглощали этанолом (30 мл) и нагревали до 50°C. Раствор нитрата серебра (2,20 г, 12,98 ммоль) в 5 мл воды добавляли по каплям. Смесь перемешивали в течение 45 минут, охлаждали до 25°C, затем выливали в 1Н HCl. Твердые вещества отфильтровывали и промывали EtOH. EtOH удаляли, и водный слой экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали насыщенным солевым раствором, высушивали над Na2SO4 и выпаривали досуха. Очисткой посредством хроматографии на колонке с использованием градиента этилацетата в гексанах (0-50%) получали 2-фтор-5-формилбензойную кислоту (0,33 г, 15%) в виде светло-желтого твердого вещества. Масса/заряд по ESI-MS: расчетное 168,02, обнаруженное 169,1 (M+1)+; Время удержания: 0,49 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 13,64 (s, 1H), 10,03 (s, 1H), 8,43 (dd, J=7,2, 2,2 Гц, 1H), 8,17 (ddd, J=8,4, 4,7, 2,2 Гц, 1H), 7,56 (dd, J=10,6, 8,6 Гц, 1H) м.д.
[00238] Дезоксифтор (566,8 мкл, 3,07 ммоль) добавляли к метил 2-фтор-5-формилбензоату (280 мг, 1,54 ммоль) с последующими 2 каплями этанола, и реакционную смесь перемешивали при 25°C в течение 4 часов. Добавляли больше дезоксифтора (100 мкл, 0,54 ммоль), и реакционную смесь перемешивали в течение дополнительного часа. Реакцию в смеси осторожно останавливали с помощью насыщенного водного раствора бикарбоната натрия, а затем экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали Over Na2SO4, фильтровали и выпаривали досуха. Очисткой посредством хроматографии на колонке с использованием градиента этилацетата в гексанах (0-20%) получали метил 5-(дифторметил)-2-фторбензоат (230 мг, 73%) в виде прозрачного масла. Масса/заряд по ESI-MS: расчетное 204,04, обнаруженное 204,9 (M+1)+; Время удержания: 1,31 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, CDCl3) δ 8,26-8,05 (m, 1H), 7,81-7,58 (m, 1H), 7,29-7,19 (m, 1H), 6,66 (t, J=56,1 Гц, 1H), 3,96 (s, 3H) м.д.
[00239] К раствору метил-5-(дифторметил)-2-фторбензоата (230 мг, 1,127 ммоль) в THF (4 мл) добавляли раствор LiOH (269,9 мг, 11,27 ммоль) в воде (1 мл), и реакционную смесь перемешивали при 25°C в течение 4 часов. pH реакционной смеси доводили до 4 с помощью 4Н HCl, а затем экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали досуха с получением 5-(дифторметил)-2-фторбензойной кислоты (187 мг, 87%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 190,02, обнаруженное 191,3 (M+1)+; Время удержания: 1,0 минут (пропускание 3 минуты).
ПРИМЕР 13
Получение 5-(дифторметил)-2-фтор-N-(3-сульфамоилфенил)бензамида

[00240] К раствору 5-(дифторметил)-2-фторбензойной кислоты (95,1 мг, 0,50 ммоль), 3-аминобензолсульфонамида (94,7 мг, 0,55 ммоль), и N-метилморфолина (109,9 мкл, 1,0 ммоль) в DMF (1 мл) добавляли HATU (209 мг, 0,55 ммоль), и реакционную смесь перемешивали при 25°C в течение 1 часа. Реакционную смесь выливали в 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой (2x), насыщенным солевым раствором, высушивали с помощью Na2SO4, фильтровали и выпаривали досуха. Очисткой посредством хроматографии на колонке с силикагелем с использованием 20-80% градиента этилацетата в гексанах получали 5-(дифторметил)-2-фтор-N-(3-сульфамоилфенил)бензамид (202 мг, >100%), который использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 344,04, обнаруженное 345,3 (M+1)+; Время удержания: 1,19 минут (пропускание 3 минуты).
ПРИМЕР 14
Получение 5-бром-4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида

[00241] К 5-бром-4-хлор-2-фтор-бензойной кислоте (5,0 г, 19,73 ммоль), 3-аминобензолсульфонамиду (5,1 г, 29,60 ммоль), 1-гидроксибензотриазолу (2,93 г, 21,70 ммоль), гидрохлориду 3-(этилиминометиленамино)-N,N-диметилпропан-1-амина (4,2 г, 21,70 ммоль) и N,N-диметилформамиду (80 мл) добавляли триэтиламин (5,5 мл, 39,46 ммоль) и перемешивали при комнатной температуре в течение 18 часов. Растворитель выпаривали. Реакционную смесь промывали 1M раствором соляной кислоты (3×50 мл), насыщенным водным раствором бикарбоната натрия (3×50 мл) и насыщенным водным раствором хлорида натрия (3×50 мл). Органический слой сушили над сульфатом натрия, фильтровали и выпаривали досуха. Неочищенный продукт растворяли в дихлорметане, и преципитат выделяли фильтрацией с получением 5-бром-4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида (4,0 г, 35%) в виде серого твердого вещества. Продукт использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 405,92, обнаруженное 407,0 (M+1)+; Время удержания: 1,7 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,84 (s, 1H), 8,32 -8,24 (m, 1H), 8,13 (d, J=7,0 Гц, 1H), 7,90 (d, J=9,7 Гц, 1H), 7,86-7,81 (m, 1H), 7,61 -7,53 (m, 2H), 7,42 (s, 2H) м.д.
ПРИМЕР 15
Получение 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамида
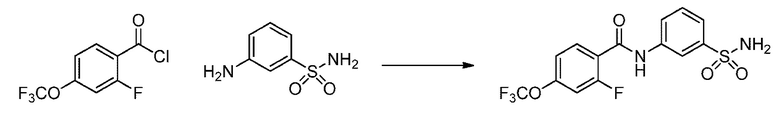
[00242] К 2-фтор-4-(трифторметокси)бензойной кислоте (5 г, 22,31 ммоль) в тионилхлориде (2,43 мл, 33,46 ммоль) добавляли N,N-диметилформамид (491,6 мкл, 6,38 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 часов. Избыток тионилхлорида и N,N-диметилформамида удаляли в вакууме с получением 2-фтор-4-(трифторметокси)бензоилхлорида, который использовали на следующей стадии без дополнительной очистки.
[00243] К 3-аминобензолсульфонамиду (4,79 г, 27,83 ммоль) добавляли карбонат калия (3,85 г, 27,82 ммоль), метил-трет-бутиловый простой эфир (27,0 мл) и воду (27,0 мл). Реакционную смесь охлаждали до 0°C. В интенсивно перемешиваемую реакционную смесь добавляли 2-фтор-4-(трифторметокси)бензоилхлорид (5,4 г, 22,26 ммоль) в дихлорметане (13,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 часов. Реакционная смесь представляла собой взвесь. Продукт выделяли фильтрацией с использованием простого эфира. Продукт наносили на целит и очищали посредством хроматографии на силикагеле с использованием градиента 0-50% этилацетата в дихлорметане с получением 3 г (35%) 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамида. 1H ЯМР (400 МГц, DMSO-d6) δ 10,83 (s, 1H), 8,38-8,25 (m, 1H), 7,90-7,78 (m, 2H), 7,66-7,52 (m, 3H), 7,47-7,36 (m, 3H) м.д. Масса/заряд по ESI-MS: расчетное 378,03, обнаруженное 379,4 (M+1)+; Время удержания: 1,56 минут (пропускание 3 минуты).
ПРИМЕР 16
Получение 2-фтор-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамида

[00244] Через перемешиваемый раствор 4-бром-2-фтор-бензойной кислоты (3,0 г, 13,70 ммоль) и меди (8,70 г, 137,0 ммоль) в DMSO (56,3 мл) в бомбе барботировали 1,1,1,2,2-пентафтор-2-иодэтан (23,6 г, 95,90 ммоль). Сосуд герметизировали и нагревали при 120°C в течение 72 часов. Реакционную смесь разбавляли водой и фильтровали через пробку из силикагеля, а затем экстрагировали этилацетатом (4x). Органические вещества объединяли, промывали насыщенным солевым раствором, высушивали (Na2SO4) и выпаривали досуха. Очисткой посредством хроматографии на колонке с использованием градиента 0-40% этилацетата в гексанах получали 2-фтор-4-(1,1,2,2,2-пентафторэтил)бензойную кислоту (1,81 г, 51%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 258,01, обнаруженное 259,3 (M+1)+; Время удержания: 1,45 минут.
[00245] Раствор 2-фтор-4-(1,1,2,2,2-пентафторэтил)бензойной кислоты (516,2 мг, 2,0 ммоль), 3-аминобензолсульфонамида (378,9 мг, 2,20 ммоль), HATU (836,5 мг, 2,20 ммоль) и N-метилморфолина (439,8 мкл, 4,0 ммоль) в DMF (6 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в воду, pH доводили до 4 с помощью 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали над Na2SO4 и выпаривали досуха. Очисткой посредством хроматографии на колонке с использованием градиента 0-50% этилацетата в гексанах получали 2-фтор-4-(1,1,2,2,2-пентафторэтил)-N-(3-сульфамоилфенил)бензамид (710 мг, 86%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 412,03165, обнаруженное 413,3 (M+1)+; Время удержания: 1,5 минуты.
ПРИМЕР 17
Получение 4,5-дихлор-2-фтор-N-(3-сульфамоилфенил)бензамида
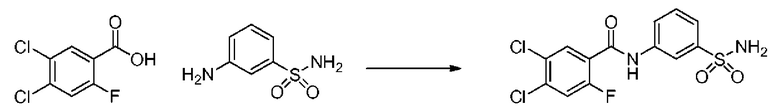
[00246] Раствор 3-аминобензолсульфонамида (271,9 мг, 1,58 ммоль), 4,5-дихлор-2-фторбензойной кислоты (300 мг, 1,43 ммоль) и HATU (654,8 мг, 1,72 ммоль) в DMF (3,12 мл) обрабатывали N-метилморфолином (315,5 мкл, 2,87 ммоль) и перемешивали при 40°C в течение 16 часов. Реакционную смесь разбавляли этилацетатом и водой, и органический слой отделяли. Органический слой промывали 1Н HCl, водой (3×50 мл) и насыщенным солевым раствором, затем высушивали над Na2SO4, фильтровали и концентрировали. Осадок суспендировали в дихлорметане с получением белого преципитата. Преципитат фильтровали и промывали дихлорметаном с получением 4,5-дихлор-2-фтор-N-(3-сульфамоилфенил)бензамида (422 мг, 81%) в виде белого порошка. 1H ЯМР (400 МГц, DMSO-d6) δ 10,85 (s, 1H), 8,32-8,25 (m, 1H), 8,03 (d, J=6,7 Гц, 1H), 7,93 (d, J=9,5 Гц, 1H), 7,83 (dt, J=6,8, 2,2 Гц, 1H), 7,64 -7,52 (m, 2H), 7,42 (s, 2H) м.д. Масса/заряд по ESI-MS: расчетное 361,96948, обнаруженное 364,7 (M+1)+; Время удержания: 1,4 минут (пропускание 3 минуты).
ПРИМЕР 18
Получение 2-фтор-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамида
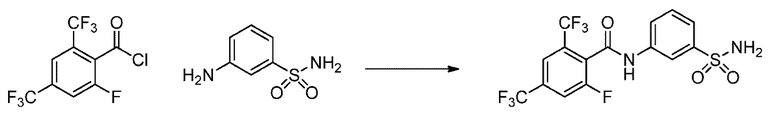
[00247] К 3-аминобензолсульфонамиду (300,8 мг, 1,75 ммоль) в метил-трет-бутиловом простом эфире (2,8 мл) добавляли К2СО3 (689,9 мг, 5,0 ммоль) в воде (2,8 мл). Реакционную смесь перемешивали при комнатной температуре, и 2-фтор-4,6-бис(трифторметил)бензоилхлорид (490 мг, 1,66 ммоль) в метил-трет-бутиловом простом эфире (2,8 мл) добавляли по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 40 минут. Добавляли этилацетат (50 мл), и органический слой отделяли, промывали насыщенным солевым раствором и концентрировали с получением 2-фтор-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамида (162 мг, 23%) в виде розового твердого вещества, которое использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, DMSO-d6) δ 11,27 (s, 1H), 8,49-8,35 (m, 1H), 8,31-8,08 (m, 2H), 7,74 (dt, J=7,5, 1,9 Гц, 1H), 7,69-7,54 (m, 2H), 7,46 (s, 2H) м.д.
ПРИМЕР 19
Получение 2,4-дихлор-6-фтор-N-(3-сульфамоилфенил)бензамида

[00248] К раствору 2,4-дихлор-6-фторбензойной кислоты (400 мг, 1,91 ммоль), 3-аминобензолсульфонамида (329,6 мг, 1,91 ммоль) и HATU (727,8 мг, 1,91 ммоль) в DMF (4 мл) добавляли N-метилморфолин (210,4 мкл, 1,91 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали 1Н HCl, водой, насыщенным солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали досуха. Очисткой посредством хроматографии на колонке с использованием градиента этилацетата в гексанах 1-50% получали 2,4-дихлор-6-фтор-N-(3-сульфамоилфенил)бензамид (420 мг, 60%>) в виде белого твердого вещества.
ПРИМЕР 20
Получение 2-циклопропил-6-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида
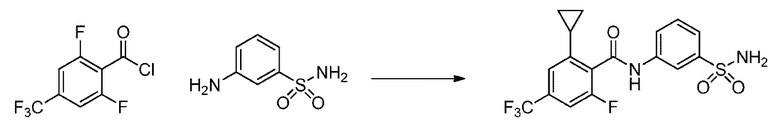
[00249] К смеси 2,6-дифтор-4-(трифторметил)бензойной кислоты (500 мг, 2,21 ммоль) в THF (4,0 мл) медленно добавляли бром(циклопропил)магний (12,0 мл 0,5 M, 6,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одного часа, затем при 55°C в течение одного часа. В реакционную смесь добавляли дополнительный бром(циклопропил)магний (8,84 мл 0,5 M, 4,42 ммоль), и реакционную смесь перемешивали при 55°C в течение 12 дополнительных часов. Реакционную смесь осторожно выливали в 50 мл насыщенного NH4C1 и экстрагировали этилацетатом. Органический слой промывали водой. Объединенные водные слои подкисляли до pH=3 с использованием 1Н HCl и экстрагировали этилацетатом (2×50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением 2-циклопропил-6-фтор-4-(трифторметил)бензойной кислоты (345 мг, 63%), которую использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 248,05, обнаруженное 249,15 (M+1)+; Время удержания: 0,59 минут (пропускание 1 минута). 1H ЯМР (400 МГц, DMSO-d6) δ 7,91-7,43 (m, 1H), 7,12 (s, 1H), 2,04 (tt, J=8,4, 5,2 Гц, 1H), 1,09-0,98 (m, 2H), 0,89-0,80 (m, 2H) м.д.
[00250] 2-циклопропил-6-фтор-4-(трифторметил)бензойную кислоту (345 мг, 1,39 ммоль), толуол (3,4 мл) и пиридин (5,6 мкл, 0,069 ммоль) добавляли в реакционный сосуд, и смесь нагревали до 60°C в инертной атмосфере. В реакционную смесь добавляли SOCl2 (202,8 мкл, 2,780 ммоль), и смесь перемешивали в течение 90 минут. Добавляли дополнительный SOCl2 (900 мкл, 12,34 ммоль), и смесь концентрировали в вакууме. Добавляли толуол, и смесь снова концентрировали с получением продукта, который использовали на следующей стадии без дополнительной очистки.
[00251] К 3-аминобензолсульфонамиду (271,4 мг, 1,576 ммоль) в метил-т-бутиловом простом эфире (1,99 мл) и DMF (1 мл) добавляли K2CO3 (544,4 мг, 3,94 ммоль) в воде (1,99 мл). Реакционную смесь перемешивали при комнатной температуре, и 2-циклопропил-6-фтор-4-(трифторметил)бензоилхлорид (350 мг, 1,31 ммоль) в метил-т-бутиловом простом эфире (1,99 мл) добавляли по каплям. Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего добавляли 50 мл этилацетата. 2 слоя разделяли, и органический слой промывали насыщенным солевым раствором, высушивали с помощью MgSO4, фильтровали и концентрировали с получением 2-циклопропил-6-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (220 мг, 42%) в виде розового твердого вещества, которое использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 402,07, обнаруженное 403,1 (M+1)+; время удержания: 0,59 минут (пропускание 1 минута).
ПРИМЕР 21
Получение 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамида (33)

[00252] К раствору 2-хлор-4-фторфенола (21 г, 143,1 ммоль) и 2-фтор-6-(трифторметил)бензальдегида (25 г, 130,1 ммоль) в DMF (125,0 мл) добавляли Cs2CO3 (46,6 г, 143,1 ммоль), и реакционную смесь перемешивали при 100°C в течение 1 часа. Смесь выливали в воду (500 мл) и экстрагировали этилацетатом (3×150 мл). Органические вещества объединяли, промывали водой, насыщенным солевым раствором (2x), высушивали над Na2SO4, фильтровали и выпаривали с получением красного масла, которое отверждалось после выдерживания в течение ночи. Затем материал растирали в порошок с помощью горячих гексанов и охлаждали до 25°C. Взвесь фильтровали и промывали холодными гексанами с получением 2-(2-хлор-4-фтор-фенокси)-6-(трифторметил)бензальдегида (32,7 г, 79%) в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 10,61 (s, 1H), 7,84-7,70 (m, 2H), 7,66 (d, J=7,9 Гц, 1H), 7,47 (dd, J=9,0, 5,3 Гц, 1H), 7,42-7,32 (m, 1H), 7,12 (d, J=8,3 Гц, 1H) м.д.
[00253] К раствору 2-(2-хлор-4-фторфенокси)-6-(трифторметил)бензальдегида (31 г, 97,3 ммоль) в tBuОН (155,0 мл), воды (100,8 мл), CH3CN (155,0 мл) и 2-метил-2-бутена (51,45 мл, 486,4 ммоль) добавляли дигидрофосфат натрия (18,3 мл, 291,9 ммоль), и смесь охлаждали до 0°C. Хлорит натрия (26,40 г, 291,9 ммоль) добавляли в один прием, и смесь перемешивали при 25°C в течение 1 часа. pH смеси доводили до 2-3 с помощью 1Н HCl, и слои разделяли. Водный слой экстрагировали этилацетатом (3 X). Все органические слои объединяли, и в делительную воронку добавляли твердый сульфит натрия (~5 г), затем насыщенный солевой раствор (50 мл) и 1Н NaOH (10 мл), и смесь встряхивали до исчезновения желтой окраски. Слои разделяли, и органический слой промывали насыщенным солевым раствором, высушивали с помощью Na2SO4, фильтровали через короткую пробку из силикагеля и выпаривали досуха с получением 2-(2-хлор-4-фторфенокси)-6-(трифторметил)бензойной кислоты (40 г, 98%) в виде масла, которое использовали на следующей стадии без дополнительной очистки. Масса/заряд по ESI-MS: расчетное 334,00, обнаруженное 335,1 (M+1)+; Время удержания: 1,78 минут (пропускание 3 минуты).
[00254] В перемешиваемый раствор 2-(2-хлор-4-фтор-фенокси)-6-(трифторметил)бензойной кислоты (20 г, 47,81 ммоль) в NMP (110 мл) добавляли HATU (16,36 г, 43,03 ммоль), затем 3-аминобензолсульфонамид (9,88 г, 57,37 ммоль) и N-метилморфолин (10,51 мл, 95,60 ммоль), и смесь нагревали до 80°C и перемешивали при этой температуре в течение 4 часов. В реакционную смесь повторно загружали 3-аминобензолсульфонамид (4,12 г, 23,91 ммоль), перемешивали при 80°C в течение 13 часов. Смесь выливали в 1Н HCl (400 мл) и экстрагировали этилацетатом (3×200 мл). Органические вещества объединяли, промывали 1Н HCl (2×400 мл), водой (2×400 мл), насыщенным солевым раствором, а затем высушивали с помощью Na2SO4, фильтровали и выпаривали досуха с получением неочищенной смеси, которую очищали посредством хроматографии на колонке с силикагелем с использованием градиента этилацетата и гексанов (0-50%) с получением желательного продукта в виде белой пены. После высушивания в вакууме, 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид (33) (14 г, 60%) получали в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 488,02, обнаруженное 489,3 (M+1)+; Время удержания: 1,57 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 11,02 (s, 1H), 8,29 (s, 1H), 7,73 (d, J=7,3 Гц, 1H), 7,69-7,60 (m, 3H), 7,59-7,51 (m, 2H), 7,41 (s, 2H), 7,38-7,29 (m, 2H), 7,10 (d, J=7,3 Гц, 1H) м.д.
ПРИМЕР 22
Получение 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамида (13)

[00255] 2-Фтор-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид (130 мг, 0,36 ммоль), 4-фтор-2-метоксифенол (204,5 мкл, 1,8 ммоль) и Cs2CO3 (584,5 мг, 1,8 ммоль) в NMP (1 мл) перемешивали при 90°C в течение 4 часов. Реакционную смесь выливали в 1Н HCl и экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали водой, насыщенным солевым раствором, высушивали с помощью Na2SO4 и выпаривали досуха. Очисткой посредством обращеннофазовой ВЭЖХ с использованием градиента (1-99% ACN в воде (модификатор HCl)) получали 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид (13) (25,6 мг, 14%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 484,07, обнаруженное 485,3 (M+1)+; Время удержания: 1,61 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,98 (s, 1H), 8,33 (s, 1H), 7,79-7,72 (m, 1H), 7,61-7,48 (m, 4H), 7,40 (s, 2H), 7,20 (dd, J=8,9, 5,9 Гц, 1H), 7,14 (dd, J=10,7, 2,9 Гц, 1H), 6,93 (d, J=8,3 Гц, 1H), 6,84 (td, J=8,4, 2,8 Гц, 1H), 3,77 (s, 3H) м.д.
[00256] Следуя способу, сходному с тем, какой описан выше для соединения (13), следующие соединения получали из 2-фтор-N-(3-сульфамоилфенил)-6-(трифторметил)бензамида и фенола.
ПРИМЕР 23
Получение 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (1)
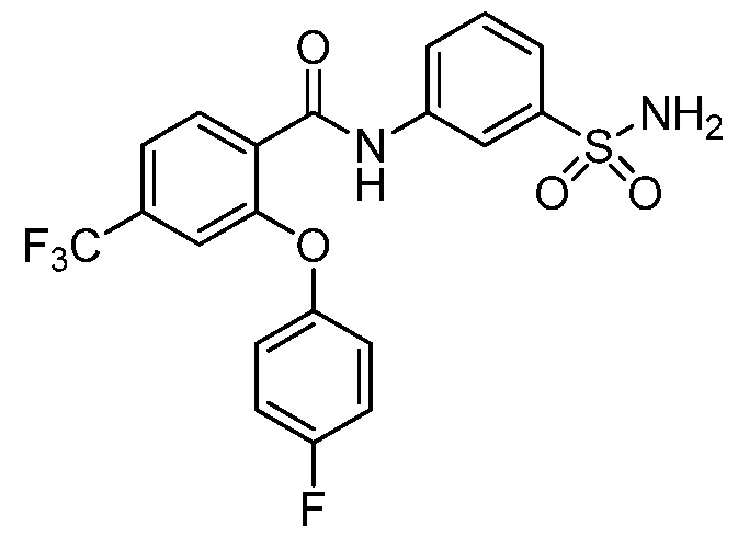
[00257] 2-Фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид (32,2 мг, 0,1 ммоль), 4-фторфенол (112,1 мг, 1 ммоль) растворяли в DMF (1 мл). Добавляли Cs2CO3 (325,8 мг, 1 ммоль), и реакционную смесь нагревали при 100°C в течение 1 часа. Реакционную смесь фильтровали и очищали посредством обращеннофазовой препаративной ВЭЖХ с использованием градиента 10-99% ацетонитрила в воде (HCl в качестве модификатора) с получением 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (1) (25,6 мг, 56%). Масса/заряд по ESI-MS: расчетное 454,06, обнаруженное 455,3 (M+1)+; Время удержания: 1,96 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,84 (s, 1H), 8,34-8,24 (m, 1H), 7,88 (d, J=7,9 Гц, 1H), 7,82-7,72 (m, 1H), 7,64 (dd, J=7,9, 0,8 Гц, 1H), 7,60-7,47 (m, 2H), 7,40 (s, 2H), 7,32-7,25 (m, 2H), 7,25-7,18 (m, 2H), 7,15 (s, 1H) м.д.
[00258] Следуя способу, сходному с тем, какой описан выше для соединения (1), следующие соединения получали, начиная с 2-фтор-N-(3-сульфамоилфенил)-4(трифторметил)бензамида и следующих фенолов.
(трифторметил)бензамид
ПРИМЕР 24
Получение 5-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамида (5)

[00259] 5-хлор-2-фтор-N-(3-сульфамоилфенил)бензамид (32,8 мг, 0,1 ммоль), 4-фторфенол (35,8 мг, 0,3 ммоль) растворяли в NMP (0,5 мл). Добавляли Cs2CO3 (98 мг, 0,3 ммоль), и реакционную смесь нагревали при 90°C в течение 6 час. Реакционную смесь фильтровали и очищали посредством обращеннофазовой препаративной ВЭЖХ с использованием градиента 10-99% ацетонитрила в воде (HCl в качестве модификатора) с получением 5-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамида (5) (10,2 мг, 24%). Масса/заряд по ESI-MS: расчетное 420,03, обнаруженное 421,1 (M+1)+; Время удержания: 1,70 минут (пропускание 3 минуты).
[00260] Следуя способу, сходному с тем, какой описан выше для соединения (5), получали следующие соединения.
ПРИМЕР 25
Получение 2-(2-хлор-4-фторфенокси)-6-метил-N-(3-сульфамоилфенил)бензамида (38)

[00261] К раствору 2-фтор-6-метилбензальдегида (1,1 г, 7,75 ммоль) и 2-хлор-4-фторфенола (817,7 мкл, 7,75 ммоль) в DMF (9,2 мл) добавляли карбонат цезия (2,5 г, 7,75 ммоль) и смесь нагревали при 100°C в течение 1 часа. Смесь охлаждали до комнатной температуры перед ее разбавлением этилацетатом и водой. Слои разделяли, и водный слой экстрагировали этилацетатом (3x). Объединенные органические слои промывали насыщенным солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством хроматографии на колонке с использованием градиента этилацетата в гексанах (0-100%) с получением 2-(2-хлор-4-фторфенокси)-6-метилбензальдегида (1,05 г, 51%). Масса/заряд по ESI-MS: расчетное 264,03, обнаруженное 265,1 (M+1)+; Время удержания: 2,02 минут (пропускание 3 минуты).
[00262] К раствору 2-(2-хлор-4-фтор-фенокси)-6-метилбензальдегида (1,05 г, 3,97 ммоль) в t-BuOH (10,50 мл), воде (6,6 мл) и ацетонитриле (6,6 мл) добавляли дигидрофосфат натрия (745,7 мкл, 11,90 ммоль), 2-метилбут-2-ен (2,1 мл, 19,83 ммоль) и хлорит натрия (1,08 г, 11,90 ммоль). Реакционную смесь перемешивали при 25°C в течение 1 час. Реакционную смесь подкисляли с помощью 1Н HCl и разбавляли этилацетатом. Добавляли сульфит натрия для удаления слабой желтой окраски. Два слоя разделяли, и водный слой экстрагировали этилацетатом (3x). Органические вещества объединяли, промывали насыщенным солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали с получением 2-(2-хлор-4-фторфенокси)-6-метилбензойной кислоты (1,06 г, 95%). Масса/заряд по ESI-MS: расчетное 280,03, обнаруженное 281,5 (M+1)+; Время удержания: 1,7 минут (пропускание 3 минуты).
[00263] DMF (1,4 мкл, 0,018 ммоль) добавляли в смесь 2-(2-хлор-4-фторфенокси)-6-метилбензойной кислоты (100 мг, 0,36 ммоль), CH2Cl2 (2,0 мл) и SOCl2 (33,8 мкл, 0,46 ммоль) при комнатной температуре. Обеспечивали перемешивание смеси в течение 1,5 часов перед ее концентрированием при пониженном давлении. Осадок помещали в высокий вакуум на 30 минут перед тем, как его поглощали CH2Cl2 (2,0 мл) и добавляли в смесь 3-аминобензолсульфонамида (92,0 мг, 0,53 ммоль), Et3N (86,5 мкл, 1,07 ммоль) и CH2Cl2 (2,0 мл) при комнатной температуре. Обеспечивали перемешивание смеси в течение 2 час при комнатной температуре перед ее распределением между 1Н HCl и CH2Cl2. Слои разделяли, и органический слой промывали насыщенным солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Осадок подвергали препаративной ВЭЖХ (10-90% ACN/вода с 0,01% HCl) с получением 2-(2-хлор-4-фторфенокси)-6-метил-N-(3-сульфамоилфенил)бензамида (38) (6,5 мг, 4%). Масса/заряд по ESI-MS: расчетное 434,05, обнаруженное 435,5 (M+1)+; Время удержания: 1,72 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,83 (s, 1H), 8,41-8,36 (m, 1H), 7,76 (dt, J=7,1, 2,0 Гц, 1H), 7,63-7,51 (m, 3H), 7,39 (s, 2H), 7,34-7,25 (m, 3H), 7,12-7,07 (m, 1H), 6,61 (t, J=8,0 Гц, 1H), 2,35 (s, 3H) м.д.
ПРИМЕР 26
Получение 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (3)
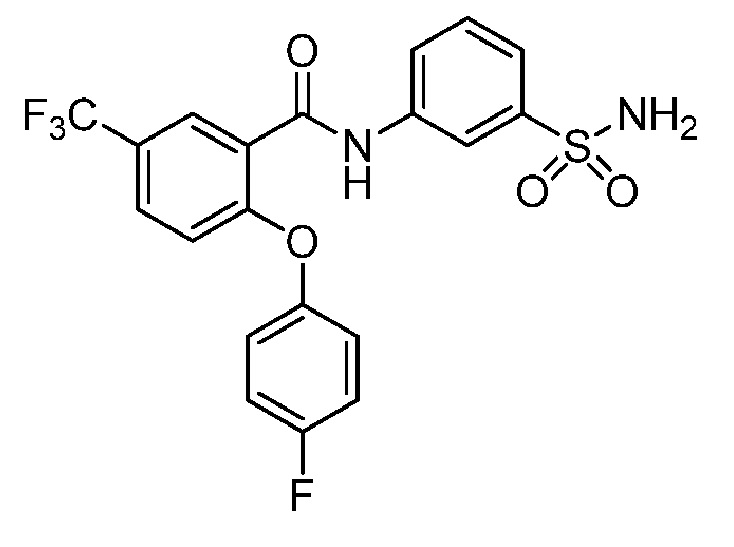
[00264] Смесь 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (9,0 г, 24,8 ммоль), 4-фторфенола (8,4 г, 74,5 ммоль), карбоната цезия (24,3 г, 74,5 ммоль) и DMF (225,0 мл) нагревали при 100°C в течение 0,5 часов. Смесь охлаждали до комнатной температуры перед ее распределением между этилацетатом и водой. Слои разделяли, и водный слой экстрагировали этилацетатом (3x). Объединенные органические слои промывали насыщенным водным NH4Cl, водой и насыщенным солевым раствором. Органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Осадок очищали посредством хроматографии на колонке (0-100% этилацетат/гексаны) с получением грязно-белого твердого вещества. Твердое вещество суспендировали с помощью гексана, затем фильтровали. Это твердое вещество суспендировали в простом диэтиловом эфире и фильтровали (2x). Твердое вещество помещали в вакуум при 55°C на 1 час с получением 2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (3) (8,6 г, 77%). Масса/заряд по ESI-MS: расчетное 454,06, обнаруженное 455,5 (M+1)+; Время удержания: 1,87 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,81 (s, 1H), 8,30 (s, 1H), 8,01 (d, J=2,1 Гц, 1H), 7,82 (ddd, J=8,9, 4,8, 2,2 Гц, 2H), 7,61-7,49 (m, 2H), 7,40 (s, 2H), 7,35-7,23 (m, 4H), 7,00 (d, J=8,7 Гц, 1H) м.д.
ПРИМЕР 27
Получение 2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (25)
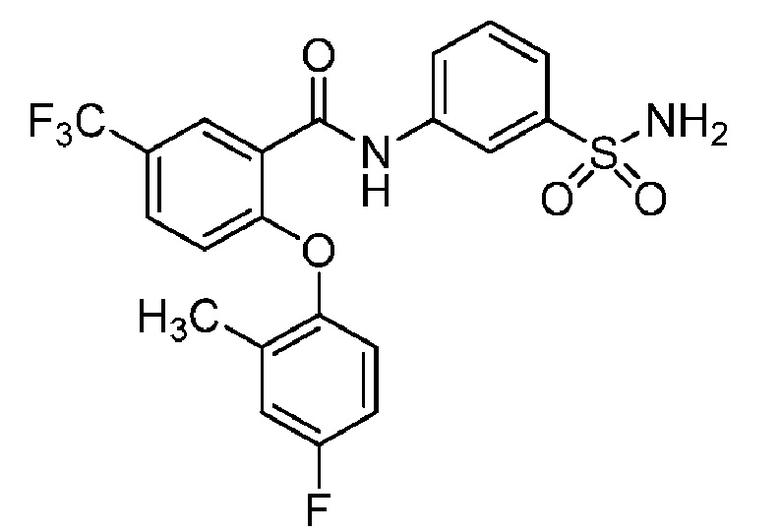
[00265] К смеси 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (10 г, 27,60 ммоль) в DMF (55,00 мл) добавляли 4-фтор-2-метил-фенол (3,7 г, 28,98 ммоль) и карбонат цезия (10,8 г, 33,12 ммоль), и смесь нагревали при 100°C в течение 1 час. Смесь охлаждали до температуры окружающей среды и разводили 300 мл ледяной воды. Смесь подкисляли с помощью 6Н HCl и разводили до объема 400 мл водой. Взвесь разводили в 400 мл этилацетата, и органическую фазу отделяли. Органическую фазу промывали 400 мл воды, а затем 400 мл насыщенного солевого раствора. Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное твердое вещество разводили в 100 мл ацетонитрила и нагревали до гомогенности. Смесь перемешивали при 25°C, преципитат собирали фильтрацией и промывали 25 мл ацетонитрила с получением 2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (25) (4,14 г, 32%). Масса/заряд по ESI-MS: расчетное 468,08, обнаруженное 469,20 (M+1)+; Время удержания: 1,81 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,83 (s, 1H), 8,33 (s, 1H), 8,01 (d, J=2,1 Гц, 1H), 7,81 (m, 2H), 7,56 (m, 2H), 7,40 (s, 2H), 7,23 (ddd, J=13,9, 9,1, 4,0 Гц, 2H), 7,14 (td, J=8,6, 3,1 Гц, 1H), 6,82 (d, J=8,7 Гц, 1H), 2,15 (s, 3H) м.д.
ПРИМЕР 28
Получение 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (26)
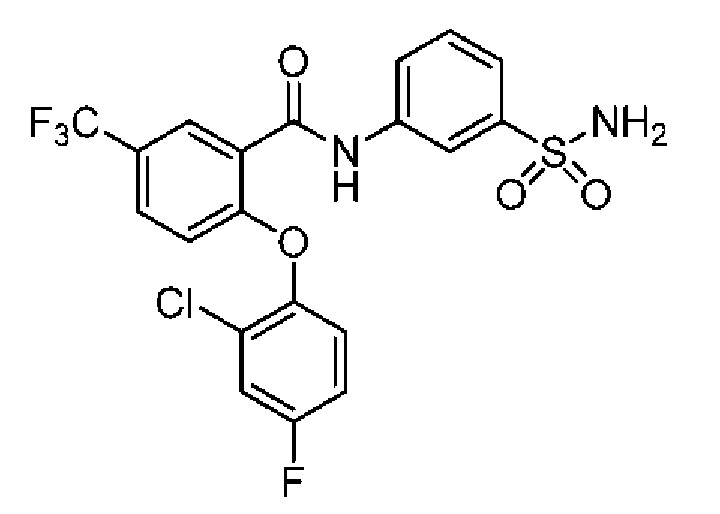
[00266] Смесь 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (15 г, 41,40 ммоль), 2-хлор-4-фторфенола (17,35 г, 118,4 ммоль), карбоната цезия (40,47 г, 124,20 ммоль) и DMF (375,0 мл) нагревали при 100°C в течение 1 часа и 15 минут. Смесь охлаждали до комнатной температуры и фильтровали с использованием этилацетата. Добавляли воду к фильтрату. Слои разделяли, и водный слой экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали насыщенным водным раствором NH4C1, водой и насыщенным солевым раствором. Органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством хроматографии на силикагеле с использованием градиента этилацетата в дихлорметане (0-10%). Фракции, содержащие желательный продукт, концентрировали, и полученное твердое вещество суспендировали в простом эфире и гексанах, и фильтровали. Растворитель выпаривали при пониженном давлении с получением 2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида (26) (10,35 г, 50%) в виде светло-розового твердого вещества. Масса/заряд по ESI-MS: расчетное 488,02, обнаруженное 489,2 (M+1)+; Время удержания: 2,03 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,83 (s, 1H), 8,37-8,27 (m, 1H), 8,04 (d, J=2,1 Гц, 1H), 7,92-7,74 (m, 2H), 7,69 (dd, J=8,4, 3,0 Гц, 1H), 7,63-7,50 (m, 2H), 7,50-7,28 (m, 4H), 6,92 (d, J=8,7 Гц, 1H) м.д.
[00267] Следуя способу, сходному с тем, какой описан выше для соединения (26), следующие соединения получали, начиная с 2-фтор-N-(3-сульфамоилфенил)-5-(трифторметил)бензамида и фенолов, перечисленных ниже.


ПРИМЕР 29
Получение 5-фтор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (21)

[00268] К раствору 2,5-дифтор-N-(3-сульфамоилфенил)бензамида (200 мг, 0,64 ммоль) в DMF (2 мл) добавляли 4-фтор-2-метоксифенол (72,99 мкл, 0,64 ммоль) и карбонат цезия (1,0 г, 3,2 ммоль), и смесь нагревали при 100°C в течение 3 часов. Реакционную смесь охлаждали до 25°C, разводили этилацетатом и выливали в воду. 2 слоя разделяли, и водный слой экстрагировали этилацетатом (2x). Органические вещества объединяли, высушивали над MgSO4, фильтровали и выпаривали с получением красного масла, которое очищали посредством хроматографии на колонке с использованием градиента этилацетата и гексанов с получением 5-фтор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (21) (7,2 мг, 3%). Масса/заряд по ESI-MS: расчетное 434,07, обнаруженное 435,3 (M+1)+; Время удержания: 1,8 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,64 (s, 1H), 8,31 (s, 1H), 7,80 (d, J=6,2 Гц, 1H), 7,52 (m, 3H), 7,39 (s, 2H), 7,29 (dd, J=11,2, 5,7 Гц, 1H), 7,19 (dd, J=8,4, 5,8 Гц, 1H), 7,10 (m, 1H), 6,78 (m, 2H), 3,74 (s, 3H) м.д.
ПРИМЕР 30
Получение 4-циано-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (10)
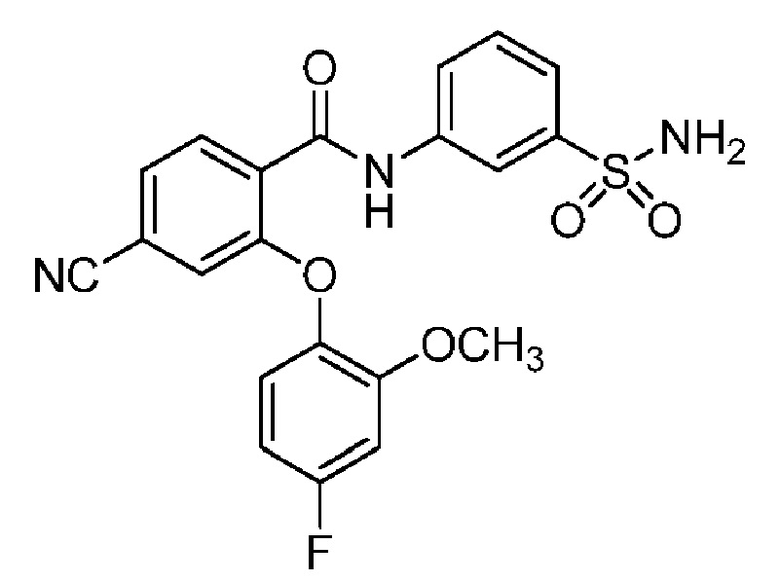
[00269] К раствору 4-циано-2-фтор-N-(3-сульфамоилфенил)бензамида (19,2 мг, 0,06 ммоль) и 4-фтор-2-метоксифенола (42,6 мг, 0,3 ммоль) в NMP (0,5 мл) добавляли Cs2CO3 (97,7 мг, 0,3 ммоль), и смесь перемешивали при 90°C в течение 4 часов. Реакционную смесь фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде (1-99%) с получением 4-циано-2-(4-фтор-2-метокси-фенокси)-N-(3-сульфамоилфенил)бензамида. Масса/заряд по ESI-MS: расчетное 441,08, обнаруженное 442,3 (M+1)+; Время удержания: 1,53 минут (пропускание 3 минуты).
[00270] Следуя способу, сходному с тем, какой описан выше для соединения (10), следующие соединения получали, начиная с 4-циано-2-фтор-N-(3-сульфамоилфенил)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 31
Получение 2-(2-хлор-4-фторфенокси)-5-циано-N-(3-сульфамоилфенил)бензамида (11)
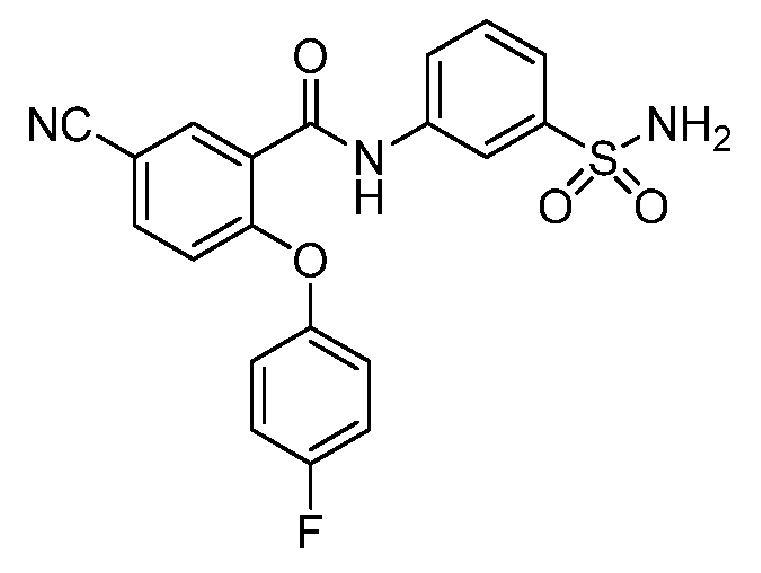
[00271] К раствору 5-циано-2-фтор-N-(3-сульфамоилфенил)бензамида (31,9 мг, 0,10 ммоль) и 2-хлор-4-фторфенола (44,0 мг, 0,30 ммоль) в NMP (0,5 мл) добавляли Cs2CO3 (97,7 мг, 0,30 ммоль), и смесь перемешивали при 90°C в течение 4 часов. Реакционную смесь фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде (1-99%) с использованием HCl в качестве модификатора с получением 2-(2-хлор-4-фторфенокси)-5-циано-N-(3-сульфамоилфенил)бензамида (11) (5,8 мг, 13%). Масса/заряд по ESI-MS: расчетное 445,03, обнаруженное 446,1 (M+1)+; Время удержания: 1,57 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,84 (s, 1H), 8,33 (s, 1H), 8,20 (d, J=2,0 Гц, 1H), 7,92 (d, J=8,7 Гц, 1H), 7,81 (d, J=6,9 Гц, 1H), 7,69 (dd, J=8,3, 2,8 Гц, 1H), 7,60-7,54 (m, 2H), 7,48 (dd, J=9,1, 5,2 Гц, 1H), 7,44-7,34 (m, 3H), 6,88 (d, J=8,7 Гц, 1H) м.д.
ПРИМЕР 32
Получение 4-хлор-2-(4-фторфенокси)-5-метил-N-(3-сульфамоилфенил)бензамида (7)

[00272] К раствору 5-бром-4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида (122,3 мг, 0,3 ммоль) и 4-фторфенола (100,9 мг, 0,9 ммоль) в N,N-диметилформамиде (3 мл) добавляли карбонат цезия (293,2 мг, 0,9 ммоль), и реакционную смесь нагревали при 100°C в течение 2 часов. Реакционную смесь фильтровали и очищали посредством обращеннофазовой препаративной хроматографии с использованием градиента 20-99% ацетонитрила в воде, содержащего HCl в качестве модификатора с получением 5-бром-4-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамида (59,5 мг, 40%).
[00273] К 5-бром-4-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамиду (44 мг, 0,09 ммоль), метилбороновой кислоте (7,9 мг, 0,13 ммоль), тетракис(трифенилфосфин)палладию (0) (5,3 мг, 0,004 ммоль) и 1,2-диметоксиэтану (500 мкл) добавляли карбонат натрия (132,1 мкл 2 M раствора, 0,26 ммоль) и реакционную смесь нагревали при 80°C в течение 65 часов. Реакционную смесь фильтровали, и растворитель выпаривали. Неочищенный продукт очищали посредством обращеннофазовой LCMS с использованием ацетонитрила и воды, содержащих HCl в качестве модификатора, с получением 4-хлор-2-(4-фторфенокси)-5-метил-N-(3-сульфамоилфенил)бензамида (7) (12,1 мг, 29%) в виде желтого твердого вещества. Масса/заряд по ESI-MS: расчетное 434,05, обнаруженное 435,15 (M+1)+; Время удержания: 1,8 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,65 (s, 1H), 8,30-8,24 (m, 1H), 7,81-7,72 (m, 1H), 7,68 (s, 1H), 7,58-7,48 (m, 2H), 7,38 (s, 2H), 7,29-7,18 (m, 2H), 7,18-7,09 (m, 2H), 6,98 (s, 1H), 2,36 (s, 3H) м.д.
ПРИМЕР 33
Получение 4-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамида (8)

[00274] К раствору 4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида (39,4 мг, 0,12 ммоль) и 2-хлор-4-фторфенола (52,8 мг, 0,36 ммоль) в DMF (0,8 мл) добавляли карбонат цезия (117,3 мг, 0,36 ммоль), и реакционную смесь нагревали при 100°C в течение 1 часа. Реакционную смесь фильтровали и очищали посредством обращеннофазовой препаративной хроматографии с использованием градиента 10-99% ацетонитрила в воде, содержащего HCl в качестве модификатора с получением 4-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамида (8) (1,7 мг, 3%). Масса/заряд по ESI-MS: расчетное 454,00, обнаруженное 455,3 (M+1)+; Время удержания: 1,73 минут (пропускание 3 минуты).
[00275] Следуя способу, сходному с тем, какой описан выше для соединения (8), следующие соединения получали, начиная с 4-хлор-2-фтор-N-(3-сульфамоилфенил)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 34
Получение 2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамида (40)

[00276] 5 (дифторметил)-2-фтор-N-(3-сульфамоилфенил)бензамид (75 мг, 0,22 ммоль), 2-хлор-4-фторфенол (95,7 мг, 0,65 ммоль) и карбонат цезия (212,9 мг, 0,65 ммоль) в NMP (0,75 мл) перемешивали при 90°C в течение 2 часов. Реакционную смесь разбавляли MeOH, фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде (1-99%) и HCl в качестве модификатора с получением 2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамида (40) (56 мг, 53%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 470,03, обнаруженное 471,3 (M+1)+; Время удержания: 1,63 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,77 (s, 1H), 8,32 (s, 1H), 7,87 (s, 1H), 7,85-7,78 (m, 1H), 7,72-7,64 (m, 2H), 7,60-7,53 (m, 2H), 7,39 (s br, 3H), 7,35 (d, J=8,1 Гц, 1H), 7,10 (t, J=55,8 Гц, 1H), 6,89 (d, J=8,5 Гц, 1H) м.д.
[00277] К 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамиду (75,7 мг, 0,2 ммоль) добавляли 4-фтор-2-метоксифенол (68,3 мкл, 0,6 ммоль), карбонат цезия (195,5 мг, 0,6 ммоль) и N-метилпирролидинон (2 мл), и реакционную смесь перемешивали при 100°C в течение 30 минут - 2 часов. Реакционную смесь фильтровали и смесь очищали посредством обращеннофазовой препаративной хроматографии с использованием градиента 10-99% ацетонитрила в воде, содержащего HCl в качестве модификатора с получением 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамида (54) (27,8 мг, 27%). Масса/заряд по ESI-MS: расчетное 500,07, обнаруженное 501,2 (M+1)+; Время удержания: 1,99 минут (пропускание 3 минуты). 1H-ЯМР (DMSO-d6) δ 10,68 (s, 1H), 8,37-8,30 (m, 1H), 7,84-7,79 (m, 1H), 7,77 (d, J=8,4 Гц, 1H), 7,60-7,50 (m, 2H), 7,40 (s, 2H), 7,37-7,28 (m, 1H), 7,23-7,11 (m, 2H), 6,93-6,82 (m, 1H), 6,58-6,50 (m, 1H), 3,75 (s, 3H) м.д.
[00278] Следующие соединения получали с использованием экспериментального способа, сходного со способом для соединения (54) выше, начиная с 2-фтор-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 36
Получение 2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамида (70)

[00279] 2-фтор-4-(1,1,2,2,2-пентафторэтил)-N-(3-сульфамоилфенил)бензамид (34,2 мг, 0,1 ммоль), 2-метокси-4-фторфенол (34,2 мкл, 0,3 ммоль) и Cs2CO3 (97,8 мг, 0,3 ммоль) в NMP (0,4 мл) перемешивали при 80°C в течение 2 часов. Очисткой посредством ВЭЖХ с использованием градиента 1-99% ацетонитрила в воде, с использованием HCl в качестве модификатора, получали 2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамида (70) (17,8 мг, 33%). Масса/заряд по ESI-MS: расчетное 534,07, обнаруженное 535,3 (M+1)+; Время удержания: 1,78 минут (пропускание 3 минуты).
[00280] Следующие соединения получали с использованием экспериментального способа, сходного с тем, какой использовали для соединения (70) выше, начиная с 2-фтор-4-(1,1,2,2,2-пентафторэтил)-N-(3-сульфамоилфенил)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 37
Получение 4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (77)

[00281] 4,5-дихлор-2-фтор-N-(3-сульфамоилфенил)бензамид (50 мг, 0,14 ммоль), 4-фтор-2-метоксифенол (17,3 мкл, 0,15 ммоль), и K2CO3 (57,1 мг, 0,41 ммоль) объединяли в DMF (0,5 мл) и нагревали при 75°C в течение 12 часов. Реакционную смесь фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде 10-99% и 5 мМ HCl в подвижной фазе для получения 4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (77) (7,5 мг, 11%). Масса/заряд по ESI-MS: расчетное 484,01, обнаруженное 485,3 (M+1)+; Время удержания: 1,74 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6) δ 10,70 (s, 1H), 8,33-8,26 (m, 1H), 7,93 (s, 1H), 7,80 (dt, J=6,4, 2,3 Гц, 1H), 7,60-7,49 (m, 2H), 7,40 (s, 2H), 7,29 (dd, J=8,8, 5,8 Гц, 1H), 7,14 (dd, J=10,7, 2,9 Гц, 1H), 6,89-6,79 (m, 2H), 3,76 (s, 3H) м.д.
[00282] Следующие соединения получали с использованием экспериментального способа, сходного со способом для соединения (77) выше, начиная с 4,5-дихлор-2-фтор-N-(3-сульфамоилфенил)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 38
Получение 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамида (89)
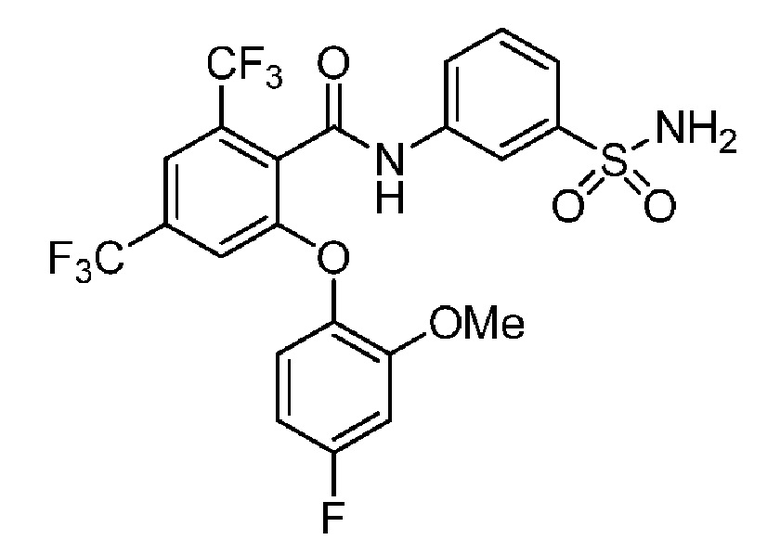
[00283] К 2-фтор-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамиду (70 мг, 0,16 ммоль) и 4-фтор-2-метоксифенолу (20,4 мкл, 0,18 ммоль) в DMF (68,4 мкл) добавляли К2СО3 (67,5 мг, 0,49 ммоль). Реакционную смесь перемешивали при 70°C в течение 2 часов, затем при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде (10-99%) с получением 2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамида (89) (44,9 мг, 50%). Масса/заряд по ESI-MS: расчетное 552,06, обнаруженное 553,2 (M+1)+; Время удержания: 1,87 минут (пропускание 3 минуты).
[00284] Следующие соединения получали с использованием экспериментального способа, сходного со способом для соединения (89) выше, начиная с 2-фтор-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамида и фенолов, перечисленных ниже.
ПРИМЕР 39
Получение 2,4-дихлор-6-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (95)

[00285] Смесь 2,4-дихлор-6-фтор-N-(3-сульфамоилфенил)бензамида (36,3 мг, 0,1 ммоль), 4-фтор-2-метоксифенол (34,2 мкл, 0,30 ммоль) и Cs2CO3 (97,7 мг, 0,3 ммоль) в NMP (0,4 мл) перемешивали в течение 1 часа при 80°C. Реакционную смесь разбавляли метанолом, фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрил/вода (1-99%) и HCl в качестве модификатора с получением 2,4-дихлор-6-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамида (95) (6,5 мг, 13%) в виде белого твердого вещества. Масса/заряд по ESI-MS: расчетное 484,01, обнаруженное 485,5 (M+1)+; Время удержания: 1,58 минут (пропускание 3 минуты). 1H ЯМР (400 МГц, DMSO-d6)5 11,02 (s, 1H), 8,34 (s, 1H), 7,81-7,74 (m, 1H), 7,61-7,53 (m, 2H), 7,48 (d, J=1,8 Гц, 1H), 7,41 (s, 2H), 7,21 (dd, J=8,8, 5,8 Гц, 1H), 7,15 (dd, J=10,6, 2,9 Гц, 1H), 6,89-6,81 (m, 1H), 6,60 (d, J=1,8 Гц, 1H), 3,78 (s, 3H) м.д.
[00286] Следующие соединения получали с использованием экспериментального способа, сходного со способом для соединения (95) выше, начиная с 2,4-дихлор-6-фтор-N-(3-сульфамоилфенил)бензамида и фенолов, перечисленных ниже.
(трифторметокси)фенол
ПРИМЕР 40
Получение 2-циклопропил-6-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (100)

[00287] К смеси 2-циклопропил-6-фтор-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (20 мг, 0,08 ммоль) и 3-фтор-4-метоксифенола (17,7 мг, 0,12 ммоль) в DMF (0,5 мл) добавляли К2СО3 (41,2 мг, 0,3 ммоль), и реакционную смесь перемешивали при 100°C в течение 2 часов, затем при 80°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, фильтровали и очищали посредством обращеннофазовой ВЭЖХ с использованием градиента ацетонитрила в воде (1-99%) и HCl в качестве модификатора с получением 2-циклопропил-6-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамида (100) (3,69 мг, 9%). Масса/заряд по ESI-MS: расчетное 524,10, обнаруженное 525,2 (M+1)+; Время удержания: 1,50 минут (пропускание 3 минуты).
ПРИМЕР 41
[00288] Аналитические данные для соединений по настоящему изобретению представлены ниже в таблице 2. Масс-спектры (например, данные M+1 в таблице 2), конечную чистоту и время удержания определяли посредством обращеннофазовой ВЭЖХ с использованием колонки Kinetix C18 (50×2,1 мм, частицы 1,7 мкм) от PHenOmenex (pn: 00B-4475-AN)), и двойного пропускания градиента 1-99% подвижной фазы В в течение 3 минут. Подвижная фаза A=H20 (0,05% CF3CO2H). Подвижная фаза В=CH3CN (0,05% CF3CO2H). Скорость потока=2 мл/мин, объем впрыска=3 мкл и температура колонки=50°C.
Аналитические данные
ПРИМЕР 42
АНАЛИЗЫ ДЛЯ ДЕТЕКЦИИ И ИЗМЕРЕНИЯ СВОЙСТВ ИНГИБИРОВАНИЯ NaV СОЕДИНЕНИЙ
Способ оптического анализа мембранного потенциала E-VIPR с электрической стимуляцией
[00290] Натриевые каналы представляют собой потенциалозависимые белки, которые можно актировать индукцией изменений напряжения на мембранах посредством приложения электрических полей. Устройство для электрической стимуляции и способы применения описаны в IOn CHannel Assay MethOds PCT/US01/21652, включенной в настоящий документ в качестве ссылки, и обозначены как E-VIPR. Устройство содержит держатель планшета для микротитрования, оптическую систему для возбуждения кумаринового красителя при одновременной регистрации излучения кумарина и оксонола, генератор волновых сигналов, усилитель с управляемой силой тока или напряжением и устройство для вставки электродов в лунку. Под контролем встроенного компьютера это устройство осуществляет запрограммированную пользователем по протоколу электрическую стимуляцию клеток в лунках планшета для микротитрования.
[00291] За 24 часа до анализа на E-VIPR клетки HEK, экспрессирующие NaV1.8 человека, высевали в 384-луночные покрытые полилизином планшеты при 15000-20000 клеток на лунку. HEK клетки выращивали в средах (точный состав является специфическим для каждого типа клеток и подтипа NaV), дополненных 10% FBS (эмбриональная телячья сыворотка, сертифицированная; GibcOBRL #16140-071) и 1% Pen-Strep (пенициллин-стрептомицин; GibcOBRL #15140-122). Клетки выращивали в колбах с крышкой с отверстием, при 90% влажности и 5% CO2.
Реагенты и Растворы:
[00292] 100 мг/мл плюроник F-127 (Sigma #P2443) в сухом DMSO
[00293] Планшеты для соединений: 384-луночные круглодонные планшеты, например, 384-луночный полипропиленовый круглодонный планшет #3656 от Corning
[00294] Планшеты для клеток: 384-луночные планшеты, обработанные для культивирования клеток, например, Greiner #781091-1B
[00295] 10 мМ DiSBAC6(3) (Aurora #00-100-010) в сухом DMSO
[00296] 10 мМ CC2-DMPE (AurOra #00-100-008) в сухом DMSO
[00297] 200 мМ ABSC1 в H2O
[00298] Буфер для промывки 1: глюкоза 10 мМ (1,8 г/л), хлорид магния (безводный), 1 мМ (0,095 г/л), хлорид кальция, 2 мМ (0,222 г/л), HEPES 10 мМ (2,38 г/л), хлорид калия, 4,5 мМ (0,335 г/л), хлорид натрия 160 мМ (9,35 г/л).
[00299] Раствор гексилового красителя: буфер для промывки 1+0,5% β-циклодекстрин (получали его перед использованием, Sigma #C4767), 8 мкМ CC2-DMPE+2,5 мкМ DiSBAC6(3). Для получения раствора добавляли объем 10% исходного раствора плюроника F127, равный объемам CC2-DMPE+DiSBAC6(3). Порядок получения: сначала смешивали плюроник и CC2-DMPE, затем добавляли DiSBAC6(3) при встряхивании, затем добавляли буфер для промывки 1+β-циклодекстрин.
Протокол анализа:
[00300] 1) Предварительно наносили пятна соединений (в чистом DMSO) в планшеты для соединений. Носитель для контроля (чистый DMSO), положительный контроль (20 мМ исходный раствор тетракаина в DMSO, конечная концентрация при анализе 125 мкМ) и тестируемые соединения добавляли в каждую лунку при 160x желательной конечной концентрации в чистом DMSO. Конечный объем в планшете для соединений составлял 80 мкл (80-кратное промежуточное разведение из 1 мкл пятна в DMSO; 160-кратное конечное разведение после переноса в планшет для клеток). Конечная концентрация DMSO для всех лунок в анализе составляла 0,625%.
[00301] 2) Получали раствор гексилового красителя.
[00302] 3) Получали планшеты с клетками. На сутки анализа, среду отбирали и клетки промывали три раза 100 мкл раствора для промывки 1, сохраняя остаточный объем 25 мкл в каждой лунке.
[00303] 4) Распределяли по 25 мкл на лунку раствора гексилового красителя в планшеты для клеток. Инкубировали в течение 20-35 минут при комнатной температуре или условиях окружающей среды.
[00304] 5) Распределяли по 80 мкл на лунку буфера для промывки 1 в планшеты для соединений. Добавляли кислый желтый-17 (1 мМ) и хлорид калия изменяли от 4,5 до 20 мМ в зависимости от подтипа NaV и чувствительности анализа.
[00305] 6) Промывали планшеты для клеток три раза по 100 мкл на лунку буфера для промывки 1, оставляя 25 мкл остаточного объема. Затем переносили по 25 мкл на лунку из планшетов для соединений в планшеты для клеток. Инкубировали в течение 20-35 минут при комнатной температуре/условиях окружающей среды.
[00306] 7) Считывали планшеты на E-VIPR. Использовали усилитель с управляемой силой тока для доставки стимулирующих волновых импульсов в течение 10 секунд и при частоте сканирования 200 Гц. Регистрацию до стимуляции проводили в течение 0,5 секунд для получения исходных значений интенсивности без стимуляции. За стимулирующей формой волны следовало 0,5 секунд регистрации после стимуляции для исследования релаксации клеток до состояния покоя.
Анализ данных
[00307] Данные анализировали и регистрировали в виде нормализованных соотношений интенсивности излучения, измеренной в каналах 460 нм и 580 нм. Ответ как функцию времени регистрировали в виде соотношений, полученных с использованием следующей формулы:
[00308] Данные дополнительно упрощали посредством вычисления начального (Ri) и конечного (RF) соотношений. Они представляли собой средние значения соотношений во время частичного или полного периода перед стимуляцией, и в точках измерения в период стимуляции. Затем рассчитывали ответ на стимул R=RF/Ri; и регистрировали как функцию от времени.
[00309] Контрольные значения ответа получали посредством проведения анализов в присутствии соединения с желательными свойствами (положительного контроля), такого как тетракаин, и в отсутствие фармакологических средств (отрицательный контроль). Ответы на отрицательный (N) и положительный (P) контроль рассчитывали, как выше. Активность антагониста A соединения определяют как:

где R представляет собой соотношение ответов для тестируемого соединения
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ АНАЛИЗЫ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ NaV И ИНГИБИРОВАНИЯ ТЕСТИРУЕМЫМИ СОЕДИНЕНИЯМИ
[00310] Электрофизиологический способ фиксации потенциала использовали для оценки эффективности и селективности блокаторов натриевых каналов в нейронах ганглиев дорсального корешка. Нейроны крысы выделяли из ганглиев дорсального корешка и поддерживали в культуре в течение 2-10 суток в присутствии NGF (50 нг/мл) (среды для культивирования, состоящей из Neurobasa1A, дополненной B27, глутамином и антибиотиками). Нейроны малого диаметра (ноцицепторы диаметром 8-12 мкм) идентифицировали визуально и зондировали тонкими наконечниками стеклянных электродов, соединенных с усилителем (AxOn Instruments). Режим «фиксации напряжения» использовали для оценки IC50 соединения, поддерживая клетки при - 60 мВ. Кроме того, режим «фиксации тока» использовали для тестирования эффективности соединений в блокировании возникновения потенциалов действия в ответ на стимуляцию током. Результаты этих экспериментов внесли свой вклад в определение профиля эффективности соединений.
[00311] Соединения, проиллюстрированные в таблице 1 в настоящем документе, проявляют активность против натриевых каналов NaV1.8, как измерено с использованием анализов, описываемых в настоящем документе, и как представлено в таблице 3 ниже.
IC50 активности для NaV1.8
ПРИМЕР 43
[00313] Анализы на IonWorks. Этот анализ проводили для определения активности для соединений по настоящему изобретению против не относящихся к NaV1.8 каналов. Натриевые токи регистрировали с использованием автоматической системы с фиксацией потенциала, IonWorks (Molecular Devices Corporation, Inc.). Клетки, экспрессирующие подтипы NaV, собирали из тканевой культуры и помещали в суспензию при 0,5-4 миллиона клеток на мл буфер для промывки 1. Устройство IonWorks измеряло изменения натриевых токов в ответ на применяемый фиксированный потенциал способом, сходным с общепринятым анализом с фиксацией потенциала, за исключением 384-луночного формата. С использованием IonWorks, зависимость доза-ответ определяли в режиме фиксации напряжения посредством деполяризации клеток от специфического для эксперимента исходного потенциала до тестового потенциала приблизительно 0 мВ до и после добавления тестируемого соединения. Влияние соединений на токи измеряли при тестовом потенциале.
ПРИМЕР 44
[00314] Протокол анализа микросом печени человека: Данные о стабильности микросом печени получали следующим образом. Субстраты инкубировали при 37°C и встряхивали в течение 30 минут в забуференном фосфатом растворе с микросомами печени человека и кофактором NADPH. Подобным образом получали контроль для нулевого времени, однако с исключением NADPH. Конечные концентрации при инкубации составляли 1 мкМ субстрат (0,2% DMSO), 0,5 мг/мл микросом печени, 2 мМ NADPH и 0,1 M фосфат. Реакции останавливали, и белки преципитировали с помощью добавления 2 объемных эквивалентов ледяного ацетонитрила, содержащего внутренний стандарт. После стадии центрифугирования, аликвоты из инкубационных смесей после остановки реакции дополнительно разводили 4 объемными эквивалентами 50% водного раствора метанола, а затем подвергали анализу LC/MS/MS для количественной оценки исходного субстрата. Значения стабильности микросом рассчитывали как процент субстрата, оставшийся через 30 минут, по отношению к контролю для нулевого времени.
[00315] Таблица 4. Данные для микросом печени человека (HLM) для избранных соединений по настоящему изобретению перечислены ниже. Представленные значения представляют собой процент соединения, оставшийся через 30 минут, с использованием протокола, описанного выше в примере 44. Соединения с зарегистрированными >100% процентами без изменения через 30 минут инкубации представляют соединения, не подвергавшиеся метаболизму в условиях анализа. Значения, превышающие 100%, были обусловлены изменчивостью аналитического количественного определения в анализе. Сокращение «ND» означает отсутствие данных.
[00316] Множество модификаций и изменений вариантов осуществления, описанных в настоящем документе, можно осуществлять без отклонения от его объема, как очевидно специалистам в данной области.
Конкретные варианты осуществления, описываемые в настоящем документе, предложены только в качестве примера.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОЛЕКАРСТВА ПИРИДОНАМИДОВ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2692766C1 |
| ПРОЛЕКАРСТВА ПИРИДОНАМИДОВ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2811402C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| АМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2658920C2 |
| ПИРИДОНАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2662223C2 |
| ПИРИДОНАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2808424C2 |
| АМИДЫ ХИНОЛИНА И ХИНАЗОЛИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2683788C2 |
| ПРОИЗВОДНОЕ 6-ОКСО-1,6-ДИГИДРОПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2020 |
|
RU2791534C2 |
| ИНГИБИТОРЫ ИОННОГО КАНАЛА, ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ПРИМЕНЕНИЕ | 2016 |
|
RU2746188C2 |
| СОЕДИНЕНИЯ 2,3-ДИГИДРОХИНАЗОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NaV1.8 | 2020 |
|
RU2833870C2 |
Изобретение относится к соединениям формулы I или их фармацевтически приемлемым солям, где R1 представляет собой H, Cl, CH3, CF3 или циклопропил; R2 представляет собой H, F, Cl, CN, CH3, CF3 или CHF2; R3 представляет собой H, F, Cl, CN, CF3, OCF3 или CF2CF3; R4 представляет собой H; R5 представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; R5’ представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2; R6 представляет собой H, F или Cl; R6' представляет собой H, F или Cl и R7 представляет собой H, F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2, при условии что R1, R2, и R3 одновременно не представляют собой водород и что R5, R5’, R6, R6’ и R7 одновременно не представляют собой водород. Изобретение также относится к фармацевтическим композициям, представляющим собой ингибитор натриевых каналов, содержащим соединения по изобретению, и к способам использования композиций в лечении различных нарушений, включая боль. Технический результат – получены новые соединения и фармацевтические композиции на их основе, которые могут найти применение в медицине для лечения боли. 6 н. и 33 з.п. ф-лы, 3 табл., 44 пр.
 I
I
1. Соединение формулы I
 I
I
или его фармацевтически приемлемая соль,
где независимо для каждого появления:
R1 представляет собой H, Cl, CH3, CF3 или циклопропил;
R2 представляет собой H, F, Cl, CN, CH3, CF3 или CHF2;
R3 представляет собой H, F, Cl, CN, CF3, OCF3 или CF2CF3;
R4 представляет собой H;
R5 представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
R5’ представляет собой H, F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2;
R6 представляет собой H, F или Cl;
R6' представляет собой H, F или Cl и
R7 представляет собой H, F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2,
при условии что R1, R2, и R3 одновременно не представляют собой водород; и
что R5, R5’, R6, R6’ и R7 одновременно не представляют собой водород.
2. Соединение или соль по п. 1, где R1 представляет собой H, CF3 или Cl.
3. Соединение или соль по п. 1 или 2, где R1 представляет собой H или CF3.
4. Соединение или соль по п. 1, где R2 представляет собой H, CF3 или Cl.
5. Соединение или соль по п. 4, где R2 представляет собой H или CF3.
6. Соединение или соль по п. 1, где R3 представляет собой H, CF3, Cl или OCF3.
7. Соединение или соль по п. 6, где R3 представляет собой H, CF3 или Cl.
8. Соединение или соль по п. 1, где R5 представляет собой H.
9. Соединение или соль по п. 1, где R6 или R6’ представляет собой H или F.
10. Соединение или соль по п. 1, где R7 представляет собой F, Cl, OCH3 или OCF3.
11. Соединение или соль по п. 10, где R7 представляет собой F или OCH3.
12. Соединение или соль по п. 1, где соединение обладает формулой I-D:
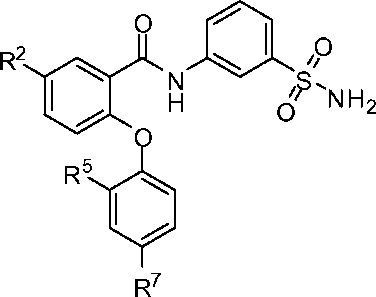 I-D
I-D
где независимо для каждого появления:
R2 представляет собой F, Cl, CN, CH3, CF3 или CHF2;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2 и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
13. Соединение или соль по п. 12, где R2 представляет собой Cl или CF3.
14. Соединение или соль по п. 12 или 13, где R5 представляет собой F, Cl, CH3 или OCH3.
15. Соединение или соль по п. 12, где R7 представляет собой F, Cl, OCH3 или OCF3.
16. Соединение или соль по п. 1, где соединение обладает формулой 1-Е:
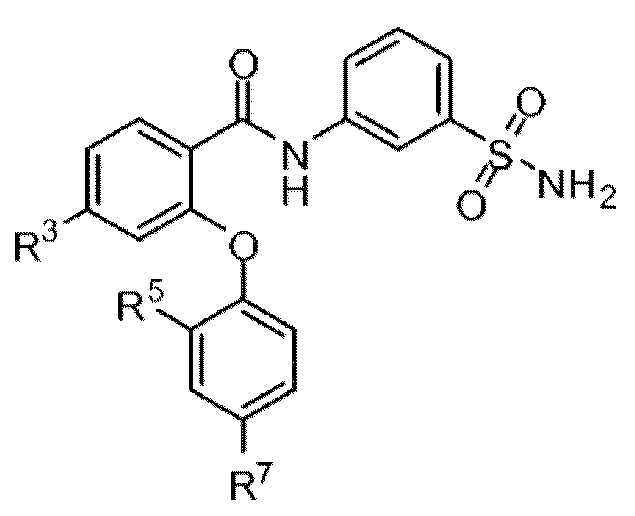 I-Е
I-Е
где независимо для каждого появления:
R3 представляет собой F, Cl, CN, CF3, OCF3 или CF2CF3;
R5 представляет собой F, Cl, CH3, OCH3, OCH2CH3, OCH2CH2CH3 или OCHF2 и
R7 представляет собой F, Cl, OCH3, OCF3, OCH2CH3, OCH(CH3)2 или OCHF2.
17. Соединение или соль по п. 16, где R3 представляет собой Cl, CF3 или OCF3.
18. Соединение или соль по п. 16 или 17, где R5 представляет собой F, Cl, CH3 или OCH3.
19. Соединение или соль по п. 16, где R7 представляет собой F, Cl, ОСН3 или OCF3.
20. Соединение или соль по п. 1, где соединение или его соль представляет собой соединение, выбранное из группы, включающей:

2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;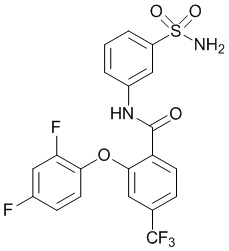
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-4-циано-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
4-хлор-2-(4-фторфенокси)-5-метил-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
4-циано-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;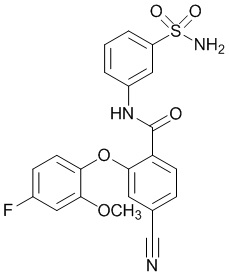
4-циано-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2-(2-хлор-4-фторфенокси)-5-циано-N-(3-сульфамоилфенил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;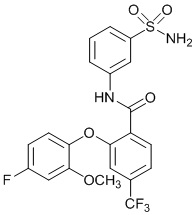
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
4-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
4-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
5-фтор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;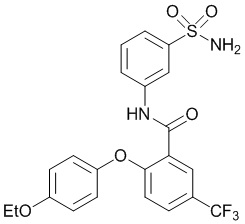
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлорфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;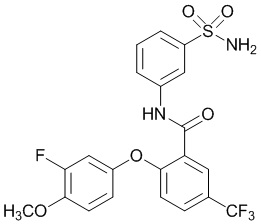
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;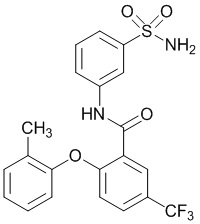
N-(3-сульфамоилфенил)-2-(o-толилокси)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;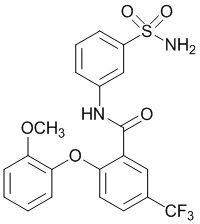
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;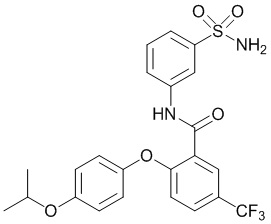
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;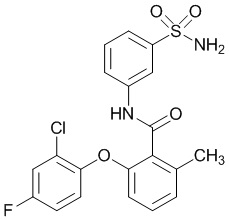
2-(2-хлор-4-фторфенокси)-6-метил-N-(3-сульфамоилфенил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамид;
2-(4-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;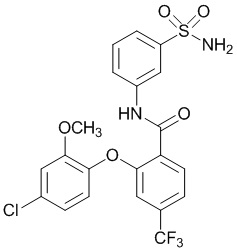
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2-пропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(o-толилокси)-4-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-метокси-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;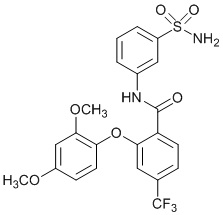
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-4-(трифторметил)бензамид;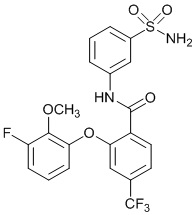
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(3-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-6-(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;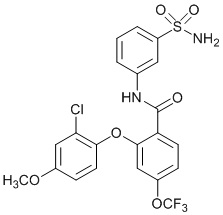
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;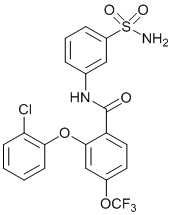
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;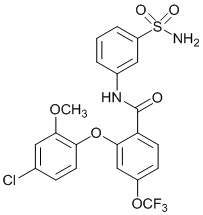
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(3-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фторфенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;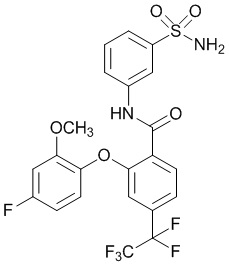
2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(4-хлор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(2-хлор-4-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;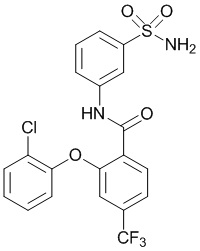
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;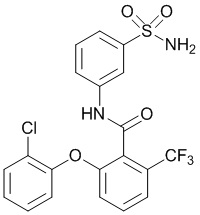
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;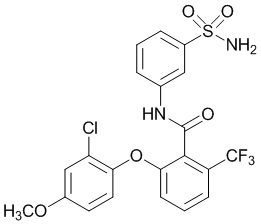
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
4,5-дихлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;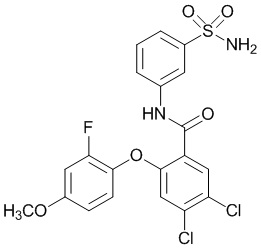
4,5-дихлор-2-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;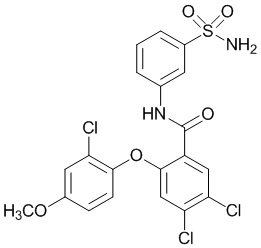
4,5-дихлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;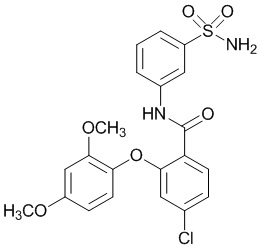
4-хлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;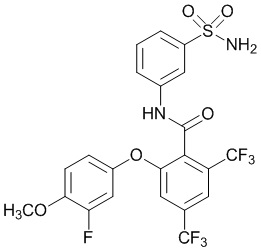
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(5-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;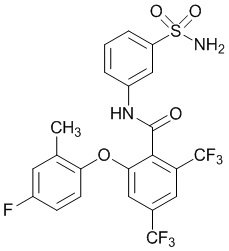
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2,4-дихлор-6-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-N-(3-сульфамоилфенил)-6-(4-(трифторметокси)фенокси)бензамид;
2,4-дихлор-6-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид и
2-циклопропил-6-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид,
или его фармацевтически приемлемая соль.
21. Соединение по п. 1, где соединение выбирают из группы, включающей:

2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-4-циано-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(2,4-дифторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
4-хлор-2-(4-фторфенокси)-5-метил-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
4-циано-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
4-циано-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2-(2-хлор-4-фторфенокси)-5-циано-N-(3-сульфамоилфенил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
4-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
4-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
5-хлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
5-фтор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлорфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(o-толилокси)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-6-метил-N-(3-сульфамоилфенил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-5-(трифторметил)бензамид;
2-(2-хлор-4-фторфенокси)-5-(дифторметил)-N-(3-сульфамоилфенил)бензамид;
2-(4-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-5-(трифторметил)бензамид;
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-этоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2-пропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(o-толилокси)-4-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-метокси-2-метилфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-4-(трифторметил)бензамид;
2-(3-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-хлор-4-фторфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(4-хлор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(3-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
N-(3-сульфамоилфенил)-2-(4-(трифторметокси)фенокси)-6-(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(2-(дифторметокси)фенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметокси)бензамид;
2-(3-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(3-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(4-фторфенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(4-фтор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(4-хлор-2-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(2-хлор-4-метоксифенокси)-4-(перфторэтил)-N-(3-сульфамоилфенил)бензамид;
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид;
2-(2-хлорфенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)-6-(трифторметил)бензамид;
4,5-дихлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4,5-дихлор-2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(2,4-диметоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(2-хлор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
4-хлор-2-(4-изопропоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2-(4-фторфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(5-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)-4,6-бис(трифторметил)бензамид;
2,4-дихлор-6-(4-фторфенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(4-фтор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(4-фтор-2-метилфенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-N-(3-сульфамоилфенил)-6-(4-(трифторметокси)фенокси)бензамид;
2,4-дихлор-6-(4-хлор-2-метоксифенокси)-N-(3-сульфамоилфенил)бензамид;
2,4-дихлор-6-(2-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)бензамид и
2-циклопропил-6-(3-фтор-4-метоксифенокси)-N-(3-сульфамоилфенил)-4-(трифторметил)бензамид,
или его фармацевтически приемлемая соль.
22. Фармацевтическая композиция, представляющая собой ингибитор натриевых каналов, содержащая терапевтически эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1-20 или соединение по п. 21 и один или несколько фармацевтически приемлемых носителей или связующих.
23. Фармацевтическая композиция, представляющая собой ингибитор натриевых каналов, содержащая соединение или его фармацевтически приемлемую соль по любому из пп. 1-20 или соединение по п. 21 и один или несколько фармацевтически приемлемых носителей или связующих.
24. Способ ингибирования потенциалозависимого натриевого канала у субъекта, включающий введение субъекту соединения или его фармацевтически приемлемой соли по любому из пп. 1-20, соединения по п. 21 или фармацевтической композиции по п. 22 или 23.
25. Способ по п. 24, где потенциалозависимый натриевый канал представляет собой Nav1.8.
26. Способ лечения или уменьшения тяжести у субъекта хронической боли, боли в кишечнике, нейропатической боли, костно-мышечной боли, острой боли, воспалительной боли, боли при злокачественной опухоли, идиопатической боли, послеоперационной боли, висцеральной боли, включающий введение эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп. 1-20, соединения по п. 21 или фармацевтической композиции по п. 22 или 23.
27. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта боли в кишечнике, где боль в кишечнике включает боль при воспалительном заболевании кишечника, боль при болезни Крона или боль при интерстициальном цистите.
28. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта нейропатической боли, где нейропатическая боль включает постгерпетическую невралгию, диабетическую невралгию, болезненную ассоциированную с ВИЧ сенсорную нейропатию, невралгию тройничного нерва, синдром жжения рта, боль после ампутации, фантомную боль, болезненную неврому, травматическую неврому, неврому Мортона, повреждение с защемлением нерва, спинальный стеноз, синдром запястного канала, радикулит, ишиас, повреждение с разрывом нерва, повреждение с разрывом плечевого сплетения, комплексный регионарный болевой синдром, невралгию, индуцированную терапией с использованием лекарственного средства, невралгию, индуцированную химиотерапией злокачественной опухоли, невралгию, индуцированную терапией против ретровирусов, боль после повреждения спинного мозга, идиопатическую нейропатию малых волокон, идиопатическую сенсорную нейропатию или тригеминальную автономную цефалгию.
29. Способ по п. 28, где нейропатическая боль включает идиопатическую нейропатию малых волокон.
30. Способ по п. 28, где нейропатическая боль включает постгерпетическую невралгию.
31. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта костно-мышечной боли, где костно-мышечная боль включает боль при остеоартрите, позвоночную боль, вызванную холодом боль, боль при ожоге или зубную боль.
32. Способ по п. 31, где костно-мышечная боль включает боль при остеоартрите.
33. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта воспалительной боли, где воспалительная боль включает боль при ревматоидном артрите или вульводинию.
34. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта идиопатической боли, где идиопатическая боль включает боль при фибромиалгии.
35. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта острой боли.
36. Способ по п. 35, где острая боль включает послеоперационную боль.
37. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта послеоперационной боли.
38. Способ по п. 26, где способ включает лечение или уменьшение тяжести у субъекта висцеральной боли.
39. Способ лечения или уменьшения тяжести у субъекта боли, включающий введение эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп. 1-12, соединения по п. 21 или фармацевтически приемлемой композиции по п. 22 или 23.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RU 2010118467 A, 20.11.2011 | |||
| NIELSEN F E ET AL | |||
| Bioorganic & Medicinal Chemistry Letters, vol.14, no | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Приспособление для подачи сверла в ручных сверлильных приборах | 1926 |
|
SU5727A1 |
Авторы
Даты
2019-02-21—Публикация
2014-07-18—Подача