Изобретение относится к иммунологии и вакцинологии и может быть использовано специалистами, проводящими исследования по оценке иммуногенности вакцины чумной живой.
Известен способ определения иммуногенности вакцины чумной живой биопробным методом, который предполагает проведение двух этапов -иммунизация и последующее заражение лабораторных животных. Иммунизируют по четыре группы нелинейных белых мышей разными дозами исследуемого вакцинного препарата. На 21 сутки после вакцинации иммунных животных заражают вирулентным штаммом чумного микроба. Через 21 сутки после заражения учитывают количество выживших животных и вычисляют ED50 - иммунизирующую дозу, защищающую 50% зараженных биомоделей. (Промышленный регламент производства «Вакцины чумной живой, лиофилизата для приготовления суспензии для инъекций, накожного скарификационного нанесения и ингаляций» ПР 0189-70-80-09-16. С-242).
К существенным недостаткам указанного способа можно отнести необходимость длительного (21 день) содержания зараженных возбудителем чумы животных в специальных условиях, обеспечивающих соблюдения требований биобезопасности при работе с ПБА I группы и потенциальная опасность работ с вирулентным штаммом чумного микроба (Yersinia pestis 231).
Известен способ определения иммуногенности вакцины чумной живой, основанный на количественном учете феномена «переживания» нелинейных белых мышей. Способ предполагает введение четырем группам нелинейных белых мышей смеси вакцинного и вирулентного штаммов в определенных соотношениях. Через 21 сутки после заражения рассчитывается LD50 вирулентного штамма, отражающая степень иммуногенности вакцинного штамма, которая выражается числом Dcl вирулентного штамма. (Будыка Д.А. Изучение в эксперименте иммунологической активности вакцины чумной живой, подвергнутой воздействию экстремальной температуры / Д.А. Будыка, А.А. Фисун, Е.Л. Ракитина, Н.В. Абзаева // Эпидемиология и вакцинопрофилактика. - 2015. - №4. - С. 74-79.; Методические рекомендации по определению степени иммуногенности авирулентных штаммов чумного микроба для белых мышей. - Иркутск, 1984. - 6 с.).
Недостаток способа - трудоемкость процесса, которая обусловлена необходимостью использования в работе вирулентного штамма чумного микроба.
Исследователями предложены различные методы оценки иммуногенности вакцины против чумы. Методы, основанные на изучении цитоэнзимохимических показателей полиморфноядерных лейкоцитов (миелопероксидаза и неферментные катионные белки) (Будыка Д.А., Абзаева Н.В., Руднев С.М. Бактерицидная активность полиморфноядерных лейкоцитов крови белых мышей привитых против чумы и в различных схемах инфицирования чумной инфекцией // Проблемы особо опасных инфекций. - Саратов, 2009. - №2 (100). - С. 56-60). Метод определения фагоцитарной и функциональной активности нейтрофилов крови (Ж.А. Коновалова, А.Г. Атлас, В.И. Дубровина Некоторые пути оптимизации процесса производства вакцины чумной живой и способы оценки ее иммуногенности Бюллетень ВСНЦ СО РАМН, 2013 №2 (90) с. 192-196.). Метод изучения структурно-функциональных изменений иммунокомпетентных органов иммунизированных биомоделей (Витязева С.А., Старовойтова Т.П., Дубровина В.И., Голубинский Е.П. Методические рекомендации по использованию показателей клеточного состава иммунокомпетентных органов экспериментальных животных для оценки иммунной перестройки организма в процессе формирования иммунитета к чуме. - Иркутск, 2007. - 7 с).
Основной недостаток предложенных методов - неспецифичность используемых реакций, соответственно исследуемые показатели лишь косвенно указывают на формирование адаптивного поствакцинального иммунитета и уровень иммуногенности вакцины.
Наиболее близким к предлагаемому изобретению является способ оценки специфической активности вакцины чумной живой на основе исследования динамики субпопуляций лимфоцитов (CD3+, CD4+, CD8+, CD19+) методом проточной цитометрии. У иммунизированных животных определяют количество лимфоцитов, экспрессирующих соответствующие рецепторы на 7, 14 и 21 сутки после вакцинации и сравнивают с данными интактных биомоделей в аналогичные сроки исследования (Логвиненко О.В., Ракитина Е.Л., Пономаренко Д.Г., Саркисян Н.С. Характеристика иммунологической реактивности животных при иммунизации штаммом Y. pestis EV «Актуальные проблемы болезней, общих для человека и животных» Материалы Всероссийской научно-практической конференции с международным участием. 2012. - С. 135-136).
К недостаткам метода можно отнести низкую информативность изменений значений исследуемых показателей (CD3+, CD4+, CD8+, CD19+), ввиду их неспецифичности и отсутствия возможности определить корреляцию дозы вакцины с уровнем ее иммуногенности.
Цель изобретения - оценка иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro, исключение этапа заражения биомоделей возбудителем чумы, сокращение времени и затрат материальных и трудовых ресурсов при исследовании иммуногенности вакцины чумной живой.
Поставленная цель достигается тем, что для определения формирования проективного иммунитета против чумы, у вакцинированных нелинейных белых мышей исследуют количество лимфоцитов, экспрессирующих рецептор CD25 после стимуляции в условиях in vitro комплексом водорастворимых антигенов Y. pestis.
Заявляемый способ основан на использовании антиген-стимулированного клеточного теста in vitro и технологии проточной цитометрии для оценки специфической иммунологической перестройки организма после вакцинации. Отличие его от известных способов в том, что в качестве диагностически информативного показателя клеточной антигенреактивности предлагается учитывать маркер (рецептор) активации лимфоцитов CD25 - высокоаффинный рецептор интерлейкина 2 (IL-2Ra), экспрессирующийся активированными Т-лимфоцитами. При (избирательной) кооперации антигенных детерминант с эпитопами специфических рецепторов лимфоцитов происходит их активация - процесс перехода клетки из фазы G0 («фаза покоя») в фазу G1, увеличение концентрации Са2+ в клетке активирует различные ферментативные системы, что приводит к стимуляции синтеза РНК, белка и ИЛ2. Эти процессы завершаются экспрессией различных генов и их рецепторов на поверхности клетки. В ходе активационного (дифференцированного) механизма на поверхности лимфоцитов последовательно экспрессируются молекулы активации, в том числе CD25 - α (альфа) рецептор интерлейкина 2 (IL-2Rα).
Оценку иммуногенности вакцины чумной живой проводят на нелинейных белых мышах, иммунизированных препаратом вакцины чумной живой из штамма Yersinia pestis EV линии НИИЭГ. Исходя из заранее определенного количества живых микробных клеток в препарате, вакцину доводят до концентраций 5×105, 1×105, 2×104 и 4×103 ж.м.к./мл. Каждую дозу вводят 24 животным в объеме 0,2 мл подкожно (иммунизирующие дозы составляли 8×102, 4×103, 2×104 и 1×105 ж.м.к.). Для определения фактического содержания микробных клеток в иммунизирующих дозах взвесь, используемую для иммунизации, разводят до концентрации 1×103 м.к./мл и высевают на пластинки питательного агара по 0,1 мл (100 м.к.). Количество выросших после инкубации колоний учитывают при вычислении ED50 испытуемой серии.
Кровь для исследования берут из сердца в объеме 1,0±0,1 мл у интактных и вакцинированных против чумы мышей на 21 сутки после иммунизации. Кровь от каждого животного вносят в пробирку с 50 мкл гепарина 5000 ЕД в 1 мл, предварительно разведенного 1:10. Тщательно перемешивают, не допуская образования сгустков.
Методика определения активационных молекул на лимфоцитах белых мышей.
На одно исследование используют две пластиковые пробирки, объем 5 мл. Пробирки маркируют, соответственно №1 и №2. В каждую пробирку вносят по 1000 мкл среды RPMI-1640 с 25 mM HEPES и пенициллина (20 ЕД/мл). В каждую пробирку добавляют по 50 мкл гепаринизированной крови. В пробирку №1 вносят 50 мкл комплекса водорастворимых антигенов Y. pestis с содержанием белка 4,5 мг/мл. В пробирку №2 вносят 50 мкл 0,9% раствора NaCl. Инкубируют 20 часов при температуре (37±1)°С в условиях повышенного содержания СО2 (5-10%). По окончании инкубации из каждой пробирки дозатором или пипеткой удаляют надосадочную жидкость в количестве 900 мкл. Из осадка по 25 мкл культуры клеток переносят в пробирки «Falcon» 12×75 мм, объемом 5 мл для проточного цитометра. В каждую пробирку добавляют 2 мкл моноклональных антител против CD25+ лимфоцитов мыши. Экспозиция 20 мин при температуре 20-22°С без доступа света. В каждую пробирку вносят по 500 мкл рабочего раствора для лизиса эритроцитов (основной лизирующий раствор разводят дистиллированной водой в 10 раз). Экспозиция 15 минут при температуре 20-22°С (контроль лизиса эритроцитов). Центрифугируют при 250 g 5 минут. Осадок ресуспендируют в 300 мкл Cell Wach (жидкость для разведения клеточной суспензии). Учет результатов производят с помощью проточного цитометра FACS Calibur с программным обеспечением Cell Quest Pro.
Для подтверждения иммуногенной активности вакцины чумной живой иммунизированных нелинейных белых мышей заражали подкожно 200 Dcl вирулентного штамма Yersinia pestis 231. Заражение проводили на 21 сутки после иммунизации - срок формирования поствакцинального иммунитета против чумы. В опыте был рассчитан показатель ED50, который оказался в пределах нормы.
На 21 сутки после вакцинации установлена очень высокая степень прямой связи (коэффициент корреляции r≥1,000) количества выживших животных с увеличением у них уровня лимфоцитов, экспрессирующих маркеры ранней активации CD 25 при активации антигеном in vitro.
Возможность практического применения заявляемого способа иллюстрируется примером его конкретного выполнения с использованием совокупности заявляемых признаков.
Пример.
4 группы по 24 животных иммунизировали вакциной чумной живой дозами 8×102, 4×103, 2×104 и 1×105 ж.м.к. в объеме 0,2 мл 0,9% раствора NaCl подкожно. Для определения фактического содержания микробных клеток в иммунизирующих дозах взвесь, используемую для иммунизации, разводили до концентрации 1×103 м.к./мл и высевали на пластинки питательного агара по 0,1 мл (100 м.к.). Количество выросших после инкубации колоний учитывали при вычислении ED50 испытуемой серии.
Кровь для исследования брали из сердца в объеме 1,0±0,1 мл у интактных и вакцинированных против чумы мышей на 21 сутки после иммунизации. Кровь от каждого животного вносили в пробирку с 50 мкл гепарина 5000 ЕД в 1 мл, предварительно разведенного 1:10. Тщательно перемешивали, не допуская образования сгустков.
На одно исследование использовали две пластиковые пробирки, объем 5 мл. Пробирки маркировали соответственно №1 и №2. В каждую пробирку вносили по 1000 мкл среды RPMI-1640 с 25 mM HEPES и пенициллина (20 ЕД/мл). В каждую пробирку добавляли по 50 мкл гепаринизированной крови. В пробирку №1 вносили 50 мкл комплекса водорастворимых антигенов Y. pestis. В пробирку №2 вносили 50 мкл 0,9% раствора NaCl. Инкубировали 20 часов при температуре (37±1)°С в условиях повышенного содержания СО2 (5-10%). По окончании инкубации из каждой пробирки дозатором или пипеткой удаляли надосадочную жидкость в количестве 900 мкл. Из осадка по 25 мкл культуры клеток переносили в пробирки «Falcon» 12×75 мм, объемом 5 мл для проточного цитометра. В каждую пробирку добавляли 2 мкл моноклональных антител против CD25+ лимфоцитов мыши. Экспозиция 20 мин при температуре 20°С - 22°С без доступа света. В каждую пробирку вносили по 500 мкл рабочего раствора для лизиса эритроцитов (основной лизирующий раствор разводили дистиллированной водой в 10 раз). Экспозиция 15 минут при температуре 20-22°С (контроль лизиса эритроцитов). Центрифугировали при 250 g 5 минут. Осадок ресуспендировали в 300 мкл Cell Wach (жидкость для разведения клеточной суспензии). Учет результатов производили с помощью проточного цитометра FACS Calibur с программным обеспечением Cell Quest Pro.
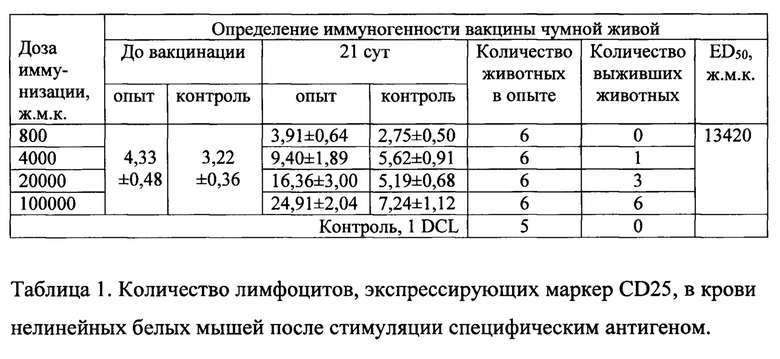
Количество лимфоцитов, экспрессирующих CD25, через 21 сутки в крови белых мышей, иммунизированных различными дозами, составило 3,91±0,64; 9,40±1,89; 16,36±3,00; 24,99±2,04%; тогда как в контроле соответственно: 2,75±0,50; 5,62±0,91; 5,19±0,68; 7,24±1,12%. Установлена очень высокая степень прямой связи (коэффициент корреляции r≥1,000) количества выживших животных с увеличением у них уровня лимфоцитов, экспрессирующих маркеры ранней активации CD25 при активации антигеном in vitro (таблица 1).
Полученные результаты позволяют четко проследить корреляцию количества лимфоцитов, экспрессирующих CD25, с иммунизирующей дозой.
Таким образом, заявляемый способ оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа обеспечен специфичностью за счет использования комплекса водорастворимых антигенов Y. pestis, позволяет исключить этап заражения экспериментальных животных и сократить длительность проведения эксперимента до 21 суток. Показатели иммуногенности вакцины чумной живой, полученные при его использовании, строго коррелируют с показателями выживаемости зараженных животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ применения комплекса водорастворимых антигенов чумного микроба для оценки уровня противочумного иммунитета | 2019 |
|
RU2725872C1 |
| СПОСОБ ОЦЕНКИ ФАКТИЧЕСКОЙ ПРИВИТОСТИ ЛЮДЕЙ ПРОТИВ БРУЦЕЛЛЁЗА НА РАННИХ СРОКАХ ПОСЛЕ ВАКЦИНАЦИИ | 2019 |
|
RU2714136C1 |
| Способ оценки протективного иммунитета к возбудителю бруцеллёза | 2022 |
|
RU2806161C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ВАКЦИОННОГО ШТАММА ЧУМНОГО МИКРОБА | 2019 |
|
RU2727258C1 |
| Способ повышения иммуногенной и протективной активности вакцинного штамма чумного микроба | 2023 |
|
RU2815337C1 |
| АНТИГЕННЫЙ СОСТАВ ЧУМНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 2001 |
|
RU2190424C1 |
| ПРОТИВОЧУМНАЯ ВАКЦИНА | 1996 |
|
RU2197988C2 |
| Рекомбинантный вакцинный препарат пролонгированного действия для профилактики чумы у млекопитающих и человека и способ его получения | 2015 |
|
RU2671525C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ИММУНОГЕННОСТИ КАПСУЛЬНЫХ АНТИГЕНОВ BURKHOLDERIA MALLEI | 2005 |
|
RU2293993C1 |
| СПОСОБ ОБНАРУЖЕНИЯ СЕКРЕТОРНЫХ АНТИТЕЛ К F-1 АНТИГЕНУ ПРИ ВАКЦИНАЦИИ ПРОТИВОИЕРСИНИОЗНЫМ ИММУНОГЕННЫМ ПРЕПАРАТОМ | 2006 |
|
RU2329506C1 |
Изобретение относится к иммунологии и биотехнологии, в частности к способу оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа. Настоящий способ заключается в определении у вакцинированных нелинейных белых мышей количества лимфоцитов, экспрессирующих рецепторы CD25 при стимуляции комплексом водорастворимых антигенов Y. pestis. Увеличение количества указанных лимфоцитов коррелирует с высоким уровнем иммуногенности вакцины. Настоящее изобретение позволяет оценить иммуногенность вакцины чумной живой in vitro. 1 табл., 1 пр.
Способ оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа, заключающийся в определении у вакцинированных нелинейных белых мышей количества лимфоцитов, экспрессирующих рецепторы CD25 при стимуляции комплексом водорастворимых антигенов Y. pestis, увеличение количества которых коррелирует с высоким уровнем иммуногенности вакцины.
| Куличенко А.Н | |||
| и др | |||
| Использование антигенспецифических клеточных тестов in vitro для оценки формирования поствакцинального противочумного иммунитета | |||
| Инфекция и иммунитет, 2017 | |||
| Бугоркова С.А | |||
| и др | |||
| Морфофункциональная характеристика иммунокомпетентных органов мышей линии BALB/С при иммунизации вакцинным штаммом Yersinia pestis EV НИИЭГ на фоне иммуномодуляции | |||
| Проблемы особо опасных инфекций, 2017 | |||
| Гостищева С.Е | |||
| и др | |||
| Оценка иммунно-аллергической перестройки организма при формировании поствакцинального иммунитета против чумы с помощью антигенстимулированных клеточных тестов in vitro | |||
| Научный альманах, 2016. |
Авторы
Даты
2019-02-25—Публикация
2018-02-19—Подача