Настоящее изобретение относится к процессу для производства аминокислот из прекурсоров, полученных путем анаэробной ферментацией из ферментируемой биомассы.
Аминокислоты представляют собой основные соединения пептидов и, таким образом, белков. В числе прочих их используют в качестве добавок в корма для животных (например, лизин, метионин или треонин), в качестве усилителей вкуса и запаха для продуктов питания для человека, (например, глутамат, серии или аспарагиновая кислота), в качестве специальных питательных веществ в медицинской сфере или, в альтернативном варианте, в косметической сфере. Можно также упомянуть глицин, аланин, норвалин и норлейцин как аминокислоты, которые нашли применение в сфере фармацевтической, косметической и промышленной химии.
Известно получение аминокислот химическим синтезом или превращением с использованием ферментов. Несмотря на легкую возможность адаптации и обеспечение оптимального контроля производственных параметров, такие способы являются сложными и дорогими для осуществления.
Для того чтобы минимизировать производственные затраты существуют способы, например, для получения аминокислот посредством микробиологического пути синтеза. Аминокислоты представляют собой первичные метаболиты, продуцируемые микроорганизмами во время процесса ферментации. Хотя такие способы дают возможность получения больших количеств аминокислот, которые непосредственно могут ассимилироваться организмом, тем не менее сохраняется тот факт, что данных тип способа ограничивается только одним типом аминокислоты.
В частности, данное изобретение направлено на преодоление данных недостатков, предлагая процесс для производства аминокислот, который позволяет производить различные типы аминокислот, особенно непротеиногенные аминокислоты, легко и без ограничений, связанных с известными способами производства из предшествующего уровня техники.
С этой целью одним объектом изобретения является процесс для производства аминокислот из молекул летучих жирных кислот (ЛЖК), называемых прекурсорами, полученных анаэробной ферментацией из ферментируемой биомассы, отличающийся тем, что он включает в себя по меньшей мере следующие этапы:
a) экстракция молекул летучих жирных кислот (ЛЖК) без остановки ферментации с помощью экстракционного средства, выбранного из средств, которые по меньшей мере нерастворимы в ферментационной среде,
b) сбор вне ферментационного реактора молекул летучих жирных кислот (ЛЖК) после их экстракции,
c) синтез данной α-галогенированной кислоты путем галогенирования с использованием типа летучей жирной кислоты (ЛЖК), выбранной из летучих жирных кислот, собранных на этапе b), и определенной в соответствии с желаемым типом аминокислоты,
d) синтез определенной аминокислоты из данной α-галогенированной кислоты. Таким образом, такой процесс дает возможность объединить фазу непрерывного
производства прекурсоров с помощью микроорганизмов с фазой синтеза, осуществляемой отдельно от ферментации, что позволяет легко управлять различными параметрами, и в то же время обеспечивая большую изменчивость в производстве данного типа аминокислот.
Такой процесс позволяет непрерывно обеспечивать прекурсоры, то есть летучие жирные кислоты, и в то же время сохранять производственную способность микроорганизмов, присутствующих в биореакторе.
В частности, этапы а) и b) экстракции и сбора дают возможность не только непрерывно экстрагировать и собирать молекулы летучих жирных кислот, образующихся в ферментационном реакторе, но также и сохранять микроорганизмы, отвечающие за их производство. В частности, экстракция и фактический сбор осуществляется в условиях, которые по меньшей мере являются нелетальными для всех микроорганизмов, то есть в биосовместимых условиях экстракции и сбора, поскольку экстракция сохраняет активность микроорганизмов и сбор выполняется вне ферментационного реактора.
Таким образом, преодолеваются проблемы, связанные с накоплением метаболитов в ферментационном реакторе, например, подкисление ферментационной среды путем накопления образующихся летучих жирных кислот, которые вредны для микроорганизмов. Количество и активность микроорганизмов поддерживаются на более высоком уровне, близком к исходному уровню, в течение всего ферментационного цикла.
Предоставляя непрерывное и регулярное производство ЛЖК, предлагается легкий и быстро используемый источник разнообразных прекурсоров. В процессе, который является объектом изобретения, такое использование происходит на этапе с) с помощью химического синтеза и, следовательно, с легко регулируемыми и модифицируемыми условиями, что также обеспечивает большую изменчивость в типе синтезируемых молекул. В частности, на этапе с), в зависимости от ЛЖК, выбранной для осуществления галогенирования, получают данный тип α-галогенированной кислоты и, следовательно, после этого получают данный тип α-аминокислоты.
Такой процесс позволяет использовать ферментируемую биомассу во время фазы анаэробной ферментации. Термин «ферментируемая биомасса» в данном документе обозначает органический субстрат, который преимущественно не является пищевым, получен из отходов, промежуточных продуктов и побочных продуктов, образованных из органического материала, то есть из биомассы, полученной в результате человеческой деятельности, будь то бытовая, промышленная, сельскохозяйственная, лесная, водная, агропромышленная, производная животноводства и т.п. Неограничивающие примеры органических субстратов, которые могут быть упомянуты, включают в себя навоз, ферментируемую фракцию бытового мусора, отходы со скотобойни, остатки целлюлозы или лигноцеллюлозы, производные агропромышленности, такие как производные от переработки сахарного тростника (багасса), подсолнечника или сои.
Термин «анаэробная ферментация» означает ферментацию, выполняемую в анаэробных условиях эукариотическими или прокариотическими микроорганизмами, такими как бактерии, грибы, водоросли или дрожжи.
В соответствии с предпочтительными, но не обязательными аспектами данного изобретения такой процесс может включать одну или более из следующих характеристик:
- на этапе с) используемым галогенсодержащим соединением является дибром,
- на этапе с) используемое галогенсодержащее соединение не является дибромом,
- на этапе с) уксусный ангидрид используют в молярной процентной концентрации в области 12% относительно летучей жирной кислоты,
- на этапе с) используют ангидрид, соответствующий летучей жирной кислоте (ЛЖК), которая должна быть галогенирована,
- на этапе с) температура, при которой выполняется реакция бромирования, составляет от 20°C до 40°C ниже точки кипения летучей жирной кислоты,
- на этапе d) синтез выполняется путем реакции с избытком аммиака относительно стехиометрии реакции,
- на этапе d) синтез выполняется путем реакции с амином,
- на этапе d) температура поддерживается между 20°C и 50°C,
- на этапе d) синтезируется по меньшей мере один промежуточный продукт, определяемый как иминодикислота и/или нитрилотрикислота.
Существует несколько типов аминокислот, которые представляют интерес для промышленного, косметического, медицинского, пищевого или другого использования. Примеры, которые могут упоминаться, включают непротеиногенные аминокислоты, такие как гомоаланин, норвалин и норлейцин, которые предназначены для синтеза молекул для фармацевтического применения.
Термин «аминокислота» в данном документе обозначает кислоты, содержащие по меньшей мере одну первичную, вторичную или третичную аминную функциональную группу.
Более того, посредством процесса по данному изобретению возможно синтезировать несколько типов аминокислот, таких как упомянутые раннее, но без ограничения, обычным и контролируемым образом из биоресурсного субстрата путем комбинирования биологического продуцирования с химическим получением.
Изобретение будет понято более четко, и другие его преимущества станут более ясными при чтении описания нескольких вариантов реализации изобретения, которое дается в виде неограничивающего примера.
Различные этапы процесса теперь описаны со ссылкой на несколько вариантов реализации изобретения, при этом понятно, что этапы, которые широко известны, не детализированы.
Во-первых, используемый субстрат преимущественно не обрабатывается, то есть он не подвергается какой-либо физико-химической или ферментативной предварительной обработке. Этот субстрат преимущественно состоит из ферментируемой биомассы. В качестве дополнительных неограничивающих примеров можно упомянуть сельскохозяйственные или растительные отходы (солома, багасса, отходы, образующиеся при дистилляции из кукурузы, трава, древесина, сено), бумажные отходы (картон, бумага), агропродовольственные отходы, отходы со скотобойни, ферментируемая фракция бытовых отходов, отходы животноводства (навоз, навозная жижа, помет), водоросли, отходы аквакультуры, отходы лесной промышленности или ферментируемые побочные продукты косметической промышленности. Некоторые субстраты содержат органические молекулы, такие как органические кислоты, которые мало влияют или вообще не влияют на процесс ферментации. С другой стороны, эти молекулы могут быть найдены в ферментационной среде и могут участвовать, например, в получении определенных конечных органических молекул.
В качестве напоминания и известным способом субстрат вводят в ферментационный реактор, который широко известен и имеет размеры, подходящие для желаемого производства, независимо от того, будет ли это производство осуществляться в лабораторном масштабе для проведения испытаний или в промышленном масштабе в случае производства. Другими словами, ферментационный реактор или биореактор имеет объем от нескольких литров до нескольких сотен кубических метров в зависимости от потребности.
Микроорганизмы сначала преимущественно вводят в ферментационный реактор в количестве, достаточном для начала ферментации. Микроорганизмы преимущественно инокулируют в форме консорциума. Термин «консорциум» обозначает комбинацию или смесь эукариотических и прокариотических микроорганизмов, будь то бактерии, дрожжи, грибы или водоросли. Эти различные микроорганизмы происходят главным образом из природных экосистем, преимущественно, но не исключительно, из анаэробных экосистем, неограничивающие примеры которых включают анаэробную зону водных сред, таких как бескислородная зона определенных озер, почв, болот, шлама очистных сооружений, рубца жвачных животных или кишечника термитов. Следует иметь в виду, что качественное и количественное распределение различных типов и видов микроорганизмов в консорциуме точно не известно и, самое главное, может варьироваться в широких пределах. Оказывается, что это качественное и количественное разнообразие как ни странно обеспечивает устойчивость и адаптивность микроорганизмов, которые позволяют обеспечить оптимальное использование субстратов, независимо от состава этих субстратов и при изменяющихся условиях ферментации.
Кроме того, в связи с тем, что субстрат используется в немодифицированной форме, то есть его не стерилизуют, или, в более общем случае, не освобождают от содержащихся в нем микроорганизмов до его введения в биореактор, оказывается, что населяющие субстрат микроорганизмы фактически включены в консорциум или по меньшей мере объединены с ним в биореакторе.
Более того, ферментация происходит в анаэробных условиях, точнее, когда окислительно-восстановительный потенциал составляет менее -300 мВ, преимущественно от -550 мВ до -400 мВ, и когда рН составляет менее 8, предпочтительно от 4 до 7. Ферментация преимущественно ограничивается выработкой «прекурсорных» ферментационных метаболитов, а именно летучих жирных кислот или ЛЖК. содержащих от двух до восьми атомов углерода, предпочтительно от двух до шести. Таким образом индуцируется реакция, которая подобна феномену ацидоза, встречающемуся у жвачных животных, но при которой в то же время продукция метана близка к нулю. Как правило, метан является одним из конечных ферментационных метаболитов, полученных в результате анаэробной ферментации микроорганизмами, происходящими из природных экосистем.
На первом этапе ферментация приводит к образованию летучих жирных кислот, в основном содержащих от двух до четырех атомов углерода, например, уксусной кислоты, пропионовой кислоты и масляной кислоты. В меньшем количестве также получают длинноцепочечные летучие жирные кислоты, имеющие больше четырех атомов углерода, такие как валериановая кислота, капроновая кислота, гептановая кислота или октановая кислота. Продолжая ферментацию и/или увеличивая количество микроорганизмов в биореакторе, если необходимо с помощью выбранных микроорганизмов, можно стимулировать продуцирование ЛЖК с длинной углеродной цепью, имеющих более четырех атомов углерода.
Другими словами летучие жирные кислоты, образующиеся в количестве во время ферментации, по существу, представляют собой летучие жирные кислоты, имеющие от двух до шести атомов углерода.
Ферментация во всех случаях проводится для обеспечения продуцирования ЛЖК в жидкой фазе. Как правило время ферментации составляет от 1 до 7 дней, предпочтительно от 2 до 4 дней. Концентрация метаболитов, полученных в ферментационной среде по завершению этого периода, является изменчивой, но для летучих жирных кислот, как правило, составляет от около 10 до 20 г/л в зависимости от летучих жирных кислот, при этом понимается, что при определенных условиях она может составлять более 35 г/л, например, в области 50 г/л. В конце этапа ферментации рН ферментационной среды является кислотным и обычно составляет от 4 до 6 из-за присутствия летучих жирных кислот в ферментационной среде.
Когда выработка ЛЖК достигает определенного количества, обычно в фазе стационарного режима ферментации, инициируется этап а) экстракции молекул. Предпочтительно, но не обязательно, это определенное количество ЛЖК соответствует замедлению роста микроорганизмов, таким образом, находясь в области порога ингибирования для микроорганизмов.
Экстракционное средство выбирают из жидкого или твердого экстракционного средства, которое по меньшей мере нерастворимо в ферментационной среде. В случае если экстракционное средство является жидким, таким образом оно является растворителем, предпочтительно плотность растворителя является меньшей, чем плотность ферментационной среды.
Точнее, экстракция осуществляется с помощью твердого или жидкого экстракционного средства, рабочие условия которого позволяют сохранить активность и/или рост микроорганизмов в условиях ферментации, преобладающих в биореакторе, и которые определены для осуществления ферментации. Молекулы ЛЖК предпочтительно экстрагируют с помощью семейств молекулярных сит и затем преимущественно разделяют индивидуально с помощью широко известных методов.
Когда молекулы, такие как летучие жирные кислоты, экстрагируются из ферментационной среды, фактически снижается создаваемая ими кислотность ферментационной среды. Таким образом, ферментация и, следовательно, продуцирование метаболитов продолжается в условиях, сходных с начальными условиями, причем ферментационная среда остается умеренно кислотной.
Предпочтительно экстракцию проводят непрерывно или по меньшей мере последовательно, например, с экстракцией каждые 12 часов. Другими словами, можно продолжать ферментацию во время экстракции полученных метаболитов либо постепенно по мере их продуцирования, либо регулярно.
Жидкость-жидкостная экстракция органическими растворителями в качестве экстракционного средства представляет собой предпочтительный принятый, но не исключительный способ экстракции.
В одном варианте реализации изобретения экстракция не выполняется в отдельном элементе реактора ферментации, но непосредственно в указанном реакторе. Растворитель вводят, например, с помощью устройства типа барботера, расположенного на дне реактора. Как вариант, экстракционный элемент соединяют с реактором, обеспечивая связь с ферментационной средой.
По завершении экстракции выполняют этап сбора b). На этом этапе ЛЖК собирают из органической фазы с помощью широко известных методов, таких как дистилляция или испарение.
Сбор осуществляется либо смеси ЛЖК, либо по типам ЛЖК. Очевидно, что выбор ЛЖК или смеси ЛЖК определяется типом конечных(ой) желательных(ой) молекул(ы). Для этого адаптируются условия сбора, в основном, параметры испарения или дистилляции.
После выполнения этого этапа сбора, выполняется следующий этап с). Это преимущественно, но не исключительно, выполняется после этапа сбора. Как вариант, он выполняется в другое время и/или в другом месте, причем полученные ЛЖК транспортируются и/или хранятся в соответствии с широко известными методами.
Данный этап галогенирования заключается во взаимодействии галогена с ЛЖК с образованием α-галогенированной кислоты, которая является высоко реакционноспособным типом молекулы и, таким образом, особенно предпочтительна для получения других молекул. Такая широко известная реакция осуществляется путем добавления брома, который является предпочтительным, при этом следует понимать, что могут быть использованы другие галогены, а именно хлор, фтор или йод или галогенированные молекулы, такие как тригалогениды фосфора, галогеновые кислоты или ацилгалогениды.
Был выбран дибром, поскольку бромированная α-галогенированная кислота является более реакционноспособной, чем соответствующая хлорированная α-галогенированная кислота, связь углерод-бром легче разрушается, чем связь углерод-хлор. Кроме того, с дибромом легче работать из-за его жидкой формы.
Для осуществления синтеза α-бромзамещенной кислоты был использован путь с использованием ангидрида, в данном случае уксусного ангидрида и пиридина. Понятно, что другие пути синтеза, например, с полифосфорной кислотой или тригалогенидами фосфора являются широко известными. Проводились испытания с полифосфорной кислотой, но результаты были неопределенными, в частности, из-за высокой вязкости этого соединения, что затрудняет работу с ним.
Испытания хлорирования также проводились Заявителем для синтеза α-хлорзамещенных кислот, например, с трихлоризоциануровой кислотой. Полученные результаты уступают с точки зрения выхода и простоты реализации результатам, полученным с дибромом.
Предпочтительным является синтетический путь с использованием ангидрида, соответствующего летучей жирной кислоте, которую желательно галогенировать, и он дает возможность получить α-галогенированную кислоту, в данном случае α-бромзамещенную кислоту данного типа. Использование уксусного ангидрида с другими ЛЖК и/или со смесью ЛЖК с количеством атомов углерода от двух до шести позволяет получить смесь α-галогенированных кислот с количеством атомов углерода от двух до шести.
Испытания с использованием уксусной кислоты (ЛЖК, содержащей два атома углерода), пропионовой кислоты (ЛЖК, содержащей три атома углерода), масляной кислоты (ЛЖК, содержащей четыре атома углерода), капроновой кислоты (ЛЖК, содержащей шесть атомов углерода), а также смеси ЛЖК с числом атомов углерода от двух до шести проводились путем изменения количества уксусного ангидрида, а также других параметров, таких как температура.
Во время различных испытаний соблюдался протокол. Он включает в себя, на предварительной фазе, нагревание до начала отгонки исходной смеси ЛЖК, уксусного ангидрида и пиридина. Затем, во время фактического бромирования, дибром медленно добавляется в течение нескольких часов при температуре ниже точки кипения смеси и после добавления диброма смесь снова доводится до начала отгонки перед охлаждением. В конце реакции, предпочтительно, добавляется вода для разрушения присутствующего ангидрида. Затем α-бромзамещенную кислоту экстрагируют различными способами, в зависимости от кислоты. К таким способам относится, например, дистилляция или разделяющая экстракция.
Начальная температура доведения смеси до начала отгонки составляет от 120°C для ЛЖК, содержащих два атома углерода, и до 200°C для ЛЖК, содержащих шесть атомов углерода. Температура бромирования колеблется от 80°C до 180°C, в зависимости от того, содержат ли ЛЖК от двух до шести атомов углерода. Время реакции бромирования и, следовательно, фактическое время добавления диброма варьируется от около одного часа для ЛЖК, содержащих шесть атомов углерода, до около четырех часов для ЛЖК, содержащих два атома углерода.
Проводились испытания бромирования летучих жирных кислот, содержащих два, три, четыре или шесть атомов углерода, а также испытание на смеси летучих жирных кислот:
- уксусная кислота (С2): 0,53 моль;
- пропионовая кислота (С3): 0,53 моль;
- масляная кислота (С4): 0,53 моль;
- капроновая кислота (С6): 0,24 моль;
- смесь ЛЖК от С2 до С6: 0,54 моль.
Количество добавляемого диброма составляет 0,21 моль или 0,11 моль, таким образом, что летучая жирная кислота находится в избытке. Предпочтительно, Заявитель обнаружил, что молярное соотношение 2:1 в пользу ЛЖК является оптимальным.
Количество добавляемого ангидрида для каждой кислоты составляет 0,06 моля для одного испытания и 0,03 моля для другого испытания.
Смесь ЛЖК включает уксусную кислоту (С2), пропионовую кислоту (С3), масляную кислоту (С4), валериановую кислоту (С5) и капроновую кислоту (С6).
Температуры начала отгонки, в ходе предварительной фазы, изменяются в зависимости от ЛЖК: 120°C для уксусной кислоты; 120°C и 140°C для испытаний с пропионовой кислотой; 150°C и 160°C для масляной кислоты; 200°C для капроновой кислоты и 180°C для смеси.
Температуры бромирования для различных испытаний с каждой кислотой составляют от 10°C до 50°C и преимущественно от 20°C до 40°C ниже температуры начала отгонки и, следовательно, точки кипения летучей жирной кислоты.
Выходы и чистота α-бромзамещенных кислот, полученных по завершению различных испытаний, сопоставлены ниже в Таблице 1, в которой для простоты ЛЖК обозначены числом атомов углерода.
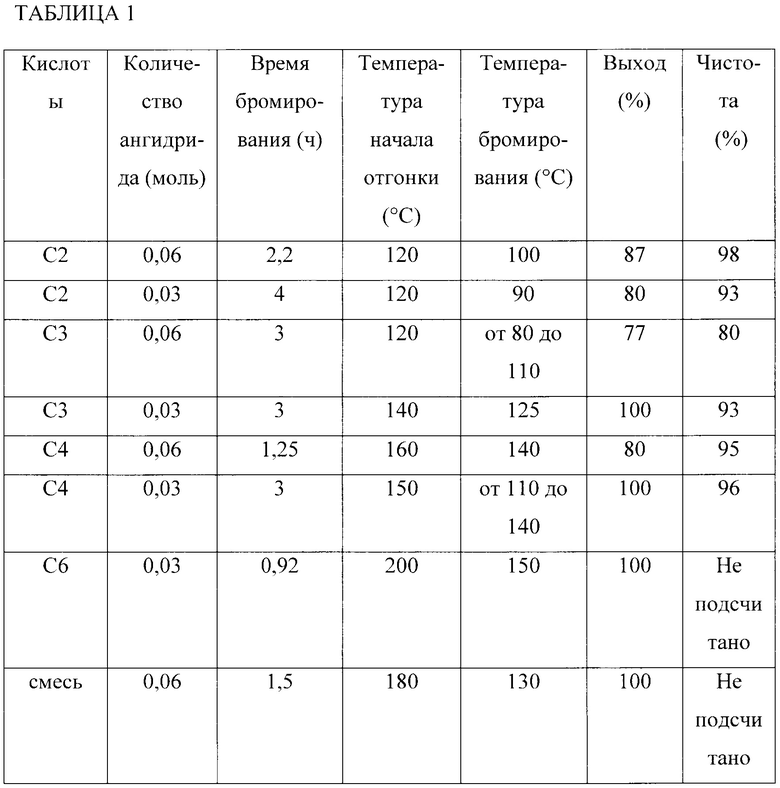
Анализ и расчеты выхода проводились с помощью широко известных аналитических методов, а именно с помощью ЯМР (ядерного магнитного резонанса) и ВЭЖХ (высокоэффективной жидкостной хроматографии). Выходы определялись относительно количества расходуемой ЛЖК.
Заявитель обнаружил, что реакция, проиллюстрированная путем обесцвечивания реакционной смеси после добавления диброма, протекает быстрее в случае большего количества ангидрида, в то же время это мало влияет на чистоту. Тем не менее, подходящим является, чтобы температура двух этапов, предварительного этапа и этапа бромирования, была оптимальной.
Для этого Заявитель отметил, что необходимо поддерживать температуру бромирования немного ниже точки кипения летучей жирной кислоты без слишком сильного отклонения от этой температуры.
Различные испытания позволили определить, что температура бромирования от около 10°C до 50°C ниже точки кипения летучей жирной кислоты, предпочтительно на 20°C ниже, позволила, при прочих равных условиях, получить оптимальный выход, как правило, от 60% до 100% при времени реакции от 1 часа до 4 часов.
Что касается роли уксусного ангидрида, то в свете результатов, приведенных в таблице, оказывается, что молярная процентная концентрация ангидрида по отношению к ЛЖК должна находиться в области 12% для оптимальной реакции бромирования, при этом следует понимать, что является приемлемой процентная концентрация от 5% до 20%.
Используя полученные α-бромзамещенные кислоты или, точнее, используя данную α-бромзамещенную кислоту, затем на этапе d) проводится синтез данной α-аминокислоты. Для его осуществления добавляется аммиак в газообразной форме или в растворе. Как вариант аммиак заменяют первичным или вторичным амином.
Испытания проводились Заявителем путем проведения реакции с α-бромзамещенными кислотами, содержащими от двух до шести атомов углерода, а именно с бромуксусной кислотой, α-бромпропионовой кислотой, α-броммасляной кислотой, α-бромвалериановой кислотой и α-бромкапроновой кислотой. Такая реакция дает возможность получать α-аминокислоты, содержащие углеродную цепь из, соответственно, двух, трех, четырех, пяти или шести атомов углерода, то есть глицин, аланин, гомоаланин, норвалин и норлейцин.
Эти α-аминокислоты находятся среди наиболее широко используемых в качестве косметических и пищевых продуктов, будь то пища для людей или корма для животных, или в качестве реакционных интермедиатов в химии и фармацевтике. Нетрудно понять, что способ, являющийся предметом изобретения, позволяет производить другие типы аминокислот.
Для различных испытаний протокол заключается в проведении реакции аммиака с α-бромзамещенной кислотой при температуре от комнатной, то есть около 20°C, и до 50°C. Реакция проводится в течение переменного времени от 30 минут до 72 часов в зависимости от типа α-бромзамещенной кислоты и в зависимости от температуры. Длинноцепочечная α-бромзамещенная кислота, то есть содержащая по меньшей мере четыре атома углерода, требует длительного времени реакции, как правило, более 24 часов при комнатной температуре, но менее 12 часов при 50°C.
Заявитель неожиданно обнаружил, что высокая температура реакции в области 50°C дает возможность снизить время реакции.
Заявитель обнаружил, что если аммиак используется в избытке, а именно в мольном соотношении в области 1:10, то это оптимизирует превращение в аминокислоту.
В Таблице 2 ниже обобщаются полученные результаты.
Анализ и расчеты выхода и степени превращения проводились с помощью аналитических методов ЯМР (ядерный магнитный резонанс) и ВЭЖХ (высокоэффективная жидкостная хроматография). Степени превращения рассчитывались из количества полученной в реакционной среде аминокислоты относительно начального количества α-бромзамещенной кислоты. Выходы определялись по отношению к массе и количественному анализу продуктов, выделенных после экстракции и перекристаллизации из метанола.


Таким образом достигается производство аминокислот из биоресурсного источника с условиями получения, которые легко осуществлять и контролировать.
В дополнение к этому, поскольку степень превращения в аминокислоту ниже степени расхода α-бромзамещенной кислоты, то обнаруживается, что синтезируется по меньшей мере один побочный продукт, определенный как иминодикислоты и/или нитрилотрикислоты. В качестве неограничивающих примеров для синтеза глицина побочные продукты включают, в числе прочих, иминодиуксусную кислоту и нитрилотриуксусную кислоту, а для синтеза аланина побочные продукты включают, в числе прочих, α,α'-иминодипропионовую кислоту и α,α',α''-нитрилотрипропионовую кислоту.
Изобретение относится к процессу для производства α-аминокислот из молекул летучих жирных кислот (ЛЖК), называемых прекурсорами, которые получены анаэробной ферментацией из ферментируемой биомассы. Процесс включает в себя по меньшей мере следующие этапы: a) экстракция молекул летучих жирных кислот (ЛЖК) без остановки ферментации с помощью экстракционного средства, выбранного из средств, которые по меньшей мере нерастворимы в ферментационной среде; b) сбор вне ферментационного реактора молекул летучих жирных кислот (ЛЖК) после их экстракции; c) синтез данной α-галогенированной кислоты путем галогенирования с использованием типа летучей жирной кислоты (ЛЖК), выбранной из летучих жирных кислот, собранных на этапе b), и определенной в соответствии с желаемым типом α-аминокислоты, с использованием ангидрида соответствующей летучей жирной кислоты, которая должна быть галогенирована; d) синтез определенной α-аминокислоты из данной α-галогенированной кислоты путем реакции с соединением, выбранным из аммиака, первичного амина, вторичного амина. Предлагаемый процесс позволяет производить различные типы α-аминокислот легко и без ограничений, связанных с другими способами производства. 8 з.п. ф-лы, 2 табл.
1. Процесс для производства α-аминокислот из молекул летучих жирных кислот (ЛЖК), называемых прекурсорами, полученных анаэробной ферментацией из ферментируемой биомассы, отличающийся тем, что он включает в себя по меньшей мере следующие этапы:
a) экстракция молекул летучих жирных кислот (ЛЖК) без остановки ферментации с помощью экстракционного средства, выбранного из средств, которые по меньшей мере нерастворимы в ферментационной среде;
b) сбор вне ферментационного реактора молекул летучих жирных кислот (ЛЖК) после их экстракции;
c) синтез данной α-галогенированной кислоты путем галогенирования с использованием типа летучей жирной кислоты (ЛЖК), выбранной из летучих жирных кислот, собранных на этапе b), и определенной в соответствии с желаемым типом α-аминокислоты, с использованием ангидрида соответствующей летучей жирной кислоты, которая должна быть галогенирована;
d) синтез определенной α-аминокислоты из данной α-галогенированной кислоты путем реакции с соединением, выбранным из аммиака, первичного амина, вторичного амина.
2. Процесс по п.1, отличающийся тем, что на этапе с) используемым галогенсодержащим соединением является дибром.
3. Процесс по п.1, отличающийся тем, что на этапе с) используемое галогенсодержащее соединение не является дибромом.
4. Процесс по п.1 или 2, отличающийся тем, что на этапе с) уксусный ангидрид используют в молярной процентной концентрации в области 12% относительно летучей жирной кислоты.
5. Процесс по одному из предшествующих пунктов, отличающийся тем, что на этапе с) температура, при которой выполняется реакция бромирования, составляет от 20 до 40°С ниже точки кипения летучей жирной кислоты.
6. Процесс по одному из предшествующих пунктов, отличающийся тем, что на этапе d) синтез осуществляют путем реакции с аммиаком в газообразной форме или в растворе.
7. Процесс по п.6, отличающийся тем, что на этапе d) синтез осуществляют путем реакции с избытком аммиака относительно стехиометрии реакции.
8. Процесс по п.6 или 7, отличающийся тем, что на этапе d) температура составляет от 20 до 50°С.
9. Процесс по одному из предшествующих пунктов, отличающийся тем, что на этапе d) синтезируется по меньшей мере один побочный продукт, определенный как иминодикислота и/или нитрилотрикислота.
| H.H | |||
| SISLER ET AL., Studies in ammonolysis | |||
| II | |||
| Ammonolysis of α-halogen acids in liquid ammonia, J | |||
| ORG | |||
| CHEM., 1941, vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Детекторный радиоприемник гетеродин | 1923 |
|
SU467A1 |
| US 3642887 A, 15.02.1972 | |||
| ИСКУССТВЕННЫЕ ЦВЕТЫ | 0 |
|
SU295550A1 |
| US 4377638 A, 22.03.1983 | |||
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 1994 |
|
RU2080388C1 |
Авторы
Даты
2019-02-28—Публикация
2016-02-17—Подача