ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к флагеллинам Roseburia, и/или полинуклеотидным последовательностям, кодирующим указанные флагеллины Roseburia, и/или к векторам, содержащим указанные полинуклеотидные последовательности, и/или к клеткам-хозяевам, включая бактерии, содержащим указанные векторы, и/или к клеткам-хозяевам, включая бактерии, содержащим указанные полинуклеотидные последовательности, для различных терапевтических и пищевых применений.
УРОВЕНЬ ТЕХНИКИ
Полагают, что кишечник человека является стерильным в утробе, однако подвергается воздействию различным материнским и внешним микроорганизмам сразу после рождения. После этого происходит динамичный период микробной колонизации и смены сообществ, на которые влияют такие факторы, как путь доставки, окружающие условия, режим питания и генотип хозяина, все из которых влияют на состав микробиоты кишечника, в частности, на ранних стадиях жизни. Затем микробиота стабилизируется и становится похожей на микробиоту взрослого человека (Spor, Koren & Ley 2011). Микробиота кишечника человека содержит более 500-1000 различных филотипов, принадлежащих по существу двум основным бактериальным группам: Bacteroidetes и Firmicutes (Eckburg et al. 2005). Успешные симбиотические взаимосвязи в результате колонизации бактериями кишечника человека обеспечили широкое множество метаболических, структурных, защитных и других благоприятных функций. Повышенная метаболическая активность колонизированного кишечника обеспечивает деградацию в ином случае неперевариваемых компонентов рациона с высвобождением побочных продуктов, обеспечивающих важный источник питательных веществ для хозяина. Аналогично, иммунологическая важность микробиоты кишечника является хорошо известной и проиллюстрирована у безмикробных животных, которые имеют нарушенную иммунную система, которая функционально восстанавливается после введения комменсальных бактерий (Macpherson et al. 2001, Macpherson, Martinic & Harris 2002, Mazmanian et al. 2005).
В противоположность продуцированию секреторного IgA кишечника, на который влияет сама по себе микробная колонизация (Chung, Kasper 2010, Macpherson 2006), развитие и дифференцировка T-клеток, по-видимому, требуют колонизации конкретными комменсальными микроорганизмами. Виды Clostridium, и, в частности, спорообразующие сегментированные нитчатые бактерии (SFB), по-видимому, являются мощным стимулом для дифференцировки и созревания тонкокишечных и толстокишечных Th1, Th17 и Treg (Gaboriau-Routhiau et al. 2009, Ivanov et al. 2009). Недавние исследования продемонстрировали, что другие бактерии кишечника, включая бактерии кластеров Clostridium IV и XIVa и измененную флору Шедлера (ASF), могут влиять на образование de novo Treg, в то время как моноколонизация Bacteroides fragilis может корректировать дисбаланс Th1/Th2 у безмикробных мышей путем стимуляции экспансии Treg (Mazmanian et al. 2005, Geuking et al. 2011, Atarashi et al. 2011). Эти данные подразумевают важные иммунорегуляторные эффекты других резидентных бактерий кишечника. Очевидно, эффекты комменсальных бактерий на пути дифференцировки T-клеток варьируют и, как описано выше, на них может влиять ряд лигандов TLR, для которых было обнаружено, что они ассоциированы с определенными бактериями (Nutsch, Hsieh 2012). Например, механизм, посредством которого SFB влияет на T-клеточные ответы, в настоящее время неизвестен, однако недавние геномные исследования, подтвердившие присутствие генов флагеллина, указывают на то, что врожденные ответы, опосредуемые взаимодействиями TLR5-флагеллин, могут быть важными (Prakash et al. 2011, Sczesnak et al. 2011). Более того, эффекты усиления Treg B. fragilis связывают с PSA и опосредованием событий передачи сигнала TLR2 (Round et al. 2011).
Значительные изменения композиции микробиоты были документально подтверждены при желудочно-кишечных нарушениях, таких как воспалительное заболевание кишечника (IBD). Например, уровни бактерий Clostridium кластера XIVa является сниженным у пациентов с IBD, в то время как число E. coli увеличено, что указывает на сдвиг равновесия симбионтов и патобионтов в кишечнике (Frank et al. 2007, Scanlan et al. 2006, Kang et al. 2010, Machiels K. et al. 2013). Интересно, что этот микробный дисбиоз также ассоциирован с дисбалансом популяций эффекторных T-клеток.
Roseburia относится к филогенетическому кластеру XIVa типа Firmicutes. В настоящее время в роде Roseburia идентифицировано и охарактеризовано пять видов: Roseburia cecicola, Roseburia faecis, Roseburia hominis, Roseburia intestinalis, Roseburia inulinivorans (Stanton and Savage 1983, Duncan et al 2006). Эти бактерии представляют собой жгутиковые комменсальные анаэробы и также являются основными продуцентами бутирата (Duncan et al. 2006). Хотя точные количества этих бактерий, колонизирующих кишечник человека, не было точно оценено, Roseburia spp. являются преобладающими в здоровом кишечнике человека и представлены в меньшем количестве у пациентов с IBD (Machiels K. et al. 2013).
Описаны роли бактериальных генов, в частности флагеллина, участвующих в колонизации и адаптации к кишечнику мыши, а также иммунные гены хозяина, отвечающие на колонизацию бактериями Roseburia. Авторы изобретения показывают, что определенные структуры флагеллина Roseburia, таких как R. hominis и R. intestinalis, индуцируют отчетливые ответы в виде передачи сигнала как в эпителиальных клетках, так и в дендритных клетках относительно других жгутиковых кишечных бактерий. Продемонстрирована важность взаимодействий TLR5-Roseburia, таких как TLR5-R.hominis, при направлении адаптивного ответа хозяина, в частности, ответов Treg. Полная геномная последовательность и аннотация для R. hominis, описанных в настоящем описании, представлена в GenBank под номером доступа CP003040 (версия 1). Для R. intestinalis (номер доступа GenBank для гена 16S рРНК штамма L1-82: AJ312385), описанных в настоящем описании, эталонная геномная последовательность представлена в GenBank под номером доступа ABYJ02000000 (версия 2) и она состоит из последовательностей ABYJ02000001- ABYJ02000409.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Неожиданно, авторы настоящего изобретения обнаружили, что белки-флагеллины Roseburia, являются важными для модулирования иммунного ответа.
Кроме того, авторы настоящего изобретения неожиданно обнаружили, что белки-флагеллины, происходящие или получаемые из Roseburia hominis или Roseburia intestinalis, являются важными для модулирования иммунного ответа.
Настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для модулирования воспаления ткани или органа (такого как кишечник) у индивидуума.
В другом аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для модулирования продукции T-клеток (например, регуляторных T-клеток, таких как регуляторные T-клетки, способные экспрессировать TLR5) у индивидуума.
Настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для восстановления иммунологической толерантности.
В следующем аспекте, настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции иммунной системы индивидуума.
В другом аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для лечения нарушения у индивидуума, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
Настоящее изобретение, в другом аспекте относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для модулирования дендритных клеток (таких как дендритные клетки костного мозга) и/или эпителиальных клеток в ткани или органе индивидуума.
Настоящее изобретение в следующем аспекте относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции продукции IL-10 и/ или TGFβ в клетке или клетках индивидуума.
В следующем аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции продукции маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, таких как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты в клетке или клетках индивидуума.
В другом аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции (например, подавления) экспрессии одного или нескольких генов IFN типа I (таких как, но не ограничиваясь ими, один или несколько генов, выбранных из группы, состоящей из IFN-β1, IFN-β3, Ifi202b, Ifi203, IFI44, IFTI, MXI, OASI, OAS2, OAS3, OASL, Irf3 и Irf4), в клетке или клетках индивидуума.
Настоящее изобретение, в следующем аспекте, относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции (например, подавления) экспрессии одного или нескольких провоспалительных генов (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими, IL1-β, IL4, IL5, IL6, IL8, IL12, IL13, IL17, IL21, IL22, IL23, IL27, IFNγ, CCL2, CCL3, CCL5, CCL20, CXCL5, CXCL10, CXCL12, CXCL13 и TNF-α) в клетке или клетках индивидуума.
Настоящее изобретение в другом аспекте относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для улучшения микробиоты кишечника у индивидуума.
В другом аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции аппетита у индивидуума.
В следующем аспекте, настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции (например, подавления) экспрессии гена, кодирующего холицистокинин (Cck) и/или экспрессии гена, кодирующего глюкагон (Gcg) в клетке или клетках индивидуума.
Настоящее изобретение, в следующем аспекте, относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для улучшения здоровья пищеварительного тракта у индивидуума.
Настоящее изобретение, в другом аспекте относится к фармацевтической композиции, содержащей флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и фармацевтически приемлемый эксципиент, носитель или разбавитель.
В другом аспекте настоящее изобретение относится к пищевой добавке, содержащей флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и диетологически приемлемый эксципиент, носитель или разбавитель.
В следующем аспекте, настоящее изобретение относится к пищевому веществу, продукту питания, диетической добавке или пищевой добавке, содержащим флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis).
Настоящее изобретение в следующем аспекте относится к способу получения фармацевтической композиции в соответствии с настоящим изобретением, причем указанный способ включает смешение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), с фармацевтически приемлемым эксципиентом, носителем или разбавителем; причем необязательно указанный флагеллин Roseburia, и/или указанная полинуклеотидная последовательность, и/или указанный вектор, и/или указанная клетка-хозяин, содержащая указанный вектор, и/или указанная клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или указанные Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis) являются инкапсулированными.
В следующем аспекте настоящее изобретение относится к способу получения пищевой добавки в соответствии с настоящим изобретением, причем указанный способ включает смешение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), с диетологически приемлемым эксципиентом, носителем или разбавителем; причем необязательно указанный флагеллин Roseburia, и/или указанная полинуклеотидная последовательность, и/или указанный вектор, и/или указанная клетка-хозяин, содержащая указанный вектор, и/или указанная клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или указанные Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), являются инкапсулированными.
В другом аспекте настоящее изобретение относится к способу модулирования воспаления ткани или органа (такого как кишенчник) у индивидуума, причем указанный способ включает введение индивидууму флагеллина Roseburia, или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит модулирование воспаление ткани или органа (такого как кишечник) у индивидуума.
Настоящее изобретение, в другом аспекте относится к способу модулирования продукции T-клеток (например регуляторных T-клеток, таких как регуляторные T-клетки, способные экспрессировать TLR5) у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит модулирование продукции T-клеток (например регуляторных T-клеток, таких как регуляторные T-клетки, способные экспрессировать TLR5) у индивидуума.
Настоящее изобретение, в следующем аспекте, относится к способу регуляции иммунной системы индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит регуляция иммунной системы индивидуума.
В следующем аспекте, настоящее изобретение относится к способу лечения нарушения у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
В другом аспекте настоящее изобретение относится к способу модулирования дендритных клеток (таких как дендритные клетки костного мозга) и/или эпителиальных клеток у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит модулирование дендритных клеток (таких как дендритные клетки костного мозга) и/или эпителиальных клеток у индивидуума.
В следующем аспекте, настоящее изобретение относится к способу регуляции продукции IL-10 и/или TGFβ в клетке или клетках индивидуума, причем указанный способ включает введение флагеллина Roseburia и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму, и где происходит регуляция продуцирования IL-10 и/или TGFβ в клетке или клетках индивидуума.
Настоящее изобретение, в другом аспекте относится к способу регуляции продукции маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, таких как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму, и где происходит регуляция продукции маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, таких как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
В другом аспекте настоящее изобретение относится к способу регуляции (например, подавления) экспрессии одного или нескольких генов IFN типа I (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IFN-β1, IFN-β3, Ifi202b, Ifi203, IFI44, IFTI, MXI, OASI, OAS2, OAS3, OASL, Irf3 и Irf4) в клетке или клетках индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), где происходит регуляция экспрессии одного или нескольких генов IFN типа I (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IFN-β1, IFN-β3, Ifi202b, Ifi203, IFI44, IFTI, MXI, OASI, OAS2, OAS3, OASL, Irf3 и Irf4) в клетке или клетках индивидуума.
В следующем аспекте настоящее изобретение относится к способу регуляции (например, подавления) экспрессии одного или нескольких провоспалительных генов (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IL1-β, IL4, IL5, IL6, IL8, IL12, IL13, IL17, IL21, IL22, IL23, IL27, IFNγ, CCL2, CCL3, CCL5, CCL20, CXCL5, CXCL10, CXCL12, CXCL13 и TNF-α в клетке или клетках индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), где происходит регуляция экспрессии одного или нескольких провоспалительных генов (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IL1-β, IL4, IL5, IL6, IL8, IL12, IL13, IL17, IL21, IL22, IL23, IL27, IFNγ, CCL3, CCL5, CCL20, CXCL5, CXCL10, CXCL12, CXCL13 и TNF-α) в клетке или клетках индивидуума.
Настоящее изобретение в следующем аспекте относится к способу улучшения кишечной микробиоты у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит улучшение микробиоты кишечника.
В другом аспекте настоящее изобретение относится к способу регуляции аппетита у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит регуляция аппетита у индивидуума.
Настоящее изобретение в другом аспекте относится к способу регуляции (например, подавления) экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит регуляция экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума.
В следующем аспекте настоящее изобретение относится к способу улучшения здоровья пищеварительного тракта у индивидуума, причем указанный способ включает введение флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит улучшение здоровья пищеварительного тракта у индивидуума.
Настоящее изобретение в следующем аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для модулирования воспаления ткани или органа (такого как кишечник) у индивидуума.
Настоящее изобретение, в другом аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для модулирования продукции T-клеток (например регуляторных T-клеток, таких как регуляторные T-клетки, способные экспрессировать TLR5) у индивидуума.
В следующем аспекте, настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции иммунной системы индивидуума.
Настоящее изобретение в следующем аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для лечения нарушения у индивидуума, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
Настоящее изобретение, в другом аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для модулирования дендритных клеток (таких как дендритные клетки костного мозга) и/или эпителиальных клеток в ткани или органе индивидуума.
В другом аспекте настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции продукции IL-10 и/или TGFβ в клетке или клетках индивидуума.
Настоящее изобретение, в следующем аспекте, относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции продукции маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, таких как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
В следующем аспекте настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции (например, подавления) экспрессии одного или нескольких генов IFN типа I (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IFN-β1, IFN-β3, Ifi202b, Ifi203, IFI44, IFTI, MXI, OASI, OAS2, OAS3, OASL, Irf3 и Irf4) в клетке или клетках индивидуума.
В другом аспекте настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции (например, подавления) экспрессии одного или нескольких провоспалительных генов (таких как один или несколько генов, выбранных из группы, состоящей из, но не ограничивающейся ими IL1-β, IL4, IL5, IL6, IL8, IL12, IL13, IL17, IL21, IL22, IL23, IL27, IFNγ, CCL2, CCL3, CCL5, CCL20, CXCL5, CXCL10, CXCL12, CXCL13 и TNF-α) в клетке или клетках индивидуума.
Настоящее изобретение в следующем аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для улучшения кишечной микробиоты у индивидуума.
Настоящее изобретение в другом аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции аппетита у индивидуума.
Настоящее изобретение в следующем аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для регуляции (например, подавления) экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума.
Настоящее изобретение в другом аспекте относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для улучшения здоровья пищеварительного канала у индивидуума.
В другом аспекте настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения в медицине.
В следующем аспекте настоящее изобретение относится к флагеллину Roseburia, и/или к полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или к Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для восстановления иммунологической толерантности.
В другом аспекте настоящее изобретение относится к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для изготовления лекарственного средства для восстановления иммунологической толерантности у индивидуума.
В другом аспекте настоящее изобретение относится к способу восстановления иммунологической толерантности у индивидуума, причем указанный способ включает введение флагеллина Roseburia и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и где происходит восстановление иммунологической толерантности у индивидуума.
ЧЕРТЕЖИ
Фигура 1. Последовательность и аннотация генома R. hominis. Была получена полная геномная последовательность R. hominis A2-183. Она представлена одной хромосомой размером 3592125 п.н. с четырьмя рибосомальными оперонами, 66 РНК и 3273 прогнозируемыми белками. (A) Карта кольцевого генома R. hominis с указанием положения областей экспериментов ПЦР (таблица S1), на которые были нацелены праймеры. Дорожки на карте генома, начиная с наружной дорожки 0, представляют собой: дорожка 0 (синяя) - эксперименты ПЦР в реальном времени, указанные пронумерованными метками; дорожка 1 (голубой) - прямая CDS; дорожка 2 (голубой) - обратная CDS; дорожка 3 (серый) - рРНК; дорожка 4 (зеленый) - тРНК; дорожка 5 (красный) - маркирующие STS области, на которые нацелена ПЦР в реальном времени; кривая 1 - содержание GC; кривая 2 - смещение в сторону GC. (B) Функциональная аннотация генома R. hominis демонстрирует, что наибольшее число генов относится к генам углеводов, метаболизма белков, аминокислотам и производным.
Фигура 2. R. hominis отвечает на среду кишечника генами активации подвижности, мобилизации и хемотаксиса. Безмикробным самцам мышей GF C3H/HeN вводили культуру R. hominis через зонд в течение 28 суток и сравнивали с контрольными безмикробными животными. На 14 сутки и 28 сутки животных, которым вводили R. hominis (N=5), и контрольных животных (N=4) умерщвляли и подвздошную кишку, ободочную кишку и слепую кишку извлекали. (A) Подтверждение способом ПЦР в реальном времени генов, вовлеченных в переход конъюгация/мобилизация. (B) Подтверждение способом ПЦР в реальном времени генов, вовлеченных в подвижность и хемотаксис. (C) Вестерн-блоттинг R. hominis, выращенных in vitro в присутствии УФ-облученного стандартного корма для мышей, подвергнутых иммунному окрашиванию антителом Fla1, подвергнутым аффинной очистки, специфичной к Fla2 антисывороткой и антителом против ДНК-гиразы A (дорожка 1: без корма, дорожка 2: 0,01 г корма/10 мл культуры R. hominis, дорожка 3: 0,02 г корма /10 мл, дорожка 4: 0,05 г корма/10 мл, дорожка 5: 0,1 г корма/10 мл, дорожка 6: 0,2 г корма/10 мл, дорожка 7: 0,5 г корма/10 мл, дорожка 8: 1 г корма/10 мл). Изображение R. hominis, полученное с использованием электронной микроскопии (EM), демонстрирующее жгутики (черные стрелки). Иммуногистохимия, проведенная для бактерий из содержимого просвета колонизированных мышей и для R. hominis, выращенных in vitro с использованием специфичной к FlaA1 и FlaA2 антисыворотки. Исходное увеличение x1000. (D) Подтверждение с использованием ПЦР в реальном времени генов, вовлеченных в метаболизм бутирата. (E) Анализ с использованием ПЦР в реальном времени транскриптов R. hominis в процессе воздействия in vitro эпителиальных клеток кишечника человека. Результаты ПЦР в реальном времени представлены в качестве кратности изменения, *P<0,05, **P<0,01, ***P<0,001.
Фигура 3. Идентификация транскриптов, дифференциально экспрессирующихся в кишечнике мыши после моноассоциации с R. hominis. (A) Анализ на микрочипах Affymetrix дифференциально экспрессируемых генов у мышей, колонизированных R. hominis (N=5), относительно GF (N=4). Столбиковые диаграммы соответствуют числу генов, выше или ниже экспрессируемых после 14 и 28 суток. (B) Тепловая карта, полученная для дифференциально экспрессируемых генов с функциональной значимостью между мышами GF и мышами, колонизированными R. hominis, на 14 сутки и 28 сутки. (C) Подтверждение с использованием ПЦР в реальном времени генов, для которых было показано, что они значимо различаются между мышами, колонизированными R. hominis, и мышами GF. Результаты ПЦР в реально v времени представлены в качестве кратности изменения, *P<0,05, **P<0,01, ***P<0,001.
Фигура 4. Индукция клеток FoxP3+ Treg посредством Roseburia hominis. Проточно-цитометрический анализ клеток FoxP3+ Treg в собственной пластинке (P=0,0425 между контрольным введением и введением R. hominis) и брыжеечных лимфатических узлах (P=0,0683) общепринятых C3H/HeN, которым проводили введение R. hominis в течение 14 суток.
Фигура 5. Маркеры T-клеток ободочной кишки в значительной степени индуцируются моноколонизацией R. hominis. (A) Иммунофлуоресцентный анализ клеток собственной пластинки восходящей ободочной кишки с помощью антител против CD3 и антител против FoxP3 у безмикробных мышей и мышей, моноколонизированных C3H/HeN R. hominis (N=8) и мышей C57Bl/6 (N=3). (B) Иммунофлуоресцентный анализ клеток собственной пластинки с использованием (i) антитела против Ly6G, (ii) антитела против CD11b, (iii) антитела против CD3, и (iv) антитела против CD3 и антитела против FoxP3 в восходящей ободочной кишке мышей C3H/HeN GF и мышей C3H/HeN, которым вводили R. hominis. Данные выражали в качестве числа положительных клеток на поле зрения у мышей GF (N=7-8) и у мышей, которым вводили R. hominis (N=8-10). *P<0,05. Исходное увеличение x630.
Фигура 6. Флагеллин RH1 R. hominis имеет определенные эффекты на эпителиальные клетки кишечника и происходящие из костного мозга мыши дендритные клетки. (A) Тепловая карта, полученная для дифференциально экспрессированных генов в эпителиальных клетках кишечника Caco-2 (N=1), обработанных различными бактериальными флагеллинами Salmonella enteritidis (SE), E. coli K12 (EC), RH1 и RH2. (B) Экспрессия (i) CD40; (ii) I-A/I-E и (iii) CD103 происходящими из CD11c+B220+CD317+ Flt3L дендритными клетками из общепринятых C3H/HeN, контролей (синий) и после инкубации в течение 24 с рекомбинантным флагеллином (SE, K12, RH1, RH2; зеленый), определенная проточной цитометрией. Гистограмма, на которой представлены данные трех экспериментов. (C) Частоты обработанных рекомбинантным флагеллином (SE, K12, RH1, RH2) полученных с помощью Flt3L и GMCSF дендритных клеток из общепринятых C3H/HeN, улавливаемых в качестве CD11c+B220+CD317+ клеток и CD11c+CD11b+B220- клеток, соответственно. Данные представлены в качестве среднего значения ± SEM процента от всех, живых и единичных клеток, для всех трех экспериментов. (D) Белковую экспрессию цитокинов IL-10 и IL-12 измеряли посредством CBA в супернатантах контрольных (нестимулированные DC; N=3) и обработанных RH1 DC (N=3), происходящих из C3H/HeN и C57Bl/6. Данные представлены в качестве среднего значения ± SD. ***P<0,001. (E) Количественный анализ посредством иммунофлуоресцентного мечения клеток собственной пластинки ободочной кишки антителами против CD3 и антителами против FoxP3 у безмикробных мышей TLR5KO и моноколонизированных посредством R. hominis мышей TLR5KO (N=2).
Фигура 7. R. hominis ослабляет воспаление в экспериментальной модели колита. Двадцать двух самок мышей C57BL/6 использовали для оценки терапевтического эффекта R. hominis в ходе индуцируемого DSS колита. Мышам, которым проводили введение, дозировали каждые сутки 109 к.о.е. R. hominis в течение 14 суток. Начиная с 8 суток мышам вводили DSS в их питьевой воде в течение 6 суток. Животных умерщвляли на 14 сутки и проводили взятие образцов ткани кишечника. (A) У мышей DSS без введения (N=8) происходило выраженное увеличение экспрессии всех генов по сравнению с контрольными мышами (N=4), в то время как дифференциальная экспрессия генов была более низкой у животных, которым вводили R. hominis (N=10). Результаты ПЦР в реальном времени представлены в качестве кратного изменения, ***P<0,001. (B) Гистопатологическая оценка ткани, представленная в качестве среднего процента полей зрения с данной степенью. Введение DSS значительно изменяло все поля зрения со степенями 0, 2, 3 и 4. R. hominis значительно снижали % полей зрения для патологии степени 4 (p=0,02) и увеличивали % полей зрения для степени 0. Данные представлены в качестве среднего значения ± SD. (C) Восходящая ободочная кишка (окрашенная гематоксилином/эозином) контрольных животных IL-10KO, которым вводили DSS, и животных IL-10KO, которым вводили DSS/R. hominis. Представленные изображения представляют собой репрезентативные поля зрения для каждой группы введения. Исходное увеличение x100.
Дополнительные Фигуры
Фигура S1. R. hominis предпочтительно колонизируют восходящую ободочную кишку моноколонизированных мышей. (A) R. hominis колонизировали восходящую ободочную кишку кишечника мышей с тесной ассоциаций бактерий с эпителием хозяина, обнаруженной посредством FISH с использованием A2-183 (зонд, специфический для R. hominis; FITC), Eub338 (универсальный зонд 16S; Cy3) и DAPI (ядра; синий). Также показано наложение A2-183 + Eub338 и Eub338 + DAPI. Величина гамма для красного канала была увеличена для наложения Eub338 + DAPI для иллюстрации меченных бактерий. Original magnification x630. (B) ПЦР с использованием праймеров, специфических для R. hominis, продемонстрировала положительный сигнал в ДНК фекалий после колонизации, в то время как фекалии животных GF были отрицательными в отношении присутствия каких-либо бактерий. (C) Анализ способом ПЦР в реальном времени, демонстрирующий уровни колонизации R. hominis/г фекалий. Бактериальную ДНК, выделенную из фекалий, сравнивали с известными стандартными концентрациями R. hominis, выращенных в культуре. Аналогичные уровни бактерий были обнаружены у всех моноколонизированных мышей, приближаясь к 1x1010 бактерий/г фекалий. Результаты исследования фекалий животных GF были отрицательными в отношении присутствия каких-либо бактерий.
Фигура S2. Анализ генной онтологии, проведенный для генов, активированных через 28 суток в восходящей ободочной кишке кишечнике. Функциональную интерпретацию данных генной онтологии (GO) проводили с использованием DAVID (http://david.abcc.ncifcrf.gov). Значимо отличающиеся транскрипты (P<0,05) были отнесены к категории GO "биологический процесс", чтобы найти значительно увеличенные значения GO. Снижались биологические процессы GO для "полимеризации актина" (GO:0030041) и "отрицательной регуляции каскада I-каппа B киназа/NF-каппа B" (GO:0043124).
Фигура S3. Идентификация транскриптов, дифференциально эксперссируемых в кишечнике мыши после моноассоциации с E. coli. (A) Анализ на микрочипах Affymetrix дифференциально экспрессируемых генов у мышей, колонизированных E. coli и R. hominis с течением времени. Столбиковые диаграммы соответствуют числу генов, выше или ниже экспрессируемых после 22 и 28 суток, соответственно. (B) Тепловая карта, полученная для дифференциально экспрессируемых генов с функциональной значимостью у мышей, колонизированных E. coli, на 22 сутки против 10 суток.
Фигура S4. Идентификация транскриптов, дифференциально экспрессируемых в кишечнике мышей TLR5KO после моноассоциации с R. hominis. (A) Тепловая карта, полученная для дифференциально экспрессируемых генов в восходящей ободочной кишке мышей TLR5KO, колонизированных R. hominis (N=3), и мышей дикого типа (N=3) на 28 сутки. (B) Тепловая карта, полученная для дифференциально экспрессируемых генов, ассоциированных с иммунитетом, в восходящей ободочной кишке мышей TLR5KO, колонизированных R. hominis, и мышей дикого типа на 28 сутки. (C) Тепловая карта, полученная для дифференциально экспрессируемых генов в подвздошной кишке мышей TLR5KO, колонизированных R. hominis, и мышей дикого типа на 28 сутки. (D) Тепловая карта, полученная для дифференциально экспрессируемых генов, ассоциированных с иммунитетом, в восходящей подвздошной кишке мышей TLR5KO, колонизированных R. hominis, и мышей дикого типа на 28 сутки.
Фигура S5. Анализ генной онтологии, проведенный на генах, подавляемых через 28 суток в восходящей кишке. В наибольшей степени снижались биологические процессы GO, вовлеченные в регуляцию аппетита, такие как "отрицательная регуляция ответа на пищу" (GO:0032096), "отрицательная регуляция аппетита" (GO:0032099) и "регуляция секреции катехоламинов" (GO:0050433).
Фигура S6. Колонизация R. hominis влияет на гены сытости и массы тела. Анализ сухой массы тела и липидного каркаса. (A) Сухая масса туши мышей, которым вводили R. hominis, была значительно большей по сравнению с животными GF. (B) Анализ массы туши показал, что общая тучность также была значительно более высокой у животных, которым вводили R. hominis, через 14 суток. Данные представлены в качестве среднего значения ± SD.
Фигура 1A. Представление клонирующего вектора PCR-Blunt II-TOPO, использованного для клонирования рекомбинантных флагеллинов, нерастворимых после лизиса клеток. На нем показано высокоэффективное клонирование ДНК продуктов ПЦР с тупыми концами. Она кодирует гены устойчивости канамицина и зеоцина для селекции в E. coli, и вкладыш фланкируется множеством участков рестрикции для вырезания.
Фиг.2A. Представление экспрессирующего вектора T7-MAT-Tag-FLAG-, использованного для клонирования рекомбинантных флагеллинов, нерастворимых после лизиса клеток. Участок множественного клонирования (MCS) фланкируется последовательностью MAT (металлсодержащая аффинная метка) и последовательностью пептида FLAG (Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys), которая приводит к продукции флагеллина с двойным мечением, который далее может быть очищен с использованием аффинных колонок. Этот экспрессирующий вектор также кодирует промотор pT7/lac (lac-оперон фага T7) для индуцируемой IPTG экспрессии на высоком уровне рекомбинантных флагеллинов MAT-ORF-FLAG, внутреннего гена lacI, который подавляет транскрипцию в базальном состоянии в любом хозяине E. coli, и ген AmpR для селекции с ампициллином.
Фигура 3A. Визуализация на SDS-PAGE рекомбинантного флагеллина, клонированного с использованием клонирующего вектора PCR-Blunt II-TOPO и экспрессированного с использованием экспрессирующего вектора pT7-MAT-Tag-FLAG-2. Описание дорожек: 1, белковый стандарт (кДа); 2, RH1.
На фигурах B1A и B1B показан SDS-анализ рекомбинантных флагеллинов.
(A) K12 (Escherichia coli K12); ER (Eubacterium rectale 33656); RI1 (Roseburia intestinalis Fla 1); RI2 (Roseburia intestinalis Fla 2);
(B) RH1 (Roseburia hominis Fla 1); RH2 (Roseburia hominis Fla 2); RI3 (Roseburia intestinalis Fla 3); RI4 (Roseburia intestinalis Fla 4).
Фигура C1-C4. Множественное выравнивание последовательностей, подтверждающее нуклеотидную последовательность флагеллина и номер доступа.
Фигура D.2. Сравнительный анализ индукции гена CCL20 различными флагеллинами. Клетки HT-29 и Caco-2 стимулировали в течение 2 часов одним рекомбинантным флагеллином в концентрации 100 нг/мл. Тотальную РНК экстрагировали и подвергали анализу с использованием количественной ПЦР в реальном времени для генов CCL20 и β-актина. Эксперименты проводили в трех экземплярах в трех отдельных случаях. В таблице D2 указаны значимые отличия между каждой обработкой, вычисленные с использованием парного t-критерия, в HT-29.
Фигура D.3. Опосредуемая флагеллином секреция хемокинов в клетках HT-29 и Caco-2. В таблицах D3a, D3b, D3c и D3d указаны значимые различия между каждой обработкой, вычисленные с использованием парного t-критерия.
Фигура D4, нейтрализация TLR5 с помощью специфического антитела против TLR5.
Фигура D5A: частоты полученных с помощью GM-CSF/IL-4 дендритных клеток, стимулированных рекомбинантными флагеллинами, данные показаны в качестве кратности изменения по сравнению с нестимулированными полученными с помощью GM-CSF/IL-4 дендритными клетками.
Фигура D5B: частоты полученных с помощью Flt3L дендритных клеток, стимулированных рекомбинантными флагеллинами, данные представлены в качестве кратности изменения по сравнению с нестимулированными полученными с помощью Flt3L дендритными клетками.
Фигура D6 A и B. Проточно-цитометрический анализ FoxP3+ Treg в собственной пластинке мышей BOY/J WT и TLR5KO, которым вводили R. hominis.
ПОДРОБНОЕ ОПИСАНИЕ
Флагеллин
Флагеллин является основным компонентом бактериального жгутика, и он присутствует в больших количествах практических всех жгутиковых бактерий. Как правило, флагеллины являются глобулярными белками, которые организуются в полый цилиндр с образованием филамента в бактериальном жгутике.
Разнообразие последовательностей структурных белков и генов флагеллинов хорошо известно и варьируется в зависимости от вида бактерий, географического, и клинического и климатического происхождения. Существуют тысячи флагеллинов и родственных флагеллинам генов. Некоторые из важных флагеллинов в бактериях кишечника включают флагеллины FLA, FliC, FlgC, FLiE, FlaB, MoA и FliG.
Существует несколько типов полипептидов FLA (Fla). FlaA1, FlaA2, FlaA3, FlaA4 и FlaB представляют собой примеры полипептидов FLA.
Полипептид FlaA1
Термин "полипептид FlaA1", как используют в рамках изобретения относится к белку-флагеллину FlaA1. Примеры таких полипептидов включают полипептид FlaA1 Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis и Roseburia inulinivorans; полипептидную последовательность, представленную в качестве SEQ ID NO: 2 или SEQ ID NO: 6; и полипептиды, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с SEQ ID NO: 2 или SEQ ID NO: 6, или их варианты, гомологи, фрагменты или производные.
SEQ ID NO: 2 имеет следующую последовательность:
MVVQHNLTAMNANRQLGITTGAQAKSSEKLSSGYKINRAADDAAGLTISEKMRSQVRGLNKASDNAQDGVSLIQVAEGALSETHSILQRMNELATQAANDTNTTSDRTAVQQEINQLASEITRIASTTQFNTMNLIDGNFTSKKLQVGSLCGQAITIDISDMSATGLGVSGLVVSSFSAAGKAMSAAQDAISYVSSMRSKLGALQNRLEHTISHLDNISEHTSSAESRIRDTDMAEEMVEYSKNNILAQAGQSMLAQANQSTQGVLSLLQ
SEQ ID NO: 2 депонирован в NCBI под номером доступа ABI48297.1.
Термины "полипептид FlaA1" и "FlaA1-полипептид" используют в настоящем описании взаимозаменяемо.
Термины "FlaA1", "Fla1" и "RH1" могут использоваться в настоящем описании взаимозаменяемо.
В одном варианте осуществления полипептид FlaA1 обладает по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с SEQ ID NO: 2 или с его вариантами, гомологами, фрагментами или производными. В одном аспекте аминокислоты в положениях 79-117 и в положениях 408-439, а также 411, 412, 420 SEQ ID NO: 2 (или их эквиваленты) считаются важными. В одном аспекте аминокислоты в положениях 411, 412, 420 SEQ ID NO: 2 (или их эквиваленты) представляют собой аланин (A), глутамин (Q) и серин (S), соответственно.
В одном варианте осуществления полипептид FlaA1 представляет собой полипептид, показанный в качестве SEQ ID NO: 2 или SEQ ID NO: 6.
Полипептиды FlaA1 могут происходить из определенных микроорганизмов. В одном аспекте полипептид FlaA1 происходит из бактерии, такой как Firmicute. В следующем аспекте полипептид FlaA1 происходит из Roseburia spp, таких как Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis или Roseburia inulinivorans.
Roseburia hominis и Roseburia intestinalis представляют собой недавно описанные комменсальные анаэробы кишечника филогенетического кластера XIVa в типе Firmicutes, относящиеся к доминирующей группе бактерий в кишечнике человека, а также являются основными продуцентами бутирата. Примером Roseburia hominis является штамм, депонированный согласно условиям Будапештского договора в National Collections of Industrial, Food and Marine Bacteria (NCIMB) в NCIMB Ltd, Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, UK, AB21 9YA, 21 октября 2004 года организацией Rowett Research Institute под номером доступа NCIMB 14029T Roseburia hominis A2-183T (DSM = 16839T). Другим примером пример является вид бактерий Roseburia hominis, как описано в Duncan, S. H., Aminov, R. I., Scott, K. P., Louis, P., Stanton, T. B., & Flint, H. J. (2006) Int. J. Syst. Evol. Microbiol. 56: 2437-2441. Примером Roseburia intestinalis является штамм, депонированный под номером доступа NCIMB 13810 Rosburia intestinalis L1-82T (DSM = 14610T). Другим примером является вид бактерий Roseburia hominis, как описано в Duncan, S. H., Aminоv, R. I., Scott, K. P., Louis, P., Stanton, T. B., & Flint, H. J. (2006) Int. J. Syst. Evol. Microbiol. 56: 2437-2441.
Термин "полинуклеотидная последовательность, кодирующая полипептид FlaA1", как используют в рамках изобретения, относится к полинуклеотидной последовательности, кодирующей белок флагеллина белок FlaA1. Примеры таких полинуклеотидных последовательностей включают ген FlaA1 R. hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis или Roseburia inulinivorans; полинуклеотидную последовательность, представленную в качестве SEQ ID NO: 1 или SEQ ID NO: 5; полинуклеотидные последовательности, кодирующие полипептид, представленный в качестве SEQ ID NO: 2 или SEQ ID NO: 6; полинуклеотидные последовательности, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с SEQ ID NO: 1 или SEQ ID NO: 5 или их варианты, гомологи, фрагменты или производные; и полинуклеотидные последовательности, кодирующие полипептид, показанный в качестве SEQ ID NO: 2 или SEQ ID NO: 6, или кодирующие полипептид, обладающий по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с полипептидом, показанным в качестве SEQ ID NO: 2 или SEQ ID NO: 6 или их варианты, гомологи, фрагменты или производные.
SEQ ID NO: 1 имеет следующую последовательность:
ATGGTAGTACAGCACAATCTTACAGCAATGAACGCTAACAGACAGTTAGGTATCACAACAGGCGCACAGGCTAAGTCTTCTGAGAAGTTATCTTCTGGTTACAAGATCAACCGCGCAGCAGATGACGCAGCAGGTCTTACGATTTCCGAGAAGATGAGAAGCCAGGTTAGAGGCTTAAATAAAGCTTCTGACAACGCACAGGATGGTGTATCCCTTATTCAGGTAGCTGAGGGTGCATTAAGTGAGACACACTCCATCTTACAGCGTATGAATGAGTTAGCAACTCAGGCAGCAAACGATACCAATACAACCTCAGACAGAACTGCAGTTCAGCAGGAGATCAACCAGTTAGCATCTGAGATCACCAGAATCGCTTCTACAACTCAGTTCAACACAATGAACCTGATCGATGGTAACTTCACAAGTAAGAAGCTTCAGGTAGGTTCCCTTTGCGGACAGGCTATCACAATCGATATCTCTGATATGTCTGCTACAGGTCTTGGCGTTAGCGGATTAGTAGTATCTTCCTTCTCTGCAGCTGGTAAGGCAATGTCTGCAGCTCAGGATGCTATCAGCTACGTATCTTCTATGCGTTCTAAGCTGGGTGCATTACAGAACAGACTTGAGCACACAATCTCCCACCTGGACAACATTTCTGAGCACACATCTTCTGCAGAGTCTCGTATCCGTGATACAGATATGGCTGAAGAGATGGTTGAGTACAGCAAGAACAACATCCTTGCTCAGGCAGGACAGTCTATGCTTGCTCAGGCTAACCAGTCTACTCAGGGTGTATTATCCTTATTACAGTAA
SEQ ID NO: 1 депонирована в NCBI под номером доступа DQ789140.1.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая полипептид FlaA1, обладает по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с полинуклеотидной последовательностью, показанной в качестве SEQ ID NO: 1 или SEQ ID NO: 5 или с их вариантами, гомологами, фрагментами или производными.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая полипептид FlaA1, кодирует полипептид, показанный в качестве SEQ ID NO: 2 или SEQ ID NO: 6, или полипептид, обладающий по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с полипептидом, показанным в качестве SEQ ID NO: 2 или SEQ ID NO: 6, или с их вариантами, гомологами, фрагментами или производными.
В одном варианте осуществления полипептид FlaA1 представляет собой укороченный полипептид FlaA1. Например, укороченный полипептид содержит по меньшей мере 20, 30, 40, 50, 75, 100, 125, 150, 175 или 200 аминокислот полипептида, показанного в качестве SEQ ID NO: 2 или SEQ ID NO: 6.
Без связи с теорией, двумя необходимыми областями белка флагеллина, вовлеченного в распознавание и активацию TLR5, являются аминокислоты 79-117 SEQ ID NO: 2 (домен N-D1) и аминокислоты 408-439 SEQ ID NO: 2 (домен C-D1). Без связи с теорией, аминокислоты: A411, Q412, S420 являются важными аминокислотами.
Примеры укороченных полипептидов FlaA1 включают: полипептиды, которые содержат аминокислоты 79-117 и аминокислоты 408-439 SEQ ID NO: 2; полипептиды, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью аминокислотами 79-117 и аминокислотами 408-439 SEQ ID NO: 2; полипептиды, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с аминокислотами 79-117 и аминокислотами 408-439 SEQ ID NO: 2, где аминокислота в положении 411 (или ее эквивалент) представляет собой аланин (A) и/или аминокислота в положении 214 представляет собой глутамин (Q) и/или аминокислота в положении 420 представляет собой серин (S); полипептиды, содержащие аминокислоты 79-439 SEQ ID NO: 2; полипептиды, содержащие аминокислоты 79-439 SEQ ID NO: 2, где аминокислота в положении 411 (или ее эквивалент) представляет собой аланин (A); полипептиды, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с аминокислотами 79-439 SEQ ID NO: 2; и полипептиды, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с аминокислотами 79-439 SEQ ID NO: 2, где аминокислота в положении 411 (или ее эквивалент) представляет собой аланин (A) и/или аминокислота в положении 214 представляет собой глутамин (Q) и/или аминокислота в положении 420 представляет собой серин (S).
В одном аспекте аминокислоты в положениях 411, 412, 420 SEQ ID NO: 2 (или их эквиваленты) в укороченном полипептиде FlaA1 представляют собой аланин (A), глутамин (Q) и серин (S), соответственно.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая полипептид FlaA1, кодирует укороченный полипептид FlaA1.
В одном варианте осуществления полипептид FlaA1 представляет собой слитый полипептид. Например, полипептид является слитым с глутатион-S-трансферазой (GST).
Род Roseburia
Бактерии Roseburia представляют собой немного искривленные палочковидные клетки, которые являются строго анаэробными и аборигенными для кишечника млекопитающих. Бактерии являются продуцирующими бутират и активно подвижными посредством множества жгутиков, присутствующих вдоль вогнутой стороны и кластером на одном конце (Stanton and Savage 1983). В настоящее время в роде Roseburia, было идентифицировано и охарактеризовано пять видов: Roseburia cecicola, Roseburia faecis, Roseburia hominis, Roseburia intestinalis и Roseburia inulinivorans (Stanton и Savage 1983, Duncan et al 2006).
В Stanton and Savage (1983 - Roseburia cecicola gen. nov., sp. nov., a motile, obligately anaerobic bacterium from a mouse cecum. Int. J. Syst. Bacteriol., 1983, 33, 618-627.) описаны Roseburia cecicola.
В Duncan et al. (2006 - Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces. Int. J. Syst. Evol. Microbiol., 2006, 56, 2437-2441) описаны Roseburia faecis.
В Duncan et al. (2006 - Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces. Int. J. Syst. Evol. Microbiol., 2006, 56, 2437-2441) описаны Roseburia hominis.
В Duncan et al. (2002 - Roseburia intestinalis sp. nov., a novel saccharolytic, butyrate-producing bacterium from human faeces. Int. J. Syst. Evol. Microbiol., 2002, 52, 1615-1620) описаны Roseburia intestinalis.
В Duncan et al. (2006 - Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces. Int. J. Syst. Evol. Microbiol., 2006, 56, 2437-2441) описаны Roseburia inulinivorans.
Флагеллин Roseburia
Термин "флагеллин Roseburia", как используют в рамках изобретения, относится к белку-флагеллину, происходящему или получаемому из бактерий Roseburia, таких как Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis и Roseburia inulinivorans.
Флагеллин Roseburia может представлять собой flaA1, flaA2, flaA3, flaA4 или их комбинации.
Термины "FlaA1", "Fla1", "flaA1" и "fla1" используют в настоящем описании.
Термины "FlaA2", "Fla2", "flaA2" и "fla2" используют в настоящем взаимозаменяемо.
Термин Fla используют в настоящем описании для обозначения полипептидов, которые могут представлять собой flaA1, flaA2, flaA3, flaA4 или fliC.
В одном варианте осуществления настоящее изобретение охватывает применение по меньшей мере одного флагеллина Roseburia. Например, настоящее изобретение охватывает применение комбинации по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех или по меньшей мере пяти флагеллинов Roseburia.
В некоторых вариантах осуществления комбинация флагеллинов Roseburia содержит флагеллины, которые происходят или которые могут быть получены из по меньшей мере двух, трех, четырех или пяти различных видов Roseburia.
Примеры флагеллинов Roseburia включают флагеллины, происходящие или получаемые из бактерий Roseburia, таких как Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis и Roseburia inulinivorans. В одном варианте осуществления флагеллин происходит или может быть получен из Roseburia hominis. В другом варианте осуществления флагеллин происходит или может быть получен из Roseburia intestinalis.
Примеры флагеллинов Roseburia включают полипептидные последовательности, обладающие по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью с SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12, или их варианты, гомологи, фрагменты или производные.
В одном варианте осуществления флагеллин Roseburia обладает полипептидной последовательностью, показанной в качестве SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12.
Примерами флагеллинов Roseburia hominis являются Fla1 и Fla2 Roseburia hominis.
Пример Roseburia hominis Fla1 представлен в качестве SEQ ID NO: 2. Fla1 Roseburia hominis также обозначают в настоящем описании как RhFlaA1, RHFlaA1, RhFla1, RHFla1, RH1 или Rh1.
SEQ ID NO: 2 имеет следующую последовательность:
MVVQHNLTAMNANRQLGITTGAQAKSSEKLSSGYKINRAADDAAGLTISEKMRSQVRGLNKASDNAQDGVSLIQVAEGALSETHSILQRMNELATQAANDTNTTSDRTAVQQEINQLASEITRIASTTQFNTMNLIDGNFTSKKLQVGSLCGQAITIDISDMSATGLGVSGLVVSSFSAAGKAMSAAQDAISYVSSMRSKLGALQNRLEHTISHLDNISEHTSSAESRIRDTDMAEEMVEYSKNNILAQAGQSMLAQANQSTQGVLSLLQ
SEQ ID NO: 2 депонирована в NCBI под номером доступа ABI48297.1.
Пример Fla2 Roseburia hominis представлен в качестве SEQ ID NO: 4. Fla2 Roseburia hominis также обозначают в настоящем описании как RhFlaA2, RHFlaA2, RhFla2, RHFla2, Rh2 или RH2.
SEQ ID NO: 4 имеет следующую последовательность:
MVVNHNMAAICESRQLRYNVKKMEKSSKKLATGYKLNTANDDAAGLQISETMRHHVKGLNKASRNSQDGISMLQTADAALQETQDVLDRMVELTTQAANDINTDSDRRAIQDELDQLNKEVDRIAYTTHFNQQYMLAEGTPQAAPGYYRIQSGALNGQAIDIHFVNASKESLGTDKVNVSSHAKASESITMVQDAIEQAALWRDEFGSQQERLEHAVRNTDNTSQNTQSAESGIRDTNMNMEMVLYSTNRILVHASQSILAQYNDDAKSVLEILK
Примеры флагеллинов Roseburia intestinalis включают Fla1, Fla2, Fla3 и Fla4 Roseburia intestinalis.
Пример Fla1 Roseburia intestinalis представлен в качестве SEQ ID NO: 6. Roseburia intestinalis также обозначают в настоящем описании как RiFlaA1, RIFlaA1, RiFla1, RIFla1, Ri1 или RI1.
SEQ ID NO: 6 имеет следующую последовательность:
MRINYNVSAAIANKHLLGIEDNLSASMERLSSGLKINHSKDNPAGMAISNKMKAQIDGLNRASQNASDGISVIQIADGALSETTSILQRMRELSVQAASDATMTPADKEAIQKEITSLKDEVDRISTDTEYNSKTLLDGSLDTRVYTKNATRVDISDHVKAGQYQLSIDTAATQAGPVTANQNYNSTAPVGASGTMSINGSKVEIEAADTYAEAFEKIRNAAETGETTVKIEKNGALSFTAEQYGMSSILEIAFDDKQLANALGFTADGGNSVVEDPENKGSYVYGQIQNGKVIVPSGTDAEVTLTKPSDGTGFGDTATVKTDGNKITVTDRAGFEMSFLADAGYTGKLDFDVTDIGTMALHIGANEDQETRVRIPEVSCKSLYIDDADVTTVNGAGRGITQFDDAISKVSEVRSRLGAYQNRLESTVSSLDTFEENMTGAQSRLTDADMASEMTDYTHQNVLNQAAISVLTQANDLPQ
Пример Fla2 Roseburia intestinalis представлен в качестве SEQ ID NO: 8. Fla2 Roseburia intestinalis также обозначают в настоящем описании как RiFlaA2, или RIFlaA2, или Ri2, или RI2.
SEQ ID NO: 8 имеет следующую последовательность:
MVVNHNMALICESRQLRCNVKNMEKSSKKLATGYKLLGANDDAAGLQISETMRHQTRGLNKASRNSQDGISMLQTADAALQETQEVLDRMTDLTTQAANDINTDADRRAIQDEIDQLNQEVDRIAYTTNFNQQYILADGTPQARPGYYMIQTGSLAGQGIEIKFVNASKESLGVDKVDVSSHAKATESIAVVQNAIEKAASFRDTFGAQQERLEHALRGTDNTSESTQRAESSRRDTNMNMEMVQYSTNRILVQASQSILAQYNDDAKYVLEMLKQVLQILQ
Пример Fla3 Roseburia intestinalis представлен в качестве SEQ ID NO: 10. Fla3 Roseburia intestinalis также обозначается в настоящем описании как RiFla3, или RIFla3, или Ri3, или RI3.
SEQ ID NO: 10 имеет следующую последовательность:
MVVQHNMTAMNANRMLGVTTSAQAKSSEKLSSGYRINRAGDDAAGLTISEKMRSQIRGLNKASDNAQDGISLIQVAEGALSETHSILQRMNELATQAANDTNTTADRGAIQDEINQLTSEINRISSTTQFNTQNLIDGTFANKNLQVGSICGQRITVSIDSMSAGSLNVSANLVKVNTFSAAGEAMSNIQGAISAISTQRSYLGALQNRLEHTISNLDNISENTQSAESRIRDTDMAEEMVTYSKNNILAQAGQSMLAQANQSTQGVLSLLQ
Пример Fla4 Roseburia intestinalis представлен в качестве SEQ ID NO: 12. Fla4 Roseburia intestinalis также обозначают в настоящем описании как RiFla4, или RIFla4, или Ri4, или RI4.
SEQ ID NO: 12 имеет следующую последовательность:
MAMVVQHNMSAMNANRNLGVTTGMQAKSSEKLSSGYKINRAADDAAGLSISEKMRSQIRGLNKASDNAQDGISLIQTAEGALNESHSILQRMRELSVQAANGTETDDDREAVQNEVSQLQEELTRISETTEFNTMKLLDGSQSGSTSSTGSGPKFGVVDATLDGALVTSNVKGIKVATAAATTTKAGQETAIWAADGKTLTLNLSKNKVYTQDEIDDLIANAKQEDSSATGAPAEVKVSLKNGIFNADADTTAGTVTAGGVKAVSDEGTVTGFVGADTISFTANKYGAEFNDTVFKFKFDKAAGKEEVETNTAIEIDGANAVTAGEYTIHLAAGKEYTAEDLEDVLKTAGFDFDVKLSGNTPDEPNTLFATSGASTVTD
ITMGAGTAGAGLGSTDAMWGQAGYDSVSSGAGITLQIGANEGQTMSFSIDDMSARALGVDGNKVDLSTQAGAQKATDTIDAAIKKVSAQRGRMGAIQNRLEHTISNLDTAAENTQTAESRIRDTDMAEEMVEYSKNNILAQAGQSMLAQANQSTQGVLSLLQ
Термины "полипептид FlaA1", "FlaA1-полипептид", "полипептид-Fla1" и "Fla1-полипептид" используют в настоящем описании взаимозаменяемо. Термины "полипептид Fla2" и "Fla2-полипептид" используют в настоящем описании взаимозаменяемо. Термины "полипептид Fla3" и "Fla3-полипептид" используют в настоящем описании взаимозаменяемо. Термины "полипептид Fla4" и "Fla4-полипептид" используют в настоящем описании взаимозаменяемо.
В одном аспекте флагеллин Roseburia выбран из группы, состоящей из Fla1, Fla2, Fla3 и Fla4. В одном варианте осуществления флагеллин Roseburia выбран из группы, состоящей из Fla2, Fla1, Fla4 и их комбинаций. В следующем варианте осуществления флагеллин Roseburia представляет собой Fla2.
В одном аспекте флагеллин Roseburia выбран из группы, состоящей из Fla1 Roseburia hominis, Fla2 Roseburia hominis, Fla1 Roseburia intestinalis, Fla2 Roseburia intestinalis, Fla3 Roseburia intestinalis и Fla4 Roseburia intestinalis. В одном варианте осуществления флагеллин Roseburia выбран из группы, состоящей из Fla2 Roseburia hominis, Fla2 Roseburia intestinalis, Fla1 Roseburia intestinalis, Fla4 Roseburia intestinalis и их комбинаций. В следующем варианте осуществления флагеллин Roseburia выбран из группы, состоящей из Fla2 Roseburia hominis, Fla2 Roseburia intestinalis и их комбинаций. В другом варианте осуществления флагеллин Roseburia представляет собой Fla2 Roseburia intestinalis.
В одном варианте осуществления настоящее изобретение охватывает применение по меньшей мере одной полинуклеотидной последовательности, кодирующей флагеллин Roseburia. Например, настоящее изобретение охватывает применение комбинации по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех или по меньшей мере пяти полинуклеотидных последовательностей, кодирующих флагеллины Roseburia.
В одном варианте осуществления настоящее изобретение охватывает применение полинуклеотидной последовательности, кодирующей по меньшей мере один флагеллин Roseburia. Например, настоящее изобретение охватывает применение полинуклеотидной последовательности, кодирующей комбинацию по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех или по меньшей мере пяти полипептидных последовательностей, кодирующих флагеллины Roseburia.
Полинуклеотидная последовательность, кодирующая флагеллин Roseburia, может кодировать flaA1, flaA2, fla3, fla4 или их комбинации.
В некоторых вариантах осуществления комбинация полинуклеотидных последовательностей, кодирующая флагеллины Roseburia, содержит полинуклеотидные последовательности, кодирующие флагеллины, которые происходят или могут быть получены из по меньшей мере двух, трех, четырех или пяти различных видов Roseburia.
В некоторых вариантах осуществления полинуклеотидная последовательность кодирует комбинацию флагеллинов Roseburia, которые происходят или могут быть получены по меньшей мере из двух, трех, четырех или пяти различных видов Roseburia.
В другом варианте осуществления настоящее изобретение охватывает применение комбинации по меньшей мере одного флагеллина Roseburia и по меньшей мере одной полинуклеотидной последовательности, кодирующей флагеллин Roseburia.
Примеры полинуклеотидной последовательности, кодирующей флагеллины Roseburia, включают флагеллины, происходящие или получаемые из бактерий Roseburia, таких как Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis и Roseburia inulinivorans. В одном варианте осуществления полинуклеотидная последовательность кодирует флагеллин Roseburia, происходящий или получаемый из Roseburia hominis. В другом варианте осуществления полинуклеотидная последовательность кодирует флагеллин Roseburia, происходящий или получаемый из Roseburia intestinalis.
Примеры полинуклеотидны последовательностей, кодирующих флагеллин Roseburia, включают полинуклеотидные последовательности, кодирующие полипептид, который обладает по меньшей мере 75% идентичностью с SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12 или их варианты, гомологи, фрагменты или производные, и полинуклеотидные последовательности, обладающие по меньшей мере 75% идентичностью с SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 11 или их вариантами, гомологами, фрагментами или производными.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, имеет полинуклеотидную последовательность, кодирующую полипептид, который обладает последовательностью, показанной в качестве SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, имеет полинуклеотидную последовательность, показанную в качестве SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 11.
Примерами полинуклеотидных последовательностей, кодирующих флагеллины Roseburia hominis, являются полинуклеотидные последовательности, кодирующие Fla1 и Fla2 Roseburia hominis.
Пример полинуклеотидной последовательности, кодирующей Fla1 Roseburia hominis, представлен в качестве SEQ ID NO: 1.
SEQ ID NO: 1 имеет следующую последовательность:
ATGGTAGTACAGCACAATCTTACAGCAATGAACGCTAACAGACAGTTAGGTATCACAACAGGCGCACAGGCTAAGTCTTCTGAGAAGTTATCTTCTGGTTACAAGATCAACCGCGCAGCAGATGACGCAGCAGGTCTTACGATTTCCGAGAAGATGAGAAGCCAGGTTAGAGGCTTAAATAAAGCTTCTGACAACGCACAGGATGGTGTATCCCTTATTCAGGTAGCTGAGGGTGCATTAAGTGAGACACACTCCATCTTACAGCGTATGAATGAGTTAGCAACTCAGGCAGCAAACGATACCAATACAACCTCAGACAGAACTGCAGTTCAGCAGGAGATCAACCAGTTAGCATCTGAGATCACCAGAATCGCTTCTACAACTCAGTTCAACACAATGAACCTGATCGATGGTAACTTCACAAGTAAGAAGCTTCAGGTAGGTTCCCTTTGCGGACAGGCTATCACAATCGATATCTCTGATATGTCTGCTACAGGTCTTGGCGTTAGCGGATTAGTAGTATCTTCCTTCTCTGCAGCTGGTAAGGCAATGTCTGCAGCTCAGGATGCTATCAGCTACGTATCTTCTATGCGTTCTAAGCTGGGTGCATTACAGAACAGACTTGAGCACACAATCTCCCACCTGGACAACATTTCTGAGCACACATCTTCTGCAGAGTCTCGTATCCGTGATACAGATATGGCTGAAGAGATGGTTGAGTACAGCAAGAACAACATCCTTGCTCAGGCAGGACAGTCTATGCTTGCTCAGGCTAACCAGTCTACTCAGGGTGTATTATCCTTATTACAGTAA
Пример полинуклеотидной последовательности, кодирующей Fla2 Roseburia hominis, представлен в качестве SEQ ID NO: 3.
SEQ ID NO: 3 имеет следующую последовательность:
ATGGTGGTTAATCATAATATGGCGGCAATCTGTGAGAGCAGGCAGCTGCGCTATAACGTGAAGAAGATGGAAAAATCTTCCAAAAAGCTTGCGACAGGGTACAAGCTGAACACAGCAAATGATGATGCGGCAGGCTTGCAGATATCAGAGACGATGCGGCATCATGTGAAAGGGCTGAACAAAGCCTCCCGGAATTCACAGGACGGCATCAGTATGCTGCAGACGGCGGATGCAGCGCTCCAAGAGACGCAGGATGTTCTCGATCGTATGGTGGAGCTGACGACGCAGGCAGCCAATGACATCAACACAGACTCGGATCGCAGGGCTATTCAGGATGAGTTGGATCAGCTGAACAAGGAAGTGGACCGCATCGCCTATACGACGCACTTCAATCAGCAGTATATGTTGGCGGAGGGAACGCCGCAGGCGGCACCGGGATATTACCGCATACAGTCCGGGGCACTGAACGGACAGGCGATAGATATCCATTTTGTAAATGCGAGCAAGGAGAGCCTTGGCACAGACAAAGTGAATGTATCTTCGCATGCGAAGGCGTCGGAATCCATCACGATGGTTCAGGACGCGATTGAACAGGCGGCGCTCTGGAGAGACGAGTTCGGCAGCCAGCAGGAGCGTCTGGAACATGCCGTGCGCAATACGGACAACACATCACAAAATACGCAGAGTGCGGAGTCAGGGATCAGAGACACCAACATGAATATGGAGATGGTATTATATTCGACCAACCGGATTCTGGTGCATGCATCCCAGAGTATTCTGGCACAGTATAATGATGATGCAAAATCAGTGCTTGAGATTTTGAAATAG
Примерами полинуклеотидных последовательностей, кодирующих флагеллины Roseburia intestinalis, являются полинуклеотидные последовательности, кодирующие Fla1, Fla2, Fla3 и Fla4 Roseburia intestinalis.
Пример полинуклеотидной последовательности, кодирующей Fla1 Roseburia intestinalis представлен в качестве SEQ ID NO: 5.
SEQ ID NO: 5 имеет следующую последовательность:
ATGCGTGGCGGAGACAATAGAAGGAGAAACAGAATGAGAATTAATTACAATGTGTCAGCAGCGATTGCGAATAAACATTTACTTGGAATTGAGGATAATTTAAGTGCATCGATGGAACGGCTTTCATCGGGACTTAAGATCAACCATTCCAAGGACAATCCGGCAGGAATGGCTATTTCCAACAAGATGAAAGCACAGATTGATGGTTTAAACCGGGCTTCCCAGAATGCATCGGATGGTATTTCTGTTATTCAGATCGCAGATGGTGCGCTGAGTGAAACGACCAGTATTTTACAGCGTATGAGAGAACTTTCCGTGCAGGCAGCGAGTGATGCAACAATGACACCGGCGGATAAAGAAGCAATCCAGAAAGAAATCACTTCATTAAAAGATGAAGTTGACCGTATTTCTACAGATACAGAGTATAACAGCAAAACACTTTTAGATGGTTCATTAGATACCAGGGTTTACACCAAAAATGCAACAAGAGTGGACATTTCTGATCATGTGAAAGCAGGACAGTATCAGCTTTCCATTGATACTGCAGCTACACAGGCCGGACCGGTAACAGCAAATCAGAATTATAATTCCACAGCACCGGTCGGTGCGTCCGGAACAATGAGTATTAATGGTTCTAAAGTAGAGATAGAGGCAGCCGACACCTATGCGGAGGCTTTTGAGAAGATCAGAAATGCAGCAGAGACTGGTGAAACAACCGTTAAGATTGAAAAGAATGGAGCACTTTCATTTACCGCAGAACAGTACGGAATGTCAAGCATCTTAGAGATCGCATTNNTGATGATAAGCAGCTTGCTAATGCACTTGGATTTACAGCAGACGGAGGAAACAGTGTTGTAGAAGATCCAGAGAATAAAGGCAGCTATGTATACGGACAGATTCAGAATGGCAAAGTGATCGTACCTTCCGGTACAGATGCCGAAGTAACGCTCACAAAACCGAGTGATGGAACCGGATTTGGTGATACAGCTACGGTAAAAACAGATGGAAATAAGATTACGGTTACAGACAGAGCCGGATTTGAGATGTCATTTCTTGCTGATGCAGGTTATACGGGTAAGCTGGATTTTGATGTCACGGATATCGGAACGATGGCACTTCATATTGGAGCAAATGAGGATCAGGAAACAAGAGTGCGTATTCCGGAGGTTTCCTGCAAGAGCCTTTACATTGATGATGCAGACGTGACGACTGTAAATGGAGCAGGCAGAGGTATCACACAGTTTGACGATGCCATTTCAAAGGTCAGTGAAGTGCGTTCAAGACTTGGTGCATACCAGAATCGTCTTGAGAGTACGGTATCAAGCCTGGATACGTTTGAAGAAAATATGACAGGAGCCCAGTCACGACTGACAGATGCGGATATGGCATCGGAAATGACAGATTATACACATCAGAATGTATTAAATCAGGCAGCAATCTCTGTTTTGACACAGGCAAACGATCTGCCACAGCAGGTATTGCAGATTCTGCAGTAA
Пример полинуклеотидной последовательности, кодирующей Fla2 Roseburia intestinalis представлен в качестве SEQ ID NO: 7.
SEQ ID NO: 7 имеет следующую последовательность:
ATGGTAGTTAATCATAATATGGCATTGATCTGTGAGAGTAGACAGTTACGATGTAATGTGAAGAACATGGAGAAGTCTTCAAAAAAGCTGGCAACAGGTTATAAATTGCTTGGAGCAAATGATGATGCAGCAGGATTACAGATATCAGAAACCATGCGTCATCAGACCAGAGGTCTTAACAAAGCATCCAGAAATTCGCAAGATGGAATTAGTATGCTGCAGACAGCAGATGCAGCATTACAGGAGACACAGGAAGTGTTGGATCGAATGACGGATCTGACAACACAGGCAGCTAATGATATCAATACGGATGCGGATCGTCGTGCAATTCAGGATGAAATCGATCAGTTAAATCAGGAAGTGGATCGTATTGCATATACGACGAATTTTAATCAGCAGTATATATTAGCGGATGGAACTCCGCAGGCAAGACCAGGATACTATATGATACAGACAGGAAGTCTTGCGGGACAGGGAATAGAGATTAAGTTTGTTAATGCGAGCAAAGAGAGCTTGGGTGTGGACAAGGTTGATGTATCATCGCATGCAAAAGCGACAGAATCTATAGCAGTGGTACAGAATGCAATTGAAAAGGCAGCTTCGTTTAGAGATACATTTGGGGCACAACAGGAGCGGTTAGAACACGCATTGCGTGGAACGGATAATACATCAGAAAGTACACAGAGGGCAGAATCAAGTAGACGCGATACCAACATGAATATGGAGATGGTACAATATTCTACAAACCGTATTTTAGTACAGGCATCTCAGAGTATTTTAGCACAGTACAATGATGATGCAAAATATGTGTTGGAAATGTTAAAATAG
Пример полинуклеотидной последовательности, кодирующей Fla3 Roseburia intestinalis, представлен в качестве SEQ ID NO: 9.
SEQ ID NO: 9 имеет следующую последовательность:
ATGGTAGTACAGCACAATATGACCGCAATGAATGCGAACAGAATGTTAGGCGTTACAACAAGCGCACAGGCAAAATCTTCAGAGAAATTATCTTCTGGTTACAGAATCAACCGTGCAGGTGATGACGCTGCTGGTTTAACAATTTCTGAGAAGATGAGAAGCCAGATCCGTGGATTAAACAAAGCTTCTGACAACGCACAGGATGGTATTTCCTTAATCCAGGTTGCTGAGGGTGCATTATCTGAGACACATTCTATCTTACAGCGTATGAATGAGTTAGCTACTCAGGCTGCTAACGATACCAATACAACTGCTGATAGAGGAGCTATTCAGGATGAGATCAACCAGTTAACATCTGAGATTAACAGAATCTCTTCTACAACTCAGTTCAATACTCAGAACCTCATCGATGGTACATTCGCAAATAAAAACCTTCAGGTTGGTTCTATCTGTGGACAGAGAATTACTGTTTCTATCGACAGTATGTCTGCTGGTAGCTTAAATGTATCTGCTAACTTAGTAAAGGTTAACACTTTCAGTGCAGCAGGTGAAGCAATGTCCAATATTCAGGGTGCTATTTCTGCAATTTCTACACAGCGTTCTTACTTAGGAGCTCTTCAGAATCGTCTGGAGCATACAATCTCCAACTTGGACAACATTTCTGAGAATACTCAGTCTGCTGAATCTCGTATCCGTGATACAGATATGGCTGAAGAGATGGTTACTTACAGCAAGAACAATATTCTTGCTCAGGCAGGACAGTCTATGCTTGCTCAGGCTAACCAGTCTACTCAGGGTGTACTTTCTCTGTTACAGTAA
Пример полинуклеотидной последовательности, кодирующей Fla4 Roseburia intestinalis, представлен в качестве SEQ ID NO: 11.
SEQ ID NO: 11 имеет следующую последовательность:
ATGGCAATGGTAGTACAGCACAACATGTCCGCAATGAATGCGAACAGAAATTTAGGTGTTACAACAGGAATGCAGGCAAAATCATCAGAGAAGTTATCTTCCGGTTACAAGATCAACCGTGCAGCAGATGATGCAGCAGGACTTTCTATTTCTGAGAAGATGAGAAGCCAGATCCGCGGTTTAAATAAAGCATCTGACAATGCACAGGATGGTATCTCTTTAATCCAGACCGCTGAGGGAGCATTAAATGAGTCCCACTCTATTTTACAGAGAATGAGAGAGTTATCCGTACAGGCAGCCAACGGTACAGAGACAGATGACGACCGCGAGGCAGTACAGAACGAGGTTTCCCAGTTACAGGAAGAGCTGACAAGAATTTCTGAGACAACAGAGTTCAACACGATGAAGCTGCTGGATGGTTCTCAGAGTGGAAGTACATCTTCAACCGGGTCAGGTCCGAAGTTTGGTGTTGTAGATGCAACATTAGACGGTGCACTTGTAACATCTAACGTGAAAGGTATTAAAGTAGCAACAGCAGCTGCCACAACAACAAAGGCAGGTCAGGAGACTGCTATCTGGGCTGCTGATGGAAAGACATTAACTTTAAATCTTTCGAAAAATAAGGTATATACACAGGACGAAATTGATGACTTGATCGCAAATGCAAAACAGGAAGACAGTTCTGCAACGGGTGCACCGGCTGAAGTGAAAGTATCTTTAAAGAATGGTATTTTTAATGCAGATGCAGACACAACTGCCGGAACTGTAACAGCCGGTGGTGTGAAGGCAGTATCTGATGAAGGAACAGTAACTGGATTTGTTGGTGCAGATACAATTTCATTTACGGCAAATAAGTATGGAGCAGAGTTCAATGATACTGTATTTAAATTCAAATTTGATAAGGCAGCAGGCAAAGAAGAAGTAGAGACAAATACAGCAATTGAAATTGATGGAGCAAATGCGGTAACAGCAGGTGAATATACAATTCATCTTGCAGCAGGCAAAGAATATACGGCAGAAGATTTAGAAGATGTTCTTAAAACGGCAGGATTCGACTTTGATGTTAAATTAAGTGGAAATACACCAGATGAGCCAAATACTTTATTTGCAACCAGTGGCGCATCAACTGTGACTGATATTACAATGGGTGCTGGCACCGCCGGAGCTGGTCTTGGAAGTACAGATGCTATGTGGGGGCAAGCTGGTTATGACAGTTATCTTCTGGTGCTGGCATTACCTTGCAGATTGGTGCAAATGAAGGTCAGACCATGAGTTTCTCTATCGATGACATGAGTGCAAGAGCACTTGGCGTAGATGGCAACAAAGTTGATTTAAGCACACAGGCTGGCGCACAGAAAGCAACTGATACCATTGATGCAGCAATCAAGAAAGTATCTGCACAGCGTGGTAGAATGGGTGCGATCCAGAACCGTCTGGAGCACACCATCAGCAACCTTGATACAGCAGCAGAGAATACCCAGACTGCAGAGTCCCGTATCCGTGATACAGATATGGCAGAAGAGATGGTTGAGTACTCCAAGAACAACATTCTTGCACAGGCAGGTCAGTCTATGCTTGCACAGGCGAACCAGTCTACACAGGGTGTACTCTCCTTATTACAGTAA
В одном аспекте полинуклеотидная последовательность кодирует флагеллин Roseburia, выбранный из группы, состоящей из Fla1, Fla2, Fla3 и Fla4. В одном варианте осуществления полинуклеотидная последовательность кодирует флагеллин Roseburia, выбранный из группы, состоящей из Fla2, Fla1, Fla4 и их комбинации. В следующем варианте осуществления полинуклеотидная последовательность кодирует флагеллин Fla2 Roseburia.
В одном аспекте полинуклеотидная последовательность, кодирующая флагеллин Roseburia, выбрана из группы, состоящей из полинуклеотидной последовательности, кодирующей Fla1 Roseburia hominis, полинуклеотидной последовательности, кодирующей Fla2 Roseburia hominis, полинуклеотидной последовательности, кодирующей Fla1 Roseburia intestinalis, полинуклеотидной последовательности, кодирующей Fla2 Roseburia intestinalis, полинуклеотидной последовательности, кодирующей Fla3 Roseburia intestinalis, и полинуклеотидной последовательности, кодирующей Fla4 Roseburia intestinalis. В одном варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, выбрана из группы, состоящей из полинуклеотидной последовательности, кодирующей Fla2 Roseburia hominis, полинуклеотидной последовательности, кодирующей Fla2 Roseburia intestinalis, полинуклеотидной последовательности, кодирующей Fla1 Roseburia intestinalis, полинуклеотидной последовательности, кодирующей Fla4 Roseburia intestinalis, и их комбинаций. В следующем варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, выбрана из группы, состоящей из полинуклеотидной последовательности, кодирующей Roseburia hominis Fla2, полинуклеотидной последовательности, кодирующей Fla2 Roseburia intestinalis и их комбинаций. В другом варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, представляет собой полинуклеотидную последовательность, кодирующую Fla2 Roseburia intestinalis.
Терапевтический эффект флагеллинов авторы настоящего изобретения оценивали с использованием функциональных анализов.
В одном варианте осуществления флагеллин Roseburia представляет собой укороченный флагеллин Roseburia. Например, укороченный флагеллин Roseburia содержит по меньшей мере 20, 30, 40, 50, 75, 100, 125, 150, 175 или 200 аминокислот полипептида, показанного в качестве SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12.
В одном варианте осуществления укороченный флагеллин Roseburia представляет собой укороченный флагеллин Roseburia hominis или укороченный флагеллин Roseburia intestinalis.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, кодирует укороченный FlaA1, Fla2, Fla3 или Fla4. Например, полинуклеотидная последовательность кодирует укороченный флагеллин Roseburia, содержащий по меньшей мере 20, 30, 40, 50, 75, 100, 125, 150, 175 или 200 аминокислота полипептида, показанного в качестве SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12.
В одном варианте осуществления полинуклеотидная последовательность, кодирующая флагеллин Roseburia, кодирует укороченный FlaA1 или Fla3.
В одном варианте осуществления флагеллин Roseburia представляет собой слитый полипептид. Например, полипептид является слитым с глутатион-S-трансферазой (GST).
обобщение последовательностей флагеллина Roseburia, описанных в настоящем описании, и бактериальных штаммов, из которых они могут происходить
Обобщение номеров доступа для флагеллинов Roseburia, описанных в настоящем описании
(GenBank)
Модулирование/регуляция
Термины "модулирование" и "регуляция" можно использовать в настоящем описании взаимозаменяемо.
В одном варианте осуществления термин "модулирование" относится к увеличению, и/или индукции, и/или стимуляции, и/или активации. В альтернативном варианте осуществления термин "модулирование" относится к снижению, и/или уменьшению, и/или ингибированию.
В одном варианте осуществления термин "регуляция" относится к активации. В альтернативном варианте осуществления термин "регуляция" относится к подавлению.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижают воспаление в ткани или органе.
Например, уменьшается воспаление пищеварительного тракта или его части (такого как кишечник).
Термин "воспаление", как используют в рамках изобретения, относится к одному или нескольким из следующих: покраснение, опухание, боль, слабость, жар и нарушенная функция ткани или органа вследствие воспалительного процесса, запускаемого чрезмерной реакцией иммунной системы.
Снижение воспаления у индивидуума можно определять путем определения уровней провоспалительных цитокинов и хемокинов в образцах ткани, сыворотки и/или фекалий у индивидуума до и после введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis) индивидууму. Например, можно проводить уровни одного или нескольких из следующих: IL-1, IL-4, IL5, IL6, IL-8, IL-12, IL-13, IL-17, IL-21, IL-22, IL23, TNFα, IFNγ, CXCL1, CXCL10, CCL2, CCL20, сывороточный и фекальный кальпротектин, кальций-связывающие белки SA1009/SA1008, и интерфероны типа 1, маркеры CD, такие как CD163, CD14, воспалительные факторы транскрипции, такие как NF-kB, STAT и MAP-киназы, c-реактивный белок (CRP), скорость оседания эритроцитов (ESR), белки системы комплемента, сывороточный альбумин, гистологическая оценка тканей-мишеней и органов-мишеней, индексы активности заболевания. Кроме того, в исследованиях у человека можно проводить исследования с использованием опросников качества жизни (QoL) до и после введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления количество ткани или органа, которое является воспаленным у индивидуума, составляет по меньшей мере 10%, 20%, 30%, 40% или 50% ниже по сравнению с количеством ткани или органа, которое является воспаленным у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащего указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидную последовательность, кодирующую флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижают воспаление эпителиальных клеток в ткани или органе.
Например, эпителиальные клетки представляют собой эпителиальные клетки пищеварительного тракта или его части (такой как кишечник).
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), увеличивает продукцию T-клеток у индивидуума.
В одном варианте осуществления T-клетки представляют собой регуляторные T-клетки (также обозначаемые как Tregs), такие как регуляторные T-клетки, способные экспрессировать TLR5 (Toll-подобный рецептор 5).
Без связи с теорией, увеличение числа Treg будет оказывать противодействие другим эффекторым T-клеткам (также обозначаемым как Teff), таким как Th1, Th17 и Th2, которые запускают воспаление, аутоиммунитет и аллергические/атопические состояния. Таким образом, это свойство флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), можно использовать для борьбы с многими заболеваниями, при которых утрачивается баланс Teff/Treg, например болезнью Крона и язвенным колитом.
В одном варианте осуществления возрастает продуцирование T-клеток у индивидуума, так что существует по меньшей мере на 10%, 20%, 30%, 40% или 50% более T-клеток или более чем на 100% больше T-клеток по сравнению с числом T-клеток у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "иммунная система", как используют в рамках изобретения, может относиться к адаптивной иммунной системы и/или врожденной иммунной системе.
В одном аспекте изобретение относится к флагеллину Roseburia и/или к полипептиду Fla (такому как FlaA1 или FlaA2), и/или к полинуклеотидной последовательности, кодирующей флагеллин Roseburia и/или Fla (такой как FlaA1 или FlaA2) полипептид, и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таким как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции адаптивной иммунной системы индивидуума.
Как используют в рамках изобретения, термин "адаптивная иммунная система", также известный как "специфическая иммунная система" относится к высокоспециализированным системным клеткам и процессам, которые устраняют или предупреждают патогенный рост. Адаптивный иммунный ответ обеспечивает иммунной системе позвоночных способность распознавать и запоминать конкретные патогены (для формирования иммунитета), и инициировать более сильные атаки, каждый раз когда патоген встречается.
Как используют в рамках изобретения, термин "регуляция адаптивной иммунной системы" означает индукцию активности адаптивной иммунной системы, и/или стимуляция иммунных гомеостатических механизмов посредством увеличения уровня активности относительно исходного уровня активности. Предпочтительно, адаптивная иммунная система модулируется в сторону иммунной регуляции (но не иммунной активации, таким образом, снижая воспаление).
Дефекты и нарушения, ассоциированные с адаптивной иммунной системой, в частности, связанные с функцией T-клеток, ассоциированы с многими воспалительными и аутоиммунными заболеваниями. T-клеточные ответы, ассоциированные с Th1, Th2 и Th17, ассоциированы с атопическими, воспалительными и аутоиммунными заболеваниями. Способы терапии, которые улучшают или увеличивают популяции регуляторных T-клеток (Treg), являются важными для контроля заболеваний, запускаемых чрезмерными ответами клеток Th1, Th2 и Th17.
Другой аспект изобретения относится к флагеллину Roseburia и/или полипептиду Fla (такому как FlaA1 или FlaA2) полипептид, и/или к полинуклеотидной последовательности, кодирующей флагеллин Roseburia и/или Fla (такой как FlaA1 или FlaA2), и/или к вектору, содержащему указанную полинуклеотидную последовательность, и/или к клетке-хозяину, содержащей указанный вектор, и/или к клетке-хозяину, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для регуляции врожденной иммунной системы индивидуума.
Как используют в рамках изобретения, термин "врожденная иммунная система", также известный как неспецифическая иммунная система, включает клетки и механизмы, которые обеспечивают у хозяина немедленную защиту от инфекции другими организмами неспецифическим образом. Это означает, что клетки врожденной иммунной системы распознают и отвечают на патогены универсальным образом, но, в отличие от адаптивной иммунной системы, они не сообщают длительного или защитного иммунитета хозяину.
Как используют в рамках изобретения, термин "регуляция врожденной иммунной системы" означает индукцию активности врожденной иммунной системы и/или повышение уровня активности относительно исходного уровня активности, так что она индуцирует иммунный гомеостаз.
Утрата или нарушение регуляции врожденной иммунной функции, либо вследствие утраты эпителиального барьера, либо вследствие пептидов врожденного иммунитета, таких как дефензины, хемокины и цитокины, либо вследствие дефектной передачи сигнала TLR, ассоциированы с увеличенным риском воспалительных заболеваний, в нескольких органах организма, включая кишечник. Такие заболевания включают воспалительное заболевание кишечника.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2) и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), восстанавливают иммунологическую толерантность.
Как используют в рамках изобретения, термин "иммунологическая толерантность" относится к процессу, посредством которого иммунная система не атакует антиген, такой как собственный антиген.
Как используют в рамках изобретения термин "восстановление иммунологической толерантности" относится к восстановлению иммунологической толерантности к одному или нескольким антигенам (таким как собственный антиген) у индивидуума, так что уровень иммунологической толерантности к антигену является более высоким по сравнению с уровнями у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis) индивидууму.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), активирует дендритные клетки и/или эпителиальные клетки.
Как используют в рамках изобретения термин "активирует дендритные клетки" относится к активации одного или нескольких клеточных маркеров (таких как клеточные маркеры I-A/I-E, CD80 и CD86 и CD40) и/или увеличению продукции одного или нескольких цитокинов (таких как IL-10 и TGFβ) клетками (такими как дендритные клетки) у индивидуума по сравнению с уровнями у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "I-A/I-E", как используют в рамках изобретения, относится к клеточным маркерам MHC класса II.
CD40 имеет неотъемлемую роль в иммунитете и он является одной из наиболее охарактеризованных костимулирующих молекул. Этот рецептор, являющийся представителем семейства рецепторов фактора некроза опухоли, экспрессируется профессиональными антигенпредставляющими клетками, такими как дендритные клетки. CD40 связывает его лиганд CD40L, который временно экспрессируется на T-клетках и других неиммунных клетках в воспалительных условиях.
CD40L является примером T-клеточного маркера. Следующими примерами T-клеточных маркеров являются CD3, CD4, CD25, FoxP3, CTLA-4, Ly6g и CD11b.
CD80 и CD86 экспрессируются на антигенпредставляющих клетках (таких как дендритные клетки) и они требуются для развития и костимуляции T-клеточных ответов. Молекулы CD28 и CTLA-4 на T клетках служат в качестве рецепторов для костимулирующих антигенов CD80 и CD86.
Примерами маркеров регуляторных T-клеток толстого кишечника являются CD3, CD4, CD25, FoxP3, CTLA-4, Ly6g и CD11b.
Без связи с теорией, истощение Ly6g (например Ly6g6c и ly6g6e) повышает риск инфекции, как в кишечнике, так и в дыхательных путях, и оно ассоциировано с заболеваниями, такими как нейтропения. Таким образом, в одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), предназначены для применения для лечения нейтропении.
Другой аспект изобретения относится к флагеллину Roseburia и/или полипептиду Fla (таком как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для применения для поддержания иммунного гомеостаза у индивидуума. Как используют в рамках изобретения "поддержание иммунного гомеостаза" относится к саморегуляции иммунной системы организма для поддержания пероральной толерантности или иммунной стабильности в ответ на изменяющиеся условия. Пероральная толерантность относится к нормальным иммунным ответам на пищу и комменсальные бактерии в здоровом кишечнике. Она утрачивается при глютеновой болезни и воспалительных заболеваниях кишечника, таких как болезнь Крона и язвенный колит. Таким образом, в одном аспекте флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), предназначены для применения для лечения глютеновой болезни и воспалительных заболеваний кишечника, таких как болезнь Крона и язвенный колит.
В одном варианте осуществления количество клеточного маркера на клетке(ах) индивидуума повышается так, что на клетке(ах) присутствует по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера на клетке(ах), или более чем на 100% больше клеточного маркера на клетке(ах), по сравнению с количеством клеточного маркера на клетке(ах) индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно, число клеток у индивидуума, которые имеют клеточный маркер, увеличивается, как например, по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточный маркер, или более чем на 100% больше клеток, которые имеют клеточный маркер, по сравнению с числом клеток с клеточным маркером у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном аспекте клетки представляют собой T-клетки.
В другом аспекте клетки представляют собой клетки пищеварительного тракта (такие как клетки кишечника).
В следующем аспекте клетки представляют собой регуляторные T-клетки толстого кишечника и/или тонкого кишечника и они могут быть либо CD4-положительными, либо CD8-положительными.
В одном аспекте клеточный маркер представляет собой T-клеточный маркер. В другом аспекте клеточный маркер представляет собой T-клеточный маркер толстого кишечника.
Примерами клеточных маркеров являются маркеры, которые представляют собой маркеры типа I-A/I-E. CD40 является другим примером клеточного маркера, также встречающегося на дендритных клетках.
В одном варианте осуществления уровень цитокина у индивидуума возрастает так, что уровень цитокина является по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким по сравнению с уровнем цитокина у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Примеры дендритных клеток включают дендритные клетки костного мозга и дендритные клетки слизистой оболочки кишечника.
Как используют в рамках изобретения термин "активирует эпителиальные клетки" относится к увеличению экспрессии экспрессии одного или нескольких провоспалительных генов эпителиальными клетками у индивидуума по сравнению с уровнями экспрессии у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "провоспалительный ген", как используют в рамках изобретения, относится к гену, который при экспрессии усиливает воспаление. Примеры провоспалительных генов включают гены, кодирующие, но не ограничивающиеся ими IL1-β, IL4, IL5, IL6, IL8, IL12, IL13, IL17, IL21, IL22, IL23, IL27, IFNγ, CCL2, CCL3, CCL5, CCL20, CXCL5, CXCL10, CXCL12, CXCL13 и TNF-α.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), активирует продукцию цитокина.
Термин "активирует продукцию цитокина", как используют в рамках изобретения, относится к увеличению уровня цитокина у индивидуума по сравнению с уровнем цитокина у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления уровень цитокина возрастает так, что уровень является по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким, по сравнению с уровнем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В другом варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), активирует продукцию IL-10 и/или TGFβ.
Термин "активирует продукцию IL-10", как используют в рамках изобретения, относится к увеличению уровня IL-10 у индивидуума по сравнению с уровнем IL-10 у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления уровень IL-10 возрастает так, что уровень является по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким по сравнению с уровнем у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В некоторых аспектах IL-10 продуцируется дендритными клетками, такими как происходящие из костного мозга дендритные клетки и дендритные клетки слизистой оболочки кишечника, в частности, подгруппы CD103+.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla, и/или полинуклеотидная последовательность, кодирующая флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), активируют продукцию маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена в клетке или клетках индивидуума.
Примеры маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигенов, включают CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты.
Маркеры клеточной поверхности (например CD317/BST-2) могут быть названы различными названиями в различных видах или маркер клеточной поверхности еще может не быть идентифицирован на клетках конкретного вида. Термин "видовой эквивалент", как используют в рамках изобретения, охватывает эти маркеры клеточной поверхности.
Термин "активирует продукцию CD40", как используют в рамках изобретения, относится к увеличению уровня CD40 у индивидуума по сравнению с уровнем CD40 у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих клеточный маркер CD40, увеличивается и/или увеличивается количество маркера CD40 на клетках.
В одном варианте осуществления количество клеточного маркера CD40 на клетке(ах) индивидуума увеличивается так, что на клетке(ах) становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера, или на клетке(ах) становится более чем на 100% больше клеточного маркера на клетке(ах), по сравнению с количеством клеточного маркера на клетке(ах) индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно число клеток у индивидуума, которые имеют клеточный маркер CD40, возрастает, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточный маркер, или более чем на 100% больше клеток, которые имеют клеточный маркер, по сравнению с количеством клеток с клеточным маркером у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию I-A/I-E", как используют в рамках изобретения, относится к увеличению уровня I-A/I-E у индивидуума по сравнению с уровнем I-A/I-E у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих один или несколько клеточных маркеров I-A/I-E, возрастает и/или количество клеточных маркеров I-A/I-E на клетке возрастает.
В одном варианте осуществления количество клеточного маркера I-A/I-E на клетке(ах) индивидуума увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера I-A/I-E на клетке(ах), или более чем на 100% больше клеточного маркера I-A/I-E cell на клетке(ах), по сравнению с количеством клеточного маркера I-A/I-E cell на клетке(ах) индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно возрастает число клеток у индивидуума, которые имеют клеточный маркер I-A/I-E, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточные маркеры I-A/I-E, или более чем на 100% больше клеток, которые имеют клеточный маркер I-A/I-E, по сравнению с числом клеток с клеточным маркером I-A/I-E у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию CD317/BST-2", как используют в рамках изобретения, относится к увеличению уровня CD317/BST-2 у индивидуума по сравнению с уровнем CD317/BST-2 у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептида Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих один или несколько клеточных маркеров CD317/BST-2, возрастает и/или возрастает количество клеточных маркеров CD317/BST-2 на клетке.
В одном варианте осуществления количества клеточных маркеров CD317/BST-2 на клетке(ах) индивидуума увеличиваются так, что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточных маркеров CD317/BST-2 на клетке(ах), или более чем на 100% больше клеточных маркеров CD317/BST-2 на клетке(ах), по сравнению с количеством клеточных маркеров CD317/BST-2 на клетке(ах) индивидуума до введения флагеллина Roseburia, и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно число клеток у индивидуума, которые имеют клеточные маркеры CD317/BST-2 увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточные маркеры CD317/BST-2, или более чем на 100% больше клеток, которые имеют клеточные маркеры CD317/BST-2, по сравнению с количеством клеток с клеточными маркерами CD317/BST-2 у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию CD103", как используют в рамках изобретения относится, к увеличению уровня CD103 у индивидуума по сравнению с уровнем CD103 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептида Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, количество клеток, содержащих один или несколько клеточных маркеров CD103, возрастает и/или возрастает количество клеточного маркера CD103 на клетке.
В одном варианте осуществления количество клеточного маркера CD103 на клетке(ах) индивидуума повышается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера CD103 на клетке(ах), или более чем на 100% больше клеточного маркера CD103 на клетке(ах), по сравнению с количеством клеточного маркера CD103 на клетке(ах) индивидуума до выведения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно число клеток у индивидуума, который имеет клеточный маркер CD103, увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточный маркер CD103, или более чем на 100% больше клеток, которые имеют клеточный маркер CD103, по сравнению с количеством клеток с клеточным маркером CD103 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такиъ как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию CD80", как используют в рамках изобретения, относится к увеличению уровня CD80 у индивидуума по сравнению с уровнем CD80 у индивидуума до введения флагеллина Roseburia, и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептида Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, количество клеток, содержащих один или несколько клеточных маркеров CD80, увеличивается и/или количество клеточных маркеров CD80 на клетке увеличивается.
В одном варианте осуществления количество клеточного маркера CD80 на клетке клетке(ах) индивидуума повышается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера CD80 на клетке(ах), или более чем на 100% больше клеточных маркеров CD80 на клетке(ах), по сравнению с количеством клеточных маркеров CD80 на клетке(ах) индивидуума до введения флагеллина Roseburia, и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно количество клеток у индивидуума, которые имеют клеточный маркер CD80, увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточный маркер CD80, или более чем на 100% больше клеток, которые имеют клеточный маркер CD80, по сравнению с количеством клеток с клеточным маркером CD80 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию CD86", как используют в рамках изобретения, относится к увеличению уровня CD86 у индивидуума по сравнению с уровнем CD86 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих один или несколько клеточных маркеров CD86, увеличивается и/или увеличивается количество клеточных маркеров CD86 на клетке.
В одном варианте осуществления количество клеточного маркера CD86 на клетке(ах) индивидуума повышается так, что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера CD86 на клетке(ах), или более чем на 100% больше клеточного маркера CD86 на клетке(ах), по сравнению с количеством клеточного маркера CD86 на клетке(ах) индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно количество клеток у индивидуума, которые имеют клеточный маркер CD86, увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточные маркеры CD86, или более чем на 100% больше клеток, которые имеют клеточный маркер CD86, по сравнению с количеством клеток с клеточным маркером CD86 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию CD83", как используют в рамках изобретения, относится к увеличению уровня CD83 у индивидуума по сравнению с уровнем CD83 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих один или несколько клеточных маркеров CD83, увеличивается и/или увеличивается количество клеточных маркеров CD83 на клетке.
В одном варианте осуществления количество клеточного маркера CD83 на клетке(ах) индивидуума повышается так, что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера CD83 на клетке(ах), или более чем на 100% больше клеточного маркера CD83 на клетке(ах), по сравнению с количеством клеточного маркера CD86 на клетке(ах) индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно количество клеток у индивидуума, которые имеют клеточный маркер CD83, увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточные маркеры CD83, или более чем на 100% больше клеток, которые имеют клеточный маркер CD86, по сравнению с количеством клеток с клеточным маркером CD83 у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "активирует продукцию Siglec-H", как используют в рамках изобретения, относится к увеличению уровня Siglec-H у индивидуума по сравнению с уровнем Siglec-H у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Например, число клеток, содержащих один или несколько клеточных маркеров Siglec-H, увеличивается и/или увеличивается количество клеточных маркеров Siglec-H на клетке.
В одном варианте осуществления количество клеточного маркера Siglec-H на клетке(ах) индивидуума повышается так, что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеточного маркера Siglec-H на клетке(ах), или более чем на 100% больше клеточного маркера Siglec-H на клетке(ах), по сравнению с количеством клеточного маркера Siglec-H на клетке(ах) индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно количество клеток у индивидуума, которые имеют клеточный маркер Siglec-H, увеличивается, так что становится по меньшей мере на 10%, 20%, 30%, 40% или 50% больше клеток, которые имеют клеточные маркеры Siglec-H, или более чем на 100% больше клеток, которые имеют клеточный маркер Siglec-H, по сравнению с количеством клеток с клеточным маркером Siglec-H у индивидуума до введения флагеллина Roseburia и/или полипептида Fla, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный Fla, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В некоторых аспектах продукция CD40 I-A/I-E, CD317/BST-2, CD80, CD86, CD83 и/или Siglec-H осуществляется дендритными клетками (такими как толерогенные CD103+ дендритные клетки, увеличенные в количестве с использованием FLT3L.).
В одном варианте осуществления экспрессия одного или нескольких генов IFN типа I в клетке или клетках индивидуума снижается.
В одном варианте осуществления уровень экспрессии одного или нескольких генов IFN типа I снижается так, что уровень становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более низким по сравнению с уровнем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Примеры генов IFN типа I включают, но не ограничиваясь ими, IFN-β1, IFN-β3, Ifi202b, Ifi203, IFI44, IFTI, MXI, OASI, OAS2, OAS3, OASL, Irf3 и Irf4.
В одном варианте осуществления экспрессия одного или нескольких провоспалительных генов в клетке или клетках индивидуума снижается.
В одном варианте осуществления уровень экспрессии одного или нескольких провоспалительных генов снижается так, что уровень становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более низким по сравнению с уровнем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "микробиота кишечника", как используют в рамках изобретения, относится к микроорганизмам, которые живут в пищеварительном тракте животных-хозяев. Эти микроорганизм выполняют широкое множество различных метаболических, структурных, защитных и других полезных функций.
Как используют в рамках изобретения, термин "улучшение микробиоты кишечника" относится к увеличению количества и/или типа микроорганизмов, присутствующих в кишечнике индивидуума (например хозяина), и/или к увеличению активности указанных микроорганизмов с точки зрения их метаболических, структурных, защитных и других полезных функций. Например, количества (т.е. уровни) бактерий Clostridium кластера XIVa увеличивается и количества E. coli снижается; такое улучшение микробиоты кишечника может происходить у индивидуумов с воспалительным заболеванием кишечника (IBD) после введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления количество микроорганизмов, присутствующих в кишечнике индивидуума (например, хозяина), увеличивается, так что количество микроорганизмов становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким, чем уровень у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно количество типов микроорганизмов, присутствующих в кишечнике индивидуума (например, хозяина), увеличивается, так что становится по меньшей мере на 5%, 10%, или 15% больше типов микроорганизмов по сравнению с количеством типов у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Как используют в рамках изобретения, термин "регуляция аппетита" относится к способности модулировать (т.е. увеличивать или снижать) желание у индивидуума употреблять пищу.
В одном варианте осуществления аппетит у индивидуума стимулируется (т.е. повышается).
Без связи с теорией, флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), подавляют стимулирующий эффект на аппетит индивидуума путем подавления экспрессии генов, ассоциированных с подавлением аппетита (таких как гены, кодирующие гормоны насыщения). Примерами генов, ассоциированных с регуляцией аппетита, являются Agt, Cartpt, Cck, Cxcl12 и Gcg и подавление одного или нескольких из этих генов ассоциировано с подавлением аппетита.
Примерами гормонов насыщения являются Cck и Gcg.
В одном аспекте флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), стимулируют аппетит у индивидуума, так что индивидуум употребляет по меньшей мере на 5%, 10%, или 15% больше пищи, чем индивидуум до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму. Дополнительно или альтернативно флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), стимулируют аппетит у индивидуума, так что через 1 месяц после введения масса индивидуума становится по меньшей мере на 2%, 5% или 10% более высокой, чем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижает уровень холицистокинина (Cck) и/или глюкагона (Gcg) в крови индивидуума.
В одном аспекте флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижает уровень холицистокинина (Cck) и/или глюкагона (Gcg) в крови индивидуума по меньшей мере на 5%, 10%, 15% или 20% по сравнению с индивидуумом до введения флагеллина Roseburia, и/или полипептида Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанного полипептида Fla (такого как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), подавляют экспрессию гена, кодирующего холицистокинин (Cck), и/или экспрессию гена, кодирующего глюкагон (Gcg) в клетке или клетках индивидуума.
В одном аспекте флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижают экспрессию гена, кодирующего холицистокинин (Cck), так что уровень экспрессии становится по меньшей мере на 5%, 10%, 15% или 20% более низким по сравнению с уровнем экспрессии у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2) и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2) и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном аспекте флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), снижают экспрессию гена, кодирующего глюкагон (Gcg), так что уровень экспрессии становится по меньшей мере на 5%, 10%, 15% или 20% более низким по сравнению с уровнем экспрессии у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
Термин "улучшение здоровья пищеварительного тракта", как используют в рамках изобретения, относится к уменьшению уровня воспаления пищеварительного тракта или его части и/или улучшение кишечной микробиоты.
В одном варианте осуществления уровень воспаления в пищеварительном тракте является по меньшей мере на 10%, 20%, 30%, 40% или 50% более низким, чем уровень воспаления в пищеварительном тракте индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), регулирует экспрессию по меньшей мере одного гена, выбранного из Tlr5, Tlr1, Vnn1, Defb37, Pla2g, Muc16, ltln, Sprr1a, Cldn4, Pmp22, Crb3, Magi3, Marveld3, Mpp7, Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a. Многие из этих генов являются генами кишечного барьера и, таким образом, функционируют, снижая инвазивность патогенов кишечника и также снижая число жизнеспособных патогенов.
В одном варианте осуществления экспрессия одного или нескольких генов, выбранных из группы, состоящей из TLR-родственных генов (например, Tlr5, Tlr1, и Vnn1), генов, кодирующих противомикробные пептиды (например, Defb37, Pla2g, Muc16, и ltln), генов функции кишечного барьера (например Sprr1a, Cldn4, Pmp22, Crb3 и Magi3), генов врожденного иммунитета (например Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a) в клетке или клетках индивидуума повышается.
В одном варианте осуществления экспрессия одного или нескольких генов, выбранных из группы, состоящей из TLR-родственных генов (например Tlr5, Tlr1 и Vnn1), генов, кодирующих противомикробные пептиды (например Defb37, Pla2g, Muc16 и ltln), генов функции кишечного барьера (например Sprr1a, Cldn4, Pmp22, Crb3 и Magi3), генов врожденного иммунитета (например Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a) увеличивается так, что уровень становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким, по сравнению с уровнем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления экспрессия одного или нескольких генов, выбранных из группы, состоящей из Tlr5, Tlr1, Vnn1, Defb37, Pla2g, Muc16, ltln, Sprr1a, Cldn4, Pmp22, Crb3, Magi3, Marveld3, Mpp7, Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a, в клетке или клетках индивидуума повышается.
В одном варианте осуществления уровень экспрессии одного или нескольких генов, выбранных из группы, состоящей из Tlr5, Tlr1, Vnn1, Defb37, Pla2g, Muc16, ltln, Sprr1a, Cldn4, Pmp22, Crb3, Magi3, Marveld3, Mpp7, Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a, повышается так, что уровень становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким, или более чем на 100% более высоким, чем уровень у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В одном варианте осуществления экспрессия одного или нескольких генов, выбранных из группы, состоящей из генов, кодирующих ацетил-CoA-ацетилтрансферазу, 3-гидроксиацил-CoA-дегидрогеназу, бутирил-CoA-дегидрогеназу и фосфоенолпируваткарбоксикиназу [ATP] в клетке или клетках индивидуума модулируется.
В одном варианте осуществления уровень экспрессии одного или нескольких генов, выбранных из группы, состоящей из генов, кодирующих ацетил-CoA-ацетилтрансферазу, 3-гидроксиацил-CoA-дегидрогеназу, бутирил-CoA-дегидрогеназу и фосфоенолпируваткарбоксикиназу [ATP], модулируется так, что уровень становится по меньшей мере на 10%, 20%, 30%, 40% или 50% более высоким или более низким по сравнению с уровнем у индивидуума до введения флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), индивидууму.
В следующем аспекте настоящее изобретение относится к трансформированному микроорганизму (такому как Firmicutes, например Roseburia spp, такие как R. hominis или R. intestinalis), в котором экспрессия флагеллина (например, флагеллина Roseburia), такого как FlaA1 или FlaA2, является повышенной по сравнению с эквивалентным микроорганизмом до трансформации, и к его применению для различных терапевтических и пищевых применений, как описано в настоящем описании. Например, трансформированный микроорганизм может быть трансформирован нуклеотидной последовательностью (такой как промотор), так что микроорганизм способен повышать экспрессию гена, кодирующего флагеллин (например флагеллин Roseburia), такой как FlaA1 или FlaA2. В другом примере трансформированный микроорганизм может быть трансформирован экспрессирующим вектором, содержащим нуклеотидную последовательность, кодирующую флагеллин (например флагеллин Roseburia) такой как FlaA1 или FlaA2, функционально связанную с регуляторной последовательностью (такой как промотор) так что микроорганизм становится способным сверхэкспрессировать ген, кодирующий флагеллин (например флагеллин Roseburia), такой как FlaA1 или FlaA2.
Как используют в рамках изобретения, термин "экспрессирующий вектор" относится к конструкции ДНК, содержащей конструкцию, содержащую кодирующую последовательность ДНК (например, последовательность гена), которая функционально связана с одной или несколькими последовательностью(ями) контроля, способными влиять на экспрессию кодирующей последовательности в хозяине. Такие последовательности контроля включают промотор для обеспечения транскрипции, необязательную последовательность оператора для контроля такой транскрипции, последовательность, кодирующую подходящие участки связывания рибосом с мРНК, и последовательности, которые контролируют завершение транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. После трансформации подходящему хозяину, вектор может реплицироваться и функционировать независимо от генома хозяина или в некоторых случаях он сам по себе может встраиваться в геном. Плазмида является наиболее часто используемой формой экспрессирующего вектора. Однако подразумевают, что описание включает такие другие формы экспрессирующих векторов, которые выполняют эквивалентные функции, которые известны или становятся известными в данной области.
Термин "функционально связанный" относится к соседнему расположению, где элементы организованы так, чтобы они были функционально сопряженными. Например, промотор функционально связан с кодирующей последовательностью, если он контролирует транскрипцию кодирующей последовательности.
Ткани
В одном варианте осуществления ткань или орган представляет собой пищеварительный тракт или его отдел (например, пищевод, желудок или кишечник, такой как тонкий кишечник или толстый кишечник и ободочная кишка) или области других слизистых оболочек (такие как носовые ходы и легкие).
В одном варианте осуществления ткань или орган представляет собой пищеварительный тракт или его часть.
Примеры частей пищеварительного тракта включают пищевод, желудок и тонкий кишечник (такой как тонкий кишечник (например, двенадцатиперстная кишка, тощая кишка или подвздошная кишка) и/или толстый кишечник (например, слепая кишка, восходящая ободочная кишка, поперечная ободочная кишка, нисходящая ободочная кишка и сигмовидная кишка)).
Индивидуум
В одном варианте осуществления индивидуумом является моногастрическое животное.
Примеры моногастрических животных включают птиц, людей, крыс, свиней, собак, кошек, лошадей и кроликов.
В другом варианте осуществления индивидуумом является млекопитающее, такое как моногастрическое млекопитающее.
Примеры моногастрических млекопитающих включают всеядных животных (таких как люди, крысы и свиньи), хищных животных (таких как собаки и кошки) и травоядных животных (таких как лошади и кролики).
В одном варианте осуществления индивидуумом является человек.
Как правило, TLR5 может экспрессироваться в клетках указанного индивидуума.
Нарушения
Roseburia флагеллин и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), можно использовать для лечения нарушения у индивидуума, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
В одном варианте осуществления воспалительное нарушение и/или аутоиммунное нарушение влияет на пищеварительный тракт или его отдел у указанного индивидуума.
В одном варианте осуществления воспалительное нарушение и/или аутоиммунное нарушение влияет на область слизистой оболочки индивидуума. Примеры областей слизистых оболочек включают пищеварительный тракт или его отдел (например, пищевод, желудок или тонкий кишечник, такой как тонкий кишечник или толстый кишечник и ободочная кишка), носовые ходы и легкие.
В одном варианте осуществления воспалительное нарушение и/или аутоиммунное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
В одном аспекте воспалительное нарушение представляет собой колит. В следующем аспекте воспалительное заболевание представляет собой болезнь Крона, язвенный колит или резервуарный илеит.
В одном аспекте воспалительное нарушение и/или аутоиммунное нарушение поражает кишечник.
В одном аспекте кишечное нарушение представляет собой IBS. Точная патофизиология IBS еще предстоит установить. В недавних исследованиях описано воспаление слизистой оболочки и изменения микробиоты кишечника у пациентов с IBS и корреляция заболевания с кишечными инфекциями.
В следующем аспекте, кишечное нарушение представляет собой болезнь Крона.
В одном аспекте нарушение представляет собой аутоиммунное нарушение.
В одном аспекте аутоиммунное нарушение выбрано из группы, состоящей из язвенного колита, резервуарного илеита, ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, аллергии (включая глютеновую болезнь), атопического дерматита и ринита.
В частности вследствие функции восстановления иммунной толерантности, особое значение имеют аутоиммунные заболевания, ревматоидный артрит, псориаз, рассеянный склероз, диабет типа I.
Как используют в рамках изобретения, термин "лекарственное средство" охватывает лекарственные средства для применения как у человека, так и у животных, в медицине человека и ветеринарии. Кроме того, термин "лекарственное средство", как используют в рамках изобретения, означает любое вещество, которое обеспечивает терапевтический и/или благоприятный эффект. Термин "лекарственное средство", как используют в рамках изобретения, не обязательно ограничивается веществами, которые требуют разрешения продажи на рынке, но могут включать вещества, которые можно использовать в косметике, нутрицевтиках, пищевых продуктах (включая, например, еду и напитки), пробиотические культуры, пищевые добавки и натуральные лекарственные средства. Кроме того, термин "лекарственное средство", как используют в рамках изобретения, охватывает продукт, предназначенный для включения в корм для животных, например, в корм для скота и/или корм для домашних животных.
Профилактические применения
Флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), согласно изобретению также можно использовать в профилактических применениях. В профилактических применениях флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), согласно изобретению вводят пациенту, предрасположенному или имеющему иной риск, конкретного заболевания в количестве, которое является достаточном, чтобы по меньшей мере частично снизить риск развития заболевания. Такое количество определяют как "профилактически эффективная доза". Точные количества зависят от ряда конкретных факторов, таких как состояние здоровья индивидуума и его масса тела.
Инкапсулирование
В одном варианте осуществления флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia of полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), является инкапсулированной.
В следующем варианте осуществления фармацевтическая композиция, содержащая флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), является инкапсулированной.
В другом варианте осуществления пищевая добавка, содержащая флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), является инкапсулированной.
В следующем варианте осуществления пищевое вещество, продукт питания, диетическая добавка или пищевая добавка, являются инкапсулированными.
Термин "инкапсулированный", как используют в настоящем описании, относится к средствам для защиты полипептида, и/или полинуклеотидной последовательности, и/или вектора, и/или клетки-хозяина, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), от несовместимой окружающей среды посредством физического разделения так, чтобы их можно было доставить в заданную область (например, кишечник) без деградации или значительной деградации, чтобы полипептид, и/или полинуклеотидная последовательность, и/или вектор, и/или клетка-хозяин, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), могли оказывать эффект на заданную область. Примером является капсула, покрытая кишечной оболочкой.
Даже когда задачей инкапсулирования является выделение полипептида, и/или полинуклеотидной последовательности, и/или вектора, и/или клетки-хозяина, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), из окружающей среды, защитное покрытие или оболочка должны быть разрушены в момент желаемого действия. Разрушение защитного покрытия или оболочки, как правило, осуществляют с использованием химических и физических стимулов, таких как давление, действие ферментов, химическая реакция и физическая дезинтеграция.
Например, инкапсулирование обеспечивает возможность проглатывания полипептида, и/или полинуклеотидной последовательности, и/или вектора, и/или клетки-хозяина, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), чтобы полипептид, и/или полинуклеотидная последовательность, и/или вектор, и/или клетка-хозяин, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), можно было доставить в кишечник (т.е. в заданную область) в количестве, которое является эффективным для обеспечения эффекта в кишечнике.
Фармацевтическая композиция
Фармацевтическая композиция может представлять собой любую фармацевтическую композицию. В одном аспекте фармацевтическую композицию вводят перорально, энтерально или ректально. Например, композиция может представлять собой годную в пищу композицию. "Годный в пищу" означает материал, который одобрен для употребления человеком или животным.
Фармацевтические композиции могут быть предназначены для употребления человеком или животным в медицине человека или в ветеринарии.
Примеры таких пригодных эксципиентов для различных форм фармацевтических композиций, описанных в настоящем описании, могут быть найдены в "Handbook of Pharmaceutical Excipients, 2nd Edition, (1994), под редакцией A Wade и PJ Weller.
Приемлемые носители или разбавители для терапевтического применения хорошо известны в области фармацевтики и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985).
Примеры пригодных носителей включают лактозу, крахмал, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т.п. Примеры пригодных разбавителей включают этанол, глицерин и воду.
Выбор фармацевтического носителя, эксципиента или разбавителя может быть осуществлен с учетом предполагаемого пути введения и стандартной фармацевтической практики. Фармацевтические композиции могут содержать в качестве или в дополнение к носителю, эксципиенту или разбавителю любое пригодное связующее вещество(а), смазывающее вещество(а), суспендирующее вещество(а), вещество(а) покрытия, солюбилизирующее вещество(а).
Примеры пригодных связующих веществ включают крахмал, желатин, природные сахара, такие как глюкоза, безводная лактоза, свободнотекучая лактоза, бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлоза и полиэтиленгликоль.
Примеры пригодных смазывающих веществ включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п.
В фармацевтической композиции могут быть предоставлены консерванты, стабилизаторы, красители и даже вкусовые добавки. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и сложные эфиры п-гидроксибензойной кислоты. Также можно использовать антиоксиданты и суспендирующие вещества.
Пищевые добавки
Диетологически приемлемые носители, разбавители и эксципиенты включают носители, разбавители и эксципиенты, пригодные для употребления человеком или животным, и которые используют в качестве стандартных в пищевой промышленности. Типичные диетологически приемлемые носители, разбавители и эксципиенты известны специалисту в данной области.
Пищевые вещества/продукты
Следующий аспект изобретения относится к пищевым веществам, продуктам питания, диетическим добавкам и пищевым добавка, содержащим флагеллин Roseburia, и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis).
Термины "пищевое вещество", "продукт питания" "пищевая добавка" и "диетическая добавка", как используют в рамках изобретения, охватывают все годные к употреблению продукты, которые могут быть твердыми, желеобразными или жидкими.
Пригодные продукты питания могут включать, например, функциональные продукты питания, пищевые композиции, корма для домашних животных, корма для скота, диетические пищевые продукты, пищевые вещества и т.п. В одном аспекте продукт питания представляет собой диетический пищевой продукт.
Как используют в рамках изобретения, термин "функциональный продукт питания" означает продукт питания, которые способен обеспечивать не только питательный эффект, но также способен обеспечивать другой полезный эффект у потребителя. Таким образом, функциональные продукты питания представляют собой обычные продукты, которые имеют компоненты или ингредиенты (такие как ингредиенты, описанные в настоящем описании), включенные в них, которые придают продукту питания конкретную функциональную, например медицинскую или физиологическую пользу, отличную от исключительно питательного эффекта.
Примеры конкретных продуктов питания, которые пригодны в рамках настоящего изобретения, включают молочные продукты, готовые к употреблению десерты, порошки для разбавления, например, молоком или водой, шоколадно-молочные напитки, солодовые напитки, готовые к употреблению блюда, блюда немедленного приготовления или напитки для людей или композиции корма, соответствующие полному или частичному рациону для домашних животных или скота.
В одном аспекте пищевое вещество, продукт питания, диетическая добавка или пищевая добавка в соответствии с настоящим изобретением предназначены для людей, домашних животных или скота, таких как моногастрические животные. Пищевое вещество, продукт питания, диетическая добавка или пищевая добавка могут быть предназначена для животных, выбранных из группы, состоящей из собак, кошек, свиней, лошадей или птиц. В следующем варианте осуществления продукт питания, диетическая добавка или пищевая добавка предназначены для взрослых особей, в частности, для взрослых людей.
Термин "молочный продукт" как используют в рамках изобретения означает любое жидкое или полутвердое молоко или продукт на основе молочной сыворотки, имеющий различное содержание жира. Молочный продукт может представлять собой, например, коровье молоко, козье молоко, овечье молоко, обезжиренное молоко, цельное молоко, молоко, восстановленное из порошкового молока, и молочную сыворотку без какой-либо обработки, или обработанный продукт, такой как йогурт, сычужная закваска, творог, простокваша, свернувшееся цельное молоко, кефир и другие кисломолочные продукты. Другая важная группа включает молочные напитки, такие как напитки из молочной сыворотки, кисломолочные продукты, сгущенное молоко, молок для младенцев и детей; молоко со вкусовыми добавками, мороженое; содержащие молоко продукты, такие как сладости.
Пищевые вещества, продукты питания, диетические добавки или пищевые добавки по настоящему изобретению могут представлять собой или могут быть добавлены к пищевым добавкам, также называемым диетическими или питательными добавками или пищевыми добавками.
Пищевые вещества, продукты питания, диетические добавки или пищевые добавки согласно изобретению также можно использовать для кормления животных (например, для кормления свиней), в частности, у рано отнятых поросят и у откормочных свиней. Ожидается, что пищевые вещества, продукты питания, диетические добавки или пищевые добавки будут усиливать иммунную функцию, снижать или предупреждать инфекционные заболевания, благоприятным образом изменять состав микробиоты и улучшать рост и характеристики животных, например, посредством повышения расхода корма на единицу прироста массы тела.
Пробиотики или живой биотерапевтический продукт
Флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), можно использовать в пробиотическом или живом биотерапевтическом продукте.
Другой аспект изобретения относится к пробиотической композиции, содержащей флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia и/или указанный полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis).
Как используют в рамках изобретения, термин "пробиотик" означает препараты микробных клеток или компонентов микробных клеток с благоприятным эффектом на здоровье или самочувствие реципиента. (Salminen S, Ouwehand A. Benno Y. et al "Probiotics: how should they be defined" Trends Food Sci. Technol. 1999:10 107-10).
В одном аспекте пробиотическая композиция представляет собой перорально вводимую композицию метаболически активных, т.е. живых и/или лиофилизированных, или нежизнеспособных убитых нагреванием, облученных или подвергнутых лизису пробиотических бактерий. Пробиотическая композиция может содержать другие ингредиенты. Пробиотическую композицию можно вводить перорально, т.е. в форме таблетки, капсулы или порошка. Пробиотическая композиция может содержать вид бактерий R. hominis или R. intestinalis. Инкапсулированные продукты являются предпочтительными для R. hominis и R. intestinalis, поскольку они являются анэробами. Могут быть включены другие ингредиенты (например, такие как витамин C), в качестве ловушек кислорода и пребиотических субстратов (таких как те, которые улучшают колонизацию и выживаемость in vivo). Альтернативно пробиотическую композицию по изобретению можно вводить перорально в качестве пищевого или питательного продукта, такого как молоко, ферментированный молочный продукт на основе молочной сыворотки, или в качестве фармацевтического продукта.
Пригодная суточная доза пробиотических бактерий составляет от приблизительно 1×103 до приблизительно 1×1011 колониеобразующих единиц (CFU); например, от приблизительно 1×107 до приблизительно 1×1010 к.о.е.; в другом примере от приблизительно 1×106 до приблизительно 1×1010 CFU.
В одном аспекте пробиотическая композиция содержит в качестве активных ингредиентов вид бактерий и/или их клеточные компоненты в количестве от приблизительно 1×106 до приблизительно 1×1011 к.о.е./г, относительно массы композиции; например, от приблизительно 1×108 до приблизительно 1×1010 к.о.е./г. Доза может составлять 1 г, 3 г, 5 г и 10 г.
Как правило, пробиотик необязательно комбинируют по меньшей мере с одним пригодным пребиотическим соединением. Пребиотик обычно представляет собой неперевариваемый углевод, такой как олиго- или полисахарид, или сахарный спирт, который не деградирует или не всасывается в верхнем пищеварительном тракте. Известные пребиотики включают коммереские продукты, такие как инулин и трансгалактоолигосахариды.
В одном аспекте пробиотическая композиция по настоящему изобретению включает пребиотик в количестве от приблизительно 1 до приблизительно 30% по массе, относительно общей массы композиции (например от 5 до 20% по массе). Углеводы могут быть выбраны из группы, состоящей из: фруктоолигосахаридов (или FOS), короткоцепочечных фруктоолигосахаридов, инулина, изомальтолигосахаридов, пектинов, ксилоолигосахаридов (или XOS), хитозанолигосахаридов (или COS), бета-глюканов, модифицированных аравийской камедью и устойчвых крахмалов, полидекстрозы, D-тагатозы, волокон акации, волокон рожкового дерева, овса и цитрусовых. В одном аспекте пребиотики представляют собой короткоцепочечные фруктоолигосахариды (для простоты представленные в настоящем описании как FOSs-c.c); указанные FOSs-c.c. представляют собой неперевариваемые углеводы, обычно получаемые путем переработки сахарной свеклы и включающие молекулу сахарозы, с которой связаны три молекулы глюкозы.
Введение
Фармацевтические композиции, питательные добавки, пищевые вещества, продукты питания, диетические добавки или пищевые добавки по настоящему изобретению могут быть адаптированы для перорального, ректального, вагинального, парентерального, внутримышечного, внутрибрюшинного, внутриартериального, интратекального, внутрибронхиального, подкожного, внутрикожного, внутривенного, назального, буккального или сублингвального путей введения.
В одном аспекте фармацевтические композиции, питательные добавки, пищевые вещества, продукты питания, диетические добавки или пищевые добавки по настоящему изобретению адаптированы для перорального. ректального, вагинального, парентерального, назального, буккального или сублингвального путей введения.
В следующем аспекте фармацевтические композиции, питательные добавки, пищевые вещества, продукты питания, диетические добавки или пищевые добавки по настоящему изобретению адаптированы для перорального введения.
Для перорального введения особенно применимыми являются прессованные таблетки, пилюли, таблетки, желатиновые капсулы, капли и капсулы.
Другие формы введения включают растворы или эмульсии, которые можно инъецировать внутривенно, внутриартериально, интратекально, подкожно, внутрикожно, внутрибрюшинно или внутримышечно, и которые получают из стерильных или стерилизуемых растворов. Фармацевтические композиции по настоящему изобретению также могут иметь форму суппозиториев, пессариев, суспензий, эмульсий, лосьонов, мазей, кремов, гелей, спреев, растворов или присыпок.
Альтернативными способами трансдермального введения являются введение с использованием кожного пластыря. Например, активный ингредиент можно включать в крем, состоящий из водной эмульсии полиэтиленгликолей или вазелинового масла. В другом примере, активный ингредиент также может быть включен в мазь, состоящую из белого воска или белой мягкой парафиновой основы вместе с такими стабилизаторами и консервантами, которые могут потребоваться.
Фармацевтические композиции, питательные добавки, пищевые вещества, продукты питания, диетические добавки или пищевые добавки могут быть составлены в единичной дозированной форме, т.е. в форме отдельных частей, содержащих единичную дозу, или множество единичных доз или части единичных доз.
Дозировка
Специалист в данной области может без труда определить соответствующую дозу флагеллина Roseburia и/или полипептида Fla (такого как FlaA1 или FlaA2), и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, и/или Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), для введения индивидууму без излишнего экспериментирования. Как правило, врач может определить истинную дозировку, который является наиболее пригодной для индивидуального пациента, и она зависит от различных факторов, включающих активность конкретного используемого бактериального штамма, метаболическую стабильность и продолжительность действия этого штамма, возраста, массы тела, общего состояния здоровья, пола, режима питания, пути и времени введения, скорости экскреции, комбинации лекарственных средств, тяжести конкретного состояния и индивидуальной проводимой терапии. Дозировки, описанные в настоящем описании, иллюстрируют средний случай. Безусловно, могут быть индивидуальные случая, когда оправданы более высокие или более низкие диапазоны дозировок, и они входят в объем настоящего изобретения.
Комбинации
В одном аспекте флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), вводят в комбинации по меньшей мере с одним, или двумя, или тремя, или четырьмя, или пятью другими активными агентами. В таких случаях флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia и/или полипептид Fla (такой как FlaA1 или FlaA2), и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и/или Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), можно вводить последовательно, одновременно или один за другим с одним или несколькими другими активными веществами.
По меньшей мере один, или два, или три, или четыре, или пять активных агентов могут быть выбраны из группы, состоящей из: флагеллинов Roseburia, полипептида Fla (такого как FlaA1 или FlaA2), полинуклеотидной последовательности(ей), кодирующей указанный флагеллин Roseburia, полинуклеотидной последовательности(ей), кодирующей указанный полипептид Fla (такой как FlaA1 или FlaA2), вектора(ов), содержащего указанную полинуклеотидную последовательность(и), клетку(и)-хозяина, содержащую указанный вектор(ы), клетку(и)-хозяина, содержащую указанную полинуклеотидную последовательность(и), и микроорганизмы (например Roseburia, такие как R. hominis и/или R. intestinalis).
По меньшей мере одно, или два, или три, или четыре, или пять других активных агентов могут представлять собой микроорганизм (например, Roseburia, такие как R. hominis и/или R. intestinalis). Примеры пригодных микроорганизмов включают: Roseburia hominis A2-183 и Roseburia intestinalis L1-82.
Идентичность последовательностей или гомология последовательностей
Термины "полипептид", "полипептид последовательность", "белок" и "аминокислотная последовательность" используют в настоящем описании взаимозаменяемо.
Термины "полинуклеотидная последовательность" и "нуклеотидная последовательность" используют в настоящем описании взаимозаменяемо.
Настоящее изобретение также охватывает применение последовательности, имеющей степень идентичности последовательности или гомологии последовательности с аминокислотной последовательностью(ями) полипептида, описанного в настоящем описании (например, варианты, гомологи и производные) или любой нуклеотидной последовательностью, кодирующей такой полипептид (далее обозначаемая как "гомологичная последовательность(и)"). В рамках настоящего изобретения термин "гомолог" означает структуру, имеющую определенную гомологию с рассматриваемыми аминокислотными последовательностями и рассматриваемыми нуклеотидными последовательностями. В рамках настоящего изобретения термин "гомология" может быть приравнен к "идентичности".
В контексте настоящего изобретения гомологичная последовательность включает аминокислотную или нуклеотидную последовательность, которая может быть по меньшей мере на 50, 60, 70, 75, 80, 85 или 90% идентичной, в некоторых вариантах осуществления по меньшей мере на 95, 96, 97, 98 или 99% идентичной рассматриваемой последовательности. Хотя гомологию также можно рассматривать в понятиях сходства (т.е. аминокислотные остатки, имеющие сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию в понятиях идентичности последовательностей.
В некоторых вариантах осуществления гомологичная последовательность включает аминокислотную последовательность или нуклеотидную последовательность, которая имеет одну или несколько вставок, делеций и/или замен по сравнению с рассматриваемой последовательностью.
В некоторых вариантах осуществления настоящее изобретение относится к применению белка, аминокислотная последовательность которого представлена в настоящем описании, или белка, происходящего из этого (родительского) белка посредством замены, делеции или вставки одной или нескольких аминокислот, как например, 2, 3, 4, 5, 6, 7, 8, 9 аминокислот или более, как например, 10 или более 10 аминокислот в аминокислотной последовательности родительского белка, и обладающего активностью родительского белка.
В некоторых вариантах осуществления настоящее изобретение относится к применению последовательности нуклеиновой кислоты (или гена), кодирующей белок, аминокислотная последовательность которого представлена в настоящем описании, или кодирующей белок, происходящий из этого (родительского) белка посредством замены, делеции или вставки одной или нескольких аминокислот, как например, 2, 3, 4, 5, 6, 7, 8, 9 аминокислот или более аминокислот, как например, 10 или более 10 аминокислот, в аминокислотной последовательности родительского белка, и имеющий активность родительского белка.
В контексте настоящего изобретения гомологичный последовательность включает нуклеотидную последовательность, которая может быть по меньшей мере на 50, 60, 70, 75, 85 или 90% идентичной, в некоторых вариантах осуществления по меньшей мере на 95, 96, 97, 98 или 99% идентичной нуклеотидной последовательности, кодирующей полипептид, описанный в настоящем описании (рассматриваемая последовательность). Как правило, гомолог содержит те же или эквивалентные последовательности, которые кодируют домен(ы) и т.д., что и рассматриваемая последовательность. Хотя гомологию также можно рассматривать в понятиях сходства (т.е. аминокислотные остатки, имеющие сходные свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию в понятиях идентичности последовательностей.
Гомологичный аминокислотная последовательность и/или нуклеотидная последовательность может обеспечивать и/или кодировать полипептид, который сохраняет функциональную активность и/или повышает активность полипептида.
В некоторых аспектах аминокислотная последовательность, как описано в настоящем описании, обладает по меньшей мере 50, 60, 70, 75, 80, 85 или 90% идентичностью, в некоторых вариантах осуществления по меньшей мере 95, 96, 97, 98 или 99% идентичностью с рассматриваемой последовательностью.
В некоторых аспектах нуклеотидная последовательность, как описано в настоящем описании, обладает по меньшей мере 50, 60, 70, 75, 80, 85 или 90% идентичностью, в некоторых вариантах осуществления по меньшей мере 95, 96, 97, 98 или 99% идентичностью с рассматриваемой последовательностью.
Сравнение гомологии можно проводить невооруженным глазом или чаще с помощью свободно доступных программ для сравнения последовательностей. Эти коммерчески доступные компьютерные программы могут вычислять % гомологию между двумя или более последовательностями.
% гомологию можно вычислять для непрерывных последовательностей, т.е. одну последовательность выравнивают с другой последовательностью, и каждая аминокислота в одной последовательность прямо сравнивается с соответствующей аминокислотой в другой последовательности, по одному остатку за раз. Это называют выравниванием "без пропусков". Как правило, такое выравнивание без пропусков проводят только на протяжении относительно короткого числа остатков.
Хотя этот способ является очень простым и унифицированным, в нем не учитывается, что, например, в случае в ином случае идентичной пары последовательностей одна инсерция или делеция будет приводить к тому, что следующие аминокислота остатки будут исключаться из выравнивания, таким образом, потенциально вызывая значительное снижение % гомологии при проведении глобального выравнивания. Следовательно, большинство способов сравнения последовательностей предназначены для проведения оптимального выравнивания, которые учитывают возможные инсерции и делеции без чрезмерного снижения общего показателя гомологии. Это осуществляется путем встраивания "пропусков" при выравнивании последовательностей, чтобы попытаться максимизировать локальную гомологию.
Однако эти более комплексные способы присваивают "штраф за внесение пропуска" каждому пропуску, который происходит при выравнивании, так что для одного и того же числа идентичных аминокислот, выравнивание последовательностей с наименьшим возможным количеством пропусков, отражающее более родство между двумя сравниваемыми последовательностями, будет обеспечивать более высокий показатель, чем выравнивание с множеством пропусков. Как правило, используют "аффинный штраф за пропуск", который предписывают относительно высокий штраф за внесение пропуска и меньший штрафы за каждый последующий остаток в пропуске. Он является наиболее часто используемой системой оценки пропусков. Высокие штрафы за пропуск, безусловно, будут обеспечивать оптимизированное выравнивание с меньшим количеством пропусков. Большинство программ выравнивания позволяют модифицировать штрафы за пропуск. Как правило, при использовании такого программного обеспечения для сравнения последовательностей используют параметры по умолчанию.
Вычисление максимальной % гомологии, таким образом, во-первых, требует проведения оптимального выравнивания, учитывая штрафы за пропуски. Пригодной компьютерной программой для проведения такого выравнивания является Vector NTI (Invitrogen Corp.). Примеры программного обеспечения, которое может проводить сравнения последовательностей, включают, но не ограничиваются ими, пакет программ BLAST (см. Ausubel et al 1999 Short Protocols in Molecular Biology, 4th Ed - Chapter 18), BLAST 2 (см. FEMS Microbiol Lett 1999 174(2): 247-50; FEMS Microbiol Lett 1999 177(1): 187-8 и tatiana@ncbi.nlm.nih.gov), FASTA (Altschul et al 1990 J. Mol. Biol. 403-410) и, например, AlignX например. По меньшей мере BLAST, BLAST 2 и FASTA являются доступными для поиска в автономном режиме и через Интернет (см. Ausubel et al 1999, стр. с 7-58 по 7-60).
Хотя конечную % гомологию можно измерять в понятиях идентичности, процесс выравнивания, сам по себе, как правило не основан на сравнении пар по принципу "все или ничего". Вместо этого обычно используют взвешенную оценочную матрицу сходства, которая приписывает оценку каждому попарному сравнению, исходя из химического сходства или эволюционного расстояния. Примером такой широко используемой матрицы является матрица BLOSUM62 - матрица по умолчанию для пакета программ BLAST. В программах Vector NTI обычно используются либо общедоступные величины по умолчанию, либо специализированная таблица сравнения символов, если она поставляется (см. руководство пользователя для дополнительных деталей). Для некоторых применений является предпочтительным использование величин по умолчанию для пакета программ Vector NTI.
Альтернативно процентную гомологию можно вычислять с использованием функции множественного сравнения в Vector NTI (Invitrogen Corp.), на основе алгоритма, аналогичного CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244).
После проведения программным обеспечением оптимального выравнивания, является возможным вычисление % гомологии, например % идентичности последовательностей. Программное обеспечение, как правило, проводит это в качестве части сравнения последовательностей и генерирует числовой результат.
При использовании штрафов за пропуск при определении идентичности последовательностей для попарного выравнивания можно использовать следующие параметры, например:
В одном варианте осуществления можно использовать CLUSTAL со штрафом за внесение пропуска и штрафом за продолжение пропуска, как определено выше.
В одном варианте осуществления степень идентичности в отношении нуклеотидной последовательности определяют на протяжении по меньшей мере 20 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 30 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 40 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 50 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 60 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 100 последовательно расположенных нуклеотидов, например, на протяжении по меньшей мере 200 последовательно расположенных нуклеотидов, например на протяжении по меньшей мере 300 последовательно расположенных нуклеотидов.
В одном варианте осуществления степень идентичности в отношении нуклеотидной последовательности можно определять на протяжении всей последовательности.
Рекомбинантный
В одном аспекте полипептид и/или полинуклеотидная последовательность флагеллина Roseburia для применения в рамках настоящего изобретения представляют собой рекомбинантную последовательность, т.е. последовательность, полученную с использованием способов рекомбинантных ДНК.
Эти способы рекомбинантных ДНК входят в пределы способности специалиста в данной области. Такие способы объяснены в литературе, например, J. Sambrook, E. F. Fritsch, и T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press.
Синтетический
В одном аспекте полинуклеотидная последовательность флагеллина Roseburia для применения в рамках настоящего изобретения представляет собой синтетическую последовательность, т.е. последовательность, полученную посредством химического или ферментативного синтеза in vitro. Она включает, но не ограничивается ими, последовательности, полученные с помощью оптимального использования кодонов для организмов-хозяев, таких как метилотрофные дрожжи Pichia и Hansenula.
Экспрессия ферментов
Нуклеотидная последовательность для применения в рамках настоящего изобретения может быть включена в рекомбинантный реплицируемого вектор. Вектор можно использовать для репликации и экспрессии нуклеотидной последовательности в белковой форме в и/или из совместимой клетки-хозяина.
Экспрессию можно контролировать с использованием последовательностей контроля, например, регуляторных последовательностей.
Белок, продуцируемой рекомбинантной клеткой-хозяином путем экспрессии нуклеотидной последовательности, может секретироватся или может содержаться внутриклеточно в зависимости от последовательности и/или используемого вектора. Кодирующие последовательности могут быть сконструированы с сигнальными последовательностями, которые направляют секрецию основных кодируемых последовательностей через конкретную мембрану прокариотических или эукариотических клеток.
Экспрессирующий вектор
В одном аспекте настоящее изобретение относится к вектору (такому как экспрессирующий вектор), содержащему по меньшей мере одну полинуклеотидную последовательность, кодирующую по меньшей мере один флагеллин Roseburia.
Термин "экспрессирующий вектор" означает конструкцию, способную к экспрессии in vivo или in vitro.
В одном варианте осуществления экспрессирующий вектор встроен в геном подходящего организма-хозяина. Термин "встроенный" в одном аспекте охватывает стабильное встраивание в геном.
Нуклеотидная последовательность по настоящему изобретению может присутствовать в векторе, в котором нуклеотидная последовательность функционально связана с регуляторными последовательностями, способными обеспечивать экспрессию нуклеотидной последовательности подходящей клеткой-хозяином или организмом-хозяином.
Векторами для применения в рамках настоящего изобретения можно трансформировать подходящую клетку-хозяина или организм-хозяина, как описано в настоящем описании, для обеспечения экспрессии полипептида по настоящему изобретению.
Выбор вектора, например плазмидного, космидного или фагового вектора, часто зависит от клетки-хозяина, в которую его намереваются вводить.
Векторы для применения в рамках настоящего изобретения могут содержать один или несколько генов селективных маркеров, таких как ген, который сообщает устойчивость к антибиотикам, например, устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Альтернативно селекцию можно проводить посредством совместной трансформации (как описано в WO91/17243).
Векторы можно использовать in vitro, например, для получения РНК, или использовать для трансфекции, трансформации, трансдукции или инфицирования клетки-хозяина.
Таким образом, в следующем варианте осуществления описание относится к способу получения нуклеотидных последовательностей по настоящему изобретению посредством внесения нуклеотидной последовательности по настоящему изобретению в реплицирующийся вектор, введения вектора в совместимую клетку-хозяина и выращивания клетки-хозяина в условиях, которые осуществляют репликацию вектора.
Вектор, кроме того, может содержать нуклеотидную последовательность, позволяющую вектору реплицироваться в рассматриваемой клетке-хозяине. Примерам таких последовательности являются ориджины репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1 и pIJ702.
Экспрессирующий вектор может содержать по меньшей мере две, три, четыре или пять полинуклеотидных последовательностей, кодирующих флагеллины Roseburia.
Примеры экспрессирующих векторов включают pGEX-6P-1, PCR-Blunt II-TOPO и T7-MAT-Tag-FLAG-.
Экспрессирующий вектор pGEX-6P-1 можно использовать для клонирования рекомбинантных флагеллинов. Экспрессирующий вектор pGEX-6P-1 содержит промотор tac для химически индуцируемой экспрессии на высоком уровне GST-меченых рекомбинантных белков, внутренний ген lacIq для применения в любом хозяине E. coli, ген AmpR для селекции с ампициллином и участок для протеазы PreScission, для отщепления, если желательно, белка от слитого продукта.
Клонирующий вектор PCR-Blunt II-TOPO можно использовать для клонирования рекомбинантных флагеллинов, в частности, флагеллинов, которые являются нерастворимыми после клеточного лизиса. Как правило, этот вектор позволяет высокоэффективное клонирование ДНК продуктов ПЦР с тупыми концами. Вектор содержит гены устойчивости к канамицину и зеоцину для селекции в E. coli, и вставка фланкируется множествами участков рестрикции для вырезания.
Для клонирования рекомбинантных флагеллинов можно использовать экспрессирующий вектор T7-MAT-Tag-FLAG-, в частности, флагеллинов, которые являются нерастворимыми после лизиса клеток. Участок множественного клонирования (MCS) фланкируется последовательностью MAT (металлсодержащая аффинная метка) и последовательностью пептида FLAG (Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys), что приводит к продуцированию флагеллина с двойным мечением, который далее можно очищать с использованием аффинных колонок. Этот экспрессирующий вектор также содержит промотор pT7/lac (lac-оперон фага T7) для индуцируемой IPTG экспрессии на высоком уровне рекомбинантных флагеллинов MAT-ORF-FLAG, внутреннего гена lacI, который подавляет транскрипцию в базальном состоянии в любом хозяине E. coli, и ген AmpR для селекции с ампициллином.
Регуляторные последовательности
В некоторых применениях нуклеотидная последовательность для применения в рамках настоящего изобретения функционально связана с регуляторной последовательностью, которая способна обеспечивать экспрессию нуклеотидной последовательности, например, выбранной клеткой-хозяином. В качестве примера настоящее изобретение охватывает вектор, содержащий нуклеотидную последовательность по настоящему изобретению, функционально связанную с такой регуляторной последовательностью, т.е. вектор представляет собой экспрессирующий вектор.
Термин "функционально связанный" относится к смежному положению, где описанные компоненты обладают взаимозависимостью, позволяющей им функционировать предполагаемым для них образом. Регуляторную последовательность, "функционально связанную" с кодирующей последовательностью, лигируют таким образом, чтобы осуществлялась экспрессия кодирующей последовательности в условиях, совместимых с последовательностями контроля.
Термин "регуляторные последовательности" включает промоторы, и энхансеры, и другие сигналы регуляции экспрессии.
Термин "промотор" используют в его обычном значении в данной области, например, в значении участка связывания РНК-полимеразы.
Увеличенной экспрессии нуклеотидной последовательности, кодирующей флагеллин по настоящему изобретению, также можно достигать посредством выбора гетерологичных регуляторных областей, например, областей промоторов, секреторных лидерных последовательностей и терминаторов.
В одном варианте осуществления нуклеотидная последовательность согласно настоящему описанию функционально связана по меньшей мере с промотором.
Другие промоторы также можно использовать для контроля экспрессии полипептида по настоящему описанию.
Примеры пригодных промоторов для контроля транскрипции нуклеотидной последовательности в хозяевах, являющихся бактериями, грибами или дрожжами, хорошо известны в данной области.
Промотор, кроме того, может включать признаки, обеспечивающие или повышающие экспрессию в подходящем хозяине. Например, признаки могут представлять собой консервативные боксы, такие как Box Прибнова или TATA-бокс.
Конструкции
Термин "конструкция", который является синонимом терминам, таким как "конъюгат", "кассета" и "гибрид", включает нуклеотидную последовательность для применения в соответствии с настоящим изобретением, прямо или непрямо связанную с промотором.
Примером непрямого присоединения является предоставление подходящей спейсерной группы, такой как последовательность интрона, такая как Sh1-интрон или интрон ADH, между промотором и нуклеотидной последовательностью по настоящему изобретению. Указанное является справедливым для термина "слитый" в отношении настоящего изобретения, который включает прямое или непрямое связывание. В некоторых случаях термины не охватывают природную комбинацию нуклеотидной последовательности, кодирующей белок, обычно связанной с промотором гена дикого типа, и случай, когда они оба находятся в их естественном окружении.
Конструкция также может содержать или экспрессировать маркер, который обеспечивает селекцию генетической конструкции.
Для некоторых применений конструкция по настоящему изобретению содержит по меньшей мере нуклеотидную последовательность по настоящему изобретению, функционально связанную с промотором.
Клетки-хозяева
Термин "клетка-хозяин" в отношении настоящего описания включает любу клетку, которая содержит нуклеотидную последовательность и/или экспрессирующий вектор, как описано в настоящем описании. Как правило, клетка-хозяин способна к рекомбинантной продукции белка, имеющего конкретные свойства, как определено в настоящем описании.
Примеры клеток-хозяев включают бактерии, такие как Roseburia spp., и компетентные клетки. Примерами Roseburia spp являются Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis и Roseburia inulinivorans. Примеры компетентных клеток включают компетентные клетки E. coli (такие как E. coli BL21(DE3) pLysS и/или E. coli B21 Rosetta).
Таким образом, следующий вариант осуществления настоящего изобретения относится к клеткам-хозяевам, трансформированным или трансфицированным нуклеотидной последовательностью по настоящему изобретению. Дополнительно или альтернативно, следующий вариант осуществления настоящего изобретения относится к клеткам-хозяевам, трансформированным или трансфицированным нуклеотидной последовательностью (например, промотор, такой как гетерологичный промотор или экзогенный промотор), которая способна активировать экспрессию (обеспечивать сверхэкспрессию) нуклеотидной последовательности (например, ген, такой как гомологичный ген или эндогенный ген), кодирующей флагеллин по настоящему изобретению по сравнению с эквивалентным микроорганизмом перед трансформацией. Клетки выбирают так, чтобы они были совместимыми с указанным вектором и, например, они могут представлять собой клетки бактерий (например прокариотические клетки), клетки грибов или клетки дрожжей.
Нуклеотидная последовательность, кодирующая флагеллин по настоящему изобретению, может быть гетерологичной или гомологичной для клетки-хозяина. Как правило, когда нуклеотидная последовательность, кодирующая флагеллин, является гомологичной клетке-хозяину, клетка-хозяин содержит множество копий нуклеотидной последовательности. Дополнительно или альтернативно, нуклеотидная последовательность, кодирующая флагеллин, функционально связана с гетерологичным промотором; как правило, указанный промотор способен активировать (сверхэкспрессировать) гомологичную нуклеотидную последовательность, кодирующую флагеллин.
В одном примере клетка-хозяин содержит нуклеотидную последовательность, кодирующую полипептид флагеллина по настоящему изобретению (такой как гомологичная или эндогенная нуклеотидная последовательность) под контролем гетерологичного или экзогенного промотора.
В одном варианте осуществления клетка-хозяин трансформирована или трансфицирована одной или несколькими нуклеотидными последовательностями, которые кодируют по меньшей мере один флагеллин (например флагеллин Roseburia), выбранный из группы, состоящей из Fla1, Fla2, Fla3 и Fla4. В другом варианте осуществления клетка-хозяин трансформирована или трансфицирована одной или несколькими нуклеотидными последовательностями, которые кодируют по меньшей мере один флагеллин (например, флагеллин Roseburia), выбранный из группы, состоящей из Fla2, Fla1 и Fla4. В следующем варианте осуществления клетка-хозяин трансформирована или трансфицирована нуклеотидными последовательностями, которые кодируют флагеллин (например флагеллин Roseburia) Fla2.
Клетка-хозяин может содержать множество копий полинуклеотидных последовательностей, кодирующих флагеллины Roseburia.
Клетка-хозяин может содержать по меньшей мере 1, 2, 3, 4 или 5 полинуклеотидных последовательностей, кодирующих по меньшей мере 1, 2, 3, 4 или 5 флагеллинов Roseburia.
В одном варианте осуществления клетка-хозяин содержит полинуклеотидную последовательность, кодирующую по меньшей мере один флагеллин Roseburia, происходящий или получаемый из одного вида Roseburia, и по меньшей мере одну дополнительную полинуклеотидную последовательность, кодирующую по меньшей мере один флагеллин Roseburia, происходящий или получаемый из отличающегося вида Roseburia. Например, клетка-хозяин содержит по меньшей мере одну полинуклеотидную последовательность, кодирующую флагеллин R. hominis (например Fla1 или Fla2), и по меньшей мере одну полинуклеотидную последовательность, кодирующую флагеллин R. intestinalis (например Fla1 или Fla 2).
Клетка-хозяин может содержать по меньшей мере 1, 2, 3, 4 или 5 экспрессирующих векторов, содержащих по меньшей мере 1, 2, 3, 4 или 5 полинуклеотидных последовательностей, кодирующих флагеллин Roseburia.
В одном варианте осуществления клетка-хозяин содержит экспрессирующий вектор, содержащий полинуклеотидную последовательность, кодирующую флагеллины Roseburia, происходящие или получаемые из одного вида Roseburia, и по меньшей мере один дополнительный экспрессирующий вектор, содержащий полинуклеотидную последовательность, кодирующую флагеллины Roseburia, происходящую или получаемую из другого вида Roseburia. Например, клетка-хозяин содержит по меньшей мере один экспрессирующий вектор, содержащий полинуклеотидную последовательность, кодирующую флагеллин R. hominis (например Fla1 или Fla2) и по меньшей мере один экспрессирующий вектор, содержащий полинуклеотидную последовательность, кодирующую флагеллин R. intestinalis (например Fla1 или Fla 2).
Нуклеотидная последовательность, кодирующая флагеллин, может быть эндогенной или экзогенной для клетки-хозяина. Как правило, когда нуклеотидная последовательность, кодирующая флагеллин, является эндогенной для клетки-хозяина, клетка-хозяин содержит множество копий нуклеотидной последовательности. Дополнительно или альтернативно, нуклеотидная последовательность, кодирующая флагеллин, функционально связана с экзогенным промотором; как правило, указанный промотор способен активировать (обеспечивать сверхэкспрессию) эндогенной нуклеотидной последовательности, кодирующей флагеллин.
Примерами пригодных бактериальных организмов-хозяев являются грам-положительные или грам-отрицательные виды бактерий.
В одном варианте осуществления клетка-хозяин представляет собой микроорганизм.
В одном варианте осуществления клетка-хозяин представляет собой вид молочнокислых бактерий, вид Lactococcus, вид Bifidobacterium, вид Lactobacillus или вид Propionibacterium.
Примеры молочно-кислых бактерий включают, но не ограничиваются ими, Lactobacillus spp., Leuconostoc spp., Pediococcus spp., Lactococcus spp., Streptococcus spp., Aerococcus spp., Carnobacterium spp., Enterococcus spp., Oenococcus spp., Sporolactobacillus spp., Tetragenococcus spp., Vagococcus spp. и Weisella spp.
Примеры Lactobacillus spp включают Lactobacillus paracasei, L. acidophilus, L. fermentum, L. brevis, L. gasseri, L. plantarum, L. bulgaricus, L. helveticus, L. reuteri, L. casei, L. jensenii, L. rhamnosus, L. crispatus, L. johnsonii, L. salivarius, L. acetotolerans, L. acidifarinae, L. acidipiscis, L. agilis, L. algidus, L. alimentarius, L. amylolyticus, L. amylophilus, L. amylotrophicus, L. amylovorus, L. animalis, L. antri, L. apodemi, L. aviarius, L. bifermentans, L. buchneri, L. camelliae, L. catenaformis, L. ceti, L. coleohominis, L. collinoides, L. composti, L. concavus, L. coryniformis, L. crustorum, L. curvatus, L. delbrueckii subsp. delbrueckii, L. delbrueckii subsp. bulgaricus, L. delbrueckii subsp. lactis, L. dextrinicus, L. diolivorans, L. equi, L. equigenerosi, L. farraginis, L. farciminis, L. fornicalis, L. fructivorans, L. frumenti, L. fuchuensis, L. galUnarum, L. gastricus, L. ghanensis, L. graminis, L. hammesii, L. hamsteri, L. harbinensis, L. hayakitensis, L. hilgardii, L. homohiochii, L. iners, L. ingluviei, L. intestinalis, L. kalixensis, L. kefiranofaciens, L. kefiri, L. kimchii, L. kitasatonis, L. kunkeei, L. leichmannii, L. lindneri, L. malefermentans, L. mail, L. manihotivorans, L. mindensis, L. mucosae, L. murinus, L. nagelii, L. namurensis, L. nantensis, L. oligofermentans, L. oris, L. panis, L. pantheris, L. parabrevis, L. parabuchneri, L. paracollinoides, L. parafarraginis, L. parakefiri, L. paralimentarius, L. paraplantarum, L. pentosus, L. perolens, L. pontis, L. psittaci, L. rennini, L. rimae, L. rogosae, L. rossiae, L. ruminis, L. saerimneri, L. sakei, L. sanfranciscensis, L. satsumensis, L. secaliphilus, L. sharpeae, L. siliginis, L. spicheri, L. suebicus, L. thailandensis, L. ultunensis, L. vaccinostercus, L. vaginalis, L. versmoldensis, L. vini, L. vitulinus, L. zeae и L. zymae.
Примеры Propionibacterium включают, но не ограничиваются ими, Propionibacterium freudenrechli subsp. shermanii (PAB), Propionibacterium acidifaciens, Propionibacterium acidipropionici, Propionibacterium acnes, Propionibacterium australiense, Propionibacterium avidum, Propionibacterium cyclohexanicum, Propionibacterium freudenrelchli subsp. freudenrelchli, Propionibacterium granulosum, Propionibacterium jensenii, Propionibacterium microaerophilum, Propionibacterium propionicum и Propionibacterium thoenii.
В одном варианте осуществления Propionibacterium представляют собой Propionibacterium freudenrechli subsp. shermanii (PAB).
Примеры Bifidobacterium включают, но не ограничиваются ими, Bifidobacterium adolescentis, B. breve, B. longum, B. animalis, B. infantis, B. thermophilum, B. bifidum, Bifidobacterium catenulatum, Bifidobacterium pseudocatenulatum, Bifidobacterium angulatum и B. lactis.
В другом варианте осуществления клетка-хозяин представляет собой Firmicute, например, вид Roseburia, такой как Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis или Roseburia inulinivorans. В одном варианте осуществления клетка-хозяин содержит по меньшей мере одну гетерологичную полинуклеотидную последовательность, кодирующую флагеллин Roseburia. Дополнительно или альтернативно, клетка-хозяин содержит по меньшей мере две копии гомологичной полинуклеотидной последовательности, кодирующей флагеллин Roseburia; например, клетка-хозяин содержит по меньшей мере 3, 4 или 5 гомологичных копии полинуклеотидной последовательности, кодирующей флагеллин Roseburia.
В зависимости от природы нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению, и/или желательности дальнейшей обработки экспрессируемого белка, можно использовать эукариотические хозяева, такие как дрожжи или другие грибы. Как правило, клетки дрожжей предпочтительнее используют среди клеток грибов, поскольку ими легче манипулировать. Однако некоторые белки либо плохо секретируются из дрожжевых клеток, либо в некоторых случаях не процессируются надлежащим образом (например, гипергликозилирование в дрожжах). В этих случаях следует выбирать другой организм гриба, являющийся хозяином.
Применение подходящих клеток-хозяев, таких как клетки-хозяева дрожжей, грибов и растений, может обеспечить посттрансляционные модификации (например, миристоилирование, гликозилирование, укорочение, липидизация и фосфорилирование тирозина, серина или треонина), которые могут потребоваться для сообщения оптимальной биологической активности рекомбинантным продуктам экспрессии по настоящему изобретению.
Клетка-хозяин может представлять собой штамм с дефицитом протеазы или минус-штамм по протеазе. Он, например, может представлять собой штамм с дефицитом протеазы Aspergillus oryzae JaL 125, в котором ген щелочной фосфатазы под названием "alp" удален. Этот штамм описан в WO97/35956.
Термин "клетка-хозяин" не охватывает нативные нуклеотидные кодирующие последовательности в их природной среде, когда они находятся под контролем их нативного промотора, который также находится в его природной среде.
Организм
Термин "организм" в рамках настоящего описания включает любой организм, который может содержать нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению, и/или продукты, полученные из нее, и/или где промотор может обеспечить экспрессию нуклеотидной последовательности согласно настоящему изобретению, когда она присутствует в организме.
Пригодные организмы могут включать бактерию (такую как прокариотическая бактерия), гриб, дрожжевую клетку или растение.
Термин "трансгенный организм" в рамках настоящего описания включает любой организм, который содержит нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению, и/или продукты, получаемые из нее, и/или где промотор может обеспечить экспрессию нуклеотидной последовательности по настоящему изобретению в организме. В одном варианте осуществления нуклеотидная последовательность включена в геном организма.
Термин "трансгенный организм" не охватывает нативные нуклеотидные кодирующие последовательности в их природной среде, когда они находятся под контролем их нативного промотора, который также находится в его природной среде.
Таким образом, трансгенный организм в рамках настоящего описания включает организм, содержащий любой из или комбинации из нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению, конструкций по настоящему изобретению, векторов по настоящему изобретению, плазмид по настоящему изобретению, клеток по настоящему изобретению или их продуктов.
Например, трансгенный организм может содержать нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению (такую как гомологичная нуклеотидная последовательность) под контролем гетерологичного промотора.
Трансформация клеток-хозяев/организма-хозяина
Как указано ранее, организм-хозяин может представлять собой прокариотический или эукариотический организм. Примеры пригодных прокариотических хозяев включают Roseburia hominis, Roseburia cecicola, Roseburia faecis, Roseburia intestinalis, Roseburia inulinivorans, E. coli и Bacillus subtilis.
Способы трансформации прокариотических хозяев широко описаны в данной области, например см. Sambrook et al (Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press). Если используют прокариотического хозяина, тогда может быть необходимым, чтобы нуклеотидная последовательность была пригодным образом модифицирована перед трансформацией, например, посредством удаления интронов.
Клетки нитчатых грибов можно трансформировать с использованием различных способов, известных в данной области, таких как способ, вовлекающий формирование и трансформацию протопластов с последующей регенерацией клеточной стенки известным способом. Применение Aspergillus в качестве микроорганизма-хозяина описано в EP 0 238 023.
Другим организмом-хозяином может быть растение. Обзор основных способов, используемых для трансформации растений, может быть найден в статьях Potrykus (Annu Rev Plant Physiol Plant Mol Biol [1991] 42:205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27). Дальнейшее описание трансформации растений может быть найдено в EP-A-0449375.
Общие способы трансформации грибов, дрожжей и растений представлены в последующих разделах.
Трансформированный гриб
Организм-хозяин может представлять собой гриб, такой как плесень. Примеры таких пригодных хозяев включают любого представителя рода Thermomyces, Acremonium, Aspergillus, Penicillium, Mucor, Neurospora, Trichoderma и т.п.
В одном варианте осуществления организм-хозяин может представлять собой нитчатый гриб.
Трансформация нитчатых грибов рассмотрена в US-A-5741665, в которой описаны стандартные способы трансформации нитчатых грибов, и культивирование грибов хорошо известно в данной области. Обширный обзор способов, используемых для N. crassa, описан, например в Davis и de Serres, Methods Enzymol (1971) 17A: 79-143.
Следующие способы, которые также можно использовать для трансформации нитчатых грибов, рассмотрены в US-A-5674707.
Кроме того, экспрессия генов в нитчатых грибах описана в Punt et al. (2002) Trends Biotechnol 2002 May;20(5):200-6, Archer & Peberdy Crit Rev Biotechnol (1997) 17(4):273-306.
Настоящее описание охватывает продуцирование трансгенных нитчатых грибов по настоящему изобретению, полученных с использованием этих стандартных способов.
В одном аспекте организм-хозяин может представлять собой организм-хозяин рода Aspergillus, такой как Aspergillus niger.
Трансгенный Aspergillus по нсатоящему описанию также можно получать, следуя, например, указаниям Turner G. 1994 (Vectors for genetic manipulation. In: Martinelli S.D., Kinghorn J.R.( Editors) Aspergillus: 50 years on. Progress in industrial microbiology vol 29. Elsevier Amsterdam 1994. pp. 641-666).
Трансформированные дрожжи
В другом варианте осуществления трансгенный организм может представлять собой дрожжи.
Обзор принципов экспрессии гетерологичных генов в дрожжах представлен, например, в Methods Mol Biol (1995), 49:341-54, и Curr Opin Biotechnol (1997) Oct;8(5):554-60.
В этом отношении, в качестве носителя для экспрессии гетерологичного гена можно использовать дрожжи, такие как виды Saccharomyces cerevisi или Pichia pastoris (см. FEMS Microbiol Rev (2000 24(1):45-66).
Обзор принципов экспрессии гетерологичных генов в Saccharomyces cerevisiae и секреции продуктов генов приведен в E Hinchcliffe E Kenny (1993, "Yeast as a vehicle for the expression of heterologous genes", Yeasts, Vol 5, Anthony H Rose and J Stuart Harrison, eds, 2nd edition, Academic Press Ltd.).
Для трансформации дрожжей было разработано несколько протоколов трансформации. Например, трансгенные Saccharomyces по настоящему изобретению можно получать, следуя указаниям Hinnen et al., (1978, Proceedings of the National Academy of Sciences of the USA 75, 1929); Beggs, J D (1978, Nature, London, 275, 104); и Ito, H et al (1983, J Bacteriology 153, 163-168).
Селекцию трансформированных клеток дрожжей можно проводить с использованием различных селективных маркеров, таких как ауксотрофные маркеры и доминантные маркеры устойчивости к антибиотикам.
Трансформированные растения/клетки растений
Организм-хозяин, пригодный в рамках настоящего изобретения, может представлять собой растение. В этом отношении, основным принципом конструирования генетически модифицированных растений является встраивание генетической информации в геном растения, чтобы обеспечить стабильное поддержание встроенного генетического материала. Обзор основных способов может быть найден в статьях Potrykus (Annu Rev Plant Physiol Plant Mol Biol [1991] 42:205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27).
Прямое инфицирование тканей растений посредством Agrobacterium является простым способом, который широко используют и который описан в Butcher D.N. et al., (1980), Tissue Culture Methods for Plant Pathologists, eds.: D.S. Ingrams and J.P. Helgeson, 203-208.
Другие способы трансформации растений включают баллистическую трансформацию, способ с карбидом кремния whisker (см. Frame BR, Drayton PR, Bagnaall SV, Lewnau CJ, Bullock WP, Wilson HM, Dunwell JM, Thompson JA & Wang K (1994) Production of fertile transgenic maize plants by silicon carbide whisker-mediated transformation, The Plant Journal 6: 941-948) и способы вирусной трансформации (например см. Meyer P, Heidmann I & Niedenhof I (1992) The use of cassava mosaic virus as a vector system for plants, Gene 110: 213-217).
Следующие способы трансформации растений могут быть найдены в EP-A-0449375.
Клетки растений можно выращивать и поддерживать в соответствии с хорошо известными способами культивирования тканей, например, посредством культивирования клеток в подходящей культуральной среде, дополненной необходимыми факторами роста, такими как аминокислоты, гормоны растений, витамины и т.д.
В следующем аспекте настоящее изобретение относится к векторной системе, которая содержит нуклеотидную последовательность или конструкцию по настоящему изобретению и которая способна вводить нуклеотидную последовательность или конструкцию в геном организма, такого как растение. Векторная система может содержать один вектор, однако она может содержать два вектора. В случае двух векторов векторную систему обычно называют бинарной векторной системой. Бинарные векторные системы описаны более подробно в Gynheung An et al., (1980), Binary Vectors, Plant Molecular Biology Manual A3, 1-19.
В одной широко используемой системе для трансформации клеток растений используется плазмида Ti из Agrobacterium tumefaciens или плазмида Ri из Agrobacterium rhizogenes An et al., (1986), Plant Physiol. 81, 301-305 и Butcher D.N. et al., (1980), Tissue Culture Methods for Plant Pathologists, eds.: D.S. Ingrams и J.P. Helgeson, 203-208. После каждого способа внесения желаемого промотора, или конструкции, или нуклеотидной последовательности по настоящему изобретению в растения, может быть необходимо присутствие и/или встраивание дополнительных последовательностей ДНК. Если, например, для трансформации используют Ti- или Ri-плазмиду клеток растений, то по меньшей мере правая граница, но часто и правая и левая границы T-ДНК Ti- и Ri-плазмиды, в качестве фланкирующих областей внесенных генов могут быть связаны. Применение T-ДНК для трансформации клеток растений широко исследовано и описано в EP-A-120516; Hoekema, in: The Binary Plant Vector System Offset-drukkerij Kanters B.B., Alblasserdam, 1985, Chapter V; Fraley, et al., Crit. Rev. Plant Sci., 4:1-46; и An et al., EMBO J. (1985) 4:277-284.
Культивирование и продукция
Клетки-хозяева, трансформированные нуклеотидной последовательностью по настоящему описанию и/или экспрессирующим вектором по настоящему описанию, можно культивировать в условиях, способствующих продуцированию кодируемого полипептида и способствующих выделению полипептида из клеток и/или культуральной среды.
Среда, используемая для культивирования клеток, может представлять собой любую общепринятую среду, пригодную для выращивания рассматриваемой клетки-хозяина и достижения экспрессии полипептида.
Белок, продуцируемый рекомбинантной клеткой, может экспонироваться на поверхности клетки.
Белок может секретироваться из клеток-хозяев и может быть удобным образом выделен из культуральной среды с использованием хорошо известных способов.
Секреция
В некоторых вариантах осуществления белок секретируется из экспрессирующего хозяина в культуральную среду, из которой белок можно выделять. В соответствии с настоящими изобретением, секреторную лидерную последовательность можно выбирать, исходя из желаемого экспрессирующего хозяина. В контексте настоящего изобретения также можно использовать гибридные сигнальные последовательности.
Типичными примерами гетерологичных секреторных лидерных последовательностей являются последовательности, происходящие из гена амилоглюкозидазы (AG) грибов (glaA - как версия из 18 аминокислот, так и версия из 24 аминокислот, например, из Aspergillus), ген a-фактора (дрожжи, например, Saccharomyces, Kluyveromyces и Hansenula) или ген α-амилазы (Bacillus).
В качестве примера, секреция гетерологичных белков в E. coli рассмотрена в Methods Enzymol (1990) 182:132-43.
Обнаружение
В данной области известны различные протоколы обнаружения и измерения экспрессии аминокислотной последовательности. Примеры включают твердофазный иммуноферментный анализ (ELISA), радиоиммунный анализ (RIA) и сортировку флюоресцентно-активированных клеток (FACS).
Специалистам в данной области известно широкое множество меток и способов конъюгации, и они могут быть использованы в различных анализах нуклеиновых кислот и аминокислот.
Ряд компаний, таких как Pharmacia Biotech (Piscataway, NJ), Promega (Madison, WI), и US Biochemical Corp (Cleveland, OH) поставляют коммерческие наборы и протоколы для этих способов.
Пригодные репортерные молекулы или метки включают радионуклиды, ферменты, флуоресцентные, хемилюминесцентные или хромогенные агенты, а также субстраты, кофакторы, ингибиторы, магнитные частицы и т.п. Патенты, в которых описано применение таких меток, включают US-A-3817837; US-A-3850752; US-A-3939350; US-A-3996345; US-A-4277437; US-A-4275149 и US-A-4366241.
Также рекомбинантные иммуноглобулины можно получать, как показано в US-A-4816567.
Слитые белки
Аминокислотную последовательность для применения в рамках настоящего описания можно продуцировать в качестве слитого белка, например, для облегчения экстракции и очистки. Примеры партнеров для слитого белка включают глутатион-S-трансферазу (GST), 6xHis, GAL4 (ДНК-связывающие домены и/или домены активации транскрипции) и β-галактозидазу. Может быть удобным включение участка протеолитического расщепления между партнером для слитого белка и представляющей интерес белковой последовательностью, чтобы обеспечить удаление последовательностей слитого белка.
Как правило, слитый белок не препятствует активности белковой последовательности.
Системы экспрессии слитых генов в E. coli рассмотрены в Curr Opin Biotechnol (1995) 6(5):501-6.
В другом варианте осуществления аминокислотная последовательность может быть лигирована с гетерологичной последовательностью, чтобы она кодировала слитый белок. Например, для скрининга пептидных библиотек в отношении средств, способных влиять на активность вещества, может быть пригодным кодирование химерного вещества, экспрессирующего гетерологичный эпитоп, который распознается коммерчески доступным антителом.
Кроме того, настоящее изобретение описано с помощью следующих неограничивающих примеров.
ПРИМЕРЫ
При применении на практике настоящего изобретения будут использоваться, если нет иных указаний, общепринятые способы химии, молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые входят в пределы способностей специалиста в данной области. Такие способы пояснены в литературе. См., например, J. Sambrook, E. F. Fritsch, and T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Col d Spring Harbor Laboratory Press; Ausubel, F. M. et al. (1995 and periodic supplements; Current Protocols in Molecular Biology, ch. 9, 13, and 16, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O’D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press; and E. M. Shevach and W. Strober, 1992 and periodic supplements, Current Protocols in Immunology, John Wiley & Sons, New York, NY. Каждый из этих общих справочников включен в настоящее описание в качестве ссылки.
Материалы и способы
ФЛАГЕЛЛИНЫ РОДА ROSEBURIA
Разнообразие флагеллинов
Флагеллины из бактерий рода Roseburia, в частности, Roseburia hominis и Roseburia intestinalis, были клонированы, экспрессированы, очищены и проанализированы.
На фиг.B1A и B1B представлен SDS-анализ рекомбинантных флагеллинов.
Номенклатура белков-флагеллинов:
Род Roseburia
Вид Roseburia
Roseburia hominis
FlaA1 Roseburia hominis (его также обозначают в настоящем описании как RhFlaA1 или Rh1)
FlaA2 Roseburia hominis (его также обозначают в настоящем описании как RhFlaA2 или Rh2)
Roseburia intestinalis
FlaA1 Roseburia intestinalis (его также обозначают в настоящем описании как RiFlaA1, или Ri1, или RI1)
FlaA2 Roseburia intestinalis (его также обозначают в настоящем описании как RiFlaA2, или Ri2, или RI2)
FlaA3 Roseburia intestinalis (его также обозначают в настоящем описании как RiFlaA3, или Ri3, или RI3)
FlaA4 Roseburia intestinalis (его также обозначают в настоящем описании как RiFlaA1, или Ri4, или RI4)
См.:
ELY, B., ELY, T.W., CRYMES, W.B.,JR and MINNICH, S.A., 2000. A family of six flagellin genes contributes to the Caulobacter crescentus flagellar filament. Journal of Bacteriology, 182(17), pp. 5001-5004.
IBRAHIM, G.F., FLEET, G.H., LYONS, M.J. and WALKER, R.A., 1985. Method for the isolation of highly purified Salmonella flagellins. Journal of clinical microbiology, 22(6), pp. 1040-1044.
NEVILLE, B.A., FORDE, B.M., CLAESSON, M.J., DARBY, T., COGHLAN, A., NALLY, K., ROSS, R.P. and O'TOOLE, P.W., 2012. Characterization of pro-inflammatory flagellin proteins produced by Lactobacillus ruminis and related motile Lactobacilli. PloS one, 7(7), pp. e40592.
NG, S.Y., CHABAN, B. and JARRELL, K.F., 2006. Archaeal flagella, bacterial flagella and type IV pili: a comparison of genes and posttranslational modifications. Journal of Molecular Microbiology and Biotechnology, 11(3-5), pp. 167-191.
WATSON, R.O. and GALAN, J.E., 2005. Signal transduction in Campylobacter jejuni-induced cytokine production. Cellular microbiology, 7(5), pp. 655-665.
Условия выращивания бактерий
R. hominis A2-183T (=DSM 16839T=NCIMB 14029T) выращивали в анаэробных условиях при 37°C в среде YCFA. Культуру осаждали центрифугированием и осадок ресуспендировали в одном мл среды YCFA, дополненной 2% цистеином (масс./об., Sigma-Aldrich) и 3% аскорбиновой кислотой (масс./об., Sigma-Aldrich).
R. intestinalis L1-82T (=DSM 14610T=NCIMB 13810T) выращивали в анаэробных условиях при 37°C в среде YCFA. Культуру осаждали центрифугированием и осадок ресуспендировали в одном мл среды YCFA, дополненной 2% цистеином (масс./об., Sigma-Aldrich) и 3% аскорбиновой кислотой (масс./об., Sigma-Aldrich).
Мыши
C3H/HeN и C57Bl/6 приобретали от Harlan Laboratories. GF C3H/HeN были предоставлены из и содержались в гнотобиотическом виварии для грызунов INRA в Jouy-en-Josas (ANAXEM plateform, Institut Micalis, INRA, Jouy-en-Josas, France). GF TLR5KO и C57Bl/6 дикого типа были предоставлены Andrew Gewirtz (Center for Inflammation, Immunity, and Infection and Department of Biology, Georgia State University, Atlanta, GA 30303, USA) и их содержали в гнотобиотическом виварии для грызунов INRA в Jouy-en-Josas. Обычные TLR5KO и BOY/J дикого типа были предоставлены Adam Cunningham (MRC Centre for Immune Regulation, Institute of Microbiology and Infection, Division of Immunity and Infection University of Birmingham UK). Организация и методики эксперимента были одобрены соответствующими местными комитетами этической экспертизы.
Эксперименты на животных
Эксперименты на безмикробных животных проводили в гнотобиотическом виварии для грызунов INRA в Jouy-en-Josas (ANAXEM plateform, Institut Micalis, INRA, Jouy-en-Josas, France). Самцов мышей GF C3H/HeN распределяли на контрольную группу (N=8) и группу введения (N=10) и содержали по отдельности в пластмассовых изоляторах. На 0, 1 и 2 сутки животным в группе введения вводили 100 мкл культуры R. hominis через зонд, в то время как контрольным животным вводили 100 мкл среды YCFA. Подвздошную кишку, восходящую ободочную кишку и слепую кишку извлекали на 14 сутки и 28 сутки.
Шести самцам мышей GF C3H/HeN вводили E. coli MG1655 (K12), как описано выше, и по трое животных умерщвляли на 10 сутки и 22 сутки, чтобы получить N=3. Трем мышам GF TLR5KO и трем мышам C57Bl/6 WT инокулировали культуру R. hominis, как описано выше, для оценки функциональной важности флагеллинов R. hominis. Через 28 суток этих животных умерщвляли вместе с их соответствующими животными GF. Двадцати двум самкам мышей C57BL/6 вводили каждые сутки 50 мкл 109 к.о.е. R. hominis в течение 14 суток. Контрольным животным вводили только культуральную среду. Начиная с 8 суток, мышам давали DSS (ММ 50 кДа, 30 г/л) в их питьевой воде в течение 6 суток. Животных умерщвляли на 14 сутки и проводили взятие образцов тканей, как описано выше.
Эксперименты с культурой тканей
Клетки Caco-2 (клетки эпителиальной колоректальной аденокарциномы Homo sapiens) и HT29 (колоректальная аденокарцинома Homo sapiens) выращивали в планшетах в анаэробной рабочей станции. Культуру R. hominis A2-183 или R. intestinalis L1-82T собирали на экспоненциальной фазе и в экспериментальные лунки добавляли 100 мкл бактериальной суспензии (108 к.о.е./мл). Бактериальные (не прикрепляющиеся и прикрепляющиеся) и эукариотические клетки (Caco-2 и HT-29) собирали после инкубации в течение 2 ч и 4 ч и хранили в RNAlater. Для экспериментов по культивированию тканей с рекомбинантными флагеллинами, 5x104 клеток Caco-2 выращивали в 24-ячеечных планшетах при 37°C в 75% увлажненной атмосфере с 5% CO2. Клетки достигали смыкания монослоя на 5-6 сутки и их использовали через трое суток после смыкания монослоя. Клетки инкубировали с рекомбинантными флагеллинами в конечной концентрации 100 нг/мкл в течение 2 ч при 37ºC в 75% увлажненной атмосфере с 5% CO2.
Анализ FISH
Анализы FISH проводили на фиксированных нейтрально забуференным формалином срезах тканей кишечника с использованием общего бактериального зонда Eub338 и вновь сконструированного специфического для R. hominis A2-183 зонда и специфического для R. intestinalis L1-82T зонда.
Конструирование библиотеки R. hominis
Хромосомную ДНК R. hominis для конструирования библиотеки малого размера и пиросеквенирования выделяли с использованием набора UltraClean™ Microbial DNA Isolation Kit (Mo Bio Laboratories Inc) и высокомолекулярную ДНК для фосмидных библиотек выделяли с использованием набора Wizard Genomic DNA Purification kit (Promega).
Анализы на микрочипах
Бактериальный микрочип
Бактериальную РНК выделяли из содержимого слепой кишки мышей и далее обрабатывали с использованием коммерческих наборов в соответствии с рекомендациями изготовителя. Продукты ПЦР, амплифицированные с 6000 клонов библиотеки плазмид R. hominis в E. coli, наносили в двух экземплярах на покрытые аминосиланом предметные стекла (Corning) с использованием MicroGrid II TAS (BioRobotics).
Анализ мышей на микрочипах
Тотальную РНК экстрагировали из ткани подвздошной кишки и восходящей ободочной кишки, преобразовывали в меченную биотином c-РНК/a-РНК (в зависимости от используемого набора Affymetrix), и гибридизовали с чипами GeneChip NuGO Mouse Array и GeneChip Mouse Genome Array (Affymetrix) с использованием стандартных способов. Анализ данных проводили с использованием пакетов программ R (http://www.r-project.org) и Bioconductor (http://www.bioconductor.org).
Анализ способом ОТ-ПЦР
Праймеры, специфические для R. hominis, 5’-CCCACTGACAGAGTATGTAATGTAC-3’ и 5’-GCACCACCTGTCACCAC-3’ использовали для анализа способом ПЦР образцов фекалий для подтверждения уровней колонизации кишечника. Анализ ПЦР в реальном времени проводили с использованием системы 7500 Fast Real-Time PCR System (Applied Biosystems) с использованием основной смеси Power SYBR Green PCR Master Mix (Applied Biosystems). Все образцы анализировали в трех экземплярах. В качестве эталонного гена для нормализации использовали GyrA. Для экспрессии гена в хозяине тотальную эукариотическую РНК, выделенную из подвздошной кишки и восходящей ободочной кишки, подвергали обратной транскрипции в кДНК с использованием набора High Capacity cDNA Reverse Transcription Kit (Applied Biosystems). Анализ ПЦР в реальном времени проводили с использованием системы 7500 Fast Real-Time PCR System (Applied Biosystems) с набором QuantiFast SYBR Green PCR Kit (Qiagen) и QuantiTect Primer Assays (Qiagen). Все образцы анализировали в трех экземплярах. В качестве эталонного гена для нормализации был выбран hprt. Все данные ОТ-ПЦР анализировали в логарифмическом масштабе с основанием 2 с использованием одностороннего ANOVA с порогом значимости P<0,05. Отличия обратно преобразовывали для вычисления кратности изменений.
Вестерн-блоттинг
Подвергнутые иммунной очистки поликлональные антитела кролика против FlaA1 и FlaA2 Roseburia hominis получали, как описано в Duck et al. (Duck et al. 2007). Для вестерн-блоттинга R. hominis выращивали в присутствии различных количеств (от 0,01 г до 1 г корма/10 мл культуры) УФ-облученного стандартного корма для мышей в течение 3 часов, фильтровали для удаления компонентов корма и разбавляли буфером laemmli, содержавшим 8M мочевину. Образцы наносили на гель NuPAGE® Novex® 4-12% Bis-Tris (Invitrogen) и подвергали электрофорезу, а затем обрабатывали с использованием системы WesternBreeze Chromogenic Immunodetection System (Invitrogen). Антитела против FlaA1 и FlaA2 использовали в разведении 1:1000 и антитело против ДНК-гиразы A (Abcam) в качестве нагрузочного контроля использовали в разведении 1:300, после которых использовали конъюгированное с щелочной фосфатазой антитело против антител кролика. Обнаружение проводили по развитию окраски субстрата относительно развития окраски нагрузочного контроля.
Иммунофлуоресценция
Иммунную локализацию флагеллина R. hominis исследовали в содержимом ободочной кишки мышей с использованием специфических антисывороток, индуцированных против определенных пептидных последовательностей как из белка флагеллина FlaA1, так и из белка флагеллина FlaA2. Мазки содержимого кишечника фиксировали в предварительно охлажденном метаноле, инкубировали с антисыворотками кролика против FlaA1 или против FlaA2 (CovaLabs) при 4°C в течение ночи и визуализировали с использованием антител осла против антител кролика с Alexa 488 (Molecular Probes).
T-клеточные маркеры исследовали на последовательных криосрезах толщиной 8 мкм. Фиксированные срезы ткани инкубировали с первичными антителами Ly6G-FITC, CD3-FITC, CD11b-FITC (BD Biosciences) с двойным мечением FoxP3 (Abcam), и CD3-FITC (BD Biosciences) или изоспецифическим IgG. Срезы подвергали контрастному окрашиванию посредством DAPI и заливали Vectashield (Vector Laboratories). Для количественного определения положительных клеток исследовали минимум пять полей зрения для каждого среза мыши.
Клонирование и очистка рекомбинантных флагеллинов
Гены флагеллинов выделяли из жидких бактериальных культур R. hominis, R. intestinalis, S. typhimurium, S. enteritidis, Eubacterium rectale 33656 и E. coli K12 посредством амплификации способом ПЦР и очистки. Клетки Caco-2 инкубировали с рекомбинантными флагеллинами при конечной концентрации 100 нг/мкл в течение 2 ч при 37°C в 75% увлажненной атмосфере из 5% CO2.
Выделение клеток тонкого кишечника и клеток MLN
Клетки выделяли из тонкого кишечника и брыжеечного лимфатического узла, как описано ранее, с незначительными модификациями (Monteleone et al. 2008). В кратком изложении, суспензии клеток инкубировали с 100 Е/мл коллагеназы VIII (Sigma-Aldrich) в RPMI, дополненной 20% FBS, при 37oC в течение 20 мин (брыжеечные лимфатические узлы) или 1 часа (фрагменты тонкого кишечника). Затем суспензии единичных клеток анализировали проточной цитометрией (как описано).
Получение происходящих из костного мозга дендритных клеток и культур
Костный мозг извлекали из бедренной и большеберцовой кости мышей C3H/HeN и C57Bl6. Для полученных с помощью GMCSF дендритных клеток клетки костного мозга ресуспендировали при 1x106/мл в RPMI, дополненной 10% FCS и 20 нг/мл rmGM-CSF и высевали в количестве 10 мл/планшет в 100-мм2 планшетах для культивирования тканей. После культивирования в течение трех суток неплотно прикрепившиеся клетки собирали и пересевали в среду, дополненную GM-CSF, в количестве 1x106/мл в 12-луночных планшетах для культивирования тканей. На 5 сутки клетки стимулировали 100 нг/мл флагеллинов, а затем на 6 сутки собирали. Для полученных с помощью Flt3L дендритных клеток, клетки костного мозга ресуспендировали в количестве 2x106/мл в RPMI, дополненной 10% FCS и 200 нг/мл rmFlt3, и высевали в количестве 2 мл/лунка в 12-луночные планшеты для культивирования тканей. Клетки культивировали в течение 10 суток причем в каждую лунку добавляли среду, дополненную Flt3, на 4 сутки. На 9 сутки клетки стимулировали посредством 100 нг/мл флагеллинов, а затем собирали на 10 сутки и анализировали проточной цитометрией.
Проточная цитометрия
Суспензии единичных клеток собственной пластинки и дендритных клеток инкубировали в блокирующем буфере (содержавшем сыворотку и антитело против CD16/CD32) при 4oC в течение 15 мин, а затем окрашивали специфическими конъюгированными с флуорохромом антителами. Клетки собственной пластинки метили антителами к белкам мыши: CD4-FITC и CD25-APC (eBioscience), CD8-APC-Cy7 и CD3-PerCP (Biolegend), и B220-BV570 (BD Biosciences). Внутриклеточное мечение FoxP3 проводили после внеклеточного окрашивания и фиксации/увеличения проницаемости клеток в соответствии с инструкциями изготовителя (eBioscience). Полученные с помощью GMCSF дендритные клетки метили антителами CD11c-PE-Cy7, CD11-PerCP Cy5, I-A/I-E -APC-Cy7, CD80-PE, CD86-APC, CD8-FITC, B220-BV570. Полученные с помощью Flt3 дендритные клетки метили посредством CD11c-PE-Cy7-, CD11b- или Siglec-H-PerCP Cy5-, I-A/I-E -APC-Cy7, CD317 -PE, CD40-APC, CD103-FITC, B220-BV570. Клетки анализировали с использованием программного обеспечения FACSArria (BD Biosciences) и FlowJo версии 7.2.5.
Цитометрическая гранульная матрица (CBA)
Клетки костного мозга выделяли из бедренной и большеберцовой кости мышей C3H/HeN и C57Bl/6 с использованием среды RPMI и увеличивали в количестве с помощью Flt3L, как описано выше. Клетки стимулировали 100 нг/мл флагеллина (например флагеллин Roseburia) после культивирования в течение 9 суток, и супернатант собирали на 10 сутки. Эксперимент проводили три раза для получения N=3.
Анализ CBA проводили на клеточных супернатантах с использованием набора Cytometric Bead Array Mouse Enhanced Sensitivity Master Buffer Kit (BD Biosciences). Стандарты и образцы наносили в 96-луночный планшет для измерения в FACSArray (BD Biosciences). Результаты анализировали с использованием программного обеспечения BD FCAP (BD Biosciences).
Гистология
Образцы ткани восходящей ободочной кишки фиксировали в нейтрально-забуференном формалине (Sigma), заключенном в смолу холодного отверждения, и 4-мкм срезы тканей окрашивали с использованием стаднартных способов гематоксилина/эозина. Область полного поперечного сечения ободочной кишки каждого животного визуализировали при увеличении x200 на микроскопе Zeiss Axioskop с использованием камеры QImaging, контролируемой программным обеспечением Image Pro Plus. Затем каждое поле зрения оценивали в диапазоне 0-4 согласно способу на основе Berg et al. (Berg et al. 1996). Средний процент полей зрения с данной степенью вычисляли и группы введения сравнивали с использованием t-критерия Стьюдента.
Следующие детальные протоколы описаны в дополнительных материалах и способах.
Дополнительная информация (SI). Материалы и способы
Условия роста бактерий
R. hominis A2-183T (=DSM 16839T=NCIMB 14029T) выращивали в анаэробных условиях на синтетической среде YCFA или комплексной среде M2GSC. Культуру инокулировали из замороженного исходного раствора в пробирки Hungate и инкубировали в течение ночи при 37°C. Затем бактерии выращивали на чашках с агаром M2GSC в течение 48 ч в анаэробной рабочей станции MACS-MG-1000 (Don Whitley Scientific) при 80% N2, 10% CO2, и 10% H2 при 37°C. Эффект муцина исследовали посредством добавления 0,5% (масс./об.) муцина типа III из желудка свиньи (Sigma-Aldrich) в среду YCFA.
Для колонизации безмикробных (GF) мышей R. hominis выращивали в среде YCFA в течение ночи при 37°C. Культуру осаждали центрифугированием и осадок ресуспендировали в одном мл среды YCFA, дополненной 2% цистеином (масс./об., Sigma-Aldrich) и 3% аскорбиновой кислотой (масс./об., Sigma-Aldrich).
Мыши
C3H/HeN и C57Bl/6 приобретали от Harlan Laboratories. Мышей содержали в изоляторах из гибкого пленочного материала с фильтрацией HEPA (Bell Isolation Systems) в University of Aberdeen. GF C3H/HeN были предоставлены из и содержались в гнотобиотическом виварии для грызунов INRA в Jouy-en-Josas (ANAXEM plateform, Institut Micalis, INRA, Jouy-en-Josas, France). Без микробные TLR5KO и C57Bl/6 дикого типа были предоставлены Andrew Gewirtz (Center for Inflammation, Immunity, and Infection and Department of Biology, Georgia State University, Atlanta, GA 30303, USA) и их содержали в гнотобиотическом виварии для грызунов INRA в Jouy-en-Josas. Организация и методики эксперимента были одобрены соответствующими местными комитетами этической экспертизы.
Эксперименты на животных
Восемнадцать самцов мышей GF C3H/HeN распределяли в группу контроля (N=8) и введения (N=10) и содержали по отдельности в пластмассовых изоляторах в пластмассовых изоляторах. Мышей кормили без ограничений стерилизованным коммерческим кормом (R03-40; UAR). На 0, 1 и 2 сутки животным в группе введения вводили 100 мкл культуры R. hominis через зонд, в то время как контрольным животным вводили 100 мкл среды YCFA. На 14 сутки и 28 сутки, четырех контрольных животных и пять животных, которым вводили R. hominis, умерщвляли. Подвздошную кишку и восходящую ободочную кишку разделяли на четыре разных части и переносили в RNAlater (Ambion), нейтрально забуференный формалин (NBF; Sigma-Aldrich) или жидкий азот. Всю слепую кишку переносили в RNAlater.
Чтобы продемонстрировать специфичность ответа на R. hominis, шести самцам мышей GF C3H/HeN вводили E. coli MG1655 (K12), и трех животных умерщвляли на 10 сутки и 22 сутки, как описано выше, с получением N=3.
Трем мышам GF TLR5KO и трем мышам C57Bl/6 WT инокулировали культуру R. hominis, как описано выше, для оценки функциональной значимости флагеллинов R. hominis. Через 28 суток этих животных умерщвляли вместе с соответствующими им мышами GF.
Двадцать две самки мышей C57BL/6 (в возрасте 6 недель) использовали для оценки терапевтического эффекта R. hominis в процессе индуцируемого DSS колита. После периода акклиматизации 7-10 суток мышам вводили 50 мкл 109 к.о.е. R. hominis в течение 14 суток. Контрольным животным вводили только культуральную среду. Начиная с 8 суток, мышам вводили DSS (ММ 50 кДа, 30 г/л) в их питьевой воде в течение 6 суток. Животных умерщвляли на 14 сутки и проводили взятие образцов тканей, как описано выше.
Эксперименты с культурой тканей
Все реагенты для культивирования клеток, если нет иных указаний, были предоставлены Sigma-Aldrich. Для этих экспериментов с культивированием в анаэробных условиях 2x105 клеток Caco-2 или HT29 в 1,5 мл среды DMEM (высокое содержание глюкозы, HEPES), дополненной инактивированной нагреванием эмбриональной телячьей сывороткой (Gibco), пенициллином, стрептомицином, амфотерицином B и L-глутамином, высевали в верхние отделения шестиячеечного планшета Transwell (Corning). Нижние отделения содержали 3,0 мл той же среды. Клетки инкубировали при 37°C в атмосфере с 5% CO2 в течение трех суток после смыкания монослоя, промывали раствором Хэнкса для удаления антибиотиков и FCS и опускали в DMEM, дополненную L-глутамином, селенитом натрия и трансферрином, на 24 ч без антибиотиков. Затем вставки планшетов Transwell переносили в бокс для анаэробного культивирования в анаэробной рабочей станции при 37°C. Верхнее отделение каждого вкладыша было заполнено анаэробной клеточной средой DMEM, в то время как нижнее отделение было заполнено оксигенированной DMEM.
Культуру R. hominis A2-183 собирали на экспоненциальной фазе посредством центрифугирования при 3500x g в течение 5 мин. Осадок промывали и ресуспендировали в 0,8 мл анаэробной DMEM. Сто микролитров бактериальной суспензии (108 CFU/мл) добавляли в экспериментальные лунки. В контрольные лунки добавляли то же количество среды без бактериальных клеток. Дополнительные контроли включали бактериальные клетки, инкубированные без клеток Caco-2 или HT29. Бактериальные и эукариотические клетки собирали через 2 ч и 4 ч после инкубации. Как не прикрепившиеся, так и прикрепившиеся, бактерии аспирировали в RNAlater (Ambion). Жизнеспособность клеток R. hominis исследовали посредством посева на планшеты с YCFA. Клетки Caco-2 или клетки HT-29 собирали из лунок и также хранили в RNAlater.
Культуру R. intestinalis L1-82T (=DSM 14610T=NCIMB 13810T) собирали на экспоненциальной фазе посредством центрифугирования при 3500x g в течение 5 мин. Осадок промывали и ресуспендировали в 0,8 мл анаэробной DMEM. В экспериментальные лунки добавляли сто микролитров бактериальной суспензии (108 к.о.е./мл). В контрольные лунки добавляли то же количество среды без бактериальных клеток. Дополнительные контроли включали бактериальные клетки, инкубированные без клеток Caco-2 или HT29. Бактериальные и эукариотические клетки собирали после инкубации в течение 2 ч и 4 ч. Как не прикрепившиеся, так и прикрепившиеся, бактерии аспирировали и хранили в RNAlater (Ambion). Жизнеспособность клеток R. intestinalis исследовали посредством посева на планшеты с YCFA. Клетки Caco-2 или клетки HT-29 собирали из лунок и также хранили в RNAlater.
Для экспериментов по культивированию тканей с рекомбинантными флагеллинами, 5x104 клеток Caco-2 высевали в 24-луночные планшеты в среду DMEM (высокое содержание глюкозы, HEPES), дополненную инактивированной нагреванием эмбриональной телячьей сывороткой (Gibco), пенициллином, стрептомицином, амфотерицином B и L-глутамином при 37°C в 75% увлажненной атмосфере с 5% CO2. Клетки достигали смыкания монослоя на 5-6 сутки и их использовали через 3 суток после смыкания монослоя. Перед какой-либо обработкой клетки промывали два раза сбалансированным солевым раствором Хэнкса и держали в DMEM, дополненной L-глутамином, селеном и трансферрином, в течение 24 часов.
Конструирование библиотеки R. hominis
Хромосомную ДНК R. hominis малого размера и пиросеквенирования выделяли с использованием набора UltraClean™ Microbial DNA Isolation Kit (Mo Bio Laboratories Inc) и высокомолекулярную ДНК для фосмидных библиотек выделяли с использованием набора Wizard Genomic DNA Purification Kit (Promega). Целостность ДНК подтверждали гель-электрофорезом.
ДНК механически расщепляли с использованием Nebulizer Kit (Invitrogen) и фракционировали гель-электрофорезом. Фрагменты ДНК желаемого размера вырезали из геля и очищали с использованием Wizard® SV Gel и PCR Clean-Up System (Promega). Репарацию концов провдили с использованием набора DNA Terminator End Repair Kit (Lucigen). Фрагменты размером 1,5-3,5 т.п.н. клонировали с использованием набора CloneSmart® LCAmp Kit (Lucigen) и библиотеку размером 4-8 т.п.н. конструировали с использованием pJAZZO®-C Vector (Lucigen). Фосмидные библиотеки конструировали с использованием набора CopyControl™ Fosmid Library Production Kit (Epicentre Biotechnologies). Колонии отбирали с использованием автоматизированного устройства для сбора колоний (BioRobotics BioPick, Genomic Solutions) и сохраняли в 384-луночных микропланшетах для титрования, содержавших 70 мкл 2x среды LB, дополненной 10% глицерином и соответствующим антибиотиком. Клетки выращивали в течение ночи при 37ºC при встряхивании и хранили при -80ºC.
Секвенирование, сборка и аннотирование
Матрицы для секвенирования библиотек малого размера получали способом ПЦР с использованием одного мкл биомассы клонов и праймеров SL1 и SR2, окружающих участок клонирования pSMART-LCAmp. Продукты ПЦР очищали с использованием фильтрационных планшетов Multiscreen PCR Clean-up filter plates (Millipore). Рекомбинантную ДНК из клонов pJAZZ®-OC выделяли с использованием системы для очистки плазмидной ДНК Wizard® SV 96 (Promega). Фосмидную ДНК выделяли с использованием набора для очистки ДНК FosmidMAX™ (Epicentre). Данные концевого считывания фрагментов ДНК из библиотек R. hominis WGS с различными размерами вставок получали с использованием ДНК-секвенаторов CEQ8000 (Beckman Coulter) и ABI 3770 (Applied Biosystems). Геномную ДНК из R. hominis также секвенировали с использованием секвенаторов 454 GS20 (454 Life Sciences) и 454 FLX (Roche). Данные секвенирования по методу Сэнгера и данные секвенирования с использованием 454 получали с помощью MIRA версии 3 (http://chevreux.org/projects_mira.html; (1)). Информационный канал для аннотирования RAST (http://rast.nmpdr.org; (2)) использовали для автоматизированного и ручного аннотирования генома и для сравнительных геномных анализов. Аннотированная геномная последовательность R. hominis A2-183 была представлена в GenBank под номером доступа CP003040.
Анализ на микрочипах
Бактериальный микрочип
Бактериальную РНК выделяли из содержимого слепой кишки мышей с использованием набора RNeasy Mini Kit (Qiagen), и далее обрабатывали с использованием набора MICROBEnrich™ Kit (Ambion), набора MICROBExpress™ Bacterial mRNA Enrichment Kit (Ambion) и набора MessageAmp™ II-Bacteria RNA Amplification Kit (Applied Biosystems). РНК метили либо dCTP-Cy3, либо dCTP-Cy5 в процессе синтеза кДНК (набор CyScribe First Strand cDNA Labelling Kit; Amersham). Меченные продукты очищали с использованием набора для очистки CyScribe GFX Purification Kit (Amersham). Продукты ПЦР, амплифицированные с 6000 клонов библиотеки плазмид R. hominis RA8 в E. coli, наносили в двух экземплярах на покрытые аминосиланом предметные стекла (Corning) с использованием a MicroGrid II TAS (BioRobotics). Амплифицированные фрагменты генов домашнего хозяйства rpoD и gyrA случайным образом распределяли на матрицы в качестве контролей. Гибридизацию микрочипов проводили на станции для гибридизации GeneTAC (Genomic Solutions). Краситель для мечения заменяли для второй гибридизации, и отдельно очищенную РНК также метили и гибридизовали два раза, чтобы убедиться в воспроизводимости и получить статистически значимые результаты. Всего четыре предметных стекла подвергали гибридизации для каждого сравнения всего с 12 точками гибридизации на амплифицированный клон. Флуоресценцию измеряли в двух каналах с использованием GeneTAC LS IV (Genomic Solutions) с использованием программного обеспечения GeneTac Integrator версии 3.0.1. Интенсивность пятен подвергали логарифмическому преобразованию и использовали нормализацию Loess для устранений отличий в мечении зонда и эффективности гибридизации. Одновыборочный t-критерий использовали для величин лолгарифмического соотношения для исследования дифференциальной экспрессии. Данные считали значимыми, когда кратность изменения >2 и P<0,05.
Анализ мышей на микрочипах
Ткань подвздошной кишки и восходящей ободочной кишки извлекали из RNAlater и лизировали в Trizol (Invitrogen). РНК выделяли с использованием стандартных стадий с хлороформом/изопропанолом. Тотальную РНК далее очищали с использованием набора RNeasy Kit (Qiagen), включая стадию расщепления свободной от РНК-аз ДНК-азы I (Qiagen). Целостность РНК определяли с использованием Agilent 2100 Bioanalyzer (Agilent Technologies). Тотальную РНК преобразовывали в меченную биотином кДНК с использованием набора One-Cycle Target Labeling Kit (Affymetrix) или меченной биотином a-РНК с использованием набора 3' IVT Express Kit (Affymetrix). Гибридизацию с GeneChip NuGO Mouse Array и GeneChip Mouse Genome Array (Affymetrix) на GeneChip Fluidics Station 450 (Affymetrix) проводили в Institute of Medical Sciences Microarray Core Facility (University of Aberdeen, UK). Чипы сканировали с использованием Affymetrix GeneChip Scanner 3000 (Affymetrix). Анализ качества изображений проводили с использованием программного обеспечения Gene Chip Operating Software (GCOS) (Affymetrix). Следующий анализ данных проводили с использованием свободно доступных пакетов программ R (http://www.r-project.org) и Bioconductor (http://www.bioconductor.org). Модерируемый F-критерий, предоставляемый пакетом программ limma от Bioconductor, использовали для исследования дифференциальной экспрессии. Данные считали значимыми при P<0,05 с использованием способа определения ложноположительных результатов Benjamini и Hochberg. Статистический анализ проводили по отдельности для каждого из двух моментов времени. Все дифференциально экспрессируемые гены (P<0,05) импортировали в аналитическое программное обеспечение MetaCore (GeneGo, St Joseph, MI) для получения карт каскадов. Интегрированный анализ усиления каскадов проводили с использованием основанных на знаниях канонических каскадов и эндогенных метаболических каскадов. Ранжирование соответствующих интегрированных каскадов было основано на значениях P, вычисленных с использованием гипергеометрического распределения. Значения P соответствовали вероятности данного ряда генов из списка ввода, что они соответствуют определенному ряду генов в карте случайным образом, рассматривая ряды генов в эксперименте против рядов генов в карте в полном наборе генов на картах.
Функциональную интерпретацию данных на основе онтологии генов (GO) проводили с использованием DAVID (http://david.abcc.ncifcrf.gov), расширенной версии оригинальной доступной через Интернет программы (3). Значимо отличающиеся транскрипты (P<0,05) относили к категории GO "Биологический процесс" для выявления профилей экспрессии генов, значительно усиленных для определенных условий GO.
Данные микрочипов предоставляли в Gene Expression Omnibus в National Center for Biotechnology Information (NCBI) (номер доступа GSE25544; http://www.ncbi.nlm.nih.gov/geo).
Анализ способом ОТ-ПЦР
Праймеры, специфические для R. hominis, 5’-CCCACTGACAGAGTATGTAATGTAC-3’ и 5’-GCACCACCTGTCACCAC-3’ использовали для полуколичественного анализа и анализа способом ПЦР в реальном времени образцов фекалий для подтверждения уровней колонизации кишечника. Кроме того, праймеры для ПЦР для бактерий конструировали с использованием доступного через Интернет инструмента Primer3Plus (4) и приобретали от Sigma-Aldrich. Анализ способом ПЦР в реальном времени проводили с использованием системы 7500 Fast Real-Time PCR System (Applied Biosystems) со смесью Power SYBR Green PCR Master Mix (Applied Biosystems). ПЦР проводили следующим образом: один цикл при 95°C в течение 10 мин, а затем 40 циклов при 95°C в течение 15 с и 60°C в течение 1 мин, завершая стадией диссоциации. Все образцы анализировали в трех экземплярах. GyrA использовали в качестве эталонного гена для нормализации вследствие его низкого варьирования между образцами.
Для экспрессии генов хозяина, 2 мкг тотальной эукариотической РНК, выделенной из подвздошной кишки и восходящей ободочной кишки, подвергали обратной транскрипции в кДНК с использованием High Capacity cDNA Reverse Транскрипция Kit (Applied Biosystems) со случайными праймерами. Анализ ПЦР в реальном времени проводили с использованием системы 7500 Fast Real-Time PCR System (Applied Biosystems) с набором QuantiFast SYBR Green ПЦР Kit (Qiagen) и QuantiTect Primer Assays (Qiagen). Условия проведения циклов ПЦР были следующими: один цикл при 95°C в течение 5 мин, а затем 40 циклов при 95°C в течение 10 секунд и 60°C в течение 30 секунд, оканчивающихся стадией диссоциации. Все образцы анализировали в трех экземплярах. В качестве эталонного гена для нормализации был выбран hprt, вследствие его низкого варьирования между образцами.
Все данные ОТ-ПЦР анализировали в логарифмическом масштабе с основанием 2 с использованием одностороннего ANOVA с порогом значимости P<0,05. Отличия обратно преобразовывали для вычисления кратности изменений.
Вестерн-блоттинг
Подвергнутые иммунной очистки поликлональные антитела кролика против FlaA1 и FlaA2 Roseburia hominis получали, как описано в Duck et al. (5). В кратком изложении, самок новозеландских белых кроликов иммунизировали синтетическим пептидом в полном адъювант Фрейнда и подвергали усиливающей иммунизации несколько раз. Для Fla1 R. hominis, использовали пептид NH2-CRSQVRGLNKASDNA-CONH2 и пептид NH2-IDGNFTSKKLQVGSLC-COOH, в то время как для R. hominis Fla2 использовали пептид C-AQYNDDAKSVLEILK-COOH и пептид C-GLNKASRNSQDGIS-CONH2. После иммунизации антитела очищали на иммуноаффинной колонке, полученной связыванием пептидов с 1 мл активированных гранул сефарозы.
Для вестерн-блоттинга R. hominis выращивали в присутствии различных количеств (от 0,01 г до 1 г корма/10 мл культуры) УФ-облученного стандартного корма для мышей в течение 3 часов, фильтровали для удаления компонентов корма и разбавляли буфером laemmli, содержавшим 8M мочевину. Тридцать мкл каждого образца наносили в лунки геля NuPAGE® Novex® 4-12% Bis-Tris (Invitrogen) и подвергали электрофорезу, а затем обрабатывали с использованием системы WesternBreeze Chromogenic Immunodetection System (Invitrogen). Антитела против FlaA1 и FlaA2 разбавляли 1:1000 и антитело против ДНК-гиразы A (Abcam) в качестве нагрузочного контроля разбавляли 1:300 в разбавителе для антител и инкубировали в течение ночи при 4°C, а затем 1 ч при комнатной температуре с конъюгированным с щелочной фосфатазой антителом против антител кролика. Обнаружение проводили по развитию окраски субстрата относительно развития окраски нагрузочного контроля.
Анализ FISH
Ткани, фиксированные в нейтрально забуференном формалине, заключали в Technovit 8100 (Heraeus Kulzer). Получали срезы размером два микрометра с использованием ротационного микротома (Leica/Reichert Autocut). Получали три среза на предметное стекло на глубине 100 мкм, 200 мкм и 300 мкм в ткани с получением девяти срезов на животное.
Предметные стекла дегидратировали посредством последовательных инкубаций в 50% (об./об.), 80% и 96% этаноле и сушили при комнатной температуре (RT). Использованные зонды FISH для 16S рРНК представляли собой общий бактериальный зонд Eub338 (GCTGCCTCCCGTAGGAGT; Cy3) и вновь сконструированный специфический зонд A2-183 R. hominis (GTACATTACATACTCTGTCAGTG; FITC), которые тщательно исследовали в отношении специфичности против панели изолятов бактерий кишечника. Десять микролитров зонда (30 нг/мкл) в 100 мкл буфера для гибридизации наносили на дегидратированный образец и инкубировали при специфической для зонда температуре. Предметные стекла промывали в промывочном буфере при 50˚C в течение 30 мин, погружали в ледяную воду для удаления остаточного буфера и сушили потоком сжатого воздуха. Контрастное окрашивание проводили с использованием 4’,6-диамидино-2-фенилиндола(DAPI; Vector Laboratories Inc) и предметные стекла заливали средой для заливки Vectashield для флуоресценции (Vector Laboratories Inc) для предотвращения выцветания. Бактерии визуализировали с использованием флуоресцентного микроскопа Leica DM RBE (Leitz GMBH) и фотографировали с помощью камеры Penguin 600CL (Pixera) и программного обеспечения Viewfinder 3.0 (Studio Lite). Изображения с высоким увеличением (x630) получали с использованием системы Apochromatics (Leica).
Иммунофлуоресценция
Иммунную локализацию флагеллина R. hominis исследовали в содержимом ободочной кишки мышей, колонизированных R. hominis, с использованием специфических антисывороток, индуцированных против определенных пептидных последовательностей как из белка флагеллина FlaA1, так и из белка флагеллина FlaA2. Содержимое кишечника разбавляли в PBS, наносили на предметные стекла и сушили воздухом. Мазки фиксировали в предварительно охлажденном метаноле в течение 5 мин при -20°C, инкубировали с антисыворотками кролика против FlaA1 или против FlaA2 (1:125, CovaLabs) при 4°C в течение ночи и визуализировали с использованием антител осла против антител кролика с Alexa 488 (1:1000, Molecular Probes).
Срезы фиксировали заранее охлажденным метанолом в течение 30 мин при -20ºC. Иммунную локализацию T-клеточных маркеров исследовали на последовательных криостатных срезах (8 мкм). Срезы фиксировали либо заранее охлажденным метанолом в течение 30 мин при -20ºC (Ly6G FITC, CD3 FITC, CD11b FITC, все при 1:50 (BD Biosciences)), либо для FoxP3 с двойным окрашиванием (1:500, Abcam) CD3 FITC (1:100, BD Biosciences)), фиксировали 1% параформальдегидом (PFA) в течение 2 мин при RT, а затем в течение 3 мин в 0,01% Triton X в PBS. Все срезы блокировали 10% BSA (Sigma), содержавшим 10% соответствующие доиммунные сыворотки в PBS (pH 7,4). Фиксированные метанолом ткани инкубировали с первичными антителами в течение 1 ч при RT. Фиксированные PFA срезы инкубировали с антителами в течение ночи при 4°C. FoxP3 визуализировали с использованием антител козы против антител кролика Alexa 594 (1:1000, Molecular Probes). Срезы подвергали контрастному мечению посредством DAPI и заливали Vectashield (Vector Laboratories). Для количественного определения положительных клеток исследовали минимум пять полей зрения для каждого среза мыши с использованием программного обеспечения и настроек микроскопа, описанных выше.
Гистология
Образцы ткани восходящей ободочной кишки фиксировали в нейтрально-забуференном формалине (Sigma) при комнатной температуре при постоянном встряхивании. Образцы ополаскивали PBS, а затем переносили в 70% этанол и хранили при комнатной температуре, а затем ориентировали для получения поперечных срезов и погружали в смолу холодного отверждения с использованием Technovit 8100 (Heraeus Kulzer) в соответствии с инструкциями изготовителя. Залитую ткань помещали на Histoblocs с использованием Technovit 3040 (Heraeus Kulzer). Срезы размером четыре микрометра нарезали с использованием ротационного микротома (Leica Autocut), оборудованного стеклянным ножом (TAAB Laboratories Equipment Ltd.). Срезы тканей окрашивали с использованием стандартных способов с гематоксилином/эозином. Область полного поперечного сечения восходящей ободочной кишки каждого животного визуализировали при увеличении x200 на микроскопе Zeiss Axioskop с использованием камеры QImaging, контролируемой программным обеспечением Image Pro Plus. Затем каждое поле зрение оценивали в диапазоне 0-4 согласно способу на основе Berg et al. (6). Показатели гистопатологии составляли 0 = мелкие крипты, отсутствие или мало инфильтрирующих клеток, интактный эпителий, бокаловидные клетки выглядят заполненными муцином (без патологии); 1 = крипты могут проявлять небольшую гиперплазию эпителиальных клеток, между криптами могут наблюдаться некоторые диффузные инфильтрирующие воспалительные клетки, эпителий просвета выглядит интактным, бокаловидные клетки могут выглядеть несколько обедненными муцином; 2 = крипты выглядят более глубокими с отчетливыми признаками гиперплазии эпителия, обеднения бокаловидных клеток муцином, явными инфильтрирующими воспалительными клетками, которые могут быть многоочаговыми по своей природе, хотя инфильтраты не наблюдаются в подслизистой оболочке; 3 = очаги повреждения вовлекают площадь слизистой оболочки большего размера и /или являются боле частыми, чем наблюдается при степени 2. Очаги повреждения не вовлекают подслизистую оболочку. Эпителиальные клетки просвета проявляют небольшие эрозии. Очаги повреждения не являются трансмуральными; 4 = Эпителий крипт выглядит разрушенным. Могут присутствовать абсцессы. Клетки эпителия просвета выглядят нерегулярными, иногда полностью утрачиваются. Наблюдают трансмуральный инфильтрат, часто ассоциированный с полной утратой эпителиальных клеток в просвет.
Средний процент полей зрения с данной степенью вычисляли и группы введения сравнивали с использованием t-критерия Стьюдента.
Клонирование и очистка рекомбинантных флагеллинов
Гены флагеллинов выделяли из жидких бактериальных культур R. hominis, R. intestinalis, S. typhimurium, S. enteritidis, Eubacterium rectale 33656 и E. coli K12 посредством амплификации способом ПЦР и очистки. Очищенный фрагмент флагеллина из R. hominis встраивали в экспрессирующий вектор pT7-MAT-Tag-FLAG (Sigma) и фрагменты флагеллина из S. enteritidis и E. coli K12 встраивали в экспрессирующий вектор pGEX-6P-1 (GE Healthcare). Рекомбинантный флагеллин экспрессировали посредством трансформации плазмидной ДНК в клетки E. coli BL21 Rosetta и E. coli BL21 (DE3), соответственно, и индукции посредством 1 мМ IPTG (изопропил b-D-галактозидаза). Флагеллины выделяли из клеточных лизатов с использованием гранул FLAG (Sigma) и гранул Ni-NTA (никель-нитрилоуксусная кислота) (Clontech, Takara) в соответствии с инструкциями изготовителя. Чистоту препарата оценивали посредством SDS-PAGE с окрашиванием раствором кумасси синим. Активность фрагментов флагеллинов определяли с использованием люциферазного анализа (Promega) в соответствии с инструкциями изготовителя с использованием клеточной линии Caco-2 с трансформированным NF-κB.
Клетки Caco-2 инкубировали с рекомбинантными флагеллинами при конечной концентрации 100 нг/мкл в течение 2 ч при 37°C в 75% увлажненной атмосфере из 5% CO2. После обработки клетки промывали раствором PBS два раза и собирали для выделения тотальной РНК.
Выделение клеток тонкого кишечника и клеток MLN
Клетки выделяли из тонкого кишечника и брыжеечного лимфатического узла, как описано ранее, с незначительными модификациями (7). В кратком изложении, суспензии клеток инкубировали с 100 Е/мл коллагеназы VIII (Sigma-Aldrich) в RPMI, дополненной 20% FBS, при 37oC в течение 20 мин (брыжеечные лимфатические узлы) или 1 часа (фрагменты тонкого кишечника). Затем суспензии единичных клеток анализировали проточной цитометрией (как описано).
Получение происходящих из костного мозга дендритных клеток и культур
Костный мозг извлекали из бедренной и большеберцовой кости мышей C3H/HeN и C57Bl6, как описано ранее (8-11). Для полученных с помощью GMCSF дендритных клеток клетки костного мозга ресуспендировали при 1x106/мл в RPMI, дополненной 10% FCS и 20 нг/мл rmGM-CSF и высевали в количестве 10 мл/планшет в 100-мм2 планшетах для культивирования тканей. После культивирования в течение трех суток неплотно прикрепившиеся клетки собирали и пересевали в среду, дополненную GM-CSF, в количестве 1x106/мл в 12-луночных планшетах для культивирования тканей. На 5 сутки клетки стимулировали 100 нг/мл флагеллинов, а затем на 6 сутки собирали. Для полученных с помощью Flt3L дендритных клеток, клетки костного мозга ресуспендировали в количестве 2x106/мл в RPMI, дополненной 10% FCS и 200 нг/мл rmFlt3, и высевали в количестве 2 мл/лунка в 12-луночные планшеты для культивирования тканей. Клетки культивировали в течение 10 суток причем в каждую лунку добавляли среду, дополненную Flt3, на 4 сутки. На 9 сутки клетки стимулировали посредством 100 нг/мл флагеллинов, а затем собирали на 10 сутки. Клетки собирали с планшетов осторожным пипетированием и анализировали проточной цитометрией.
Проточная цитометрия
Суспензии единичных клеток собственной пластинки и дендритных клеток брыжеечного лимфатического узла инкубировали в блокирующем буфере (содержавшем сыворотку и антитело против CD16/CD32) при 4oC в течение 15 мин, а затем окрашивали специфическими конъюгированными с флуорохромом антителами. Клетки собственной пластинки метили антителами к белкам мыши: CD4-FITC и CD25-APC (eBioscience), CD8-APC-Cy7, CD3-PerCP Cy5.5 и B220-BV570 (Biolegend). Внутриклеточное мечение FoxP3-PE проводили после внеклеточного окрашивания и фиксации/увеличения проницаемости клеток в соответствии с инструкциями изготовителя (eBioscience). Полученные с помощью GMCSF дендритные клетки метили антителами CD11b-PerCP Cy5.5 (BD Biosciences), CD11c-PE-Cy7, I-A/I-E -APC-Cy7, CD80-PE, CD86-APC, CD8-FITC, B220-BV570 (Biolegend). Полученные с помощью Flt3 дендритные клетки метили посредством CD11c-PE-Cy7-, CD11b- или Siglec-H-PerCP Cy5.5 (Bioegend), I-A/I-E -APC-Cy7, CD317-PE, CD40-Alexa Fluor 647, CD103-FITC, B220-BV570. Клетки анализировали с использованием программного обеспечения FACSArria (BD Biosciences) и FlowJo версии 7.2.5.
Цитометрическая гранульная матрица (CBA)
Клетки костного мозга выделяли из бедренной и большеберцовой кости мышей C3H/HeN и C57Bl/6 с использованием среды RPMI и увеличивали в количестве с помощью Flt3L, как описано выше. Клетки стимулировали 100 нг/мл флагеллина (например флагеллин Roseburia) после культивирования в течение 9 суток, и супернатант собирали на 10 сутки. Эксперимент проводили три раза для получения N=3.
Анализ CBA проводили на клеточных супернатантах с использованием набора Cytometric Bead Array Mouse Enhanced Sensitivity Master Buffer Kit (BD Biosciences) в соответствии с инструкциями изготовителя. Стандарты и образцы наносили в 96-луночный планшет для измерения в FACSArray (BD Biosciences). Результаты анализировали с использованием программного обеспечения BD FCAP (BD Biosciences).
Анализ туши в отношении сухой массы тела и липидов
Потрошеную тушу взвешивали, лиофилизировали до постоянной массы, а затем измельчали для анализа. Содержание липидов определяли посредством экстракции (1:100 масс./об.) хлороформом/метанолом (2:1 об./об.), как описано ранее (12).
Клонирование флагеллинов Roseburia.
Амплификация способом ПЦР гена флагеллина из жидкой бактериальной культуры.
Последовательности флагеллина Roseburia hominis A2-183 были получены с web-сайта National Center for biotechnology Information (NCBI) (http://www.ncbi.nlm.nih.gov/).
Последовательности флагеллина Roseburia intestinalis L1-82T (NCIMB = 13810; DSM = 14610T) были получены с web-сайта National Center for biotechnology Information (NCBI) (http://www.ncbi.nlm.nih.gov/). Номера доступа для генов и белков флагеллина представлены в таблице B (таблица B - обобщенное представление номеров доступа для флагеллинов Roseburia, описанных в настоящем описании) ***
Выделение тотальной РНК из бактерий
Тотальную РНК выделяли из 1 мл жидкой культуры бактерий на логарифмической фазе роста с использованием набора RNAeasy minkit (Qiagen, Sussex, UK), сопряженного с расщеплением свободной от РНКаз ДНКазой I (Qiagen) и на основе протокола изготовителя. В кратком изложении, один миллилитр жидкой культуры помещали в 1,5-мл пробирку, центрифугировали при 5000 × g в течение 5 мин при 4°C и супернатант выбрасывали. Бактериальный осадок ресуспендировали в 100 мкл содержавшего лизоцим буфера TE (10 мМ Tris-HCl, 1 мМ EDTA, pH 8,0) и инкубировали при RT (комнатная температура). Грамположительные бактерии RH (Roseburia hominis) инкубировали в течение 10 мин при концентрации лизоцима 3 мг/мл. Затем в пробирку добавляли триста пятьдесят микролитров лизирующего буфера, содержащего 1% β-меркаптоэтанол, для разрушения клеток посредством встряхивания и добавляли 250 мкл 100% этанола (Molecular grade, Merck). Семьсот микролитров полученной суспензии наносили на колонку RNeasy mini, оборудованную пробиркой для улавливания, центрифугировали в течение 15 секунд при 8000 × g и извлекали содержимое из пробирки для улавливания. Вновь, 350 мкл промывочного буфера наносили на колонку, которую центрифугировали в течение 15 с при 8000 × g и прошедшую фракцию выбрасывали. Расщепление ДНК проводили посредством добавления в каждую колонку, 30 единиц ДНК-азы I, смешанной с 70 мкл буфера RDD, и инкубации при RT в течение 15 мин. Колонку вновь промывали, как описано ранее, 350 мкл буфера для промывания, а затем два раза 500 мкл буфера RPE. После высушивания воздухом колонки центрифугированием пустой колонки в течение 1 мин при 8000 × g, 40 мкл свободной от РНКазы воды добавляли прямо в колонку и инкубировали в течение 1 мин при RT, а затем центрифугировали в течение 1 мин при 8000 × g. Элюат, содержавший тотальную РНК, измеряли спектрофотметрически с использованием способа Nanodrop для определения концентрации. Целостность РНК проверяли в геномном отделении RINH (University of Aberdeen, UK) с использованием Agilent 2100 Bioanalyzer (Agilent Technologies). РНК с числом целостности (RIN) от 9,5 до 10, считали имеющей превосходное качество. Тотальную РНК хранили при -80°C до последующего применения.
Обратная транскрипция
Тотальную РНК подвергали обратной транскрипции с использованием набора для обратной транскрипции Quantitect (Qiagen), в соответствии с инструкциями изготовителя. В кратком изложении один микрограмм тотальной РНК в общем объеме 12 мкл инкубировали в течение 2 мин при 42°C с 1 X буфером для разрушения геномной ДНК и далее смешивали с 1X буфером Quantiscript RT (3 мкл), смесь праймеров для RT (2 мкл) и обратной транскриптазой Quantiscript (1 мкл) в конечном объеме 20 мкл. Программа обратной транскрипции представляла собой 15 мин при 42°C, а затем 3 мин при 95°C для инактивации фермента. Полученная концентрация комплементарной ДНК (кДНК) составляла 50 нг/мкл и кДНК хранили при -20°C до последующего применения.
Амплификация способом ПЦР генов флагеллина
Для амплификации флагеллина с геномной ДНК прямой и обратный праймеры конструировали вручную и приобретали от Sigma-Aldrich (Poole, UK). Амплификацию способом ПЦР фрагментов флагеллина проводили с использованием прямого праймера, встраивающего участок рестрикции BglII на 5’-конце, и обратного праймера, встраивающего участок рестрикции XhoI на 3’-конце.
Roseburia hominis (fla1)
Прямой праймер (5’-3’): CTCGAGATATGGTAGTACAGCACAA
Обратный праймер (5’-3’): CTTAGATCTCTGTAATAAGGATAATA
Roseburia hominis (fla2)
Прямой праймер (5’-3’): CTCGAGATATGGTGGTTAATCATAA
Обратный праймер (5’-3’): CTTAGATCTTTTCAAAATCTCAAGCAC
Roseburia intestinalis (Fla1)
Прямой праймер (5’-3’): GCAGGATCCATGCGTGGCGGAGACAAT
Обратный праймер (5’-3’): AATGTGGTGGTGGTGGTGGTGCTGCAGAATCTGCAA
Roseburia intestinalis (Fla2)
Прямой праймер (5’-3’): CTCGAGATATGGTAGTTAATCATAA
Обратный праймер (5’-3’): CTTAGATCTTTTTAACATTTCCAACAC
Roseburia intestinalis (Fla3)
Прямой праймер (5’-3’): CTCGAGATATGGTAGTACAGCACAA
Обратный праймер (5’-3’): CTTAGATCTCTGTAACAGAGAAAGTA
Roseburia intestinalis (Fla4)
Прямой праймер (5’-3’): CCGGGATCCATGGTAGTACAGCACAAT
Обратный праймер (5’-3’): TTAGTGGTGGTGATGATGATGCTGTAACAGAGAAAG
С использованием 1 мкл бактериальной культуры в качестве матрицы, гены флагеллина амплифицировали способом ПЦР. Температурная программа для амплификации была адаптирована из Fermentas (Fermentas GMBH, Germany) для оптимального функционирования полимеразы KOD (Novagen, Madison, WI) и она представляла собой 95°C в течение 2 мин для активации полимеразы, затем 34 циклов амплификации, 95°C в течение 20 c, температура отжига в течение 10 с и 70°C в течение 20 с, оканчивающаяся 2 мин при 70°C с использованием полимеразы KOD. Детали смеси для ПЦР приведены в таблице 1. Продукты ПЦР анализировали на 1% агарозном геле в течение 30 мин при 120 В и представляющие интерес полосы вырезали и очищали. Вставку сначала клонировали в клонирующий вектор PCR™-Blunt II-TOPO с использованием набора для клонирования Zero Blunt TOPO PCR cloning kit (Invitrogen) в соответствии с инструкциями изготовителя и путем смешения, как описано на фиг.1A и в таблице 1.
Состав смеси для встраивания продукта ПЦР в клонирующий вектор PCR-Blunt II-TOPO. Солевой раствор и смесь вектор-фермент представляли собой готовые для применения растворы
Электрофоретическое разделение и очистка продуктов ПЦР
Для визуализации выделенного продукта флагеллина, амплифицированного способом ПЦР, реакционную смесь для ПЦР смешивали с 1X красителем для нанесения Blue-orange loading dye (Promega) и наносили на 1% агарозный гель (изготовленный из 1% агарозы, разбавленной буфером TAE (40 мМ основание Tris, 0,1% (об./об.) уксусная кислота, 1 мМ EDTA), доведенной до кипения и перелитой в лоток для геля), содержавшим 0,5 мкг/мл бромида этидия для окрашивания нуклеиновых кислот. Образцы разделяли в течение 30 мин при 120 В с использованием TAE в качестве подвижного буфера. Когда миграция завершалась, гель визуализировали под ультрафиолетовым (УФ) излучением и продукт идентифицировали с использованием эталона и вырезали с использованием чистого скальпеля. Затем фрагмент геля переносили в предварительно взвешенную пробирку Eppendorf, и его массу регистрировали путем вычитания из массы пустой пробирки. Продукт ПЦР очищали. К фрагменту геля добавляли мембраносвязывающий раствор в соотношении 10 мкл раствора на 10 мг фрагмента агарозного геля. Затем смесь инкубировали при 65°C в течение 10 мин при часом встряхивании до тех пор, пока фрагмент геля не растворялся полностью. Пробирку кратковременно центрифугировали при RT, чтобы гарантировать, что все содержимое находится на дне пробирки, а затем проводили очистку ДНК. С этого момента времени и далее очистка продуктов ПЦР вовлекала использование геля Wizard® SV Gel и системы PCR Clean-up system (Promega, Southampton, UK) в соответствии с инструкциями изготовителя. Одну миниколонку SV на продукт ПЦР вставляли в пробирку для сбора. Продукт ПЦР добавляли в собранную конструкцию миниколонки SV и инкубировали в течение 1 мин при комнатной температуре (RT). Колонку центрифугировали при 16000 × g в течение 1 мин, и прошедшую фракцию выбрасывали. Затем колонку промывали добавлением 700 мкл раствора для промывания мембраны и центрифугировали в течение 5 мин при RT. Прошедшую жидкость выбрасывали и собранную конструкцию вновь центрифугировали в течение 1 мин и сушили при RT в течение 2 мин для выпаривания какого-либо остаточного этанола. Затем колонку переносили в свежую 1,5-мл пробирку, свободную от нуклеазы. Для выделения продукта ПЦР 25 мкл свободной от нуклеазы воды наносили в центр колонки и ДНК элюировали посредством инкубации в течение 1 мин при RT и осаждения в течение 1 мин при 16000 × g. Концентрацию элюата измеряли спектрофотометрически с использованием Nanodrop (Thermo Fisher Scientific) и хранили при -20°C.
Расщепление флагеллина и экспрессирующего вектора.
Двести микролитров свежеразмороженных компетентных клеток DH5α держали на льду и добавляли 4 мкл смеси продуктов ПЦР, и оставляли на льду на 5 мин. Тепловой шок выполняли в течение 1 мин при 42°C и клетки возвращали на лед на 5 мин, а затем добавляли 400 мкл среды SOC. Среда SOC (Sigma) представляет собой богатую среду, используемую в основном на стадиях восстановления при трансформации компетентных клеток Escherichia coli. Использованием SOC максимизирует эффективность трансформации компетентных клеток.
Клетки росли при 37°C в течение 1 часа и 200 мкл смеси высевали на планшет с агаром LB, дополненный 50 мкг/мл канамицина. Положительные клоны получали в качестве минипрепаратов, разделенных на нанокапли и расщепленных BamH1 и Xho1 в течение 2 часов для вырезания флагеллина. Экспрессирующий вектор pT7-MAT-Tag-FLAG-2 (Sigma), представленный на фиг.2A, также расщепляли посредством BamH1 и Xho1. После разделения продукта на 1% агарозном геле и очистки расщепленного вектора и фрагмента, вектор и вставку лигировали при 4°C в течение ночи и трансформировали в E.coli DH5a. Продукты лигирования высевали на агар LB, дополненный 100 мкг/мл ампициллина. Положительные клоны получали в качестве минипрепаратов и трансформировали в компетентные клетки E.coli BL21 (DE3). Положительные клоны секвенировали соответствующими праймерами для проверки присутствия вставки. Из положительных клонов получали аликвоты глицерина. Экспрессирующие векторы, кодирующие флагеллины Roseburia, далее приготавливали в качестве минипрепаратов и трансформировали в компетентные клетки E.coli для повышения выхода очистки; для Rh1, Rh2 и Ri2 компетентные клетки E. coli представляли собой E.coli BL21 Rosetta и для RI3, Ri1 Ri4, Se, St, K12 и Er компетентные клетки E. coli представляли собой E.coli BL21 (DE3).
Экспрессия и очистка флагеллинов Roseburia
Трансформированные E.coli (например, BL21, Rosetta), кодирующие ген флагеллина (RH1 или FLaA1), выращивали в 1 литре среды LB с ампициллином (100 мкг/мл) и дополняли хлорамфениколом (50 мкг/мл) в случае клеток Rosetta при 37°C при встряхивании 180 об./мин. до логарифмической фазы. Культуру индуцировали в течение 3 часов посредством 1 мМ IPTG в тех же условиях для обеспечения специфической экспрессии белка флагеллина. Бактерии осаждали центрифугированием 4000 × g, 4°C, в течение 10 мин и ресуспендировали в 60 мл буфера 1 (50 мМ Tris (pH 7,4), 150 мМ NaCl) и обрабатывали ультразвуком с помощью Soniprep 150 (Sanyo, Japan), в течение 1 мин при использовании BL21 (DE3), или 3 мин при использовании Rosetta с 1 мин покоя после каждой минуты. Клеточный лизат центрифугировали при 9000 × g в течение 10 мин при 4°C и супернатант выбрасывали. Осадок, который содержал нерастворимые белки, ресуспендировали в 60 мл буфера 2 (50 мМ Tris (pH 8,0), 100 мМ NaCl, 5 мМ EDTA, 0,5% Triton-X100, 1 мМ DTT), вновь обрабатывали ультразвуком до полного ресуспендирования и центрифугировали при 5000 × g в течение 15 мин при 4°C. Нерастворимую фракцию промывали второй и третий раз буфером 2. Последнее промывание проводили с использованием буфера 2 без Tx-100 и DTT, как описано выше. Для солюбилизации белков нерастворимую фракцию ресуспендировали с использованием обработки ультразвуком в 4 мл буфера на основе мочевины (2 M мочевина, 50 мМ Tris (pH 7,4), 150 мМ NaCl) и центрифугировали при 5000 × g, 5 мин при RT. Супернатант выбрасывали посредством декантации и осадок ресуспендировали в 2 мл 4 M мочевины, 50 мМ Tris (pH7,4), 150 мМ NaCl, посредством обработки ультразвуком и центрифугировали при 5000 × g, 5 мин при RT. Супернатант собирали посредством декантации и осадок ресуспендировали в 2 мл 8 M раствора мочевины, 50 мМ Tris (pH 7,4), 150 мМ NaCl, посредством обработки ультразвуком и центрифугировали при 5000 × g, 5 мин RT. Супернатант собирали посредством декантации и смешивали с фракцией 4 M мочевины, с получением 6 M раствора мочевины, содержащего солюбилизированные флагеллины. Один миллилитр смолы Talon (Clontech, Takara, UK) промывали два раза 2 мл буфера 1 (50 мМ Tris (pH7,4), 150 мМ NaCl) и центрифугировали при 1000 × g, 2 мин при RT. Супернатант выбрасывали и добавляли фракцию 6 M мочевины, содержавшую флагеллин, и оставляли для вращения при 4°C в течение 1 часа. После центрифугирования при 1000 × g в течение 2 мин при RT смолу промывали два раза буфером, содержавшим 2 M мочевину, 50 мМ Tris (pH 7,4), 150 мМ NaCl, 15 мМ имидазол. После центрифугирования смолу инкубировали в течение 10 мин с 300 мкл буфера для элюирования (360 мМ Tris-HCl, 680 мМ имидазол, 360 мМ NaCl, 0,35 Н HCl, 1,43 M мочевина), осторожно перемешивали и элюлат собирали после центрифугирования при 2000 × g в течение 2 мин при RT. Элюирование повторяли один раз и два элюата смешивали. Вторую стадию очистки с использованием магнитных грану с антителом против FLAG M2 (Sigma) проводили для повышения чистоты препарата белка. Четыреста микролитров сверхчистой воды медленно добавляли к элюату смолы Talon до конечной концентрации мочевины 0,9 M, пригодной для гранул FLAG. Двести пятьдесят микролитров магнитных гранул FLAG промывали два раза посредством 750 мкл буфера 1, смешивая и оставляя на магнитном стенде (Ambion) для удаления супернатанта. К гранулам добавляли элюат Talon и центрифугировали в течение 30 мин при 4°C. Гранулы промывали пять раз 1 мл 0,9 M мочевины, 50 мМ Tris (pH7,4), 150 мМ NaCl. Элюирование состояло в добавлении к гранулам 250 мкл раствора пептида FLAG в концентрации 200 мкг/мл, содержавшего 0,9 M мочевину, 50 мМ Tris (pH7,4), 150 мМ NaCl, тщательном перемешивании и инкубации в течение 30 мин при RT. Пробирки помещали на магнитный стенд и конечный продукт собирали. Эту стадию элюирования повторяли один раз и 500 мкл конечных продуктов далее подвергали диализу в PBS с 0,9 M мочевиной в течение 1 часа при 4°C, разделяли на аликвоты и хранили при -80°C. Чистоту препаратов оценивали посредством SDS-PAGE с окрашиванием раствором кумасси синим (фиг.3A). Непосредственно перед применением аликвоту белка подвергали диализу в течение 1 часа против PBS, заменяя буфер два раза, в slide-a-lyser с порогом молекулярной массы 20 кДа (Pierce, UK) и концентрацию белка измеряли с использованием способа Брэдфорд. Измерение эндотоксинов подтвердило, что величины составляли <0,25 МЕ/мл.
Нуклеотидная последовательность, кодирующая Fla1, представлена в SEQ ID NO: 1 и аминокислотная последовательность Fla1 представлена в SEQ ID NO: 2.
ATGGTAGTACAGCACAATCTTACAGCAATGAACGCTAACAGACAGTTAGGTATCACAACAGGCGCACAGGCTAAGTCTTCTGAGAAGTTATCTTCTGGTTACAAGATCAACCGCGCAGCAGATGACGCAGCAGGTCTTACGATTTCCGAGAAGATGAGAAGCCAGGTTAGAGGCTTAAATAAAGCTTCTGACAACGCACAGGATGGTGTATCCCTTATTCAGGTAGCTGAGGGTGCATTAAGTGAGACACACTCCATCTTACAGCGTATGAATGAGTTAGCAACTCAGGCAGCAAACGATACCAATACAACCTCAGACAGAACTGCAGTTCAGCAGGAGATCAACCAGTTAGCATCTGAGATCACCAGAATCGCTTCTACAACTCAGTTCAACACAATGAACCTGATCGATGGTAACTTCACAAGTAAGAAGCTTCAGGTAGGTTCCCTTTGCGGACAGGCTATCACAATCGATATCTCTGATATGTCTGCTACAGGTCTTGGCGTTAGCGGATTAGTAGTATCTTCCTTCTCTGCAGCTGGTAAGGCAATGTCTGCAGCTCAGGATGCTATCAGCTACGTATCTTCTATGCGTTCTAAGCTGGGTGCATTACAGAACAGACTTGAGCACACAATCTCCCACCTGGACAACATTTCTGAGCACACATCTTCTGCAGAGTCTCGTATCCGTGATACAGATATGGCTGAAGAGATGGTTGAGTACAGCAAGAACAACATCCTTGCTCAGGCAGGACAGTCTATGCTTGCTCAGGCTAACCAGTCTACTCAGGGTGTATTATCCTTATTACAGTAA (SEQ ID NO: 1).
MVVQHNLTAMNANRQLGITTGAQAKSSEKLSSGYKINRAADDAAGLTISEKMRSQVRGLNKASDNAQDGVSLIQVAEGALSETHSILQRMNELATQAANDTNTTSDRTAVQQEINQLASEITRIASTTQFNTMNLIDGNFTSKKLQVGSLCGQAITIDISDMSATGLGVSGLVVSSFSAAGKAMSAAQDAISYVSSMRSKLGALQNRLEHTISHLDNISEHTSSAESRIRDTDMAEEMVEYSKNNILAQAGQSMLAQANQSTQGVLSLLQ (SEQ ID NO: 2).
Структура флагеллина состоит из четырех доменов: DO, D1, D2 и D3. См. фиг.4A.
D0: N-концевая α-спираль начинается с Gln 2 и продолжается до Ser 32 (ND0). C-концевая α-спираль начинается с Ala 459 и продолжается до Ser 491 (CD0).
Область перекладины, которая соединяет домены D0 и D1 домены, состоит из двух цепей (Ns и Cs), одна от Ser 32 до Ala 44, а другая от Glu 454 до Ala 459.
D1: N-концевой сегмент продолжается от Ala 44 до Gln 176 и C-концевой сегмент продолжается от Asn 406 до Glu 454. N-концевой сегмент состоит из α-спирали (от Ala 44 до Ala 99) (ND1a), за которой следует петля, связывающая со второй более короткой α-спиралью (ND1b), которая проходит вниз и цепь продолжается двумя β-поворотами, β-шпилькой, указывающей вниз и вытянутой вверх цепью, а остальная часть цепи в итоге переходит в домен D2. C-концевая α-спираль в домене 1 (CD1) начинается с Asn 406 и продолжается до Glu 454.
Домен D0 и D1 упакованы в структуру протофиламентов так, что N-D0 ориентирован наружу и C-D0 экспонирован к центральному каналу.
Домен D2 содержит два сегмента: N-концевой сегмент от Lys 177 до Gly 189 и C-концевой сегмент от Ala 284 до Glu 405. Он состоит в основном из β-цепей за исключением двух спиралей: 285-289 и 288-298.
Домен D3 содержит центральный сегмент от Tyr 190 до Val 283. По большей части состоит из β-цепей с одним коротким участком спиральной укладки (199-209).
Без связи с теорией, полагают, что две необходимых области белка флагеллина, вовлеченных в распознавание и активацию TLR5, представляют собой аминокислоты в положениях 79-117 SEQ ID NO: 2 (домен N-D1) и аминокислоты в положениях 408-439 SEQ ID NO: 2 (домен C-D1), а также аминокислоту аланин (A) в положении 411 SEQ ID NO: 2, аминокислоту глутамин (Q) в положении 412 SEQ ID NO: 2 и аминокислоту серин (S) в положении 420 SEQ ID NO: 2.
ПРИМЕРЫ
R. hominis предпочтительно колонизируют ободочную кишку
Безмикробным мышам C3H/HeN (GF) проводили инокулцяцию R. hominis посредством трех зондов в течение трех последовательных суток. Авторы изобретения сообщают о первой успешной моноколонизации безмикробных мышей одним видом бактерий из типа Firmicutes. Успешной колонизации достигали с использованием среды для инокуляции, содержавшей 3% аскорбиновую кислоту и 2% цистеин для защиты этих чувствительных к кислороду бактерий. Анализ ткани кишечника посредством флуоресцентной гибридизации in situ (FISH) выявил, что R. hominis колонизировали как подвздошную кишку, так и ободочную кишку, но обнаруживались в значительно более высоких количествах в ободочной кишке. Также было обнаружено, что бактерии тесно ассоциированы со слизистой оболочкой ободочной кишки (фиг.S1A). Колонизацию далее подтверждали и количественно определяли способом ПЦР с использованием праймеров, специфичных к R. hominis, с количествами, приближающимися к 1x1010 бактерий/г фекалий (фиг.S1B-C). Тесты фекалий животных GF в отношении каких-либо бактерий были отрицательными.
В геном R. hominis выявлены уникальные гены, стимулирующие взаимодействия с хозяином
Была получена полная геномная последовательность R. hominis A2-183 и она представлена одной хромосомой размером 3592125 п.н. (фиг.1A). Автоматизированное и ручное аннотирование генома с использованием платформы RAST выявило присутствие четырех рибосомальных оперонов, 66 РНК и 3273 спрогнозированных белков. Наибольшая группа генов принадлежала к категории подсистемы "Углеводы" (271 гены), кодирующей белки, вовлеченные в метаболизм углеводов, за которой следовали "Метаболизм белков" (197) и "Аминокислоты и производные" (175) (фиг.1B). Другие важные функциональные категории включали "Подвижность и хемотаксис" (49) и "Латентность и споруляцию" (12). Сравнительный геномный анализ показал, что наиболее близким родственником с точки зрения геномной структуры и функции среди полных бактериальных геномов является Eubacterium rectale (Mahowald et al. 2009), что является неудивительным, учитывая тесное таксономическое родство этих организмов (Duncan et al. 2006, Aminov et al. 2006). Сравнительное реконструирование двух геномов с 1095 генами выявило, что они отличались приблизительно 25% генов. В частности, эти отличия охватывали гены, кодирующие важные функции для взаимодействия с хозяином. Например, гены категории "Подвижность и хемотаксис", кодирующие белки типа IV сборки фимбрий PilB и PilC, присутствовали в E. rectale, но отсутствовали в R. hominis, в то время как жгутиковый стержневидный белок базального тела FlgC, жгутиковый комплексный белок крюк-базальное тело FliE, белок флагеллина FlaB и белок переключения мотора жгутиков FliG были уникальными для R. hominis (Таблица S1). Эти два бактериальных генома также отличались 42 генами углеводов, что отражает их различные пищевые потребности. Интересно, что R. hominis являются уникальными, поскольку они экспрессируют два гена флагеллина, оба из которых принадлежат типу FLA, в противоположность флагеллинам, гомологичным FliC, экспрессируемому видами бактерий Salmonella и E. coli.
Таблица S1. Сравнительный анализ геномов R. hominis и E. rectale. Сравнительный геномный анализ показал, что Eubacterium rectale является наиболее близким известным родственником R. hominis с точки зрения геномной структуры и функции и эти два генома различались приблизительно 25% генов. (A) Гены, присутствующие в R. hominis, но отсутствующие в E. rectale, и (B) гены, присутствующие в E. rectale, но отсутствующие в R. hominis.
Гены, присутствующие R. hominis, но отсутствующие в E. rectale.
Гены, присутствующие в E. rectale, но отсутствующие в R. hominis
R. hominis отвечают на среду кишечника активацией генов подвижности, мобилизации и хемотаксиса
Для определения генов, дифференциально экспрессируемых R. hominis в ответ на ассоциацию с хозяином и рацион, микрочип конструировали с использованием 6000 фрагментов ПЦР из библиотеки секвенирования вставок малого размера. После этого проводили подтверждение способом ПЦР в реальном времени для 42 дифференциально экспрессируемых генов (таблицы S2 и S3), которые кластеризуются в конкретных областях генома R. hominis, как проиллюстрировано на фиг.2A. Для различения эффектов среды кишечника и компонентов рациона, бактериальную РНК выделяли из четырех различных экспериментальных условий: (i) in vivo, из слепой кишки моноассоциированных мышей; (ii) in vitro, из бактерий, выращенных в культуральных средах; (iii) in vitro, из бактерий, выращенных в присутствии компонентов рациона; и (iv) из бактерий, инкубированных на поверхности смыкающегося монослоя клеток Caco-2 и HT-29.
Таблица S2. Анализ ПЦР в реальном времени бактериальной РНК с использованием специфических праймеров R. hominis. Бактериальные праймеры для ПЦР конструировали для дифференциально экспрессируемых генов с использованием Primer3Plus. Все образцы анализировали в трех экземплярах. В качестве эталонного гена для нормализации использовали GyrA.
Таблица S3. Индекс экспериментов ПЦР с R. hominis, нанесенный на кольцевую карту генома. Перечень экспериментов ПЦР с R. hominis, как показано на кольцевой карте генома
Было идентифицировано пятьдесят дифференциально экспрессируемых генов (in vivo против in vitro). Наиболее неожиданным открытием было была высокая активация in vivo генов, вовлеченных в конъюгацию/мобилизационный перенос, гены, подобные mobA и mobL (фиг.2A). Присутствие таких генов в исследованиях транскрипции было неожиданным, поскольку не было поддающихся идентификации генов, присвоенных фагам, профагам, мобильным элементам и плазмидам в признаке категории подсистемы. Это отличие в обнаружении и распределении генов, вероятно, является следствием общепризнанных ограничений аннотирования категории подсистемы. Стимулирующий эффект соединений рациона был значительно менее выраженным, что указывает на то, что сама по себе среда кишечника является основным индуктором генов, вовлеченных в горизонтальный перенос генов.
Другие индуцируемые окружением кишечник подсистемы включали мембранный транспорт, в частности транспорт магния, и подвижность и хемотаксис, включая множество метил-акцептирующих белков хемотаксиса и генов жгутикового оперона (фиг.2B). R. hominis обладает множеством генов флагеллинов: flaA1, flaA2, flaA3 и flaB. В среде кишечника мыши экспрессия флагеллина была подтверждена вестерн-блоттином и иммуногистохимией с использованием бактерий, выделенных как из мышей, колонизированных in vivo, так и из культур in vitro, выращенных в присутствии корма, со специфическими антителами, индуцированными против рекомбинантных белков-флагеллинов FlaA1 и FlaA2 (RH1 и RH2) (фиг.2C). Это положительное подтверждение экспрессии флагеллина in vivo согласуется с предшествующими сообщениями, указывающими на то, что только определенные подгруппы Firmicutes образуют жгутики in vivo (Turnbaugh et al. 2008), в отличие от других видов бактерий, которые активно подавляют экспрессию бактериального белка. Также среда кишечника влияла на экспрессию генов катаболического метаболизма в R. hominis в среде кишечника (фиг.2D). Вовлеченные гены включали ацетил-CoA-ацетилтрансферазу, 3-гидроксиацил-CoA-дегидрогеназу, бутирил-CoA-дегидрогеназу и фосфоенолпируваткарбоксикиназу [ATP].
Чтобы далее исследовать эффекты адаптации к хозяину транскриптома R. hominis, проводили стимуляцию in vitro эпителиальных клеток кишечника человека (Caco-2 и HT-29). Это показало, что белок 1 mobA/mobL гена конъюгации/мобилизационного переноса, который индуцировался адаптацией к кишечнику мыши, также активировался в обеих клеточных линиях (фиг.2E). В соответствии с данными in vivo, ген флагеллин MotA активировался в клетках Caco-2. Гены, вовлеченные в метаболизм бутирата, продемонстрировали различия между двумя клеточными линиями, причем в клетках Caco-2 наблюдали подавление и в клетках HT-29 наблюдали активацию.
R. hominis в наибольшей степени влияет на естественные каскады передачи сигнала в кишечнике
Колонизация мышей GF посредством R. hominis коррелировала с увеличенной экспрессией генов хозяев, которая была наиболее высокой в ободочной кишке (фиг.3A и таблица S4). Дифференциальная экспрессия была наиболее выражена через 28 суток после колонизации, причем 159 генов активировались и 143 гена подавлялись. Число дифференциально экспрессируемых генов в подвздошной кишке на 14 сутки было сходным с восходящей ободочной кишкой, причем 79 генов активировались и 119 генов подавлялись. Дифференциальная экспрессия в подвздошной кишке была очень низкой на 28 сутки, что согласуется со сниженными уровнями колонизации. Транскриптомный ответ различался в два момента времени, как показано четким разделением значимых транскриптов в анализе тепловой карты (фиг.3B). Положительное подтверждение с использованием ПЦР в реальном времени данных Affymetrix представлено на фиг.3C.
Таблица S4. Данные Affymetrix между животными, которым инокулировали R. hominis, и животными GF. Анализ на микрочипах Affymetrix проводили на РНК, выделенной из ткани восходящей ободочной кишки и подвздошной кишки. Данные считали значимыми при P<0,05 с использованием способа обнаружения ложноположительных результатов Benjamini и Hochberg. (A) Транскрипты, дифференциально экспрессированные в восходящей ободочной кишке на 14 сутки. (B) Транскрипты, дифференциально экспрессированные в восходящей ободочной кишке на 28 сутки. (C) Транскрипты, дифференциально экспрессированные в подвздошной кишке на 14 сутки. (D) Транскрипты, дифференциально экспрессированные в подвздошной кишке на 28 сутки.
Транскрипты, дифференциально экспрессированные в восходящей ободочной кишке через 14 суток между животными, которым инокулировали R. hominis, и безмикробными животными
Транскрипты, дифференциально экспрессируемые в восходящей ободочной кишке на 28 сутки между животными, которым инокулировали R. hominis, и безмикробными животными
Транскрипты, дифференциально экспрессируемые в подвздошной кишке на 14 сутки между животными, которым инокулировали R. hominis, и безмикробными животными
Транскрипты, дифференциально экспрессируемые в подвздошной кишке через 28 суток между животными, которых инокулировали R. hominis, и безмикробными животными
Гены, вовлеченные во врожденный иммунитет и барьерную функцию кишечника, в значительной степени индуцировались присутствием R. hominis в восходящей ободочной кишке. Процесс GO "врожденный иммунный ответ" (GO:0045087) был активирован и включал важные TLR-родственные гены Tlr5, Tlr1 и Vnn1. Особый интерес представляла активация Tlr5, учитывая соответствующую индукцию генов жгутиков и белка флагеллина в R. hominis в процессе колонизации кишечника, и она может указывать на роль этого врожденного каскада передачи сигнала в опосредовании врожденных и адаптивных иммунных ответов. Другие гены врожденного иммунного ответа, на которые влияет в ободочной кишке R. hominis, включали противомикробные пептиды Defb37, Pla2g3, Muc16 и Itln и ген функции кишечного барьера Sprr1a, Cldn4, Pmp22, Crb3 и Magi3. Гены врожденного иммунитета, демонстрирующие активацию в ответ на R. hominis, включали Defcr20, Pcgf2, Ltbp4, Igsf8 и Tcfe2a. Интересно, что в настоящем описании показана отрицательная регуляция каскада NF-κB (GO:0043124) (фиг.S2) посредством R. hominis, которые подобно B. thetaiotaomicron (Kelly et al. 2004), могут вносить вклад в иммунный гомеостаз посредством подавления этого воспалительного каскада.
Чтобы продемонстрировать, что эти ответы являются специфическими для R. hominis, исследовали ответ безмикробных животных на другую комменсальную бактерию. Ответы экспрессии генов на колонизацию E. coli MG1655 (K12) сравнивали с R. hominis через 10-14 суток и 22-2 суток после колонизации. На протяжении этого временного интервала наблюдали большие отличия в экспрессии генов в ответ на R. hominis, но не на E. coli, что указывает на то, что R. hominis являются биологически высокоактивными в кишечнике в противоположность минимальному влиянию E. coli (фиг.S3). Ответ на E. coli, установленный из данных экспрессии генов в восходящей ободочной кишке кишечники, оказался в основном опосредуемым B-клетками антительным ответом.
R. hominis влияют на T-клеточные каскады в основном в ободочной кишке
Большинство каскадов, в которых произошли изменения на 14 сутки, распределяли на категории: клеточная дифференцировка, регуляция клеточного цикла и ремоделирование тканей. Важно, что иммунный ответ представлял собой основной каскад, индуцируемый на 28 сутки в восходящей ободочной кишке. Значительно измененные каскады в этой категории по большей части были вовлечены в функцию T-клеток, включая передачу сигнала IL-10 и регуляцию T-клеточной функции посредством CTLA-4 (таблица S5). Гены, вовлеченные в эти каскады, продемонстрировали как активацию, так и подавление, так что хотя на эти каскады значительно влияло присутствие R. hominis, точные суммарные функциональные эффекты на дифференцировку T-клеток требовали дальнейшего исследования. Для пояснения роли R. hominis в дифференцировке T-клеток, обычным мышам вводили R. hominis в течение 14 суток и определяли влияние на подгруппы T-клеток как в собственной пластинке, так и в брыжеечных лимфатических узлах (MLN). Введение R. hominis повышало популяцию CD3+CD4+CD25+FoxP3+ T-клеток в обеих областях (фиг. 4). Была проведена оценка числа двойных положительных CD3+FoxP3+ клеток в собственной пластинке восходящей и нисходящей ободочной кишки моноассоциированных животных C3H/HeN и C57Bl6, и было подтверждено значительное повышение количества регуляторных T-клеток у мышей, которым вводили R. hominis (фиг.5A). Процесс GO для "полимеризации актина" (GO:0030041) (Arpc3, Capg, Cdc42ep5 и Rhoc) активировался на 28 сутки в ободочной кишке мышей, колонизированных R. hominis (фиг.S2). Для активации T-клеток и эффекторной функции требуется полимеризация актина в иммунном синапсе. В целом, эти данные указывают на то, что R. hominis активно влияет на адаптивный иммунный ответ в ободочной кишке посредством положительного влияния на регуляцию T-клеток.
Анализ каскада ответа иммунной системы в отношении транкриптов, дифференциально экспрессируемых в восходящей ободочной кишке между мышами, которым вводили R. hominis, и безмикробными мышами на 28 сутки
Дифференциально экспрессируемые гены (P<0,05) импортировали в аналитическое программное обеспечение GeneGo MetaCore для определения значимо усиленных канонических каскадов в каждой группе. * Число генов на каждой карте, которые дифференциально экспрессировались при конкретном сравнении введений. ** Число генов на каждой карте.
Ly6 в восходящей ободочной кишке. В частности, GPI-заякоренный продукт гена Ly6g6c активировался в 25 раз, и родственный ген Ly6g6e активировался в двадцать раз через 28 суток. Большинство гемопоэтических клеток, включая нейтрофилы и плазмацитоидные дендритные клетки, экспрессируют один или несколько представителей семейства Ly6. Более того, было сделано предположение о возможной роли Ly6 на активацию дифференцировку и созревание T-клеток, (Mallya, Campbell & Aguado 2006). Иммуноцитохимия подтвердила увеличение присутствия клеток Ly6G+, CD11b+ и CD3+ FoxP3+ у мышей, колонизированных R. hominis (фиг.5B).
Флагеллины R. hominis модулируют дифференцировку T-клеток
Влияние бактерий на дифференцировку T-клеток может отражать набор экспонированных лигандов TLR. Например, сопряжение между передачей сигнала TLR5 и ответами CD4+ T-клеток недавно было продемонстрировало для жгутиковых патогенов (Letran et al. 2011). Интересно, что в зависимости от экспериментальных условий, флагеллин может индуцировать диапазон T-клеточных ответов, включая ответы Th1, Th2, Th17 и Treg (Wilson et al. 2012).
Функциональность бактериальных флагеллинов FlaA1 (RH1) и FlaA2 (RH2) исследовали с использованием новых растворимых рекомбинантных белков флагеллинов, полученных против уникальных последовательностей флагеллина R. hominis. Способность RH1 и RH2 активировать ответы передачи сигнала в линиях эпителия кишечника и происходящих из костного мозга дендритных клетках, увеличенных в количестве с помощью либо FLT3L, либо GM-CSF, сравнивали и сопоставляли с различными комменсальными и патогенными флагеллинами, полученными с использованием идентичных протоколов.
Эпителиальные клетки, которые обрабатывали идентичными концентрациями различных бактериальных флагеллинов, выявили различные профили экспрессии генов (фиг.6A). Важно, что не было обнаружено контаминации эндотоксином в препаратах рекомбинантного белка. Salmonella enteritidis (SE) были более эффективными, чем E. coli K12 (EC) или флагеллин RH1. Флагеллин RH1 также продемонстрировал выраженный ответ, но кластеризовался в отдельный клад вместе с комменсальным EC. С использованием эпителиальных клеток, экспрессирующих доминантно-негативный TLR5, было показано, что ответы являются TLR5-зависимыми. Напротив, было показано, что RH2 является минимально активным; в основном он не было провоспалительным и не активировал набор консервативных генов (IL-8, CXCL-1, CXCL-2 и CXCL-10), индуцируемый другими рекомбинантными бактериальными флагеллинами. Белок флагеллин RH1 является более биологически активным, чем RH2, in vitro; хотя оба рекомбинантных белка экспрессировались in vivo, RH1 также значительно активировался на уровне экспрессии генов in vivo. Было продемонстрировано, что флагеллин RH1 из R. hominis индуцировал различные ответы в полученных с помощью Flt3L и GM-CSF дендритных клетках относительно комменсальных E. coli и патогенных Salmonella enteritidis (фиг.6B-C). В частности, RH1 был уникальным с точки зрения его способности активировать DC, увеличенные в количестве с помощью Flt3L, с активацией I-A/I-E и CD40 и продуцированием IL-10 происходящими из костного мозга DC из мышей C3H/HeN и C57Bl/6. Соотношение IL-10/IL-12, в частности, было увеличенным в DC C57Bl/6 (фиг.6D), для которых было обнаружено, что они являются CD103+ Siglec-H+. В соответствии с наблюдениями, описанными в настоящем описании, в недавних сообщениях также было показано, что флагеллин может активировать популяции CD103+DC (Flores-Langarica et al. 2012, Kinnebrew et al. 2012).
Для оценки функциональной важности R. hominis и его флагеллинов, безмикробных мышей TLR5KO и WT подвергали моноколонизации. Тепловая карта, демонстрирующая дифференциально экспрессируемые гены как для TLR5KO, так и для мышей дикого типа, колонизированных R. hominis, выявили очень мощный эффект TLR5 (фиг.S4). Хотя у мышей TLR5KO колонизация R. hominis все еще влияла на клеточные каскады, ответы были в большей степени связаны с каскадами IL4, IL5, IL-6, IL-9, но не IL-10 и CTLA-4 (таблица S6). Более того, количества двойных положительных клеток CD3+FoxP3+ в собственной пластинке мышей TLR5KO не увеличивались посредством обработки R. hominis (фиг.6E), в противоположность моноассоциированным животным C3H/HeN и C57Bl6 (фиг.5A).
Таблица S6. Анализ каскада ответа иммунной системы в отношении транскриптов, дифференциально экспрессируемых в восходящей ободочной кишке между мышами TLR5 KO и мышами WT, моноколнизированными R. hominis. Дифференциально экспрессированные гены (P<0,05) импортировали в аналитическое программное обеспечение GeneGo MetaCore для определения значительно усиленных канонических каскадов в каждой группе. * Число генов на каждой карте, которые дифференциально экспрессировались при конкретном сравнении введений. ** Число генов на каждой карте.
Наблюдение в настоящем описании, что R. hominis влияют на Treg у общепринятых безмикробных мышей, но не у TLR5KO, согласуется с сообщениями о взаимодействиях флагеллин-TLR5, стимулирующих CD4+CD25+Foxp3+ регуляторные T-клетки (Crellin et al. 2005, Hossain et al. 2011). Аналогично, недавно была описана способность слитого белка флагеллин-овальбумин подавлять продукцию IL-4 CD4(+) T-клетками посредством OVA-T-клеточного рецептора через зависимый от IL-10 механизм (Schulke et al. 2011), что указывает на то, что флагеллин может влиять на направленную дифференцировку подгрупп T-клеток. Кроме того, влияние TLR5KO на T-клеточные ответы, запускаемые R. hominis, подразумевает, что RH1 (флагеллин передачи сигнала) был ключевым для опосредования ответов Treg, но не RH2 (не передающий сигнал флагеллин). Наконец, дополнительное наблюдение состояла в усилении генов IFN типа I у мышей TLR5KO (включая Ifi202b, Ifi203 и Irf4), что указывает на то, что передача сигнала TLR5 может ослабить ответы интерферона типа I.
R. hominis модулируют гены врожденного иммунного ответа как в подвздошной кишке, так и в ободочной кишке, и ослабляют колит у мышей, которым вводили DSS
Модель на мышах с DSS использовали для исследования терапевтической эффективности R. hominis, вследствие контроля воспалительных каскадов, а также положительных эффектов на индукцию Treg у моноассоциированных мышей. Мышам проводили дозирование (~50 мкл, 109 к.о.е.) каждые сутки в течение 14 суток, и вводили DSS (ММ 50 кДа, 30 г/л) в их питьевой воде, начиная с 8 суток. Экспрессия генов на панели провоспалительных маркеров показана, что мыши с DSS, которым не проводили введение, имели мощную активацию всех исследованных генов по сравнению с мышами дикого типа, причем индукция генов находилась в диапазоне от 4 до 49 раз (фиг.7A). Индукция провоспалительных генов была значимо более низкой у мышей, которым вводили R. hominis, по сравнению с мышами без введения, что указывает на высокую терапевтическую пользу перорального введения R. hominis. Гистологический анализ показал присутствие тяжелого воспаления в восходящей ободочной кишке мышей с DSS, которым не проводили введение, в то время как слизистая оболочка ободочной кишки животных, которым вводили R. hominis, была нормальной с воспалением на низком уровне, что соответствует сниженной экспрессии воспалительных генов (фиг.7B и C).
Колонизация R. hominis влияет на композицию тела и экспрессию генов насыщения
Значительное метаболическое действие R. hominis у моноассоциированных мышей также было очевидным. Все из процессов GO "отрицательная регуляция в ответа на пищу" (GO:0032096), "отрицательная регуляция аппетита" (GO:0032099), и "регуляция секреции катехоламинов" (GO:0050433) подавлялись в восходящей ободочной кишке после колонизации R. hominis (фиг.S5). Эти данные указывают на то, что R. hominis оказывают стимулирующий эффект на аппетит хозяина. Гены, вовлеченные в эти процессы, представляли собой Agt, Cartpt, Cck и Cxcl12, с кратностью изменений в диапазоне от 2 до 12 раз. Cck, в частности, играет основную роль в переваривании и насыщении в качестве подавляющего голод фактора. Gcg также продемонстрировал подавление в этой области кишечника.
Для установления того, имели ли эти изменения генов физиологическое значение в отношении употребления пищи и композиции тела, проводили анализы сухой массы и композиции туши. Сухая масса туши мышей, ассоциированных с R. hominis, была значительно более тяжелой по сравнению с животными GF, и отличия были наиболее различимыми на 14 сутки (фиг.S6A). Следующий анализ липидов туши показал, что общее содержание жировой ткани также было значимо более высоким у животных, которым вводили R. hominis, на 14 сутки (фиг.S6B). Эти данные согласуются с недавно полученными данными, демонстрирующими роль Firmicutes в запасании энергии посредством ферментации пищи, но также подтверждают мнение, что бактерии кишечника в действительности могут модулировать нервную регуляцию пищеварительной системы и регулирующие аппетит гормоны.
Обсуждение
Длительная совместная эволюция мутуализма хозяин-микроорганизм, вероятно запустила селекцию функционально важных видов бактерий в кишечнике, большинство из которых не представлены на высоком уровне в других экосистемах. В настоящее время существует ограниченная информация, касающаяся вклада индивидуальных представителей микробного сообщества в функции кишечника, в частности, в отношении развития иммунной системы слизистых оболочек.
Недавно проведенная работа с использованием модели обратимой колонизации на основе E. coli (HA 107) продемонстрировала, что живые бактерии требуются в количествах, достигающих 108 к.о.е. на грамм содержимого, для иммунной индукции эффектов на IgA (Hapfelmeier et al. 2010). Конкретные функции SFB и Bacteroides fragilis были исследованы в кишечнике мышей для определения их индивидуальных вкладов в биологи T-клеток и было показано, что обе из этих бактерий являются мощными индукторами клеток Treg и Th17 (Mazmanian et al. 2005, Gaboriau-Routhiau et al. 2009, Ivanov et al. 2009). Эффекты индивидуальных представителей кластера XIVa Firmicutes не были сообщены ранее, хотя их присутствие в ASF и был отмечен вклад смешанной культуры 46 штаммов клостридий, которая также влияет на дифференцировку T-клеток (Geuking et al. 2011, Atarashi et al. 2011).
В настоящем описании описана первая успешная моноассоциация кишечника безмикробной мыши с анаэробными бактериями R. hominis, которые являются представителями типа Firmicutes. Чрезвычайная чувствительность бактерий, таких как Roseburia, к кислороду требует жестких анаэробных способов культивирования, что затрудняя проведение функциональной охарактеризации. Стабильная моноколнизация R. hominis у безмикробных мышей была достигнута и была получена полная аннотированная геномная последовательность, раскрывающая ее метаболомную организацию, физиологию и симбиотические свойства. Было обнаружено, что транскрипционные ответы R. hominis после колонизации могут быть отнесены как к среде кишечника человека, так и к рациону. Среди запускаемых у хозяина эффектов доминировал ответ R. hominis после моноассоциации. Он включал подсистемы переноса генов, мембранного транспорта, хемотаксиса и подвижности. Выраженная активация генов, вовлеченных в мобилизационный перенос, подтверждает точку зрения, что среда кишечника является в высокой степени способствующей горизонтальному обмену генами между членами микробиоты кишечника. Таким образом, эта среда может ускорить распространение генов, важных для выживания бактерий, колонизации и функционирования в экосистеме кишечника. Роль подвижности и жгутикового аппарата в колонизации хозяина была тщательно исследована для патогенных бактерий, но значительно меньше известно о роли жгутиковых белков в комменсальных бактериях. Эксперименты in vivo выявили стимулирующий эффект кишечной среды хозяина на экспрессию генов флагеллина.
Была установлена очевидная роль R. hominis в обеспечении функции барьера кишечника и врожденного иммунитета в ободочной кишке мыши. Плотные соединения, щелевые контакты и адгезионные контакты функционируют, ограничивая перемещение бактерий в субэпителиальный слой (Werth et al. 2010). Как болезнь Крона, так и язвенный колит, характеризуются утратой барьерной функции и целостностью плотных соединений. Интересно, что дисбиоз микробиоты кишечника при IBD ассоциирован с уменьшением числа Firmicutes (Spor, Koren & Ley 2011, Qin et al. 2010). Наблюдение, сделанное в рамках настоящего изобретения, что R. hominis активно повышает экспрессию барьерных генов, указывает на то, что их утрата у пациентов IBD может быть функционально значимой. Активация комплексов плотного соединения не является прерогативой только R. hominis; другие комменсалы, такие как Bacteroides thetaiotaomicron и Lactobacillus acidophilus, также усиливают барьерную функцию слизистой оболочки (Hooper et al. 2001, Ukena et al. 2007), что предполагает пробиотические возможности для этих бактерий при IBD у человека.
Эффекты R. hominis на иммунную систему кишечника являются интересными. Наиболее выраженные эффекты были отмечены в восходящей ободочной кишке и гены, такие как Ly6g6c, в высокой степени активировались, также как и каскады, вовлеченные в регуляцию и дифференцировку T-клеток и полимеризацию актина в иммунном синапсе, которые вовлечены в активацию T-клеток и эффекторные функции. Подвергнутые наибольшему влиянию каскады T-клеток включали каскады, связанные с IL-10, ICOS и CTLA-4, все из которых вовлечены в поддержание дифференцировки Treg. Важно, что было продемонстрировано значительное увеличение количества клеток CD3+CD4+CD25+FoxP3+ в ободочной кишке безмикробных мышей и обычных мышей, колонизированных R. hominis, при использовании как проточной цитометрии, так и иммуноцитохимии. Эти данные дополняют недавние данные, полученные для других видов Clostridium, которые запускают дифференцировку Treg. Очевидно, что R. hominis в качестве единственного бактериального вида может стимулировать экспансию T-клеток слизистых оболочек и влиять на дифференцировку T-клеток.
Сигналы флагеллина воспринимаются рецепторами TLR5 хозяина и многие патогенные структуры флагеллина индуцируют выраженные провоспалительные ответы (Hayashi et al. 2001). Передача сигнала через TLR5 в ответ на резидентных жгутиковых комменсалов может быть важной для гомеостаза, поскольку делеция TLR5 приводит к спонтанному колиту у мышей (Vijay-Kumar et al. 2007). Усиленная экспрессия флагеллина FlaA1 (RH1) R. hominis in vivo и его эффективность в отношении активации эпителиальных клеток и BMDC, представляет большой интерес. В другой работе было показано, что E. coli, являющиеся мутантами по флагеллину, имеют преимущество при колонизации над жгутиковыми штаммами дикого типа, возможно вследствие отсутствия врожденного распознавания посредством передачи сигнала TLR5 (De Paepe et al. 2011, Giraud et al. 2008). В настоящем описании показано, что для определенных Firmicutes экспрессия или возможная активация флагеллина является природным ответом на колонизацию кишечника. Белок флагеллина R. hominis остается экспрессированным in vivo и коррелирует с непрерывной колонизацией, отсутствием явного воспаления и экспансией T-клеток регуляторного фенотипа. Недавнее подтверждение генов флагеллина в SFB (Prakash et al. 2011, Sczesnak et al. 2011) может коррелировать с ответами T-клеток хозяина, индуцированными этой бактерией (Gaboriau-Routhiau et al. 2009, Ivanov et al. 2009). Интересно, что RH1 индуцировал уникальный эффект как в эпителиальных культурах, так и в культурах DC, по сравнению с другими флагеллинами, хотя все исследованные структуры обладают консервативным Arg90, ассоциированным с флагеллинами, которые связываются и активируют TLR5 (Yoon et al. 2012), что указывает на то. что другие отличия последовательности/структурные отличия, могут объяснить уникальные ответы передачи сигнала, опосредуемые RH1. Значимость передачи сигнала флагеллин-TLR5 в ответах Treg, индуцированных R. hominis, была подтверждена с использованием TLR5KO. Без связи с теорией, определенные комменсальные структуры флагеллина могут помочь обеспечивать ответы иммунной толерантности через TLR5, экспрессируемый либо на подгруппе CD103+DC, либо на подгруппе Treg (Flores-Langarica et al. 2012, Kinnebrew et al. 2012, Crellin et al. 2005). Более того, иммунный гомеостатический эффект R. hominis был подтвержден у мышей, которым вводили DSS, хотя другие части, передающие сигнал, такие как бутират, также могут вносить вклад в иммунную толерантность. Эти данные указывают на потенциальную терапевтичекую пользу R. hominis при IBD.
Интересным дополнительным биологическим эффектом колонизации R. hominis была регуляция генов, влияющих на ответы на пищу и контроль аппетита. В частности, уровни гормонов сытости Cck и Gcg были значительно снижены. Эффекты Cck на употребление пищи опосредуется вагусным афферентным путем. Он является основным нервным проводящим путем, посредством которого информация об употребленных питательных веществах достигает центральной нервной системы, влияя как на функцию кишечника, так и на пищевое поведение. Cck действует на вагусную систему, снижая экспрессию молекул, которые стимулируют аппетит и употребление пищи, и увеличивая экспрессию молекул, которые ингибируют употребление пищи и снижают аппетит (как Npy2r, так и Cartpt подавляются в два раза в настоящем исследовании). На настоящий момент отсутствуют сообщения о связи между Cck, Gcg и комменсальными бактериями, однако, как жирные кислоты, так и белки, являются мощными индукторами Cck и Gcg (Geraedts et al. 2010). R. hominis продуцируют короткоцепочечные жирные кислоты, такие как бутират, с алифатическими хвостовыми частями менее шести атомов углерода; было сообщено, что эта метаболическая активность снижает стимулирующий эффект на Cck в плазме, наблюдаемый в случае жирных кислот с более длинной цепью (McLaughlin et al. 1999). Анализ массы туши выявил, что как масса тела, так и содержание липидов были действительно значительно увеличенными в случае R. hominis, что согласуется с увеличениями массы тела, наблюдаемой при конвенционализации безмикробных мышей (Turnbaugh et al. 2006). То, является ли это прямым эффектом снижения уровня гормонов насыщения, как видно в настоящем исследовании, еще предстоит узнать, поскольку вовлечение Cck и Gcg не было описано ранее. Однако важно признать, что связь между колонизацией микробиотой и накоплением энергии из рациона, частично посредством высвобождения SCFA, была показана ранее (Turnbaugh et al. 2006) (Tremaroli, Kovatcheva-Datchary & Backhed 2010). Учитывая, что R. hominis является основным продуцентом бутирата, этот механизм, вероятно, также вносит вклад в метаболическую эффективность, наблюдаемую после введения R. hominis.
В общем, моноассоциация кишечника мыши с R. hominis индуцировала мощную двунаправленную экспрессию генов, кульминацией которых является комменсальная бактериальная адаптация и толерантность хозяев. Продукт флагеллин RH1, по-видимому, проявляет уникальный эффект передачи сигнала, который предпочтительно запускает экспансию Treg. Была продемонстрирована важность TLR5 для обеспечения дифференцировки и экспансии Treg. В совокупности, эти данные подчеркивают дополнительную функциональность комменсальных флагеллинов, передачи сигнала TLR5 и суммарного направления ответа T-клеток слизистой оболочки.
Функциональные анализы
Модель in vitro
Анализ ответа эпителиальных клеток кишечника (IEC) на различные рекомбинантные флагеллины.
Молекулярный анализ экспрессии гена CCL20 (провоспалительный ген) после стимуляции IEC различными рекомбинантными флагеллинами (фиг.D.2) показал, что патогенные флагеллины (SE, ST, LF и HM) индуцировали сходные, но не идентичные уровни мРНК CCL20, комменсальные флагеллины проявляли значительно более выриабельные уровни индукции. Флагеллины ER (Eubacterium rectale 33656), K12 (Escherichia coli K12), RH1 и RI3 индуцировали CCL20 на сходных уровнях с патогенными флагеллинами, RI1 и RI4 имели промежуточную стимулирующую активность, RH2 был выявлен в качестве низкого индуктора CCL20 в HT-29 и был лишен агонистического потенциала в клетках Caco-2, и RI2 не имел поддающейся обнаружению активности в обеих клеточных линиях. В заключение, авторы изобретения выделили три категории агонистов TLR5 (i) агонисты с отсутствием иммуностимулирующей активности или очень низкой иммуностимулирующей активностью, (ii) агонисты с промежуточной иммуностимулирующей активностью и (iii) агонисты с высокой иммуностимулирующей активностью.

В таблице D2 указаны значимые отличия между каждой обработкой, вычисленные с использованием парного t-критения в HT-29 (сверху справа) и Caco-2 (снизу слева). Использованные T-критерии были односторонними для сравнения обработок для нестимулированных клеток (unstim) и двухсторонними для сравнения одной обработки с другой. NS (нет значимых отличий); *(p<0,05); ** (p<0,01); *** (p<0,001).
Клеточный и иммунологический анализ эффектов рекомбинантных флагеллинов на IEC определяли путем измерения уровней секретируемых цитокинов CXCL8, CXCL10 и CCL2 (MCP-1). IEC стимулировали в течение 24 часов рекомбинантными флагеллинами (фиг.D3).
Флагеллины ST, SE, K12, ER, RI3 и RH1 индуцировали секрецию вариабельных, но сходных уровней хемокинов IL-8, IP-10 и MCP-1, в то время как RI1, RI2, RI4 и RH2, особенно в Caco-2, выступали в качестве низких агонистов TLR5, индуцируя значимо более низкие количества секретируемых хемокинов.


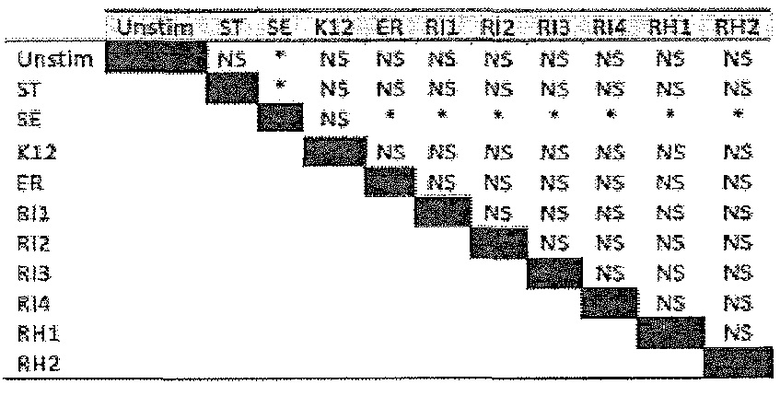
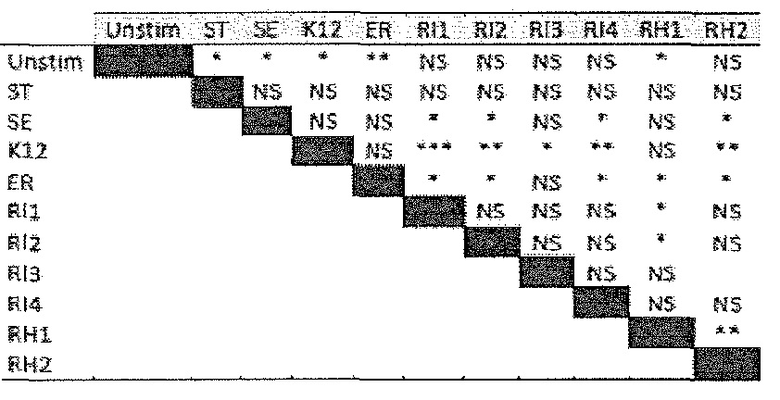
В таблицах D3a, D3b, D3c и D3d указаны значимые отличия между каждой обработкой, вычисленные с использованием парного t-критерия. На верхней правой стороне таблицы D3a и D3b приведены значения t для IL-8 и на нижней левой стороне для IP-10, и в таблицах D3c и D3d приведены значения t для MCP-1. NS (нет значимых отличий); *(p<0,05); ** (p<0,01); *** (p<0,001).
Как показано на фиг.D4, нейтрализация TLR5 специфическим антителом против TLR5 устраняла опосредуемый флагеллином воспалительный ответ, независимо от комменсального или патогенного происхождения флагеллина. Таким образом, провоспалительные эффекты флагеллина, набллюдаемые в клетках Caco-2, являются зависимыми от активации TLR5.
Получение происходящих из костного мозга дендритных клеток и культур
Костный мозг извлекали из бедренной и большеберцовой кости мышей C3H/HeN и C57Bl6. Для полученных с помощью GMCSF дендритных клеток клетки костного мозга ресуспендировали при 1x106/мл в RPMI, дополненной 10% FCS и 20 нг/мл rmGM-CSF и высевали в количестве 10 мл/планшет в 100-мм2 планшетах для культивирования тканей. После культивирования в течение трех суток неплотно прикрепившиеся клетки собирали и пересевали в среду, дополненную GM-CSF, в количестве 1x106/мл в 12-луночных планшетах для культивирования тканей. На 5 сутки клетки стимулировали 100 нг/мл флагеллинов, а затем на 6 сутки собирали. Для полученных с помощью Flt3L дендритных клеток, клетки костного мозга ресуспендировали в количестве 2x106/мл в RPMI, дополненной 10% FCS и 200 нг/мл rmFlt3, и высевали в количестве 2 мл/лунка в 12-луночные планшеты для культивирования тканей. Клетки культивировали в течение 10 суток, причем в каждую лунку добавляли среду, дополненную Flt3, на 4 сутки. На 9 сутки клетки стимулировали посредством 100 нг/мл флагеллинов, а затем собирали на 10 сутки и анализировали проточной цитометрией.
Проводили проточно-цитометрический анализ полученных с помощью GM-CSF/IL-4 дендритных клеток (фиг.D5) и полученных с помощью Flt3L дендритных клеток (фиг.D6), стимулированных рекомбинантными флагеллинами. Флагеллин Rh1 был наиболее мощным в отношении индукции клеточного ответа в полученных с помощью GM-CSF/IL-4 дендритных клетках, причем Ri4 и Ri3 имели сходный ответ с комменсальными флагеллинами K12 и Er и патогенными флагеллинами SE и ST. В противоположность этому, Rh2 и Ri2 не индуцировали клеточный ответ в полученных с помощью GM-CSF/IL-4 дендритных клетках, но значительно увеличивали клеточные ответы в полученных с помощью Flt3L дендритных клетках. Эти флагеллины и, в частности, Ri1, являются особенными вследствие их способности обеспечивать различные ответы с активацией полученных с помощью Flt3L дендритных клеток. Этот ответ означает специфичность флагеллинов к конкретной подгруппе дендритных клеток. Эти полученные с помощью Flt3L дендритные клетки отнесены к категории плазмацитоидных дендритных клеток, которые играют важную роль в иммунологической толерантности.
Модель in vivo
Мышей BOY/J WT и TLR5KO использовали для оценки функциональной важности R. hominis и их флагеллинов. Мышей колонизировали R. hominis. Животных умерщвляли и проводили взятие образцов тканей кишечника. Тонкий кишечник собирали для иммунологического анализа посредством проточной цитометрии.
Проводили проточно-цитометрический анализ популяций T-клеток, в частности, T-регуляторных (Treg) клеток, в собственной пластинке тонкого кишечника (фиг.6A и B). Процент клеток FoxP3+CD25+ в популяции CD4+ T-клеток был значительно более высоким у мышей BOY/J WT по сравнению с мышами TLR5KO. Это указывает на то, что R. hominis и, более конкретно, флагеллины влияют на T-reg путем стимуляции CD4+ FoxP3+CD25+ регуляторных T-клеток. Таким образом, можно сделать заключение, что флагеллины являются важными в отношении контроля иммунного ответа хозяина посредством взаимодействий TLR5.
Обобщающие положения
Настоящее изобретение определено в формуле изобретения и в прилагаемом описании. Для удобства другие аспекты настоящего изобретения представлены в настоящем описании в качестве пронумерованных положений.
1. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для регуляции иммунной системы индивидуума.
2. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, согласно положению 1 для применения для регуляции адаптивной иммунной системы индивидуума.
3. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, согласно положению 1 для применения для регуляции врожденной иммунной системы индивидуума.
4. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для поддержания иммунного гомеостаза у индивидуума.
5. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для лечения иммунного нарушения у индивидуума.
6. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно положению 5, где иммунное нарушение выбрано из язвенного колита, резервуарного илеита, других аутоиммунных состояний, включая ревматоидный артрит, псориаз, рассеянный склероз, аллергии, включая глютеновую болезнь, атопический дерматит и ринит.
7. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для лечения нарушения, выбранного из воспалительного нарушения, иммунного нарушения и нарушения кишечника у индивидуума.
8. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно положению 7, где нарушение выбрано из синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), включая болезнь Крона и язвенный колит, резервуарного илеита, функциональной диспепсии, функционального запора, функциональной диареи (включая ассоциированную с антибиотиками диарею, диарею путешественников и педиатрическую диарею), функциональной боли в животе, функционального вздутия, синдрома боли в эпигастрии, постпрандиального дистресс-синдрома, желудочно-кишечного рефлюксного заболевания (GERD), аутоиммунных заболеваний, таких как диабет, артрит, рассеянный склероз и псориаз, аллергии, атопических заболеваний, например, атопического дерматита, некротизирующего энтероколита, других инфекций и их комбинаций.
9. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для улучшения микробиоты кишечника у индивидуума.
10. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для регуляции аппетита у индивидуума.
11. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для обеспечения здоровья кишечника у индивидуума.
12. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения для стимуляции клеток Treg и механизмов толерантности в иммунной системе индивидуума.
13. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из положений 1-12, которые регулируют индукцию и/или экспрессию по меньшей мере одного гена мобилизации или хемотаксиса.
14. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно положению 13, которые активируют экспрессию по меньшей мере одного гена мобилизации или хемотаксиса, и где указанный ген выбран из MobA и MobL.
15. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые регулируют по меньшей мере один ген, выбранный из FlaA1, Fla2, FlaA3 и FlaB.
16. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые регулируют экспрессию по меньшей мере одного из следующих: ацетил-CoA-ацетилтрансфераза, 3-гидроксиацил-CoA-дегидрогеназа, бутирил-CoA-дегидрогеназа, бета-субъединица флавопротеина переноса электронов, альфа-субъединица флавопротеина переноса электронов.
17. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые подавляют экспрессию по меньшей мере одного гена, выбранного из Agt, Cartpt, Cck, Cxcl12 и Gcg.
18. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые активируют по меньшей мере один ген иммунного ответа в ободочной кишке или подвздошной кишке.
19. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1 и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые активируют адаптивный иммунный ответ посредством регуляции индукции и/или экспрессии генов, ассоциированных с регуляцией T-клеток.
20. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые активируют экспрессию по меньшей мере одного гена, выбранного из Ly6g6c и Ly6g6e в восходящей ободочной кишке.
21. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1 и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения согласно любому из предшествующих положений, которые регулируют экспрессию по меньшей мере одного гена, выбранного из Tlr5, Tlr1, Vnn1, Defb37, Pla2g, Muc16, ltln, Sprr1a, Cldn4, Pmp22, Crb3, Magi3, Marveld3, Mpp7, Defcr20, Pcgf2, Ltbp4, lgsf8 и Tcfe2a.
22. Применение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, для получения лекарственного средства для регуляции иммунной системы индивидуума.
23. Применение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, согласно положению 22 для получения лекарственного средства для регуляции врожденной иммунной системы индивидуума.
24. Применение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, согласно положению 22, для получения лекарственного средства для регуляции адаптивной иммунной системы индивидуума.
25. Применение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, для получения лекарственного средства для поддержания иммунного гомеостаза у индивидуума.
26. Применение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, для получения лекарственного средства для лечения иммунного нарушения у индивидуума.
27. Способ регуляции иммунной системы индивидуума, причем указанный способ включает введение индивидууму композиции, содержащей Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
28. Способ активации врожденной иммунной системы у индивидуума, причем указанный способ включает введение индивидууму композиции, содержащей Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
29. Способ активации адаптивной иммунной системы индивидуума, причем указанный способ включает введение индивидууму композиции, содержащей Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
30. Способ лечения иммунного нарушения у индивидуума, причем указанный способ включает введение индивидууму фармацевтически эффективного количества Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность.
31. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность для применения согласно любому из положений 1-21, или способ согласно любому из положений 27-30, или применение согласно любому из положений 22-26, где индивидуумом является млекопитающее.
32. Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидная последовательность, кодирующая указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, для применения в медицине.
33. Фармацевтическая композиция, содержащая Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и фармацевтически приемлемый эксципиент, носитель или разбавитель.
34. Питательная добавка, содержащая Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность, и диетологически приемлемый эксципиент, носитель или разбавитель.
35. Пробиотическая композиция, содержащая Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
36. Пищевое вещество, продукт питания, диетическая добавка, питательная добавка или пищевая добавка, содержащие Roseburia (такие как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептид FlaA1, и/или полинуклеотидную последовательность, кодирующую указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотид, кодирующий указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
37. Процесс получения фармацевтической композиции согласно положению 32, причем указанный процесс включает смешение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, с фармацевтически приемлемым эксципиентом, носителем или разбавителем.
38. Процесс получения питательной добавки согласно положению 33, причем указанный процесс включает смешение Roseburia (таких как вид бактерий Roseburia hominis или вид бактерий Roseburia intestinalis), и/или полипептида FlaA1, и/или полинуклеотидной последовательности, кодирующей указанный полипептид и/или флагеллин Roseburia, и/или полинуклеотида, кодирующего указанный флагеллин Roseburia, и/или вектора, и/или клетки-хозяина, содержащей указанный вектор, и/или клетки-хозяина, содержащей указанную полинуклеотидную последовательность, с диетологически приемлемым эксципиентом, носителем или разбавителем.
ОБОБЩАЮЩИЕ АБЗАЦЫ
Для удобства другие аспекты настоящего изобретения представлены в настоящем описании в качестве пронумерованных абзацев.
1. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для модулирования воспаления ткани или органа у индивидуума.
2. Полипептид или полинуклеотид согласно абзацу 1, где указанный полипептид или полинуклеотид снижают воспаление ткани или органа.
3. Полипептид или полинуклеотид согласно абзацу 2, где указанный полипептид или полинуклеотид снижают воспаление эпителиальных клеток ткани или органа.
4. Полипептид или полинуклеотид согласно абзацу 3, где указанные эпителиальные клетки представляют собой эпителиальные клетки пищеварительного тракта.
5. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для модулирования продукции T-клеток у индивидуума; предпочтительно, полипептид или полинуклеотид увеличивают продукцию регуляторных T-клеток у индивидуума.
6. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для восстановления иммунологической толерантности.
7. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции иммунной системы и восстановления иммунологической толерантности индивидуума.
8. Полипептид или полинуклеотид согласно абзацу 7 для применения для регуляции адаптивной иммунной системы индивидуума.
9. Полипептид или полинуклеотид согласно абзацу 7 для применения для регуляции врожденной иммунной системы индивидуума.
10. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для лечения нарушения у индивидуума, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
11. Полипептид или полинуклеотид согласно абзацу 10, где указанное нарушение влияет на пищеварительный тракт или ее отдел у указанного индивидуума.
12. Полипептид или полинуклеотид согласно абзацу 10, где указанное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
13. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для модулирования дендритных клеток и/или эпителиальных клеток в ткани или органе индивидуума.
14. Полипептид или полинуклеотид согласно абзацу 13, где указанный полипептид или полинуклеотид активирует дендритные клетки и/или эпителиальные клетки.
15. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции продукции IL-10 и/или TGFβ в клетке или клетках индивидуума.
16. Полипептид или полинуклеотид согласно абзацу 15, где продукция IL-10 осуществляется дендритными клетками.
17. Полипептид или полинуклеотид согласно абзацу 15 или 16, где указанный полипептид или полинуклеотид активирует продукцию IL-10 и/или TGFβ.
18. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции продукции CD40 и/или I-A/I-E в клетке или клетках индивидуума.
19. Полипептид или полинуклеотид согласно абзацу 18, где продукция CD40 и/или I-A/I-E осуществляется дендритными клетками.
20. Полипептид или полинуклеотид согласно абзацу 18 или 19, где указанный полипептид или полинуклеотид активирует продукцию CD40 и/или I-A/I-E.
21. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции экспрессии одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
22. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции экспрессии одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
23. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для улучшения микробиоты кишечника у индивидуума.
24. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции аппетита у индивидуума.
25. Полипептид или полинуклеотид согласно абзацу 24, где указанный полипептид или полинуклеотид стимулируют аппетит у индивидуума.
26. Полипептид или полинуклеотид согласно абзацу 24 или 25, где уровень холицистокинина (Cck) и/или глюкагона (Gcg) снижен в крови индивидуума.
27. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для регуляции экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума.
28. Полипептид FlaA1 или полинуклеотидная последовательность, кодирующая указанный полипептид, для применения для улучшения здоровья пищеварительного тракта у индивидуума.
29. Полипептид или полинуклеотид согласно любому из абзацев 1-28, где указанный полипептид или полинуклеотид являются инкапсулированными.
30. Фармацевтическая композиция, содержащая полипептид FlaA1 или полинуклеотидную последовательность, кодирующую указанный полипептид, и фармацевтически приемлемый эксципиент, носитель или разбавитель.
31. Фармацевтическая композиция согласно абзацу 30, где указанный полипептид или полинуклеотид являются инкапсулированными.
32. Питательная добавка, содержащая полипептид FlaA1 или полинуклеотидную последовательность, кодирующую указанный полипептид, и диетологически приемлемый эксципиент, носитель или разбавитель.
33. Питательная добавка согласно абзацу 32, где указанный полипептид или полинуклеотид являются инкапсулированными.
34. Пищевое вещество, продукт питания, диетическая добавка или пищевая добавка, содержащая полипептид FlaA1 или полинуклеотидную последовательность, кодирующую указанный полипептид.
35. Пищевое вещество, продукт питания, диетическая добавка или пищевая добавка согласно абзацу 34, где указанное пищевое вещество, продукт питания, диетическая добавка или пищевая добавка являются инкапсулированными.
36. Процесс получения фармацевтической композиции согласно абзацу 30, причем указанный процесс включает смешение указанного полипептида или полинуклеотида с фармацевтически приемлемым эксципиентом, носителем или разбавителем; необязательно указанный полипептид или полинуклеотид являются инкапсулированными.
37. Процесс получения питательной добавки согласно абзацу 32, причем указанный процесс включает смешение указанного полипептида или полинуклеотида с диетологически приемлемым эксципиентом, носителем или разбавителем; необязательно указанный полипептид или полинуклеотид являются инкапсулированными.
38. Способ модулирования воспаления ткани или органа у индивидуума, причем указанный способ включает введение индивидууму полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит модулирование воспаления ткани или органа у индивидуума.
39. Способ модулирования продукции T-клеток у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит модулирование продукции T-клеток у индивидуума, в частности регуляторных T-клеток.
40. Способ регуляции иммунной системы у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит регуляция иммунной системы индивидуума.
41. Способ лечения нарушения у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
42. Способ модулирования дендритных клеток и/или эпителиальных клеток у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит модулирование дендритных клеток и/или эпителиальных клеток у индивидуума.
43. Способ регуляции продукции IL-10 и/или TGFβ в клетке или клетках индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, индивидууму, и где происходит регуляция продукции IL-10 и/или TGFβ в клетке или клетках индивидуума.
44. Способ регуляции продукции CD40 и/или I-A/I-E в клетке или клетках индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, индивидууму, и где происходит регуляция продукции CD40 и/или I-A/I-E в клетке или клетках индивидуума.
45. Способ регуляции экспрессии одного или нескольких генов IFN типа I в клетке или клетках индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, где происходит регуляция экспрессии одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
46. Способ регуляции экспрессии одного или нескольких провоспалительных генов в клетке или клетках индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, где происходит регуляция экспрессии одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
47. Способ улучшения микробиоты кишечника у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит улучшение микробиоты кишечника у индивидуума.
48. Способ регуляции аппетита у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит регуляция аппетита у индивидуума.
49. Способ регуляции экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит регуляция экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума.
50. Способ улучшения здоровья пищеварительного тракта у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где происходит улучшение здоровья пищеварительного тракта у индивидуума.
51. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для модулирования воспаления ткани или органа у индивидуума.
52. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для модулирования продукции T-клеток у индивидуума.
53. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции иммунной системы индивидуума.
54. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для лечения нарушения у индивидуума, где указанное нарушение представляет собой воспалительное нарушение и/или аутоиммунное нарушение.
55. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для модулирования дендритных клеток и/или эпителиальных клеток в ткани или органе индивидуума.
56. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции продукции IL-10 и/или TGFβ в клетке или клетках индивидуума.
57. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции продукции CD40 и/или I-A/I-E в клетке или клетках индивидуума.
58. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции экспрессии одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
59. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции экспрессии одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
60. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для улучшения микробиоты кишечника у индивидуума.
61. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции аппетита у индивидуума.
62. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для регуляции экспрессии гена, кодирующего холицистокинин (Cck), и/или экспрессии гена, кодирующего глюкагон (Gcg), в клетке или клетках индивидуума.
63. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для улучшения здоровья пищеварительного тракта у индивидуума.
64. Применение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, для изготовления лекарственного средства для восстановления иммунологической толерантности у индивидуума.
65. Способ восстановления иммунологической толерантности у индивидуума, причем указанный способ включает введение полипептида FlaA1 или полинуклеотидной последовательности, кодирующей указанный полипептид, и где иммунологическая толерантность у индивидуума восстанавливается.
ССЫЛКИ:
Aminov, R.I., Walker, A.W., Duncan, S.H., Harmsen, H.J., Welling, G.W. & Flint, H.J. 2006, "Molecular diversity, cultivation, and improved detection by fluorescent in situ hybridization of a dominant group of human gut bacteria related to Roseburia spp. or Eubacterium rectale", Applied and Environmental Microbiology, vol. 72, no. 9, pp. 6371-6376.
Atarashi, K., Tanoue, T., Shima, T., Imaoka, A., Kuwahara, T., Momose, Y., Cheng, G., Yamasaki, S., Saito, T., Ohba, Y., Taniguchi, T., Takeda, K., Hori, S., Ivanov, I.I., Umesaki, Y., Itoh, K. & Honda, K. 2011, "Induction of colonic regulatory T cells by indigenous Clostridium species", Science (New York, N.Y.), vol. 331, no. 6015, pp. 337-341.
Berg, D.J., Davidson, N., Kuhn, R., Muller, W., Menon, S., Holland, G., Thompson-Snipes, L., Leach, M.W. & Rennick, D. 1996, "Enterocolitis and colon cancer in interleukin-10-deficient mice are associated with aberrant cytokine production and CD4(+) TH1-like responses", The Journal of clinical investigation, vol. 98, no. 4, pp. 1010-1020.
Chung, H. & Kasper, D.L. 2010, "Microbiota-stimulated immune mechanisms to maintain gut homeostasis", Current opinion in immunology, vol. 22, no. 4, pp. 455-460.
Crellin, N.K., Garcia, R.V., Hadisfar, O., Allan, S.E., Steiner, T.S. & Levings, M.K. 2005, "Human CD4+ T cells express TLR5 and its ligand flagellin enhances the suppressive capacity and expression of FOXP3 in CD4+CD25+ T regulatory cells", Journal of immunology (Baltimore, Md.: 1950), vol. 175, no. 12, pp. 8051-8059.
De Paepe, M., Gaboriau-Routhiau, V., Rainteau, D., Rakotobe, S., Taddei, F. & Cerf-Bensussan, N. 2011, "Trade-off between bile resistance and nutritional competence drives Escherichia coli diversification in the mouse gut", PLoS genetics, vol. 7, no. 6, pp. e1002107.
Duck, L.W., Walter, M.R., Novak, J., Kelly, D., Tomasi, M., Cong, Y. & Elson, C.O. 2007, "Isolation of flagellated bacteria implicated in Crohn's disease", Inflammatory bowel diseases, vol. 13, no. 10, pp. 1191-1201.
Duncan, S.H., Aminov, R.I., Scott, K.P., Louis, P., Stanton, T.B. & Flint, H.J. 2006, "Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces", International Journal of Systematic and Evolutionary Microbiology, vol. 56, no. Pt 10, pp. 2437-2441.
Eckburg, P.B., Bik, E.M., Bernstein, C.N., Purdom, E., Dethlefsen, L., Sargent, M., Gill, S.R., Nelson, K.E. & Relman, D.A. 2005, "Diversity of the human intestinal microbial flora", Science (New York, N.Y.), vol. 308, no. 5728, pp. 1635-1638.
Flores-Langarica, A., Marshall, J.L., Hitchcock, J., Cook, C., Jobanputra, J., Bobat, S., Ross, E.A., Coughlan, R.E., Henderson, I.R., Uematsu, S., Akira, S. & Cunningham, A.F. 2012, "Systemic flagellin immunization stimulates mucosal CD103+ dendritic cells and drives Foxp3+ regulatory T CELL and IgA responses in the mesenteric lymph node", Journal of immunology (Baltimore, Md.: 1950), vol. 189, no. 12, pp. 5745-5754.
Frank, D.N., St Amand, A.L., Feldman, R.A., Boedeker, E.C., Harpaz, N. & Pace, N.R. 2007, "Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases", Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no. 34, pp. 13780-13785.
Gaboriau-Routhiau, V., Rakotobe, S., Lecuyer, E., Mulder, I., Lan, A., Bridonneau, C., Rochet, V., Pisi, A., De Paepe, M., Brandi, G., Eberl, G., Snel, J., Kelly, D. & Cerf-Bensussan, N. 2009, "The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses", Immunity, vol. 31, no. 4, pp. 677-689.
Geraedts, M.C., Troost, F.J., Tinnemans, R., Soderholm, J.D., Brummer, R.J. & Saris, W.H. 2010, "Release of satiety hormones in response to specific dietary proteins is different between human and murine small intestinal mucosa", Annals of Nutrition & Metabolism, vol. 56, no. 4, pp. 308-313.
Geuking, M.B., Cahenzli, J., Lawson, M.A., Ng, D.C., Slack, E., Hapfelmeier, S., McCoy, K.D. & Macpherson, A.J. 2011, "Intestinal bacterial colonization induces mutualistic regulatory T cell responses", Immunity, vol. 34, no. 5, pp. 794-806.
Giraud, A., Arous, S., De Paepe, M., Gaboriau-Routhiau, V., Bambou, J.C., Rakotobe, S., Lindner, A.B., Taddei, F. & Cerf-Bensussan, N. 2008, "Dissecting the genetic components of adaptation of Escherichia coli to the mouse gut", PLoS genetics, vol. 4, no. 1, pp. e2.
Hapfelmeier, S., Lawson, M.A., Slack, E., Kirundi, J.K., Stoel, M., Heikenwalder, M., Cahenzli, J., Velykoredko, Y., Balmer, M.L., Endt, K., Geuking, M.B., Curtiss, R.,3rd, McCoy, K.D. & Macpherson, A.J. 2010, "Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses", Science (New York, N.Y.), vol. 328, no. 5986, pp. 1705-1709.
Hayashi, F., Smith, K.D., Ozinsky, A., Hawn, T.R., Yi, E.C., Goodlett, D.R., Eng, J.K., Akira, S., Underhill, D.M. & Aderem, A. 2001, "The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5", Nature, vol. 410, no. 6832, pp. 1099-1103.
Hooper, L.V., Wong, M.H., Thelin, A., Hansson, L., Falk, P.G. & Gordon, J.I. 2001, "Molecular analysis of commensal host-microbial relationships in the intestine", Science (New York, N.Y.), vol. 291, no. 5505, pp. 881-884.
Hossain, M.S., Jaye, D.L., Pollack, B.P., Farris, A.B., Tselanyane, M.L., David, E., Roback, J.D., Gewirtz, A.T. & Waller, E.K. 2011, "Flagellin, a TLR5 agonist, reduces graft-versus-host disease in allogeneic hematopoietic stem cell transplantation recipients while enhancing antiviral immunity", Journal of immunology (Baltimore, Md.: 1950), vol. 187, no. 10, pp. 5130-5140.
Ivanov, I.I., Atarashi, K., Manel, N., Brodie, E.L., Shima, T., Karaoz, U., Wei, D., Goldfarb, K.C., Santee, C.A., Lynch, S.V., Tanoue, T., Imaoka, A., Itoh, K., Takeda, K., Umesaki, Y., Honda, K. & Littman, D.R. 2009, "Induction of intestinal Th17 cells by segmented filamentous bacteria", Cell, vol. 139, no. 3, pp. 485-498.
Kang, S., Denman, S.E., Morrison, M., Yu, Z., Dore, J., Leclerc, M. & McSweeney, C.S. 2010, "Dysbiosis of fecal microbiota in Crohn's disease patients as revealed by a custom phylogenetic microarray", Inflammatory bowel diseases, vol. 16, no. 12, pp. 2034-2042.
Kelly, D., Campbell, J.I., King, T.P., Grant, G., Jansson, E.A., Coutts, A.G., Pettersson, S. & Conway, S. 2004, "Commensal anaerobic gut bacteria attenuate inflammation by regulating nuclear-cytoplasmic shuttling of PPAR-gamma and RelA", Nature immunology, vol. 5, no. 1, pp. 104-112.
Kinnebrew, M.A., Buffie, C.G., Diehl, G.E., Zenewicz, L.A., Leiner, I., Hohl, T.M., Flavell, R.A., Littman, D.R. & Pamer, E.G. 2012, "Interleukin 23 production by intestinal CD103(+)CD11b(+) dendritic cells in response to bacterial flagellin enhances mucosal innate immune defense", Immunity, vol. 36, no. 2, pp. 276-287.
Letran, S.E., Lee, S.J., Atif, S.M., Flores-Langarica, A., Uematsu, S., Akira, S., Cunningham, A.F. & McSorley, S.J. 2011, "TLR5-deficient mice lack basal inflammatory and metabolic defects but exhibit impaired CD4 T cell responses to a flagellated pathogen", Journal of immunology (Baltimore, Md.: 1950), vol. 186, no. 9, pp. 5406-5412.
Machiels K., Joossens M., Sabino J., De Preter V., Arijs I., Ballet V., Claes K., Verhaegen J., Van Assche G., Rutgeerts P. & Vermeire S. 2013, "Predominant dysbiosis in patients with ulcerative colitis is different from Crohn's disease patients", Inflammatory Bowel Diseases. 8th Congress of ECCO, Feb 14-16, 2013.
Macpherson, A.J. 2006, "IgA adaptation to the presence of commensal bacteria in the intestine", Current topics in microbiology and immunology, vol. 308, pp. 117-136.
Macpherson, A.J., Hunziker, L., McCoy, K. & Lamarre, A. 2001, "IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms", Microbes and infection / Institut Pasteur, vol. 3, no. 12, pp. 1021-1035.
Macpherson, A.J., Martinic, M.M. & Harris, N. 2002, "The functions of mucosal T cells in containing the indigenous commensal flora of the intestine", Cellular and molecular life sciences : CMLS, vol. 59, no. 12, pp. 2088-2096.
Mahowald, M.A., Rey, F.E., Seedorf, H., Turnbaugh, P.J., Fulton, R.S., Wollam, A., Shah, N., Wang, C., Magrini, V., Wilson, R.K., Cantarel, B.L., Coutinho, P.M., Henrissat, B., Crock, L.W., Russell, A., Verberkmoes, N.C., Hettich, R.L. & Gordon, J.I. 2009, "Characterizing a model human gut microbiota composed of members of its two dominant bacterial phyla", Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no. 14, pp. 5859-5864.
Mallya, M., Campbell, R.D. & Aguado, B. 2006, "Characterization of the five novel Ly-6 superfamily members encoded in the MHC, and detection of cells expressing their potential ligands", Protein science : a publication of the Protein Society, vol. 15, no. 10, pp. 2244-2256.
Mazmanian, S.K., Liu, C.H., Tzianabos, A.O. & Kasper, D.L. 2005, "An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system", Cell, vol. 122, no. 1, pp. 107-118.
McLaughlin, J., Grazia Luca, M., Jones, M.N., D'Amato, M., Dockray, G.J. & Thompson, D.G. 1999, "Fatty acid chain length determines cholecystokinin secretion and effect on human gastric motility", Gastroenterology, vol. 116, no. 1, pp. 46-53.
Monteleone, I., Platt, A.M., Jaensson, E., Agace, W.W. & Mowat, A.M. 2008, "IL-10-dependent partial refractoriness to Toll-like receptor stimulation modulates gut mucosal dendritic cell function", European journal of immunology, vol. 38, no. 6, pp. 1533-1547.
Nutsch, K.M. & Hsieh, C.S. 2012, "T cell tolerance and immunity to commensal bacteria", Current opinion in immunology, vol. 24, no. 4, pp. 385-391.
Prakash, T., Oshima, K., Morita, H., Fukuda, S., Imaoka, A., Kumar, N., Sharma, V.K., Kim, S.W., Takahashi, M., Saitou, N., Taylor, T.D., Ohno, H., Umesaki, Y. & Hattori, M. 2011, "Complete genome sequences of rat and mouse segmented filamentous bacteria, a potent inducer of th17 cell differentiation", Cell host & microbe, vol. 10, no. 3, pp. 273-284.
Qin, J., Li, R., Raes, J., Arumugam, M., Burgdorf, K.S., Manichanh, C., Nielsen, T., Pons, N., Levenez, F., Yamada, T., Mende, D.R., Li, J., Xu, J., Li, S., Li, D., Cao, J., Wang, B., Liang, H., Zheng, H., Xie, Y., Tap, J., Lepage, P., Bertalan, M., Batto, J.M., Hansen, T., Le Paslier, D., Linneberg, A., Nielsen, H.B., Pelletier, E., Renault, P., Sicheritz-Ponten, T., Turner, K., Zhu, H., Yu, C., Li, S., Jian, M., Zhou, Y., Li, Y., Zhang, X., Li, S., Qin, N., Yang, H., Wang, J., Brunak, S., Dore, J., Guarner, F., Kristiansen, K., Pedersen, O., Parkhill, J., Weissenbach, J., MetaHIT Consortium, Bork, P., Ehrlich, S.D. & Wang, J. 2010, "A human gut microbial gene catalogue established by metagenomic sequencing", Nature, vol. 464, no. 7285, pp. 59-65.
Round, J.L., Lee, S.M., Li, J., Tran, G., Jabri, B., Chatila, T.A. & Mazmanian, S.K. 2011, "The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota", Science (New York, N.Y.), vol. 332, no. 6032, pp. 974-977.
Scanlan, P.D., Shanahan, F., O'Mahony, C. & Marchesi, J.R. 2006, "Culture-independent analyses of temporal variation of the dominant fecal microbiota and targeted bacterial subgroups in Crohn's disease", Journal of clinical microbiology, vol. 44, no. 11, pp. 3980-3988.
Schulke, S., Burggraf, M., Waibler, Z., Wangorsch, A., Wolfheimer, S., Kalinke, U., Vieths, S., Toda, M. & Scheurer, S. 2011, "A fusion protein of flagellin and ovalbumin suppresses the TH2 response and prevents murine intestinal allergy", The Journal of allergy and clinical immunology, vol. 128, no. 6, pp. 1340-1348.e12.
Sczesnak, A., Segata, N., Qin, X., Gevers, D., Petrosino, J.F., Huttenhower, C., Littman, D.R. & Ivanov, I.I. 2011, "The genome of th17 cell-inducing segmented filamentous bacteria reveals extensive auxotrophy and adaptations to the intestinal environment", Cell host & microbe, vol. 10, no. 3, pp. 260-272.
Spor, A., Koren, O. & Ley, R. 2011, "Unravelling the effects of the environment and host genotype on the gut microbiome", Nature reviews.Microbiology, vol. 9, no. 4, pp. 279-290.
Tremaroli, V., Kovatcheva-Datchary, P. & Backhed, F. 2010, "A role for the gut microbiota in energy harvesting?", Gut, vol. 59, no. 12, pp. 1589-1590.
Turnbaugh, P.J., Backhed, F., Fulton, L. & Gordon, J.I. 2008, "Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome", Cell host & microbe, vol. 3, no. 4, pp. 213-223.
Turnbaugh, P.J., Ley, R.E., Mahowald, M.A., Magrini, V., Mardis, E.R. & Gordon, J.I. 2006, "An obesity-associated gut microbiome with increased capacity for energy harvest", Nature, vol. 444, no. 7122, pp. 1027-1031.
Ukena, S.N., Singh, A., Dringenberg, U., Engelhardt, R., Seidler, U., Hansen, W., Bleich, A., Bruder, D., Franzke, A., Rogler, G., Suerbaum, S., Buer, J., Gunzer, F. & Westendorf, A.M. 2007, "Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity", PloS one, vol. 2, no. 12, pp. e1308.
Vijay-Kumar, M., Sanders, C.J., Taylor, R.T., Kumar, A., Aitken, J.D., Sitaraman, S.V., Neish, A.S., Uematsu, S., Akira, S., Williams, I.R. & Gewirtz, A.T. 2007, "Deletion of TLR5 results in spontaneous colitis in mice", The Journal of clinical investigation, vol. 117, no. 12, pp. 3909-3921.
Werth, M., Walentin, K., Aue, A., Schonheit, J., Wuebken, A., Pode-Shakked, N., Vilianovitch, L., Erdmann, B., Dekel, B., Bader, M., Barasch, J., Rosenbauer, F., Luft, F.C. & Schmidt-Ott, K.M. 2010, "The transcription factor grainyhead-like 2 regulates the molecular composition of the epithelial apical junctional complex", Development (Cambridge, England), vol. 137, no. 22, pp. 3835-3845.
Wilson, R.H., Maruoka, S., Whitehead, G.S., Foley, J.F., Flake, G.P., Sever, M.L., Zeldin, D.C., Kraft, M., Garantziotis, S., Nakano, H. & Cook, D.N. 2012, "The Toll-like receptor 5 ligand flagellin promotes asthma by priming allergic responses to indoor allergens", Nature medicine, vol. 18, no. 11, pp. 1705-1710.
Yoon, S.I., Kurnasov, O., Natarajan, V., Hong, M., Gudkov, A.V., Osterman, A.L. & Wilson, I.A. 2012, "Structural basis of TLR5-flagellin recognition and signaling", Science (New York, N.Y.), vol. 335, no. 6070, pp. 859-864.
Список ссылок для дополнительной информации
(1) Genome sequence assembly using trace signals and additional sequence information. Computer Science and Biology: Proceedings of the German Conference on Bioinformatics (GCB); 1999.
(2) Aziz RK, Bartels D, Best AA, DeJongh M, Disz T, Edwards RA, et al. The RAST Server: rapid annotations using subsystems technology. BMC Genomics 2008 Feb 8;9:75-2164-9-75.
(3) Dennis G,Jr, Sherman BT, Hosack DA, Yang J, Gao W, Lane HC, et al. DAVID: Database for Annotation, Visualization, and Integrated Discovery. Genome Biol 2003;4(5):P3.
(4) Untergasser A, Nijveen H, Rao X, Bisseling T, Geurts R, Leunissen JA. Primer3Plus, an enhanced web interface to Primer3. Nucleic Acids Res 2007 Jul;35(Web Server issue):W71-4.
(5) Duck LW, Walter MR, Novak J, Kelly D, Tomasi M, Cong Y, et al. Isolation of flagellated bacteria implicated in Crohn's disease. Inflamm Bowel Dis 2007 Oct;13(10):1191-1201.
(6) Berg DJ, Davidson N, Kuhn R, Muller W, Menon S, Holland G, Thompson-Snipes L, Leach MW, Rennick D. Enterocolitis and colon cancer in interleukin-10-deficient mice are associated with aberrant cytokine production and CD4(+) TH1-like responses. J.Clin.Invest., 1996, 98, 4, 1010-1020.
(7) Monteleone I, Platt AM, Jaensson E, Agace WW, Mowat AM. IL-10-dependent partial refractoriness to Toll-like receptor stimulation modulates gut mucosal dendritic cell function. Eur J Immunol. 2008 38(6):1533-47
(8) Inaba K, Inaba M, Romani N, Aya H, Deguchi M, Ikehara S, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med 1992 Dec 1;176(6):1693-1702.
(9) Brasel K, De Smedt T, Smith JL, Maliszewski CR. Generation of murine dendritic cells from flt3-ligand-supplemented bone marrow cultures. Blood 2000 Nov 1;96(9):3029-3039.
(10) Weigel BJ, Nath N, Taylor PA, Panoskaltsis-Mortari A, Chen W, Krieg AM, et al. Comparative analysis of murine marrow-derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood 2002 Dec 1;100(12):4169-4176.
(10) Xu Y, Zhan Y, Lew AM, Naik SH, Kershaw MH. Differential development of murine dendritic cells by GM-CSF versus Flt3 ligand has implications for inflammation and trafficking. J Immunol 2007 Dec 1;179(11):7577-7584.
(12) Olivera L, Canul RR, Pereira-Pacheco F, Cockburn J, Soldani F, McKenzie NH, et al. Nutritional and physiological responses of young growing rats to diets containing raw cowpea seed meal, protein isolate (globulins), or starch. J Agric Food Chem 2003 Jan 1;51(1):319-325.
Все публикации, упомянутые в приведенном выше описании, включены в настоящее описание в качестве ссылок. Различные модификации и вариации описанных способов и системы по изобретению без отклонения от объема и сущности изобретения будут очевидны специалистам в данной области. Хотя изобретение описано применительно конкретным предпочтительным вариантам осуществления, следует понимать, что заявленное изобретение не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления изобретения, которые очевидны специалистам в области биохимии и молекулярной биологии или в сходных областях, входят в объем представленной ниже формулы изобретения.
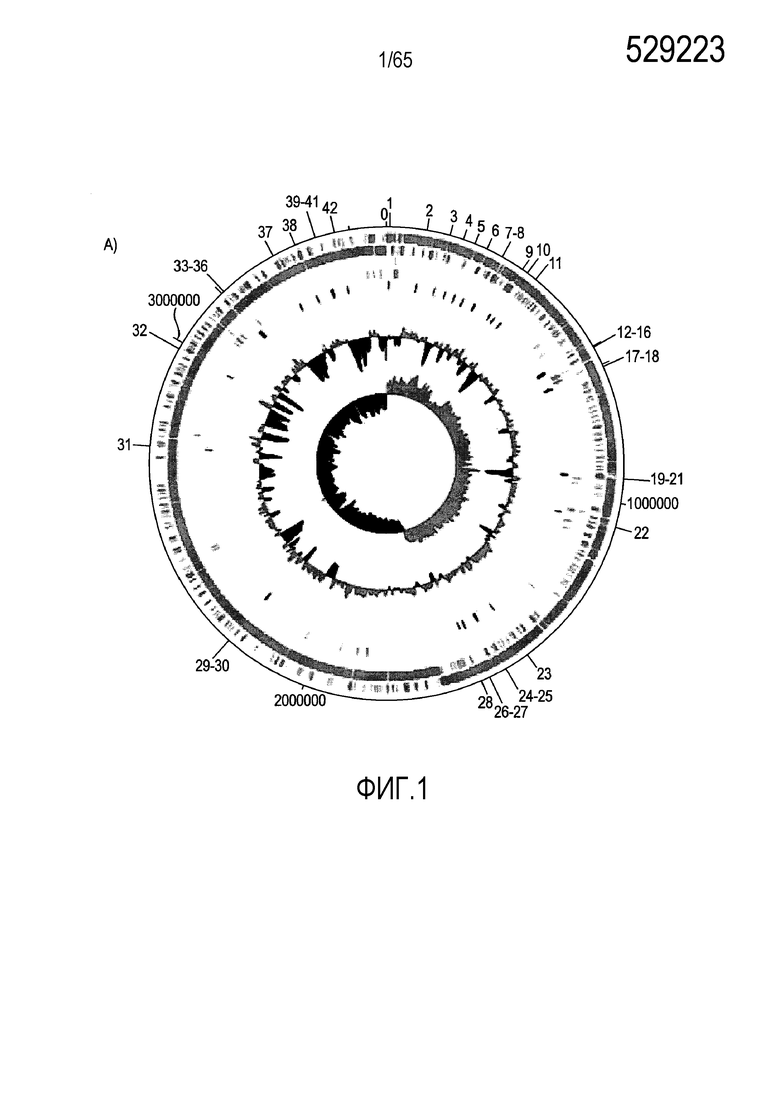
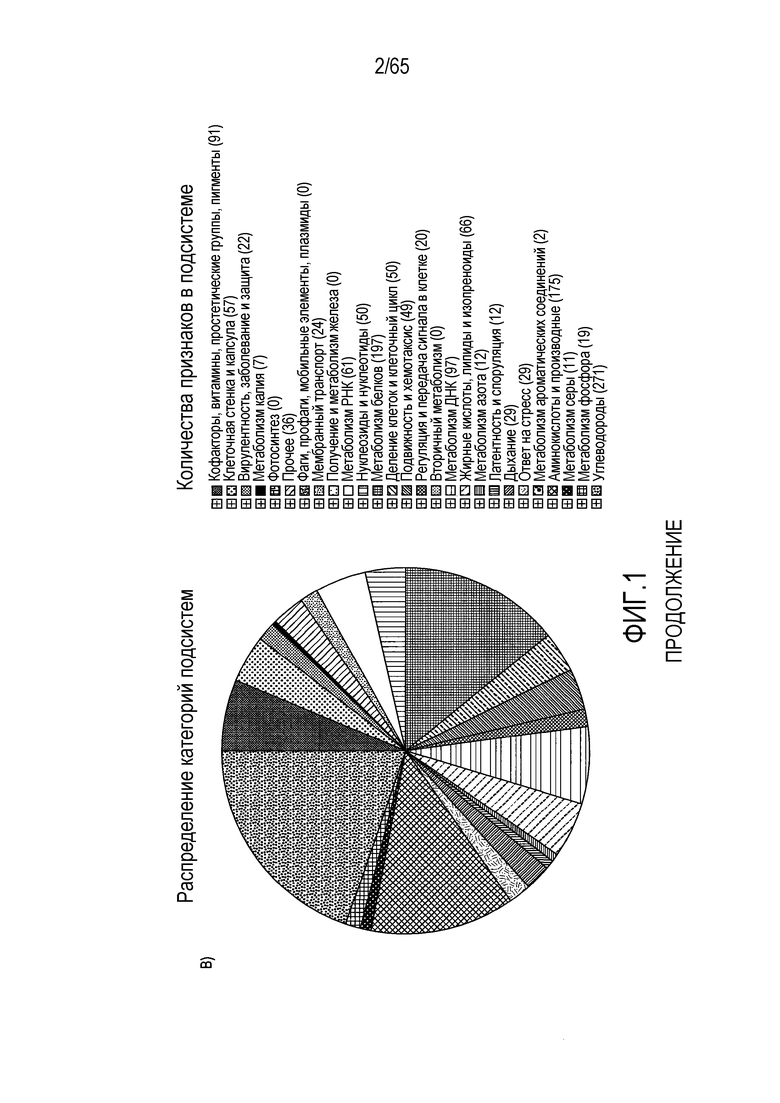
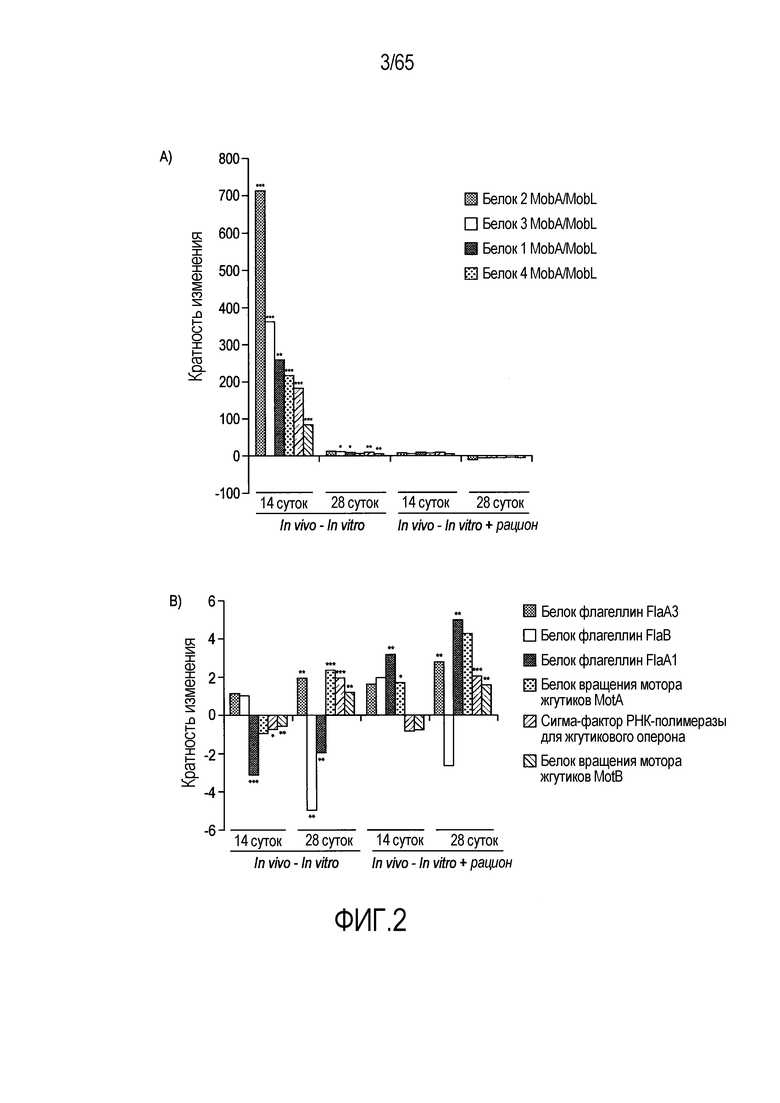
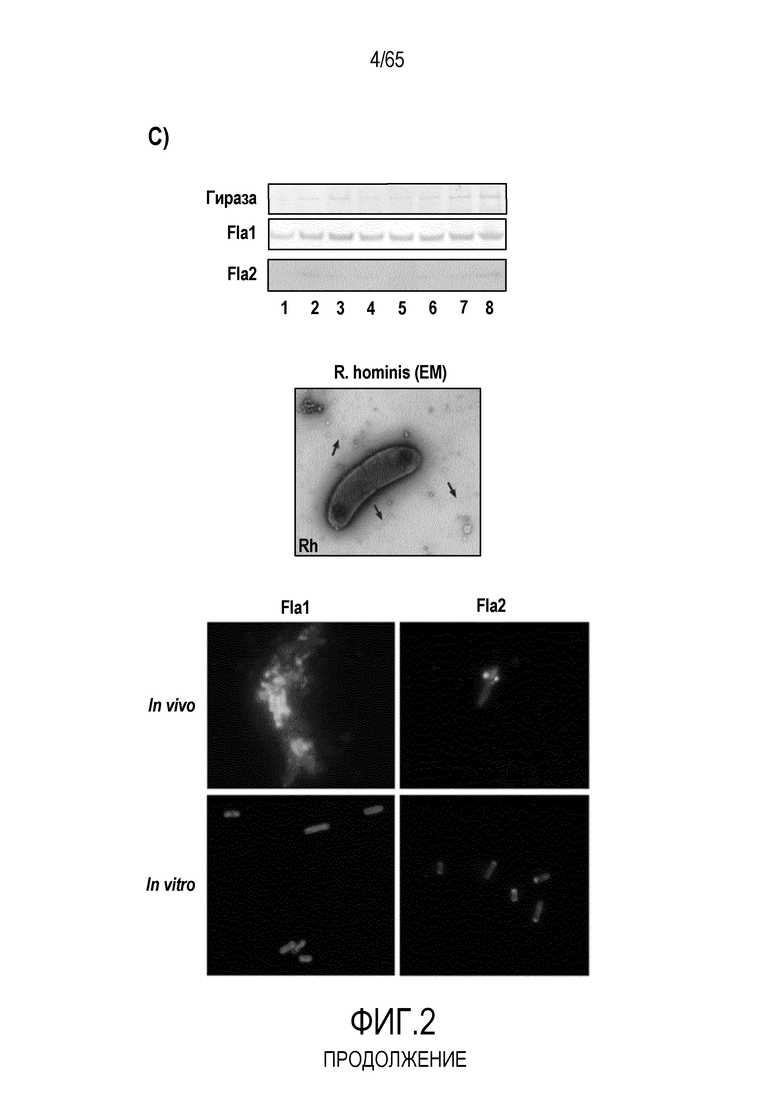
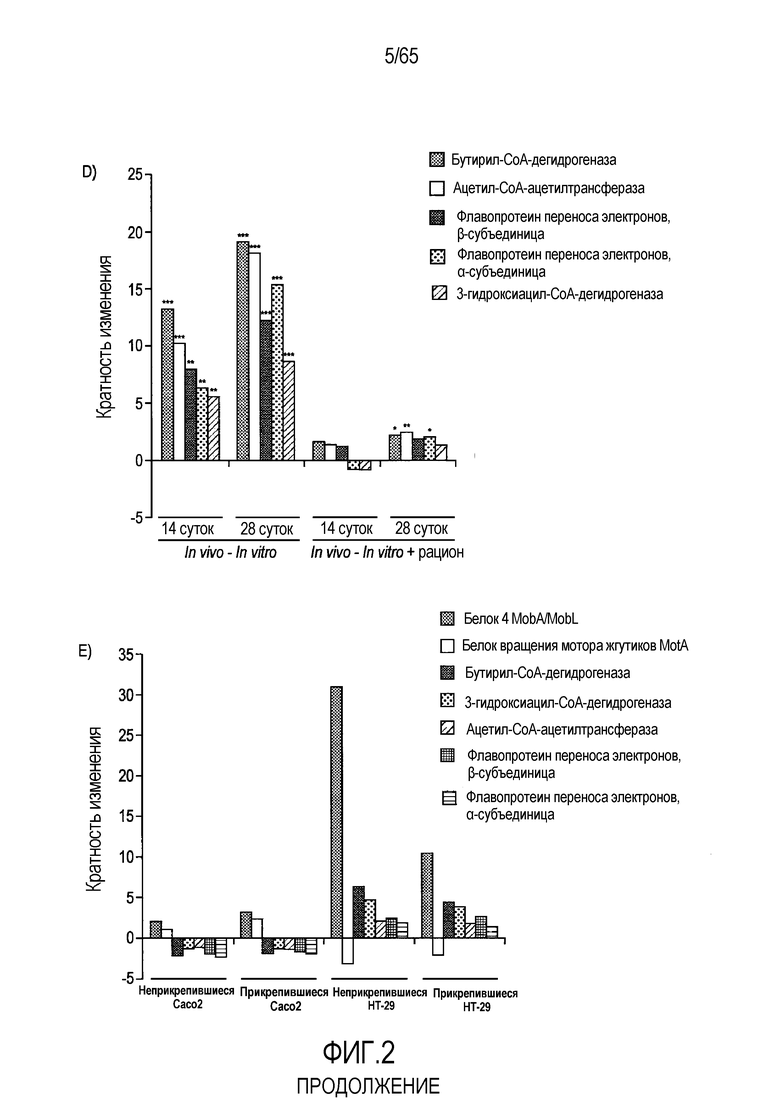
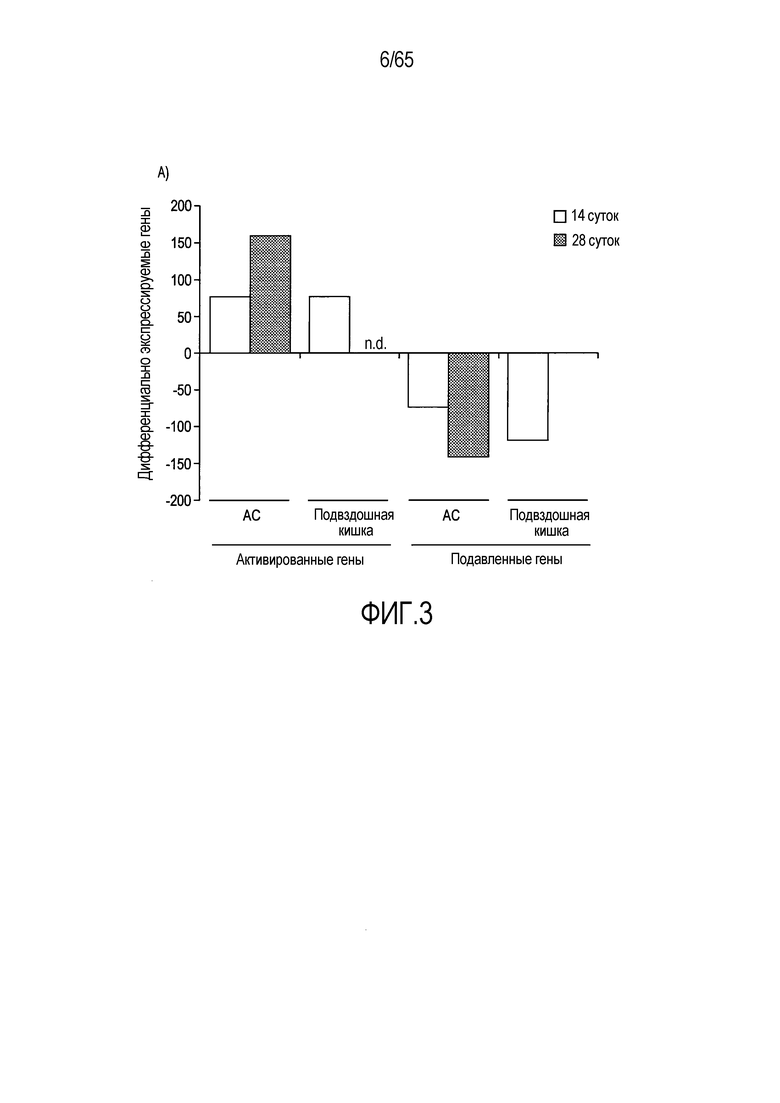

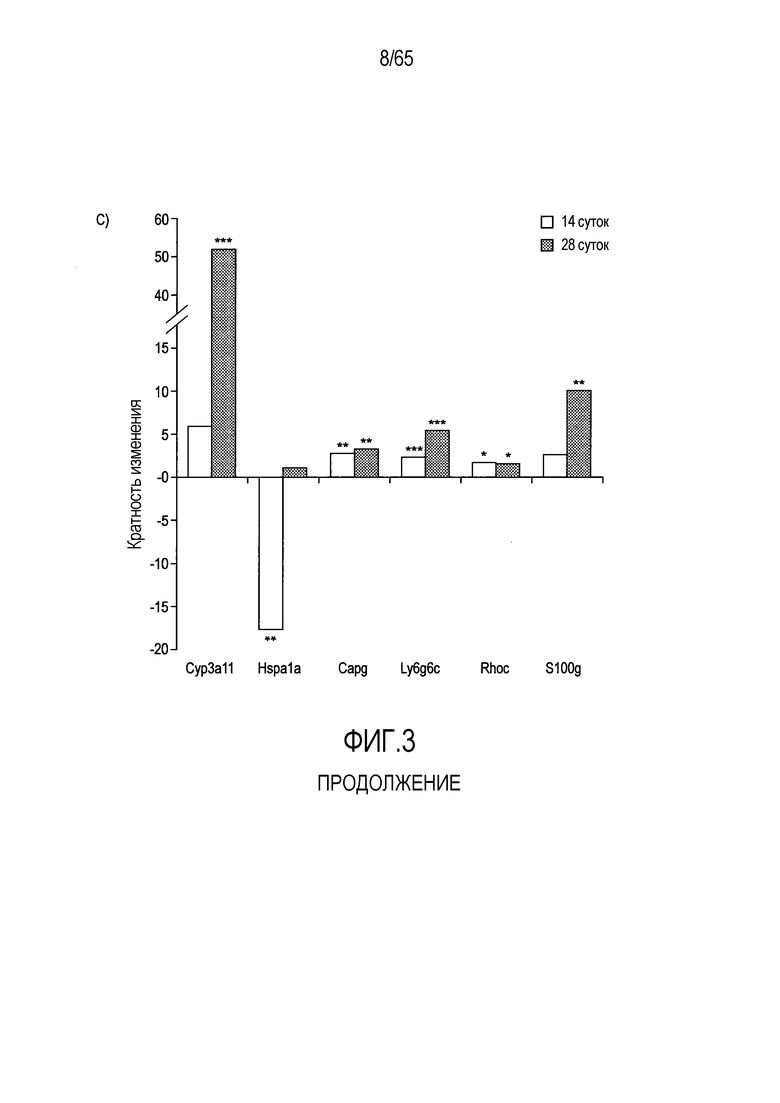
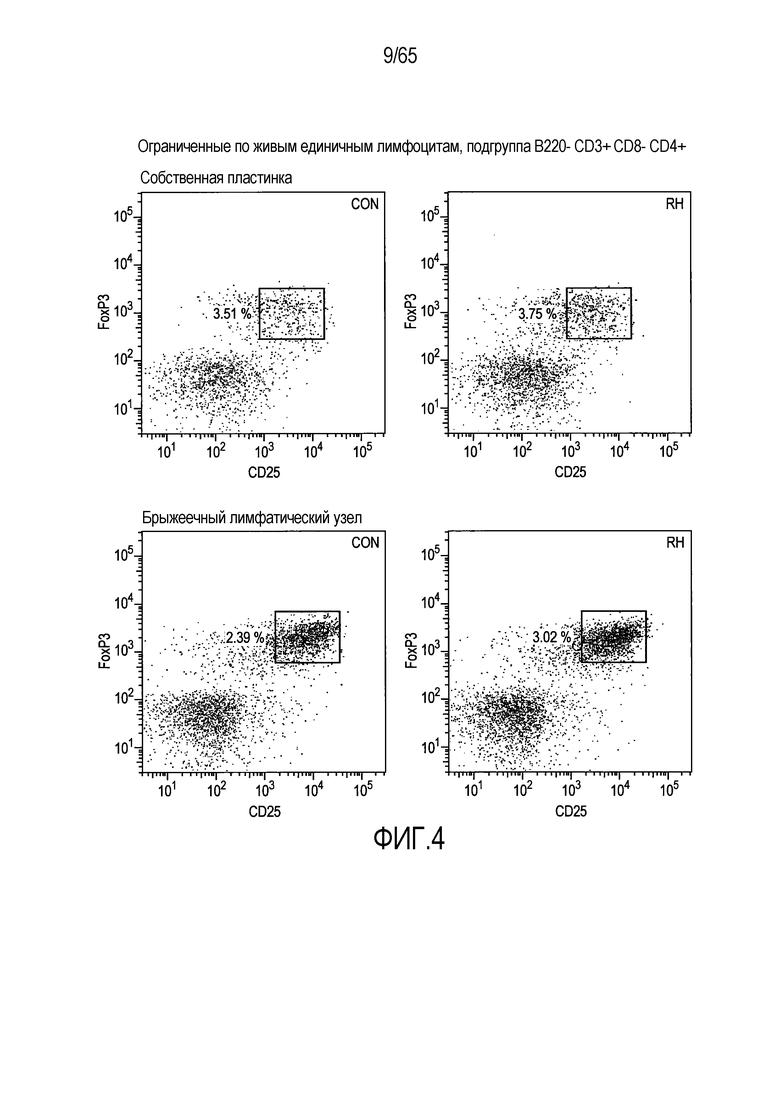
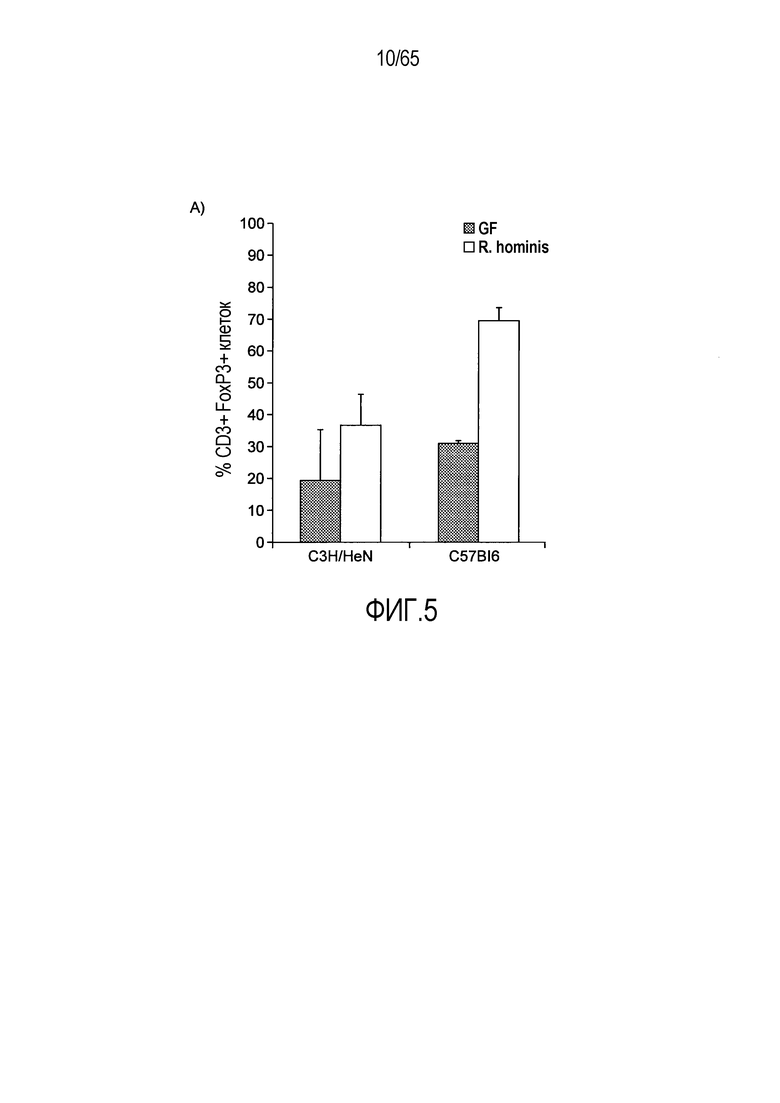
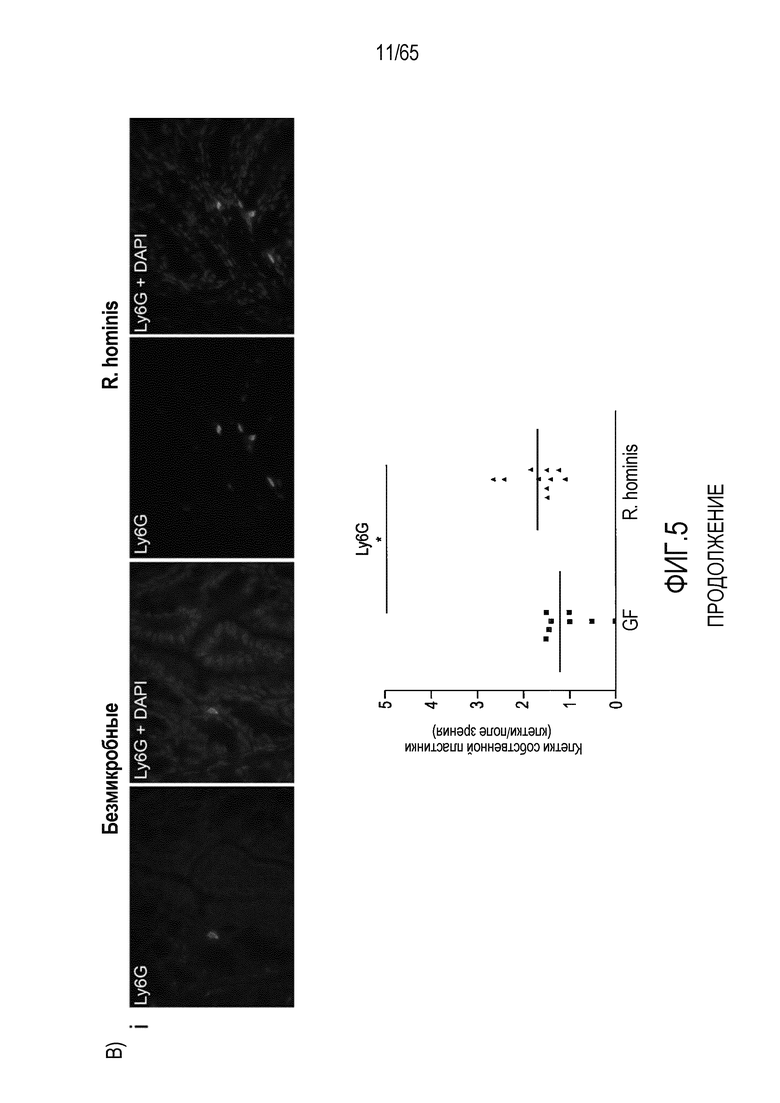
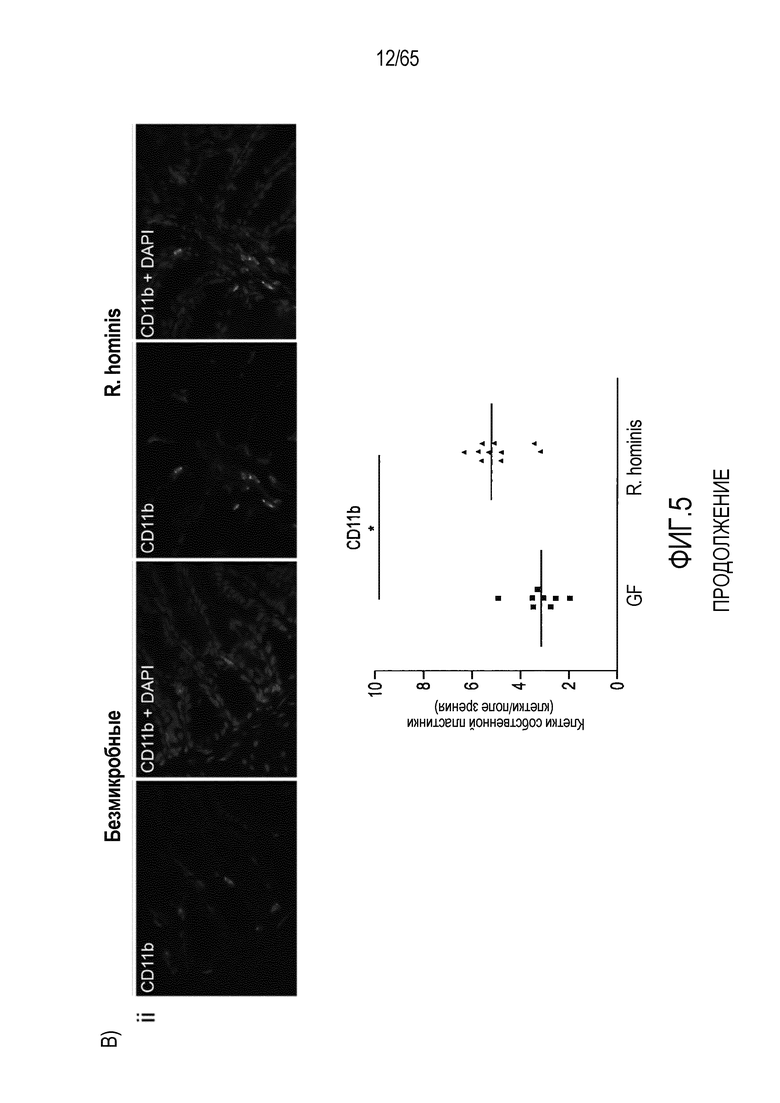
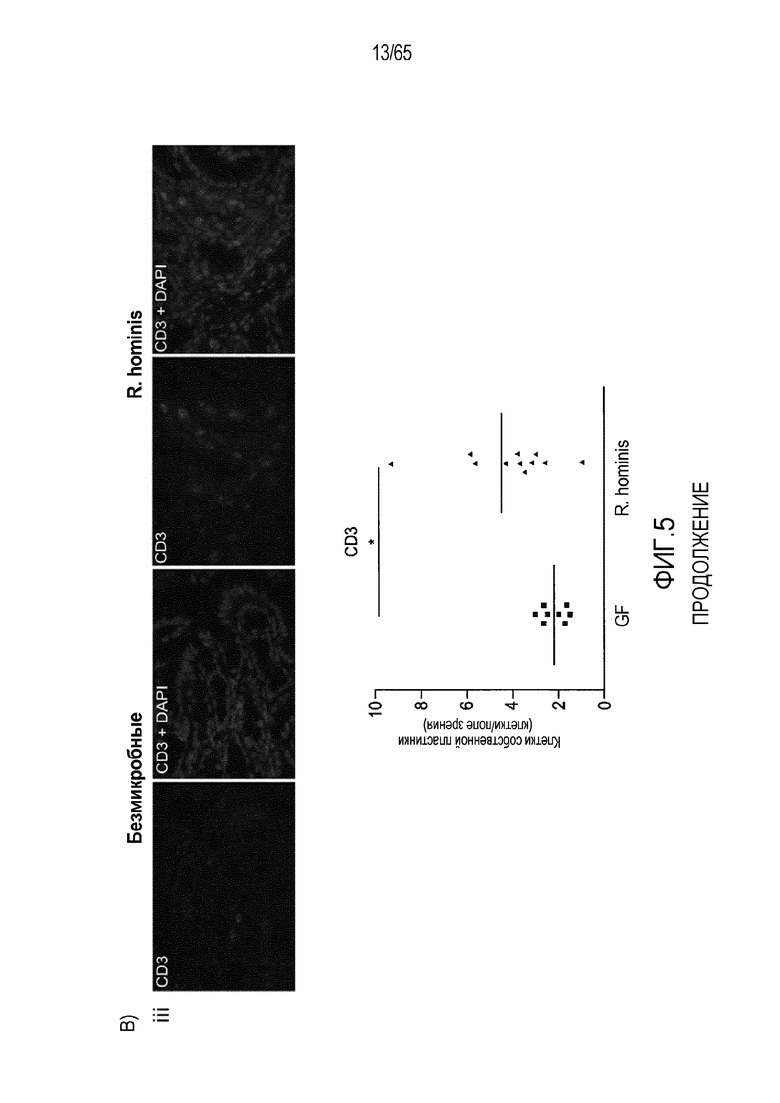

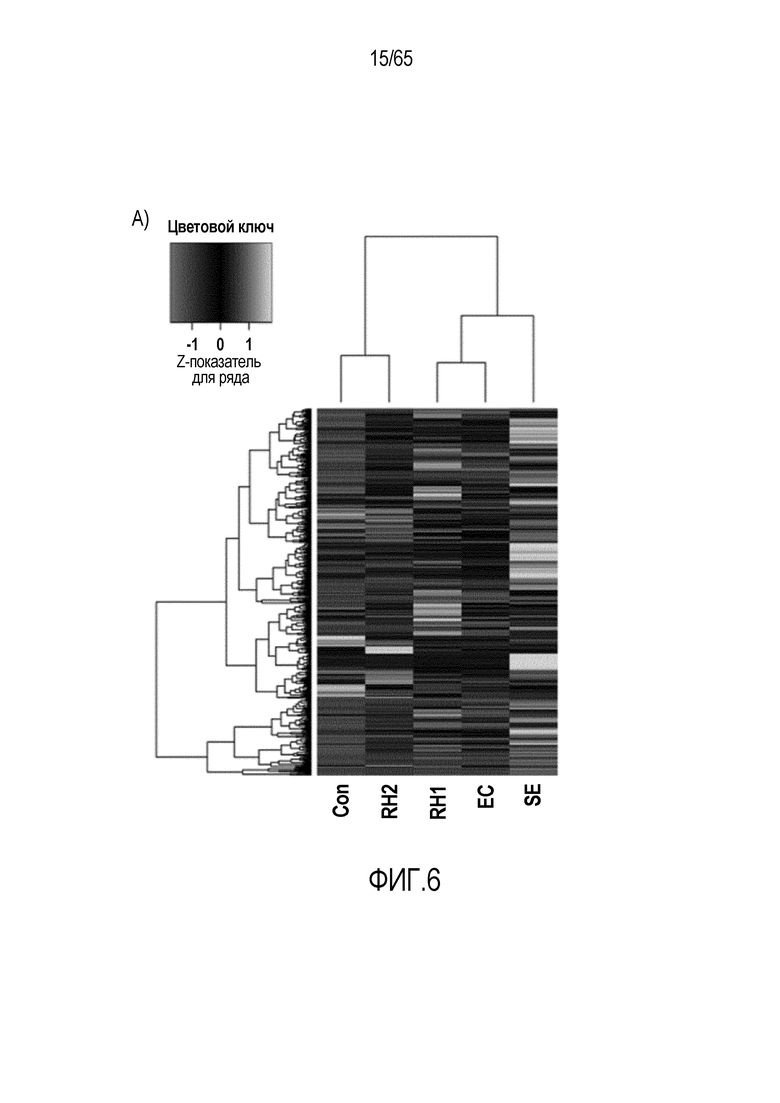
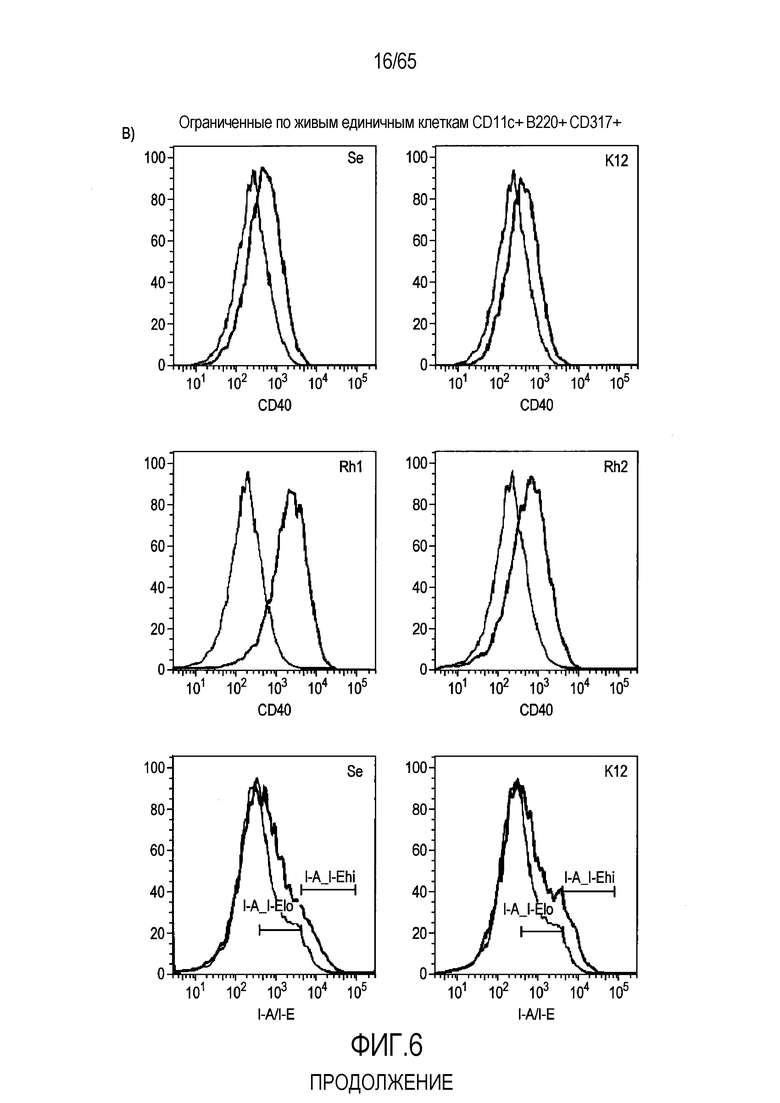
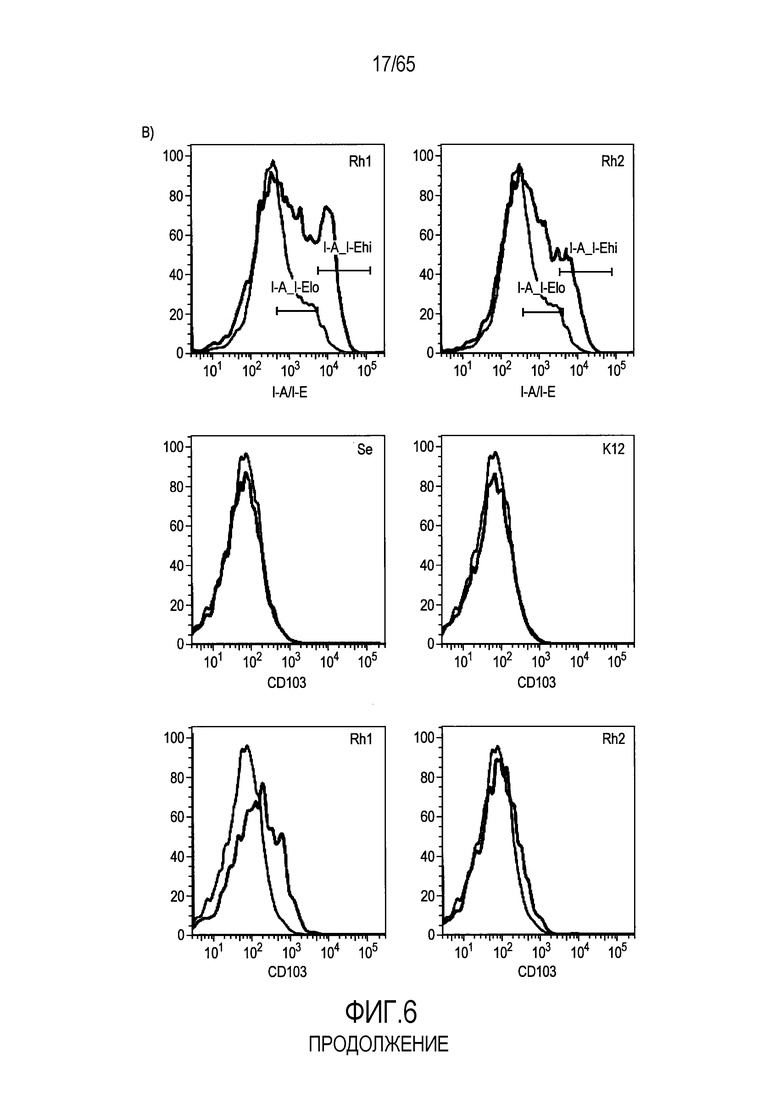
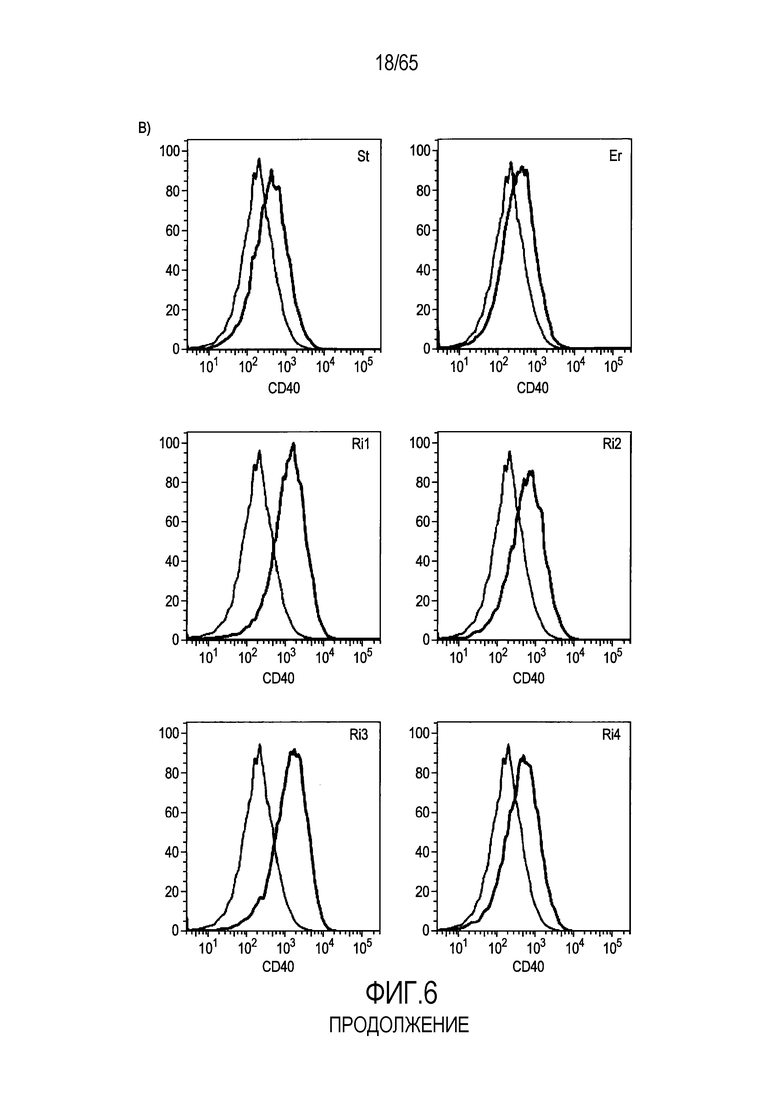
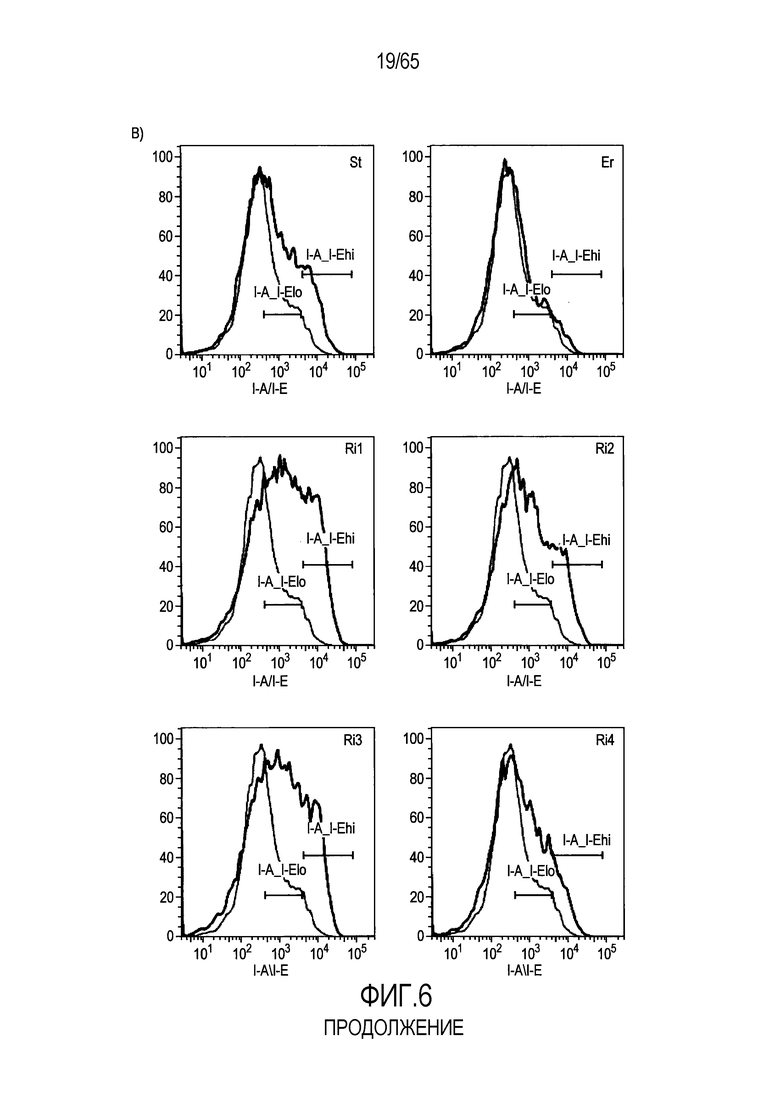
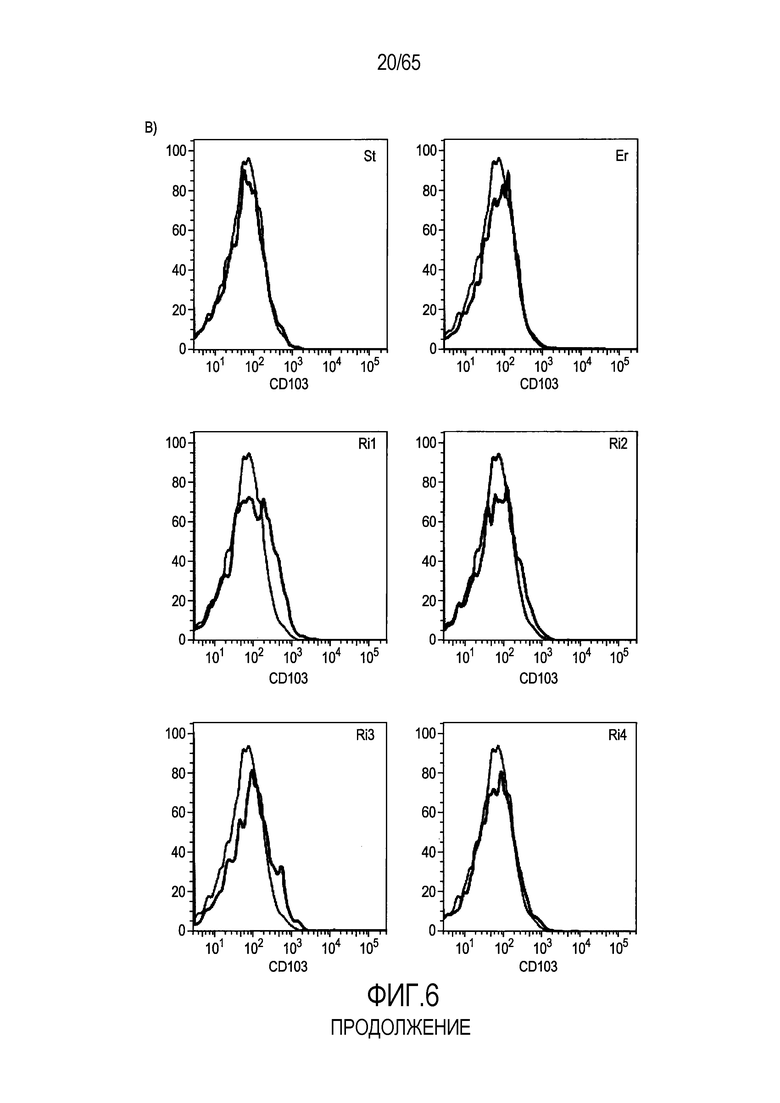
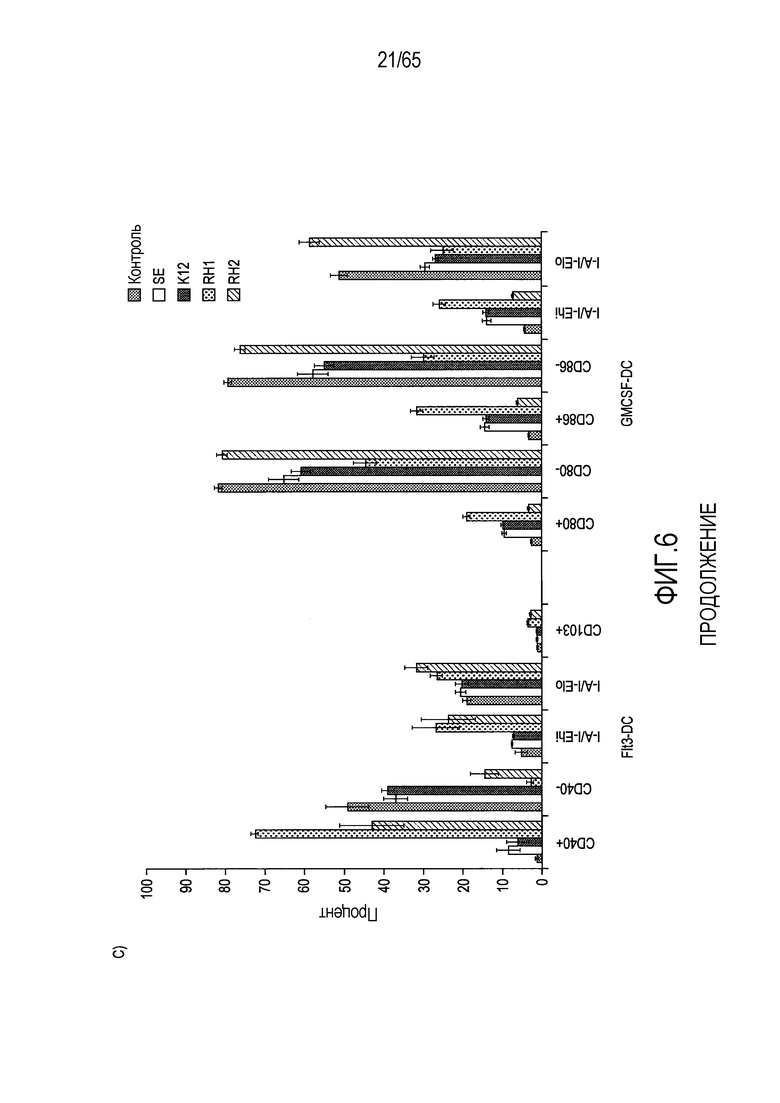
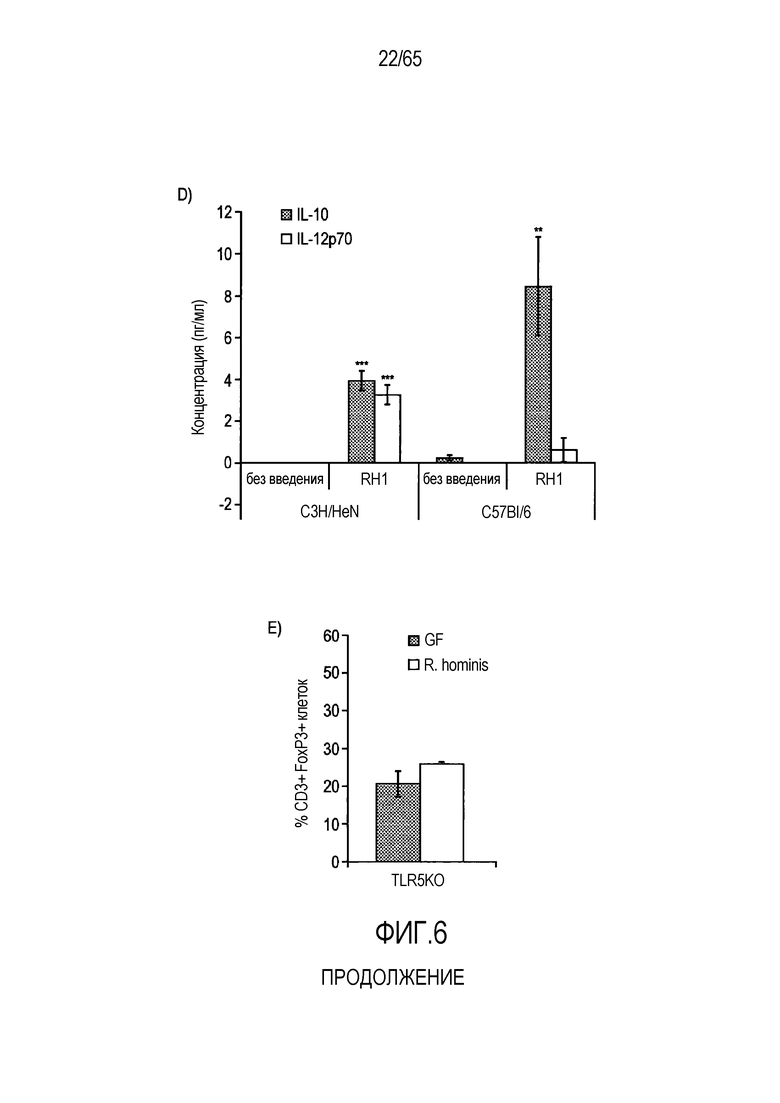
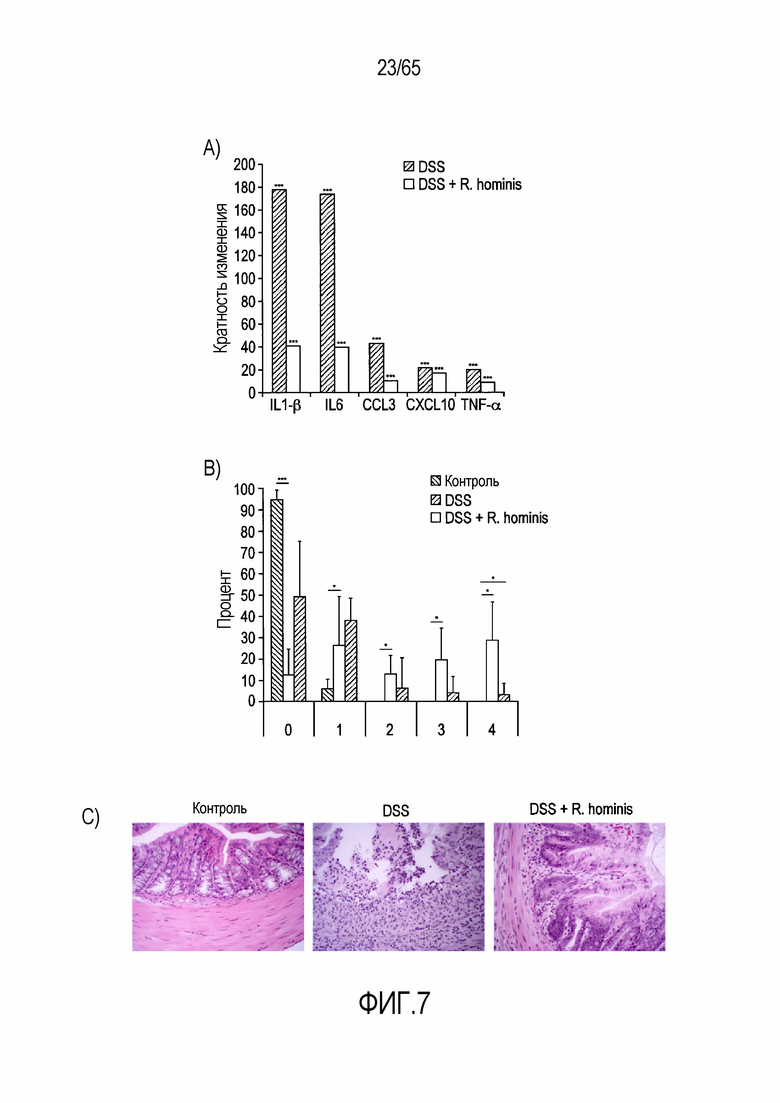
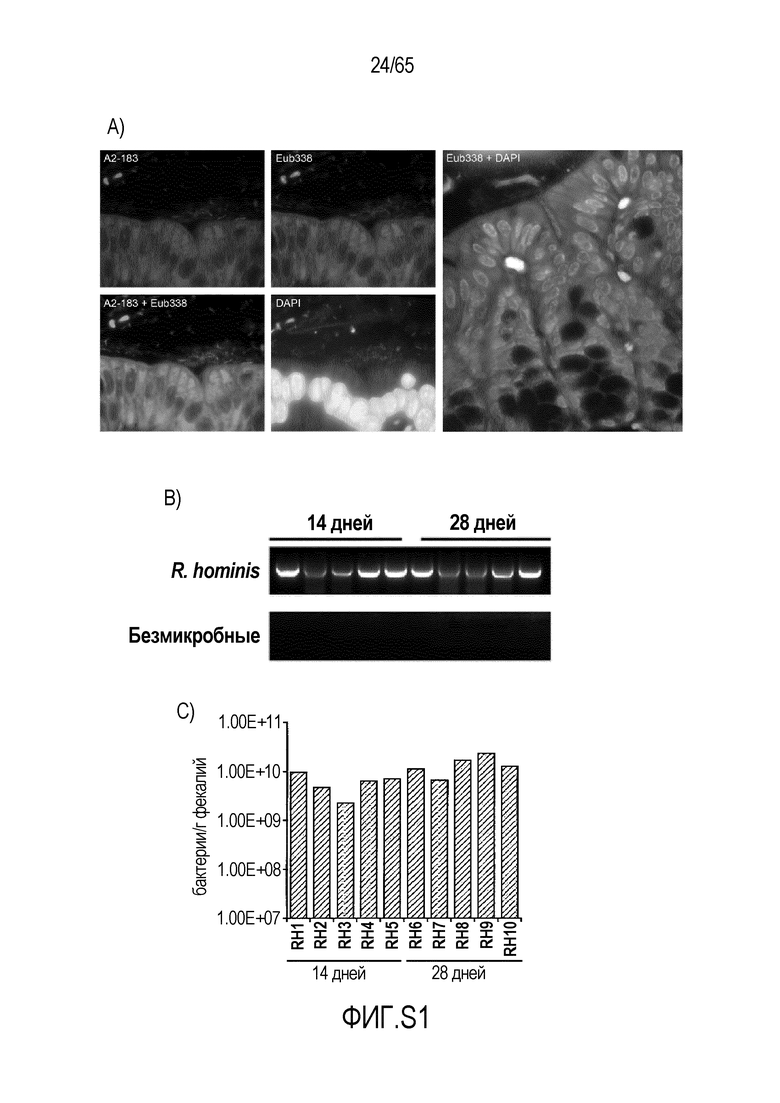
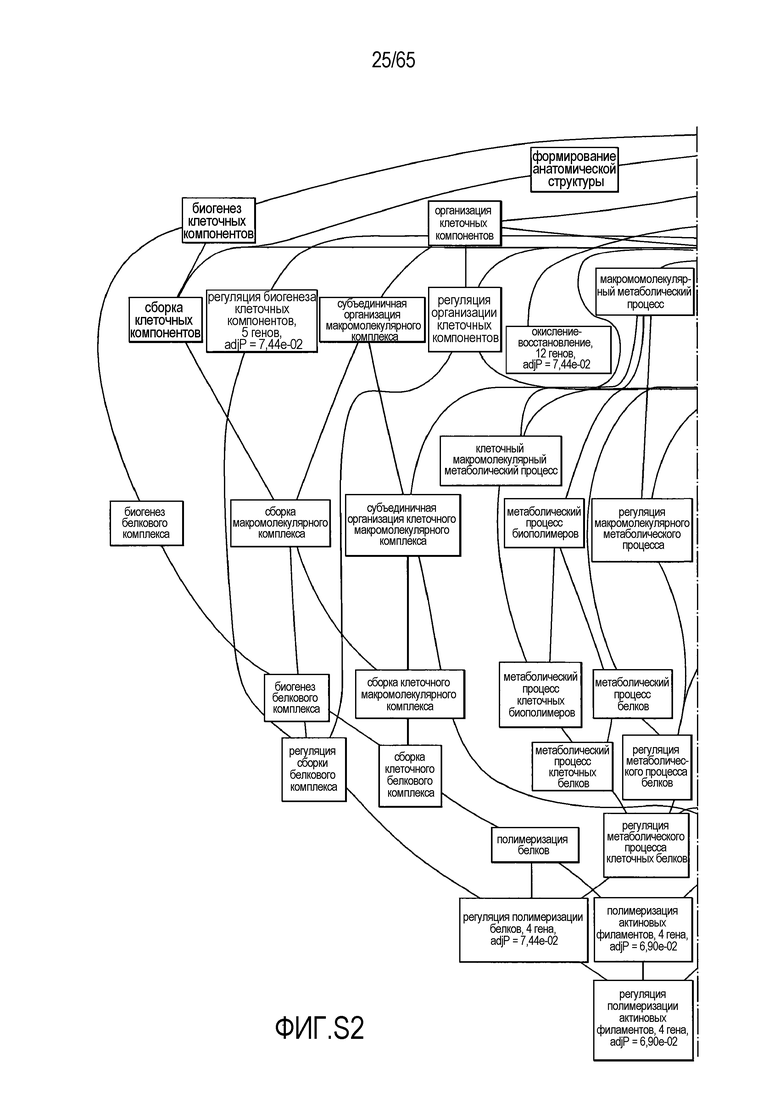
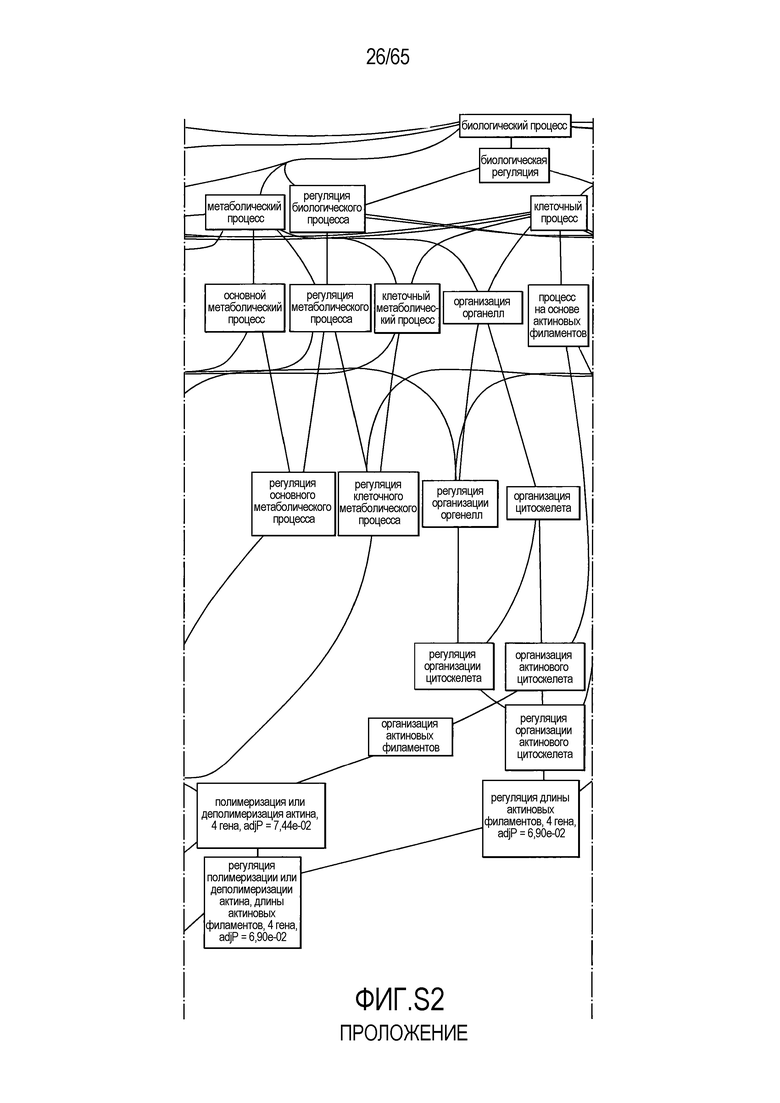
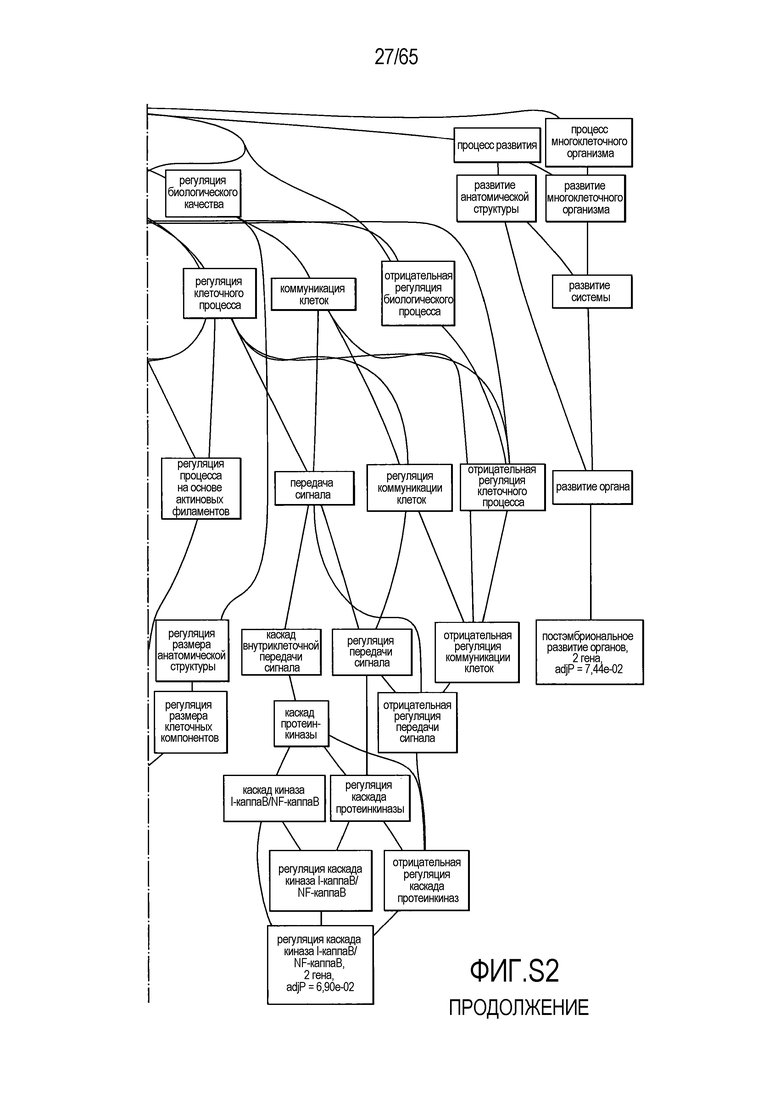
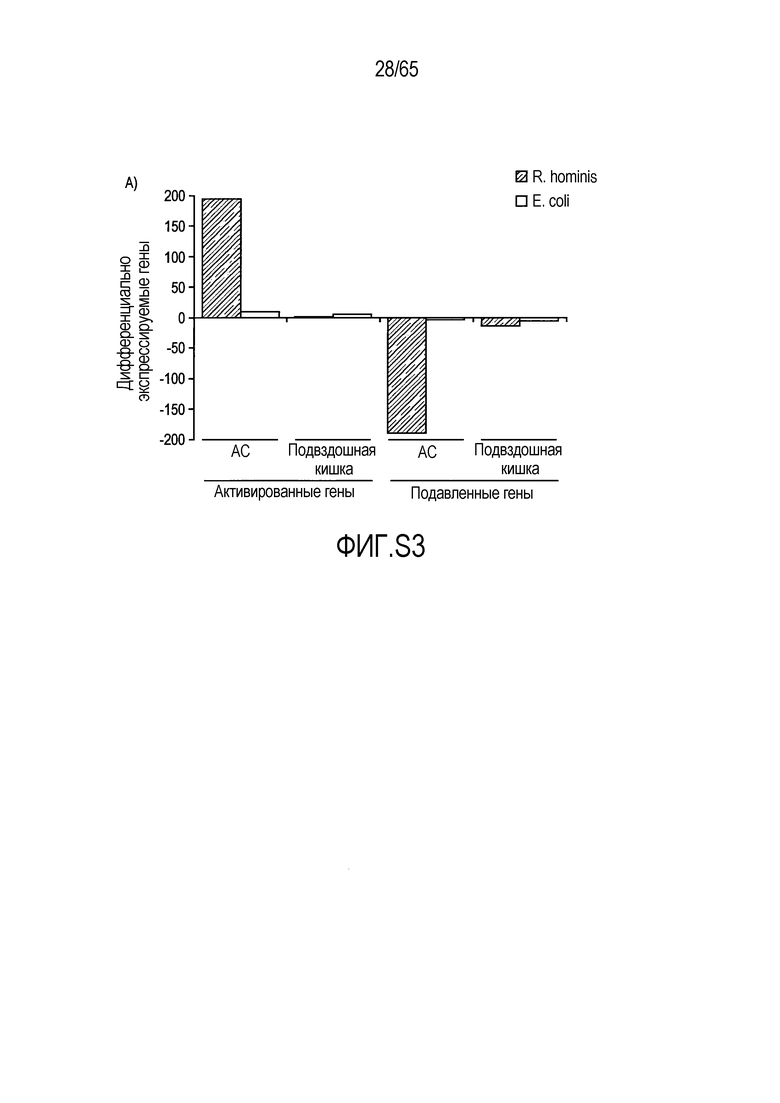
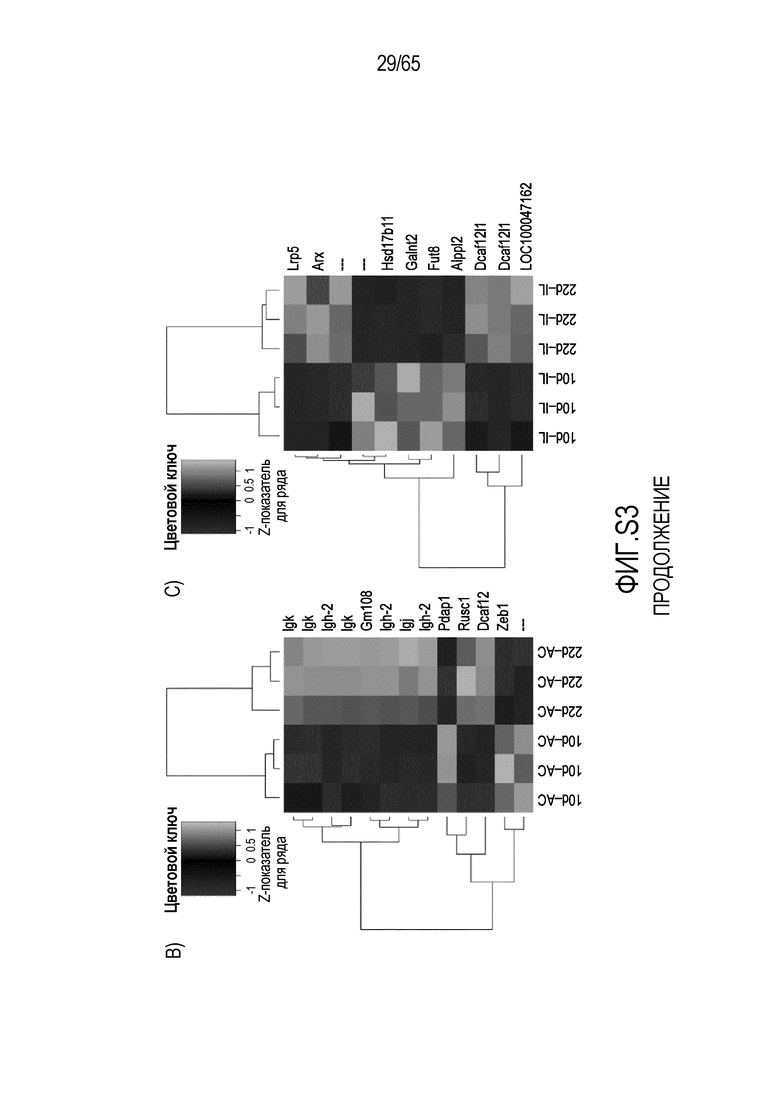
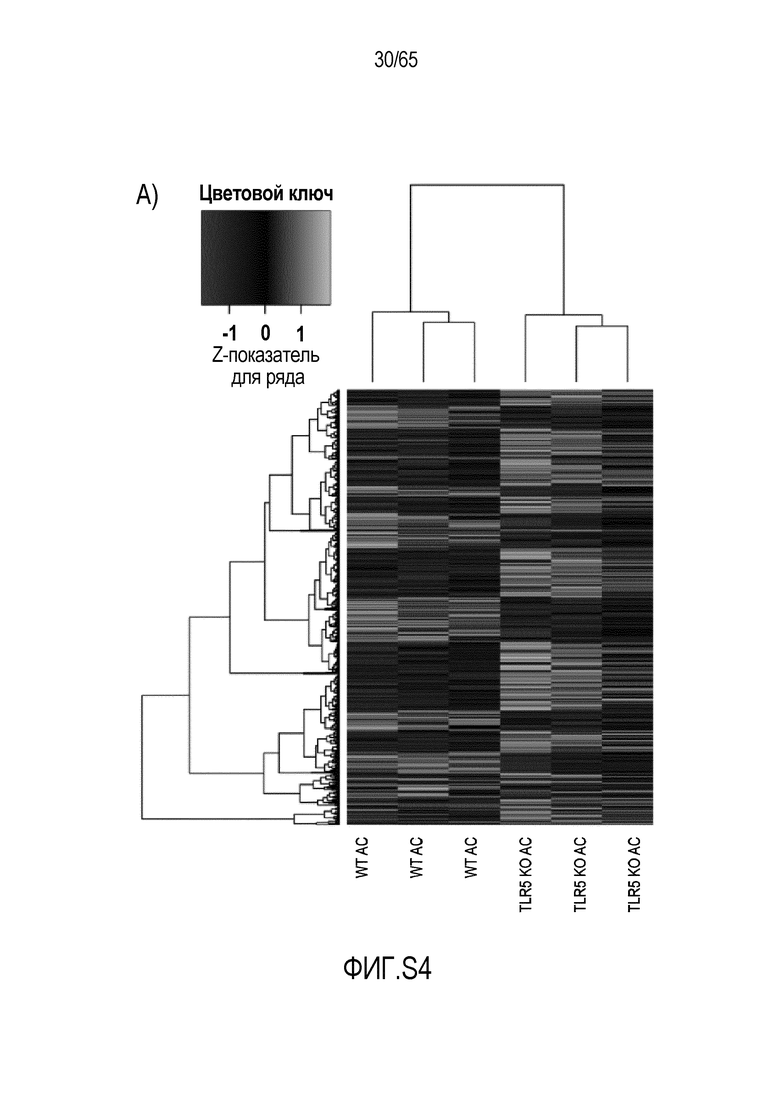


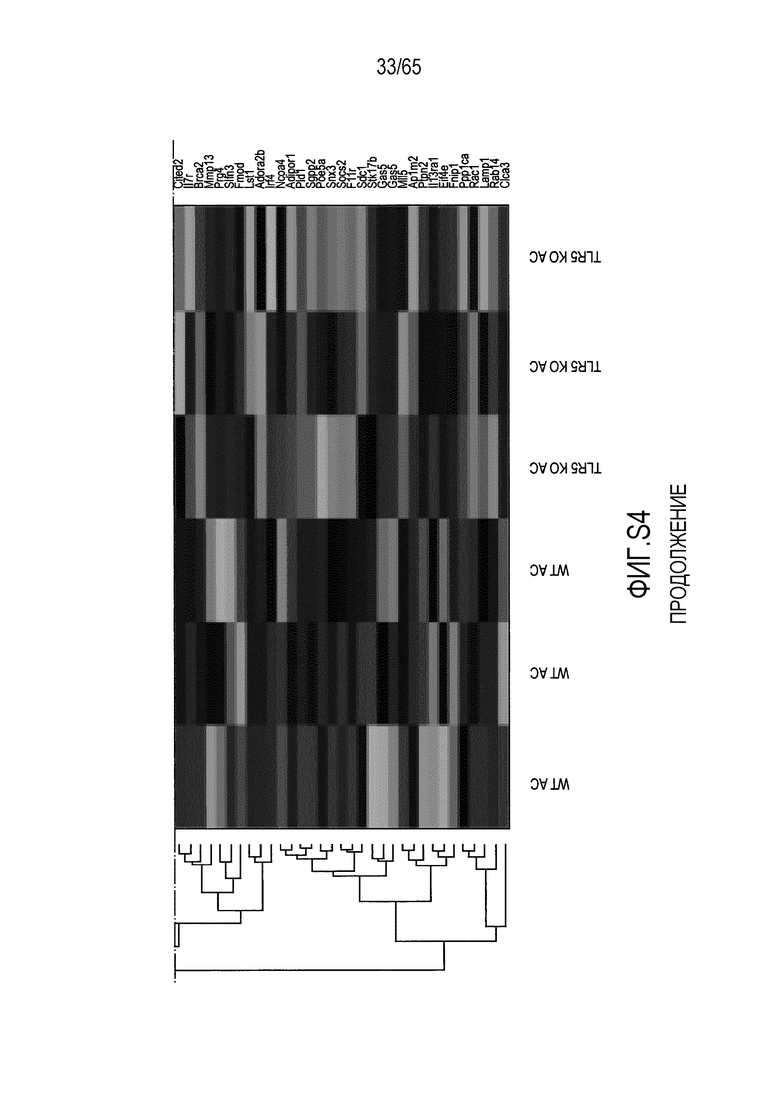
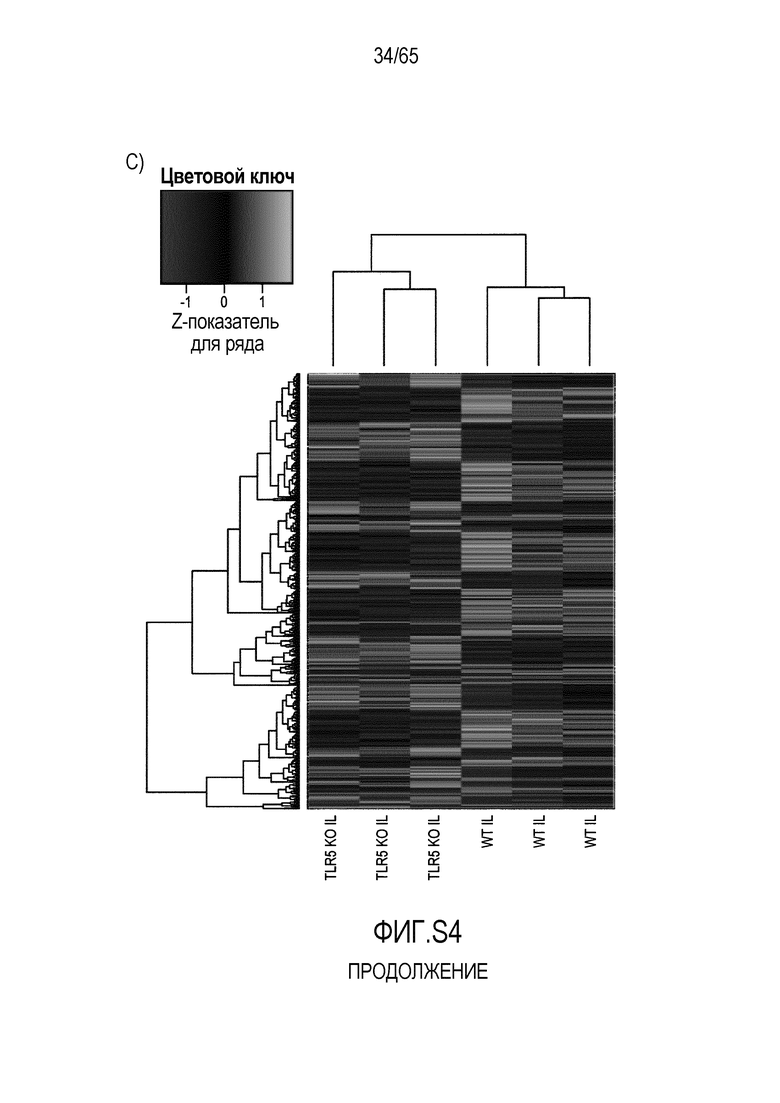
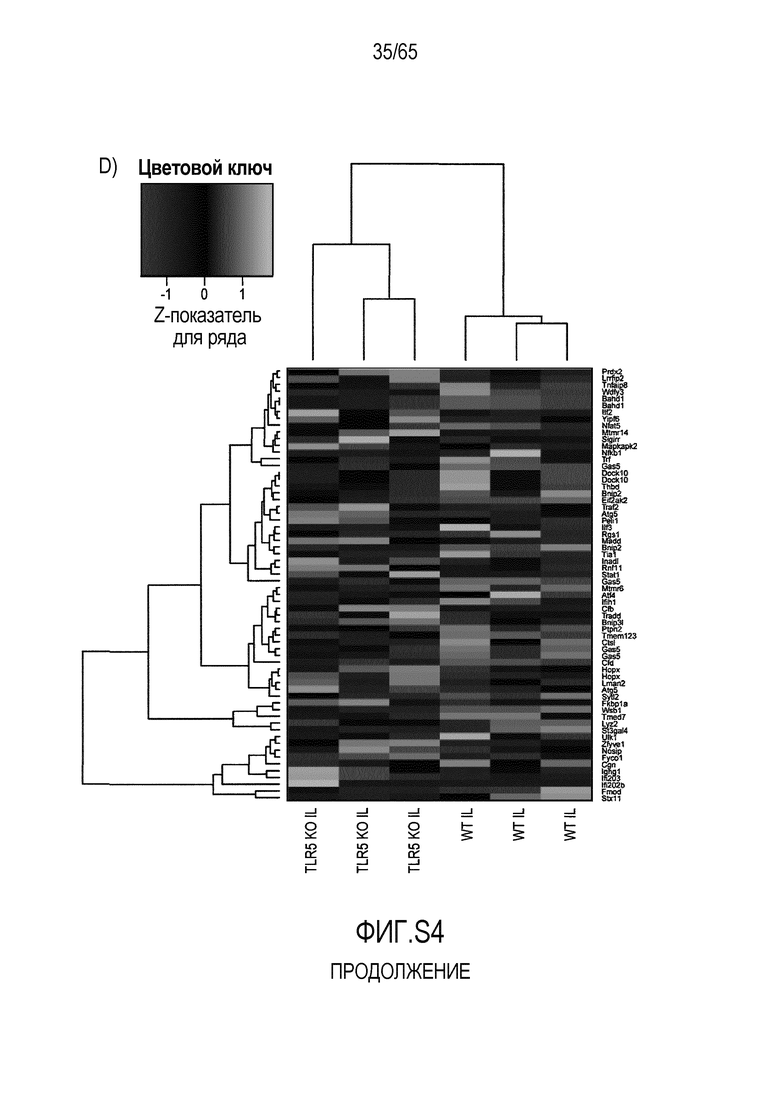

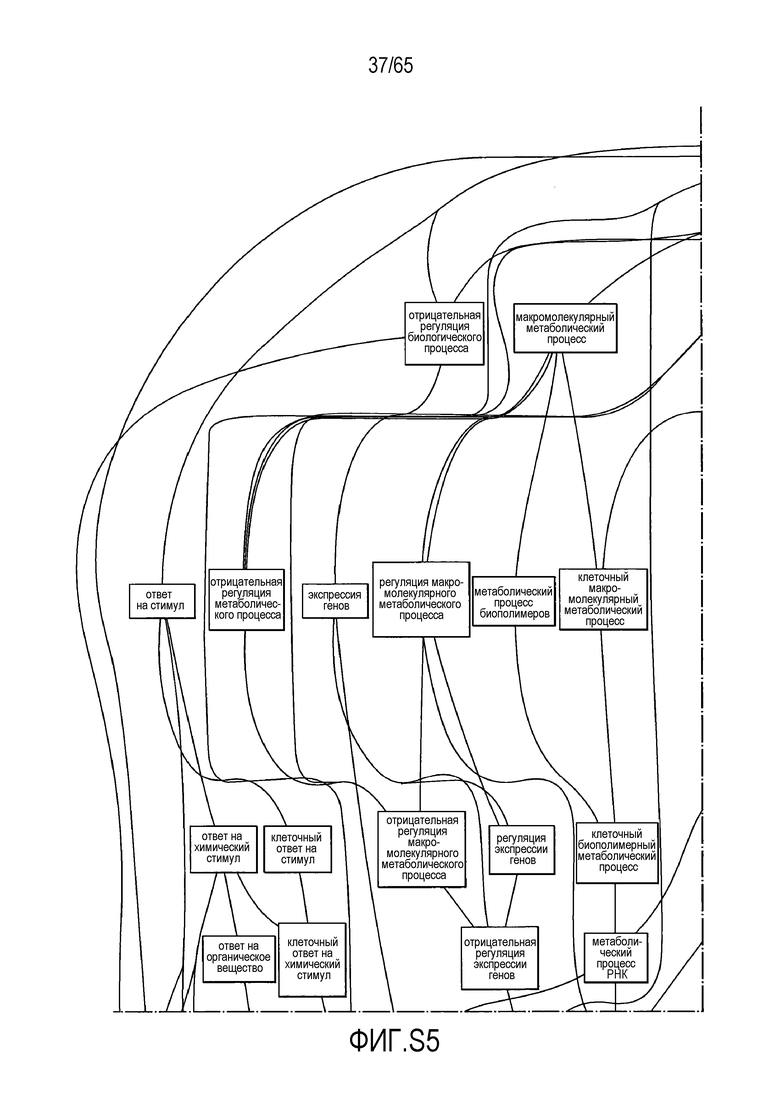
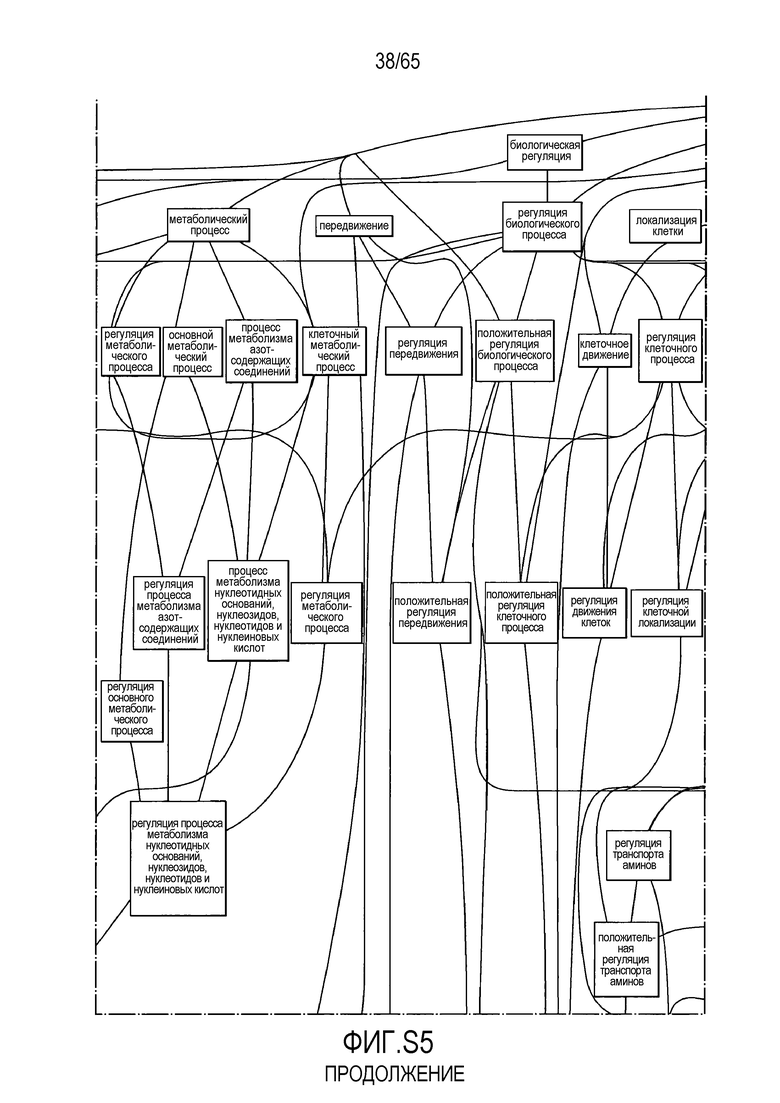
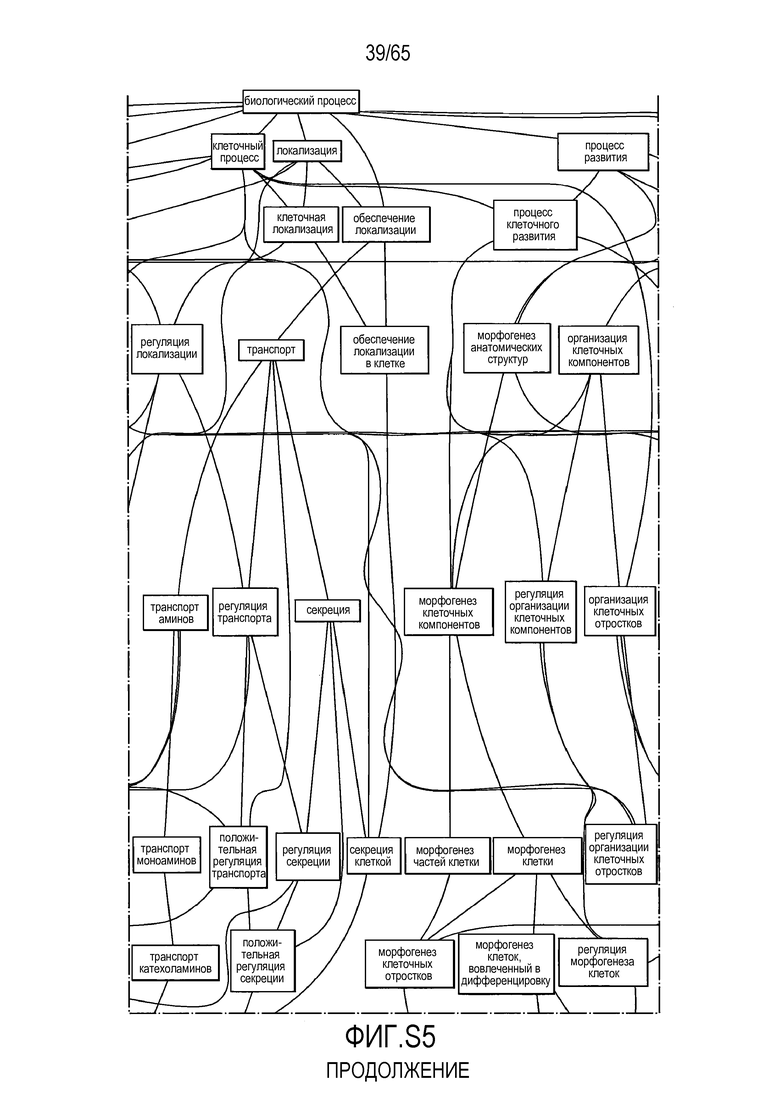
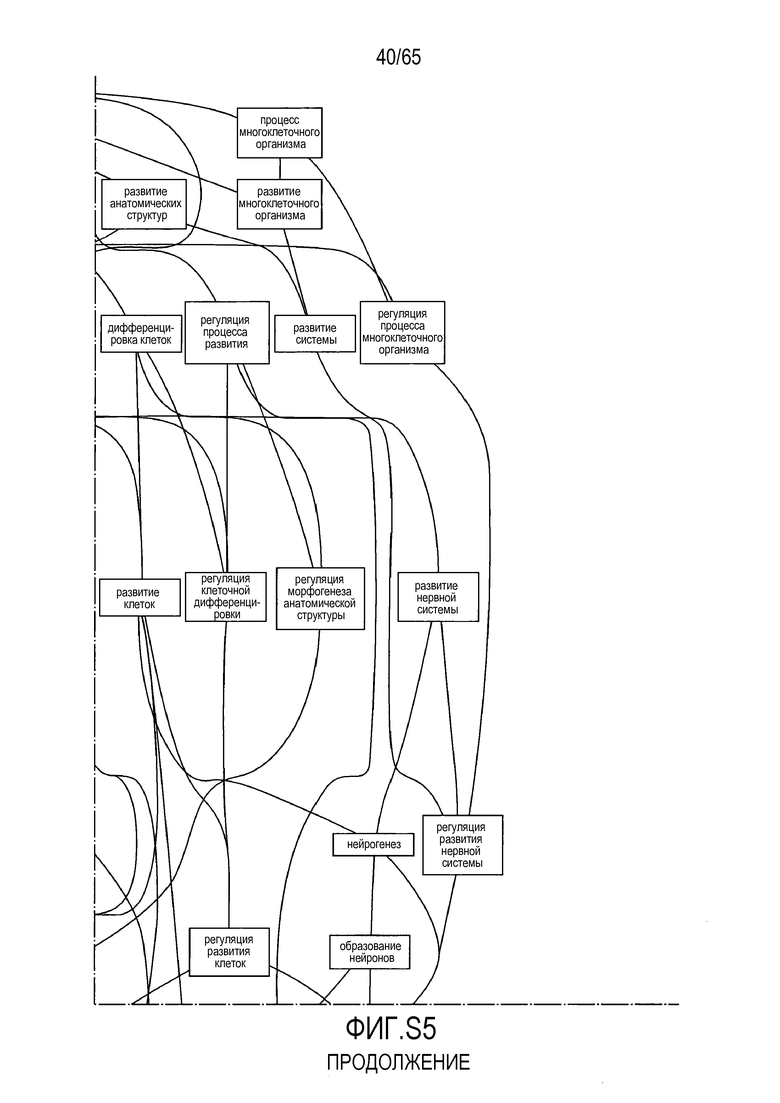
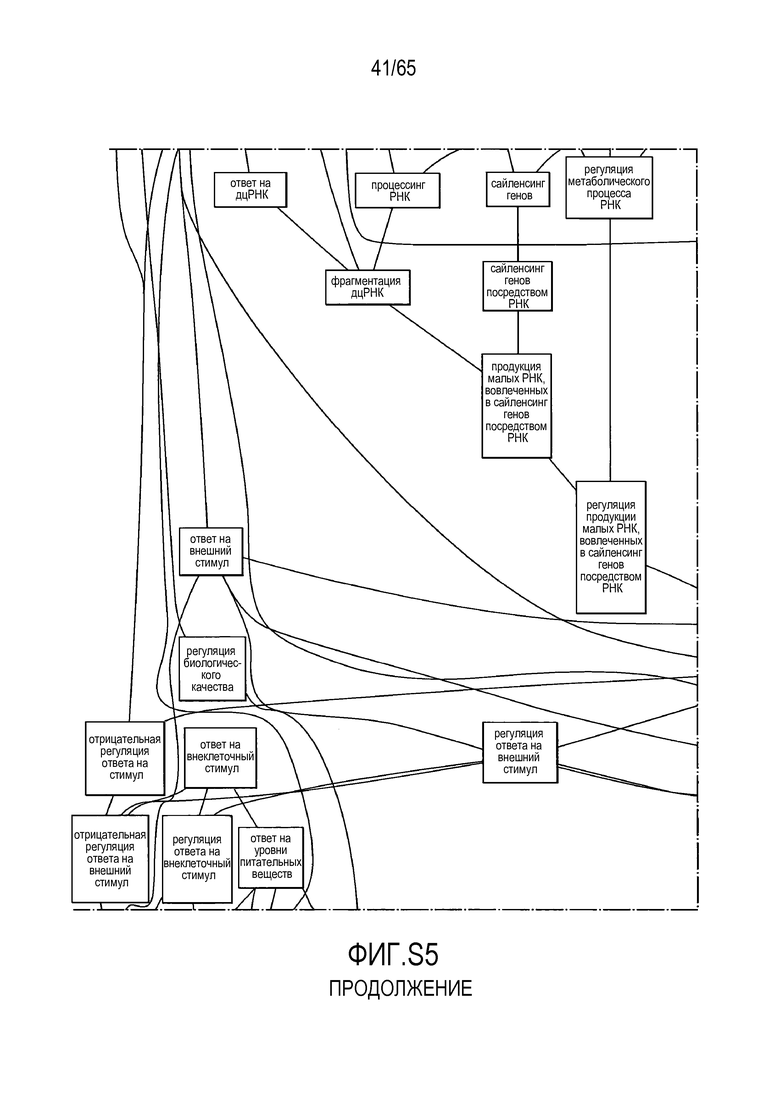
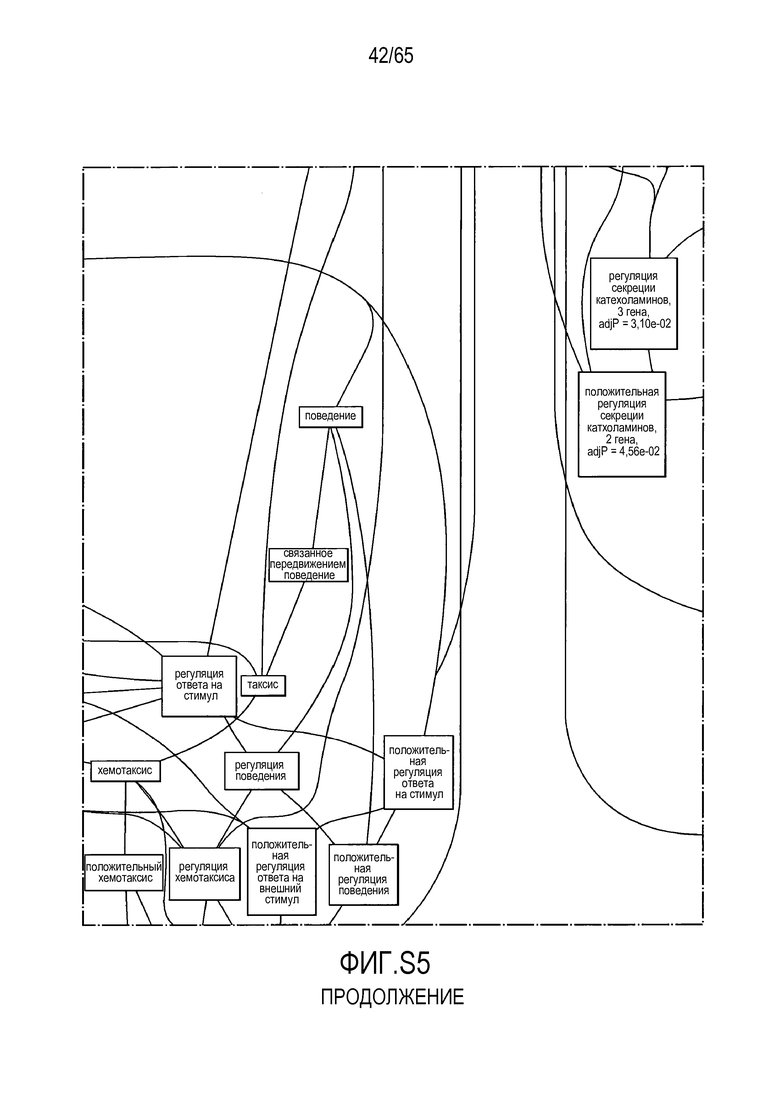
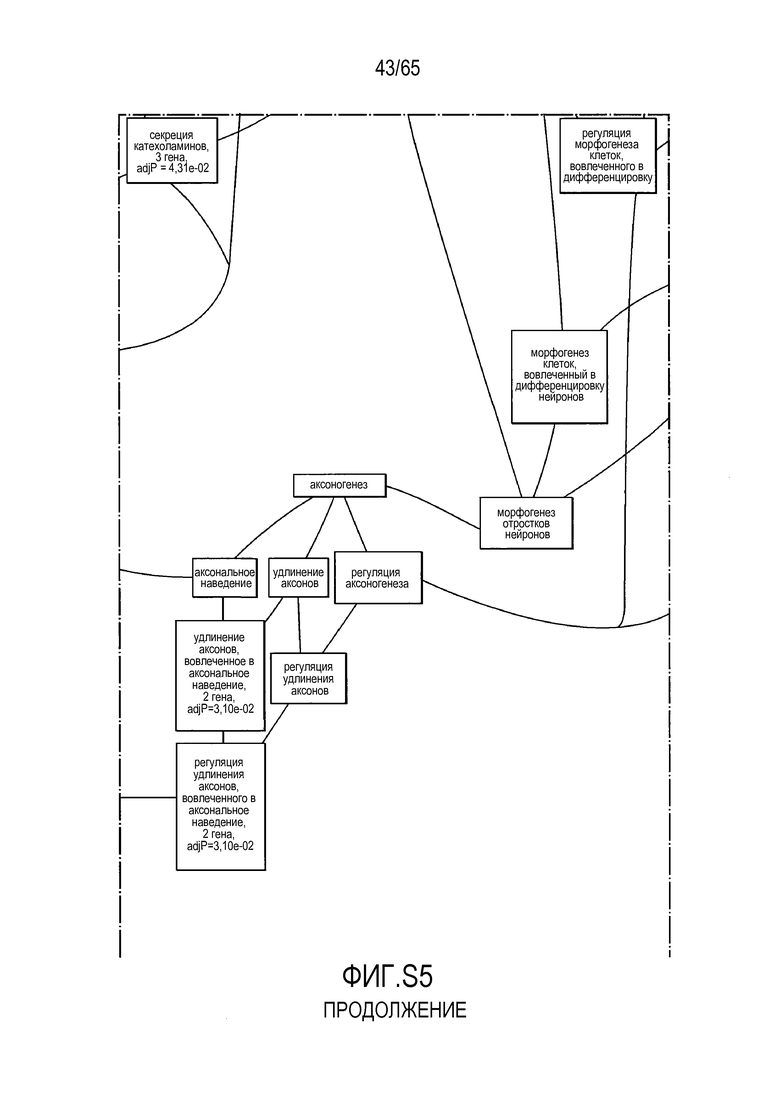
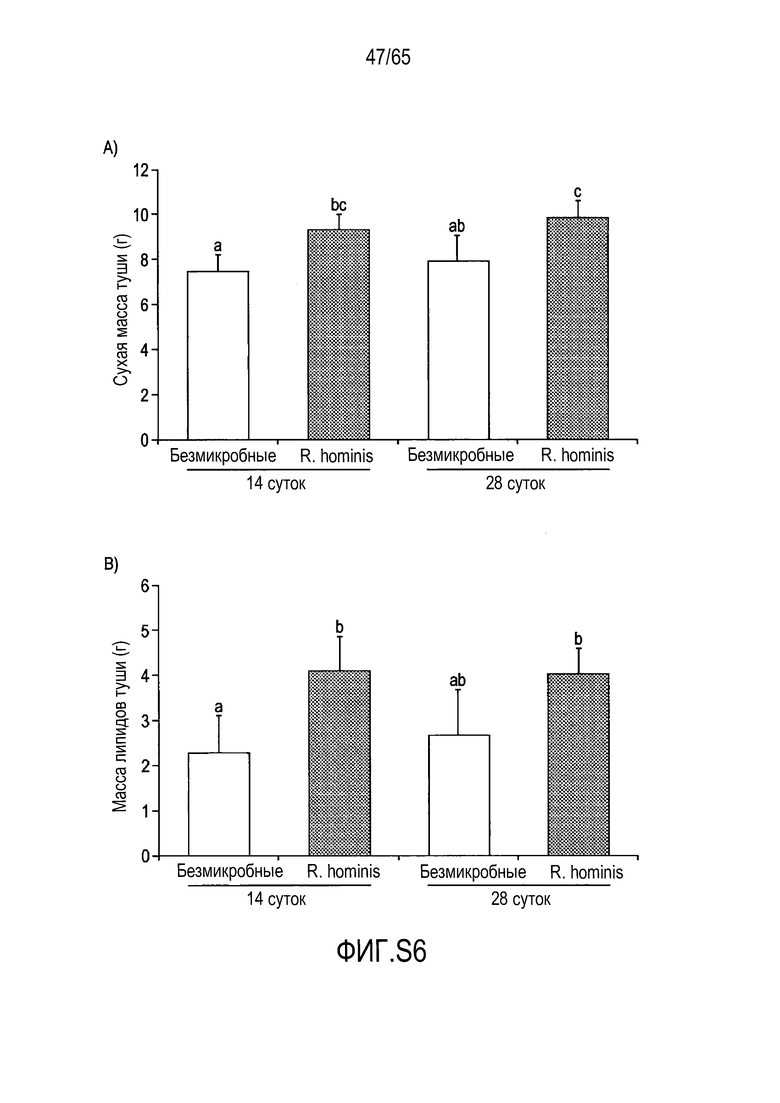
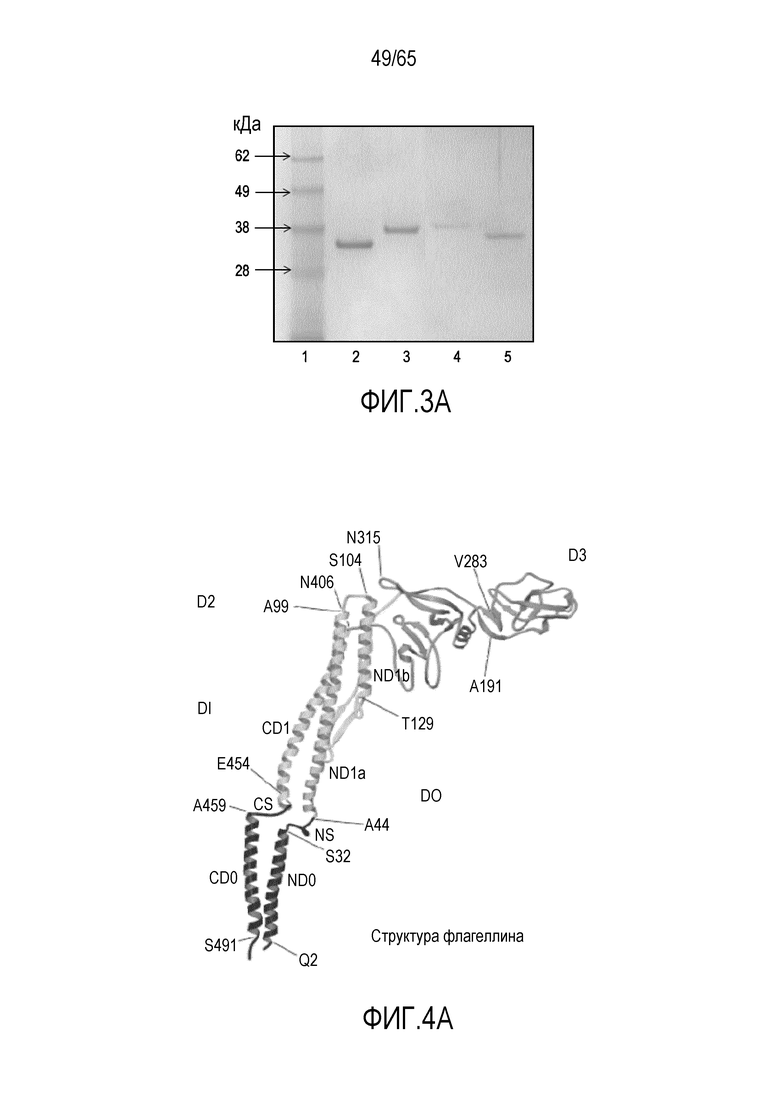
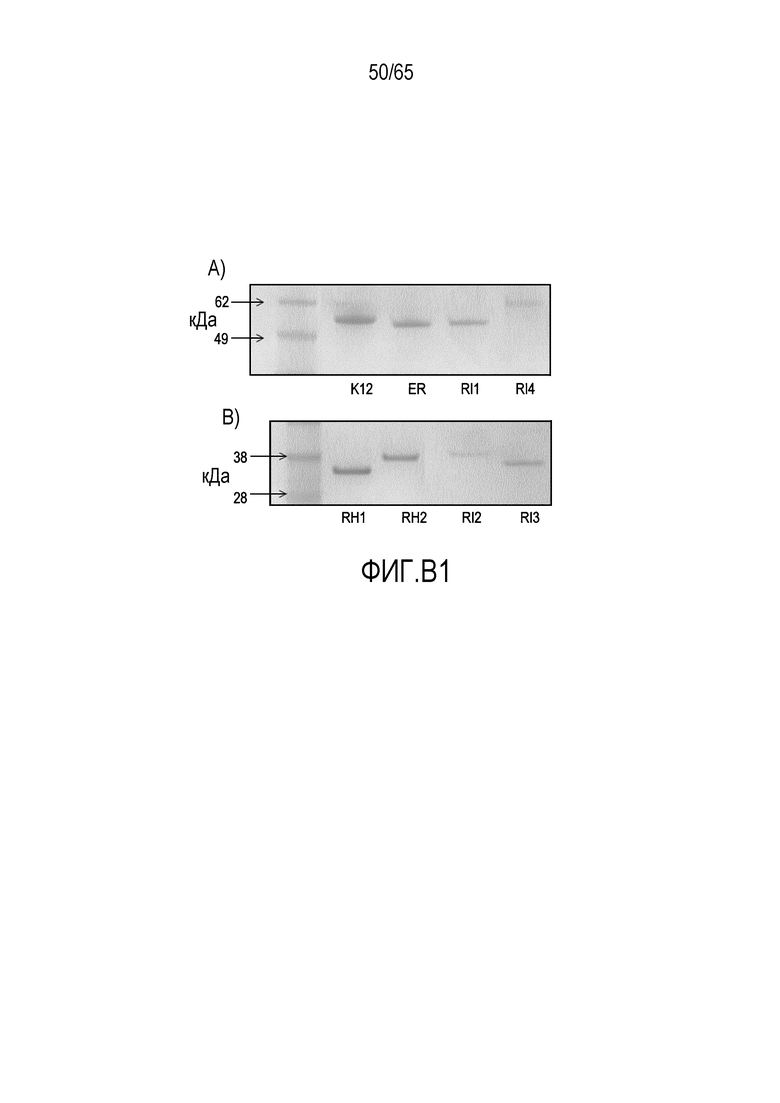






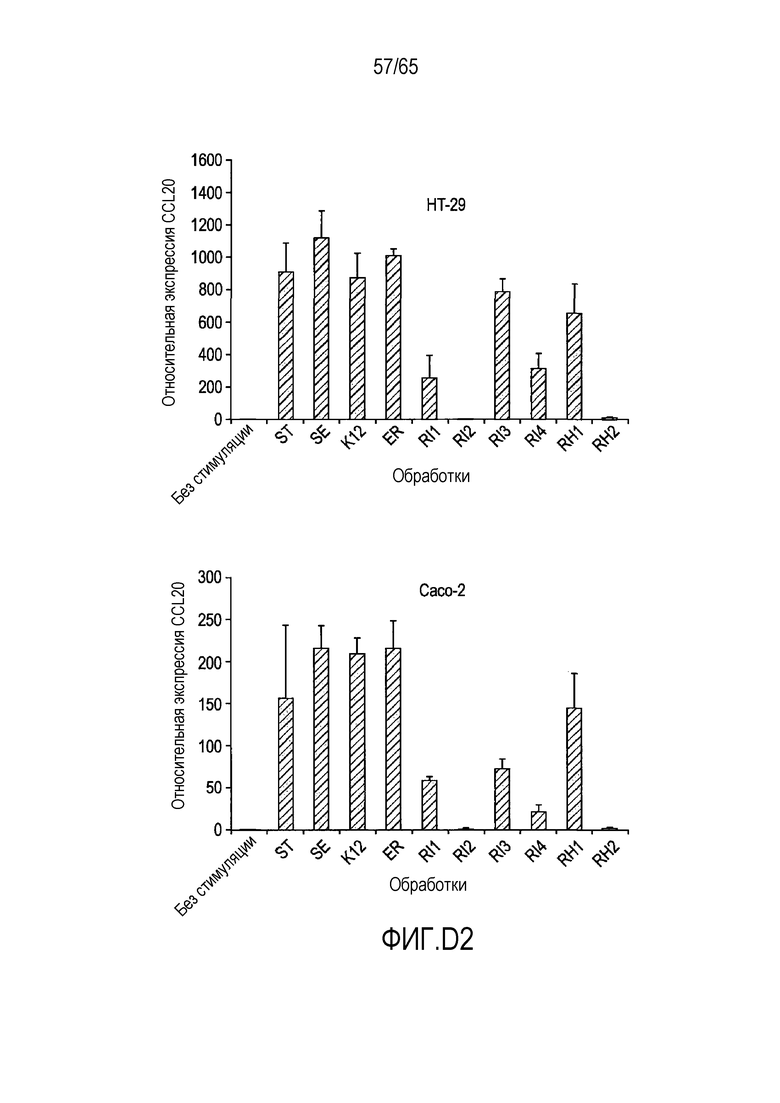
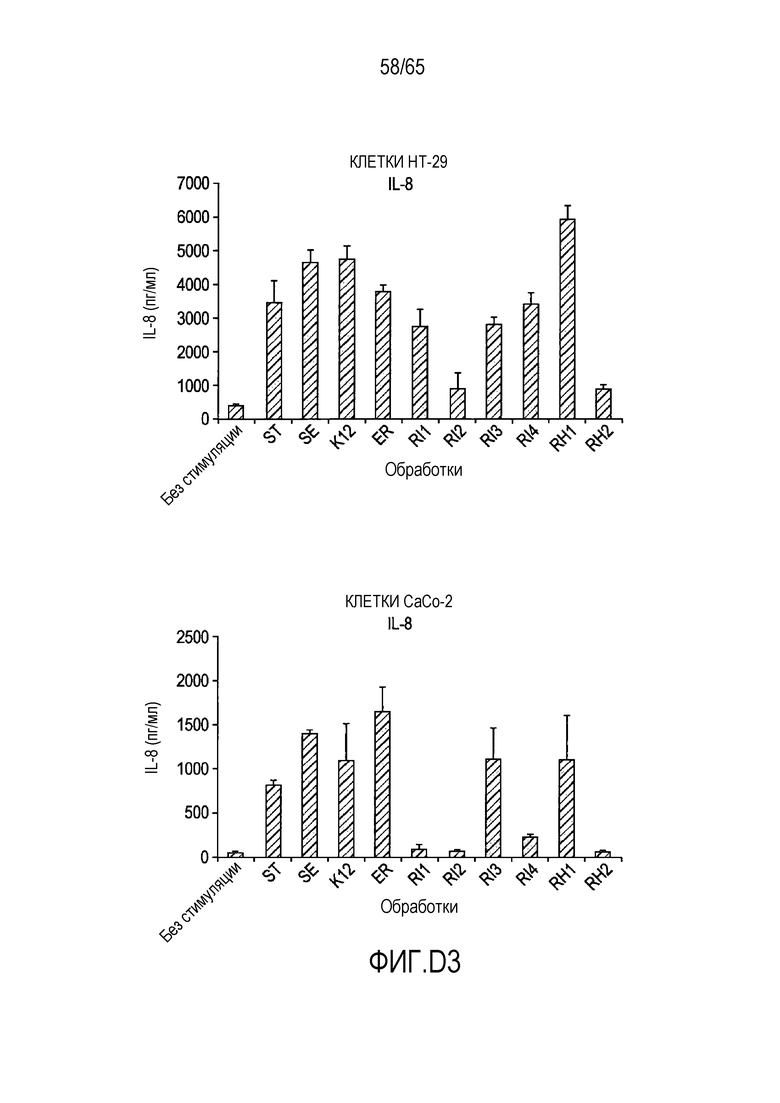
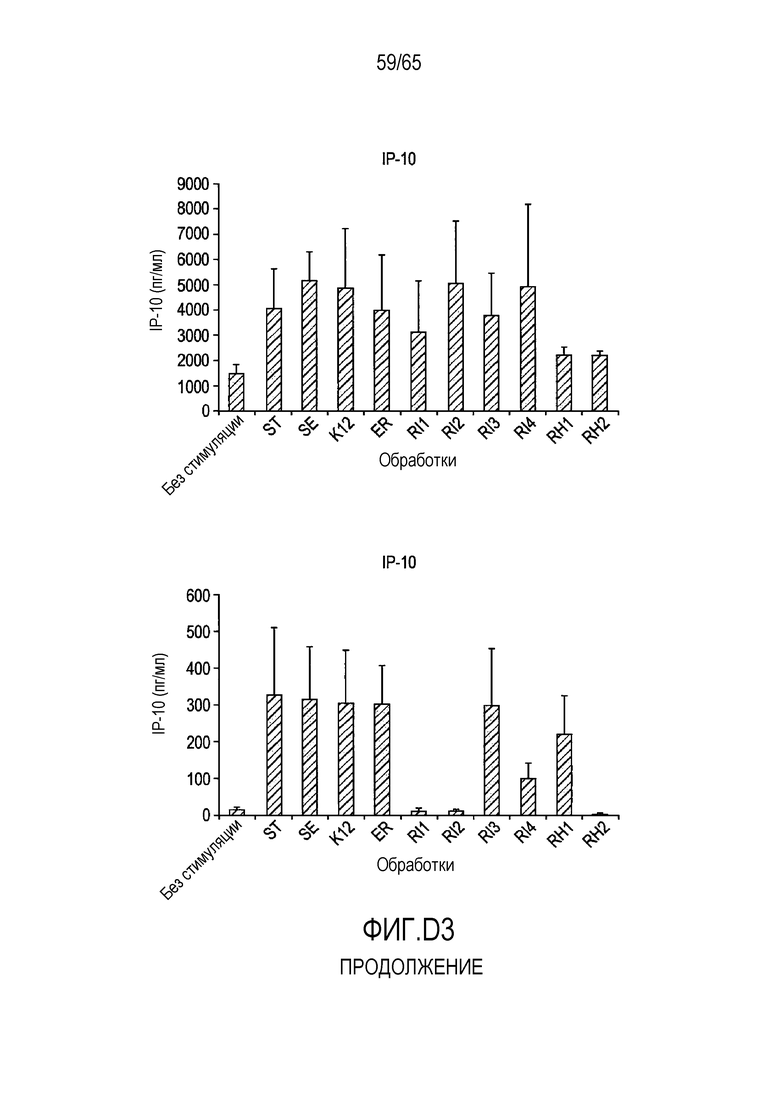
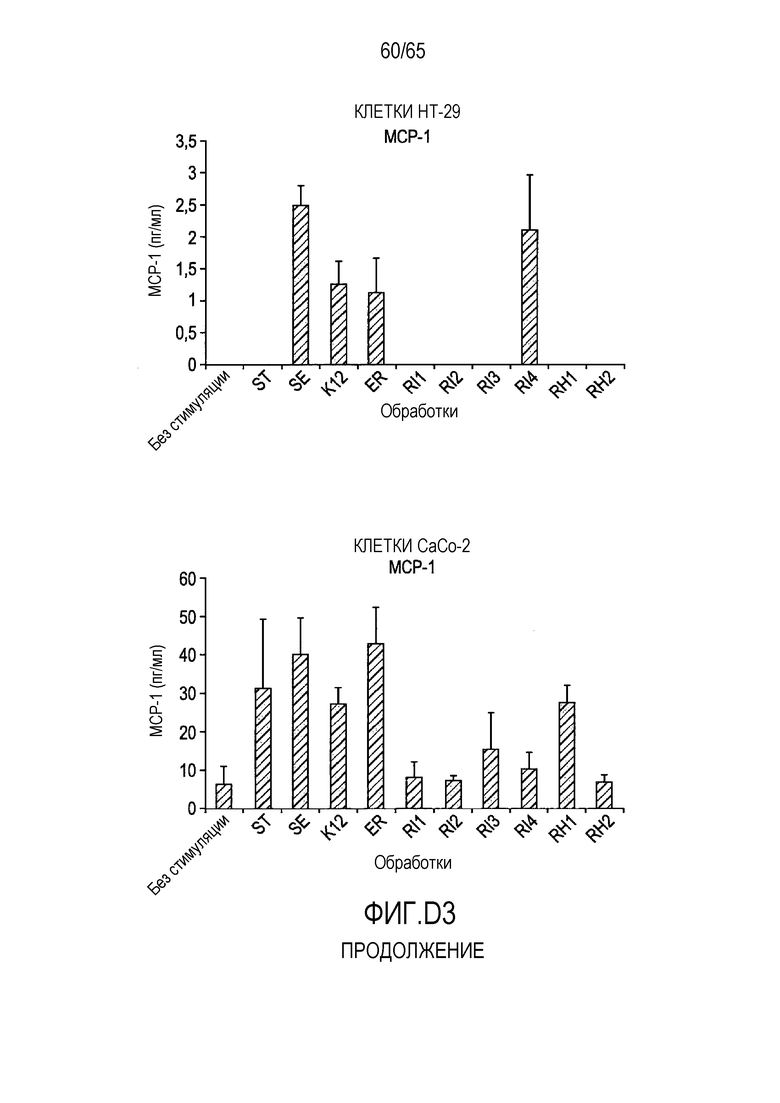
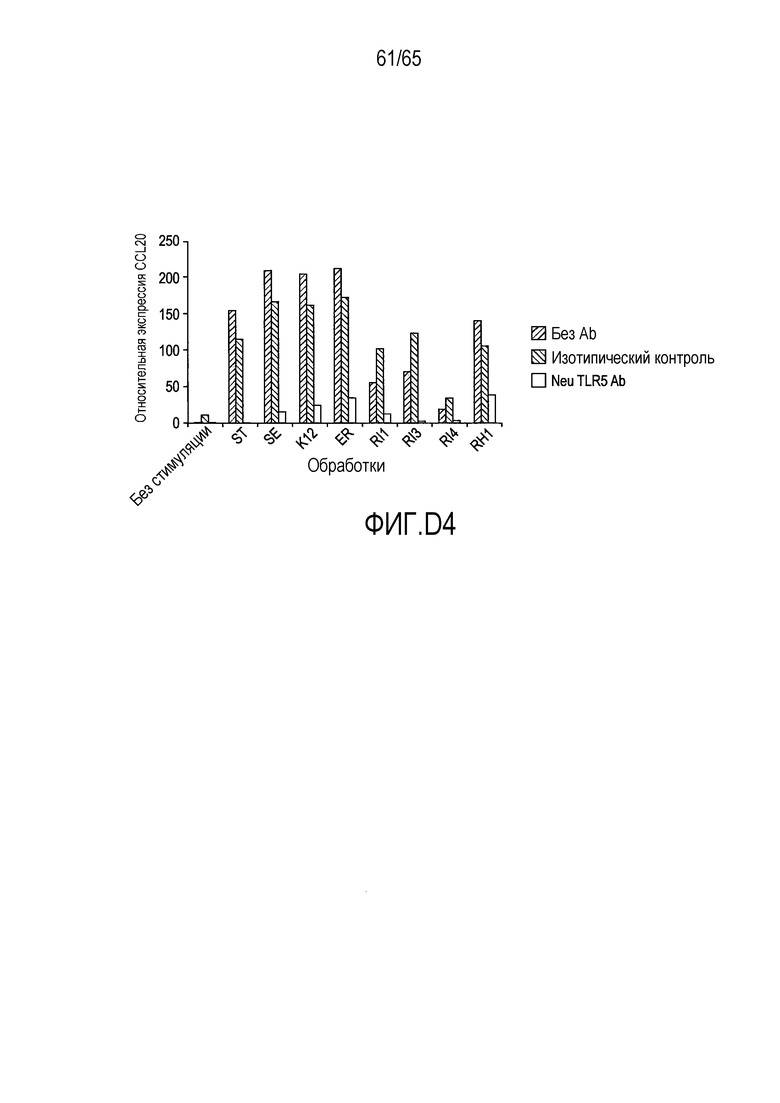
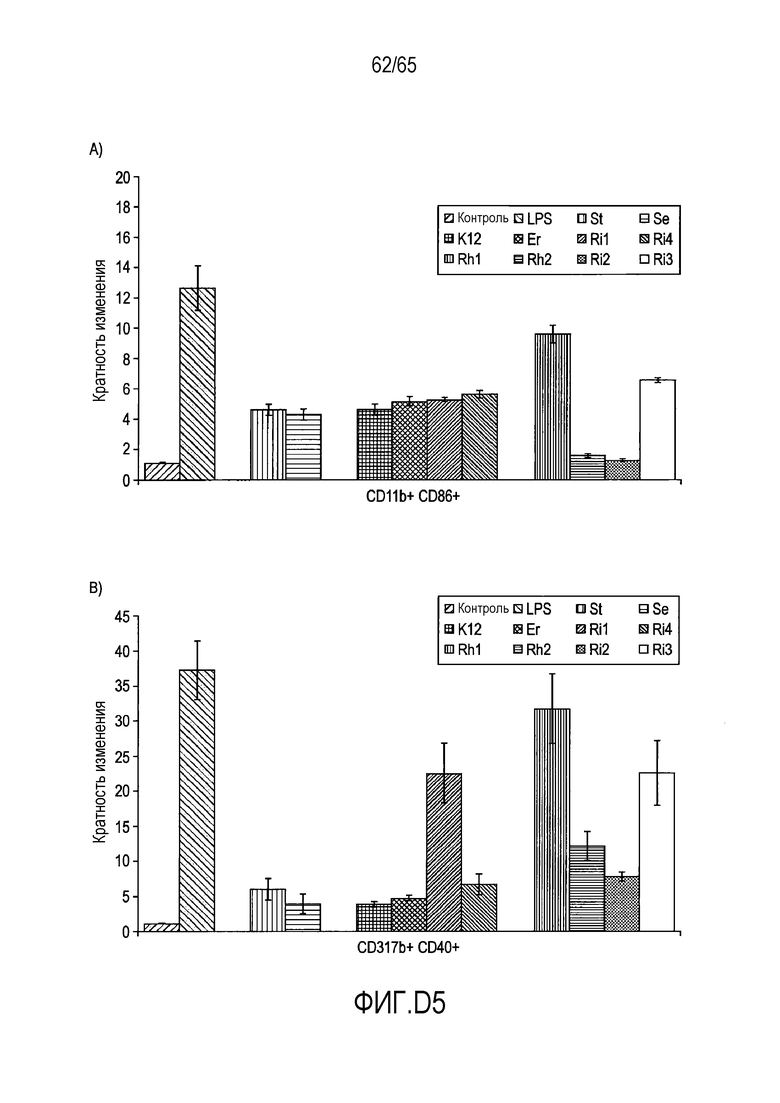
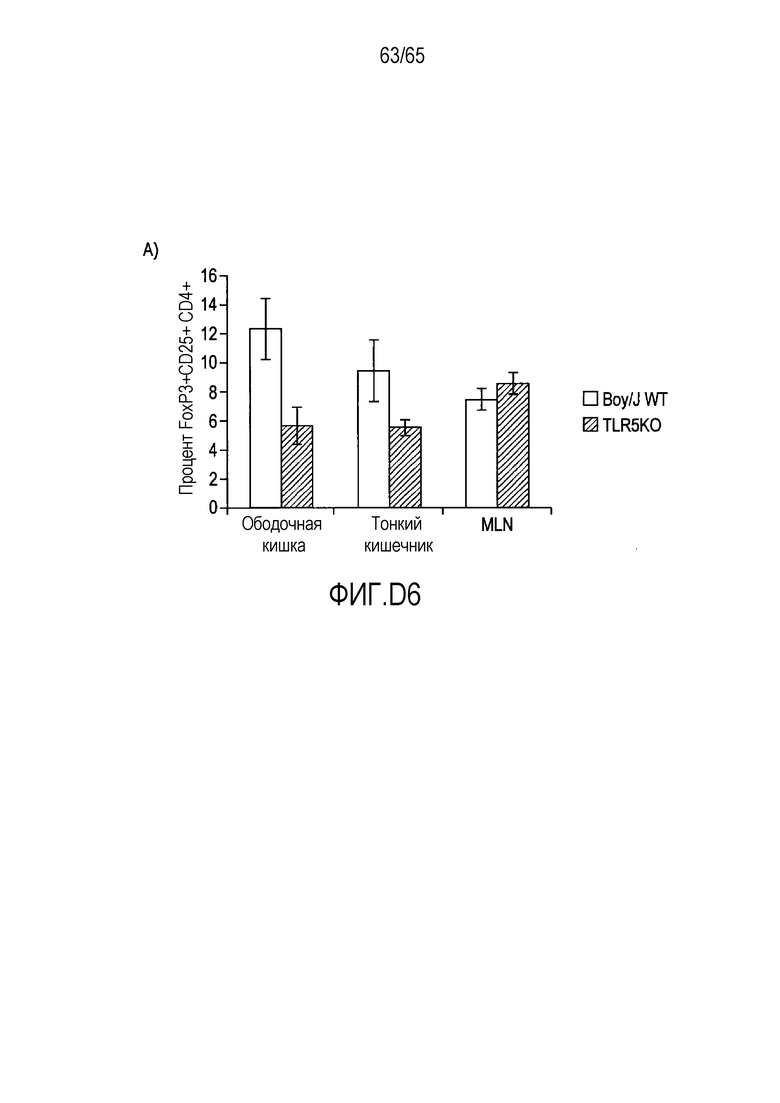
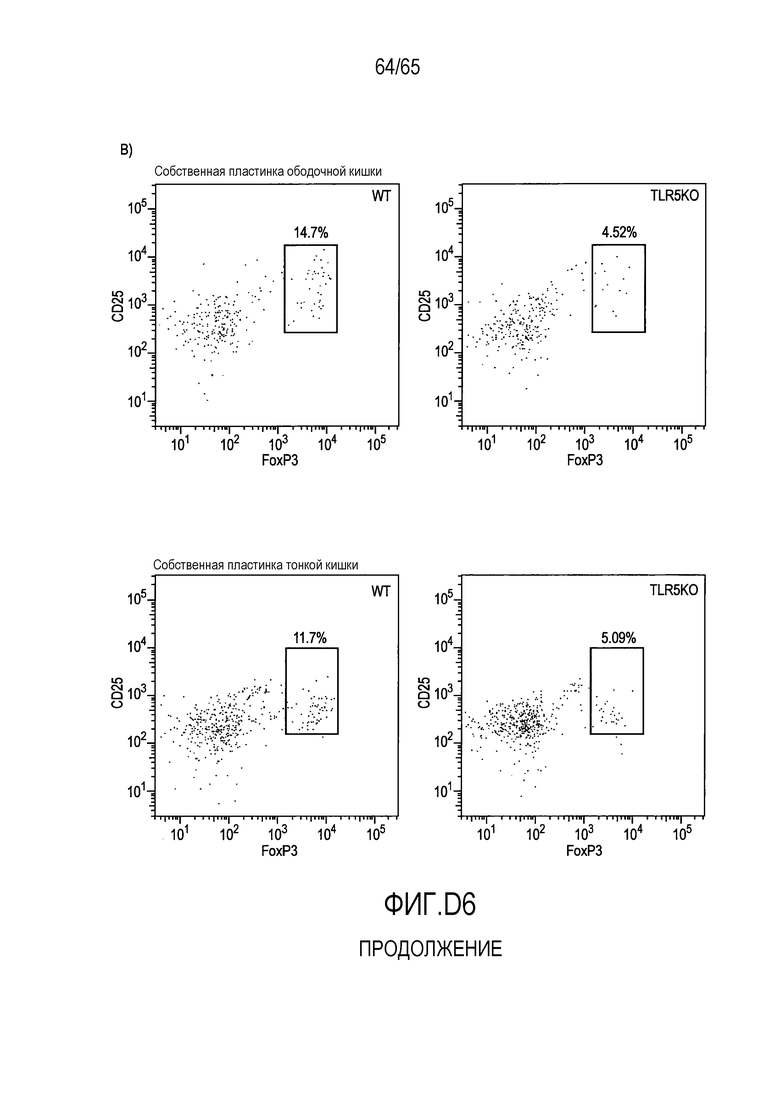
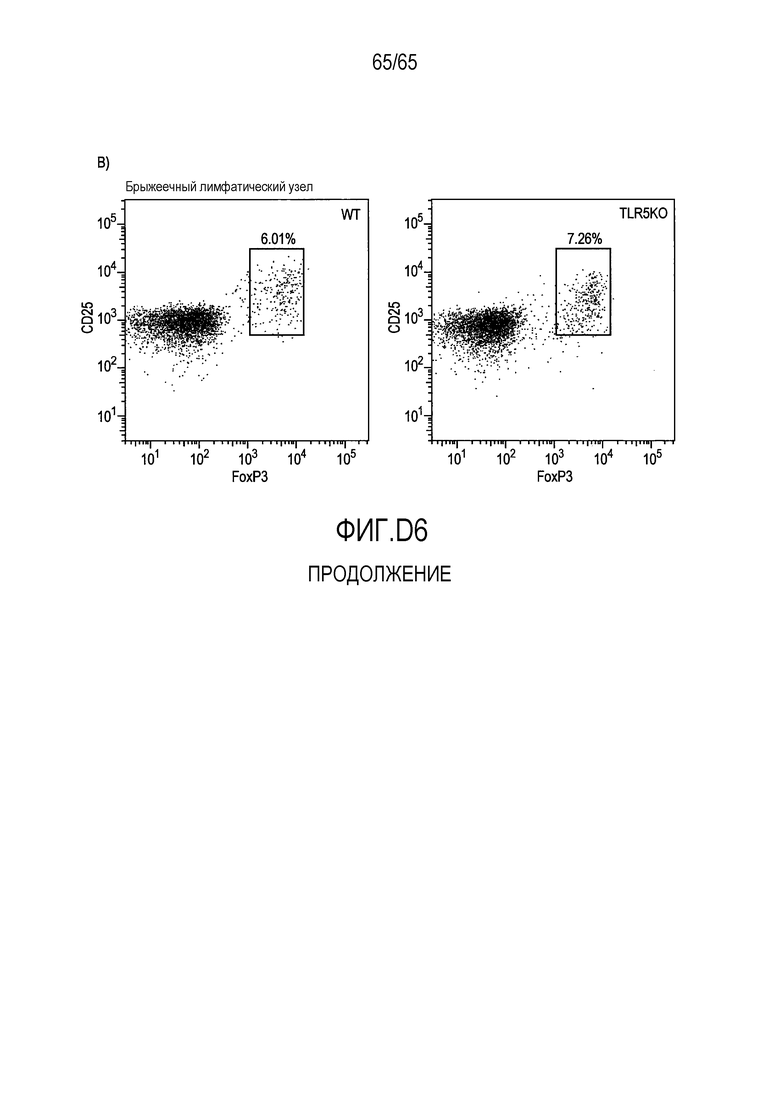
Группа изобретений относится к медицине, в частности к применению флагеллина Roseburia, и/или полинуклеотидной последовательности, кодирующей указанный флагеллин Roseburia, и/или вектора, содержащего указанную полинуклеотидную последовательность, и/или клетки-хозяина, включающей бактерии, содержащей указанный вектор, и/или клетки-хозяина, включающей бактерии, содержащей указанную полинуклеотидную последовательность, для снижения воспаления у индивидуума. Также группа изобретений относится к фармацевтической композиции для снижения воспаления у индивидуума, содержащей флагеллин Roseburia и фармацевтически приемлемый эксципиент, носитель или разбавитель. Также описаны питательная добавка, пищевое вещество, продукт питания, диетическая добавка, пищевая добавка, содержащие флагеллин Roseburia. Также описаны способ получения фармацевтичской композиции и питательной добавки, содержащей флагеллин Roseburia. Группа изобретений обеспечивает получение средства, обладающего противовоспалительной и терапевтически релевантной эффективностью. 12 н. и 108 з.п. ф-лы, 27 ил., 18 табл., 1 пр.
1. Применение флагеллина Roseburia для снижения воспаления у индивидуума.
2. Применение по п. 1, в котором флагеллин Roseburia модулирует воспаление ткани или органа у индивидуума.
3. Применение по п. 2, где указанный флагеллин Roseburia уменьшает воспаление ткани или органа.
4. Применение по п. 3, где указанный флагеллин Roseburia уменьшает воспаление эпителиальных клеток ткани или органа.
5. Применение по п. 1, в котором флагеллин Roseburia модулирует продукцию T-клеток у индивидуума.
6. Применение п. 5, где флагеллин Roseburia увеличивает продукцию регуляторных T-клеток у индивидуума.
7. Применение по п. 1, в котором флагеллин Roseburia восстанавливает иммунологическую толерантность.
8. Применение по п. 1, в котором флагеллин Roseburia регулирует иммунную систему и восстанавливает иммунологическую толерантность у индивидуума.
9. Применение по п. 8, где флагеллин Roseburia регулирует адаптивную иммунную систему у индивидуума.
10. Применение по п. 8, где флагеллин Roseburia регулирует врожденную иммунную систему индивидуума.
11. Применение по п. 1, в котором флагеллин Roseburia лечит воспалительное нарушение и/или аутоиммунное нарушение.
12. Применение по п. 11, где указанное нарушение влияет на пищеварительный тракт или его сегмент у указанного индивидуума.
13. Применение по п. 11, где указанное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
14. Применение по п. 1, в котором флагеллин Roseburia модулирует дендритные клетки и/или эпителиальные клетки в ткани или органе индивидуума.
15. Применение по п. 14, где указанный флагеллин Roseburia, и/или полинуклеотидная последовательность, и/или вектор, и/или клетка-хозяин активируют дендритные клетки и/или эпителиальные клетки.
16. Применение по п. 1, в котором флагеллин Roseburia регулирует продукцию IL-10 и/или TGFβ в клетке или клетках индивидуума.
17. Применение по п. 16, где продукция IL-10 осуществляется дендритными клетками.
18. Применение по п. 16, где указанный флагеллин Roseburia активирует продукцию IL-10 и/или TGFβ.
19. Применение по п. 1, в котором флагеллин Roseburia регулирует продукцию маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
20. Применение по п. 19, где продукция маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, осуществляется дендритными клетками.
21. Применение по п. 19, где указанный флагеллин Roseburia активирует продукцию CD40 и/или I-A/I-E.
22. Применение по п. 1, в котором флагеллин Roseburia регулирует экспрессию одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
23. Применение по п. 1, в котором флагеллин Roseburia регулирует экспрессию одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
24. Применение полинуклеотидной последовательности, кодирующей флагеллин Roseburia, для снижения воспаления у индивидуума.
25. Применение по п. 24, в котором полинуклеотидная последовательность модулирует воспаление ткани или органа у индивидуума.
26. Применение по п. 25, где указанная полинуклеотидная последовательность уменьшает воспаление ткани или органа.
27. Применение по п. 26, где указанная полинуклеотидная последовательность уменьшает воспаление эпителиальных клеток ткани или органа.
28. Применение по п. 24, в котором полинуклеотидная последовательность модулирует продукцию T-клеток у индивидуума.
29. Применение по п. 28, где полинуклеотидная последовательность увеличивает продукцию регуляторных T-клеток у индивидуума.
30. Применение по п. 24, в котором полинуклеотидная последовательность восстанавливает иммунологическую толерантность.
31. Применение по п. 24, в котором полинуклеотидная последовательность регулирует иммунную систему и восстанавливает иммунологическую толерантность у индивидуума.
32. Применение по п. 31, где полинуклеотидная последовательность регулирует адаптивную иммунную систему у индивидуума.
33. Применение по п. 31, где полинуклеотидная последовательность регулирует врожденную иммунную систему индивидуума.
34. Применение по п. 24, в котором полинуклеотидная последовательность лечит воспалительное нарушение и/или аутоиммунное нарушение.
35. Применение по п. 34, где указанное нарушение влияет на пищеварительный тракт или его сегмент у указанного индивидуума.
36. Применение по п. 34, где указанное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
37. Применение по п. 24, в котором полинуклеотидная последовательность модулирует дендритные клетки и/или эпителиальные клетки в ткани или органе индивидуума.
38. Применение по п. 37, где указанная полинуклеотидная последовательность активирует дендритные клетки и/или эпителиальные клетки.
39. Применение по п. 24, в котором полинуклеотидная последовательность регулирует продукцию IL-10 и/или TGFβ в клетке или клетках индивидуума.
40. Применение по п. 39, где продукция IL-10 осуществляется дендритными клетками.
41. Применение по п. 39, где указанная полинуклеотидная последовательность активирует продукцию IL-10 и/или TGFβ.
42. Применение по п. 24, в котором полинуклеотидная последовательность регулирует продукцию маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
43. Применение по п. 42, где продукция маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, осуществляется дендритными клетками.
44. Применение по п. 42, где указанная полинуклеотидная последовательность активирует продукцию CD40 и/или I-A/I-E.
45. Применение по п. 24, в котором полинуклеотидная последовательность регулирует экспрессию одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
46. Применение по п. 24, в котором полинуклеотидная последовательность регулирует экспрессию одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
47. Применение вектора, включающего полинуклеотидную последовательность, кодирующую флагеллин Roseburia, для снижения воспаления у индивидуума, где вектор представляет собой экспрессирующий вектор, способный к in vivo или in vitro экспрессии флагеллина Roseburia.
48. Применение по п. 47, в котором вектор модулирует воспаление ткани или органа у индивидуума.
49. Применение по п. 48, где указанный вектор уменьшает воспаление ткани или органа.
50. Применение по п. 49, где указанный вектор уменьшает воспаление эпителиальных клеток ткани или органа.
51. Применение по п. 47, в котором вектор модулирует продукцию T-клеток у индивидуума.
52. Применение по п. 51, где вектор увеличивает продукцию регуляторных T-клеток у индивидуума.
53. Применение по п. 47, в котором вектор восстанавливает иммунологическую толерантность.
54. Применение по п. 47, в котором вектор регулирует иммунную систему и восстанавливает иммунологическую толерантность у индивидуума.
55. Применение по п. 54, где вектор регулирует адаптивную иммунную систему у индивидуума.
56. Применение по п. 54, где вектор регулирует врожденную иммунную систему индивидуума.
57. Применение по п. 47, в котором вектор лечит воспалительное нарушение и/или аутоиммунное нарушение.
58. Применение по п. 57, где указанное нарушение влияет на пищеварительный тракт или его сегмент у указанного индивидуума.
59. Применение по п. 57, где указанное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
60. Применение по п. 47, в котором вектор модулирует дендритные клетки и/или эпителиальные клетки в ткани или органе индивидуума.
61. Применение по п. 60, где указанный вектор активирует дендритные клетки и/или эпителиальные клетки.
62. Применение по п. 47, в котором вектор регулирует продукцию IL-10 и/или TGFβ в клетке или клетках индивидуума.
63. Применение по п. 62, где продукция IL-10 осуществляется дендритными клетками.
64. Применение по п. 62, где указанный вектор активирует продукцию IL-10 и/или TGFβ.
65. Применение по п. 47, в котором вектор регулирует продукцию маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
66. Применение по п. 65, где продукция маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, осуществляется дендритными клетками.
67. Применение по п. 65, где указанный вектор активирует продукцию CD40 и/или I-A/I-E.
68. Применение по п. 45, в котором вектор регулирует экспрессию одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
69. Применение по п. 45, в котором вектор регулирует экспрессию одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
70. Применение клетки-хозяина, содержащей полинуклеотидную последовательность, кодирующую флагеллин Roseburia, для снижения воспаления у индивидуума.
71. Применение по п. 70, в котором клетка-хозяин модулирует воспаление ткани или органа у индивидуума.
72. Применение по п. 71, где указанная клетка-хозяин уменьшает воспаление ткани или органа.
73. Применение по п. 72, где указанная клетка-хозяин уменьшает воспаление эпителиальных клеток ткани или органа.
74. Применение по п. 70, где клетка-хозяин модулирует продукцию T-клеток у индивидуума.
75. Применение по п. 74, где клетка-хозяин увеличивает продукцию регуляторных T-клеток у индивидуума.
76. Применение по п. 70, где клетка-хозяин восстанавливает иммунологическую толерантность.
77. Применение по п. 70, где клетка-хозяин регулирует иммунную систему и восстанавливает иммунологическую толерантность у индивидуума.
78. Применение по п. 77, где клетка-хозяин регулирует адаптивную иммунную систему у индивидуума.
79. Применение по п. 77, где клетка-хозяин регулирует врожденную иммунную систему индивидуума.
80. Применение по п. 70, где клетка-хозяин лечит воспалительное нарушение и/или аутоиммунное нарушение.
81. Применение по п. 80, где указанное нарушение влияет на пищеварительный тракт или его сегмент у указанного индивидуума.
82. Применение по п. 80, где указанное нарушение выбрано из группы, состоящей из ревматоидного артрита, псориаза, рассеянного склероза, диабета типа I, глютеновой болезни, атопического дерматита, ринита, синдрома раздраженной кишки (IBS), колита, воспалительного нарушения кишечника (IBD), язвенного колита, резервуарного илеита, болезни Крона, функциональной диспепсии, атопических заболеваний, некротизирующего энтероколита и их комбинаций.
83. Применение по п. 70, где клетка-хозяин модулирует дендритные клетки и/или эпителиальные клетки в ткани или органе индивидуума.
84. Применение по п. 83, где указанная клетка-хозяин активирует дендритные клетки и/или эпителиальные клетки.
85. Применение по п. 70, в котором клетка-хозяин регулирует продукцию IL-10 и/или TGFβ в клетке или клетках индивидуума.
86. Применение по п. 85, где продукция IL-10 осуществляется дендритными клетками.
87. Применение по п. 85, где указанная клетка-хозяин активирует продукцию IL-10 и/или TGFβ.
88. Применение по п. 70, в котором клетка-хозяин регулирует продукцию маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, в клетке или клетках индивидуума.
89. Применение по п. 88, где продукция маркеров клеточной поверхности, вовлеченных в иммунные ответы и распознавание антигена, такого как CD40, I-A/I-E, CD317/BST-2, CD103, CD80, CD86, CD83 и/или Siglec-H и/или их видовые эквиваленты, осуществляется дендритными клетками.
90. Применение по п. 88, где указанная клетка-хозяин активирует продукцию CD40 и/или I-A/I-E.
91. Применение по п. 70, в котором клетка-хозяин регулирует экспрессию одного или нескольких генов IFN типа I в клетке или клетках индивидуума.
92. Применение по п. 70, в котором клетка-хозяин регулирует экспрессию одного или нескольких провоспалительных генов в клетке или клетках индивидуума.
93. Применение по любому из пп. 1-92, где указанный флагеллин Roseburia выбран из группы, состоящей из:
полипептидов, обладающих по меньшей мере 75% идентичностью с SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12, или их вариантов, гомологов, фрагментов или производных и их комбинации;
и где полинуклеотидная последовательность, кодирующая указанный флагеллин Roseburia, выбрана из группы, состоящей из:
полинуклеотидных последовательностей, кодирующих полипептид, обладающий по меньшей мере 75% идентичностью с SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 12, или их вариантов, гомологов, фрагментов или производных;
полинуклеотидных последовательностей, обладающих по меньшей мере 75% идентичностью с SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 11, или их вариантов, гомологов, фрагментов или производных;
и их комбинаций.
94. Применение по любому из пп. 4, 27, 50 или 73, где указанные эпителиальные клетки представляют собой эпителиальные клетки пищеварительного тракта.
95. Применение по любому из пп. 1-92, где указанный флагеллин Roseburia, и/или полинуклеотидная последовательность, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или клетка-хозяин, содержащая указанную полинуклеотидную последовательность, является инкапсулированной.
96. Применение по любому из пп. 70-92, где клетка-хозяин является бактериальной клеткой-хозяином.
97. Фармацевтическая композиция для снижения воспаления у индивидуума, содержащая флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность и фармацевтически приемлемый эксципиент, носитель или разбавитель, где фармацевтическая композиция имеет фармацевтические средства.
98. Фармацевтическая композиция по п. 97, где указанный флагеллин Roseburia, и/или указанная полинуклеотидная последовательность, и/или указанный вектор, и/или указанная клетка-хозяин, содержащая указанный вектор, и/или указанная клетка-хозяин, содержащая указанную полинуклеотидная последовательность, являются инкапсулированными.
99. Фармацевтическая композиция по п. 97 или 98, где клетка-хозяин является бактериальной клеткой-хозяином.
100. Питательная добавка, содержащая флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность и диетологически приемлемый эксципиент, носитель или разбавитель.
101. Питательная добавка по п. 100, где указанный флагеллин Roseburia, и/или указанная полинуклеотидная последовательность, и/или указанный вектор, и/или указанная клетка-хозяин, содержащая указанный вектор, и/или указанная клетка-хозяин, содержащая указанную полинуклеотидная последовательность, являются инкапсулированными.
102. Питательная добавка по п. 100 или 101, где клетка-хозяин является бактериальной клеткой-хозяином.
103. Пищевое вещество, содержащее флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
104. Пищевое вещество по п. 103, отличающееся тем, что указанное пищевое вещество является инкапсулированным.
105. Пищевое вещество по п. 103, где клетка-хозяин является бактериальной клеткой-хозяином.
106. Продукт питания, содержащий флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
107. Продукт питания по п. 106, отличающийся тем, что указанный продукт питания является инкапсулированным.
108. Продукт питания по п. 106, где клетка-хозяин является бактериальной клеткой-хозяином.
109. Диетическая добавка, содержащая флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
110. Диетическая добавка по п. 109, отличающаяся тем, что указанная диетическая добавка является инкапсулированной.
111. Диетическая добавка по п. 109, где клетка-хозяин является бактериальной клеткой-хозяином.
112. Пищевая добавка, содержащая флагеллин Roseburia, и/или полинуклеотидную последовательность, кодирующую указанный флагеллин Roseburia, и/или вектор, содержащий указанную полинуклеотидную последовательность, и/или клетку-хозяина, содержащую указанный вектор, и/или клетку-хозяина, содержащую указанную полинуклеотидную последовательность.
113. Пищевая добавка по п. 112, отличающаяся тем, что указанная пищевая добавка является инкапсулированной.
114. Пищевая добавка по п. 112, где клетка-хозяин является бактериальной клеткой-хозяином.
115. Способ получения фармацевтической композиции по п. 97, причем указанный способ включает смешение указанного флагеллина Roseburia, и/или указанной полинуклеотидной последовательности, и/или указанного вектора, и/или указанной клетки-хозяина, содержащей указанный вектор, и/или указанной клетки-хозяина, содержащей указанную полинуклеотидную последовательность, с фармацевтически приемлемым эксципиентом, носителем или разбавителем, где фармацевтическая композиция имеет фармацевтические средства.
116. Способ получения питательной добавки по п. 98, причем указанный способ включает смешение указанного флагеллина Roseburia, и/или указанной полинуклеотидной последовательности, и/или указанного вектора, и/или указанной клетки-хозяина, содержащей указанный вектор, и/или указанной клетки-хозяина, содержащей указанную полинуклеотидную последовательность, с диетологически приемлемым эксципиентом, носителем или разбавителем.
117. Способ по п. 115 или 116, где флагеллин Roseburia, и/или полинуклеотидная последовательность, и/или вектор, и/или клетка-хозяин, содержащая указанный вектор, и/или указанная клетка-хозяин, содержащая указанную полинуклеотидную последовательность, являются инкапсулированными.
118. Способ по любому из пп. 115 или 116, где клетка-хозяин является бактериальной клеткой-хозяином.
119. Применение по п. 93, где клеткой-хозяином является бактериальная клетка–хозяин.
120. Применение по п. 95, где клетка-хозяин является бактериальной клеткой-хозяином.
| RU 98123839 A, 20.12.2000 | |||
| WO 2003053220 A2, 03.07.2003 | |||
| WO 2005030133 A2, 07.04.2005 | |||
| B ANNE NEVILLE: "Functional genomics of motile commensal intestinal bacteria"In: "PhD Thesis, University College Cork | |||
| ", 15.01.2013, p.87, paragraph 1.2.2.4 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Прибор для запора стрелок | 1921 |
|
SU167A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| I | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2019-03-20—Публикация
2014-04-10—Подача