Данная заявка претендует на приоритет предварительной патентной заявки США с регистрационным номером 60/331190, поданной 9 ноября 2001 г. Эта приоритетная заявка включена тем самым в настоящее описание путем отсылки в ее полном виде.
Данное изобретение было сделано при поддержке правительства США по гранту Министерства обороны DAMD17-98-1-8093, гранту Национального Института Здравоохранения NHLBI RО1 HL60660 и гранту Национального Института Рака СА58185-08. Правительство имеет определенные права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к композициям, которые применимы в лечении состояний, в которых выгодно, чтобы ангиогенез был ингибированным, например в лечении солидных опухолей, диабетической ретинопатии, саркомы Капоши, псориаза и ревматоидного артрита. В частности, данное изобретение относится к новым изоформам ингибитора роста васкулярных эндотелиальных клеток (VEGI), их ДНК и ассоциированным белковым последовательностям, их композициям и вариантам и их применению в лечении движимых ангиогенезом заболеваний.
Уровень техники
При нормальных физиологических условиях люди и животные подвергаются ангиогенезу, возникновению новых кровеносных сосудов в ткани или органе, в очень специфических ограниченных ситуациях. Например, ангиогенез обычно наблюдается при заживлении ран, при эмбриональном развитии и при образовании желтого тела, эндометрия и плаценты. Термин "эндотелий" обозначает тонкий слой плоских эпителиальных клеток, которые выстилают серозные полости, лимфатические сосуды и кровеносные сосуды. Термин "антиангиогенная" или "ингибирующая ангиогенез активность" обозначает способность молекулы ингибировать ангиогенез вообще.
Считается, что как контролируемый, так и неконтролируемый ангиогенез происходит сходным образом. Эндотелиальные клетки активно участвуют в воспалении, клеточной адгезии, свертывании, тромбозе, фибринолизе и ангиогенезе. Эндотелиальные клетки и перициты (периваскулярные клетки), окруженные базальной мембраной, образуют капиллярные кровеносные сосуды. Ангиогенез начинается с эрозии базальной мембраны ферментами, высвобождаемыми эндотелиальными клетками и лейкоцитами. Затем эндотелиальные клетки, которые выстилают просвет кровеносных сосудов, выпячиваются через базальную мембрану. Стимуляторы ангиогенеза индуцируют эндотелиальные клетки к миграции через эрозированную базальную мембрану. Мигрирующие клетки образуют "росток" из исходного кровеносного сосуда, где эндотелиальные клетки подвергаются митозу и пролиферируют. Эндотелиальные ростки сливаются друг с другом с образованием капиллярных петель, создающих новый кровеносный сосуд.
Стойкий нерегулируемый ангиогенез происходит при многих патологических состояниях, метастазировании опухолей и отклоняющемся от нормы росте эндотелиальных клеток и поддерживает патологическое повреждение, наблюдаемое в этих условиях. Разнообразные патологические состояния, при которых присутствует нерегулируемый ангиогенез, были объединены вместе как ангиогенез-зависимые или ангиогенез-ассоциированные заболевания.
Во время роста опухоли эндотелиальные клетки пролиферируют, инвазируют строму, мигрируют в направлении источника ангиогенных стимулов, такого как раковые клетки, взаимодействуют с периваскулярными клетками и стромальными клетками и, в конце концов, образуют капиллярные сосуды, связывающие ткань опухоли с кровотоком (J.Folkman (1995) Nat.Med. 1:27-31). Хотя механизм несомненно высокой сложности, который регулирует ангиогенез, является все еще невыясненным, становится ясно, что инициация или терминация этого процесса является результатом баланса между положительными и отрицательными регуляторами ангиогенеза. Ряд ангиогенных факторов, зачастую испытывающих выраженную повышающую регуляцию в тканях опухолей, был описан, в том числе несколько членов семейства факторов роста фибробластов, таких как FGF-I (G.Gimenez-Gallego et al. (1985) Science 230:1385), FGF-2 (L.Schweigerer et al. (1987) Nature 325:257), и членов семейства факторов роста васкулярных эндотелиальных клеток (VEGF) (D.W.Leung et al. (1989) Science 246:1390), а также рецепторов этих факторов роста (L.W.Burros and В.В.Olwin (1989) J.Biol.Chem. 264:18647; S.Wemistrom et al. (1991) Growth Factors 4:197; В.Tennan et al. (1992) Biochem. Biopys. Res. Comm. 187:1579). С.de Vries et al. (1992) Science 255:989). Недавно было обнаружено, что два новых белковых фактора, пролиферин и родственный пролиферину белок, участвуют в регуляции инициации и прекращения неоваскуляризации в плаценте мыши (Jackson D, et al. Science 266, 1581-4, 1994). Все документы, цитируемые здесь supra и infra, специально включены в описание путем отсылки в их полном виде.
Сообщалось также о нескольких ингибиторах ангиогенеза, в том числе тромбоспондине (D.J.Good et al. (1990) Proc. Natl.Acad.Sci. USA 87:6624), ангиостатине (M.S.O'Reilly et al. (1994) Cell 79:315), эндостатине (M.S.O'Reilly et al. (1997) Cell 88:277) и факторе-4 тромбоцитов (Е.Maione et al. (1997) Science 247:77). Очевидно, что нормальный ангиогенез быстро активируется при необходимости и быстро терминируется, когда он больше не требуется, тогда как патологический ангиогенез, начавшись, часто продолжается, и его трудно остановить. Это указывает на то, что механизм отрицательной регуляции, функционирующий в процессе нормального ангиогенеза, отсутствует или является подавленным в процессе патологического ангиогенеза. Было высказано предположение, что протеолитические активности, которые высвобождают ингибиторы ангиогенеза из ряда предшественников, могут быть частично ответственными за понижающую регуляцию ангиогенеза, как показывает протеолитическая активация ангиостатина из плазминогена и протеолитическая активация эндостатина из коллагена XVIII (M.S.O'Reilly (1997) Cell 88:277). Многие известные регуляторы ангиогенеза являются плейотропными и могут действовать на другие типы клеток, а также на клетку, которая продуцирует эти регуляторы, хотя возможно, что эндотелиальные клетки могут продуцировать аутокринные факторы для супрессии процесса ангиогенеза или поддержания состояния покоя зрелой сосудистой сети. Таким образом, целью данной заявки является описание новых аутокринных отрицательных регуляторов ангиогенеза класса, называемого ингибиторами роста васкулярных эндотелиальных клеток (VEGI), которые специфически экспрессируются эндотелиальными клетками.
Опубликованная заявка РСТ WO 99/23105 описывает белок VEGI (VEGI-174) и сплайсинговый вариант VEGI-251 и их соответствующие нуклеотидные последовательности, раскрытие которой специально включено тем самым в данную заявку путем отсылки в полном виде. Была описана антиангиогенная активность укороченных с N-конца форм VEGI-174. Белок VEGI-174 обнаруживал 20-30% гомологию последовательности с TNFα, TNFβ и Fas-лигандом. Белок с молекулярной массой 22 кДа образовывался в эксперименте с транскрипцией и трансляцией in vitro с использованием кДНК-клона в качестве матрицы, что согласуется с предсказанной открытой рамкой считывания из 174 аминокислот. Здесь этот белок называется VEGI-174. Анализ гидрофобности этого белка позволил предсказать гидрофобный район из 12 аминокислот непосредственно после N-концевого сегмента из 14 негидрофобных аминокислот. Это согласовалось со структурой трансмембранного белка типа II, сходного с TNF (В.В.Aggarwal and К.Natarajan (1996) Eur. Cytokine News. 7:93). Была также описана изоформа VEGI. Этот белок называется здесь VEGI-251, который, как предсказано, является мембранным белком.
Недавний Нозерн-анализ препаратов тотальной РНК из 22 различных типов культивируемых клеток различных линий дифференцировки показал, что транскрипты для этого белка могут быть детектированы только в двух линиях эндотелиальных клеток: в клетках HUVE и венозных эндотелиальных клетках человека раннего пассажа. мРНК не детектировалась в венозных эндотелиальных клетках более позднего пассажа и не обнаруживалась в артериальных клетках человека. В резком противоречии с этим, члены семейства TNF экспрессируются, в основном, в иммунных клетках (В.В.Aggarwal and К.Natarajan (1996) (supra). Например, TNFα продуцируется макрофагами, моноцитами, нейтрофилами и Т-клетками, тогда как TNFβ преимущественно продуцируется стимулированными митогеном Т-лимфоцитами и лейкоцитами. Подобным образом, лиганды для Fas и других членов семейства TNF, CD27, CD30, CD40, OХ40 и 4-1 ВВ все экспрессируются в типах клеток иммунной системы. С использованием Нозерн-блотов множества тканей было обнаружено, что транскрипт EGI экспрессируется в плаценте, легком, почке, скелетной мышце, головном мозгу, печени, тимусе, яичке, яичнике и лимфоцитах периферической крови.
Ингибирование ангиогенеза в опухоли является важным подходом для лечения рака, такого как рак молочной железы и другие солидные опухоли. Прежде всего, рост и метастазирование опухоли зависят от ангиогенеза. В модельной системе было показано, что блокирование капилляров новообразованной сосудистой сети специфически индуцированным свертыванием вызывает ликвидацию сосудистой сети опухоли и приводит к подавлению опухолей. Кроме того, было сделано предположение, что эндотелиальные клетки являются высокопролиферативными в тканях опухоли, но большей частью покоящимися в нормальных тканях. Это делает новообразованную сосудистую сеть опухоли специфической и привлекательной мишенью. Кроме того, хотя свойства раковых клеток могут в значительной степени варьировать в различных опухолях, популяция эндотелиальных клеток в большинстве солидных опухолей является, по всей вероятности, нетрансформированной и, следовательно, остается гомогенной. Это относится как к человеку, так и животным. Таким образом, возможно, что может быть разработан антиангиогенный терапевтический агент, который может быть применен универсально для лечения многочисленных различных раков.
Кроме солидных опухолей, другие важные движимые ангиогенезом заболевания включают в себя диабетическую ретинопатию, саркому Калоши, псориаз, ревматоидный артрит. Пациенты, которые страдают от этих заболеваний, могут получить пользу от антиангиогенного терапевтического подхода.
Данное изобретение идентифицирует и описывает последовательности, функции, композиции и терапевтическое применение новых изоформ членов семейства белков VEGI. Две новые изоформы, названные соответственно VEGI-192a и VEGI-192b, содержат новую N-концевую последовательность, которая существенно изменяет свойства этого белка, касающиеся его экспрессии, секреции и антиангиогенных свойств.
Описаны две новые изоформы VEGI, названные VEGI-192a и VEGI-192b, состоящие обе из 192 аминокислотных остатков. Обе изоформы обнаруживают специфическую для эндотелиальных клеток экспрессию и имеют общий С-концевой сегмент из 151 остатка с ранее описанными VEGI-174 и VEGI-251. Эти изоформы образуются из гена размером 17 т.п.н. человека альтернативным сплайсингом. VEGI-251, наиболее обильная изоформа, содержит предположительный сигнал секреции. Белок VEGI детектируется в кондиционированных средах эндотелиальных клеток, сыворотках человека и трансфицированных VEGI-251 клетках млекопитающих. Распределение субклеточной локализации VEGI-251 предполагает, что он является секреторным белком. Сверхэкспрессия VEGI-251 в эндотелиальных клетках вызывает зависимую от дозы смерть клеток. VEGI-251-трансфицированные раковые клетки дают начало опухолям ксенотрансплантатов с уменьшенной скоростью роста и уменьшенной плотностью микрососудов в сравнении с опухолями VEGI-174-трансфектантов. Данное изобретение обосновывает точку зрения, что секретируемый эндотелиальными клетками VEGI может функционировать в качестве аутокринного ингибитора ангиогенеза и природно существующего модулятора васкулярного гомеостаза.
Все цитируемые здесь публикации включены тем самым в описание путем отсылки в их полном виде.
Раскрытие изобретения
Данное изобретение относится к ингибиторам пролиферации эндотелиальных клеток вообще и к ингибиторам ангиогенеза, в частности, и к способам их применения. Полные нуклеотидные последовательности VEGI-192a, VEGI-192b и VEGI-251 показаны в таблице 1 (SEQ ID NO:1), таблице 2 (SEQ ID NO:2) и таблице 3 (SEQ ID NO:3), a предсказанные аминокислотные последовательности показаны в таблице 4 (SEQ ID NO:4), таблице 5 (SEQ ID NO:5) и таблице 6 (SEQ ID NO:6) соответственно.
Таким образом, в одном воплощении данное изобретение обеспечивает изолированный полинуклеотид, который содержит последовательность, показанную в таблице 1 (SEQ ID NO:1), или ее комплемент. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:1, где эти смежные нуклеотиды находятся в пределах нуклеотидов 1-93 SEQ ID NO:1. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:1, где эти смежные нуклеотиды включают нуклеотиды 93 и 94 SEQ ID NO:1.
В других воплощениях данное изобретение обеспечивает изолированный полинуклеотид, который содержит последовательность, показанную в таблице 2 (SEQ ID NO:2), или ее комплемент. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:2, где эти смежные нуклеотиды находятся в пределах нуклеотидов 1-386 SEQ ID NO:2. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:2, где эти смежные нуклеотиды включают нуклеотиды 386 и 387 SEQ ID NO:2.
В некоторых воплощениях данное изобретение обеспечивает изолированный полинуклеотид, который содержит последовательность, кодирующую полипептид SEQ ID NO:4. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит полинуклеотид, кодирующий, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4, где эти смежные аминокислоты находятся в пределах аминокислот 1-26 SEQ ID NO:4. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит полинуклеотид, кодирующий, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4, где эти смежные аминокислоты включают аминокислоты 26 и 27 SEQ ID NO:4. В некоторых воплощениях эти смежные аминокислоты являются аминокислотами приблизительно 5-192, 10-192, 15-192, 20-192 или 25-192 последовательности, показанной в таблице 4 (SEQ ID NO:4).
В некоторых воплощениях данное изобретение обеспечивает изолированный полинуклеотид, который содержит последовательность, кодирующую полипептид SEQ ID NO:5. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит полинуклеотид, кодирующий, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:5, где эти смежные аминокислоты находятся в пределах аминокислот 1-26 SEQ ID NO:5. Данное изобретение обеспечивает также изолированный полинуклеотид, который содержит полинуклеотид, кодирующий, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:5, где эти смежные аминокислоты включают аминокислоты 26 и 27 SEQ ID NO:5. В некоторых воплощениях эти смежные аминокислоты являются аминокислотами приблизительно 5-192, 10-192, 15-192, 20-192 или 25-192 последовательности, показанной в таблице 5 (SEQ ID NO:5).
В некоторых воплощениях полинуклеотид данного изобретения обеспечивает последовательность, кодирующую функционально-сохранные варианты последовательностей нуклеиновых кислот, описанных здесь, которые включают в себя замены, добавления и/или делеции нуклеиновых кислот. Варианты включают в себя природно встречающиеся варианты этой полинуклеотидной последовательности (например, вырожденные варианты, аллельные варианты и т.д.).
В некоторых воплощениях данное изобретение обеспечивает изолированный полинуклеотид, имеющий, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с полинуклеотидами данного изобретения, описанными здесь. Одно воплощение обеспечивает изолированный полинуклеотид, имеющий, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с последовательностью нуклеотидов 1-93, показанной в таблице 1 (SEQ ID NO:1), или нуклеотидов 1-386, показанной в таблице 2 (SEQ ID NO:2).
В некоторых воплощениях полинуклеотиды данного изобретения дополнительно содержат детектируемую метку. В некоторых воплощениях полинуклеотид данного изобретения иммобилизован на поверхности. В некоторых воплощениях данного изобретения полинуклеотид данного изобретения является одноцепочечным. В некоторых воплощениях данного изобретения полинуклеотид данного изобретения выбран из группы, состоящей из ДНК и РНК. В некоторых воплощениях данного изобретения полинуклеотид данного изобретения получают частично химическим синтезом.
Понятно, что (если обратное не указано или не требуется) любое описанное здесь воплощение данного изобретения, которое представлено, является полинуклеотидом, включает в себя как двухцепочечную форму, так и каждую из двух комплементарных одноцепочечных форм, которые, как это известно или предсказано, образуют эту двухцепочечную форму.
Понятно также, что данное изобретение обеспечивает воплощения, "состоящие из" или "состоящие, по существу, из" полинуклеотида, полипептидов и/или антител, описанных здесь.
В другом аспекте данное изобретение обеспечивает векторы и экспрессирующие векторы, содержащие любые из описанных здесь полинуклеотидов.
В других аспектах данное изобретение обеспечивает клетку-хозяина, содержащую любой из полинуклеотидов или векторов, описанных здесь. В некоторых воплощениях эта клетка-хозяин является прокариотической, такой как Е.coli. В некоторых вариантах клетка-хозяин является эукариотической, такой как клетки яичника китайского хомячка (СНО).
Данное изобретение включает в себя также клетки, содержащие рекомбинантные полинуклеотиды, которые содержат полинуклеотид VEGI-192a или VEGI-192b или варианты полинуклеотида VEGI-192a или VEGI-192b. В одном воплощении данное изобретение обеспечивает генетически сконструированную клетку млекопитающего или бактериальнную клетку, такую как Е.coli, содержащую рекомбинантно модифицированный полинуклеотид VEGI-192a или VEGI-192b, так что этот полинуклеотид сверхэкспрессируется. В другом воплощении данное изобретение обеспечивает клетки, содержащие вариант полинуклеотида VEGI-192a или VEGI-192b. В другом воплощении полинуклеотид VEGI-192a или VEGI-192b функционально связан с индуцибельным промотором. В других воплощениях генетически сконструированные клетки имеют вариантный ген VEGI-192a или VEGI-192b вместо природного гена VEGI-192a или VEGI-192b.
Данное изобретение обеспечивает также полипептиды VEGI-192a. Таким образом, данное изобретение обеспечивает изолированный полипептид, содержащий последовательность SEQ ID NO:4. Данное изобретение обеспечивает также изолированный полипептид, содержащий полипептид, кодируемый любым из полинуклеотидов данного изобретения, описанных здесь. В других воплощениях данное изобретение обеспечивает также изолированный полипептид, который содержит, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот последовательности, изображенной в таблице 4 (SEQ ID NO:4), где эти смежные аминокислоты находятся в пределах аминокислот 1-26 последовательности, изображенной в таблице 4 (SEQ ID NO:4). В других воплощениях данное изобретение обеспечивает также выделенный полипептид, который содержит, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот последовательности, изображенной в таблице 4 (SEQ ID NO:4), где эти смежные аминокислоты включают аминокислоты 26 и 27 SEQ ID NO:4. В некоторых воплощениях эти смежные аминокислоты являются аминокислотами приблизительно 5-192, 10-192, 15-192, 20-192, 25-192 SEQ ID NO:4.
Данное изобретение обеспечивает также полипептиды VEGI-192b. Таким образом, данное изобретение обеспечивает изолированный полипептид, содержащий последовательность SEQ ID NO:5. Данное изобретение обеспечивает также изолированный полипептид, содержащий полипептид, кодируемый любым из полинуклеотидов данного изобретения, описанных здесь. В других воплощениях данное изобретение обеспечивает также изолированный полипептид, который содержит, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот последовательности, изображенной в таблице 5 (SEQ ID NO:5), где эти смежные аминокислоты находятся в пределах аминокислот 1-26 последовательности, изображенной в таблице 5 (SEQ ID NO:5). В других воплощениях данное изобретение обеспечивает также изолированный полипептид, который содержит, по меньшей мере, приблизительно 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот последовательности, изображенной в таблице 5 (SEQ ID NO:5), где эти смежные аминокислоты включают аминокислоты 26 и 27 SEQ ID NO:5. В некоторых воплощениях эти смежные аминокислоты являются аминокислотами приблизительно 5-192, 10-192, 15-192, 20-192, 25-192 SEQ ID NO:5.
В других воплощениях данное изобретение обеспечивает любой описанный здесь полипептид, где этот полипептид включает в себя эпитоп. В других воплощениях данное изобретение обеспечивает любой описанный здесь полипептид, где этот полипептид иммобилизован на твердой подложке.
В других воплощениях данное изобретение обеспечивает полипептиды, которые сохраняют биологическую активность VEGI-192a, и/или VEGI-192b, и/или VEGI-251. Как показано в примерах, VEGI-192a ингибирует рост васкулярных эндотелиальных клеток; и VEGI-251, будучи экспрессирован, ингибирует рост васкулярных эндотелиальных клеток, образование капилляроподобных трубочек в модели ангиогенеза in vitro и также ингибирует рост опухолей ксенотрансплантатов в бестимусных голых мышах.
Данное изобретение обеспечивает также антитела, которые селективно связывают VEGI-192a и/или VEGI-192b. Таким образом, данное изобретение обеспечивает антитело, которое селективно связывается с любым из полипептидов VEGI-192a и/или VEGI-192b, описанных здесь. В одном воплощении антитело способно связываться селективно с VEGI-192a или VEGI-192b. В другом воплощении это антитело способно селективно связываться как с VEGI-192a, так и с VEGI-192b, но не с другими изоформами VEGI. В некоторых воплощениях антитело связывается с полипептидом, кодируемым любым из описанных здесь полинуклеотидов. В одном воплощении данное изобретение обеспечивает антитело, способное связываться с полипептидом данного изобретения. В другом воплощении антитело способно селективно связываться с полипептидом, содержащим (а) последовательность, показанную в таблице 4 (SEQ ID NO:4) и/или таблице 5 (SEQ ID NO:5); или (b) по меньшей мере, 10 смежных аминокислот SEQ ID NO:4 и/или SEQ ID NO:5, где эти смежные аминокислоты находятся в пределах аминокислот 1-26, показанных в таблице 4 (SEQ ID NO:4) и/или в таблице 5 (SEQ ID NO:5). Данное изобретение обеспечивает также антитело, которое способно связываться с участком полипептида, показанного в таблице 4 (SEQ ID NO:4) и/или в таблице 5 (SEQ ID NO:5), где указанный участок представляет собой, по меньшей мере, приблизительно 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4 и/или SEQ ID NO:5, и указанный участок содержит аминокислоты 26 и 27 SEQ ID NO:4 и/или SEQ ID NO:5.
В некоторых воплощениях антитело является поликлональным антителом. В других воплощениях антитело является моноклональным антителом. В других воплощениях антитело иммобилизовано на твердой подложке. В других воплощениях антитело дополнительно содержит детектируемую метку.
Данное изобретение обеспечивает также композиции, в том числе фармацевтические композиции, содержащие полинуклеотиды, полипептиды, антитела, рекомбинантные векторы и клетки-хозяева данного изобретения. В некоторых воплощениях данное изобретение обеспечивает фармацевтическую композицию, содержащую полипептид SEQ ID NO:4 или его фрагмент, где этот фрагмент содержит аминокислоты 26 и 27, в фармацевтически приемлемом носителе.
Данное изобретение обеспечивает также ингибитор ангиогенеза, где этот ингибитор содержит полинуклеотиды, полипептиды или производные VEGI-192a, VEGI-192b или VEGI-251 в фармацевтически приемлемом носителе, в фармацевтически приемлемом количестве.
В другом воплощении данное изобретение обеспечивает композицию репрессора или ингибитора роста рака, содержащую, по существу, очищенные полинуклеотиды или полипептиды изоформ VEGI (т.е. VEGI-192a; VEGI-192b или VEGI-251) данного изобретения.
В другом воплощении данное изобретение обеспечивает ускоритель ангиогенеза, содержащий антитело, антисмысловой олигонуклеотид, антагонист, рибозим, лекарственное средство или агент, который уменьшает или элиминирует функцию VEGI-192a, VEGI-192b или VEGI-251 при доставке в фармацевтически приемлемом носителе, в фармацевтически приемлемом количестве.
Данное изобретение обеспечивает также наборы, массивы, содержащие любой из полинуклеотидов, полипептидов и антител, описанных здесь. В одном воплощении данное изобретение обеспечивает наборы или массивы для оценки количества полинуклеотида в образце, содержащие любой из описанных здесь полинуклеотидов. В другом воплощении данное изобретение обеспечивает наборы или массивы для оценки уровня полипептида в образце, содержащие любое из антител, описанных здесь.
В другом воплощении данное изобретение обеспечивает способ ингибирования ангиогенеза, предусматривающий введение индивидууму (такому как человек или животное) композиции, содержащей, по существу, очищенные полинуклеотид, полипептиды VEGI-192a, VEGI-192b или VEGI-251 данного изобретения или модифицированную форму этих раскрытых изоформ VEGI, описанных здесь, в дозе, достаточной для ингибирования ангиогенеза. В одном воплощении данная композиция содержит вектор доставки гена, содержащий полинуклеотид, показанный в таблице 3 (SEQ ID NO:3), или полинуклеотид, кодирующий полипептид SEQ ID NO:6. В некоторых воплощениях этот полинуклеотид функционально связан с регуляторной последовательностью, которая управляет экспрессией гена. В другом воплощении композиция содержит, по существу, очищенный полипептид VEGI-192a с последовательностью, показанной в таблице 4 (SEQ ID NO:4), или функциональный фрагмент, где этот фрагмент включает аминокислоты 26 и 27 SEQ ID NO:4 или включает, по меньшей мере, одну аминокислоту из аминокислот 1-26 SEQ ID NO:4.
В другом воплощении данное изобретение обеспечивает способ лечения или облегчения заболевания и процессов, которые опосредованы неконтролируемым ангиогенезом, предусматривающий стадию введения индивидууму композиции, содержащей полинуклеотид, полипептиды VEGI-192a, VEGI-192b или VEGI-251, или модифицированную форму этих раскрытых изоформ VEGI, описанных здесь, в дозе, достаточной для контроля ангиогенеза. В одном воплощении эта композиция содержит вектор для доставки генов, содержащий полинуклеотид, показанный в таблице 3 (SEQ ID NO:3), или полинуклеотид, кодирующий полипептид SEQ ID NO:6. В некоторых воплощениях этот полинуклеотид функционально связан с регуляторной последовательностью, которая управляет экспрессией гена. В другом воплощении эта композиция содержит, по существу, очищенный полипептид VEGI-192a с последовательностью, показанной в таблице 4 (SEQ ID NO:4), или функциональный фрагмент, где этот фрагмент включает аминокислоты 26 и 27 SEQ ID NO:4 или включает, по меньшей мере, одну аминокислоту из аминокислот 1-26 SEQ ID NO:4.
В другом воплощении данное изобретение обеспечивает способ лечения рака или подавление роста опухоли, предусматривающий введение индивидууму композиции, содержащей полинуклеотид, полипептиды VEGI-192a; VEGI-192b, или VEGI-251, или модифицированную форму этих раскрытых изоформ VEGI, описанных здесь, в дозе, достаточной для подавления роста опухоли. В одном воплощении эта композиция содержит вектор для доставки генов, содержащий полинуклеотид, показанный в таблице 3 (SEQ ID NO:3), или полинуклеотид, кодирующий полипептид SEQ ID NO:6. В некоторых воплощениях этот полинуклеотид функционально связан с регуляторной последовательностью, которая управляет экспрессией гена. В другом воплощении эта композиция содержит, по существу, очищенный полипептид VEGI-192a с последовательностью, показанной в таблице 4 (SEQ ID NO:4), или функциональный фрагмент, где этот фрагмент включает аминокислоты 26 и 27 SEQ ID NO:4 или включает, по меньшей мере, одну аминокислоту из аминокислот 1-26 SEQ ID NO:4.
В другом воплощении данное изобретение обеспечивает способ ускорения ангиогенеза, предусматривающий введение человеку или животному композиции, содержащей антитело, антисмысловой олигонуклеотид, антагонист, рибозим, лекарственное средство или агент, который снижает или элиминирует активность VEGI-192a, VEGI-192b и/или VEGI-251.
Еще в одном воплощении данное изобретение обеспечивает терапевтический способ и композицию для лечения или облегчения заболеваний или процессов, которые опосредованы ангиогенезом, в том числе, но не ограничиваясь, гемангиомы, солидных опухолей, лейкоза, метастазирования, телеангиэктазии, псориаза, склеродермии, пиогенной гранулемы, ангиогенеза миокарда, plagie неоваскуляризации, коронарных коллатералей, ангиогенеза ишемических конечностей, заболеваний роговицы, покраснения кожи, неоваскулярной глаукомы, диабетической ретинопатии, ретролентальной фиброплазии, артрита, диабетической неоваскуляризации, увеита, ретинопатии недоношенности, дегенерации желтого пятна, неоваскуляризации роговичного трансплантата, реакции трансплантат против хозяина, воспалительного заболевания кишечника, миелосупрессии и рестеноза; где ангиогенез является неконтролируемым или избыточным и требует ингибирования, причем данный способ предусматривает предоставление индивидууму, нуждающемуся в таком лечении, эффективного количества полинуклеотидов или полипептидов изоформ VEGI (т.е. VEGI-192a, VEGI-192b или VEGI-251) данного изобретения, так что ангиогенез ингибируется.
Еще в одном воплощении данное изобретение обеспечивает терапевтический способ и композицию для лечения или ослабления заболеваний, таких как дегенерация желтого пятна, плохое заживление ран, пептическая язва, переломы, келоиды, образование и развитие сосудов (васкулогенез), гемопоэз, овуляция, менструация и образование плаценты, в которых ангиогенез является желательным, причем данный способ предусматривает введение индивидууму, нуждающемуся в таком лечении, антагониста полинуклеотидов или полипептидов изоформ VEGI (т.е. VEGI-192a, VEGI-192b или VEGI-251) данного изобретения; антисмысловых олигонуклеотидов, специфичных к полинуклеотидам изоформ VEGI или анти-VEGI-антител, агентов или лекарственных средств, которые снижают или элиминируют функцию VEGI, в фармацевтически приемлемом носителе, в фармацевтически приемлемом количестве.
В другом воплощении данное изобретение обеспечивает способ обнаружения полипептида изоформы VEGI (VEGI-192a или VEGI-192b), предусматривающий контактирование пробы из индивидуума с антителом, описанным здесь, которое селективно связывается с полипептидом VEGI данного изобретения, и детектирование присутствия или отсутствия комплекса, образованного между полипептидом в пробе и этим антителом. Эти способы детектирования применимы также для обнаружения любого из VEGI-192a или VEGI-192b, описанных здесь.
В другом воплощении данное изобретение обеспечивает также способ обнаружения полинуклеотидов изоформ VEGI (VEGI-192a или VEGI-192b), предусматривающий контактирование пробы из индивидуума с полинуклеотидом (таким как олигонуклеотид), который селективно связывается с полинуклеотидом VEGI данного изобретения; и детектирование присутствия или отсутствия дуплекса, образованного между этим олигонуклеотидом и полинуклеотидом пробы. Эти способы применимы также для обнаружения любого из полинуклеотидов VEGI-192a или VEGI-192b, описанных здесь.
Еще в одном воплощении данное изобретение обеспечивает способ диагностики состояний, включающих в себя патологический ангиогенез, причем этот способ предусматривает детектирование присутствия или отсутствия полипептидов, происходящих из VEGI-192a или VEGI-192b, в пробе, предусматривающий стадии:
(i) контактирования пробы из субъекта, у которого подозревают наличие патологического ангиогенеза, с антителами, которые являются специфическими для полипептидов VEGI-192a и/или VEGI-192b данного изобретения; и
(ii) детектирования присутствия или отсутствия комплекса, образованного между VEGI-192a и/или VEGI-192b и антителами.
Еще в одном воплощении данное изобретение обеспечивает способ диагностики патологического ангиогенеза, предусматривающий обнаружение присутствия или отсутствия полинуклеотидов VEGI-192a или VEGI-192b (предпочтительно РНК) в пробе, причем этот способ предусматривает стадии:
(i) контактирования пробы из субъекта, у которого подозревают наличие патологического ангиогенеза, с полинуклеотидами (такими как олигонуклеотиды), которые специфически связывают полинуклеотиды VEGI-192a или VEGI-192b данного изобретения (например, РНК); и
(ii) детектирования присутствия или отсутствия комплекса, образованного между полинуклеотидами и олигонуклеотидами, происходящими из VEGI-192a или VEGI-192b.
В другом воплощении данное изобретение обеспечивает способ диагностики патологического ангиогенеза с использованием полимеразной цепной реакции (ПЦР), предусматривающий конструирование праймеров с использованием нуклеотидной последовательности изоформы VEGI (т.е. VEGI-192a, VEGI-192b), показанной в SEQ ID NO:1 и SEQ ID NO:2, в котором полимеразная цепная реакция специфически амплифицирует район VEGI в качестве основы для детектирования. Эти праймеры могут быть использованы для амплификации ДНК VEGI или РНК VEGI, причем последняя амплификация происходит после превращения РНК в комплементарную ДНК (кДНК) обратной транскрипцией этой РНК. ПЦР-анализ может быть сделан количественным посредством сравнения амплифицированного продукта со стандартом, который может быть получен с использованием способов, известных в данной области.
Еще в одном воплощении данное изобретение обеспечивает способ обнаружения полинуклеотидов изоформ VEGI (т.е. VEGI-192a или VEGI-192b) в пробе, предусматривающий анализ на присутствие или отсутствие РНК или ДНК изоформы VEGI-192a или VEGI-192b в пробе с использованием гибридизационного анализа.
В следующем воплощении данное изобретение обеспечивает диагностический или прогностический набор, содержащий антитела, которые связывают полинуклеотиды или полипептиды изоформ VEGI (т.е. VEGI-192a или VEGI-192b) данного изобретения; олигонуклеотиды, которые гибридизуются с ДНК или РНК VEGI; и/или ПЦР-праймеры для амплификации ДНК или РНК VEGI и вспомогательные реагенты, пригодные для использования в детектировании присутствия изоформы VEGI в пробе. Поскольку VEGI может функционировать как мембранный белок, природно существующая растворимая форма мембраносвязанного VEGI может функционировать как его антагонист, и способы обнаружения такой растворимой формы включены в другое воплощение данного изобретения.
Еще в одном воплощении данное изобретение обеспечивает диагностический анализ, предусматривающий детектирование присутствия или отсутствия мутации в полинуклеотидах изоформ VEGI (т.е. VEGI-192a или VEGI-192b), которая приводит к уменьшению или увеличению экспрессии или функции изоформы VEGI. Такой анализ включает в себя гибридизационный анализ, анализы полиморфизмов рестрикционных карт и секвенирование генов, среди прочего.
Еще в одном воплощении данное изобретение обеспечивает способ испытания возможных агентов или лекарственных средств на ингибирующую ангиогенез активность посредством испытания, способны или неспособны лекарственное средство или агент повышающе регулировать экспрессию и/или активность изоформ VEGI (т.е. VEGI-192a или VEGI-192b). Поскольку изоформы VEGI, подобно другим ингибиторам ангиогенеза, активируются протеазами, которые высвобождают белок из клеточной мембраны, протеазы, а также другие агенты, которые облегчают такую активацию, такие как ионы металлов, могли бы быть полезными в качестве средств для увеличения экспрессии изоформ VEGI.
В следующем воплощении настоящее изобретение обеспечивает способ тестирования возможных противоопухолевых агентов или лекарственных средств посредством испытания, способно или не способно лекарственное средство или агент ингибировать ангиогенез путем повышающей регуляции экспрессии и/или активности изоформы VEGI.
Еще в одном воплощении данное изобретение обеспечивает способ испытания возможных лекарственных средств или агента, которые стимулируют ангиогенез, посредством испытания, может или не может данный агент или данное лекарственное средство блокировать и/или ингибировать функцию VEGI (например, ингибирование ангиогенеза). В этом случае может быть использовано ингибирование протеаз, которые активируют изоформы VEGI, как обсуждалось выше, или агентов, которые необходимы или которые облегчают такую активацию, таких как ионы металлов, для понижающей регуляции VEGI с усилением посредством этого ангиогенеза.
Краткое описание чертежей
Фигура 1. Уровень VEGI в сыворотке здоровых взрослых. Сыворотку из 40 здоровых добровольцев (20 мужчин, 20 женщин) измеряли при помощи ELISA с анти-VEGI-антителом. Каждая точка представляет единичное значение. Для получения стандартной кривой использовали очищенный рекомбинантный VEGI. Горизонтальные линии среди точек указывают значение медианы для группы каждого пола.
Фигура 2. VEGI экспрессируется в виде множественных транскриптов в ткани человека. Экспрессию VEGI в тканях взрослых людей определяли Нозерн-блоттинг-анализом множества тканей с использованием 32Р-меченной полноразмерной кДНК VEGI-174 в качестве зонда. Обнаружили три отдельных относящихся к VEGI мРНК-транскрипта указанных размеров.
Фигура 3. Выделение кДНК новых VEGI. Схема, показывающая синтез 5'RACE-продуктов с последующим скринингом кДНК-библиотеки для выделения полноразмерных кДНК VEGI из различных тканей человека. Затемненные блоки представляют лигированные 5'-адапторы, присутствующие в панели RACE (способа быстрой амплификации концов кДНК). ПЦР-праймеры обозначены стрелками с открытыми остриями. ПЦР-продукты разного размера визуализировали окрашиванием бромидом этидия. Эти ПЦР-продукты выделяли и подвергали секвенированию. L=легкое; U=матка; В=головной мозг. Маркер молекулярных весов ДНК (лэддер) 1 т.п.н. показан между дорожками L и U. Выравнивание аминокислотных последовательностей трех изоформ VEGI. Предположительные гидрофобные области VEGI-251 и VEGI-174 подчеркнуты. Звездочкой обозначено начало гомологичных последовательностей.
Фигура 4. Дифференциальная экспрессия VEGI-174 и VEGI-251 в тканях человека. Нозерн-блоттинг-анализ экспрессии VEGI в тканях взрослого человека выполняли с кДНК-фрагментами, специфичными для VEGI-251 и VEGI-174. Транскрипт 2 т.п.н. детектировали с зондом VEGI-174, тогда как транскрипт 7,5 т.п.н. детектировали с зондом VEGI-251. Исследованными тканями человека были следующие: 1. Лейкоциты периферической крови, 2. Легкое, 3. Плацента, 4. Тонкая кишка, 5. Печень, 6. Почка, 7. Селезенка, 8. Тимус, 9. Ободочная кишка, 10. Скелетная мышца, 11. Сердце, 12. Головной мозг.
Фигура 5. Анализ с использованием защиты от рибонуклеазы изоформ VEGI в различных культивируемых клетках. Тотальную РНК из каждой культуры гибридизовали с изоформа-специфичными VEGI-зондами и использовали β-актин для контроля нанесения. Полноразмерные нерасщепленные зонды показаны в дорожке зондов (Р), указанные стрелками с темными остриями, а продукты защиты от РНКазы показаны стрелками со светлыми остриями. Y=PHK дрожжей, Нс=эндотелиальные клетки коронарной артерии человека, Hm=эндотелиальные клетки дермальных микрососудов человека, Hu=эндотелиальные клетки пупочной вены человека, Sm=клетки гладких мышц коронарной артерии человека, 3Т=линия эмбриональных мышиных клеток NIH3T3, Ba=эндотелиальные клетки аорты взрослой коровы, Bh=эндотелиальные клетки фетального телячьего сердца, Ну=клетки гибридомы человека ЕА.Ну926, bE=клетки эндотелиомы головного мозга мыши bEND.3.
Фигура 6. Структура гена VEGI человека и предлагаемое генерирование изоформ. Сегменты, пронумерованные 1-9, представляют ПЦР-фрагменты, полученные во время картирования гена с парами специфических праймеров, приведенными в разделе "Материалы и способы". Прямоугольники с римскими цифрами над ними представляют экзоны, а горизонтальные линии представляют интронную последовательность. Предположительный сайт инициации транскрипции указан стрелкой с двойным острием. R обозначает 5'-нетранслируемую последовательность, уникальную для каждого соответствующего транскрипта, а гравированные прямоугольники представляют общую 3'-нетранслируемую область. Указаны приближенные размеры интронов. VEGI-251, VEGI-192a или VEGI-174-специфические последовательности помечены как 251, 192 или 174. Экзон IIIb кодирует остатки, общие как с VEGI-251, так и с VEGI-192a. Интроны в 5'-направлении от экзонов III и IV показаны пунктиром, так как 5'-концы или сайты инициации транскриптов VEGI-192a и VEGI-174 не были определены. "СОМ" обозначает кодирующий район последнего экзона, который является общим для всех трех изоформ.
Фигура 7. TNFα индуцирует экспрессию изоформ VEGI в эндотелиальных клетках как микрососудов, так и крупных сосудов. Анализы защиты от рибонуклеазы, показывающие параллельную индукцию экспрессии VEGI. Стрелки показывают защищенные РНК. А. Клетки HMVE, обработанные TNFα при 15, 50 и 90 нг/мл на протяжении 24 часов. В. Индукция посредством TNFα экспрессии генов VEGI в клетках HUVE. Клетки HUVE обрабатывали 20 нг/мл TNFα в течение 4, 8 и 24 часов (+). Контроли (-) получали соответствующие обработки носителем.
Фигура 8. Внутриклеточная локализация рекомбинантных VEGI-174 и VEGI-251 в трансфицированных эндотелиальных клетках. A. VEGI-174-myc и VEGI-251-myc (В) детектировали в трансфицированных клетках АВАЕ окрашиванием Техасским красным связанных myc-меток. С. Двойное окрашивание VEGI-251-myc (красный) и фактора фон Виллебранда (зеленый) в трансфицированных клетках HUVE. Диаграмма в D изображает экспрессионные конструкции VEGI с С-концевой myc-меткой. E-J. Меченные по N-концу конструкции GFP-VEGI показали различающееся распределение в клетках АВАЕ. Клетки, трансфицированные векторной плазмидой (Е), показали распределение GFP по всей клетке, тогда как три конструкции VEGI (F, H-J) приводили к локализованному распределению GFP. В I и J VEGI-251 1-99 направлял распределение GFP в плазматической мембране. К. Метки GFP в экспрессионных конструкциях, использованных в F-J, расположены на аминоконцах VEGI-фрагментов.
Фигура 9. Детектирование VEGI-251 при помощи Вестерн-анализа в среде, кондиционированной трансфицированными клетками МВ231 и нетрансфицированными клетками HUVE. А. Кондиционированная среда от стабильных трансфектантов MDA-МВ231. Дорожка 1 = только вектор pcDNA3, дорожки 2 и 3 = два независимых клона, экспрессирующие VEGI-251. В. Дорожка 1 = Кондиционированная клетками HUVE среда, дорожка 2 = лизат клеток HUVE. В обоих экспериментах кондиционированные среды концентрировали с использованием колонок Centricon (предел пропускания по молекулярному весу 10000), иммунопреципитировали с использованием поликлонального антитела, затем подвергали электрофорезу в ДСН-ПААГ и Вестерн-детектированию с использованием моноклонального антитела 1-8F против общего С-концевого района VEGI (остатки 29-174). Обе панели показывают VEGI-пептиды с массой приблизительно 25 кДа.
Фигура 10. Сверхэкспрессия VEGI-251 вызывает смерть клеток и препятствует новообразованию сосудов опухоли (неоваскуляризации). А. Доставка с использованием лентивируса секретируемого VEGI является летальной для клеток HUVE. Зависимую от дозы цитотоксичность исходного раствора лентивируса, экспрессирующего VEGI-251 и sVEGI, сравнивали с VEGI-174. Спустя двадцать четыре часа после вирусной инфекции прикрепленные клетки, оставшиеся в культуре, подчитывали с использованием счетчика Коултера. Уровни вирусного р24 определяли, дозу вируса выражали в виде множественности заражения (MOI). Представленные величины являются средними ± среднеквадратическая ошибка из трех независимых экспериментов. В. Задержка роста опухоли молочной железы ксенотрансплантата MDA-MB231 VEGI-251 и sVEGI. Пулы стабильно трансфицированных клеток MDA-MB231, экспрессирующих указанную конструкцию, инъецировали подкожно в жировые скопления молочной железы самок бестимусных мышей и размеры опухолей регистрировали вслепую. Контрольные мыши получали клетки MDA-MB231, трансфицированные пустым вектором pcDNA3. Ослабление роста опухолей наблюдали как для VEGI-251, так и для sVEGI, но не для полноразмерного VEGI-174. С. Трансфекция VEGI-251 и sVEGI приводит к уменьшенным плотностям микрососудов в опухолях ксенотрансплантатов МВ231. Парафиновые срезы (5 мкм) из опухолей делали для мышей, описанных на фигуре 10А. Сосуды идентифицировали СD31-иммуноокрашиванием, как описано в разделе "Материалы и способы". Использовали однофакторный дисперсионный анализ, а: Р<0,0005; b: P<0,05 в сравнении с контрольными ксенотрансплантатами с вектором pcDNA3.
Фигура 11. Фотография результатов Нозерн-блоттинг-анализа множества тканей на экспрессию VEGI в различных органах человека с использованием 32Р-меченой кДНК VEGI-174 в качестве зонда. Видны сигналы мРНК VEGI различного размера.
Фигура 12. Схема, иллюстрирующая процедуры RACE-PCR, используемые для поиска на возможные изоформы VEGI. ADP1 и ADP2 указывают адаптер-специфические праймеры. GSP1 и GSP2 указывают ген-специфические праймеры.
Фигура 13. Фотография результатов электрофореза в агарозном геле продуктов RACE-PCR. Четыре ПЦР-продукта различных размеров из разных тканей человека визуализировали с использованием окрашивания бромидом этидия. ПЦР-продукты выделяли и подвергали секвенированию.
Фигура 14. Фотография Вестерн-блоттинг-анализа кондиционированных сред клеток MDA-MB-231, трансфицированных пустым вектором (дорожка 1) или кДНК VEGI-251 (дорожка 2). Кондиционированные среды подвергали гель-фильтрационной хроматографии и фракции с диапазоном молекулярных масс 10-50 кДа собирали и подвергали электрофорезу в ДСН-ПААГ. Панель А: Окрашивание геля Кумасси синим. Панель В: Вестерн-блоттинг с моноклональным антителом (13-2D) к VEGI.
Фигура 15. График, показывающий ингибирование роста опухолей ксенотрансплантатов, образованных клетками MDA-MB231, трансфицированными VEGI-174, VEGI-251, IL-6/VEGI или пустым вектором pCDNA-3. Один миллион стабильно трансфицированных клеток инъецировали в жировые скопления молочной железы самок бестимусных голых мышей. Было 2 места введения на каждое животное и 5 животных на группу. Эти группы кодировали, и размеры опухолей ксенотрансплантатов регистрировали вслепую. Статистически значимое ингибирование роста этих опухолей наблюдали для сверхэкспрессирующих VEGI-251 или IL-6/VEGI клеток. Сверхэкспрессяи VEGI-174 не оказывала влияния на рост опухолей.
Фигура 16. Иммуногистохимический анализ проб опухолей, полученных из экспериментов, описанных на фигуре 7, с использованием mAb 13-2D против VEGI человека. Сверхэкспрессирующие VEGI клетки окрашиваются в коричневый цвет. Панели слева являются фотографиями срезов опухоли, образованной VEGI-251-трансфицированными клетками. Уровни образования VEGI-251 были явно высоковариабельными, как видно из интенсивного окрашивания некоторых из срезов опухоли (G9-1R), что предполагает высокие уровни продуцирования VEGI, в сравнении с заметно меньшим окрашиванием некоторых опухолей той же самой группы (G9-2R). Панели справа являются фотографиями срезов опухолей, образованных контрольными клетками с вектором. Коричневое окрашивание в срезах контрольной опухоли является, по-видимому, результатом перекрестной реакции антитела с природными молекулами VEGI на эндотелии мыши.
Фигура 17. График, показывающий, что скорость роста опухолей, образованных VEGI-251-трансфицированными раковыми клетками MDA-MB-231, варьирует в соответствии с количеством VEGI, продуцируемым этими раковыми клетками. Опухоли, в которых уровень VEGI является более высоким (G9-1R), растут гораздо медленнее, чем опухоли с низкими уровнями VEGI (G9-2R).
Фигура 18. Нозерн-блоттинг-анализ транскриптов VEGI. Панель А, экспрессия VEGI в клетках человека: Jurkat, клетки Т-клеточного лейкоза человека; L293, эмбриональные почечные клетки человека; HL60, промиелоцитарный лейкоз человека; V.E., венозные эндотелиальные клетки человека (10-й пассаж); А431, эпидермоидная карцинома человека; V.E.-2, венозные эндотелиальные клетки человека (20-й пассаж); Raji, лимфома Беркитта человека; А.Е., артериальные эндотелиальные клетки человека; ТНР-1, моноцитарный лейкоз человека; CCD-29Lu, эмфизема легкого человека; САМА1, рак молочной железы; AN3CA, рак матки; SK.UT.1, рак матки; MG63, остеобластома; HOS, остеобластома; MCF7, рак молочной железы; OVCAR-3, рак яичника; CAOV-3, рак яичника; HUVE, эндотелиальные клетки умбиликальной (пупочной) вены человека; AOSMIC, клетки гладких мышц. Рассчитанный размер транскрипта равен 6,5 т.п.н. Панель В, экспрессия VEGI в тканях взрослого человека с использованием Нозерн-блотов множества тканей (Clontech): проводили три отдельных блоттинга. Показаны положительные результаты, полученные в любом из трех экспериментов.
Фигура 19. График, показывающий действие VEGI на пролиферацию эндотелиальных клеток и раковых клеток молочной железы. Число клеток наносили на график зависимости от концентрации VEGI, как показано. Показано ингибирование роста клеток АВАЕ (темные кружки), но не клеток MDA-MB-231 (светлые кружки) или MDA-МВ-435 (треугольники). Раковые клетки и клетки АВАЕ высевали в количестве при 2000 и 8000 клеток на лунку соответственно в трех повторностях в 24-луночные планшеты. Культуральная среда содержала IMEM (Gibco) и 10% ФТС. В среду для клеток АВАЕ добавляли FGF-2 (1 нг/мл). Культуры поддерживали при 37°С, 5% CO2 в течение 6 дней. Затем клетки трипсинизировали, и количество клеток определяли с использованием счетчика Коултера. Показана одна пятая общего числа полученных клеток АВАЕ для нормализации сравнения с раковыми клетками.
Фигура 20. Экспрессия VEGI в пролиферирующих или покоящихся эндотелиальных клетках. Уровни мРНК VEGI в культивируемых клетках HUVE определяют Нозерн-блоттинг-анализом. Идентичное количество тотальной РНК (15 мкг) наносят на каждую дорожку, как свидетельствует интенсивность полосы β-актина. Тотальную РНК получают в указанных временных точках (дни после засева). Количество клеток в каждой культуральной колбе определяют одновременно. Этот эксперимент проводят в двух повторностях. Клетки высевают при плотности 125000 клеток на колбу (Т-25) в IMEM, 10% ФТС, 6 нг/мл FGF-2 и культивируют при 37°С, 5% СО2.
Фигура 21. График, показывающий действие VEGI на способность клеток АВАЕ образовывать капилляроподобные трубочки на коллагеновых гелях. Показана способность рекомбинантного VEGI ингибировать образование капилляроподобных трубочек клетками АВАЕ. Величины р (t - критерий), приведенные над столбцами, получают сравнением степени образования капилляроподобных трубочек клетками АВАЕ в присутствии различных концентраций VEGI, как показано, со степенью образования их в отсутствие VEGI в культуральной среде.
Фигура 22. График, показывающий ингибирование VEGI ангиогенеза в коллагеновых гелях, помещенных на хориоаллантоисной мембране куриного эмбриона (САМ). Рост новых капиллярных сосудов в гранулы коллагенового геля (0,05 мл), помещенные на САМ, индуцируют либо FGF-2 (100 нг), либо VEGF (250 нг), заключенными в эти гели. Степень ангиогенеза в гелях определяют оценкой интенсивности флуоресценции FITC-декстрана, инъецируемого в кровоток САМ и задерживаемого в этом геле. Показано ингибирование роста капиллярных сосудов VEGI, на что указывает величина, меньшая, чем 100. Этот ингибитор также заключен в гели. Вертикальные линии представляют стандартное отклонение трех повторностей экспериментальных величин.
Фигура 23. График, показывающий ингибирование VEGI роста опухолей ксенотрансплантатов рака молочной железы человека в бестимусных голых мышах. Смеси сверхэкспрессирующих VEGI или трансфицированных вектором клеток СНО (5×106 клеток на одну инъекцию) и клеток рака молочной железы человека (1×106 клеток на одну инъекцию) инъецировали в жировые скопления молочной железы самок голых мышей. Размеры опухолей регистрировали после инъекции. Панель А: График размеров опухолей ксенотрансплантатов MDA-MB-231 (мм2) как функция времени после инокуляции (дни). Панель В: График размеров опухолей ксенотрансплантатов MDA-MB-435 (мм2) как функция времени после инокуляции (дни). Светлые кружки, инокулированные совместно с трансфицированными вектором клетками СНО. Темные кружки, инокулированные совместно с трансфицированными секретируемым VEGI клетками СНО.
Фигура 24. График, показывающий действие VEGI-192a на пролиферацию эндотелиальных клеток. Показано ингибирование роста клеток АВАЕ правильно повторно уложенным VEGI-192a, но не неправильно повторно уложенным VEGI-192a или буфером. Клетки АВАЕ высевают в количестве 8000 клеток на лунку соответственно в трех повторностях в 24-луночные планшеты. Культуральная среда содержала IMEM (Gibco) и 10% ФТС. В среду для клеток АВАЕ добавляли FGF-1 (1 нг/мл). Культуры выдерживали при 37°С, 5% СО2 в течение 6 дней. Затем клетки трипсинизировали и количество клеток определяли при помощи счетчика Коултера. Показана одна пятая общего числа полученных клеток АВАЕ для нормализации сравнения с раковыми клетками.
Осуществление изобретения
Данное изобретение обеспечивает новые изоформы полинуклеотидов и полипептидов VEGI, которые ингибируют рост васкулярных эндотелиальных клеток, и способы для лечения заболеваний и процессов, которые опосредованы ангиогенезом или связаны с ангиогенезом, посредством введения этих полинуклеотидов, полипептидов и других агентов. Полинуклеотиды или полипептиды VEGI данного изобретения могут быть выделены из жидкостей тела, в том числе, но не только, сыворотки, мочи и асцитов, или синтезированы химическими или биологическими способами (например, с использованием культуры клеток, экспрессии рекомбинантных генов).
Рекомбинантные способы включают в себя амплификациию генов из источников ДНК с использованием полимеразной цепной реакции (ПЦР) и амплификацию генов из источников РНК с использованием обратной транскриптазы/ПЦР. Эти способы хорошо известны в данной области. VEGI ингибирует прорастание кровеносных сосудов в такие ткани, как неваскуляризированные или васкуляризированные опухоли. Данное изобретение включают в себя белок, который имеет молекулярную массу приблизительно 22 кДа, и любую модифицированную форму этого белка, в том числе, но не только, укороченную форму или посттрансляционную модификацию, такую как гликозилированная форма этого белка, которая способна преодолевать ангиогенную активность эндогенных факторов роста.
Определения
Как описано здесь, "мутантный" или "вариантный" полинуклеотид или полипептид VEGI является полинуклеотидной или полипептидной последовательностью, которая содержит одну (одно) или несколько делеций, добавлений, трансверсий или изменений в последовательности нуклеиновой кислоты или аминокислотной последовательности. Как описано дополнительно здесь, мутантная последовательность VEGI может приводить к укороченному или измененному полинуклеотиду или полипептиду VEGI, увеличенной или уменьшенной экспрессии полинуклеотида или полипептида VEGI или любой их комбинации. Мутация может находиться в кодирующих, некодирующих, 5'- или 3'-фланкирующих, геномных или кодирующих нуклеотидах.
"Функционально сохранным" вариантом полинуклеотида изоформы VEGI (т.е. VEGI-192a, VEGI-192b или VEGI-251) или полипептида изоформы VEGI является последовательность VEGI, которая сохраняет, по меньшей мере, один аспект функции изоформы VEGI. Функционально сохранные варианты могут возникать вследствие различий в линейной последовательности, возникающих, например, из мутации (мутаций) единственного основания, добавления (добавлений), делеции (делеций) и/или модификации (модификаций) оснований. Это различие может возникать также из изменений в сахаре (сахарах) и/или в связи (связях) между основаниями. Что касается полипептидов, функционально сохранные варианты могут возникать, например, посредством консервативных и/или неконсервативных замен аминокислот, аминокислотных аналогов и делеций. Функция, которая сохраняется, зависит от релевантной рассматриваемой функции. Например, если полинуклеотид изоформы VEGI рассматривается в качестве зонда, то этой релевантной функцией является способность вариантной полинуклеотидной последовательности гибридизоваться с мишенью. Если полинуклеотид рассматривается в отношении его способности кодировать полипептид изоформы VEGI (или его фрагмент), то этой релевантной функцией является способность вариантной последовательности кодировать тот же самый полипептид. Если полипептид изоформы VEGI рассматривается в отношении его способности связываться с конкретной молекулой (такой как антитело или другой белок), то релевантной функцией вариантной последовательности является ее способность кодировать полипептид с эквивалентными связывающими характеристиками. Полипептид изоформы VEGI может также рассматриваться в отношении биологической активности кодируемого продукта гена (например, биологической активности, приписываемой продукту гена, соответствующему полинуклеотидам изоформы VEGI, как результат отнесения этого продукта гена к семейству (семействам) белков и/или идентификации функционального домена, присутствующего в данном продукте гена). Полипептид, демонстрирующий "функциональную активность", обозначает полипептид, способный проявлять одну или несколько функциональных активностей, связанных с полным или зрелым полипептидом изоформы VEGI. Такие функциональные активности включают в себя, но не ограничиваются ими, биологическую активность (например, ингибирование ангиогенеза, ингибирование пролиферации васкулярных эндотелиальных клеток, индукцию клеточной адгезии, антигенность (способность связываться или конкурировать с одним или несколькими полипептидами изоформы VEGI за связывание с антителом против изоформы VEGI), иммуногенность (способность генерировать антитело, которое связывается с одним или более полипептидами изоформы VEGI), способность образовывать полимеры с другими полипептидами VEGI и способность связываться с рецептором или лигандом для полипептида VEGI (например, DR3).
В данном контексте "экспрессия" включает в себя транскрипцию и/или трансляцию.
"Гетерологичный" означает происходящий из (т.е. полученный из) организма, генотипически отличного от организма, с которым производят сравнение. Например, полинуклеотид может быть помещен способами генетической инженерии в плазмиду или вектор, происходящие из отличающегося источника, так что таким образом он становится гетерологичным полинуклеотидом. Промотор, который связан с кодирующей последовательностью, с которой он не является естественно связанным, является гетерологичным промотором.
Полинуклеотидом-"реагентом", полипептидом-"реагентом" или антителом-"реагентом" является вещество, обеспечиваемое для реакции, вещество, имеющее некоторые известные и желательные параметры для этой реакции. Реакционная смесь может также содержать "мишень", такую как полинуклеотид, антитело, полипептид или ансамбль полипептидов, с которыми способен реагировать этот реагент. Например, в некоторых диагностических тестах присутствие и/или количество мишени в пробе определяют добавлением реагента, позволением этому реагенту взаимодействовать с мишенью и измерением количества продукта реакции (если он имеется). В контексте клинического использования "мишень" может быть также клеткой, смесью клеток, тканью или органом, которые являются целью введенного вещества, такого как фармацевтическое соединение.
Термин "стабильный дуплекс" полинуклеотидов или "стабильный комплекс", образованный между любыми двумя или более компонентами в биохимической реакции, относится к дуплексу или комплексу, который является достаточно долго сохраняющимся для существования между образованием дуплекса или комплекса и последующим детектированием, включающим в себя любые необязательные стадии промывок или другую манипуляцию, которые могут иметь место в этом промежутке времени.
Ген или полинуклеотид является "дифференциально экспрессируемым" в тест-пробе, когда полинуклеотид детектируют при более высоком или более низком уровне в сравнении с контрольной пробой того же самого типа. Обычно дифференциально экспрессируемый полинуклеотид включает в себя полинуклеотиды, которые экспрессируются таким образом, что, например, мРНК обнаруживается при уровнях, по меньшей мере, приблизительно на 25%, по меньшей мере, приблизительно на 50-75%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно в 2 раза, по меньшей мере, приблизительно в 4 раза, по меньшей мере, приблизительно в 5 раз и, по меньшей мере, приблизительно в 10 раз или более высоком уровне (т.е. сверхэкспрессируются), или более низком уровне (например, недостаточно экспрессируются). Сравнение может производиться, например, между двумя тканями, если используют гибридизацию in situ или другой способ анализа, который позволяет некоторую степень дискриминации между типами клеток в данной ткани. Это сравнение может также производиться между клетками, выделенными из своих тканей-источников.
"Эффективное количество" лекарственного средства, соединения или фармацевтической композиции означает количество, достаточное для получения благоприятных или желаемых результатов, в том числе клинических результатов, таких как ингибирование роста васкулярных эндотелиальных клеток, ингибирование ангиогенеза, стимуляция ангиогенеза, уменьшение размера опухоли, задержка роста раковых клеток, уменьшение одного или нескольких симптомов, вызываемых заболеванием, улучшение качества жизни пациентов, страдающих от данного заболевания, уменьшение дозы других лекарственных средств, необходимых для лечения данного заболевания, увеличение эффекта других лекарственных средств, задержка развития заболевания и/или продление выживания пациентов, либо прямое, либо опосредованное. Эффективное количество может вводиться в виде одного или нескольких введений. Как это понятно в клиническом контексте связанного с ангиогенезом заболевания, эффективное количество лекарственного средства, соединения или фармацевтической композиции может быть достигнуто вместе с другим лекарственным средством, соединением или с другой фармацевтической композицией или без них. Таким образом, термин "эффективное количество" может рассматриваться в контексте введения одного или нескольких терапевтических агентов, и единственный агент может рассматриваться как предоставляемый в эффективном количестве, если, вместе с одним или несколькими другими агентами, может быть получен или достигается желаемый результат.
В данном контексте термин "лечение" является подходом для получения благотворных или желаемых результатов, в том числе и предпочтительно клинических результатов. Для целей данного изобретения благотворные или желаемые клинические результаты включают в себя, но не ограничиваются ими, один или несколько из следующих результатов: уменьшение пролиферации васкудярных эндотелиальных клеток, ингибирование ангиогенеза, стимуляция ангиогенеза, уменьшение размера опухоли, уменьшение симптомов, являющихся следствием заболевания, улучшение качества жизни пациентов, страдающих от данного заболевания, уменьшение дозы других лекарственных средств, необходимых для лечения данного заболевания, задержка прогрессирования заболевания и/или продление выживания пациентов.
"Развитие" или "прогрессирование" связанного с ангиогенезом заболевания означает здесь начальные проявления и/или последующее прогрессирование нарушения. Развитие связанного с ангиогенезом заболевания может быть детектируемым и оцениваемым стандартными клиническими способами. Однако развитие относится также к прогрессированию заболевания, которое может быть недетектируемым. Для целей данного изобретения термины "развитие" или "прогрессирование" обозначают биологическое течение патологического состояния. Термин "развитие" включает в себя проявление, рецидив и появление. В данном контексте термин "появление" или "проявление" связанного с ангиогенезом заболевания включает в себя первоначальное появление и/или рецидив.
В данном контексте "задержка развития" связанного с ангиогенезом заболевания означает отсрочку, откладывание, замедление, торможение, стабилизацию и/или отсрочивание развития данного заболевания. Эта задержка может быть различной по времени в зависимости от истории нарушения и/или медицинского профиля подлежащего лечению индивидуума. Как очевидно для специалиста в данной области, достаточная или значимая задержка может фактически включать в себя предупреждение, заключающееся в том, что данный индивидуум не развивает детектируемое заболевание. Способом, который "задерживает" развитие заболевания, является способ, который уменьшает степень заболевания в данных временных рамках в сравнении с неприменением данного способа. Такие сравнения обычно основаны на клинических исследованиях, использующих статистически значимое число субъектов, хотя это знание может быть основано на эпизодических данных. "Задержка развития" может означать, что степень и/или нежелательные клинические ослабляются и/или временной ход прогрессирования ослабляется или удлиняется в сравнении с отсутствием введения агента. Таким образом, этот термин включает в себя также, но не только, ослабление симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление прогрессирования заболевания и ремиссию (частичную или общую), детектируемую или недетектируемую.
В применении здесь и в прилагаемой формуле изобретения единственные формы "a", "and" и "the" включают в себя множественные объекты, если контекст не диктует явным образом обратное. Так, например, ссылка на "полинуклеотид" включает в себя множество таких полинуклеотидов, а ссылка на "агент" включает в себя ссылку на один или более агентов и их эквивалентов, известных специалистам в данной области, и т.д.
Общие методы
Практика данного изобретения будет использовать, если нет других указаний, общепринятые методы молекулярной биологии (в том числе рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в рамках компетенции в данной области. Такие методы полным образом объясняются в литературе, такой как: "Molecular Cloning: A Laboratory Manual, Second Edition (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M.J.Gait, ed., 1984); "Animal Cell Culture" (R.I.Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Handbook of Experimental Immunology" (D.M.Wei and C.C.Blackwell, eds.); "Gene Transfer Vectors for Mammalian Cells" (J.M.Miller and M.P.Calos, eds., 1987); "Current Protocols in Molecular Biology" (F.M.Ausubel et al., eds., 1987); "PCR: The Polymerase Chain Reaction" (Mullis et al., eds., 1994); "Current Protocols in Immunology" (J.E.Coligan et al., eds., 1991).
Полинуклеотиды данного изобретения
Данное изобретение обеспечивает полинуклеотиды изоформ VEGI, в том числе полинуклеотиды VEGI-192a, VEGI-192b и VEGI-251. Нуклеотидные последовательности, соответствующие этим новым изоформам, приведены в таблицах 1, 2 и 3 (SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3), а соответствующие им полипептидные последовательности приведены в таблицах 4, 5 и 6 (SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6).
Полинуклеотидная последовательность, показанная в таблице 1 (SEQ ID NO:1), была получена секвенированием кДНК-клона, который был депонирован в Американской Коллекции Типовых Культур, 10801 University Boulevard, Manassas, VA 20110-2209, и получила номер доступа.
Полинуклеотидная последовательность, показанная в таблице 2 (SEQ ID NO:2), была получена секвенированием кДНК-клона, который был депонирован в Американской Коллекции Типовых Культур, 10801 University Boulevard, Manassas, VA 20110-2209, и получила номер доступа.
Со ссылкой на выравнивание последовательностей, сравнивающее предсказанные аминокислотные последовательности для SEQ ID NO:4, 5 и 6 (таблица 7), С-концевой район полипептидов, кодируемых этими SEQ ID-последовательностями, является идентичным от Val-24 VEGI-174 до С-конца этого белка. Однако N-концы этих четырех изоформ являются различными. В примерах показано, что VEGI-174 не ингибирует ангиогенез, так как он не экспортируется эффективно из клетки после экспрессии. В противоположность этому, VEGI-251 эффективно транспортируется во внеклеточную среду после экспрессии и является поэтому эффективным в ингибировании ангиогенеза. Экспорт VEGI-251 приводит к отщеплению его пре-последовательности; считается, что сайт протеолиза находится в положении 61 или 96 VEGI-251; но он может также находиться в другом сайте, локализованном приблизительно между Glu-20 и Ser-57 VEGI-251. Возможные сайты включают в себя, но не ограничиваются ими, Е64, К73, Е77, S81, R90 и К95. Очищенный полипептид VEGI-192a также является эффективным в ингибировании роста васкулярных эндотелиальных клеток.
Таким образом, данное изобретение обеспечивает изолированные молекулы нуклеиновых кислот, содержащие последовательности, соответствующие новым изоформам VEGI, показанным в таблицах 1, 2 и 3 (SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3). Полинуклеотиды данного изобретения, в том числе фрагменты полинуклеотидов данного изобретения, применимы в качестве зондов, праймеров, в системах экспрессии (в том числе в системах экспрессии in vivo и in vitro, описанных здесь, которые могут быть также основой генотерапии) и в системах скрининга. Особенно полезные применения этих полинуклеотидов будут обсуждаться ниже.
Термин "изолированная" молекула нуклеиновой кислоты относится к молекуле нуклеиновой кислоты, ДНК или РНК, которая была удалена из ее природного окружения. В некоторых воплощениях удалены, по меньшей мере, 50%, предпочтительно, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80% и еще более предпочтительно, по меньшей мере, 90% веществ, с которыми она ассоциирована в природе. Например, рекомбинантные молекулы ДНК, содержащиеся в векторе, считаются изолированными для целей данного изобретения. Другие примеры изолированных молекул ДНК включают в себя рекомбинантные молекулы ДНК, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или, по существу, очищенные) молекулы ДНК в растворе. Изолированные молекулы РНК включают в себя РНК-транскрипты in vivo или in vitro молекул ДНК данного изобретения. Кроме того, изолированные молекулы нуклеиновых кислот включают в себя такие молекулы, полученные синтетическим путем. Таким образом, "изолированными" полинуклеотидами или полипептидами называют также рекомбинантные или другие не встречающиеся в природе формы полинуклеотидов или полипептидов, которые, вследствие их происхождения или манипуляции: (1) не связаны со всем или частью полинуклеотида или полипептида, с которым он связан в природе; (2) связаны с полинуклеотидом или полипептидом, другим, чем полинуклеотид или полипептид, с которым он связан в природе, или (3) не встречаются в природе или, (4) в случае полипептидов, возникают в результате экспрессии рекомбинантных полинуклеотидов.
Данное изобретение обеспечивает также молекулы нуклеиновых кислот (в том числе, как хорошо понятно специалисту в данной области и описано здесь, изолированные и/или рекомбинантные формы), кодирующие зрелую форму полипептидов белков, описанных здесь. Аминокислотная последовательность полного полипептида изоформы VEGI включает в себя лидерную последовательность и зрелый белок. Согласно гипотезе сигнальных последовательностей, как только инициируется экспорт растущей цепи белка через шероховатую эндоплазматическую сеть, белки, секретируемые клетками млекопитающих, имеют сигнальную или секреторную лидерную последовательность, которая отщепляется от полного полипептида с образованием секретируемой "зрелой" формы белка. Большинство клеток млекопитающих и даже клеток насекомых расщепляют секретируемые белки с одной и той же специфичностью. Однако в некоторых случаях расщепление секретируемого белка не является полностью однородным, что приводит к двум или более зрелым разновидностям белка. Далее, давно было известно, что специфичность расщепления секретируемого белка определяется, в конечном счете, первичной структурой полного белка, т.е. она присуща аминокислотной последовательности данного полипептида.
Данное изобретение обеспечивает также полинуклеотиды, кодирующие слитый белок. Как хорошо известно в данной области, слитым белком или полипептидом является полипептид, содержащий участки в отличающемся положении, в сравнении с природным положением. Эти участки могут в норме существовать в отдельных белках и соединяться вместе в слитом полипептиде, или они могут в норме существовать в одном и том же белке, но помещаться в новое расположение в слитом полипептиде. Таким образом, данное изобретение обеспечивает полинуклеотиды, в которых кодирующая последовательность для зрелого белка может быть слита в одной и той же рамке считывания с полинуклеотидной последовательностью, которая способствует экспрессии и секреции полипептида из клетки-хозяина, например лидерной последовательностью, которая функционирует в качестве секреторной последовательности для регуляции транспорта полипептида из клетки. Полипептид, имеющий лидерную последовательность, является пре-белком и может иметь лидерную последовательность, отщепляемую клеткой-хозяином с образованием зрелой формы этого полипептида. Полинуклеотиды могут также кодировать про-белок, который представляет собой зрелый белок плюс дополнительные 5'-аминокислотные остатки. Зрелый белок, имеющий пропоследовательность, является про-белком и является неактивной формой этого белка. При отщеплении этой пропоследовательности остается активный зрелый белок. Таким образом, например, полинуклеотид данного изобретения может кодировать зрелый белок или белок, имеющий пропоследовательность и пре-последовательность (лидерную последовательность).
Полинуклеотид данного изобретения обеспечивает кодирующую последовательность, слитую в рамке считывания с маркерной последовательностью, которая обеспечивает очистку или детектирование полипептида данного изобретения. Эта маркерная последовательность может быть гексагистидиновой меткой, предоставляемой вектором pQE-9, для обеспечения очистки зрелого полипептида, слитого с этим маркером, в случае бактериального хозяина, или, например, этой маркерной последовательностью может быть гемагглютининовая (НА) метка, когда используют клетку млекопитающего в качестве клетки-хозяина, например клетки COS. НА-метка соответствует эпитопу, происходящему из белка гемагглютинина вируса гриппа (Wilson I., et al. Cell, 37:767 (1984).
Таким образом, термин "полинуклеотид, кодирующий полипептид" включает в себя полинуклеотид, который включает в себя только кодирующую последовательность для полипептида, а также полинуклеотид, который включает в себя дополнительную кодирующую и/или некодирующую последовательность. Для целей данного изобретения и во избежание обременительных ссылок на комплементарные цепи утверждается, что антисмысловая (или комплементарная) цепь такого полинуклеотида также кодирует эту последовательность, т.е. полинуклеотидная последовательность, которая "кодирует" полипептид, включает в себя как общепринятую кодирующую цепь, так и комплементарную последовательность (или цепь).
Мутант или вариант полинуклеотида может быть природно встречающимся аллельным вариантом данного полинуклеотида или не встречающимся природно вариантом данного полинуклеотида. Такие нуклеотидные мутанты или варианты включают в себя делеционные варианты, варианты с заменами и варианты с добавлениями или инсерциями. Вариантная последовательность может приводить к укороченному или измененному полинуклеотиду или полипептиду, увеличенной или уменьшенной экспрессии полинуклеотида или полипептида или любой их комбинации. Вариант может быть в кодирующих, некодирующих, 5'- или 3'-фланкирующих, геномных или кодирующих нуклеотидах.
В некоторых воплощениях полинуклеотидая последовательность содержит последовательность, отличающуюся от последовательностей, показанных в таблицах 1, 2 или 3 (SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3), вследствие вырожденности генетического кода. Генетический код хорошо известен в данной области. Получение таких вырожденных вариантов является рутинным для специалиста в данной области. Таким образом, в некоторых воплощениях данное изобретение обеспечивает полинуклеотид, кодирующий полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6.
Далее, данное изобретение обеспечивает фрагменты или укороченную форму изолированных молекул нуклеиновых кислот, описанных здесь. Под фрагментом изолированной молекулы нуклеиновой кислоты, имеющей нуклеотидную последовательность из приведенных здесь нуклеотидных последовательностей или комплементарную ей цепь, имеются в виду фрагменты длиной, по меньшей мере, 5 нт, по меньшей мере, 10 нт, по меньшей мере, 15 нт, по меньшей мере, 20 нт, по меньшей мере, 30 нт, по меньшей мере, 40, 50, 100, 150, 200, 250, 300, 400 или 500 нт (смежных нуклеотидов). Эти фрагменты имеют многочисленные применения, которые включают в себя, но не ограничиваются ими, применение в качестве диагностических зондов и праймеров, как обсуждается здесь. Как хорошо понятно специалистам в данной области, обычно зонд используют для детектирования мишени посредством гибридизации. В некоторых воплощениях зонд может содержать метку или средство, при помощи которого метка может присоединяться, либо до, либо после реакции гибридизации. Подходящие метки включают в себя, но не ограничиваются ими, радиоактивные изотопы, флуорохромы, хемилюминесцентные соединения, красители и ферменты. Далее, специалистам в данной области понятно, что праймер обычно удлиняется полимеризацией после гибридизации с последовательностью-мишенью. Конечно, более крупные фрагменты с длиной 50-1500 нт также применимы в соответствии с данным изобретением. Под фрагментом с длиной, по меньшей мере, 20 нт имеют в виду фрагменты, которые включают в себя 20 или более смежных оснований из данной нуклеотидной последовательности. В некоторых воплощениях эти фрагменты содержат нуклеотиды 93 и 94 последовательности, показанной в таблице 1 (SEQ ID NO:1), или нуклеотиды 386 и 387 последовательности, показанной в таблице 2 (SEQ ID NO:2). Альтернативно, фрагменты могут иметь длину менее 1500, 1250, 1000, 750, 500, 250, 150, 100, 50, 40 нт и включать нуклеотиды 93 и 94 последовательности, показанной в таблице 1 (SEQ ID NO:1), или нуклеотиды 386 и 387 последовательности, показанной в таблице 2 (SEQ ID NO:2).
Данное изобретение обеспечивает также полинуклеотиды, содержащие последовательность VEGI-192a (нуклеотиды 1-93 последовательности, показанной в таблице 1 (SEQ ID NO:1) или VEGI-192b (нуклеотиды 1-386 последовательности, показанной в таблице 2 (SEQ ID NO:2).
В некоторых воплощениях данное изобретение обеспечивает полинуклеотид, содержащий, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:1 (которые обычно могут называться также участками), где указанные смежные нуклеотиды находятся в пределах нуклеотидов 1-93 последовательности, показанной в таблице 1 (SEQ ID NO:1). В некоторых воплощениях данное изобретение обеспечивает полинуклеотид, содержащий, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100 или более смежных нуклеотидов SEQ ID NO:1, где указанные смежные нуклеотиды включают нуклеотиды 93 и 94 SEQ ID NO:1.
В некоторых воплощениях данное изобретение обеспечивает также изолированный полинуклеотид, который содержит, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100, по меньшей мере, 150, по меньшей мере, 175, по меньшей мере, 200, по меньшей мере, 250, по меньшей мере, 275, по меньшей мере, 300, по меньшей мере, 350, по меньшей мере, 375, по меньшей мере, 400 или более смежных нуклеотидов SEQ ID NO:2, где указанные смежные нуклеотиды находятся в пределах нуклеотидов 1-386 последовательности, показанной в таблице 2 (SEQ ID NO:2). В некоторых воплощениях данное изобретение обеспечивает полинуклеотид, содержащий, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 50 и, по меньшей мере, 100, по меньшей мере, 150, по меньшей мере, 175, по меньшей мере, 200, по меньшей мере, 250, по меньшей мере, 275, по меньшей мере, 300, по меньшей мере, 350, по меньшей мере, 375, по меньшей мере, 400 или более смежных нуклеотидов SEQ ID N0:2, где указанные смежные нуклеотиды включают нуклеотиды 386 и 387 SEQ ID NO:2.
Данное изобретение обеспечивает изолированный полинуклеотид, содержащий последовательность, кодирующую полипептид SEQ ID NO:4. Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4, где указанные смежные аминокислоты находятся в пределах аминокислотных остатков 1-26 в таблице 4 (SEQ ID NO:4). Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4, где указанные смежные аминокислоты включают аминокислоты 26 и 27 последовательности, показанной в таблице 4 (SEQ ID NO:4). Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую аминокислотные остатки 5-192, 10-192, 15-192, 25-192 последовательности, показанной в таблице 4 (SEQ ID NO:4).
Данное изобретение обеспечивает изолированный полинуклеотид, содержащий последовательность, кодирующую полипептид SEQ ID NO:5. Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую, по меньшей мере, 5, по меньшей мере, 8, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:5, где указанные смежные аминокислоты находятся в пределах аминокислотных остатков 1-26, показанных в таблице 5 (SEQ ID NO:5). Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую, по меньшей мере, 5, по меньшей мере, 8, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:5, где эти смежные аминокислоты включают аминокислоты 26 и 27 последовательности, показанной в таблице 5 (SEQ ID NO:5). Данное изобретение обеспечивает также изолированный полинуклеотид, содержащий последовательность, кодирующую аминокислотные остатки 5-192, 10-192, 15-192, 20-192 или 25-192 последовательности, показанной в таблице 5 (SEQ ID NO:5).
Понятно, что район смежных аминокислот или нуклеотидов, которые находятся в пределах конкретной пары аминокислот или нуклеотидов, может, но необязательно, включать в себя любой член указанной пары. Например, смежные нуклеотиды в пределах нуклеотидов 1-93 SEQ ID NO:1 могут включать в себя нуклеотид 1 и/или нуклеотид 93 SEQ ID NO:1.
Воплощения данного изобретения исключают полинуклеотиды, кодирующие полипептид, состоящий из аминокислот 27-192 SEQ ID NO:4 или SEQ ID NO:5, или любую укороченную форму таких полинуклеотидов.
Данное изобретение обеспечивает также полинуклеотиды, содержащие последовательность, кодирующую любой из описанных здесь полипептидов VEGI.
В характерных воплощениях фрагменты полинуклеотидов данного изобретения кодируют полипептид, который демонстрирует функциональную активность. Под полипептидом, демонстрирующим функциональную активность, имеют в виду полипептид, способный проявлять одну или более известных функциональных активностей, связанных с полным или зрелым полипептидом VEGI. Такие функциональные активности включают в себя, но не ограничиваются ими, биологическую активность (например, ингибирование ангиогенеза, ингибирование пролиферации васкулярных эндотелиальных клеток, индукцию клеточной адгезии), антигенность (способность связываться или конкурировать с полипептидом VEGI-192a и/или VEGI-192b за связывание с антителом против VEGI-192a и/или против VEGI-192b); иммуногенность (способность генерировать антитело, которое связывается с полипептидом VEGI-192a и/или VEGI-192b), способность образования полимеров с другими полипептидами VEGI и способность связываться с рецептором или лигандом для полипептида VEGI (например, DR3).
Подобным образом полипептиды VEGI, кодируемые любым из описанных здесь полинуклеотидов, могут иметь одну или более функциональных активностей VEGI, описанных выше и здесь.
Другое воплощение данного изобретения обеспечивает изолированный полинуклеотид, имеющий, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности с полинуклеотидами данного изобретения, описанными здесь. Одно воплощение обеспечивает изолированный полинуклеотид, имеющий, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности с последовательностью VEGI-192a или VEGI-192b, показанной в таблице 1 или таблице 2 (SEQ ID NO:1 или SEQ ID NO:2). В других воплощениях изолированные полинуклеотиды дополнительно имеют менее чем 85%, 83%, 80%, 75%, 70% идентичности последовательности с указанной выше последовательностью VEGI-192a или VEGI-192b. Данное изобретение включает в себя также изолированные полинуклеотиды, имеющие, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности с фрагментами из, по меньшей мере, 10 смежных нуклеотидов (или более, например, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 смежных нуклеотидов) последовательности, показанной в таблице 1 (SEQ ID NO:1) или таблице 2 (SEQ ID NO:2), где эти смежные нуклеотиды включают нуклеотиды 93 и 94 SEQ ID NO:1 или нуклеотиды 386 и 387 SEQ ID NO:2. В некоторых воплощениях полинуклеотиды имеют, по меньшей мере, 85%, по меньшей мере, 88%, по меньшей мере, 90%, по меньшей мере, 92%, по меньшей мере, 94%, по меньшей мере, 96%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности с фрагментами из, по меньшей мере, 10 смежных нуклеотидов (или более, например, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 смежных нуклеотидов) последовательности, показанной в таблице 1 (SEQ ID NO:1), или последовательности, показанной в таблице 2 (SEQ ID NO:2), где эти смежные нуклеотиды находятся в пределах нуклеотидов 1-93 SEQ ID NO:1 или нуклеотидов 1-386 SEQ ID NO:2.
Когда говорят, что полинуклеотид или район полинуклеотида имеет определенный процент (например, 80%, 85%, 90% или 95%) "идентичности последовательности" относительно другой последовательности, это означает, что при выравнивании этот процент оснований является одинаковым в сравнении этих двух последовательностей. Это выравнивание и процент гомологии или идентичность последовательностей могут быть определены с использованием программ, известных в данной области, например программ, описанных в Current Protocols in Molecular Biology (F.M.Ausubel et al., eds., 1987) Supplement 20, section 7.718, Table 4.7.1. Процент идентичности может быть определен электронным способом, например, с использованием программы MegAlign. TM.program (DNASTAR, Inc., Madison Wiss.). MegAlign. TM.program может создавать выравнивание между двумя или более последовательностями в соответствии с различными способами, например, с использованием алгоритма Clustal. (См., например, Higgins, D.G. and P.M.Sharp (1988) Gene 73:237-244.) Алгоритм Clustal группирует последовательности в кластеры путем анализа расстояний между всеми парами. Эти кластеры выравниваются попарно и затем в группах. Процент сходства между двумя аминокислотными последовательностями, например последовательностью А и последовательностью В, рассчитывают делением длины последовательности А минус число остатков в брешах в последовательности А, минус число остатков в брешах в последовательности В, на сумму совпадений остатков между последовательностью А и последовательностью В, и умножением на 100. Бреши с низким сходством или с отсутствием сходства между этими двумя аминокислотными последовательностями не включают в определение процента сходства. Процент идентичности между последовательностями нуклеиновых кислот может быть также подсчитан или вычислен другими способами, известными в данной области, например, по способу Jotun Hein. (См., например, Hein, J. (1990) Methods Enzymol. 183:626-645.)
Данное изобретение обеспечивает также изолированную нуклеиновую кислоту, которая гибридизуется в условиях высокой строгости с нуклеиновой кислотой, имеющей последовательность, комплементарную нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO:1 и SEQ ID NO:2, или с нуклеиновой кислотой, имеющей последовательность, комплементарную нуклеотидной последовательности, кодирующей полипептид SEQ ID NO:4 или SEQ ID NO:5, или их комплемент.
С точки зрения условий гибридизации, чем выше требуемая идентичность последовательности, тем более строгими являются условия гибридизации, если такие последовательности определяют по их способности гибридизоваться с последовательностью полинуклеотида данного изобретения. Таким образом, данное изобретение включает в себя также полинуклеотиды, которые способны гибридизоваться с последовательностью, содержащей полинуклеотид данного изобретения, как обсуждается здесь. Примером строгих условий гибридизации является инкубирование в течение ночи при 42°С в растворе: 50% формамид, 1×SSC (150 мМ хлорид натрия, 15 мМ цитрат натрия), 50 мМ фосфат натрия (рН 7,6), 5X раствор Денхардта, 10% декстрансульфат и 20 мкг/мл денатурированной, фрагментированной ДНК спермы лосося, с последующим промыванием фильтров в 0,1×SSC при приблизительно 65°С. Обсуждение, касающееся реакций гибридизации, см. ниже.
В одном воплощении данное изобретение обеспечивает изолированный полинуклеотид, содержащий последовательность из, по меньшей мере, 10 смежных нуклеотидов (или более, например, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 (или более) смежных нуклеотидов), который гибридизуется с полинуклеотидом (таким как ДНК или РНК), содержащим последовательность, изображенную в таблице 1 (SEQ ID NO:1) или таблице 2 (SEQ ID NO:2), или его фрагментом, как описано выше, в условиях, в которых он не гибридизуется с другими полинуклеотидами из клетки млекопитающего, предпочтительно клетки человека, или в условиях, в которых гибридизация с полинуклеотидом, имеющим последовательность, изображенную в таблице 1 (SEQ ID NO:1) или таблице 2 (SEQ ID NO:2), является повышенной по отношению к гибридизации с другими полинуклеотидами из клетки млекопитающего. В некоторых воплощениях эти фрагменты включают нуклеотиды 93 и 94 SEQ ID NO:1 или нуклеотиды 386-387 SEQ ID NO:2. В некоторых воплощениях эти фрагменты находятся в пределах нуклеотидов 1-93 SEQ ID NO:1 или нуклеотидов 1-386 SEQ ID NO:2.
Эти воплощения особенно применимы в диагностическом контексте (детекция).
В другом воплощении данное изобретение включает в себя полинуклеотидную последовательность, содержащую, по меньшей мере, 10, предпочтительно 15, предпочтительно 18, предпочтительно 20, более предпочтительно 25, более предпочтительно 35, более предпочтительно 50, еще более предпочтительно 75, 100, 125, 150, 200, 250 смежных нуклеотидов некодирующей (т.е. фланкирующей) части, показанной в таблице 1 (SEQ ID NO:1) или таблице 2 (SEQ ID NO:2). Эти воплощения могут быть особенно полезными в качестве диагностических зондов или в качестве праймеров для амплификации некодирующих частей гена VEGI-192a или VEGI-192b.
Понятно, что (если обратное не указано или не требуется) любое воплощение данного изобретения, описанное здесь, которое является полинуклеотидом, включает в себя как двухцепочечную форму, так и каждую из двух комплементарных одноцепочечных форм, о которых известно или предсказано, что они образуют двухцепочечную форму.
Реакции гибридизации могут выполняться в условиях различной "строгости". Условия, которые увеличивают строгость реакции гибридизации, широко известны и опубликованы в данной области. См., например, Sambrook et al. (1989). Примеры релевантных условий включают в себя (в порядке увеличения строгости): температуры инкубирования 25°С, 37°С, 50°С и 68°С; концентрации буфера 10×SSC, 6×SSC, 1×SSC, 0,1×SSC (где SSC представляет собой 0,15М NaCl и 15 мМ цитратный буфер) и их эквиваленты с использованием других буферных систем; концентрации формамида 0%, 25%, 50% и 75%; периоды инкубации от 5 минут до 24 часов; 1, 2 или более стадий промывок; периоды инкубации при промывках 1, 2 или 15 минут и промывающие растворы 6×SSC, 1×SSC, 0,1×SSC или деионизованная вода. Примером строгих условий гибридизации является гибридизация при 50°С или выше и 0,1×SSC (15 мМ хлорид натрия/1,5 мМ цитрат натрия). Другим примером строгих условий гибридизации является инкубация в течение ночи при 42°С в растворе: 50% формамид, 1×SSC (150 мМ хлорид натрия, 15 мМ цитрат натрия), 50 мМ фосфат натрия (рН 7,6), 5×раствор Денхардта, 10% декстрансульфат и 20 мкг/мл денатурированной, фрагментированной ДНК спермы лосося, с последующим промыванием фильтров в 0,1×SSC при приблизительно 65°С. Строгие условия гибридизации являются условиями гибридизации, которые являются, по меньшей мере, такими же строгими, как описанные выше репрезентативные условия. Другие строгие условия гибридизации известны в данной области и могут также использоваться для идентификации нуклеиновых кислот этого конкретного воплощения данного изобретения.
Данное изобретение обеспечивает также праймеры и зонды, содержащие участок SEQ ID NO:1 или SEQ ID NO:2, где этот участок находится в пределах нуклеотидов 1-93 SEQ ID NO:1 или нуклеотидов 1-386 SEQ ID NO:2. Данное изобретение обеспечивает также праймеры и зонды, содержащие участок SEQ ID NO:1 или SEQ ID NO:2, где этот участок включает нуклеотиды 93 и 94 SEQ ID NO:1 или нуклеотиды 386 и 387 SEQ ID NO:2.
Зонды из более чем одной полинуклеотидной последовательности, обеспеченной здесь, могут гибридизоваться с одной и той же нуклеиновой кислотой, если кДНК, из которой они были произведены, соответствует одной мРНК. С использованием зондов, в частности меченых зондов, на последовательности ДНК, можно выделить гомологичные или родственные гены. Источником гомологичных генов может быть любой вид, например виды приматов, собачьих, кошачьих, овец, лошадей, дрожжей, нематод. Могут быть использованы зонды из более чем 10 нуклеотидов ("нт"), например зонды с размером в диапазоне приблизительно 15 нт, 18 нт, 20 нт, 25 нт, 75 нт или 100 нт, но обычно зонд приблизительно 15 нт представляет достаточную последовательность для уникальной идентификации.
"Тm" является температурой в градусах Цельсия, при которой 50% полинуклеотидного дуплекса, полученного из комплементарных цепей, связанных водородными связями в антипараллельном направлении в результате спаривании оснований по правилам Уотсона-Крика, диссоциируют на одиночные цепи в условиях эксперимента. Тm может быть предсказана в соответствии со стандартной формулой, такой как:
Тm=81,5+16,6log[X+]+0,41(%G/C)-0,61(%F)-600/L,
где [X+] обозначает концентрацию катиона (обычно иона натрия, Na+) в моль/л; (%G/C) обозначает количество остатков G и С в процентах от общего количества остатков в дуплексе; (%F) обозначает процент формамида в растворе (мас./об.) и L обозначает количество нуклеотидов в каждой цепи дуплекса.
Как описано выше, данное изобретение включает в себя варианты или модификации полинуклеотидов VEGI-192a и VEGI-192b, такие как делеции, замены, добавления или изменения в природе любых частей молекул нуклеиновых кислот. Вариантом или модификацией является любое различие в нуклеотидной последовательности в сравнении с полинуклеотидом, который, как показано здесь, кодирует полипептид VEGI-192a или VEGI-192b и/или любое различие в молекулах нуклеиновых кислот этого полинуклеотида (полинуклеотидов). Такие изменения могут быть полезными для облегчения клонирования или модификации экспрессии полинуклеотидов VEGI-192a или VEGI-192b. Такие изменения могут быть также полезными для придания желательных свойств полинуклеотиду (полинуклеотидам), таких как стабильность. Определение полинуклеотида, приведенное здесь, дает примеры этих модификаций. Таким образом, данное изобретение включает в себя также функционально сохранные варианты последовательностей нуклеиновых кислот, описанных здесь, которые включают в себя замены, добавления и/или делеции нуклеиновых кислот. Варианты включают в себя природно встречающиеся варианты полинуклеотидной последовательности (например, вырожденные варианты, аллельные варианты и т.д.). Обычно аллельные варианты содержат 15-25% ошибочных спариваний (мисматчей) пар оснований (п.н.) и могут содержать всего лишь 5-15% или 2-5%, или 1-2% ошибочных спариваний пар оснований, а также ошибочное спаривание одной пары оснований.
Как описано выше, данное изобретение включает в себя полинуклеотиды VEGI-192a или VEGI-192b, в том числе полноразмерные (непроцессированные), процессированные, кодирующие, некодирующие или их части. Частичная карта геномного участка VEGI-192a показана на фигуре 6, в том числе предсказанные границы интронов-экзонов. Данное изобретение может дополнительно включать в себя 3'- и 5'-нетранслируемые области, обнаруживаемые в зрелой мРНК, специфические регуляторные последовательности транскрипции и трансляции, такие как промоторы, энхансеры и т.д., включающие приблизительно 1 т.п.н. и, возможно, более фланкирующей геномной ДНК либо на 5'-, либо на 3'-конце транскрибируемого участка. Эта геномная ДНК может быть выделена в виде фрагмента 100 т.п.н. или менее и, по существу, свободна от фланкирующей хромосомной последовательности. Геномная ДНК, фланкирующая кодирующий участок либо с 3'-, либо с 5'-конца, либо внутренние регуляторные последовательности, такие как обнаруживаемые иногда в интронах, содержит последовательности, необходимые для правильной тканеспецифической, стадиеспецифической или специфической для состояния болезни экспрессии. Воплощениями являются также мРНК- и кДНК-последовательности и их фрагменты, включающие в себя фрагменты, которые включают в себя часть кодирующего сегмента VEGI-192a или VEGI-192b. Обычно разновидности мРНК имеют смежные экзоны с промежуточными интронами, когда они присутствуют, удаляемыми сплайсингом ядерной РНК, с образованием непрерывной открытой рамки считывания, кодирующей полипептид. Разновидности мРНК могут также существовать как с экзонами, так и с интронами, где эти интроны могут удаляться альтернативным сплайсингом. Кроме того, различные разновидности мРНК, кодируемые одними и теми же геномными последовательностями, могут существовать в варьирующих количествах в клетке, и детектирование этих различных количеств разновидностей мРНК может свидетельствовать о дифференциальной экспрессии кодируемого продукта гена в клетке.
Данное изобретение включает в себя также полинуклеотиды, кодирующие функционально эквивалентные варианты и производные полноразмерного VEGI-192a или VEGI-192b и их функционально эквивалентные фрагменты (такие как делеция аминокислот с N-конца и/или с С-конца VEGI-192a или VEGI-192b), которые могут усиливать, уменьшать свойства или не влиять значимо на свойства кодируемых ими полипептидов. Например, изменения в ДНК-последовательности, которые не изменяют кодируемой аминокислотной последовательности, а также которые приводят к консервативным заменам аминокислотных остатков, не являющимся пагубными неконсервативными заменами, делеций или добавлений одной или малого числа аминокислот и замене аминокислотных остатков аналогами аминокислот, являются изменениями, которые не будут значимо влиять на свойства кодируемого полипептида. Нуклеотидные замены, которые не изменяют кодируемых аминокислотных остатков, могут быть полезными для оптимизации экспрессии генов в различных системах. Подходящие замены известны специалистам в данной области и проводятся, например, для отражения предпочтительного использования кодонов в конкретных системах экспрессии. В другом варианте полинуклеотиды альтернативного сплайсинга могут приводить к функционально эквивалентному фрагменту или варианту VEGI. Альтернативно процессированные варианты полинуклеотидной последовательности определяются как полинуклеотидные последовательности, соответствующие мРНК, которые отличаются по их последовательности друг относительно друга, но происходят из одного и того же геномного участка, например мРНК, которые возникают вследствие: 1) использования альтернативных промоторов; 2) использования альтернативных сайтов полиаденилирования или 3) использования альтернативных сайтов сплайсинга.
Данное изобретение обеспечивает также ДНК-вставку, содержащую нуклеиновую кислоту, имеющую нуклеотидную последовательность SEQ ID NO:1 или ее комплемент. В других воплощениях данное изобретение обеспечивает ДНК-вставку, содержащую нуклеиновую кислоту, имеющую нуклеотидную последовательность SEQ ID NO:2 или ее комплемент.
Как хорошо понятно специалистам в данной области, термин "полинуклеотид" относится к полимерным формам нуклеотидов любой длины, которые включают в себя дезоксирибонуклеотиды, рибонуклеотиды и/или их аналоги. Термины "полинуклеотид" и "нуклеиновая кислота" используются взаимозаменяемо, как хорошо известно в данной области. Полинуклеотиды могут иметь любую трехмерную структуру. Термин "полинуклеотид" включает в себя двухцепочечные, одноцепочечные молекулы и молекулы в виде тройной спирали. Если другого не указано или не требуется, любое воплощение данного изобретения, описанное здесь, которое является полинуклеотидом, включает в себя как двухцепочечную форму, так и каждую из двух комплементарных одноцепочечных цепей, о которых известно или предсказано, что они образуют двухцепочечнную форму. Не все связи в полинуклеотиде должны быть идентичными.
В некоторых воплощениях полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Применение урацила в качестве замены тимина в дезоксирибонуклеиновой кислоте также рассматривается как применение аналога пиримидина.
Как широко известно в данной области, модификация нуклеотидной структуры может быть осуществлена до или после сборки полимера. В некоторых вариантах последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Как описано здесь, полинуклеотид может быть дополнительно модифицирован после полимеризации, например, конъюгацией с метящим компонентом. Другими типами модификаций являются, например, "кэпы", замена одного или нескольких из природно встречающихся нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые цепи, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.д.), модификации с интеркаляторами (например, акридином, псораленом и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, металлы-окислители, и т.д.), модификации, содержащие алкилирующие агенты, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты, и т.д.), а также немодифицированные формы полинуклеотида (полинуклеотидов). Все эти модификации хорошо известны в данной области.
Далее, любые из гидроксильных групп, обычно присутствующих в сахарах, могут быть заменены фосфонатными группами, фосфатными группами, защищены стандартными защитными группами или активированы для получения дополнительных связей с дополнительными нуклеотидами или могут быть конъюгированы с твердыми носителями. 5'- и 3'-концевые ОН-группы могут быть фосфорилированы или заменены аминами или органическими блокирующими группами из 1-20 атомов углерода. Другие гидроксилы могут быть также дериватизованы стандартными защитными группами.
Полинуклеотиды могут также содержать аналоги сахаров рибозы или дезоксирибозы, которые общеизвестны в данной области, в том числе, но не только, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, (-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и не содержащие основания аналоги нуклеозидов, такие как метилрибозид).
Хотя используют обычно общепринятые сахара и основания, замена аналогами сахаров, пуринов и пиримидинов может быть полезной в конструировании конечного продукта, как и альтернативные скелетные структуры, такие как полиамидный скелет или фосфоротиоатный скелет.
Данное изобретение включает в себя композиции, в том числе фармацевтические композиции, содержащие описанные здесь полинуклеотиды. Эти композиции могут дополнительно содержать подходящие наполнители, такие как фармацевтически приемлемые наполнители, в том числе буферы, которые хорошо известны в данной области.
Данное изобретение обеспечивает также наборы, содержащие любой из описанных здесь полинуклеотидов. В некоторых воплощениях эти наборы содержат полинуклеотиды SEQ ID NO:1 и/или SEQ ID NO:2. В некоторых воплощениях эти наборы содержат полинуклеотиды, кодирующие полипептид SEQ ID NO:4 и/или SEQ ID NO:5. В некоторых воплощениях эти наборы содержат зонды и праймеры, содержащие, по меньшей мере, 15 смежных, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30 или, по меньшей мере, 50 нуклеотидов SEQ ID NO:1 или SEQ ID NO:2, причем указанные смежные нуклеотиды находятся в пределах нуклеотидов 1-93 SEQ ID NO:1 или нуклеотидов 1-386 SEQ ID NO:2. Эти наборы могут дополнительно включать в себя реагенты и инструкции для детектирования присутствия или отсутствия или уровня экспрессии VEGI-192a и/или VEGI-192b. Наборы данного изобретения находятся в подходящей упаковке и могут, при необходимости, обеспечивать дополнительные компоненты, такие как буферы или инструкции.
Данное изобретение обеспечивает также полинуклеотиды, описанные здесь, присоединенные к твердому носителю. Способы прикрепления полинуклеотидов к твердому носителю, например к поверхности массивов (матриц), также известны в данной области. Твердым носителем является любой подходящий материал, в том числе гранулы на основе полистирола и стеклянные чипы, такие как GeneChip. RTM. product (Affymetrix, Inc., Santa Clara, Calif.). См. Международные Публикации с номерами WO 97/10365, WO 97/29212, WO 97/27317, WO 95/11995, WO 90/15070 и Патенты США с номерами 5744305 и 5445934.
Данное изобретение обеспечивает также массивы, содержащие полинуклеотиды VEGI-192a и/или VEGI-192b. Массивы полинуклеотидов обеспечивает высокопроизводительный способ, которым можно анализировать большое количество полинуклеотидов или полипептидов в пробе. Эта технология может быть использована в качестве инструмента для испытания на дифференциальную экспрессию. Многочисленные способы получения массивов, а также вариации этих способов известны в данной области и предусмотрены для применения в данном изобретении. Например, массивы могут быть созданы нанесением полинуклеотидных зондов на подложку (например, стекло, нитроцеллюлозу и т.д.) в виде двухмерного массива или матрицы, несущих связанные зонды. Эти зонды могут быть связаны с подложкой либо ковалентными связями, либо нековалентными взаимодействиями, такими как гидрофобные взаимодействия. Пробы полинуклеотидов могут быть детектируемо помечены (например, с использованием радиоактивных или флуоресцентных меток) и затем гибридизованы с этими зондами. Двухцепочечные полинуклеотиды, содержащие меченые полинуклеотиды пробы, связанные с полинуклеотидами зондов, могут быть детектированы, как только несвязавшаяся часть этой пробы будет отмыта. Альтернативно, полинуклеотиды тест-пробы могут быть иммобилизованы в этом массиве, а зонды детектируемо помечены. Способы конструирования массивов и способы использования этих массивов описаны, например, в Schena et al. (1996) Proc.Natl.Acad.Sci. USA 93(20):10614-9; Schena et al. (1995) Science 270(5235):467-70; Shalon et al. (1996) Genome Res. 6(7):639-45, USPN 5807522, EP 799897; WO 97/29212; WO 97/27317; EP 785280; WP 97/02357; USPN 5593839; USPN 5578832; ЕР 728520; USPN 5599695; ЕР 721016; USPN 5556752; WO 95/22058 и USPN 5631734.
Массивы могут быть использованы для исследования дифференциальной экспрессии генов и могут быть использованы для определения функции генов. Например, массивы могут быть использованы для детектирования дифферециальной экспрессии изоформы VEGI, соответствующей описанному здесь полинуклеотиду, где экспрессию сравнивают между опытной клеткой и контрольной клеткой. Например, высокая экспрессия мРНК конкретной изоформы VEGI в клетке из субъекта, который имеет заболевание, которая не наблюдается в соответствующей нормальной клетке, может указывать на ассоциацию этой изоформы VEGI с таким заболеванием. Примеры применений массивов дополнительно описаны, например, в Pappalarado et al., Sem. Radiation Oncol. (1998) 8:217, и Ramsay Nature Biotechnol. (1998) 16:40. Кроме того, многие вариации способов детектирования с использованием массивов находятся вполне в рамках квалификации специалистов в данной области и в рамках данного изобретения. Например, вместо иммобилизации зонда на твердой подложке на этой твердой подложке может быть иммобилизована тест-проба, которую затем приводят в контакт с зондом.
Полинуклеотид изоформы VEGI, который дифференциально экспрессируется в клетке из индивидуума, имеющего заболевание, может иметь клиническое значение в отношении этого заболевания. Полинуклеотид изоформы VEGI дифференциально экспрессируется в клетке, когда этот полинуклеотид детектируется при более высоком или менее высоком уровнях в клетке индивидуума, имеющего заболевание, в сравнении с клеткой того же клеточного типа, которая взята из индивидуума, который не имеет этого заболевания. Обычно скрининг на дифференциально экспрессируемые полинуклеотиды фокусируется на полинуклеотиде, который экспрессируется таким образом, что, например, мРНК обнаруживается на уровнях, по меньшей мере, приблизительно на 25%, по меньшей мере, приблизительно на 50% - приблизительно на 75%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно в 2 раза, по меньшей мере, приблизительно в 4 раза, по меньшей мере, приблизительно в 5 раз, по меньшей мере, приблизительно в 10 раз или, по меньшей мере, приблизительно в 50 раз или более, более высоких (например, сверхэкспрессируются) или более низких (например, недостаточно экспрессируются) уровнях в клетке из индивидуума, который имеет это заболевание, в сравнении с клеткой того же типа, которая взята не из такого индивидуума. Сравнение может производиться, например, между двумя тканями, если используют гибридизацию in situ, или другой способ анализа, который позволяет некоторую степень дискриминации среди типов клеток в данной ткани. Это сравнение может также производиться между клетками, выделенными из их тканевого источника.
Таким образом, данное изобретение обеспечивает массив, содержащий полинуклеотиды изоформы VEGI, описанные здесь. В некоторых воплощениях данное изобретение обеспечивает массив, содержащий полинуклеотидную последовательность, показанную в таблице 1 (SEQ ID NO:1), или участок полинуклеотида этой последовательности, показанной в таблице 1 (SEQ ID NO:1), где указанный участок является участком из, по меньшей мере, 10 смежных нуклеотидов (или более, например, 15, 18, 20, 25, 35, 40,45, 50, 60, 75 или 100 смежных нуклеотидов). В других воплощениях этот участок дополнительно включает нуклеотиды 93 и 94 последовательности, показанной в таблице 1 (SEQ ID NO:1). В других воплощениях этот участок находится в пределах нуклеотидов 1-93 последовательности, показанной в таблице 1 (SEQ ID NO:1).
В некоторых воплощениях данное изобретение обеспечивает массив, содержащий полинуклеотидную последовательность, показанную в таблице 2 (SEQ ID NO:2), или участок полинуклеотида этой последовательности, показанной в таблице 2 (SEQ ID NO:2), где указанный участок является участком из 10 смежных нуклеотидов (или более, например, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 смежных нуклеотидов). В других воплощениях этот участок дополнительно включает нуклеотиды 386 и 387 последовательности, показанной в таблице 2 (SEQ ID NO:2). В других воплощениях этот участок находится в пределах нуклеотидов 1-386 последовательности, показанной в таблице 2 (SEQ ID NO:2).
Массивы применимы также для детектирования мутантных полинуклеотидов изоформы VEGI. Мутантные полинуклеотиды изоформы VEGI могут быть обнаружены в геномной ДНК, например геномной ДНК, выделенной из крови индивидуума или из пробы другой ткани. Мутантные полинуклеотиды изоформы VEGI могут быть также обнаружены с использованием кДНК или мРНК из индивидуума, имеющего измененный полинуклеотид изоформы VEGI, если этот мутантный полинуклеотид изоформы VEGI приводит к мРНК, которая является, например, измененной по размеру. Мутантный ген изоформы VEGI может также приводить к дифференциальной экспрессии (увеличенной или уменьшенной) мРНК изоформы VEGI, которая может быть детектирована, как описано здесь.
Данное изобретение обеспечивает также массив, содержащий один или более выделенных полинуклеотидов, которые специфически гибридизуются с описанным здесь полинуклеотидом. В некоторых воплощениях данное изобретение обеспечивает массив, содержащий один или более изолированных полинуклеотидов, которые специфически гибридизуются с полинуклеотидом, показанным в таблице 1 (SEQ ID NO:1), или участком полинуклеотида последовательности, показанной в таблице 1 (SEQ ID NO:1), где указанный участок является участком из, по меньшей мере, 10 смежных нуклеотидов (или более, например, по меньшей мере, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 смежных нуклеотидов). В других воплощениях этот участок дополнительно включает нуклеотиды 93 и 94 последовательности, показанной в таблице 1 (SEQ ID NO:1). В других воплощениях этот участок находится в пределах нуклеотидов 1-93 последовательности, показанной в таблице 1 (SEQ ID NO:1).
В других воплощениях данное изобретение обеспечивает массив, содержащий один или более изолированных полинуклеотидов, которые специфически гибридизуются с полинуклеотидом, показанным в таблице 2 (SEQ ID NO:2), или участком полинуклеотида последовательности, показанной в таблице 2 (SEQ ID NO:2), где указанный участок является участком из, по меньшей мере, 10 смежных нуклеотидов (или более, например, по меньшей мере, 15, 18, 20, 25, 35, 40, 45, 50, 60, 75 или 100 смежных нуклеотидов). В других воплощениях этот участок дополнительно включает нуклеотиды 386 и 387 последовательности, показанной в таблице 2 (SEQ ID NO:2). В других воплощениях этот участок находится в пределах нуклеотидов 1-386 последовательности, показанной в таблице 2 (SEQ ID NO:2).
Полипептиды данного изобретения
Данное изобретение включает в себя полипептидные последовательности VEGI-192a, VEGI-192b и VEGI-251 человека, показанные в таблицах 4 (SEQ ID NO:4), 5 (SEQ ID NO:5) и 6 (SEQ ID NO:6). Полипептиды VEGI могут быть извлечены и очищены из культур рекомбинантных клеток способами, включающими в себя осаждение сульфатом аммония или этанолом, экстракцию кислотой, анионо- или катионообменную хроматографию, фосфоцеллюлозную хроматографию, гидрофобную хроматографию, аффинную хроматографию, гидроксилапатитную хроматографию и хроматографию с использованием лектина. Стадии повторной укладки (рефолдинга) белка могут быть использованы при необходимости при восстановлении структуры зрелого белка. Наконец, для конечных стадий очистки может быть использована высокоэффективная жидкостная хроматография (ВЭЖХ). Примеры способов повторной укладки и очистки белков описаны в заявке на патент США 20010044521 и WO 01/55174.
Полипептиды данного изобретения могут быть природным очищенным продуктом или продуктом способов химического синтеза или могут быть получены рекомбинантными способами из прокариотического (такого как Е.coli) или эукариотического хозяина (такого как клетки СНО). В зависимости от хозяина, используемого в способе рекомбинантного получения, полипептиды данного изобретения могут быть гликозилированными или могут быть негликозилированными. Полипептиды данного изобретения могут также включать в себя аминокислотный остаток инициирующего метионина.
Полипептиды VEGI-192a, VEGI-192b и VEGI-251 данного изобретения (которые, как описано здесь, включают в себя различные варианты, такие как полноразмерные, зрелые, слитые, фрагменты и т.д.) имеют различные применения, как описано здесь. Эти полипептиды представляют особый интерес в качестве генетических или биохимических маркеров (например, в крови или тканях), которые указывают на связанное с ангиогенезом заболевание, и/или для мониторинга эффективности различных терапий и профилактических вмешательств. Диагностические способы (т.е. детектирование) и способы скрининга описаны более подробно ниже. Полипептиды данного изобретения используются также в получении антител, которые связываются с этими полипептидами, их применение в качестве агента для скрининга фармацевтических кандидатов (как in vitro, так и in vivo), их применение в рациональном (т.е. основанном на структуре) конструировании лекарственных средств, а также другие применения включают в себя терапевтические применения, которые описаны здесь (например, если полноразмерный VEGI-192a или VEGI-192b проявляет его действие посредством связывания с другим белком, полипептид, который конкурентно связывается с VEGI-192a или VEGI-192b, мог бы ухудшать функцию VEGI-192a или VEGI-192b в качестве конкурентного ингибитора и, следовательно, проявлять терапевтическую активность). Полипептиды VEGI-192a или VEGI-192b могут быть также использованы для идентификации белков, в частности белков из людей, которые связываются (или взаимодействуют физически) с VEGI-192a или VEGI-192b, которые, следовательно, могли бы сами быть мишенями лекарственных средств.
Данное изобретение обеспечивает полипептид, укороченные формы или фрагменты VEGI-192a и VEGI-192b. Полипептиды VEGI данного изобретения имеют одну или более функций, как описано в предыдущем разделе. В некоторых воплощениях полипептид VEGI служит для связывания специфического антитела. В других воплощениях полипептид VEGI является иммуногеном. В следующих воплощениях полипептид VEGI ингибирует рост васкулярных эндотелиальных клеток и/или ангиогенез. Способы тестирования активности полипептида VEGI (в том числе укороченной формы VEGI) хорошо известны в данной области и описаны подробно в примерах, такие как анализ для тестирования действия на рост сосудистых эндотелиальных клеток, образование капилляроподобных трубок, рост капилляров в коллагеновых гелях, помещенных на хориоаллантоисную мембрану куриного эмбриона, рост опухолей-ксенотрансплантатов.
Размер полипептидных фрагментов может широко варьироваться. Так, данное изобретение включает в себя полипептидные фрагменты полноразмерного VEGI-192a или VEGI-192b, содержащие часть аминокислотной последовательности, изображенной в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5), в которых полипептид VEGI-192a или VEGI-192b является, по меньшей мере, приблизительно 5, приблизительно 10, приблизительно 15, 25, 50, 75, 100, 150 или более смежными аминокислотами последовательности, показанной в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5). Понятно, что эти фрагменты содержат, по меньшей мере, одну из аминокислот в пределах аминокислот 1-26 SEQ ID NO:4 или SEQ ID NO:5, предпочтительно участок в пределах аминокислот 1-26 SEQ ID NO:4 или SEQ ID NO:5. В некоторых воплощениях эта часть аминокислотной последовательности содержит аминокислоты 26 и 27, показанные в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5). В некоторых воплощениях эта часть аминокислотной последовательности находится в пределах аминокислот 1-26 SEQ ID NO:4 или SEQ ID NO:5. Как очевидно специалисту с квалификацией в данной области, эти полипептиды, независимо от их размера, могут также быть связаны или конъюгированы с другими веществами или агентами для облегчения, усиления или модуляции функции и/или специфичности полипептида VEGI-192a или VEGI-192b. Эти фрагменты могут быть использованы для различных целей, в том числе в качестве иммуногена (либо отдельно, либо вместе с подходящим агентом) или в качестве агента для ингибирования ангиогенеза. Эти фрагменты (как и полипептиды) должны иметь одну или более биологических функций, описанных выше для полипептида VEGI. В некоторых вариантах эти фрагменты ингибируют ангиогенез. Укороченные формы могут иметь меньший размер, чем любое число из следующих: 185, 170, 160, 150, 125, 100, 80, 50, 40, 25, 20, 15 или 10 аминокислот.
Понятно, что участок смежных аминокислот или нуклеотидов, которые ограничены конкретной парой аминокислот или нуклеотидов, может, но необязательно, включать в себя любой член указанной пары. Например, смежные аминокислоты в пределах аминокислот 1-26 SEQ ID NO:4 могут включать в себя аминокислоту 1 и/или аминокислоту 26 SEQ ID NO:4.
В некоторых воплощениях данного изобретения полипептиды данного изобретения содержат, по меньшей мере, 5, по меньшей мере, 8, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот в пределах аминокислотных остатков 1-26, показанных в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5) (которые обычно могут также называться участками). Данное изобретение обеспечивает также полипептиды, содержащие аминокислотные остатки приблизительно 5-192, 10-192, 15-192, 20-192 или 25-192 последовательности, показанной в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5).
Воплощения данного изобретения исключают любые полипептиды, состоящие из аминокислот 27-192 SEQ ID NO:4 или SEQ ID NO:5, или укороченную форму таких полипептидов.
Далее, данное изобретение включает в себя полипептиды, которые имеют, по меньшей мере, 90% сходства, более предпочтительно, по меньшей мере, 95% сходства и еще более предпочтительно 96%, 97%, 98% или 99% сходства с полипептидами, описанными выше. Полипептиды данного изобретения включают в себя также полипептиды, которые являются, по меньшей мере, на 80% идентичными, более предпочтительно, по меньшей мере, на 90% или на 95% идентичными, еще более предпочтительно, по меньшей мере, на 96%, 97%, 98% или 99% идентичными полипептидам, описанным здесь, а также включают в себя части таких полипептидов с, по меньшей мере, 30 аминокислотами и более предпочтительно с, по меньшей мере, 50 аминокислотами. В некоторых воплощениях данное изобретение обеспечивает полипептиды, которые имеют, по меньшей мере, 90% сходства, более предпочтительно, по меньшей мере, 95% сходства и еще более предпочтительно, по меньшей мере, 96%, 97%, 98% или 99% сходства с полипептидом SEQ ID NO:4 или полипептидом SEQ ID NO:5. Полипептиды данного изобретения включают в себя также полипептиды, которые являются, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90% или на 95% идентичными, еще более предпочтительно, по меньшей мере, на 96%, 97%, 98% или 99% идентичными полипептиду SEQ ID NO:4 или полипептиду SEQ ID NO:5.
Данное изобретение обеспечивает также слитые белки, включающие описанные здесь полипептиды. Полипептиды, описанные здесь, могут быть слиты с такими последовательностями, как последовательности, которые усиливают иммунологическую реактивность, облегчают связывание данного полипептида с подложкой или носителем или облегчают очистку (например, последовательности, кодирующие эпитопы, такие как Мус, НА, происходящий из гемагглютинина вируса гриппа, His-6 или FLAG). Кроме того, белок или полинуклеотид может быть слит с другими полипептидами, которые увеличивают его функцию или определяют его локализацию в клетке, такими как секреторная последовательность, описанная здесь. Способы получения рекомбинантного слитого белка, описанного выше, являются обычными в данной области. Рекомбинантный или слитый белок может быть выделен способами, хорошо известными в данной области.
Для анализа эффективности лекарственных средств и агентов, которые ингибируют или активируют функцию VEGI, таких как белки хозяина или химически полученные агенты или другие белки, которые взаимодействуют с полинуклеотидами VEGI, понижающе регулируя или изменяя экспрессию полипептидов VEGI или действуя на их способность ингибировать ангиогенез, используют трансформированные клетки-хозяева. Способом для испытания эффективности лекарственного средства или агента против VEGI или против ангиогенеза может быть, например, блокирование ингибитора роста эндотелиальных клеток.
Данное изобретение включает в себя композиции, в том числе фармацевтические композиции, содержащие описанные здесь полипептиды. В некоторых воплощениях эти композиции содержат полипептид SEQ ID NO:4. Эта композиция применима для ингибирования ангиогенеза. Эти композиции могут дополнительно содержать подходящие наполнители, такие как фармацевтически приемлемые наполнители, в том числе буферы, которые хорошо известны в данной области.
Данное изобретение обеспечивает также наборы, содержащие описанные здесь полипептиды. В некоторых воплощениях эта композиция содержит полипептид SEQ ID NO:4. В некоторых аспектах эти наборы могут быть использованы для лечения патологического ангиогенеза, ингибирования ангиогенеза или лечения рака, например уменьшения размера опухоли. Наборы данного изобретения находятся в подходящей упаковке и могут при необходимости обеспечивать дополнительные компоненты, такие как буферы и инструкции.
Данное изобретение обеспечивает также описанные здесь полипептиды, прикрепленные к твердой подложке. Способы получения такого прикрепления, например прикрепления к поверхности массива, хорошо известны в данной области. Полипептиды данного изобретения, прикрепленные к твердой подложке, такой как частицы агарозы, Сефадекс или т.п., применимы для скрининга молекул, которые селективно связывают описанные здесь полипептиды.
Данное изобретение включает в себя также массив, содержащий полипептиды изоформ VEGI данного изобретения, как описано здесь. Таким образом, в одном аспекте данное изобретение обеспечивает массив, содержащий полипептиды изоформ VEGI, кодируемые полинуклеотидом данного изобретения, как описано здесь. В другом аспекте данное изобретение обеспечивает массив, содержащий полипептид, содержащий последовательность, показанную в таблице 4 (SEQ ID NO:4), или ее участок, где этот участок имеет длину, по меньшей мере, приблизительно 5 смежных аминокислот (или более, например, по меньшей мере, 10, 15, 25, 50, 75, 100, 150 или более аминокислот). В некоторых воплощениях этот участок включает аминокислоты 26 и 27 последовательности, показанной в таблице 4 (SEQ ID NO:4). В других воплощениях этот учаток находится в пределах аминокислот 1-26 последовательности, показанной в таблице 4 (SEQ ID NO:4).
В другом аспекте данное изобретение обеспечивает массив, содержащий полипептид, содержащий последовательность, показанную в таблице 5 (SEQ ID NO:5), или ее участок, где этот участок имеет длину, по меньшей мере, приблизительно 5 смежных аминокислот (или более, например, по меньшей мере, 10, 15, 25, 50, 75, 100, 150 или более аминокислот). В некоторых воплощениях этот участок включает аминокислоты 26 и 27 последовательности, показанной в таблице 5 (SEQ ID NO:5). В других воплощениях этот участок находится в пределах аминокислот 1-26 последовательности, показанной в таблице 5 (SEQ ID NO:5).
Термины "полипептид" и "белок" используются здесь взаимозаменяемо и, как хорошо известно в данной области, относятся к полимерам аминокислот любой длины. В различных воплощениях полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, он может прерываться компонентами, не являющимися аминокислотами, и/или он может быть собран в комплекс из более чем одной полипептидной цепи. Как хорошо понятно специалистам в данной области, полипептид может быть модифицирован природным путем или посредством вмешательства; например, образованием дисульфидных связей, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией, такой как конъюгация с метящим компонентом. В некоторых воплощениях полипептиды содержат один или несколько аналогов аминокислот (в том числе, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области.
Данное изобретение включает в себя также функционально сохранные полипептиды VEGI, описанные здесь. Такие варианты могут быть получены с использованием способов, стандартных в данной области, например консервативными заменами аминокислот. В различных воплощениях функционально сохранный вариант содержит (или, в некоторых вариантах, состоит из них) любые из одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти консервативных замен аминокислот.
Векторы и клетки-хозяева
Данное изобретение относится также к векторам, которые включают в себя выделенные полинуклеотиды данного изобретения, клеткам-хозяевам, которые генетически сконструированы с использованием этих рекомбинантных векторов или которые сконструированы другим способом для получения полипептидов данного изобретения, и к получению полипептидов данного изобретения рекомбинантыми способами.
Термин "вектор" относится к плазмиде, вирусу или другому носителю, известному в данной области, который был подвергнут манипуляции посредством инсерции или включения генетических последовательностей VEGI-251, VEGI-192a или VEGI-192b или их фрагментов. Полинуклеотидным (обычно ДНК) элементом, который делает вектор пригодным для размножения, может быть сайт инициации репликации (ориджин репликации), который работает в прокариотических или эукариотических клетках. Примером сайта инициации репликации, который работает в прокариотических клетках, является colE1 ori. Рекомбинантный вектор требует дополнительно маркера отбора для контроля роста организмов, которые несут этот вектор. Подходящие маркеры отбора включают в себя гены, которые защищают организмы от антибиотиков (гены устойчивости к антибиотикам), например ампициллина, стрептомицина, хлорамфеникола, или обеспечивают рост в условиях лишения какого-либо соединения (условиях ауксотрофного роста) при экспрессии в качестве белков в клетках. В предпочтительном воплощении данного изобретения для размножения рекомбинантного вектора эти прокариотические клетки являются бактериями. В особенно предпочтительных версиях данного изобретения этими бактериями являются, в частности, бактерии Escherichia coli или Bacillus sp. В следующем предпочтительном воплощении данного изобретения для размножения рекомбинантного вектора эукариотические клетки являются клетками клеточной линии или дрожжевыми клетками. В особенно предпочтительных версиях данного изобретения клетками клеточной линии являются клетки линий СНО, COS, HeLa или 3Т3, а дрожжевыми клетками являются клетки Saccharomyces cerevisiae.
Данное изобретение включает в себя различные векторы (т.е. клонирующие и/или экспрессирующие векторы, а также векторы для клонирования и/или репликации), имеющие клонированные в них полинуклеотиды VEGI-192a, VEGI-192b или VEGI-251. Эти векторы могут быть использованы для экспрессии рекомбинантных полипептидов, а также в качестве источника полинуклеотидов VEGI-192a, VEGI-192b или VEGI-251. Клонирующие векторы могут быть использованы для получения реплик-копий полинуклеотидов VEGI-192a, VEGI-192b или VEGI-251, которые они содержат, или в качестве средства хранения этих полинуклеотидов в депозитарии для будущего использования. Экспрессирующие векторы (и клетки-хозяева, содержащие эти экспрессирующие векторы) могут быть использованы для получения полипептидов, продуцируемых из полинуклеотидов, которые они содержат. Они могут быть также использованы в том случае, когда желательно экспрессировать полипептиды VEGI-192a, VEGI-192b или VEGI-251 в индивидууме, например, для индукции иммунной реакции посредством полипептида (полипептидов), кодируемых в этом экспрессирующем векторе (векторах). Подходящие клонирующие и экспрессирующие векторы включают в себя любые известные в данной области векторы, например векторы для использования в бактериальных системах экспрессии, системах экспрессии млекопитающих, дрожжей и насекомых. Конкретные векторы и подходящие клетки-хозяева известны в данной области и не требуют подробного описания здесь. См., например, Gacesa and Ramji, Vectors, John Wiley and Sons (1994).
Клонирующие и экспрессирующие векторы обычно содержат селектируемый маркер (например, ген, кодирующий белок, необходимый для выживания или роста клетки-хозяина, трансформированной этим вектором), хотя такой маркерный ген может переноситься на другую полинуклеотидную последовательность, совместно вводимую в клетку-хозяина. Только те клетки-хозяева, в которые был введен селектируемый ген, будут выживать и/или расти при селективных условиях. Типичные селектируемые гены кодируют белок (белки), которые: (а) сообщают устойчивость к антибиотикам или другим веществам-токсинам, например ампициллину, неомицину, метотрексату и т.д.; (b) восполняют ауксотрофные недостаточности или (с) предоставляют критические питательные вещества, недоступные из сложной среды. Выбор подходящего маркерного гена будет зависеть от клетки-хозяина, и подходящие гены для различных хозяев известны в данной области. Клонирующие и экспрессирующие векторы обычно содержат также систему репликации, узнаваемую хозяином.
Подходящие клонирующие векторы могут быть сконструированы в соответствии со стандартными способами или могут быть выбраны из большого числа клонирующих векторов, доступных в данной области. Хотя выбранный клонирующий вектор может варьироваться в зависимости от клетки-хозяина, которую предполагается использовать, применимые клонирующие векторы обычно способны к саморепликации, могут иметь единственную мишень для конкретной рестриктазы и/или могут нести гены для маркера, который может быть использован в селекции клонов, содержащих данный вектор. Подходящие примеры включают в себя плазмиды и вирусы бактерий, например, pUC18, pUC19, BlueScript (например, pBS SK+) и ее производные, mp18, mp19, pBR22, pМВ9, ColE1, pCR1, RP4, ДНК фагов и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие клонирующие векторы являются доступными от коммерческих фирм-поставщиков, таких как BioRad, Stratagene и Invitrogen.
Экспрессирующие векторы обычно являются способными к репликации полинуклеотидными конструкциями, которые содержат полинуклеотид, кодирующий представляющий интерес полипептид VEGI. Полинуклеотид, кодирующий полипептид VEGI, функционально связан с подходящими регуляторными элементами транскрипции, такими как промоторы, энхансеры и терминаторы. Для экспрессии (т.е. трансляции) обычно требуются также регуляторные элементы, такие как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны. Эти регуляторные элементы (транскрипции и трансляции) могут быть получены из полинуклеотидов VEGI (т.е. одного из генов изоформ VEGI) или они могут быть гетерологичными (т.е. происходящими из других генов и/или других организмов). Может быть также включена полинуклеотидная последовательность, кодирующая сигнальный пептид, чтобы полипептид VEGI мог пересекать клеточные мембраны и/или откладываться в клеточные мембраны или секретироваться из клетки. Ряд экспрессирующих векторов, пригодных для экспрессии в эукариотических клетках, в том числе дрожжах, клетках птиц и млекопитающих, известны в данной области.
Векторы, содержащие представляющие интерес полинуклеотиды, могут вводиться в клетку-хозяина любым из ряда подходящих способов, в том числе электропорацией, трансфекцией с использованием хлорида кальция, хлорида рубидия, фосфата кальция, ДЭАЭ-декстрана или других веществ, бомбардировкой микроснарядами, липофекцией и инфицированием (когда вектор является инфекционным агентом, таким как вирус осповакцины). Выбор способов введения векторов или полинуклеотидов часто будет зависеть от клетки-хозяина.
Данное изобретение включает в себя также клетку-хозяина и культуру клеток, содержащую клетки-хозяева. Эта клетка-хозяин, содержащая, по меньшей мере, один рекомбинантный полинуклеотидный (обычно ДНК) вектор, упоминалась выше. "Клетками-хозяевами" являются клетки, в которых вектор может размножаться, а его ДНК может экспрессироваться. Эта клетка может быть прокариотической или эукариотической. Этот термин включает в себя любое потомство рассматриваемой клетки-хозяина. Понятно, что все потомство может не быть идентичным родительской клетке, так как могут происходить мутации, которые встречаются во время репликации. Однако такое потомство включено, когда используется термин "клетка-хозяин". Способы стабильного переноса, что означает, что чужеродная ДНК непрерывно сохраняется в хозяине, известны в данной области. Когда клетка-хозяин выбрана из прокариотических клеток, она предпочтительно представляет клетку бактерии, в частности Escherichia coli или Bacillus sp. Когда клетка-хозяин является эукариотической клеткой, она предпочтительно является клеткой или клеточной линией, в частности клеткой линии COS, Hela или 3Т3 или клеткой дрожжей, в частности клеткой Saccharomyces cerevisiae.
Клетки-хозяева данного изобретения могут быть использованы, inter alia, в качестве хранилищ полинуклеотидов VEGI и/или носителей для получения полинуклеотидов и/или полипептидов VEGI, как описано здесь. Клетки-хозяева могут также служить хранилищами мутантных полинуклеотидов VEGI-192a, VEGI-192b или VEGI-251, как описано далее. Такие клетки-хозяева могут быть полезными для скрининга, получения терапевтического белка или полипептида, как описано далее.
Антитела и их получение
Данное изобретение обеспечивает также антитела, которые селективно связываются с белками VEGI-192a и/или VEGI-192b (в том числе фрагментами), как описано здесь. Термин "антитело" включает в себя, но не ограничивается ими, интактные молекулы, их фрагменты, такие как Fab, F(ab')2, Fv, которые способны связывать эпитопную детерминанту. Эти фрагменты антител сохраняют некоторую способность селективно связываться с их антигеном или рецептором и определяются следующим образом:
(1) Fab, фрагмент, который содержит одновалентный антигенсвязывающий фрагмент молекулы антитела, может быть получен расщеплением целого антитела ферментом папаином с получением интактной легкой цепи и части одной тяжелой цепи;
(2) Fab', фрагмент молекулы антитела, который может быть получен обработкой целого антитела пепсином с последующим восстановлением с получением интактной легкой цепи и части тяжелой цепи; получают два Fab'-фрагмента на молекулу антитела;
(3) F(ab')2, фрагмент антитела, который может быть получен обработкой целого антитела ферментом пепсином без последующего восстановления; F(ab')2 является димером двух Fab'-фрагментов, удерживаемых вместе двумя дисульфидными связями;
(4) Fv, определяемый как генетически сконструированный фрагмент, содержащий вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, экспрессируемые в виде двух цепей; и
(5) одноцепочечное антитело ("SCA"), определяемое как генетически сконструированная молекула, содержащая вариабельный район легкой цепи, вариабельный район тяжелой цепи, связанные подходящим полипептидным линкером в виде генетически слитой одноцепочечной молекулы.
В некоторых воплощениях антитела данного изобретения могут быть любыми из следующих антител: поликлональных, моноклональных, одноцепочечных (ScFv), мутантов этих вариантов, слитых белков, содержащих часть антитела (такую как один или более CDR-областей), гуманизированных антител, химерных антител, антител человека или любой модифицированной конфигурации молекулы иммуноглобулина, которая содержит сайт узнавания антигена требуемой специфичности.
Как понятно специалистам в данной области, "моноклональное антитело" обозначает гомогенную популяцию антител, в которой моноклональное антитело состоит из аминокислот (природно встречающихся и не встречающихся в природе), которые участвуют в селективном связывании антигена. Моноклональные антитела являются высокоспецифичными, направленными против единственного антигенного сайта. Термин "моноклональное антитело" включает в себя не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные scFv, их мутанты, слитые белки, содержащие антитело в качестве части слитого белка, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт узнавания антигена требуемой специфичности и способна связываться с антигеном. Не предполагаются ограничения в отношении источника этого антитела или способа, которым его получают (например, с использованием гибридомы, фагового отбора, рекомбинантной экспрессии, трансгенных животных и т.д.).
"Гуманизированными" антителами называют молекулу, имеющую антигенсвязывающий сайт, который, по существу, происходит из иммуноглобулина из вида, не являющегося человеком, и остальную структуру иммуноглобулина этой молекулы, основанную на структуре и/или последовательности иммуноглобулина человека. Этот антигенсвязывающий сайт может содержать либо вариабельные домены, слитые с константными доменами, либо определяющие комплементарность области (CDR), пересаженные на подходящие каркасные участки в вариабельных доменах. Антигенсвязывающие сайты могут быть сайтами дикого типа или модифицированными одной или несколькими аминокислотными заменами, например модифицированными для того, чтобы они имели более близкое сходство с иммуноглобулином человека. Некоторые формы гуманизированных антител сохраняют все CDR-последовательности (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиных антител). Другие формы гуманизированных антител имеют один или более CDR (один, два, три, четыре, пять, шесть), которые изменены относительно исходного антитела, которые также называют одним или более CDR, "происходящими из" одного или более CDR из этого антитела.
Способы получения антител и фрагментов антител известны в данной области. (См., например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1988, включенный в описание путем отсылки.)
Данное изобретение обеспечивает также антитело, которое селективно связывает полипептид, содержащий SEQ ID NO:4, SEQ ID NO:5 или его фрагмент, где этот фрагмент находится в пределах аминокислот 1-26 SEQ ID NO:4 или SEQ ID NO:5, или этот фрагмент включает аминокислоты 26 и 27 SEQ ID NO:4 или SEQ ID NO:5. Данное изобретение обеспечивает также антитела, которые селективно связывают VEGI-192a и VEGI-192b, но не другие изоформы VEGI (не связываются селективно с другими изоформами VEGI, такими как VEGI-251). Данное изобретение обеспечивает также антитела, которые селективно связывают VEGI-192a или VEGI-192b.
Далее, данное изобретение обеспечивает антитело, которое селективно связывает полипептид, кодируемый SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, или его фрагмент.
В некоторых воплощениях данное изобретение обеспечивает антитело, которое селективно связывается с полипептидом, содержащим участок из, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4 или SEQ ID NO:5, где этот участок находится в пределах аминокислотных остатков 1-26, показанных в таблице 4 (SEQ ID NO:4) или таблице 5 (SEQ ID NO:5). В других воплощениях данное изобретение обеспечивает антитело, которое селективно связывается с полипептидом, содержащим участок из, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25 или более смежных аминокислот SEQ ID NO:4 или SEQ ID NO:5, где этот участок включает аминокислоты 26 и 27 SEQ ID NO:4 или SEQ ID NO:5.
В некоторых воплощениях антитело данного изобретения ингибирует активность VEGI; например, такое антитело могло бы стимулировать ангиогенез. Способы скрининга такого антитела описаны ниже.
В некоторых воплощениях антитело данного изобретения может быть агонистическим антителом в том смысле, что оно стимулирует активность VEGI. Способы скрининга такого антитела описаны ниже.
Понятно, что в этом контексте, когда имеются различные изоформы VEGI, селективное связывание обозначает связывание преимущественно (или даже исключительно) с конкретной изоформой в сравнении с другой изоформой (если уже нет другого указания). В некоторых воплощениях антитело селективно связывает полипептид VEGI данного изобретения в сравнении с изоформой VEGI не из человека. В качестве примера антитело данного изобретения могло бы селективно связывать человеческий VEGI-192a, но не мышиный (не человека) VEGI-192a.
Антитела данного изобретения могут быть связаны (т.е. конъюгированы) с детектируемым агентом или гаптеном. Этот комплекс применим для детектирования полипептида (полипептидов) (или фрагментов полипептидов), с которыми антитело специфически связывается в образце, с использованием стандартных иммунохимических способов, таких как иммуногистохимия, как описано Harlow and Lane (1988), supra. Примерами типов иммуноанализов, в которых могут использоваться моноклональные антитела данного изобретения, являются конкурентный и неконкурентный иммуноанализы в прямом или непрямом формате. Примерами таких иммуноанализов являются иммуноферментный (твердофазный) анализ (ELISA), радиоиммунный анализ (RIA) и сэндвич(иммунометрический)-анализ. Детектирование с использованием моноклональных антител данного изобретения может выполняться с использованием иммуноанализов, которые работают в прямом, обратном или одновременных режимах, в том числе иммуногистохимических анализов на физиологических образцах. Специалисты в данной области знают или могут легко выбрать другие форматы иммуноанализов без чрезмерного экспериментирования.
Другой способ, который может также давать более высокую чувствительность, состоит в связывании антител с низкомолекулярными гаптенами. Затем эти гаптены могут быть специфически детектированы с использованием второй реакции. Например, используют обычно такие галтены, как биотин, который реагирует с авидином, или динитрофенил, пиридоксаль и флуоресцеин, которые могут реагировать со специфическими антителами против гаптена. См. Harlow and Lane (1988) supra.
Антитела данного изобретения могут быть также связаны с различными носителями. Таким образом, данное изобретение обеспечивает также композиции, содержащие антитела и носитель. Носители могут быть активными и/или инертными. Примеры хорошо известных носителей включают в себя стекло, полистирол, полипропилен, полиэтилен, декстран, найлон, амилозы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. По своей природе этот носитель может быть либо растворимым, либо нерастворимым для целей данного изобретения. Специалистам с квалификацией в данной области будут известны другие подходящие носители для связывания моноклональных антител, или они смогут найти их в ходе рутинного экспериментирования.
Имеется много различных меток и способов мечения, известных специалистам с обычной квалификацией в данной области. Примеры типов меток, которые могут быть использованы в данном изобретении, включают в себя ферменты, радиоизотопы, флуоресцентные соединения, коллоидные металлы, хемилюминесцентные соединения и биолюминесцентные соединения. Специалистам с обычной квалификацией в данной области будут известны другие подходящие метки для связывания с моноклональными антителами, или они смогут найти их с использованием рутинного экспериментирования. Кроме того, связывание этих меток с моноклональным антителом данного изобретения может быть выполнено с использованием стандартных способов, обычных для специалистов с обычной квалификацией в данной области.
Для целей данного изобретения полипептиды этого изобретения могут детектироваться антителами данного изобретения, если они присутствуют в образцах, таких как жидкости и ткани. Это применение антител обсуждается более подробно ниже.
Композиции, содержащие антитела, их фрагменты или клеточные линии, которые продуцируют эти антитела, охватываются данным изобретением. При фармацевтическом применении этих композиций их объединяют с фармацевтически приемлемым эксципиентом. Данное изобретение включает в себя также массивы, содержащие антитела или их фрагменты. Антитела могут быть иммобилизованы на поверхности, например, массива для использования в детектировании и диагностических анализах, как описано более подробно ниже. Антитела могут быть также иммобилизованы на носителе для очистки описанных здесь полипептидов или их фрагментов.
Композиции
Кроме того, данное изобретение обеспечивает композиции, в том числе фармацевтические композиции, содержащие полипептиды, полинуклеотиды, антитела, рекомбинантные векторы и клетки-хозяева данного изобретения. Эти композиции могут включать в себя буфер, который выбирают в соответствии с желаемым применением полипептида, антитела, полинуклеотида, рекомбинантного вектора или клетки-хозяина, и могут также включать в себя другие вещества, подходящие для предполагаемого применения. Специалисты в данной области могут легко выбрать подходящий буфер, большое разнообразие которых известно в данной области, пригодный для предполагаемой цели. В некоторых случаях эта композиция является фармацевтической композицией и может содержать фармацевтически приемлемые наполнители, множество которых известно в данной области и не требует подробного обсуждения здесь. Фармацевтически приемлемые наполнители были достаточно полно описаны в многочисленных публикациях, в том числе, например, A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams and Wilkins.
Наборы, содержащие полинуклеотиды, полипептиды и/или антитела данного изобретения
Как описано здесь, данное изобретение включает в себя также наборы, содержащие полинуклеотид (полинуклеотиды), полипептид (полипептиды) и/или антитела данного изобретения, такие как наборы для диагностики, для терапии. Наборы, являющиеся воплощением данного изобретения, включают в себя наборы, которые позволяют проводить анализ на присутствие полинуклеотидов, полипептидов VEGI и/или анти-VEGI-антител, таких как любые из описанных здесь, для детектирования и/или количественного определения этих молекул. Таким образом, данное изобретение включает в себя (а) набор для детектирования или количественного определения полинуклеотида VEGI в пробе, содержащей любой из полинуклеотидов VEGI, описанных здесь; (b) набор, содержащий любое из антител, описанных здесь, для детектирования или количественного определения полипептида VEGI в пробе; (с) набор, содержащий любой из полипептидов, описанных здесь, для детектирования или количественного определения анти-VEGI-антитела в пробе. Данное изобретение обеспечивает также наборы, содержащие полинуклеотиды или полипептиды данного изобретения, для применения в терапии.
Наборы данного изобретения находятся в подходящих упаковках и могут при необходимости содержать дополнительные компоненты, которые применимы в этой процедуре. Эти необязательные компоненты включают в себя, но не ограничиваются ими, буферы, захватывающие реагенты, прояляющие реагенты, метки, реагирующие поверхности, средства для детектирования, контрольные образцы, инструкции и пояснительную информацию.
Способы применения полинуклеотидов, полипептидов и антител: системы детектирования
Данное изобретение обеспечивает также способы применения полинуклеотидов, полипептидов и/или антител VEGI-192a и VEGI-192b данного изобретения для обнаружения подходящих мишеней в образце. Как данное изобретение делает это ясным, способы обнаружения относятся к любому детектированию присутствия, отсутствия, а также количественному определению. Процедуры для проведения диагностических тестов (т.е. детектирования) с использованием полинуклеотидов, полипептидов или антител широко известны в данной области и являются рутинными для практика с обычной квалификацией в данной области. Обычно для проведения диагностического способа данного изобретения одну из композиций данного изобретения используют в качестве реагента для обнаружения мишени, с которой он реагирует в образце. Эта мишень обеспечивается получением подходящего образца из индивидуума, для которого должен быть измерен диагностический параметр. Многие типы образцов являются пригодными для этой цели. Если желательно, мишень может быть частично очищена из этого образца или амплифицирована перед проведением анализа.
Данное изобретение относится к способу обнаружения присутствия или отсутствия или уровня полипептидов VEGI-192a или VEGI-192b в образце, предусматривающему контактирование образца из человека или животного с антителами, которые селективно связываются с описанным здесь полипептидом, и детектирование присутствия, или отсутствия, или количества комплекса, образованного между этим полипептидом и этими антителами. Такое детектирование применимо для целей диагностики, прогноза и/или мониторинга, связанного с ангиогенезом заболевания. В некоторых воплощениях данное изобретение обеспечивает способ для диагностики патологического ангиогенеза, предусматривающий стадии контактирования образца из человека или животного, у которого подозревают наличие патологического ангиогенеза, с антителами, которые узнают описанный здесь полипептид, и детектирования присутствия или отсутствия комплекса, образованного между этим полипептидом и этими антителами.
Может быть использован конкурентный анализ, в котором антитела, которые селективно связываются с полипептидами VEGI-192a и/или VEGI-192b, прикреплены к твердому носителю, а меченые VEGI-192a и/или VEGI-192b и образец, полученный из хозяина, пропускают над этим твердым носителем, и количество метки, детектируемое, например, жидкостной сцинтилляционной хроматографией, может быть скоррелировано с количеством VEGI-192a и/или VEGI-192b в этом образце.
"Сэндвич-анализ" является сходным с анализом ELISA. В сэндвич-анализе VEGI-192a и/или VEGI-192b пропускается над твердым носителем и связывается с антителом, прикрепленным к этому твердому носителю. Затем второе антитело связывают с этим VEGI-192a и/или VEGI-192b. Затем третье антитело, которое является меченым и специфичным в отношении второго антитела, пропускается над твердым носителем и связывается со вторым антителом, и затем может быть определено связанное количество.
С использованием стандартной методологии, хорошо известной в данной области, может быть сконструирован диагностический анализ посредством нанесения на поверхность (т.е. на твердый носитель), например микротитровальный планшет или мембрану (например, нитроцеллюлозную мембрану), антител, специфичных к полипептиду VEGI-192a, или VEGI-192b, или обоих, или связывающихся с ними, и контактирования этой покрытой поверхности с сывороткой, тканью или другим биологическим или химическим образцом, полученным от лица, у которого предполагают наличие связанного с ангиогенезом заболевания. Присутствие или отсутствие полученного комплекса, образованного между полипептидом VEGI-192a или VEGI-192b в образце и антителами, специфичными к ним, может быть детектировано любым из известных способов, общепринятых в данной области, таких как спектроскопия или колориметрия флуоресцентных антител. Этот способ детектирования может быть использован, например, для диагностики или прогнозирования рака.
Анализ уровней полипептидов VEGI-192a и/или VEGI-192b в образце может использовать любой из способов на основе антител, которые хорошо известны в данной области. Например, экспрессия полипептидов VEGI-192a и/или VEGI-192b в тканях может быть исследована классическими иммуногистологическими способами (Jalkanen, M., et al., J.Cell.Biol. 101:976-985 (1985); Jalkanen, M., et al., J.Cell.Biol. 105:3087-3096 (1987). Другие способы на основе антител, применимые для детектирования экспрессии генов полипептидов VEGI-192a и/или VEGI-192b, включают в себя иммуноанализы, такие как иммуноферментный твердофазный анализ (ELISA) и радиоиммунный анализ (RIA). Подходящие метки для анализа антител известны в данной области и включают в себя ферментные метки, такие как глюкозооксидаза, и радиоактивные изотопы, такие как иод (125I, 121I), углерод (14С), сера (35S), тритий (3H), индий (112In) и технеций (99mTc), и флуоресцентные метки, такие как флуоресцеин и родамин, и биотин.
Кроме анализа уровней полипептида VEGI-192a и/или VEGI-192b в образце, полученном от индивидуума, полипептид VEGI-192a и/или VEGI-192b может быть также детектирован in vivo посредством получения изображения (imaging). Метки антител или маркеры для получения изображения in vivo полипептида VEGI-192a или VEGI-192b включают в себя метки, детектируемые рентгенографией, ЯМР или ЭСР (электронно-спиновым резонансом). Для рентгенографии подходящими метками являются радиоизотопы, такие как барий или цезий, которые испускают детектируемое излучение, но не являются явно вредными для субъекта. Подходящие маркеры для ЯМР и ЭСР включают в себя маркеры с детектируемым характерным спином, такие как дейтерий, которые могут быть включены в антитело посредством мечения питательных веществ для релевантной гибридомы.
Антитело или фрагмент антитела, которые селективно связываются с полипептидом VEGI-192a и/или VEGI-192b, которые были помечены подходящей, дающей изображение молекулой, такой как радиоизотоп (например, 131I, 112In, 99mTc), непроницаемое для излучения вещество или материал, детектируемый ядерным магнитным резонансом, вводят (например, парентерально, подкожно или внутрибрюшинно) в млекопитающее, обследуемое в отношении нарушения иммунной системы. Специалистам в данной области будет понятно, что размер субъекта и используемая система получения изображения будут определять количество дающей изображение молекулы, необходимое для получения диагностических изображений. В случае радиоактивной молекулы для человека количество инъецируемой радиоактивности будет обычно находиться в диапазоне от приблизительно 5 до 20 милликюри 99mTc. Затем меченое антитело или фрагмент антитела будут преимущественно накапливаться в расположении клеток, которые содержат полипептид VEGI-192a и/или VEGI-192b. Получение изображений опухолей in vivo описано Burchiel et al. (Chapter 13 in Tumor Imaging: The Radiochemical Detection of Cancer, Burchiel, S.W. and Rhodes, B.A., eds., Masson Publishing Inc. (1982)).
Как понятно специалистам в данной области, полипептиды VEGI-192a и/или VEGI-192b могут быть детектированы с использованием любого агента, который связывается с этими полипептидами.
В другом воплощении данное изобретение относится к диагностическому набору, содержащему антитела, которые селективно связываются с полипептидами данного изобретения, например антитела, которые селективно связывают VEGI-192a или VEGI-192b или оба полипептида, и вспомогательные реагенты для применения в детектировании присутствия этих полипептидов в образце. Эти реагенты хорошо известны в данной области и пригодны для применения в детектировании присутствия или отсутствия полипептидов VEGI в сыворотке, ткани или другом образце. Рассматриваемые образцы ткани могут быть получены из обезьяны, или человека, или других млекопитающих. Этот набор может дополнительно включать в себя инструкции по применению, контролю и пояснительную информацию.
Данное изобретение обеспечивает также способ для обнаружения присутствия, или отсутствия, или уровня полинуклеотидов, описанных здесь, предусматривающий контактирование образца из индивидуума, такого как человек или животное, с полинуклеотидом (в некоторых воплощениях олигонуклеотидом), который селективно связывается с описанным здесь полинуклеотидом, и детектирование присутствия, или отсутствия, или количества дуплекса, образованного между используемым полинуклеотидом и полинуклеотидом в образце. В некоторых воплощениях способ данного изобретения, который применим для диагностики патологического ангиогенеза, предусматривает стадии контактирования образца из человека или животного, у которого предполагают наличие патологического ангиогенеза, с полинуклеотидом (таким как олигонуклеотид), который связывается с описанным здесь полинуклеотидом, и детектирования присутствия или отсутствия дуплекса, образованного между используемым полинуклеотидом и полинуклеотидом в образце. В другом воплощении данное изобретение относится к РНК, ДНК или другим нуклеотидным последовательностям для применения в детектировании присутствия или отсутствия полинуклеотидов VEGI с использованием полимеразной цепной реакции (ПЦР) или обратной транскрипции-ПЦР (ОТ-ПЦР). Могут быть использованы другие способы амплификации на основе праймеров. ДНК-последовательность данного изобретения, показанная в таблице 1 (SEQ ID NO:1) или таблице 2 (SEQ ID NO:2), может быть использована для конструирования праймеров, которые специфически связываются с полинуклеотидной последовательностью VEGI-192a или VEGI-192b в случае ПЦР или с кДНК VEGI-192a или VEGI-192b, полученной обратной транскрипцией РНК, кодирующей полипептид VEGI-192a или VEGI-192b, для цели детектирования присутствия, отсутствия или количественного определения полинуклеотида VEGI-192a или VEGI-192b посредством сравнения со стандартом. Эти праймеры могут иметь любую длину, например в диапазоне 7-40 нуклеотидов, предпочтительно 10-15 нуклеотидов, наиболее предпочтительно 18-25 нуклеотидов. Реагенты и контроли, необходимые для реакций ПЦР или ОТ-ПЦР, хорошо известны в данной области. Затем амплифицированные продукты могут анализироваться на присутствие или отсутствие последовательностей полинуклеотидов VEGI-192a или VEGI-192b, например, фракционированием в геле, с гибридизацией или без гибридизации, радиохимией и иммунохимическими способами. Этот способ является предпочтительным, так как требуется только малое количество образца для получения достаточного количества матричной ДНК, с которой проводят ПЦР или ОТ-ПЦР.
В некоторых воплощениях способы детектирования влекут за собой применение одного или нескольких праймеров для амплификации представляющей интерес последовательности VEGI-192a и/или VEGI-192b. В других воплощениях детектирование выполняют с использованием специфических зондов (например, меченых зондов), которые детектируют присутствие или отсутствие (или могут количественно определять) представляющей интерес последовательности VEGI-192a и/или VEGI-192b. В некоторых воплощениях этот зонд содержит метку.
В некоторых воплощениях этот способ используют для детектирования уровня VEGI-192a или VEGI-192b посредством детектирования присутствия, или отсутствия, или количества клеточной РНК, кодирующей VEGI-192a или VEGI-192b, или фрагмент, описанные здесь. Тотальная клеточная РНК может быть выделена из пробы с использованием любого подходящего способа, такого как одностадийный способ с использованием тиоцианата гуанидина-фенола-хлороформа, описанный Chomczynski and Sacchi (Anal.Biochem. 162:156-159 (1987). Затем уровни мРНК, кодирующие полипептид VEGI-192a и/или VEGI-192b, анализируют с использованием любого подходящего способа. Эти способы включают в себя Нозерн-блот-анализ, картирование нуклеазой S1, полимеразную цепную реакцию (ПЦР), обратную транскрипцию в комбинации с полимеразной цепной реакцией (ОТ-ПЦР) и обратную транскрипцию в комбинации с лигазной цепной реакцией (ОТ-ЛЦР).
В другом воплощении данное изобретение относится к диагностическому набору, который содержит праймеры ПЦР или ОТ-ПЦР, один или несколько праймеров, таких как праймеры, специфичные в отношении полинуклеотидов VEGI-192a или VEGI-192b; и/или праймеры, специфичные в отношении других изоформ VEGI, таких как VEGI-251, VEGI-174, и вспомогательные реагенты, которые хорошо известны в данной области и которые являются пригодными для применения в детектировании присутствия или отсутствия полинуклеотидов изоформ VEGI или количественном определении РНК, которая кодирует полипептид изоформы VEGI, в образце с использованием ПЦР или ОТ-ПЦР, или одного или нескольких других способов амплификации. Рассматриваемые образцы могут быть получены из людей или животных.
В другом воплощении данное изобретение относится к диагностическому набору, который содержит зонды, один или несколько зондов, таких как зонды, специфичные в отношении полинуклеотидов VEGI-192a или VEGI-192b, и/или зонды, специфичные в отношении других изоформ VEGI, таких как VEGI-251, VEGI-174, и вспомогательные реагенты, которые хорошо известны в данной области и которые являются пригодными для применения в детектировании присутствия или отсутствия полинуклеотидов изоформ VEGI или количественном определении РНК, которая кодирует полипептид изоформы VEGI в образце, с использованием таких способов, как Нозерн-блоттинг или один или более других способов. Рассматриваемые образцы могут быть получены из людей или животных.
Как понятно в данной области, "образцом" может быть любой образец, полученный из индивидуума (часто называемый "биологическим образцом"): жидкость тела, клеточная линия, культура ткани или другой источник, который содержит или может содержать полипептид или мРНК VEGI-192a и/или VEGI-192b. Как указано, биологические образцы включают в себя жидкости тела (такие как сыворотки, плазма, моча, синовиальная жидкость и спинальная жидкость), которые содержат свободный полипептид VEGI-192a и/или VEGI-192b, ткань иммунной системы и кровеносной системы и другие тканевые источники, которые, как было обнаружено, экспрессируют полные или зрелые полипептиды VEGI-192a, и/или VEGI-192b, и/или рецептор VEGI-192a, и/или VEGI-192b. Способы получения тканевых биопсий и жидкостей тела из млекопитающих хорошо известны в данной области. В случае, когда биологический образец должен содержать мРНК, предпочтительным источником является тканевая биопсия.
Под "анализом уровня экспрессии гена, кодирующего белок VEGI-192a и/или VEGI-192b", имеют в виду качественное или количественное измерение или определение уровня полипептида VEGI-192a и/или VEGI-192b или уровня мРНК, кодирующей полипептид VEGI-192a и/или VEGI-192b, в первом образце либо непосредственно (например, определением или оценкой абсолютного уровня полипептида или уровня мРНК), либо относительно (например, сравнением с уровнем полипептида VEGI-192a и/или VEGI-192b или уровнем мРНК во втором образце). Предпочтительно, уровень полипептида или уровень мРНК VEGI-192a и/или VEGI-192b в первом образце измеряют или оценивают и сравнивают со стандартным уровнем полипептида или уровнем мРНК VEGI-192a и/или VEGI-192b, причем за этот стандарт берется второй образец, полученный из индивидуума, не имеющего нарушения, или определяется усреднением уровней из популяции индивидуумов, не имеющих нарушения иммунной системы и кровеносной системы. Как будет понятно в данной области, когда стандартный уровень полипептида или уровень мРНК VEGI-192a и/или VEGI-192b является известным, он может использоваться многократно в качестве стандарта для сравнения.
Как отмечалось выше, полинуклеотиды и полипептиды VEGI-192a и/или VEGI-192b применимы для диагностики состояний, включающих в себя аномально высокую или низкую экспрессию активностей VEGI-192a и/или VEGI-192b. С учетом клеток и тканей, в которых экспрессируется VEGI-192a и/или VEGI-192b, а также активностей, модулируемых VEGI-192a и/или VEGI-192b, очевидно, что существенно измененный (увеличенный или уменьшенный) уровень экспрессии VEGI-192a и/или VEGI-192b в индивидумме, в сравнении со стандартным или "нормальным" уровнем, вызывает патологические состояния, связанные с системой (системами) тела, в которых VEGI-192a и/или VEGI-192b экспрессируется и/или является активным.
Данное изобретение обеспечивает также способы, способствующие диагностике VEGI-ассоциированного нарушения или состояния. Эти способы помогают в выполнении клинического определения, касающегося классификации, или природы патологического ангиогенеза, или прогноза рака, и могут быть или могут не быть решающими в отношении окончательного диагноза. Таким образом, способ способствования диагностике патологического ангиогенеза, или прогноза рака, или родственного заболевания может включать в себя стадию детектирования уровня экспрессии изоформ VEGI (т.е. VEGI-192a, VEGI-192b) в образце из индивидуума. Способ способствования диагностике ангиогенез-ассоциированного заболевания может также включать стадию детектирования измененных уровней полинуклеотида и/или полипептида изоформы VEGI в образце из индивидуума и/или детектирования увеличенных или уменьшенных уровней полинуклеотида и/или полипептида изоформы VEGI в образце из индивидуума.
Данное изобретение обеспечивает также способ детектирования индивидуума с повышенным риском, который может иметь или может не иметь детектируемого ангиогенез-ассоциированного заболевания и/или состояния, связанного с аномальным уровнем VEGI-192a и/или VEGI-192b, и может проявлять или может не проявлять детектируемые признаки заболевания до лечения способами, описанными здесь. Термин "с повышенным риском" означает, что индивидуум, как было определено на основе общепринятых способов оценки риска, имеет большую вероятность развития симптома или имеет один или более факторов риска, которые коррелируют с развитием ангиогенез-ассоциированного заболевания. Индивидуум, имеющий один или более этих факторов риска, имеет более высокую вероятность развития ангиогенез-ассоциированного заболевания, чем индивидуум без этих факторов риска. Примеры (т.е. категории) групп риска являются хорошо известными в данной области и обсуждаются здесь.
Полинуклеотид VEGI-192a и/или VEGI-192b может быть также использован в качестве зондов для обнаружения присутствия или отсутствия мутаций или полиморфизмов в гене VEGI-192a и/или VEGI-192b, а также любой представляющей интерес последовательности VEGI-192a или VEGI-192b, являющейся или не являющейся мутацией. Мутантные VEGI-192a и/или VEGI-192b могут быть ассоциированы с ангиогенезом или различными нарушениями, связанными с иммунной системой или кровеносной системой. Способы для обнаружения мутантных полинуклеотидных последовательностей хорошо известны в данной области и включают в себя, например, одноцепочечный конформационный полиморфизм (SSCP) и различные способы на основе амплификации последовательности для детектирования мутаций последовательности, в том числе точковых мутаций, например ЛЦР, NASBA, ПЦР, ограниченное удлинение праймеров и т.д. Способы для детектирования измененных белковых последовательностей включают в себя Вестерн-блот-анализ, капиллярный электрофорез, масс-спектроскопию и WAVE. Обычно эксперимент по детектированию выполняют параллельно с контрольным полинуклеотидом или полипептидом VEGI-192a и/или VEGI-192b или, в случае, когда определяются измененные уровни экспрессии, с контрольным образцом, имеющим нормальные уровни полинуклеотида или полипептида VEGI-192a и/или VEGI-192b.
Последовательности данного изобретения являются ценными для хромосомной идентификации. Эта последовательность специфически нацеливается на конкретное местоположение на индивидуальной хромосоме человека и может гибридизоваться с конкретным местоположением на этой хромосоме. Кроме того, в настоящее время существует потребность в идентификации конкретных сайтов на хромосоме. Картирование ДНК относительно хромосом в соответствии с данным изобретением является важной первой стадией в коррелировании этих последовательностей.
Вкратце, последовательности могут быть картированы на хромосомах получением ПЦР-праймеров (предпочтительно 15-25 п.н.) из кДНК. Компьютерный анализ 3'-нетранслируемой области этой последовательности используют для быстрого отбора праймеров, которые не простираются более чем на один экзон в геномной ДНК, что осложнило бы таким образом процесс амплификации. Затем эти праймеры используют для ПЦР-скрининга гибридов соматических клеток, содержащих индивидуальные хромосомы человека. Только гибриды, содержащие ген человека, соответствующий этому праймеру, будут давать амплифицированный фрагмент.
ПЦР-картирование гибридов соматических клеток является быстрой процедурой для отнесения конкретной ДНК к конкретной хромосоме. При помощи данного изобретения с одними и теми же олигонуклеотидными праймерами сублокализация может быть достигнута с панелями фрагментов из специфических хромосом или пулов больших геномных клонов аналогичным образом. Другие стратегии картирования, которые могут быть подобным образом использованы для картирования на хромосоме, включают в себя гибридизацию in situ, предварительный скрининг с мечеными проточно отсортированными хромосомами и предварительную селекцию посредством гибридизации для конструирования библиотек хромосома-специфических кДНК.
Флуоресцентная гибридизация in situ (FISH) кДНК-клона с мазком метафазных хромосом может быть использована для получения точного хромосомного местоположения в одну стадию. Этот способ может быть использован с такой короткой кДНК, как 50 или 60 оснований. В отношении обзора этого способа см. Verma et al., Human Chromosomes: a Manual of Basic Techniques, Pergamon Press, New York (1988).
После того как последовательность картирована в точном положении на хромосоме, это физическое положение этой последовательности на хромосоме может быть скоррелировано с данными генетических карт. Такие данные можно найти, например, в V, McKusick, Mendelian Inheritance in Man. Взаимосвязь между генами и заболеваниями, которые были картированы в одном и том же хромосомном районе, идентифицируют затем с использованием анализа сцепления (совместное наследование физически смежных генов).
Затем необходимо определить различия в кДНК или геномной последовательности между пораженным и непораженным субъектами. Если мутация наблюдается в некоторых или во всех пораженных индивидуумах, но не в любых нормальных субъектах, то эта мутация, по-видимому, является причинным фактором данного заболевания; ген, локализованный в хромосомном районе, ассоциированном с этим заболеванием, мог бы быть одним из 50-500 потенциальных причинных генов. Это предполагает разрешение картирования 1 миллион пар нуклеотидов и один ген на 20 т.п.н. С использованием описанных выше способов было определено, что хромосомное местоположение VEGI было 9q32 с очень высокой доверительной вероятностью. Прежние исследования по хромосомному картированию установили связь нескольких дефектов развития с локусами в этом участке хромосомы 9.
Данное изобретение применимо также для диагностики или лечения различных нарушений, связанных с иммунной системой и кровеносной системой, у млекопитающих, предпочтительно, у людей. Такие нарушения включают в себя инфекции бактериями, вирусами и другими паразитами, иммунодефициты, воспалительные заболевания, лимфоаденопатию, аутоиммунные заболевания, реакцию трансплантат против хозяина и любое нарушение регуляции функции клеток иммунной и кровеносной системы, в том числе, но не только, аутоиммунное заболевание, лейкозы, лимфомы, иммуносупрессию, иммунитет, воспалительное заболевание пищеварительного тракта, миелосупрессию и т.п.
Для ряда нарушений существенно измененные (увеличенные или уменьшенные) уровни экспрессии генов VEGI-192a и/или VEGI-192b могут быть детектированы в различных тканях (например, ткани кровеносной системы) или других клетках или жидкостях тела (например, сыворотках, плазме, моче, синовиальной жидкости или спинальной жидкости), взятых из индивидуума, имеющего такое нарушение, относительно "стандартного" уровня экспрессии генов VEGI- и/или VEGI-192b, т.е. уровня экспрессии VEGI-192a и/или VEGI-192b из индивидуума, не имеющего этого нарушения. Таким образом, данное изобретение обеспечивает диагностический способ, применимый при диагностике связанного с VEGI нарушения, который предусматривает измерение уровня экспрессии гена, кодирующего белок VEGI-192a и/или VEGI-192b, в образце из индивидуума и сравнение измеренного уровня экспрессии гена со стандартным уровнем экспрессии гена VEGI-192a и/или VEGI-192b, так что увеличение или уменьшение уровня экспрессии этого гена в сравнении со стандартом свидетельствует об этом нарушении.
Таким образом, данное изобретение обеспечивает диагностический способ, применимый при диагностике связанного с VEGI нарушения, предусматривающий измерение уровня экспрессии гена, кодирующего белок VEGI-192a и/или VEGI-192b, в образце из индивидуума и сравнение измеренного уровня экспрессии гена со стандартным уровнем экспрессии гена VEGI-192a и/или VEGI-192b, так что увеличение или уменьшение уровня экспрессии этого гена в сравнении со стандартом свидетельствует об этом нарушении.
Если диагноз нарушения уже был поставлен в соответствии с общепринятыми способами, данное изобретение применимо в качестве прогностического индикатора и/или индикатора при мониторинге, так что пациенты, обнаруживающие пониженную экспрессию гена VEGI-192a и/или VEGI-192b, будут испытывать более плохой клинический исход по сравнению с пациентами, экспрессирующими этот ген на уровне, более близком к стандартному уровню.
Способы применения полинуклеотидов, полипептидов и антител: скрининг-анализы
Полинуклеотиды и полипептиды данного изобретения могут быть использованы в качестве исследовательских реагентов и материалов для разработки способов лечения и диагностики заболевания человека.
Данное изобретение обеспечивает способ идентификации агентов, которые модулируют активность VEGI-192a и/или VEGI-192b, способы для идентификации агентов, которые модулируют экспрессию VEGI-192a и/или VEGI-192b в клетке. В некоторых воплощениях этот анализ является бесклеточным анализом. В других вариантах этот анализ является анализом на основе клеток.
В данном контексте термин "модулировать" включает в себя "увеличивать" и "уменьшать". В некоторых воплощениях представляющими особый интерес являются агенты, которые ингибируют активность VEGI-192a и/или VEGI-192b. Такие агенты применимы для стимуляции ангиогенеза. В других воплощениях представляющими интерес агентами являются агенты, которые увеличивают активность VEGI-192a и/или VEGI-192b. Такие агенты представляют интерес для ингибирования ангиогенеза и лечения ангиогенез-ассоциированного заболевания.
Обычно способы скрининга или тестирования используют агенты или лекарственные средства, такие как простая или сложная органическая или неорганическая молекула, пептид, белок, олигонуклеотид, полинуклеотид, углевод или липопротеин. Может быть синтезировано огромное множество соединений, например, олигомеров, таких как олигопептиды и олигонуклеотиды, и синтетических органических соединений на основе различных коровых структур, и они также включены в термин "агент". Кроме того, различные природные источники могут обеспечивать соединения для скрининга, такие как экстракты растений или тканей животных, и т.п. Соединения могут тестироваться отдельно или в комбинации друг с другом.
Данное изобретение обеспечивает способы идентификации агентов, которые модулирует активность VEGI-192a и/или VEGI-192b после связывания с VEGI-192a и/или VEGI-192b. Этот способ обычно предусматривает контактирование тестируемого агента, который селективно связывается с VEGI-192a и/или VEGI-192b, с образцом, содержащим VEGI-192a и/или VEGI-192b; и определение активности VEGI-192a и/или VEGI-192b в присутствии или в отсутствие этих агентов. Увеличение или уменьшение активности VEGI-192a и/или VEGI-192b в присутствии агента в сравнении с отсутствием этого агента свидетельствует о том, что данный агент увеличивает (является агонистом) или уменьшает (является антагонистом) активности VEGI-192a и/или VEGI-192b. Потенциальные агонисты или антагонисты включают в себя небольшие органические молекулы, пептиды, полипептиды и антитела, которые связываются с полипептидом данного изобретения и тем самым увеличивают или уменьшают его активность.
Анализы для испытания способности агента селективно связываться с полипептидом данного изобретения известны в данной области. Например, полипептиды данного изобретения могут быть прикреплены к твердому носителю, и агент, который селективно связывается с этим полипептидом, может быть идентифицирован с использованием способов, известных в данной области. Альтернативно, агонисты и/или антагонисты VEGI-192a и/или VEGI-192b могут быть детектированы объединением VEGI-192a или VEGI-192b и потенциального агониста и/или антагониста с мембраносвязанными рецепторами VEGI-192a или VEGI-192b (если такие рецепторы являются идентифицированными) или рекомбинантными рецепторами в подходящих условиях для анализа конкурентного ингибирования. VEGI-192a или VEGI-192b могут быть мечеными, например, с использованием радиоактивности, так что количество молекул VEGI-192a или VEGI-192b, связанных с рецептором, может определять эффективность потенциального агониста и/или антагониста.
Анализы для испытания активности VEGI известны в данной области. Примеры таких анализов на основе клеток описаны в примерах более подробно, например испытание действия на рост васкулярных эндотелиальных клеток, образование и организацию эндотелиальных клеток в капилляроподобные трубчатые структуры или организацию эндотелиальных клеток в капиллярные сосуды в хориоаллантоисной мембране куриного эмбриона.
Антитела, которые селективно связываются с полипептидами VEGI-192a и/или VEGI-192b, могут быть использованы в качестве антагонистов посредством связывания с VEGI-192a и/или VEGI-192b и предотвращения выполнения ими своей активности.
Данное изобретение обеспечивает также способы для идентификации агентов, которые модулируют активность описанной здесь изоформы VEGI без связывания с этой изоформой VEGI. Такие агенты включают в себя, но не ограничиваются ими, агенты, которые находятся выше (upstream) или ниже (downstream) от активности VEGI в регуляторном каскаде. Эти способы включают в себя анализ активности VEGI в присутствии или в отсутствие испытуемого агента.
Данное изобретение обеспечивает также способы идентификации агентов, которые модулируют уровень мРНК и/или полипептида VEGI, описанных здесь.
Таким образом, данное изобретение обеспечивает способ идентификации агента, который модулирует уровень экспрессии VEGI в клетке, причем этот способ предусматривает: контактирование испытуемого агента-кандидата с клеткой, содержащей нуклеиновую кислоту, которая кодирует описанный здесь полипептид VEGI, и определение действия указанного агента на экспрессию полипептида VEGI. В некоторых воплощениях это действие измеряют детектированием уровня мРНК, кодирующей полипептид VEGI, с использованием описанных здесь полинуклеотидов VEGI. В других воплощениях это действие измеряют детектированием уровня полипептида VEGI с использованием описанных здесь антител.
Другие потенциальные антагонисты включают в себя антисмысловые молекулы. Антисмысловая технология может быть использована для контроля экспрессии генов через антисмысловую ДНК или РНК или через образование тройной спирали. Антисмысловые способы обсуждаются в ряде исследований (например, Okano, J.Neurochem. 56:560 (1991); "Oligodesoxynucleotides as Antisense Inhibitors of Gene Expression." CRC Press, Boca Raton, Fla. (1988)). Образование тройной спирали обсуждается также в ряде исследований (например, Lee, et al., Nucleic Acids Research 6:3073 (1979); Cooney, et al.. Science 241:456 (1988); Dervan, et al.. Science 251:1369 (1991)). Эти способы основаны на связывании полинуклеотида с комплементарной ДНК или РНК. Например, 5'-кодирующая часть полинуклеотида, которая кодирует зрелый полипептид данного изобретения, может быть использована для конструирования антисмыслового РНК-олигонуклеотида с длиной приблизительно 10-40 п.н. ДНК-олигонуклеотид конструируют таким образом, чтобы он был комплементарным участку гена, участвующему в транскрипции, предотвращая тем самым транскрипцию и продукцию VEGI-192a и/или VEGI-192b. Антисмысловой РНК-олигонуклеотид гибридизуется с мРНК in vivo и блокирует трансляцию молекулы мРНК в полипептид VEGI-192a и/или VEGI-192b. Описанные выше олигонуклеотиды могут также доставляться в клетки, так что эта антисмысловая РНК или ДНК может экспрессироаться in vivo для ингибирования продукции полипептида VEGI-192a и/или VEGI-192b.
Данное изобретение обеспечивает также способы идентификации таких агентов, как мутанты или варианты VEGI-192a и/или VEGI-192b, которые могут конкурировать за связывание с мишенями, с которыми связывается VEGI-192a и/или VEGI-192b, и препятствуют взаимодействию VEGI-192a и/или VEGI-192b с их мишенями. Такие мутанты или варианты могут быть агонистами или антагонистами VEGI-192a и/или VEGI-192b.
Данное изобретение обеспечивает способ идентификации агентов, которые связываются с VEGI-192a и/или VEGI-192b, предусматривающий контактирование этих агентов с VEGI-192a и/или VEGI-192b и затем детектирование связывания агентов с VEGI-192a и/или VEGI-192b.
Способы применения полинуклеотидов, полипептидов и антител: лечение заболеваний
Данное изобретение обеспечивает способы ингибирования роста васкулярных эндотелиальных клеток, ингибирования ангиогенеза, для лечения или ослабления заболеваний и процессов, которые опосредованы неконтролируемым ангиогенезом, для лечения рака, например супрессии роста опухолей. В противоположность утверждениям, что VEGI-251 является мембраносвязанным белком, примеры показывают, что VEGI-251 является секретируемым белком, ингибирует рост васкулярных эндотелиальных клеток и оказывает антиангиогенное действие при экспрессии. Кроме того, пример показывает также, что VEGI-192a ингибирует рост васкулярных эндотелиальных клеток.
Таким образом, композиции, которые могут быть использованы для этого способа данного изобретения, включают в себя, но не ограничиваются ими, описанные здесь полинуклеотиды, такие как полинуклеотиды, кодирующие полипептиды SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6; описанные здесь полипептиды, такие как полипептиды SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит одну или более аминокислот из района аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6; и агонист или антагонист описанных здесь полипептидов VEGI, такой как антитело, которое блокирует активность полипептида VEGI.
Данное изобретение включает в себя также способы задержки развития ангиогенез-ассоциированного заболевания в индивидууме.
Полипептиды изоформ VEGI данного изобретения (и полинуклеотиды, кодирующие полипептиды изоформ VEGI) могут быть использованы для уменьшения образования капилляроподобных трубчатых структур, образуемых эндотелиальными клетками in vitro. Полипептиды изоформ VEGI данного изобретения могут быть использованы для ингибирования образования эндотелиальных клеток, организованных в капилляроподобные трубчатые структуры, в ответ на ангиогенные факторы, такие как FGF-2. Кроме того, описанные здесь изолированные полипептиды изоформ VEGI данного изобретения могут быть также использованы для ингибирования роста и организации эндотелиальных клеток в капиллярные сосуды в модифицированной хориоаллантоисной мембране куриного эмбриона (САМ). В результате полипептиды изоформ VEGI данного изобретения могут быть использованы для ингибирования образования капилляров или капилляроподобных структур из эндотелиальных клеток in vitro.
Должно быть понятно, что состояния, вызываемые уменьшением стандартного или нормального уровня активностей полипептидов изоформ VEGI в индивидууме, в частности нарушений иммунной и кровеносной систем, могут лечиться введением описанных здесь полипептидов изоформ VEGI (или полинуклеотидов, кодирующих полипептиды изоформ VEGI). Таким образом, данное изобретение обеспечивает также способ лечения индивидуума, нуждающегося в увеличенном уровне активности изоформ VEGI, предусматривающий введение такому индивидууму фармацевтической композиции, содержащей количество изолированного полипептида изоформы VEGI (или полинуклеотида) данного изобретения, такого как зрелая форма полипептида изоформы VEGI данного изобретения, эффективное для увеличения уровня активности полипептида изоформы VEGI в таком индивидууме. Данное изобретение обеспечивает также способ лечения индивидуума, нуждающегося в уменьшенном уровне активности изоформы VEGI, предусматривающий введение такому индивидууму фармацевтической композиции, содержащей количество антагониста изоформы VEGI, такого как антитело, специфичное в отношении изоформы VEGI, которое блокирует активность изоформы VEGI, эффективное для уменьшения уровня активности полипептида изоформы VEGI, в таком индивидууме.
Доставка на основе полинуклеотида
В некоторых воплощениях данное изобретение включает в себя способ ингибирования ангиогенеза в ткани или клетке, состоящий в том, чтобы вызвать, чтобы эффективное количество полипептида, имеющего аминокислотную последовательность SEQ ID NO:4 или SEQ ID NO:5, или SEQ ID NO:6, или укороченной формы, которая содержит, по меньшей мере, одну или более аминокислот из участка аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6, вошло в контакт с тканью или клеткой или было экспрессировано вблизи от ткани или клетки, так что ангиогенез ингибируется. В некоторых воплощениях данное изобретение включает в себя способ ингибирования ангиогенеза, предусматривающий введение индивидууму, такому как человек или животное, композиции, содержащей молекулу нуклеиновой кислоты, кодирующую полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит, по меньшей мере, одну или более аминокислот из участка аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6 в дозе, достаточной для ингибирования ангиогенеза. В некоторых воплощениях молекула нуклеиновой кислоты функционально связана с регуляторной последовательностью, которая управляет экспрессией гена. Такие регуляторные последовательности известны в данной области.
Индивидуумом является животное, в некоторых воплощениях индивиддумом может быть млекопитающее.
Данное изобретение обеспечивает также способ лечения или ослабления заболевания и процессов, которые опосредованы неконтролируемым ангиогенезом, предусматривающий стадию введения индивидууму, такому как человек или животное, композиции, содержащей молекулу нуклеиновой кислоты, кодирующей полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит, по меньшей мере, одну или более аминокислот из участка аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6 в дозе, достаточной для регуляции ангиогенеза. В некоторых воплощениях молекула нуклеиновой кислоты функционально связана с регуляторной последовательностью, которая управляет экспрессией гена.
Данное изобретение обеспечивает также способ лечения рака или супрессии роста опухоли, предусматривающий стадию введения индивидууму, такому как человек или животное, композиции, содержащей молекулу нуклеиновой кислоты, кодирующей полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит, по меньшей мере, одну или более аминокислот из района аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6 в дозе, достаточной для супрессии роста опухоли. В некоторых вариантах молекула нуклеиновой кислоты функционально связана с регуляторной последовательностью, которая управляет экспрессией гена.
Понятно, что, если используют укороченную форму VEGI и укорочение имеет место по секреторной сигнальной последовательности, эта укороченная форма включает в себя секреторную сигнальную последовательность, гомологичную или гетерологичную, для управления секрецией этого белка. Гетерологичные секреторные сигнальные последовательности известны в данной области.
Способы доставки полинуклеотидов для экспрессии в индивидууме (как ex vivo, так и in vivo) известны в данной области. Обычно готовят и вводят подходящую полинуклеотидную векторную конструкцию.
Может быть использована нацеленная доставка терапевтических композиций, содержащих полинуклеотиды, экспрессирующий вектор или субгеномные полинуклеотиды. Способы опосредованной рецептором доставки ДНК описаны, например, Findeis et al., Trends Biotechnol. (1993) 11:202; Chiou et al., Gene Therapeutics: Methods And Applications Of Direct Gene Transfer (J.A.Wolff, ed.) (1994); Wu et al., J.Biol.Chem. (1994) 269-542; Zenke et al., Proc.Natl.Acad.Sci. USA (1990) 87:3655; Wu et al., J.Biol.Chem. (1991) 266:338. Терапевтические композиции, содержащие полинуклеотид, могут вводиться в диапазоне приблизительно 100 нг - приблизительно 200 мг ДНК для местного введения в протоколе генотерапии. Диапазоны концентраций приблизительно 500 нг - приблизительно 50 мг, приблизительно 1 мкг - приблизительно 2 мг, приблизительно 5 мкг - приблизительно 500 мкг и приблизительно 20 мкг - приблизительно 100 мкг ДНК могут быть также использованы в протоколе генотерапии. Терапевтические полинуклеотиды данного изобретения могут доставляться с использованием векторов для доставки генов. Вектор для доставки генов может быть вирусного или невирусного происхождения (см., в общем виде, Jolly, Cancer Gene Therapy (1994) 1:51; Kimura, Human Gene Therapy (1994) 5:845; Connelly, Human Gene Therapy (1995) 1:185 и Kaplitt, Nature Genetics (1994) 6:148). Экспрессия таких кодирующих последовательностей может индуцироваться с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Экспрессия кодирующей последовательности может быть либо конститутивной, либо регулируемой.
Векторы на основе вирусов для доставки желаемого полинуклеотида и экспрессии в желаемой клетке хорошо известны в данной области. Примеры векторов на основе вирусов включают в себя, но не ограничиваются ими, рекомбинантные ретровирусы (см., например, публикации РСТ с номерами WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; WO 93/10218; WO 91/02805; патенты США с номерами 5219740 и 4777127; патент Великобритании №2200651 и ЕР 0345242), векторы на основе альфавирусов (например, векторы вируса Синдбис, вируса леса Семлики (АТСС VR-67; ATCC VR-1247), вируса реки Росс (АТСС VR-373; ATCC VR-1246) и вируса Венесуэльского лошадиного энцефалита (ANCC VR-923; ATCC VR-1250; ATCC VR-1249; ATCC VR-532) и векторы на основе аденоассоциированного вируса (AAV) (см., например, публикации РСТ с номерами WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655). Можно также использовать введение ДНК, связанной с убитым аденовирусом, как описано в Curiel, Hum. Gene Ther. (1992) 3:147.
Могут также использоваться невирусные векторы и способы, в том числе, но не только, конденсированная с поликатионами ДНК, связанная или не связанная только с убитым аденовирусом (см., например, Curiel, Hum. Gene Ther. (1992) 3:147); лиганд-связанная ДНК (см., например, Wu, J.Biol.Chem. (1989) 264:16985); векторы доставки на основе эукариотических клеток (см., например, патент США № 5814482; публикации РСТ с номерами WO 95/07994; WO 96/17072; WO 95/30763 и WO 97/42338) и нейтрализация заряда нуклеиновой кислоты или слияние с клеточными мембранами. Может также использоваться "голая" ДНК. Примеры способов введения "голой" ДНК описаны в публикации РСТ №WO 90/11092 и патенте США №5580859. Липосомы, которые могут действовать в качестве векторов доставки генов, описаны в патенте США 5422120; публикациях РСТ с номерами WO 95/13796; WO 94/23697; WO 91/14445 и ЕР 0524968. Дополнительные подходы описаны в Philip, Mol. Cell Biol. (1994) 14:2411 и в Woffendin, Proc.Natl.Acad.Sci. USA (1994) 91:1581.
Так, например, могут быть сконструированы клетки от пациента с полинуклеотидом (ДНК или РНК), кодирующим такой полипептид, как VEGI-251, ex vivo, причем эти сконструированные клетки вводят пациенту, который должен лечиться этим полинуклеотидом. Такие способы хорошо известны в данной области и являются очевидными из приведенных здесь описаний. Например, могут быть сконструированы клетки с использованием вирусной или ретровирусной частицы, содержащей ДНК или РНК, кодирующие полипептид данного изобретения.
Подобным образом клетки могут быть сконструированы in vivo для экспрессии полипептида in vivo, например, процедурами, известными в данной области. Например, клетка-продуцент для продуцирования ретровирусной частицы, содержащей РНК, кодирующей полипептид данного изобретения, может вводиться пациенту для конструирования клеток in vivo и экспрессии этого полипептида in vivo. Эти и другие способы введения полипептида данного изобретения таким способом должны быть очевидными для специалистов с квалификацией в данной области из описаний данного изобретения. Например, экспрессирующий вектор для конструирования клеток может быть другим, чем ретровирус, например аденовирусом, который может быть использован для конструирования клеток in vivo после объединения с подходящим средством доставки.
Ретровирусы, из которых могут быть произведены ретровирусные плазмидные векторы, включают в себя, но не ограничиваются ими, вирус мышиного лейкоза Молони, вирус некроза селезенки, ретровирусы, такие как вирус саркомы Рауса, вирус саркомы Гарвея, вирус лейкоза птиц, вирус лейкоза гиббона, вирус иммунодефицита человека, аденовирус, вирус миелопролиферативной саркомы и вирус опухоли молочной железы. В одном воплощении ретровирусный плазмидный вектор получают из вируса мышиного лейкоза Молони.
Вектор обычно включает в себя один или более промоторов. Подходящие промоторы, которые могут быть использованы, включают в себя, но не ограничиваются ими, ретровирусный LTR, промотор SV40 и промотор цитомегаловируса человека (CMV), описанный Миллером и сотр. (Biotechniques 7:980-990 (1989), или любой другой промотор (например, клеточные промоторы, такие как промоторы эукариотических клеток, в том числе, но не только, промоторы гистонов, pol III и β-актина). Другие вирусные промоторы, которые могут быть использованы, включают в себя, но не ограничиваются ими, промоторы аденовирусов, промоторы тимидинкиназы (ТК) и промоторы парвовируса В19. Выбор подходящего промотора будет очевидным специалистам с квалификацией в данной области из содержащихся здесь объяснений.
Последовательность нуклеиновой кислоты, кодирующая полипептид данного изобретения, находится под контролем подходящего промотора. Подходящие промоторы, которые могут быть использованы, включают в себя, но не ограничиваются ими, аденовирусные промоторы, такие как аденовирусный основной поздний промотор, или гетерологичные промоторы, такие как промотор цитомегаловируса человека (CMV), промотор респираторно-синцитиального вируса (RSV), индуцибельные промоторы, такие как промотор ММТ, промотор металлотионеина, промоторы теплового шока, промотор альбумина, промотор ApoAI, промоторы глобина человека, вирусные промоторы тимидинкиназы, такие как промотор тимидинкиназы вируса простого герпеса, ретровирусные LTR (в том числе модифицированные ретровирусные LTR, описанные здесь), промотор β-актина и промоторы гормона роста человека. Промотором может быть также природный промотор, который контролирует ген, кодирующий этот полипептид.
При выборе системы ретровирусного вектора ретровирусный плазмидный вектор используют для трансдукции линий упаковывающих клеток для образования линии клеток-продуцентов. Примеры упаковывающих клеток, которые могут быть трансфицированы, включают в себя, но не ограничиваются ими, линии клеток РЕ501, РА317, b-2, b-AM, PA12, Т19-14Х, VT-19-17-H2, CRE, beta-CRIP, GP+E-86, GP+envAm12 и DAN, описанные в статье Miller (Human Gene Therapy 1:5-14 (1990), включенной здесь путем отсылки в ее полном виде. Этот вектор может трансдуцировать упаковывающие клетки любыми способами, известными в данной области. Такие способы включают в себя, но не ограничиваются ими, электропорацию, применение липосом и осаждение CaPO4. В одной альтернативе ретровирусный плазмидный вектор может быть инкапсулирован в липосому или связан с липидом и затем введен в хозяина.
Линия клеток-продуцентов вырабатывает инфекционные ретровирусные векторные частицы, которые включают в себя последовательность (последовательности) нуклеиновой кислоты, кодирующей эти полипептиды. Такие ретровирусные векторные частицы могут быть затем использованы для трансдукции эукариотических клеток in vitro или in vivo. Трансдуцированные эукариотические клетки будут экспрессировать последовательность (последовательности) нуклеиновой кислоты, кодирующей этот полипептид. Эукариотические клетки, которые могут быть трансдуцированы, включают в себя, но не ограничиваются ими, эмбриональные стволовые клетки, эмбриональные клетки карциномы, а также гемопоэтические стволовые клетки, гепатоциты, фибробласты, миобласты, кератиноциты, эндотелиальные клетки и бронхиальные эпителиальные клетки.
Эти общие принципы применимы также для других систем доставки на основе вирусов, таких как AAV.
Доставка полипептидов
Данное изобретение обеспечивает также способ ингибирования ангиогенеза, предусматривающий введение индивидууму, такому как человек или животное, описанного здесь полипептида, такого как полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченной формы, которая содержит, по меньшей мере, одну или более аминокислот из района аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6, в дозе, достаточной для ингибирования ангиогенеза.
Данное изобретение обеспечивает также способ для лечения или ослабления заболевания и процессов, которые опосредованы неконтролируемым ангиогенезом, предусматривающий стадию введения индивидууму, такому как человек или животное, композиции, содержащей полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит, по меньшей мере, одну или более аминокислот из района аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6, в дозе, достаточной для контроля ангиогенеза.
Данное изобретение обеспечивает также способ лечения рака или супрессии роста опухоли, предусматривающий стадию введения индивидууму, такому как человек или животное, композиции, содержащей полипептид SEQ ID NO:4, SEQ ID NO:5 или SEQ ID NO:6, или укороченную форму, которая содержит, по меньшей мере, одну или более аминокислот из района аминокислот 1-26 SEQ ID NO:4, аминокислот 1-26 SEQ ID NO:5 или аминокислот 1-85 SEQ ID NO:6, в дозе, достаточной для супрессии роста опухоли.
Способы для определения активности полипептида VEGI (в том числе укороченной формы VEGI) хорошо известны в данной области и подробно описаны в примерах, таких как испытание действия на рост васкулярных эндотелиальных клеток, образование капилляроподобных трубок, рост капилляров в коллагеновых гелях, помещенных на хориоаллантоисную мембрану куриного эмбриона, рост опухолей ксенотрансплантатов.
В данном контексте термин "ангиогенез-ассоциированное заболевание" означает заболевание или состояние, которое ассоциировано с нежелательным и/или нерегулируемым ангиогенезом, или заболевание или состояние, для которого является выгодным ингибирование ангиогенеза. Он включает в себя заболевание и процессы, опосредованные нежелательным и/или неконтролируемым ангиогенезом. Примеры таких ангиогенез-ассоциированных заболеваний, таких как рост опухоли, описаны здесь.
Полипептиды изоформ VEGI, описанные здесь, могут быть использованы для ингибирования пролиферации эндотелиальных клеток, например эндотелиальных клеток аорты. Таким образом, полипептид VEGI-192a и/или VEGI-192b может быть использован для лечения заболеваний и нарушений, в которых является выгодным ингибирование роста эндотелиальных клеток.
Композиция полипептида изоформ VEGI будет составляться и вводиться в соответствии с хорошей медицинской практикой, с учетом клинического состояния индивидуального пациента (особенно побочных действий лечения только полипептидами изоформ VEGI), места доставки композиции полипептида изоформы VEGI, способа введения, схемы введения и других факторов, известных практикующим врачам. Таким образом, "эффективное количество" полипептида изоформы VEGI для указанных здесь целей определяется с учетом таких соображений.
Полипептиды изоформ VEGI и агонисты и антагонисты данного изобретения могут использоваться в комбинации с подходящим фармацевтическим носителем. Такие композиции обычно содержат терапевтически эффективное количество этого соединения и фармацевтически приемлемый носитель или наполнитель. Такой носитель включает в себя, но не ограничивается ими, солевой раствор, забуференный солевой раствор, глюкозу, воду, глицерин, этанол и их комбинации. Эта форма должна подходить для конкретного способа (схемы) введения.
Данное изобретение обеспечивает также фармацевтическую упаковку или набор, содержащий один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций данного изобретения. К таким контейнерам может быть приложена инструкция в форме, предписываемой государственным ведомством, регулирующим производство, применение или продажу фармацевтических средств или биологических продуктов, которая отражает одобрение этим ведомством изготовление, использование или продажу для введения человеку. Кроме того, фармацевтические композиции данного изобретения могут быть использованы вместе с другими терапевтическими соединениями.
Фармацевтические композиции могут вводиться подходящим образом, например местным, внутривенным, внутрибрюшинным, внутримышечным, подкожным, интраназальным или интрадермальным способами. Фармацевтические композиции вводят в количестве, которое является эффективным для лечения и/или профилактики конкретного показания. Обычно их вводят в количестве, по меньшей мере, приблизительно 10 г/кг массы тела и в большинстве случаев их вводят в количестве, не превышающем приблизительно 8 мг/кг массы тела в сутки. В большинстве случаев эта доза равна приблизительно 10 г/кг - приблизительно 1 мг/кг массы тела в сутки с учетом способов введения, симптомов и т.д.
Различные системы доставки известны и могут быть использованы для введения полипептидов изоформ VEGI данного изобретения, например инкапсулирование в липосомах, микрочастицах, микрокапсулах, опосредованный рецептором эндоцитоз (см., например, Wu and Wu 1987, J.Biol.Chem. 262:4429-4432). Способы введения включают в себя, но не ограничиваются ими, местный, интрадермальный, внутримышечный, внутрибрюшинный, внутивенный, подкожный, интраназальный, эпидуральный, офтальмический и пероральный способы. Эти соединения могут вводиться любым общепринятым способом, например инфузией или болюсной инъекцией, посредством абсорбции через эпителиальные или слизисто-кожные выстилки (например, слизистую оболочку полости рта, ректальную слизистую оболочку и кишечную слизистую оболочку и т.д.), и могут вводиться вместе с другими биологически активными агентами.
В конкретном варианте может быть желательным введение фармацевтических композиций данного изобретения локально в зону, нуждающуюся в лечении. Это может выполняться, например, и без ограничения, локальной инфузией во время хирургии, местным нанесением, например при проведении наложения повязки на рану, инъекцией, посредством катетера, посредством суппозитория или посредством трансплантата, причем указанный трансплантат является пористым, непористым или гелеобразным материалом, в том числе мембранами, такими как мембраны или волокна из эластомера силастика.
Оценку заболевания выполняют с использованием стандартных способов, известных в данной области, таких как способы получения изображения и мониторинга подходящих маркеров.
Специалисту с квалификацией в данной области должно быть понятно, что, поскольку полипептиды изоформ VEGI данного изобретения являются членами TNF-семейства, зрелая секретируемая форма этого белка может высвобождаться в растворимой форме из клеток, которые экспрессируют описанные здесь полипептиды изоформ VEGI, посредством протеолитического расщепления. Таким образом, когда эта зрелая форма или растворимый внеклеточный домен полипептидов изоформ VEGI добавляется из экзогенного источника к клеткам, тканям или телу индивидуума, этот полипептид будет проявлять свои физиологические активности на своих клетках-мишенях этого индивидуума. Клетки, экспрессирующие этот трансмембранный полипептид типа II, могут быть также добавлены к клеткам, тканям или в тело индивидуума, и эти добавленные клетки будут связываться с клетками, экспрессирующими рецептор описанных здесь полипептидов изоформ VEGI, вследствие чего клетки, экспрессирующие полипептиды изоформ VEGI, могут оказывать действие (например, регуляцию роста и регуляцию эндотелиальных клеток) на несущие рецепторы клетки-мишени.
Как указывалось выше, известно, что VEGI оказывает сильные антипролиферативные эффекты в отношении роста эндотелиальных клеток. Таким образом, VEGI может также использоваться для регуляции развития эндотелиальных клеток из гемопоэтических и циркулирующих эндотелиальных клеток-предшественников.
Таким образом, данное изобретение обеспечивает способы усиления ангиогенеза, предусматривающие введение ингибитора VEGI-192a и/или VEGI-192b, так что ангиогенез усиливается. Такое усиление может быть желательным, например, в контексте состояний, ассоциированных с обструкцией кровеносного сосуда, например, при ишемических состояниях или сердечных приступах. Эти формы могут вводиться локально или системно с использованием известных в данной области способов.
Антитело данного изобретения, которое блокирует или подавляет активность полипептида VEGI, может быть использовано для стимуляции или усиления ангиогенеза.
Примеры
Ниже описаны примеры данного изобретения, которые приведены только для иллюстративных целей, а не для ограничения данного изобретения. В свете данного описания многочисленные воплощения в рамках прилагаемой формулы изобретения будут очевидными для специалистов с обычной квалификацией в данной области.
Данное изобретение будет далее описано со ссылкой на следующие примеры, однако, должно быть понятно, что данное изобретение не ограничивается такими примерами.
Недавно было сообщено об открытии специфического для эндотелиальных клеток генного продукта, ингибитора роста васкулярных эндотелиальных клеток (VEGI) (Zhai Y, et al., FASEB J., 13:181-189, 1999; Zhai, Y, et al., Int. J. Cancer, 82:131-136, 1999). Этот белок состоит из 174 аминокислот, т.е. VEGI-174, с 20-30% гомологией последовательности относительно членов суперсемейства TNF. Нозерн-блоттинг-анализ большого спектра клеточных линий и первичных культур клеток показывает, что ген VEGI-174 экспрессируется преимущественно в эндотелиальных клетках. Кроме того, мРНК VEGI-174 детектируется во многих органах взрослого человека, что предполагает физиологическую роль этого гена в нормальной сосудистой сети. Функцию VEGI-174 исследовали на ряде клеточных и животных моделей. Рекомбинантная укороченная форма VEGI-174 ингибировала пролиферацию эндотелиальных клеток с высокой эффективностью, но не действовала на рост любых других типов исследованных клеток. Укороченная форма этого белка ингибировала также образование калилляроподобных структур эндотелиальными клетками в коллагеновых гелях и прорастание капилляров в коллагеновые гели, помещенные на хориоаллантоисную мембрану куриного эмбриона. Сверхэкспрессия секретируемой формы VEGI-174 в раковых клетках ободочной кишки мыши (МС-38) почти полностью предотвращала рост опухолей этих клеток в сингенных мышах C57/BL. Кроме того, совместная инокуляция клеток рака молочной железы человека с клетками яичника китайского хомячка, сверхэкспрессирующими секретируемую форму VEGI-174, приводила к заметному ингибированию роста опухолей ксенотрансплантатов рака молочной железы в голых мышах.
Пример 1. ELISA-анализ сывороток человека
Нормальные сыворотки человека здоровых взрослых индивидуумов мужского и женского пола получали из банка сывороток Lombardi Cancer Center. Для измерения содержания VEGI в сыворотках использовали сэндвич-ELISA. Образцы сывороток (100 мкл) или варьирующие количества рекомбинантного белка VEGI в 3% БСА добавляли в 96-луночные планшеты, покрытые поликлональным анти-VEGI-антителом, и блокировали 3% БСА. Добавляли моноклональное антитело (100 мкл, 2 мкг/мл) против VEGI (3-12D). Добавляли биотинилированное антитело против мышиного IgG (2 мкг/мл. Vector laboratories, Burlingame, CA) с последующим добавлением комплекса авидин-пероксидаза хрена с 3,3',5,5'-тетраметилбензидином (Vector laboratories) в качестве субстрата. Эти пробы инкубировали при комнатной температуре в течение 10 минут, реакцию останавливали 50 мкл 1М H2SO4, затем анализировали при 450 нм с использованием спектрофотометрического планшет-ридера с применением стандартной кривой у=-0,72+0,409·log(x). Использовали диапазон стандартного белка 0,32-1000 нг/мл.
Пример 2. Нозерн-блоттинг
Нозерн-блоты множества тканей и дот-блот-панели множества тканей (Clontech, Palo Alto, CA) гибридизовали в растворе ExpressHyb (Clontech) с двухцепочечными кДНК-зондами. Полноразмерным используемым VEGI-174-зондом был кДНК-фрагмент HindIII-BamHI (номер доступа GenBank AF03990) в pCDNA3.1 (Invitrogen, Carlsbad, CA). Для изоформа-специфичных зондов с использованием ПЦР-амплификации получали матрицу VEGI-251 297 п.н., кодирующую 99 N-концевых аминокислот, и метили 32P-dCTP с использованием метода случайной затравки (Life Technologies, Invitrogen, CA). VEGI-174-специфичный зонд, соответствующий 22 N-концевым аминокислотам, получали посредством концевого мечения ПЦР-продукта 66 п.н. Эти блоты гибридизовали при 42°С в течение ночи и отмывали в промывочном буфере 1 (2 X SSC, 0,1% лаурилсульфат натрия) и промывочном буфере 2 (1 X SSC, 1% ДСН) при 42°С с последующей радиоавтографией при -70°С с усиливающим экраном.
Пример 3. 5'RACE и клонирование изоформ VEGI
5'-последовательности VEGI амплифицировали из панели RACE множества тканей (ORIgene, Rockville, MD) в соответствии с инструкциями изготовителя. Эта панель содержит образцы кДНК, полученные из 24 отдельных тканей человека, с адаптером, лигированным с 5'-концами этих кДНК. Два раунда "гнездовой" (nested) ПЦР проводили с использованием двух пар олигонуклеотидных праймеров. В первом раунде ПЦР использовали адапторный праймер ADP1, 5' CGGAATTCGT CACTCAGCG 3' (SEQ ID NO:8) и VEGI-ген-специфичный праймер GSP1, 5' CCCGGATCCT ATAGTAAGAA GGCTCC 3' (SEQ ID NO:9). Затем продукты реакции разбавляли 1:10 водой. Затем разбавленные ПЦР-образцы использовали для второго раунда ПЦР с другим адапторным праймером, ADP2 5' AGCGCGTGAA TCAGATCG 3' (SEQ ID NO:10) и VEGI-ген-специфичным праймером GSP2, 5' CGGTGGATCC CGAGTTTGTC TCACAACTG 3' (SEQ ID NO:11). Продукты ПЦР разделяли в агарозном геле, очищали и секвенировали на автоматическом синтезаторе ABI.
Пример 4. Выделение VEGI-251 и VEGI-192a
Ген-специфичные праймеры, сконструированные в соответствии с результатами секвенирования продуктов RACE, использовали для повторения второго раунда ПЦР для подтверждения идентичности их последовательностей. Затем очищенные в геле продукты RACE клонировали в плазмиду pCR3.1 (Invitrogen, Frederick, MD) и секвенировали. На основе этих последовательностей конструировали специфичные для изоформ праймеры. Общий обратный праймер Vg161 (161), 5' GTGTAATCCA CCAAAGAG 3' (SEQ ID NO:12) использовали с прямыми праймерами, перечисленными в таблице 8.
Пример 5. Культура клеток и обработка TNFα
Эндотелиальные клетки пупочной вены человека (HUVE) и эндотелиальные клетки фетального бычьего сердца (FBHE) получали от Clonetics (Walkersville, MD) и выращивали в EGM-2 (Clonetics). Дермальные микроваскулярные эндотелиальные клетки человека (HMVE), эндотелиальные клетки коронарной артерии человека (НСАЕ) и клетки NIH3T3 получали из Американской Коллекции Типовых Культур (АТСС) и выращивали в EGM2-MV (Clonetics). Эндотелиальные клетки аорты взрослых коров (АВАЕ) и эндотелиомы головного мозга мышей bEND.3, которые были любезным подарком доктора Peter Bohlen из ImClone Inc. New York, NY. Клетки гладких мышц коронарной артерии человека (HCASM) (Clonetics) и клетки АВАЕ культивировали в IMEM (Biofluids, Biosource International, Camarillo, CA), 10% ФТС, 1 нг/мл фактора-2 роста фибробластов (Promega, Madison, WI). ЕА.Ну926, линия клеток, полученная из эндотелиальных клеток человека, была подарком доктора Cora-Jean Edgell, University of North Carolina. Эти клетки вместе с bEND.3 мозга мышей и линиями клеток эндотелиомы H5V поддерживали в IMEM с 10% ФТС. Субконфлюэнтные клетки, выращиваемые в чашках 100 мм, обрабатывали различными дозами фактора а некроза опухолей (TNFα) (Biosource International, Camarillo, CA) перед анализом РНК.
Пример 6. Анализы защиты от рибонуклеазы
Для зондов, специфичных в отношении конкретных изофом, получали при помощи ПЦР кДНК-фрагменты из VEGI-174 (862-1062 р.н.), VEGI-251 (1-160 п.н.), VEGI-192a (277-656 п.н.) человека и встраивали между сайтами EcoRI и NotI pcDNA3 (Invitrogen) в антисмысловом направлении. Зонд на ген мышиного β-актина (824-942) клонировали в pSP72 (Promega) между сайтами HindIII и BamHI. VEGI- и β-актин-матрицы линеаризовали с использованием HindIII и EcoRI, соответственно. Антисмысловые run-off зонды синтезировали с использованием РНК-полимеразы SP6 с применением набора для транскрипции Maxiscript (Ambion, Woodward TX). Для защиты от нуклеазы с использованием набора RPAIII (Ambion, TX) 15-20 мкг тотальной РНК гибридизовали в течение ночи с 1-3×105 имп/мин каждого зонда при 52°С. Расщепление РНКазой выполняли с разведением 1:100 смеси РНКазы А/Т1 (Ambion) в течение 30 минут при 37°С. Продукты расщепления осаждали, разделяли в 6% полиакриламидном геле и подвергали радиоавтографии при -70°С.
Пример 7. Анализ структуры гена
Организацию гена VEGI человека анализировали при помощи ПЦР с использованием клона бактериальной искусственной хромосомы (ВАС) (Genome Systems, Inc. St. Louis, МО). Конструировали ПЦР-праймеры из экзонных последовательностей, которые давали перекрывающиеся продукты ПЦР. Эти продукты ПЦР секвенировали для определения их относительных положений. Праймеры для интронного района конструировали на основе записи GenBank для контига NT_017569 хромосомы 9, которые соответствуют последовательностям между основаниями 2643881 и 2694724. Они приведены в списке в таблице 9. С использованием ДНК плаценты человека в качестве матрицы проводили сверхдлинную ПЦР с применением ПЦР-набора rTth XL от Perkin Elmer (Foster City, CA) и следующих условий для сверхдлинной ПЦР: 95°С, 1 мин, 97°С, 15 сек, 60,5°С, 10 мин, 17 циклов; 97°С, 15 сек, 60,5°С, 10 мин плюс 15 сек удлинение, 13 циклов с последующим конечным удлинением при 72°С в течение 11 мин. Эти ПЦР-фрагменты получали с использованием пар праймеров, показанных в таблице 9. Эти ПЦР-продукты секвенировали.
Продукт ПЦР 2b также секвенировали с использованием праймеров 61, 57, 51 и 53.
Пример 8. Экспрессионные плазмиды и транзиторные трансфекции
Открытые рамки считывания VEGI-H4 и VEGI-251 инсертировали в pcDNA3.1-myc (Invitrogen, MD) для получения пептидов, несущих С-концевую myc-метку. Полученные плазмиды трансфицировали в клетки АВАЕ и HUVE для исследований клеточной локализации. Для трансфекции клеток 3×104 клеток высевали на покровное стекло (Lab-Tek chambered coverglass (Nalge, Naperville, IL) и выдерживали в течение ночи. Плазмидную ДНК (400 нг) в 25 мкл бессывороточной IMEM смешивали с реагентом PLUS (4 мкл) (Gibco-BRL). Реагент липофектамин (Gibco) (1 мкл) был 200-кратным, и его смешивали с раствором ДНК в течение 15 минут. Затем комплекс ДНК-липофектамин добавляли к клеткам с 200 мкл IMEM и инкубировали при 37°С в течение 3 часов. Этим клеткам давали восстановиться в содержащей сыворотку культуральной среде в течение 36 часов перед иммуноокрашиванием и последующей флуоресцентной микроскопией. Полноразмерный кодирующий район VEGI-174 или VEGI-251 также встраивали между сайтами EcoRI и BamHI pEGFP-C2 (Clontech) для получения слитых белков GFP-VEGI. Слитые конструкции GFP-VEGI трансфицировали в клетки АВАЕ, как описано выше. Спустя 48 часов после трансфекции клеточную локализацию этих слитых белков исследовали с использованием флуоресцентной микроскопии.
Пример 9. Иммуноокрашивание для субклеточной локализации
Трансфицированные клетки аорты взрослой коровы (АВАЕ) и клетки HUVE промывали ЗФР и фиксировали смесью 3,7% параформальдегид/0,1% Тритон Х-100 в ЗФР в течение 10 минут, пермеабилизовали 0,5% Тритоном Х-100 в ЗФР в течение 5 минут и затем инкубировали с разведением 1:300 анти-myc-моноклонального антитела 9-10Е (Sigma) в течение 1 часа. Клетки промывали ЗФР и инкубировали с моноклональным антителом против мышиного IgG, конъюгированным с красителем Техасским Красным, при разведении 1:60 (Jackson ImmunoResearch Labs, Inc West Grove, PA), затем промывали три раза ЗФР. Клетки визуализировали конфокальной флуоресцентной микроскопией (Olympus IX70-SIF).
Пример 10. Получение моноклональных антител
Шестинедельных самок мышей Balb/с (Charles River Laboratories, Wilmington, MA) инъецировали подкожно очищенным рекомбинантным белком VEGI (остатки 20-174) в количестве 50 мкг на мышь в 0,1 мл полного адъюванта Фрейнда (Life Technologies). После внутрибрюшинных бустерных инъекций мыши с более высокими титрами получали конечную внутрибрюшинную инъекцию антигена 30 мкг/мышь. Клетки селезенки выделяли и сливали с клетками мышиной миеломы SP2/0 с использованием полиэтиленгликоля 1500 (Boehringer Mannheim). Гибридомы отбирали при помощи среды HAT и подвергали скринингу с использованием ELISA. Положительные гибридомы клонировали, и подкласс моноклональных антител определяли с использованием набора мышиных изотипов (SIGMA, МО). Гибридомы культивировали на среде INTEGRA CL 350 (INTEGRA Biosciences, Inc., liamsville, MD), супернатанты собирали и моноклональные антитела очищали с использованием белка А-агарозы AffiGel (BioRad).
Пример 11. Получение поликлональных антител
Четырех-шестимесячных Новозеландских белых кроликов SPF (Charles River) инокулировали подкожно 100 мкг экспрессированного в Е.coli рекомбинантного VEGI (как описано выше), смешивали с полным адъювантом Фрейнда (Life Technologies). После внутримышечных бустерных инъекций сыворотку собирали из кроликов, обнаруживающих существенную иммунную реакцию. Сыворотки очищали абсорбцией на лизате клеток Е.coli (трансформированных пустым экспрессионным вектором), затем на лизате клеток гладких мышц коронарной артерии человека.
Пример 12. Анализ VEGI в клетках млекопитающих и кондиционированных средах
Кодирующий район полноразмерного VEGI-251 встраивали между сайтами HindIII и BamHI pcDNA3 (Invitrogen). Эти плазмиды pcDNA3, в том числе вектор, трансфицировали в клетки рака молочной железы MDA-MB231 электропорацией. Стабильные трансфектанты отбирали на 2 мг/мл G418-сульфата (Gibco). Кондиционированные среды концентрировали с использованием колонок Centricon (предел пропускания по молекулярному весу 10000). Как клеточные лизаты, так и кондиционированные среды иммунопреципитировали с помощью белка A/G-агарозы (Oncogene, Boston, МА) и поликлонального антитела против VEGI. Пробы анализировали Вестерн-блоттингом. Детекцию проводили с разведением 1:1000 мышиных моноклональных антител 1-8F и визуализировали антителом против мышиного IgG, конъюгированным с пероксидазой хрена (Набор ECL, Amersham).
Пример 13. Лентивирусный перенос генов
Лентивирусные векторы, содержащие VEGI-174, sVEGI и VEGI-251, получали с использованием ранее описанных способов (Dull, et al. J.Virol 72, 8463-8471, 1998; Naldini, et al. Proc.Natl.Acad.Sci. USA 93, 11382-11388, 1996; Naldini, et al. Science 272, 263-267, 1996; Stewart, et al. Proc.Natl.Acad.Sci. USA 96. 12039-12043, 1999). Вкратце, лентивирусный вектор получали в клетках 293Т с использованием 3 плазмид: трансдуцирующей плазмиды pHR'CMV-VEGI, упаковывающей плазмиды pCMV ΔR8.2 Δvpr, и плазмиды оболочки pCMV-VSV-G. Вирусные супернатанты собирали через каждые 24 часа спустя два дня после трансфекции, очищали фильтрованием через фильтр 0,45 мкм и определяли титр при помощи анализа р24 (Dull, et al. J.Virol 72, 8463-8471, 1998; Naldini, et al. Proc.Natl.Acad.Sci. USA 93, 11382-11388, 1996; Naldini, et al. Science 272, 263-267, 1996; Stewart, et al. Proc.Natl.Acad.Sci. USA 96,12039-12043, 1999). Один пг количества р24 определяли как одну инфекционную дозу для культуры ткани (TCID). Для анализов на клеточную токсичность клетки HUVE высевали при плотности 2×104 на лунку в 24-луночном планшете за 20 часов перед инфекцией вирусным супернатантом. Ожидалось, что количество клеток удвоится спустя 20 часов после посева. Увеличивающиеся дозы вирусного вектора добавляли к клеткам HUVE. Множественность заражения (MOI) оценивали как TCID на клетку в момент инфицирования. Количество прикрепленных клеток, оставшихся в культуре спустя 24 часа после вирусной инфекции, определяли с использованием счетчика Коултера.
Пример 14. Анализ онкогенности in vivo
Стабильно трансфицированные клетки MDA-MB-231, содержавшие пустой вектор pcDNA3, VEGI-174, VEGI-251 или sVEGI, инъецировали в жировые скопления молочных желез самок бестимусных голых мышей (1×106 клеток на одну инъекцию). Имелись 2 сайта инъекции на животное и 15 животных в каждой группе, которые получали трансфектанты VEGI-174, VEGI-251 и sVEGI. Группу из 5 животных, которым инъецировали вектор pcDNA, использовали в качестве контроля. Размеры полученных опухолей ксенотрансплантатов регистрировали слепым образом. Определение плотности микрососудов проводили, как описано (Weidner, et al. N Engi J Med 324, 1-8, 1991). Вкратце, внутриопухолевые микрососуды иммуноокрашивали крысиным моноклональным антителом против мышиного CD31 (РЕСАМ-1) (клон МЕС13.3, Pharmingen International, San Diego, CA). Антитело разводили 1:100 в ЗФР, инкубировали в течение ночи с фиксированными в парафине срезами опухолей толщиной 5 мкм и визуализировали биотинилированным антителом против крысиного IgG (Vector Laboratories) по способу Vectastain ABC (Vector Laboratories). Каждую пробу исследовали при малом увеличении (х10 линзы объектива и х10 линзы окуляра) для идентификации зон с наибольшей васкуляризацией опухоли ("горячие пятна", см. ссылку (Weidner, et al. N Engi J Med 324, 1-8, 1991)). В этих зонах обследовали максимально 10 полей зрения при увеличении х400 (х40 линзы объектива и х10 линзы окуляра; 0,16 мм2 на одно поле) и рассчитывали средние величины. Большие сосуды с мышечными стенками исключали. Внутренний просвет не требовался для идентификации сосуда. Любые положительно окрашенные эндотелиальные клетки или кластеры клеток, четко отделенные от смежного микрососуда, опухолевых клеток и элементов соединительной ткани, рассматривали как отдельные, подлежащие подсчету микрососуды. Все измерения выполняли слепым образом. Результаты анализировали однофакторным дисперсионным анализом (ANOVA). Уровень значимости a priori устанавливали при значении Р менее 0,05.
Пример 15. Детектирование белка VEGI в сыворотках человека
В качестве первоначального скрининга для определения, существует ли VEGI в растворимой форме, авторы изобретения анализировали банк сывороток человека здоровых взрослых людей с использованием моноклональных антител. Авторы изобретения смогли детектировать при помощи ELISA с антителом против С-конца концентрации VEGI в диапазоне между 1 и 10 нг/мл (фигура 1). Это свидетельствовало о том, что, кроме ранее охарактеризованного VEGI, который считают мембраносвязанным, растворимая форма VEGI могла бы также иметь значимое физиологическое значение. Поскольку прежние исследования показали алоптотическую активность рекомбинантного С-концевого пептида, и сверхэкспрессия полноразмерного VEGI-174 была неээфективной на опухолях ксенотрансплантатов, образованных трансфицированными раковыми мышами, авторы изобретения резонным образом решили, что содержащий С-конец растворимый пептид, обнаруженный в сыворотках человека, вряд ли происходил из VEGI-174. Это наблюдение побудило авторов предположить, что ген VEGI может экспрессировать альтернативные формы в ткани человека.
Пример 16. Детектирование множественных транскриптов VEGI и клонирование новых изоформ VEGI
С использованием полноразмерной кДНК первоначально обнаруженного VEGI человека в качестве зонда Нозерн-блоты тканей здорового человека воспроизводимо обнаруживали множественные полосы следующих размеров: 7,5 т.п.н., 2,0 т.п.н. и 1,5 т.п.н. (фигура 2). Эти множественные транскрипты VEGI обнаруживали в некоторой мере перекрывающееся распределение в тканях и продемонстрировали существование семейства VEGI. Для выяснения структуры VEGI-родственных транскриптов авторы изобретения предприняли выделение изоформ VEGI при помощи ПЦР. С использованием VEGI-специфичных 3'-праймеров, 5'RACE использовали для амплификации 5'-концов мРНК VEGI из ряда тканей человека. Затем продукты RACE клонировали в pcR3.1 и секвенировали (фигура 3). Анализ последовательности выявил две новые последовательности VEGI, VEGI-251 и VEGI-192a (таблица 8 и фигура 3). На основе этих 5'-последовательностей были сконструированы изоформа-специфичные праймеры и были выделены полноразмерные кДНК из выполненных в виде массива панелей кДНК. Таким образом, были выделены три изоформы VEGI из фетального мозга, матки взрослого и легкого (фигуры 3А и В). Эти новые кДНК содержат открытые рамки считывания из 251 и 192 аминокислот (фигура 3В) с рассчитанными молекулярными массами 28086 и 21052 Дальтон соответственно. Эти два новых пептида VEGI, VEGI-251 и VEGI-192a имеют общие 151 аминокислотный остаток с исходным VEGI (Zhai, et al. hit J Cancer 82, 131-136, 1999), называемым теперь VEGI-174. Профиль гидрофобности этих белков показал гидрофобный район из 20 аминокислотных остатков в VEGI-251 вблизи его N-конца (фигура 3В), который отсутствует в VEGI-174 и VEGI-192a. Было предсказано, что эта последовательность содержит сигнальный пептид. Другой высокогидрофобный, возможно, трансмембранный район был ранее идентифицирован на N-конце VEGI-174 (фигура 3В).
Пример 17. Экспрессия изоформ VEGI
Индивидуальные профили экспрессии этих изоформ дополнительно исследовали Нозерн-анализом блотов множества тканей. Транскрипт VEGI-251 7,5 т.п.н. был обнаружен в плаценте, почке, легком и печени, тогда как транскрипт VEGI-174 2 т.п.н. наблюдали в печени, почке, скелетной мышце и сердце (фигура 4). При использовании тех же самых зондов на дот-блоте РНК из множества тканей наблюдали, что, кроме перекрывающейся экспрессии между VEGI-251 и VEGI-174 в предстательной железе, слюнных железах и плаценте, VEGI-251 был более обильным, чем VEGI-174, в фетальной почке и фетальном легком, тогда как VEGI-174 был более обильным в сердце, скелетной мышце, поджелудочной железе, надпочечнике и печени (таблица 10). Значение таких профилей экспрессии в настоящее время не является вполне очевидным для авторов данного изобретения. мРНК VEGI-192a не удалось с легкостью обнаружить при помощи Нозерн-блоттинга вследствие ее низкого содержания.
Экспрессию VEGI in vitro исследовали также способом защиты от РНКаз. В соответствии с прежними наблюдениями для VEGI-174, VEGI-251 и VEGI-192a обнаруживались в тех же самых типах клеток, что и VEGI-174, присутствуя в эндотелиальных клетках человека, в том числе эндотелиальных клетках коронарной артерии (НСАЕ), эндотелиальных клетках пупочной вены (HUVE) и эндотелиальных клетках микрососудов человека (HMVE), и не детектировались в гладких мышцах коронарной артерии человека (HCASM), АВАЕ и мышиных эндотелиомах bEND.3. Следует также отметить, что более чем одна изоформа, экспрессировалась в одном и том же типе клеток, причем изоформа VEGI-251 была самой обильной. Это предполагает, что экспрессия этих изоформ играет регуляторную роль в функции VEGI.
Экспрессия РНК VEGI-174 и VEGI-251 в ткани человека*
* Сравнение экспрессии РНК VEGI-174 и VEGI-251 с использованием дот-блота полиА + РНК множества тканей человека. -: не детектируется; ±: незначимо выше уровня фона; +: очень низкая; ++++: обильная. Экспрессия VEGI-192a не детектировалась.
Пример 18. Организация гена VEGI человека
Для определения структурного родства трех транскриптов VEGI анализировали организацию гена VEGI человека. Это выполняли с использованием клона ВАС, а также геномной ДНК, выделенной из образцов плаценты человека. Было обнаружено, что ген VEGI человека простирается на протяжении 17 т.п.н. с 4 экзонами и 3 интронами (фигура 6). Интрон-экзонные границы подчиняются правилу GT-AG. На основании размера фрагмента 2 интрон 1 был оценен в 13-15 т.п.н., хотя информация о последовательности не могла быть получена из этого продукта ПЦР. Все три изоформы имеют общий район 438 п.н., кодирующий остатки 29-174 VEGI-174 (таблица 12), кодируемые экзоном IVb (фигура 6), но их 5'-районы образуются из альтернативного использования экзонов. Интересно, что VEGI-251 и VEGI-192a используют акцепторные сайты сплайсинга экзонов для генерирования их соответствующих продуктов (таблица 11). Исследования с защитой от рибонуклеазы и 5'RACE с использованием геномных зондов и РНК HUVE показали, что предположительный сайт инициации транскрипции для VEGI-251 локализован приблизительно в 100 п.н. против направления транскрипции от его ATG (неопубликованные данные. Chew LJ), но эти сайты для VEGI-174 и VEGI-192a еще не были картированы. Вследствие очень низкого содержания РНК VEGI-192a последующие исследования были сосредоточены на VEGI-251. Хотя в настоящее время неясно, все ли эти изоформы инициируются с одного и того же промотора, авторы данного изобретения тем не менее делают вывод, что значение образования множественных транскриптов могло бы заключаться в дифференциальной регуляции синтеза, которая, в свою очередь, может указывать на относительную важность одной конкретной изоформы VEGI.
Пример 9. Транскрипты изоформ VEGI индуцируются параллельно посредством TNFα
Для того, чтобы проверить возможность дифференциальной регуляции транскрипции изоформ VEGI, анализировали регуляцию генов VEGI с использованием примера антиангиогенного действия при обработке TNFα. Хотя многие исследования описывают антипролиферативные действия провоспалительных цитокинов, таких как TNFα, на эндотелиальные клетки, эти цитокины могут быть также ангиогенными в зависимости от дозы и используемой системы (см. обсуждение). Такие модуляторные эффекты на эндотелиальных клетках могут служить для регуляции уровней специфического для эндотелиальных клеток цитокина, такого как VEGI. Авторы данного изобретения обнаружили, что концентрации 15 нг/мл TNFα или более высокие концентрации могут индуцировать увеличение уровней РНК VEGI в эндотелиальных клетках как крупных сосудов (умбиликальной вены), так и мелких сосудов (дермального микрососуда) (фигура 7), и что все изоформы индуцировались в этих обоих типах эндотелиальных клеток. Ясно также, что VEGI-251 остается наиболее представленной из этих изоформ. Эта параллельная повышающая регуляция транскриптов VEGI посредством TNF не только указывает на то, что опосредуемая VEGI активность потенциально является мишенью действия TNFα, но также на то, что контроль функции VEGI через синтез множественных пептидов, наиболее вероятно, лежит на посттранскрипционном уровне.
Пример 20. Субклеточная локализация
Поскольку TNF-подобные пептиды часто присутствуют как в виде мембраносвязанных, так и в виде растворимых форм, эту возможность исследовали с использованием рекомбинантных трансфицированных VEGI клеток АВАЕ.
Эксперименты по локализации выполняли с конструкциями, несущими метку myc на С-концах кодирующих областей VEGI (фигура 8). Экспрессионные конструкции изоформ VEGI в pcDNA3.1-myc трансфицировали в клетки АВАЕ и анализировали распределение VEGI-myc-продукта при помощи иммуноцитохимии с анти-myc-антителом. VEGI-174 детектировали в клетке с распределением в эндоплазматической сети/аппарате Гольджи (фигура 8А). Однако VEGI-251 обнаружил более органиченное перинуклеарное гранулярное окрашивание (фигура 8В). В обоих случаях локализация на клеточной поверхности не была обнаружена конфокальной флуоресцентной микроскопией. В клетках HUVE было обнаружено, что VEGI-251-myc-содержащие гранулы не являются тельцами Вайбеля-Паладе эндотелиальных клеток, так как сигнал туе не солокализовался с окрашиванием на фактор фон Виллебранда (vWF) (фигура 8С). Таким образом, возможно, что, в противоположность vWF, процессинг VEGI-251 не включает в себя регулируемый секреторный путь в эндотелиальных клетках.
Для определения, могут ли эти изоформы проявлять определяемые N-концом различия в субклеточной локализации, получали химерные экспрессионные конструкции GFP-VEGI как с полноразмерньми VEGI, так и с их соответствующими уникальными N-концевыми последовательностями. Эти конструкции с GFP-метками на их N-концах (фигура 8) транзиторно трансфицировали в клетки АВАЕ. Как показано на фигурах 8Е-8J, за исключением 8G, распределение GFP-VEGI отличалось от распределения GFP. Полноразмерный VEGI-174 показал локализацию в эндоплазматической сети/аппарате Гольджи (ER/Golgi), как наблюдали ранее с myc-меченным VEGI-174, тогда как первые 22 остатка VEGI-174, оказались недостаточными для нацеливания распределения GFP в специфическую внутриклеточную органеллу (фигура 8G). В противоположность этому первые 99 аминокислот VEGI-251 были достаточными для того, чтобы GFP локализовался в везикулах, которые граничили с плазматической мембраной. Это распределение наблюдали в виде флуоресцентной полосы, которая очерчивает границу клетки (фигуры 8Н-J). Наблюдения авторов предполагают, что VEGI-251 может быть локализован в секреторных везикулах, которые подвергаются конститутивному экзоцитозу.
В отличие от GFP-VEGI-251 отсутствие локализации в плазматической мембране VEGI-251-myc (фигура 8В) в сильной степени предполагает, что С-концевая метка myc была потеряна в этой клетке, возможно, вследствие отщепления секреторного сигнала и секреции растворимого С-концевого фрагмента. Известно, что подлинные сигнальные последовательности, которые расположены по ходу транскрипции (downstream) N-концов, такие как в GFP-VEGI-251 и GFP-VEGI-1-99, не отщеплялись во время синтеза в эндоплазматической сети (ER). Это различие в профилях распределения VEGI-251 с С-концевой и N-концевой метками находилось в согласии с секреторным механизмом, который включает в себя расщепление VEGI-251 по или внутри его N-концевой последовательности перед высвобождением во внеклеточную среду.
Пример 21. Демонстрация VEGI в кондиционированной клетками среде
С учетом гидрофобных остатков в N-конце VEGI-251 и его наблюдаемого субклеточного распределения кажется вероятным, что VEGI-251 является секретируемым белком. Для проверки этой гипотезы получали стабильные трансфектанты VEGI-251 в клетках рака молочной железы MDA-MB-231. В качестве отрицательного контроля получали также трансфектанты вектора pcDNA3. Экспрессию этих конструкций в MDA-MB-231 подтверждали анализом защиты от РНКазы. Следует отметить, что ни трансфекция вектором, ни трансфекция VEGI не влияли на выживание и пролиферацию этих клеток in vitro. Кондиционированные среды трансфектантов собирали, концентрировали и иммунопреципитировали поликлональным антителом к VEGI и подвергали Вестерн-анализу с моноклональным анти-VEGI-антителом 3-12D. Результаты авторов изобретения обнаружили белок с молекулярной массой приблизительно 25 кДа (фигура 9А). Появление дублета не может быть легко объяснено, но может быть результатом альтернативного гликозилирования или другой посттрансляционной модификации рекомбинантного пептида в трансфицированных клетках МВ231. Белок VEGI не был обнаружен в средах из нетрансфицированных клеток или клеток, несущих пустой вектор pcDNA (фигура 9А). VEGI-174 не мог быть обнаружен в кондиционированной среде при тех же самых экспериментальных условиях (не показано). В отдельном эксперименте Вестерн-анализ концентрированной кондиционированной клетками HUVE среды также выявил полосу сходной молекулярной массы, в сравнении с полосой, полученной с трансфектантами VEGI-251, и кондиционированная клетками HUVE среда также иммунопреципитировалась поликлональным антителом (фигура 9В). Эти наблюдения указывают на то, что VEGI-251 не является мембраносвязанным белком, а является, напротив, секретируемым белком.
Пример 22. Сверхэкспрессия VEGI-251 в эндотелиальных клетках вызывает смерть клеток
Для исследования биологической активности VEGI-251 на эндотелиальных клетках была выбрана лентивирусная система доставки генов для трансфекции клеток HUVE экспрессионными конструкциями VEGI. Лентивирусную доставку генов сначала исследовали с GFP-конструкцией и подтвердили, что более 90% клеток HUVE могли быть трансдуцированы (не показано). Наблюдения авторов изобретения с VEGI-174, VEGI-251 и секретируемой формой VEGI с сигнальным пептидом IL-6, sVEGI показали, что только секретируемые формы VEGI, в том числе VEGI-251 и sVEGI, были цитотоксичными в отношении клеток HUVE (фигура 10А), тогда как VEGI-174 не оказывал такого действия.
Эти результаты указывают на то, что клетки HUVE несут мембранные рецепторы для VEGI, которые могут становиться активированными через аутокринный механизм.
Пример 23. Противоопухолевая активность VEGI-251
Ранее было показано, что рекомбинантная форма VEGI-174, несущая секреторный сигнальный пептид, sVEGI, была эффективной в ингибировании роста опухолей карциномы ободочной кишки МС38 in vivo (Zhai, et al. hit J Cancer 82, 131-136, 1999). Поскольку природный VEGI-251 является секретируемым белком, авторы изобретения определили, мог ли он также ингибировать рост опухолей ксенотрансплантатов in vivo. Отбирали пятнадцать линий стабильно трансфицированных клонов MDA-MB-231 для каждой конструкции с пятью линиями трансфицированных вектором контролей. Клетки из каждой группы объединяли и инъецировали в жировые скопления молочной железы самок бестимусных голых мышей. Объемы опухолей определяли в зависимости от времени после инъекции. Сравнивали подобным образом культуры клеток VEGI-174-трансфицированных и sVEGI-трансфицированных клонов. Объединенные трансфицированные вектором клоны использовали в качестве контролей. Нетрансфицированные исходные клетки также анализировали, и было обнаружено, что они являются идентичными с трансфицированными вектором клонами.
Результаты авторов изобретения показывают, что сверхэкспрессия полноразмерного VEGI-174 раковыми клетками слабо влияла на рост опухолей ксенотрансплантатов (фигура 10В). Однако сверхэкспрессия интактного VEGI-251, а также слитого белка sVEGI задерживала существенно рост опухоли. Эти наблюдения находятся в полном согласии с эффектом лентивирусной трансфекции in vitro (фигура 10А), подтверждая биологическую активность природного VEGI-251. Затем авторы изобретения определяли эффект сверхэкспрессии полноразмерного VEGI-251 раковыми клетками на неоваскуляризацию опухолей. Было обнаружено, что ассоциированная с опухолями плотность микрососудов значимо уменьшается при экспрессии VEGI-251. Степень уменьшения была сравнима со степенью уменьшения в сверхэкспрессирующих sVEGI опухолях. Поскольку слитый белок sVEGI состоит из секреторного сигнального пептида IL-6 и остатков 23-174 VEGI-174, эти результаты показывают, что остатки 23-174 содержат биологический эквивалент нативного VEGI-251. Взятые вместе, эти открытия демонстрируют, что секреция VEGI-251 во внеклеточный матрикс является необходимой для его противоопухолевой активности. Кроме того, подобно sVEGI, эта противоопухолевая активность VEGI-251 не обусловлена прямым действием на опухолевые клетки, а скорее с тем, что он препятствует развитию связанной с опухолью сосудистой сети.
Пример 24. Идентификация потенциальных изоформ VEGI
Установлено, что при анализе Нозерн-блот-мембраны тканей человека при помощи кДНК-зонда VEGI многочисленное число полос мРНК появляется в различных тканях (фигура 11). Поскольку экспериментальные условия, использованные в этих экспериментах, не благоприятствуют неспецифическому связыванию этих зондов, согласно оценке на основе приближенных размеров мРНК-молекул, присутствовали по меньшей мере три изоформы, соответствующие 7,5 т.п.н., 2,0 т.п.н. и 1,5 т.п.н. соответственно. Различное распределение этих изоформ в различных тканях предполагало, что они играют различные физиологические роли.
Пример 25. Подтверждение новых изоформ VEGI
С использованием способа быстрой амплификации концов кДНК (RACE) (коммерчески доступного от OriGene Technology, Rockville, MD) для поиска изоформ VEGI использовали панель кДНК-библиотек, представляющих различные ткани человека. Эта панель содержит образцы кДНК, полученные из 24 индивидуальных тканей человека, с адаптером, лигированным с 5'-концом каждой молекулы кДНК. Для проведения полимеразной цепной реакции (ПЦР) использовали ген-специфический олигонуклеотидный праймер (GSP), соответствующий части кДНК VEGI, и адалторный праймер (ADP) (фигура 12). Два раунда "гнездовой" (nested) ПЦР проводили с использованием двух пар олигонуклеотидных праймеров. После первого раунда ПЦР (94°С 3 мин, 4 цикла 94°С в течение 30 сек, 65°С в течение 30 сек, 72°С в течение 2 мин; затем 72°С в течение 6 мин) с адапторным праймером (ADP1, 5'-CGGAATTCGT CACTCAGCG-3') (SEQ ID NO:8) и VEGI-ген-специфическим праймером (GSP1, 5'-CCCGGATCCT ATAGTAAGAA GGCTCC-3') (SEQ ID NO:9) продукты реакции разбавляли 1:10 водой. Разбавленные ПЦР-образцы использовали во втором раунде ПЦР (94°С в течение 3 мин; 35 циклов 94°С в течение 30 сек; 54°С в течение 30 сек; 72°С в течение 2 мин; затем 72°С в течение 6 мин) с другим адапторным праймером (ADP2, 5'-AGCGCGTGAA TCAGATCG-3') (SEQ ID NO:10) и VEGI-ген-специфическим праймером (GSP2, 5'-CGGTGGATCC CGAGTTTGTC TCACAACTG-3')(SEQ ID NO:11). Продукты ПЦР фракционировали в агарозном геле. Положительные ДНК-фрагменты вырезали из геля, очищали для анализа последовательности. Из различных тканей получали четыре продукта ПЦР с различными длинами (фигура 13). Эти продукты ПЦР подвергали секвенированию ДНК, подтверждая, что нуклеотидные последовательности этих продуктов ПЦР отличались друг от друга. Эти изоформы названы теперь VEGI-174, VEGI-192a, VEGI-192b и VEGI-251 в соответствии с количеством аминокислотных остатков в белках, кодируемых этими кДНК-молекулами.
Пример 26. Клонирование полноразмерной кДНК этих изоформ
Ген-специфические праймеры, сконструированные в соответствии с результатами секвенирования продуктов ПЦР, полученных из экспериментов с RACE, описанных выше, использовали для повторения второго раунда ПЦР для подтверждения специфичности их последовательностей. Затем очищенные продукты RACE клонировали в плазмиду pCR3.1 Invitrogen (San Diego, CA) для получения образцов ДНК высокого качества для секвенирования. На основе присутствия стоп-кодона и инициирующего кодона в 5'-последовательности VEGI-192a и VEGI-192b в рамке считывания конструировали полноразмерную кДНК-молекулу VEGI-192a с использованием двух пар праймеров для "гнездовой" (nested) ПЦР: Vg3A: 5'-AATCTCACCT GTCTCTGCCT G-3' (SEQ ID NO:43) и Vg-3'-1: 5'-CTAAACCGTT GTCCCTGTGG-3' (SEQ ID NO:44); Vg3B: 5'-CCTGTAAAAA TGGTTATAGT AG-3' (SEQ ID NO:45) и VG-3'-2: 5'-GGTGGCAGAG GACTTTC-3' (SEQ ID NO:46). Полноразмерную кДНК-молекулу VEGI-192b конструировали при помощи праймера VG4B 5'-CTCTACTTAC GCCAAGG-3' (SEQ ID NO:47) и праймера JY2 5'-CCCGGATCCT ATAGTAAGAA GGCTCC-3' (SEQ ID NO:48). кДНК-библиотеки, из которых были идентифицированы эти изоформы, использовали для ПЦР. Как VEGI-192a, так и VEGI-192b клонировали в pCR3.1 от Invitrogen (San Diego, CA). Поскольку не удалось обнаружить инициирующего кодона в рамке считывания в 5'-последовательности VEGI-251, использовали пару ген-специфических праймеров vg5B: 5'-CACCACATAC CTGCTTG-3' (SEQ ID NO:49) и vg161: 5'-GTGTAATCCA CCAAAGAG-3' (SEQ ID NO:12) для выделения полноразмерного кДНК-клона VEGI-251 из выполняемой в виде массива панели библиотеки кДНК от OriGene (Rockville, MD). кДНК-последовательность VEGI-192a показана в таблице 13.
Пример 27. Антиангиогенная и противораковая активность VEGI-251
Рекомбинантный белок, полученный из укороченной формы VEGI-174, состоящий из остатков 29-174, является сильным ингибитором онкогенеза (Zhai Y, et al., FASEB J., 13:181-189, 1999; Zhai, Y, et al. Int.J.Cancer, 82:131-136, 1999). Показано, что VEGI не оказывает прямого действия на рост раковых клеток и что механизм действия VEGI в ингибировании роста опухолей заключается в ингибировании образования кровеносных сосудов в этих опухолях. Таким образом, полноразмерную кДНК VEGI-251 трансфицировали в линию клеток рака молочной железы человека MDA-MB-231, затем имплантировали в жировые скопления молочной железы самок бестимусных голых мышей, чтобы показать, что продукт этого гена способен ингибировать рост опухолей посредством этих клеток. Для ингибирования роста эндотелиальных клеток в непосредственном окружении раковых клеток необходимо, чтобы продукт гена VEGI высвобождался наружу из трансфицированных клеток. Было показано, а) что продукт гена мог быть обнаружен в кондиционированных средах трансфицированных клеток в культуре и b) что эти трансфицированные клетки могли вырастать в опухоли в голых мышах.
Клетки рака молочной железы MDA-MB-231 трансфицировали либо пустым вектором, либо кДНК полноразмерного VEGI-174, либо кДНК полноразмерного VEGI-251 или слитым геном, в котором белок VEGI был связан с секреторным сигнальным пептидом, полученным из интерлейкина-6 (TL-6/VEGI). При анализе Вестерн-блоттингом с использованием моноклонального антитела (13-2D) против VEGI продукт гена VEGI-251 обнаруживали в кондиционированных средах трансфицированных клеток (фигура 14). В противоположность этому продукт гена VEGI-174 не обнаруживался в кондиционированных средах.
Стабильно трансфицированные клоны MDA-MB-231 инъецировали в жировые скопления молочной железы бестимусных самок голых мышей (1×106 на инъекцию). Размеры опухолей измеряли как функцию времени. Анализировали также плотность микрососудов в опухоли. Свехэкспрессия полноразмерного VEGI-174 раковыми клетками оказывала незначительное действие на рост опухолей ксенотрансплантатов, а сверхэкспрессия секретируемой формы предположительного внеклеточного домена VEGI и полноразмерного VEGI-251 заметно ингибировали рост опухоли (фигура 15). Кроме того, было показано проведением иммуногистохимического анализа срезов опухолей с использованием моноклонального антитела против VEGI, что белок VEGI был доступным в опухолях. Некоторые из опухолей (G9-1R) имели раковые клетки, которые продуцировали значительное количество VEGI-251, тогда как другие имели раковые клетки, которые продуцировали мало VEGI-251 (G9-2R) в сравнении с опухолями, образованными клетками (G10-2R), трансфицированными вектором (фигура 16). Чем больше VEGI-251 продуцировалось этими опухолями, тем медленнее была скорость роста этих опухолей (фигура 17). Эти результаты показывают, что VEGI-251 секретируется трансфицированными раковыми клетками и что секретируемый VEGI-251 является сильным ингибитором роста опухолей вследствие ингибирования роста эндотелиальных клеток в окружении опухолей. В противоположность этому, VEGI-m не секретировался этими клетками и, следовательно, не мог ингибировать рост эндотелиальных клеток.
Пример 28. Тканевое распределение экспрессии VEGI
В отличие от других членов TNF-семейства VEGI-174 специфически экспрессируется в эндотелиальных клетках. Нозерн-блоттинг-анализ препаратов тотальной РНК из 23 клеточных линий и первичных культур клеток показал, что VEGI детектировался только в HUVE и венозных эндотелиальных клетках человека (фигура 18). VEGI-174 не наблюдался также в артериальных эндотелиальных клетках человека. С использованием Нозерн-блотов множества тканей транскрипт VEGI-174 был обнаружен во многих тканях взрослого человека, в том числе плаценте, легком, скелетной мышце, почке, поджелудочной железе, селезенке, предстательной железе, тонкой кишке и ободочной кишке (фигура 18), что предполагает, что продукт этого гена может играть роль в функционировании нормальной сосудистой сети.
Пример 29. Специфическое ингибирование роста эндотелиальных клеток посредством VEGI
Укороченную версию VEGI-174 получали в соответствии с предположительным внеклеточным доменом, состоящим из остатков 39-174. Этот белок экспрессировали в Е.coli, очищали до кажущейся гомогенности, оцениваемой электрофорезом в ДСН-полиакриламидном геле, и испытывали в различных клеточных анализах. Этот укороченный белок был способен специфически ингибировать пролиферацию аортальных эндотелиальных клеток (АВАЕ) взрослых коров (фигура 19). Почти полное ингибирование роста эндотелиальных клеток достигалось при 10 мкг/мл со значением концентрации полумаксимального ингибирования (IC50) приблизительно 1 мкг/мл (приблизительно 70 нМ). В противоположность этому, этот белок не влиял на рост раковых клеток молочной железы человека (MDA-MB-231 или MDA-MB-435) при тех же самых экспериментальных условиях (фигура 19). VEGI не ингибировал также пролиферацию клеток Т-клеточного лейкоза человека (Jurkat), клеток лимфомы Беркитта человека (Raji), клеток моноцитарного лейкоза человека (ТНР-1) или клеток промиелоцитарного лейкоза человека (HL60), т.е. клеток, которые часто являются чувствительными к цитотоксической активности TNF. Эффективность VEGI оказалась более низкой, чем активность, которая могла бы ожидаться от цитокина; однако она сравнима с активностью известных белковых ингибиторов ангиогенеза, таких как ангиостатин и эндостатин, а также лиганд CD40 (другой член TNF-семейства). Относительно низкая наблюдаемая активность укороченного VEGI может быть также отчасти обусловлена неоптимальным сайтом укорочения или отсутствием посттрансляционной модификации, такой как гликозилирование, так как этот рекомбинантный белок экспрессировали в Е.coli.
Пример 30. Повышающая регуляция (up-regulation) гена VEGI в конфлюэнтных эндотелиалъных клетках
Специфическая в отношении эндотелиальных клеток ингибирующая активность VEGI свидетельствует о том, что этот белок действует в качестве отрицательного регулятора ангиогенеза. Чтобы показать, что ген VEGI понижающе регулируется (down-regulated) в пролиферирующих эндотелиальных клетках, но повышающе регулируется, когда эти клетки находятся в покое, исследовали экспрессию VEGI в культивируемых клетках HUVE с использованием Нозерн-блоттинга (фигура 20). Низкие уровни мРНК VEGI наблюдали в свежевысеянных клетках HUVE; однако при увеличении количества клеток в этих культурах уровень мРНК VEGI соответственно увеличивается и достигает плато при достижении конфлюэнтности этими культурами.
Пример 31. Ингибирование образования капилляроподобных трубок эндотелиальными клетками на коллагеновых гелях
Антиангиогенную активность укороченного VEGI исследовали с использованием модели ангиогенеза in vitro (Montesano, R. and OOrci, L., Cell 42:469, 1985). Эндотелиальные клетки, культивируемые на поверхности трехмерного коллагенового геля, образуют покоящийся монослой, когда культура достигает конфлюэнтности. Однако после стимуляции клеток этого монослоя ангиогенным фактором, таким как FGF-2, эти клетки инвазируют гель и образуют капилляроподобные трубчатые структуры в геле. Это образование трубочек может ингибироваться антиангиогенными факторами. Степень образования трубочек может определяться количественно с использованием компьютерного анализа изображения (Li, L. Y., Biochemistry 33:10999, 1994). Укороченный VEGI-174 был способен ингибировать образование капилляроподобных трубочек клетками АВАЕ (фигура 21). Величина IC50 для ингибирования была приблизительно 1 мкг/мл, что сходно с величиной, наблюдаемой для ингибирования роста эндотелиальных клеток.
Пример 32. Ингибирование роста капилляров в коллагеновых гелях, помещенных на хориоаллантоисную мембрану куриного эмбриона
Антиангиогенную активность VEGI-174 дополнительно демонстрировали с использованием модифицированного способа на хориоаллантоисной мембране куриного эмбриона (САМ) (Nguyen, M. et al., Microvasc. Res. 42:31, 1994). Этот способ основан на росте новых капиллярных сосудов в таблетку коллагенового геля, помещенную на САМ. Кровеносные сосуды стимулировали для вертикального роста в полимеризованный коллагеновый гель в присутствии ангиогенного фактора, такого как FGF-2 или VEGF, залитого в этот гель. Ингибитор включали в эти гели для определения его действия на рост капилляров. Степень ангиогенеза в геле оценивали с использованием FITC-декстрана, инъецируемого в кровоток САМ. Рекомбинантный VEGI-174 (5,0 мкг/мл) ингибировал приблизительно 50% роста новых капилляров в коллагеновые гели индуцированного FGF-2 (2,0 мкг/мл) (фигура 22).
Пример 33. Ингибирование роста опухолей ксенотрансплантатов коинъецированными клетками СНО, сверхэкспрессирующими VEGI
Противораковая активность VEGI демонстрируется с использованием модели опухоли ксенотрансплантата при имплантации в жировые скопления молочной железы самок бестимусных голых мышей. Секретируемую форму VEGI-174 конструируют заменой N-концевого и предположительного трансмембранного сегментов VEGI-174 (остатков 1-25) секреторным сигнальным пептидом, происходящим из интерлейкина-6 человека. Эту секретируемую конструкцию VEGI-174 клонировали в эукариотический экспрессирующий вектор, который затем трансфицировали в клетки яичника китайского хомячка (СНО). Экспрессию соответствующей конструкции подтверждали Нозерн-блот-анализом. Секрецию модифицированного VEGI трансфицированными клетками подтверждали способностью кондиционированной среды ингибировать рост клеток АВАЕ. Затем трансфицированные клетки СНО смешивали с раковыми клетками молочной железы человека (MDA-MB-231 или MDA-MB-435), и эти смеси клеток инъецировали в жировые скопления молочной железы голых мышей. Рост опухолей ксенотрансплантатов регистрировали после инъекции. Несмотря на высокую онкогенность использованных линий клеток рака молочной железы, наблюдали выраженное ингибирование роста опухолей ксенотрансплантатов, образованных либо клетками MDA-MB-231 (фигура 23А), либо клетками MDA-MB-435 (фигура 23В). При повторении этого эксперимента с использованием клеток MDA-MB-435 эта коинъекция приводила также к полному ингибированию образования опухолей. Трансфицированные вектором клетки СНО не влияли на рост опухолей ни в одном случае. Поскольку VEGI не ингибировал рост клеток рака молочной железы в культуре, эта противораковая активность данного белка являлась результатом его антиангиогенной активности.
Пример 34. Ингибирование пролиферации клеток АВАЕ VEGI-192a
Полноразмерный VEGI-192a экспрессировали в Е.coli и повторно укладывали и очищали с использованием способа, описанного в заявке РСТ WO 01/55174. Конкретно, конструировали экспрессионный вектор (PET11, Novagen), содержащий полинуклеотидную вставку, которая кодирует полноразмерный полипептид VEGI-192a. Этот экспрессионный вектор трансформировали в Е. coli и трансформированную Е. coli выращивали для экспрессии полипептида VEGI-192a. Клетки собирали и из разрушенных клеток выделяли тельца включений. OD280 раствора, содержащего эти тельца включений, доводили до 5,0 8,0 М раствором мочевины. Конечный раствор содержал следующие восстанавливающие компоненты: 10 мМ бета-меркаптоэтанол, 10 мМ ДТТ (дитиотреитол), 1 мМ восстановленный глутатион (GSH), 0,1 мМ окисленный глутатион (GSSG). Конечный рН этого раствора был 10,0. Этот раствор быстро разбавляли в 20 объемах 20 мМ Трис™-основания, рН доводили до 9,0 и затем медленно доводили до 8,0 1 М HCl посредством доведения рН до 8,8 в течение 24 часов, затем до 8,6 в течение 24 часов и т.д., пока рН не становился 8,0. Альтернативно, белки могли быть повторно уложены с использованием диализа. OD280 8 М раствора мочевины доводили до 0,5 и диализовали против 20 объемов Трис™-основания. рН этого раствора медленно доводили опять до 8,0. Затем повторно уложенный материал концентрировали ультрафильтрацией и разделяли гель-фильтрацией, например, на колонке с Сефакрилом™ S-300 с использованием 20 мМ Триса™, HCl, 0,4 М мочевины, рН 8,0. Фракции с S-300 могли проверяться путем электрофореза в невосстанавливающем ДСН-ПААГ. Неправильно уложенный белок мигрировал с очень высокой молекулярной массой, тогда как правильно уложенные белки мигрировали с нормальной молекулярной массой.
Белки VEGI-192a из фракций с S-300 испытывали на их способность ингибировать рост эндотелиальных клеток. Аортальные эндотелиальные клетки взрослых коров (АВАЕ) высевали в трех повторностях при концентрации 8000 клеток на лунку в 24-луночные планшеты в IMEM (Gibco, Gaithersburg, MD), 10% фетальной телячьей сыворотке. К средам добавляли FGF-2 (1 нг/мл). Эти культуры выдерживали при 37°С, 5% CO2 в течение 6 дней. Затем клетки трипсинизировали и количество клеток определяли с использованием счетчика Коултера (Hialeah, FL).
Как показано на фигуре 24, правильно уложенный 12а, но не неправильно уложенный VEGI-192a, из фракций с S-300 был способен ингибировать рост клеток АВАЕ. Почти полное ингибирование роста эндотелиальных клеток достигалось при 1000 нг/мл, причем величина концентрации полумаксимального ингибирования (IC50) была приблизительно 10 нг/мл.











| название | год | авторы | номер документа |
|---|---|---|---|
| БИОМАРКЕРЫ НА ОСНОВЕ ОПУХОЛЕВОЙ ТКАНИ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ БЕВАЦИЗУМАБОМ | 2011 |
|
RU2605282C2 |
| АНТАГОНИСТЫ WNT И СПОСОБЫ ЛЕЧЕНИЯ И ТЕСТИРОВАНИЯ | 2011 |
|
RU2593947C2 |
| НЕПРИРОДНЫЕ СЕМАФОРИНЫ КЛАССА 3 И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2722832C2 |
| ПРОТИВОРАКОВЫЕ ВАКЦИНЫ, НАЦЕЛЕННЫЕ НА СУРВИВИН, И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2751253C1 |
| ПРОТИВОРАКОВЫЕ ВАКЦИНЫ, НАЦЕЛЕННЫЕ НА СУРВИВИН, И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2776949C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ VEGF-C И CCBE1 | 2014 |
|
RU2691104C2 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2627176C2 |
| АНТАГОНИСТЫ АКТИВИНА-ActRIIa-Fc И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2473362C2 |
| ВАРИАНТЫ ДИЗИНТЕГРИНА И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2685869C1 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |
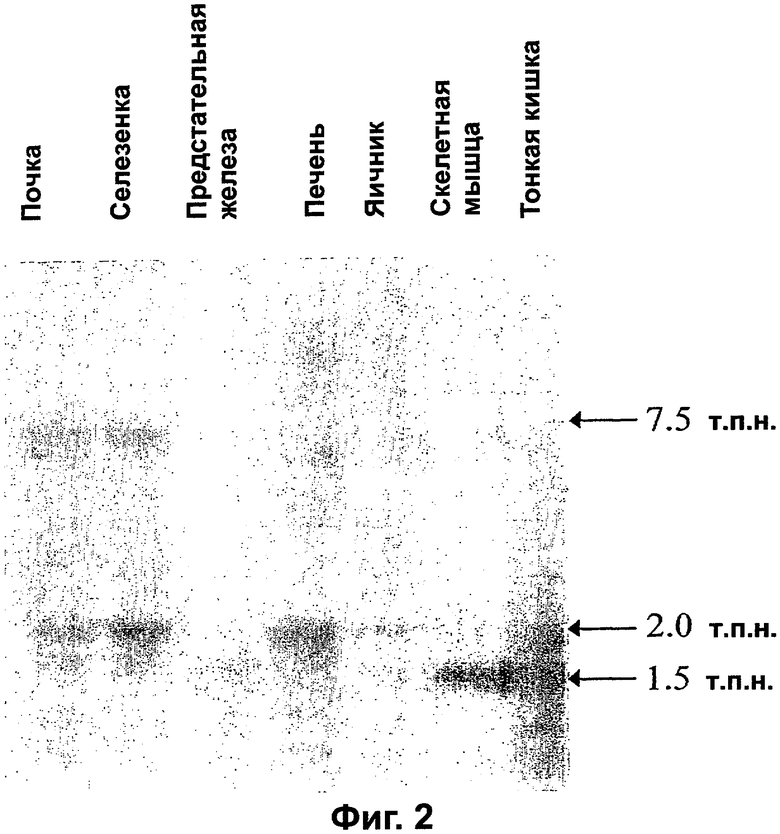
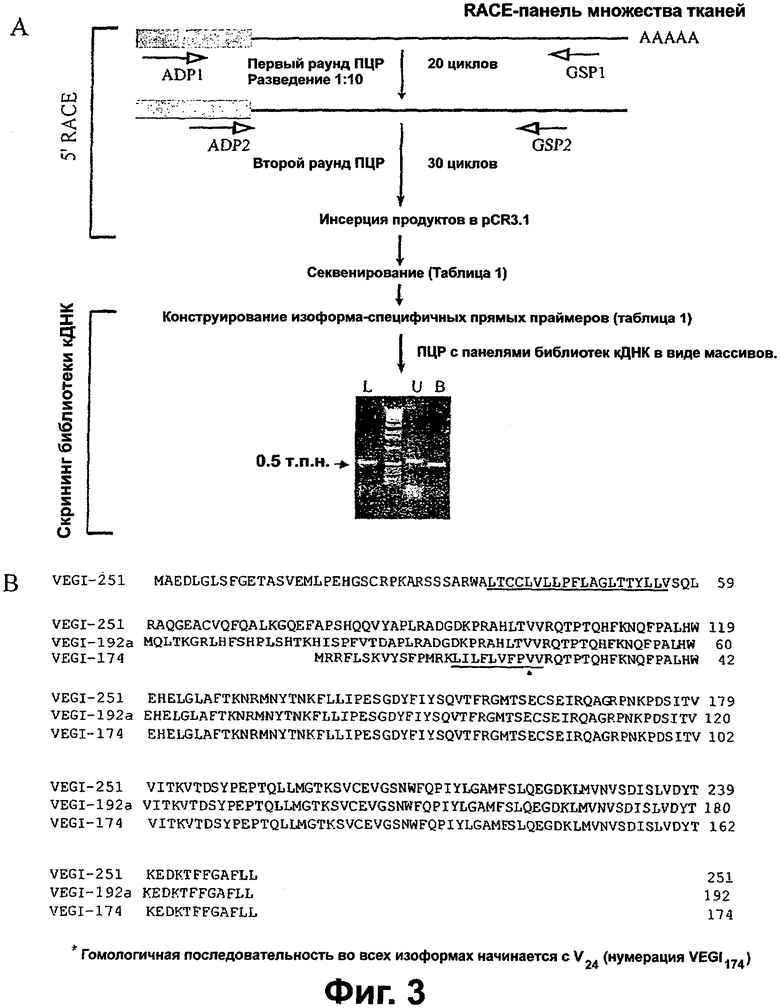
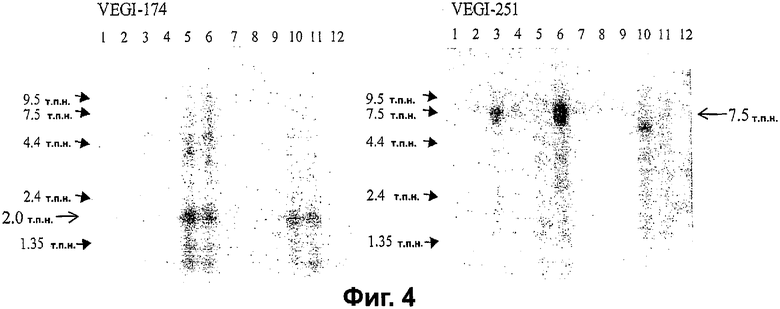
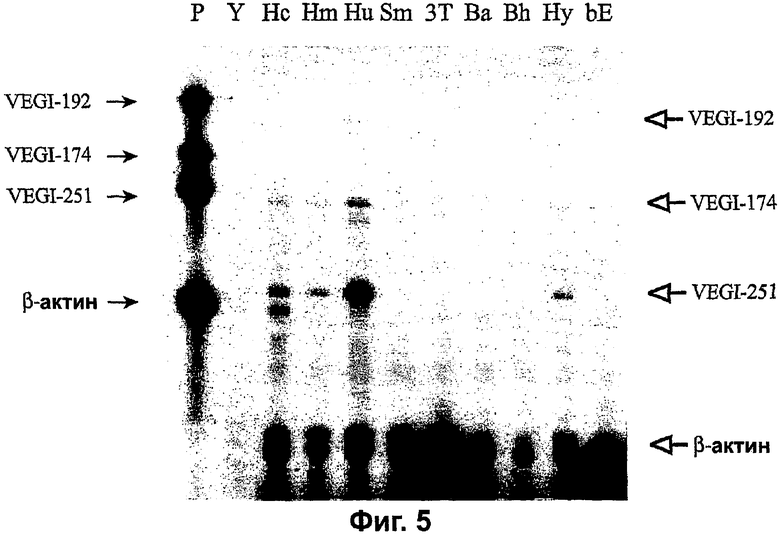
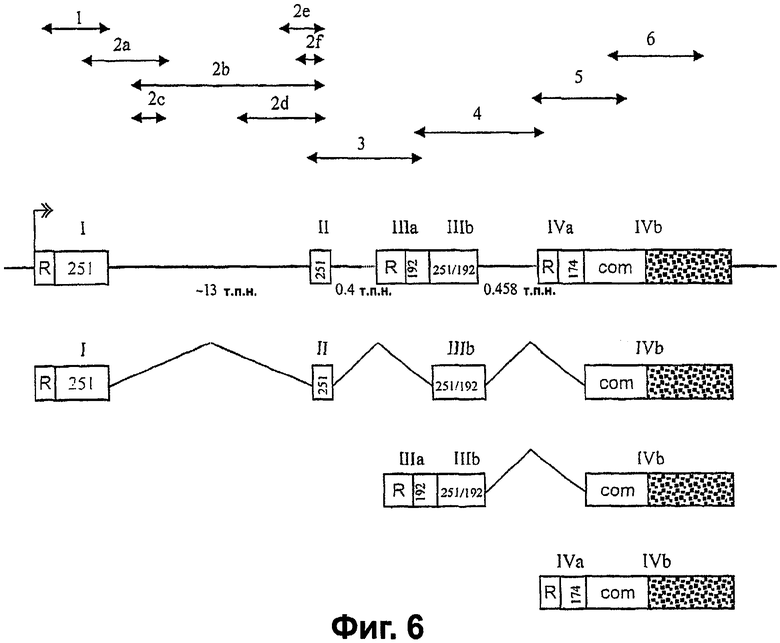
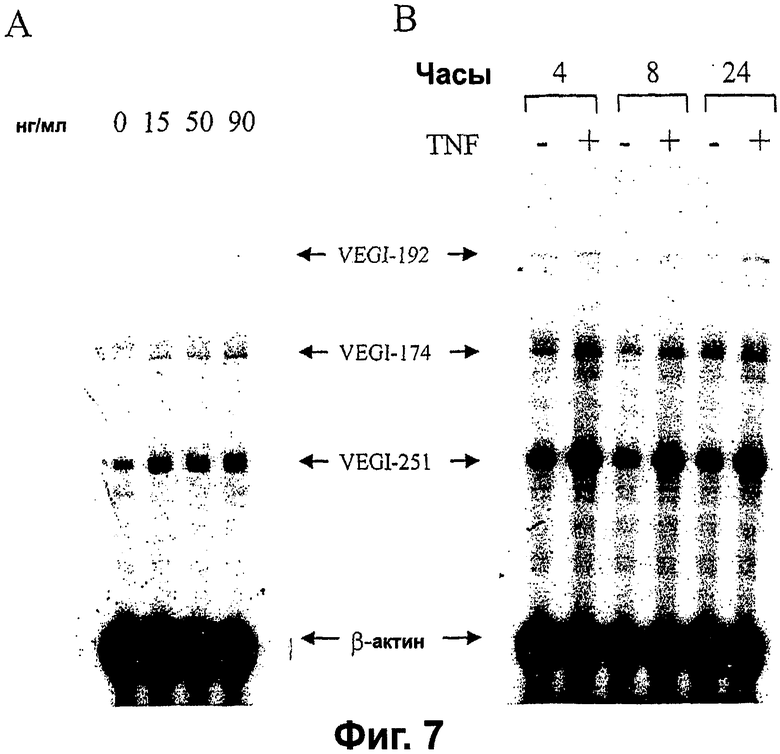
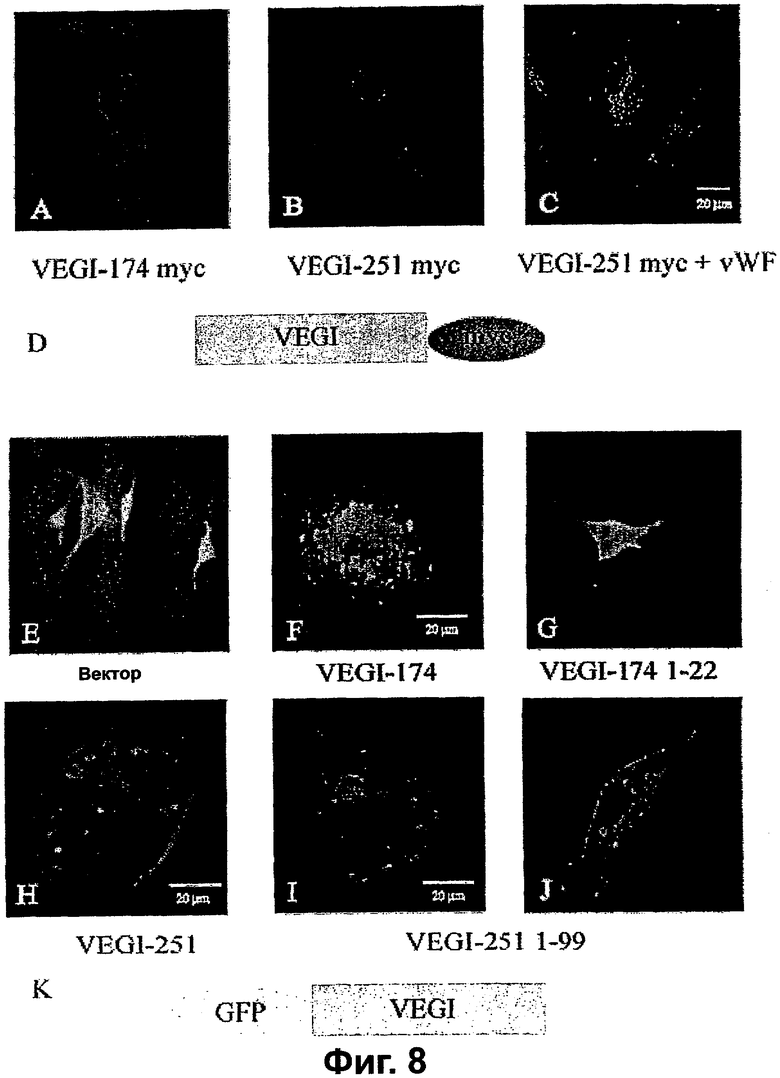
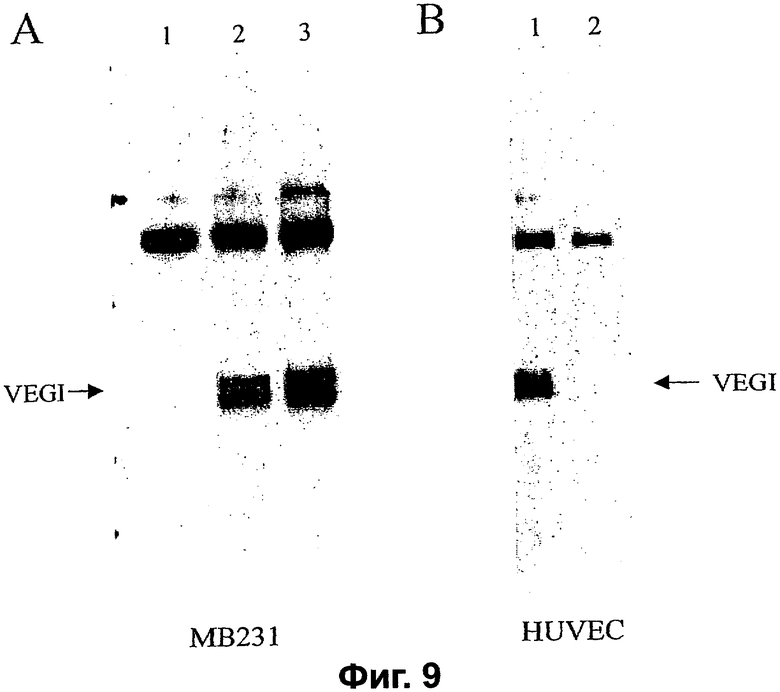
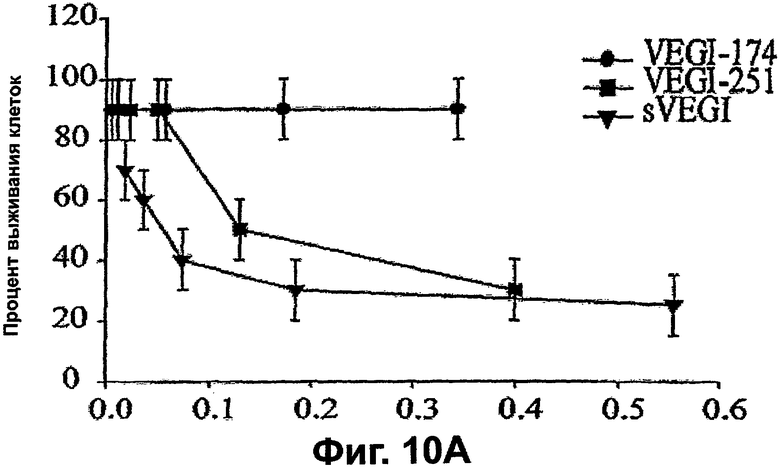
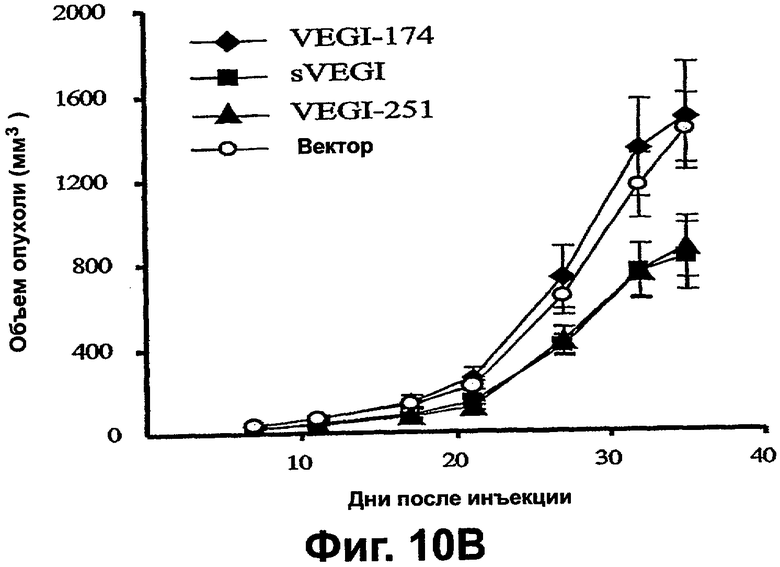
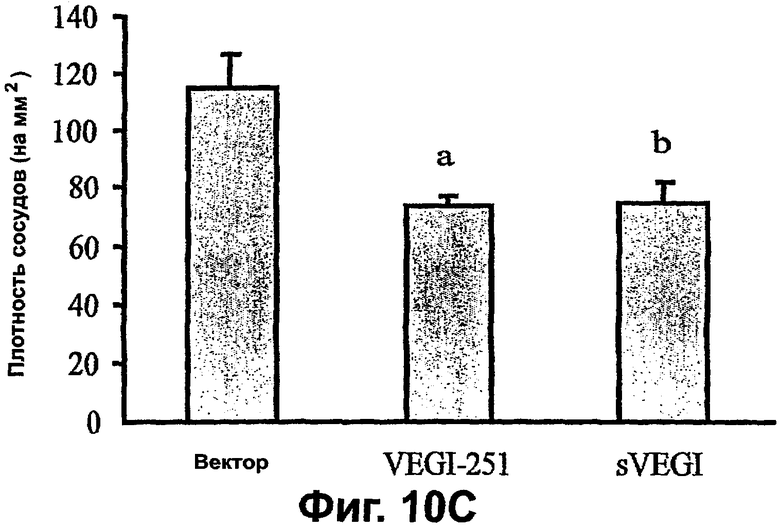
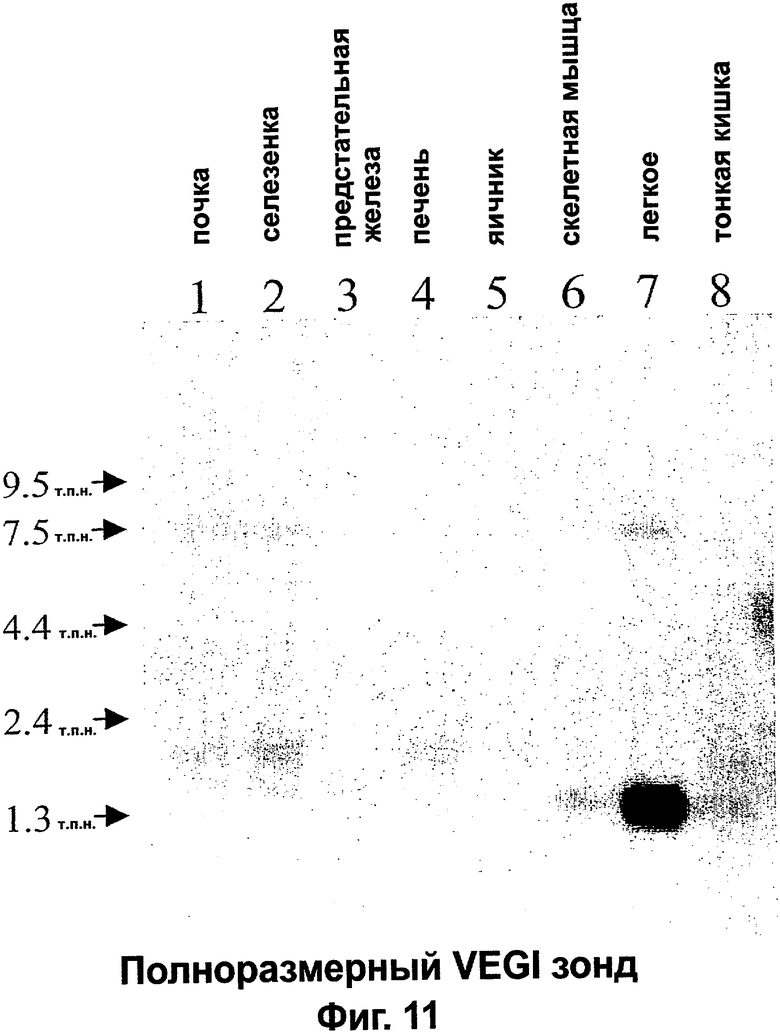
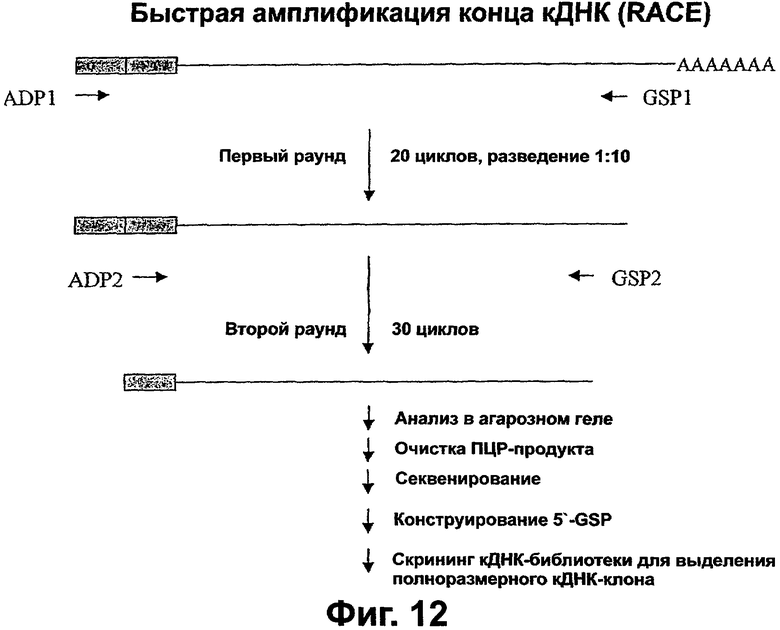
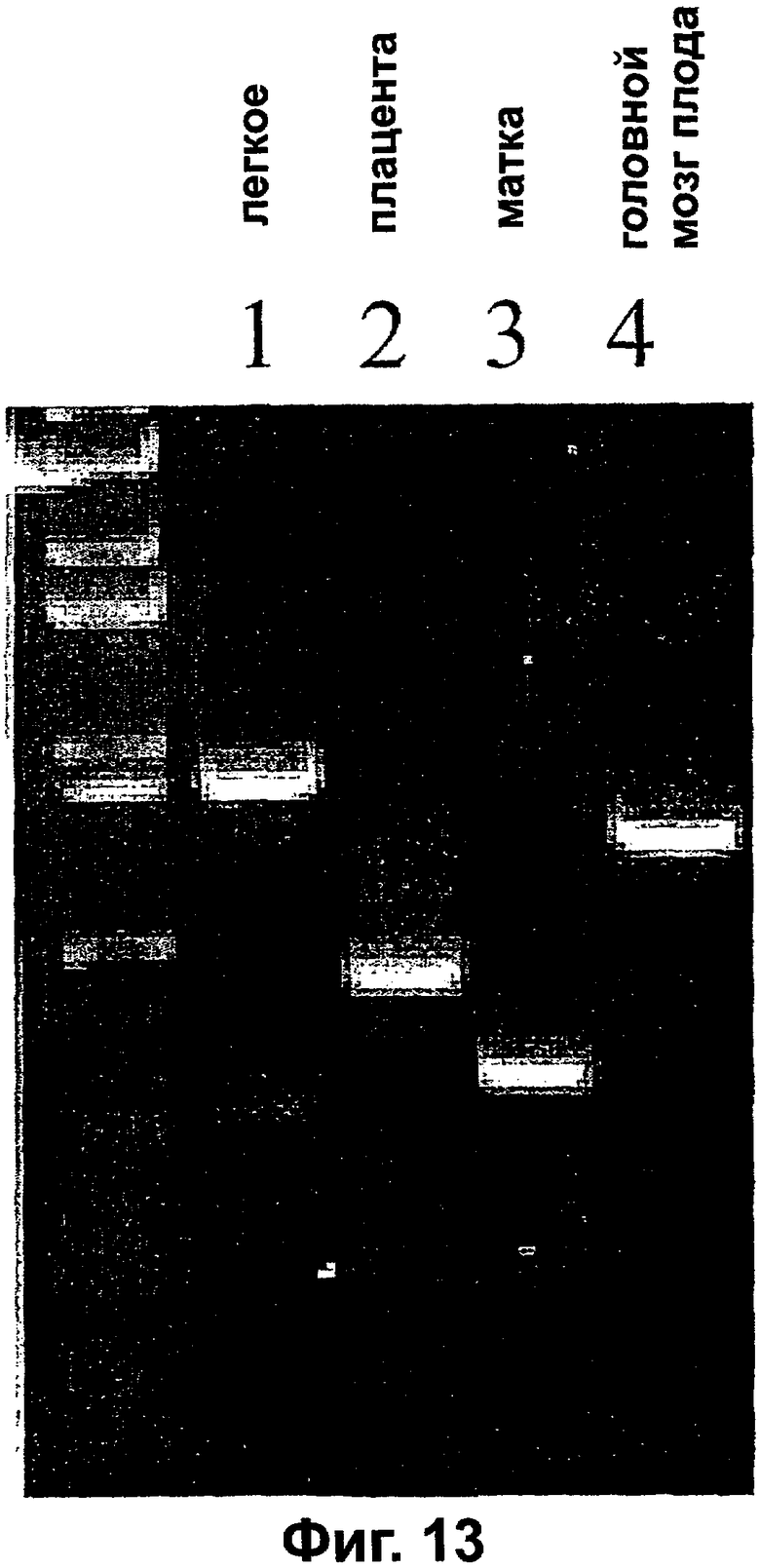

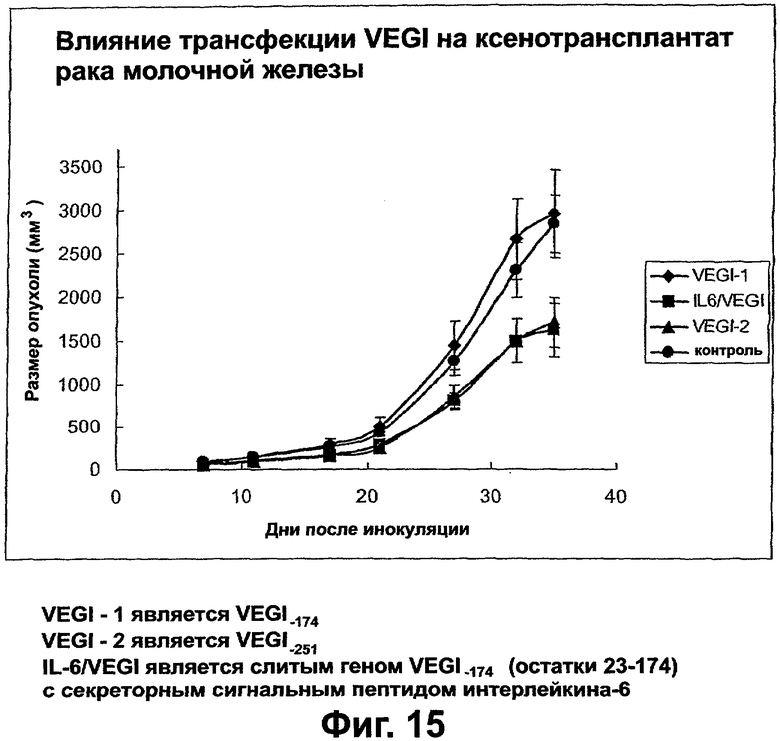
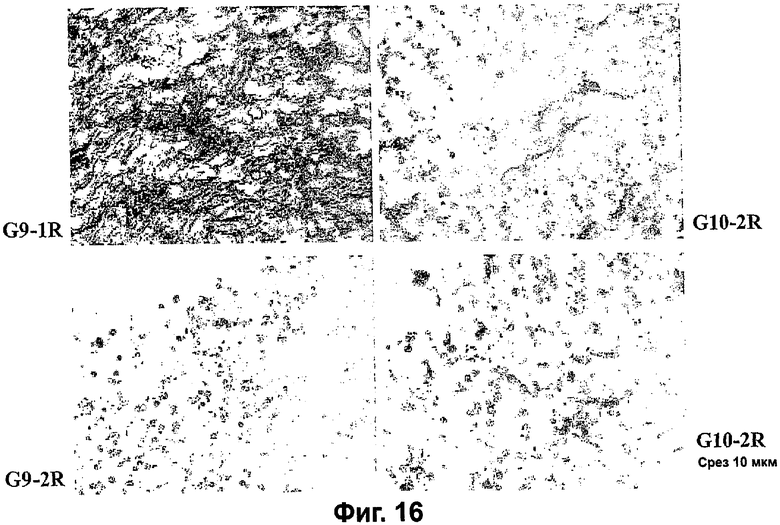
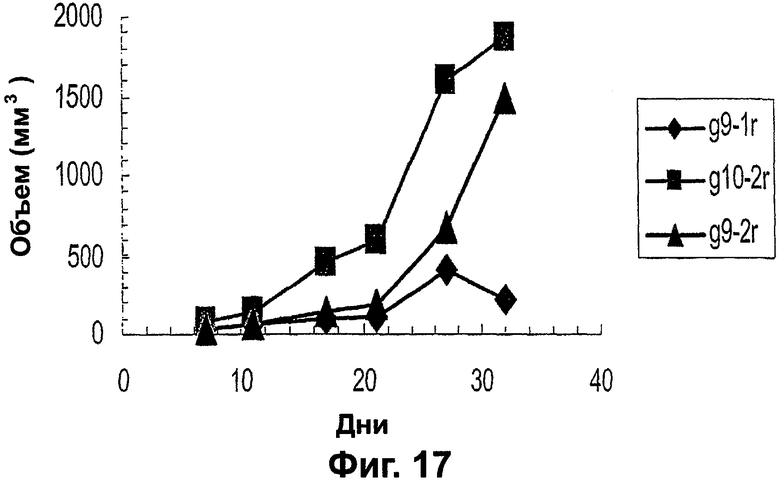

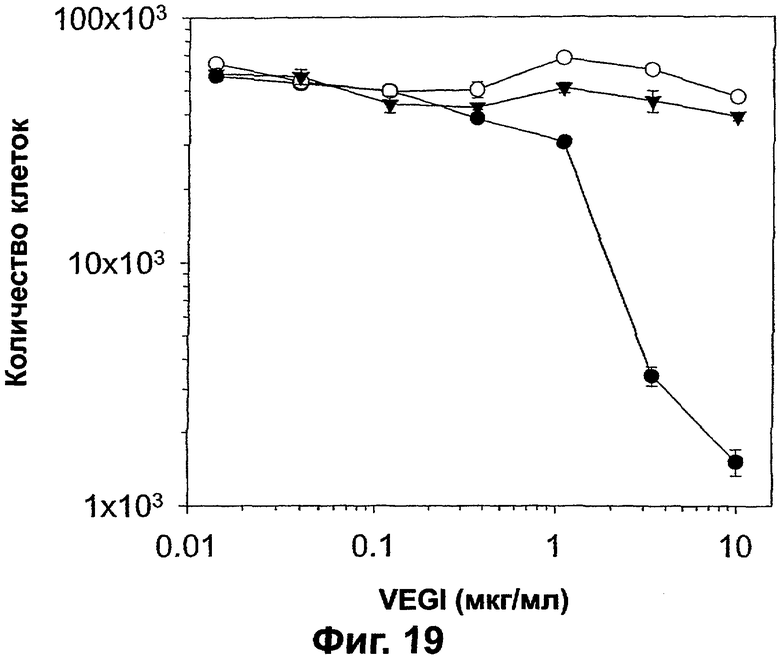
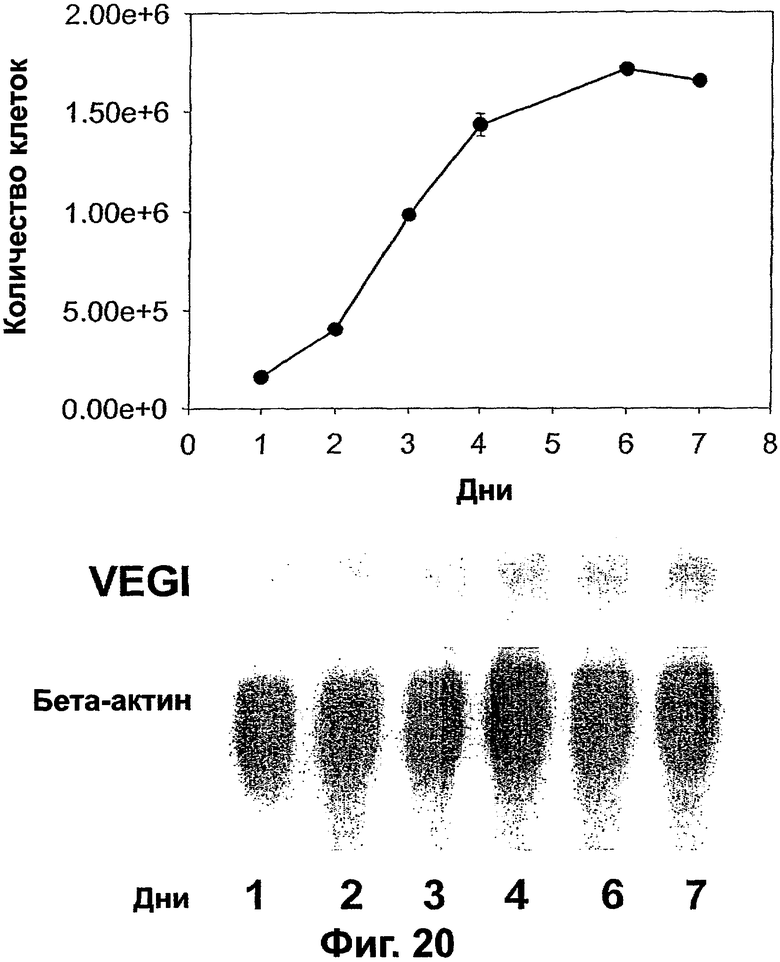
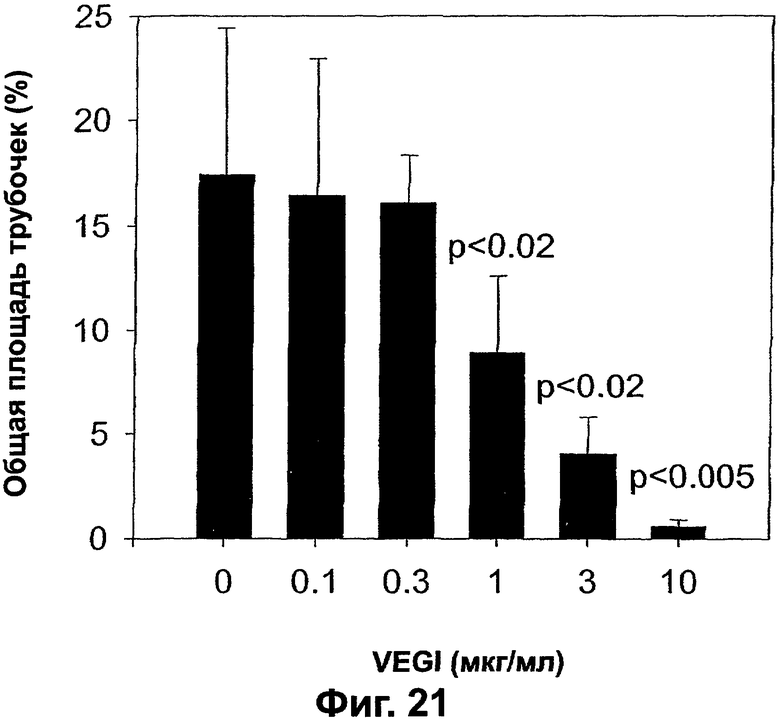
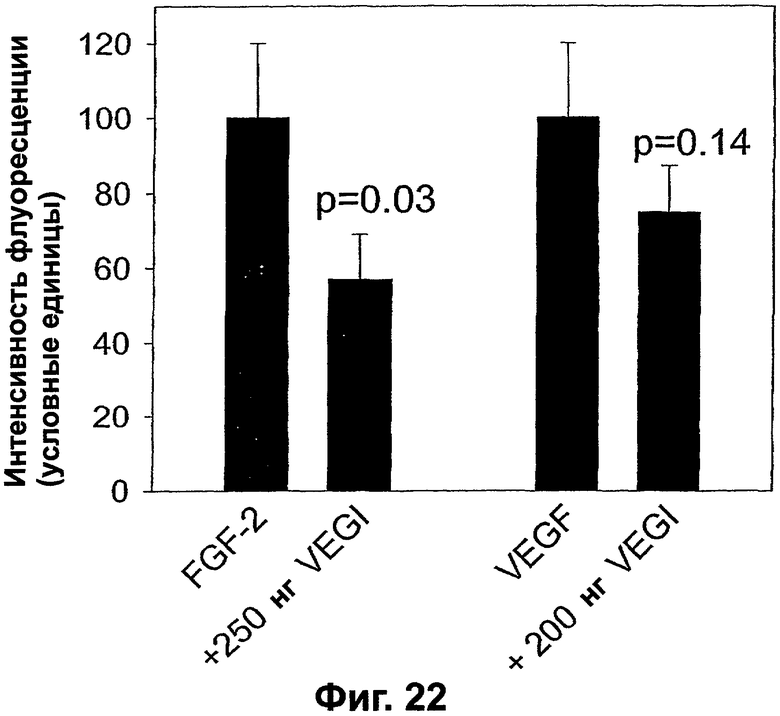
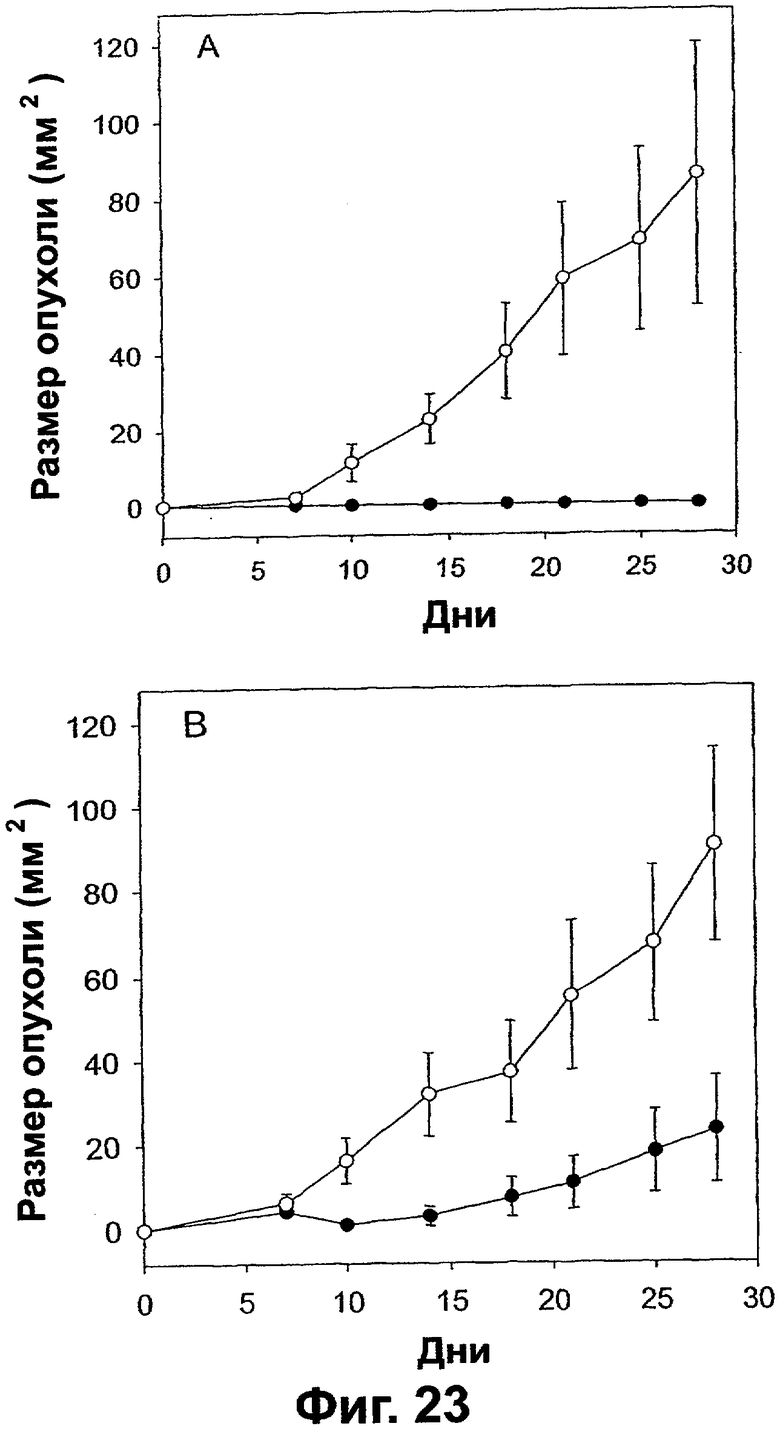
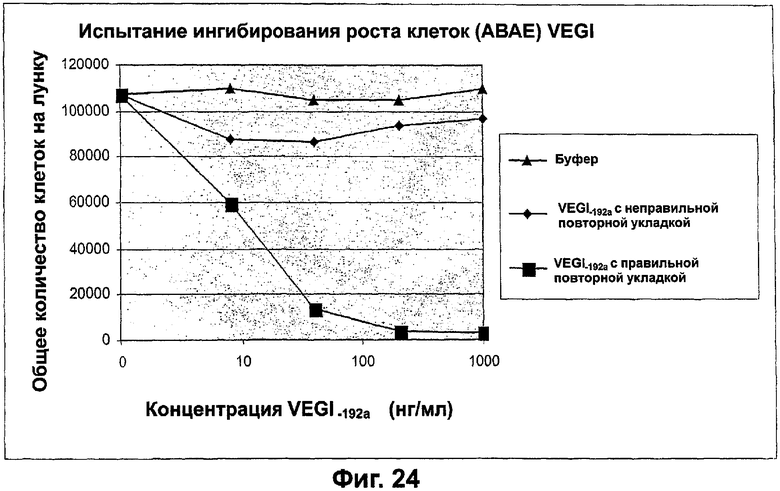
Изобретение относится к биотехнологии. Предложен полинуклеотид VEGI-192a, кодирующий полипептид, который ингибирует рост васкулярных эндотелиальных клеток человека. Описан экспрессирующий вектор, содержащий полинуклеотид, и клетка-хозяин E.coli, содержащая вектор. Раскрыт полипептид, кодируемый полинуклеотидом, и слитый белок на основе указанного полипептида. Описан полинуклеотид, кодирующий слитый белок и экспрессирующий вектор на основе указанного полинуклеотида. Раскрыта фармацевтическая композиция для ингибирования ангиогенеза на основе полипептида-ингибитора роста васкулярных эндотелиальных клеток человека и кодирующего его полинуклеотида. Описаны терапевтические способы ингибирования ангиогенеза и супрессии роста опухоли на основе композиции. Описано антитело к полипетиду, ингибирующему рост васкулярных эндотелиальных клеток человека. Использование изобретения обеспечивает новые формы ингибитора роста васкулярных эндотелиальных клеток человека и может найти применение в медицине. 11 н. и 16 з.п. ф-лы, 24 ил., 13 табл.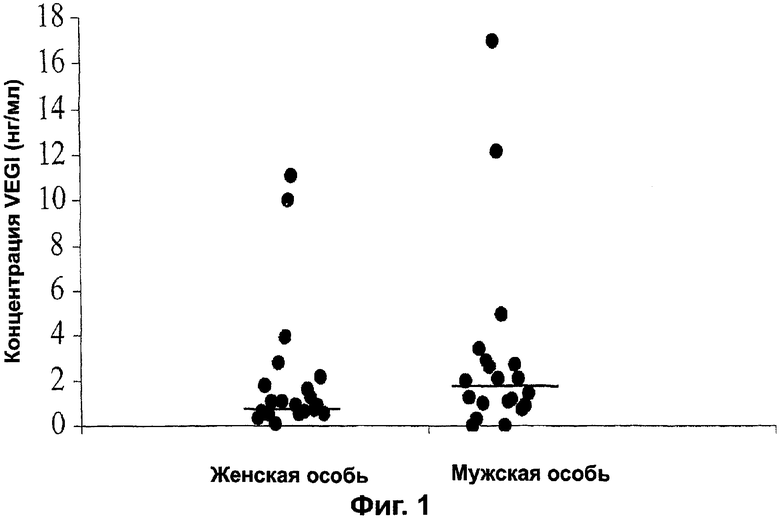
| WO 9923105 A, 14.05.1999 | |||
| Zhai et al., VEGI, a novel cytokine of the tumor necrosis factor family, is an angiogenesis inhibitor that suppresses the growth of colon carcinomas in vivo | |||
| FASEB J | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Wang et al., Cloning, Expression and Biological Activity of VEGI(151), a Novel Vascular Endothelial Cell Growth Inhibitor | |||
| Sheng Wu | |||
Авторы
Даты
2008-02-10—Публикация
2002-11-12—Подача