ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к фармацевтическим композициям карбидопы и при необходимости леводопы, содержащим безопасную и приемлемую концентрацию гидразина, а также способы их применения и содержащие их наборы.
УРОВЕНЬ ТЕХНИКИ
[0002] Болезнь Паркинсона является дегенеративным состоянием, характеризующимся снижением концентрации нейромедиатора дофамина в мозгу. Леводопа (L-дофа или L-3,4-дигидроксифенилаланин) является непосредственным метаболическим предшественником дофамина, который в отличие от дофамина, способен проникать через гематоэнцефалический барьер, и наиболее часто используется для восстановления концентрации дофамина в мозгу. В течение последних 40 лет леводопа остается наиболее эффективным средством терапии для лечения болезни Паркинсона.
[0003] Вместе с тем, леводопа имеет короткий период полужизни в плазме, что, даже при наилучшем современном стандарте лечения, приводит к пульсирующей дофаминергической стимуляции. Вследствие этого продолжительная терапия осложняется двигательными флуктуациями и дискинезией, что может являться источником существенной недееспособности некоторых пациентов. Стратегия лечения, которая в конечном итоге сможет обеспечить доставку леводопы/дофамина в мозг при непрерывном и физиологическом подходе, приведет к успеху стандартного приема использования леводопы при снижении двигательных осложнений и остро необходима пациентам, страдающим болезнью Паркинсона и другими неврологическими или двигательными расстройствами (Olanow, Mov. Dis., 2008, 23 (Suppl. 3), S613-S622). Были разработаны пероральные составы замедленного высвобождения на основе леводопы, но в лучшем случае, установлено, что такие средства не более действенны, чем стандартные таблетки. Также может быть применимо непрерывное применение леводопы путем интрадуоденального применения или инфузии с использованием амбулаторных насосов или пластырей. Такие способы лечения, особенно интрадуоденальное применение, являются чрезмерно инвазивными и вызывают неудобство.
[0004] Метаболическая трансформация леводопы до дофамина катализируется ферментом декарбоксилазой ароматической L-аминокислоты, широко распространённым ферментом, концентрация которого особенно высока в слизистой оболочке кишечника, печени, мозгу и капиллярах мозга. Из-за возможности экстрацеребрального метаболизма леводопы, необходимо применять большие дозы леводопы, приводящие к высокой экстрацеребральной концентрации дофамина, что вызывает у некоторых пациентов тошноту. В связи с этим леводопа обычно применяется одновременно с пероральным приемом ингибитора ДОФА-декарбоксилазы, таким как, карбидопа или бенсеразид, который сокращает на 60-80% дозу леводопы, требуемую для клинического ответа, и, таким образом предотвращает проявление ее побочных эффектов, ингибируя конверсию леводопы в дофамин вне мозга.
[0005] Хорошо известны различные пероральные составы наряду с ингибиторами ферментов, ассоциированными с метаболическим распадом леводопы, например, ингибиторы декарбоксилазы, такие как карбидопа и бенсеразид, ингибиторы моноаминоксидазы (МАО)-А или МАО-В, такие как моклобемид разагилин, селегилин и сафинамид, и ингибиторы катехол-О-метилтрансферазы КОМТ (СОМТ), такие как толкапон и энтакапон. Существующие пероральные лекарственные средства включают таблетки замедленного высвобождения SINEMET® и SINEMET®CR, содержащие карбидопу и леводопу; и таблетки MADOPAR®, содержащие леводопу и бенсеразид; и таблетки STALEVO®, содержащие карбидопу, энтакапон и леводопу.
[0006] Карбидопа представляет собой неконкурентный ингибитор ДОФА-декарбоксилазы. При смешивании с леводопой карбидопа ингибирует периферическую конверсию леводопы в дофамин. Это приводит к повышению уровня леводопы, способной к транспорту по ЦНС. Карбидопа также ингибирует метаболизм леводопы в желудочно-кишечном тракте, таким образом повышая биологическую доступность леводопы. Это применяется в практике болезни Паркинсона для сокращения периферических эффектов дофамина. Потеря функциональной группы гидразина представляет собой основной метаболический путь карбидопы.
[0007] Гидразин (N2H4) и его соли используют в фармацевтической промышленности в качестве промежуточного продукта для производства лекарственных средств с различными терапевтическими эффектами, включая ингибиторы декарбоксилаз, противогипертонические и антибактериальные агенты. Это может быть причиной серьезных побочных действий на центральную нервную систему, печень и почки. В дополнение к указанным эффектам, у лабораторных животных были установлены следующие симптомы: потеря массы тела, анемия, гипогликемия, жировая дегенерация печени и конвульсии. Также установлено, что гидразин вызывает повреждение ДНК, генные мутации и хромосомные аберрации (Критерии качества окружающей среды (Environmental health criteria) No. 68 Гидразин (1987)) и индуцирует рост опухоли у мышей, хомяков и крыс после перорального, внутрибрюшинного и ингаляционного введения (MacEwan, J.D., Vernot, Е.Н., Haun С.С., et al., Chronic inhalation toxicity of hydrazine: oncogenic effects (1981). Air Force Aerospace Medical Research Laboratory, Wright-Patterson Air Force Base, Ohio, NTIS Springfield VA). В связи с токсичностью гидразина и его потенциальной канцерогенностью для человека, его наличие ограничено в некоторых из этих лекарственных средствах в соответствии с монографией Европейской Фармакопеи (Ph. Eur.).
[0008] Таким образом, в настоящее время существует острая необходимость в жидких составах и композициях, обеспечивающих достижение продолжительной дофаминергической стимуляции для более эффективного лечения двигательных расстройств, таких как болезнь Паркинсона, содержащих безопасную и приемлемую концентрацию гидразина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] К данному моменту, в соответствии с настоящим изобретением обнаружено, что составы на основе карбидопы, содержащие особые комбинации двух антиоксидантов или скавенджеров о-хиноновой природы (o-quinone scavengers), где один из указанных антиоксидантов представляет собой аскорбиновую кислоту или ее соль, являются существенно более стабильными, чем составы, содержащие только один антиоксидант. В частности, обнаружено, что особые комбинации антиоксидантов, содержащие аскорбиновую кислоту или ее соль и один или более дополнительных антиоксидантов, сильно ингибируют распад карбидопы, что значительно снижает, т.е. лимитирует образование нежелательных продуктов деструкции, в частности, 3,4-дигидроксифенил-2-метилпропионовой кислоты (обозначенной в данной заявке как «деградант») и гидразина, и существенно стабилизирует составы. Неожиданным оказалось также то, что составы на основе карбидопы могут храниться при различных температурах и условиях длительный период времени, в частности, до нескольких лет, причем с сохранением безопасной и приемлемой концентрации гидразина.
[0010] Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая карбидопу, по меньшей мере два антиоксиданта, и фармацевтически приемлемый носитель, где один из указанных антиоксидантов представляет собой аскорбиновую кислоту или ее соль, и указанная композиция содержит менее 1 мкг/мл гидразина, определенного методом газовой хромато-масс-спектрометрии (ГХ-МС), или менее 5% по массе 3,4-дигидроксифенил-2-метилпропионовой кислоты относительно начального количества карбидопы, определенного методом высокоэффективной жидкостной хроматографии (ВЭЖХ). В частности, указанные лекарственные композиции содержат от 0,1% до 10%, предпочтительно от 0,5% до 6% по массе карбидопы, и/или от 0,1% до 10%, предпочтительно от 0,2% до 2% по массе аскорбиновой кислоты или ее соли.
[0011] В частности, в соответствии с данным аспектом настоящего изобретения предложена фармацевтическая композиция, также содержащая (i) леводопу; (ii) аргинин, меглумин, или их комбинацию; или (iii) оба (i) и (ii); и может при необходимости также содержать поверхностно-активное вещество. В частности, указанные лекарственные композиции содержат или менее 1% или от 1% до 20%, предпочтительно 2% до 16% по массе леводопы; и/или от 0,1% до 42%, предпочтительно от 2% до 40% по массе аргинина, меглумина, или комбинацию аргинина и меглумина.
[0012] В частности, согласно настоящему изобретению предложены лекарственные композиции, содержащие карбидопу; аскорбиновую кислоту или ее соль; по меньшей мере один дополнительный антиоксидант, не являющийся указанной аскорбиновой кислотой или ее солью, например, L-цистеин или его соль, N-ацетилцистеин (N-АЦ) или его соль, глутатион или его соль, диацетилцистин или его соль, или бисульфит натрия; леводопу; аргинин; меглумин, или их комбинацию; и при необходимости поверхностно-активное вещество, например, полисорбат 80.
[0013] Более конкретно указанные композиции содержат (i) от 0,1% до 10%, предпочтительно от 0,5% до 6% по массе карбидопы; (ii) от 0,1% до 10%, предпочтительно от 0,2% до 2% по массе аскорбиновой кислоты или ее соли; (iii) от 0,001% до 5% по массе L-цистеина или его соли; от 0,001% до 5% по массе N-АЦ; или от 0,01% до 2% по массе бисульфита натрия; (iv) или менее 1% или от 1% до 20%, предпочтительно от 2% до 16% по массе леводопы; (v) от 0,1% до 42%, предпочтительно от 2% до 40% по массе аргинина, меглумина или их комбинации; и при необходимости (vi) от 0,01% до 5% по массе полисорбата 80, причем композиция содержит менее 1 мкг/мл, предпочтительно менее 0,5 мкг/мл, более предпочтительно менее 0,1 мкг/мл гидразина.
[0014] Показано, что фармацевтические композиции, заявленные согласно настоящему изобретению, являются высокостабильными, причем особая комбинация антиоксидантов стабилизирует карбидопу, таким образом минимизируя распад карбидопы, следовательно, ингибируя образование деграданта и гидразина. Таким образом, указанная композиция может храниться в различных условиях, например, в диапазоне температур от -20°C до 25°C без существенного распада, причем содержание гидразина в таких композициях остается менее 1 мкг/мл, предпочтительно менее 0,1 мкг/мл после 1-24 ч, 1-30 суток, 1-12 месяцев, или 1-3 лет.
[0015] Согласно другому аспекту настоящее изобретение относится к способу лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона, у пациентов, а именно у млекопитающих в целом или у человека в частности, указанный способ включает введение указанному пациенту эффективного количества лекарственной композиции вышеуказанным способом. В соответствии с настоящим изобретением способ может включать по существу продолжительное применение композиции.
[0016] Согласно другому аспекту настоящего изобретения предложена вышеуказанная фармацевтическая композиция для применения для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона.
[0017] Согласно другому аспекту настоящего изобретения предложено применение вышеуказанной лекарственной композиции для приготовления лекарственного средства для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона.
[0018] Согласно другому аспекту настоящего изобретения предложен набор, содержащий по меньшей мере один, т.е. один, два, три или более контейнера, каждый из которых содержит вышеуказанную лекарственную композицию, где указанная композиция представлена в количестве, достаточном для лечения у пациента, т.е. млекопитающего или человека, болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона, в течение по меньшей мере 1, 2, 3, 4 или 5 суток; 1, 2, 3 или 4 недель; от 1 до 12 (например, 1, 2, 3, 6, 9 или 12) месяцев; или от 1 до 20 (например, 1, 2, 3, 4, 5, 6, 8, 10 или 12) лет. В отдельных примерах реализации настоящего изобретения композиция представлена в виде отдельных доз.
[0019] В отдельных примерах реализации согласно любому из представленных аспектов фармацевтическая композиция, способ или набор, заявленный в соответствии с настоящим изобретением, также содержит, или содержит применение, второго активного агента. Указанным вторым агентом может быть ингибитор катехол-О-метилтрансферазы КОМТ (СОМТ), например, толкапон, энтакапон, или их фармацевтически приемлемая соль.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
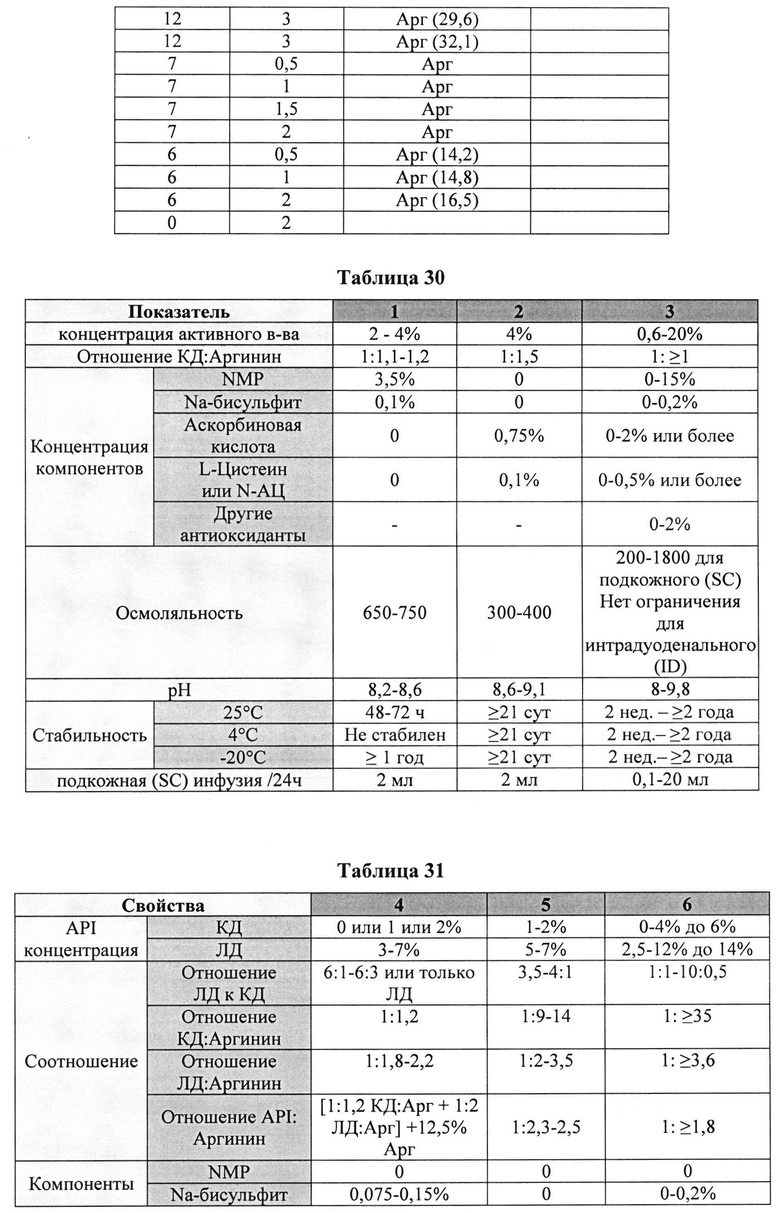
[0020] На Фиг. 1 показаны данные, демонстрирующие основную примесь ("деградант") при времени выхода около 14,5±0,2 мин.
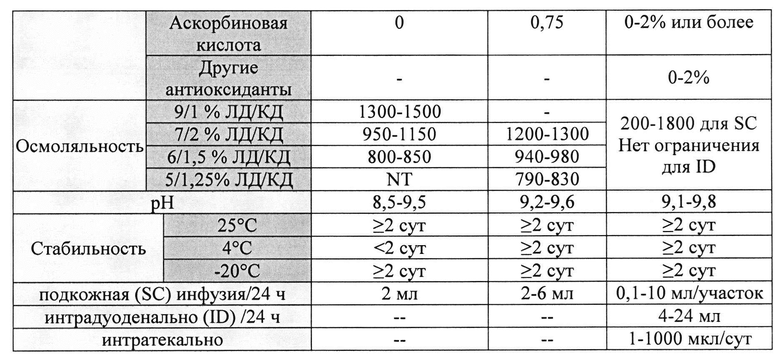
[0021] На Фиг. 2А-2В показаны данные, демонстрирующие типовой МС-спектр при отрицательном (режиме регистрации отрицательных ионов) (2А) и положительном (режиме регистрации положительных ионов) (2В) режимах пика собранной основной примеси в образце состава.
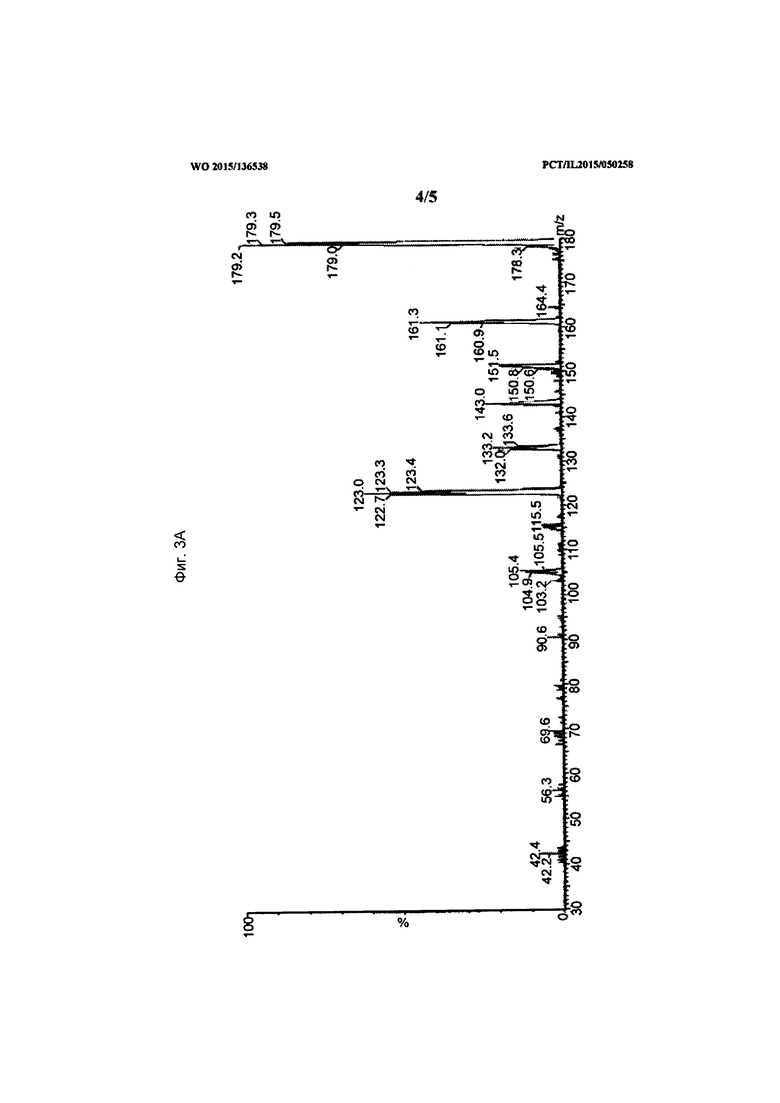
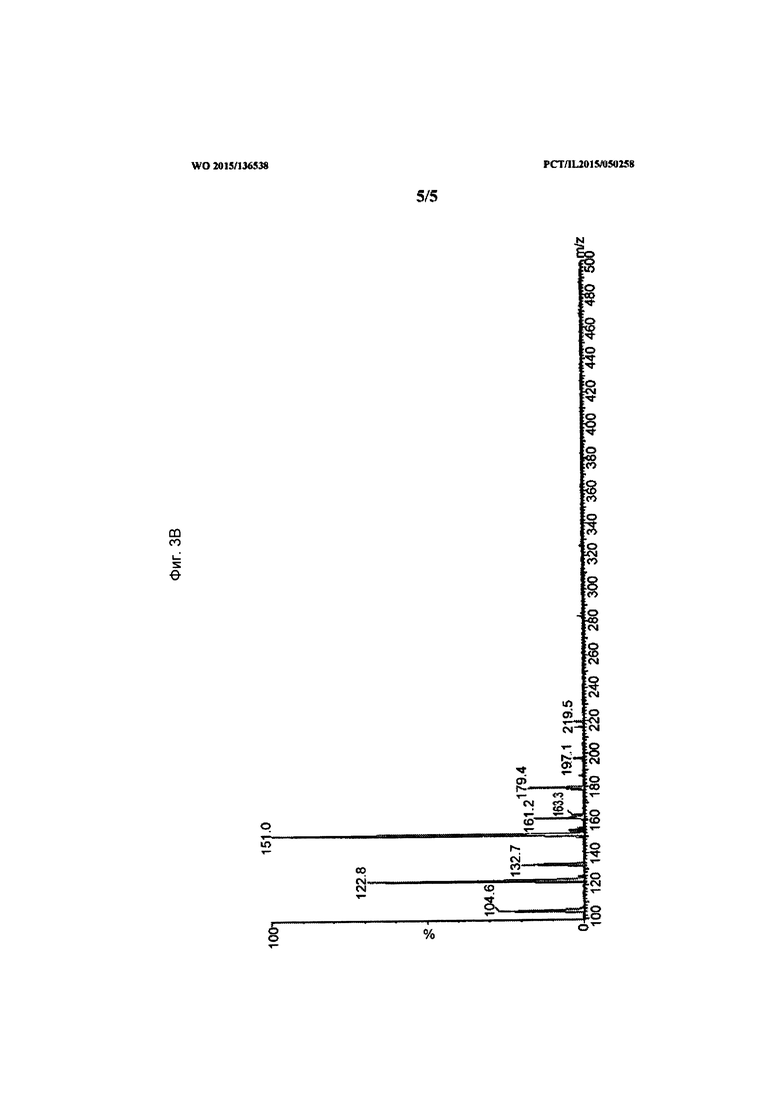
[0022] На Фиг. 3А-3В показаны данные, демонстрирующие типовой МС/МС скан спектра (3А) дочерних ионов (масса иона к заряду M/Z=179) и скан исходного спектра (3В) (масса иона к заряду M/Z=105) пика собранной основной примеси в образце состава.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0023] Согласно настоящему изобретению предложены фармацевтические композиции на основе карбидопы, которые являются высокостабильными в течение длительного периода времени, в частности, в течение нескольких суток, недель, месяцев и лет, и содержат очень малое количество, т.е. безопасное и приемлемое содержание гидразина. Поскольку композиции на основе карбидопы, содержащие антиоксидант, известны из уровня техники, лекарственные композиции, заявленные согласно настоящему изобретению стабилизированы особой комбинацией из двух или более, т.е. 2, 3, 4 или более антиоксидантов, причем один из этих антиоксидантов представляет собой аскорбиновую кислоту или ее соль, а другие антиоксиданты в комбинации антиоксидантов независимо выбирают, например, из L-цистеина, N-АЦ, глутатиона, диацетилцистина, солей вышеуказанных соединений, или бисульфита натрия. Каждая композиция может содержать активные агенты, не являющиеся карбидопой, в частности леводопу, а также другие ингредиенты для дополнительной стабилизации композиции, например, аргинин (Apr; L-Арг), меглумин или оба аргинин и меглумин, а также одно или более поверхностно-активное вещество.
[0024] Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция (также называемая в данной заявке фармацевтический состав), содержащая карбидопу (и/или ее сложный эфир), по меньшей мере два антиоксиданта (также обозначенные в данной заявке как скавенджеры о-хиноновой природы (o-quinone scavengers), и фармацевтически приемлемый носитель, где один из указанных антиоксидантов представляет собой аскорбиновую кислоту или ее соль, и указанная композиция содержит менее 1 мкг/мл гидразина, определенного путем ГХ-МС, или до (и не более) 5% по массе 3,4-дигидроксифенил-2-метилпропионовой кислоты относительно начального количества карбидопы, определенного путем ВЭЖХ.
[0025] В отдельных примерах реализации настоящего изобретения фармацевтическая композиция содержит менее 1,0, 0,75, 0,5, 0,25, 0,1, 0,05, или 0,025 мкг/мл гидразина, определенному путем ГХ-МС, в частности менее 0,1 или 0.05 мкг/мл гидразина, или от 0,1 до 0,5 мкг/мл гидразина, например, определенному путем ГХ-МС; или менее 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3%, 0,2%, 0,1% или 0,05% по массе деграданта относительно начального количества карбидопы, определенного путем ВЭЖХ.
[0026] В отдельных примерах реализации настоящего изобретения фармацевтическая композиция содержит от 0,1% до 10% по массе карбидопы. В частных случаях данных примеров реализации фармацевтическая композиция согласно настоящему изобретению содержит от 0,5% до 6%, предпочтительно от 0,75% до 4%, более предпочтительно 0,75%, 1,4%, 3%, 3,3% или 4% по массе карбидопы.
[0027] Фармацевтическая композиция согласно настоящему изобретению содержит комбинацию двух или более антиоксидантов, где один из указанных антиоксидантов представляет собой аскорбиновую кислоту или ее соль. Примеры солей аскорбиновой кислоты включают, не ограничиваясь ими, аскорбат натрия, аскорбат калия, аскорбат кальция, аскорбилстеарат и аскорбилпальмитат, причем предпочтительно аскорбат натрия.
[0028] В отдельных примерах реализации настоящего изобретения фармацевтическая композиция содержит от 0,1% до 10% по массе аскорбиновой кислоты или ее соли. В частных случаях данных примеров реализации композиция содержит от 0,2% до 2%, предпочтительно от 0,4% до 1,3%, более предпочтительно 0,5%, 0,6%, 0,75%, 0,85%, 1,0%, 1,2% или 1,3% по массе аскорбиновой кислоты или ее соли, например, аскорбат натрия, аскорбат калия, аскорбат кальция, аскорбилстеарат и аскорбилпальмитат.
[0029] Согласно настоящему изобретению каждый из антиоксидантов, включенных в фармацевтическую композицию согласно настоящему изобретению, не являющийся аскорбиновой кислотой или ее солью, может быть любым антиоксидантом или скавенджером о-хиноновой природы (o-quinone scavenger), но предпочтительно тот антиоксидант, который совместно с аскорбиновой кислотой или ее солью обеспечивает комбинацию, способную сильно ингибировать распад карбидопы, таким образом минимизировать образование гидразина и, следовательно, существенно стабилизировать указанную композицию в течение длительного периода времени, например, в течение нескольких часов, суток, недель, месяцев или лет.
[0030] В отдельных примерах реализации настоящего изобретения каждый из антиоксидантов, не являющийся аскорбиновой кислотой или ее солью, независимо выбирают из L-цистеина (L-Цис) или производного цистеина, такого как N-АЦ, глутатиона, диацетилцистина, S-метил-N-ацетилцистеин амида, ацетильных производных S-метил-N-ацетилцистеин метилгидразина, S-метилцистеин морфолинамида, и S-метил-N-ацетилцистеин морфолинамида, солей указанных соединений, или бисульфита, таких как бисульфит натрия, гидросульфит натрия или матабисульфит натрия, но предпочтительно из L-цистеина или его соли, такой как гидрохлорид цистеина, N-АЦ, или бисульфита натрия. В частных случаях данных примеров реализации фармацевтическая композиция согласно настоящему изобретению содержит (i) от 0,001% до 5%, предпочтительно от 0,01% до 1%, более предпочтительно от 0,1% до 0,6%, 0,3%, или 0,4% по массе L-цистеина или его соли, такой как гидрохлорид цистеина; и/или (ii) от 0,001% до 5%, предпочтительно от 0,01% до 1%, более предпочтительно 0,1%, 0,2%, 0,3% или 0,4% по массе N-АЦ; и/или (iii) от 0,01% до 2%, предпочтительно от 0,075% до 0,75%, более предпочтительно 0,1% по массе бисульфита натрия; и/или (iv) от 0,001% до 5%, предпочтительно от 0,1% до 1% по массе глутатиона; и/или (v) от 0,001% до 5%, предпочтительно от 0,01% до 1% по массе диацетилцистина или его соли.
[0031] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит от 0,1% до 10% по массе карбидопы; от 0,1% до 10% по массе аскорбиновой кислоты или ее соли, такой как аскорбат натрия, аскорбат калия, аскорбат кальция, аскорбилстеарат и аскорбилпальмитат; и (i) от 0.001% до 5% по массе L-цистеина или его соли, такой как гидрохлорид цистеина; или (ii) от 0,001% до 5% по массе N-АЦ; или (iii) от 0,001% до 5% по массе глутатиона; или (iv) от 0,001% до 5% по массе диацетилцистина или его соли; или (v) от 0,01% до 2% по массе бисульфита натрия. В частных случаях данных примеров реализации композиция содержит от 0,5% до 6%, предпочтительно от 0,75% до 4%, более предпочтительно 0,75%, 1,4%, 3%, 3,3% или 4% по массе карбидопы; от 0,2% до 2%, предпочтительно от 0,4% до 1,3%, более предпочтительно 0,5%, 0,6%, 0,75%, 0,85%, 1,0% или 1,2% по массе аскорбиновой кислоты или ее соли; и (i) от 0,01% до 1%, предпочтительно от 0,1% до 0,6% по массе L-цистеина или его соли; (ii) от 0,01% до 1%, предпочтительно от 0,1% до 0,4% по массе N-АЦ; или (iii) от 0,075% до 0,75% по массе бисульфита натрия.
[0032] В частных случаях данного аспекта фармацевтическая композиция согласно настоящему изобретению в соответствии с любым из вышеуказанных примеров реализации изобретения также содержит (i) леводопу (и/или ее сложный эфир); (ii) аргинин, меглумин, соль указанных соединений, или их комбинацию; или (iii) оба (i) и (ii); и при необходимости также содержит поверхностно-активное вещество. Частным случаем таких композиций являются композиции, не содержащие леводопу.
[0033] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит карбидопу и по меньшей мере два антиоксиданта, которые определены в любом из вышеуказанных примеров реализации изобретения, и также содержит леводопу. Частным случаем таких композиций являются композиции, содержащие менее 1% (например, менее 0,5%, 0,25%, 0,1%, 0,05% или 0,01%) по массе леводопы, тогда как другие композиции содержат от 1% до 20%, предпочтительно от 2% до 16% (например, от 2% до 8%, от 4% до 8%, от 5% до 7%, от 8% до 16%, от 10% до 15%, от 12% до 15%), более предпочтительно 4%, 6%, 12% или 13,2% по массе леводопы.
[0034] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит карбидопу и по меньшей мере два антиоксиданта, которые определены в любом из вышеуказанных примеров реализации изобретения, и также содержит аргинин, меглумин, или их комбинацию. В частном случае композиции содержат от 0,1% до 42% (например, от 0,1% до 40%, от 10% до 25%, от 13% до 18%, от 14% до 16%, от 12% до 40%, от 25% до 40%, от 30% до 38%, от 10% до 20% и от 20% до 42%), предпочтительно от 2% до 40% или от 10% до 38%, более предпочтительно от 12% до 36% или от 15,2% до 32% по массе аргинина, меглумина или их комбинации. Следует учесть, что некоторые частные случаи композиций предполагают содержание только аргинина, другие частные случаи композиций - только меглумина, и также некоторые частные случаи композиций предполагают содержание обоих компонентов, аргинина и меглумина.
[0035] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит карбидопу; по меньшей мере два антиоксиданта; и (i) леводопу; (ii) аргинин, меглумин или их комбинацию; или (iii) оба (i) и (ii), в соответствии с любым из вышеуказанных примеров реализации изобретения, и также содержит поверхностно-активное вещество, например, неионогенное поверхностно-активное вещество, такое как полисорбат 20 [полиоксиэтилен(20)сорбитанмонолаурат], полисорбат 40 [полиоксиэтилен (20) сорбитанмонопальмитат], полисорбат 60 [полиоксиэтилен (20) сорбитанмоностеарат], полисорбат 80 [полиоксиэтилен (20) сорбитанмоноолеат; Твин® 80] или их комбинацию. В частном случае композиции содержат от 0,01% до 5%, предпочтительно от 0,1% до 0.5% или от 0,2% до 0,4%, более предпочтительно 0,3% по массе вышеуказанного неионогенного поверхностно-активного вещества, предпочтительно полисорбата 80.
[0036] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит карбидопу и по меньшей мере два антиоксиданта, в соответствии с любым из вышеуказанных примеров реализации изобретения, и также содержит от 1% до 20% по массе леводопы; и от 0,1% до 42% по массе аргинина, меглумина или их комбинации. Частными случаями данных примеров реализации являются композиции, содержащие от 2% до 16% (например, от 2% до 8%, от 4% до 8%, от 5% до 7%, от 8% до 16%, от 10% до 15%, от 12% до 15%), предпочтительно 4%, 6%, 12% или 13,2% по массе леводопы; и от 0,1% до 42% (например, от 0,1% до 40%, от 10% до 25%, от 13% до 18%, от 14% до 16%, от 12% до 40%, от 25% до 40%, от 30% до 38%, от 10% до 20% и от 20% до 42%), предпочтительно от 10% до 38%, более предпочтительно от 12% до 36% или от 15,2% до 32% по массе аргинина, меглумина или их комбинации. В частных случаях этих примеров реализации, композиция согласно настоящему изобретению также содержит поверхностно-активное вещество, например, полисорбат 80, в частности от 0,1% до 0,5% или от 0,2% до 0,4%, предпочтительно 0,3% по массе полисорбата 80.
[0037] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит (i) от 0,1% до 6% по массе карбидопы; (ii) от 0,1% до 10% по массе аскорбиновой кислоты или ее соли; (iii) от 0,01% до 1% по массе L-цистеина или его соли, N-АЦ, или глутатиона; (iv) от 0% до 16% по массе леводопы; и (v) от 0,1% до 40% по массе аргинина.
[0038] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению также содержит (i) от 0,1% до 10% по массе карбидопы; (ii) от 0,1% до 10% по массе аскорбиновой кислоты или ее соли, такой как аскорбат натрия, аскорбат калия, аскорбат кальция, аскорбилстеарат и аскорбилпальмитат; (iii) от 0,001% до 5% по массе L-цистеина или его соли, такой как гидрохлорид цистеина; или от 0,001% до 5% по массе N-АЦ; или от 0,001% до 5% по массе глутатиона; или от 0,001% до 5% по массе диацетилцистина или его соли; или от 0,01% до 2% по массе бисульфита натрия; (iv) от 1% до 20% по массе леводопы; (v) от 0,1% до 42% по массе аргинина, меглумина, или их комбинации; и при необходимости (vi) от 0,01% до 5% по массе полисорбата 80, причем композиция содержит менее 1 мкг/мл, предпочтительно менее 0,5 мкг/мл, более предпочтительно менее 0,1 мкг/мл, гидразина. В частных случаях этих примеров реализации изобретения композиция содержит (i) от 0,5% до 6%, предпочтительно от 0,75% до 4%, более предпочтительно 0,75%, 1,4%, 3%, 3,3%, или 4% по массе карбидопы; (ii) от 0,2% до 2%, предпочтительно от 0,4% до 1,3%, более предпочтительно 0,5%, 0,6%, 0,75%, 0,85%, 1,0%, 1,2% или 1,3% по массе аскорбиновой кислоты или ее соли; (iii) от 0,01% до 1%, предпочтительно от 0,1% до 0,6% по массе L-цистеина или его соли; от 0,01% до 1%, предпочтительно от 0,1% до 0,4% по массе N-АЦ; или от 0,075% до 0,75% по массе бисульфита натрия; (iv) от 2% до 16%, предпочтительно от 4% до 14%, более предпочтительно 4%, 6%, 12% или 13,2% по массе леводопы; (v) от 2% до 42%, предпочтительно от 10% до 38%, более предпочтительно от 12% до 36% или от 15,2% до 32% по массе аргинина, меглумина или их комбинации; и при необходимости (vi) от 0,1% до 0,5% или от 0,2% до 0,4%, предпочтительно 0,3% по массе полисорбата 80. В других частных случаях данных примеров реализации настоящего изобретения композиция содержит (i) от 0,1% до 3%, предпочтительно от 0,5% до 2% или от 0,6% до 1,5% по массе карбидопы; (ii) от 0,1% до 10%, предпочтительно от 0,1% до 2% или от 0,3% до 0,7% по массе аскорбиновой кислоты или ее соли; (iii) от 0,001% до 5%, предпочтительно от 0,1% до 2% или от 0.3% до 0,5% по массе L-цистеина или его соли, N-АЦ, глутатиона или диацетилцистина; (iv) от 2% до 8%, предпочтительно от 4% до 8% или от 5% до 7% по массе леводопы; (v) от 10% до 25%, предпочтительно от 13% до 18% или от 14% до 16% по массе аргинина, меглумина или их комбинации; и при необходимости (vi) от 0,01% до 5% или от 0,1% до 0,5%, или 0,3% по массе полисорбата 80. В других частных случаях данных примеров реализации настоящего изобретения композиция содержит (i) от 1% до 4%, предпочтительно от 1,2% до 4% или от 2% до 4% по массе карбидопы; (ii) от 0,1% до 10%, предпочтительно от 0,1% до 2% или от 0,3% до 0,7% по массе аскорбиновой кислоты или ее соли; (iii) от 0,001% до 1%, предпочтительно от 0,1% до 1% или от 0,2% до 0,5% по массе L-цистеина или его соли, N-АЦ, глутатиона или диацетилцистина; (iv) от 8% до 16%, предпочтительно от 10% до 15% или от 12% до 15% по массе леводопы; (v) от 12% до 40%, предпочтительно от 25% до 40% или от 30% до 38% по массе аргинина, меглумина или их комбинации; и при необходимости (vi) от 0,01% до 5% или от 0,1% до 0,5%, или 0,3% по массе полисорбата 80. В других частных случаях данных примеров реализации настоящего изобретения композиция содержит (i) от 0,1% до 1,5% по массе карбидопы; (ii) от 0,1% до 1,5%, предпочтительно от 0,4% до 0,6% или от 0,4% до 1% по массе аскорбиновой кислоты или ее соли; (iii) от 0,1% до 0,7% по массе L-цистеина или его соли, или N-АЦ; (iv) от 4% до 8% по массе леводопы; (v) от 10% до 20% по массе аргинина; и при необходимости (vi) от 0,1% до 0,5% по массе полисорбата 80. В других частных случаях этих примеров реализации настоящего изобретения композиция содержит (i) от 1% до 4% по массе карбидопы; (ii) от 0,1% до 1,5%, предпочтительно от 1% до 1,4% по массе аскорбиновой кислоты или ее соли; (iii) от 0,1% до 1%, предпочтительно от 0,1% до 0,5% по массе L-цистеина или его соли, или N-АЦ; (iv) от 8% до 16% по массе леводопы; (v) от 20% до 40% по массе аргинина, меглумина или их комбинации.
[0039] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению также содержит (i) от 12% до 15% по массе леводопы, от 1,2% до 4% по массе карбидопы, от 32% до 42%, например, 32%, 33%, 34%, 35% или 36% по массе аргинина или меглумина, от 1% до 1,3% по массе аскорбата натрия, 0,1-0,5% по массе L-цистеина (или гидрохлорид цистеина) или N-АЦ, и при необходимости полисорбата 80, например, 0,3% по массе; или (ii) 6% по массе леводопы, от 0,6% до 1,4% по массе карбидопы, от 15% до 16% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,3% по массе полисорбата 80, и 0,5% по массе N-АЦ или 0,4% по массе L-цистеина.
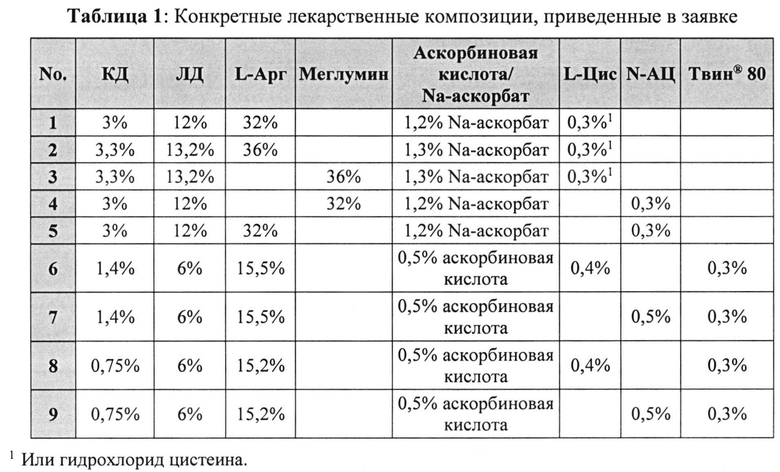
[0040] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению имеет состав, описанный в заявке и представленный в Таблице 1. Указанные композиции содержат (i) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе аргинина, 1,2% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина; (ii) 13,2% по массе леводопы, 3,3% по массе карбидопы, 36% по массе аргинина, 1,3% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина; (iii) 13,2% по массе леводопы, 3,3% по массе карбидопы, 36% по массе меглумина, 1,3% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина; (iv) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе меглумина, 1,2% по массе аскорбата натрия и 0,3% по массе N-АЦ; (v) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе аргинина, 1,2% по массе аскорбата натрия и 0,3% по массе N-АЦ; (vi) 6% по массе леводопы, 1,4% по массе карбидопы, 15,5% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,4% по массе L-цистеина и 0,3% по массе полисорбата 80; (vii) 6% по массе леводопы, 1,4% по массе карбидопы, 15,5% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,5% по массе N-АЦ и 0,3% по массе полисорбата 80; (viii) 6% по массе леводопы, 0,75% по массе карбидопы, 15,2% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0.4% по массе L-цистеина и 0,3% по массе полисорбата 80; или (ix) 6% по массе леводопы, 0,75% по массе карбидопы, 15,2% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,5% по массе N-АЦ и 0,3% по массе полисорбата 80. Композиции по вышеуказанным вариантам (i)-(v) могут также содержать полисорбат 80, например, 0,3% по массе.
[0041] Лекарственные композиции согласно настоящему изобретению могут также содержать антиоксиданты, такие как ди-трет-бутил-метилфенолы, трет-бутил-метоксифенолы, полифенолы, токоферолы и убихиноны, например, кофейную кислоту; и/или глюкозамин, которые могут, например, заменять некоторое или все количество аргинина, содержащегося в составах. Композиции согласно настоящему изобретению могут также содержать ингибитор тирозиназы, такой как, без ограничения: каптоприл, метимазол, кверцетин, арбутин, алоэзин, N-ацетилглюкозамин, ретиноевая кислота, α-токоферил ферулат, Mg аскорбил фосфат (MAP), субстратные аналоги, например, бензоат натрия и L-фенилаланин, Cu++ хелатирующие агенты, например, Na2-ЭДТА, Na2-ЭДТА-Ca, DMSA (сукцимер), DPA (D-пеницилламин), триентин-HCl, димеркапрол, клиохинол, тиосульфат натрия, ТЕТА (триэтилентетрамин), ТЕРА (тетраэтиленпентамин), куркумин, неокупроин, таннин и купризон. Композиции могут также содержать фармацевтически приемлемые наполнители, носители, растворители или адъюванты, а также другие инертные ингредиенты и вспомогательные вещества.
[0042] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению содержит карбидопу; по меньшей мере два антиоксиданта; леводопу; аргинин, меглумин или их комбинацию; и при необходимости поверхностно-активное вещество в соответствии с вышеприведенными примерами реализации изобретения, где композиция имеет pH от 9,1 до 10, предпочтительно 9,4-9,8, более предпочтительно от 9,6 до 9,8.
[0043] Как заявлено выше, лекарственные композиции согласно настоящему изобретению являются высокостабильными благодаря особой антиоксидантной комбинации, которая стабилизирует карбидопу в композиции и сильно ингибирует ее распад до деграданта и гидразина. Кроме того, эти композиции могут храниться в различных условиях и температурах, например, при температуре до 25°C, длительный период времени, в частности до нескольких лет, пока сохраняется безопасная и приемлемая концентрация гидразина.
[0044] В отдельных примерах реализации фармацевтическая композиция согласно настоящему изобретению, соответствующая любому из вышеуказанных примеров реализации содержит менее 1 мкг/мл, предпочтительно менее 0,5 мкг/мл, более предпочтительно менее 0,1 мкг/мл гидразина, определенному путем ГХ-МС, или менее 5%, предпочтительно менее 1%, более предпочтительно менее 0,75%, 0,6%, 0,5%, 0,4%, 0,3%, 0,25%, 0,2%, 0,1%, 0,05% или 0,01%, по массе деграданта относительно начального количества карбидопы, определенному путем ВЭЖХ, после хранения в течение 1, 2, 3, 4, 5, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24 ч; в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 28 или 30 суток; в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев; или в течение 1, 1,5, 2, 2,5 или 3 лет, при температуре в диапазоне от -20°C до 25°C, например, при -20°C, при 2-8°C или 25°C.
[0045] Лекарственные композиции согласно настоящему изобретению могут быть приготовлены с использованием общепринятых способов, например, описанных в руководстве-справочнике по фармации (Remington: The Science and Practice of Pharmacy, 19th Ed., 1995), согласно которому описаны процедуры проведения в экспериментальной части настоящей заявки. Например, указанные композиции могут быть приготовлены путем смешивания всех ингредиентов, т.е. карбидопы, антиоксидантов, и при необходимости леводопы, аргинина и/или меглумина и поверхностно-активного вещества, в виде порошков, в количестве как описано выше, с получением порошковой смеси. Затем к смеси может быть добавлена вода для получения суспензии. Вода может быть предварительно нагрета или суспензия может быть нагрета до необходимой температуры в течение времени, достаточного для растворения смеси, например, от 40°C до 100°C, от 40°C до 80°C или от 60°C до 90°C, в частности, 65±5°C, 72±5°C или 73±3°C, например, путем добавления предварительно нагретой воды и/или путем нагревания смеси на горячей водяной бане, например, в течение 3, 5, 10, 20, 30, 40, 50, 60 мин или более, для получения раствора, при необходимости с перемешиванием. Затем следует охлаждение раствора для получения композиции. N2 может быть использован для заполнения свободного пространства в контейнере. Конкретные способы приготовления описаны далее в Примере 1. Лекарственные композиции, описанные в настоящем изобретении, могут быть стерилизованы, например, с применением фильтров с размером отверстий 0,2 мкм, таких как нейлоновые фильтры или мембраны на основе поливинилидендифторида (PVDF).
[0046] Фармацевтическая композиция согласно настоящему изобретению может быть изготовлена в виде жидкости, геля, крема, твердого вещества, пленки, эмульсии, суспензии, раствора, лиофилизата или аэрозоли, но предпочтительно в виде жидкости. Указанные композиции могут быть приготовлены для любого способа введения, но предпочтительно приготовленные для подкожного, трансдермального, интрадермального, внутривенного, внутримышечного, внутритрахеального, интратекального, интрадуоденального или перорального введения. Композиции также могут быть приготовлены для ингаляции или прямой абсорбции слизистыми оболочками.
[0047] Согласно другому аспекту настоящее изобретение относится к способу лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, у пациентов, нуждающихся в таком лечении, указанный способ включает введение указанному пациенту эффективного количества лекарственной композиции, как описано в любом из вышеуказанных примеров реализации, т.е. композиции на основе карбидопы, содержащей безопасную и приемлемую концентрацию гидразина. Болезнь, расстройство или состояние, связанное с потерей дофамина или дофаминергических нейронов, может представлять собой неврологические или двигательные расстройства, включая синдром беспокойных ног, болезнь Паркинсона, вторичный паркинсонизм, болезнь Хантингтона, синдром Шая-Дрейджера и состояния, обусловленные повреждением мозга, включая интоксикацию монооксидом углерода или марганцем. В одном из примеров реализации изобретения неврологическое расстройства представляет собой болезнь Паркинсона.
[0048] Согласно способу, описанному в настоящем изобретении, фармацевтическая композиция может вводиться в течение определенного периода времени, например, в течение нескольких суток, недель, месяцев или лет; и эффективна при введении подходящим способом, например, подкожно, транс дермально, внутривенно, внутримышечно, интрадермально, внутритрахеально, интратекально, интрадуоденально или перорально, а также путем ингаляции или прямой абсорбции слизистыми оболочками.
[0049] В отдельных примерах реализации введение лекарственной композиции в соответствии со способом согласно настоящему изобретению по существу непрерывно, например, подкожно или трансдермально. Термин "по существу непрерывно", используемый в данной заявке означает, что одноразовая доза композиции вводится указанному пациенту или индивидууму в течение определенного заданного периода времени, например, в течение периода по меньшей мере 10, 20 или 30 мин, 1 ч, 2 ч, 4, ч, 6 ч, 8 ч, 12 ч, 15 ч, 18 ч, 21 ч или 24 ч, в отличие от болюсного введения лекарственного средства, например, принимаемой перорально таблетки или болюсной инъекции. По существу непрерывное введение указанных лекарственных композиций может быть достигнуто, используя, например, трансдермальный пластырь или насосное устройство, которые обеспечат непрерывное введение композиции пациенту в течение определенного времени.
[0050] В отдельных примерах реализации жидкие композиции в соответствии с настоящим изобретением, в частности, содержащие леводопу, могут быть введены со скоростью от 0,01 мл/ч/участок до 0,4 мл/ч/ участок, например, от 0,16 мл/ч/участок до 0,24 мл/ч/участок. Указанные скорости введения могут поддерживаться постоянными в течение дня и ночи или варьироваться в соответствии с необходимостью для пациента, например, может учитывать состояние отдыха или сна, или прогулки, или период высокой активности. Следовательно, указанные лекарственные композиции могут вводиться, например, при скорости 0,32 мл/ч/участок утром (например, в течение 2-4 ч до прогулки), 0,24 мл/ч/участок в течение дня или активного периода (например, от 10 до 12 ч), и/или 0,08 мл/ч/участок в состоянии отдыха или ночной период. В отдельных примерах реализации изобретения указанные композиции вводятся, например, интрадуоденально, при скорости введения 1,0 мл/ч в течение дня или активного периода (например, в течение 2-3 ч до прогулки и от 10 до 12 ч в последующий период), и от 0 до 0,5 мл/ч в состоянии отдыха или ночной период. В отдельных примерах реализации изобретения указанные композиции могут вводиться при скорости 1,25 мл/ч в течение дня или активного периода (например, в течение 2-3 ч до или после прогулки и от 10 до 14 ч в последующий период), и от 0 до 0,5 мл/ч (например, 0,5±0,25 мл/ч) в состоянии отдыха или ночной период. В отдельных примерах реализации изобретения указанные композиции могут вводиться при скорости от 0,1 до 1000 мкл/ч/участок; или в объеме от 2 до 10 мл/24 ч/участок, предпочтительно от 4 до 6 мл/24 ч/участок; или при дозе от 80 до 800 мг леводопы/день и от 20 до 200 мг карбидопы/день; или при скорости от 240 до 360 мг леводопы и от 60 до 90 мг карбидопы/день/участок.
[0051] В отдельных примерах реализации фармацевтическая композиция в соответствии с настоящем изобретением может быть введена по существу непрерывно, например, с использованием насоса для подкожной инфузии (например, инсулиновая помпа) при средней скорости 10-1000 мкл/ч (например, 10-250 мкл/ч), 300±100 мкл/ч или 200±40 мкл/ч непрерывно в течение 24 ч; 440±200 мкл/ч или 200±50 мкл/ч непрерывно в течение 16 ч (в течение прогулки) и от 0 до 80 мкл/ч или от 0 до 200 мкл/ч в течение 8 ч (ночной период); или с использованием трансдермального пластыря. По существу непрерывное введение композиции пациенту может быть удвоено или утроено с применением более одного насоса, пластыря или сайта (зоны) инфузии. В отдельных примерах реализации изобретения по существу непрерывное введение, например, жидкой композиции, может проводиться при средней скорости 0,2-2 мкл/ч, или 1±0,5 мкл/ч непрерывно в течение 24 ч; 1±0,5 мкл/ч непрерывно в течение 16 ч (в течение прогулки) и от 0 до 0,5 мкл/ч в течение 8 ч (ночной период), посредством насоса, трансдермального пластыря или комбинации устройств для доставки, приемлемых для, например, подкожного, внутривенного, внутритрахеального и/или интрадуоденального введения.
[0052] В отдельных примерах реализации фармацевтическая композиция в соответствии с настоящем изобретением используется для лечения указанных неврологических или двигательных расстройств путем однократного или немедленного введения, например, путем ингаляции или инъекции.
[0053] Термин "фармацевтически приемлемый носитель" или "фармацевтически приемлемое вспомогательное вещество" в данной заявке взаимозаменяемо относится к любому и всем растворителям, диспергаторам, консервантам, антиоксидантам, покрывающим агентам, изотоническим и задерживающим абсорбцию агентам и подобным веществам, совместимым с фармацевтическим введением. Применение указанных сред и ингредиентов для фармацевтически активных веществ хорошо известно специалисту в данной области техники. Следует отметить, что композиции согласно настоящему изобретению могут также содержать другие активные агенты, обеспечивающие дополнительные, добавочные или усиливающие терапевтические функции.
[0054] Термин "приемлемый" в отношении носителя или вспомогательного вещества, включенного в фармацевтическую композицию, относится к любому носителю, ингредиенту или молекулярному соединению, которое не дает неблагоприятной, аллергической или другой нежелательной реакции при введении млекопитающему или человеку в зависимости от обстоятельств. Для введения человеку композиции должны отвечать требованиям стерильности, пирогенности и стандартам общей безопасности и чистоты, например, в соответствии с требованиями Администрации США по пищевым продуктам и лекарственным веществам (U.S. Food and Drug Administration (FDA)) или Европейского агентства по лекарственным средствам (European Medicines Agency (EMA)).
[0055] Термин "физиологически приемлемый pH" принят для обозначения pH, например, составов или композиций, который способствует введению составов или композиций пациенту без оказания существенного негативного влияния, например, pH от 4 до 9,8 (например, от 4±0,3 до 9,5±0,3).
[0056] Термин "температура окружающей среды" в данной заявке относится к температурному диапазону от 10°C до 30°C. В отдельных примерах реализации изобретения температура окружающей среды составляет 25°C.
[0057] Процентное содержание, приведенное в данной заявке в отношении фармацевтических композиций согласно настоящему изобретению представлено по массе, если не указано иное.
[0058] В другом аспекте настоящее изобретение относится к фармацевтической композиции как описано выше, т.е. композиции на основе карбидопы, содержащей безопасную и приемлемую концентрацию гидразина, для применения для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона.
[0059] В другом аспекте настоящее изобретение относится к применению фармацевтической композиции как описано выше, т.е. композиции на основе карбидопы, содержащей безопасную и приемлемую концентрацию гидразина, для приготовления лекарственного средства для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона.
[0060] В другом аспекте настоящее изобретение относится к набору, содержащему по меньшей мере один, т.е., 1, 2, 3 или более контейнеров, каждый из которых содержит фармацевтическую композицию согласно любому из вышеуказанных примеров реализации изобретения, где указанная композиция представлена в количестве, достаточном для лечения пациента, нуждающегося в лечении болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например, болезни Паркинсона, в течение по меньшей мере 1 суток, 1 недели, 1 месяца, 2 месяцев, 6 месяцев или 1 года. Контейнеры, входящие в набор согласно настоящему изобретению могут быть, например, предварительно наполненными флаконами или виалами, подходящими для использования пациентом или медицинским работником.
[0061] В отдельных примерах реализации набор в соответствии с настоящим изобретением также содержит предварительно наполненный флакон, содержащий фармацевтическую композицию, как описано выше, например, предварительно наполненный флакон, содержащий одноразовую дозу или дозу, подходящую для одноразового введения, или многоразовых введений указанной композиции пациенту, и при необходимости инструкции к применению. Указанные контейнеры, виалы, предварительно наполненные шприцы и другие устройства могут содержать, например, 1-10 мл заявленной композиции. В частном случае примера реализации набор согласно настоящему изобретению содержит одну или более предварительно наполненных виал, контейнеров или шприцов, каждый из которых содержит заявленную жидкую фармацевтическую композицию в количестве, подходящем для наполнения шприцевой помпы или безыгольной помпы (patch pump), например, 1-10 мл, 1-2 мл, 2-5 мл, 1-2 мл или 4-10 мл заявленной композиции.
[0062] В соответствии с повышенной стабильностью композиций согласно настоящему изобретению, в частном случае наборы согласно настоящему изобретению включают запас композиции в количестве, достаточном для применения по меньшей мере в течение 1, 2, 3, 4 или 5 сут; 1, 2, 3 или 4 недели; 1, 2, 3, 4, 6 или 9 месяцев; или 1 или 1,5 года, путем введения пациенту, композиция может быть упакована, например, в подходящие дозированные формы (например, стандартная доза). Указанные наборы могут при необходимости содержать инструкции по их применению. Например, набор для дневного применения может содержать один, два или более контейнеров или виал с заявленной композицией, инфузионную систему и одноразовое устройство доставки, например, шприц.
[0063] Таким образом, представлено общее описание настоящего изобретения, которое будет далее пояснено примерами, включенными исключительно с целью иллюстрации отдельных аспектов и примеров реализации настоящего изобретения и не предназначенных никоим образом ограничить изобретение.
ПРИМЕРЫ
Пример 1. Процедура приготовления состава
[0064] Составы на основе леводопы (ЛД) и карбидопы (КД) могут быть приготовлены следующим образом:
Способ #1 (L-Арг раствор): L-Арг и Na-бисульфит (Na-Bis) растворяли в воде. Раствор добавляли к порошкам ЛД и КД. Смесь нагревали при перемешивании в течение 13 мин при 75°C до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре (RT) в течение 10 мин для охлаждения.
Способ #2 (все порошки вместе): Все порошки (ЛД, КД, и L-Арг) взвешивали, и добавляли воду с Na-Bis. Суспензию нагревали при перемешивании в течение 13 мин при 75°C до полного растворения. Раствор ЛД/КД выдерживали при комнатной температуре (RT) в течение 10 мин для охлаждения.
Способ #3 (аналогично #2 без предварительного нагрева Na-Bis): Все порошки (ЛД, КД и L-Арг) взвешивали вместе и добавляли воду. Суспензию нагревали при перемешивании в течение 13 мин при 75°C до полного растворения. Раствор ЛД/КД выдерживали при RT в течение 10 мин для охлаждения.
Способ #4 (постадийное приготовление): ЛД и соответствующее количество L-Арг взвешивали; добавляли воду и раствор Na-Bis. Суспензию нагревали в течение 7 мин при 75°C до полного растворения с последующим выдерживанием в течение 7 мин при RT. КД и соответствующее количество L-Арг взвешивали и добавляли к раствору ЛД/Арг при 60°C до полного растворения. В завершении добавляли экстра-количество L-Арг.
Способ #5 (аналогично #4 без предварительного нагрева Na-Bis): ЛД и соответствующее количество L-Арг взвешивали; добавляли воду. Суспензию нагревали в течение 7 мин при 75°C до полного растворения с последующим выдерживанием в течение 7 мин при RT. КД и соответствующее количество L-Арг взвешивали и добавляли к раствору ЛД/Арг при 60°C до полного растворения. В завершении добавляли экстра-количество L-Арг.
[0065] После охлаждения все составы, полученные по указанным способам, разделяли на 3 виалы, и в каждую виалу добавляли воду, раствор Na-Bis или раствор Na-Bis-Apr.
Пример 2. Идентификация основного деграданта в КД-содержащих составах
[0066] Жидкие составы с леводопой, карбидопой и аргинином готовили в соответствии с процедурой, описанной в Примере 1, и проводили ВЭЖХ-анализ в соответствии с аналитической методикой определения стабильности (АРН) для составов карбидопы леводопы с использованием системы Agilent 1100.
[0067] Система ВЭЖХ, описанная в данной заявке, включает следующие компоненты, произведенные Agilent: насосная система (модель G1311A), детектор на диодной матрице (модель G1315B), автосамплер (модель G1329A), дегазатор (модель G1379A), термостат (модель G1330B), модуль термостатируемой колонки (модель G1316A). Использовали новую колонку Synergi 4 мкм Fusion-RP 80А, 250×4,6 мм (Phenomenex®).
[0068] Рабочие условия ВЭЖХ: длина волны: 280 нм; скорость потока: 1,0 мл/мин; вводимый объем пробы: 10 мкл; температура колонки: 30°C; температура термостата: 4°C; время окончания: 27 мин; давление: 105 бар (10500 кПа).
[0069] Приготовление подвижной фазы: Компонент А: ацетонитрил, Компонент В: 20 мМ однозамещенный фосфорнокислый калий, pH=2,4. Мобильную фазу В готовили, отбирая 2,72 г/л однозамещенного фосфорнокислого калия. pH доводили до 2,4 введением H3PO4. Используемый градиент соответствовал данным, представленным в Таблице 2.
[0070] Дилюент (разбавитель): 0,1 М HCl/MeOH 9:1 (8,3 мл HCl 37% к 1 л) --> 0,1 М HCl. STD ЛД = 100,00 мг/100 мл. STD КД = 25,00 мг/100 мл.
[0071] Калибровочная зависимость представлена в Таблице 3.
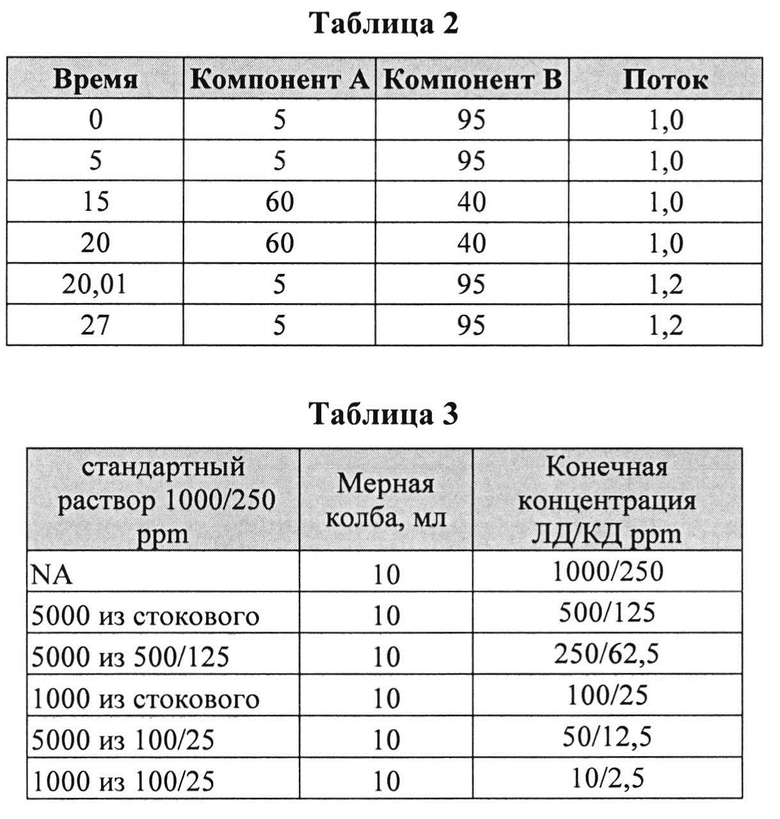
[0072] Один мл образца (леводопа/карбидопа состав) помещали в мерную стеклянную колбу темного стекла на 25 мл и доводили до метки разбавителем (0,1 М HCl/MeOH 9/1). Образец разлагали пероксидом водорода.
[0073] Примесь обнаруживали при времени удерживания около 14,5±0,2 мин (Фиг. 1). Для подтверждения того, что полученный пик действительно отвечает требуемому компоненту, фракцию основного пика деграданта отбирали из системы ВЭЖХ, выпаривали в токе азота и восстанавливали в разбавителе. Полученные образцы тестировали путем ВЭЖХ/МС.
[0074] Изначально, применили анализ МС скана (Фиг. 2А-2В). Неизвестный компонент показал чистый и интенсивный сигнал в положительной модели (режиме регистрации положительных ионов) и более шумовой сигнал в отрицательной модели (режиме регистрации отрицательных ионов). Таким образом, было предположено, что это скорее донор протонов, чем акцептор. Базовый пик в отрицательной модели был при отношении масса к заряду M/Z=195 Да, что позволило охарактеризовать его как (М-H). Различия в массе между этим ионом и пиком масса к заряду M/Z=217 составила 22, и это, возможно, натриевый аддукт. Это явление объясняется присутствием карбоксильных или/и фенольных групп. В связи с указанным фактом предположительная молекулярная масса может быть 196 Да.
[0075] Пик при отношении масса к заряду M/Z=197 (М+Н+)+ не был обнаружен при положительной модели, но получен пик масса к заряду M/Z=197 (М-H2O)+, что является типичным для кислородсодержащей молекулы.
[0076] Дочерние и исходный МС/МС спектры также были получены для определения молекулярной структуры. Пики, обнаруженные в положительной модели при отношении масса к заряду M/Z=179, 161, 151, 133, 123, 105, охарактеризованы как соответствующие. Они были определены как внутренние фрагментарные ионы, полученные от молекулярного иона с отношением масса к заряду M/Z=197. Типичный МС и МС/МС спектр показан на фигурах (Фиг. 3A-3B).
[0077] Химическая формула деграданта представляет собой C10H12O4, с молекулярной структурой, соответствующей 3-(3,4 дигидроксифенил)-2-метилпропановой кислоты.
Пример 3. Влияние аскорбиновой кислоты с ЭДТА или без ЭДТА на стабильность состава ЛД/КД
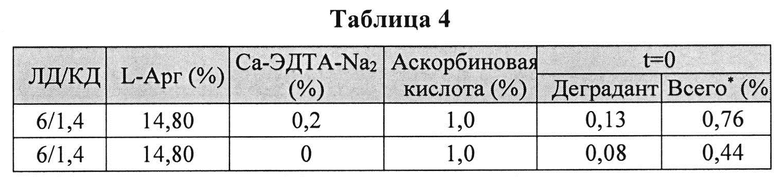
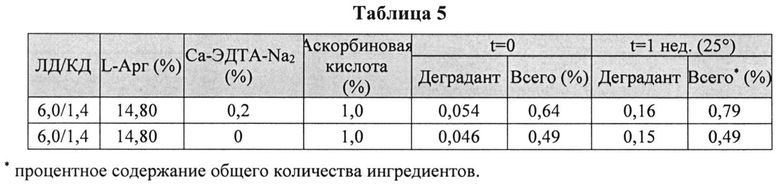
[0078] Жидкие составы готовили путем взвешивания всех порошков (ЛД, КД, ЭДТА, аскорбиновой кислоты и L-Арг) и добавлением воды, предварительно нагретой до 73±3°C. Суспензию помещали на водяную баню при 73±3°C и перемешивали в течение 10 мин до полного растворения. Раствор ЛД/КД выдерживали при RT в течение 10 мин для охлаждения. Растворы разделяли на две стеклянные виалы и выдерживали при +25°C и при -20°C определенный период времени. До начала анализа замороженные виалы выдерживали при RT до полного оттаивания. Затем составы смешивали и готовили к анализу стабильности. Влияние аскорбиновой кислоты с ЭДТА или без ЭДТА на стабильность составов ЛД/КД измеряли путем ВЭЖХ. Уровень деграданта, представленный в Таблице 4 и 5, (как процентное содержание относительно начального количества КД) показывает уровень стабильности составов ЛД/КД, и, предположительно, ЭДТА не имеет существенного влияния на стабильность составов ЛД/КД.
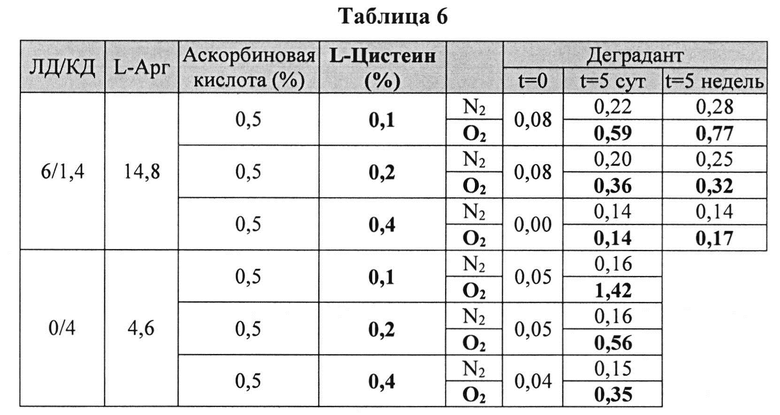
Пример 4. Влияние L-цистеина на стабильность растворов, содержащих КД/ЛД [0079] Жидкие составы готовили путем взвешивания всех порошков (ЛД, КД, L-цистеина, аскорбиновой кислоты и L-Арг) и добавлением воды, предварительно нагретой до 73±3°C. Суспензию помещали на водяную баню при 73±3°C и перемешивали в течение 10 мин до полного растворения. Раствор ЛД/КД выдерживали при RT в течение 10 мин для охлаждения. Для КД составов КД, L-цистеин и аскорбиновую кислоту взвешивали и добавляли воду, предварительно нагретую до 60°C. Растворы разделяли по стеклянным виалам и выдерживали при +25°C и при -20°C определенный период времени. До начала анализа замороженные виалы выдерживали при RT до полного оттаивания. Затем составы смешивали и готовили к анализу стабильности. Влияние L-цистеина на стабильность составов карбидопы при хранении при 25°C, либо выдерживая на воздухе, либо оставляя в анаэробных условиях (N2), измеряли путем ВЭЖХ. Уровень деграданта, представленный в Таблице 6 (как процентное содержание относительно начального количества КД) указывает на уровень стабильности составов карбидопы.
[0080] Как указано в Таблице 6, аскорбиновой кислоты с 0,1% L-цистеина было достаточно для ингибирования образования деграданта в составах, содержащих карбидопу (с или без леводопы), при сохранении в анаэробных условиях при 25°C в течение по меньшей мере 5 недель. В соответствии с данными этой Таблицы также установлено, что L-цистеин сокращает образование деграданта в анаэробных условиях при 25°C в соответствии (в зависимости) с дозой.
[0081] В составах, содержащих карбидопу и 0,4% L-цистеина, образование деграданта ингибировалось в процессе приготовления состава. Эти составы были стабильны по меньшей мере 5 недель при 25°C и в аэробных, и в анаэробных условиях. Составы, содержащие карбидопу, являются более стабильными, когда они также содержат ЛД при выдерживании на воздухе.
Пример 5. Влияние L-цистеина на стабильность состава ЛД/КД 6/1,4%
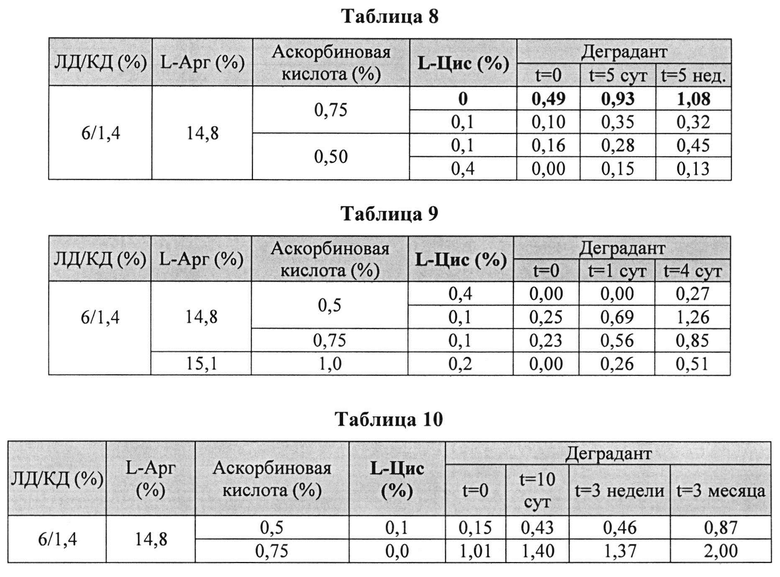
[0082] Жидкие составы готовили аналогично Примеру 3. Влияние L-цистеина на стабильность растворов леводопа/карбидопа 6/1,4% при 25°C анализировали путем ВЭЖХ. Уровень деграданта, представленный в Таблицах 7-10 (как процентное содержание относительно начального количества КД), указывает на уровень стабильности исследуемых составов.
[0083] Результаты показывают, что составы леводопы/карбидопы были более стабильны с обоими компонентами и с аскорбиновой кислотой, и с L-цистеином, по сравнению одной аскорбиновой кислотой, что позволяет предположить, что L-цистеин и аскорбиновая кислота имеют синергическое действие в предотвращении образования деграданта. Другие результаты показывают, что один L-цистеин вообще не имеет эффекта (данные не показаны). Кроме того, L-цистеин ингибировал образование деграданта в процессе приготовления состава и сохранял стабильность состава по меньшей мере до 5 недель при 25°C, в соответствии (в зависимости) с дозой. Повышение количества аскорбиновой кислоты сокращает образование деграданта, но эффект оказался значительно меньший, чем при использовании комбинации аскорбиновой кислоты с L-Цис.

Пример 6. Влияние Твин-80 и аскорбата натрия на стабильность состава ЛД/КД
[0084] Жидкие составы готовили путем взвешивания всех порошков (ЛД, КД, L-цистеина, аскорбиновой кислоты, аскорбата натрия и L-Арг) и добавлением воды, предварительно нагретой до 73±3°C. Суспензию помещали на водяную баню при 73±3°C и перемешивали в течение 10 мин до полного растворения. Раствор ЛД/КД выдерживали при RT в течение 10 мин для охлаждения. Затем добавляли Твин-80. Растворы разделяли по стеклянным виалам и выдерживали при +25°C и при -20°C определенный период времени. До начала анализа замороженные виалы выдерживали при RT до полного оттаивания. Затем составы смешивали и готовили к анализу стабильности. Влияние Твин-80 и аскорбата натрия на стабильность составов карбидопа/леводопа анализировали путем ВЭЖХ. Уровень деграданта, представленный в Таблице 11 (как процентное содержание относительно начального количества КД) указывает на уровень стабильности составов карбидопы/леводопы.

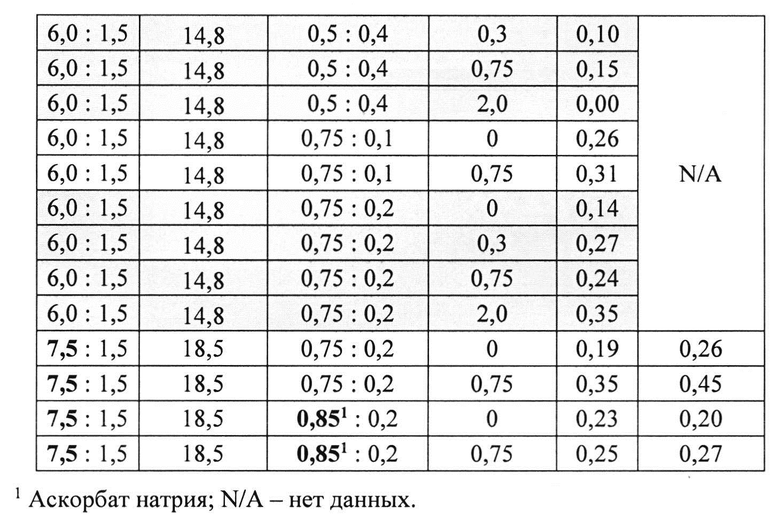
[0085] Результаты показывают, что Твин-80 не влияет на образование деграданта. Также показано, что влияние L-цистеина на стабильность составов было дозозависимым. Также показано, что влияние аскорбата натрия и аскорбиновой кислоты на стабильность составов и образование деграданта было аналогично.
Пример 7. Влияние аскорбиновой кислоты с или без L-Цис или N-АЦ на долговременную стабильность составов ЛД/КД
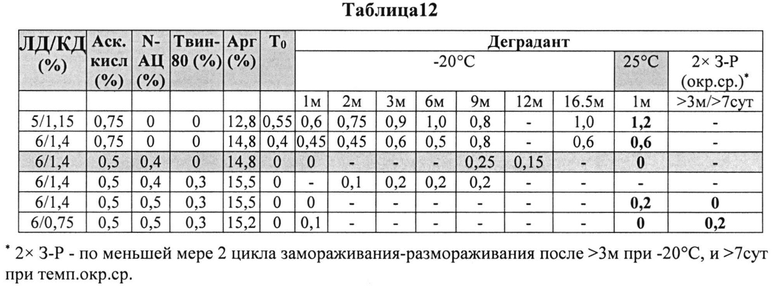
[0086] Жидкие составы готовили путем взвешивания всех порошков (ЛД, КД, аргинина, L-цистеина или N-АЦ, аскорбиновой кислоты или аскорбата натрия) и добавлением воды, предварительно нагретой до 73±3°C. Суспензию помещали на водяную баню при 73±3°C и перемешивали в течение 10 мин до полного растворения. Раствор ЛД/КД выдерживали при RT для охлаждения. Затем добавляли Твин-80. Растворы разделяли по стеклянным виалам и выдерживали при +25°C и при -20°C определенный период времени. До начала анализа замороженные виалы выдерживали при RT до полного оттаивания. Затем составы смешивали и готовили к анализу стабильности. Влияние аскорбиновой кислоты с или без внесения L-цистеина или N-АЦ на стабильность составов карбидопы/леводопы анализировали путем ВЭЖХ. Уровень деграданта, представленный в Таблице 12 (как процентное содержание относительно начального количества КД) указывает на уровень стабильности составов карбидопы/леводопы.
[0087] Результаты, представленные в Таблице 12, позволяют предположить, что составы, содержащие оба компонента и аскорбиновую кислоту и N-АЦ более стабильны, чем составы, содержащие только аскорбиновую кислоту при а) Т0, т.е. непосредственно после приготовления состава, b) по меньшей мере в течение 9 месяцев при -20°C, и c) по меньшей мере в течение 1 месяца при температуре окружающей среды.
Пример 8. Влияние антиоксидантов на стабильность составов КД
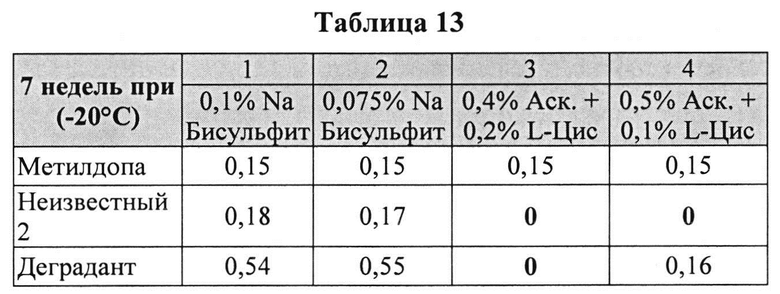
[0088] Жидкие составы карбидопы и аргинина готовили, как описано выше. Влияние антиоксидантов на стабильность составов карбидопы анализировали путем ВЭЖХ. Уровень деграданта, представленный в Таблицах 13 и 14 (как процентное содержание относительно начального количества КД), указывает на уровень стабильности составов карбидопы.
[0089] Результаты, представленные в Таблицах 13 и 14, позволяют предположить, что составы, содержащие аскорбиновую кислоту + L-цистеин, были значительно более устойчивы, чем составы, содержащие Na-бисульфит (составы 3 и 4 против составов 1 и 2). Аналогичное количество примесей было определено с 0,075 и 0,1% Na-бисульфита, обусловливающее, что был достигнут максимально возможный уровень сохранения с Na-бисульфитом.
[0090] В соответствии с полученными результатами комбинация аскорбиновая кислота/L-цистеин способна предотвратить образование деграданта и других примесей, таких как гидразин (см. другие примеры), в то время как Na-бисульфит не обеспечивает сохранение составов, содержащих карбидопу, в той же степени.
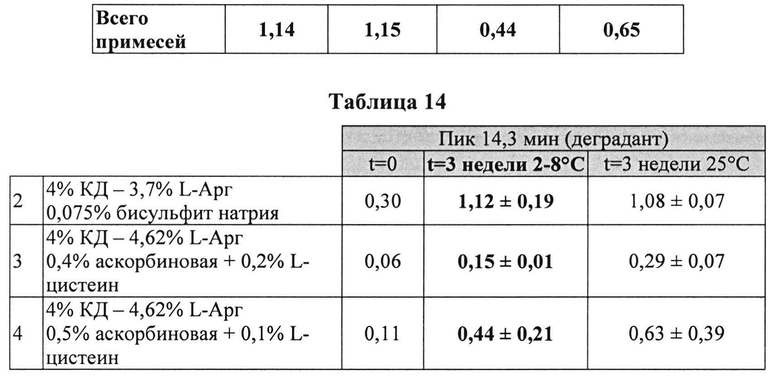
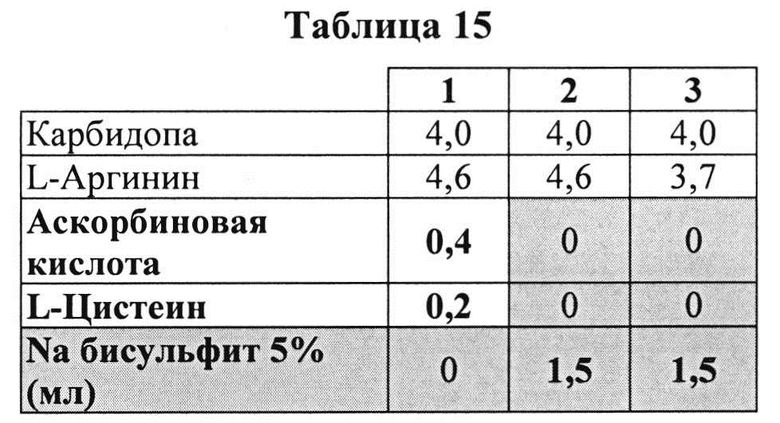
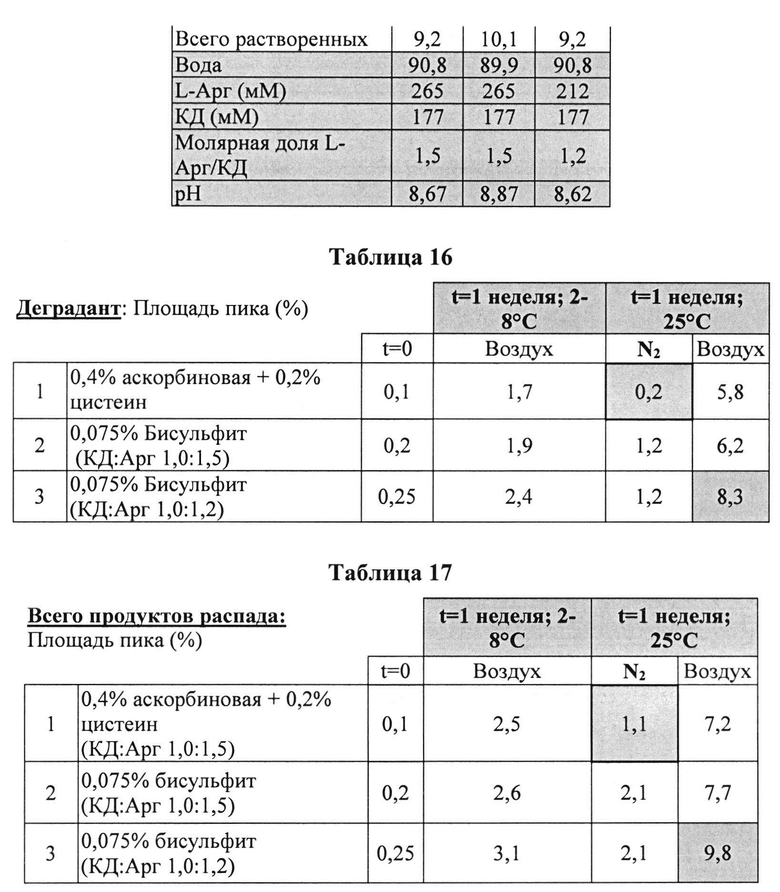
Пример 9. Влияние различных антиоксидантов и различных концентраций аргинина на стабильность составов, содержащих 4% КД
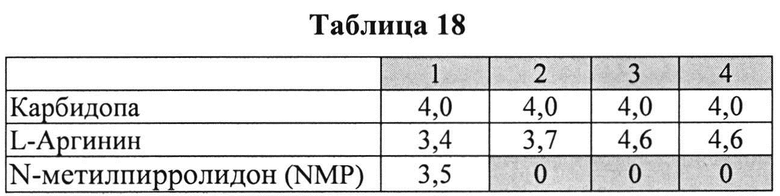
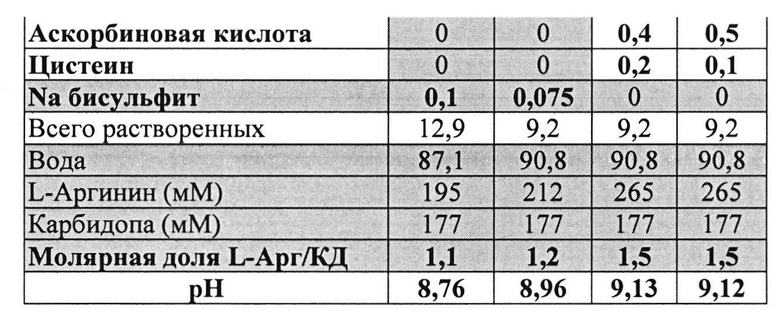
[0091] Жидкие составы с карбидопой и аргинином (Таблица 15) готовили как описано выше. Влияние различных антиоксидантов и различных концентраций аргинина на стабильность составов, содержащих 4% КД, помещенных для хранения в аэробных (воздух) или анаэробных (N2) условиях, при температуре окр. среды (25°C) или в холодных условиях (2-8°C) оценивали путем ВЭЖХ анализа. Уровень деграданта и всех примесей, как показано в Таблицах 16 и 17, соответственно, указывает на уровень стабильности составов карбидопы.
[0092] Результаты, представленные в Таблицах 16 и 16, указывают, что составы, содержащие больше аргинина, были более стабильными при хранении на воздухе при 25°C (составы 2 vs. 3). Также составы, содержащие Na-бисульфит, были менее стабильными, чем составы, содержащие аскорбиновую кислоту и L-цистеин (составы 2 vs. 1, соответственно) при хранении в азоте (анаэробные условия). N2 обеспечивает существенную защиту от распада и образования деграданта. Составы, сохраняемые на воздухе, были более стабильными при хранении в замороженном виде, по сравнению с хранением при температуре окружающей среды (комнатной).
Пример 10. Влияние различных антиоксидантов на стабильность составов, содержащих 4% КД при 40°C
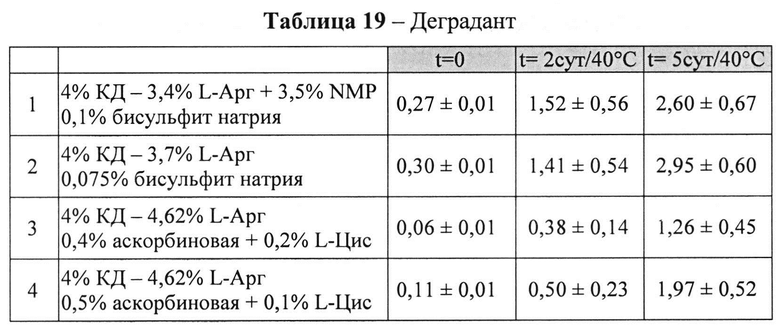
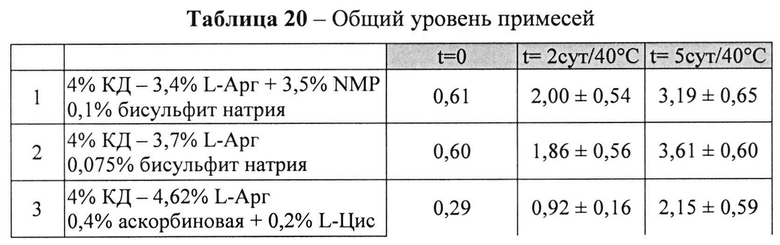
[0093] Жидкие составы с карбидопой и аргинином (Таблица 18) готовили, как описано выше. Влияние различных антиоксидантов на стабильность составов, содержащих 4% КД при 40°C, оценивали путем ВЭЖХ анализа. Уровень деграданта (как процентное содержание относительно начального количества КД) и всех примесей, как показано в Таблицах 19 и 20, соответственно, указывает на уровень стабильности составов карбидопы.
[0094] Результаты, представленные в Таблицах 19-20, позволяют предположить, что составы, содержащие Na-бисульфит, были менее стабильными, чем составы, содержащие аскорбиновую кислоту и L-цистеин (составы 1&2 vs. 3&4), оба варианта в процессе приготовления и при хранении при 40°C. Кроме того, наблюдали дозозависимый эффект цистеина, т.е. чем выше концентрация L-цистеина, тем меньше образуется деграданта. Не наблюдали дозозависимый эффект с Na-бисульфитом, что позволяет предположить, что при 0,075% Na-бисульфита достигнут максимально возможный уровень сохранения.

Пример 11. Влияние аскорбиновой кислоты совместно с различными антиоксидантами на стабильность составов, содержащих 4% КД
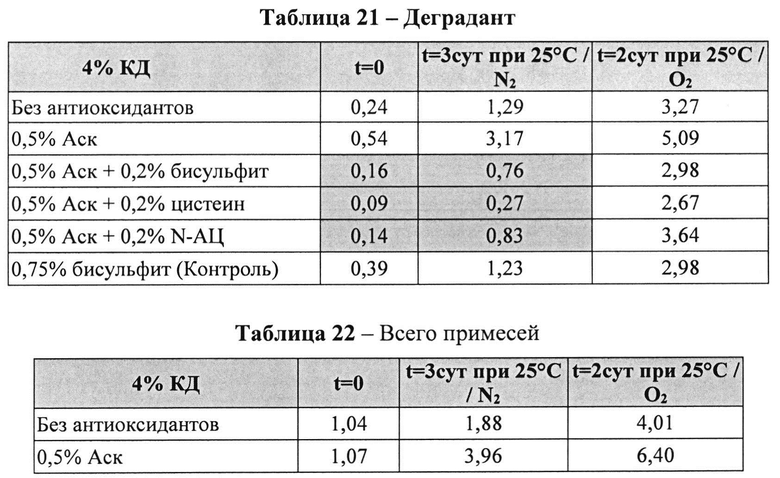
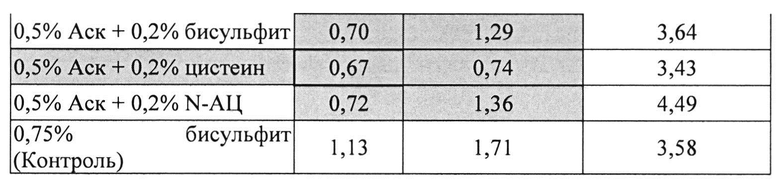
[0095] Жидкие составы с карбидопой и аскорбиновой кислотой с или без внесения дополнительных антиоксидантов готовили, как описано выше. Совместное влияние аскорбиновой кислоты и различных антиоксидантов на стабильность составов, содержащих 4% КД при 25°C, оценивали путем ВЭЖХ анализа. Уровни деграданта (как процентное содержание относительно начального количества КД) и всех примесей, представленные в Таблицах 21 и 22, соответственно, указывают на уровень стабильности составов карбидопы.
[0096] Результаты, представленные в Таблицах 21-22, показывают, что аскорбиновой кислоты, в количестве 0,5%, было достаточно для предотвращения образования деграданта в составах, содержащих карбидопу. Кроме того, аскорбиновая кислота требует внесения другого антиоксиданта для того, чтобы достичь своей максимальной антиоксидантной активности, например, аскорбиновая кислота 0,5% и L-цистеин, N-АЦ или Na-бисульфит ингибируют распад карбидопы синергически. Составы, содержащие аскорбиновую кислоту и L-цистеин, имели наименьшее количество деграданта после 3 суток при 25°C.
[0097] Влияние Na-бисульфит на распад карбидопы был аналогичный полученному при полном отсутствии антиоксидантов.
Пример 12. Влияние антиоксидантов на стабильность составов, содержащих 4% КД при 25°C
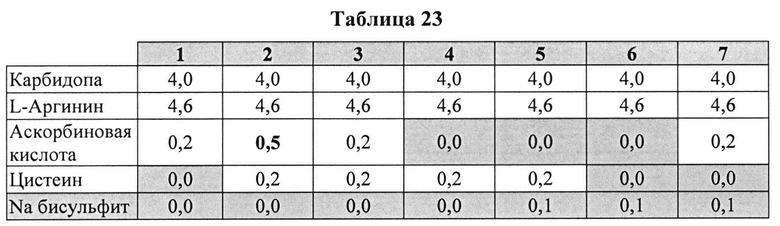
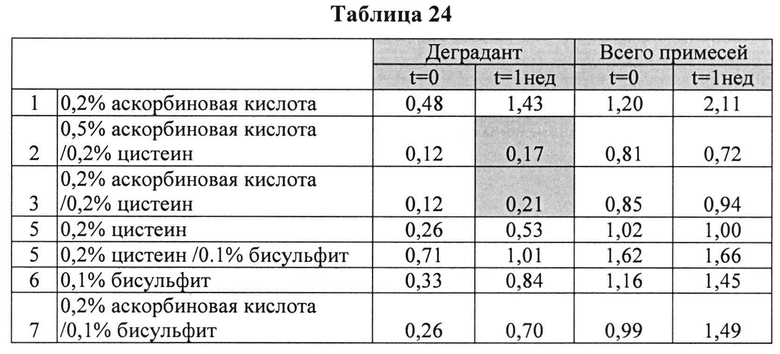
[0098] Жидкие составы с карбидопой (4%) и аргинином (Таблица 23) готовили, как описано выше, и влияние различных антиоксидантов на стабильность таких составов при 25°C, оценивали путем ВЭЖХ анализа. Содержание деграданта (процентное содержание относительно начального количества КД) и всех примесей, представленные в Таблице 24, указывают на степень стабильности таких составов.
[0099] Результаты, представленные в Таблице 24, позволяют предположить, что аскорбиновая кислота, бисульфит или цистеин, используемые по отдельности, не ингибируют образование деграданта. Комбинации бисульфита и цистеина или аскорбиновой кислоты не ингибируют образование деграданта. Проявляется синергический эффект ингибирования на образование деграданта при использовании аскорбиновой кислоты и цистеина, но не наблюдается синергизма при использовании цистеина и бисульфита. Указанный синергический эффект может быть отмечен при использовании аскорбиновой кислоты и бисульфита (при высоких концентрациях аскорбиновой кислоты). Эти результаты также позволяют предположить, что составы, содержащие уникальную комбинацию аскорбиновой кислоты и цистеина, могут обеспечить лучший результат ингибирования образования деграданта.
[00100] Аскорбиновой кислоты в количестве 0,2% было недостаточно для предотвращения образования деграданта. Совместно с 0,2% цистеина 0,5% аскорбиновой кислоты было более эффективно, чем 0,2% для сокращения общего количества примесей и образования деграданта, что позволяет предположить, что по меньшей мере 0,5% аскорбиновой кислоты с 0,2% цистеина являются предпочтительными.
Пример 13. Определение уровня гидразина в составах КД и КД/ЛД
[00101] Определение гидразина проводили путем дериватизации с использованием ацетона-d6 (дейтероацетон). Производное гидразина анализировали путем газовой хромато-масс-спектрометрии (ГХ-МС). Количество производного гидразина измеряли в режиме регистрации выбранных ионов (SIM-mode) в соответствии со стандартными операционными (рабочими) процедурами Solvias (SOP's).
[00102] Жидкие составы с карбидопой, леводопой и аргинином (Таблица 25) готовили, как описано выше. Измеряли уровень гидразина в указанных составах (Таблица 26).
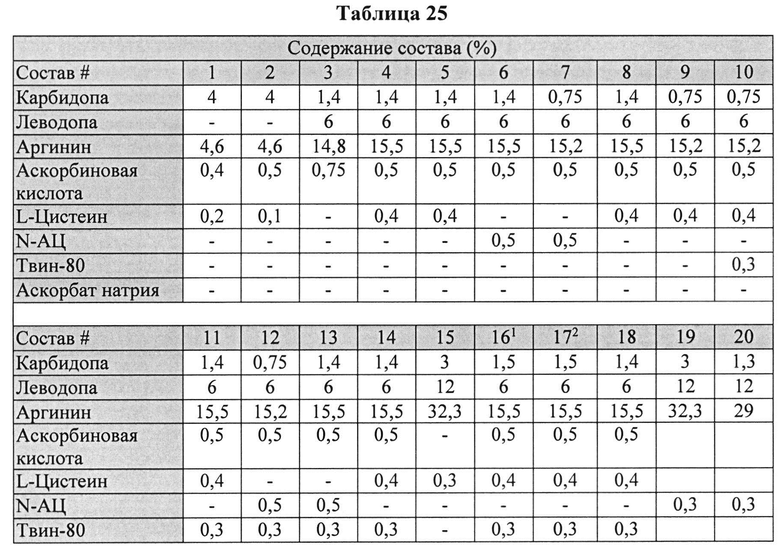
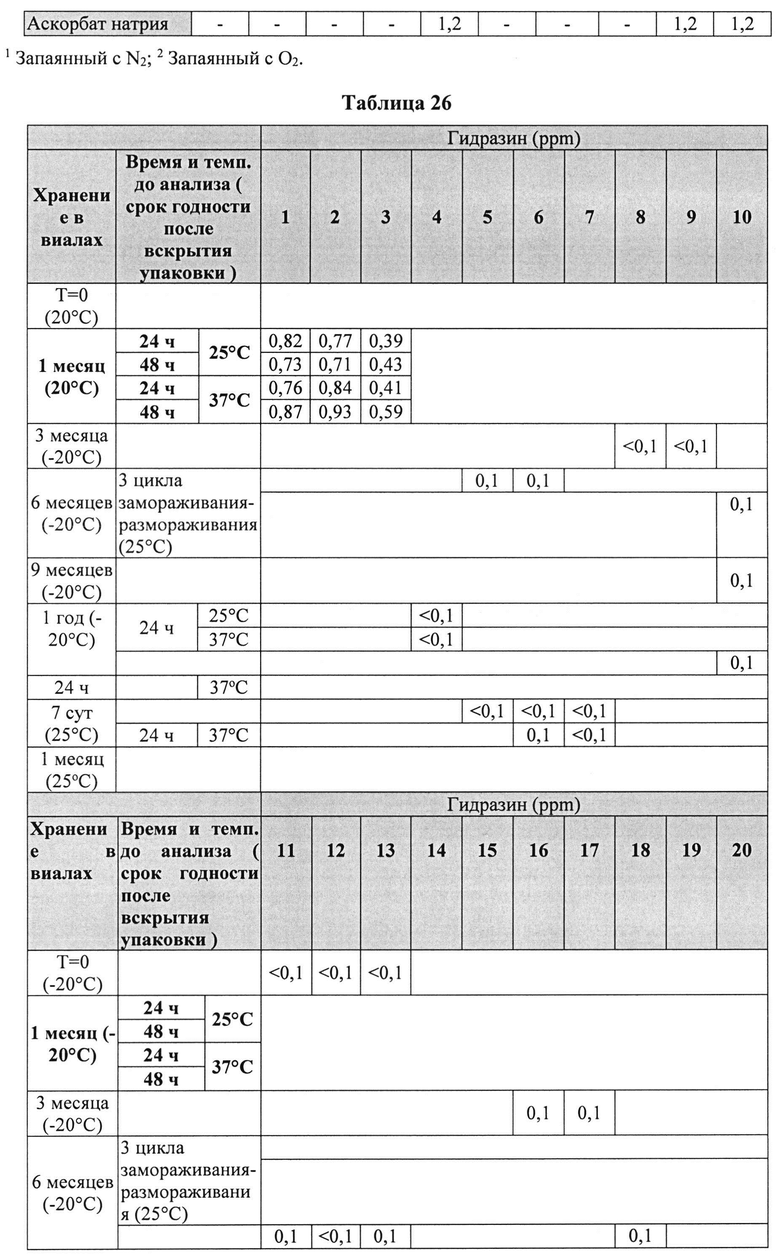

[00103] Результаты, представленные в Таблице 26 ясно показывают, что уровни гидразина были по меньшей мере в 2 раза ниже в составах с леводопой vs. (по сравнению) с составами без леводопы. Кроме того, составы, содержащие L-цистеин или N-АЦ, показали по меньшей мере в четыре раза более низкий уровень гидразина по сравнению с составами без L-цистеина или N-АЦ.
Пример 14. КД/ЛД составы
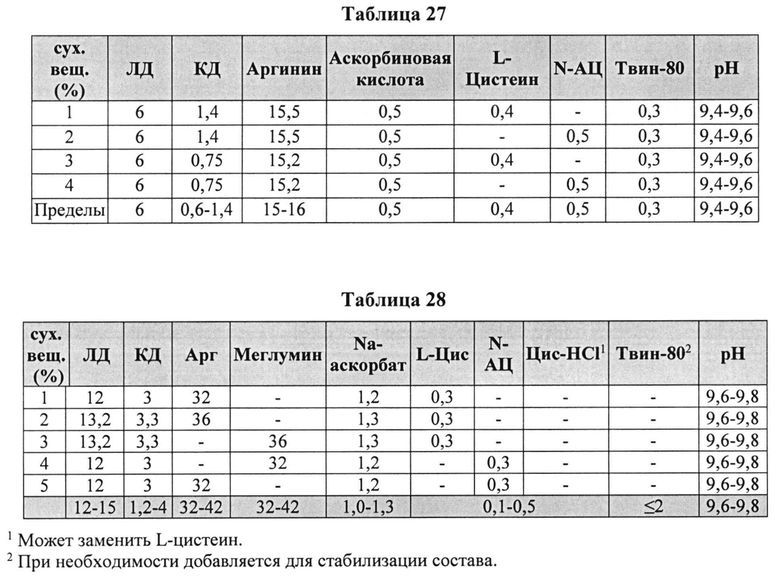
[00104] На основании исследованных комбинаций, способствующих снижению деграданта и образования гидразина, нами разработаны новые составы КД/ЛД. Эти составы показаны в Таблицах 27 и 28.
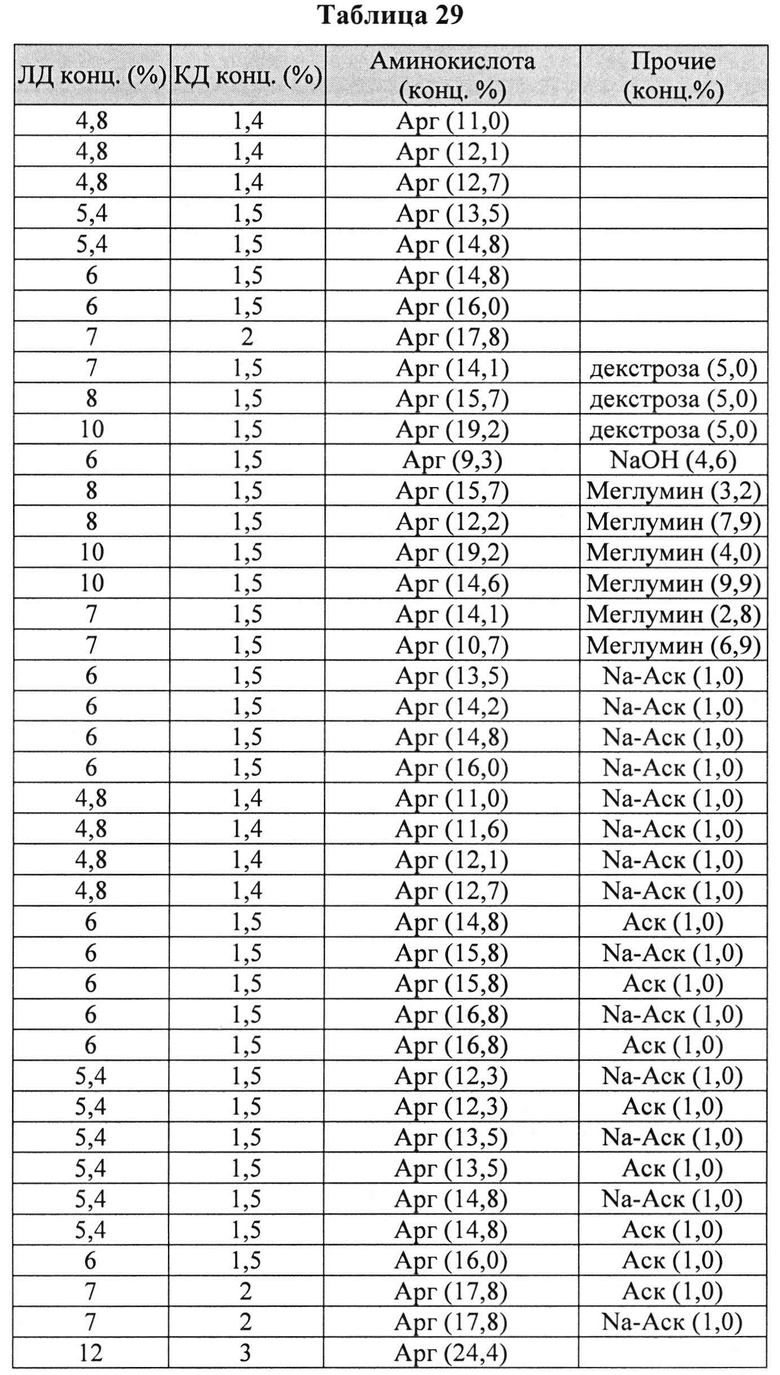
[00105] Дополнительно составы, которые могут применяться в контексте информации, раскрытой в настоящем изобретении, представлены в Таблице 29. Составы могут содержать дополнительные компоненты (например, любой из описанных в данной заявке). Таблицы 30 и 31 описывают также составы, которые могут применяться в контексте информации, раскрытой в настоящем изобретении.
ЭКВИВАЛЕНТЫ
[00106] Примеры реализации изобретения, представленные в описании данной заявки, носят иллюстративный характер и не ограничивают объем настоящего изобретения. Различные варианты, предложенные согласно настоящему изобретению, очевидны специалисту в данной области техники на основании описания данной заявки. Изобретение в полном объеме определяется ссылкой на формулу изобретения, совместно с полным объемом эквивалентов, и описание, совместно с полным объемом вариаций.
[00107] Если не указано иное, то все числовые значения, выражающие количество ингредиентов, условия реакций и подобное, представленные в описании и формуле изобретения, могут варьироваться во всех возможных случаях посредством термина «около». Таким образом, если не указано противоположное, числовые параметры, представленные в описании и формуле изобретения, являются приблизительными, и могут варьироваться в зависимости от желаемых свойств, достигаемых в соответствии с настоящем изобретением.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00108] Полное содержание всех патентов, опубликованных заявок на изобретения, вебсайтов и других источников, на которые ссылается заявка, полностью включено в данную заявку посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2014 |
|
RU2677278C2 |
| НЕПРЕРЫВНОЕ ВВЕДЕНИЕ L-ДОПА, ИНГИБИТОРОВ ДОПА-ДЕКАРБОКСИЛАЗЫ, ИНГИБИТОРОВ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЭТОГО КОМПОЗИЦИИ | 2011 |
|
RU2607497C2 |
| НЕПРЕРЫВНОЕ ВВЕДЕНИЕ L-ДОПА, ИНГИБИТОРОВ ДОПА-ДЕКАРБОКСИЛАЗЫ, ИНГИБИТОРОВ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЭТОГО КОМПОЗИЦИИ | 2011 |
|
RU2740080C2 |
| КОМПОЗИЦИИ ДЛЯ НЕПРЕРЫВНОГО ВВЕДЕНИЯ ИНГИБИТОРОВ ДОПА-ДЕКАРБОКСИЛАЗЫ | 2010 |
|
RU2678839C2 |
| КОМПОЗИЦИИ ДЛЯ НЕПРЕРЫВНОГО ВВЕДЕНИЯ ИНГИБИТОРОВ ДОПА-ДЕКАРБОКСИЛАЗЫ | 2010 |
|
RU2559083C9 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АПОМОРФИН И ОРГАНИЧЕСКИЕ КИСЛОТЫ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2688672C2 |
| УСТРОЙСТВО ДЛЯ ПОДКОЖНОЙ ДОСТАВКИ ТЕКУЧЕГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2018 |
|
RU2765171C2 |
| ПРОЛЕКАРСТВА КАРБИДОПА И L-DOPA И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2015 |
|
RU2743347C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2009 |
|
RU2540470C9 |
| ОБЛАДАЮЩИЙ ПИТАТЕЛЬНЫМИ СВОЙСТВАМИ ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ НА ОСНОВЕ ПОЛИФЕНОЛОВ И ЕГО ИСПОЛЬЗОВАНИЕ ПРИ ЛЕЧЕНИИ РАКА | 2003 |
|
RU2301666C2 |

Изобретение относится к высокостабильным фармацевтическим композициям на основе карбидопы, содержащим комбинацию антиоксидантов, включающую аскорбиновую кислоту и по меньшей мере один дополнительный антиоксидант, причем указанная комбинация сильно ингибирует распад карбидопы. Эти композиции также содержат леводопу и один или оба компонента из группы аргинина и меглумина, и полезны для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, например болезни Паркинсона. 4 н. и 27 з.п. ф-лы, 5 ил., 31 табл., 14 пр.
1. Фармацевтическая композиция для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, содержащая (i) карбидопу или ее сложный эфир; (ii) от 2 до 16% по массе леводопы; (iii) аргинин, меглумин, или их комбинацию; (iv) по меньшей мере два антиоксиданта; и (v) фармацевтически приемлемый носитель, где:
один из указанных антиоксидантов представляет собой аскорбиновую кислоту или ее соль, и другой из указанных антиоксидантов каждый независимо представляет собой L-цистеин или его соль в концентрации от 0,001 до 5% по массе, N-ацетилцистеин (N-АЦ) в концентрации от 0,001 до 5% по массе, глутатион в концентрации от 0,001 до 5% по массе, диацетилцистин или его соль в концентрации от 0,001 до 5% по массе или бисульфит натрия в концентрации от 0,01% до 2% по массе;
указанная композиция имеет рН от 9,1 до 10; и
указанная композиция содержит менее 1 мкг/мл гидразина, определенного методом ГХ-МС, и менее 5% по массе 3,4-дигидроксифенил-2-метилпропионовой кислоты (указанной здесь в качестве деграданта) относительно начального количества карбидопы или ее указанного сложного эфира, определенной методом ВЭЖХ.
2. Фармацевтическая композиция по п. 1, содержащая менее 0,5 мкг/мл гидразина, и менее 1% деграданта относительно начального количества карбидопы или ее указанного сложного эфира.
3. Фармацевтическая композиция по п. 1, содержащая от 0,1 до 10% по массе карбидопы.
4. Фармацевтическая композиция по п. 3, содержащая от 0,5до 6% по массе карбидопы.
5. Фармацевтическая композиция по п. 1, где указанная соль аскорбиновой кислоты представляет собой аскорбат натрия, аскорбат калия, аскорбат кальция, аскорбилстеарат или аскорбилпальмитат.
6. Фармацевтическая композиция по п. 1, содержащая от 0,1 до 10% по массе аскорбиновой кислоты или ее соли.
7. Фармацевтическая композиция по п. 6, содержащая от 0,2 до 2% по массе аскорбиновой кислоты или ее соли.
8. Фармацевтическая композиция по п. 1, содержащая от 0,1 до 10% по массе карбидопы, от 0,1 до 10% по массе аскорбиновой кислоты или ее соли, и:
(i) от 0,001 до 5% по массе L-цистеина или его соли;
(ii) от 0,001 до 5% по массе N-АЦ; или
(iii) от 0,01 до 2% по массе бисульфита натрия.
9. Фармацевтическая композиция по п. 8, содержащая от 0,5 до 6% по массе карбидопы, от 0,2 до 2% по массе аскорбиновой кислоты или ее соли, и:
(i) от 0,01 по массе L-цистеина или его соли;
(ii) от 0,01 до 1% по массе N-АЦ; или
(iii) от 0,075 до 0,75% по массе бисульфита натрия.
10. Фармацевтическая композиция по п. 1, дополнительно содержащая поверхностно-активное вещество.
11. Фармацевтическая композиция по п. 1, содержащая от 4% до 16% по массе леводопы.
12 Фармацевтическая композиция по п. 10, содержащая 4%, 6%, 12% или 13,2% по массе леводопы.
13. Фармацевтическая композиция по п. 1, содержащая от 0,1% до 42% по массе аргинина, меглумина или их комбинацию.
14. Фармацевтическая композиция по п. 10, отличающаяся тем, что указанное поверхностно-активное вещество представляет собой полисорбат 80.
15. Фармацевтическая композиция по п. 14, содержащая от 0,01 до 5% по массе полисорбата 80.
16. Фармацевтическая композиция по п. 1, содержащая от 4 до 16% по массе леводопы; и от 2 до 40% по массе аргинина, меглумина или их комбинации.
17. Фармацевтическая композиция по п. 16, содержащая от 0,1 до 0,5% по массе полисорбата 80.
18. Фармацевтическая композиция по п. 1, содержащая:
(i) от 0,1 до 10% по массе карбидопы;
(ii) от 0,1 до 10% по массе аскорбиновой кислоты или ее соли;
(iii) от 0,001 до 5% по массе L-цистеина или его соли; от 0,001 до 5% по массе N-АЦ; или от 0,01 до 2% по массе бисульфита натрия;
(iv) от 2 до 16% по массе леводопы;
(v) от 0,1 до 42% по массе аргинина, меглумина или их комбинации; и необязательно
(vi) от 0,01 до 5% по массе полисорбата 80, где композиция содержит менее 1 мкг/мл гидразина.
19. Фармацевтическая композиция по п. 18, содержащая:
(i) от 0,5 до 6% по массе карбидопы;
(ii) от 0,2 до 2% по массе аскорбиновой кислоты или ее соли;
(iii) от 0,01 до 1% по массе L-цистеина или его соли; от 0,01 до 1% по массе N-АЦ; или от 0,075 до 0,75% по массе бисульфита натрия;
(iv) от 4 до 16% по массе леводопы;
(v) от 2 до 40% по массе аргинина, меглумина или их комбинации; и при необходимости
(vi) от 0,1 до 0,5% по массе полисорбата 80.
20. Фармацевтическая композиция по п. 19, содержащая:
(i) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе аргинина, 1,2% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина;
(ii) 13,2% по массе леводопы, 3,3% по массе карбидопы, 36% по массе аргинина, 1,3% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина;
(iii) 13,2% по массе леводопы, 3,3% по массе карбидопы, 36% по массе меглумина, 1,3% по массе аскорбата натрия и 0,3% по массе L-цистеина или гидрохлорида цистеина;
(iv) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе меглумина, 1,2% по массе аскорбата натрия и 0,3% по массе N-АЦ;
(v) 12% по массе леводопы, 3% по массе карбидопы, 32% по массе аргинина, 1,2% по массе аскорбата натрия и 0,3% по массе N-АЦ;
(vi) 6% по массе леводопы, 1,4% по массе карбидопы, 15,5% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,4% по массе L-цистеина и 0,3% по массе полисорбата 80;
(vii) 6% по массе леводопы, 1,4% по массе карбидопа, 15,5% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,5% по массе N-АЦ и 0,3% по массе полисорбата 80;
(viii) 6% по массе леводопы, 0,75% по массе карбидопы, 15,2% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,4% по массе L-цистеина и 0,3% по массе полисорбата 80; или
(ix) 6% по массе леводопы, 0,75% по массе карбидопы, 15,2% по массе аргинина, 0,5% по массе аскорбиновой кислоты, 0,5% по массе N-АЦ и 0,3% по массе полисорбата 80.
21. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанная композиция имеет рН от 9,6 до 9,8.
22. Фармацевтическая композиция по п. 1, содержащая менее 1 мкг/мл гидразина после 1-24 ч, 1-30 суток, 1-12 месяцев или 1-3 лет при температурном режиме от -20 до 25°С.
23. Фармацевтическая композиция по п. 22, где указанная температура составляет -20°С, 2-8°С или 25°С.
24. Фармацевтическая композиция по любому из пп. 1-23, отличающаяся тем, что композиция выполнена в виде жидкой композиции, геля, крема, твердой композиции, пленки, эмульсии, суспензии, раствора, лиофилизата или аэрозоля.
25. Фармацевтическая композиция по п. 24, отличающаяся тем, что композиция выполнена в виде жидкой композиции.
26. Способ лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, у пациента, нуждающегося в таком лечении, где указанный способ включает введение указанному пациенту эффективного количества фармацевтической композиции по любому из пп. 1-25.
27. Способ по п. 26, где указанная болезнь, расстройство или состояние представляет собой болезнь Паркинсона.
28. Способ по п. 26, где указанное введение непрерывно.
29. Применение фармацевтической композиции по любому из пп. 1-25 для приготовления лекарственного средства для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов.
30. Набор для лечения болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, содержащий один, два или более контейнеров, каждый из которых содержит фармацевтическую композицию по любому из пп. 1-25, где указанная композиция представлена в количестве, достаточном для лечения пациента, нуждающегося в таком лечении, болезни, расстройства или состояния, связанного с потерей дофамина или дофаминергических нейронов, по меньшей мере 1 сутки, 1 неделю, 1 месяц, 2 месяца, 6 месяцев или один год.
31. Набор по п. 30, где указанная болезнь, расстройство или состояние представляет собой болезнь Паркинсона.
| WO 2005023185 A2, 17.03.2005 | |||
| US 2014051755 A1, 20.02.2014 | |||
| УСТРОЙСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ СОЕДИНЕНИЯ НЕИЗОЛИРОВАННЫХ ПРОВОДОВ НА ОПОРАХ ВОЗДУШНЫХ ЛИНИЙ ЭЛЕКТРОПЕРЕДАЧИ НАПРЯЖЕНИЕМ 6-500 КВ | 2017 |
|
RU2656856C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ЭНТАКАПОНА, ЛЕВОДОПЫ И КАРБИДОПЫ С УЛУЧШЕННОЙ БИОДОСТУПНОСТЬЮ | 2009 |
|
RU2485947C2 |
Авторы
Даты
2019-04-04—Публикация
2015-03-12—Подача