Область техники, к которой относится изобретение
Настоящее изобретение относится к противораковой вакцине для трансдермального введения, содержащей пептид WT1 и/или модифицированный пептид WT1 и стимулятор индукции клеточного иммунитета.
Уровень техники
Существует противораковая вакцина, которая предотвращает вирусную инфекцию, тем самым предотвращая развитие раковой опухоли, вызванной вирусом, и противораковая вакцина, которая приводит к такому результату, что раковые клетки подвергаются специфичной атаке иммунной системой за счет узнавания специфичного для раковой опухоли антигена иммунным механизмом, в частности, клеточным иммунным механизмом, в котором важную роль играют цитотоксические T-клетки (CTL). Первая совсем не эффективна в случае раковой опухоли, в которой вирус не принимает участия. Последняя позволяет осуществлять терапию раковой опухоли, основанную на целенаправленном воздействии на антиген, которым обладает сама раковая клетка. Полагают, что последняя эффективна против широкого круга раковых опухолей, имеющих антиген, за счет точного определения антигена. Наряду с прочим, противораковой вакциной, основанной на принципах последней вакцины, можно лечить опухоли, которые трудно удалять посредством хирургической операции из-за их размера, и она вызывает меньше побочных эффектов по сравнению с обычной терапией, такой как химиотерапия и лучевая терапия.
Ген WT1 (опухоли Вильмса 1) сверхэкспрессируется во многих гематопоэтических опухолях и солидных раковых опухолях, например, при остром миелоцитарном лейкозе, остром лимфоцитарном лейкозе, хроническом миелоцитарном лейкозе, миелодиспластическом синдроме, множественной миеломе, неходжкинской лимфоме, раке легких, раке молочной железы, раке желудка, раке толстой/прямой кишки, раке поджелудочной железы, раке желчных протоков, плоскоклеточном раке головы и шеи, раке щитовидной железы, раке почек, раке простаты, раке яичника, раке матки, саркоме мягких тканей и костей, злокачественной меланоме, злокачественной мезотелиоме, опухоли половых клеток яичка и злокачественной глиоме. Такие раковые опухоли сверхпродуцируют белок WT1. Белок WT1 фрагментируется в раковой опухоли с образованием неполных пептидов, состоящих из 8-12 аминокислот. Пептид WT1 является одним из пептидных фрагментов, который был связан с молекулой MHC класса I в раковой клетке, перемещен к поверхности раковой клетки и презентирован в виде антигена, связанного с молекулой MHC класса I на поверхности раковой клетки. Пептид WT1 становится маркером раковой клетки. Аминокислотная последовательность пептида WT1 соответствует типу молекулы MHC класса I клетки. Например, в случае клетки, имеющей MHC HLA-A*0201-типа, образуется пептид WT1, ограниченный MHC HLA-A*0201-типа, такой как пептид Db126, состоящий из 9 аминокислот, и в случае клетки, имеющей MHC HLA-A*2402-типа, образуется пептид WT1, ограниченный MHC HLA-A*2402-типа, такой как пептид Db235, состоящий из 9 аминокислот. В случае клетки, имеющей другой MHC, такой как MHC HLA-A26-типа (WO 2005/095598), HLA-A*3303-типа (WO 2007/097358) или HLA-A*1101-типа (WO 2008/081701), образуется пептид WT1, ограниченный по каждому из указанных типов MHC. Когда пептид WT1 или модифицированный пептид WT1, в котором часть аминокислот пептида WT1 заменена или модифицирована, вводят в живой организм в качестве антигена (в данном случае, пептид WT1 или модифицированный пептид WT1, который вводят в качестве антигена, называют «антигенным пептидом WT1»), антигенный пептид WT1 связывается с молекулой MHC класса I на поверхности дендритной клетки, которая является антигенпрезентирующей клеткой, или антигенный пептид WT1 захватывается дендритной клеткой, связывается с молекулой MHC класса I дендритной клетки и затем перемещается к поверхности дендритной клетки, и таким образом презентируется в виде антигена, связанного с молекулой MHC класса I, на поверхности дендритной клетки. Активированная дендритная клетка, имеющая комплекс антигенный пептид WT1/молекула MHC класса I, перемещается в регионарный лимфатический узел и активирует CD8-позитивный T-лимфоцит, который распознает комплекс антигенный пептид WT1/молекула MHC класса I, при этом происходит дифференцировка и пролиферация клетки в цитотоксическую T-клетку (CTL). CTL распознает раковые клетки, имеющие комплекс пептида WT1 (полученного из эндогенного белка WT1) с такой же аминокислотной последовательностью, как и у антигенного пептида WT1, и молекулы MHC класса I, или раковую клетку, имеющую комплекс пептида WT1 (полученного из эндогенного белка WT1) с аминокислотной последовательностью, обладающей перекрестной иммунореактивностью с антигенным пептидом WT1, и молекулы MHC класса I, и атакует распознаваемые раковые клетки. Таким образом, указанные выше различные MHC-ограниченные пептиды WT1, такие как пептид Db126 и пептид Db235, и модифицированные пептиды WT1, в которых часть аминокислот заменена или модифицирована, применимы в качестве противораковых вакцин (непатентный документ 1).
Также известно, что адъювант используют для того, чтобы усилить действие пептида WT1 и/или модифицированного пептида WT1 в качестве противораковой вакцины. В качестве адъюванта для пептида WT1 и/или модифицированного пептида WT1 известны, например, минеральные гели, такие как гидроксид алюминия; поверхностно-активные вещества, такие как лизолецитин, и полиолы типа плюроников; полианионы; пептиды; или масляные эмульсии (патентный документ 1), и GM-CSF, BCG-CWS и монтанид ISA51 (непатентный документ 1). В дополнение к указанному, известно множество вакцинных адъювантов, включая циклические динуклеотидные аналоги (патентный документ 3 и патентный документ 4), такие как 1H-имидазо[4,5-c]хинолин-4-амин, имихимод (патентный документ 2) и циклический ди-GMP (c-ди-GMP) и лиганды TLR2, 3, 7, 8 и 9 (патентный документ 5). Кроме того, также известно, что иммунитет, индуцированный трансдермальным введением пептида, содержащего имихимод, дополнительно усиливается добавлением пептида-25 (непатентный документ 2).
Как правило, вакцины вводят посредством подкожной или интрадермальной инъекции. В дополнение к указанным путям было проведено испытание индукции иммунитета с использованием различных путей введения, например, трансдермального введения (патентный документ 5 и непатентный документ 2) и мукозального введения, такого как буккальное введение, назальное введение и подъязычное введение (непатентный документ 3, патентный документ 6 и патентный документ 7).
Список документов
[Патентный документ 1] патент Японии №4422903;
[патентный документ 2] JP 7-505883 A;
[патентный документ 3] JP 2007-529531 A;
[патентный документ 4] публикация патентной заявки США № 2008/0286296;
[патентный документ 5] публикация патентной заявки США № 2008/0193487;
[патентный документ 6] JP 2002-531415 A;
[патентный документ 7] публикация патентной заявки США № 2008/0112974.
[непатентный документ 1] Yoshihiro Oka et al., Current Opinion in Immunology, 20: 211-220 (2008);
[непатентный документ 2] Hosoi Akihiro et al., Cancer Research, 68, 3941-3949 (2008);
[непатентный документ 3] Zhengrong Cui et al., Pharmaceutical Research, Vol. 19, № 7, 947-953 (2002).
Сущность изобретения
Хорошо известно, что адъювант применяют для усиления эффективности вакцины. Подходящие адъюванты обычно варьируют, например, в зависимости от вида антигена, пути введения и иммунного ответа, который требуется индуцировать (т.е. клеточного иммунитета или гуморального иммунитета). Кроме того, в дополнение к адъюванту существует множество веществ, которые стимулируют индукцию иммунитета. Таким образом, задачей настоящего изобретения является получение композиции для применения в качестве противораковой вакцины с более высокой эффективностью и удобной для применения.
Микроорганизм или вирус сами по себе или их часть входят в состав широко используемой вакцины, и вакцину вводят для индукции иммунного ответа. Обычно в связи с тем, что инвазии микроорганизма или вируса препятствует кожа вследствие их размера, необходимо инвазивное введение вакцины в организм. Поэтому вакцины обычно вводят посредством инъекции. Однако инъекция имеет несколько проблем, включая боль, страх, след на месте инъекции и последующее рубцевание. Людям, не являющимся медицинскими работниками, не разрешено осуществлять инъекцию. Интрадермальная инъекция, которая может вызывать более сильный иммунный ответ, является трудным способом введения. Существует риск случайной инфекции медицинских работников вследствие повреждения в результате укола иглой. Пациенты вынуждены много раз посещать лечебное учреждение, когда введение осуществляют многократно. Образуются медицинские отходы, которые требуют специальной утилизации, такие как иглы для инъекций. С точки зрения указанных выше проблем инъекция не является обязательно оптимальным путем введения.
Пептид WT1 и/или модифицированный пептид WT1 может активировать CTL (цитотоксические T-клетки) посредством молекулы MHC класса I, то есть, пептид может индуцировать клеточный иммунитет. Пептид WT1 и/или модифицированный пептид WT1 представляет собой молекулу, имеющую молекулярную массу примерно от 700 до примерно 1600, и состоящую из 8-12 аминокислот, и имеющую значительно меньшие размеры, чем сами микроорганизмы или вирусы, хотя они не считаются низкомолекулярным веществом. Возможно, что их можно вводить другим путем, отличным от инъекции. Однако препарат для введения пептидной вакцины другим путем, отличным от инъекции, еще не был разработан. Это обусловлено многими причинами, например: подходящее вещество, которое может стимулировать индукцию клеточного иммунитета, не было известно; также было неизвестно, может ли быть доставлен антиген в ткань, подходящую для индукции клеточного иммунитета. В частности, вещество, которое может стимулировать индукцию клеточного иммунитета, которое можно применять вместе с антигеном при введении другим путем, отличным от инъекции, не было известно.
Авторы настоящего изобретения обнаружили, что клеточный иммунитет может быть эффективно индуцирован при трансдермальном введении пептидной вакцины. Авторы изобретения также обнаружили, что некоторые вещества подходят для усиления клеточного иммунитета, индуцированного трансдермальным введением пептида WT1 и/или модифицированного пептида WT1. Такие вещества могут включать лиганды TLR, такие как лиганд TLR1/2, лиганд TLR2 и дектина-1, лиганд TLR2/6, лиганд TLR3, лиганд TLR4, лиганд TLR5, лиганд TLR7 и/или TLR8 и лиганд TLR9; циклические динуклеотиды, такие как циклический ди-ГМФ и циклический ди-АМФ; иммуномодулирующие низкомолекулярные лекарственные средства, такие как бестатин, пидотимод и левамизола гидрохлорид; ингибиторы циклооксигензы, такие как этодолак и локсопрофен; антагонисты рецепторов простагландинов, такие как антагонист рецептора EP2, антагонист рецептора EP4, антагонист рецептора DP и антагонист рецептора IP; агонисты рецепторов простагландинов, такие как агонист рецептора EP3; ингибиторы продукции TSLP, такие как хлорид берберина и нарингенин; ингибиторы аденилатциклазы, такие как 2',5'-дидезоксиаденозин и ниацин; омега-3 жирные кислоты, такие как эйкозапентаеновая кислота и докозагексаеновая кислота; агонисты PPAR, такие как агонист PPAR-α, агонист PPAR-δ и агонист PPAR-γ; антагонисты рецепторов дофамина, такие как антагонист рецептора D1 и антагонист рецептора D5; агонисты рецепторов дофамина, такие как агонист рецептора D2, агонист рецептора D3 и агонист рецептора D4; антагонисты рецепторов гистамина, такие как антагонист рецептора H1 и антагонист рецептора H2; агонисты рецепторов гистамина, такие как агонист рецептора H1, агонист рецептора H3 и агонист рецептора H4; антагонисты рецепторов серотонина, такие как антагонист рецептора 5-HT2, антагонист рецептора 5-HT4, антагонист рецептора 5-HT6 и антагонист рецептора 5-HT7; агонисты рецепторов серотонина, такие как агонист рецептора 5-HT1 и агонист рецептора 5-HT2; антагонисты рецепторов вазопрессина, такие как антагонист рецептора V2; агонисты рецепторов вазопрессина, такие как агонист рецептора V1; антагонисты мускариновых рецепторов, такие как антагонист рецептора M1, антагонист рецептора M3 и антагонист рецептора M5; агонисты мускариновых рецепторов, такие как агонист рецептора M1, агонист рецептора M2, агонист рецептора M3, агонист рецептора M4 и агонист рецептора M5; антагонисты рецепторов адреналина, такие как антагонист рецептора α1, антагонист рецептора β1, антагонист рецептора β2 и антагонист рецептора β3; агонисты рецепторов адреналина, такие как агонист рецептора α1 и агонист рецептора α2; агонисты рецепторов ангиотензина, такие как агонист рецептора AT2; агонисты рецепторов ГАМК, такие как агонисты рецептора ГАМКB; антагонисты рецепторов тромбина, такие как антагонист рецептора PAR-1; агонисты рецепторов тромбина, такие как агонист рецептора PAR-1; агонисты рецепторов опиоидов, такие как бупренорфин; антагонисты рецепторов лейкотриена, такие как антагонист рецептора CysLT1 и антагонист рецептора CysLT2; агонисты рецепторов лейкотриена, такие как агонист рецептора BLT; агонисты рецепторов АДФ, такие как аденозиндифосфат; агонисты рецепторов мелатонина, такие как мелатонин; агонисты рецепторов соматостатина, такие как октреотид; агонисты рецепторов каннабиноидов, такие как дронабинол; агонисты рецепторов сфингозин-1-фосфата, такие как финголимод; агонисты метаботропных рецепторов глутамата, такие как агонист рецептора mGluR2, агонист рецептора mGluR3, агонист рецептора mGluR4, агонист рецептора mGluR6, агонист рецептора mGluR7 и агонист рецептора mGluR8; ингибиторы фосфолипазы A2, такие как глицирризиновая кислота; ингибиторы продукции TGF-β, такие как пирфенидон; или ингибиторы цитокина Th2, такие как тозилат суплатаста. Кроме того, авторы настоящего изобретения обнаружили, что хелперный пептид, такой как пептид-25 или hWT135, также применим для стимуляции индукция клеточного иммунитета, индуцируемого трансдермальным введением пептида WT1 и/или модифицированного пептида WT1, когда его применяют вместо или дополнительно к описанным выше веществам. То есть, было обнаружено, что клеточный иммунитет заметно усиливается в случае комбинации лиганда TLR и хелперного пептида, комбинации циклического динуклеотида и хелперного пептида, комбинации иммуномодулирующего низкомолекулярного лекарственного средства и хелперного пептида, комбинации ингибитора циклооксигеназы и хелперного пептида, комбинации антагониста рецептора простагландина и хелперного пептида, комбинации агониста рецептора простагландина и хелперного пептида, комбинации ингибитора продукции TSLP и хелперного пептида, комбинации ингибитора аденилатциклазы и хелперного пептида, комбинации омега-3 жирной кислоты и хелперного пептида, комбинации агониста PPAR и хелперного пептида, комбинации антагониста рецептора дофамина и хелперного пептида, комбинации агониста рецептора дофамина и хелперного пептида, комбинации агониста рецептора гистамина и хелперного пептида, комбинации антагониста рецептора гистамина и хелперного пептида, комбинации агониста рецептора серотонина и хелперного пептида, комбинации антагониста рецептора серотонина и хелперного пептида, комбинации антагониста рецептора вазопрессина и хелперного пептида, комбинации агониста рецептора вазопрессина и хелперного пептида, комбинации антагониста мускаринового рецептора и хелперного пептида, комбинации агониста мускаринового рецептора и хелперного пептида, комбинации антагониста рецептора адреналина и хелперного пептида, комбинации агониста рецептора адреналина и хелперного пептида, комбинации агониста рецептора ангиотензина и хелперного пептида, комбинации агониста рецептора ГАМК и хелперного пептида, комбинации антагониста рецептора тромбина и хелперного пептида, комбинации агониста рецептора тромбина и хелперного пептида, комбинации агониста рецептора опиоидов и хелперного пептида, комбинации агониста рецептора АДФ и хелперного пептида, комбинации антагониста рецептора лейкотриена и хелперного пептида, комбинации агониста рецептора лейкотриена и хелперного пептида, комбинации агониста рецептора мелатонина и хелперного пептида, комбинации агониста рецептора соматостатина и хелперного пептида, комбинации агониста рецептора каннабиноидов и хелперного пептида, комбинации агониста рецептора сфингозин-1-фосфата и хелперного пептида, комбинации агониста метаботропного рецептора глутамата и хелперного пептида, комбинации ингибитора фосфолипазы A2 и хелперного пептида, комбинации ингибитора продукции TGF-β и хелперного пептида или комбинации ингибитора цитокина Th2 и хелперного пептида. В особенно предпочтительном аспекте клеточный иммунитет заметно усиливается под действием комбинации лиганда TLR и хелперного пептида или комбинации циклического динуклеотида и хелперного пептида. Кроме того, было обнаружено, что при введении в условиях слабого раздражения получают высокий эффект в отношении индукции клеточного иммунитета. В частности, высокий эффект в отношении индукции клеточного иммунитета получают в случае выбора состояния слабого раздражения, когда трансэпидермальная потеря влаги (TEWL) (г/час•м2), которая является показателем для кожи животной модели при оценке раздражения кожи, перед введением композиции противораковой вакцины для трансдермального введения составляет 50 или менее, и трансдермального введения композиции противораковой вакцины для трансдермального введения. Альтернативно, высокий эффект в отношении индукции клеточного иммунитета может быть получен в том случае, когда композиция противораковой вакцины для трансдермального введения обладает таким свойством слабого раздражения, так что уровень TSLP в коже (пг/мг белка) у животной модели в случае оценки раздражения кожи при завершении введении становится равным 10000 или менее.
Таким образом, настоящее изобретение в первом аспекте относится к аспектам, перечисленным ниже.
(1) Композиция противораковой вакцины для трансдермального введения для индукции клеточного иммунитета, содержащая:
(i) пептид WT1 и/или модифицированный пептид WT1; и
(ii) стимулятор индукции клеточного иммунитета, выбранный из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-β, ингибитора цитокина Th2 и комбинации двух или более указанных видов.
(2) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является лиганд TLR.
(3) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является циклический динуклеотид.
(4) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является иммуномодулирующее низкомолекулярное лекарственное средство.
(5) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор циклооксигеназы.
(6) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора простагландина, и данный антагонист рецептора простагландина представляет собой антагонист рецептора EP2, антагонист рецептора EP4, антагонист рецептора DP или антагонист рецептора IP.
(7) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора простагландина, и данный агонист рецептора простагландина представляет собой агонист рецептора EP3.
(8) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор продукции TSLP.
(9) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор аденилатциклазы.
(10) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является омега-3 жирная кислота.
(11) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист PPAR, и данный агонист PPAR представляет собой агонист PPAR-α, агонист PPAR-δ или агонист PPAR-γ.
(12) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора дофамина, и данный антагонист рецептора дофамина представляет собой антагонист рецептора D1 или антагонист рецептора D5.
(13) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора дофамина, и данный агонист рецептора дофамина представляет собой агонист рецептора D2, агонист рецептора D3 или агонист рецептора D4.
(14) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора гистамина, и данный антагонист рецептора гистамина представляет собой антагонист рецептора H1 или антагонист рецептора H2.
(15) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора гистамина, и данный агонист рецептора гистамина представляет собой агонист рецептора H1, агонист рецептора H3 или агонист рецептора H4.
(16) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора серотонина, и данный антагонист рецептора серотонина представляет собой антагонист рецептора 5-HT2, антагонист рецептора 5-HT4, антагонист рецептора 5-HT6 или антагонист рецептора 5-HT7.
(17) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора серотонина, и данный агонист рецептора серотонина представляет собой агонист рецептора 5-HT1 или агонист рецептора 5-HT2.
(18) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора вазопрессина, и данный антагонист рецептора вазопрессина представляет собой антагонист рецептора V2.
(19) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора вазопрессина, и данный агонист рецептора вазопрессина представляет собой агонист рецептора V1.
(20) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист мускаринового рецептора, и данный антагонист мускаринового рецептора представляет собой антагонист рецептора M1, антагонист рецептора M3 или антагонист рецептора M5.
(21) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист мускаринового рецептора, и данный агонист мускаринового рецептора представляет собой агонист рецептора M1, агонист рецептора M2, агонист рецептора M3, агонист рецептора M4 или агонист рецептора M5.
(22) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора адреналина, и данный антагонист рецептора адреналина представляет собой антагонист рецептора α1, антагонист рецептора β1, антагонист рецептора β2 или антагонист рецептора β3.
(23) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора адреналина, и которой агонист рецептора адреналина представляет собой агонист рецептора α1 или агонист рецептора α2.
(24) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора ангиотензина, и данный агонист рецептора ангиотензина представляет собой агонист рецептора AT2.
(25) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора ГАМК, и данный агонист рецептора ГАМК представляет собой агонист рецептора ГАМКB.
(26) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора тромбина, и данный антагонист рецептора тромбина представляет собой антагонист рецептора PAR-1.
(27) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора тромбина, и данный агонист рецептора тромбина представляет собой агонист рецептора PAR-1.
(28) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист опиоидного рецептора.
(29) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является антагонист рецептора лейкотриена, и данный антагонист рецептора лейкотриена представляет собой антагонист рецептора CysLT1 или антагонист рецептора CysLT2.
(30) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора лейкотриена, и данный агонист рецептора лейкотриена представляет собой агонист рецептора BLT.
(31) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора мелатонина.
(32) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора соматостатина.
(33) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора каннабиноида.
(34) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора сфингозин-1-фосфата.
(35) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист метаботропного рецептора глутамата, и данный агонист метаботропного рецептора глутамата представляет собой агонист рецептора mGluR2, агонист рецептора mGluR3, агонист рецептора mGluR4, агонист рецептора mGluR6, агонист рецептора mGluR7 или агонист рецептора mGluR8.
(36) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является агонист рецептора АДФ.
(37) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор фосфолипазы A2.
(38) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор продукции TGF-β.
(39) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является ингибитор цитокина Th2.
(40) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является хелперный пептид.
(41) Композиция противораковой вакцины для трансдермального введения по пункту (1), в которой стимулятором индукции клеточного иммунитета является комбинация хелперного пептида и одного или более веществ, выбранных из группы, состоящей из лиганда TLR, циклического динуклеотида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-β и ингибитора цитокина Th2.
(42) Композиция противораковой вакцины для трансдермального введения по любому из пунктов (1)-(41), которую вводят в условиях слабого раздражения.
(43) Композиция противораковой вакцины для трансдермального введения по пункту (42), в которой условие слабого раздражения представляет собой условие, при котором трансэпидермальная потеря влаги (TEWL) у животной модели при оценке раздражения кожи перед введением композиции составляет 50 г/час•м2 или менее.
(44) Композиция противораковой вакцины для трансдермального введения по пункту (42) или (43), в которой условие слабого раздражения представляет собой условие, при котором уровень TSLP кожи у животной модели в случае оценки раздражения при осуществлении введения композиции составляет 10000 пг/мг белка или менее.
В другом аспекте композицию противораковой вакцины согласно настоящему изобретению можно применять для лечения или профилактики раковой опухоли. Таким образом, настоящее изобретение также относится к перечисленным ниже вариантам осуществления.
(45) Способ лечения или профилактики раковой опухоли у субъекта, включающий трансдермальное введение субъекту терапевтически эффективного количества (i) пептида WT1 и/или модифицированного пептида WT1, и (ii) стимулятора индукции клеточного иммунитета, выбранного из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-β, ингибитора цитокина Th2 и комбинации двух или более указанных видов.
И
(46) Способ лечения или профилактики раковой опухоли у субъекта, включающий введение субъекту терапевтически эффективного количества композиции противораковой вакцины для трансдермального введения по любому из пунктов (1)-(44).
В другом аспекте настоящее изобретение относится к лиганду TLR, циклическому динуклеотиду, хелперному пептиду, иммуномодулирующему низкомолекулярному лекарственному средству, ингибитору циклооксигеназы, антагонисту рецептора простагландина, агонисту рецептора простагландина, ингибитору продукции TSLP, ингибитору аденилатциклазы, омега-3 жирной кислоте, агонисту PPAR, антагонисту рецептора дофамина, агонисту рецептора дофамина, агонисту рецептора гистамина, антагонисту рецептора гистамина, агонисту рецептора серотонина, антагонисту рецептора серотонина, антагонисту рецептора вазопрессина, агонисту рецептора вазопрессина, антагонисту мускаринового рецептора, агонисту мускаринового рецептора, антагонисту рецептора адреналина, агонисту рецептора адреналина, агонисту рецептора ангиотензина, агонисту рецептора ГАМК, антагонисту рецептора тромбина, агонисту рецептора тромбина, агонисту опиоидного рецептора, агонисту рецептора АДФ, антагонисту рецептора лейкотриена, агонисту рецептора лейкотриена, агонисту рецептора мелатонина, агонисту рецептора соматостатина, агонисту рецептора каннабиноида, агонисту рецептора сфингозин-1-фосфата, агонисту метаботропного рецептора глутамата, ингибитору фосфолипазы A2, ингибитору продукции TGF-β, ингибитору цитокина Th2 или комбинации двух или более указанных средств для применения в качестве стимулятора индукции клеточного иммунитета, который может усиливать иммунный ответ, индуцированный трансдермальным введением пептида WT1 и/или модифицированного пептида WT1. Таким образом, настоящее изобретение также относится к следующим перечисленным аспектам.
(47) Лиганд TLR, циклический динуклеотид, хелперный пептид, иммуномодулирующее низкомолекулярное лекарственное средство, ингибитор циклооксигеназы, антагонист рецептора простагландина, агонист рецептора простагландина, ингибитор продукции TSLP, ингибитор аденилатциклазы, омега-3 жирная кислота, агонист PPAR, антагонист рецептора дофамина, агонист рецептора дофамина, агонист рецептора гистамина, антагонист рецептора гистамина, агонист рецептора серотонина, антагонист рецептора серотонина, антагонист рецептора вазопрессина, агонист рецептора вазопрессина, антагонист мускаринового рецептора, агонист мускаринового рецептора, антагонист рецептора адреналина, агонист рецептора адреналина, агонист рецептора ангиотензина, агонист рецептора ГАМК, антагонист рецептора тромбина, агонист рецептора тромбина, агонист опиоидного рецептора, агонист рецептора АДФ, антагонист рецептора лейкотриена, агонист рецептора лейкотриена, агонист рецептора мелатонина, агонист рецептора соматостатина, агонист рецептора каннабиноида, агонист рецептора сфингозин-1-фосфата, агонист метаботропного рецептора глутамата, ингибитор фосфолипазы A2, ингибитор продукции TGF-β, ингибитор цитокина Th2 или комбинация двух или более указанных средств для применения в качестве стимулятора индукции клеточного иммунитета, который может усиливать иммунный ответ, индуцированный трансдермальным введением пептида WT1 и/или модифицированного пептида WT1.
Настоящее изобретение также относится к следующим вариантам осуществления.
(48) Способ индукции клеточного иммунитета у субъекта, включающий трансдермальное введение субъекту (i) пептида WT1 и/или модифицированного пептида WT1 и (ii) стимулятора индукции клеточного иммунитета, выбранного из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств.
(49) Лиганд TLR, циклический динуклеотид, хелперный пептид, иммуномодулирующее низкомолекулярное лекарственное средство, ингибитор циклооксигеназы, антагонист рецептора простагландина, агонист рецептора простагландина, ингибитор продукции TSLP, ингибитор аденилатциклазы, омега-3 жирная кислота, агонист PPAR, антагонист рецептора дофамина, агонист рецептора дофамина, агонист рецептора гистамина, антагонист рецептора гистамина, агонист рецептора серотонина, антагонист рецептора серотонина, антагонист рецептора вазопрессина, агонист рецептора вазопрессина, антагонист мускаринового рецептора, агонист мускаринового рецептора, антагонист рецептора адреналина, агонист рецептора адреналина, агонист рецептора ангиотензина, агонист рецептора ГАМК, антагонист рецептора тромбина, агонист рецептора тромбина, агонист опиоидного рецептора, агонист рецептора АДФ, антагонист рецептора лейкотриена, агонист рецептора лейкотриена, агонист рецептора мелатонина, агонист рецептора соматостатина, агонист рецептора каннабиноида, агонист рецептора сфингозин-1-фосфата, агонист метаботропного рецептора глутамата, ингибитор фосфолипазы A2, ингибитор продукции TGF-бета, ингибитор цитокина Th2 или комбинация двух или более указанных средств для применения в стимуляции индукции клеточного иммунитета, который индуцирован трансдермальным введением пептида WT1 и/или модифицированного пептида WT1.
(50) Комбинация (i) пептида WT1 и/или модифицированного пептида WT1 и (ii) стимулятора индукции клеточного иммунитета, выбранного из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств, для индукции клеточного иммунитета.
(51) Комбинация (i) пептида WT1 и/или модифицированного пептида WT1 и (ii) стимулятора индукции клеточного иммунитета, выбранного из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств для применения при лечении или профилактике раковой опухоли.
И
(52) Применение (i) пептида WT1 и/или модифицированного пептида WT1 и (ii) стимулятора индукции клеточного иммунитета, выбранного из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, антагониста рецептора тромбина, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств при производстве композиции противораковой вакцины для трансдермального введения с целью индукции клеточного иммунитета.
Так как композицию противораковой вакцины согласно настоящему изобретению можно вводить трансдермально, она обладает следующими преимуществами: прекрасное соответствие требованиям, например, неинвазивное введение, нет боли и освобождение от страха перед инъекцией; пациенты могут вводить композицию противораковой вакцины сам/сама, так как введение является простым; можно избежать риска случайной инфекции вследствие повреждения в результате укола иглой для медицинского персонала; в случае многократного введения частота амбулаторных посещений может быть снижена и это может вносить вклад в улучшение качества жизни пациента; и медицинские отходы, которые требуют специальной утилизации, такие как иглы для инъекций, не образуются. Кроме того, если композиция противораковой вакцины имеет форму препарата в виде пластыря, такого как препарат для компресса или препарат в форме ленты, то конечно можно вводить предварительно определяемую дозу, можно произвольно контролировать скорость высвобождения лекарственного средства, и композиция противораковой вакцины не прилипает к другой стороне при введении. Кроме того, так как препарат в виде пластыря можно легко отлепить, то в случае, когда возникает побочный эффект, пациент сам/сама может мгновенно остановить введение, удалив пластырь с места нанесения. Кроме того, также существует преимущество, которое заключается в том, что эффективность композиции противораковой вакцины согласно настоящему изобретению заметно улучшена по сравнению с введением пептида WT1 и/или модифицированного пептида WT1 отдельно. Кроме того, композиция противораковой вакцины также имеет преимущество в том, что трансдермальное введение композиции индуцирует более сильный клеточный иммунитет по сравнению с инъекционным введением.
Краткое описание фигур
[Фиг.1] На фиг.1 показано иммуностимулирующее действие имихимода и синергическое действие с пептидом-25.
[Фиг.2] На фиг.2 показано иммуностимулирующее действие ц-ди-ГМФ и синергическое действие с пептидом-25.
[Фиг.3] На фиг.3 показано влияние физического раздражения (предварительная обработка кожи) на уровень индукции клеточного иммунитета.
[Фиг.4] На фиг.4 показано влияние физического раздражения (предварительная обработка кожи) на проницаемость кожи для антигенного пептида (пептида Db126) и стимулятора индукции клеточного иммунитета (имихимода).
[Фиг.5] На фиг.5 показано влияние химического раздражения (поверхностно-активного вещества) на уровень индукции клеточного иммунитета.
[Фиг.6] На фиг.6 показано влияние химического раздражения (поверхностно-активного вещества) на проницаемость кожи для антигенного пептида (пептида Db126) и стимулятора индукции клеточного иммунитета (имихимода).
[Фиг.7] На фиг.7 показано сравнение иммунитета в случае введения с использованием препарата в форме ленты в нормальную кожу и физически поврежденную кожу.
[Фиг.8] На фиг.8 показано синергическое действие имихимода и локсопрофена-Na.
[фиг.9] На фиг.9 показан уровень индукции клеточного иммунитета при инъекции и уровень индукции клеточного иммунитета композицией противораковой вакцины для трансдермального введения согласно настоящему изобретению.
Подробное описание изобретения
Сначала будут определены термины, используемые в настоящем описании, чтобы настоящее изобретение можно было легче понять. Термины, которым не дано определение, имеют значение, которые обычно подразумевает специалист в данной области, в частности в области медицины, фармации, иммунологии, клеточной биологии, биохимии, химии полимеров и подобных, если контекст не требует иного.
I. Определения
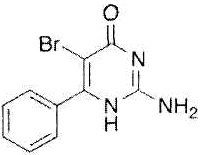
Как использовано в настоящем описании, термин «пептид WT1» означает неполный пептид, состоящий примерно из 8-15, предпочтительно примерно из 8-12 аминокислот. Пептид WT1 представляет собой пептид, полученный в результате фрагментации белка WT1, который является продуктом ракового гена WT1 (опухоль Вильмса), и включает пептид Db126, пептид Db235 и тому подобное. Кроме того, неполный пептид продукта WT1, описанный в WO 2000/06602, полученный из WT1 пептид ракового антигена, связывающий HLA-A26, описанный в WO 2005/095598, ограниченный по HLA-A*3303 пептид WT1, описанный в WO 2007/097358, и ограниченный по HLA-A*1101 пептид WT1, описанный в WO 2008/081701, также включены в термин «пептид WT1» согласно настоящему изобретению.
Термин «пептид Db126» означает пептид WT1, состоящий из последовательности Arg Met Phe Pro Asn Ala Pro Tyr Leu (SEQ ID NO:1). Термин «пептид Db235» означает пептид WT1, состоящий из последовательности Cys Met Thr Trp Asn Gln Met Asn Leu (SEQ ID NO:2) (патентный документ 1).
Как использовано в настоящем описании, термин «модифицированный пептид WT1» означает пептид, в котором все или часть аминокислот пептида WT1 модифицированы заменой, модификацией или подобным.
Модифицированный пептид WT1 включает, например,
(a) пептид, состоящий из аминокислотной последовательности, в которой одна до нескольких, например, 1, 2, 3, 4 или 5 аминокислот заменены, делетированы или добавлены в аминокислотной последовательности пептида WT1; и
(b) пептид, состоящий из аминокислотной последовательности, в которой все или часть аминокислот, например, одна или более, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 аминокислот модифицированы в аминокислотной последовательности пептида WT1.
Примеры «модификации» аминокислоты, которая может присутствовать в модифицированном пептиде WT1, включают, но без ограничения, модификацию за счет добавления алифатической цепи, такую как алкилирование, такое как ацетилирование и метилирование, гликозилирование, гидроксилирование, карбоксилирование, введение альдегидной группы, фосфорилирование, сульфонилирование, формилирование, миристоилирование, пальмитоилирование и стеарилирование, октаноилирование, этерефикация, амидирование, дезамидирование, модификацию за счет образования дисульфидной связи, такую как модификация цистеином, модификация глутатионом и модификация тиогликолевой кислотой, гликирование, убиквитинилирование, образование сукцинимида, глутамилирование, пренилирование и тому подобное. Модифицированный пептид WT1 может содержать комбинацию замены, делеции или добавления одной или более аминокислот и модификации одной или более аминокислот.
В качестве конкретного примера, пептид Db235m, в котором часть пептида Db235 модифицирована, представляет собой модифицированный пептид WT1, состоящий из последовательности Cys Tyr Thr Trp Asn Gln Met Asn Leu (SEQ ID NO:3) (WO 2002/079253) и включен в термин «модифицированный пептид WT1» согласно настоящему изобретению. Пептид WT1, относящийся к типу пептидов с заменами, описанный в WO 2004/026897, производное пептида WT1235-243, описанное в WO 2007/063903 A1, и HLA-A24-ограниченный пептид ракового антигена, описанный в WO 2003/106682, также включены в термин «модифицированный пептид WT1» в настоящем изобретении. Конкретные примеры HLA-A24-ограниченного модифицированного пептида WT1, описанного в WO 2003/106682, включают пептид RYF с последовательностью Arg Tyr Phe Pro Asn Ala Pro Tyr Leu (SEQ ID NO:4) и пептид AYL с последовательностью Ala Tyr Leu Pro Ala Val Pro Ser Leu (SEQ ID NO:5).
Пептид WT1 и/или модифицированный пептид WT1 могут быть в свободной форме или в форме любой фармакологически приемлемой соли, например, в форме солей кислот (соль уксусной кислоты, соль ТФУ, соль хлористоводородной кислоты, соль серной кислоты, соль фосфорной кислоты, соль молочной кислоты, соль винной кислоты, соль малеиновой кислоты, соль фумаровой кислоты, соль щавелевой кислоты, соль бромистоводородной кислоты, соль янтарной кислоты, соль азотной кислоты, соль яблочной кислоты, соль лимонной кислоты, соль олеиновой кислоты, соль пальмитиновой кислоты, соль пропионовой кислоты, соль муравьиной кислоты, соль бензойной кислоты, соль пикриновой кислоты, соль бензолсульфоновой кислоты, соль додецилсерной кислоты, соль метансульфоновой кислоты, соль п-толуолсульфоновой кислоты, соль глутаровой кислоты, соли различных аминокислот и т.д.), солей металлов (соли щелочных металлов (например, соль натрия, соль калия), солей щелочноземельных металлов (например, соль кальция, соль магния, соль алюминия и т.д.)) или солей аминов (соль триэтиламина, соль бензиламина, соль диэтаноламина, соль трет-бутиламина, соль дициклогексиламина, соль аргинина, соль диметиламмония, соль аммония и т.д.). Предпочтительной фармакологически приемлемой солью является соль уксусной кислоты или соль ТФУ. Можно использовать пептид WT1 и/или модифицированный пептид WT1, который был синтезирован или получен и выделен и очищен хорошо известным способом.
Как использовано в настоящем описании, термин «стимулятор индукции клеточного иммунитета» означает любое вещество, которое может усиливать клеточный иммунный ответ, индуцированный антигеном, который вводят вместе с веществом, по сравнению иммунным ответом, индуцированным антигеном без вещества. Стимулятор индукции клеточного иммунитета может включать вещества, подробно описанные в настоящем описании, хотя стимулятор не ограничен механизмом действия, посредством которого происходит стимуляция индукции клеточного иммунитета.
Как использовано в настоящем описании, термин «лиганд TLR» означает лиганд Toll-подобного рецептора (TLR) и включает, например, лиганды TLR 1-9. Примеры лиганда TLR включают лиганд TLR1/2, лиганд TLR2/6, лиганд TLR2 и дектина-1, лиганд TLR3, лиганд TLR4, лиганд TLR5, лиганд TLR7 и/или TLR8, лиганд TLR9 и тому подобное. В предпочтительном аспекте настоящего изобретения лигандом TLR является лиганд TLR1/2, лиганд TLR2 и дектина-1, лиганд TLR3, лиганд TLR4, лиганд TLR7 и/или TLR8 и/или лиганд TLR9.
Как использовано в настоящем описании, термин «лиганд TLR1/2» означает лиганд гетеродимера Toll-подобного рецептора (TLR) 1 и Toll-подобного рецептора (TLR) 2 и включает, например, триацилированный липопротеид, полученный из клеточной стенки бактерии, и его соль, которые могут представлять собой экстракт, продукт или синтетический продукт, но ограничиваются указанным.
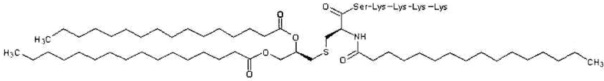
В предпочтительном аспекте настоящего изобретения лигандом TLR1/2 является Pam3CSK4. Pam3CSK4 имеет формулу:
Как использовано в настоящем описании, термин «лиганд TLR2 и дектина-1» означает лиганд Toll-подобного рецептора (TLR) 2 и рецептора β1,3-глюкана (дектина-1) и включает, например, β1,3-глюкан, полученный из клеточной стенки гриба, и его соль, которые могут представлять собой экстракт, продукт или синтетический продукт, но ограничиваются указанным. В предпочтительном аспекте настоящего изобретения лигандом TLR2 и дектина-1 является зимозан, полученный из клеточной стенки дрожжей.
Как использовано в настоящем описании, термин «лиганд TLR3» означает лиганд Toll-подобного рецептора (TLR) 3 и включает, например, двухцепочечную РНК (днРНК), полученную из вируса, и ее соль, и они могут представлять собой экстракт, продукт или синтетический продукт, но ограничиваются указанным. В предпочтительном аспекте настоящего изобретения лигандом TLR3 является полиинозиновая-полицитидиловая кислота (поли(I:C)), которая является синтетическим продуктом, и/или ее соль.
Как использовано в настоящем описании, термин «лиганд TLR4» означает лиганд Toll-подобного рецептора (TLR) 4 и включает, например, липополисахарид (LPS), полученный из бактерии или растения, в частности, производное липида A, например, монофосфориллипид A, 3-деацилированный монофосфориллипид A (3D-MPL), OM174, OM294 DP или OM197 MP-Ac DP и тому подобное, алкилглюкозаминидфосфат (AGP), например, AGP, описанный в WO 98/50399 или США 6303347, или соль AGP, которая описана в США 6764840, и липополисахарид, полученный из бактерии Pantoea, глюкопиранозиллипид и гиалуронат натрия, но не ограничивается указанным.
В предпочтительном аспекте настоящего изобретения предпочтительными в качестве лиганда TLR4 являются липополисахариды, полученные из рода Acetobacter (например, Acetobacter aceti, Acetobacter xylinum, Acetobacter orientalis и т.д.), рода Zymomonas (например, Zymomonas mobilis и т.д.), рода Xanthomonas (например, Xanthomonas campestris и т.д.), рода Enterobacter (например, Enterobacter cloacae и т.д.) и рода Pantoea (например, Pantoea agglomerans и т.д.). Экстракты, полученные из таких липополисахаридов, или очищенные липополисахариды могут быть использованы как таковые. Кроме того, например, липополисахариды (IP-PA1), полученные из Pantoea agglomerans, можно приобрести у компании Funakoshi. Кроме того, в предпочтительном аспекте настоящего изобретения лигандом TLR4 является липополисахарид, полученный из бактерии Pantoea, глюкопиранозиллипид и/или гиалуронат натрия.
Как использовано в настоящем описании, термин «лиганд TLR7 и/или TLR8» означает лиганд Toll-подобного рецептора (TLR) 7 и/или TLR8 и включает, например, одноцепочечную РНК, имихимод, резихимод (R848), TLR7-II и другие соединения, например, локсорибин и бропиримин, но не ограничивается указанным.
В предпочтительном аспекте настоящего изобретения лигандом TLR7 и/или TLR8 является имихимод. Имихимод представляет собой 1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-4-амин формулы:
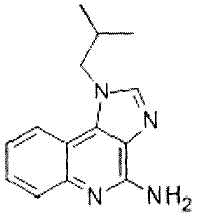 ,
,
и его характеристики и способ получения описаны, например, в JP 7-505883 A (патентный документ 2).
В другом предпочтительном аспекте лигандом TLR7 и/или TLR8 является резихимод. Резихимод представляет собой 4-амино-2-(этоксиметил)-α,α-диметил-1H-имидазо[4,5-c]хинолин-1-этанол формулы:
 .
.
В другом предпочтительном аспекте лигандом TLR7 и/или TLR8 является TLR7-II. TLR7-II представлен формулой:
 .
.
В другом предпочтительном аспекте лигандом TLR7 и/или TLR8 является бропиримин. Бропиримин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «лиганд TLR9» означает лиганд Toll-подобного рецептора (TLR) 9 и включает, например, ODN1826 и тому подобное. Лиганд TLR9, используемый в настоящем изобретении, может представлять собой экстракт, продукт или синтетический продукт, но не ограничивается указанным. В предпочтительном аспекте настоящего изобретения лигандом TLR9 является ODN1826.
ODN1826 является олигодезоксинуклеотидом, состоящим из следующей последовательности (SEQ ID NO:6):
5'-tccatgacgttcctgacgtt-3'.
Как использовано в настоящем описании, термин «лиганд TLR2/6» означает лиганд гетеродимера Toll-подобного рецептора (TLR) 2 и Toll-подобного рецептора (TLR) 6 и включает, например, диацилированный липопротеид, полученный из клеточной стенки микоплазмы, и его соль, которые могут представлять собой экстракт, продукт или синтетический продукт, но ограничиваются указанным. В предпочтительном аспекте настоящего изобретения лигандом TLR2/6 является Pam2CSK4, MALP-2 и/или FSL-1.
Pam2CSK4 представлен следующей формулой.
 .
.
FSL-1 представлен следующей формулой.
Как использовано в настоящем описании, термин «лиганд TLR5» означает лиганд Toll-подобного рецептора (TLR) 5 и включает, например, флагеллин и тому подобное. Лиганд TLR5, используемый в настоящем изобретении, может представлять собой экстракт, продукт или синтетический продукт, но не ограничивается указанным. В предпочтительном аспекте настоящего изобретения лигандом TLR5 является флагеллин.
Toll-подобные рецепторы (TLR) составляют семейство трансмембранных белков I-типа, которые инициируют врожденный иммунный ответ, в котором принимают участие специфичный цитокин, специфичный хемокин и фактор роста, за счет их активации in vivo. Все TLR могут активировать определенную молекулу передачи внутриклеточного сигнала, например, ядерный фактор κB (NF-κB) и активируемую митогенами протеинкиназу (MAP-киназу) или тому подобное, хотя каждому TLR, по-видимому, соответствуют конкретные популяции цитокинов и хемокинов, которые высвобождаются. TLR3, 7, 8 и 9 включены в подсемейство TLR, которое присутствует во фракции эндосом или фракции лизосом иммунной клетки (например, дендритной клетки и моноцита). В частности, TLR3 экспрессируется широким кругом клеток, таких как дендритная клетка и фибробласт, TLR7 экспрессируется дендритной клеткой, подобной плазматической клетке, и в меньшей степени экспрессируется моноцитом, TLR8 экспрессируется моноцитом, а также полученной из моноцита дендритной клеткой и миелоидной дендритной клеткой, и TLR9 экспрессируется дендритной клеткой, подобно плазматической клетке. Такое подсемейство опосредует узнавание нуклеиновой кислоты микроорганизма (одноцепочечной РНК, двухцепочечной РНК, одноцепочечной ДНК и т.д.). Агонисты TLR3, TLR7 и/или TLR8 и TLR9 стимулируют продукцию различных воспалительных цитокинов (включая, например, интерлейкин-6, интерлейкин-12, TNF-α и интерферон-γ). Такие агонисты также стимулируют повышение экспрессии костимулирующей молекулы (например, CD40, CD80 и CD86), молекулы главного комплекса гистосовместимости и рецептора хемокина. Интерфероны I-типа (IFNα и IFNβ) продуцируются клеткой при активации агонистами TLR7 и/или TLR8.
Как использовано в настоящем описании, термин «циклический динуклеотид» означает молекулу, в которой две группы OH в представленной сахаром части двух нуклеотидов, образуют сложный эфир c каждой молекулой фосфорной кислоты, и при этом происходит циклизация нуклеотидов, и ее аналог, и включает, например, циклический ди-АМФ (ц-ди-АМФ), циклический ди-ГМФ (ц-ди-ГМФ), c-dGpGp, c-dGpdGp, c-GpAp, c-GpCp, c-GpUp и тому подобное, но не ограничивается указанным. Циклический динуклеотид активирует дендритную клетку или T-клетку. Дополнительные примеры циклического динуклеотида, их применение в качестве адъюванта и способ их получения описаны в JP 2007-529531 A (патентный документ 3). В предпочтительном аспекте настоящего изобретения циклическим динуклеотидом является циклический ди-ГМФ и/или циклический ди-АМФ. Циклический ди-ГМФ имеет формулу:
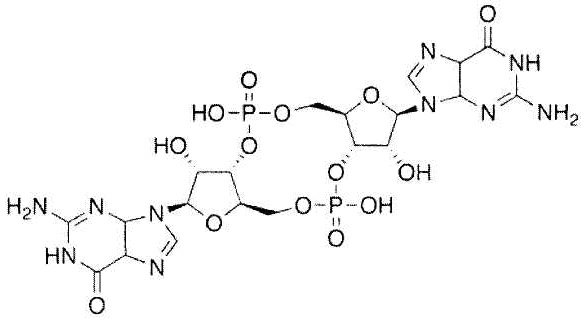 ,
,
и способ его синтеза описан Kawai et al., Nucleic Acids Research Suppl. 3: 103-4.
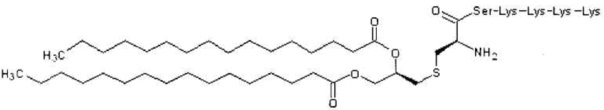
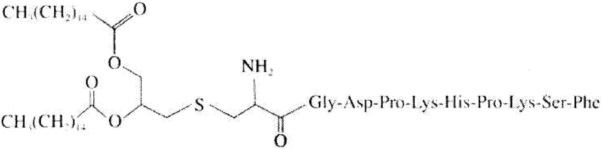
Как использовано в настоящем описании, термин «хелперный пептид» означает любой пептид, который активирует хелперную T-клетку, и включает, например, полученный из туберкулезной бациллы хелперный пептид, полученный из вируса кори хелперный пептид, полученный из вируса гепатита B хелперный пептид, полученный из вируса гепатита C хелперный пептид, полученный из Chlamydia trachomatis хелперный пептид, полученный из спорозоита Plasmodium falciparum хелперный пептид, полученный из гемоцианина морского блюдечка «замочная скважина» хелперный пептид, полученный из столбнячного токсина хелперный пептид, полученный их коклюшного токсина хелперный пептид, полученный из дифтерийного токсина хелперный пептид, полученный из раковой клетки хелперный пептид (например, хелперный пептид WT1_332-347 (описанный в патенте Японии 4621142 «WT1-derived HLA-DR binding Antigen Peptide»), хелперный пептид WT135, хелперный пептид hWT186, хелперный пептид hWT1294 (все три вида описаны в WO 2010/123065 «Cancer Antigen Helper Peptide»), хелперный пептид IMA-MMP-001, хелперный пептид CEA-006, хелперный пептид MMP-001, хелперный пептид TGFBI-004, хелперный пептид HER-2/neu (а/к 776-790), хелперный пептид AE36, хелперный пептид AE37, хелперный пептид MET-005, хелперный пептид BIR-002 и т.д., и универсальный хелперный аналог (например, PADRE). В предпочтительном аспекте настоящего изобретения хелперный пептид состоит из 10-20 аминокислот, предпочтительно из 12-19 аминокислот, более предпочтительно из 13-18 аминокислот. В предпочтительном аспекте настоящего изобретения хелперным пептидом является пептид-25, hWT135, PADRE или WT1_332-347. Пептид-25 представляет собой пептид из 15 аминокислот, состоящий из последовательности Phe Gln Asp Ala Tyr Asn Ala Ala Gly Gly His Asn Ala Val Phe (SEQ ID NO:7), соответствующий аминокислотным остаткам 240-254 Ag85B, который является одним из основных белков, секретируемых туберкулезной бациллой человека (Mycobacterium tuberculosis). Кроме того, hWT135 представляет собой пептид из 18 аминокислот, состоящий из последовательности Trp Ala Pro Val Leu Asp Phe Ala Pro Pro Gly Ala Ser Ala Tyr Gly Ser Leu (показанной в виде SEQ ID NO:8 в настоящем описании), описанный в WO 2010/123065 «Cancer Antigen Helper Peptide». PADRE представляет собой пептид из 13 аминокислот, состоящий из последовательности D-Ala Lys циклогексил-Ala Val Ala Ala Trp Thr Leu Lys Ala Ala D-Ala (показанной в виде SEQ ID NO:9 в настоящем описании). WT1_332-347 представляет собой пептид из 16 аминокислот, состоящий из последовательности Lys Arg Tyr Phe Lys Leu Ser His Leu Gln Met His Ser Arg Lys His (показанной в виде SEQ ID NO:10 в настоящем описании), описанный в патенте Японии 4621142 «WT1-derived HLA-DR binding Antigen Peptide».
Кроме того, в настоящем изобретении вместо вышеуказанных хелперных пептидов или в комбинации с ними также могут быть использованы пептиды, в которых все или часть аминокислот хелперных пептидов модифицированы заменой, модификацией или подобным (далее называемые «модифицированными хелперными пептидами»).
Модифицированный хелперный пептид включает, например,
(a) пептид, состоящий из аминокислотной последовательности, в которой одна до нескольких, например, 1, 2, 3, 4 или 5 аминокислот заменены, делетированы или добавлены в аминокислотной последовательности исходного хелперного пептида; и
(b) пептид, состоящий из аминокислотной последовательности, в которой все или часть аминокислот, например, одна или несколько, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 аминокислот модифицированы в аминокислотной последовательности исходного хелперного пептида.
Одним примером модифицированного хелперного пептида является пептид-25B. Пептид-25B является одним из примеров модифицированного пептида-25, в котором часть аминокислот пептида-25 модифицирована, чтобы усилить эффект иммуностимуляции, и представляет собой пептид из 15 аминокислот, состоящий из последовательности Phe Gln Asp Ala Tyr Asn Ala Val His Ala Ala His Ala Val Phe (SEQ ID NO:11).
Примеры «модификации» аминокислоты, которую может иметь модифицированный хелперный пептид, включают, но без ограничения, модификацию посредством добавления алифатической цепи, такую как ацетилирование, алкилирование, такое как метилирование, гликозилирование, гидроксилирование, карбоксилирование, введение альдегидной группы, фосфорилирование, сульфонилирование, формилирование, добавление жирной кислоты, такое как миристоилирование, пальмитоилирование и стеарилирование, октаноилирование, этерефикация, амидирование, дезамидирование, модификацию за счет образования дисульфидной связи, такую как модификация цистеином, модификация глутатионом и модификация тиогликолевой кислотой, гликирование, убиквитинилирование, образование сукцинимида, глутамилирование, пренилирование и тому подобное. Кроме того, модифицированный хелперный пептид может содержать комбинацию замены, делеции или добавления одной или более аминокислот и модификации одной или более аминокислот.
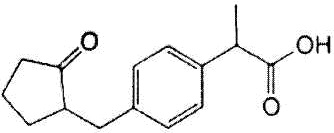
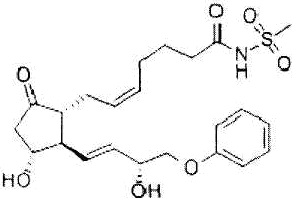
Как использовано в настоящем описании, термин «ингибитор циклооксигеназы» означает вещество, которое ингибирует функцию циклооксигеназы (COX). Далее его также называют «ингибитор COX». В качестве ингибиторов COX существуют ингибитор COX, который избирательно действует на конкретную циклооксигеназу (например, COX-1 или COX-2), и ингибитор COX, не обладающий избирательностью. Примеры ингибиторов COX, которые можно использовать в настоящем изобретении, включают этодолак, локсопрофен, целекоксиб, вальдекоксиб, парекоксиб, лумиракоксиб, мелоксикам, теноксикам, диклофенак, мефенамовую кислоту, толфенамовую кислоту, флуфенамовую кислоту, меклофенамовую кислоту, нифлумовую кислоту, бензидамин, индобуфен, трифлусал, толметин, фенопрофен, тиапрофеновую кислоту, фелбинак, непафенак, амфенак, правадолин, залтопрофен, сулиндак, набуметон, дифлунисал, пироксикам, ибупрофен, напроксен, фенопрофен, аспирин, метилсалицилат, салициламид, салсалат, алоксиприн, толметин, индометацин, проглуметацин, ацеметацин, флурбипрофен, пранопрофен, ацетаминофен, флоктафенин, лорноксикам, теноксикам, тиапрофеновую кислоту, оксапрозин, кетопрофен, декскетопрофен, дексибупрофен, алминопрофен, кеторолак, мофезолак, фенилбутазон, оксифенилбутазон, кетофенилбутазон, фепразон, фенбутазон, этензамид, тиарамид, тиноридин, эпиризол, эморфазон и их производное, а также их фармакологически приемлемую соль. В предпочтительном аспекте настоящего изобретения ингибитором COX является этодолак и/или локсопрофен.
Локсопрофен представлен формулой:
 .
.
Как использовано в настоящем описании, термин «антагонист рецептора простагландина» означает вещество, обладающее функцией предотвращения действия простагландина на рецептор, и включает, например, антагонист рецептора EP2, антагонист рецептора EP4, антагонист рецептора DP и антагонист рецептора IP.
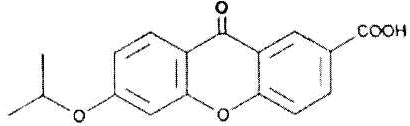
Как использовано в настоящем описании, термин «антагонист рецептора EP2» означает вещество, обладающее функцией предотвращения действия простагландина E2 на рецептор EP2. Примеры антагониста рецептора EP2 включают AH6809 и его производное, а также его фармакологически приемлемую соль.
AH6809 представлен формулой:
 .
.
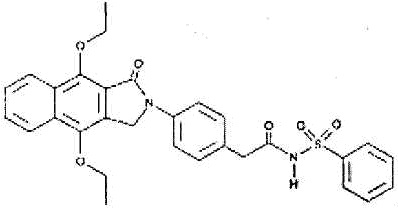
Как использовано в настоящем описании, термин «антагонист рецептора EP4» означает вещество, обладающее функцией предотвращения действия простагландина E2 на рецептор EP4. Примеры антагониста рецептора EP4 включают GW627368X и его производное, а также его фармакологически приемлемую соль.
GW627368X представлен формулой:
 .
.
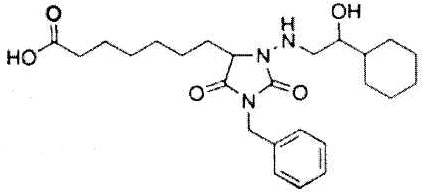
Как использовано в настоящем описании, термин «антагонист рецептора DP» означает вещество, обладающее функцией предотвращения простагландин действия D2 на рецептор DP. Примеры антагониста рецептора DP включают S-5751, BWA868C и их производное, а также их фармакологически приемлемую соль.
BWA868C представлен формулой:
 .
.
Как использовано в настоящем описании, термин «антагонист рецептора IP» означает вещество, обладающее функцией предотвращения действия простагландина I2 на рецептор IP. Примеры антагониста рецептора IP включают RO1138452 и его производное, а также его фармакологически приемлемую соль.
RO1138452 представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора простагландина» означает вещество, обладающее функцией действия на рецептор простагландина, и включает, например, агонист рецептора EP3.
Как использовано в настоящем описании, термин «агонист рецептора EP3» означает вещество, обладающее функцией действия на рецептор EP3. Примеры агониста рецептора EP3 включают сульпростон, GR63799, клопростенол, ONO-AE-248, карбациклин и их производное, а также их фармакологически приемлемую соль.
Сульпростон представлен формулой:
 .
.
Как использовано в настоящем описании, термин «ингибитор продукции TSLP» означает вещество, обладающее функцией ингибирования продукции TSLP. Так как считается, что лекарственное средство, которое ингибирует NF-κB, опосредованно ингибирует продукцию TSLP, то его включают в указанную категорию. Примеры ингибитора продукции TSLP включают нарингенин, берберин, ресвератрол, лютеолин, апигенин, хризоэриол, велутин, рутин, гесперидин, кверцетин, дайдзеин, генистеин, носкапин, дииндолилметан, ксантон, партенолид и их производное, а также их фармакологически приемлемую соль.
Берберин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «ингибитор аденилатциклазы» означает вещество, обладающее функцией ингибирования активности аденилатциклазы. Примеры ингибитора аденилатциклазы включают 2',5'-дидезоксиаденозин, ниацин, инсулин и их производное, а также их фармакологически приемлемую соль.
2',5'-Дидезоксиаденозин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «омега-3 жирная кислота» относится к ненасыщенной жирной кислоте, имеющей углерод-углеродную двойную связь в положении ω-3. Примеры омега-3 жирной кислоты включают эйкозапентаеновую кислоту, α-линоленовую кислоту, докозагексаеновую кислоту и их производное, а также их фармакологически приемлемую соль.
Эйкозапентаеновая кислота представлена формулой:
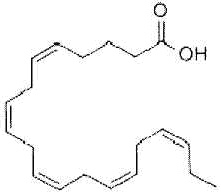 .
.
Как использовано в настоящем описании, термин «агонист PPAR» означает вещество, обладающее функцией действия на активируемый пролифератором пероксисом рецептор, и включает, например, агонист PPAR-α, агонист PPAR-δ и агонист PPAR-γ.
Как использовано в настоящем описании, термин «агонист PPAR-α» означает вещество, обладающее функцией действия на активируемый пролифератором пероксисом рецептор типа α. Термин «агонист PPAR-δ» означает вещество, обладающее функцией действия на активируемый пролифератором пероксисом рецептор типа δ. Термин «агонист PPAR-γ» означает вещество, обладающее функцией действия на активируемый пролифератором пероксисом рецептор типа γ. Примеры агониста PPAR-α и/или агониста PPAR-δ, и/или агониста PPAR-γ включают клофибрат, фенофибрат, безафибрат, ципрофибрат, этофибрат, телмисартан, олеилэтаноламид, тетрадецилтиоуксусную кислоту, троглитазон, пиоглитазон, росиглитазон, балаглитазон, ривоглитазон, циглитазон, дарглитазон, эдаглитазон, нетоглитазон, индеглитазар, тесаглитазар, мураглитазар, алеглитазар и их производное, а также их фармакологически приемлемую соль.
Клофибрат представлен формулой:
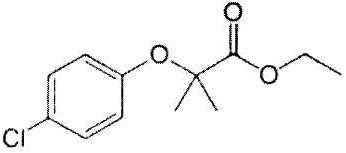 .
.
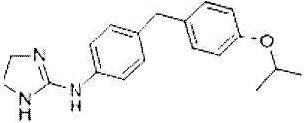
Как использовано в настоящем описании, термин «антагонист рецептора дофамина» означает вещество, обладающее функцией предотвращения действия дофамина на рецептор, и включает, например, антагонист рецептора D1 и антагонист рецептора D5.
Как использовано в настоящем описании, термин «антагонист рецептора D1» означает вещество, обладающее функцией предотвращения действия дофамина на рецептор D1. Примеры антагониста рецептора D1 включают бензазепин, фенолдопам, лоркасерин, SCH23390, SCH39166, LE300 и их производное, а также их фармакологически приемлемую соль.
Бензазепин представлен формулой:
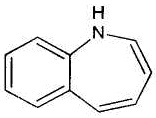 .
.
Как использовано в настоящем описании, термин «антагонист рецептора D5» означает вещество, обладающее функцией предотвращения действия дофамина на рецептор D5. Примеры антагониста рецептора D5 включают SCH39166 и его производное, а также его фармакологически приемлемую соль.
SCH39166 представлен формулой:
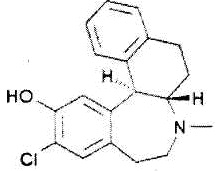 .
.
Как использовано в настоящем описании, термин «агонист рецептора дофамина» означает вещество, обладающее функцией действия на рецептор дофамина, и включает, например, агонист рецептора D2, агонист рецептора D3 и агонист рецептора D4.
Как использовано в настоящем описании, термин «агонист рецептора D2» означает вещество, обладающее функцией действия на рецептор D2. Примеры агониста рецептора D2 включают каберголин, бромкриптин, перголид, ропинирол, талипексол, арипипразол, луразидон и их производное, а также их фармакологически приемлемую соль.
Ропинирол представлен формулой:
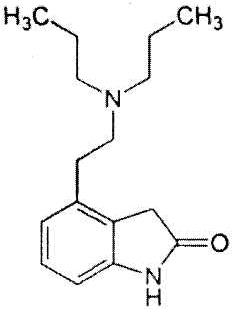 .
.
Как использовано в настоящем описании, термин «агонист рецептора D3» означает вещество, обладающее функцией действия на рецептор D3. Примеры агониста рецептора D3 включают пирибедил, ротиготин, PD1289077, OH-DPAT и их производное, а также их фармакологически приемлемую соль.
Ротиготин представлен формулой:
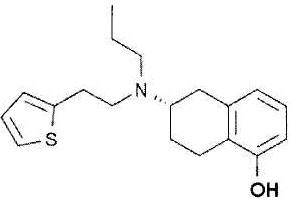 .
.
Как использовано в настоящем описании, термин «агонист рецептора D4» означает вещество, обладающее функцией действия на рецептор D4. Примеры агониста рецептора D4 включают флибансерин, ABT724, PD168077, CP226269 и их производное, а также их фармакологически приемлемую соль.
Флибансерин представлен формулой:
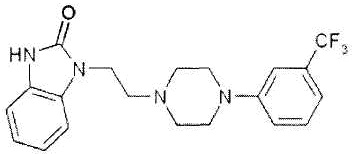 .
.
Как использовано в настоящем описании, термин «антагонист рецептора гистамина» означает вещество, обладающее функцией предотвращения действия гистамина на рецептор, и включает, например, антагонист рецептора H1 и антагонист рецептора H2.
Как использовано в настоящем описании, термин «антагонист рецептора H1» означает вещество, обладающее функцией предотвращения действия гистамина на рецептор H1. Примеры антагониста рецептора H1 включают кетансерин, тонзиламин, мепирамин, трипеленамин, диметинден, клемастин, бамипин, изотипендил, хлорфеноксамин, диметотиазин, хлорпромазин, гидроксизин, опипрамол, бетагистин, циннаризин, левокабастин, антазолин, дифенилпиралин, карбиноксамин, доксиламин, алимемазин, циклизин, меклозин, левоцетиризин, ципрогептадин, фениндамин, трипролидин, азатадин, астемизол, терфенадин, акривастин, эбастин, деслоратадин, рупатадин, биластин, мизоластин, ноберастин, рокастин, темеластин, бепотастин, дифенгидрамин, хлорфенирамин, кетотифен, прометазин, ципрогептадин, эпинастин, олопатадин, бепотастин, астемизол, эмедастин, меквитазин, оксатомид, лоратадин, фексофенадин, цетиризин, азеластин и их производное, а также их фармакологически приемлемую соль.
Дифенгидрамин представлен формулой:
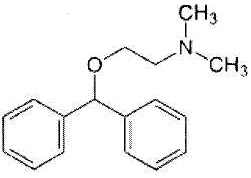 .
.
Как использовано в настоящем описании, термин «антагонист рецептора H2» означает вещество, обладающее функцией предотвращения действия гистамина на рецептор H2. Примеры антагониста рецептора H2 включают циметидин, ранитидин, фамотидин, низатидин, роксатидин, лафутидин и их производное, а также их фармакологически приемлемую соль.
Фамотидин представлен формулой:
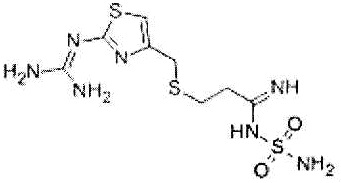 .
.
Как использовано в настоящем описании, термин «агонист рецептора гистамина» означает вещество, обладающее функцией действия на рецептор гистамина, и включает, например, агонист рецептора H1, агонист рецептора H3 и агонист рецептора H4.
Как использовано в настоящем описании, термин «агонист рецептора H1» означает вещество, обладающее функцией действия на рецептор H1. Примеры агониста рецептора H1 включают 2-пиридилэтиламин, 2-тиазолилэтиламин и их производное, а также их фармакологически приемлемую соль.
2-Пиридилэтиламин представлен формулой:
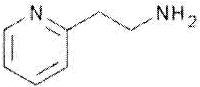 .
.
Как использовано в настоящем описании, термин «агонист рецептора H3» означает вещество, обладающее функцией действия на рецептор H3. Примеры агониста рецептора H3 включают имметридин, иметит, иммепип, α-метилгистамин, проксифан и их производное, а также их фармакологически приемлемую соль.
Проксифан представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора H4» означает вещество, обладающее функцией действия на рецептор H4. Примеры агониста рецептора H4 включают 4-метилгистамин, VUF8430, иммепип и их производное, а также их фармакологически приемлемую соль.
4-Метилгистамин представлен формулой:
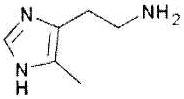 .
.
Как использовано в настоящем описании, термин «антагонист рецептора серотонина» означает вещество, обладающее функцией предотвращения действия серотонина на рецептор, и включает, например, антагонист рецептора 5-HT2, антагонист рецептора 5-HT4, антагонист рецептора 5-HT6 и антагонист рецептора 5-HT7.
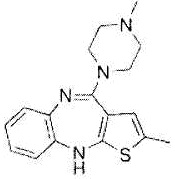
Как использовано в настоящем описании, термин «антагонист рецептора 5-HT2» означает вещество, обладающее функцией предотвращения действия серотонина на рецептор 5-HT2. Примеры антагониста рецептора 5-HT2 включают пизотифен, рисперидон, оланзапин, кветиапин, арипипразол, блонансерин, клозапин, палиперидон, ритансерин, йохимбин, месулергин, агомелатин, циклобензаприн, сарпогрелат, метисергид, кетансерин и их производное, а также их фармакологически приемлемую соль.
Оланзапин представлен формулой:
 .
.
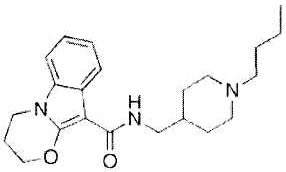
Как использовано в настоящем описании, термин «антагонист рецептора 5-HT4» означает вещество, обладающее функцией предотвращения действия серотонина на рецептор 5-HT4. Примеры антагониста рецептора 5-HT4 включают пибосерод, GR113808, GR125487, RS39604, SB204070 и их производное, а также их фармакологически приемлемую соль.
Пибосерод представлен формулой:
 .
.
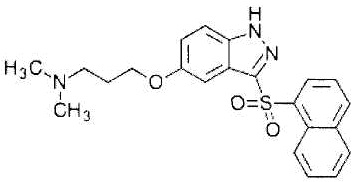
Как использовано в настоящем описании, термин «антагонист рецептора 5-HT6» означает вещество, обладающее функцией предотвращения действия серотонина на рецептор 5-HT6. Примеры антагониста рецептора 5-HT6 включают церлапирдин, клозапин и их производное, а также их фармакологически приемлемую соль.
Церлапирдин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «антагонист рецептора 5-HT7» означает вещество, обладающее функцией предотвращения действия серотонина на рецептор 5-HT7. Примеры антагониста рецептора 5-HT7 включают лурасидон, метерголин и их производное, а также их фармакологически приемлемую соль.
Метерголин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора серотонина» означает вещество, обладающее функцией действия на рецептор серотонина, и включает, например, агонист рецептора 5-HT1 и агонист рецептора 5-HT2.
Как использовано в настоящем описании, термин «агонист рецептора 5-HT1» означает вещество, обладающее функцией действия на рецептор 5-HT1. Примеры агониста рецептора 5-HT1 включают пиклозотан, тандоспирон, суматриптан, золмитриптан, элетриптан, ризатриптан, наратриптан, алмотриптан, фроватриптан, авитриптан, эрготамин, алкалоид спорыньи и их производное, а также их фармакологически приемлемую соль.
Золмитриптан представлен формулой:
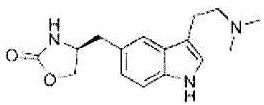 .
.
Как использовано в настоящем описании, термин «агонист рецептора 5-HT2» означает вещество, обладающее функцией действия на рецептор 5-HT2. Примеры агониста рецептора 5-HT2 включают α-метил-5-HT, агомелатин, норфенфлурамин, мета-хлорфенилпиперазин и их производное, а также их фармакологически приемлемую соль.
Агомелатин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «антагонист рецептора вазопрессина» означает вещество, обладающее функцией предотвращения действия вазопрессина на рецептор, и включает, например, антагонист рецептора V2.
Как использовано в настоящем описании, термин «антагонист рецептора V2» означает вещество, обладающее функцией предотвращения действия вазопрессина на рецептор V2. Примеры антагониста рецептора V2 включают толваптан, мозаваптан, кониваптан, ликсиваптан и их производное, а также их фармакологически приемлемую соль.
Мозаваптан представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора вазопрессина» означает вещество, обладающее функцией действия на рецептор вазопрессина, и включает, например, агонист рецептора V1.
Как использовано в настоящем описании, термин «агонист рецептора V1» означает вещество, обладающее функцией действия на рецептор V1. Примеры агониста рецептора V1 включают вазопрессин, фелипрессин, десмопрессин, липрессин, терлипрессин, орнипрессин, аргипрессин и их производное, а также их фармакологически приемлемую соль.
Десмопрессин представлен формулой:
 .
.
Как использовано в настоящем описании, термин «антагонист мускаринового рецептора» означает вещество, обладающее функцией действия на мускариновый рецептор, и включает, например, антагонист рецептора M1, антагонист рецептора M3 и антагонист рецептора M5.
Как использовано в настоящем описании, термин «антагонист рецептора M1» означает вещество, обладающее функцией предотвращения действия ацетилхолина на рецептор M1. Термин «антагонист рецептора M3» означает вещество, обладающее функцией предотвращения действия ацетилхолина на рецептор M3. Термин «антагонист рецептора M5» означает вещество, обладающее функцией предотвращения действия ацетилхолина на рецептор M5. Примеры антагониста рецептора M1 и/или антагониста рецептора M3 и/или антагониста рецептора M5 включают пирензепин, атропин, тримебутин, пиперидолат, оксибутинин, тропикамид, пропиверин, толтеродин, солифенацин, дарифенацин, имидафенацин, оксифенциклимин, бромид тиотропия, эзоксибутинин, тиквизий и их производное, а также их фармакологически приемлемую соль.
Оксибутинин представлен формулой:
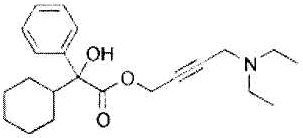 .
.
Как использовано в настоящем описании, термин «агонист мускаринового рецептора» означает вещество, обладающее функцией действия на мускариновый рецептор, и включает, например, агонист рецептора M1, агонист рецептора M2, агонист рецептора M3, агонист рецептора M4 и агонист рецептора M5.
Как использовано в настоящем описании, термин «агонист рецептора M1» означает вещество, обладающее функцией действия на рецептор M1. Термин «агонист рецептора M2» означает вещество, обладающее функцией действия на рецептор M2. Термин «агонист рецептора M3» означает вещество, обладающее функцией действия на рецептор M3. Термин «агонист рецептора M4» означает вещество, обладающее функцией действия на рецептор M4. Термин «агонист рецептора M5» означает вещество, обладающее функцией действия на рецептор M5. Примеры агониста рецептора M1 и/или агониста рецептора M2, и/или агониста рецептора M3, и/или агониста рецептора M4, и/или агониста M5 включают ацетилхолин, ацеклидин, алвамелин, талсаклидин, ксаномелин, пилокарпин, цевимелин, бетанехол, мазатикол, мускарин и их производное, а также их фармакологически приемлемую соль.
Бетанехол представлен формулой:
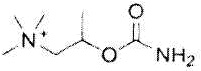 .
.
Как использовано в настоящем описании, термин «антагонист рецептора адреналина» означает вещество, обладающее функцией предотвращения действия адреналина на рецептор, и включает, например, антагонист рецептора α1, антагонист рецептора β1, антагонист рецептора β2 и антагонист рецептора β3.
Как использовано в настоящем описании, термин «антагонист рецептора α1» означает вещество, обладающее функцией предотвращения действия адреналина на рецептор α1. Примеры антагониста рецептора α1 включают празолин, доксазозин, буназозин, тримазозин, алфузозин, силодозин, теразозин, тамусулозин и их производное, а также их фармакологически приемлемую соль.
Тамусулозин представлен формулой:
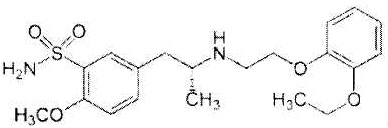 .
.
Как использовано в настоящем описании, термин «антагонист рецептора β1» означает вещество, обладающее функцией предотвращения действия адреналина на рецептор β1. Термин «антагонист рецептора β2» означает вещество, обладающее функцией предотвращения действия адреналина на рецептор β2. Термин «антагонист рецептора β3» означает вещество, обладающее функцией предотвращения действия адреналина на рецептор β3. Примеры антагониста рецептора β1 и/или антагониста рецептора β2, и/или антагониста рецептора β3 включают бопиндолол, пиндолол, тимолол, дихлоризопреналин, алпренолол, картеолол, инденолол, бунитролол, пенбутолол, пропранолол, надолол, нипрадилол, тилизолол, ацебутолол, целипролол, метопролол, атенолол, бисопролол, бетаксолол, практолол, бевантолол, бутоксамин, карведилол, амосулалол, аротинолол, лабеталол и их производное, а также их фармакологически приемлемую соль.
Пропранолол представлен формулой:
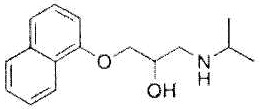 .
.
Как использовано в настоящем описании, термин «агонист рецептора ангиотензина» означает вещество, обладающее функцией действия на рецептор ангиотензина, и включает, например, агонист рецептора AT2.
Как использовано в настоящем описании, термин «агонист рецептора адреналина» означает вещество, обладающее функцией действия на рецептор адреналина, и включает, например, агонист рецептора α1 и агонист рецептора α2.
Как использовано в настоящем описании, термин «агонист рецептора α1» означает вещество, обладающее функцией действия на рецептор α1. Термин «агонист рецептора α2» означает вещество, обладающее функцией действия на рецептор α2. Примеры агониста рецептора α1 и/или агониста рецептора α2 включают норэпинефрин, норфенефрин, этилефрин, нафазолин, фенилэфрин, мидодрин, метоксамин, окседрин, метараминол, арбутамин, эфедрин, оксиметазолин, тетризолин, ксилометазолин, трамазолин, псевдоэфидрин, дипивефрин, амидефрин, метилэфедрин, рилменидин, бримонидин, медетомидин, ксилазин, тизанидин, кванфацин, метилдопа, кванабенз и их производное, а также их фармакологически приемлемую соль.
Ксилазин представлен формулой:
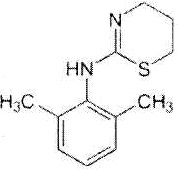 .
.
Как использовано в настоящем описании, термин «агонист рецептора ангиотензина» означает вещество, обладающее функцией действия на рецептор ангиотензина, и включает, например, агонист рецептора AT2.
Как использовано в настоящем описании, термин «агонист рецептора AT2» означает вещество, обладающее функцией действия на рецептор AT2. Примеры агониста рецептора AT2 включают новокинин, ангиотензин и их производное, а также их фармакологически приемлемую соль.
Ангиотензин представлен формулой:
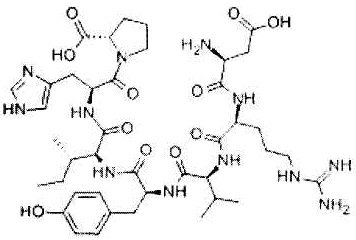 .
.
Как использовано в настоящем описании, термин «агонист рецептора ГАМК» означает вещество, обладающее функцией действия на рецептор ГАМК, и включает, например, агонист рецептора ГАМКB.
Как использовано в настоящем описании, термин «агонист рецептора ГАМКB» означает вещество, обладающее функцией действия на рецептор ГАМКB. Примеры агониста рецептора ГАМКB включают баклофен, γ-аминомасляную кислоту, арбаклофен и их производное, а также их фармакологически приемлемую соль.
Баклофен представлен формулой:
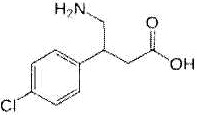 .
.
Как использовано в настоящем описании, термин «антагонист рецептора тромбина» означает вещество, обладающее функцией предотвращения действия тромбина на рецептор, и включает, например, антагонист рецептора PAR-1.
Как использовано в настоящем описании, термин «антагонист рецептора PAR-1» означает вещество, обладающее функцией предотвращения действия тромбина на рецептор PAR-1. Примеры антагониста рецептора PAR-1 включают ворапаксар, атопаксар, FR171113, RWJ56110, дабигатран, этексилат дабигатрана, мелагатран, ксимелагатран, гирудин, гирулог, аргатробан и их производное, а также их фармакологически приемлемую соль.
Ворапаксар представлен формулой:
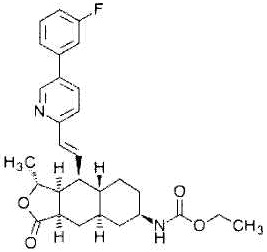 .
.
Как использовано в настоящем описании, термин «агонист рецептора тромбина» означает вещество, обладающее функцией действия на рецептор тромбина, и включает, например, агонист рецептора PAR-1.
Как использовано в настоящем описании, термин «агонист рецептора PAR-1» означает вещество, обладающее функцией действия на рецептор PAR-1. Примеры агониста рецептора PAR-1 включают TRAP-6, TRAP-14, NAT6-NH2 и их производное, а также их фармакологически приемлемую соль.
TRAP-6 представлен формулой:
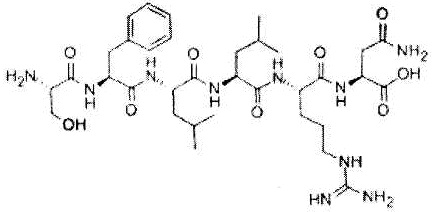 .
.
Как использовано в настоящем описании, термин «агонист опиоидного рецептора» означает вещество, обладающее функцией действия на опиоидный рецептор. Примеры агониста опиоидного рецептора включают тримебутин, алвимопан, морфин, оксикодон, дигидрокодеин, диаморфин, петидин, пентазоцин, бупренорфин, буторфанол, налбуфин, тилидин, дезоцин, мептазинол, тапентадол, налтрексон, метадон, этилморфин, гидрокодон, ацетилдигидрокодеин, налорфин, лоперамид, ремоксиприд, опипрамол, и их производное, а также их фармакологически приемлемую соль.
Бупренорфин представлен формулой:
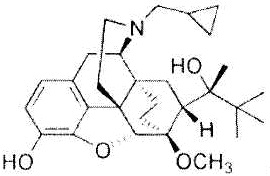 .
.
Как использовано в настоящем описании, термин «антагонист рецептора лейкотриена» означает вещество, обладающее функцией предотвращения действия лейкотриена на рецептор, и включает, например, антагонист рецептора CysLT1 и антагонист рецептора CysLT2.
Как использовано в настоящем описании, термин «антагонист рецептора CysLT1» означает вещество, обладающее функцией предотвращения действия лейкотриена на рецептор CysLT1. Термин «антагонист рецептора CysLT2» означает вещество, обладающее функцией предотвращения действия лейкотриена на рецептор CysLT2. Примеры антагониста рецептора CysLT1 и/или антагониста рецептора CysLT2 включают монтелукаст, зафирлукаст, пранлукаст, и их производное, а также их фармакологически приемлемую соль. Примеры фармакологически приемлемой соли монтелукаста включают монтелукаст натрия и тому подобное.
Монтелукаст натрия представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора лейкотриена» означает вещество, обладающее функцией действия на рецептор лейкотриена, и включает, например, агонист рецептора BLT.
Как использовано в настоящем описании, термин «агонист рецептора BLT» означает вещество, обладающее функцией действия на рецептор BLT. Примеры агониста рецептора BLT включают лейкотриен B4, CAY10583 и их производное, а также их фармакологически приемлемую соль.
Лейкотриен B4 представлен формулой:
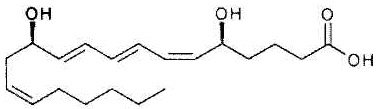 .
.
Как использовано в настоящем описании, термин «агонист рецептора АДФ» означает вещество, обладающее функцией действия на рецептор АДФ. Примеры агониста рецептора АДФ включают аденозиндифосфат и его производное, а также его фармакологически приемлемую соль.
Аденозиндифосфат представлен формулой:
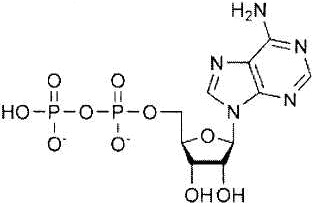 .
.
Как использовано в настоящем описании, термин «агонист рецептора мелатонина» означает вещество, обладающее функцией действия на рецептор мелатонина. Примеры агониста рецептора мелатонина включают мелатонин, перлапин, тасимелтеон и их производное, а также их фармакологически приемлемую соль.
Мелатонин представлен формулой:
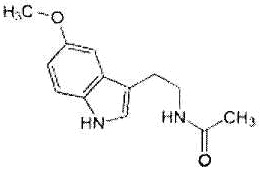 .
.
Как использовано в настоящем описании, термин «агонист рецептора соматостатина» означает вещество, обладающее функцией действия на рецептор соматостатина. Примеры агониста рецептора соматостатина включают соматостатин, соматостатин-14, октреотид и их производное, а также их фармакологически приемлемую соль.
Октреотид представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора каннабиноида» означает вещество, обладающее функцией действия на рецептор каннабиноида. Примеры агониста рецептора каннабиноида включают дронабинол, набилон, левонантрадол, отенабант, GW833972A, GW405833 и их производное, а также их фармакологически приемлемую соль.
Дронабинол представлен формулой:
 .
.
Как использовано в настоящем описании, термин «агонист рецептора сфингозин-1-фосфата» означает вещество, обладающее функцией действия на рецептор сфингозин-1-фосфата. Примеры агониста рецептора сфингозин-1-фосфата включают финголимод, понесимод, RPC-1063, ONO-4641, SEW2871, сфингозин-1-фосфат и их производное, а также их фармакологически приемлемую соль.
Финголимод представлен формулой:
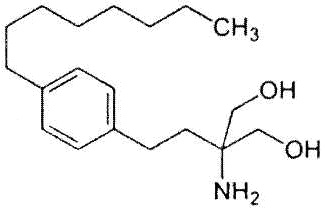 .
.
Как использовано в настоящем описании, термин «агонист метаботропного рецептора глутамата» означает вещество, обладающее функцией действия на метаботропный рецептор глутамата, и включает, например, агонист рецептора mGluR2, агонист рецептора mGluR3, агонист рецептора mGluR4, агонист рецептора mGluR6, агонист рецептора mGluR7 и агонист рецептора mGluR8.
Как использовано в настоящем описании, термин «агонист рецептора mGluR2» означает вещество, обладающее функцией действия на рецептор mGluR2. Термин «агонист рецептора mGluR3» означает вещество, обладающее функцией действия на рецептор mGluR3. Термин «агонист рецептора mGluR4» означает вещество, обладающее функцией действия на рецептор mGluR4. Термин «агонист рецептора mGluR6» означает вещество, обладающее функцией действия на рецептор mGluR6. Термин «агонист рецептора mGluR7» означает вещество, обладающее функцией действия на рецептор mGluR7. Термин «агонист рецептора mGluR8» означает вещество, обладающее функцией действия на рецептор mGluR8. Примеры агониста рецептора mGluR2 и/или агониста рецептора mGluR3, и/или агониста рецептора mGluR4, и/или агониста рецептора mGluR6, и/или агониста рецептора mGluR7, и/или агониста рецептора mGluR8 включают VU0361737, VU0155041, бифенилинданон A, PBDA, L-AP4, и их производное, а также их фармакологически приемлемую соль.
VU0361737 представлен формулой:
 .
.
Как использовано в настоящем описании, термин «ингибитор фосфолипазы A2» означает вещество, обладающее функцией ингибирования активности фосфолипазы A2. Примеры ингибитора фосфолипазы A2 включают глицирризиновую кислоту, глицирретиновую кислоту и их производное, а также их фармакологически приемлемую соль.
Глицирретиновая кислота представлена формулой:
 .
.
Как использовано в настоящем описании, термин «ингибитор продукции TGF-β» означает вещество, обладающее функцией ингибирования продукции TGF-β. Примеры ингибитора продукции TGF-β включают пирфенидон, траниласт и их производное, а также их фармакологически приемлемую соль.
Пирфенидон представлен формулой:
 .
.
Как использовано в настоящем описании, термин «ингибитор цитокина Th2» означает вещество, обладающее функцией ингибирования продукции цитокина Th2, такое как IL-4 и IL-5. Примеры ингибитор цитокина Th2 включают суплатаст и его производное, а также его фармакологически приемлемую соль. Примеры фармакологически приемлемой соли суплатаста включают тозилат суплатаста. В предпочтительном аспекте настоящего изобретения ингибитором цитокина Th2 является тозилат суплатаста.
Тозилат суплатаста представлен формулой:
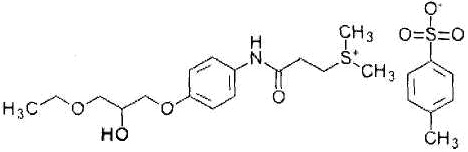 .
.
Как использовано в настоящем описании, термин «иммуномодулирующее низкомолекулярное лекарственное средство» означает вещество, которое активирует или подавляет иммунные клетки, такие как T-клетка, NK-клетка, макрофаг и тому подобное, и которое не соответствует ни одному из указанных выше веществ: лиганду TLR, циклическому динуклеотиду, хелперному пептиду, иммуномодулирующему низкомолекулярному лекарственному средству, ингибитору циклооксигеназы, антагонисту рецептора простагландина, агонисту рецептора простагландина, ингибитору продукции TSLP, ингибитору аденилатциклазы, омега-3 жирной кислоте, агонисту PPAR, антагонисту рецептора дофамина, агонисту рецептора дофамина, агонисту рецептора гистамина, антагонисту рецептора гистамина, агонисту рецептора серотонина, антагонисту рецептора серотонина, антагонисту рецептора вазопрессина, агонисту рецептора вазопрессина, антагонисту мускаринового рецептора, агонисту мускаринового рецептора, антагонисту рецептора адреналина, агонисту рецептора адреналина, агонисту рецептора ангиотензина, агонисту рецептора ГАМК, антагонисту рецептора тромбина, агонисту рецептора тромбина, агонисту опиоидного рецептора, агонисту рецептора АДФ, антагонисту рецептора лейкотриена, агонисту рецептора лейкотриена, агонисту рецептора мелатонина, агонисту рецептора соматостатина, агонисту рецептора каннабиноида, агонисту рецептора сфингозин-1-фосфата, агонисту метаботропного рецептора глутамата, ингибитору фосфолипазы A2, ингибитору продукции TGF-β и ингибитору цитокина Th2. Примеры иммуномодулирующего низкомолекулярного лекарственного средства включают бестатин, пидотимод, левамизол, голотимод, форфеникинол и их производное, а также их фармакологически приемлемую соль. Примеры фармакологически приемлемой соли левамизола включают гидрохлорид левамизола и тому подобное.
Бестатин представлен формулой:
 .
.
Пидотимод представлен формулой:
 .
.
Гидрохлорид левамизола представлен формулой:
 .
.
В настоящем изобретении иммуномодулирующим низкомолекулярным лекарственным средством обычно является соединение, имеющее молекулярную массу менее 1000, предпочтительно менее 500. В предпочтительном аспекте настоящего изобретения иммуномодулирующим низкомолекулярным лекарственным средством является одно или несколько соединений, выбранных из группы, состоящей из бестатина, пидотимода и гидрохлорида левамизола.
Как описано выше, авторы настоящего изобретения обнаружили, что среди множества стимуляторов индукции клеточного иммунитета лиганд TLR, циклический динуклеотид, хелперный пептид, иммуномодулирующее низкомолекулярное лекарственное средство, ингибитор циклооксигеназы, антагонист рецептора простагландина, агонист рецептора простагландина, ингибитор продукции TSLP, ингибитор аденилатциклазы, омега-3 жирная кислота, агонист PPAR, антагонист рецептора дофамина, агонист рецептора дофамина, агонист рецептора гистамина, антагонист рецептора гистамина, агонист рецептора серотонина, антагонист рецептора серотонина, антагонист рецептора вазопрессина, агонист рецептора вазопрессина, антагонист мускаринового рецептора, агонист мускаринового рецептора, антагонист рецептора адреналина, агонист рецептора адреналина, агонист рецептора ангиотензина, агонист рецептора ГАМК, антагонист рецептора тромбина, агонист рецептора тромбина, агонист опиоидного рецептора, агонист рецептора АДФ, антагонист рецептора лейкотриена, агонист рецептора лейкотриена, агонист рецептора мелатонина, агонист рецептора соматостатина, агонист рецептора каннабиноида, агонист рецептора сфингозин-1-фосфата, агонист метаботропного рецептора глутамата, ингибитор фосфолипазы A2, ингибитор продукции TGF-β и ингибитор цитокина Th2, являются особенно применимыми для усиления иммунного ответа, индуцируемого трансдермальным введением пептидного антигена WT1 и/или модифицированного пептидного антигена WT1. Таким образом, в одном аспекте стимулятор индукции клеточного иммунитета согласно настоящему изобретению представляет собой одно или более веществ, выбранных из указанных выше веществ. С точки зрения эффекта усиления иммунного ответа, индуцируемого антигенным пептидом WT1 и/или модифицированным пептидным антигеном WT1, предпочтительными стимуляторами индукции клеточного иммунитета является одно или более веществ, выбранных из группы, состоящей из лиганда TLR3, лиганда TLR4, лиганда TLR7 и/или лиганда TLR8, лиганда TLR9, иммуностимулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы и циклического динуклеотида, и более предпочтительным стимулятором индукции клеточного иммунитета является одно или более веществ, выбранных из группы, состоящей из лиганда TLR7 и/или TLR8, циклического динуклеотида, лиганда TLR9 и ингибитора циклооксигеназы. Индукцию клеточного иммунитета можно определить количественно различными известными способами. В настоящем изобретении можно применять любой такой известный способ, например, способ ELISPOT, описанный в примерах.
Как использовано в настоящем описании, неинвазивное введение означает введение без активного причинения физического раздражения и/или химического раздражения, предпочтительно без физического раздражения (например, без раздражения при соскобе лентой или раздражения микроиглой) кожи.
Как использовано в настоящем описании, термин «условие слабого раздражения» означает условие, в случае которого раздражение, причиняемое коже, меньше, чем раздражение, обычно причиняемое, чтобы улучшить проницаемость кожи для антигена, находящегося в обычных вакцинах, или условие, в случае которого кожа вообще не получает раздражения. Как правило, физическую и/или химическую стимуляцию кожи осуществляют перед или одновременно с трансдермальным введением обычной вакцинной композиции так, чтобы антиген мог проникнуть через кожу. В предпочтительном аспекте настоящего изобретения примеры условия слабого раздражения включают условие слабого физического раздражения и условие слабого химического раздражения. Условие слабого физического раздражения представляет собой, например, условие, при котором трансэпидермальная потеря влаги (TEWL) (г/час•м2) у животной модели при оценке раздражения кожи составляет 50 или менее, предпочтительно 45 или менее, более предпочтительно 40 или менее, еще более предпочтительно 35 или менее, и еще более предпочтительно 30 или менее. Так как уровень TEWL в необработанной коже составляет примерно 2 (г/час•м2), то уровень TEWL перед введением композиции вакцины может составлять 2 (г/час•м2) или более. Условием слабого химического раздражения является, например, условие, при котором уровень тимусного стромального лимфопоэтина (TSLP) (пг/мл белка) в коже животной модели при оценке раздражения кожи составляет 10000 или менее, предпочтительно 9000 или менее, более предпочтительно 8000 или менее, еще более предпочтительно 7000 или менее. Так как уровень TSLP составляет примерно 1 (пг/мг белка) в необработанной коже, то уровень TSLP при осуществлении введения вакцинной композиции превышает 1 (пг/мг белка), предпочтительно превышает 2 (пг/мг белка), более предпочтительно превышает 3 (пг/мг белка). «Тимусный стромальный лимфопоэтин (TSLP)» является цитокином, который принимает участие в дифференцировке и рекрутинге T-клеток, и который может быть использован в качестве показателя степени раздражения кожи в настоящем изобретении. Более высокое значение TSLP означает более сильное раздражение кожи. Примеры средств достижения условия слабого физического раздражения включают исключение проведения обычной предварительной обработки кожи перед введением, например, исключение соскоба лентой, пункции микроиглой или подобного перед введением. Примеры средств достижения условия слабого химического раздражения включают избегание введения раздражающего химического ингредиента, такого как этанол, поверхностно-активное вещество или тому подобное в определенном или большем количестве. Способ достижения условия слабого раздражения можно определить, используя животную модель для оценки раздражения кожи, и определяемый при этом способ можно применять на субъекте, которому необходимо лечение вакцинной композицией, например, человеке.
Как использовано в настоящем описании, термин «раковая опухоль» означает раковую опухоль, связанную с аномальной экспрессией, например, сверхэкспрессией гена WT1. Примеры раковой опухоли могут включать гематопоэтические опухоли или солидные раковые опухоли. Примеры гематопоэтических опухолей, связанных с аномальной экспрессией гена WT1, включают, но без ограничения, лейкоз, такой как острый миелоцитарный лейкоз, острый лимфоцитарный лейкоз и хронический миелоцитарный лейкоз, миелодиспластический синдром, множественную миелому, а также злокачественную лимфому, такую как неходжкинская лимфома. Примеры солидных раковых опухолей, связанных с аномальной экспрессией гена WT1, включают, но без ограничения, рак легкого, рак молочной железы, рак желудка, рак толстой/прямой кишки, рак половых клеток, рак печения, рак кожи, рак поджелудочной железы, рак желчных протоков, плоскоклеточный рак головы и шеи, рак щитовидной железы, рак почек, рак мочевого пузыря, рак простаты, рак яичника, рак матки, рак шейки матки, саркому мягких тканей и костей, злокачественную меланому, злокачественную мезотелиому, опухоль половых клеток яичка и злокачественную глиому.
Как использовано в настоящем описании, термин «аномальная экспрессия гена» означает, что уровень экспрессии гена в клетке заметно повышен или понижен, например, в 2 раза или более, например в 4 раза или более, по сравнению с другими клетками в той же ткани. Термин «сверхэкспрессия» означает, что аномальная экспрессия представляет собой повышение уровня экспрессия. Уровень экспрессии гена можно легко измерить, используя любой хорошо известный в данной области способ.
Как использовано в настоящем описании, термин «субъект» означает любое животное, имеющее ген WT1, иммунный ответ которого может быть индуцирован посредством трансдермального введения композиции противораковой вакцины для трансдермального введения на практической стадии. Обычно субъектом может быть млекопитающее, такое как человек, мышь, крыса, собака, кошка, кролик, лошадь, корова, овца, свинья, коза, мартышка и шимпанзе. Особенно предпочтительным субъектом является человек.
Как использовано в настоящем описании, термин «животная модель для иммунологической оценки» означает животную модель для оценки свойства композиции противораковой вакцины для трансдермального введения индуцировать иммунитет. В частности, термин означает животную модель для оценки свойства индуцировать клеточный иммунитет. Животную модель для иммунологической оценки следует выбирать с точки зрения совместимости между антигеном в композиции вакцины, которую необходимо оценить, и молекулой MHC класса 1 животного. Следует использовать животную модель, подходящую для оценки свойства композиции вакцины индуцировать клеточный иммунитет. Например, в случае композиции вакцины, содержащей пептид класса 1, ограниченный по MHC типа HLA-A*24, свойство можно оценивать на мыши BALB/c. В случае композиции вакцины, содержащей пептид, ограниченный по MHC типа HLA-A*02, свойство можно оценивать на генетически модифицированной мыши, на которой можно оценить индукцию иммунитета пептидом, ограниченным по MHC типа HLA-A*02. В случае композиции вакцины, содержащей пептид, ограниченный по MHC другого HLA-типа, свойство оценивают на животном, на котором можно оценить индукцию иммунитета пептидом, ограниченным по MHC данного HLA-типа. В случае композиции вакцины, содержащей белковый антиген, свойство оценивают на животном, имеющем MHC, совместимый с эпитопом класса 1, используемым для индукции иммунитета, из числа различных эпитопов класса 1, включенных в состав аминокислотной последовательности белкового антигена. Кроме того, в случае композиции противораковой вакцины для трансдермального введения, в которой использован пептид Db126, который совместим не только с типом HLA-A*02, но также с типом MHC-H-2Db, в качестве животной модели для иммунологической оценки можно использовать не только генетически модифицированную мышь, у которой можно оценить индукцию иммунитета пептидом, ограниченным MHC типа HLA-A*0201, но также и мышь C57BL/6, которая является животным, имеющим тип MHC-H-2Db. В случае срезания волос животного при подготовке места для трансдермального введения животное следует использовать после заживления у него повреждения кожи, вызванного срезанием волос.
Как использовано в настоящем описании, термин «животная модель для оценки раздражения кожи» означает животную модель для оценки трансэпидермальной потери влаги (TEWL) в качестве показателя физического раздражения кожи или животную модель для оценки TSLP в качестве показателя свойства раздражения кожи композицией противораковой вакцины для трансдермального введения. Независимо от вида антигена, входящего в состав композиции противораковой вакцины для трансдермального введения, мышь C57BL/6 можно использовать в качестве животной модели для оценки раздражения кожи. В случае срезания волос животного при подготовке места для трансдермального введения, животное следует использовать после заживления у него повреждения кожи, вызванного срезанием волос.
II. Композиция противораковой вакцины для трансдермального введения
Ранее уже было показано, что пептиды WT1 и/или модифицированные пептиды WT1 применимы в качестве противораковой вакцины (например, патентный документ 1).
Как использовано в настоящем описании, композиция «для трансдермального введения» может быть представлена в виде любого препарата или препаративной формы, которую обычно используют для трансдермального введения, например, в виде жидкого препарата для наружного применения, такого как препарат в виде линимента или препарат для примочки, препарата в виде спрея для наружного применения, такого как аэрозольный препарат, препарата в виде мази, препарата в виде наклейки, препарата в форме крема, гелевого препарата или препарата в виде пластыря, такого как препарат в форме ленты, или препарата для горячего компресса. Группы, определения, природа, способ получения и тому подобное в отношении таких препаратов или препаративных форм хорошо известны в данной области. Например, смотри Фармакопею Японии, 16-е издание.
Примеры основы для препарата линимента включают воду, этанол, жирные масла, такие как твердый парафин, мягкий парафин, жидкий парафин, глицерин, парафиновое масло и пчелиный воск, металлическое мыло; клейкие вещества; природные масла (например, миндальное масло, кукурузное масло, арахисовое масло, касторовое масло, оливковое масло или их производное (такое как полиоксилированное касторовое масло)); бараний жир или его производное, жирные кислоты и/или сложные эфиры (например, стеариновую кислоту, олеиновую кислоту, изопропилмиристат).
Композиция в форме примочки представляет собой препарат, в котором активный ингредиент тонко и гомогенно диспергирован в водной жидкости, и существуют суспензионный препарат для примочки и эмульгированный препарат для примочки. Примеры суспендирующего средства включают аравийскую камедь, альгинат натрия, натрийкарбоксиметилцеллюлозу, метилцеллюлозу, бентонит и тому подобное. Примеры эмульгирующего средства включают лаурилсульфат натрия, сложный эфир сорбитана и жирной кислоты и тому подобное.
Например, в качестве основы для мази обычно можно использовать гидрофобную основу, такую как жиры или масла, воски и углеводородные соединения. В частности, примеры основы для мазей включают минеральные основы, такие как желтый вазелин, белый вазелин, парафин, жидкий парафин, пластибейз, силикон и тому подобное, и животные или растительные основы, такие как пчелиный воск, животный жир или растительное масло и тому подобное.
Примеры основы для препарата в форме крема включают основы типа вода/масло типа, такие как гидрофильная мазь, быстро впитывающийся крем и тому подобное; и основы типа масло/вода, такие как гидрофильный вазелин, очищенный ланолин, аквахол, эуцерин, неоцерин, водный ланолин, кольдкрем, гидрофильная основа пластибейз и тому подобное.
В качестве основы геля можно использовать, например, карбоксивиниловый полимер, гелевую основу, не содержащую жира мазь, поливинилпирролидон, поливиниловый спирт, полиакрилат натрия, карбоксиметилцеллюлозу, крахмал, ксантановую камедь, камедь карайи, альгинат натрия, метилцеллюлозу, гидроксипропилцеллюлозу, фталат гидроксипропилметилцеллюлозы (HPMCP), ацетет-фталат целлюлозы (CAP), карбоксиметилэтилцеллюлозу (CMEC), этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксивиниловый полимер, трагакантовую камедь, аравийскую камедь, камедь тары, камедь семян тамаринда, камедь семян подорожника, агар, геллановую камедь, глюкоманнан, камедь бобов рожкового дерева, гуаровую камедь, каррагинан, декстрин, декстран, амилозу, калийкарбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, пуллулан, хитозан, натрийкарбоксиметилкрахмал, оболочку семян подорожника, галактоманнан, сополимер аминоалкилметакрилата E, сополимер аминоалкилметакрилата RS, сополимер метакриловой кислоты L, сополимер метакриловой кислоты LD, сополимер метакриловой кислоты S, сополимер метилакрилат/метакриловая кислота/метилметакрилат, сополимер этилакрилат/метилметакрилат, диэтиламиноацетат поливинилацеталя, казеин, сложный алкиловый эфир альгиновой кислоты, желатин, полиэтиленгликоль и тому подобное в виде основы гидрогеля.
Примеры основы препарата для горячего компресса включают желатин, натрийкарбоксиметилцеллюлозу, метилцеллюлозу, полиакрилат натрия, каолин, поливиниловый спирт, поливинилпирролидон, глицерин, пропиленгликоль, воду и тому подобное.
Например, препарат в форме ленты имеет липкий слой, содержащий акриловый адгезив, природный каучуковый адгезив, синтетический каучуковый адгезив (включая каучуковый эластомер, такой как синтетический изопреновый каучук, полиизобутилен (PIB), стирол-бутадиеновый каучук, стирол-изопрен-стирольный (SIS) каучук и т.д.), силиконовый адгезив, адгезив на основе сложного винилового эфира, адгезив на основе простого винилового эфира или тому подобное, и подложку, которая поддерживает адгезивный слой. Необязательно препарат может дополнительно содержать защитную удаляемую пленку, которая покрывает адгезивный слой, чтобы избежать его обнажения до применения, и которую можно легко снять с адгезивного слоя при использовании.
Количество пептида WT1 и/или модифицированного пептида WT1 и стимулятора индукции клеточного иммунитета в композиции противораковой вакцины согласно настоящему изобретению особым образом не ограничено. В одном аспекте композиция противораковой вакцины согласно настоящему изобретению содержит пептид WT1 и/или модифицированный пептид WT1 предпочтительно в количестве от 0,01 до 40% масс., более предпочтительно от 0,1 до 30% масс., в расчете на общую массу композиции. В одном аспекте композиция противораковой вакцины согласно настоящему изобретению содержит стимулятор индукции клеточного иммунитета, стимулятор индукции клеточного иммунитета предпочтительно содержится в количестве от 0,001 до 30% масс., более предпочтительно от 0,01 до 20% масс., в расчете на общую массу композиции.
Когда композиция согласно настоящему изобретению представлена препаратом в форме ленты, такой препарат в форме ленты содержит адгезивный слой, содержащий активный ингредиент, который представляет собой пептид WT1 и/или модифицированный пептид WT1, и подложку, которая поддерживает адгезивный слой, в случае препарата в форме ленты матричного типа. В случае препарата в форме ленты резервуарного типа, препарат в форме ленты содержит резервуар, содержащий активный ингредиент, и адгезивный слой, и подложку, которая поддерживает резервуар и адгезивный слой. Препарат в форме ленты, который описан ниже, необязательно, может дополнительно содержать защитную удаляемую пленку, которая закрывает адгезивный слой перед применением, и которую можно легко снять с адгезивного слоя при применении. Ниже соответствующим образом будет приведено подробное объяснение препарата в форме ленты. Адгезивный слой препарата в форме ленты (далее также называемого «препаратом в форме ленты согласно настоящему изобретению») содержит пептид WT1 и/или модифицированный пептид WT1 и стимулятор индукции клеточного иммунитета. В одном аспекте адгезивный слой препарата в форме ленты согласно настоящему изобретению содержит пептид WT1 и/или модифицированный пептид WT1 предпочтительно в количестве от 0,01 до 40% масс., более предпочтительно от 0,1 до 30% масс., в расчете на общую массу адгезивного слоя. В одном аспекте адгезивный слой препарата в форме ленты согласно настоящему изобретению содержит стимулятор индукции клеточного иммунитета предпочтительно в количестве от 0,001 до 30% масс., более предпочтительно от 0,01 до 20% масс., в расчете на общую массу адгезивного слоя.
Адгезив, который должен образовывать адгезивный слой препарата в форме ленты согласно настоящему изобретению, особым образом не ограничен, и его примеры включают акриловые адгезивы, состоящие из акрилового полимера; каучуковые адгезивы, содержащие каучуковый эластомер, такой как стирол-диен-стироловый блок-сополимер (например, стирол-изопрен-стироловый блок-сополимер, стирол-бутадиен-стироловый блок-сополимер и т.д.), полиизопрен, полиизобутилен, бутилкаучук, полибутадиен и тому подобное; силиконовые адгезивы, такие как силиконовый каучук, диметилсилоксановая основа, дифенилсилоксановая основа и тому подобное; адгезивы на основе простого винилового эфира, такие как простой поливинилметиловый эфир, простой поливинилэтиловый эфир, простой поливинилизобутиловый эфир и тому подобное; адгезивы на основе сложного винилового эфира, такие как сополимер винилацетат-этилен и тому подобное; и сложные полиэфирные адгезивы, состоящие из компонента карбоновой кислоты, такого как диметилтерефталат, диметилизофталат, диметилфталат, и компонента многоатомного спирта, такого как этиленгликоль. Особенно предпочтительным адгезивом является акриловый адгезив, каучуковый адгезив и силиконовый адгезив. Такие адгезивы находятся в адгезивном слое предпочтительно в количестве от 10 до 90% масс., более предпочтительно от 20 до 80% масс., в виде твердого вещества в расчете на общую массу адгезивного слоя.
Примеры акрилового адгезива включают адгезив на основе сложного эфира акриловой кислоты, содержащий в качестве основного компонента полимер, содержащий C2-C18-алкиловый эфир (мет)акриловой кислоты в качестве первого мономера. Примеры алкилового эфира (мет)акриловой кислоты (первого мономера) включают алкиловые эфиры (мет)акриловой кислоты, в которых алкильной группой является алкильная группа с прямой цепью, разветвленной цепью или циклическая алкильная группа, имеющая 1-18 атомов углерода (например, метил, этил, пропил, бутил, пентил, гексил, циклогексил, гептил, октил, 2-этилгексил, нонил, децил, ундецил, додецил, тридецил и т.д.). Предпочтительными являются алкиловые эфиры (мет)акриловой кислоты, в которых алкильной группой является алкильная группа с прямой цепью, разветвленной цепью или циклическая алкильная группа, имеющая 4-18 атомов углерода (например, бутил, пентил, гексил, циклогексил, гептил, октил, 2-этилгексил, нонил, децил, ундецил, додецил, тридецил и т.д.). Кроме того, так как применение мономерного компонента, который снижает температуру стеклования полимера, является подходящим для придания адгезивности при комнатной температуре, более предпочтительными являются алкиловые эфиры (мет)акриловой кислоты, в которых алкильной группой является алкильная группа с прямой цепью, разветвленной цепью или циклическая алкильная группы, имеющая 4-8 атомов углерода (например, бутил, пентил, гексил, циклогексил, гептил, октил, 2-этилгексил и т.д., предпочтительно бутил, 2-этилгексил и циклогексил, особенно предпочтительно 2-этилгексил). В частности, более предпочтительными являются бутилакрилат, 2-этилгексилакрилат, 2-этилгексилметакрилат, циклогексилакрилат, циклогексилметакрилат и тому подобное, и среди них наиболее предпочтительным является 2-этилгексилакрилат. Такие алкиловые эфиры (мет)акриловой кислоты (первый мономерный компонент) можно использовать отдельно или их можно использовать, комбинируя по два или более.
Кроме того, акриловый адгезив может содержать второй мономер сополимеризуемый с алкиловым эфиром (мет)акриловой кислоты, и примеры второго мономера включают мономеры, имеющие функциональную группу, которая может стать точкой поперечного сшивания при использовании поперечно сшивающего агента. Примеры функциональной группы, которая может принимать участие в реакции образования поперечной сшивки, включают гидроксигруппу, карбоксильную группу, группу винила и тому подобное, и предпочтительными являются гидроксигруппа и карбоксильная группа. Конкретные примеры мономера (второго мономерного компонента) включают гидроксиэтиловый эфир (мет)акриловый кислоты, гидроксипропиловый эфир (мет)акриловый кислоты, N-гидроксиалкил(мет)акриламид, (мет)акриловую кислоту, итаконовую кислоту, малеиновую кислоту, малеиновый ангидрид, мезаконовую кислоту, цитраконовую кислоту, глютаконовую кислоту и тому подобное. Среди них наиболее предпочтительными с точки зрения легкой доступности являются акриловая кислота, метакриловая кислота и гидроксиэтиловый эфир акриловой кислоты (в частности, 2-гидроксиэтилакрилат), и наиболее предпочтительной является акриловая кислота. Такие мономеры (второй мономерный компонент) можно использовать отдельно или их можно использовать, комбинируя по два или более.
Кроме того, акриловый адгезив необязательно может содержать третий мономер дополнительно ко второму мономеру. Примеры третьего мономера (третьего мономерного компонента) включают сложные виниловые эфиры, такие как винилацетат, винилпропионат и тому подобное; простые виниловые эфиры, такие как метилвиниловый эфир, этилвиниловый эфир и тому подобное; виниламиды, такие как N-винил-2-пирролидон, N-винилкапролактам и тому подобное; алкоксиэфиры (мет)акриловой кислоты, такие как метоксиэтиловый эфир (мет)акриловой кислоты, этоксиэтиловый эфир (мет)акриловой кислоты, тетрагидрофурфуриловый эфир (мет)акриловой кислоты и тому подобное; содержащие гидроксигруппу мономеры (при использовании в качестве третьего мономерного компонента не является точкой образования поперечной сшивки), такие как гидроксипропил(мет)акрилат, α-гидроксиметилакрилат и тому подобное; производные (мет)акриловой кислоты, имеющие амидную группу, такие как (мет)акриламид, диметил(мет)акриламид, N-бутил(мет)акриламид, N-метилол(мет)акриламид и тому подобное; сложные аминоалкиловые эфиры (мет)акриловой кислоты, такие как аминоэтиловый эфир (мет)акриловой кислоты, диметиламиноэтиловый эфир (мет)акриловой кислоты, трет-бутиламиноэтиловый эфир (мет)акриловой кислоты и тому подобное; алкоксиалкиленгликолевые эфиры (мет)акриловой кислоты, такие как метоксиэтиленгликолевый эфир (мет)акриловой кислоты, метоксидиэтиленгликолевый эфир (мет)акриловой кислоты, метоксиполиэтиленгликолевый эфир (мет)акриловой кислоты, метоксиполипропиленгликолевый эфир (мет)акриловой кислоты и тому подобное; (мет)акрилонитрилы; мономеры, имеющие сульфоновую кислоту, такие как стиролсульфоновая кислота, аллилсульфоновая кислота, сульфопропил(мет)акрилат, (мет)акрилоилоксинафталинсульфоновая кислота, акриламидметилсульфоновая кислота и тому подобное; и мономеры, содержащие группу винила, такие как винилпиперидон, винилпиримидин, винилпиперазин, винилпиррол, винилимидазол, винилоксазол, винилморфолин и тому подобное. Среди них предпочтительными являются сложные виниловые эфиры и виниламиды, при этом винилацетат является предпочтительным среди сложных виниловых эфиров, и N-винил-2-пирролидон является предпочтительным среди виниламидов. Такие мономеры (третий мономерный компонент) можно использовать отдельно или их можно использовать, комбинируя по два или более.
Когда акриловым адгезивом является сополимер сложного алкилового эфира (мет)акриловой кислоты (первого мономерного компонента) и винилового мономера, имеющего функциональную группу, которая может принимать участие в реакции образования поперечной сшивки (второго мономерного компонента), алкиловый эфир (мет)акриловой кислоты и виниловый мономер, имеющий функциональную группу, которая может принимать участие в реакции образования поперечной сшивки, подвергают сополимеризации смешиванием компонентов в массовом соотношении алкиловый эфир (мет)акриловой кислоты:виниловый мономер, имеющий функциональную группу, которая может принимать участие в реакции образования поперечной сшивки, предпочтительно 99-85:1-15, более предпочтительно 99-90:1-10.
Кроме того, когда акриловым адгезивом является сополимер алкилового эфира (мет)акриловой кислоты (первого мономерного компонента), винилового мономера, имеющего функциональную группу, которая принимает участие в реакции образования поперечной сшивки (второго мономерного компонента) и другого мономера, отличного от первых двух (третьего мономерного компонента), алкиловый эфир (мет)акриловой кислоты, виниловый мономер, имеющий функциональную группу, которая принимает участие в реакции образования поперечной сшивки, и другой мономер, отличный от первых двух, подвергают сополимеризации, смешивая компоненты в массовом соотношении алкиловый эфир (мет)акриловой кислоты:виниловый мономер, имеющий функциональную группу, которая принимает участие в реакции образования поперечной сшивки:другой мономер, отличный от первых двух, предпочтительно 40-94:1-15:5-50, более предпочтительно 50-89:1-10:10-40.
Компоненты можно полимеризовать известным способом. Например, мономеры в растворителе, таком как этилацетат, можно подвергать взаимодействию в присутствии инициатора полимеризации (например, бензоилпероксида, азобисизобутиронитрила и т.д.) при 50-70°C в течение 5-48 часов.
Особенно предпочтительными акриловыми адгезивами в настоящем изобретении являются, например, сополимер 2-этилгексиловый эфир акриловой кислоты/акриловая кислота/N-винил-2-пирролидон, сополимер 2-этилгексиловый эфир акриловой кислоты/N-(2-гидроксиэтил)акриламид/N-винил-2-пирролидон, сополимер 2-этилгексиловый эфир акриловой кислоты/2-гидроксиэтиловый эфир акриловой кислоты/винилацетат и сополимер 2-этилгексиловый эфир акриловой кислоты/акриловая кислота и более предпочтителен сополимер 2-этилгексиловый эфир акриловой кислоты/акриловая кислоты/N-винил-2-пирролидон.
Необязательно такие акриловые адгезивы могут быть подвергнуты физической обработке для образования поперечных сшивок с использованием ультрафиолетового облучения или радиационного облучения, такого как облучение электронным пучком, или химической обработке для образования поперечных сшивок с использованием различных поперечно сшивающих агентов, таких как соединение изоцианата, такое как трехфункциональный изоцианат, органический пероксид, металлоорганическая соль, алкоголят металла, хелатирующее металлы соединение, полифункциональное соединение (полифункциональный агент, образующий внешние поперечные сшивки, мономер для полифункционального внутреннего поперечного сшивания, такой как диакрилат и диметакрилат).
Примеры каучукового адгезива включают каучуковые адгезивы, в которых смешивают каучуковый эластомер, такой как полиизобутилен/полибутеновый эластомер, стирол/диен/стироловый блок-сополимер, стирол/бутадиеновый эластомер, нитриловый эластомер, хлоропреновый эластомер, винилпиридиновый эластомер, полиизобутиленовый эластомер, бутиловый эластомер или изопрен/изобутиленовый эластомер. Из них, с точки зрения растворимости пептида и стимулятора индукции клеточного иммунитета в адгезиве и адгезивности кожи, предпочтительно используют полиизобутилен (PIB), стирол/диен/стироловый блок-сополимер (например, стирол/бутадиен/стироловый блок-сополимер (SBS), стирол/изопрен/стироловый блок-сополимер (SIS) и т.д.) и тому подобное. Также можно использовать смесь из двух или более таких адгезивов.
Кроме того, чтобы достичь подходящей силы адгезии и растворимости лекарственного средства в случае каучукового адгезива, каучуковый адгезив может представлять собой смесь двух или более каучуковых эластомеров из одинаковых или разных мономерных компонентов, которые имеют разные средние молекулярные массы. Например, что касается полиизобутилена, то предпочтительной является смесь полиизобутилена с высокой молекулярной массой, имеющего среднюю молекулярную массу от 150000 до 5500000, полиизобутилена со средней молекулярной массой, имеющего среднюю молекулярную массу от 10000 до 150000, и/или полиизобутилена с низкой молекулярной массой, имеющего среднюю молекулярную массу от 500 до 4000. В данном случае, предпочтительно смешивание полиизобутиленов с высокой молекулярной массой, средней молекулярной массой и низкой молекулярной массой в массовом соотношении высокая молекулярная масса:средняя молекулярная масса:низкая молекулярная масса=10-80, предпочтительно 20-70:0-90, предпочтительно 10-80:0-80, предпочтительно 10-60.
Как использовано в настоящем описании, средняя молекулярная масса означает средневязкостную молекулярную массу, вычисленную из выражения вязкости по Флори, и ее получают, вычисляя индекс Штаудингера (J0), исходя из времени истечения через капилляр 1 вискозиметра Уббелоде при 20°C, используя выражение Шульца-Блашке и используя такое значение J0 в следующем выражении.
(Формула)
J0=ηsp/c(1+0,31ηsp) (уравнение Шульца-Блашке)
ηsp=t/t0-1
t: время истечения раствора (согласно формуле поправки Хагенбаха-Куэтта)
t0: Время истечения раствора (согласно формуле поправки Хагенбаха-Куэтта)
c: Концентрация раствора (г/см3)
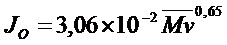
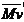 : средневязкостная молекулярная масса.
: средневязкостная молекулярная масса.
Чтобы придать подходящую адгезивность, в каучуковый адгезив может быть примешан, например, агент, придающий клейкость, такой как канифольная смола, политерпеновая смола, кумарон-инденовая смола, нефтяная смола, терпен-фенольная смола, ксиленовая смола, алициклическая насыщенная углеводородная смола или тому подобное. В смесь могут быть введены один, два или более видов агентов, придающих клейкость, в количестве 50% масс. или менее, предпочтительно от 5 до 40% масс., в расчете на общую массу каучукового адгезива.
Примеры силиконового адгезива включают силиконовые адгезивы, состоящие из полиорганосилоксанового адгезива, полидиметилсилоксанового адгезива, полидиметилдифенилсилоксанового адгезива. Наряду с прочими, предпочтительно используют коммерчески доступный силиконовый адгезив, такой как BIO PSA из Dow Corning Corporation.
Подложка, которая поддерживает адгезивный слой, особым образом не ограничена, и используют подложку, которая по существу непроницаема для пептида и стимулятора индукции клеточного иммунитета, так что пептид, стимулятор индукции клеточного иммунитета, добавки или тому подобное, которые находятся в адгезивном слое, не будут проходить через подложку и просачиваться на задней поверхности.
В качестве подложки можно использовать, например, одну пленку из полиэфира, полиамида, поли(винилиденхлорида), полиэтилена, полипропилена, поли(винилхлорида), сополимера этилена-этилакрилата, политетрафторэтилена, иономерной смолы, металлической фольги или подобного, или многослойную пленку из указанных пленок. Кроме того, чтобы получить хорошую адгезивность (способность к заякориванию) между подложкой и адгезивным слоем, предпочтительно, чтобы подложка представляла собой многослойную пленку из непористой полимерной пленки и пористой пленкой, изготовленной из указанного выше материала. В данном случае желательно, чтобы адгезивный слой был образован со стороны пористой пленки. В качестве такой пористой пленки выбрана пористая пленка, которая улучшает заякоривание на адгезивном слое, и конкретные примеры такой пленки включают лист бумаги, тканое полотно, нетканое полотно, трикотажное полотно, лист, который был механически обработан с целью перфорирования, и тому подобное. С точки зрения осуществления технологической обработки и подобного из них особенно предпочтительными являются бумажный лист, тканое полотно и нетканое полотно. В качестве пористой пленки, с точки зрения улучшения заякоривания, мягкости и простоты приклеивания препарата в форме ленты и подобного, выбрана пористая пленка, имеющая толщину в диапазоне от 1 до 200 мкм. Кроме того, в случае использования в качестве пористой пленки тканого полотна или нетканого полотна, масса на единицу площади предпочтительно составляет от 5 до 30 г/м2, более предпочтительно от 6 до 15 г/м2.
Примеры наиболее подходящих подложек включают многослойную пленку из полиэфирной пленки (предпочтительно, полиэтилентерефталатной пленки), имеющей толщину от 1,5 до 6 мкм, и нетканого полотна из полиэфира (предпочтительно, полиэтилентерефталата), имеющего массу на единицу площади от 6 до 15 г/м2.
В препарате в форме ленты согласно настоящему изобретению для того, чтобы защитить поверхность адгезивного слоя до использования, желательно, чтобы на адгезивную поверхность была нанесена защитная удаляемая пленка. Защитная удаляемая пленка особым образом не ограничена, так как ее обрабатывают так, чтобы она обладала свойством, позволяющим ее снимать, и ее можно было снимать с приложением достаточно небольшой силы для отделения. Например, пленка из полиэфира, поли(винилхлорида), поли(винилиденхлорида), полиэтилентерефталата или подобного, бумаги, такой как очищенная бумага, пергамин и тому подобное, или многослойная пленка из очищенной бумаги или пергамина и полиолефина может быть обработана с образованием покрытия силиконовой смолой, фторсодержащей смолой и подобным на поверхности, которая должна контактировать с адгезивным слоем, и использована в качестве защитной удаляемой пленки. Толщина защитной удаляемой пленки предпочтительно составляет от 10 до 200 мкм, более предпочтительно от 25 до 100 мкм. В качестве защитной удаляемой пленки с точки зрения изоляционного свойства и стоимости предпочтительным является полиэфирный слой, в частности, слой полиэтилентерефталата. Кроме того, с точки зрения свойств, способствующих облечению обработки, в данном случае предпочтительной является защитная удаляемая пленка, имеющая толщину примерно от 25 до 100 мкм.
Кроме того, композиция согласно настоящему изобретению при необходимости может содержать добавку. Добавка выбрана, например, из средств для обеспечения изотоничности, антисептиков/бактерицидных средств, антиоксидантов, противовоспалительных средств, солюбилизаторов, суспендирующих средств, наполнителей, средств для корректировки pH, стабилизаторов, стимуляторов всасывания, средств, контролирующих скорость высвобождения, красителей, пластификаторов, поперечно сшивающих агентов, адгезивов и подобного или комбинации двух или более видов указанных средств, в зависимости от совместимости с основным ингредиентом основы, пептидом WT1 и/или модифицированным пептидом WT1 и стимулятором индукции клеточного иммунитета, планируемой схемы введения и подобного. Кроме того, в том случае, когда композиция согласно настоящему изобретению представляет собой препарат в форме ленты, препарат в форме ленты может содержать в качестве добавки усилитель проницаемости кожи.
Как использовано в настоящем описании, термин «усилитель проницаемости кожи» означает любое вещество, которое может повысить эффективность проникновения трансдермально вводимого антигена через кожу, по сравнению с эффективностью, получаемой без такого вещества. Усилитель проницаемости кожи особым образом не ограничен, при условии, что он представляет собой жидкость при комнатной температуре (25°C), то есть, обладает текучестью при такой температуре и оказывает действие, усиливающее всасывание. Когда усилитель проницаемости кожи представляет собой смесь двух или более веществ, смесь представляет собой жидкость при комнатной температуре (25°C) и оказывает действие, усиливающее всасывание. Усилитель проницаемости кожи может представлять собой органическую жидкость и предпочтительно гидрофобную жидкость с точки зрения ее совместимости с адгезивным слоем.
Примеры усилителей проницаемости кожи включают высшие спирты, такие как олеиловый спирт, октилдодеканол и тому подобное; многоатомные спирты, такие как глицерин, этиленгликоль, полипропиленгликоль и тому подобное; высшие жирные кислоты, такие как олеиновая кислота, каприловая кислота и тому подобное; сложные эфиры жирных кислот, такие как изопропилмиристат, изопропилпальмитат, этилолеат и тому подобное; сложные эфиры многоосновных кислот, такие как диэтилсебацат, диизопропиладипат и тому подобное; сложные эфиры многоатомных спиртов и жирных кислот, такие как диглицерилтриизостеарат, эфир моноолеиновой кислоты и сорбитана, эфир дикаприловой кислоты и пропиленгликоля, эфир монолауриновой кислоты и полиэтиленгликоля, эфир тетраолеиновой кислоты и полиоксиэтиленсорбита и тому подобное; простые алкиловые эфиры полиоксиэтилена, такие как лауриловый эфир полиоксиэтилена и тому подобное; углеводороды, такие как сквалан, жидкий парафин и тому подобное; растительные масла, такие как оливковое масло, касторовое масло и тому подобное; силиконовые масла; пирролидоны, такие как N-метилпирролидон, N-додецилпирролидон и тому подобное; сульфоксиды, такие как децилметилсульфоксид и тому подобное, и такие усилители можно использовать отдельно или их можно использовать в виде смесей двух или более видов усилителей.
Предпочтительно введение субъекту композиции согласно настоящему изобретению в условиях слабого раздражения. Введение в условиях слабого раздражения может быть достигнуто, например, (i) введением субъекту композиции согласно настоящему изобретению в таких условиях введения, когда трансэпидермальная потеря влаги (TEWL) (г/час•м2), оцениваемая на животной модели при оценке раздражения кожи, составляет 50 или менее, (ii) введением субъекту композиции, обеспечивающей уровень TSLP в коже (пг/мг белка) 10000 или менее, оцениваемый на животной модели при оценке раздражения кожи.
Кроме того, эффект стимуляции индукции клеточного иммунитета композицией согласно настоящему изобретению можно улучшить добавлением дополнительного стимулятора индукции клеточного иммунитета, который может представлять собой фармакологически приемлемую кислоты или ее фармакологически приемлемую соль.
Как использовано в настоящем описании, термин «фармакологически приемлемая кислота», которая может входить в состав композиции согласно настоящему изобретению, означает кислоту, которая не оказывает вредного влияния на субъекта, которому вводят композицию, и не приводит к потере фармакологической активности ингредиентов в композиции. В предпочтительном аспекте настоящего изобретения фармакологически приемлемой кислотой является органическая кислота, более предпочтительно органическое соединение, содержащее карбоксильную группу, или органическое соединение, содержащее сульфогруппу, более предпочтительно насыщенная или ненасыщенная жирная кислота с прямой или разветвленной цепью, в которой часть, представленная насыщенной прямой цепью, имеет 8-20 атомов углерода, молочная кислота, яблочная кислота, салициловая кислота, малеиновая кислота, лимонная кислота, или органическое соединение, содержащее сульфогруппу, более предпочтительно насыщенная или ненасыщенная жирная кислота с прямой или разветвленной цепью, в которой часть, представленная насыщенной прямой цепью, имеет 8-16 атомов углерода, молочная кислота, яблочная кислота, салициловая кислота, малеиновая кислота, лимонная кислота, или органическое соединение, содержащее сульфогруппу, более предпочтительно жирная кислота, выбранная из группы, состоящей из декановой кислоты, лауриновой кислоты, миристиновой кислоты, изостеариновой кислоты и олеиновой кислоты, или молочной кислоты, салициловой кислоты, лимонной кислоты или метансульфоновой кислоты.
Как использовано в настоящем описании, «фармакологически приемлемая соль», которая может входить в состав композиции согласно настоящему изобретению, означает соль, которая не оказывает вредного влияния на субъекта, которому вводят композицию, и не приводит к утрате фармакологической активности ингредиентов в композиции. Примеры фармакологически приемлемых солей включает соли неорганических кислот (например, соль хлористоводородной кислоты и соль фосфорной кислоты), соли органических кислот (например, соль уксусной кислоты, соль фталевой кислоты и соль ТФУ), соли металлов (соли щелочных металлов (например, соль натрия и соль калия), соли щелочноземельных металлов (например, соль кальция и соль магния), соль алюминия и т.д.)), соли аминов (соль триэтиламина, соль бензиламина, соль диэтаноламина, соль трет-бутиламина, соль дициклогексиламина, соль аргинина, соль диметиламмония, соль аммония и т.д.), но не ограничивается указанными солями.
Терапевтически эффективное количество пептида WT1 и/или модифицированного пептида WT1 может широко варьировать, в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, а также других известных факторов. Как правило, удовлетворительный результат может быть получен в случае суточной дозы примерно от 0,1 мкг до 1 г/кг массы тела. Стимулятор индукции клеточного иммунитета вводят одновременно с пептидом WT1 и/или модифицированным пептидом WT1 или последовательно, и предпочтительно его вводят одновременно с пептидом. Эффективное количество стимулятора индукции клеточного иммунитета может широко варьировать, в зависимости от вида используемого стимулятора индукции клеточного иммунитета, присутствия или отсутствия другого стимулятора индукции клеточного иммунитета и подобного, и удовлетворительный результат получают в случае суточной дозы примерно от 0,01 мкг до 1 г/кг массы тела. Суточную дозу можно вводить в виде однократной дозы или несколькими разделенными дозами несколько раз, например два раза или более, например, два, три, четыре или пять раз. Композицию можно применять непрерывно в течение периода времени от 1 минуты до 7 дней на одно введение. Интервал введения соответственно выбран из интервалов от ежедневного введения до введения раз в год (например, ежедневно, раз в 2 дня, раз в 3 дня, раз в неделю, раз в 2 недели, раз в месяц, раз в 3 месяца, раз в 6 месяцев, раз в год) и более длительных интервалов, в зависимости состояния пациента, тяжести раковой опухоли, в зависимости от того, с какой целью осуществляют введение: терапевтической или профилактической, или тому подобное. Обычно, в целях лечения пациента, действительно имеющего тяжелую форму раковой опухоли, пептид WT1 и/или модифицированный пептид WT1 вводят с более высокой частотой и в более высокой дозе, и в целях профилактики пациенту, не имеющему раковой опухоли, пептид WT1 и/или модифицированный пептид WT1 вводят с более низкой частотой и в более низкой дозе.
В настоящем изобретении физическое раздражение означает любое физическое раздражение, которое вызывает повреждение рогового слоя, включая царапину и соскобы. Например, процедура соскоба лентой, которая удаляет роговой слой, при использовании адгезивной ленты или подобного, процедура нанесения повреждения кожи при использовании режущего инструмента и процедура, в которой используют микроиглу, такая как перфорирование рогового слоя тонкой иглой, также относятся к физическому раздражению.
Трансэпидермальная потеря влаги означает количество воды (г), испаряемой с 1 м2 кератина в час. Трансэпидермальную потерю влаги можно легко измерить с помощью устройства для измерения потери влаги в течение короткого периода времени, и такое измерение широко используют в качестве показателя в случае оценки степени повреждения кожи. Также в настоящем изобретении трансэпидермальную потерю влаги используют в качестве показателя уровня физического раздражения.
TSLP (тимусный стромальный лимфопоэтин) является одним из IL-7-подобных цитокинов, которые продуцируются кератиноцитами кожи, тимусом и эпителиальными клетками слизистой оболочки, и, как известно, вовлечен в созревание дендритных клеток и дифференцировку T-клеток. В настоящем изобретении уровень TSLP может быть использован в качестве показателя уровня химического раздражения, которое представляет собой раздражение, получаемое в результате действия лекарственного средства.
Настоящее изобретение будет объяснено более подробно и конкретно ниже с использованием примеров. Настоящее изобретение не ограничено примерами.
ПРИМЕРЫ
Препарат в форме крема
Получали препарат в форме крема, содержащий ингредиенты, указанные в следующей ниже таблице 1. В частности, пептид Db126 (ограниченный по MHC HLA-A*02-типа пептид) или пептид RYF (ограниченный по MHC HLA-A*24-типа пептид), или пептид AYL (ограниченный по MHC HLA-A*24-типа пептид), стимулятор индукции клеточного иммунитета, отличный от хелперного пептида, и хелперный пептид взвешивали в количествах, точно указанных в таблице 1, затем в смесь добавляли 15 частей по массе ДМСО и добавляли основу (крем для основы) до получения в итоге 100 частей по массе, с получением препарата в форме крема. Кремовую основу с ISA, указанную в таблице 1, получали, вводя в смесь и перемешивая вещества, описанные в таблице 2.
Получали композитную подложку, в которой многослойный продукт ПЭТ-пленка/ПЭТ-нетканое полотно (площадью 0,7 см2) приклеивали к центральной части адгезивной ленты для фиксации, так чтобы сторона с ПЭТ-пленкой была обращена лицом к ленте. Препарат в форме крема (4 мг) наносили в виде покрытия на часть такой композитной подложки, состоящей из нетканого полотна, и полученный продукт использовали в тесте по иммунизации.
Тест иммунизации мышей 1 (препарат в форме крема)
Тест по иммунизации мышей осуществляли, используя препараты в форме крема и животную модель для иммунологической оценки. Оценку уровня индукции иммунитета осуществляли способом ELISPOT. В частности, на спине мыши выстригали волосы. Мышь оставляли вплоть до заживления у нее повреждения кожи вследствие срезания волос. Затем образец наносили на спину мыши на предварительно определяемый период времени и затем удаляли. Затем мышь оставляли на период времени, составляющий предварительно определяемое количество дней, и оценивали уровень антиген-специфичного клеточного иммунитета. После периода времени, составляющего предварительно определяемое количество дней, рассчитываемого от момента нанесения образца, выделяли селезенку и готовили суспензию клеток селезенки. Клетки селезенки (3 × 106 клеток/лунку) и антигенный пептид (100 мкМ) вместе со средой для культивирования помещали в лунку планшета ELISPOT, на котором были иммобилизованы антитела против IFN-γ мыши. Планшет культивировали в течение 20 часов в условиях 37°C и 5% CO2. Количество пятен, представляющих IFN-γ-продуцирующие клетки (количество пятен/3×106 клеток) оценивали способом ELISPOT. Во всех случаях 4 мг препарата в форме крема наносили один раз на 24 часа и селезенку отделяли через 6 дней после завершения нанесения.
В примере 5 делали соскоб кожи лентой (TS) десять раз, используя ленту DUNPLON (№ 375, производства NITTO DENKO CS SYSTEM CORPORATION), перед нанесением образца, и в примерах 6 и 7 кожу повреждали мирорезаком (MICRO FEATHER № 7330G, производства FEATHER) и микроиглой (длина иглы 750 мкм Micro Needle Roller System MR75, производства Ostar Beauty), соответственно, перед нанесением.
Кроме того, в некоторых группах также измеряли уровень TSLP в коже мыши после введения, трансэпидермальную потерю влаги у мыши перед введением и проницаемость кожи для антигенного пептида Db126 и имихимода.
(Способ измерения уровня TSLP)
Уровень TSLP оценивали, используя мышь C57BL/6 в качестве животной модели для оценки раздражения кожи. Образец наносили модельной мыши для оценки раздражения кожи в таких же условиях, которые использовали в тесте иммунизации мышей 1. После завершения нанесения образца кожу со спины мыши отделяли и кожу измельчали, используя гомогенизатор (Physcotron, Microtec Co., Ltd.), в растворителе для экстракции (раствор PBS, содержащий ингибитор протеаз (смесь ингибиторов протеаз для общего применения, Sigma-Aldrich) и 10 мкМ индометацина (производства Wako Pure Chemical Industries, Ltd.)). Измельченную кожу центрифугировали при 4°C и 9000 g в течение 10 минут, и извлекали супернатант. Количество TSLP в супернатанте измеряли в ELISA (набор для ELISA TSLP Quantikine на мышах, R&D Systems). Кроме того, измеряли количество общего белка в супернатанте способом BCA (набор для анализа белков Pierce BCA, Thermo Fisher Scientific K.K.), и количество TSLP делили на количество общего белка для стандартизации.
(Измерение трансэпидермальной потери влаги)
Трансэпидермальную потерю влаги кожей до введения образца оценивали, используя мышь C57BL/6 в качестве животной модели для оценки раздражения кожи. Измерение осуществляли с использованием портативного устройства для измерения потери влаги с системой переключения камер (производства Asahibiomed Co., Ltd., VAPO SCAN AS-VT100RS). Устройство приводили в контакт с кожей мыши в течение примерно 5-15 секунд, определяя значение. В примерах 5-7 TEWL (г/час•м2) измеряли через 10 минут после осуществления предварительной обработки.
(Тестирование проницаемости кожи мыши)
Проницаемость кожи для антигенного пептида Db126 и имихимода определяли, используя диффузионную ячейку Франца. Волосы со спины мыши C57BL/6 сбривали заранее. Кусочек кожи выделяли со спины мыши и закрепляли в диффузионной ячейке Франца (площадь нанесения 4,91 см2), в которой циркулировал фосфатный буфер (изотоничный буфер, pH 7,4) при 37°C. Препарат 0,7 см2 приклеивали на закрепленную кожу, и образец в ячейке собирали через 24 часа. Собранный образец подвергали высокоэффективной жидкостной хроматографии-тандемной масс-спектрометрии, и вычисляли количество антигенного пептида Db126, который проникал через кожу через 24 часа (проникающее количество антигенного пептида Db126, мкг/см2/24 час), и количество имихимода (проникающее количество имихимода, мкг/см2/24 час) на основании калибровочной кривой, которая была определена заранее.
Результаты теста по иммунизации и результаты измерения уровня TSLP и трансэпидермальной потери влаги показаны в следующей ниже таблице 1, наряду с линией мышей, используемой в тесте по иммунизации. «Генетически модифицированная мышь» в таблице 1 означает мышь, которую можно использовать для оценки способности пептида, ограниченного по MHC HLA-A*0201-типа, индуцировать клеточный иммунитет. Кроме того, результаты измерения проницаемости кожи показаны в таблице 3.
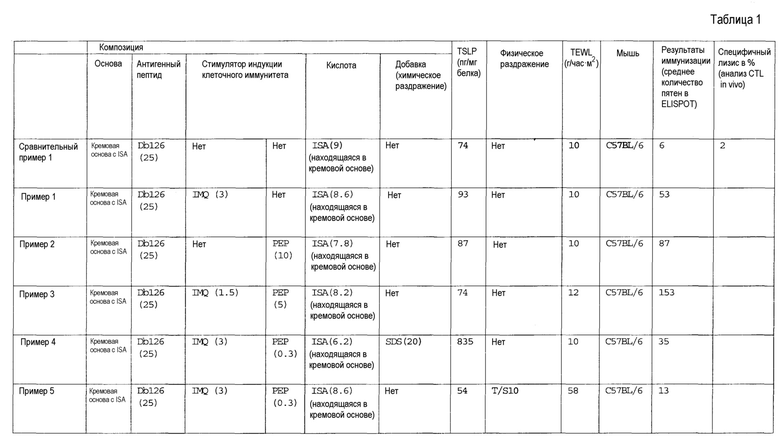
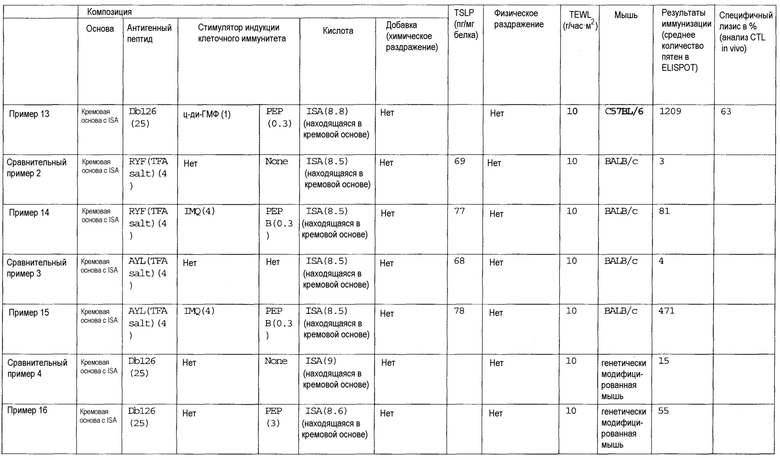
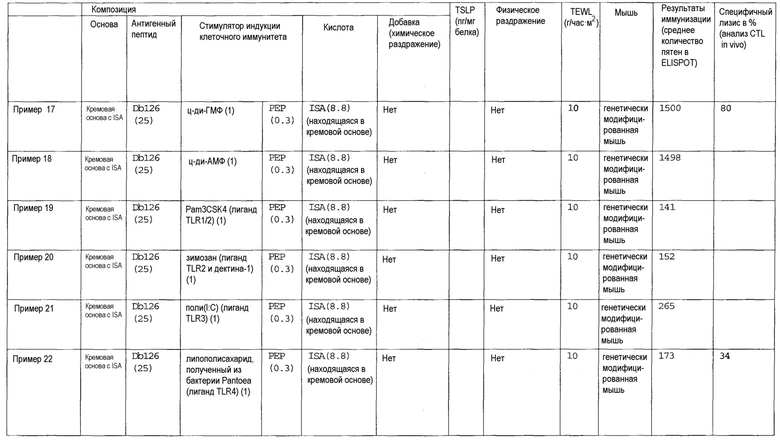
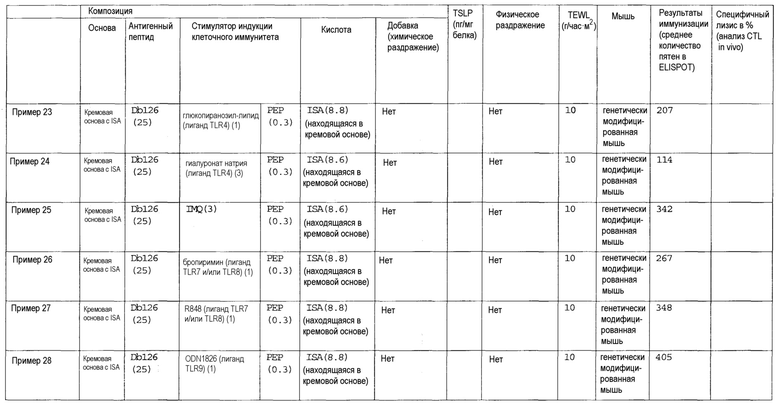
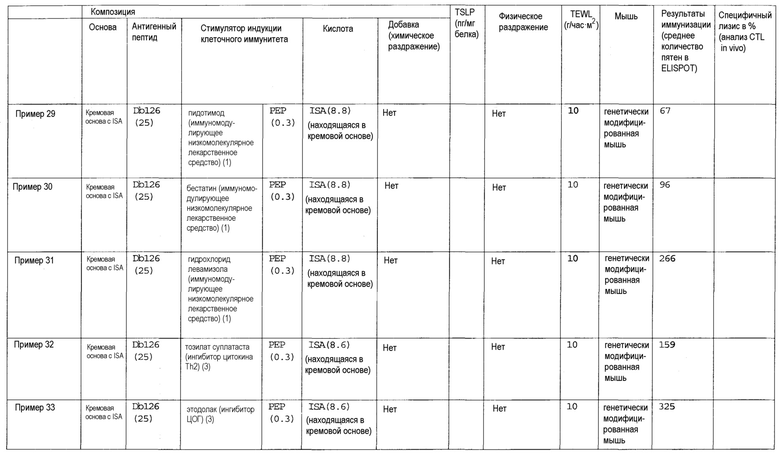
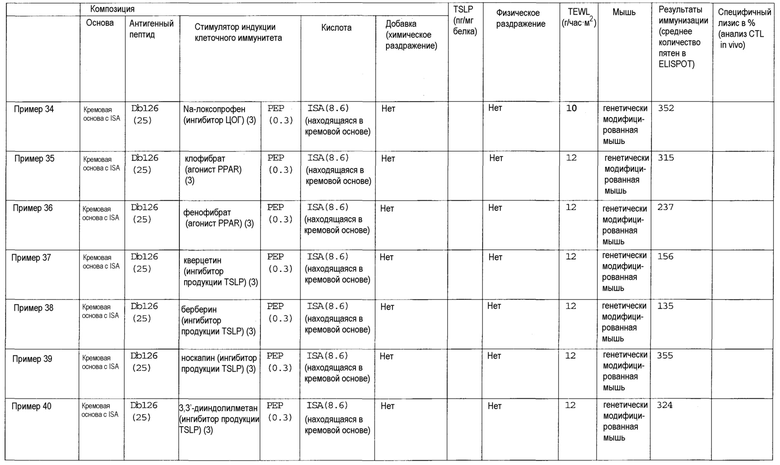
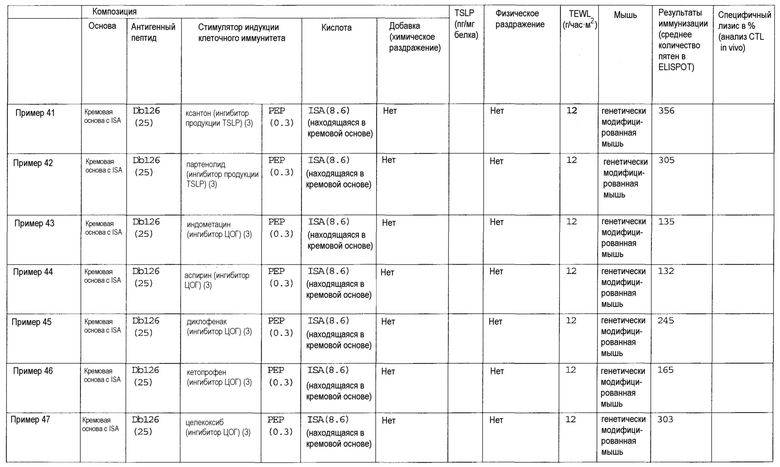
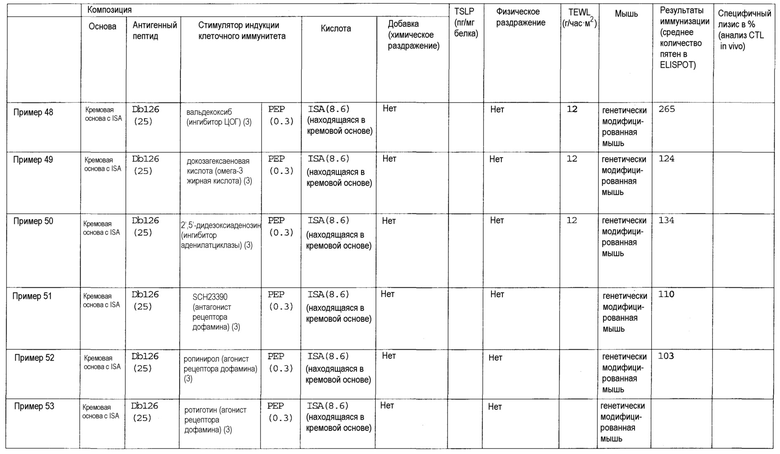
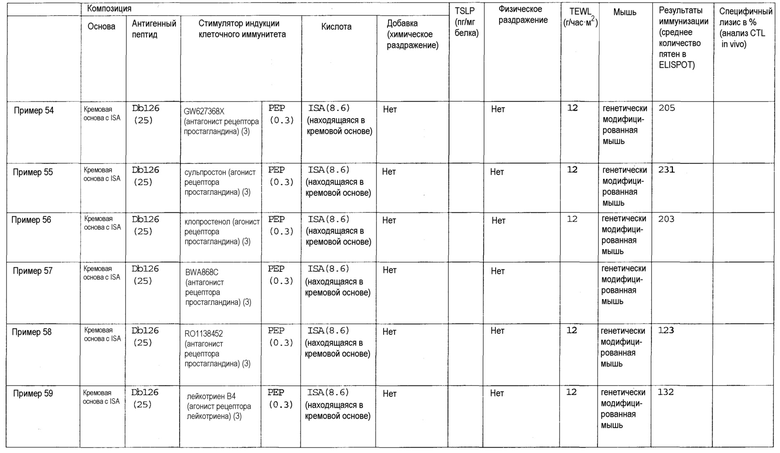
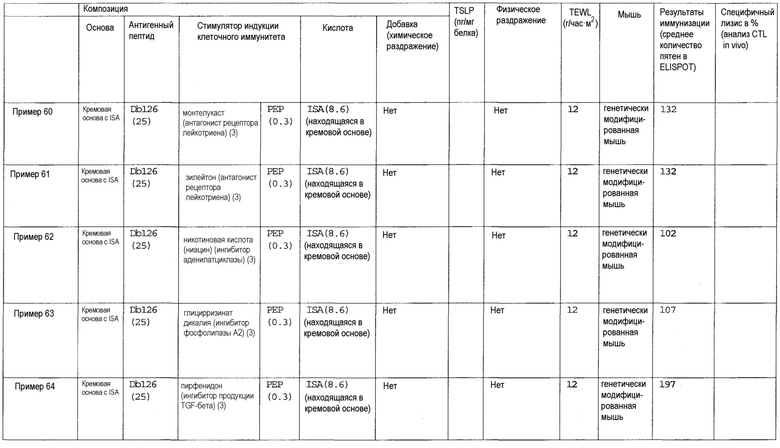
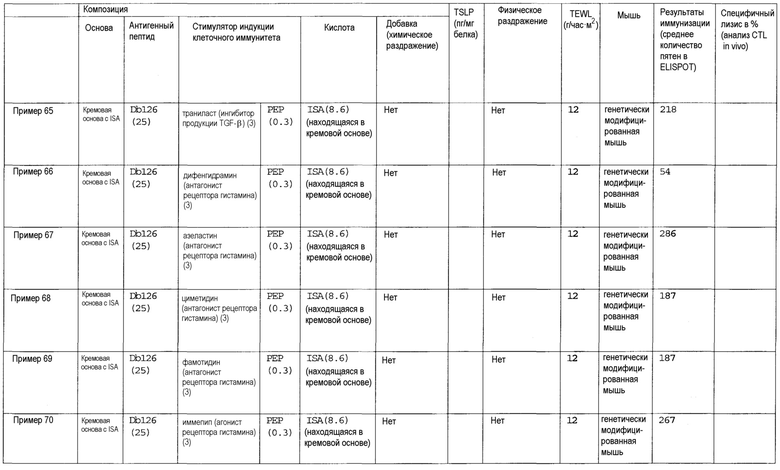
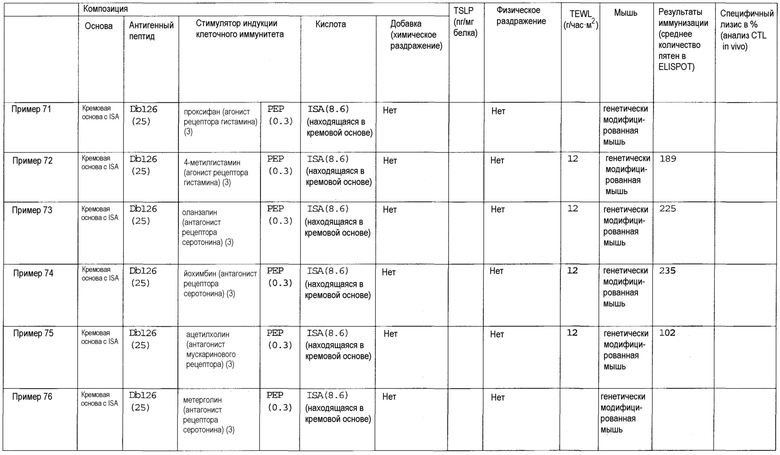
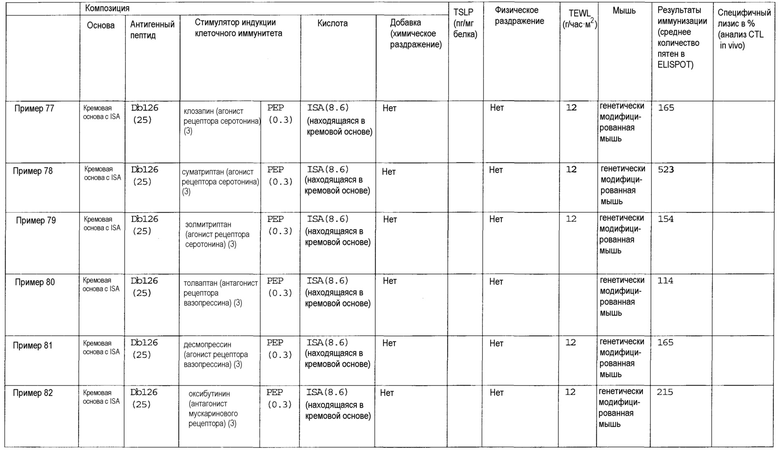
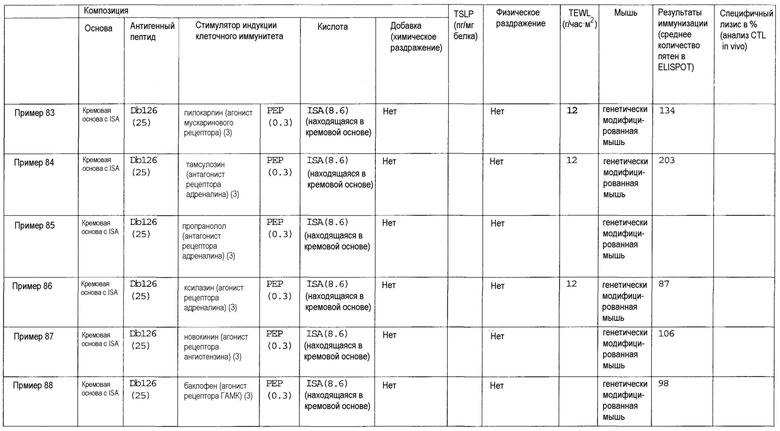
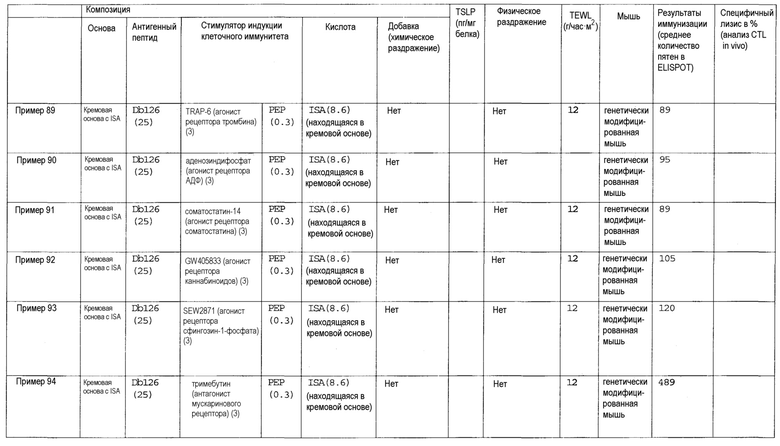
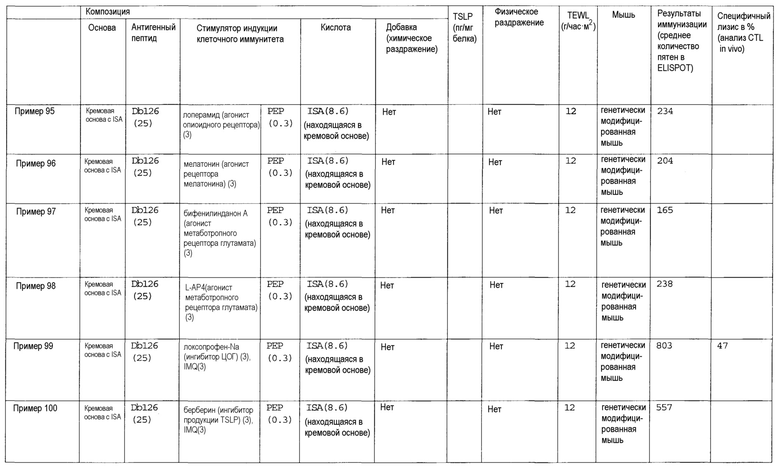
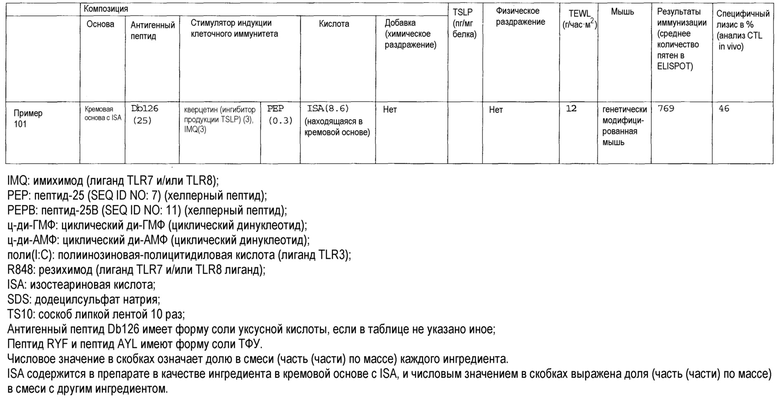
ТФУ-соль антигенного пептида Db126, ТФУ-соль пептида RYF, ТФУ-соль пептида AYL, уксуснокислую соль антигенного пептида Db126, пептид-25 (Pep25), пептид-25B (Pep25B), PADRE (универсальный хелперный пептид), WT135 (хелперный пептид hWT135) и WT1332 (хелперный пептид WT1332-347) химически синтезировали и очищали, используя ВЭЖХ. Имихимод (IMQ) приобретали из Tokyo Chemical Industry Co., Ltd. Циклический ди-ГМФ (ц-ди-ГМФ) и циклический ди-АМФ (ц-ди-АМФ) приобретали из Biolog Life Science Institute.
Соответственно, использовали Pam3CSK4 производства InvivoGen, зимозан производства Nacalai Tesque, Inc., поли(I:C) производства InvivoGen, полученный из бактерий Pantoea липополисахарид производства Macrophi Inc., глюкопиранозил-липид производства InvivoGen (MPLA), гиалуронат натрия производства Kikkoman Biochemifa Company (микрогиалуроновая кислота FCH), бропиримин производства TOCRIS bioscience, R848 и ODN1826 производства InvivoGen, пидотимод производства Santa Cruz Biotechnology, Inc., бестатин производства Wako Pure Chemical Industries, Ltd., левамизола гидрохлорид производства MP Biomedicals, тозилат суплатаста производства TOCRIS bioscience, этодолак производства Wako Pure Chemical Industries, Ltd., и Na-локсопрофен производства Yoshindo Inc.
Использовали следующие вещества.
Клофибрат: производства LKT Laboratories, Inc., фенофибрат: производства Wako Pure Chemical Industries, Ltd., кверцетин: производства Cayman Chemical Company, берберин (берберина н-гидрохлорид): производства Wako Pure Chemical Industries, Ltd., носкапин: производства Wako Pure Chemical Industries, Ltd., 3,3'-дииндолилметан: производства Wako Pure Chemical Industries, Ltd., ксантон: производства Wako Pure Chemical Industries, Ltd., партенолид: производства Wako Pure Chemical Industries, Ltd., индометацин: производства Wako Pure Chemical Industries, Ltd., аспирин: производства Sigma-Aldrich, диклофенак (диклофенак натрия): производства Wako Pure Chemical Industries, Ltd., кетопрофен: производства Wako Pure Chemical Industries, Ltd., целекоксиб: производства TOCRIS bioscience, вальдекоксиб: производства TOCRIS bioscience, докозагексаеновую кислоту: производства Cayman Chemical Company, 2',5'-дидезоксиаденозин: производства BIOMOL International, SCH23390: производства Wako Pure Chemical Industries, Ltd., ропинирол (ропинирол HCl): производства Ragactives, ротиготин: производства STARNASCENS, GW627368X: производства Cayman Chemical Company, сульпростон: производства Cayman Chemical Company, клопростенол: производства Wako Pure Chemical Industries, Ltd., BWA868C: производства Cayman Chemical Company, RO1138452: производства Cayman Chemical Company, лейкотриен B4: производства Cayman Chemical Company, монтелукаст (монтелукаст натрия): производства LG Life Sciences, зилейтон: производства Toronto Research Chemicals, Inc., никотиновую кислоту: производства Wako Pure Chemical Industries, Ltd., глицирризиновую кислоту (глицирризинат дикалия): производства Wako Pure Chemical Industries, Ltd., пирфенидон: производства TOCRIS bioscience, траниласт: производства Wako Pure Chemical Industries, Ltd., фамотидин: производства Wako Pure Chemical Industries, Ltd., иммепип (иммепипа дигидробромид): производства TOCRIS bioscience, проксифан: производства TOCRIS bioscience, азеластин (азеластина гидрохлорид): производства LKT Laboratories, Inc., циметидин: производства Wako Pure Chemical Industries, Ltd., 4-метилгистамин: производства TOCRIS bioscience, оланзапин: производства Wako Pure Chemical Industries, Ltd., йохимбин (йохимбина гидрохлорид): производства Wako Pure Chemical Industries, Ltd., ацетилхолин (хлорид ацетилхолина): производства Wako Pure Chemical Industries, Ltd., метерголин (сложный фенилметиловый эфир метерголина): производства TOCRIS bioscience, клозапин: производства Wako Pure Chemical Industries, Ltd., суматриптан: производства MYUNG IN PHARM. CO., LTD., золмитриптан: производства Cipla, толваптан: производства Sigma-Aldrich, десмопрессин: производства Sigma-Aldrich, пилокарпин (пилокарпина гидрохлорид): производства Wako Pure Chemical Industries, Ltd., пропранолол (пропранолола гидрохлорид): производства Wako Pure Chemical Industries, Ltd., ксилазин: производства Wako Pure Chemical Industries, Ltd., новокинин: производства Sigma-Aldrich, баклофен: производства Tokyo Chemical Industry Co., Ltd., TRAP-6: производства Bachem, аденозиндифосфат: производства MP Biomedicals, соматостатин-14: производства Bachem, GW405833: производства Sigma-Aldrich, SEW2871: производства Cayman Chemical Company, тримебутин (малеат тримебутина): производства Tokyo Chemical Industry Co., Ltd., лоперамид (лоперамида гидрохлорид): производства Wako Pure Chemical Industries, Ltd., мелатонин: производства LKT Laboratories, Inc., бифенилинданон A: производства Sigma-Aldrich и L-AP4 (L-2-амино-4-фосфономасляная кислота): производства Wako Pure Chemical Industries, Ltd., дифенгидрамин (дифенгидрамина гидрохлорид): производства Wako Pure Chemical Industries, Ltd., тамсулозин (тамсулозина гидрохлорид): производства Cipla, и оксибутинин (оксибутинина гидрохлорид): производства Sigma-Aldrich.
Антигенные пептиды, стимуляторы индукции клеточного иммунитета, кислоты, добавки и другие вещества для приготовления препарата в форме ленты, жидкого препарата для наружного применения и инъекционного препарата, получали из тех же источников, которые описаны выше.
Препарат в форме ленты
Получали адгезивы для препаратов в форме ленты.
(Полимеризация акрилового адгезива A)
В атмосфере инертного газа 75 частей 2-этилгексилакрилата, 22 части N-винил-2-пирролидона, 3 части акриловой кислоты и 0,2 части азобисизобутиронитрила полимеризовали в растворе при 60°C в этилацетате, с получением раствора акрилового адгезива A.
(Полимеризация акрилового адгезива B)
В атмосфере инертного газа 70 частей 2-этилгексилакрилата, 25 частей N-винил-2-пирролидона, 5 частей N-(2-гидроксиэтил)акриламида и 0,2 части азобисизобутиронитрила полимеризовали в растворе при 60°C в этилацетате, с получением раствора акрилового адгезива B.
(Получение каучукового адгезива PIB)
В толуоле растворяли 24 части полиизобутилена (Oppanol B200, производства BASF), 36 частей полиизобутилена (Oppanol B12, производства BASF) и 40 частей алициклической нефтяной смолы (Arkon P-100, производства Arakawa Chemical Industries, Ltd.), с получением раствора каучукового адгезива PIB.
(Получение SIS-адгезива A)
В толуоле растворяли 60 частей блок-сополимера стирол-изопрен-стирол (SIS5002, производства JSR Corporation) и 40 частей алициклической нефтяной смолы (Arkon P-100, производства Arakawa Chemical Industries, Ltd.), с получением раствора SIS-адгезива.
(Получение SIS-PIB-адгезива A)
В толуоле растворяли 30 частей блок-сополимера стирол-изопрен-стирол (SIS5002, производства JSR Corporation), 30 частей полиизобутилена (Oppanol B100, производства BASF) и 40 частей алициклической нефтяной смолы (Arkon P-100, производства Arakawa Chemical Industries, Ltd.), с получением раствора SIS-PIB-адгезива A.
Получали препараты в форме ленты, показанные в следующей таблице 4. В частности, антигенный пептид Db126, стимулятор индукции клеточного иммунитета и необязательно усилитель проницаемости кожи и/или фармакологически приемлемую кислоту, раствор адгезива и органический растворитель (этилацетат, этанол, толуол и т.д.) в количествах, описанных в таблице 4, вносили в смесь, перемешивали и распределяли на защитной удаляемой пленке так, чтобы толщина слоя после сушки составляла примерно 80 мкм, органический растворитель удаляли при сушке и приклеивали к подложке, с получением препарата в форме ленты. Раствор адгезива добавляли в смесь так, чтобы общее количество ингредиентов и адгезива после сушки для удаления органического растворителя составляло 100 частей по массе. В качестве подложки использовали полиэтилентерефталатную (ПЭТ) пленку (толщиной 25 мкм). Лист полиэтилентерефталата (ПЭТ) (толщиной 75 мкм), обработанный силиконом, использовали в качестве защитной удаляемой пленки. Полученный таким образом препарат в форме ленты разрезали, с получением кусочков 0,7 см2, и брали для теста иммунизации. Защитную удаляемую пленку снимали непосредственно перед нанесением препарата в форме ленты.
Тест иммунизации мышей 2 (препарат в форме ленты)
Используя полученный таким образом препарат в форме ленты, осуществляли тест 2 по иммунизации мышей таким же образом, как тест 1 по иммунизации мышей. Препарат наносили один раз на 24 часа и выделяли селезенку через 6 дней после завершения нанесения. Генетически модифицированную мышь, которую можно применять для оценки способности индуцировать клеточный иммунитет пептида, ограниченного по MHC HLA-A*0201-типа, использовали в качестве животной модели для иммунологической оценки.
В примере 111 кожу повреждали микрорезаком (MICRO FEATHER No. 7330G, производства FEATHER) перед нанесением препарата.
В некоторых группах уровень TSLP в коже после нанесения, трансэпидермальную потерю влаги до нанесения и проницаемость кожи для антигенного пептида Db126 и имихимода измеряли с использованием мыши C57BL/6 таким же образом, как в тесте иммунизации мышей 1.
Результаты теста иммунизации и результаты измерения уровня TSLP и трансэпидермальной потери влаги показаны в следующей далее таблице 4. Кроме того, результаты измерения проницаемости кожи показаны в таблице 5.
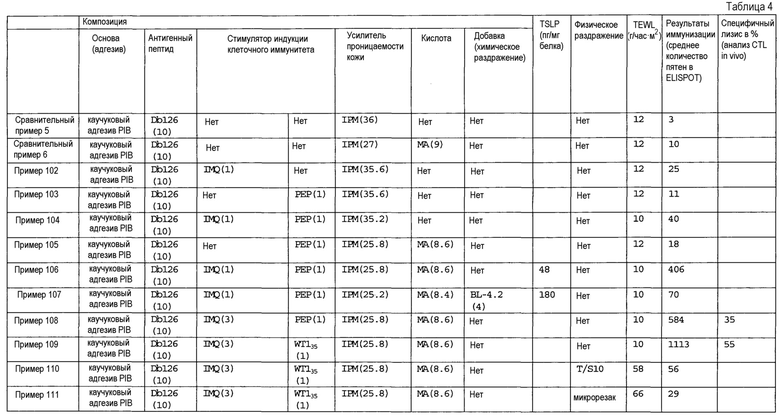
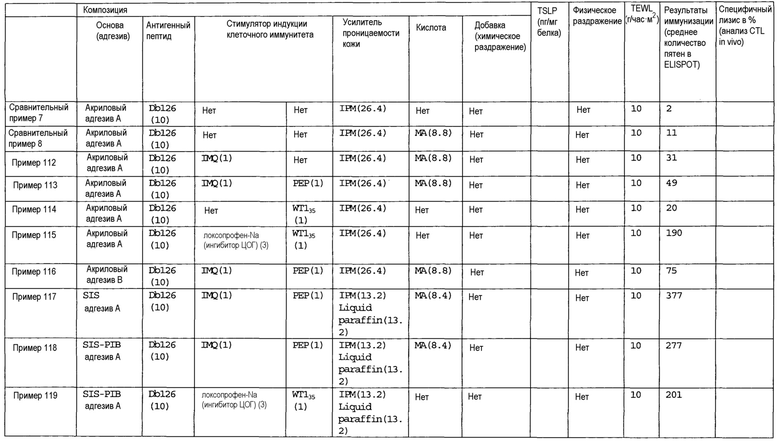
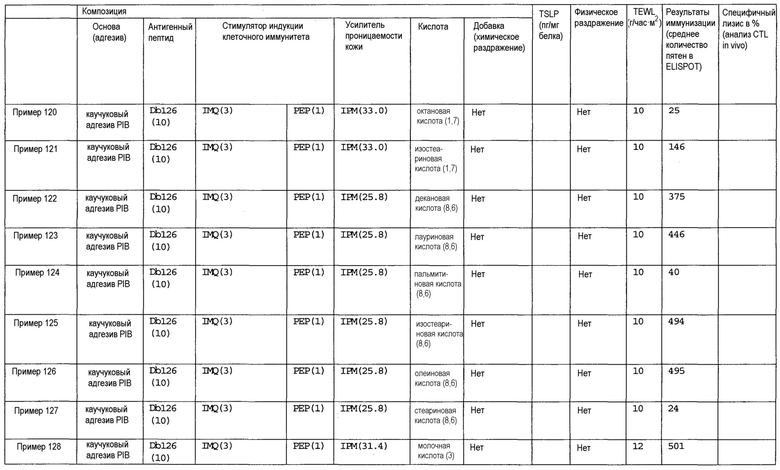
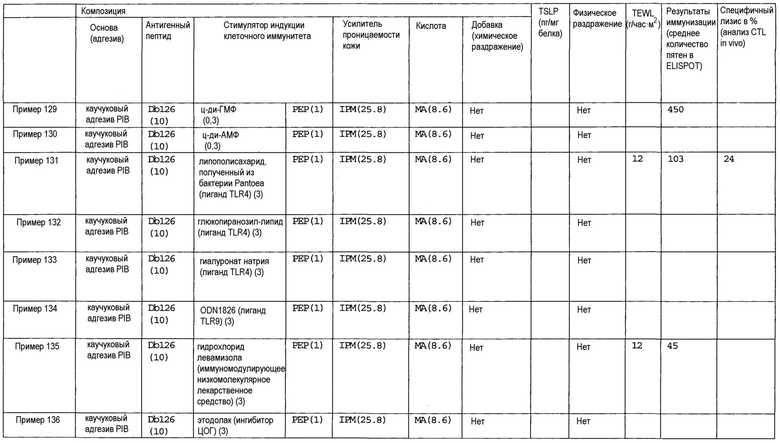
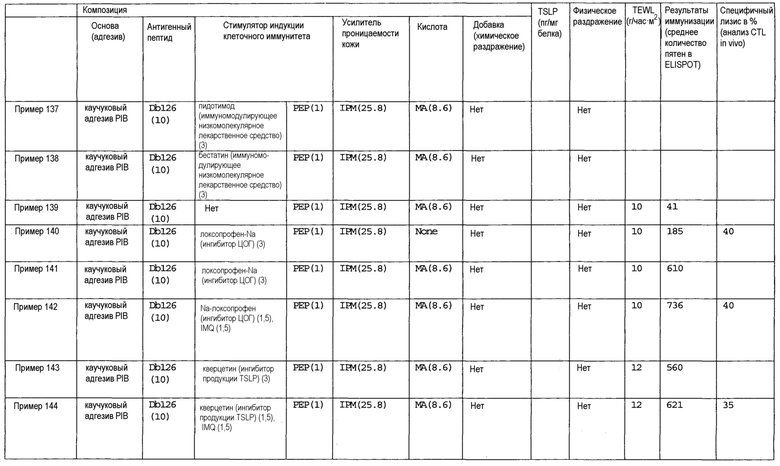
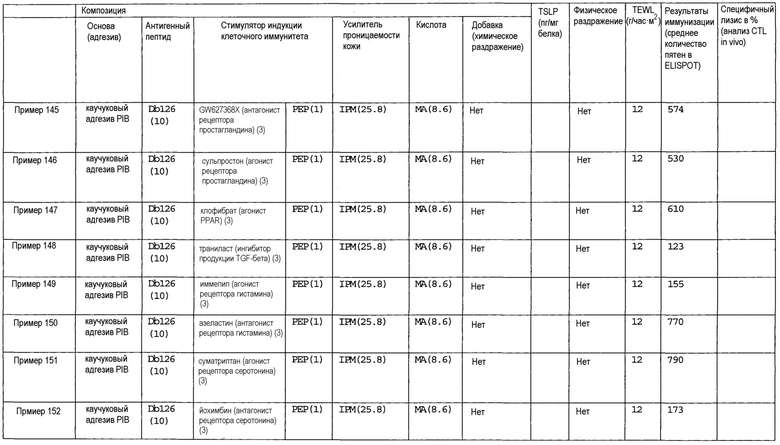
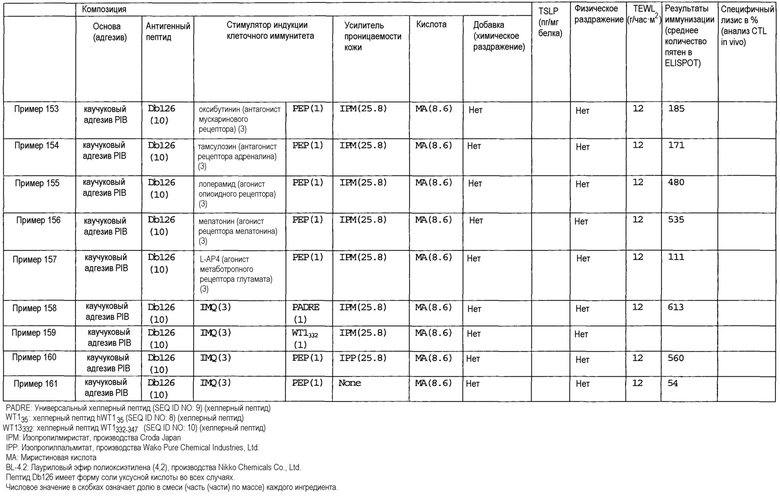
Жидкий препарат для наружного применения
Готовили жидкий препарат для наружного применения, содержащий ингредиенты, указанные в следующей таблице 6. Антигенный пептид Db126, стимуляторы индукции клеточного иммунитета, отличные от хелперного пептида, и хелперный пептид в количествах, описанных в таблице 6, и 15 частей по массе ДМСО смешивали, добавляли основу так, чтобы в сумме получить 100 частей по массе. Смесь перемешивали, с получением жидкий препарат для наружного применения. Пропиленгликоль (PG) и олеиловый спирт (OA) смешивали так, чтобы соотношение по массе соответствовало соотношению 98:2 или 90:10, с получением основу. Получали композитную подложку, в которой часть, состоящая из целлюлозного нетканого полотна (площадью 0,8 см2) приклеивали к центральной части адгезивной ленты для фиксации. Часть такой композитной подложки, состоящую из нетканого полотна, пропитывали 67 мкл полученного жидкого препарата для наружного применения и использовали в тесте иммунизации.
Тест иммунизации мышей 3 (жидкий препарат для наружного применения)
Используя жидкий препарат для наружного применения, полученный как описано выше, тест по иммунизации мышей осуществляли таким же образом, как тест по иммунизации мышей 1. Использовали дозу 67 мкл, как описано выше. Жидкий препарат наносили один раз на 24 часа и селезенку отделяли через 6 дней после завершения нанесения. В данном тесте использовали мышь C57BL/6.
В некоторых группах уровень TSLP в коже после нанесения и трансэпидермальную потерю влаги до нанесения измеряли, используя мышь C57BL/6, таким же образом, как и в тесте иммунизации мышей 1.
Результаты теста иммунизации, результаты измерения уровня TSLP и трансэпидермальной потери влаги показаны в следующей ниже таблице 6.
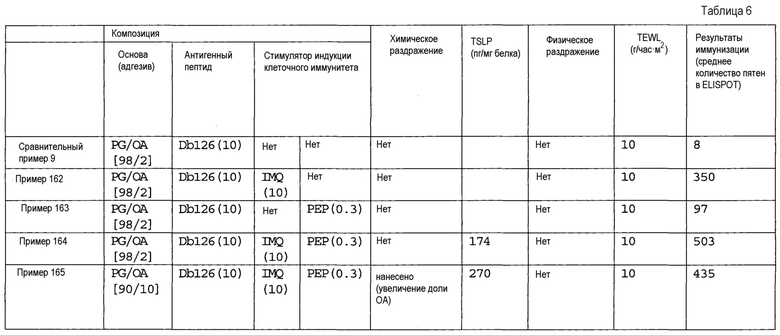
PG/OA: Смесь пропиленгликоля и олеилового спирта (оба производства Wako Pure Chemical Industries, Ltd. Во всех случаях).
Числовое значение, указанное в квадратных скобках [] означает массовое соотношение PG и OA.
Пептид Db126 имеет форму соли уксусной кислоты во всех случаях.
Числовое значение в круглых скобках () означает долю в смеси (часть(части) по массе) каждого ингредиента.
Инъекционный препарат
Готовили препараты для интрадермальной инъекции, содержащие ингредиенты, указанные в следующей ниже таблице 7. В частности, добавляли физиологический раствор в качестве основы к антигенному пептиду Db126 и монтаниду ISA51VG (производства Freund Corporation), используемому в качестве адъюванта, в количествах, описанных в таблице 7, получая в итоге 100 частей по массе, и смесь перемешивали, используя гомогенизатор, с получением инъекционного подобного эмульсии препарата.
Тест иммунизации мышей 4 (инъекционный препарат)
Используя инъекционный препарат, полученный, как описано выше, осуществляли тест по иммунизации мышей таким же образом, как тест по иммунизации мышей 1. 30 мкл инъекционного препарата вводили один раз в область спины мыши посредством интрадермальной инъекции и выделяли селезенку через 6 дней после введения. Генетически модифицированную мышь, которую можно использовать для оценки способности пептида, ограниченного MHC HLA-A*0201-типа, индуцировать клеточный иммунитет, использовали в качестве животной модели. Результаты теста иммунизации показаны в следующей ниже таблице 7.
В сравнительных примерах 10-14 количество инъецируемого пептида Db126 вычисляли как количество для интрадермального введения, так как пептид вводили интрадермально. Кроме того, тестировали проницаемость кожи мышей с использованием препарата из примера, при этом количество пептида, проникающего в кожу в течение 24 часов, сравнивали с интрадермально вводимым количеством пептида. Сравнение поступающего внутри кожи количества при инъекции и в случае использования препарата в форме ленты показано в таблице 8.
ISA51VG (50)
ISA51VG (50)
ISA51VG (50)
ISA51VG (50)
ISA51VG (50)
Пептид Db126 имеет форму соли уксусной кислоты во всех случаях.
Числовое значение в круглых скобках означает долю в смеси (часть (части) по массе) каждого ингредиента.
Анализ CTL in vivo
Через семь дней после конечной иммунизации клетки селезенки (клетка-мишень или контрольная клетка) трансплантировали согласно следующей методике, и затем выделяли селезенку спустя 18 часов. Значение специфичного лизиса в % получали, осуществляя измерение FACS.
Методика 1. Сбор клеток селезенки у нативной мыши
Использовали не подвергавшуюся обработке (нативную) мышь, того же вида, что и мышь, используемая в тесте иммунизации. Селезенку выделяли из нативной мыши и раздавливали, используя предметное стекло, в чашке Петри, содержащей среду RPMI1640. Раздавленную селезенку помещали в пробирку объемом 50 мл и центрифугировали при 10°C и 1100 об./мин в течение 5 минут. Супернатант отбрасывали. В пробирку добавляли 20 мл лизирующего буфера с последующей инкубацией при комнатной температуре в течение 5 минут. В пробирку добавляли 20 мл среды и затем пробирку центрифугировали. В пробирку добавляли среду и полученную смесь пропускали через сито, с получением суспензию клеток.
Методика 2. Мечение клеток селезенки антигеном
Клетки селезенки, полученные согласно методике 1, центрифугировали при 10°C и 1100 об./мин в течение 5 минут, супернатант отбрасывали и добавляли буфер HBSS, с получением суспензию клеток 2×107 клеток/мл. Суспензию клеток распределяли в две пробирки объемом 50 мл, добавляли 100 мкМ раствор антигена (антиген представлял собой такой же антиген, который использовали в тесте иммунизации) в одну из пробирок, содержащих раствор с клетками, так чтобы конечная концентрация достигала 10 мкМ, с получением при этом клетки-мишени. Клетки в другой пробирке считали контрольными. Клетки в обеих пробирках инкубировали при 37°C в течение 1 часа, центрифугировали, супернатант отбрасывали и добавляли среду.
Методика 3. Мечение клеток селезенки CFSE
Клетки, меченные антигеном согласно методике 2, центрифугировали и добавляли 0,1% БСА-PBS до получения 1×107 клеток/мл. К суспензии клеток-мишеней добавляли 5 мМ раствор CFSE до конечной концентрации 10 мкМ, и к суспензии контрольных клеток добавляли 5 мМ раствор CFSE до конечной концентрации 1 мкМ и смесь встряхивали, затем инкубировали при 37°C в течение 10 минут. Затем осуществляли центрифугирование, супернатант отбрасывали и добавляли среду.
Методика 4. Трансплантация клеток селезенки
Клетки, меченые CFSE согласно методике 3, центрифугировали, супернатант отбрасывали и к клеткам добавляли буфер HBSS, с получением суспензию клеток в концентрации 5×107 клеток/мл. Равные количества суспензии клеток-мишеней и суспензии контрольных клеток смешивали и аликвоту смеси объемом 200 мкл вводили каждой иммунизированной мыши через глазничные вены (количество клеток для трансплантации: 1×107 клеток/животное).
Методика 5. Получение клеток селезенки от иммунизированной мыши и измерение FACS
Через восемнадцать часов после трансплантации клеток выделяли селезенку мыши и готовили суспензию клеток селезенки таким же образом, как в методике 1. Затем выявляли CFSE-позитивные клетки, используя FACS, и получали соотношение между клетками с высоким содержанием CFSE (клетки-мишени) и низким содержанием CFSE (контрольные клетки). Цитотоксическую активность вычисляли по формуле, показанной ниже. Полученное значение может быть использовано в качестве показателя, свидетельствующего о способности антигенспецифичных клеток-киллеров, индуцированных в результате иммунизации вакцинной композицией, специфично атаковать клетки, которые презентируют антиген в живом организме. Было подтверждено, что композиция согласно настоящему изобретению может индуцировать сильный антиген-специфичный клеточный иммунитет.
r=(% клеток с низким содержанием CFSE)/(% клеток с высоким содержанием CFSE)
Специфичный лизис, %=(1-(r_неиммунизированные/r_иммунизированные))×100
Результаты, полученные в сравнительном примере 1, примере 1 и примере 11, показаны на фиг.1. При использовании имихимода клеточный иммунитет был усилен, при совместном использовании имихимода и пептида-25 клеточный иммунитет был заметно усилен. Подобным образом, результаты сравнительного примера 1, примера 12 и примера 13 показаны на фиг.2. При использовании циклического ди-ГМФ, клеточный иммунный ответ был усилен, и при совместном использовании циклического ди-ГМФ и пептида-25 клеточный иммунный ответ был заметно усилен. Кроме того на основании сравнительного примера 1 и примера 2 показано, что клеточный иммунный ответ также может быть индуцирован в том случае, когда добавляли только хелперный пептид пептид-25 в качестве стимулятора индукции клеточного иммунитета. Кроме того, на основании сравнения между примером 1 и примером 2 и примером 11 показано, что проявляется синергический эффект в случае комбинации другого стимулятора индукции клеточного иммунитета, отличного от хелперного пептида, и хелперного пептида. На основании результатов примера 2 показано, что эффект индукции клеточного иммунитета не намного повышен, даже когда количество хелперного пептида повышено. Кроме того, препарат в форме ленты или жидкий препарат также успешно индуцировали клеточный иммунный ответ у мыши, подобно препарату в форме крема.
Результаты теста по иммунизации мышей и теста для оценки проницаемости кожи, описанных в примерах 5-8, в которых исследовали влияние физического раздражения, показаны на фиг.3 и фиг.4. Результат TEWL в качестве физического показателя, показан в таблице 1. В таблице 1 и на фиг.3 показано, что клеточный иммунный ответ ослабевает при физическом раздражении, и введение в условиях слабого раздражения является эффективным. То есть, показано, что более низкое значение TEWL является эффективным в индукции более сильного клеточного иммунного ответа. На фиг.4 показано, что количества проникающих через кожу Db126 и имихимода повышены при физическом раздражении, и показано, что даже в том случае, когда проникающие через кожу количества повышены, клеточный иммунный ответ не может быть усилен.
Результаты теста по иммунизации мышей и теста по оценке проницаемости кожи мышей согласно примерам 106 и 107, в которых исследовали влияние химического раздражения (поверхностно-активного вещества), показаны на фиг.5 и на фиг.6. На фиг.5 показано, что клеточный иммунный ответ ослаблен при химическом раздражении, и эффективным является введение в условиях слабого раздражения. На фиг.6 показано, что проникающие через кожу количества Db126 и имихимода были повышены при химическом раздражении, и показано, что клеточный иммунный ответ не может быть усилен, даже в том случае, когда проникающее через кожу количество увеличивается.
Результаты теста по иммунизации мышей согласно примерам 109 и 111, в которых исследовали влияние физического раздражения, показаны на фиг.7. Когда препарат вводили препарат в форме ленты на кожу, которая была подвергнута физическому раздражению, уровень индукции иммунитета был ослаблен, и показано, что введение в условиях слабого раздражения является эффективным.
Результаты теста по иммунизации мышей согласно примерам 139, 108, 141 и 142, в которых исследовали синергический эффект имихимода и локсопрофена-Na, показаны на фиг.8. Показано, что уровень индукции иммунитета выше, когда добавляют и имихимод (1,5%) и локсопрофен-Na (1,5%), чем при введении отдельно имихимода (3%) или отдельно локсопрофена-Na (3%).
В таблице 1 и таблице 4 оценивали эффект стимулятора индукции клеточного иммунитета в композиции для трансдермального введения, содержащей пептид WT1 и/или модифицированный пептид WT1. Обнаружено, что стимулятор индукции клеточного иммунитета, выбранный из лиганда TLR, циклического динуклеотида, хелперного пептида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств, является эффективным. Предпочтительно стимулятор индукции клеточного иммунитета, выбранный из лиганда TLR, циклического динуклеотида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, антагониста рецептора простагландина, агониста рецептора простагландина, ингибитора продукции TSLP, ингибитора аденилатциклазы, омега-3 жирной кислоты, агониста PPAR, антагониста рецептора дофамина, агониста рецептора дофамина, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста рецептора вазопрессина, агониста рецептора вазопрессина, антагониста мускаринового рецептора, агониста мускаринового рецептора, антагониста рецептора адреналина, агониста рецептора адреналина, агониста рецептора ангиотензина, агониста рецептора ГАМК, агониста рецептора тромбина, агониста опиоидного рецептора, агониста рецептора АДФ, антагониста рецептора лейкотриена, агониста рецептора лейкотриена, агониста рецептора мелатонина, агониста рецептора соматостатина, агониста рецептора каннабиноида, агониста рецептора сфингозин-1-фосфата, агониста метаботропного рецептора глутамата, ингибитора фосфолипазы A2, ингибитора продукции TGF-бета, ингибитора цитокина Th2 и комбинации двух или более указанных средств, а также комбинации хелперного пептида и первого стимулятора индукции клеточного иммунитета, отличного от хелперного пептида, были эффективными. Более предпочтительно первый стимулятор индукции клеточного иммунитета, выбранный из лиганда TLR, циклического динуклеотида, иммуномодулирующего низкомолекулярного лекарственного средства, ингибитора циклооксигеназы, ингибитора продукции TSLP, антагониста рецептора простагландина, агониста рецептора простагландина, агониста PPAR, ингибитора продукции TGF-бета, агониста рецептора гистамина, антагониста рецептора гистамина, агониста рецептора серотонина, антагониста рецептора серотонина, антагониста мускаринового рецептора, антагониста рецептора адреналина, агониста опиоидного рецептора, агониста рецептора мелатонина, агониста метаботропного рецептора глутамата и комбинации двух или более указанных средств, а также комбинации хелперного пептида и первого стимулятора индукции клеточного иммунитета, отличного от хелперного пептида, были эффективными.
Как показано в таблице 1, таблице 4, таблице 6 и таблице 7, трансдермальное введение композиции противораковой вакцины, содержащей пептид WT1 и/или модифицированный пептид WT1, может индуцировать клеточный иммунный ответ, эквивалентный или более сильный, чем иммунный ответ, индуцированный при инъекции антигена. В публикации Current Opinion in Immunology 2008, 20: 211-220 сообщены результаты клинических исследований, и было подтверждено, что WT1-вакцина полезна в качестве противораковой вакцины при введении с помощью инъекции. Трансдермальное введение вакцинной композиции согласно настоящему изобретению может индуцировать клеточный иммунный ответ, который эквивалентен или является более сильным, чем иммунный ответ, индуцированный при инъекции у мышей, и поэтому предполагается, что композиция согласно настоящему изобретению также может эффективно индуцировать клеточный иммунный ответ, который сравним или является более сильным, чем иммунный ответ, индуцированный в результате инъекции. Композиция вакцины является полезной противораковой вакциной.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ПРОТИВОРАКОВОЙ ВАКЦИНЫ, СОДЕРЖАЩАЯ ПЕПТИД WT1, ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ | 2014 |
|
RU2685933C2 |
| ПРЕПАРАТ ПРОТИВОРАКОВОЙ ВАКЦИНЫ, СОДЕРЖАЩИЙ ПЕПТИД WT1, В ФОРМЕ ЛЕНТЫ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ | 2014 |
|
RU2697443C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ НА ОСНОВЕ ПЕПТИДА WT1 ДЛЯ МУКОЗАЛЬНОГО ВВЕДЕНИЯ | 2014 |
|
RU2687026C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ИММУННОГО ОТВЕТА | 2015 |
|
RU2689162C2 |
| КОМПЛЕКС АГОНИСТА ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА 7 ИЛИ 8 И ХОЛЕСТЕРИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2790702C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2016 |
|
RU2709015C2 |
| ИММУНОСТИМУЛИРУЮЩАЯ КОМБИНАЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГЕПАТИТА С | 2006 |
|
RU2431499C2 |
| Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина | 2014 |
|
RU2664197C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2737765C2 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |



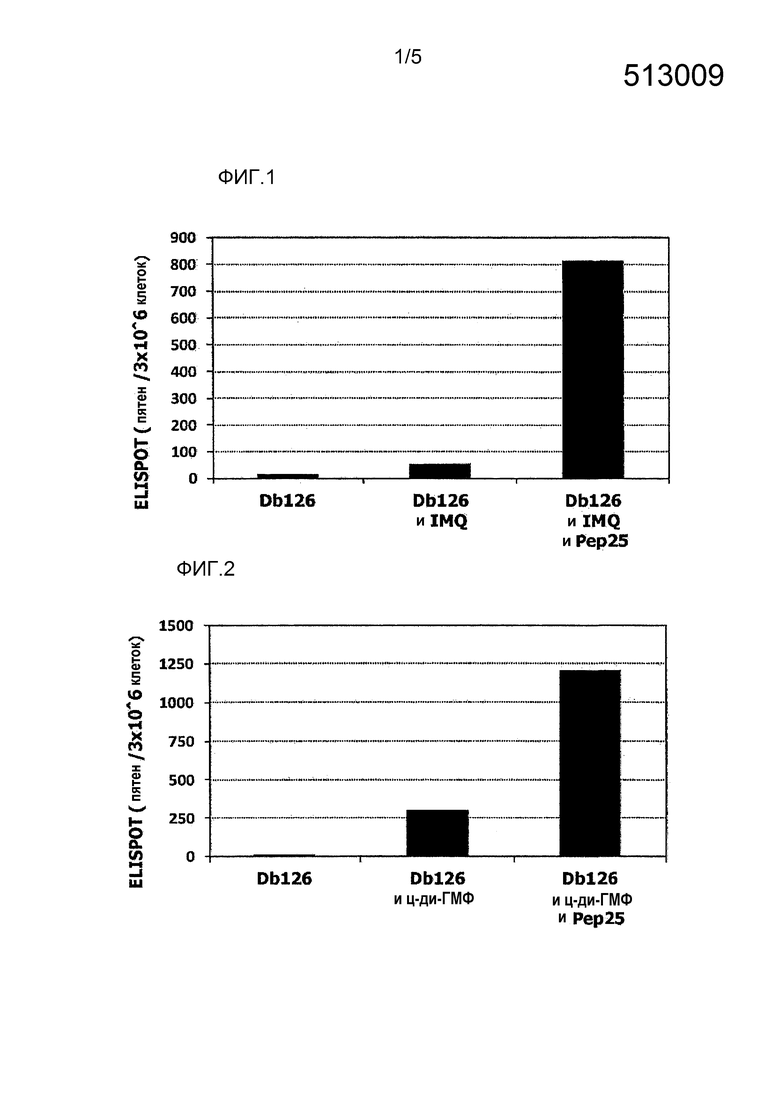
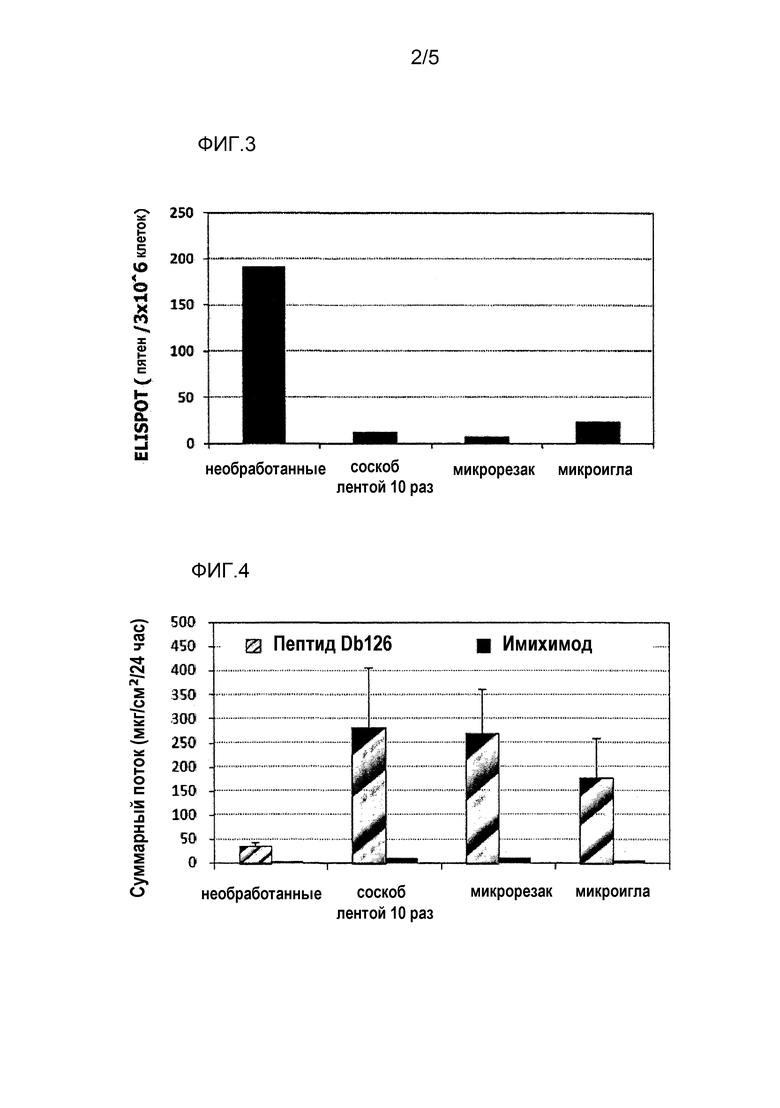
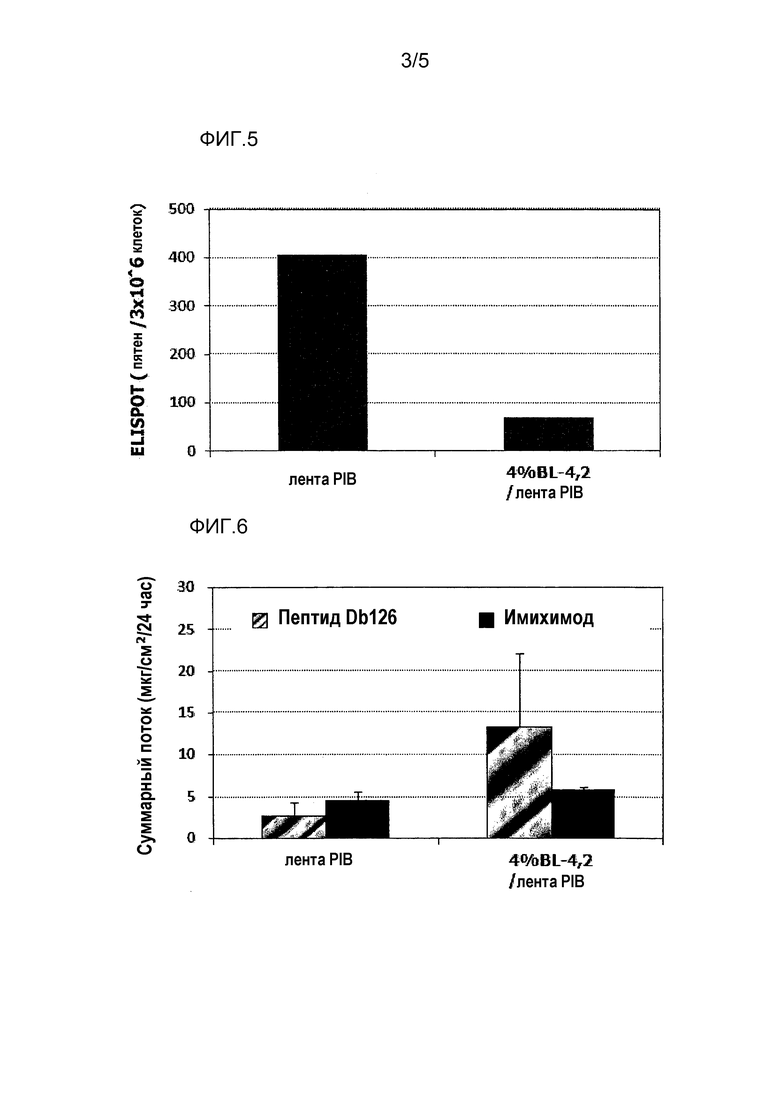
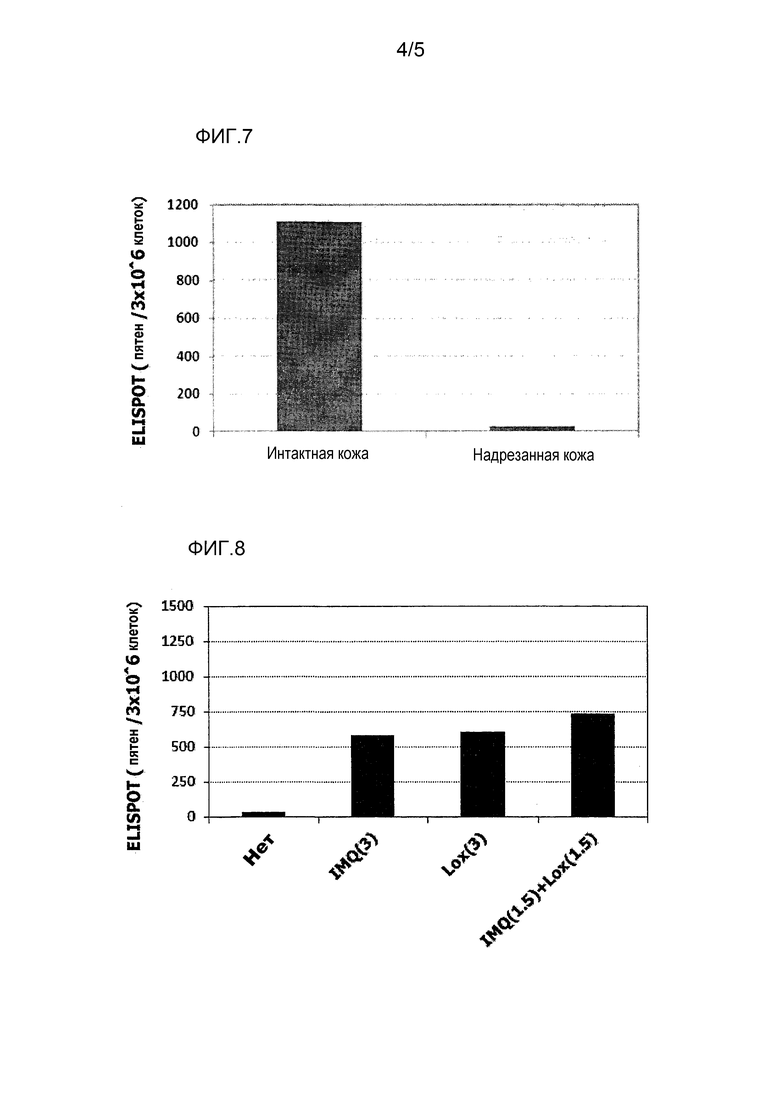
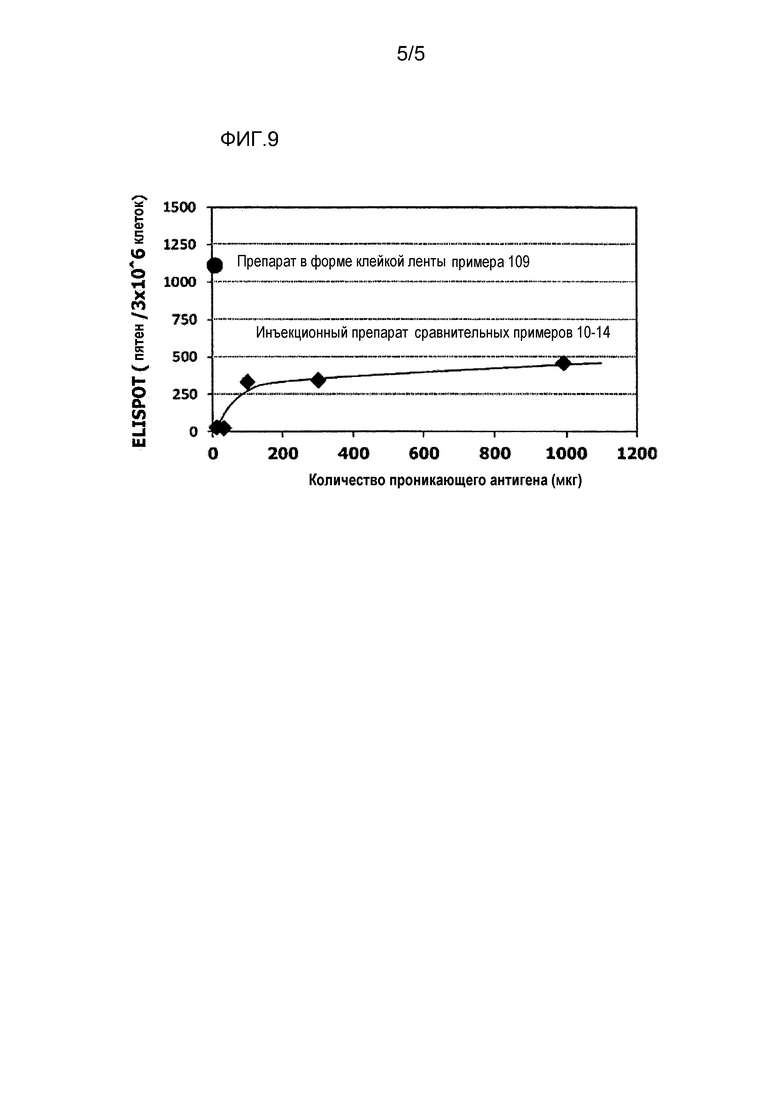
Изобретение относится к области биотехнологии, в частности к композиции противораковой вакцины для трансдермального введения для применения в индукции клеточного иммунитета против рака со сверхэкспрессией гена WT1. Вышеуказанная композиция содержит в эффективном количестве: пептид Db126 и ингибитор циклооксигеназы, выбранный из группы, состоящей из этодолака, локсопрофена и/или его соли, индометацина, аспирина, диклофенака, кетопрофена, целекоксиба и вальдекоксиба. Изобретение позволяет эффективно индуцировать клеточный иммунитет против раковой опухоли. 4 з.п. ф-лы, 9 ил., 8 табл.
1. Композиция противораковой вакцины для трансдермального введения для применения в индукции клеточного иммунитета против рака со сверхэкспрессией гена WT1, содержащая в эффективном количестве:
(i) пептид Db126 и
(ii) ингибитор циклооксигеназы, выбранный из группы, состоящей из этодолака, локсопрофена и/или его соли, индометацина, аспирина, диклофенака, кетопрофена, целекоксиба и вальдекоксиба.
2. Композиция противораковой вакцины для трансдермального введения по п. 1, в которой композиция предназначена для применения в лечении рака со сверхэкспрессией гена WT1.
3. Композиция противораковой вакцины для трансдермального введения по п. 1, которую вводят в условиях слабого раздражения.
4. Композиция противораковой вакцины для трансдермального введения по п. 3, где условие слабого раздражения представляет собой условие, при котором трансэпидермальная потеря влаги (TEWL) у животной модели при оценке раздражения кожи перед введением композиции составляет 50 г/ч⋅м2 или менее.
5. Композиция противораковой вакцины для трансдермального введения по п. 3 или 4, где условие слабого раздражения представляет собой условие, при котором уровень TSLP кожи у животной модели в случае оценки раздражения при осуществлении введения композиции составляет 10000 пг/мг белка или менее.
| US 20110070251 А1, 24.03.2011 | |||
| US 20050215501 A1, 29.09.2005 | |||
| INOUE J | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
| ПРИСПОСОБЛЕНИЕ К ВЕЛОСИПЕДУ ДЛЯ ЕЗДЫ ПО ОДНОМУ РЕЛЬСУ | 1922 |
|
SU614A1 |
| KARANDE P | |||
| et al.: "Transcutaneous immunization: an overview of advantages, disease targets, vaccines, and delivery technologies", ANNUAL REVIEW OF CHEMICAL AND BIOMOLECULAR ENGINEERING., 2010, vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ручной прибор для загибания кромок листового металла | 1921 |
|
SU175A1 |
| ВАКЦИНА ДЛЯ СТИМУЛЯЦИИ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА | 2000 |
|
RU2192884C2 |
Авторы
Даты
2019-05-07—Публикация
2014-01-29—Подача