ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к молекулам, таким как пептиды, полипептиды и белки, которые иммунологически взаимодействуют с Т-лимфоцитами у субъектов, имеющих аллергию на арахис или аллергию на другие лесные орехи, и генетическим последовательностям, кодирующим их. Предпочтительно эти молекулы являются иммуноинтерактивными по отношению к Т-клеткам субъектов, имеющих аллергию на аллерген Ara h 1. Молекулы по данному изобретению являются полезными в разработке диагностических, терапевтических и профилактических средств для состояний, характеризующихся аберрантным, неадекватным или иным нежелательным иммунным ответом на Ara h 1, его производное или гомолог.
УРОВЕНЬ ТЕХНИКИ
Библиографические данные публикаций, указанных автором в данном описании изобретения собраны в алфавитном порядке в конце описания.
Ссылка на любой известный уровень техники в данном описании изобретения не является и не должна рассматриваться как подтверждение или любая другая форма утверждения того, что известный уровень техники соответствует части общего уровня знаний в данной области техники в Австралии.
Аллергия на арахис является опасным для жизни и неизлечимым расстройством, поражающим около 1% популяции (Husain et al. J Am Acad Dermatol. 66(1): 136-43, 2012, Burks, Lancet. 371(9623):1538-46,2008). Оно характеризуется внезапным началом анафилаксии, которая может возникнуть при воздействии малых количеств белков арахиса (Hourihane et al., J Allergy Clin Immunol 100: 596-600, 1997; Pumphrey, Current Opinion in Allergy & Clinical Immunology. 4(4):285-90, 2004). Анафилаксию, индуцируемую орехами, чаще всего связывают со смертностью или угрожающими жизни признаками (Bock et al. J Allergy Clin Immunol. 119(4): 1016-8, 2007; Burks 2008, см. выше). Белки арахиса часто скрыты в, на первый взгляд, безопасных источниках питания, так, что в течение 5 лет случайный контакт наблюдается у до 50% больных (Sicherer et al., Paediatrics 102: е6, 1998). Неудивительно, что аллергию на орехи связывают со значительной психологической заболеваемостью как у больных, так и у лиц, осуществляющих уход за ними, близких к тем, кто пострадал от хронических дегенеративных заболеваний, таких как ревматоидный артрит (Primeau et al., Clin Exp Allergy 30: 1135-43, 2000; Kemp et al. Med. J. Aust. 188(9):503-4, 2008). Лечение, в то же время, является необходимым для того, чтобы аллергия на орехи не являлась причиной смертности, также необходимо снять хроническую психологическую нагрузку, которую несут субъекты, страдающие аллергией на арахис.
На сегодняшний день усилия, направленные на иммунотерапию при аллергии на арахис, увенчались крайне ограниченным успехом. Nelson et al. показали, что толерантность к арахису может быть индуцирована с применением протокола интенсивной иммунотерапии, но такая толерантность теряется в процессе гибкого дозирования приблизетельно у половины субъектов и, кроме того, такие инъекции связывают с частыми эпизодами анафилаксии у большинства субъектов, как во время фазы развития, так и во время фазы стабилизации (Nelson et al., J Allergy Clin Immunol 99: 744-51, 1997). Oppenheimer et al. в рамках своего исследования продемонстрировали сходные результаты, снова указывая на то, что активная терапия связана с высоким уровнем общей анафилактической реакции. Сбор данных в этом исследовании был прекращен после того, как введение экстракта арахиса субъекту с рандомизированным плацебо привело к их смерти, подчеркивая опасность этого состояния (Oppenheimer et al., J Allergy Clin Immunol 90: 256-62, 1992). Недавние исследования оральной иммунотерапии непросеянной арахисовой мукой дали обнадеживающий результат, что десенсибилизация возможна, но наблюдаемые побочные реакции указывают на основные проблемы безопасности (Hofmann et al. J. Allergy Clin. Immunol. 124, 286, 2009; Jones et al J. Allergy Clin. Immunol. 24, 292, 2009; Clark et al. Allergy 64, 1218,2009; Varshney et al. J Allergy Clin Immunol. 127(3):654-60, 2011; Varshney et al. J Allergy Clin Immunol. 124(6):1351-2, 2009; Anagnostou et al. Clin Exp Allergy. 41(9):1273-81, 2011; Allen & O'Hehir. Clin Exp Allergy. 41(9):1172-4, 2011; Yuetal Int Arch Allergy Immunol. 159(2): 179-182, 2012; Thyagarajan et al. J Allergy Clin Immunol. 126(l):31-2, 2010; Blumchen et al. J Allergy Clin Immunol. 126(1):83-91, 2010). Даже за исключением детей, склонных к тяжелым симптомам или астме, об анафилактическом эпизоде сообщалось в двух исследованиях, в одном случае во время начальной пищевой провокации (Clark et al. Allergy 64,1218, 2009), а в другом случае во время лечения ребенка, который ранее не испытывал анафилаксии (Hofmann et al. J. Allergy Clin. Immunol. 124, 286, 2009).
Разработка новых стратегий преодоления осложнений, связанных с аллерговакцинацией, зависит от точного понимания иммунологической основы для успешной иммунотерапии, а также ее побочных эффектов. Давно установлено, что заболеваемость в связи с аллерговакцинацией обусловлена перекрестным связыванием IgE и что это действие не требуется для того, чтобы такая терапия была эффективной (Litwin et al., Int Arch Allergy Appl Immunol 87: 361-61, 998). Известно также, что одним из важнейших эффектов иммунотерапии в достижении толерантности является ее способность изменять преобладающий фенотип конкретной Т-клетки от TH2 до регуляторного фенотипа. Эти регуляторные Т-клетки действуют посредством образования противовоспалительных цитокинов IL-10 и/или TGFβ.(Akdis & Akdis, J Allergy Clin Immunol. 123:735-46, 2009; Akdis & Akdis, Nature Reviews: Drug Discovery. 8:645-60. 2009; Akdis & Akdis, J Allergy Clin Immunol 127:18-27, 2011).
Основное различие гуморального и лимфоцитарного ответов заключается в распознавании антигена: антитела распознают конформационные эпитопы в зависимости от молекулярной третичной структуры, тогда как CD4+ Т-клетки распознают короткие линейные пептиды. Эта разница в распознавании антигена является основой многих новых стратегий иммунотерапии, в том числе с применением пептидов, основанных на Т-клеточных эпитопах, мутантах В-клеточных эпитопов и измененных пептидных лигандах (Rolland et al. Pharmacology & Therapeutics 121:273-284, 2009). Все подобные способы основаны на изменении или отсутствии молекулярной третичной структуры, так что теряются перекрестное связывание IgE и активация эффекторной клетки. Пептидная иммунотерапия представляет собой способ, по отношению к которому существуют данные об эффективности, документируемые как в случае аллергии на кошачью перхоть, так и в случае аллергии на пчелиный яд. Три различных исследования показали, что при отсутствии каких-либо системных побочных эффектов толерантность по отношению к основному аллергену пчелиного яда фосфолипазе А2 (PLA2) может быть достигнута с применением последовательностей, содержащих Т-клеточные эпитопы (Muller et al. J Allergy Clin Immunol. 101: 747-54, 1998; Tarzi et al. Clin Exp Allergy. 36: 465-74, 2006; Fellrath et al. J Allergy Clin Immunol. 111: 854-61, 2003), в то время как несколько исследований показали, что пептиды, основанные на структуре основного аллергена кошек Fel d 1, могут быть применены, чтобы вызвать сниженный клинический ответ (Norman et al.,Am JRespir Crit Care Med 154: 1623-8, 1996; Marcotte et al., J Allergy Clin Immunol 101: 506-13, 1998; Pene et al., J Allergy Clin Immunol 102: 571-8, 1998; Oldfield et al. Lancet 360:47-53, 2002; Alexander et al. Clin Exp Allergy 35: 52-8, 2004; Alexander et al. Allergy 60:1269-74, 2005). Совсем недавно исследование фазы На подтвердило безопасность, переносимость и потенциальную эффективность смеси с Fel d 1, состоящей из семи пептидов (Toleromune Cat©, Cicassia Ltd., Oxford, UK) (Worm et al. J Allergy Clin Immunol. 127: 89-97, 2011), а в настоящее время ведется исследование Phase lib (Moldaver & Larche. Allergy. 66: 784-91, 2011). Решающее значение в развитии подобных стратегий имеет сохранение Т-клеточных эпитопов, чтобы обеспечить возможность индукции фенотипического изменения Т-клеток.
Способность связываться непосредственно с молекулами МНС класса II позволяет пептидам презентироваться "непрофессиональной" или незрелой АПК без провоспалительных и костимулирующих сигналов, которые способствуют индукции толерантности, анергии и/или подавляющей активности в отвечающих Т-клетках (Moldaver & Larche, Allergy 66: 784-91, 2011). Это также позволяет пептидам презентироваться чаще, чем пептиды, полученные из целой молекулы (Santambrogio et al. Proc Natl Acad Sci USA, 1999, 96:15056-61), и поскольку они также более безопасны, чем весь аллерген, пептиды могут презентироваться при более высоких концентрациях, при этом реполяризующая Т-клетка отвечает более эффективно.
Важно отметить, что нацеливание Т-клеток, специфичных по отношению к доминирующим эпитопам основных аллергенов, может изменить ответы на экстракты цельных аллергенов (связанное подавление). Многие исследования, сообщающие об успешной пептидной иммунотерапии на мышиных моделях аллергии, показали, что введение пептидов доминантных Т-клеточных эпитопов основных аллергенов индуцирует толерантность не только к этим пептидам, но и к очищенному аллергену и экстрактам цельных аллергенов (Yang et al. Clin Exp Allergy 40(4):668-78, 2010; Yoshitomi etal. JPeptSci. 13(8):499-503, 2007; Marazuela et al. Mol Immunol. 45(2):438-45, 2008; Rupa et al. Allergy. 67(l):74-82, 2012; Hoyne et al. J Exp Med. 178(5): 1783-8,1993; Hall etal. Vaccine. 21(5-6):549-61,2003).
Таким образом, существует необходимость как в идентификации основных аллергенов арахиса, так и в определении Т-клеточных эпитопов этих аллергенов. Идентификация, характеризация и анализ этих эпитопов являются критичными для разработки специфической диагностической и иммунотерапевтической методологии. В связи с этим, хоть молекула аллергена арахиса Ara h 1 и была ранее предметом анализа, идентификация коровых эпитопных областей Т-клеток, которые имеют важное значение для разработки эффективной вакцины, не была осуществлена. Более того, предыдущие исследования были ограничены тем, что они были основаны на применении тетрамеров HLA-DR, таким образом, что препятствуют выявлению эпитопов, презентируемых другими типами HLA. Поскольку эффективность вакцины в популяции требует, чтобы эпитопы, которые являются предметом обсуждения, могли презентироваться целым рядом различных типов HLA, существует потребность не только в идентификации Т-клеточных эпитопов внутри молекулы Ara h 1, но и, кроме того, в идентификации эпитопов, которые являются и доминирующими, и могут эффективно презентироваться разнообразными типами HLA, которые являются репрезентативными для популяции.
В работе, предшествующей данному изобретению, были идентифицированы доминантные, HLA-вырожденные коровые эпитопные области Ara h 1. Эта группа коровых эпитопных областей является уникальной с точки зрения ее особенно высокого уровня эффективности. В отличие от ранее изученных 20-мерных пептидов Ara h 1, которые были идентифицированы на основании только их способности демонстрировать некоторый уровень реактивности Т-клеток, последовательности по данному изобретению представляют собой выбранный набор коровых Т-клеточных эпитопных областей, которые являются и иммунодоминантными, по сравнению с другими пептидными фрагментами Ara h 1, и HLA-вырожденными в том, что они соединяются с двумя или более типами HLA. Более того, эти эпитопные коровые области презентируются молекулами HLA-DQ. Молекулы HLA-DQ являются более консервативными в смешанных популяциях, чем молекулы HLA-DR. Соответственно, пептиды, презентируемые на HLA-DQ, обеспечивают условия более широкого охвата популяции. Идентификация этой конкретной группы коровых эпитопных областей способствовала, впервые, разработке эффективных способов лечения состояний, характеризующихся аберрантными, неадекватными или иными нежелательными иммунными ответами Ara h 1 или его производного или гомолога, другой аллергией на лесные орехи или аллергией на композицию, такую как пищевые продукты, содержащие аллерген Ara h 1. Идентификация этих эпитопов также способствует развитию соответствующей диагностической технологии
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном описании изобретения и в формуле изобретения, которые следуют далее, если контекст не требует иного, слово "содержать" и его вариации, такие как "содержит" и "содержащий", как следует понимать, означают включение указанного целого числа или этапа или группы целых чисел или этапов, но не исключение любого другого целого числа или этапа или группы целых чисел или этапов.
Как применяют в данном документе, термин "полученный из" должен быть принят для того, чтобы указать, что конкретное целое число или группа целых чисел происходит из указанных видов, но не обязательно были получены непосредственно из указанного источника. Дополнительно, как применяют в данном документе, слова в единственном числе означают также и множественное число, если из контекста очевидно не следует иное.
Если не указано иначе, все технические и научные термины, применяемые в данном документе, имеют такое же значение, которое обычно понимает специалист с обычной квалификацией в данной области техники, к которой это изобретение принадлежит.
Спецификация субъекта содержит информацию об аминокислотной последовательности, полученной с применением программы Patentln Version 3.5, представленной в данном документе после библиографии. Каждую аминокислотную последовательность определяют в перечне последовательностей с помощью цифрового индикатора <210>, который идет после идентификатора последовательности (например, <210>1, <210>2 и т.д.). Длина, тип последовательности (белок и т.д.) и источник организма для каждой последовательности указывает информацию, представленную в числовых полях-индикаторах <211>, <212> и <213>, соответственно. Аминокислотные последовательности, указанные в описании, определяют с помощью индикатора SEQ ID NO: после идентификатора последовательности (например, SEQ ID NO: 1, SEQ ID NO: 2 и т.д.). Идентификатор последовательности, указанный в спецификации, коррелирует с информацией, представленной в числовом поле-индикаторе <400> в перечне последовательностей, за которым следует идентификатор последовательности (например, <400>1, <400>2 и т.д.). То есть последовательность SEQ ID NO: 1, как подробно описано в спецификации, коррелирует с последовательностью, указанной в <400>1 в перечне последовательностей.
Один аспект данного изобретения относится к композиции, содержащей одну или более коровых эпитопных областей Т-клеток Ara h 1, выбранных из группы, состоящей из:

или их функциональных производных или гомологов.
В родственном аспекте данное изобретение относится к композиции, содержащей один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат одну или более коровых эпитопных областей Т-клетки Ara h 1, выбранных из списка, состоящего из:


или их функциональных производных или гомологов.
В одном варианте реализации предыдущих аспектов изобретения указанные пептиды или эпитопы способны модифицировать функции Т-клеток, при условии, что присутствуют в Т-клетках, выделенных у субъектов, имеющих состояние, характеризующееся аберрантным, нежелательным или иным неадекватным иммунным ответом на Ara h 1, но пептиды которых не могут связываться с Ara h 1 - специфическим IgE.
В дополнительном родственном аспекте предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат одну или более коровых эпитопных областей Т-клетки Ara h 1, выбранных из списка, состоящего из:

или функциональные производные или гомологи, пептиды которой способны снижать гиперчувствительность Ara h 1 или гиперчувствительность к композиции, содержащей Ara h 1 при введении субъекту, имеющему состояние, характеризующееся указанной гиперчувствительностью.
В дополнительном родственном аспекте предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат эпитоп NEGVIVKVSK (SEQ ID NO: 3) вместе с одной или несколькими коровыми эпитопными областями Т-клетки Ara h 1, выбранными из списка, состоящего из:

или их функциональных производных или гомологов.
В дополнительном родственном аспекте предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат эпитоп EGALML (SEQ ID NO: 6) вместе с одной или несколькими коровыми эпитопными областями Т-клетки Ara h 1, выбранными из списка, состоящего из:

или их функциональных производных или гомологов.
В тех случаях, когда композиция выполнена таким образом, что коровые эпитопные области изобретения включены как часть более крупного пептида, следует понимать, что любой данный пептид может быть сконструирован для того, чтобы включать одну или более коровых эпитопных областей. С этой целью, в одном варианте реализации по данному изобретению, один или более пептидов целевой композиции выбирают из списка:

В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 15, 16 или 17, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-14 или 18-33.
В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 23, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-22 или 24-33.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1: Частотный профиль респондера донора в случае 20-мерных пептидов Ara h 1
Частоты респондера донора в случае распознавания ТКЛ 20-мерных пептидов Ara h 1 (n=18 субъектов с аллергией на арахис).
Фигура 2: Картирование коровых Т-клеточных эпитопов в пределах 20-мерных пептидов 50 и 51 Ara h 1
Пролиферация ТКЛ, специфическая к 20-мерам, по отношению к усеченным наборам пептидов. Типичная ТКЛ показана для пептидов 50 (А) и 51 (В) (имеется в виду имп./мин повторяющихся лунок +SD). В верхних частях указывают эпитоп в перекрывании между 20-мерами (n=2; 3 ТКЛ). В нижних частях указывают эпитопы, уникальные для каждого 20-мера; А) n=3; 6 ТКЛ. В) n=4; 7 ТКЛ. Последовательности эпитопа, распознанные представленной ТКЛ, выделены жирным шрифтом, а 'соединенные эпитопы', распознанные всеми конкретными ТКЛ, подчеркнуты.
Фигура 3: Активация базофила в ответ на пептиды потенциального Ara h 1
Коробчатая диаграмма демонстрирует процент активированных (CD63h1) базофилов (IgEh1) в ответ на Ara h 1 или потенциальные пептиды в случае семи субъектов с аллергией на арахис. Отрицательный контроль был без антигена (без стимуляции), а положительные контроли представляли собой анти-IgE, fMLP и ЭСА. Усы показывают значения от минимального до максимального.
Фигура 4: Типичный анализ на основе CFSE для определения пролиферации CD4+ Т-клеток в РВМС
Распространение CF SE-меченого РВМС от субъекта 26 с аллергией на арахис за следующие 7 дней стимуляции с выбранными 20-мерными пептидами Ara h 1. Отдельно взятая среда (без антигена) или экстракт сырого арахиса (ЭСА) обеспечивают отрицательный и положительный контроли, соответственно. По меньшей мере, анализируют 10000 живых CD4+ Т-клеток на образец. На вставках указан процент CD4+CFSElo (пролиферирующих) Т-клеток от общего количества CD4+ Т-клеток с индексами стимуляции (ИС) в скобках.
Фигура 5: Типичная специфичность рестрикции HLA класса II распознавания Т-клеточного эпитопа
Пролиферацию специфической ТКЛ в выбранных эпитопах в присутствии HLA-DR (кружки), -DQ (квадраты) или -DP (треугольники) мАт (Ai и Bi) или изотипических контрольных антител (10 мкг/мл) (АН и Bii), (имеется в виду имп./мин повторяющихся лунок +SD). Графики демонстрируют выборочные данные для HLA-DR-ограниченного эпитопа (442-458) (А) и HLA-DQ-ограниченного эпитопа (507-524) (В).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, в частности, на идентификации HLA-вырожденных коровых эпитопных областей доминантных Т-клеток Ara h 1. Идентификация этих иммунодоминантных коровых эпитопных областей позволяет улучшить диагностическую методологию и разработать значительно более эффективные терапевтические и профилактические композиции и подходы к лечению, чем доступные на сегодняшний день, для условий, таких как, но не ограничиваясь этим, аллергия на арахис.
Соответственно, один аспект данного изобретения относится к композиции, содержащей одну или более коровых эпитопных областей Т-клеток Ara h 1, выбранных из группы, состоящей из:

или их функциональных производных или гомологов.
В родственном аспекте данное изобретение относится к композиции, содержащей один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат одну или более коровых эпитопных областей Т-клетки Ara h 1, выбранных из списка, состоящего из:


или их функциональных производных или гомологов.
В отдельном варианте реализации предыдущих аспектов изобретения указанные пептиды или коровые эпитопные области способны модифицировать функции Т-клеток, при условии, что присутствуют в Т-клетках, выделенных у субъектов, имеющих состояние, характеризующееся аберрантным, нежелательным или иным неадекватным иммунным ответом на Ara h 1, или аллерген присутствует в композиции, такой как пищевые продукты, включающие Ara h 1, но пептиды которых не могут связываться с Ara h 1-специфическим IgE.
Без ограничения данного изобретения каким-либо образом, арахис содержит большое количество белков, которым соответствует множество различных полос, различимых на SDS-PAGE, в зависимости от используемой методологии. После жидкостной хроматографии высокого давления видимыми являются до 53 полос (de Jong et al., Clin Exp Allergy 28: 743-51, 1998). Только два из этих белков могут быть классифицированы в качестве основных аллергенов с применением стандартных критериев, при условии, что реактивность IgE наблюдается у более чем 50% от популяции с аллергией на арахис; эти белки называются Ara h 1 и Ara h 2 (Burks et al., Allergy 53: 725-30, 1998). Хотя ряд исследований и показал, что Ara h 2 является более мощным из этих двух аллергенов (Blanc et al. Clin Exp Allergy. 2009; 39(8): 1277-85; Koppelman et al. Clin Exp Allergy. 2004; 34(4):583-90; Palmer et al. Clin Immunol. 2005; 115(3):302-12), Ara h 1 также играет важную роль в патогенезе аллергии на арахис, причем многочисленные исследования сообщают о сильных корреляциях между тяжестью симптомов и реактивностью IgE в отношении как Ara h 1, так и Ara h 2 (Glaumann et al. Allergy. 2012; 67(2):242-7; Chiang et al. Pediatr Allergy Immunol. 2009; 21(2 Pt 2):e429-38; Asarnoj et al. Allergy. 2010, 65(9): 1189-95; Moverare et al. Int Arch Allergy Immunol 2011; 156(3):282-90; Lin et al. J Microbiol Immunol Infect. 2012; Peeters et al. Clin Exp Allergy. 2007; 37(1):108-15). Ara h 1 является наиболее распространенным основным аллергеном в арахисе, составляя 12-16% от общего количества белка арахиса (Koppelman et al. Allergy. 2001; 56(2): 132-7).
Тем не менее, не ограничивая каким-либо образом данное изобретение, аллерген Ara h 1 представляет собой гликопротеин запасных белков семян семейства 7S или вицилин. Концентрация Ara h 1 в арахисах возрастает с увеличением размера ядра (4-16 мг экстрагированного Ara h 1/ г арахиса), поэтому экспрессия белка связана со зрелостью арахиса (Pomes et al. 2006, Clin. Exp. Allergy 36(6):824-30). Ara h 1 представляет собой гомотример, удерживаемый вместе посредством гидрофобных областей на дистальных концах мономеров, где расположено большинство эпитопов, связывающих IgE. Каждый мономер 64,5 кДа имеет мотив cupin, который состоит из двух коровых β-цилиндров, каждый из которых связан с петельным доменом из α-спиралей.
Ссылку на "Ara h 1" следует понимать как ссылку на все формы этой молекулы, в том числе ссылку на любые изоформы, которые могут возникнуть в связи с альтернативным сплайсингом мРНК Ara h 1, функциональные мутанты или полиморфные формы Ara h 1. Следует также иметь в виду, что это дополнительно распространяется на любой белок, кодируемый геном Ara h 1, любой полипептид субъединицы, например, форм-предшественников, которые могут быть получены, существующие либо в виде мономера, мультимера, либо слитого белка. Она также включает ссылку на аналоги или эквиваленты Ara h 1, которые могут наблюдаться при условии, что продукт, который, естественно, включает Ara h 1, является получаемым синтетически с целью получения продукта, например, в виде пищевой добавки. Настоящее изобретение, таким образом, предлагает эпитопы и способы их применения в диагностике и лечении любого состояния, характеризующегося повышенной чувствительностью к Ara h 1 или Ara h 1 - подобной молекуле, такого как аллергия на арахис, аллергия на лесные орехи или аллергия на антиген, присутствующий в такой композиции, как пищевые продукты, в состав которых также входит Ara h 1. Предпочтительно, указанный Ara h 1 содержит последовательность, представленную в SEQ ID NO: 11.
Ссылку на "Т-клетки" следует понимать как ссылку на любую клетку, содержащую Т-клеточный рецептор. В связи с этим Т-клеточный рецептор может содержать любую одну или более из α, β, γ и δ цепей. Настоящее изобретение не предназначено быть ограниченным каким-либо конкретным функциональным подклассом Т-клеток, хотя, в предпочтительном варианте реализации изобретения целевая Т-клетка представляет собой Т-хелперную клетку и, еще более предпочтительно, клетку типа Th2 и/или клетку Treg. В связи с этим, ссылку на "изменение функции Т-клеток" следует понимать как ссылку на изменение какой-либо одной или нескольких функций, которые способна выполнять Т-клетка. Например, целевой функцией может быть пролиферация, дифференцирование или другая форма клеточной функциональной активности, такая как образование цитокинов. В одном варианте реализации изобретения целевая функциональная активность представляет собой пролиферацию.
С точки зрения "модификации функции" Т-клеток, выделенных у субъектов, имеющих состояние, характеризующееся аберрантным, нежелательным или неадекватным иммунным ответом на Ara h 1 или на композицию, которая содержит Ara h 1, следует понимать, что это не обязательно ссылка на изменение функции всех Т-клеток в данном биологическом образце, а, скорее всего, на самом деле, существует для отражения модификации функционирования лишь некоторых из Т-клеток в образце. Например, только часть клеток Т-хелперов в данном образце Т-клеток может функционально реагировать на контакт с целевым пептидом. Такой частичный ответ следует понимать как попадающий в пределы объема по данному изобретению. Следует также понимать, что Т-клетки, которые получены от субъекта, могут быть свежесобранными Т-клетками или они могут претерпевать некоторую форму in vitro или in vivo манипуляции перед тестированием. Например, Т-клеточные линии могут быть получены из образца клеток, и именно эти Т-клеточные линии, которые затем образуют субъект, полученный из Т-клеточной популяции, испытываемую в соответствии с данным изобретением. В тех случаях, когда целевой функциональной активностью является пролиферация Т-клеток, анализ пролиферации Т-клеток проводят, предпочтительно, таким образом, как описано в данном документе. Еще более предпочтительно, целевая модификация функции Т-клеток представляет собой индукцию пролиферации. В этом отношении, ссылка на " реактивную в отношении Ara h 1" Т-клетку следует понимать как ссылку на Т-клетку, которая функционально отвечает презентирование HLA Т-клеточного эпитопа Ara h 1. Аналогичным образом, ссылку на "Ara h 1 - специфический" IgE следует понимать как ссылку на IgE, направленный на В-клеточные эпитопы Ara h 1. Ссылка на "аберрантный, нежелательный или иной нецелесообразный" иммунный ответ должна быть понята как ссылка на любую форму физиологической активности, которая включает активацию и/или функционирование одной или нескольких иммунных клеток, где такая активность является неприемлемой, в которой она имеет неподходящий тип или проистекает в неуместной степени. Он может быть аберрантным, при этом, согласно известным иммунологических принципам, он либо не происходит, когда должен, либо, в ином случае, может произойти, когда не должен. В другом примере, иммунный ответ может быть неуместным в том, что он является физиологически нормальным ответом, но который не является необходимым и/или нежелательным, как это происходит по отношению к ответам гиперчувствительности типа I на безвредные аллергены. В контексте по данному изобретению, этот иммунный ответ может быть направлен на Ara h 1 или он может быть направлен на другой аллерген, который присутствует в композиции вместе с Ara h 1. Не ограничивая данное изобретение какой-либо теорией или механизмом действия, было установлено, что даже там, где реакция гиперчувствительности направлена на аллерген, отличный от Ara h 1, аллерген, который присутствует в композиции, которая, тем не менее, включает Ara h 1, лечение с помощью способа по данному изобретению, направленного на Ara h 1, тем не менее вызывает положительную модуляцию Th2 и такую функциональность Treg, что гиперчувствительность, которая существует по отношению к несвязанному аллергену, тем не менее уменьшается. Предпочтительно, указанный иммунный ответ представляет собой гиперчувствительность к арахису.
Под "гиперчувствительностью к арахису" имеют в виду индукцию клинических симптомов IgE-опосредованной гиперчувствительности к арахису. Тем не менее, следует понимать, что, хотя клинические симптомы могут быть очевидны, не все такие индивидуумы будут обязательно демонстрировать определяемые уровни специфических к арахису IgE сыворотки крови, которые измеряют с помощью Kallestad Allercoat EAST System (Sanofi-Pasteur Diagnostics, США), хотя такие индивидуумы, тем не менее, как следует понимать, могут попадать в рамки определения тех, которые демонстрируют "гиперчувствительность к арахису". В альтернативном варианте, тестирование может продолжить применение систем Pharmacia или UniCap. Ссылку на "гиперчувствительность к Ara h 1" следует понимать как имеющую соответствующее значение в контексте реактивности в отношении белка Ara h 1.
В дополнительном родственном аспекте предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат одну или более коровых эпитопных областей Т-клетки Ara h 1, выбранных из списка, состоящего из:

или функциональные производные или гомологи, пептиды которой способны снижать гиперчувствительность Ara h 1 или гиперчувствительность к композиции, содержащей Ara h 1 при введении субъекту, имеющему состояние, характеризующееся указанной гиперчувствительностью.
Снижение гиперчувствительности к Ara h 1 (и гиперчувствительность к аллергену в целом) обсуждается более подробно ниже. Вкратце, однако, это может принять форму либо частичного, либо полного снижения чувствительности, либо вызывает толерантность индивидуума либо конкретно к Ara h 1, либо к арахису, либо другим белкам в целом.
Ссылка на "пептид" включает ссылку на пептид, полипептид или белок или их части. Пептид может быть гликозилированным или негликозилированным и/или может содержать ряд других молекул, слитых, сшитых, связанных или иным образом ассоциированных с белком, таким как аминокислоты, липиды, углеводы или другие пептиды, полипептиды или белки. Ссылка далее на "пептид" включает пептид, содержащий последовательность аминокислот, а также пептид, связанный с другими молекулами, такими как аминокислоты, липиды, углеводы или другие пептиды, полипептиды или белки.
"Производные" включают фрагменты, сегменты, части и варианты из натуральных, синтетических или рекомбинантных источников, в том числе слитых белков. Части или фрагменты включают, например, активные области целевого пептида. Производные могут быть получены с помощью вставки, делеции или замены аминокислот. Аминокислотные инсерционные производные включают аминокислоты и/или карбоксильные концевые слияния, а также вставки внутри одной или нескольких аминокислот. Инсерционные варианты аминокислотных последовательностей представляют собой те, в которых один или более аминокислотных остатков вводят в заранее определенном сайте в белок, хотя также возможны случайные вставки с помощью подходящего скрининга полученного продукта. Делеционные варианты характеризуются удалением одной или нескольких аминокислот из последовательности.
Варианты с замещенными аминокислотами представляют собой такие, в которых по меньшей мере один остаток в последовательности был удален, а другой остаток вставлен на его место. Пример вариантов с замещенными аминокислотами представляют собой консервативные аминокислотные замены. Консервативные аминокислотные замены обычно включают замены в пределах следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин и глутамин; серии и треонин; лизин и аргинин; и фенил аланин и тирозин. Присоединения к аминокислотным последовательностям включают слияния с другими пептидами, полипептидами или белками.
Химические и функциональные эквиваленты целевого пептида следует понимать как молекулы, обладающие какой-либо одной или несколькими функциональными активностями этих молекул, и могут быть получены из любого источника, например, быть химически синтезированными или определенными с помощью способов скрининга, таких как скрининг натуральных продуктов.
Гомологи включают пептиды, полученные из других, отличных от арахиса сортов, таких как пептиды, полученные из других лесных орехов. Аналоги, предусмотренные в данном документе, включают, но не ограничиваясь этим, модификацию в боковых цепях, включение не встречающихся в природе аминокислот и/или их производных во время синтеза пептида, полипептида или белка и применение сшивающих средств и других способов, которые накладывают конформационные ограничения на белокподобные молекулы или их аналоги. Мутанты включают молекулы, которые демонстрируют измененную функциональную активность (например, пептиды Ara h 1, которые экспрессируют один или более Т-клеточных эпитопов, но не имеют реактивности В-клеток).
Примеры модификаций боковой цепи, рассматриваемые в данном изобретении, включают модификацию аминогрупп, такие как с помощью восстановительного алкилирования по реакции с альдегидом с последующим восстановлением с помощью NaBH4; амидинирования с метилацетимидатом; ацилирования уксусным ангидридом; карбамоилирования аминогрупп цианатом; тринитрибензилирования аминогрупп 2,4,6-тринитробензолсульфоновой кислоты (TNBS); ацилирования аминогрупп янтарным ангидридом и тетрагидрофталевым ангидридом; и пиридоксилирования лизина пиридоксаль-5-фосфатом с последующим восстановлением с помощью NaBH4.
Группа гуанидина остатков аргинина может быть модифицирована с образованием гетероциклических продуктов конденсации с помощью таких реагентов, как 2,3-бутандион, фенилглиоксаль и глиоксаль.
Карбоксильная группа может быть модифицирована с помощью активации via образования О-ацилизомочевины с последующей дериватизацией, например, в соответствующий амид.
Сульфгидрильные группы могут быть модифицированы такими способами, как карбоксиметилирование иодуксусной кислотой или иодацетамидом; окисление пермуравьиной кислотой до цистеиновой кислоты; образование смешанных дисульфидов с другими тиоловыми соединениями; реакция с малеимидом, малеиновым ангидридом или другим замещенным имидом малеиновой кислоты; формирование ртутных производных с применением 4-хлоромеркурибензоата, 4-хлоромеркурифенилсульфоновой кислоты, хлорида фенилртути, 2-хлоромеркури-4-нитрофенола и других ртутьсодержащих соединений; карбамоилирование цианатом при щелочном рН.
Остатки триптофана могут быть модифицированы, например, окислением N-бромсукцинимидом или алкилированием индольного кольца с помощью 2-гидрокси-5-нитробензилбромида или сульфенильных галогенидов. Остатки тирозина, с другой стороны, могут быть изменены с помощью нитрования тетранитрометаном с образованием производного 3-нитротирозина.
Модификация имидазольного кольца остатка гистидина может быть выполнена с помощью алкилирования производными иодуксусной кислоты или N-карбоэтоксилирования с диэтилпирокарбонатом.
Примеры включения не встречающихся в природе аминокислот и производных в процессе синтеза белка включают, но не ограничиваясь этим, применение норлейцина, 4-аминомасляной кислоты, 4-амино-3-гидрокси-5-фенилпентановой кислоты, 6-аминокапроновой кислоты, трет-бутилглицина, норвалина, фенилглицина, орнитина, саркозина, 4-амино-3-гидрокси-6-метилгептановой кислоты, 2-тиенилаланина и/или D-изомеров аминокислот.Список не встречающихся в природе аминокислот, предусмотренных в данном документе, приведены в Таблице 1.



Сшивающие средства могут быть применены, например, для стабилизации 3D-конформаций с применением гомо-бифункциональных сшивающих средств, таких как бифункциональные имидоэфиры, имеющие разделительные группы (СН2)n с от n=1 до n=6, глутаральдегид, N-гидроксисукцинимидные сложные эфиры и гетеро-бифункциональные реагенты, которые обычно содержат амино-реактивный фрагмент, такой как N-гидроксисукцинимид и другой реакционноспособный фрагмент, специфический к другой группе.
Возможно изменить структуру пептида согласно изобретению для различных целей, таких как для увеличения растворимости, повышения терапевтической или профилактической эффективности, повышения стабильности и увеличения устойчивости к протеолитической деградации. Может быть получен модифицированный пептид, в котором была изменена последовательность аминокислоты, например, с помощью аминокислотной замены, делеции или присоединения, для того, чтобы изменить иммуногенность и/или снизить аллергенность. Аналогичным образом, для получения того же результата, к пептидам по изобретению могут быть добавлены компоненты.
Например, пептид может быть модифицирован таким образом, чтобы приобрести способность индуцировать Т-клеточную анергию. В этом случае, критические остатки для связывания рецепторов Т-клеток могут быть определены с применением известных технологий (например, замены каждого остатка и определения наличия или отсутствия реактивности Т-клеток). В одном примере, эти остатки, которые, как показано, важны для взаимодействия с Т-клеточным рецептором, могут быть изменены с помощью замены незаменимой аминокислоты на другой, предпочтительно, подобный остаток аминокислоты (консервативное замещение), присутствие которого, как показано, изменяет реакционную способность Т-клеток или функционирование Т-клеток. Кроме того, эти аминокислотные остатки, которые не являются незаменимыми при взаимодействии Т-клеточного рецептора, могут быть изменены с помощью замены на другую аминокислоту, чье включение затем может изменить реакционную способность Т-клеток или функционирование Т-клеток, но не, например, устранить связывание с соответствующими белками МНС. В еще одном примере, могут быть созданы мутантные пептиды, которые демонстрируют нормальное связывание Т-клеток, но нейтрализует связывание IgE.
Иллюстративные консервативные замены подробно описаны в Таблице 2 ниже и включают:

Подобные модификации будут приводить к получению молекул, входящих в пределы объема "мутантов" целевого пептида, как определено в данном документе. "Мутанты" следует понимать, как ссылку на пептиды, которые имеют одну или более структурных особенностей или функциональные активности, которые отличаются от тех, которые демонстрируются эквивалентом немутировавшего пептида.
Пептиды по изобретению могут быть также модифицированы для того, чтобы включать один или более полиморфизмов, происходящих из природных аллельных вариаций и D-аминокислот, ненатуральных аминокислот или аналогов аминокислот, которые могут быть замещены в пептидах с получением модифицированных пептидов, попадающих в пределы объема изобретение. Пептиды с помощью известных технологий также могут быть модифицированы конъюгацией с полиэтиленгликолем (ПЭГ). Репортерные группы также могут быть добавлены для облегчения очистки и потенциально увеличивают растворимость пептидов согласно изобретению. Для введения модификаций, которые могут быть полезными в широком диапазоне целей, также могут быть применены другие известные типы модификаций, в том числе вставки сайтов расщепления специфическими эндопротеазами, присоединение функциональных групп или замена гидрофобных остатков с менее гидрофобными остатками, а также сайт-направленного мутагенеза ДНК, кодирующей пептиды по изобретению. Различные модификации пептидов согласно изобретению, которые были упомянуты выше, упоминают только в виде примера и предназначены только для того, чтобы свидетельствовать о широком диапазоне модификаций, которые могут быть произведены.
Как подробно описано выше, данное изобретение относится к пептидам, которые сохраняют все или некоторые из их способности взаимодействовать с Т-клетками, но проявляют частично или полностью ингибированную, нейтрализованную или иным образом отрицательно регулированную реактивность антител. Осуществление отрицательной регуляции реактивности антител может быть достигнуто любым подходящим способом, способы которых хорошо известны специалистам в данной области техники. Например, в том случае, когда В-клеточный эпитоп определяют с помощью его линейной аминокислотной последовательности, можно добавлять, удалять или заменить один или более аминокислотных остатков, для того, чтобы выполнить мутантную линейную последовательность, отличающуюся от последовательности, встречающейся в природе. В тех случаях, когда эпитоп может быть определен дополнительно, или в альтернативном варианте с помощью конформационного эпитопа, можно обратиться к нарушению этой конформации, нарушая 2ю или, при условии, что существуют гомодимеры или гетеродимеры, 3ю структуру пептида. Это может быть достигнуто, например, с помощью нарушением формирование связей, таких как дисульфидные связи, которые, как известно, стабилизируют 2ю и/или 3ю структуры. С точки зрения Т-клеточных эпитопов, определенных выше, эти эпитопные область не содержат эпитопы В-клеток.
Эпитопы, определенные с помощью SEQ ID NO: 1-10, представляют собой коровые эпитопные области Т-клетки Ara h 1, которые были определены также с целью продемонстрировать вырождение HLA, в частности, презентирование с помощью HLA-DQ, что крайне важно с точки зрения создания эффективного режима лечения. Следует понимать, что композиция по данному изобретению может включать одну из перечисленных коровых эпитопных областей или может содержать две или более из указанных коровых эпитопных областей.
В одном варианте реализации изобретения указанная композиция содержит любые две эпитопные области, три эпитопные области, четыре эпитопные области, пять эпитопных областей, шесть эпитопных областей, семь эпитопных областей, восемь эпитопных областей, девять эпитопных областей или десять эпитопных областей.
В одном варианте реализации изобретения предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат эпитоп NEGVIVKVSK (SEQ ID NO: 3) вместе с одной или несколькими коровыми эпитопными областями Т-клетки Ara h 1, выбранными из списка, состоящего из:

или их функциональных производных или гомологов.
В еще одном варианте реализации изобретения предлагают композицию, содержащую один или более пептидов, каждый из пептидов которой имеет до 60 последовательно расположенных аминокислот в длину и пептиды которой содержат эпитоп EGALML (SEQ ID NO: 6) вместе с одной или несколькими коровыми эпитопными областями Т-клетки Ara h 1, выбранными из списка, состоящего из:

или их функциональных производных или гомологов.
В соответствии с этими аспектами, в других вариантах реализации изобретения указанная композиция содержит по меньшей мере три пептида, по меньшей мере четыре пептида, по меньшей мере пять пептидов, по меньшей мере шесть пептидов, по меньшей мере семь пептидов, по меньшей мере восемь пептидов, по меньшей мере девять пептидов или десять пептидов.
Как подробно описано выше, композиция по данному изобретению содержит HLA-вырожденные коровые эпитопные области Т-клеток Ara h 1. Указанные коровые эпитопные области могут быть введены в виде отдельных пептидов или они могут образовывать часть более крупной структуры, такой как более длинный пептид или не-пептидная структура. Как будет оценено специалистами в данной области техники, эпитопная область иногда может быть слишком мала, сама по себе, чтобы индуцировать иммунный ответ.Гаптены являются примером этого типа эпитопа. Коровые эпитопные области по данному изобретению, следовательно, могут быть составлены вместе с любой белковой или небелковой молекулой-носителем, так, чтобы достигать необходимого уровня иммуногенности.
В одном варианте реализации изобретения целевые коровые эпитопные области образуют часть более крупного пептида до 30 последовательно расположенных аминокислот в длину. Целевой пептид может иметь 10, 11, 12, 13, 14, 15, 16,17,18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот в длину. Предпочтительно, целевой пептид имеет 12-25 аминокислот в длину, 15-25 аминокислот в длину, 15-20 аминокислот в длину или 10-20 аминокислот в длину.
В тех случаях, когда композиция выполнена таким образом, что коровые эпитопные области изобретения содержатся в составе более крупного пептида, следует понимать, что любой данный пептид может быть сконструирован для того, чтобы включать одну или более коровых эпитопных областей. С этой целью, в одном варианте реализации по данному изобретению, один или более пептидов целевой композиции выбирают из списка:

В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 15, 16 или 17, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-14 или 18-33.
В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 23, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-22 или 24-33.
В еще одном аспекте, один или более пептидов целевой композиции выбирают из списка:

В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 15 или 16, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-14, 18-26 или 28-32.
В дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 23, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 12-16, 18-22, 24-26 или 28-32.
В еще одном отличном варианте реализации изобретения, один или более пептидов целевой композиции выбирают из списка:

В дополнительном аспекте этого вариант реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 15, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 14, 21, 23, 24, 29 или 30.
В еще одном дополнительном аспекте этого варианта реализации изобретения указанная композиция содержит пептид, определенный как SEQ ID NO: 23, вместе с одним или несколькими пептидами, определенными как SEQ ID NO: 14, 15, 21, 24, 29 или 30.
В еще одном варианте реализации изобретения указанная композиция содержит пептиды, определенные как SEQ ID NO: 14,15, 21, 23, 24, 29 и 30.
Еще в одном варианте реализации изобретения указанная композиция содержит пептиды, определенные как SEQ ID NO: 14, 16, 21, 23, 24, 29 и 30.
В еще одном отличном варианте реализации изобретения указанная композиция содержит пептиды, определенные как SEQ ID NO: 14, 15, 22, 23, 24, 29 и 30.
Еще в одном отличном варианте реализации изобретения указанная композиция содержит пептиды, определенные как SEQ ID NO: 14, 15, 21, 23,24, 29 и 32.
В контексте данного изобретения, следует понимать, что там, где делается ссылка на применение пептида, определенного как SEQ ID NO: 14, этот пептид может быть замещен:

В тех случаях, когда делается ссылка на применение пептида, определенного как SEQ ID NO: 15, этот пептид может быть замещен пептидом, определенным как SEQ ID NO: 16 или 17.
В тех случаях, когда ссылка на применение пептида, определенного как SEQ ID NO: 21, этот пептид может быть замещен пептидом, определенным как:

В тех случаях, когда ссылка на применение пептида, определенного как SEQ ID NO: 29, этот пептид может быть замещен пептидом, определенным как:

В тех случаях, когда ссылка на применение пептида, определенного как SEQ ID NO: 30, этот пептид может быть замещен пептидом, определенным как:

В еще одном дополнительном аспекте этих вариантов реализации изобретения указанная композиция содержит 3, 4, 5 или 6 перечисленных пептидов.
В еще одном варианте реализации указанная композиция содержит все 7 пептидов.
Пептиды по данному изобретению могут быть получены с помощью рекомбинантных или синтетических химических средств. В соответствии с предпочтительным аспектом данного изобретения, предлагают рекомбинантный пептид или его мутант, который предпочтительно является иммунологически реактивным к Т-клеткам индивидуумов с гиперчувствительностью к арахису, что выражается с помощью экспрессии в клетке-хозяине, трансформированной вектором, кодирующим пептидную последовательность по данному изобретению. Пептид может быть слит с другим пептидом, полипептидом или белком. Кроме того, пептид может быть получен с помощью технологий химического синтеза, таким образом, как с помощью процедуры твердофазного синтеза по Меррифилду. Кроме того, хотя синтетические пептиды последовательности, приведенные выше, представляют собой предпочтительный вариант реализации изобретения, данное изобретение также относится к биологически чистым препаратам встречающихся в природе пептидов или их фрагментов. Под "биологически чистый" подразумевают препарат, содержащий по меньшей мере около 60%, предпочтительно, по меньшей мере около 70%, или, более предпочтительно, по меньшей мере около 80% и, еще более предпочтительно, по меньшей мере около 90% или более, как определено по массе, активности или другими подходящими способами,
Поэтому данное изобретение следует понимать как охватывающее пептиды, которые содержат по меньшей мере одну коровую эпитопную область Т-клетки Ara h 1, как определено выше, в сочетании с другими аминокислотами (которая может быть или может не быть встречающейся в природе) или другими химическими соединениями. В предпочтительном аспекте изобретения подобные пептиды могут содержать один или более эпитопов Ara h 1, эпитопы которых представляют собой коровые эпитопные области Т-клеток. Пептиды с одним или несколькими эпитопами Ara h 1 являются желательными для повышенной терапевтической эффективности.
В другом аспекте, данное изобретение относится к молекуле нуклеиновой кислоты, содержащей последовательность нуклеотидов, кодирующую или комплементарную последовательности, кодирующей эпитопы и пептиды, как определено выше, или его производное, гомолог или аналог.
Следует понимать, что ссылка на "пептиды" включает ссылку на пептиды, содержащие один или более Т-клеточных эпитопов. Молекула нуклеиновой кислоты, кодирующая целевой пептид, предпочтительно представляет собой последовательность дезоксирибонуклеиновой кислоты, такой как кДНК, или геномную последовательность. Геномная последовательность может содержать экзоны и интроны. Геномная последовательность может также содержать промоторную область или другие регуляторные области.
Молекула нуклеиновой кислоты может быть лигирована с вектором экспрессии, способным к экспрессии в прокариотической клетке (например, Е. coli) или эукариотической клетке (например, дрожжевых клетках, клетках грибов, клетках насекомых, клетках млекопитающих или клетках растений). Молекула нуклеиновой кислоты может быть лигирована или слита или иным образом связана с молекулой нуклеиновой кислоты, кодирующей другой элемент, такой как, например, сигнальный пептид. Она может также содержать дополнительную информацию в виде нуклеотидной последовательности, которая слита, связана или иным образом связана с ним либо на 3', либо на 5' концевых участках, или и на 3', и на 5'-концевых участках. Молекула нуклеиновой кислоты может также быть частью вектора, такого как вектор экспрессии. Последний вариант реализации изобретения обеспечивает получение рекомбинантных форм целевого пептида, и эти формы входят в объем данного изобретения.
Такие нуклеиновые кислоты могут быть применены для рекомбинантного получения Т-клеточных эпитопов Ara h 1 или содержащих их белков путем вставки в соответствующий вектор и трансфекции в подходящую клеточную линию. Такие векторы экспрессии и линии клетки-хозяина также составляют аспект изобретения.
При получении пептидов с помощью рекомбинантных технологий клетки-хозяева трансформируются нуклеиновой кислотой, имеющей последовательность, кодирующую пептид согласно изобретению, или функциональный эквивалент последовательности этой нуклеиновой кислоты культивируют в среде, подходящей для конкретных клеток. Пептиды могут быть очищены от клеточной культуральной среды, клеток-хозяев или их обоих с применением технологий, хорошо известных в данной области техники, таких как ионообменная хроматография, гель-фильтрационная хроматография, ультрафильтрация, электрофорез или иммуноочистка с антителами, специфичными к пептиду.
Нуклеиновые кислоты, кодирующие Ara h 1, или пептиды, содержащие коровые эпитопные области Т-клеток Ara h 1, могут быть экспрессированы в бактериальные клетки, такие как Е. coli, клетки насекомых, дрожжи или клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО). Подходящие векторы экспрессии, промоторы, энхансеры и другие элементы, контролирующие экспрессию, упоминаются в Sambruck et al (1989). Другие подходящие векторы экспрессии, промоторы, энхансеры и другие элементы экспрессии хорошо известны специалистам в данной области техники. Примеры подходящих векторов экспрессии в дрожжах включают Yep Sec 1 (Balderi et al., 1987, Embo J., 6:229-234); pMFa (Kurjanand Herskowitz., 1982, Cell, 30:933-943); JRY88 (Schultz etal, 1987, Gene., 54: 113-123) и pYES2 (Invitrogen Corporation, Сан Диего, Калифорния). Эти векторы находятся в свободном доступе, в виде бакуловируса и систем экспрессии млекопитающих. Например, система бакуловируса является коммерчески доступной (ParMingen, Сан Диего, Калифорния) для экспрессии в клетки насекомых, а вектор PMSG является коммерчески доступным (Pharmacia, Пискатауэй, Нью-Джерси) для экспрессии в клетках млекопитающих.
Для экспрессии в Е. coli подходящие векторы экспрессии включают, в частности, pTrc (Amann et al., 1998, Gene., 69:301-315) pGex (Amrad Corporation, Мельбурн, Австралия); pMal (N.E. Biolabs, Беверли, Массачусетс); pRit5 (Pharmacia, Пискатауэй, Нью-Джерси); pEt-1 Id (Novagen, Мэддисон, Висконсин) (Jameel et al., 1990, J. Virol, 64:3963-3966) и pSem (Knapp et al., 1990, Bio Techniques., 5:280-281). Применение pTRC и pEt-1 Id, например, приведет к экспрессии неслитого белка. Применение pMal, pRit5, pSem и pGex приведет к экспрессии аллергена, слитого с мальтозо-связывающим белком Е (pMal), белком A (pRit5), усеченного галактозидазой (PSEM) или глутатион-8-трансферазой (pGex). При условии, что Т-клеточный эпитоп Ara h 1 или пептид, содержащий его, экспрессируется в виде слитого белка, особенно предпочтительным является введение сайта ферментативного расщепления в месте слитого перехода между белком-носителем и соответствующих пептидом. Пептид по изобретению может быть извлечен из слитого белка с помощью ферментативного расщепления по ферментативному сайту и биохимической очистки с применением традиционных технологий очистки белков и пептидов. Различные векторы также имеют различные промоторные области, которые делают возможной конститутивную или индуцированную экспрессию или температурную индукцию. Кроме того, может быть целесообразно экспрессировать рекомбинантные пептиды в различных хозяевах Е. coli, которые имеют измененную способность к разложению рекомбинантно экспрессированных белков. В альтернативном варианте, может быть предпочтительным изменить последовательность нуклеиновой кислоты для применения кодонов, предпочтительно используемых Е. coli, где такое изменение нуклеиновой кислоты не влияет на аминокислотную последовательность экспрессированных белков.
Клетки-хозяева могут быть трансформированы для того, чтобы экспрессировать нуклеиновые кислоты по изобретению с применением традиционных способов, таких как соосаждение фосфатом кальция или хлоридом кальция, DEAE-декстран-опосредованной трансфекции или электропорации. Подходящие способы трансформации клеток-хозяев могут быть найдены в Sambruck et al. (1989) и других лабораторных руководствах. Последовательность нуклеиновой кислоты по изобретению может также быть химически синтезирована с применением стандартных технологий.
В дополнение к рекомбинантному получению пептидов согласно изобретению, нуклеиновые кислоты могут быть применены в качестве зондов для экспериментальных задач или очистки.
Идентификация и синтез Т-клеточных эпитопов Ara h 1, как описано в данном документе, на данный момент способствует развитию ряда диагностических и профилактических/терапевтических протоколов лечения для применения по отношению к иммунологическим состояниям, связанным с арахисом. Также облегченной является разработка реагентов для применения в этом отношении.
Соответственно, данное изобретение следует понимать как то, которое распространяется на применение пептидов или функциональных производных, гомологов или их аналогов в терапевтическом и/или профилактическом лечении пациентов. Подобные способы лечения включают, но не ограничиваясь этим:
(i) Введение целевых пептидов или их мутантов пациенту с целью снижения чувствительности или индуцирования иммунологической толерантности к Ara h 1 или Ara h 1-подобных молекул. Это может быть достигнуто, например, с помощью индуцирования анергии Th2, направленной на Ara h 1, или апоптоза. Такой результат может быть достигнут с помощью любой из ряда технологий, включая применение пептидов, которые поддерживают реактивность Т-клеточного эпитопа, но которые либо естественным путем, либо в результате мутации не могут подвергаться связыванию с IgE. В альтернативном варианте, можно использовать протоколы десенсибилизация/лечения, которые основаны на введении конкретных концентраций данного пептида в соответствии с конкретным режимом для того, чтобы вызвать толерантность. Такая методология может устранить гиперчувствительность Ara h 1 или это может уменьшить тяжесть гиперчувствительности Ara h 1 или чувствительность к аллергену, присутствующему в композиции, содержащей Ara h 1, такую как аллергия к арахису. Ссылку в данном документе на лечении чувствительности Ara h 1 следует понимать как охватывающую в своем объеме лечение состояний, характеризующихся чувствительностью к композициям, которые содержат Ara h 1, такие как арахис, в целом, даже если чувствительность направлена на аллерген, отличный от Ara h 1.
Предпочтительно, такой режим лечения не способен модифицировать ответ Т-клеток или ответ и В, и Т-клеток соответствующих индивидуумов. Как применяют в данном документе, модификация аллергической реакции индивидуума, страдающего от гиперчувствительности к арахису, может быть определена как индуцирующую либо толерантность, либо ослабление симптомов по отношению к молекулам Ara h 1, как определено с помощью стандартных клинических процедур (Varney et al. 1991 British Medical Journal 502:265-269). Ослабление симптомов включает любое снижение аллергической реакции у индивидуума на Ara h 1 после того, как был завершен режим лечения. Это ослабление может быть субъективным или клинически установленным, например, с помощью стандартных кожных проб, известных в данной области техники.
Воздействие человека на пептиды по данному изобретению, которые содержат пептиды по меньшей мере одного Т-клеточного эпитопа, может вызывать толерантность или вызывать анергию соответствующих Т-клеточных субпопуляций таким образом, что они становятся невосприимчивыми к Ara h 1, и не участвуют в стимулировании иммунного ответа при подобном воздействии. Предпочтительно, пептиды согласно изобретению сохраняют иммуногенные Т-клеточные эпитопы, но обладают способностью нейтрализовать связывание IgE. Более того, даже если аллерген, который является предметом обсуждения, не является Ara h 1, но направлен на другой аллерген, который присутствует в той же композиции, что и Ara h 1 (например, аллерген другой арахиса), иммунизация с помощью Ara h 1 тем не менее может вызывать супрессирующий эффект свидетеля, который действует таким образом, что уменьшает степень чувствительности к этому аллергену.
Введение пептида по изобретению может модифицировать профиль секреции цитокинов по сравнению с воздействием встречающегося в природе аллергена Ara h 1. Это воздействие может также влиять на Т-клеточные субпопуляции, которые обычно участвуют в аллергической реакциях, для мигрирования с сайта или сайтов нормального контакта с аллергеном к сайту или сайтам терапевтического введения. Такое перераспределение субпопуляций Т-клеток может улучшить или уменьшить способность иммунной системы индивидуума стимулировать обычный иммунный ответ на сайте нормального контакта с аллергеном, что приводит к уменьшению симптомов аллергии.
Модификация ответа В-клеток может быть достигнута, например, посредством модуляции профиля цитокина, производимого Т-клетками, как описано выше. В частности, уменьшение Т-клеток, полученных при получении IL-4 и IL-13, тем самым уменьшает синтез IgE.
(ii) Пептиды по данному изобретению могут быть применены в качестве адсорбента для удаления Т-клетки, направленных на Ara h 1, из биологического образца или у пациента.
Соответственно, в другом аспекте данное изобретение относится к способу лечения и/или профилактики состояния у субъекта, чье состояние характеризуется аберрантным, нежелательным или иным неадекватным иммунным ответом на Ara h 1 или аллерген в композиции, содержащей Ara h 1, причем указанный способ включает введение указанному субъекту эффективного количества композиции, как определено выше, в течение времени и в условиях, достаточных для устранения или уменьшения присутствия или функции у указанного субъекта Т-клеток, направленных на указанный Ara h 1 или другой аллерген.
Предпочтительно, указанное состояние представляет собой гиперчувствительность к арахису или лесным орехам, содержащим Ara h 1 или Ara h 1 -подобные молекулы, таким как фундук, миндаль или бразильские орехи.
В одном варианте реализации изобретения указанный способ снижает чувствительность или индуцирует иммунологическую толерантность к Ara h 1 или другому аллергену указанной композиции.
В другом варианте реализации изобретения указанная десенсибилизация или толерантность достигается с помощью индукции анергии ТЫ или апоптоза.
В еще одном варианте реализации изобретения указанная десенсибилизация или толерантность достигается с помощью индукции Ara h 1 - специфических клеток Treg.
"Эффективное количество" означает количество, необходимое для того, чтобы по меньшей мере частично достичь желаемый иммунный ответ, отложить наступление, ингибировать прогрессирование или остановить вообще начало или прогрессирование конкретного подлежащего лечению состояния. Количество изменяется в зависимости от подлежащего лечению состояния здоровья и физического состояния индивидуума, таксономической группы индивидуума, подвергаемого лечению, степени желаемой защиты, состава композиции, оценки медицинской ситуации и прочих факторов. Ожидается, что количество будет падать в относительно широком диапазоне, что может быть определено с помощью обычных испытаний.
Следует также понимать, что композиция по данному изобретению может содержать исключительно эпитопы Ara h 1 или она может также содержать другие эпитопы или молекулы, полезные для достижения терапевтической эффективности, например, в диапазоне эпитопов Ara h 2.
Субъект лечения или профилактики обычно представляет собой млекопитающее, такое как, но не ограничиваясь этим, человек, примат, сельскохозяйственное животное (например, овца, корова, лошадь, осел, свинья), домашнее животное (например, собака, кошка), животное для лабораторных испытаний (например, мышь, кролик, крыса, морская свинка, хомяк), пойманное дикое животное (например, лисица, олень). Предпочтительно, млекопитающим является человек или примат. Наиболее предпочтительно, млекопитающее является человеком.
Ссылка в данном документе на "лечение" и "профилактику" будет рассматриваться в самом широком контексте. Термин "лечение" не обязательно означает то, что субъекта лечат до полного восстановления. Аналогичным образом, "профилактика" не обязательно означает, что субъект в конечном итоге не будет страдать болезненным состоянием. Соответственно, лечение и профилактика включают облегчение симптомов конкретного заболевания или предотвращение или уменьшение риска развития конкретного состояния иным образом. Термин "профилактика" можно рассматривать как снижение тяжести или наступления конкретного состояния. "Лечение" может также уменьшить тяжесть существующего состояния.
Введение пептида по данному изобретению (в дальнейшем именуемое "средство") в виде фармацевтической композиции, может быть выполнено любым удобным способом. Средство фармацевтической композиции, как предполагается, демонстрирует терапевтическую активность при введении в количестве, которое зависит от конкретного случая. Изменение зависит, например, от человека или животного и выбранного средства. Может применяться широкий диапазон доз. Учитывая пациента, на каждый килограмм веса тела в день можно вводить, например, от около 0,1 мг до около 1 мг средства. Режимы дозировки могут быть отрегулированы для того, чтобы предложить оптимальный терапевтический ответ. Например, несколько разделенных доз можно вводить ежедневно, еженедельно, ежемесячно или через другие подходящие интервалы времени или доза может быть пропорционально уменьшена, как указывают в связи со сложившейся ситуацией.
Средство может быть введено удобным способом, например, пероральным, внутривенным (при условии, что является водорастворимым), внутрибрюшинным, внутримышечным, подкожным, внутрикожным, интраназальным, сублингвальным путем или в виде суппозитория или имплантата (например, при применении медленно высвобождающихся молекул). Средство может быть введено в виде фармацевтически приемлемых нетоксичных солей, таких как кислотно-аддитивные соли или комплексы металлов, например с цинком, железом и т.п. (которые рассматривают как соли для целей данной заявки). Примерами таких кислотно-аддитивных солей могут служить гидрохлорид, гидробромид, сульфат, фосфат, малеат, ацетат, цитрат, бензоат, сукцинат, малат, аскорбат, тартрат и тому подобные. Если активный ингредиент следует вводить в виде таблеток, таблетка может содержать связующее вещество, такое как трагакант, кукурузный крахмал или желатин; дезинтегрирующее средство, такое как альгиновая кислота; и смазку, такую как стеарат магния.
В соответствии с этими способами, средство, определенное в соответствии с данным изобретением, может быть введено совместно с одним или несколькими другими соединениями или молекулами. Под "совместным введением" имеется в виду одновременное введение в одной и той же композиции или двух различных композиций одними и теми же или различными путями или последовательное введение одними и теми же или различными путями. Под "последовательным" введением подразумевают разницу во времени от нескольких секунд, минут, часов или дней между введением двух типов молекул. Эти молекулы могут быть введены в любом порядке.
Другой аспект данного изобретения относится к применению композиции, как определено выше, при изготовлении лекарственного средства для лечения состояния у млекопитающего, чье состояние характеризуется аберрантным, нежелательным или иным образом неадекватным иммунным ответом на Ara h 1.
Предпочтительно, указанное состояние представляет собой гиперчувствительность к арахису или лесным орехам, которые содержат Ara h 1 или Ara h 1 - подобные молекулы, таким как фундук.
В еще одном дополнительном аспекте данное изобретение предусматривает фармацевтическую композицию, содержащую композицию, как определено выше, вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями. Указанная композиция упоминается в качестве активных ингредиентов.
Фармацевтические формы, пригодные для инъекционного применения, содержат стерильные водные растворы (при условии, что являются водорастворимыми) или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий, или могут быть в виде крема или другой формы, подходящей для местного применения. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобные), их подходящие смеси и растительные масла. Надлежащую текучесть можно поддерживать, например, с помощью применения покрытия, такого как лецитин, с помощью поддержания требуемого размера частиц в случае дисперсии и с применением суперфактантов. Предотвращение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и тому подобных. Во многих случаях, будет предпочтительно включать изотонические средства, например сахара или хлорид натрия. Пролонгированное всасывание инъекционных композиций может быть осуществлено с применением в композициях средств, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
Стерильные инъекционные растворы получают введением активных соединений в необходимом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, по мере необходимости, с помощью последующей стерилизации фильтрованием. Как правило, дисперсии получают включением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются вакуумная сушка и технология сублимационной сушки, которые дают порошок активного ингредиента плюс любой дополнительный желательный ингредиент из их предварительно стерилизованного фильтрацией раствора.
При условии, что активные ингредиенты соответствующим образом защищены, они могут быть введены перорально, например, с инертным разбавителем или с усваиваемым съедобным носителем, или они могут быть заключены в твердую или мягкую желатиновую капсулу, или они могут быть спрессованы в таблетки, или они могут быть включены непосредственно в пищевые продукты диеты. В случае перорального терапевтического введения активное соединение может быть включено с эксципиентами и применено в виде таблеток для приема внутрь, защечных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобных. Такие композиции и препараты должны содержать активного соединения по меньшей мере 1% по массе. Процентное содержание композиций и препаратов может, конечно, варьироваться и обычно может быть в пределах от около 5 до около 80% массы единицы. Количество активного соединения в таких терапевтически применимых композициях, таким образом, будет получено в подходящей дозировке. Предпочтительные композиции или препараты в соответствии с данным изобретением получают таким образом, что единичная дозировка пероральной формы содержит от около 0,1 мкг до 2000 мг активного вещества.
Таблетки, пастилки, пилюли, капсулы и тому подобные могут также содержать компоненты, перечисленные ниже: связующее вещество, такое, как камедь, гуммиарабик, кукурузный крахмал или желатин; наполнители, такие как дикальцийфосфат; дезинтегрирующее средство, такое как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобные; смазывающее вещество, такое как стеарат магния; и подслащивающее средство, такое как сахароза, лактоза или сахарин, могут быть добавлены или ароматизирующее средство, такое как перечная мята, масло грушанки, или вишневый ароматизатор. При условии, что стандартная лекарственная форма представляет собой капсулу, она может содержать, в дополнение к материалам указанного выше типа, жидкий носитель. В качестве покрытий или для модификации физической формы дозированной единицы могут присутствовать другие различные материалы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или ими обоими. Сироп или эликсир могут содержать активное соединение, сахарозу в качестве подслащивающего агента, метил и пропилпарабены в качестве консервантов, краситель и ароматизатор, например вишневый или апельсиновый. Конечно, любой материал, применяемый для получения любой стандартной лекарственной формы, должен быть фармацевтически чистым и по существу нетоксичным в применяемых количествах. Кроме того, активное соединение(я) может быть включено в препараты и составы с замедленным высвобождением.
Фармацевтическая композиция может также содержать генетические молекулы, такие как вектор, способный трансфекцировать клетки-мишени, при условии, что вектор несет молекулу нуклеиновой кислоты, кодирующую модулирующее средство. Вектор может быть, например, вирусным вектором.
Способы введения включают, но не ограничиваясь этим, респираторный (например, интраназально или перорально с помощью аэрозоля), внутритрахеально, назофарингеально, внутривенно, внутрибрюшинно, подкожно, интракраниально, внутрикожно, внутримышечно, интраокулярно, интратекально, интрацеребрально, интраназально, инфузией, перорально, ректально, с помощью установки внутривенной капельницы, имплантата и сублингвально. Предпочтительно, указанный путь введения является подкожным, внутрикожным или интраназальным.
Еще один аспект данного изобретения относится к композициям, как определено выше, при применении в способе по данному изобретению.
В еще одном аспекте, данное изобретение следует понимать как расширение применения эпитопов и пептидов по данному изобретению в диагностических применениях. Указанные диагностические применения включают, но не ограничиваясь этим:
(i) Для измерения реактивности клеток в отношении Ara h 1 субъекта. Это представляет собой применение, например, по отношению к диагностике и/или мониторингу состояний, характеризующихся аберрантным, нежелательным или иным неадекватным иммунным ответом на Ara h 1. Пептиды могут быть добавлены в раствор или связаны с твердым носителем вместе с клетками, полученными из периферической крови или из либо нефракционированных, фракционированных, либо полученных в виде непрерывной клеточной линии тканевых биопсий. Реактивность в отношении целевого пептида может быть измерена с помощью стандартных анализов пролиферации, таких как включение Н3-тимидина, измерение экспрессированных или секретированных молекул, таких как поверхностные маркеры, цитокины, или других стандартных анализов клеточной активности, которые хорошо известны в данной области техники.
(ii) Применение Т-клеточного эпитопа включает пептиды вместе с анализом Т-клеточной пролиферации, который применяет образец Т-клеток, полученных от субъекта, будет способствовать, например, идентификации чувствительного к Т-клеткам популяции.
Способы выявления Ara h 1 могут быть применены, например, для того, чтобы качественно или количественно обнаружить уровни Ara h 1. Тем не менее, эти способы могут быть также применены для скрининга мутаций или полиморфизмов в Ara h 1, которые могут возникнуть в результате мутации, например, потери реактивности Т-клеток в отношении Ara h 1. Эти способы могут быть применены для целей скрининга пептидных молекул, подходящих для применения в терапевтических или профилактических целях лечения индивидуума, страдающего от гиперчувствительности, связанной с Ara h 1.
Соответственно, еще один аспект данного изобретения относится к способу диагностики или мониторинга состояния млекопитающего, состояние которого характеризуется аберрантным, нежелательным или неадекватным ответом на Ara h 1, где указанный способ включает скрининг Т-клеток, реактивных в отношении Ara h 1, с применением пептидов или эпитопов, определенных выше.
Предпочтительно, указанное состояние представляет собой гиперчувствительность к арахису или лесным орехам, содержащим Ara h 1 или Ara h 1 - подобные молекулы, таким как фундук, миндаль или бразильские орехи.
В другом вариант реализации изобретение относится к диагностическим наборам для применения в диагностической методологии, которая была определена выше.
Данное изобретение будет теперь дополнительно описано со ссылкой на следующие неограничивающие Примеры.
ПРИМЕРЫ
СПОСОБЫ
Субъекты
Взрослые испытуемые с аллергией на арахис были набраны из The Alfred Allergy Clinic, Мельбурн, Австралия (Таблица 4). Все субъекты имели клинические симптомы IgE-опосредованную аллергию на арахис и результат САР арахис-специфичного IgE>1 (>0,49 kUA/1; Pharmacia CAP System™, Pharmacia Diagnostics, Уппсала, Швеция). Субъекты, применяемые для поколения Т-клеточной линии (ТКЛ), генотипировали (HLA-DRB 1, -DQB 1 и -DPB 1, экзон 2) с помощью Victorian Transplantation and Immunogenetics Service (Таблица 5). Исследование было утверждено The Alfred and Monash University Ethics Committees и письменное информированное согласие получено от каждого субъекта.
Антигены
Экстракт сырого арахиса (ЭСА) получали из коммерческого несоленого, сухого жареного арахиса, как описано (Prickett et al. 2011 см. выше; de Leon et al. Clin Exp Allergy. 2003; 33(9): 1273-80). Ara h 1 и Ara h 1 обогащали из ЭСА с помощью жидкостной хроматографии, как описано (Prickett et al. 2011 см. выше). Содержание эндотоксина составляло 1,7,4,0 и 78,0 ЕЭ/мг в случае ЭСА, Ara h 1 и Ara h 1, соответственно (Endpoint Chromogenic LAL assay, Lonza, Уолкерсвилль, США). Пептиды Ara h 1 (Mimotopes, Виктория, Австралия и GenScript USA Inc, Нью-Джерси, США; Таблица 6) восстанавливали при 2 мг/мл в 10% диметилсульфоксида/PBS (20-меры и наборы усеченных пептидов) или отдельно PBS (синтезированные на заказ коровые эпитопные пептиды). Подтверждали, что все антигены не были ни митогенными, ни токсичными, как описано (Eusebius et al. Int Arch Allergy Immunol. 2002; 127(3):234-44).
Получение Ara h l-специфических CD4+ Т-клеточных линий (ТКЛ)
Ara h 1-специфическую олигоклональную ТКЛ получали из мононуклеарных клеток периферической крови (РВМС) субъектов с аллергией на арахис, используя методологию на основе 5,6-карбоксифлуоресцеиндиацетатсукцинимидилового эфира (CFSE) (Mannering et al. J Immunol Methods. 2005; 298(1 -2):83-92) как описано (Prickett et al. 2011 см. выше) с ЭСА (100 пг/мл), Ara h 1 (10 пг/мл) или 20-мерными пептидами, охватывающими последовательность Ara h 1 (перекрывание 11 аминокислот (ак) (17 ак перекрывание с последним пептидом); Таблица 6; 10 пг/мл/пептид) в качестве основных антигенов. Все ТКЛ тестировали на специфичность (пролиферацию) по отношению к 20-мерам Ara h 1 индивидуума (10 пг/мл), а также ЭСА (100 пг/мл) и/или Ara h 1 (10 пг/мл). Коровые эпитопные последовательности картировали в пределах выбранных 20-меров, используя пептидные наборы, усеченные с N- или С-конце 20-мера, как описано (Prickett et al. 2011 см. выше).
Анализы Т-клеток
Все культивирование проводили в RPMI-1640, содержащей 2 мМ L-глутамина, 100 МЕ/мл пенициллина-стрептомицина и 5% инактивированной нагреванием человеческой сыворотки АВ (Sigma-Aldrich, Сент-Луис, США) (cRPMI). Антиген-индуцированную пролиферацию ТКЛ оценивали с помощью анализов поглощения 3Н-тимидина (3H-TDR), как описано (Prickett et al. 2011 см. выше). Индекс стимуляции (ИС; имп./мин антиген-стимулированных Т-клеток/имп./мин нестимулированных Т-клеток)>2,5 считали положительным, а все положительные ответы подтверждали >2 анализами. HLA-ограничение распознавания эпитопа с помощью ТКЛ оценивали с помощью моноклональных антител (мАт) против HLA-DR (L243), HLA-DQ (SVP-L3) или HLA-DP (В7/21), для того, чтобы презентировать эпитоп, как описано (Prickett et al. 2011 см. выше). Чтобы выявить пептид-индуцированную пролиферацию CD4+Т-клеток в пределах всей РВМС, 7-дневные культуры CFSE-меченого РВМС устанавливали, как описано в случае получения ТКЛ (Prickett et al. 2011 см. выше). В образце анализировали по меньшей мере 10000 CD4+ Т-клеток и рассчитывали ИС как процентное отношение CD4+CFSElo (пролиферированных) клеток с антигеном/процентное отношение CD4+CFSElo клеток без антигена (фон). Порог выявления в случае конкретного ответа в этом анализе оценивали с помощью расширения пептид-специфической ТКЛ от пролиферированных CD4+ клетки в диапазоне значений ИС для трех субъектов. Конкретная ТКЛ может быть получена из разделенных Т-клеток с ИС всего лишь 1,1 у всех трех субъектов (данные не приведены), что позволяет обозначить ИС>1,1 как положительный.
Тест активации базофилов
Активацию базофилов оценивали с помощью позитивной регуляции CD63, выявленной с помощью проточной цитометрии, как описано (Drew et al. JImmunol. 2004; 173(9):5872-9). Положительными контролями были антитела против IgE человека кролика (7,5 мкг/мл; DAKO Corporation, Калифорния, США), N-формил-метионин-лейцин-фенилаланин (fMLP) (0,4 мкг/мл; Sigma) и ЭСА. ЭСА, Ara h 1 и пептиды были испытаны в диапазоне 3 концентраций, отличающихся на порядок (5, 0,5 и 0,05 мкг/мл)
РЕЗУЛЬТАТЫ
Выбор 20-мерных пептидов Ara h 1, содержащих доминантные CD4+ Т-клеточные эпитопы, распознаваемые субъектами с аллергией на арахис
Общее количество 145 Ara h 1-специфических Т-клеточных линий (ТКЛ) получали из РВМС 18 отличных по HLA субъектов с аллергией на арахис (Таблица 4 и 5) с помощью выделения и расширения антиген-специфических (пролиферированных) CD4+CFSElo Т-клеток из 7-дневных CFSE-меченных культур РВМС, стимулированных ЭСА, Ara h 1 или пулами 20-мерных пептидов Ara h 1, вместе охватывающих последовательность Ara h 1 (Таблица 6). 20-мерный пептид(ы), который распознали (ИС≥2,5) по каждому субъекту, приведен в Таблице 7, а данные обобщены на Фигуре 1. В случае некоторых субъектов, стимуляция ЭСА или Ara h 1 создает больше ТКЛ, в то время как в случае других это были пептидные пулы. При условии, что ТКЛ получали от данного субъекта, используя различные антигенные препараты (ЭСА, Ara h или пептидные пулы), специфичности 20-меров ТКЛ были сопоставимы. В целом, не было никакого изменения в специфичности 20-мера ТКЛ, получаемого в зависимости от антигенного препарата.
145 ТКЛ совместно распознавали эпитопы на протяжении всей последовательности Ara h 1, только с четырьмя из шестидесяти девяти 20-меров, которые не стимулируют любую ТКЛ. Каждый из четырнадцати 20-меров (23, 24, 26, 38, 40, 44-51 и 57) был распознан четырьмя (22%) или более субъектами, с пептидами 50 и 51, имеющими наибольшее количество респондеров (шесть субъектов; 33%) (Фигура 1). Для того, чтобы выбрать 20-меры, содержащие доминирующие Т-клеточные эпитопы, в дополнение к частотам респондеров был рассмотрен ряд факторов, в том числе величины ответа ТКЛ, количество специфических ТКЛ на субъект, воспроизводимость специфического ответа ТКЛ и способность к нацеливанию на конкретные Т-клетки в РВМС.Исходя из этих параметров, девять из четырнадцати 20-меров (пептиды 23, 24, 40,46,47,49, 50, 51 и 57) были выбраны для последующих анализов. Эти девять 20-меров вместе были распознаны 16 из 18 субъектов (89%) в этой группе, и, как правило, индуцировали сильные и последовательные пролиферативные ответы в конкретной ТКЛ, с большинством ИС более пяти и многими значительно выше (Таблица 7). Кроме того, каждый из этих 20-меров был распознан множеством ТКЛ от многих респондентов, что отражает распространенность Т-клеток, специфичных для этих пептидов среди совокупностей Т-клеток субъектов. Для оценки распознавания в более широкой группе, РВМС от дополнительных 21 субъектов с аллергией на арахис, проверяли с помощью анализа CFSE на пролиферацию CD4+ Т-клеток в РВМС все следующие семь дней стимуляции каждым пептидом (Таблица 1, верхняя часть и Фигура 4). Этот анализ предложил чувствительный и точный скрининг для выявления пептид-специфических CD4+ Т-клеточных ответов в пределах всей РВМС. Все 21 субъекта продемонстрировали пролиферацию Т-клеток РВМС к ЭСА или комбинацию обогащенных Ara h 1 и Ara h 1. 20-меры были вместе распознаны 19 (90 из этих субъектов, с 8-12 (38-60%) респондерами на 20-мер. Анализ четырех субъектов из исходной группы, применяемой для получения ТКЛ, подтвердили, что они также имели Т-клетки, специфические к другим 20-мерам, в дополнение к тем, которые распознаются с помощью их ТКЛ (Таблица 1, нижняя часть). В целом, распознавание Т-клеток выбранной части из девяти 20-меров подтверждали у 35 (90%) из 39 анализируемых субъектов.
Картирование коровых Т-клеточных эпитопов в пределах выбранных 20-мерных пептидов Ara h 1
Пептиды минимальной длины уменьшают риск перекрестного связывания IgE, фиксированного на клетке, на воспалительных клетках во время клинического введения и облегчают терапевтическое получение. Минимальную последовательность (коровую эпитопную), стимулирующую Т-клетки, в пределах каждого выбранного 20-мера определяли с помощью тестирования пролиферации реактивной ТКЛ у различных субъектов по отношению к усеченным множествам пептидов (например, Фигура 2 и Таблица 2). Количество остатков, необходимых для индуцирования максимальной пролиферации Т-клеток, изменяется от 6 до 19 ак между различными ТКЛ и/или субъектами (Таблица 2), в соответствии с предыдущими отчетами для CD4+ Т-клеточных эпитопов (Hemmer et al. Int Immunol. 2000; 12(3):375-83 (Hemmer et al. Int Immunol. 2000; 12(3):375-83; Suri etal. Curr Opin Immunol. 2006; 18(1):70-7). В связи с изменением количества фланкирующих остатков, необходимых для оптимального распознавания эпитопа (Suri et al. 2006 см. выше), ТКЛ рассматривали для того, чтобы распознать тот же эпитоп, если пептиды, содержащие общее ядро последовательность, индуцируют распознавание. Основываясь на этом критерии, определяли десять различных CD4+ Т-клеточных эпитопов ('соединенные эпитопы', Таблица 2), с общими ядрами, изменяющимися от 5 до 12 ак (подчеркнутые последовательности, Таблица 2). Последовательности 'соединенных эпитопов' выбирали для того, чтобы охватить остатки, необходимые для максимальной стимуляции всех конкретных ТКЛ, протестированных на то, чтобы гарантировать максимально широкое возможное распознавание.
По меньшей мере, в каждом из девяти 20-меров был найдена один эпитоп с 20-мерами 50 и 51, каждый из которых содержит два различных, но перекрывающихся Т-клеточных эпитопа: один уникальный для каждого 20-мера ((442- 458) и (452-470)), а другой в пределах последовательности перекрывания ((451-461), Таблица 2 и Фигура 2). Ни один ТКЛ не ответил на оба эпитопа в любом 20-мере, дополнительно подтверждая различие этих эпитопов (данные не приведены). Алгоритмы предсказания HLA-эпитоп (Singh et al. Bioinformatics. 2001; 17(12): 1236-7; Vita et al. Nucleic Acids Res. 2010; 38(Номер в базе данных):0854-62) также подчеркнули один или более сильных мотива, связывающие HLA класса II (HLA-II), в каждой из наших минимально стимулирующих последовательностей. Данные представлены в алгоритме связывания HLA-DR Propred (Singh et al. 2001 см. выше) в Таблице 8. Этот алгоритм не предсказывает эпитопы HLA-DR в пределах пептида 40, но алгоритмы Immune Epitope Database (IEDB) и Analysis Resource (Vita et al. 2010, см. выше) предсказывают, что эпитопы в пределах этого пептида связываются наиболее сильно с молекулами HLA-DP и/или -DQ.
Наконец, чтобы избежать ненужного дублирования последовательности и свести к минимуму число пептидов для терапевтического средства, шесть из соединенных эпитопов (включая три перекрывающиеся пары эпитопов) объединяли в три отдельные пептиды из 20 ак или менее ((206-225), (409-427) и (451- 470); серый фон, Таблица 2). Объединенные пептиды эпитопа, эффективно стимулированные ТКЛ, специфические для каждого эпитопа (данные не приведены) и вместе с остальными четырьмя соединенными эпитопами ((353-371), (436-452), (442-458) и (507-524)) предлагали набор из семи потенциальных пептидов для дополнительной характеристики (смотри звездочки, Таблица II). Скрининг девяти субъектов из наших групп на основе CFSE подтвердил, что каждый из этих пептидов может непосредственно нацеливать выявляемые количества Ara h 1 - специфических Т-клеток среди всех РВМС субъектов с аллергией на арахис (Таблица 9).
Определение специфика рестрикции HLA класса II Т-клеточных эпитопов Ara h 1
Не существует определенной связи между HLA-II и аллергией на арахис (Shreffler et al. Ann Allergy Asthma Immunol 2006; 96(6):865-9), поэтому пептиды, выбранные для терапии, для широкого применения необходимо связать различными молекулами HLA-II. Для определения присутствия каждого эпитопа типа HLA-II, для блокирования индивидуального презентирования эпитопа с Т-клетками применяли анти-HLA-DR, -DP или -DQ-мАт (моноклональные антитела). Для каждого испытанного ТКЛ, распознавание эпитопа в зависимости от дозы (например, Фигура 5) предотвращали одним или несколькими HLA-мАт и тем же самым мАт, блокирующим распознавание ЭСА (данные не приведены), демонстрируя консистенцию для презентирования натуральных, обработанных и синтетических форм эпитопа. На эпитоп протестировали, по меньшей мере, два субъекта и/или ТКЛ (Таблица 3). В соответствии с предсказаниями алгоритмов HLA-II, описанными выше (Singh et al. 2001 см. выше; Vita et al. 2010 см. выше), анти-HLA-DR, блокирующий распознавание всех, кроме одного эпитопа, (353-371), который был заблокирован анти-HLA-DQ у обоих протестированных субъектов. В случае эпитопов (436-452) и (507-524), распознавание было заблокировано анти-HLA-DR в случае некоторых ТКЛ, но анти-HLA-DQ в случае других, подтверждая HLA-связывающий вырождение этих эпитопов.
Для оценки HLA-связывающего вырождения эпитопов, чье распознавание было заблокировано одной HLA-мАт, сравнивали соответствующие HLA-аллели по меньшей мере двух субъектов с ТКЛ, специфичной по отношению к этому эпитопу (Таблица 5 и Таблица 3). Отсутствие общих аллелей HLA-DRB1 или HLA-DQB1 между субъектами, распознающими HLA-DR-или HLA-DQ-ограниченные эпитопы, соответственно, подтвердило, что каждый эпитоп был презентирован на по меньшей мере двух различных HLA-молекулах. HLA-связывающие алгоритмы дополнительно подкрепляют эти данные с каждыми содержащими эпитоп мотивами, которые, как предполагают, связывают несколько HLA-молекул ((Singh et al. 2001 см. выше; Vita et al. 2010 см. выше) (например, Таблица 8).
Тестирование потенциальных пептидов для активации базофилов
Для того, чтобы предложить безопасную альтернативу для целых аллергенов, пептиды не должны связывать и сшивать IgE, фиксированный на клетке. Реактивность базофила на пептиды оценивали в свежей крови семи субъектов с аллергией на арахис, набранных для исследования (Таблица 4) (Фигура 3). Все семь субъектов демонстрировали высокие уровни активации базофилов с ЭСА в диапазоне концентраций. Несмотря на то, что ответы на Ara h 1 изменялись между субъектами с низкой дозой, самая высокая концентрация индуцировала высокую активацию у всех субъектов. Тем не менее, ни один из потенциальных пептидов не индуцирует активацию в любой испытанной концентрации. Один субъект показал очень низкий ответ (8%) на пептид (409-427), но это было ниже порога положительной активации (Boumiza et al. Clin Mol Allergy. 2005; 3:9) и был пренебрежимо малым по сравнению с активацией, вызванной Ara h 1 (80-90%) или ЭСА (74-76%) у этого субъекта.
Специалистам в данной области техники будет понятно, что изобретение, описанное в данном документе, является чувствительным к изменениям и модификациям, кроме тех, которые конкретно описаны. Следует понимать, что изобретение включает все подобные вариации и модификации. Изобретение также включает все этапы, признаки, композиции и соединения, упомянутые или указанные в данном описании изобретения, отдельно или вместе, и любые и все комбинации любых двух или более из указанных этапов или признаков.
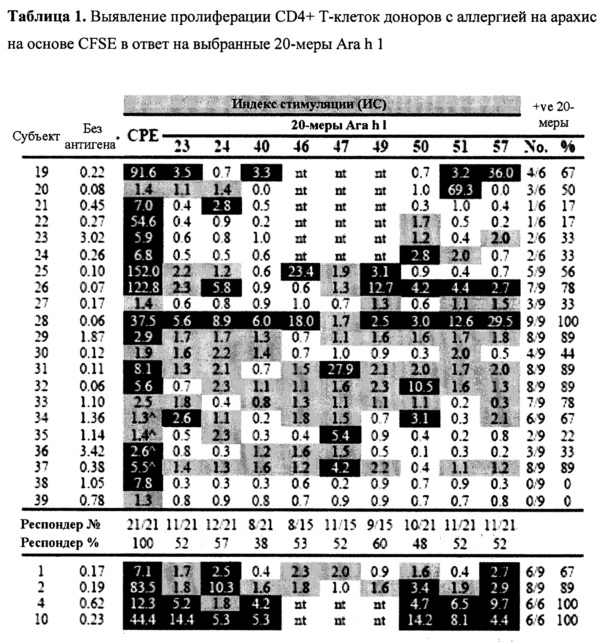
Верхняя часть иллюстрирует новую группа доноров с аллергией на арахис; нижняя часть иллюстрирует четыре субъекта из группы доноров с аллергией на арахис, применяемых для получения ТКЛ. ЭСА, экстракт сырого арахиса; +ve, положительный; нт, не тестированный (запасы пептида не доступны на момент тестирования); Серый, индексы стимуляции >1,1<2,5; Черный, индексы стимуляции >2,5
* Фоновая пролиферация без антигена, % CD4+CFSElo Т-клеток от общего количества CD4+ Т-клеток; ^А в случае этих субъектов вместо ЭСА применяли комбинацию обогащенного Ara h 1 и Ara h 1 (10 1/тг/мл каждого).

Серый оттенок указывает перекрывание пары соединенных эпитопов, объединенные в отдельные пептиды для дополнительного анализа.
*Семь потенциальных пептидов, предлагаемых для терапевтического средства

нт = не тестированный (ТКЛ отсутствует); Серый оттенок указывает перекрывание пары соединенных эпитопов, объединенные в отдельные пептиды для дополнительного анализа.
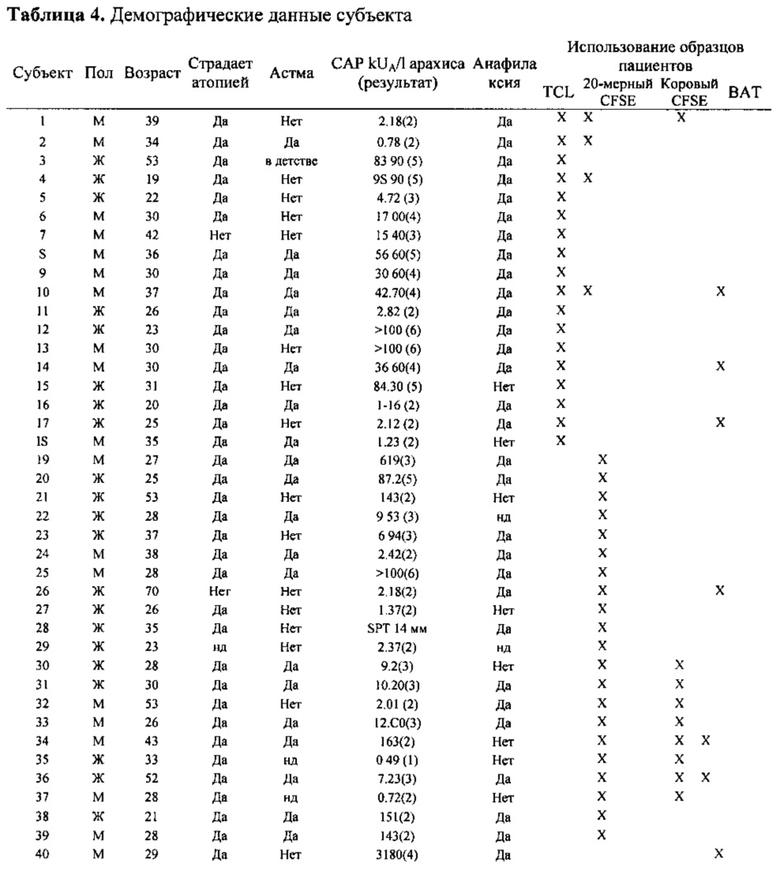
ТКЛ, Т-клеточная линия; 20-мерный CFSE, скрининг реактивности Т-клеток на отдельные 20-меры Ara h 1; Коровый CF SE, скрининг реактивности Т-клеток на потенциальные пептиды Ara h 1; ВАТ, тест активации базофилов; нд, данные не доступны; SPT, кожная инъекционная проба (RAST не доступны для этого субъекта).

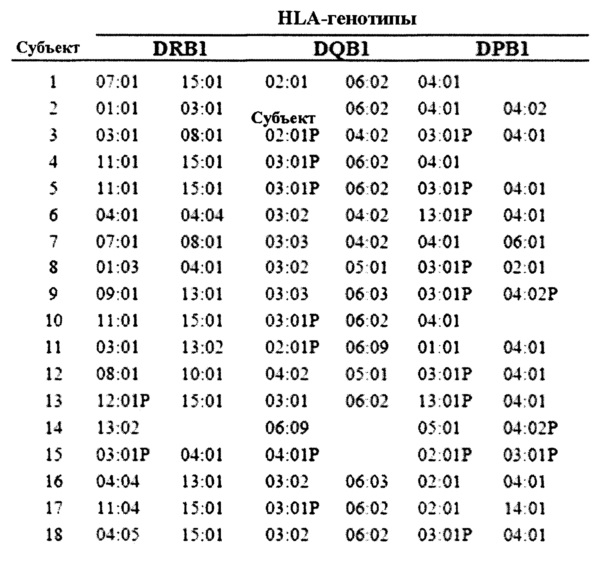
Все сокращения HLA соответствуют последним изменениям аллельной номенклатуры (http://hla.alleles.org/announcement.html и http://www.ebi.ac.uldimgt/h 1 a/).
Аллели, за которым следует Iv, представляют собой группы аллелей, которые разделяют общие последовательности в экзоне 2 (http://hla.alleles.org/alleles/p_groups.html).
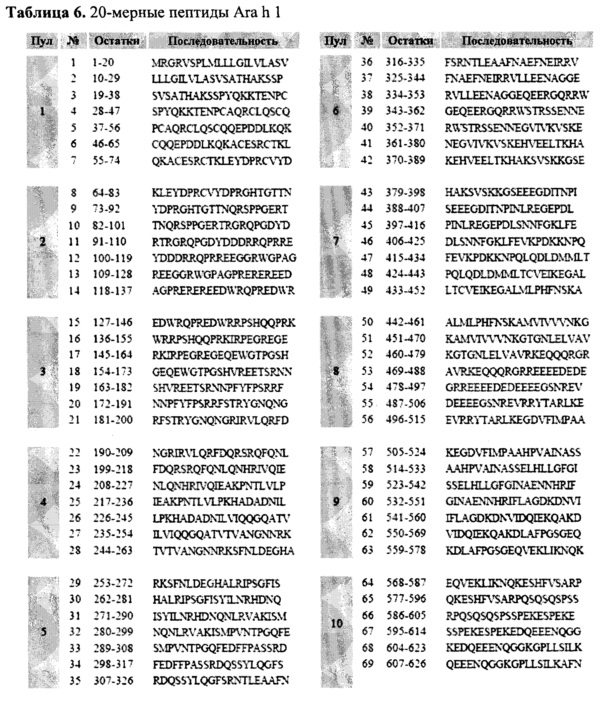

ТКЛ, Т-клеточная линия. Приведены только положительные индексы стимуляции (ИС >2,5). Для субъектов с множеством ТКЛ, специфическими для данного 20-мера, показан высокий ИС.ИС выше 10 были округлены до ближайшего целого числа. Темно серый, ИС>2,5<5,0; Черный, ИС>5,0.

HLA-DR-связывающие мотивы (серый фон) были предсказаны с помощью алгоритма ProPred (http:www.immuneepitope.org; доступ 30ого января 2012). Предсказанные первичные якорные остатки выделены полужирным шрифтом и подчеркнуты. Пептид 40 (352-371 не показан, так как для этого пептида по этому алгоритму не были предсказаны HLA-DR-связывающие мотивы.
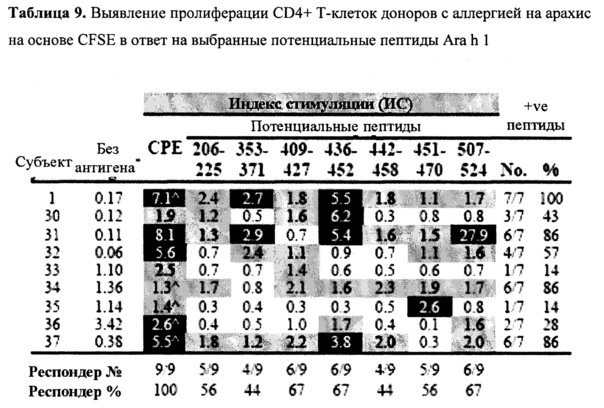
ЭСА, экстракт сырого арахиса; +ve, положительный; Серый, индексы стимуляции >1,1<2,5; Черный, индексы стимуляции >2,5
* Фоновая пролиферация без антигена, % CD4+CFSElo Т-клеток от общего количества CD4+ Т-клеток; ^А в случае этих субъектов вместо ЭСА применяли комбинацию обогащенного Ara h 1 и Ara h 1 (10 1/тг/мл каждого).
ЛИТЕРАТУРА
Akdis and Akdis. J Allergy Clin Immunol 2011; 127(l):18-27; quiz 8-9.
Akdis et al., Allergy 55: 522-530, 2000
Akdis et al., Trends Immunol 22: 175-8, 2001
Alexander et al. Allergy. 2005; 60(10): 1269-74.
Alexander et al. Clin Exp Allergy. 2005; 35(l):52-8.
Allen and O'Hehir. Clin Exp Allergy. 2011; 41(9):1172-4.
Allergen Nomenclature, International Union of Immunological Societies (IUIS) Allergen Nomenclature Sub-committee. Доступна на: http://www.allergen.org/Allergen.aspx. Доступ April 22nd, 2012.
Amann et al., 1998, Gene., 69:301-315
Anagnostou etal. Clin Exp Allergy. 2011; 41(9):1273-81.
Asarnoj et al. Allergy. 2010, 65(9): 1189-95
Asarnoj et al. Allergy. 65(9): 1189-95, 2010.
Avery et al. Pediatr Allergy Immunol 2003; 14(5):378-82.
Balderi et al., 1987, Embo J., 6:229-234)
Bateman et al. Clin Exp Allergy. 2008; 38(11):1760-8.
Blanc et al. Clin Exp Allergy. 2009; 39(8): 1277-85
Bock et al. J Allergy Clin Immunol. 2007; 119(4): 1016-8.
Boumiza et al. Clin Mol Allergy. 2005; 3:9.
Burks AW. Lancet. 2008; 371(9623):1538-46.
Burks etal. EurJBiochem. 1997; 245(2):334-9.
Burks et al., Allergy 53: 725-30, 1998
Busse et al. N Engl J Med. 2002; 347(19):1535-6.
Campbell et al. J Exp Med. 2009; 206(7): 1535-47.
Chiang et al. Pediatr Allergy Immunol. 2009; 21(2 Pt 2):e429-38
de Jong et al., Clin Exp Allergy 28: 743-51, 1998
de Leon etal. Clin Exp Allergy. 2003; 33(9):1273-80.
de Leon et al. Expert Reviews in Molecular Medicine. 2007; 9(1): 1-18.
DeLong et al. J Allergy Clin Immunol. 2011; 127(5):1211-8 e3.
Drew et al. J Immunol. 2004; 173(9):5872-9.
Eusebius etal. Int Arch Allergy Immunol. 2002; 127(3):234-44.
Glaumann et al. Allergy. 2012; 67(2):242-7
Hall et al. Vaccine. 2003; 21(5-6):549-61.
Hemmer et al. Int Immunol. 2000; 12(3):375-83.
Higgins et al. J Allergy Clin Immunol. 1994; 93(5):891-9.
Hofmann et al. J Allergy Clin Immunol. 2009; 124(2):286-91.
Hourihane et al., J Allergy Clin Immunol 100: 596-600, 1997
Hoyne etal. J Exp Med. 1993; 178(5): 1783-8.
Husain and Schwartz. J Am Acad Dermatol. 2012; 66(1): 136-43.
Jameel et al., 1990, J. Virol, 64:3963-3966
Jones et al. J Allergy Clin Immunol 2009; 124(2):292-300.
Kammerer et al. J Allergy Clin Immunol. 1997; 100(1):96-103.
Kay and Larche. Springer Semin Immunopathol. 2004; 25(3-4):391-9.
Kemp and Hu. Med J Aust. 2008; 188(9):503-4.
Knapp et al., 1990, Bio Techniques., 5:280-281
Koppelman et al. Allergy. 2001; 56(2): 132-7
Koppelman et al. Clin Exp Allergy. 2004; 34(4):583-90
Kurjan and Herskowitz., 1982, Cell, 50:933-943
Larche M. Clin Exp Allergy. 2008; 38(11):1709-11.
Lin et al. J Microbiol Immunol Infect. 2012
Lin et al. J Microbiol Immunol Infect. 2012.
Litwin et al., Int Arch Allergy Appl Immunol 87: 361-61, 998
Maguire et al., Clin Immunol 93: 222-31, 1999
Mannering et al. J Immunol Methods. 2005; 298(1-2):83-92.
Marazuela et al. Mol Immunol. 2008; 45(2):438-45.
Marcotte et al., J Allergy Clin Immunol 101: 506-13, 1998
Middleton et al. Новая база данных частоты аллеля: http://www.allelefrequencies.net. Tissue Antigens. 2003; 61(5):403-7.
Moverare et al. Int Arch Allergy Immunol 2011; 156(3):282-90
Muller et al. J Allergy Clin Immunol 1998; 101(6 Pt 1):747-54.
Muller et al., J Allergy Clin Immunol 101: 747-754, 1998
Nelson et al. J Allergy Clin Immunol 1997; 99(6 Pt 1):744-51.
Norman et al.,Am JRespir Crit Care Med 154: 1623-8, 1996
Oldfield et al. Lancet. 2002; 360(9326):47-53.
Oppenheimer et al. J Allergy Clin Immunol 1992; 90(2):256-62.
Palmer and Burks. Curr Opin Allergy Clin Immunol 2006; 6(3):202-6.
Palmer etal. Clin Immunol. 2005; 115(3):302-12
Peeters etal. Clin Exp Allergy. 2007; 37(1):108-15
Pene et al., J Allergy Clin Immunol 102: 571-8, 1998
Pomes et al. 2006, Clin. Exp.Allergy 36(6):824-30
Prickett et al. J Allergy Clin Immunol. 2011; 127(3):608-15 el-5.
Primeau et al., Clin Exp Allergy 30: 1135-43, 2000
Pumphrey R. Current Opinion in Allergy & Clinical Immunology. 2004; 4(4):285-90.
Robinson, Br Med Bull 56: 956-968, 2000
Rolland et al. Curr Opin Allergy Clin Immunol. 2010; В печати.
Rolland et al. Pharmacol Ther. 2009; 121(3):273-84.
Ruiter et al. Int Arch Allergy Immunol. 2007; 143(2): 119-26.
Rupa and Mine. Allergy. 2012; 67(1):74-82.
Sabatos-Peyton et al. Curr Opin Immunol 2010; 22(5):609-15.
Sampson etal,. N Engl J Med 327:380-4, 1992
Sampson et al. J Allergy Clin Immunol. 2006; 117(6): 1440-5.
Schultz et al., 1987, Gene., 54:113-123
Shek et al. J Allergy Clin Immunol. 2010; 126(2):324-31 e7.
Shreffler et al. Ann Allergy Asthma Immunol 2006; 96(6):865-9.
Shreffler et al. J Allergy Clin Immunol. 2004; 113(4):776-82.
Sicher et al., J Allergy Clin Immunol 103: 559-562, 1999
Sicherer et al. J Allergy Clin Immunol. 2010; 125(6):1322-6.
Sicherer et al., Paediatrics 102: e6,1998
Singh etal. Bioinformatics. 2001; 17(12):1236-7.
Suri et al. Curr Opin Immunol. 2006; 18(l):70-7.
Thyagarajan et al. J Allergy Clin Immunol 2010; 126(1):31-2.
van Boxtel et al. JAgric Food Chem. 2008; 56(6):2223-30.
van Neerven et al. J Immunol 1994; 152(8):4203-10.
Varney et al. 1991 British Medical Journal 302:265-269
Varshney et al. J Allergy Clin Immunol 2009; 124(6): 1351-2.
Varshney et al. J Allergy Clin Immunol 2011; 127(3):654-60.
Verhoef etal. Int Immunol. 1993; 5(12):1589-97.
Vita et al. Nucleic Acids Res. 2010; 38 (Номер в базе данных):В854-62.
Yang et al. Clin Exp Allergy. 2010; 40(4):668-78.
Yoshitomi et al.JPept Sci. 2007; 13(8):499-503.
Yun and Katelaris. Intern Med J. 2009; 39(7):475-8.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВАЯ ИММУНОТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЯ | 2014 |
|
RU2689552C2 |
| ИММУННАЯ МОДУЛЯЦИЯ | 2014 |
|
RU2709771C2 |
| ИММУННАЯ МОДУЛЯЦИЯ | 2014 |
|
RU2662927C2 |
| ГИБРИДНЫЕ БЕЛКИ-НОСИТЕЛИ ПЕПТИДОВ В КАЧЕСТВЕ ВАКЦИН ОТ АЛЛЕРГИИ | 2012 |
|
RU2630652C2 |
| НОВЫЕ ИММУНОГЕННЫЕ ПЕПТИДЫ | 2015 |
|
RU2709711C2 |
| МОЛОЧНАЯ СМЕСЬ СО СПЕЦИФИЧЕСКИМИ ПЕПТИДАМИ БЕТА-ЛАКТОГЛОБУЛИНА | 2019 |
|
RU2780747C2 |
| ЭПИТОПНЫЕ ПЕПТИДЫ RAB6KIFL/KIF20A И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2532105C2 |
| ПЕПТИДЫ HJURP И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2011 |
|
RU2570560C2 |
| ПЕПТИДЫ CDC45L И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ТАКОВЫЕ | 2010 |
|
RU2562160C2 |
| ПЕПТИД | 2014 |
|
RU2667428C2 |










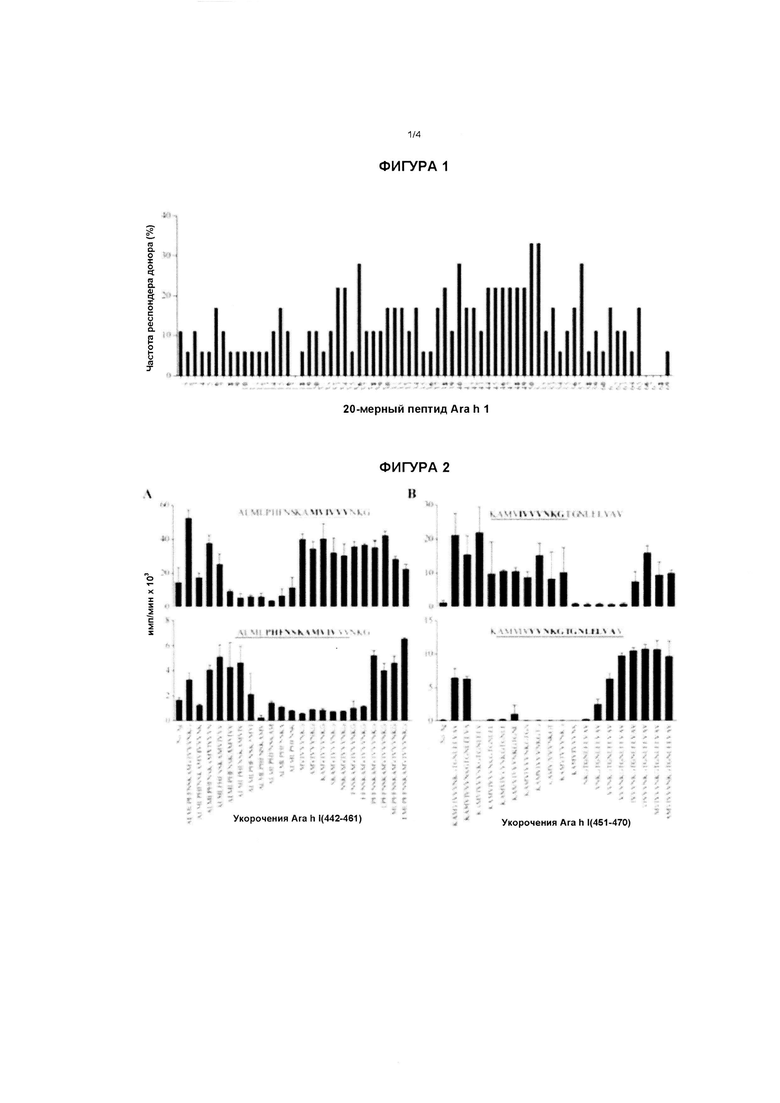
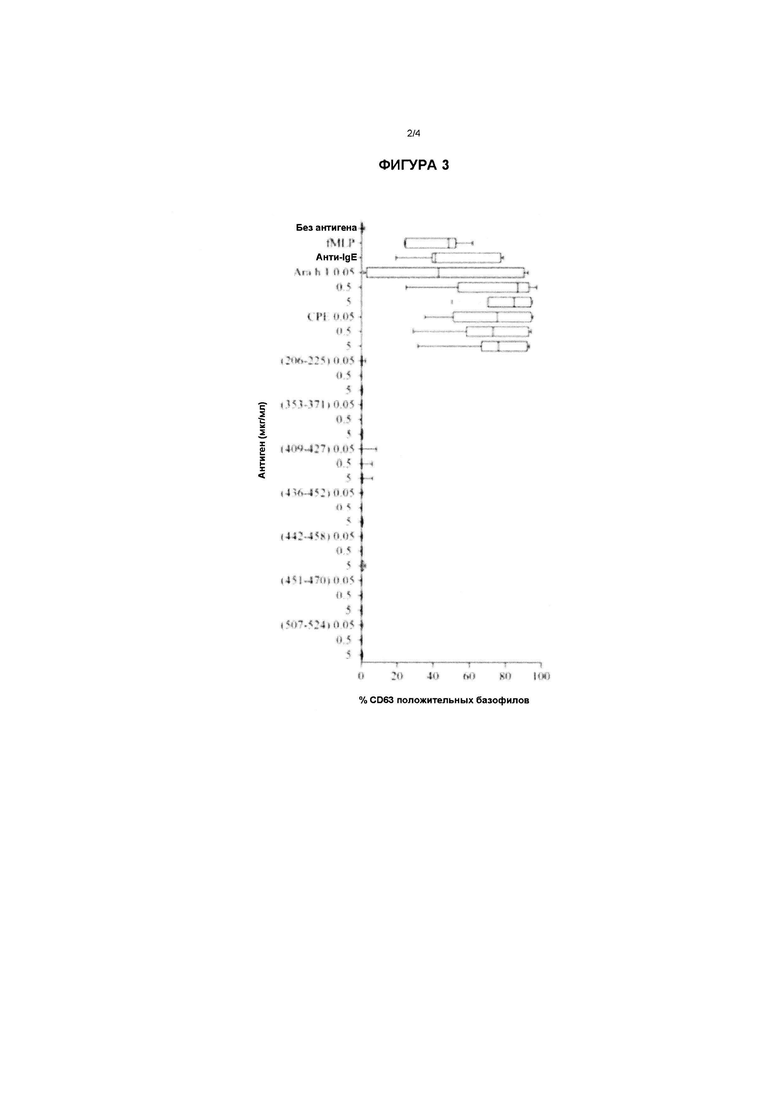
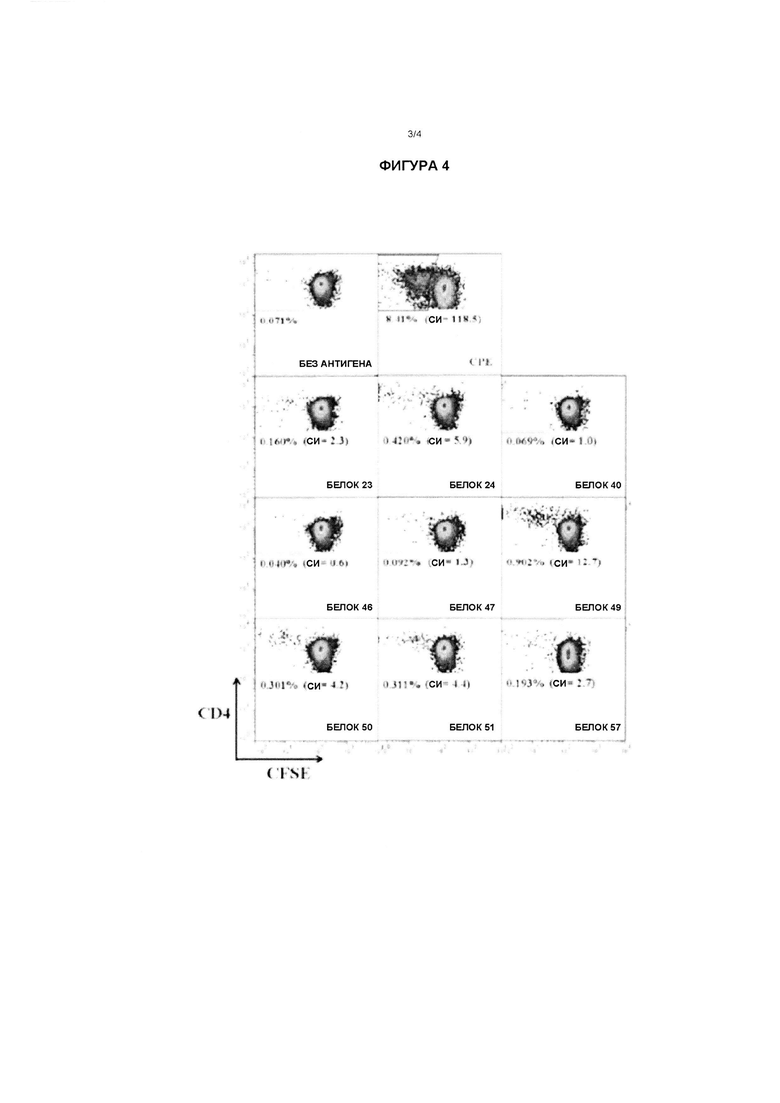
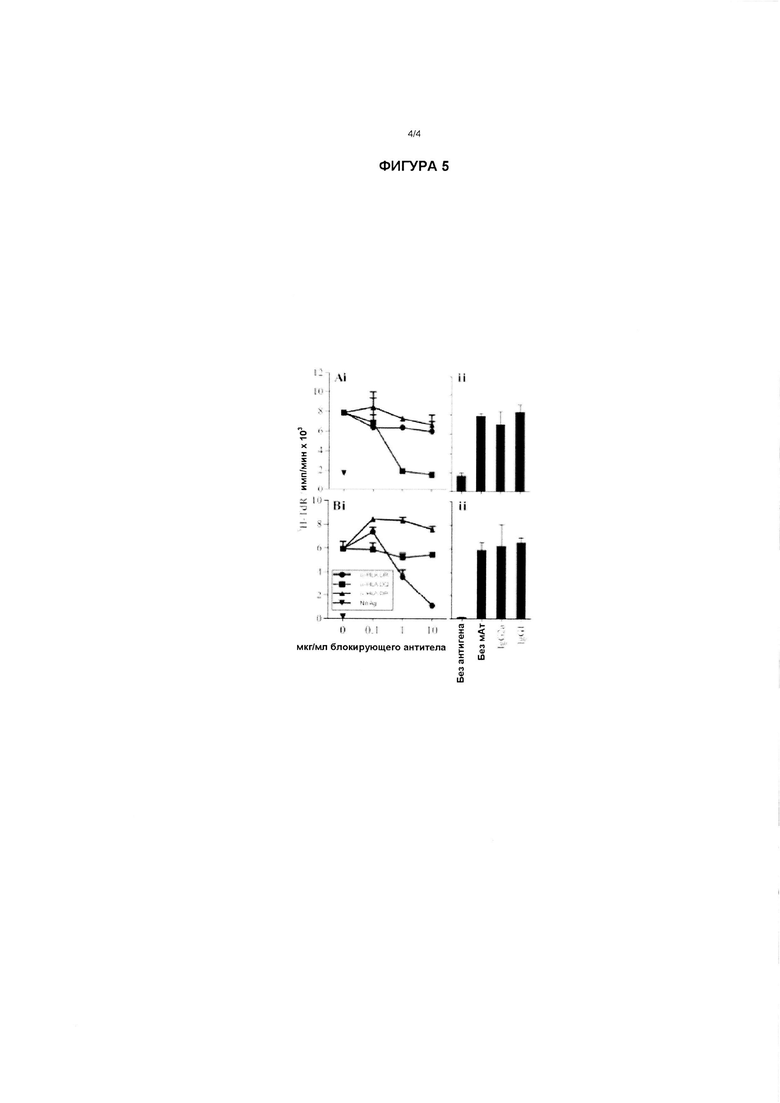
Настоящее изобретение относится к области биотехнологии, конкретно к иммунологии, и может быть использовано в медицине и диагностике состояний у млекопитающего, характеризующихся гиперчувствительностью к арахису или лесным орехам, которые содержат Ara h 1. Получены композиции из пептидов коровой эпитопной области Ara h 1 Т-клеток. Изобретение обеспечивает десенсибилизацию или индукцию иммунологической толерантности к Ara h 1. 10 н. и 14 з.п. ф-лы, 5 ил., 11 табл., 1 пр.
1. Композиция, содержащая эффективное количество по меньшей мере одного пептида, длина которого не превышает 60 аминокислот,
где по меньшей мере один пептид содержит по меньшей мере одну последовательность коровой эпитопной области Ara h 1 Т-клеток, выбранную из группы, включающей:
(i) EGALML (SEQ ID NO:6)
(ii) NEGVIVKVSK (SEQ ID NO:3)
(iii) PHFNSKAMVIV (SEQ ID NO:7),
для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
2. Композиция по п.1, отличающаяся тем, что указанная композиция содержит один или более пептидов, каждый из этих пептидов в длину составляет до 60 последовательно расположенных аминокислот, и эти пептиды содержат один или более указанных эпитопов Ara h 1 T-клеток.
3. Композиция, содержащая эффективное количество одного или более пептидов, каждый из этих пептидов в длину составляет до 60 последовательно расположенных аминокислот, и эти пептиды содержат коровую эпитопную область EGALML (SEQ ID NO:6) вместе с одним или несколькими эпитопами Ara h 1 Т-клеток, выбранными из списка, состоящего из:
(i) FQNLQNHR (SEQ ID NO:1)
(ii) IVQIEA (SEQ ID NO:2)
(iii) FGKLFEVK (SEQ ID NO:4)
(iv) IVVVN (SEQ ID NO:8)
(v) VVNKGTGNLEL (SEQ ID NO:9)
(vi) IMPAAHP (SEQ ID NO:10),
для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
4. Композиция, содержащая эффективное количество одного или более пептидов, каждый из которых в длину составляет до 60 последовательно расположенных аминокислот, и эти пептиды содержат коровую эпитопную область NEGVIVKVSK (SEQ ID NO:3) вместе с одним или несколькими эпитопами Ara h 1 Т-клеток, выбранными из списка, состоящего из:
(i) FQNLQNHR (SEQ ID NO:1)
(ii) IVQIEA (SEQ ID NO:2)
(iii) FGKLFEVK (SEQ ID NO:4)
(iv) EVKPDKKNPQLQ (SEQ ID NO:5)
(v) IVVVN (SEQ ID NO:8)
(vi) VVNKGTGNLEL (SEQ ID NO:9)
(vii) IMPAAHP (SEQ ID NO:10),
для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
5. Композиция по п.3, отличающаяся тем, что указанная композиция содержит по меньшей мере три пептида, по меньшей мере четыре пептида, по меньшей мере пять пептидов, по меньшей мере шесть пептидов, по меньшей мере семь пептидов, по меньшей мере восемь пептидов, по меньшей мере девять пептидов или десять пептидов.
6. Композиция по п.3, отличающаяся тем, что длина указанного пептида составляет 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот.
7. Композиция по п.3, отличающаяся тем, что длина указанного пептида равна 10-25 аминокислот, предпочтительно 15-25 аминокислот, предпочтительно 15-20 аминокислот, предпочтительно 10-20 аминокислот.
8. Композиция, содержащая эффективное количество одного или более пептидов, каждый из которых в длину составляет до 60 последовательно расположенных аминокислот, и эти пептиды содержат коровую эпитопную область VEIKEGALMLPHFNSKA (SEQ ID NO:23) вместе с одним или несколькими эпитопами Ara h 1 Т-клеток, выбранными из списка, состоящего из:
(i) FQNLQNHRIV (SEQ ID NO:12)
(ii) RIVQIEAKPNTLV (SEQ ID NO:13)
(iii) FQNLQNHRIVQIEAKPNTLV (SEQ ID NO:14)
(iv) WSTRSSENNEGVIVKVSKE (SEQ ID NO:15)
(v) STRSSENNEGVIVKVSKE (SEQ ID NO:16)
(vi) ENNEGVIVKVSKE (SEQ ID NO:17)
(vii) NNFGKLFEVKPDKKNPQ (SEQ ID NO:18)
(viii) EVKPDKKNPQLQ (SEQ ID NO:5)
(ix) NNFGKLFEVKPDKKNPQLQ (SEQ ID NO:21)
(x) SNNFGKLFEVKPDKKNPQLQ (SEQ ID NO:22)
(xi) ALMLPHFNSKAMVIVVV (SEQ ID NO:24)
(xii) KAMVIVVVNKG (SEQ ID NO:25)
(xiii) AMVIVVVNKGTGNLELVAV (SEQ ID NO:26)
(xiv) VVNKGTGNLELVAVRK (SEQ ID NO:27)
(xv) AMVIVVVNKGTGNLELV (SEQ ID NO:28)
(xvi) KAMVIVVVNKGTGNLELVAV (SEQ ID NO:29)
(xvii) GDVFIMPAAHPVAINASS (SEQ ID NO:30)
(xviii) VFIMPAAHPVAINASSE (SEQ ID NO:31)
(xix) GDVFIMPAAHPVAINASSE (SEQ ID NO:32)
(xx) VFIMPAAHPVAINASS (SEQ ID NO:33),
для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
9. Композиция по п.8, отличающаяся тем, что указанная композиция содержит пептид, определенный как SEQ ID NO:23, вместе с одним или несколькими пептидами, определенными как SEQ ID NO:5, 12-18, 21-22 или 24-33.
10. Композиция, содержащая один или более пептидов, каждый из которых в длину составляет до 60 последовательно расположенных аминокислот, и эти пептиды содержат коровую эпитопную область EGALML (SEQ ID NO:6) вместе с одним или несколькими эпитопами Ara h 1 Т-клеток, выбранными из списка, состоящего из:
(i) FQNLQNHRIVQIEAKPNTLV (SEQ ID NO:14)
(ii) WSTRSSENNEGVIVKVSKE (SEQ ID NO:15)
(iii) NNFGKLFEVKPDKKNPQLQ (SEQ ID NO:21)
(iv) VEIKEGALMLPHFNSKA (SEQ ID NO:23)
(v) ALMLPHFNSKAMVIVVV (SEQ ID NO:24)
(vi) KAMVIVVVNKGTGNLELVAV (SEQ ID NO:29)
(vii) GDVFIMPAAHPVAINASS (SEQ ID NO:30)
(viii) STRSSENNEGVIVKVSKE (SEQ ID NO:16)
(ix) VFIMPAAHPVAINASS (SEQ ID NO:33)
(x) EVKPDKKNPQLQ (SEQ ID NO:5),
для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
11. Композиция по п.10, отличающаяся тем, что указанная композиция содержит пептид, определенный как SEQ ID NO:6, вместе с одним или несколькими пептидами, определенными как SEQ ID NO:5, 14, 16, 23 или 33.
12. Композиция, содержащая молекулу нуклеиновой кислоты, содержащую кодирующую нуклеиновую кислоту в составе вектора экспрессии, для рекомбинантного получения эпитопов Ara h 1 Т-клеток, содержащая последовательность нуклеотидов, кодирующую по меньшей мере один пептид, длина которого не превышает 60 аминокислот, где по меньшей мере один пептид содержит по меньшей мере одну последовательность коровой эпитопной области Ara h 1 Т-клеток, выбранную из группы, включающей:
(i) EGALML (SEQ ID NO:6)
(ii) NEGVIVKVSK (SEQ ID NO:3) и
(iii) PHFNSKAMVIV (SEQ ID NO:7).
13. Способ лечения или профилактики состояния у млекопитающего, чье состояние характеризуется гиперчувствительностью к арахису или лесным орехам, которые содержат Ara h 1, причем указанный способ включает введение указанному млекопитающему эффективного количества композиции по любому из пп.1-11.
14. Способ по п.13, отличающийся тем, что указанные лесные орехи представляют собой фундук, миндаль или бразильские орехи.
15. Способ по п.13, отличающийся тем, что указанный способ десенсибилизирует или индуцирует иммунологическую толерантность к Ara h 1.
16. Способ по п.15, отличающийся тем, что указанная десенсибилизация или толерантность достигается с помощью индукции анергии Th2 или апоптоза.
17. Применение эффективного количества композиции по любому из пп.1-11 для получения лекарственного средства для лечения или профилактики состояния у млекопитающего, чье состояние характеризуется гиперчувствительностью к арахису или лесным орехам, которые содержат Ara h 1.
18. Применение по п.17, отличающееся тем, что указанные лесные орехи представляют собой фундук, миндаль или бразильские орехи.
19. Применение по п.17, отличающееся тем, что указанный способ десенсибилизирует или индуцирует иммунологическую толерантность к Ara h 1.
20. Применение по п.19, отличающееся тем, что указанная десенсибилизация или толерантность достигается с помощью индукции анергии Th2 или апоптоза.
21. Фармацевтическая композиция, содержащая эффективное количество композиции по любому из пп.1-11 вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями, для лечения или профилактики состояния у млекопитающего, которое характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1.
22. Способ диагностики или мониторинга состояния млекопитающего, причем это состояние характеризуется гиперчувствительностью к аллергену, присутствующему в композиции, содержащей Ara h 1, где указанный способ включает скрининг Т-клеток, реактивных в отношении Ara h 1, используя по меньшей мере один пептид, длина которого не превышает 60 аминокислот, где по меньшей мере один пептид содержит по меньшей мере одну последовательность коровой эпитопной области Ara h 1 Т-клеток, выбранную из группы, включающей:
(i) EGALML (SEQ ID NO:6)
(ii) NEGVIVKVSK (SEQ ID NO:3) и
(iii) PHFNSKAMVIV (SEQ ID NO:7).
23. Способ по п.22, отличающийся тем, что указанное состояние представляет собой гиперчувствительность к арахису или лесным орехам, которые содержат Ara h 1.
24. Способ по п.23, отличающийся тем, что указанные лесные орехи представляют собой фундук, миндаль или бразильские орехи.
| DELONG J.H | |||
| et al., Ara h 1-reactive T cells in individuals with peanut allergy,J | |||
| Allergy Clin | |||
| Immunol., 2011, v.127,n.5,p.1211-1218 | |||
| WO 2011106645 A1, 01.09.2011 | |||
| US 20100291145 A1, 18.11.2010 | |||
| US 20040265342 A1, 30.12.2004 | |||
| НОВЫЕ МУТАНТНЫЕ АЛЛЕРГЕНЫ | 2001 |
|
RU2285042C2 |
Авторы
Даты
2019-05-07—Публикация
2013-10-30—Подача