Область техники, к которой относится изобретение
Настоящее изобретение относится к новым рекомбинантным аллергенам, которые являются мутантами существующих в природе аллергенов. Изобретение относится также к композиции, включающей в себя смесь новых рекомбинантных мутантных аллергенов. Кроме того, изобретение относится к способу получения таких рекомбинантных мутантных аллергенов, а также к фармацевтическим композициям, включая вакцины, содержащим рекомбинантные мутантные аллергены. В дополнительных осуществлениях настоящее изобретение относится к способам индукции иммунных ответов у субъекта, вакцинации или лечения субъекта, а также к способам получения композиций согласно изобретению.
Известный уровень техники
Генетически предрасположенные индивидуумы становятся сенсибилизированными (аллергизированными) к антигенам, происходящим от разнообразных природных источников, к аллергенам, с которыми встречаются индивидуумы. Аллергическая реакция наступает тогда, когда ранее сенсибилизированный индивидуум повторно встречается с тем же самым или гомологичным антигеном. Аллергические ответы варьируют от сенной лихорадки, риноконъюнктивита, ринита и астмы до системной анафилаксии и смерти в ответ, например, на ужаливание пчелы или осы или укус насекомых. Реакция является немедленной и может быть вызвана множеством атопических аллергенов, таких как соединения, имеющиеся в травах, деревьях, сорняках, насекомых, пище, лекарствах, химических соединениях и парфюмерии.
Однако ответы не наступают, когда индивидуум встречается с аллергеном впервые. Развивается первоначальный адаптивный ответ, и обычно не возникает никаких симптомов. Но когда продуцируются антитела и Т-клетки, способные взаимодействовать с аллергеном, любая последующая экспозиция может провоцировать симптомы. Таким образом, аллергические ответы показывают, что сам иммунный ответ может вызвать существенные патологические состояния, которые могут представлять собой угрозу для жизни.
Антитела, вовлеченные в атопическую аллергию, принадлежат в первую очередь к иммуноглобулинам класса Е. IgE связываются со специфическими рецепторами на поверхности тучных клеток и базофилов. После образования комплекса специфического аллергена с IgE, связанным с тучными клетками, перекрестная сшивка рецепторов на клеточной поверхности ведет к проведению сигнала через рецепторы и физиологическому ответу клеток-мишеней. Дегрануляция заключается в высвобождении, среди прочего, гистамина, гепарина, хемотаксического фактора для эозинофильных лейкоцитов, лейкотриенов C4, D4 и E4, которые вызывают продолжительное сокращение клеток гладких мышц бронхов. Получаемые в результате этого эффекты могут быть системными или местными по природе.
Реакции гиперчувствительности, опосредуемые антителами, могут быть подразделены на четыре класса, обозначаемые как тип I, тип II, тип III и тип IV. Аллергические реакции типа I представляют собой классическую реакцию немедленной гиперчувствительности, наступающей в течение секунд или минут после экспозиции с антигеном. Данные симптомы опосредуются аллерген-специфичными IgE.
Обычно аллергические реакции наблюдаются в виде ответа на белковые аллергены, присутствующие, например, в пыльце, клещах домашней пыли, шерсти и перхоти животных, яде и пищевых продуктах.
Для того чтобы снизить или уничтожить аллергические реакции, обычно применяют точно контролируемое и повторное введение вакцин аллергенов. Вакцинацию аллергеном обычно осуществляют с помощью парентерального, интраназального или подъязычного введения в увеличивающихся дозах в течение довольно длительного периода времени, в результате чего происходит десенсибилизация пациента. Точный иммунологический механизм не известен, но индуцированные различия в фенотипе аллерген-специфичных Т-клеток, как предполагается, имеет особое значение.
Вакцинация аллергеном
Концепция вакцинации основывается на двух фундаментальных характеристиках иммунной системы, называемых специфичностью и памятью. Вакцинация будет праймировать иммунную систему реципиента и при повторной экспозиции со сходными белками иммунная система будет в состоянии более точно отвечать на контрольное заражение, например инфицирование микробами. Вакцины представляют собой смеси белков, предназначенные для применения при вакцинации, с целью выработки такого защитного иммунного ответа у реципиента. Защита должна охватывать только компоненты, присутствующие в вакцине, и гомологичные антигены. По сравнению с другими типами вакцинации вакцинация аллергеном осложняется существованием текущего иммунного ответа у пациентов с аллергией. Данный иммунный ответ характеризуется присутствием IgE, аллерген-специфичного, опосредующего реализацию аллергических симптомов при экспозиции с аллергенами. Таким образом, вакцинация аллергеном с применением аллергенов из природных источников имеет присущий ей риск побочных эффектов, имеющих весьма существенные последствия, угрожающие жизни пациента.
Попытки обойти данную проблему можно подразделить на три категории. При практических мерах часто сочетают более одной категории. Первая категория мер включает в себя введение нескольких небольших доз в течение продолжительного времени для достижения существенной аккумулированной дозы. Вторая категория мер включает в себя физическую модификацию аллергенов путем включения аллергенов в образующие гель вещества, такие как гидроксид алюминия. Состав гидроксида алюминия имеет эффект адъюванта и эффект депо для медленного высвобождения аллергена, снижающий тканевую концентрацию активных компонентов аллергена. Третья категория мер включает в себя химическую модификацию аллергенов с целью снижения аллергенности, т.е. связывания IgE.
Подробный механизм после успешной вакцинации аллергеном остается противоречивым. Установлено, однако, что Т-клетки играют ключевую роль в общей регуляции иммунных ответов. В соответствии с имеющимся в настоящее время всеобщим мнением отношение между двумя крайними фенотипами Т-клеток, Th1 и Th2 определяет аллергический статус индивидуума. При стимуляции аллергеном клетки Th1 секретируют интерлейкины с преобладанием интерферона-γ, что ведет к защитному иммунитету и к сохранению здоровья индивидуума. Клетки Th2, с другой стороны, секретируют преимущественно интерлейкин 4 и 5, что ведет к синтезу IgE и эозинофилии и к индукции аллергии у индивидуума. Исследования in vitro продемонстрировали возможность изменения ответов Т-клеток, аллерген-специфичных, путем нагрузки пептидами, происходящими из аллергена и содержащими эпитопы, связанные с Т-клетками. Имеющиеся в настоящее время подходы к новым вакцинам аллергенов, следовательно, основаны главным образом на воздействиях на Т-клетки с целью вызова ареактивности Т-клеток (индукция анергии) или переключения ответа с фенотипа Th2 на фенотип Th1.
Эпитопы, связывающие антитела (В-клеточные эпитопы)
Рентгеновский кристаллографический анализ комплексов Fab-антиген способствовал пониманию структуры эпитопов, связывающих антитела. В соответствии с данным типом анализа эпитопы, связывающие антитела, могут быть определены как часть поверхности антигена, включающая в себя атомы 15-25 аминокислотных остатков, которые находятся в пределах досягаемости атомов антитела, способных к прямому взаимодействию. Аффинность взаимодействия антиген-антитело не может быть предсказана только на основе энтальпии, в которую вносят вклад силы Ван-дер-Ваальса, водородные связи или ионные связи. Энтропия, связанная почти с полным удалением молекул воды с поверхности взаимодействия, дает сходный по величине энергетический вклад. Это означает, что совершенная подгонка между контурами взаимодействующих молекул является принципиальным фактором, лежащим в основе высокой аффинности взаимодействий антиген-антитело.
В патенте WO 97/30150 (ссылка 1) заявляется панель белковых молекул, причем белковые молекулы характеризуются распределением конкретных мутаций в аминокислотной последовательности по сравнению с родительским белком. Из описания ясно, что изобретение касается получения аналогов, которые являются модифицированными по сравнению с родительским белком, но которые захватываются, гидролизуются и представляются Т-клеткам тем же самым образом, что и родительский белок (природно существующие аллергены). Тем самым получают модифицированный Т-клеточный ответ. Библиотеки модифицированных белков получены с применением способов, обозначаемых как PM (экономный мутагенез).
В патенте WO 92/02621 (ссылка 2) описаны рекомбинантные молекулы ДНК, причем молекулы включают в себя ДНК, кодирующую полипептид, имеющий по меньшей мере один эпитоп аллергена деревьев рода Fagales, причем аллерген выбран из Aln g 1, Cor a 1 и Bet v 1. Описываемые в данном описании рекомбинантные молекулы все должны иметь аминокислотную последовательность или часть аминокислотной последовательности, которая соответствует последовательности природно существующего аллергена.
Патент WO 90/11293 (ссылка 3) относится, среди прочего, к выделенным пептидам аллергена пыльцы амброзии полыннолистной и к модифицированным пептидам пыльцы амброзии полыннолистной. Раскрытые в нем пептиды имеют последовательность аминокислот, соответствующую последовательности либо природно существующего аллергена, либо его природно существующих изоформ.
Химическая модификация аллергенов
Было предпринято несколько подходов к химической модификации аллергенов. Подходы начала семидесятых включают в себя химическое присоединение аллергенов к полимерам и химическую поперечную сшивку аллергенов с применением формальдегида и так далее с получением так называемых "аллергоидов". Рациональное обоснование данных подходов состояло в рандомизированном разрушении эпитопов, связывающих IgE, путем присоединения химического лиганда, в результате чего снижалось связывание IgE при сохранении иммуногенности за счет увеличенной молекулярной массы комплексов. Недостатки, присущие получению "аллергоидов", связаны с трудностями контролирования процесса химической поперечной сшивки и с трудностями в анализе и стандартизации получаемых в результате высокомолекулярных комплексов. "Аллергоиды" в настоящее время применяются в клинической практике, и за счет рандомизированного разрушения эпитопов, связывающих IgE, могут быть введены более высокие дозы по сравнению с общепринятыми вакцинами, но параметры безопасности и эффективности не улучшаются по сравнению с применением традиционных вакцин.
Более современные подходы к химической модификации аллергенов направлены на полное разрушение третичной структуры аллергена, причем уничтожается таким образом связывание IgE и предполагается, что важной мишенью терапевтического воздействия является аллерген-специфичная Т-клетка. Такие вакцины содержат синтетические пептиды, полученные на основе последовательности аллергена, представляющие собой минимальные эпитопы для Т-клеток, более длинные пептиды, представляющие собой связанные с Т-клетками эпитопы, синтетические пептиды, полученные на основе более длинной последовательности аллергена, представляющие собой области иммунодоминантных эпитопов для Т-клеток, или молекулы аллергенов, разрезанные на две половины с помощью рекомбинантных способов. Другой подход, основанный на данном рациональном обосновании, представляет собой предложение по использованию рекомбинантных изоформ с "низким связыванием IgE". В последние годы стало ясно, что природные аллергены являются гетерогенными, содержащими изоаллергены и варианты, в которых заменено приблизительно до 25% аминокислот. Некоторые рекомбинантные изоаллергены, как обнаружено, являются менее эффективными при связывании IgE, возможно из-за разрушения третичной структуры.
Мутагенез in vitro и вакцинация аллергеном
Попытки снизить аллергенность с помощью сайт-направленного мутагенеза in vitro предпринимали с применением нескольких аллергенов, включая Der f 2 (Takai et al., ссылка 4), Der p 2 (Smith et al., ссылка 5), 39 кДа аллерген Dermatophagoides farinae (Aki et a.l, ссылка 6), фосфолипазу А2 яда пчелы (Förster et al., ссылка 7), Ara h 1 (Burks et al., ссылка 8), Ara h 2 (Stanley et al., ссылка 9), Bet v 1 (Ferreira et al., ссылка 10 и 11), профилин березы (Wiedemann et al., ссылка 12) и Ory s 1 (Alvarez et al., ссылка 13).
Обоснование данных подходов опять основывается на аллерген-специфичных Т-клетках вместе с тем, в то же самое время на снижении риска побочных эффектов, опосредованных IgE, путем снижения или уничтожения связывания IgE с помощью нарушения третичной структуры рекомбинантного мутантного аллергена. Обоснование данных подходов не включает в себя концепцию доминантных эпитопов, связывающих IgE, и не включает в себя концепцию инициации нового защитного иммунного ответа, который также вовлекает В-клетки в выработку антител.
В статье Ferreira et al. (ссылка 11) описывается применение сайт-направленного мутагенеза с целью снижения связывания IgE. Хотя трехмерная структура Bet v 1 упоминается в статье, авторы не используют структуру для предсказания экспонированных в растворитель аминокислотных остатков в отношении мутации, половина из которых характеризуется низкой степенью экспонирования в растворитель. Скорее они применяют способ, разработанный для предсказания функциональных остатков в белках, отличный от представления о структуре, основанной на идентификации консервативных областей поверхности, описываемой в данном описании. Хотя авторы действительно обсуждают консерватизм третичной структуры α-углеродного скелета, данная концепция не является частью терапевтической стратегии, а просто включена для оценки связывания IgE in vitro. Более того, представленное доказательство не является адекватным, так как нормализация спектров КД препятствует оценке денатурации доли образца, что является обычной проблемой. Описанная терапевтическая стратегия направлена на индукцию толерантности аллерген-специфичных Т-клеток и инициация нового иммунного ответа не упоминается.
В статье Wiedemann et al. (ссылка 12) описывается применение сайт-направленного мутагенеза и пептидного синтеза с целью эпитопной характеристики моноклонального антитела. Авторы знают третичную структуру антигена и они применяют данное знание для отбора экспонированной на поверхности аминокислоты для мутации. Применяемый алгоритм может быть оценен как противоположный описанному изобретателями настоящего изобретения, так как выбирается аминокислота, отличающаяся от гомологичных последовательностей. Исследование показывает, что замена поверхностно расположенной аминокислоты способна модифицировать связывающие характеристики моноклонального антитела, что не удивительно, если учесть известные факты. Описанные эксперименты не предназначены для оценки модуляции связывания поликлональных антител, таких как сывороточные IgE, пациентов с аллергией. В одном из содержащихся там экспериментов действительно применяют IgE сыворотки и, хотя данный эксперимент не подходит для количественного анализа, на связывание IgE, очевидно, не повлияли сделанные мутации.
В статье Smith et al. (ссылка 5) описывается применение сайт-направленного мутагенеза с целью картирования эпитопов моноклонального антитела и снижения связывания IgE. Авторам не известна третичная структура и они не делают попытки оценить консерватизм третичной структуры α-углеродного скелета. Применяемый алгоритм не гарантирует того, что аминокислоты, выбранные для мутагенеза, действительно экспонируются на поверхности молекулы. Только один из описанных мутантов ведет к существенному снижению связывания IgE. Данный мутант характеризуется недостаточностью связывания со всеми тестируемыми антителами, что указывает на нарушение третичной структуры. Авторы не определяют терапевтическую стратегию, и инициация нового иммунного ответа не упоминается.
В статье Colombo et al. (ссылка 14) описывается исследование эпитопа, связывающего IgE, с помощью применения сайт-направленного мутагенеза и пептидного синтеза. Авторы применяют компьютерное моделирование трехмерной структуры, основанное на кристаллической структуре гомологичного белка, для иллюстрации присутствия эпитопа на поверхности молекулы. Дополнительное присутствие эпитопа на отличном аллергене, имеющем гомологию первичной структуры, достигается применением синтетических пептидов, представляющих эпитоп. Терапевтическая стратегия основывается на лечении с применением данного синтетического пептида, представляющего эпитоп, связывающийся с моновалентным IgE. Консервативные области поверхности между гомологичными аллергенами, а также терапевтическая концепция инициации нового защитного иммунного ответа не упоминаются.
В статье Spangfort et al. (ссылка 15) описывается трехмерная структура и консервативные расположенные на поверхности зоны главного аллергена березы. В статье не упоминаются ни главные эпитопы, связывающие IgE, ни сайт-направленный мутагенез, ни цели терапевтического применения.
Ни в одном из исследований, описанных выше, связывание IgE не снижалось при замене экспонированных на поверхности аминокислот при сохранении третичной структуры α-углеродного скелета. Обоснование упомянутых выше подходов не включает в себя концепцию доминантных эпитопов связывания IgE и не включает в себя терапевтическую концепцию инициации нового защитного иммунного ответа.
В патенте WO 99/47680 раскрыто введение искусственных аминокислотных замен в определенные критические положения при сохранении третичной структуры α-углеродного скелета аллергена. В частности, в патенте WO 99/47680 раскрыт рекомбинантный аллерген, который является неприродным мутантом, ведущим начало от природного аллергена, в котором по меньшей мере один экспонированный на поверхности консервативный аминокислотный остаток эпитопа В-клеток заменен другим остатком, который не находится в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономического порядка, от которого происходит указанный природный аллерген, причем указанный мутантный аллерген имеет по существу ту же самую третичную структуру α-углеродного скелета, что и указанный природный аллерген, и специфическое связывание IgE с мутантным аллергеном снижалось по сравнению со связыванием с указанным природным аллергеном.
Рекомбинантный аллерген, раскрытый в патенте WO 99/47680, получают путем a) идентификации аминокислотных остатков в природном аллергене, которые сохраняются более чем с 70% идентичностью во всех известных гомологичных белках, в пределах таксономического порядка, от которого происходит указанный природный аллерген, b) определения по меньшей мере одной зоны консервативных аминокислотных остатков, согласованно соединенных на протяжении по меньшей мере 400 Å2 поверхности трехмерной молекулы аллергена, как определяется наличием доступности для растворителя, составляющей по меньшей мере 20%, причем по меньшей мере одна зона включает в себя по меньшей мере один эпитоп В-клеток, и с) замены по меньшей мере одного аминокислотного остатка в указанной по меньшей мере одной зоне другой аминокислотой, которая является неконсервативной в конкретном положении и при этом по существу сохраняет общую третичную структуру α-углеродного скелета молекулы аллергена.
Краткое описание чертежей
На фиг.1 показаны специфичные для мутанта олигонуклеотидные праймеры, примененные для мутанта номер 1 Bet v 1. Мутантные нуклеотиды подчеркнуты.
На фиг.2 показаны два общеприменимых праймера (обозначенных "полностью смысловой" и "полностью антисмысловой"), которые синтезировали и применяли для всех мутантов.
На фиг.3 показана ДНК и аминокислотная последовательность природного аллергена 1 Bet v 1, а также ряд мутаций Bet v 1.
На фиг.4 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Glu45Ser.
На фиг.5 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Asn28Thr+Lys32Gln.
На фиг.6 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Pro108Gly.
На фиг.7 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Glu60Ser.
На фиг.8 показаны спектры КД рекомбинанта и мутанта по трем зонам, записанные при концентрациях, близких к равным.
На фиг.9 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 по трем зонам.
На фиг.10А-D показана доступность для растворителя индивидуально выровненных остатков антигена 5 и выравнивание последовательностей антигена 5 Vespula (левая панель). На правой панели фигуры 10 показана молекулярная поверхность антигена 5 с консервативными среди антигена 5:s Vespula областями.
На фиг.11 показана последовательность праймера, соответствующего аминоконцу Ves v 5, ведущая начало от смысловой цепи. Последовательность нижнего праймера берет начало от антисмысловой цепи.
На фиг.12 показаны два общеприменимых праймера (обозначенных "полностью смысловой" и "полностью антисмысловой"), которые синтезировали и применяли для всех мутантов.
На фиг.13 показана ДНК и аминокислотная последовательность природного аллергена Ves v 5, а также две мутации Ves v 5.
На фиг.14 показано ингибирование связывания биотинилированного рекомбинантного Ves v 5 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Ves v 5 и мутантом Ves v 5 Lys72Ala.
На фиг.15А и В показана теоретическая модель взаимодействия между аллергеном и тучными клетками посредством перекрестного взаимодействия с IgE.
На фиг.16 показана ДНК и аминокислотная последовательность природного аллергена Der p 2.
На фиг.17 схематически показаны праймеры, примененные для создания мутаций. (I) показывает смысловой и антисмысловой праймеры. (II) показывает конечный рекомбинантный белок, несущий мутации в указанных положениях.
На фиг.18 показана иллюстрация конструирования мутантов Bet v 1 и перечень примененных праймеров. Мутанты содержат от пяти до девяти аминокислот.
На фиг.19 показаны введенные точечные мутации на поверхности Bet v 1 (2628) и Bet v 1 (2637). В мутант Bet v 1 (2628) вводили пять первичных мутаций в одну половину Bet v 1, при этом другая половина оставалась неизмененной. В мутант Bet v 1 (2637) вводили пять первичных и три вторичных мутации в другую половину, при этом первая половина оставалась неизмененной.
На фиг.20 показаны спектры кругового дихроизма (КД) рекомбинантного Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2637), записанные при почти равных концентрациях.
На фиг.21 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1.2801 (дикого типа) с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1.2801 и Bet v 1 (2628), Bet v 1 (2637) и смесью 1:1 Bet v 1 (2628) и Bet v 1 (2637).
На фиг.22 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа), Bet v 1 (2628) и Bet v 1 (2637).
На фиг.23 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа), Bet v 1 (2628) и Bet v 1 (2637).
На фиг.24 показаны точечные мутации на поверхности Bet v 1 (2744).
На фиг.25 показаны точечные мутации на поверхности Bet v 1 (2753).
На фиг.26 показаны точечные мутации на поверхности Bet v 1 (2744) и Bet v 1 (2753).
На фиг.27 показаны спектры кругового дихроизма (КД) Bet v 1.2801 (дикого типа) и Bet v 1 (2744), записанные при почти равных концентрациях.
На фиг.28 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2744).
На фиг.29A-D показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2744).
На фиг.30 показаны точечные мутации на поверхности Bet v 1 (2733).
На фиг.31 показаны праймеры, примененные для сайт-направленного мутагенеза, Der p 2.
На фиг.32А-С показано выравнивание последовательности Der p 2 с другой группой 2 аллергенов клещей домашней пыли.
На фиг.33 показаны контуры поверхности Der p 2 под четырьмя различными углами.
На фиг.34 показаны контуры поверхности мутанта Der p 2 под четырьмя различными углами.
На фиг.35А и B показано выравнивание последовательности Der p 2 с другой группой 1 аллергенов клещей домашней пыли.
На фиг.36 показаны контуры поверхности Der p 1 под четырьмя различными углами.
На фиг.37 показаны контуры поверхности мутанта Der p 1 под четырьмя различными углами.
На фиг.38A-D показано выравнивание последовательности Phl p 5 c другой группой 5 аллергенов травы.
На фиг.39A и B показаны контуры поверхности Phl p 5, модель A и модель B соответственно, под четырьмя различными углами.
На фиг.40A и B показаны контуры поверхности мутанта Phl p 5, модель A и B соответственно, под четырьмя различными углами.
На фиг.41 показана пролиферация лимфоцитов периферической крови, выраженная в виде индекса стимуляции (SI), для различных препаратов Bet v 1.
На фиг.42-44 показан профиль цитокинов Т-клеток, стимулированных различными препаратами Bet v. На фиг.42 показан больной с профилем Th0, на фиг.43 - профиль Th1, и на фиг.44 - профиль Th2.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Обоснование настоящего изобретения
Настоящее изобретение основано на уникальном обосновании. В соответствии с данным обоснованием механизмом успешной вакцинации аллергеном является не изменение текущего иммунного ответа типа Th2, а предпочтительно параллельная инициация нового иммунного ответа, включающего в себя узнавание В-клетками эпитопа, сформированного на базе третичной структуры, и образование антител. Предполагается, что новый иммунный ответ частично представляет собой иммунный ответ типа Th1. Данная модель подтверждается обнаружением того, что на уровни специфических IgE не влияет успешное проведение вакцинации и данное успешное лечение часто сопровождается существенным ростом аллерген-специфичных IgG4. Кроме того, исследования биоптатов носовой полости перед нагрузкой аллергеном и после нее не указывают на снижение Т-клеток с Th2-подобным фенотипом, но наблюдается предпочтительно увеличение Т-клеток с Th1-подобным фенотипом. Когда вакцину (или фармацевтические композиции) вводят другим путем, отличным от воздушного, предполагается, что новый иммунный ответ развивается в месте, физически отделенном от текущего Th2 ответа, что обеспечивает тем самым возможность параллельного существования двух ответов.
Другим важным аспектом иммунной системы является признание существования так называемых доминантных эпитопов, связывающих IgE. Предполагается, что данные доминантные эпитопы, связывающие IgE, сформированы сцепленными областями поверхности, зависящими от третичной структуры, достаточно большими, чтобы приспособить связывание антитела и консервативных эпитопов среди изоаллергенов, вариантов и/или гомологичных аллергенов от родственных видов. Существование перекрестно реактивных IgE, способных связывать сходные эпитопы на гомологичных аллергенах, поддерживается клиническим наблюдением, что больные аллергией часто реагируют на несколько близкородственных видов, например ольху, березу и орешник, многие виды трав или несколько видов клещей домашней пыли рода Dermatophagoides. Это дополнительно поддерживается лабораторными экспериментами, демонстрирующими перекрестную реактивность IgE между гомологичными аллергенами от родственных видов и способность одного аллергена ингибировать связывание IgE с гомологичными аллергенами (Ipsen et al., 1992, ссылка 16). Хорошо известно, что экспозиция и иммунные ответы связаны дозо-зависимым образом. Основываясь на сочетании данных наблюдений, предполагается, что консервативные области поверхности предъявляются иммунной системе в более высоких дозах, чем неконсервативные области поверхности, что в результате ведет к выработке антител IgE с более высокой аффинностью, отсюда термин "доминантные эпитопы, связывающие IgE".
В соответствии с данным обоснованием существенно, чтобы аллерген имел третичную структуру α-углеродного скелета, которая по существу является той же самой, что и природный аллерген, обеспечивая таким образом консервативность топологии поверхности областей, окружающих консервативные зоны, представляющие собой мишени для мутагенеза, предназначенного для снижения связывания IgE. Удовлетворяющий данным критериям аллерген может вводиться в относительно более высоких дозах, что улучшает его эффективность в отношении выработки защитного иммунного ответа без риска для безопасности.
Более того, изобретение основывается на данных о том, что триггером для аллергических симптомов является перекрестное связывание аллергена с двумя специфичными IgE, связанными с поверхностью эффекторных клеток, т.е. тучных клеток и базофилов, через высокоаффинный рецептор IgE, FceRI. Для иллюстрации авторы ссылаются на фиг.15, на которой изображена теоретическая модель аллергена с эпитопами, связывающими IgE. На индукцию высвобождения медиатора тучной клеткой и, отсюда, на аллергические симптомы влияет опосредованное аллергеном перекрестное связывание IgE, связанного с поверхностью тучной клетки, сравните фиг.15А. В случае, представленном на фиг.15В, два эпитопа подвергают мутагенезу так, чтобы снизить их связывающую способность по отношению к IgE, и, следовательно, опосредуемое аллергеном перекрестное связывание предотвращается. В этой связи должно быть отмечено, что аллергены обычно включают в себя более трех В-клеточных эпитопов. Однако на основе теоретической модели, изображенной на фиг.15, можно предположить, что чем больше эпитопов, которые подвергают мутагенезу так, чтобы уничтожить или снизить их связывающую способность по отношению к IgE, тем ниже риск опосредуемого аллергеном перекрестного связывания и возникающих в результате этого аллергических симптомов.
Однако для того чтобы мутантный аллерген был способен вызывать новый иммунный ответ, включая IgG ответ, аллерген должен включать в себя по меньшей мере один интактный эпитоп. Предпочтительно, чтобы интактный эпитоп представлял собой доминантный эпитоп, так как такой мутантный аллерген должен обеспечивать улучшенную защиту при применении для вакцинации.
В заключение изобретательская идея настоящего изобретения основывается на признании того, что мутантный аллерген, несущий мутации, снижающие связывание с IgE, во многих В-клеточных эпитопах, и по меньшей мере один интактный эпитоп должен, с одной стороны, снижать опосредуемое аллергеном перекрестное связывание и, с другой стороны, давать возможность индукции IgG ответа со связывающей способностью, конкурирующей с IgE. Таким образом, указанный мутантный аллерген должен быть крайне выгодным аллергеном в результате того, что риск анафилактических реакций должен быть существенно снижен.
Настоящее изобретение также основано на признании того, что вакцина, содержащая смесь различных мутированных указанным образом аллергенов, где в идеале многие или все эпитопы представлены как интактные, должна быть столь же эффективной по свой способности индуцировать защиту против аллергических симптомов, как и природно существующий аллерген, от которого произошли мутантные аллергены.
Краткое изложение существа изобретения
Настоящее изобретение относится к введению искусственных аминокислотных замен в ряд определенных критических положений, т.е. эпитопы, связывающие IgE, с целью снижения специфической IgE-связывающей способности каждого мутантного эпитопа.
В изобретении предлагается рекомбинантный аллерген, отличающийся тем, что он является мутантом природно существующего аллергена, где мутантный аллерген имеет по меньшей мере четыре первичных мутации, каждая из которых снижает специфическую IgE-связывающую способность мутантного аллергена по сравнению с IgE-связывающей способностью указанного природно существующего аллергена, где каждая первичная мутация является заменой одного экспонированного на поверхности аминокислотного остатка другим остатком, который не встречается в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономических видов, из которых происходит указанный природно существующий аллерген, где каждая первичная мутация разделена с каждой другой первичной мутацией промежутком по меньшей мере в 15 Å и где первичные мутации расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной 800 Å2 не содержит мутации.
Не связывая себя теорией, авторы предполагают, что В-клеточные эпитопы могут быть распределены почти по всей поверхности аллергена. Более того, существует экспериментальное доказательство того, что по меньшей мере некоторые эпитопы составляют часть кластера эпитопов, включающего в себя большое количество перекрывающихся эпитопов. Следовательно, теоретическая основа настоящего изобретения заключается в том, что любая экспонированная на поверхности аминокислота является потенциальным сайтом для мутации, которая может приводить к пониженной способности связывания IgE.
Соответственно, первичные мутации определяют по их расположению по отношению друг к другу, т.е. они распределены по отдельности, с тем чтобы была уверенность, что они представляют собой мутации в отдельных кластерах эпитопов.
В настоящем изобретении также предлагается композиция, включающая в себя два или более указанных выше рекомбинантных мутантных аллергенных варианта, где каждый вариант определяется как имеющий по меньшей мере одну главную мутацию, которая отсутствует по меньшей мере в одном из других вариантов, где в каждом варианте не присутствует вторичной мутации в радиусе 15 Å от каждой отсутствующей первичной мутации. Композиция предпочтительно включает в себя 2-12, более предпочтительно 3-10, еще более предпочтительно 4-8 и наиболее предпочтительно 5-7 вариантов.
В настоящем изобретении также предлагается способ получения указанного выше рекомбинантного аллергена, отличающийся тем, что
а) в природно существующем аллергене идентифицируют ряд аминокислотных остатков, которые имеют по меньшей мере 20% доступность для растворителя;
b) выбирают по меньшей мере четыре идентифицированных аминокислотных остатка таким образом, что каждая выбранная аминокислота разделена с другой выбранной аминокислотой промежутком по меньшей мере в 15 Å и что выбранные аминокислоты расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной 800 Å2 не содержит выбранной аминокислоты, и
с) осуществляют первичную мутацию каждой из выбранных аминокислот, которая снижает специфическую IgE-связывающую способность мутантного аллергена по сравнению со связывающей способностью указанного природно существующего аллергена, где каждая первичная мутация представляет собой замену выбранного аминокислотного остатка другой аминокислотой, которая не существует в том же самом положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономического вида, от которого происходит указанный природно существующий аллерген.
В альтернативном аспекте изобретение относится к способу получения рекомбинантного аллергена в соответствии с изобретением, отличающемуся тем, что аллерген получают из последовательности ДНК, полученной с помощью перетасовки ДНК (молекулярной селекции), от ДНК, кодирующей соответствующий природно существующий аллерген.
Более того, изобретение относится к указанному выше рекомбинантному аллергену для применения в качестве фармацевтического средства.
Кроме того, изобретение относится к применению указанного выше рекомбинантного аллергена для получения фармацевтического средства для профилактики и/или лечения аллергии.
Более того, изобретение относится к указанной выше композиции для применения в качестве фармацевтического средства.
Также изобретение относится к применению указанной выше композиции для получения фармацевтического средства для профилактики и/или лечения аллергии.
Далее, изобретение относится к указанной выше фармацевтической композиции, отличающейся тем, что она включает в себя указанный выше рекомбинантный аллерген или указанную выше композицию необязательно в сочетании с фармацевтически приемлемым носителем и/или эксципиентом и необязательно с адъювантом. Фармацевтическая композиция в соответствии с изобретением может быть в форме вакцины против аллергических реакций, вызываемых природно существующим аллергеном у пациентов, страдающих от аллергии.
Также изобретение относится к способу выработки иммунного ответа у субъекта, включающему в себя введение субъекту указанного выше рекомбинантного аллергена, указанной выше композиции или указанной выше фармацевтической композиции.
Далее, изобретение относится к вакцинации или лечению субъекта, включающим в себя введение субъекту указанного выше рекомбинантного аллергена, указанной выше композиции или указанной выше фармацевтической композиции.
Также изобретение относится к способу получения указанной выше фармацевтической композиции, включающему в себя смешивание указанного выше рекомбинантного аллергена или указанной выше композиции с фармацевтически приемлемыми веществами и/или эксципиентами.
Далее, изобретение относится к фармацевтической композиции, получаемой с помощью указанного выше способа.
Также изобретение относится к способу лечения, профилактики или облегчения аллергических реакций у субъекта, включающему в себя введение субъекту указанного выше рекомбинантного аллергена, указанной выше композиции или указанной выше фармацевтической композиции.
Далее, изобретение относится к последовательности ДНК, кодирующей аллерген в соответствии с изобретением, к ее производному, к части данной последовательности, к ее вырожденной последовательности или к последовательности, которая с ней гибридизуется в жестких условиях, где указанное производное, частичная последовательность, вырожденная последовательность или гибридизующаяся последовательность кодирует пептид, имеющий по меньшей мере один В-клеточный эпитоп.
Также изобретение относится к экспрессионному вектору, включающему в себя ДНК в соответствии с изобретением.
Более того, изобретение относится к клетке-хозяину, включающей в себя экспрессионный вектор в соответствии с изобретением.
Дополнительно изобретение относится к способу получения рекомбинантного мутантного аллергена, включающему в себя стадию культивирования клетки-хозяина в соответствии с изобретением.
Наконец, изобретение относится к рекомбинантному аллергену в соответствии с изобретением или кодируемому последовательностью ДНК в соответствии с изобретением, включающему в себя по меньшей мере один Т-клеточный эпитоп, способный стимулировать клон Т-клеток, или Т-клеточную линию, специфичную в отношении природно существующего аллергена.
Мутанты в соответствии с изобретением должны предпочтительно быть способны стимулировать аллерген-специфичные Т-клеточные линии сходным образом/в сходной степени при измерении с помощью индекса стимуляции Т-клеток.
Подробное описание изобретения
В предпочтительном осуществлении изобретения первичные мутации разделены промежутками в 20 Å, предпочтительно 25 Å и наиболее предпочтительно 30 Å.
Предполагается, что аллерген включает в себя ряд потенциальных связывающих областей для специфичных IgE, где каждая область имеет размер приблизительно 800 Å2, причем область поверхности включает в себя большое число перекрывающихся эпитопов. Таким образом, аллерген имеет количество потенциальных первичных мутаций области поверхности, разделенной на 800 Å2.
Предпочтительно, чтобы рекомбинантный аллерген в соответствии с изобретением включал в себя от 5 до 20, предпочтительно от 6 до 15, более предпочтительно от 7 до 12 и наиболее предпочтительно от 8 до 10, первичных мутаций.
В предпочтительном осуществлении изобретения область поверхности, не включающая в себя мутации, составляет зону в 700 Å2, предпочтительно в 600 Å2, более предпочтительно в 500 Å2 и наиболее предпочтительно в 400 Å2.
В предпочтительном осуществлении изобретения рекомбинантный аллерген включает в себя ряд вторичных мутаций, каждая из которых снижает специфическую IgE-связывающую способность мутантного аллергена по сравнению со связывающей способностью указанного природно существующего аллергена, где каждая вторичная мутация является заменой одного экспонированного на поверхности аминокислотного остатка другим остатком, который не встречается в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономических видов, из которых происходит указанный природно существующий аллерген, где вторичные мутации расположены вне указанной круговой области поверхности.
Вторичные мутации могут быть локализованы в непосредственной близости от первичных мутаций, т.е. вторичная мутация вполне может быть дополнительной мутацией того же самого эпитопа, который был мутирован при первичной мутации.
В предпочтительном осуществлении изобретения по меньшей мере одна из экспонированных на поверхности аминокислот, заменяемая в природно существующем аллергене, имеет доступность для растворителя выше 20%, предпочтительно выше 30%, более предпочтительно выше 40% и наиболее предпочтительно выше 50%.
В другом предпочтительном осуществлении изобретения по меньшей мере одна из экспонированных на поверхности аминокислот, заменяемая в природно существующем аллергене, является консервативной более чем с 70%, предпочтительно 80% и наиболее предпочтительно 90% идентичностью во всех известных гомологичных белках в пределах видов, из которых происходит указанный природно существующий аллерген.
Предпочтительно, чтобы рекомбинантный аллерген в соответствии с изобретением имел ту же самую третичную структуру α-углеродного скелета, что и указанный природно существующий аллерген.
При сравнении третичных структур α-углеродного скелета молекул мутантного и природно существующего аллергена средняя величина корня среднеквадратичного отклонения атомных координат составляет предпочтительно ниже 2 Å.
В предпочтительном осуществлении рекомбинантного аллергена согласно изобретению каждый аминокислотный остаток, включаемый в мутантный аллерген, не встречается в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономического рода, предпочтительно подсемейства, более предпочтительно - семейства, более предпочтительно - суперсемейства, более предпочтительно - легиона, более предпочтительно - подотряда и наиболее предпочтительно - отряда, из которого происходит указанный природно существующий аллерген.
В предпочтительном осуществлении изобретения рекомбинантный мутантный аллерген в соответствии с изобретением представляет собой не существующий в природе аллерген.
Специфическое связывание IgE с мутантным аллергеном предпочтительно снижается по меньшей мере на 5%, предпочтительно по меньшей мере на 10% по сравнению с природно существующими изоаллергенами или сходными рекомбинантными белками в иммунологических тестах с сыворотками, полученными у пациентов с аллергией, реагирующих на специфический IgE источник, или их пулами.
Другим путем оценки сниженного связывания IgE и сниженной способности опосредовать перекрестное связывание мутанта является способность мутанта инициировать высвобождение гистамина (HR). Высвобождение гистамина может быть измерено в нескольких тестах по определению высвобождения гистамина. Сниженная способность мутантов высвобождать гистамин происходит из-за сниженной аффинности специфического IgE, связанного с клеточной поверхностью, а также их сниженной способности облегчать перекрестное связывание. HR предпочтительно снижается на 5-100%, более предпочтительно на 25-100%, еще более предпочтительно на 50-100% и наиболее предпочтительно на 75-100% для мутантов согласно изобретению по сравнению с природно существующими аллергенами.
Обычно круговая область поверхности с зоной в 800 Å2, не содержащая мутации, включает в себя атомы 15-25 аминокислотных остатков.
Предпочтительный рекомбинантный аллерген в соответствии с изобретением отличается тем, что экспонированные на поверхности аминокислотные остатки ранжированы в отношении доступности для растворителя, и тем, что одна или более аминокислот среди более доступных для растворителя заменены.
Дополнительный предпочтительный рекомбинантный аллерген в соответствии с изобретением отличается тем, что экспонированные на поверхности аминокислотные остатки ранжированы в отношении степени консервативности во всех известных гомологичных белках в пределах видов, из которых происходит указанный природно существующий аллерген, и тем, что одна или более аминокислот среди более консервативных заменены.
Предпочтительно рекомбинантный аллерген в соответствии с изобретением включает в себя от 1 до 4 вторичных мутаций на первичную мутацию.
Предпочтительное осуществление изобретения отличается тем, что одна или более замен осуществляется с помощью сайт-направленного мутагенеза.
Другое предпочтительное осуществление изобретения отличается тем, что одна или более замен осуществляется с помощью случайного мутагенеза.
Дополнительное предпочтительное осуществление изобретения отличается тем, что одна или более замен осуществляется с помощью перетасовки ДНК.
Рекомбинантные аллергены в соответствии с изобретением могут быть подходящим мутантом вдыхаемого аллергена, происходящего, кроме прочего, от деревьев, трав, растений, грибов, клещей домашней пыли, тараканов, а также волос животных и перхоти. Важными аллергенами пыльцы деревьев, трав и растений являются те, которые происходят из таксономических отрядов Fagales, Oleales и Pinales, включая, среди прочего, березу (Betula), ольху (Alnus), орешник (Corylus), граб (Carpinus) и оливу (Olea), отряда Poales, включая, среди прочего, травы родов Lolium, Phleum, Poa, Cynodon, Dactylis и Secale, отряды Asterales и Urticales, включая, среди прочего, растения родов Ambrosia и Artemisia. Важными вдыхаемыми аллергенами грибов являются, среди прочего, такие, которые происходят из родов Alternaria и Cladosporium. Другими важными вдыхаемыми аллергенами являются такие, которые происходят от клещей домашней пыли рода Dermatophagoides, которые происходят от тараканов и которые происходят от животных, таких как кошка, собака и лошадь. Кроме того, рекомбинантные аллергены в соответствии с изобретением могут быть мутантами аллергенов ядов, включая такие, которые происходят от жалящих или кусающихся насекомых, таких как те, которые происходят от таксономического отряда Hymenoptera, включая пчел (суперсемейство Apidae), ос (суперсемейство Vespidea) и муравьев (суперсемейство Formicoidae).
Специфические аллергические компоненты включают в себя, например, Bet v 1 (B. verrucosa, береза), Aln g 1 (Alnus glutinosa, ольха), Cor a 1 (Corylus avelana, орешник) и Car b 1 (Carpinus betulus, граб) отряда Fagales. Другие представляют собой Cry j 1 (Pinales), Amb a 1 и 2, Art v 1 (Asterales), Par j 1 (Urticales), Ole e 1 (Oleales), Ave e 1, Cyn d 1, Dac g 1, Fes p 1, Hol 1 1, Lol p 1 и 5, Pas n 1, Phl p 1 и 5, Poa p 1, 2 и 5, Sec c 1 и 5, и Sor h 1 (различные типы пыльцы травы), Alt a 1 и Cla h 1 (грибы), Der f 1 и 2, Der p 1 и 2 (клещи домашней пыли, D. farinae и D. pteronyssinus соответственно), Lep d 1 и 2 (Lepidoglyphus destructor; клещи хранилищ), Bla g 1 и 2, Per a 1 (тараканы, Blatella germanica и Periplaneta americana соответственно), Fel d 1 (кошка), Can f 1 (собака), Equ c 1, 2 и 3 (лошадь), Apis m 1 и 2 (рабочая пчела), Ves v 1, 2 и 5, Pol a 1, 2 и 5 (все для ос) и Sol i 1, 2, 3 и 4 (муравей Рихтера).
В одном осуществлении рекомбинантный аллерген представляет собой мутант Bet v 1. Аминокислоты, которые потенциально подходят для замены, включают в себя аминокислоты

Одна или более первичных или вторичных замен могут быть выбраны из группы, состоящей из

и +160 N,
где + означает, что включена дополнительная аминокислота.
Примеры мутантов Bet v 1 в соответствии с настоящим изобретением представляют собой следующее (скобки, когда они употребляются, указывают первичную и вторичную мутации):
Мутант A:

Мутант B:

Мутант 2595 (пример 2):
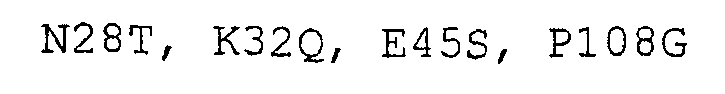
Мутант 2628 (пример 4):
Мутант 2637 (пример 4):

Мутант 2724:
Мутант 2733 (пример 4):


Мутант 2753 (пример 4):

Мутант 2744 + 2595:

Мутант 2744 + 2628:

Мутант 2744 + 2595 + 2628:
Кроме того, все указанные выше мутанты включают в себя одну или более из следующих замен:
В другом осуществлении рекомбинантный аллерген происходит из аллергена яда от таксономических отрядов Vespidae, Apidae и Formicoidae.
В дополнительном осуществлении рекомбинантный аллерген происходит от Ves v 5. Аминокислоты, которые потенциально подходят для замены, включают в себя аминокислоты

Одна или более первичных и вторичных замен могут быть выбраны из группы, состоящей из K29A, T67A, K78A, V84S, Yl02A, K112S, K144A, K202M и N203G.
В другом осуществлении рекомбинантный аллерген происходит от Der p 2. Аминокислоты, которые потенциально подходят для замены, включают в себя аминокислоты

Одна или более первичных и вторичных замен могут быть выбраны из группы, состоящей из K6A, N10S, Kl5E, S24N, H30N, K48A, E62S, H74N, K77N, K82N, K100N и Rl28Q.
Примеры мутантов Bet v 1, в соответствии с настоящим изобретением, представляют собой следующие.
Мутант A:
K6A, K15E, H30N, E62S.
Мутант B:
K6A, K15E, H30N, E62S, H74N, K82N.
Мутант C:
K6A, N10S, K15E, S24N, H30N, K48A, E62S, H74N, K77N, K82N, K100N и R128Q
Вакцины
Получение вакцин в целом хорошо известно в данной области техники. Вакцины обычно получают в форме препаратов для инъекций либо в виде жидких растворов, либо в виде суспензий. Такую вакцину можно также эмульгировать или составлять таким образом, чтобы она была пригодна для интраназального введения, а также для перорального введения, включая защечное и подъязычное введение. Рассматриваемый иммуногенный компонент (рекомбинантный аллерген, как здесь определено) может быть подходящим образом смешан с эксципиентами, которые являются фармацевтически приемлемыми и, кроме того, совместимыми с активным ингредиентом. Примерами подходящих эксципиентов являются вода, физиологический раствор, декстроза, глицерин, этанол и тому подобное, а также их сочетания. Вакцина может дополнительно содержать другие вещества, такие как увлажняющие агенты, эмульгирующие агенты, забуферивающие агенты или адъюванты, повышающие эффективность вакцины.
Чаще всего вакцины вводят парентерально путем подкожной или внутримышечной инъекции. Составы, которые пригодны для введения другим путем, включают в себя пероральные составы и суппозитории. Вакцины для перорального введения могут быть подходящим образом составлены с эксципиентами, обычно применяемыми для таких составов, например маннитом, лактозой, крахмалом, стеаратом магния, сахарином натрия, целлюлозой, карбонатом магния и тому подобное, фармацевтического качества. Композиция может быть составлена в виде растворов, суспензий, эмульсий, таблеток, пилюль, капсул, составов с непрерывным высвобождением, аэрозолей, порошков или гранулированных форм.
Вакцины вводят таким путем, который был бы совместим с дозировкой состава, и в таком количестве, которое должно быть терапевтически эффективным и иммуногенным. Количество активного компонента, содержащегося в вакцине, зависит от подлежащего лечению субъекта, кроме прочего, способности иммунной системы субъекта отвечать на лечение, путей введения, возраста и массы субъекта. Подходящие диапазоны доз могут варьировать в диапазоне приблизительно от 0,0001 мкг до 1000 мкг.
Как указывалось выше, усиленное действие может быть получено добавлением к составу адъювантов. Примерами таких адъювантов являются гидроксид алюминия и фосфат (квасцы) или фосфат кальция в виде от 0,05 до 0,1-процентного раствора в забуференном фосфатом физиологическом растворе, синтетические полимеры сахаров или полилактидгликолид (PLG), применяемые в виде 0,25-процентного раствора. Могут быть также применены смесь c бактериальными клетками, такими как C. parvum, эндотоксины или липополисахаридные компоненты грамотрицательных бактерий, эмульсия в физиологически приемлемых масляных носителях, таких как моноалеат маннида (Aracel A) или эмульсия с 20-процентным раствором перфторуглерода (например, Fluosol-DA), используемых в качестве блочной замены. Могут быть также применены масляные эмульсии, такие как MF-59. Могут быть также применены другие адъюванты, такие как полный и неполный адъюванты Фрейнда, а также сапонины, такие как Qui1A, Qs-21 и ISCOM и RIBI.
Чаще всего для обеспечения действия должно быть необходимо многократное введение вакцины. Часто вакцину вводят в виде исходного введения с последующими инокуляциями или другими введениями. Количество вакцинаций обычно составляет от 1 до 50, обычно не превышает 35 вакцинаций. Вакцинацию обычно проводят в интервале от одного раза в две недели до одного раза в два месяца в течение периода от 3 месяцев до 5 лет. Предполагается, что это создает желаемый уровень профилактического или терапевтического действия.
Рекомбинантный аллерген может быть применен в виде фармацевтического препарата, который пригоден для обеспечения определенной защиты против аллергических реакций в период года, когда имеют место симптомы (профилактика). Обычно лечение должно повторяться каждый год для поддержания защитного действия. В особенности пригодны для данной цели препараты, составленные для интраназального, перорального и подъязычного нанесения.
Способ получения рекомбинантного аллергена согласно изобретению
Как указано выше, настоящее изобретение также относится к способу получения рекомбинантного мутантного аллергена согласно изобретению, ср. п.48.
Экспонированные на поверхности аминокислоты, которые подходят для замены в соответствии с настоящим изобретением, могут быть идентифицированы на основе информации об их доступности для растворителя (воды), которая отражает степень экспонирования на поверхности. Предпочтительное осуществление способа согласно изобретению характеризуется ранжированием указанных идентифицированных аминокислотных остатков в отношении доступности для растворителя и заменой одной или более аминокислот среди более доступных для растворителя.
Вторым параметром, который может вносить вклад в идентификацию экспонированных на поверхности аминокислот, которые подходят для замены в соответствии с настоящим изобретением, является степень консервативности аминокислоты во всех известных гомологичных белках в пределах видов, из которых происходит указанный природно существующий аллерген. Альтернативно, в качестве второго параметра применяют степень консервативности во всех известных гомологичных белках в пределах таксономического рода, подсемейства, семейства, суперсемейства, более предпочтительно легиона, подотряда и наиболее предпочтительно отряда, из которого происходит указанный природно существующий аллерген.
Соответственно, предпочтительное осуществление способа согласно изобретению отличается выбором идентифицированных аминокислотных остатков, которые являются консервативными, с более чем 70%, предпочтительно более чем 80% и наиболее предпочтительно более чем 90% идентичностью со всеми известными гомологичными белками в пределах видов, из которых происходит указанный природно существующий аллерген.
Более того, особенно предпочтительное осуществление способа согласно изобретению отличается ранжированием указанных идентифицированных аминокислотных остатков в отношении степени консервативности во всех известных гомологичных белках в пределах видов, из которых происходит указанный природно существующий аллерген, и заменой одной или более аминокислот среди более консервативных.
Дополнительное предпочтительное осуществление способа согласно изобретению включает в себя отбор идентифицированных аминокислот так, чтобы создать мутантный аллерген, который имеет по существу ту же самую третичную структуру α-углеродного скелета, что и указанный природно существующий аллерген.Другое предпочтительное осуществление способа согласно изобретению отличается тем, что замена аминокислотных остатков выполняется с помощью сайт-направленного мутагенеза.
Альтернативное предпочтительное осуществление способа согласно изобретению отличается тем, что замена аминокислотных остатков выполняется с помощью перетасовки ДНК.
Критерии замены
Для молекул, третичная структура которых определена (например, с помощью рентгеновской кристаллографии или ЯМР электронной микроскопии), мутант, несущий замененную аминокислоту(ты), должен предпочтительно удовлетворять следующим критериям.
1. Полная третичная структура α-углеродного скелета молекулы предпочтительно является консервативной. Консервативность определяется как средняя величина квадратного корня среднеквадратичного отклонения атомных координат атомов при сравнении структур ниже 2 Å. Это важно по двум причинам: а) ожидается, что цельную поверхность природного аллергена составляет перекрывающийся континуум потенциальных эпитопов, связывающихся с антителами. Основная часть поверхности молекулы не подвергается замене(нам), и, таким образом, ее свойства индуцировать связывание антител сохраняется, что важно для выработки новых защитных вариантов антител, направленных на эпитопы, присутствующие также в природном аллергене; b) Стабильности, касающейся как сроков хранения, так и при введении в жидкости организма.
2. Аминокислоты, которые будут заменены, расположены предпочтительно на поверхности и, таким образом, доступны для связывания антителами. Аминокислоты, расположенные на поверхности в трехмерной структуре, обычно имеют доступность для растворителя (воды) по меньшей мере 20%, подходит 20-80%, более пригодно 30-80%. Доступность для растворителя определяют как область молекулы, доступную для сферы с радиусом, сравнимым с молекулой растворителя (вода, r=1,4 Å).
3. Каждая из заменяемых аминокислот предпочтительно расположена в консервативных зонах, имеющих области, большие чем 400 Å2. Консервативные зоны определяют как согласованно связанные области экспонированных на поверхности консервативных аминокислотных остатков и скелета. Консервативные аминокислотные остатки определяют с помощью выравнивания последовательностей всех известных (выведенных) аминокислотных последовательностей гомологичных белков в пределах тех же самых таксономических видов, рода, подсемейства, семейства, суперсемейства, легиона, подотряда или отряда. Положения аминокислот с идентичными аминокислотными остатками в более чем 70% последовательностей рассматриваются как консервативные. Ожидается, что консервативные зоны содержат эпитопы, на которые направлены IgE большинства пациентов.
Консерватизм третичной структуры α-углеродного скелета наилучшим образом определяется путем получения идентичных структур с помощью рентгеновской кристаллографии или ЯМР до и после мутагенеза. При отсутствии структурных данных, описывающих неотличающиеся спектры КД мутанта, или иммунохимических данных, например, реактивности антител, можно представить возможную консервативность третичной структуры α-углеродного скелета, если сравнить с данными, полученными при анализе молекулы, определенной структурно.
4. В пределах консервативных зон аминокислоты для мутагенеза должны быть предпочтительно выбраны среди наиболее доступных для растворителя (воды), расположенных предпочтительно вблизи центра консервативной зоны.
5. Предпочтительно полярный аминокислотный остаток заменяют другим полярным аминокислотным остатком и неполярный аминокислотный остаток заменяют другим неполярным аминокислотным остатком.
С целью по существу сохранения трехмерной структуры аллергена аминокислота, предназначенная для включения, может быть выбрана на основе сравнения с белком, который является структурным гомологом аллергена, например белком, который принадлежит к тому же таксономическому отряду, что и аллерген, и который не имеет каких-либо перекрестных реакций с аллергеном.
ДНК согласно изобретению
В предпочтительном осуществлении последовательность ДНК согласно изобретению представляет собой производное последовательности ДНК, кодирующей природно существующий аллерген.
Предпочтительно производное ДНК получают путем сайт-направленного или случайного мутагенеза ДНК, кодирующей природно существующий аллерген.
В первом особенно предпочтительном осуществлении последовательность ДНК представляет собой производное последовательности, представленной на фиг.3, где последовательность ДНК мутирована так, что она кодирует аллерген, имеющий по меньшей мере четыре мутации, выбранные из группы, состоящей из

Во втором особенно предпочтительном осуществлении последовательность ДНК представляет собой производное последовательности, представленной на фиг.13, где последовательность ДНК мутирована так, что она кодирует аллерген, имеющий по меньшей мере четыре мутации, выбранные из группы, состоящей из

В третьем особенно предпочтительном осуществлении последовательность ДНК представляет собой производное последовательности, представленной на фиг.16, где последовательность ДНК мутирована так, что она кодирует аллерген, имеющий по меньшей мере четыре мутации, выбранные из группы, состоящей из

Перетасовка ДНК
Рекомбинантный мутантный аллерген в соответствии с настоящим изобретением может быть получен с применением последовательности ДНК, полученной путем перетасовки ДНК (молекулярной селекции), соответствующей природной ДНК. Перетасовка ДНК может быть выполнена в соответствии с методиками, раскрытыми в статье Punnonen et al. (ссылка 25), а также методиками, раскрытыми в упомянутых там статьях, все из которых включены в данное описание в качестве данной ссылки.
Диагностический тест
Рекомбинантные мутантные аллергены в соответствии с изобретением обладают диагностическими возможностями и преимуществами. Вакцины аллергенов предшествующего уровня техники основываются на экстрактах природно существующего источника аллергена, и, таким образом, представляют собой широкое разнообразие изоформ. Индивидуума с аллергией первоначально сенсибилизируют, и он имеет IgE к одной или нескольким присутствующим изоформам. Некоторые из изоформ могут иметь отношение к аллергическим реакциям индивидуума с аллергией из-за гомологии и последующей перекрестной реакции с изоформой, в отношении которой индивидуум имеет аллергию, в то время как другие изоформы могут не иметь отношения, так как они не несут никаких связывающих IgE эпитопов, к которым индивидуум с аллергией имеет специфические IgE. Из-за данной гетерогенности специфичности популяции IgE некоторые изоформы могут, следовательно, быть безопасными при введении, т.е. они не ведут к аллергическому ответу через IgE, в то время как другие изоформы могут быть вредными, вызывая нежелательные побочные эффекты.
Таким образом, мутанты согласно изобретению и композиции согласно изобретению, предназначенные для терапевтического введения, могут также быть использованы для диагностического теста in vivo или in vitro для мониторинга уместности, безопасности или исхода лечения с помощью таких мутантов или композиций. Диагностические образцы, предназначенные для применения, включают в себя образцы, взятые из организма, такие как сыворотка.
Таким образом, изобретение также относится к диагностическому тесту для оценки уместности, безопасности или исхода терапии субъекта с применением мутантного аллергена в соответствии с изобретением или композиции в соответствии с изобретением, где содержащий IgE образец субъекта смешивают с указанным мутантом или указанной композицией и оценивают уровень взаимодействия между IgE указанного образца и указанным мутантом. Оценка уровня взаимодействия между IgE образца и мутантом может быть осуществлена с применением известного иммуноанализа.
Определения
В соответствии с настоящим изобретением выражение "снижение специфической IgE-связывающей способности по сравнению с IgE-связывающей способностью указанного природно существующего аллергена" означает, что снижение измеряют с учетом статистической значимости (p<0,05) по меньшей мере в одном иммунологическом тесте с применением сыворотки от субъекта, имеющего аллергию по отношению к природно существующему аллергену. Предпочтительно IgE-связывающая способность снижена по меньшей мере на 5%, более предпочтительно по меньшей мере на 10%.
Выражение "экспонированная на поверхности аминокислота" означает, что аминокислотный остаток расположен на поверхности трехмерной структуры таким образом, что когда аллерген находится в растворе по меньшей мере часть по меньшей мере одного атома аминокислотного остатка доступна для контакта с окружающим растворителем. Предпочтительно, чтобы аминокислотный остаток в трехмерной структуре имел доступность для растворителя (воды) по меньшей мере 20%, подходит по меньшей мере 30%, больше подходит по меньшей мере 40% и наиболее предпочтительно по меньшей мере 50%.
Выражение "доступность для растворителя" определяют как зону молекулы, доступную для сферы с радиусом, сравнимым с радиусом молекулы растворителя (вода, r=1,4 Å).
Выражения "экспонированная на поверхности" и "экспонированная для растворителя" применяют взаимозаменяемо.
Выражение "таксономические виды, из которых происходит указанный природно существующий аллерген" означает виды в таксономической системе.
Далее, выражение "указанный мутантный аллерген, имеющий по существу ту же самую третичную структуру α-углеродного скелета, что и указанный природно существующий аллерген", означает, что при сравнении структур средняя величина квадратного корня среднеквадратичного отклонения атомных координат составляет предпочтительно ниже 2 Å.
В соответствии настоящим изобретением, выражение "замена" означает делецию, замену или добавление аминокислоты по сравнению с аминокислотной последовательностью природно существующего аллергена.
Настоящее изобретение будет далее проиллюстрировано следующими не ограничивающими примерами.
Пример 1
В примере 1 описано получение рекомбинантных мутантных аллергенов с одной и тремя первичными мутациями. Рекомбинантные мутантные аллергены согласно изобретению, т.е. аллергены, содержащие по меньшей мере четыре первичные мутации, могут быть получены с использованием аналогичных методик.
Идентификация общих эпитопов в аллергенах пыльцы Fagales
Главный аллерген пыльцы березы Bet v 1 проявляет приблизительно 90% идентичность аминокислотной последовательности с главными аллергенами пыльцы таксономически родственных деревьев, т.е. Fagales (например, лесного ореха и граба), и у пациентов с аллергией на пыльцу березы часто проявляются клинические симптомы перекрестной аллергической реакции на данные гомологичные Bet v 1 белки.
Bet v 1 также проявляет приблизительно 50-60% идентичность последовательности с аллергенными белками, имеющимися в некоторых фруктах (например, яблоке и вишне) и овощах (например, сельдерее и моркови), и имеются клинические указания на перекрестную аллергическую реакцию на Bet v 1 и данные, связанные с пищей белки.
Кроме того, Bet v 1 проявляет значительное сходство в последовательности (20-40%) с группой растительных белков, называемых белками, связанными с патогенезом (RP-10), однако сообщения о перекрестной аллергической реакции на данные RP-10 белки отсутствуют.
Молекулярное моделирование позволяет предполагать, что структуры аллергенов Fagales и пищевых аллергенов и белков RP-10 почти идентичны структуре Bet v 1.
О структурной основе аллергенной перекрестной реакции Bet v 1 сообщалось у Gajhede et al., 1996 (ссылка 17), где на поверхности молекулы Bet v 1 удалось идентифицировать три зоны, общие для известных аллергенов пыльцы деревьев. Таким образом, любой IgE, узнающий данные зоны на Bet v 1, должен быть способен перекрестно реагировать и связываться с другими главными аллергенами пыльцы Fagales и вызывать симптомы аллергии. Идентификацию данных общих зон осуществляли после выравнивания всех известных аминокислотных последовательностей главных аллергенов пыльцы деревьев в сочетании с анализом поверхности молекулы Bet v 1, выявленной на основании третичной структуры α-углеродного скелета, о которой сообщалось в ссылке 17. Кроме того, по площади, покрываемой антителом после связывания, определяли как зоны, имеющие определенный минимальный размер (>400 Å2).
Выбор аминокислотных остатков для сайт-направленного мутагенеза
Аминокислотные остатки для сайт-направленного мутагенеза выбирали среди остатков, имеющихся в специфических областях Bet v 1 и общих зонах, поскольку ожидалось, что их модификации будут влиять на связывание сывороточного IgE у большинства пациентов, проявляющих клиническую перекрестную аллергическую реакцию на пыльцу деревьев.
Относительную ориентацию и процент экспонирования в растворитель каждого аминокислотного остатка в соответствующей зоне вычисляли на основе их атомных координат. Остатки, имеющие низкую степень экспонирования в растворитель (<20%), рассматривали как несущественные для мутагенеза из-за возможного нарушения структуры или отсутствия взаимодействия с антителом. Остальные остатки ранжировали в соответствии со степенью их экспонирования в растворитель.
Выравнивание последовательностей
Последовательности, гомологичные интересующей последовательности (Bet v 1 No. 2801, WHO IUIS Подкомитета по номенклатуре аллергенов), получали из GenBank и базы данных последовательностей EMBL с помощью поиска BLAST (Altschul et al., ссылка 18). Принимали к рассмотрению все последовательности, для которых BLAST давала вероятность менее 0,1, и составляли один перечень, содержащий недублированный перечень гомологичных последовательностей. Их выравнивали с помощью CLUSTAL W (Higgins et al., ссылка 19) и процент идентичности рассчитывали для каждого положения в последовательности при рассмотрении полного перечня или лишь таксономически родственных видов. Всего с Bet v 1 No. 2801 были гомологичны 122 последовательности, из которых 57 последовательностей брали начало от таксономически родственных видов.
Клонирование гена, кодирующего Bet v 1
РНК получали из пыльцы Betula verrucosa (Allergon, Швеция) с помощью экстракции фенолом и осаждения LiCl. Аффинную хроматографию на олиго(dT)-целлюлозе проводили порционным способом в эпендорфовских пробирках, а двухцепочечную кДНК синтезировали с применением имеющегося в продаже набора (Amersham). Кодирующую Bet v 1 ДНК амплифицировали с помощью ПЦР и клонировали. Вкратце, ПЦР проводили с применением кДНК в качестве матрицы, а праймеры создавали таким образом, чтобы они соответствовали последовательности кДНК в положениях, соответствующих аминоконцу Bet v 1 и 3'-нетранслируемой области соответственно. Праймеры расширяли по 5'-концам для создания сайтов рестрикции (NcoI и HindIII) для направленного клонирования в pKK233-2.
Субклонирование в pMAL-c
Ген, кодирующий Bet v 1, затем субклонировали в гибридный вектор белка, связывающего мальтозу, pMAL-c (New England Biolabs). Ген амплифицировали с помощью ПЦР и субклонировали в одной рамке с malE для создания оперонов гибридного белка - белок, связывающий мальтозу (MBP), - Bet v 1, в которых MBP и Bet v 1 разделяли сайтом протеолитического расщепления фактором Xa, помещенным для восстановления истинной аминоконцевой последовательности Bet v 1 после расщепления, как описано в ссылке 15. Вкратце, проводили ПЦР с применением pKK233-3, содержащей вставку Bet v 1, в качестве матрицы и праймеров, соответствующих амино- и карбоксиконцам белка соответственно. Промоторный проксимальный праймер был расширен с 5'-конца для создания 4 кодонов, кодирующих в рамке считывания сайт протеолитического расщепления фактором Xa. Оба праймера дополнительно расширяли по 5'-концам для создания сайтов рестрикции (KpnI) для клонирования. Кодирующие Bet v 1 гены субклонировали с помощью 20 циклов ПЦР для снижения частоты артефактов ПЦР.
Мутагенез in vitro
Мутагенез in vitro проводили с помощью ПЦР с применением рекомбинантной pMAL-c со вставкой Bet v 1 в качестве матрицы. Каждый мутантный ген Bet v 1 получали с помощью 3 реакций ПЦР с применением 4 праймеров.
Два специфичных для мутаций олигонуклеотидных праймера синтезировали в соответствии с каждой мутацией, по одному для каждой цепи ДНК, см. фиг.1 и 2. С применением мутантного нуклеотида(ов) в качестве исходной точки оба праймера расширяли на 7 нуклеотидов по 5'-концу и на 15 нуклеотидов по 3'-концу. Расширяющие нуклеотиды были идентичны по последовательности гену Bet v 1 в эффекторной области.
Далее синтезировали и применяли для всех мутантов два общеприменимых праймера (обозначенных на фиг.2 как «полностью смысловой» и «полностью антисмысловой»). Данные праймеры имели длину 15 нуклеотидов и соответствовали последовательности областей вектора pMAL-c, расположенных приблизительно на расстоянии 1 т.п.н. выше и ниже Bet v 1. Последовательность верхнего праймера берет начало от смысловой цепи, а последовательность нижнего праймера берет начало от антисмысловой цепи, см. фиг.2.
Проводили две независимые реакции ПЦР, по существу в соответствии со стандартными способами, за исключением того, что проводили лишь 20 температурных циклов для снижения частоты артефактов ПЦР. В каждой реакции ПЦР применяли pMAL-c со вставкой Bet v 1 в качестве матрицы, одного специфичного для мутации и одного общеприменимого праймера в конкретных сочетаниях.
Введение четырех аминокислотных замен (Asn28Thr, Lys32Gln, Glu45Ser, Pro108Gly) в мутант по трем зонам проводили аналогично описанной выше стадии постадийного способа. Сначала вводили мутацию Glu45Ser, затем мутацию Pro108Gly и, наконец, мутации Asn28Thr, Lys32Gln с применением pMAL-c со вставкой Bet v 1 No. 2801, Bet v 1 (Glu45Ser), Bet v 1 (Glu45Ser, Pro108Gly) в качестве матриц соответственно. Продукты ПЦР очищали путем электрофореза в агарозном геле и электроэлюирования с последующим осаждением этанолом. Третью реакцию ПЦР проводили с применением объединенных продуктов ПЦР двух первых реакций ПЦР в качестве матрицы и обоих общеприменимых праймеров. И вновь применяли стандартную ПЦР с 20 циклами. Продукт ПЦР очищали методами электрофореза в агарозном геле и электроэлюирования с последующим осаждением этанолом, разрезали ферментами рестрикции (BsiWI/EcoRI) и направленно лигировали в pMAL-c со вставкой Bet v 1, вырезанной теми же ферментами.
На фиг.3 показан общий вид всех указанных ниже 9 мутаций Bet v 1: Thr10Pro, Asp25Gly, Asn28Thr + Lys32Gln, Glu45Ser, Asn47Ser, Lys55Asn, Glu60Ser (внезональная), Thr77Ala и Pro108Gly. Был также получен дополнительный мутант с четырьмя мутациями (Asn28Thr, Lys32Gln, Glu45Ser, Pro108Gly). Из них пять мутантов отобрали для дальнейшего тестирования: Asn28Thr + Lys32Gln, Glu45Ser, Glu60Ser, Pro108Gly и мутант по трем зонам Asn28Thr, Lys32Gln, Glu45Ser, Pro108Gly.
Секвенирование нуклеотидов
Определение нуклеотидной последовательности гена, кодирующего Bet v1, проводили до и после субклонирования и после мутагенеза in vitro, соответственно. Плазмидные ДНК из 10 мл бактериальной культуры, растущей до насыщения в течение ночи в среде LB с добавкой 0,1 г/л ампициллина, очищали на колонках Qiagen-tip 20 и секвенировали с применением набора для секвенирования ДНК Sequenase версии 2.0 (USB), в соответствии с рекомендациями поставщиков.
Экспрессия и очистка рекомбинантного Bet v 1 и мутантов
Рекомбинантный Bet v 1 (Bet v 1 No. 2801 и мутанты) гиперэкспрессировали в Escherichia coli DH 5a в форме гибрида со связывающим мальтозу белком и очищали, как описано в ссылке 15. Вкратце, рекомбинантные клетки E. coli выращивали при 37°С до оптической плотности 1,0 при 436 нм, после чего экспрессию гибридного белка Bet v 1 индуцировали добавлением IPTG. Клетки собирали путем центрифугирования через 3 часа после индукции, ресуспендировали в лизирующем буфере и разрушали обработкой ультразвуком. После обработки ультразвуком и дополнительного центрифугирования выделяли рекомбинантный гибридный белок с помощью амилозной аффинной хроматографии и затем расщепляли путем инкубации с фактором Xa (ссылка 15). После расщепления FXa рекомбинантный Bet v 1 выделяли методом гель-фильтрации и, если считали необходимым, подвергали дополнительному циклу амилозной аффинной хроматографии для удаления следовых количеств связывающего мальтозу белка.
Очищенный рекомбинантный Bet v 1 концентрировали путем ультрафильтрации приблизительно до 5 мг/мл и хранили при 4°С. Конечный выход препаратов очищенного рекомбинантного Bet v 1 составлял от 2 до 5 мг на литр культуры E. coli.
Препараты очищенного рекомбинантного Bet v 1 представляли собой единственные полосы после электрофореза в полиакриламиде с ДДС-Na и окраски серебром с кажущейся молекулярной массой 17,5 кДа. Секвенирование N-конца показало последовательности, ожидаемые на основании кДНК нуклеотидных последовательностей, и количественный аминокислотный анализ показал ожидаемые аминокислотные составы.
Ранее было показано (ссылка 15), что рекомбинантный Bet v 1 No. 2801 иммунохимически не отличим от природного Bet v 1.
Иммуноэлектрофорез с применением кроличьих поликлональных антител
Семь мутантов Bet v 1 получали в виде рекомбинантных белков Bet v 1, очищали, как указано выше, и тестировали на их способность реагировать с поликлональными антителами кролика, индуцированными против Bet v 1, выделенного из пыльцы березы. При анализе с помощью иммуноэлектрофореза (рокетного иммуноэлектрофореза) в естественных условиях антитела кролика были способны преципитировать все мутанты, что указывает на то, что мутанты содержали консервативный α-углеродный скелет третичной структуры.
Для анализа влияния на реакцию поликлональных IgE человека для последующего анализа отобрали мутанты Glu45Ser, Pro108Gly, Asn28Thr + Lys32Gln и Glu60Ser.
Мутант Glu45Ser Bet v 1
Глутаминовая кислота в положении 45 проявляет высокую степень экспозиции в растворитель (40%) и находится в зоне поверхности молекулы, общей для аллергенов Fagales (зоне I). Было обнаружено, что остаток серина находится в положении 45 некоторых гомологичных Bet v 1 белков PR-10, что позволяет предполагать, что глутаминовая кислота может быть заменена серином без нарушения α-углеродного скелета третичной структуры. Кроме того, поскольку известные последовательности аллергенов Fagales не содержат серин в положении 45, замена глутаминовой кислоты серином ведет к возникновению не имеющейся в природе молекулы Bet v 1.
Тест пролиферации T-клеток с применением рекомбинантного мутанта Glu45Ser Bet v 1
Анализ проводили, как описано у Spangfort et al., 1996a. Было обнаружено, что рекомбинантный мутант Glu45Ser Bet v 1 способен индуцировать пролиферацию линий T-клеток трех разных пациентов с аллергией на пыльцу березы с показателями стимуляции, сходными с показателями, присущими рекомбинантному и природному белку.
Кристаллизация и структурный анализ рекомбинантного Glu45Ser Bet v 1
Кристаллы рекомбинантного Glu45Ser Bet v 1 выращивали с помощью паровой диффузии при 25°С, по существу как описано у Spangfort et al., 1996b (ссылка 21). Glu45Ser Bet v 1 в концентрации 5 мг/мл смешивали с равным объемом смеси 2,0 М сульфата аммония, 0,1 М цитрата натрия, 1% (об/об) диоксана, pH 6,0, и уравновешивали против 100х объема смеси 2,0 М сульфата аммония, 0,1 М цитрата натрия, 1% (об/об) диоксана, pH 6,0. Через 24 часа уравновешивания рост кристаллов индуцировали с применением метода посева, описанного в ссылке 21, с использованием кристаллов рекомбинантного Bet v 1 дикого типа в качестве затравки.
Приблизительно через 2 месяца кристаллы собирали и анализировали с помощью рентгеновских лучей, полученных с вращающегося анода Rigaku, как описано в ссылке 21, и структуру определяли методом молекулярного замещения.
Структура мутанта Bet v 1 Glu45Ser
Структурное влияние мутации выясняли путем определения дифракции выращенных трехмерных кристаллов белка Bet v 1 Glu45Ser с разрешением 3,0 Å при анализе с помощью рентгеновских лучей, полученных с вращающегося анода. Замена глутаминовой кислоты серином в положении 45 подтверждали с помощью карты электронной плотности структуры Bet v 1 Glu45Ser, которая также показала, что общая третичная структура α-углеродного скелета сохраняется.
Свойства связывания IgE мутанта Bet v 1 Glu45Ser
Свойства связывания IgE мутанта Bet v 1 Glu45Ser сравнивали с таковыми рекомбинантного Bet v 1 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу.
Рекомбинантный Bet v 1 no. 2801 биотинилировали при молярном отношении 1:5 (Bet v 1 no. 2801:биотин). Тест ингибирования проводили следующим образом: образец сыворотки (25 мкл) инкубировали с анти-IgE на твердой фазе, промывали, ресуспендировали и дополнительно инкубировали со смесью биотинилированного Bet v 1 no. 2801 (3,4 нМ) и данного мутанта (0-28,6 нМ). Количество биотинилированного Bet v 1 no. 2801, связанного с твердой фазой, определяли путем измерения RLU после инкубации со стрептавидином, меченным эфиром акридина. Степень ингибирования рассчитывали как отношение между RLU, полученными с применением буфера и мутанта в качестве ингибитора.
На фиг.4 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1 и мутантом Bet v 1 Glu45Ser.
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Bet v 1 достигается приблизительно при 6,5 нг, тогда как соответствующая концентрация для мутанта Bet v 1 Glu45Ser составляет приблизительно 12 нг. Это показывает, что точечная мутация, введенная в мутант Bet v 1 Glu45Ser, снижает сродство к специфическому сывороточному IgE приблизительно в 2 раза. Максимальный уровень ингибирования, достигаемый под действием мутанта Bet v 1 Glu45Ser, явно ниже достигаемого под действием рекомбинантного Bet v 1. Это может указывать на то, что после замены Glu45Ser некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутант Bet v 1 Glu45Ser.
Мутант Bet v 1 Asn28Thr + Lys32Gln
Аспартат и лизин в положениях 28 и 32, соответственно, проявляют высокую степень экспонирования в растворитель (35% и 50%, соответственно) и локализованы в зоне молекулярной поверхности, являющейся общей для аллергенов Fagales (зона II). Структурно аспартат 28 и лизин 32 расположены близко друг от друга на молекулярной поверхности и, наиболее вероятно, взаимодействуют посредством водородных связей. Было обнаружено, что в некоторых белках PR-10, гомологичных Bet v 1, остатки треонина и глутамата занимают положения 28 и 32, соответственно, что указывает на то, что аспартат и лизин могут быть заменены треонином и глутаматом, соответственно, без нарушения третичной структуры α-углеродного скелета. Кроме того, поскольку ни одна из природных изоаллергенных последовательностей не содержит треонин и глутамат в положениях 28 и 32, соответственно, замены создают не существующую в природе молекулу Bet v 1.
Свойства связывания IgE мутанта Bet v 1 Asn28Thr + Lys32Gln
Свойства связывания IgE мутанта Asn28Thr + Lys32Gln сравнивали с таковыми рекомбинантного Bet v 1 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, как описано выше.
На фиг.5 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1 и мутантом Bet v 1 Asn28Thr + Lys32Gln.
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Bet v 1 достигается приблизительно при 6,5 нг, тогда как соответствующая концентрация для мутанта Bet v 1 Asn28Thr + Lys32Gln составляет приблизительно 12 нг. Это показывает, что точечные мутации, введенные в мутант Bet v 1 Asn28Thr + Lys32Gln, снижают сродство к специфическому сывороточному IgE приблизительно в 2 раза.
Максимальный уровень ингибирования, достигаемый под действием мутанта Bet v 1 Asn28Thr + Lys32Gln, явно ниже достигаемого под действием рекомбинантного Bet v 1. Это может указывать на то, что после замен Asn28Thr + Lys32Gln некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутант Bet v 1 Asn28Thr + Lys32Gln.
Мутант Bet v 1 Pro108Gly
Пролин в положении 108 проявляет высокую степень экспонирования в растворитель (60%) и локализован в зоне молекулярной поверхности, являющейся общей для аллергенов Fagales (зона III). Было обнаружено, что в некоторых белках PR-10, гомологичных Bet v 1, остаток глицина занимает положение 108, что указывает на то, что пролин может быть заменен глицином без нарушения третичной структуры α-углеродного скелета. Кроме того, поскольку ни одна из природных изоаллергенных последовательностей не содержит глицин в положении 108, замена пролина на глицин создает не существующую в природе молекулу Bet v 1.
Свойства связывания IgE мутанта Bet v 1 Pro108Gly
Свойства связывания IgE мутанта Bet v 1 Pro108Gly сравнивали с таковыми рекомбинантного Bet v 1 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, как описано выше.
На фиг.6 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1 и мутантом Bet v 1 Pro108Gly.
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Bet v 1 достигается приблизительно при 6,5 нг, тогда как соответствующая концентрация для мутанта Bet v 1 Pro108Gly составляет приблизительно 15 нг. Это показывает, что единственная точечная мутация, введенная в Bet v 1 Pro108Gly, снижает сродство к специфическому сывороточному IgE приблизительно в 2 раза.
Максимальный уровень ингибирования, достигаемый под действием мутанта Bet v 1 Pro108Gly, несколько ниже достигаемого под действием рекомбинантного Bet v 1. Это может указывать на то, что после замены Pro108Gly некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутант Bet v 1 Pro108Gly.
Мутант Bet v 1 Glu60Ser (внезональный мутант)
Глутаминовая кислота в положении 60 проявляет высокую степень экспонирования в растворитель (60%), однако не расположена в зоне молекулярной поверхности, являющейся общей для аллергенов Fagales. Было обнаружено, что в некоторых белках PR-10, гомологичных Bet v 1, остаток серина занимает положение 60, что указывает на то, что глутаминовая кислота может быть заменена серином без нарушения третичной структуры α-углеродного скелета. Кроме того, поскольку ни одна из природных изоаллергенных последовательностей не содержит серин в положении 60, замена глутаминовой кислоты серином создает не существующую в природе молекулу Bet v 1.
Свойства связывания IgE мутанта Bet v 1 Glu60Ser
Свойства связывания IgE мутанта Bet v 1 Glu60Ser сравнивали с таковыми рекомбинантного Bet v 1 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, как описано выше.
На фиг.7 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1 и мутантом Bet v 1 Glu60Ser. В отличие от мутантов Glu45Ser, Pro108Gly и Asn28Thr+Lys32Gln замена глутаминовой кислоты 60 серином не оказывает какого-либо заметного влияния на свойства связывания IgE. Это указывает на то, что замены за пределами определенных общих зон Fagales оказывают лишь незначительное влияние на связывание специфического сывороточного IgE, что подтверждает концепцию о том, что консервативные области молекулярной поверхности аллергена включают в себя доминантные эпитопы связывания IgE.
Мутант Bet v 1 по трем зонам
В мутанте Bet v 1 по трем зонам точечные мутации (Glu45Ser, Asn28Thr+Lys32Gln и Pro108Gly), введенные в три различные общие зоны Fagales, описанные выше, вводили одновременно для создания искусственного мутанта, несущего четыре аминокислотные замены.
Структурный анализ мутанта Bet v 1 по трем зонам
Структурную целостность очищенного мутанта по трем зонам анализировали с помощью спектроскопии кругового дихроизма (КД). На фиг.8 показаны спектры КД рекомбинанта и мутанта по трем зонам, записанные при близких к равным концентрациях. Перекрытие пиковых амплитуд и положений в спектрах КД двух рекомбинантных белков показывает, что препараты включают в себя равное содержание вторичных структур, что позволяет обоснованно предполагать, что третичная структура α-углеродного скелета не меняется с введением аминокислотных замен.
Свойства связывания IgE мутанта Bet v 1 по трем зонам
Свойства связывания IgE мутанта Bet v 1 по трем зонам сравнивали с таковыми рекомбинантного Bet v 1 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, как описано выше.
На фиг.9 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1 и мутантом Bet v 1 по трем зонам. В отличие от одиночных мутантов, описанных выше, кривая ингибирования мутантом по трем зонам не остается параллельной таковой рекомбинанта. Это указывает на то, что замены, введенные в мутант по трем зонам, изменили свойства связывания IgE и эпитопный профиль по сравнению с рекомбинантом. Отсутствие параллельности затрудняет количественную оценку снижения сродства мутанта по трем зонам к специфическому IgE сыворотки.
50% ингибирование рекомбинантным Bet v 1 достигается при приблизительно 6 нг, тогда как соответствующая концентрация для мутанта Bet v 1 по трем зонам составляет 30 нг, т.е. сродство снижено в 5 раз. Однако при достижении 80% ингибирования соответствующие величины равны 20 нг и 400 нг, соответственно, т.е. снижение является 20-кратным.
Тест пролиферации T-клеток с применением рекомбинантного мутанта Bet v 1 по трем зонам
Анализ проводили, как описано в ссылке 15. Было обнаружено, что рекомбинантный мутант Bet v 1 по трем зонам способен индуцировать пролиферацию линий T-клеток трех разных пациентов с аллергией на пыльцу березы с показателями стимуляции, сходными с таковыми рекомбинантного и природного аллергена. Это позволяет предполагать, что мутант по трем зонам может инициировать клеточный иммунный ответ, необходимый для продукции антител.
Пример 2
В примере 2 описано получение рекомбинантных мутантных аллергенов с одной первичной мутацией. Рекомбинантные мутантные аллергены согласно изобретению, т.е. аллергены, включающие по меньшей мере четыре первичные мутации, могут быть получены с использованием аналогичных методик.
Идентификация общих эпитопов главного аллергенного антигена 5 яда Vespula vulgaris
Антиген 5 является одним из трех белков яда осы, которые являются известными аллергенами у человека. Осы включают в себя шершней, настоящих ос и роющих ос. Два других известных аллергена осиного яда являются фосфолипазой A1 и гиалуронидазой. Антиген 5 из Vespula vulgaris (Ves v 5) был клонирован и экспрессирован в виде рекомбинантного белка в системе дрожжей (Monsalve et al., 1999, ссылка 22). Недавно была определена трехмерная кристаллическая структура рекомбинантного Ves v 5 с разрешением 1,8 Å (готовится к печати). Основные особенности структуры состоят в наличии четырех β-цепей и четырех α-спиралей, организованных в три уложенных ярусами слоя с формированием «α-β-α сэндвича». Совпадение последовательности гомологичных антигену 5 аллергенов различных видов Vespula составляет приблизительно 90%, что предполагает наличие консервативных областей молекулярной поверхности и эпитопов B-клеток.
Выявление наличия и идентификацию общих зон проводили после выравнивания всех известных аминокислотных последовательностей аллергенов антигена 5 Vespula, как описано выше для аллергенов пыльцы деревьев, в сочетании с анализом молекулярной поверхности антигена 5, раскрытой данными о трехмерной структуре Ves v 5. На фиг.10 показана доступность для растворителя индивидуально выровненных остатков антигена 5 и выравнивание последовательностей антигена 5 Vespula (левая панель). На правой панели фиг.10 показана молекулярная поверхность антигена 5 с окрашенными консервативными для антигена 5:s Vespula областями.
Выбор аминокислотных остатков для сайт-направленного мутагенеза
Аминокислотные остатки для сайт-направленного мутагенеза выбирали среди остатков, имеющихся в зонах, общих для Vespula, поскольку ожидалось, что их модификации будут влиять на связывание сывороточного IgE от большинства пациентов, проявляющих клиническую перекрестную аллергическую реакцию Vespula.
Относительную ориентацию и процент экспонирования в растворитель каждого аминокислотного остатка в соответствующей зоне вычисляли на основе их атомных координат. Остатки, имеющие низкую степень экспонирования в растворитель, рассматривали как не пригодные для мутагенеза из-за возможного нарушения структуры или отсутствия взаимодействия с антителом. Остальные остатки ранжировали в соответствии со степенью их экспонирования в растворитель.
Клонирование гена, кодирующего Ves v 5
Суммарную РНК выделяли из ядовитых кислых желез ос Vespula vulgaris, как описано в Fang et al., 1988 (ссылка 23).
Синтез первой цепи кДНК, амплификацию ПЦР и клонирование гена Ves v 5 проводили, как описано у Lu et al., 1993 (ссылка 24).
Субклонирование в pPICZαA
Кодирующий Ves v 5 ген затем субклонировали в вектор pPICZαA (Invitrogen) для секретируемой экспрессии Ves v 5 в Pichia pastoris. Ген амплифицировали с помощью ПЦР и субклонировали в рамке считывания с кодирующей последовательностью для α-фактора сигнала секреции Saccharomyces cerevisiae. В данном конструкте α-фактор отщепляется in vivo протеазной системой Kex2 Pichia pastoris во время секреции белка.
Вкратце, ПЦР проводили с применением Ves v 5 в качестве матрицы и праймеров, соответствующих амино- и карбоксиконцу белка, соответственно. Праймеры расширяли с 5'-конца для формирования сайтов рестрикции для клонирования, EcoRI и XbaI, соответственно. Нуклеотиды, кодирующие сайт расщепления Kex2, в данном конструкте находились на расстоянии 18 нуклеотидов выше аминоконца белка, в результате чего Ves v5 экспрессировался с шестью дополнительными аминокислотами, Glu-Ala-Glu-Ala-Glu-Phe, на аминоконце.
Вставка pPICZαA-ves v 5 в P. pastoris
Векторы pPICZαA со вставкой гена Ves v 5 линеризовали с помощью рестрикции Sac I и вставляли в локус AOX1 генома Pichia pastoris. Вставку производили гомологичной рекомбинацией в клетках KM71 Pichia pastoris в соответствии с рекомендациями Invitrogen.
Мутагенез in vitro
Мутагенез in vitro проводили с помощью ПЦР с применением рекомбинантной pPICZαA со вставкой Ves v 5 в качестве матрицы. Каждый мутантный ген Ves v 5 получали с помощью 3 реакций ПЦР с применением 4 праймеров.
Два специфичных для мутаций олигонуклеотидных праймера синтезировали в соответствии с каждой мутацией, по одному для каждой цепи ДНК, см. фиг.11 и 12. Применяя мутантный(е) нуклеотид(ы) в качестве исходной точки, оба праймера расширяли на 6-7 нуклеотидов по 5'-концу и на 12-13 нуклеотидов по 3'-концу. Расширяющие нуклеотиды были идентичны по последовательности гену Ves v 5 в эффекторной области.
Далее синтезировали и применяли для всех мутантов два общеприменимых праймера (обозначенных на фиг.12 как «полностью смысловой» и «полностью антисмысловой»). Для обеспечения экспрессии мутантов Ves v 5 с существующим в природе аминоконцом один праймер, соответствующий аминоконцу белка, расширяли по 5'-концу сайтом Xho I. После вставки мутантных генов Ves v 5 в вектор pPICZαA восстанавливали сайт расщепления протеазой Kex2 непосредственно перед аминокислотным концом Ves v 5. Второй праймер по последовательности соответствовал области вектора pPICZαA, расположенной на расстоянии приблизительно 300 п.н. ниже гена Ves v 5. Последовательность праймера, соответствующего аминоконцу Ves v 5, ведет начало от смысловой цепи, а последовательность нижнего праймера ведет начало от антисмысловой цепи, см. фиг.11.
Проводили две независимые реакции ПЦР по существу в соответствии со стандартными методиками (Saiki et al., 1988), за исключением того, что проводили лишь 20 температурных циклов для снижения частоты артефактов ПЦР. В каждой реакции ПЦР применяли pPICZαA со вставкой Ves v 5 в качестве матрицы, одного специфичного для мутации и одного общеприменимого праймера в конкретных сочетаниях.
Продукты ПЦР очищали с применением "Concert, Rapid PCR Purification System" (Life Technologies). Третью реакцию ПЦР проводили с применением объединенных продуктов ПЦР двух первых реакций ПЦР в качестве матрицы и обоих общеприменимых праймеров. И вновь применяли стандартную ПЦР с 20 циклами. Продукт ПЦР очищали с применением "Concert, Rapid PCR Purification System" (Life Technologies), разрезали ферментами рестрикции (XhoI/XbaI) и направленно лигировали в вектор pPICZαA, рестриктированный теми же ферментами. На фиг.11 представлены в общем виде все мутации Ves v 5.
Вставка мутантов pPICZαA-Ves v 5 в P. pastoris
Вставляемые векторы pPICZαA с мутантными генами Ves v 5 линеризовали рестрикцией Sac I и вставляли в локус AOX1 генома Pichia pastoris. Вставки производили гомологичной рекомбинацией в клетках KM71 Pichia pastoris в соответствии с рекомендациями Invitrogen.
Секвенирование нуклеотидов
Определение нуклеотидной последовательности гена, кодирующего Ves v 5, проводили до и после субклонирования и после мутагенеза in vitro, соответственно.
Плазмидные ДНК из 10 мл бактериальной культуры, растущей до насыщения в течение ночи в среде LB с добавкой 0,1 г/л ампициллина, очищали на колонках Qiagen-tip 20 и секвенировали с применением набора для секвенирования ДНК Sequenase версии 2.0 (USB) в соответствии с рекомендациями поставщиков.
Экспрессия и очистка рекомбинантного Ves v 5
Рекомбинантные дрожжевые клетки штамма KM71 Pichia pastoris выращивали в 500-миллилитровых флаконах, содержащих 100 мл фосфатного буфера с pH 6,0, содержащего азотистое основание дрожжей, биотин, глицерин и гистидин, при 30°С с круговым перемешиванием при 225 об/мин до A600 нм 4-6. Клетки собирали путем центрифугирования и ресуспендировали в 10 мл аналогичной буферной среды, содержащей метанол вместо глицерина. Инкубацию продолжали при 30°С в течение 7 дней при ежедневном добавлении 0,05 мл метанола.
Клетки собирали путем центрифугирования и объединенную культуральную жидкость концентрировали путем ультра-фильтрации. После диализа против 50 мМ аммоний-ацетатного буфера, pH 4,6, образец наносили на колонку катионообменника SE-53 для ВЭЖХ (Pharmacia), уравновешенную тем же буфером. Колонку элюировали линейным градиентом смеси 0-1,0 М NaCl, 50 мМ ацетат аммония. Элюируемый при приблизительно 0,4 М NaCl пик рекомбинантного Ves v 5 собирали и диализовали против 0,02 н. уксусной кислоты. После концентрирования до приблизительно 10 мг/мл очищенный Ves v 5 хранили при 4°С.
Кристаллизация рекомбинантного Ves v 5
Кристаллы Ves v 5 выращивали способом паровой диффузии при 25°С. Для кристаллизации 5 мкл Ves v 5 в концентрации 5 мг/мл смешивали с 5 мкл смеси 18% PEG 6000, 0,1 М цитрата натрия, pH 6,0 и уравновешивали против 1 мл 18% PEG 6000, 0,1 М цитрата натрия, pH 6,0.
Данные по дифракции рентгеновских лучей получали при 100 K с применением кристаллов нативного Ves v 5 и после введения производных тяжелых атомов и применяли для выяснения трехмерной структуры Ves v 5, см. фиг.10 (рукопись в процессе подготовки).
Иммуноэлектрофорез с применением кроличьих поликлональных антител
Два мутанта Ves v 5 получали в виде рекомбинантных белков Ves v 5 и тестировали на их способность реагировать с поликлональными антителами кролика, индуцированными против рекомбинантного Ves v 5. При анализе с помощью рокетного иммуноэлектрофореза в естественных условиях антитела кролика были способны преципитировать рекомбинантный Ves v 5, а также оба мутанта, что указывает на то, что мутанты содержали консервативный α-углеродный скелет третичной структуры.
Ингибирование специфичного сывороточного IgE
Свойства связывания IgE мутантов Ves v 5 сравнивали с таковыми рекомбинантного Ves v 5 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на осиный яд.
Тест ингибирования проводили, как описано выше, с применением биотинилированного Ves v 5 вместо Bet v 1.
Мутант Lys72Ala Ves v 5
Лизин в положении 72 проявляет высокую степень экспозиции в растворитель (70%) и находится в зоне поверхности молекулы, общей для антигена 5 Vespula. Относительная ориентация и высокая степень экспозиции в растворитель свидетельствуют о том, что лизин-72 может быть заменен остатком аланина без нарушения α-углеродного скелета третичной структуры. Кроме того, поскольку ни одна из известных природных последовательностей изоаллергенов не содержит аланина в положении 72, замена лизина аланином ведет к созданию не имеющейся в природе молекулы Ves v 5.
Свойства связывания IgE мутанта Ves v 5 Lys72Ala
Свойства связывания IgE мутанта Ves v 5 Lys72Ala сравнивали с таковыми рекомбинантного Ves v 5 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, описанного выше.
На фиг.14 показано ингибирование связывания биотинилированного рекомбинантного Ves v 5 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Ves v 5 и мутантом Ves v 5 Lys72Ala.
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Ves v 5 достигается при приблизительно 6 нг, тогда как соответствующая концентрация для мутанта Ves v 5 Lys72Ala составляет 40 нг. Это показывает, что точечная мутация, введенная в мутант Ves v 5 Lys72Ala, снижает сродство к специфическому сывороточному IgE приблизительно в 6 раз. Максимальный уровень ингибирования, достигаемый под действием мутанта Ves v 5 Lys72Ala, значительно ниже достигаемого под действием рекомбинантного Ves v 5. Это может указывать на то, что после замены Lys72Ala некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутант Ves v 5 Lys72Ala.
Мутант Tyr96Ala Ves v 5
Тирозин в положении 96 проявляет высокую степень экспонирования в растворитель (65%) и находится в зоне поверхности молекулы, общей для антигена 5 Vespula. Относительная ориентация и высокая степень экспонирования в растворитель свидетельствуют о том, что тирозин 96 может быть заменен остатком аланина без нарушения трехмерной структуры. Кроме того, поскольку ни одна из известных природных последовательностей изоаллергенов не содержит аланина в положении 96, замена тирозина аланином ведет к созданию не имеющейся в природе молекулы Ves v 5.
Свойства связывания IgE мутанта Ves v 5 Tyr96Ala
Свойства связывания IgE мутанта Ves v 5 Tyr96Ala сравнивали с таковыми рекомбинантного Ves v 5 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу, описанного выше.
На фиг.14 показано ингибирование связывания биотинилированного рекомбинантного Ves v 5 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Ves v 5 и мутантом Ves v 5 Tyr96Ala.
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Ves v 5 достигается при приблизительно 6 нг, тогда как соответствующая концентрация для мутанта Ves v 5 Tyr96Ala составляет 40 нг.
Это показывает, что единственная точечная мутация, введенная в мутант Ves v 5 Tyr96Ala, снижает сродство к специфическому сывороточному IgE приблизительно в 6 раз.
Максимальный уровень ингибирования, достигаемый под действием мутанта Ves v 5 Tyr96Ala, значительно ниже достигаемого под действием рекомбинантного Ves v 5. Это может указывать на то, что после замены Tyr96Ala некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутант Ves v 5 Tyr96Ala.
Пример 3
Идентификация и отбор аминокислот для замены
Для идентификации и отбора экспонированных на поверхности аминокислот, пригодных для замены в аллергенах Bet v 1, Der p 2 и Ves v 5, использовали параметры доступности для растворителя и степени консервативности.
Доступность для растворителя
Доступность для растворителя рассчитывали с помощью программы InsightII, версия 97.0 (MSI) и радиус зонда 1,4 Å (поверхность Connolly).
Внутренние полости исключали из анализа путем заполнения зондами с применением программы PASS (предполагаемые активные сайты со сферами). Затем вручную удаляли зонды на поверхности.
Консервативность
Bet v 1:
3-мерная структура основана на данных с регистрационным номером Z80104 (lbvl.pdb).
38 других последовательностей Bet v 1, включенных в анализ консервативных остатков, включают в себя следующие номера регистрации:

Der p 2:
3-мерная структура основана на данных с регистрационным номером P49278 (1a9v.pdb).
6 других последовательностей Der v 2, включенных в анализ консервативных остатков, включают в себя следующие замены:
Ves v 5:
3-мерная структура основана на данных с регистрационным номером Q05110 (pdb координаты не опубликованы).
Другая последовательность Ves v 5 в анализе консервативных остатков содержит одну аминокислотную замену: M202K.
Результаты
Bet v 1:
59 аминокислот с высоким экспонированием в растворитель:

57 аминокислот с высоким экспонированием в растворитель и консервативностью (>70%):

Произведенные 23 мутации:

В таблице 1 представлен перечень аминокислот Bet v 1 в порядке убывания экспонирования в растворитель. В колонке 1 представлен номер аминокислоты, начиная с аминоконца, в колонке 2 указана аминокислота в однобуквенной аббревиатуре, в колонке 3 представлен нормализованный показатель экспонирования в растворитель, в колонке 4 представлен процент известных последовательностей, содержащих рассматриваемую аминокислоту в данном положении.
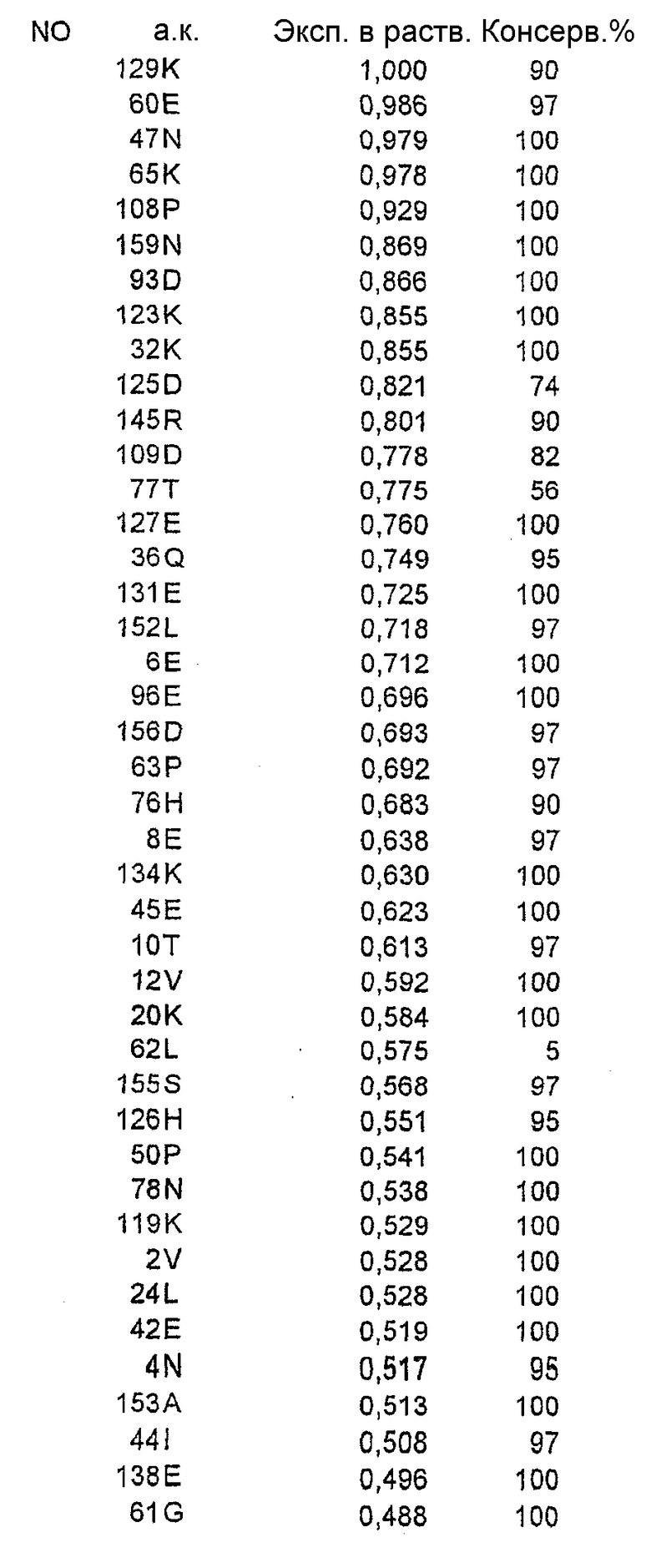
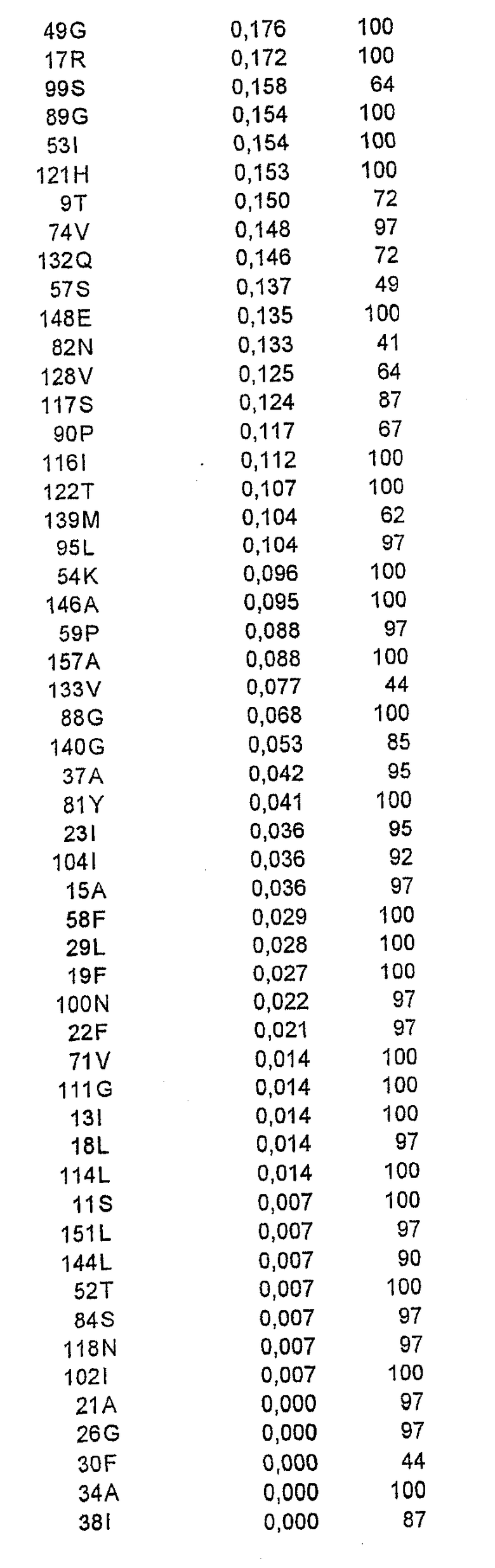
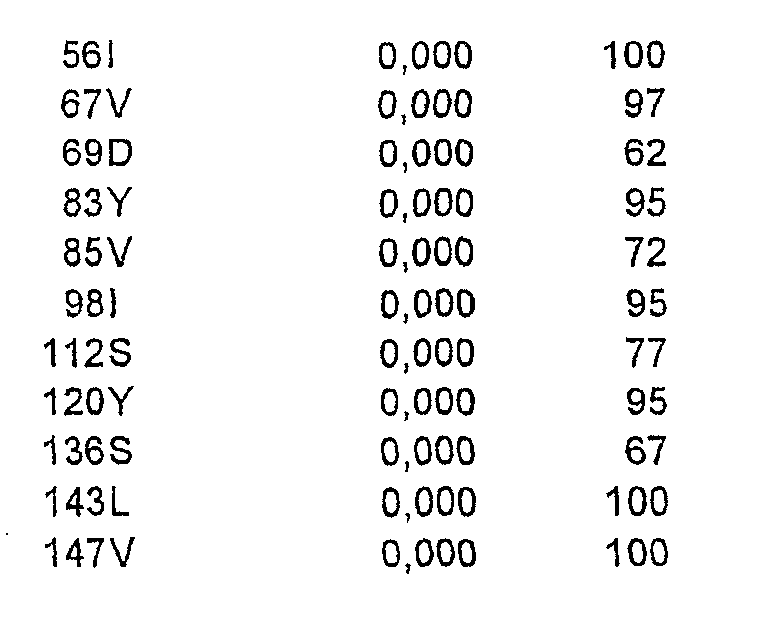
Der p 2:
55 аминокислот с высокой степенью экспонирования в растворитель:

54 аминокислоты с высокой степенью экспонирования в растворитель и консервативностью (>70%):

Произведенные мутации:
K6A, K15E, H30N, E62S, H74N, K82N.
В таблице 2 представлен перечень аминокислот Der p 2 в порядке убывания экспонирования в растворитель. В колонке 1 представлен номер аминокислоты, начиная с аминоконца, в колонке 2 указана аминокислота в однобуквенной аббревиатуре, в колонке 3 представлен нормализованный показатель экспонирования в растворитель, в колонке 4 представлен процент известных последовательностей, содержащих рассматриваемую аминокислоту в данном положении.
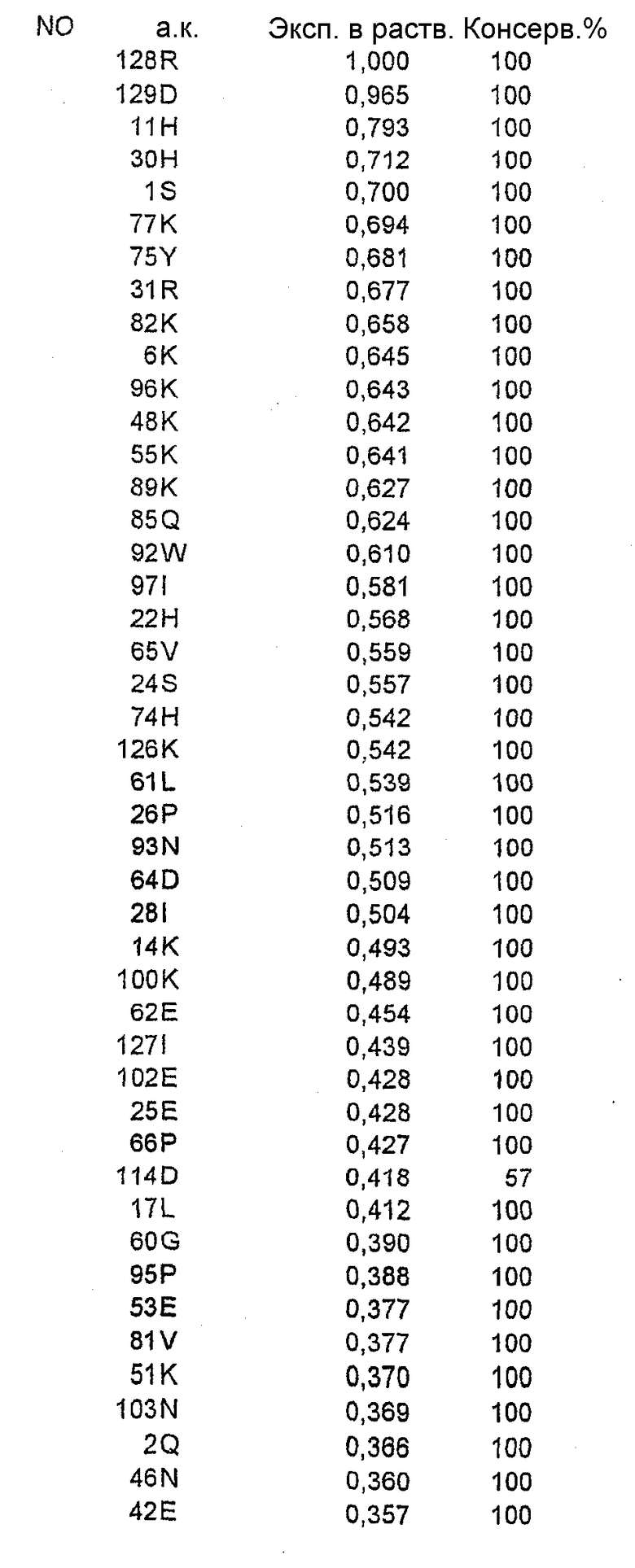
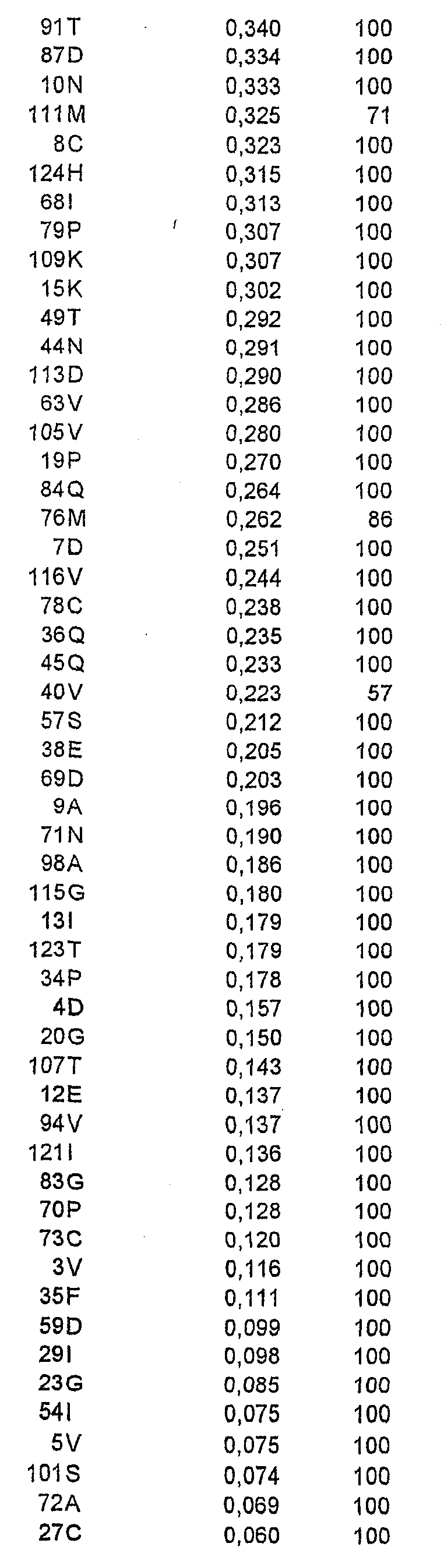
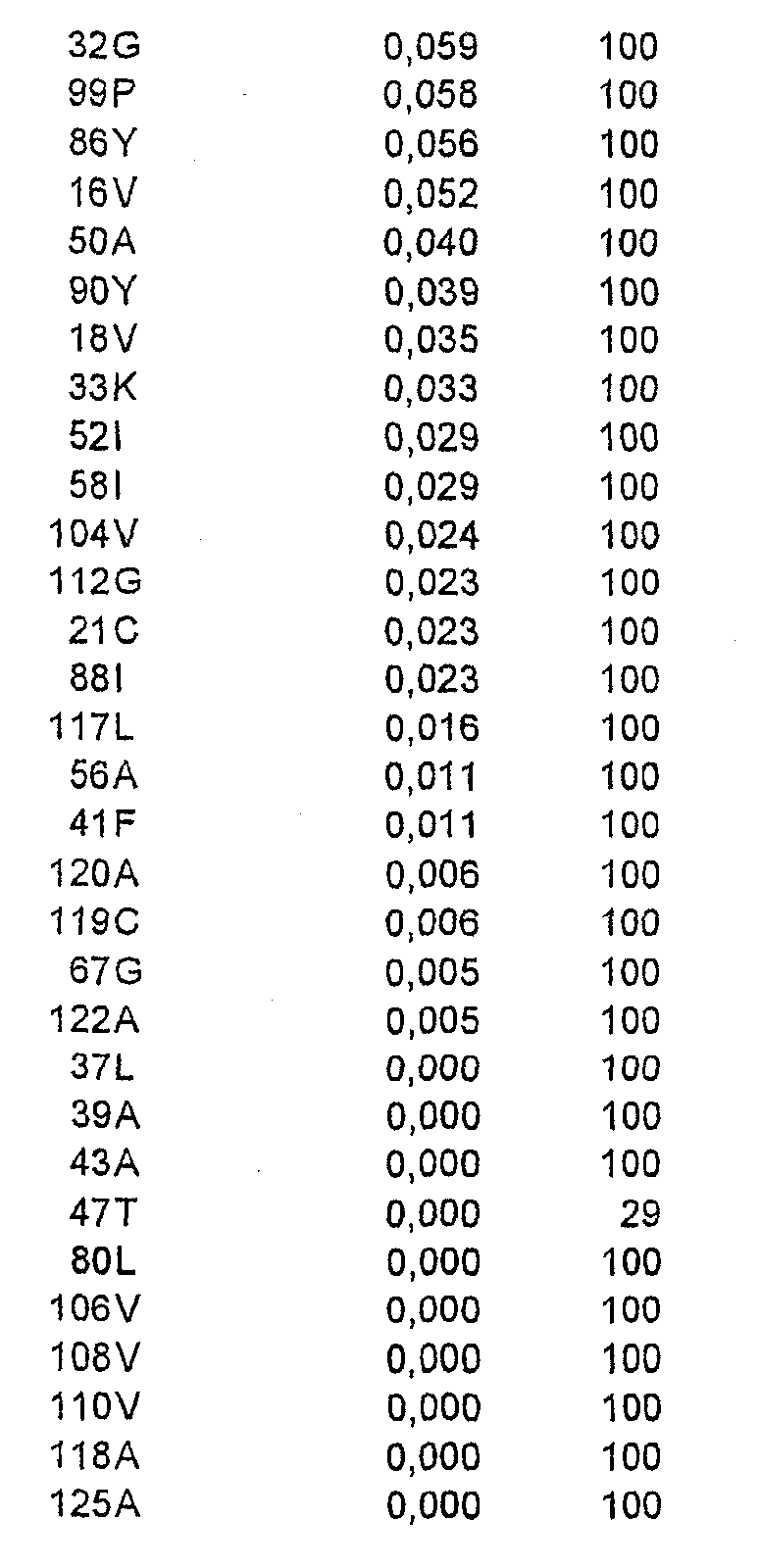
Ves v 5:
89 аминокислот с высокой степенью экспонирования в растворитель:

88 аминокислот с высокой степенью экспонирования в растворитель и консервативности (>70%):

9 произведенных мутаций:
K29A, T67A, K78A, V84S, Y102A, K112S, K144A, K202M, N203G.
В таблице 3 представлен перечень аминокислот Ves v 5 в порядке убывания экспонирования в растворитель. В колонке 1 представлен номер аминокислоты, начиная с аминоконца, в колонке 2 указана аминокислота в однобуквенной аббревиатуре, в колонке 3 представлен нормализованный показатель экспонирования в растворитель, в колонке 4 представлен процент известных последовательностей, содержащих рассматриваемую аминокислоту в данном положении.
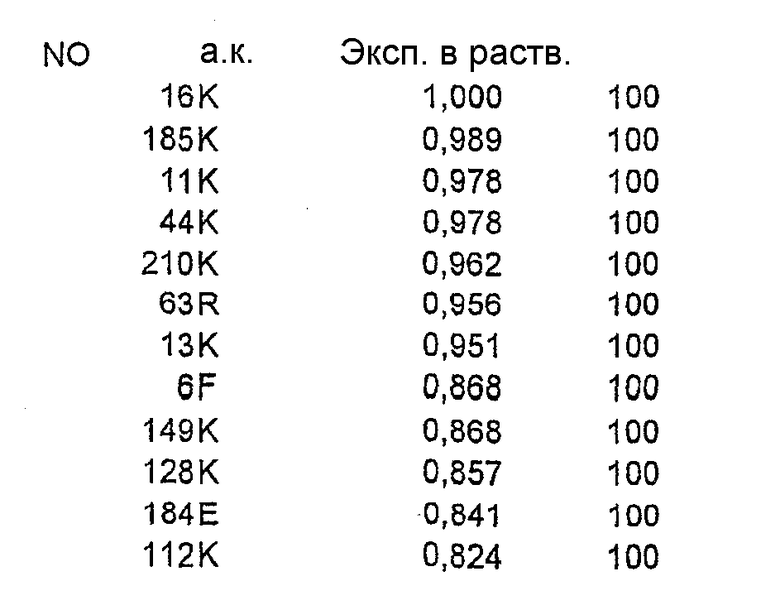
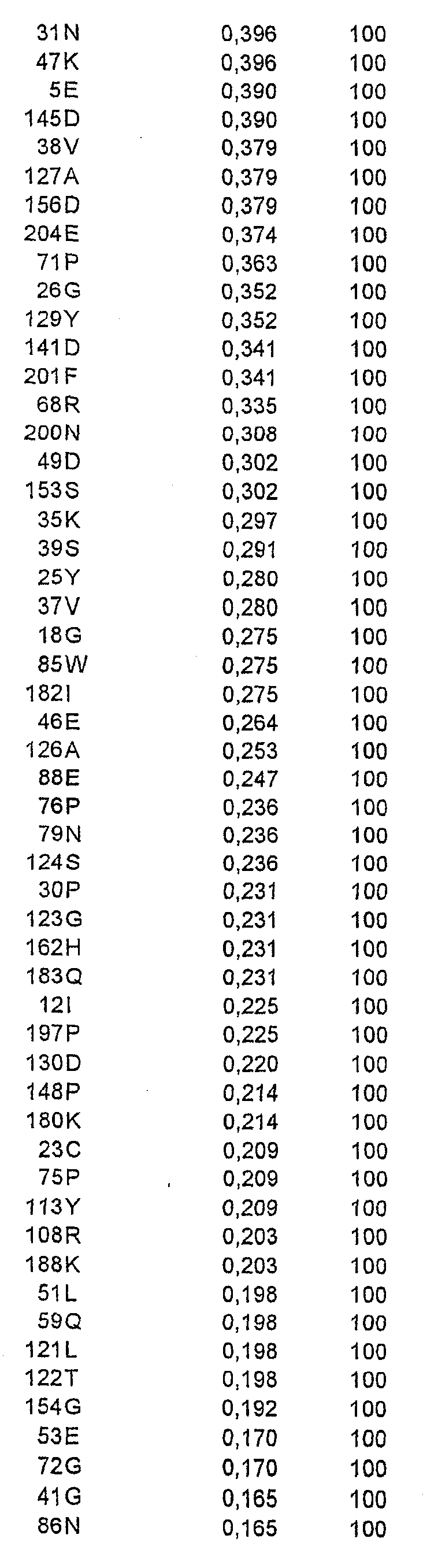
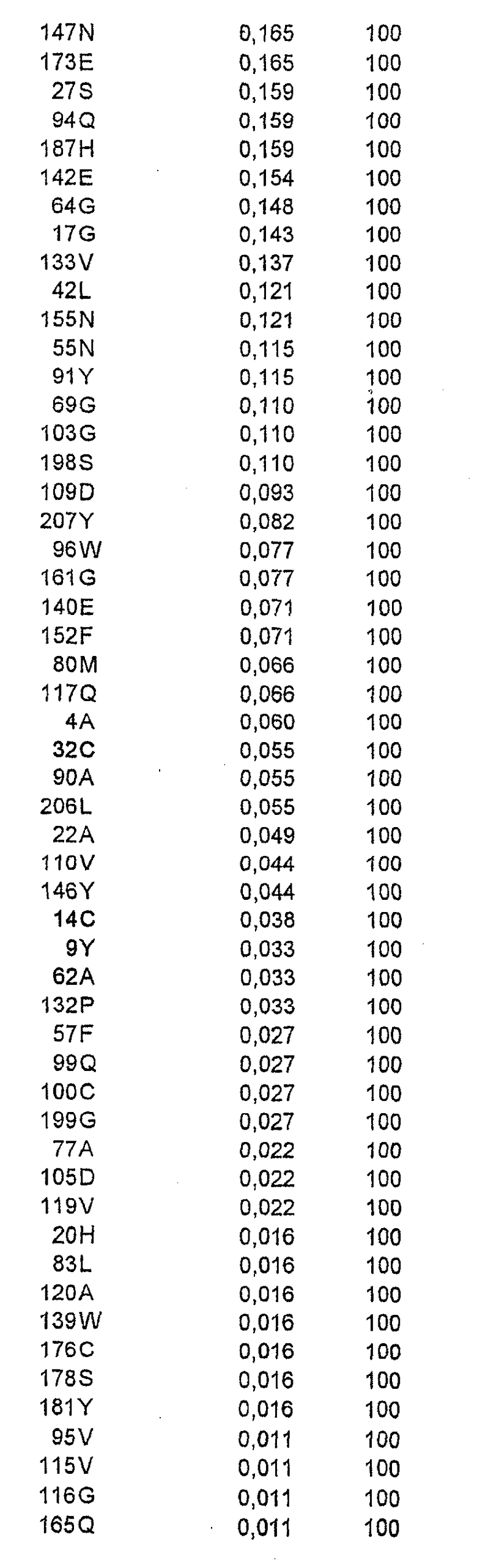
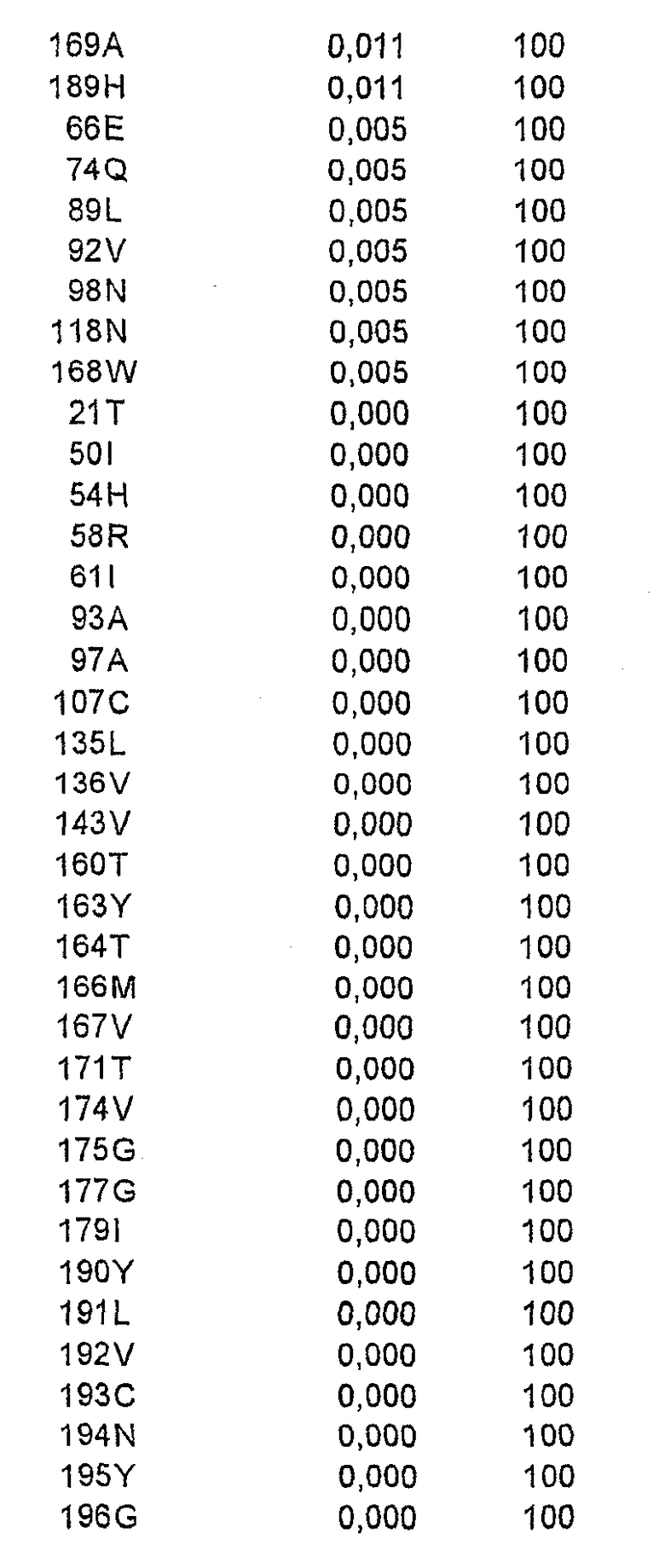
Пример 4
В данном примере описаны получение и характеристика рекомбинантных мутантных аллергенов Bet v 1 согласно изобретению, т.е. аллергенов со сниженным сродством связывания IgE, включающим в себя по меньшей мере четыре первичные мутации.
Выбор аминокислотных остатков для сайт-направленного мутагенеза Bet v 1
Доступность аминокислотных остатков Bet v 1 для растворителя показана в примере 3, таблица 1. Степень консервативности аминокислот основана на выравнивании последовательностей, осуществленном с помощью ExPaSy Molecular Biology Server (http://www.expasy.ch/) с применением алгоритма Clusta1W поиска BLAST, где в качестве вводной последовательности используется аминокислотная последовательность Bet v 1.2801 дикого типа. Выравнивание включает в себя 67 последовательностей аллергенов (39 последовательностей Bet v 1, 11 последовательностей Car b 1, 6 последовательностей Cor a 1 и 13 последовательностей Aln g 1) в пределах отряда Fagales (Bet v 1: Betula verrucosa; Car b 1: Carpinus betulus; Cor a 1: Corylus avellana; Aln g 1: Alnus glutinosa). Что касается показанных в примерах мутантных рекомбинантных аллергенов Bet v 1, то основанием для замены остатков-мишеней являлась идентичность аминокислот ≥95%.
Как описано в примере 1, для сайт-направленного мутагенеза отбирали аминокислотные остатки с высокой степенью экспонирования в растворитель и высокой степенью консерватизма среди аллергенов пыльцы родственных видов. Аминокислотные остатки с низкой степенью экспонирования в растворитель (<20%) рассматривали как неподходящие для мутагенеза из-за возможного нарушения третичной структуры или отсутствия взаимодействия с антителами.
Все введенные остатки имеются в соответствующих положениях изоформ группы растительных белков, называемых связанными с патогенезом (PR-10) белками. Молекулярное моделирование позволяет предполагать, что третичные структуры аллергенов Fagales и белков PR-10 близки к совпадению. Bet v 1 проявляет значительное совпадение последовательности (20-40%) с белками PR-10. Однако не имеется сообщений об аллергической перекрестной реакции в отношении к данным белкам PR-10. Таким образом, замена высококонсервативной и экспонированной в растворитель аминокислоты из Bet v 1 на аминокислоту в соответствующем положении в белке PR-10 дает мутантный белок Bet v 1 с неизмененной третичной структурой α-углеродного скелета, но со сниженным сродством связывания IgE.
Мутагенез in vitro
Мутагенез in vitro проводили с помощью ПЦР с применением рекомбинантной pMAL-c со вставкой Bet v 1 в качестве матрицы. Получение рекомбинантных мутантных аллергенов, включающих от пяти до девяти первичных мутаций, включало две стадии ПЦР, стадию I и стадию II. Во-первых, каждую одиночную мутацию (или несколько мутаций, если они находились рядом друг с другом в последовательности ДНК) вводили последовательно в последовательности ДНК Bet v 1.2801 или производные Bet v 1.2801 с применением смысловых и антисмысловых специфичных в отношении мутаций олигонуклеотидных праймеров, адаптированных для каждой мутации(мутаций) в пределах смыслового и антисмыслового олигонуклеотидных праймеров, адаптированных к расположенным выше или ниже соседним мутациям или N-концу/C-концу Bet v 1, как схематически изображено на фиг.17 (I). Во вторых, продукты ПЦР реакции I ПЦР очищали, смешивали и применяли в качестве матриц для дополнительной реакции ПЦР (II) с олигонуклеотидными праймерами, адаптированными к N-концу и C-концу Bet v 1, как схематически иллюстрировано на фиг.17 (II). Продукты ПЦР очищали путем электрофореза в агарозном геле и очистки ПЦР в геле (Life Technologies) с последующим осаждением этанолом, разрезанием ферментами рестрикции (SacI/EcoRI или SacI/XbaI) и направленно лигировали в pMAL-c, разрезанной теми же ферментами.
На фиг.18 показаны синтезированные олигонуклеотидные праймеры и схематические иллюстрации конструирования мутантов Bet v 1, содержащих от пяти до девяти первичных мутаций. Мутантные аминокислоты предпочтительно выбирали из группы, состоящей из аминокислот, характеризуемых высокой степенью экспонирования в растворитель и консерватизма, как описано в примере 3. Мутанты Bet v 1, обозначенные в скобках, включают в себя следующие первичные и вторичные мутации:
Мутант Bet v 1 (2628): Tyr5Val, G1u45Ser, Lys65Asn, Lys97Ser, Lysl34Glu.
Мутант Bet v 1 (2637): Ala16Pro, (Asn28Thr, Lys32Gln), Lys103Thr, Pro108Gly, (Leu152Lys, Alal53Gly, Ser155Pro).
Мутант Bet v 1 (2733): (Tyr5Val, Lysl34Glu), (Asn28Thr, Lys32Gln), Glu45Ser, Lys65Asn, (Asn78Lys, Lys103Val) Lys97Ser, Pro108Gly, Arg145Glu, (Aspl56His, +160Asn)
Мутант Bet v 1 (2744): (Tyr5Val, Lysl34Glu), Glu42Ser, Glu45Ser), (Asn78Lys, Lys103Val), Lysl23Ile, (Aspl56His, + 160Asn).
Мутант Bet v 1 (2753): (Asn28Thr, Lys32Gln), Lys65Asn, (Glu96Leu, Lys97Ser), (Pro108Gly, Asp109Asn), (Aspl25Tyr, Glul27Ser), Argl45Glu.
Секвенирование нуклеотидов
Определение нуклеотидной последовательности гена, кодирующего Bet v 1, проводили до и после субклонирования и после мутагенеза in vitro, соответственно. Плазмидные ДНК из 10 мл бактериальной культуры, растущей до насыщения в течение ночи в среде LB с добавкой 0,1 г/л ампициллина, очищали на колонках Qiagen-tip 20 и секвенировали с применением набора для секвенирования Ready reaction dye terminator cycle и флуоресцентного секвенатора AB PRISM 377, оба от (Perkin Elmer) в соответствии с рекомендациями поставщиков.
Экспрессия и очистка рекомбинантного Bet v 1 и мутантов
Рекомбинантный Bet v 1 (Bet v 1 No. 2801 и мутанты) гиперэкспрессировали в Escherichia coli DH 5α в форме гибрида со связывающим мальтозу белком и очищали, как описано в ссылке 15. Вкратце, рекомбинантные клетки E. coli выращивали при 37°С до оптической плотности 0,8 при 600 нм, после чего экспрессию гибридного белка Bet v 1 индуцировали добавлением IPTG. Клетки собирали путем центрифугирования через 3 часа после индукции, ресуспендировали в лизирующем буфере и разрушали обработкой ультразвуком. После обработки ультразвуком и дополнительного центрифугирования выделяли рекомбинантный гибридный белок с помощью амилозной аффинной хроматографии и затем расщепляли инкубацией с фактором Xa (ссылка 15). После расщепления FXa рекомбинантный Bet v 1 выделяли гель-фильтрацией и подвергали дополнительному циклу амилозной аффинной хроматографии для удаления следовых количеств связывающего мальтозу белка.
Очищенный рекомбинантный Bet v 1 концентрировали путем ультра-фильтрации до приблизительно 5 мг/мл и хранили при 4°С. Конечный выход препаратов очищенного рекомбинантного Bet v 1 находился между 2 и 5 мг на литр клеточной культуры E. coli.
Препараты очищенного рекомбинантного Bet v 1 представляли собой единственные полосы после электрофореза в полиакриламиде с ДДС-Na и окраски серебром с кажущейся молекулярной массой 17,5 кДа.
Ранее было показано (ссылка 15), что рекомбинантный Bet v 1 No. 2801 иммунохимически неотличим от природного Bet v 1.
Мутанты Bet v 1 (2628) и Bet v 1 (2637)
На фиг.19 показаны введенные точечные мутации на молекулярной поверхности Bet v 1 (2628) и Bet v 1 (2637). В мутанте Bet v 1 (2628) пять первичных мутаций вводили в половину Bet v 1 при сохранении другой половины неизмененной. В мутанте Bet v 1 (2637) пять первичных и три вторичные мутации вводили в другую половину при сохранении левой половины неизмененной. Таким образом, мутации в мутанте Bet v 1 (2628) и мутанте Bet v 1 (2637) влияют на разные половины поверхности Bet v 1, соответственно.
Кристаллизация и структурный анализ рекомбинантного Bet v 1 (2628) мутантного белка
Кристаллы рекомбинанта Bet v 1 (2628) выращивали с помощью паровой диффузии при 25°С, по существу как описано у Spangfort et al., 1996b (ссылка 21). Bet v 1 (2628) в концентрации 5 мг/мл смешивали с равным объемом смеси 2,2 М сульфата аммония, 0,1 М цитрата натрия, 1% (об/об) диоксана, pH 6,3, и уравновешивали против 100х объема смеси 2,2 М сульфата аммония, 0,1 М цитрата натрия, 1% (об/об) диоксана, pH 6,3. Через 24 часа уравновешивания рост кристаллов индуцировали с применением метода посева, описанного в ссылке 21, с использованием кристаллов рекомбинантного Bet v 1 дикого типа в качестве затравки.
Приблизительно через 4 месяца кристаллы собирали и анализировали с помощью рентгеновских лучей, полученных с вращающегося анода Rigaku, как описано в ссылке 21, и структуру определяли с применением молекулярного замещения.
Структура мутанта Bet v 1 (2628)
Структурное влияние мутаций выясняли определением дифракции выращенных трехмерных кристаллов белка Bet v 1 (2628) с разрешением 2,0 Å при анализе с помощью рентгеновских лучей, полученных с вращающегося анода. Замены Tyr5Val, Glu45Ser, Lys65Asn, Lys97Ser, Lys134Glu подтверждены с помощью карты электронной плотности структуры Bet v 1 (2628), которая также показала, что общая третичная структура α-углеродного скелета сохраняется.
Структура мутанта Bet v 1 (2637)
Структурную целостность очищенного мутанта Bet v 1 (2637) анализировали с помощью спектроскопии кругового дихроизма (КД). На фиг.20 показаны спектры КД рекомбинанта Bet v 1.2801 (дикий тип) и мутанта Bet v 1 (2637), записанные при близких к равным концентрациях. Перекрытие пиковых амплитуд и положений в спектрах КД двух рекомбинантных белков показывает, что два препарата включают в себя равное содержание вторичных структур, что позволяет обоснованно предполагать, что третичная структура α-углеродного скелета не меняется введением аминокислотных замен.
Свойства связывания IgE мутантов Bet v 1 (2628) и Bet v 1 (2637)
Свойства связывания IgE Bet v 1 (2628) и Bet v 1 (2637), а также смеси 1:1 Bet v 1 (2628) и Bet v 1 (2637) сравнивали с таковыми рекомбинанта дикого типа Bet v 1.2801 в тесте жидкофазного ингибирования IgE с применением пула сывороточного IgE, полученного у пациентов с аллергией на березу.
Как описано в примере 1, рекомбинантный Bet v 1.2801 биотинилировали при молярном отношении 1:5 (Bet v 1 no. 2801:биотин). Тест ингибирования проводили следующим образом: образец сыворотки (25 мкл) инкубировали с анти-IgE на твердой фазе, промывали, ресуспендировали и дополнительно инкубировали со смесью биотинилированного Bet v 1.2801 и данного мутанта или смесью 1:1 обоих мутантов. Количество биотинилированного Bet v 1.2801, связанного с твердой фазой, определяли на основании измерения RLU после инкубации со стрептавидином, меченным эфиром акридина. Степень ингибирования рассчитывали как отношение величин RLU, полученных с применением буфера и мутанта в качестве ингибитора.
На фиг.21 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1.2801 с сывороточным IgE из пула, полученного у пациентов с аллергией, небиотинилированным Bet v 1.2801 и Bet v 1 (2628), Bet v 1 (2637) и смесью 1:1 Bet v 1 (2628) и Bet v 1 (2637).
Имеется четкая разница в количестве соответствующих рекомбинантных белков, необходимом для достижения 50% ингибирования связывания с сывороточным IgE, присутствующим в объединенной сыворотке. 50% ингибирование рекомбинантным Bet v 1.2801 достигается при приблизительно 5 нг, тогда как соответствующая концентрация для мутанта Bet v 1 (2628) составляет приблизительно 15-20 нг. Это показывает, что точечная мутация, введенная в мутант Bet v 1 (2628), снижает сродство к специфическому сывороточному IgE приблизительно в 3-4 раза.
Максимальный уровень ингибирования, достигаемый под действием мутантного белка Bet v 1 (2628), явно ниже достигаемого под действием рекомбинантного Bet v 1. Это может указывать на то, что некоторые из специфических IgE, присутствующих в объединенной сыворотке, не способны узнавать мутантный белок Bet v 1 (2628) из-за введенных точечных мутаций.
50% ингибирование под действием Bet v 1 (2837) достигается при приблизительно 400-500 нг, что указывает на то, что введенная в мутант Bet v 1 (2837) точечная мутация снижает сродство к специфическому сывороточному IgE в 80-100 раз по сравнению с Bet v 1.2801. Большая разница в связывании IgE дополнительно подтверждается четким различием в наклоне кривой ингибирования, полученной с мутантным белком Bet v 1 (2837) и кривой ингибирования, полученной для Bet v 1.2801. Различие в наклонах служит указанием на то, что снижение связывания IgE обусловлено четко различающимся паттерном эпитопов мутанта и Bet v 1.2801.
В дополнение к тестам ингибирования с отдельными модифицированными аллергенами тестировали смесь 1:1 Bet v 1 (2628) и Bet v 1 (2637) с той же молярной концентрацией Bet v 1, что и каждый из образцов Bet v 1 (2628) или Bet v 1 (2637), соответственно, и тестирование показало полную (100%) способность ингибировать связывание IgE с rBet v 1.2801. Способность к полному ингибированию связывания IgE служит четким указанием на то, что все активные эпитопы, имеющиеся на Bet v 1.2801, присутствовали в смеси аллергенов 1:1. Дополнительным доказательством служит сопоставимый наклон двух кривых ингибирования для Bet v 1.2801 и смеси аллергенов. О сниженном взаимодействии с IgE образца со смесью аллергенов свидетельствует необходимость использования четырехкратной по сравнению с Bet v 1.2801 концентрации смеси аллергенов для достижения 50% ингибирования связывания IgE.
Тест пролиферации T-клеток с применением мутантных рекомбинантных аллергенов Bet v 1
Анализ проводили, как описано в ссылке 15. И Bet v 1 (2628), и Bet v 1 (2637) мутантные белки были способны индуцировать пролиферацию линий T-клеток пациентов с аллергией на пыльцу березы с показателями стимуляции, сходными с показателями, присущими рекомбинантному и природному белку. Это позволяет предполагать, что каждый из мутантных белков Bet v 1 (2628) и Bet v 1 (2637) может инициировать клеточный иммунный ответ, необходимый для продукции антител.
Тест высвобождения гистамина базофилами человека
Тест высвобождения гистамина базофильными лейкоцитами человека проводили следующим образом. У каждого пациента с аллергией на пыльцу березы брали гепаринизированную кровь (20 мл), оставляли ее при комнатной температуре и использовали в пределах 24 часов. Двадцать пять микролитров гепаринизированной цельной крови вносили в лунки для микротитрования, покрытые стеклянными волокнами (Reference Laboratory, Copenhagen, Дания), и инкубировали с 25 микролитрами аллергена или анти-IgE в течение 1 часа при 37°С. После этого планшеты промывали и мешающие анализу вещества удаляли. Наконец, с помощью спектрофотофлуориметрии измеряли связанный с микроволокнами гистамин.
Свойства высвобождения гистамина мутантных белков Bet v 1 (2628) и Bet v 1 (2637)
Данные по высвобождению гистамина показаны на фиг.22 и 23. Тестировали эффективность мутантных белков Bet v 1 (2628) и Bet v 1 (2637) в индукции высвобождения гистамина базофилами человека у двух пациентов с аллергией на пыльцу березы. В обоих случаях кривые высвобождения гистамина, индуцированного мутантными аллергенами, явно сдвинуты вправо по сравнению с кривой высвобождения, индуцированного Bet v 1.2801. Сдвиг указывает на то, что эффективность Bet v 1 (2628) и Bet v 1 (2637) снижена 3 - 10-кратно.
Мутант Bet v 1 (2744) и мутант Bet v 1 (2753)
Таким же образом конструировали Bet v 1 (2744) и Bet v 1 (2753) для применения в смешанной аллергенной вакцине. В данных мутантных аллергенах точечные мутации распределяли по всей поверхности, обусловливая форму, показанную на фиг.24 и 25, и вновь созданные для оказания влияния на различные области в двух молекулах, соответственно, как показано на фиг.26. Однако данные модифицированные аллергены могли бы быть также применены раздельно в качестве вакцин с единственным аллергеном.
Структурный анализ мутантного белка Bet v 1 (2744)
Структурную целостность очищенного мутанта Bet v 1 (2744) анализировали с помощью спектроскопии кругового дихроизма (КД). На фиг.27 показаны спектры КД рекомбинантного Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2744), записанные при близких к равным концентрациях. Перекрытие пиковых амплитуд и положений в спектрах КД двух рекомбинантных белков показывает, что два препарата содержат равное количество вторичных структур, что позволяет обоснованно предполагать, что третичная структура α-углеродного скелета не меняется с введением аминокислотных замен.
Свойства Bet v 1 (2744) по высвобождению гистамина
Данные пяти экспериментов с базофильными лейкоцитами от пяти разных пациентов с аллергией на пыльцу березы по высвобождению гистамина показаны на фиг.29A-D. Тестировали эффективность мутантного белка Bet v 1 (2744) в индукции высвобождения гистамина базофилами человека. Кривые высвобождения для мутантных аллергенов явно смещены вправо по сравнению с кривой высвобождения Bet v 1.2801, что указывает на то, что эффективность Bet v 1 (2744) в отношении высвобождения гистамина снижена 3-5-кратно.
Мутант Bet v 1 (2733)
Был сконструирован и рекомбинантно экспрессирован мутант Bet v 1 (2733) с девятью первичными мутациями. Распределение точечных мутаций в Bet v 1 (2733) обеспечивает сохранение нескольких областей поверхности, составляющих >400Å2, неизмененными. На фиг.30 показаны введенные точечные мутации на молекулярной поверхности Bet v 1 (2733).
Пример 5
В данном примере описано клонирование гена, кодирующего Der p 2, из Dermatophagoides pteronyssinus и конструирование мутантов со сниженным сродством связывания IgE.
Амплифицированные ПЦР продукты синтеза первой цепи кДНК суммарной РНК Dermatophagoides pteronyssinus получали от Dr. Wendy-Anne Smith и Dr. Wayne Thomas (TVW Telethon Institute for Child Health Research, 100 Roberts Rd, Subiaco, Западная Австралия 6008). При амплификации библиотеки первой цепи кДНК Der p 2 был избирательно амплифицирован с применением специфичных для Der p 2 праймеров. Фрагменты ПЦР затем клонировали в сайт Bam HI pUC19 (New England BioLabs). Секвенирование ДНК Der p 2, специфичных для вектора смыслового (5'-GGCGATTAAGTTGGGTAACGCCAGGG-3') и антисмыслового (5'-GGAAACAGCTATGACCATGATTACGCC-3') праймеров.
Суммарно идентифицировали семь отдельных изоформ Der p 2, обозначенные ALK-101, ALK-102, ALK-103, ALK-104, ALK-113, ALK-114 и ALK-120. Клон, названный ALK-114, выбирали в качестве отправной точки для создания низкоаффинных к IgE мутантов из-за его высокой степени идентичности ЯМР-структуре Der p 2 с базой данных под регистрационным номером 1A9V. По сравнению с ALK-114 6 других природных изоформ включают в себя следующие замены:
ALK-101: M76V.
ALK-102: V40L, T47S.
ALK-103: M111L, D114N.
ALK-104: T47S, M111L, D114N.
ALK-113: T47S.ALK-120: V40L, T47S, D114N.
Вставка Der p 2 в pGAPZα-A
Ген, кодирующий Der p 2 (ALK-114), затем вставляли в вектор pGAPZα-A (Invitrogen) для секретируемой экспрессии Der p 2 в дрожжах, Pichia pastoris. Ген амплифицировали с применением смыслового праймера OB27 (5'-GGAATTCCTCGAGAAAAGAGATCAAGTCGATGTCAAAGATTGTGCC-3') и антисмыслового праймера OB28 (5'-CGTTCTAGACTATTAATCGCGGATTTTAGCATGAGTTCG-3'), соответствующих амино- и карбоксиконцам полипептида Der p 2, соответственно. Праймеры расширяли по 5'-концу для включения сайтов рестрикции Xho I и Xba I, соответственно. Сайт рестрикции Xho I сливается с первым кодоном Der p 2 в рамке считывания последовательности нуклеиновой кислоты, кодирующей сайт расщепления KEX2 (LYS-ARG) pGAPZα-A. Проводили один раунд амплификации ПЦР в объеме 100 микролитров (мкл): 0,1 мг матричной ДНК ALK-114, 1 X буфера полимеразы Expand (доступного от Boehringer Mannheim), 0,2 миллимолярные (мМ) каждый из четырех dNTP, 0,3 микромолярные (мкМ) смысловой и антисмысловой праймеры и 2,5 единицы полимеразы Expand (доступной от Boehringer Mannheim). ДНК амплифицировали в результате 25 циклов: 95°С в течение 15 секунд, 45°С в течение 30 секунд, 72°С в течение 1 минуты с последующим 1 циклом при 72°С в течение 7 минут. Полученный ПЦР фрагмент ALK-114 из 475 пар нуклеотидов очищали с применением процедуры очистки QIAquick spin (доступного от Qiagen). Затем очищенный фрагмент ДНК переваривали Xho I и Xba I, очищали в геле и лигировали с аналогичным образом переваренной pGAPZα-A. Продуктом реакции лигирования трансформировали штамм DH5α E.coli, что давало плазмиду pCBo06.
Нуклеотидная последовательность Der p 2 подтверждена секвенированием ДНК до и после клонирования и последующим мутагенезом in vitro (см. ниже).
Последовательности Der p 2
SEQ ID NO 1 соответствует последовательности нуклеиновой кислоты Der p 2 (ALK-114):

SEQ ID NO 2 соответствует выведенной аминокислотной последовательности Der p 2 (ALK-114):

Введение pGAPZα-A-Der p 2 в P. pastoris
Вектор pCBo06 линеризовали с помощью фермента рестрикции Avr II и им трансформировали компетентный штамм P. pastoris, X-33, как описано в руководстве Invitrogen. Отбирали рекомбинантные клетки, устойчивые к 100 микрограммам на миллилитр (мкг/мл) зеоцина, и колонии очищали на свежих планшетах YPD, содержащих 100 мкг/мл зеоцина.
Экспрессия и очистка рекомбинантного Der p 2
250 мкл среды YPD (1% дрожжевой экстракт, 2% пептон, 2% глюкоза), содержащей 100 мкг/мл зеоцина, инокулировали в ночную культуру рекомбинантных дрожжевых клеток, экспрессирующих Der p 2. Культуру выращивали при 30°С в течение 72 часов для достижения оптимальной экспрессии Der p 2. Клетки собирали путем центрифугирования и полученный культуральный супернатант насыщали 50% сульфатом аммония. После центрифугирования при 3000xg в течение 30 минут супернатант насыщали 80% сульфатом аммония. После следующего центрифугирования осадок ресуспендировали в 150 миллимолярном (мМ) NH4HCO3 и фракционировали на колонке для гель-фильтрации Superdex 75, уравновешенной тем же буфером. Der p 2 элюировался в виде основного пика, соответствующего его ожидаемой молекулярной массе. Элюирование Der p 2 отслеживали с помощью электрофореза в Na-ДДС ПАГ с последующей окраской серебром и с помощью анализа иммуноблоттингом с применением Der p 2 специфичных поликлональных антител.
Выбор аминокислотных остатков для сайт-направленного мутагенеза
Выбор аминокислотных остатков для мутагенеза основывался на идентификации остатков с высоким экспонированием в растворитель и высоким консерватизмом среди аллергенов из клещей домашней пыли (Der p 2/f 2 и Eur m 2) и клещей хранилищ (Tyr p 2, Lep d 2, Gly d 2). Аминокислотные остатки с высоким экспонированием в растворитель идентифицировали визуально путем анализа молекулярной поверхности ЯМР-структуры Der p 2 (#1.9 1A9V.pdb). Для мутагенеза отобрали двенадцать аминокислотных остатков: K6A, N10S, K15E, S24N, H30N, K48A, E62S, H74N, K77N, K82N, K100N и R128Q.
Сайт-направленный мутагенез
Ниже описано конструирование рекомбинантных мутантных аллергенов с одиночными первичными мутациями и их множественными сочетаниями.
Экспрессионные плазмиды, кодирующие мутанты Der p 2, получали с применением pCBo06 в качестве матричной ДНК. Реакции ПЦР проводили с применением смысловых и антисмысловых праймеров, включающих конкретные мутации. Пары праймеров, примененных в реакциях ПЦР для создания конкретных мутаций, перечислены на фиг.31, на которой мутации отмечены жирным шрифтом, а сайты рестрикции, использовавшиеся на следующей стадии клонирования, подчеркнуты. Для конструирования мутантов K6A, K15E, H30N, H74N и K82N реакции ПЦР проводили в точном соответствии с описанием в разделе «Клонирование Der p 2 в pGAPZα-A». Очищенные фрагменты GWH переваривали по созданным сайтам для ферментов рестрикции (см. фиг.31), очищали в геле, лигировали в аналогичным образом переваренную pCBo06 и использовали для трансформации E.coli DH5α.
Мутацию E62S вызывали, используя способ альтернативного мутагенеза ПЦР, описанный для создания мутантов Bet v 1 в примере 1. Синтезировали два специфичных для мутации олигонуклеотидных праймера, покрывающих указанные мутации (OB47 и OB48, приведенные на фиг.31). Двумя дополнительными праймерами, примененными на стадии вторичной амплификации, были OB27 и OB28, как описано в разделе «Вставка Der p 2 в pGAPZα-A».
Полученные мутантные аллергены характеризовали с использованием аналогичных методик, как описано в примере 4, например спектроскопии кругового дихроизма (КД), кристаллизации, измерений свойств связывания IgE, высвобождения гистамина, способности стимуляции пролиферации T-клеток и т.д.
Пример 6
Мутантные рекомбинантные аллергены клеща (Der p 2) с усовершенствованной безопасностью для специфической аллергической вакцинации
В данном примере применение концепции настоящего изобретения к аллергенам клеща домашней пыли иллюстрируется одним аллергеном, Der p 2. Манипуляции с другими аллергенами клеща домашней пыли могут быть выполнены с помощью эквивалентных методик.
Создание мутантных рекомбинантных молекул Der p 2
SEQ ID NO. 3 показывает нуклеотидную и выведенную аминокислотную последовательность клона Der p 2-ALK-G, который является изоформой дикого типа.
SEQ ID NO. 3: нуклеотидная и выведенная аминокислотная последовательность Der p 2-ALK-G:

На фиг.32 показано выравнивание последовательности, произведенное на ExPaSy Molecular Biology Server (http://www.expasy.ch/) с применением алгоритма ClustalW с поиском BLAST, используя аминокислотную последовательность Der p 2-ALK-G, показанную в SEQ ID NO. 3, в качестве вводной последовательности. Выравнивание включает в себя последовательности из видов клеща домашней пыли, т.е. Der p 2, Der f 2 и Eur m 2. На фиг.32 аминокислотные остатки, идентичные аминокислотам в том же положении в белке Der p 2-ALK-G, выделены черными буквами на сером фоне. Неидентичные аминокислоты напечатаны черным на белом фоне.
Изображения структуры поверхности
Аминокислотные последовательности, представляющие собой группу 2 аллергенов клеща домашней пыли, имеют сходство выше 85%, и часть молекулярной поверхности консервативна (окрашенные серым зоны), см. фиг.33.
На фиг.33 показаны контуры поверхности, изображенные под 4 разными углами при наложении последовательности белка Der p 2-ALK-G на опубликованную ЯМР-структуру PDB:1A9V, структуру под номером 1 из 10, содержащихся в файле PDB.
Для мутации выбирают консервативные аминокислоты с высоким экспонированием в растворитель, распределенные в пространстве вдоль полной поверхности на расстояниях в пределах 25-30 Å. В представленных ниже разделах дается следующая информация: перечень аминокислот, рассматриваемых как подходящие для мутации (A), перечень созданных мутантов (B) и последовательности ДНК, представляющие созданные мутанты (C). На фиг.34 в качестве примера показаны контуры поверхности мутанта под номером 1. Серым цветом показаны консервативные аминокислотные остатки. Черным цветом показаны аминокислотные остатки, выбранные для мутации.
A. Перечень аминокислот, выбранных для мутации.
K15, S24, H30, R31, K48, E62, H74, K77, K82, K100, R128.
B. Перечень созданных мутантов.


C. Нуклеотидная последовательность мутантов.




Пример 7
Мутантные рекомбинантные аллергены клеща (Der p 1) с усовершенствованной безопасностью для специфической аллергической вакцинации
В данном примере применение концепции настоящего изобретения к аллергенам клеща домашней пыли иллюстрируется одним аллергеном, Der p 1. Манипуляции с другими аллергенами клеща домашней пыли могут быть выполнены с помощью эквивалентных методик.
Создание мутантных рекомбинантных молекул Der p 1
SEQ ID NO. 4 показывает нуклеотидную и выведенную аминокислотную последовательность клона Der p 1-ALK, который является изоформой дикого типа.
SEQ ID NO. 4: нуклеотидная и выведенная аминокислотная последовательность Der p 1-ALK

На фиг.35 показано выравнивание последовательности, произведенное на ExPaSy Molecular Biology Server (http://www.expasy.ch/) с применением алгоритма ClustalW с поиском BLAST, используя аминокислотную последовательность Der p 1-ALK, показанную в SEQ ID NO. 4, в качестве вводной последовательности. Выравнивание включает в себя последовательности из видов клеща домашней пыли, т.е. Der p 1, Der f 1 и Eur m 1. На фиг.35 аминокислотные остатки, идентичные аминокислотам в том же положении в последовательности белка Der p 1-ALK, выделены черными буквами на сером фоне. Неидентичные аминокислоты напечатаны черным на белом фоне.
Изображения структуры поверхности
Аминокислотные последовательности, представляющие группу 1 аллергенов клеща домашней пыли, имеют определенное сходство, и некоторая часть молекулярной поверхности консервативна (окрашенные серым зоны), см. фиг.36. На фиг.36 показаны контуры поверхности, изображенные под 4 разными углами при наложении последовательности белка Der p 1-ALK на модель молекулярной структуры Der p 1.
Для мутации выбирают консервативные аминокислоты с высоким экспонированием в растворитель, распределенные в пространстве вдоль полной поверхности на расстояниях в пределах 25-30 Å. В представленных ниже разделах дается следующая информация: перечень аминокислот, рассматриваемых как подходящие для мутации (A), перечень созданных мутантов (B) и последовательности ДНК, представляющие созданные мутанты (C). На фиг.37 в качестве примера показаны контуры поверхности мутанта под номером 11. Серым цветом показаны консервативные аминокислотные остатки. Черным цветом показаны аминокислотные остатки, выбранные для мутации.
A. Перечень аминокислот, выбранных для мутации.
E13, P24, R20, Y50, S67, R78, R99, Q109, R128, R156, R161, P167, W192
B. Перечень созданных мутантов.



C. Нуклеотидные последовательности мутантов.






Пример 8
Мутантные рекомбинантные аллергены травы (Phl p 5) с усовершенствованной безопасностью для специфической аллергической вакцинации
В данном примере применение концепции настоящего изобретения к аллергенам пыльцы травы иллюстрируется одним аллергеном, Phl p 5. Манипуляции с другими аллергенами пыльцы травы могут быть выполнены с помощью эквивалентных процедур.
Создание мутантных рекомбинантных молекул Phl p 5
SEQ ID NO. 5 показывает нуклеотидную и выведенную аминокислотную последовательность клона Phl p 5.0103, который является изоформой дикого типа.
SEQ ID NO. 5: нуклеотидная и выведенная аминокислотная последовательность Phl p 5.0103:

На фиг.38 показано выравнивание последовательности, произведенное на ExPaSy Molecular Biology Server (http://www.expasy.ch/) с применением алгоритма ClustalW с поиском BLAST, используя аминокислотную последовательность Phl p 5.0103, показанную в SEQ ID NO. 5, в качестве вводной последовательности. Выравнивание включает в себя последовательности из группы 5 аллергенов видов травы, т.е. Phl p 5, Poa p 5, Lol p 5, Hol p 5, Pha a 5, Hor v 9 и Hor v 5. На фиг.38 аминокислотные остатки, идентичные аминокислотам в том же положении в последовательности белка Phl p 5.0103, выделены черными буквами на сером фоне. Неидентичные аминокислоты напечатаны черным на белом фоне.
Изображения структуры поверхности
Аминокислотные последовательности, представляющие группу 5 аллергенов пыльцы травы, имеют некоторое сходство, и некоторая часть молекулярной поверхности консервативна (окрашенные серым зоны), см. фиг.39. На фиг.39 показаны контуры поверхности, изображенные под 4 разными углами при наложении последовательности белка Phl p 5.0103 на модель молекулярной структуры Phl p 5. Структурная модель включает в себя модели двух половин молекулы, модель A (аминокислоты 34-142), показанную на фиг.39A, и модель B (аминокислоты 149-259), показанную на фиг.39B.
Для мутации выбирают аминокислоты с высоким экспонированием в растворитель, распределенные в пространстве вдоль полной поверхности на расстояниях в пределах 25-30 Å. В представленных ниже разделах дается следующая информация: перечень аминокислот, рассматриваемых как подходящие для мутации (A), перечень созданных мутантов (B) и последовательности ДНК, представляющие созданные мутанты (C). На фиг.40 A и B в качестве примера показаны контуры поверхности мутанта под номером 1 на моделях A и B, соответственно. Серым цветом показаны консервативные аминокислотные остатки. Черным цветом показаны аминокислотные остатки, выбранные для мутации.
A. Перечень аминокислот, выбранных для мутации.
I45, R66, E133, R136, I137, D186, F188, K211, P214, Q222, P232, L243, Q254
B. Перечень созданных мутантов.


C. Нуклеотидные последовательности мутантов.






Пример 9
Реакция T-клеток на рекомбинантный и мутантный Bet v 1
Цель: исследовать ответ T-клеток in vitro на мутантные аллергены в плане пролиферации и продукции цитокинов.
Способы:
В следующем исследовании применяли PBL (лимфоциты периферической крови) пациентов с аллергией.
Как описано в ранее опубликованном протоколе (26), из PBL с природным очищенным bet v 1 было выделено восемь bet v 1 специфичных линий T-клеток для поддержания T-клеток, презентирующих множество изоформ bet v 1.
Десять PBL и восемь линий T-клеток стимулировали экстрактом березы (Bet v), очищенным природным bet v 1 (nBet v 1), рекомбинантным Bet v 1 (rBet v1 или дикого типа; 27) и четырьмя разными мутантными формами rBet v 1 (описанными в другом месте): 2595, 2628, 2637, 2744, 2773. Позднее было обнаружено, что мутант 2637 частично развернут, и он не будет обсуждаться.
Вкратце, в круглодонный 96-луночный планшет добавляли PBL в количестве 2×105 на лунку. Добавляли различные образцы березы в трех разных концентрациях в четырех параллелях, и клеткам давали расти в течение 6 дней. На 6 день отбирали половину объема клеток (100 мкл) из каждой лунки с наибольшей концентрацией березы на определение продукции цитокинов. В лунки добавляли радиоактивно меченный тимидин. На следующий день (день 7) клетки собирали на фильтре. К фильтру добавляли сцинтилляционную жидкость и радиоактивность измеряли на сцинтилляционном счетчике.
Аналогичным образом в круглодонный 96-луночный планшет добавляли T-клетки в количестве 3×104 T-клеток на лунку и стимулировали обученными аутологичными PBL (1×105 клеток на лунку) и 3 разными концентрациями различных образцов березы. Через 1 день клетки из каждой лунки с наибольшей концентрацией березы собирали для определения продукции цитокинов. В лунки добавляли радиоактивно меченный тимидин. На 2 день клетки собирали на фильтре и радиоактивность измеряли, как описано для PBL.
Супернатант из четырех параллельных образцов объединяли и цитокины измеряли с помощью CBA (шарикового набора для цитокинов) от Becton Dickinson.
Результаты
Десять культур PBL показали специфическую стимуляцию березой. В целом, пролиферация PBL в ответ на различные образцы березы была аналогичной, хотя можно было видеть вариации. В 3 PBL nBet v 1 стимулировал пролиферацию лучше, чем rBet v 1 и мутанты. Мутантные образцы березы стимулировали PBL почти одинаково с rBet v 1 (фиг.41). На фиг.41 показаны индексы стимуляции для указанных выше препаратов Bet v 1. Индекс стимуляции рассчитывают как пролиферацию (имп/мин: импульсы в минуту) стимулированного образца (наибольшая концентрация), деленную на пролиферацию (имп/мин) в контрольной среде. PPD обозначает очищенное белковое производное mucobacterium tuberculosis, которое служило положительным контролем.
Продукция цитокинов с доминированием IFN-гамма возрастала пропорционально пролиферации PBL. Не было заметно признаков смещения Th1/Th2 (фиг.42-44). На фиг.42 показан пациент с профилем Th0, на фиг.43 - профиль Th1 и на фиг.44 - профиль Th2. Продукция цитокинов, измеренная в пг/мл, показана в виде столбиков, а отношение ИЛ-5/IFN-гамма представлено нижней пунктирной линией (ось Y справа). Пролиферация, измеренная в виде имп/мин, показана на оси Y справа в виде сплошной линии в имп/мин. В качестве фоновых контролей включены среда и MBP (белок, связывающий мальтозу).
За исключением одной, все восемь выделенных на nBet v 1 линий T-клеток одинаково хорошо пролиферировали в ответ на все образцы березы. Четыре линии T-клеток по соотношению ИЛ-5 и IFN-гамма секретировали цитокины по типу Th0 (Th2>5, 5>Th0>0,2, 0,2>Th1). Три T-клеточные линии секретировали цитокины Th1 и одна T-клеточная линия секретировала цитокины Th2. Отношение ИЛ-5/IFN-гамма не менялось под действием различных образцов березы.
Заключение
Все культуры PBL и 7/8 T-клеточных линий, которые показали специфичную стимуляцию в ответ на nBet v 1, также отвечали на rBet v 1 и мутанты. Эти данные позволяют предполагать, что для стимуляции T-клеток единственная изоформа Bet v 1 или данные 4 мутанта могут заменять смесь отдельных изоформ, обнаруженных в препаратах природных аллергенов.
Таким образом, вакцины, основанные на рекомбинантных аллергенах или данных 4 мутантах, должны быть направлены на существующую популяцию T-клеток, специфичных для Bet v 1.
Пример 10
Индукция специфичных для Bet v 1 IgG антител и блокада антител после иммунизации рекомбинантным и мутантными белками Bet v 1
В данном разделе термином «блокирующие антитела» обозначаются антитела, отличные от антител IgE человека, которые способны связываться с аллергеном и предотвращать связывание антител IgE человека с данным аллергеном.
Способность рекомбинантного белка дикого типа Bet v1 2227 (rBet v 1) и мутантных белков Bet v 1 2595, 2628, 2744 и 2773 индуцировать Bet v 1 специфичные антитела IgG и блокирующие антитела тестировали в экспериментах с иммунизацией мышей.
Мышей BALB/cA (по 8 в каждой группе) иммунизировали с помощью внутрибрюшинных инъекций рекомбинантного белка дикого типа Bet v1 2227 или четырех мутантных белков. Мышей иммунизировали четыре раза с интервалом между дозами 14 дней. Различные белки конъюгировали с 1,25 мг/мл Alhydrogel (гель гидроксида алюминия, 1,3%, pH 8,0-8,4, Superfos Biosector). Мышей иммунизировали либо 1 мкг белка на дозу, либо 10 мкг белка на дозу. Образцы крови отбирали кровопусканием из глазницы на 0, 14, 35, 21, 49 и 63 дни.
Уровень специфичных антител IgG анализировали прямым ELISA с использованием планшетов для микротитрования, покрытых rBet v 1, и биотинилированных антител кролика против IgG мыши (Jackson) в качестве проявляющего антитела. Иммунизация рекомбинантным белком дикого типа Bet v1 2227 или четырьмя мутантными белками вызвала сильный r Bet v 1 специфичный IgG ответ. Данное наблюдение показывает, что четыре мутантных белка способны индуцировать антитела, которые эффективно перекрестно реагируют с белком дикого типа Bet v1 2227.
Для оценки индукции блокирующих антител образцы сыворотки, полученные у пациентов с аллергией на пыльцу березы, инкубировали с парамагнитными шариками, покрытыми моноклональным антителом мыши против IgE человека. После инкубации шарики промывали и ресуспендировали в буфере или разведенных образцах (1:100) сыворотки неиммунизированных мышей (контроль) или мышей, иммунизированных, как описано выше. Затем к данной смеси шариков и сывороточных антител мыши добавляли биотинилированный r Bet v 1. После инкубации шарики промывали и связанный биотинилированный r Bet v 1 определяли с помощью меченного акридином стрептавидина. Инкубация шариков с сывороткой от неиммунизированных мышей не меняла связывание r Bet v 1 с шариками. Напротив, инкубация шариков с сывороткой мышей, иммунизированных рекомбинантным белком дикого типа Bet v1 2227 или четырьмя мутантными белками, значительно снижала связывание r Bet v 1 с шариками, что указывает на присутствие специфичных в отношении Bet v 1 блокирующих антител в образцах сыворотки. Так, на 63 день один или более образцов сыворотки от всех групп с иммунизацией высокой дозой (10 мкг/доза) были способны снижать связывание r Bet v 1 с шариками более чем на 80%. Эти данные показывают, что четыре мутантных белка способны индуцировать антитела, которые могут действовать в качестве специфичных в отношении Bet v 1 блокирующих антител.
Ссылки





































































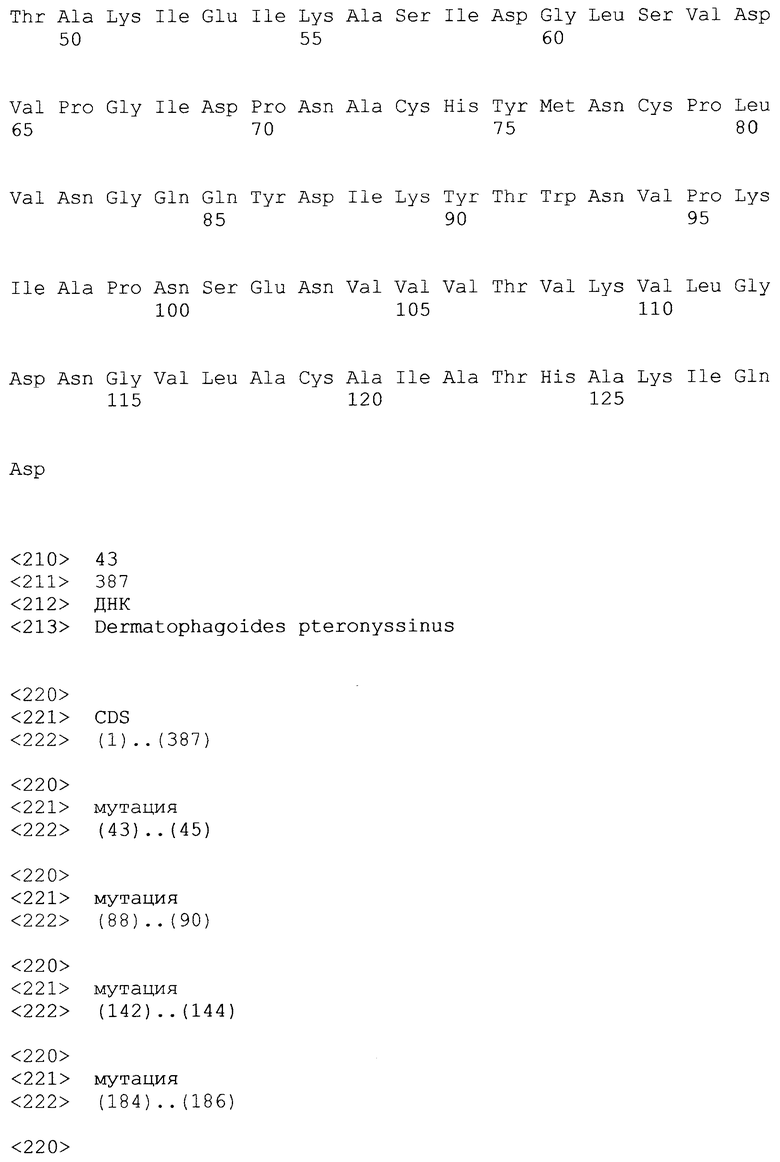

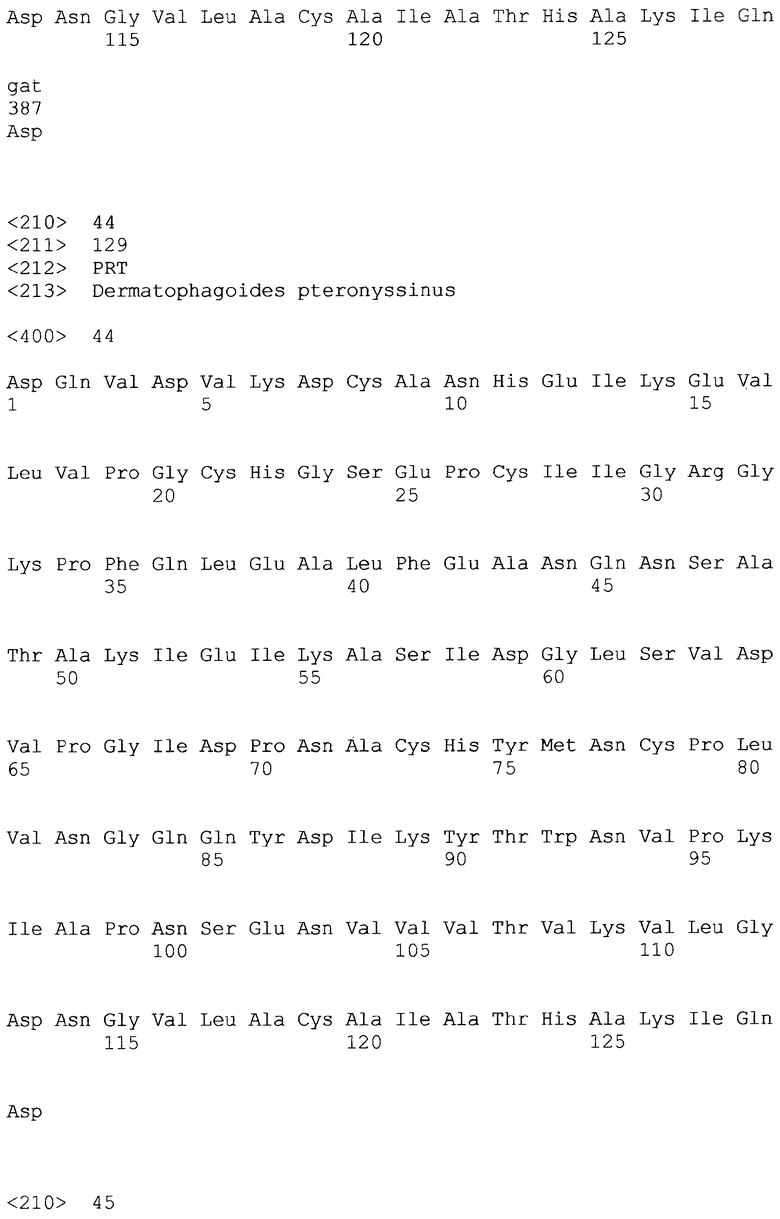












































































| название | год | авторы | номер документа |
|---|---|---|---|
| ГИПОАЛЛЕРГИЧЕСКИЕ ВАРИАНТЫ Mal d 1, ГЛАВНОГО АЛЛЕРГЕНА Malus domectica | 2012 |
|
RU2624030C2 |
| Рекомбинантный полипептид на основе аллергена пыльцы березы и аллергена яблока в качестве вакцины от аллергии | 2020 |
|
RU2761431C1 |
| ГИБРИДНЫЕ БЕЛКИ-НОСИТЕЛИ ПЕПТИДОВ В КАЧЕСТВЕ ВАКЦИН ОТ АЛЛЕРГИИ | 2012 |
|
RU2630652C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2658767C1 |
| МОДИФИКАЦИИ АЛЛЕРГЕНОВ ГРУППЫ 6 POACEAE (МЯТЛИКОВЫХ), ИМЕЮЩИХ ПОНИЖЕННУЮ АЛЛЕРГЕННОСТЬ БЛАГОДАРЯ МУТАГЕНЕЗУ ПРОЛИНОВЫХ ОСТАТКОВ | 2010 |
|
RU2607373C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2575606C2 |
| ПРОИЗВОДНЫЕ PhI p 5а, ОБЛАДАЮЩИЕ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ | 2004 |
|
RU2368620C2 |
| ВАРИАНТ АЛЛЕРГЕНА ГРУППЫ I ИЗ Роасеае, ХАРАКТЕРИЗУЮЩИЙСЯ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО МОЛЕКУЛА ДНК И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2409589C2 |
| КЛЕЩЕВОЙ АЛЛЕРГЕН ДОМАШНЕЙ ПЫЛИ | 2007 |
|
RU2570563C2 |
| ИЗМЕНЕНИЕ ИММУНОГЕННОСТИ АНТИГЕНА ПУТЕМ УСТРАНЕНИЯ ЭПИТОПОВ, УЗНАВАЕМЫХ NKT-КЛЕТКАМИ | 2011 |
|
RU2598247C2 |



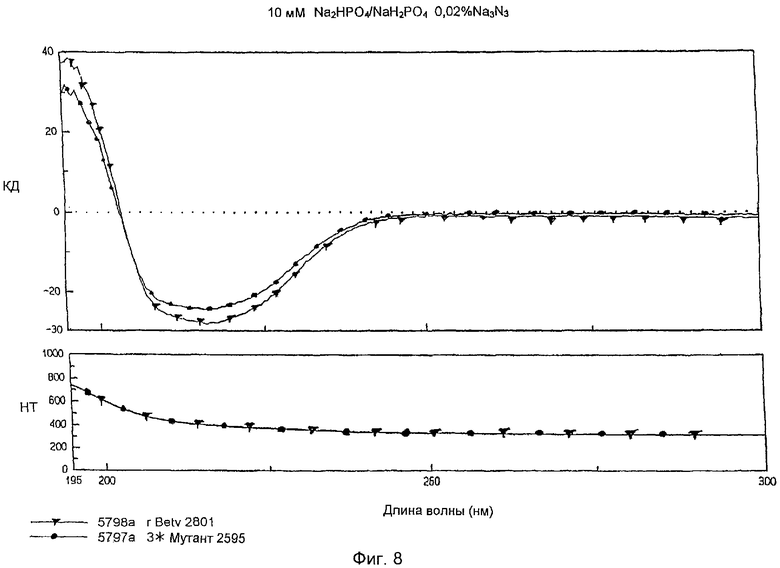
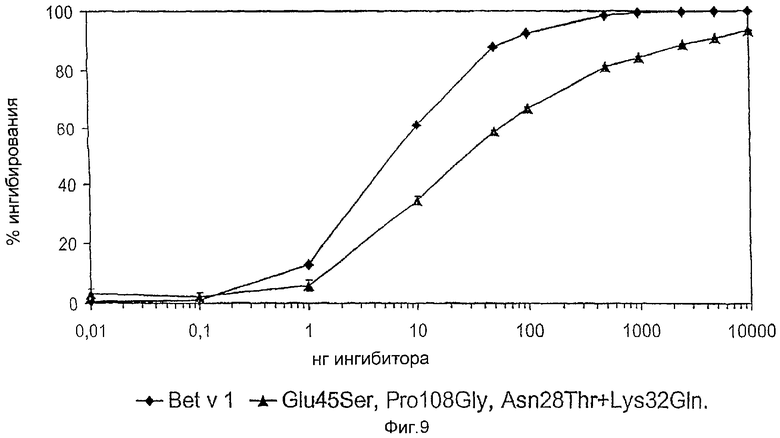
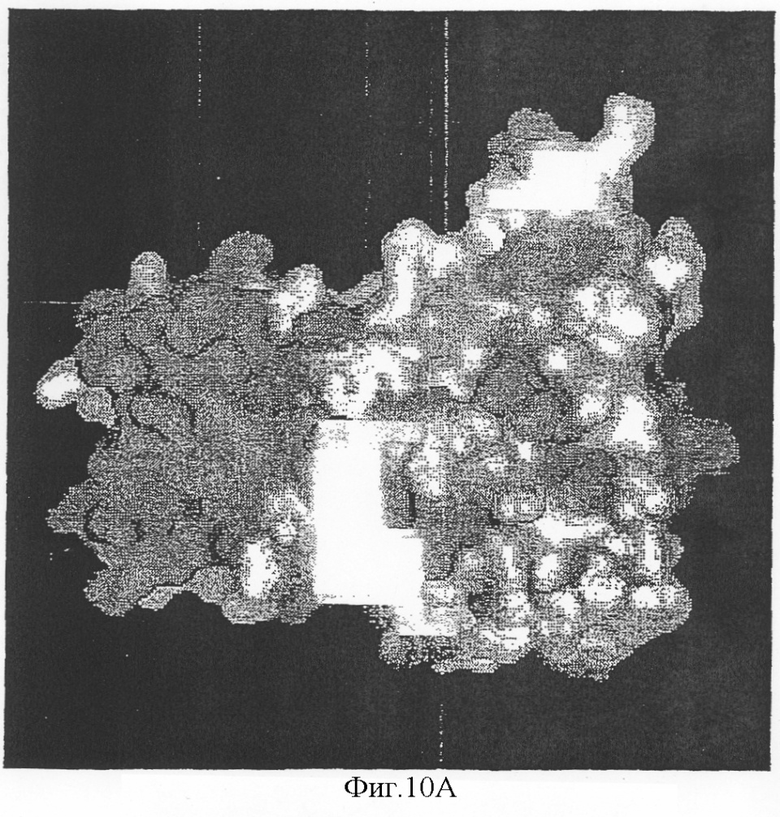
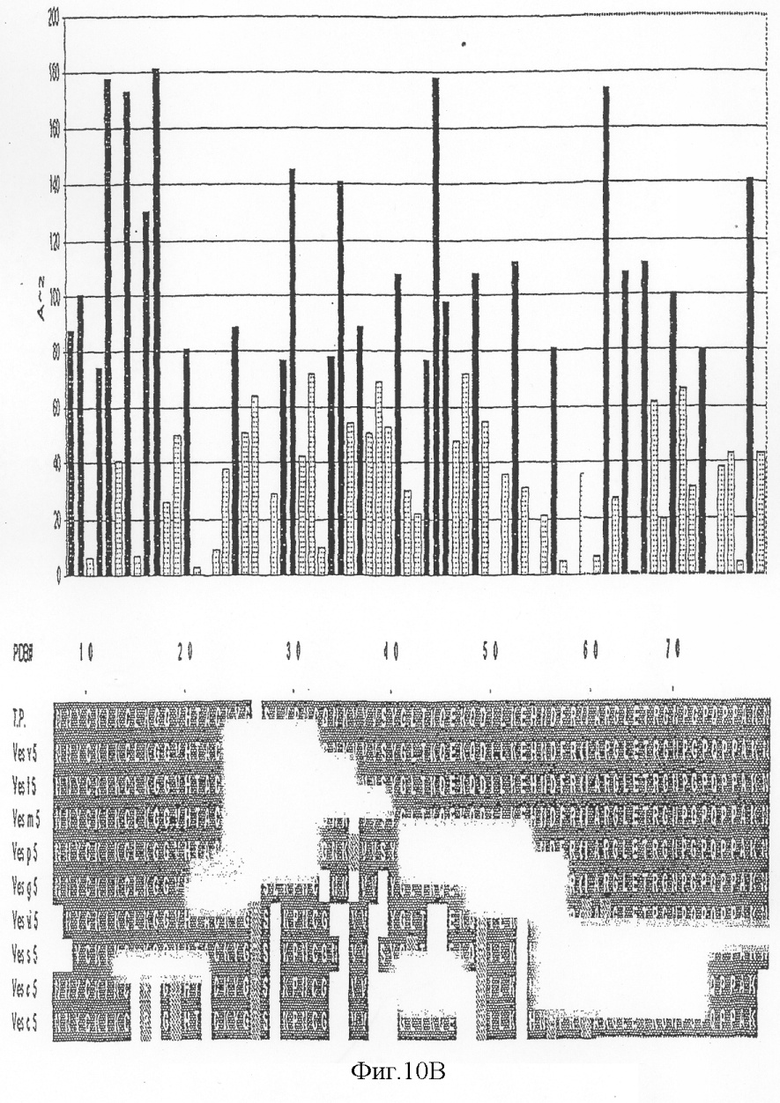
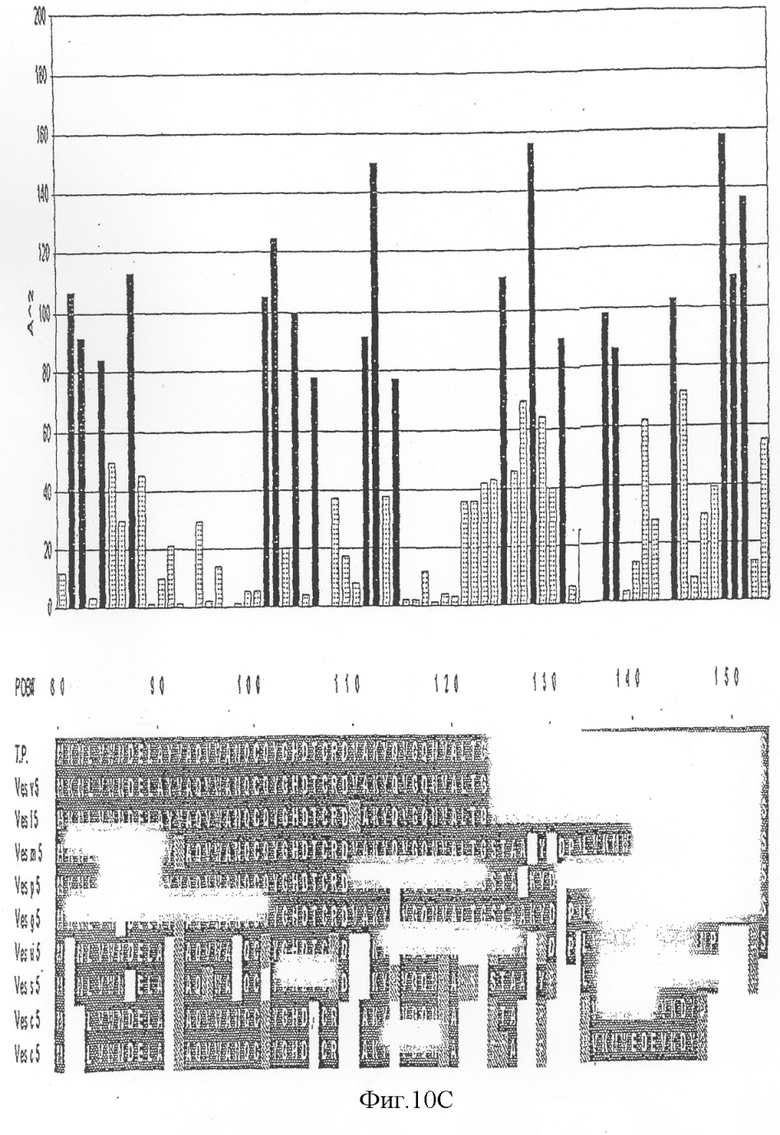
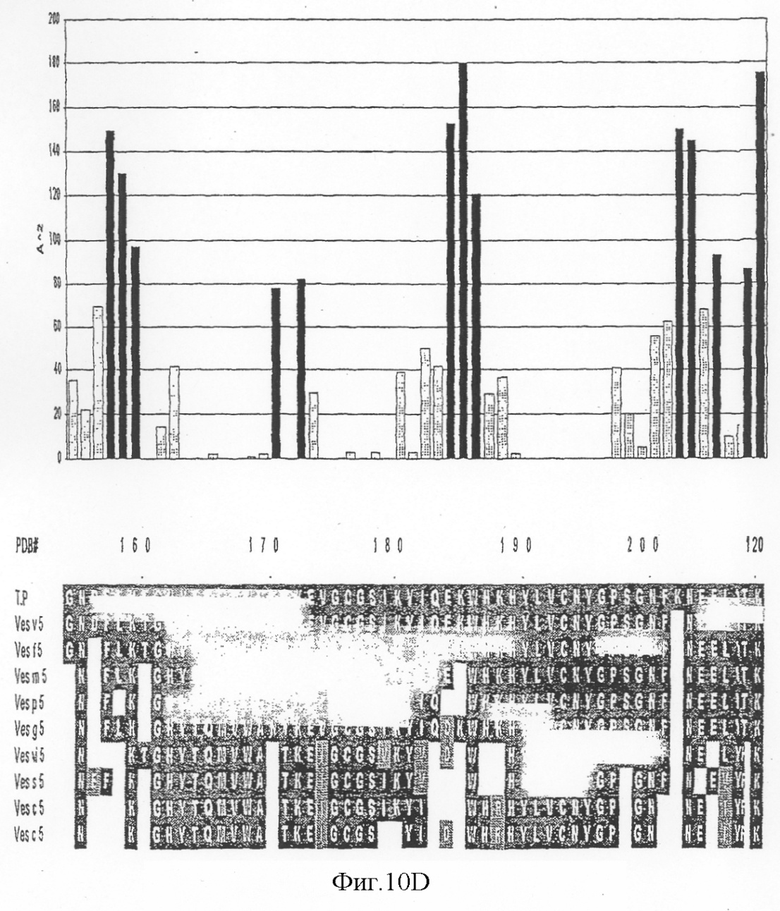



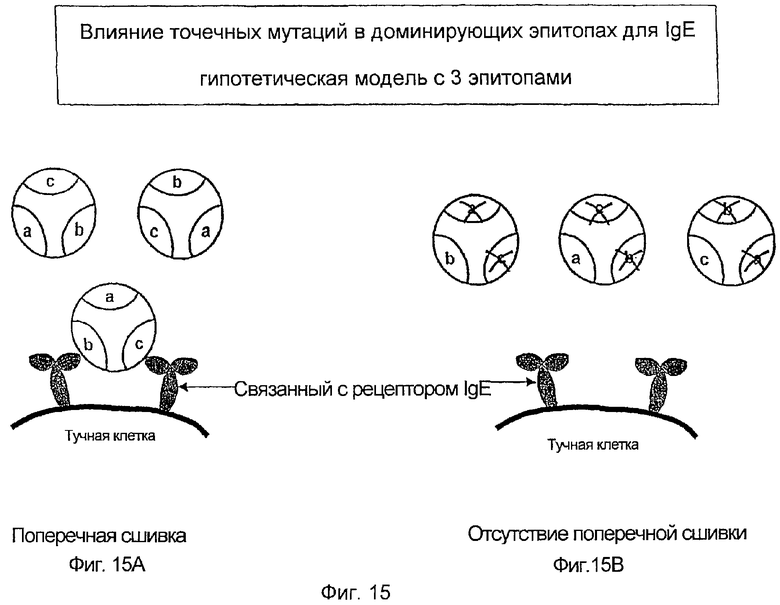

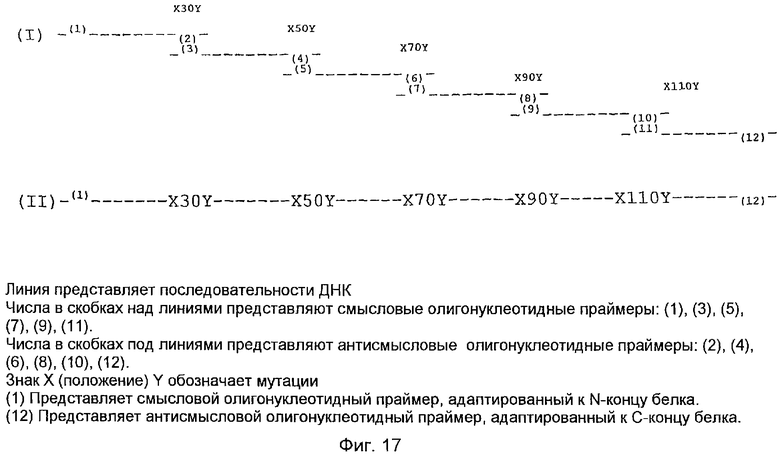

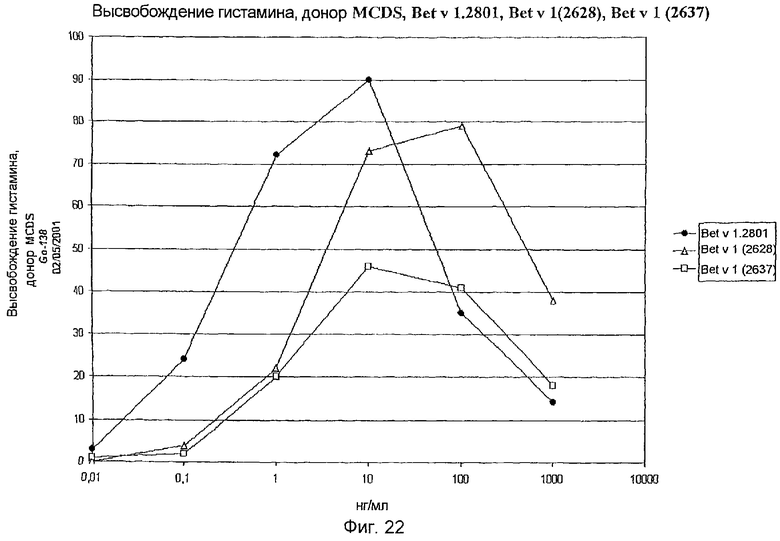
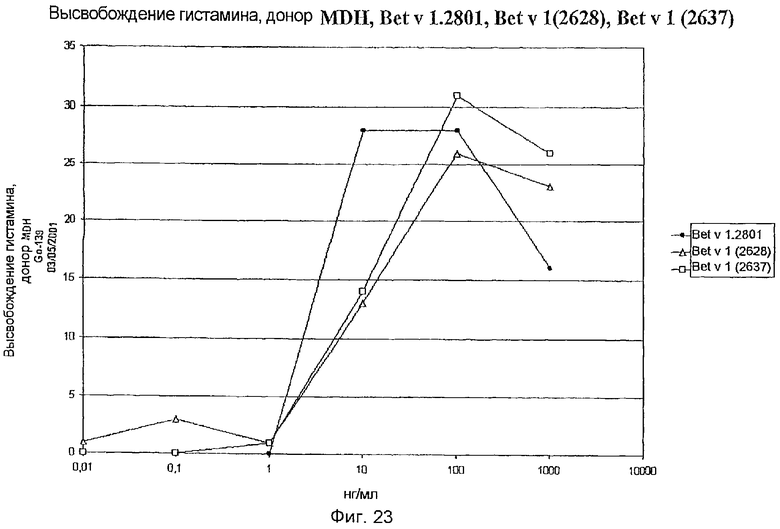


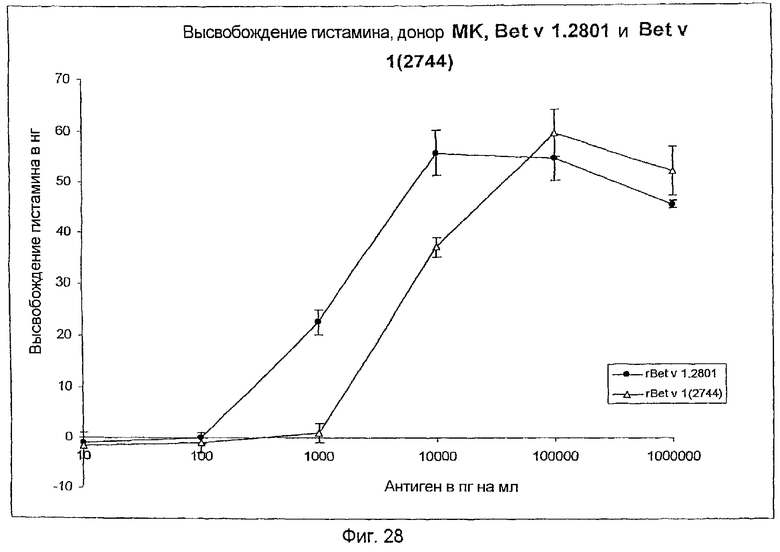
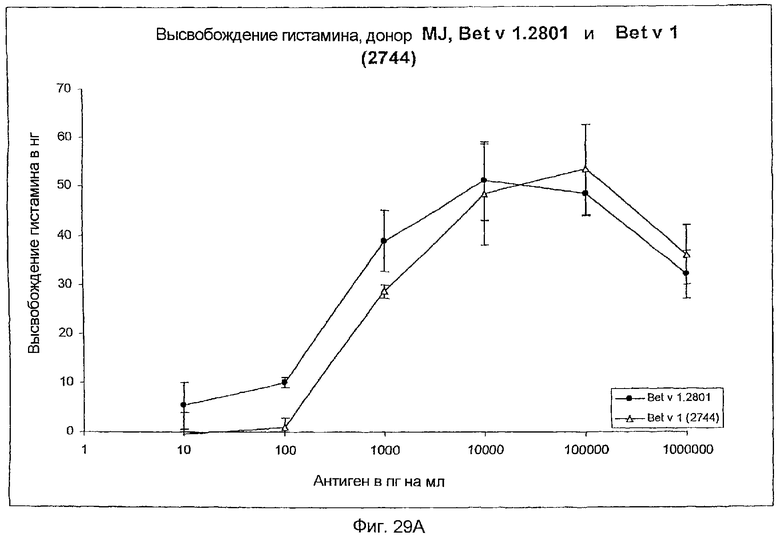
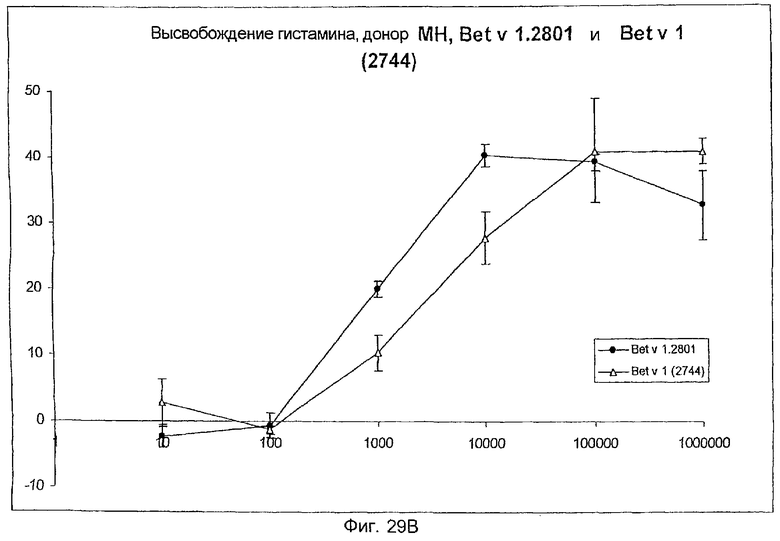
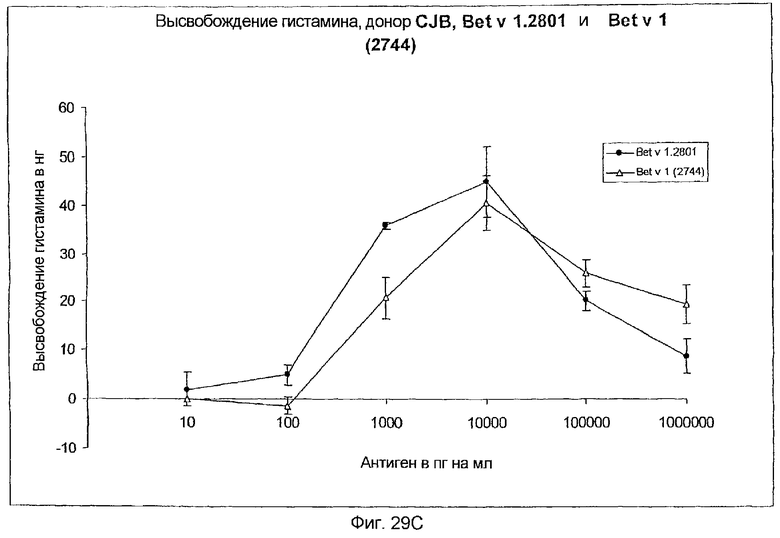
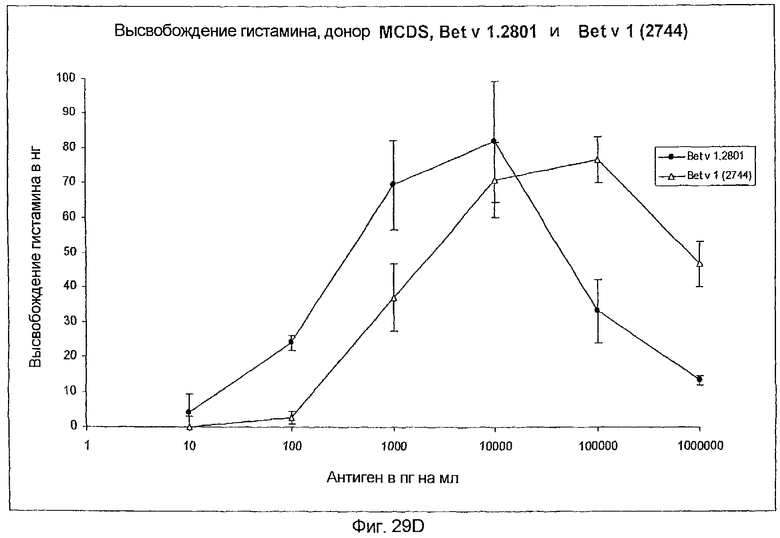


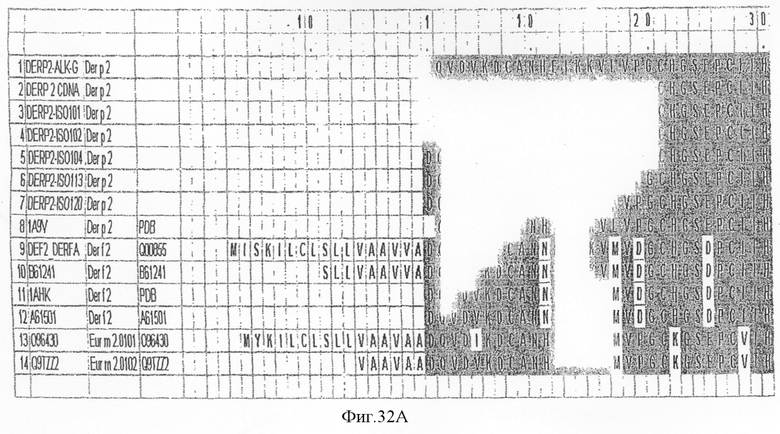

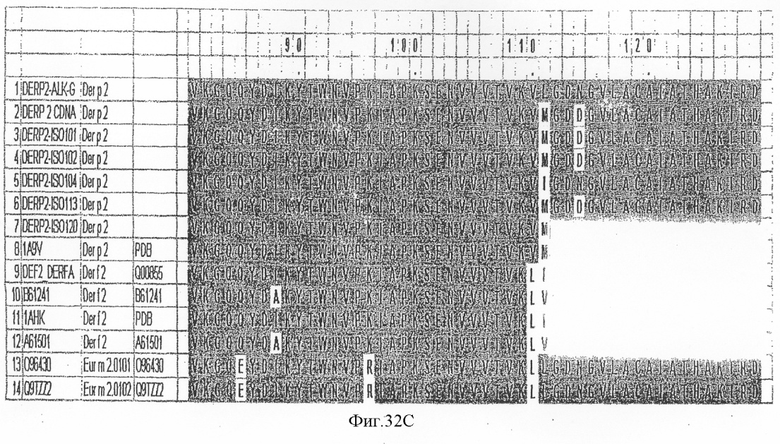
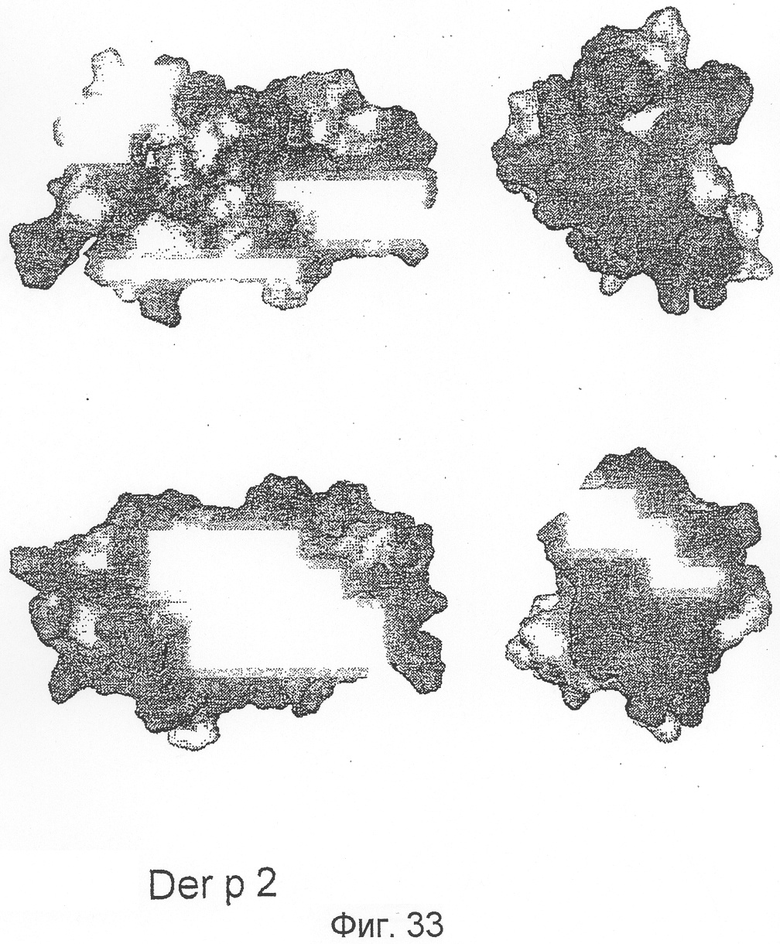

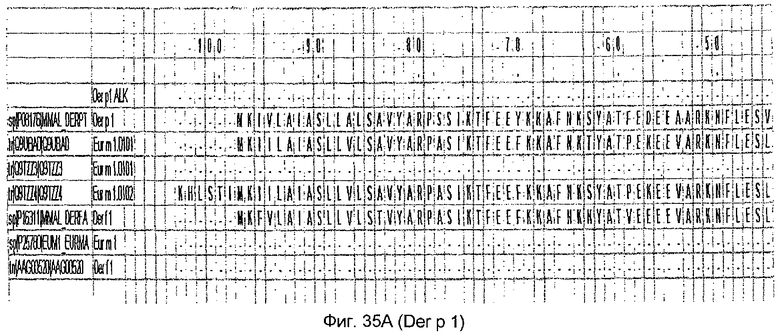

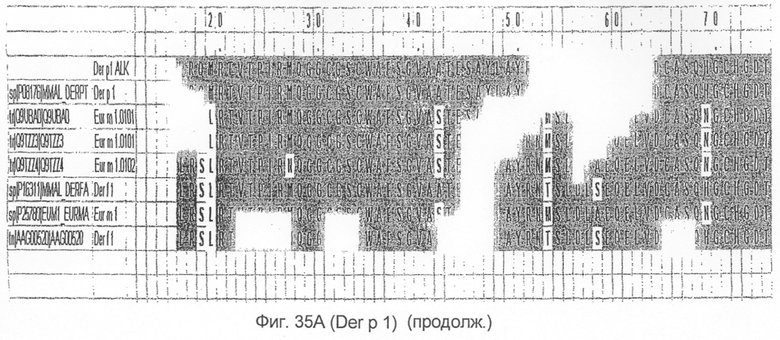
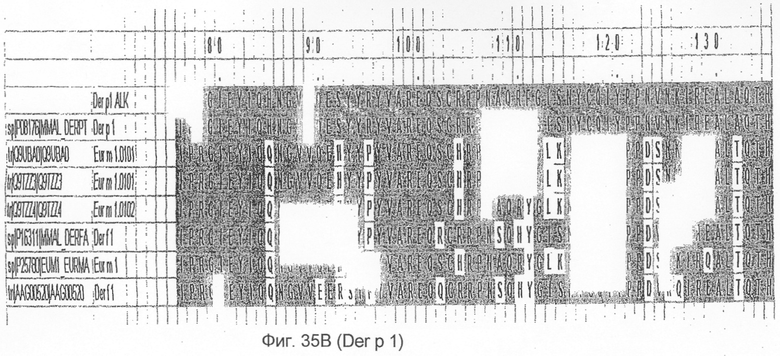
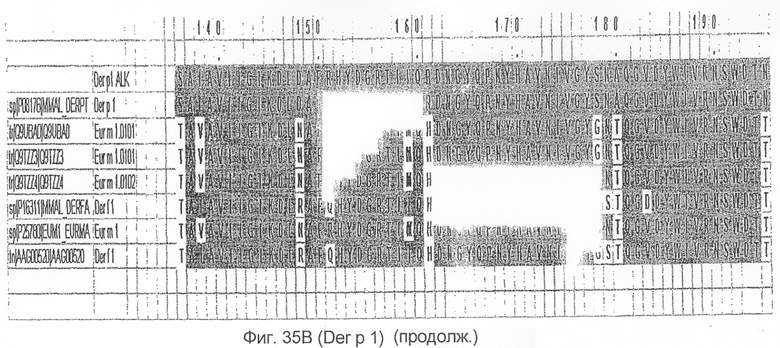
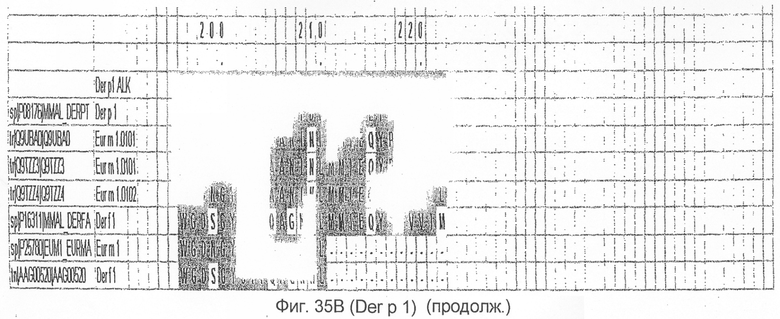


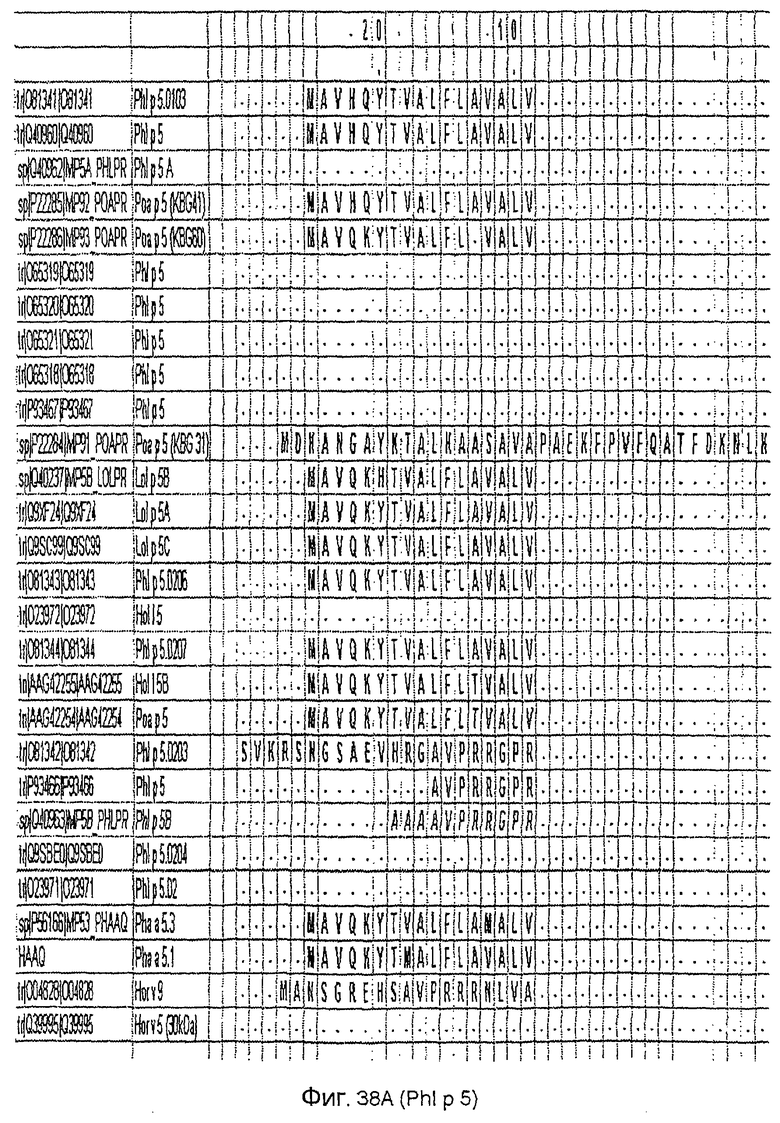





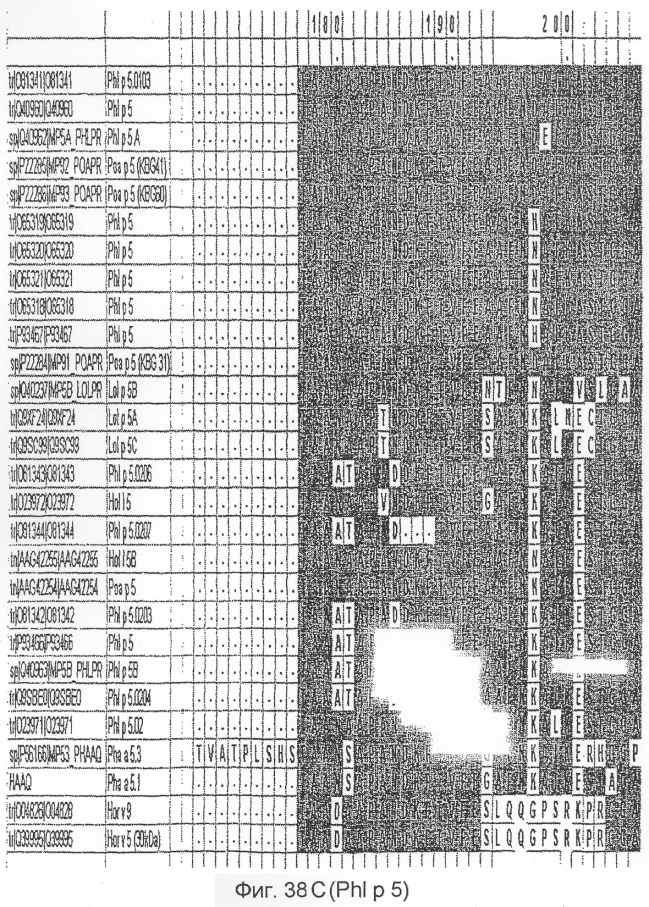


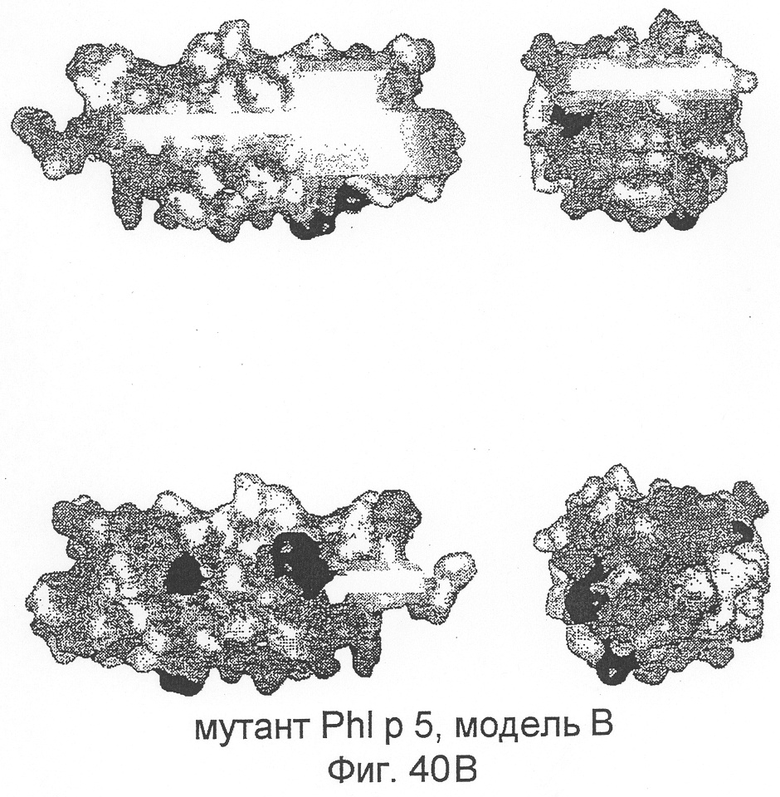
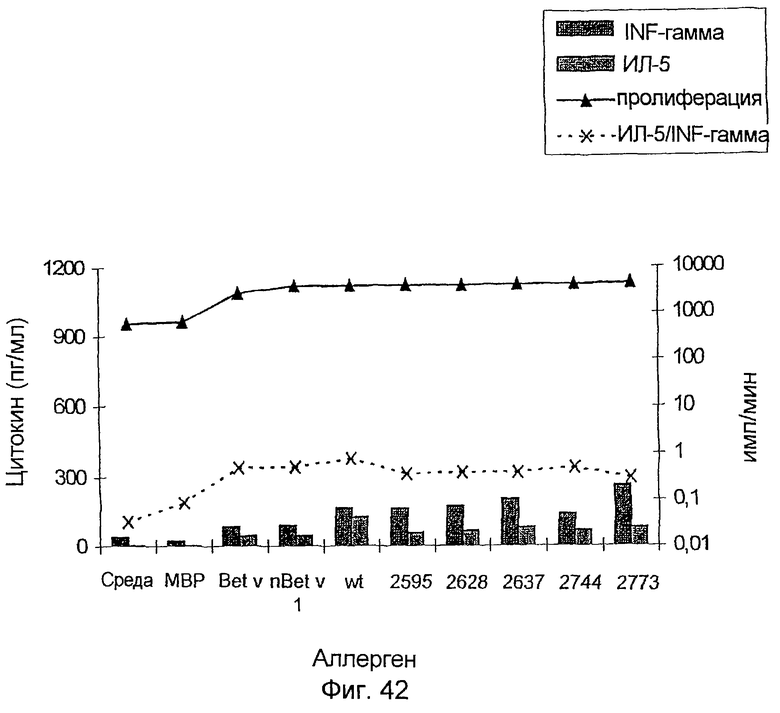
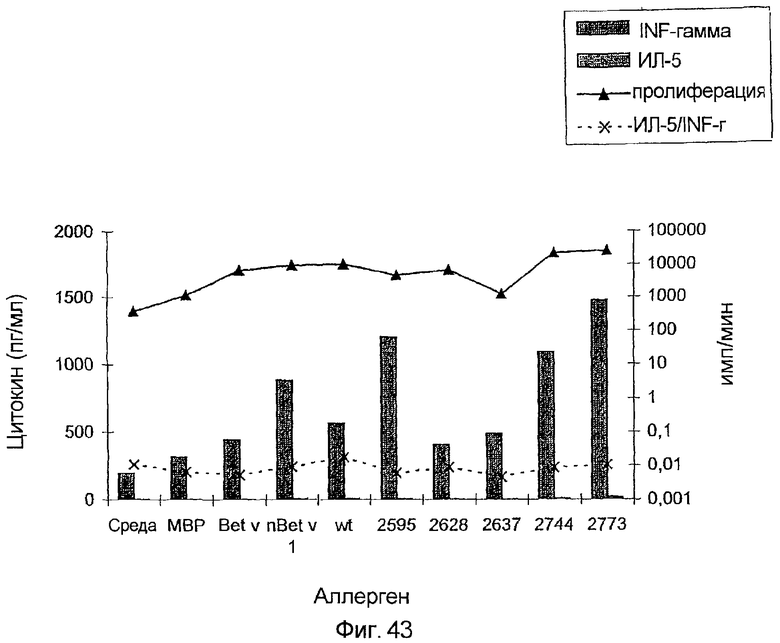
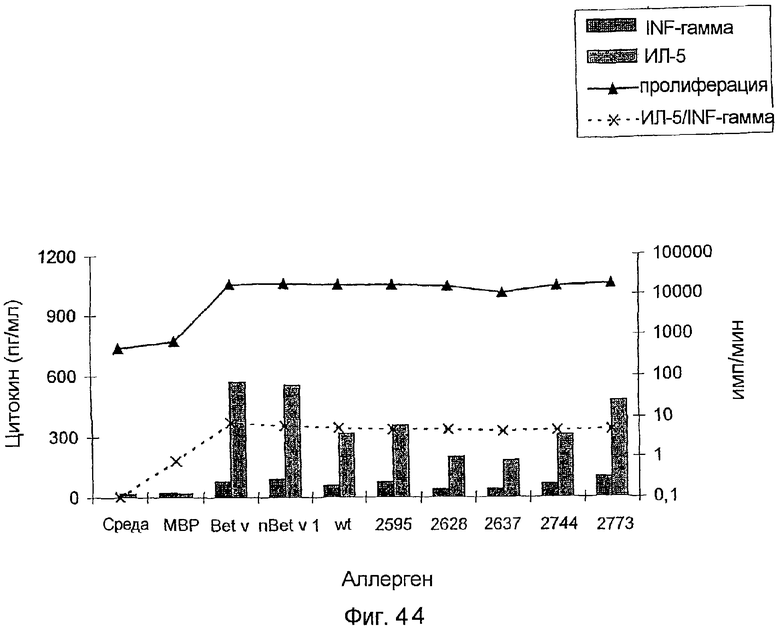
Изобретение относится к биотехнологии и может найти применение в медицине для приготовления вакцины против аллергических реакций. Рекомбинантные аллергены по изобретению представляют собой мутанты аллергенов природного происхождения, имеющие по меньшей мере четыре мутации. Примерами рекомбинантных аллергенов являются аллергены Bet v 1 и Ves v 1. Первичные мутации в рекомбинантном аллергене отделены друг от друга промежутком по меньшей мере в 15Å и расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной в 800Å2 не содержит мутаций. Рекомбинантные аллергены применяются в качестве фармацевтического агента в составе фармацевтической композиции, представляющей вакцину против аллергических реакций. В изобретении описаны способы использования рекомбинантных аллергенов и фармацевтической композиции для выработки иммунного ответа у субъекта. Представлены последовательности ДНК, представленные в формуле, кодирующие рекомбинантные аллергены, экспрессирующий вектор, включающий ДНК, и клетка-хозяин для получения рекомбинантного аллергена. Описаны также способы получения фармкомпозиции и рекомбинантного мутантного аллергена. Использование рекомбинантных аллергенов позволяет снизить специфическую IgE-связывающую способность по сравнению с IgE-связывающей способностью аллергена природного происхождения. 12 н. и 21 з.п. ф-лы, 44 ил., 3 табл.
К-16, К-185, К-11, К-44, К-210, R-63, K-13, F-6, К-149, К-128, Е-184, К-112, F-157, E-3, K-29, N-203, N-34, K-78, K-151, L-15, L-158, Y-102, W-186, К-134, D-87, К-52, Т-67, Т-125, К-150, Y-40, Q-48, L-65, K-81, Q-101, Q-208, К-144, N-8, N-70, Н-104, Q-45, К-137, К-159, Е-205, N-82, А-111, D-131, К-24, -V-36, N-7, M-138, T-209, V-84, K-172, V-19, D-56, P-73, G-33, T-106, N-170, L-28, T-43, Q-114, C-10, K-60, N-31, K-47, E-5, D-145, V-38, A-127, D-156, E-204, P-71, G-26, Y-129, D-141, F-201, R-68, N-200, D-49, S-153, K-35, S-39, Y-25, V-37, G-18, W-85 и I-182.
V2, D72, Е87, К-129, Е-60, N-47, К-65, Р-108, N-159, D-93, К-123, К-32, D-125, R-145, D-109, E-127, Q-36, E-131, L-152, Е-6, Е-96, D-156, Р-63, Н-76, Е-8, К-134, Е-45, Т-10, V-12, K-20, S-155, H-126, P-50, N-78, К-119, V-2, L-24, Е-42, N-4, А-153, I-44, Е-138, G-61, A-130, R-70, N-28, P-35, S-149, K-103, Y-150, Н-154, N-43, А-106, К-115, Р-14, Y-5, К-137, Е-141, Е-87 и Е-73.
К-16, К-185, К-11, К-44, К-210, R-63, K-13, F-6, К-149, К-128, Е-184, К-112, F-157, E-3, K-29, N-203, N-34, K-78, K-151, L-15, L-158, Y-102, W-186, К-134, D-87, К-52, Т-67, Т-125, К-150, Y-40, Q-48, L-65, K-81, Q-101, Q-208, К-144, N-8, N-70, Н-104, Q-45, К-137, К-159, Е-205, N-82, А-111, D-131, K-24, V 36, N-7, M-138, Т 209, V-84, K-172, V-19, D-56, P-73, G-33, T-106, N-170, L-28, T-43, Q-114, C-10, K-60, N-31, K-47, E-5, D-145, V-38, A-127, D-156, E-204, P-71, G-26, Y-129, D-141, F-201, R-68, N-200, D-49, S-153, K-35, S-39, Y-25, V-37, G-18, W-85 и I-182.
R-128, D-129, Н-11, Н-30 S-1, K-77, Y-75, R-31, К-82, К-6, К-96, К-48, К-55, К-89, Q-85, W-92, I-97, Н-22, V-65, S-24, H-74, K-126, L-61, P-26, N-93, D-64, I-28, К-14, К-100, Е-62, I-127, Е-102, Е-25, Р-66, L-17, G-60, Р-95, Е-53, V-81, K-51, N-103, Q-2, N-46, Е-42, Т-91, D-87, N-10, М-111, С-8, Н-124, I-68, Р-79, К-109 and R-128, D-129, H-11, H-30, S-1, K-77, Y-75, R-31, K-82, K-6, K-96, K-48, K-55, K-89, Q-85, W-92, I-97, H-22, V-65, S-24, H-74, K-126, L-61, P-26, N-93, D-64, I-28, K-14, K-100, E-62, I-127, E-102, E-25, P-66, L-17, G-60, P-95, E-53, V-81, K-51, N-103, Q-2, N-46, E-42, T-91, D-87, N-10, M-111, С-8, Н-124, I-68, Р-79, К-109 и К-15.
| WO 9947680 А, 23.09.1999 | |||
| WO 9843657 A, 08.10.1998 | |||
| WO 9938978 А, 05.08.1999 | |||
| А.РОЙТ с соавт | |||
| Иммунология | |||
| М.: Мир, 2000, с.417-439. |
Авторы
Даты
2006-10-10—Публикация
2001-11-16—Подача