УРОВЕНЬ ТЕХНИКИ
[0001] Ретиноидные рецепторы и другие ядерные рецепторы (которые включают стероидные, тиреоидные и рецепторы гормона витамина D, а также другие «сиротские» рецепторы, лиганды к которым неизвестны) представляют собой мишени для разработки лекарственных препаратов. Предполагается, что ретиноевая кислота (RA) и синтетические ретиноиды действуют как зависимые от лигандов факторы транскрипции с различными членами ядерных ретиноидных рецепторов для контроля генной транскрипции, отвечающей за клеточную пролиферацию, дифференцировку, развитие и гибель клеток. К настоящему времени определено два класса ядерных ретиноидных рецепторов (RAR и RXR), и каждый из них имеет несколько различных подтипов (α, β, γ). И (E)-RA, и (9Z)-RA связываются с RAR и активируют транскрипцию, опосредованную гетеродимерами RAR/RXR, однако (9Z)-RA является единственным природным лигандом к рецепторам RXR, которые опосредуют транскрипцию за счет образования гомодимеров или гетеродимеров.
[0002] Недавние достижения в химиопрофилактике усилили интерес к применению RXR-селективных ретиноидов при некоторых типах солидных опухолей различных органов, а самый большой терапевтический успех был продемонстрирован при использовании ретиноидов в отношении некоторых лимфом. Бексаротен (RXR-селективный ретиноид) одобрен для лечения кожной Т-клеточной лимфомы.
[0003] Широкий ряд преимуществ от применения указанных ретиноидных соединений, включая их применение для лечения, предупреждения или улучшения не связанных с новообразованиями состояний или расстройств, определен или изучен не до конца. Хотя известно, что RAR-селективные соединения вызывают гиперплазию кожи, которая является показателем ретиноидной активности в коже, ранее было показано, что RXR-селективные соединения не являются эффективными инициаторами эпидермальной гиперплазии, что позволяет считать их пассивными участниками в гетеродимере RAR-RXR с маловероятным клиническим применением при кожных состояниях, не связанных с новообразованиями. См., например, Thacher, S.М., et al., Receptor Specificity of Retinoid-Induced Epidermal Hyperplasia: Effect of RXR-Selective Agonists and Correlation with Topical Irritation, JPET 282: 528-534, 1997. Настоящее изобретение направлено на удовлетворение потребности в новых и преимущественных применениях ретиноидных соединений, в частности, RXR-селективных соединений для не связанных с новообразованиями кожных состояний или расстройств, которые не были описаны или реализованы ранее.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение относится к некоторым RXR-селективным ретиноидным соединениям, включая аналоги, производные или изомеры указанных ретиноидных соединений, а также к их новому применению в способах лечения не связанных с новообразованиями кожных состояний или расстройств, включая кожные воспалительные состояния. Ретиноидные соединения могут быть смешаны с фармацевтически приемлемыми адъювантами, носителями, вспомогательными веществами или разбавителями для получения фармацевтических композиций, пригодных для лечения кожных состояний или расстройств. Указанные фармацевтические композиции могут быть в форме пероральных лекарственных форм, парентеральных (например, инъецируемых) лекарственных форм или могут быть составлены в виде композиций для местного применения.
[0005] Предпочтительные ретиноидные соединения, пригодные в соответствии с рассматриваемым изобретением, обозначены как UAB30 или аналоги, производные или изомеры указанных соединений. Соединение UAB30 и его аналоги, а также описание способа получения указанных соединений представлено в патенте США №6172112, который включен в настоящий документ посредством ссылки в полном объеме. Альтернативные способы получения некоторых ретиноидных соединений, включая UAB30 или его аналоги, и композиций, содержащих указанные соединения, а также способы их применения описаны в публикации заявки на патент США №2010/0204327, полное содержание которой также включено в настоящий документ посредством ссылки.
[0006] В одном из вариантов реализации настоящего изобретения предложен способ лечения, предупреждения или улучшения кожного состояния или расстройства, такого как дерматологические заболевания, связанные с избыточной выработкой кожного сала (например, обыкновенные угри), расстройства дифференцировки и/или пролиферации (например, псориаз, актинический кератоз, себорейный дерматит, бородавки, выпадение волос), нарушения кератинизации (например, кератоз, ксероз, ихтиоз, лишай, кератодермия, фолликулит), нарушения пигментации кожи (например, витилиго, мелазма, актинический лентигиноз) и/или кожные воспалительные расстройства (например, угревая сыпь, розовые угри, экзема), состояния, обусловленные световым повреждением (например, кожа, поврежденная в результате светового воздействия, или естественное старение кожи), у индивидуума, нуждающегося в таком лечении, путем введения указанному индивидууму эффективной дозы RXR-селективного ретиноидного соединения, например, UAB30, или композиции, содержащей указанное соединение.
[0007] Предпочтительно, указанный способ включает лечение индивидуума, нуждающегося в лечении обыкновенных угрей, псориаза, актинического кератоза или повреждения кожи, обусловленного световым воздействием. Ретиноидные соединения могут быть использованы для лечения в комбинации с одним или несколькими другими ретиноидными соединениями, или с одним или несколькими другими неретиноидными соединениями.
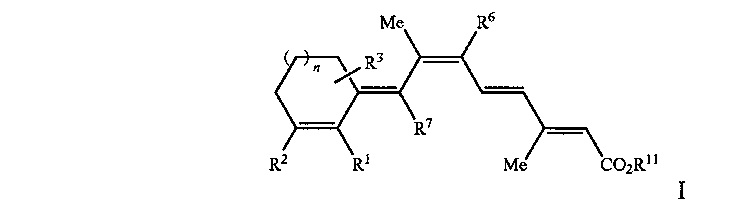
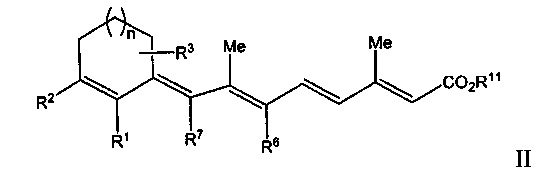
[0008] Таким образом, рассматриваемое изобретение относится к способу лечения, предупреждения или ослабления тяжести не связанного с новообразованиями кожного состояния или расстройства у пациента, нуждающегося в этом, включающему стадию введения указанному пациенту ретиноидного соединения или композиции, содержащей ретиноидное соединение, имеющее формулу, выбранную из Формулы I или Формулы II, представленной ниже:
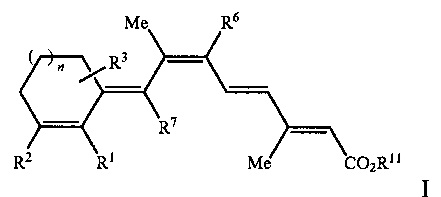
или
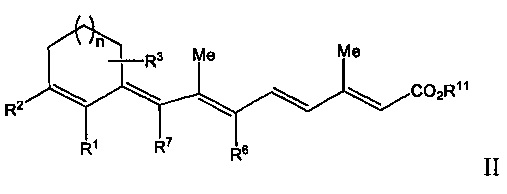
где
R1 представляет собой Н или C1-C5, или более длинную разветвленную или прямую алкильную группу;
R2 представляет собой Н, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу, или
R1 и R2 вместе образуют замещенную или незамещенную конденсированную арильную группу;
R3 представляет собой одну или несколько групп, независимо представляющих собой Н, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу;
R6 и R7 независимо представляют собой Н, CF3, C1-C15 разветвленную или прямую алкильную группу или замещенную или незамещенную циклоалкильную группу;
R11 представляет собой Н или C1-C15 разветвленную или прямую алкильную группу;
n равен от 0 до 3;
при этом один или несколько атомов углерода в кольцевых структурах Формулы I или II могут быть факультативно заменены гетероатомом; или его фармацевтически приемлемую соль или изомер.
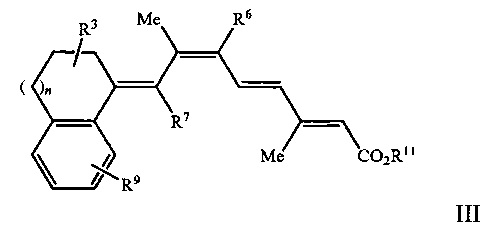
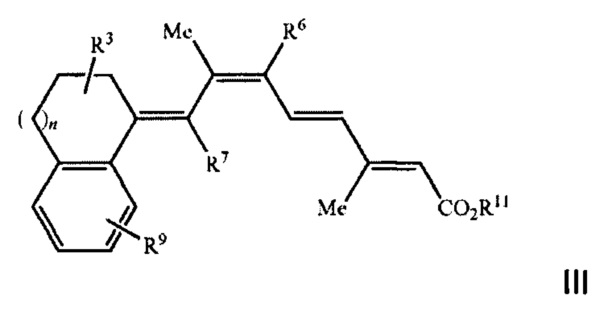
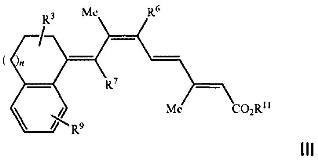
[0009] Более предпочтительно, указанный способ относится к применению соединения, имеющего формулу III, представленную ниже:
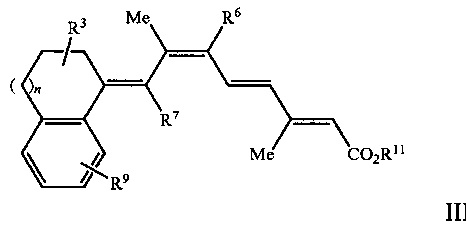
где
R3 представляет собой одну или несколько групп, независимо представляющих собой Н, F, дифтор, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу;
R6 и R7 независимо представляют собой Н, CF3, C1-C15 разветвленную или прямую алкильную группу или замещенную или незамещенную циклоалкильную группу;
R9 представляет собой одну или несколько групп, независимо представляющих собой Н, F, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, или замещенную или незамещенную циклоалкильную группу;
R11 представляет собой Н или C1-C15 разветвленную или прямую алкильную группу;
n равен от 0 до 3;
при этом один или несколько атомов углерода в кольцевых структурах Формулы I или II могут быть факультативно заменены гетероатомом;
или его фармацевтически приемлемой соли или изомера.
[00010] Наиболее предпочтительный вариант реализации рассматриваемого способа включает применение соединения Формулы III в форме 9(Z), имеющей структуру Формулы IV, изображенной ниже:
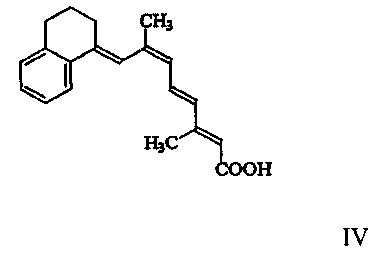
[00011] Не связанные с новообразованиями кожные состояния или расстройства, которые можно лечить, предупреждать или улучшать ретиноидным соединением согласно настоящему изобретению, включают, но не ограничиваются ими, угри, псориаз, актинический кератоз, актинический лентигиноз, себорейный дерматит, розовые угри, волосяной лишай, бородавки, витилиго, мелазму, фолликулит, экзему, ихтиоз, лишай, ксероз, кератодермию, гирсутизм или выпадение волос.
[00012] Способ согласно настоящему изобретению также может быть использован для лечения, предупреждения или улучшения расстройства или состояния, вызванного УФ-повреждением, такого как повреждение кожи под действием света или естественного старения кожи. Таким образом, в указанном способе может быть использована комбинация ретиноидного соединения согласно настоящему изобретению со стандартным солнцезащитным агентом.
[00013] В настоящем изобретении дополнительно рассмотрены фармацевтические композиции, подходящие для лечения, предупреждения или улучшения не связанного с новообразованиями кожного состояния. Композиции в соответствии с настоящим изобретением в качестве активного фармацевтического ингредиента (АФИ) содержат по меньшей мере одно ретиноидное соединение, описанное в настоящем документе, и фармацевтически приемлемый разбавитель или носитель. Предпочтительно, композиция согласно настоящему изобретению содержит носители или разбавители, которые фармацевтически приемлемы для перорального и/или местного применения или нанесения на кожу. Более предпочтительно, указанная композиция содержит соединение, описанное в настоящем документе, обозначенное как UAB 30, или его аналог, производное, изомер или соль.
[00014] Композиции согласно настоящему изобретению могут содержать два или более активных ингредиентов, при этом активные ингредиенты могут представлять собой два или более ретиноидных соединений, или могут содержать одно или более ретиноидных соединений в комбинации с неретиноидным соединением. Активные ингредиенты могут быть введены последовательно или одновременно.
[00015] Композиция согласно настоящему изобретению содержит RXR-селективное ретиноидное соединение в терапевтически эффективных дозах, которые могут быть определены специалистами в данной области техники. Ретиноидное соединение согласно настоящему изобретению может быть представлено в виде композиции для местного применения, составленной так, чтобы концентрация ретиноидного соединения по настоящему изобретению в качестве активного фармацевтического ингредиента (АФИ) составляла приблизительно от 0,01 приблизительно до 10%. Более предпочтительно, концентрация ретиноидного соединения в композиции для местного применения согласно настоящему изобретению составляет приблизительно от 0,025% приблизительно до 5%, и наиболее предпочтительно-приблизительно от 0,1% приблизительно до 3% относительно композиции (масс./масс. в твердых и полутвердых лекарственных формах и масс/об. в жидких лекарственных формах).
[00016] Ретиноидное соединение согласно настоящему изобретению может быть представлено в виде композиции для перорального применения, полученной так, чтобы содержание ретиноидного соединения согласно настоящему изобретению в качестве активного фармацевтического ингредиента (АФИ) составляло приблизительно от 1 мг приблизительно до 600 мг. Более предпочтительно, количество ретиноидного соединения в пероральной композиции согласно настоящему изобретению составляет приблизительно от 5 мг приблизительно до 300 мг, и наиболее предпочтительно-приблизительно от 20 мг приблизительно до 200 мг относительно композиции.
[00017] Другие и дополнительные аспекты, особенности и преимущества настоящего изобретения станут понятны из следующего описания предпочтительных в настоящее время вариантов реализации настоящего изобретения, представленных с целью описания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00018] Настоящее изобретение относится к RXR-селективным ретиноидным соединениям, например, UAB30, описанным в настоящем документе, а также к их новому применению для лечения кожных состояний или расстройств.
[00019] В одном из вариантов реализации настоящего изобретения предложены ретиноидные соединения, например, UAB30 и его аналоги или изомеры, имеющие общие структуры, выбранные из группы Формулы I (9(Z)-изомер) и Формулы II (полностью (Е)-изомер), как показано ниже:
и
где
R1 представляет собой Н, CF3 или С1-С5, или более длинную разветвленную или прямую алкильную группу;
R2 представляет собой Н, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу, или
R1 и R2 вместе образуют замещенную или незамещенную конденсированную арильную группу; и
R3 представляет собой одну или несколько групп, независимо представляющих собой Н, F, дифтор, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу;
R6 и R7 независимо представляют собой Н, CF3, С1-С15 разветвленную или прямую алкильную группу или замещенную или незамещенную циклоалкильную группу;
R11 представляет собой Н или C1-C15 разветвленную или прямую алкильную группу;
n равен от 0 до 3;
при этом один или несколько атомов углерода в кольцевых структурах Формулы I или II могут быть факультативно заменены гетероатомом;
или его фармацевтически приемлемая соль или изомер.
[00020] Одно из предпочтительных соединений Формул I или II, показанных выше, представляет собой соединение, в котором R1 представляет собой изопропиловый или изопентиловый алкан, которое включает соединение UAB-111.
[00021] Более предпочтительно, указанный способ относится к применению соединения, в котором R1 и R2 в Формулах I или II, показанных выше, образуют конденсированную арильную группу, при этом указанное соединение имеет формулу III, представленную ниже:
где
R3 представляет собой одну или несколько групп, независимо представляющих собой Н, F, дифтор, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, замещенную или незамещенную циклоалкильную группу;
R6 и R7 независимо представляют собой Н, CF3, C1-C15 разветвленную или прямую алкильную группу или замещенную или незамещенную циклоалкильную группу;
R9 представляет собой одну или несколько групп, независимо представляющих собой Н, F, CF3, C1-C15 разветвленную или прямую алкильную группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную аралкильную группу, или замещенную или незамещенную циклоалкильную группу;
R11 представляет собой Н или C1-C15 разветвленную или прямую алкильную группу.
n равен от 0 до 3;
при этом один или несколько атомов углерода в кольцевых структурах Формулы I или II могут быть факультативно заменены гетероатомом;
или его фармацевтически приемлемой соли или изомера.
[00022] Наиболее предпочтительный вариант реализации представляет собой соединение Формулы III в 9(Z)-форме, имеющее структуру, показанную ниже как Формула IV:
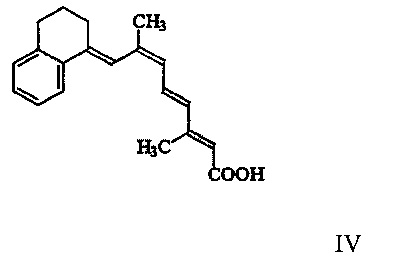
[00023] Если не указано иное, то подразумевается, что структуры, изображенные в настоящем документе, включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы указанной структуры; например, R и S конфигурации для каждого асимметрического центра, Z и Е изомеры двойной связи, и Z и Е конформационные изомеры. Следовательно, в рамки настоящего изобретения входят отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений согласно настоящему изобретению. Если не указано иное, то в рамки настоящего изобретения входят все таутомерные формы соединений согласно настоящему изобретению. В химических описаниях, используемых в настоящем документе, обозначение «Е» может быть синонимично заменено на «транс», a «Z» может быть синонимично заменено на «цис».
[00024] В другом варианте реализации настоящее изобретение относится к способу лечения индивидуума, страдающего кожным состоянием или расстройством, при котором могут быть полезны ретиноиды и их производные. Предпочтительно, при местном нанесении указанное соединение вводят в диапазоне доз приблизительно от 0,001 мг/см2 приблизительно до 10 мг/см2 поверхности кожи, и более предпочтительно-приблизительно от 0,005 мг/см2 приблизительно до 2 мг/см2 поверхности кожи.
[00025] Преимущественно, соединения, применяемые в соответствии с рассматриваемым изобретением, также могут быть использованы при пероральном введении. Диапазоны доз при пероральном введении предпочтительно составляют приблизительно от 0,01 мг/кг приблизительно до 300 мг/кг относительно массы тела, и более предпочтительно - приблизительно от 0,1 мг/кг приблизительно до 100 мг/кг относительно массы тела. Соединения Формулы III считаются особенно подходящими для перорального введения при лечении не связанных с новообразованиями кожных состояний или расстройств.
[00026] В другом варианте реализации настоящего изобретения предложен способ лечения индивидуума, страдающего кожным состоянием или расстройством, путем введения указанному индивидууму комбинации двух или более чем двух ретиноидных соединений, описанный в настоящем документе. Указанная комбинация может дополнительно содержать одно или несколько ретиноидных соединений, описанных в настоящем документе, и одно или несколько дополнительных активных соединений, которые не являются ретиноидными соединениями, описанными в настоящем документе.
[00027] Репрезентативные кожные состояния, которые можно лечить в соответствии с рассматриваемым изобретением, включают, но не ограничиваются ими, состояния или расстройства, связанные с эпителием или кожей. В некоторых вариантах реализации кожные состояния могут включать дерматологические заболевания, связанные с избыточной выработкой кожного сала (например, обыкновенные угри), расстройства клеточной дифференцировки и/или пролиферации (например, псориаз, актинический кератоз, себорейный дерматит, бородавки, выпадение волос), расстройства кератинизации (например, кератоз, ксероз, ихтиоз, лишай, кератодермия, фолликулит), нарушения пигментации кожи (например, витилиго, мелазма, актинический лентигиноз) и/или кожные воспалительные расстройства (например, угревая сыпь, розовые угри, экзема), и/или состояния, обусловленные световым повреждением (например, кожа, поврежденная в результате воздействия света или естественного старения кожи).
[00028] Все соединения, описанные в настоящем документе, могут быть составлены в фармацевтическую композицию. В одном из аспектов соединение можно комбинировать по меньшей мере с одним фармацевтически приемлемым носителем с образованием фармацевтической композиции, полученной по известным в данной области техники способам. В одном из аспектов композицию получают смешиванием указанного соединения с фармацевтически приемлемым носителем. В зависимости от компонентов, подлежащих смешиванию, указанные компоненты могут химически или физически взаимодействовать или не взаимодействовать друг с другом.
[00029] Соединения, представленные в настоящем документе, могут быть составлены в фармацевтические композиции, которые содержат по меньшей мере одно соединение согласно настоящему изобретению вместе с одним или несколькими фармацевтически приемлемыми носителями, включая вспомогательные вещества, такие как разбавители, связующие вещества и т.п., и могут, при необходимости, дополнительно содержать добавки, такие как стабилизаторы, консерванты, солюбилизаторы и буферы.
[00030] Помимо активного ингредиента, фармацевтические композиции могут содержать носители, загустители, разбавители, буферы, консерванты, поверхностно-активные агенты и т.п. Фармацевтические композиции могут также содержать более одного активного ингредиента, такого как ретиноид в соответствии с настоящим изобретением, и один или несколько противомикробных агентов, кератолитических агентов, перекиси бензоила, противовоспалительных агентов, кортикостероидов или т.п. Специалистам в данной области техники известны фармацевтически приемлемые носители. Наиболее часто они представляют собой стандартные носители для введения людям, включая растворы, такие как стерильная вода, солевой раствор и буферные растворы при физиологическом pH.
[00031] Фармацевтическая композиция может быть составлена для введения различными способами, в зависимости от того, необходимо ли местное или системное лечение, или в зависимости от области, подлежащей лечению. Введение может быть местным (нанесение на поверхность кожи) или в виде инъецируемого раствора или суспензии, предпочтительно для подкожной инъекции. Альтернативно, введение может быть пероральным, с использованием такой лекарственной формы как таблетка или капсула, что нетрудно понять специалистам в данной области техники.
[00032] При практическом применении представленное соединение согласно настоящему изобретению может быть использовано в качестве активного ингредиента в смеси с фармацевтическим носителем, в соответствии со стандартными приемами фармацевтического компаундирования. Используемый носитель может принимать различные формы в зависимости от лекарственной формы, требуемой для введения, например, пероральной, парентеральной, дермальной или локальной, трансдермальной, буккальной или т.п.
[00033] В случае водного раствора представленное соединение может быть надлежащим образом забуферено при помощи солевого раствора, ацетатного, фосфатного, цитратного, ацетатного или других буферных агентов, которые могут находиться при любом физиологически приемлемом pH, как правило, приблизительно от pH 4 приблизительно до pH 7. Также может быть использована комбинация буферных агентов, такая как фосфатно-солевой буферный раствор, солевой и ацетатный буфер и т.п. В случае солевого раствора может быть использован 0,9% солевой раствор. В случае ацетата, фосфата, цитрата и т.п. может быть использован 50 мМ раствор. Помимо буферных агентов может быть использован подходящий консервант для предотвращения или ограничения роста бактерий и других микробов. Один из таких консервантов, который может быть использован, представляет собой 0,05% хлорид бензалкония.
[00034] Препараты для введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры водных или неводных носителей включают воду, водно-спиртовые растворы, эмульсии или суспензии, в том числе солевой раствор и буферные среды. Парентеральные разбавители включают раствор хлорида натрия, раствор Рингера с декстрозой, раствор декстрозы с хлоридом натрия, раствор Рингера с лактатом или нелетучие масла.
[00035] Составы для местного применения могут включать мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны стандартные фармацевтические носители, водные, порошкообразные или масляные основы, загустители и т.п. Можно ожидать, что фактические предпочтительные количества активного соединения в определенном случае варьируются в соответствии с конкретным используемым соединением, конкретной составленной композицией, способом введения и конкретным местом применения, и млекопитающим, подлежащим лечению.
[00036] При получении композиций для пероральной лекарственной формы могут быть использованы стандартные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.п. - в случае жидких пероральных препаратов, таких как, например, суспензии, эликсиры и растворы; или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавляющие средства, гранулирующие агенты, смазывающие вещества, связующие агенты и средства для улучшения распадаемости таблеток - в случае твердых пероральных препаратов, таких как, например, порошки, твердые и мягкие капсулы и таблетки.
[00037] Для твердых составов, подлежащих введению, могут быть использованы любые добавки из множества загустителей, наполнителей, объемообразующих агентов и носителей, такие как крахмалы, сахара, жирные кислоты и т.п. Вспомогательные вещества для получения состава могут включать поливинилпирролидон, желатин, гидроксицеллюлозу, гуммиарабик, полиэтиленгликоль, маннит, хлорид натрия и цитрат натрия.
[00038] Для фармацевтических составов подразумевается также, что могут быть использованы любые из множества составов и добавок с дозированным высвобождением, медленным высвобождением или высвобождением по времени, поэтому доза может быть составлена так, чтобы обеспечивать доставку представленного соединения в течение определенного периода времени, и такие составы обычно упоминаются как составы с контролируемым, замедленным, пролонгированным, медленным или постоянным высвобождением. Например, в состав могут быть включены желатин, карбоксиметилцеллюлоза натрия и/или другие целлюлозные вспомогательные вещества для получения составов с высвобождением по времени или с замедленным высвобождением, особенно для введения подкожной и внутримышечной инъекцией.
[00039] Состав может быть таким, что нанесение, введение или инъекция необходима периодически, с интервалом в один день, неделю, месяц или другой период времени, в зависимости от концентрации и количества представленного соединения, скорости биоразложения полимера, используемого в составе, и других факторов, известных специалистам в данной области техники.
[00040] Дозы для данного реципиента можно определить при помощи стандартных критериев, например, обычным сравнением определенных характеристик рассматриваемых соединений и известного агента, например, при помощи подходящего стандартного фармакологического протокола. Для лечащих врачей и разработчиков рецептур, имеющих опыт в области определения доз фармацевтических соединений, не составит труда определить дозу в соответствии со стандартными рекомендациями (Physician's Desk Reference, Barnhart Publishing (1999)).
[00041] Следующие примеры приведены в целях иллюстрации различных вариантов реализации настоящего изобретения, и их никоим образом не следует толковать как ограничение настоящего изобретения.
ПРИМЕР 1 - Химический анализ аналогов ретиноевой кислоты
[00042] Спектры 1Н ЯМР записали при 400,1 МГц (спектрометр Bruker DRX) в CDCl3. Испытания ядерного эффекта Оверхаузера (NOE) выполнили на дегазированных образцах при помощи 2D фазочувствительных экспериментов спектроскопии ядерного эффекта Оверхаузера (NOESY) с разным временем смешивания (от 250 до 2000 мс). Как правило, использовали время смешивания, составляющее 1 секунду, с фазами по 16 импульсов и 2 холостыми прогонами. Данные обрабатывали уширением линий спектра на 0,3 Гц в каждом направлении и заполняли нулевыми значениями для получения 512X4096 2D контурных кривых. Интегрированные интенсивности отрицательных кросс-пиков определяли при помощи стандартных программных возможностей ЯМР-спектрометра Bruker.
[00043] УФ/видимые спектры записали на спектрофотометре AVIV 14DS в циклогексановых или метанольных растворах (Fisher, Spectrograde). ИК спектры записали при помощи ИК-спектрометра Nicolet FT на тонких пленках. Разделение при помощи ВЭЖХ выполнили на градиентной системе ВЭЖХ Gilson, используя напор насоса 25 мл и детектор с переменной длиной волны ISCO V4.
Использовали колонку Whatman Partisil 10 М20/50 (500 X 22 мм, внутренний диаметр) со скоростью потока 5 мл/мин. и контролировали по УФ/видимому обнаружению при 340 нм. ТСХ хроматографию выполнили на стеклянных пластинах GF, предварительно покрытых 250 мкм силикагелем (Analtech, Inc.; 5 X 10 см). Растворители и жидкие исходные материалы перед применением дистиллировали. Реакции и очистку выполняли при помощи обескислороженных растворителей, под инертным газом (N2) и при приглушенном освещении. Способы синтеза ретиноидных соединений согласно настоящему изобретению описаны в патенте США №6172112 и в публикации заявки на патент США №2010/0204327, полное содержание которых включено в настоящий документ посредством ссылки.
(2E,4E,6E,8E)- и (2Z,4Е,6Е,8Е)-этил 8-(3',4'-дигидро-1'(2'H)-нафталин-1'-илиден-3,7-диметил-2,4,6-октатриеноат ((полностью Е)- и (13Z)-5)
[00044] Для получения использовали суспензию NaH (0,050 г, 2,1 ммоль) в сухом ТГФ (1 мл), раствор триэтилфосфоносенеционата (0,11 г, 0,40 ммоль) в сухом ТГФ (1 мл), НМРА (0,048 г, 0,22 ммоль) и раствор (полностью Е)-4 (0,065 г, 0,31 ммоль) в сухом ТГФ (1 мл), и получили 2:1 смесь сложных эфиров (полностью Е) и (13)-5 (0,12 г, выход 78%). Указанную смесь разделили при помощи ВЭЖХ на силикагеле, используя 1% Et2O, 0,5% ТГФ в гексане.
Способ гидролиза отдельных изомеров сложного эфира 5
[00045] К раствору сложного эфира 5 (1 экв.) в метаноле (конечная концентрация 0,061 М) добавили 2 М водный раствор КОН (10 экв.). Указанный раствор нагревали при дефлегмации, а ход реакции контролировали по ТСХ. Через 90 минут горячий раствор вылили в стакан со льдом (40 мг) и подкислили при помощи 10% HCl до pH 2. Затем смесь экстрагировали при помощи Et2O, который промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали под пониженным давлением с получением продукта. ЯМР показал, что гидролиз прошел без изомеризации. По этому способу синтезировали следующие кислоты.
(2Е,4Е,6Е,8Е)-8-(3',4'-Дигидро-1'(2'H)-нафталин-1'-илиден)-3,7-диметил-2,4,6-октатриеновая кислота ((полностью E)-UAB30)
[00046] Для получения использовали раствор КОН (0,258 г, 4,61 ммоль) в воде (2 мл) и теплый раствор эфира (полностью Е)-5 (0,122 г, 0,378 ммоль) в метаноле (10 мл), и получили кислоту (полностью E)-UAB30 (0,104 г, выход 93%) в виде желтого твердого вещества: Т.пл. 192-197°С (циклогексан).
(2Е,4Е,6Е,8Е)-8-(3',4'-Дигидро-1'(2'Н)-нафталин-1'-илиден)-3,7-диметил-2,4,6-октатриеновая кислота ((9Z)-UAB30)
[00047] Для получения использовали раствор КОН (0,15 г, 2,8 ммоль) в воде (1 мл) и теплый раствор эфира (9Z)-5 (0,073 г, 0,23 ммоль) в метаноле (3 мл), и получили кислоту (9Z)-UAB30 (0,065 г, выход 98%) в виде желтого твердого вещества: Т.пл. 182-185°С (циклогексан).
(2Е,4Е,6Е,8Е)-8-(3',4'-Дигидро-1'(2'Н)-нафталин-1'-илиден)-3,7-диметил-2,4,6-октатриеновая кислота ((13Z)-UAB30)
[00048] Для получения использовали раствор КОН (0,085 г, 1,50 ммоль) в воде (1 мл) и теплый раствор эфира (13Z)-5 (0,040 г, 0,12 ммоль) в метаноле (4 мл), и получили кислоту (13Z)-UAB30 (0,034 г, выход 93%) в виде желтого твердого вещества: Т.пл. 180-185°С (циклогексан).
ПРИМЕР 2 - Биологическая активность аналогов ретиноевой кислоты (испытания на коже)
а. Краткое описание
[00049] Соединения UAB30, 4Me-UAB30, UAB111 и тазаротен исследовали на возможное воздействие на кожу (эпидермальное и дермальное утолщение, а также раздражение кожи) после 14-дневного локального нанесения на кожу бесшерстных мышей SKH1-E. Известные RAR-селективные ретиноиды, такие как тазаротен, при локальном нанесении стимулируют пролиферацию эпидермальных кератиноцитов в коже людей и грызунов. Стимуляция пролиферации кератиноцитов (описанная гистологически как эпидермальная гиперплазия) предположительно обусловлена усилением активации рецептора эпидермального фактора роста и, как известно, отражает действие ретиноида (G., Vorhees J., Molecular mechanism of retinoid actions in skin. FASEB J. 1996; 10: 1002-1013). Помимо эпидермальной гиперплазии, RAR-селективные ретиноиды ассоциируют также с сильным раздражением кожи. Ранее было описано, что RXR-селективные ретиноиды не являются эффективными инициаторами эпидермальной гиперплазии. Неожиданно было установлено, что RXR-селективные соединения рассматриваемого изобретения демонстрируют влияние на пролиферацию кератиноцитов, сравнимое с сильнодействующим RAR-селективным ретиноидом (тазаротеном). Дополнительное преимущество, демонстрируемое RXR-селективными соединениями рассматриваемого изобретения в сравнении с тазаротеном, заключается в наблюдении минимального раздражения или его отсутствия при локальном нанесении.
[00050] UAB30, 4Me-UAB30 и UAB111 при 0,1% и 0,3%, тазаротен при 0,1% и жидкий носитель наносили локально приблизительно на 8 см2 (2×4 см) кожи спины (100 мкл) и на правое ухо (20 мкл).
[00051] Локальное нанесение UAB30 привело к эпидермальной гиперплазии с оценкой от 1,8 до 2 (по шкале от 0 = отсутствие до 5 = выраженная) для концентраций 0,1% и 0,3%, соответственно. Степень эпидермальной гиперплазии, вызванной действием UAB30, была сравнима с гиперплазией, вызванной сильнодействующим RAR ретиноидом тазаротеном при 0,1%, средняя оценка которой составила 2. Обработка 4Me-UBA30 в концентрации 0,1% и 0,3%, а также UAB111 в концентрации 0,1% и 0,3% вызвала сравнимую эпидермальную гиперплазию с оценками от 2,2 до 2,4 по 5-балльной шкале. При обработке всеми активными соединениями наблюдали также слабое снижение образования эллиптического мешочка и гиперплазии сальной железы, обычно наблюдаемых у данного штамма мышей.
[00052] Тазаротен при 0,1% вызвал сильное раздражение, измеренное как эритема, шелушение и ссадины на коже спины всех экспериментальных мышей (средняя оценка раздражения кожи = 3; шкала от 0 до 4). Носитель не вызвал раздражения кожи. UAB30 при 0,1% не вызвал никакого раздражения, тогда как концентрация 0,3% ассоциировалась лишь с легкой эритемой (средняя оценка раздражения = 1). 4Me-UAB30 при 0,1% вызвал легкую эритему только у 2 из 5 животных, однако концентрация 0,3% ассоциировалась с сильным раздражением у всех мышей (средняя оценка раздражения = 3,6). UAB111 при 0,1% и 0,3% вызвал сильное раздражение (средняя оценка раздражения = 3,8). Тазаротен при 0,1%, 4Me-UAB30 при 0,3% и UAB111 при 0,1% и 0,3% ассоциировались с заметным увеличением уровня миелопероксидазы (МРО) в ухе, которая является маркером нейтрофильной инфильтрации, тогда как UAB30 при 0,1% и 0,3%, а также 4Me-UAB30 при 0,1% не оказали влияния на эту переменную.
[00053] Таким образом, UAB30 при 0,1% и 0,3% вызывает эпидермальную гиперплазию, которая неожиданно сравнима с сильнодействующим RAR ретиноидом, но при этом обусловливает значительно меньшее раздражение при локальном нанесении в течение 14 дней в указанной модели на бесшерстных мышах.
b. Материалы
1. Исследуемые вещества и схема введения доз
[00054] Исследуемыми соединениями были UAB30, 4Me-UAB30 и UAB111. Тазаротен (0,1% крем) приобрели у компании Ricerca Taiwan Ltd. Каждое из указанных трех соединений в концентрации 0,1% и 0,3%, тазаротен (0,1% крем) и носитель (70% этанола/30% пропиленгликоля) наносили локально на спину (100 мкл) и на правое ухо (20 мкл) один раз в день в течение двух недель.
[00055] Ниже представлены составы:
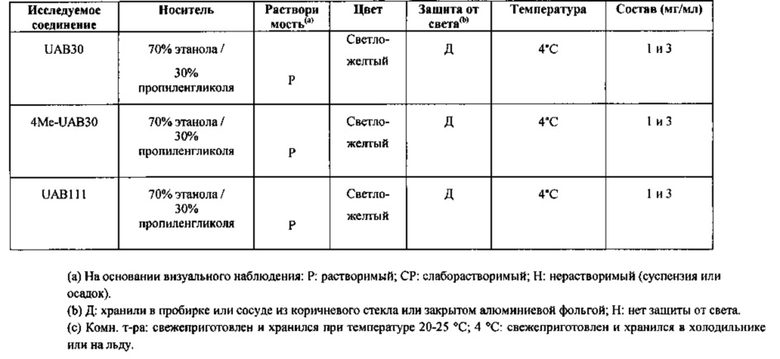
2. Животные
[00056] Самок мышей SKH1-E массой 22±2 г приобрели у компании Charles River, США. Животных содержали в отдельных вентилируемых клетках на стеллажах (IVC Racks, система 36 мини-изоляторов), поддерживая чистоту воздуха в ходе эксперимента. В каждой клетке (длина 26,7 см × ширина 20,7 см × высота 14,0 см) содержали 2 или 3 мыши при контролируемой температуре (20-24°C) и влажности (50%-80%) с 12-часовыми циклами освещения/темноты. Животным обеспечили свободный доступ к стерилизованному стандартному корму для лабораторных животных [MF-18 (Oriental Yeast Co., Ltd., Япония)] и неограниченный доступ к стерильной питьевой воде. Все аспекты указанной работы, т.е. содержание, выполнение эксперимента и захоронение животных были выполнены в соответствии с руководством по содержанию и использованию лабораторных животных (National Academy Press, Вашингтон, округ Колумбия, 2011).
3. Химические реактивы
[00057] Абсолютный этанол (Merck, Германия), набор для твердофазного иммуноферментного анализа миелопероксидазы (МРО) мышей (НК210, Hycult® biotech, Нидерланды), пропиленгликоль (Sigma, США) и Zorac® (тазаротен, 1% крем) (Allergan, США).
4. Оборудование
[00058] Клетки для животных (Techniplast, Италия), микрометр модели Dyer (Peacock, Япония), пипетки Pipetman (Gilson, Франция) и секундомер (Wisewind, Тайвань),
с. Способы
1. Кожа, местно, гиперплазия, анализ раздражения.
[00059] Использовали бесшерстных самок мышей SKH1-E (Cr1:SKH1-Hrhr) массой 22±2 г. Животных разделили на группы по 5 животных. Один раз в день при помощи микропипетки на спину наносили 100 мкл разбавителя, тазаротена и исследуемых соединений и равномерно размазывали пальцем в перчатке по коже спины площадью приблизительно 8 см2 (2×4 см); на правое ухо наносили 20 мкл. Экспериментальных животных обрабатывали в течение двух последовательных недель. Дважды в неделю измеряли массу тела.
2. Активность ретиноидов.
[00060] В качестве индикатора активности ретиноидов использовали эпидермальную гиперплазию на коже спины. Для гистологической оценки мышей умертвили на 15 день. Вырезали кожу со спины и растянули на фильтре до естественного размера. Собрали пункционные биопсии (ED 8 мм), фиксировали в 10% буферном формалине и залили в парафин. Отрезали пять микротонких сегментов, окрасили гематоксилином и эозином (г/э), и выбрали репрезентативный сегмент каждой биопсии для гистохимической оценки.
3. Эпидермальное измерение.
[00061] Толщину эпидермиса и дермы измерили при помощи микроскопа с микрометром в окуляре. Подробности описаны в гистологическом заключении (см. раздел «Гистопатология», представленный ниже).
4. Раздражение кожи.
[00062] Покраснение, десквамацию (шелушение кожи) и кожные повреждения/ссадины на коже спины отдельных животных определяли визуально по окончании 2-недельного эксперимента и оценивали по шкале от 0 до 4+, где 4+ является максимальной оценкой.
0: Нормальное
1+: Слабое покраснение
2+: Умеренное покраснение
3+: Сильное покраснение/десквамация
4+: Повреждения/ссадины.
5. Гистология.
[00063] Для гистологической оценки вырезали кожу со спины и растянули на фильтре до естественного размера. Собрали пункционные биопсии (ED 8 мм), фиксировали в 10% буферном формалине и залили в парафин. Отрезали пять микротонких сегментов, окрасили гематоксилином и эозином (г/э), и выбрали репрезентативный сегмент каждой биопсии для гистохимической оценки. На 15 день отрезали правые уши для выполнения измерений активности миелопероксидазы при помощи набора для твердофазного иммуноферментного анализа МРО мышей, которая является мерой нейтрофильных инфильтратов.
d. Гистопатология
[00064] Результаты гистопатологии представлены ниже:
1) Гиперплазия эпидермиса отмечена во всех экспериментальных группах, за исключением группы, обработанной носителем. По сравнению с коммерческим продуктом, 0,1% тазаротеном, обработка соединениями UAB30, 4Me-UBA30 и UAB111 привела к сравнимой инцидентности эпидермальной гиперплазии.
2) Гиперкератоз и/или сероцеллюлярную корку (струпья) наблюдали у большинства (3-5 из 5) мышей, обработанных 0,1% тазаротеном, UAB111 и 0,3% 4Me-UBA30, но не наблюдали у мышей, обработанных носителем и 0,3% UAB30, и наблюдали лишь у 1 животного в группе с 0,1% UAB30 и у 2 мышей в группе с 0,1% 4Ме-UBA30.
е. Выводы:
[00065]У самок бесшерстных мышей SKH1-E 14-дневное местное нанесение 0,1% и 0,3% UAB30, 4Me-UBA30 и UAB111 привело к эпидермальной гиперплазии, сравнимой с обработкой 0,1% тазаротеном. UAB30 при 0,1 и 0,3%, а также 4Me-UBA30 при 0,1% вызвали заметно меньшее раздражение и гиперкератоз, чем обработка тазаротеном.
[00066] Специалистам в данной области техники понятно, что настоящее изобретение или его очевидные модификации могут быть легко приспособлены для выполнения задач и достижения преимуществ, упомянутых или содержащихся в настоящем документе. Представленные примеры вместе со способами, приемами, способами лечения и соединениями или композициями являются иллюстрацией предпочтительных или иллюстративных вариантов реализации изобретения, и они не предназначены для ограничения рамок или общей идеи настоящего изобретения.
Группа изобретений относится к медицине, а именно к дерматологии, и может быть использована для лечения кожных заболеваний. Способ, применение и композиция по изобретению касаются введения пациенту соединения Формулы III
Использование изобретений позволяет лечить кожные заболевания за счет пролиферации кератиноцитов под действием селективных RXR-ретиноидов при значительно меньшем раздражении кожи при локальном нанесении. 3 н. и 20 з.п. ф-лы, 2 пр.
1. Способ лечения, предупреждения или ослабления тяжести не связанного с новообразованиями кожного состояния или расстройства у пациента, нуждающегося в этом, включающий стадию введения указанному пациенту соединения Формулы III
где R3 представляет собой одну или несколько групп, независимо представляющих собой Н, F, дифтор и CF3;
R6 и R7 независимо представляют собой Н или CF3;
R9 представляет собой одну или несколько групп, независимо представляющих собой Н, F или CF3;
R11 представляет собой Н или С1-С15 разветвленную или прямую алкильную группу;
n равен от 0 до 3;
или его фармацевтически приемлемой соли или изомера,
при этом указанное не связанное с новообразованиями кожное состояние или расстройство выбрано из группы, состоящей из обыкновенных угрей, псориаза, актинического кератоза, розовых угрей, себорейного дерматита, актинического лентигиноза, экземы, бородавок, кератоза, ксероза, ихтиоза, лишая, кератодермии, фолликулита, витилиго и мелазмы.
2. Способ по п. 1, отличающийся тем, что соединение имеет химическую формулу, изображенную в виде Формулы IV

3. Способ по п. 1, отличающийся тем, что кожное состояние представляет собой обыкновенные угри.
4. Способ по п. 1, отличающийся тем, что кожное состояние представляет собой псориаз.
5. Способ по п. 1, отличающийся тем, что кожное состояние представляет актинический кератоз.
6. Фармацевтически приемлемая дермальная композиция для лечения, предупреждения или улучшения не связанного с новообразованиями кожного состояния, содержащая разбавитель или носитель, фармацевтически приемлемый для нанесения на кожу, и соединение, имеющее химическую Формулу III

где R3 представляет собой одну или несколько групп, независимо представляющих собой Н, F, дифтор и CF3;
R6 и R7 независимо представляют собой Н и CF3;
R9 представляет собой одну или несколько групп, независимо представляющих собой Н, и CF3;
R11 представляет собой Н или С1-С15 разветвленную или прямую алкильную группу;
n равен от 0 до 3;
или его фармацевтически приемлемую соль или изомер,
при этом указанное не связанное с новообразованиями кожное состояние или расстройство выбрано из группы, состоящей из обыкновенных угрей, псориаза, актинического кератоза, розовых угрей, себорейного дерматита, актинического лентигиноза, экземы, бородавок, кератоза, ксероза, ихтиоза, лишая, кератодермии, фолликулита, витилиго и мелазмы.
7. Композиция по п. 6, отличающаяся тем, что соединение имеет химическую формулу, изображенную ниже в виде Формулы IV

8. Композиция по п. 7, отличающаяся тем, что указанная композиция составлена для местного нанесения.
9. Композиция по п. 7, содержащая по меньшей мере два активных ингредиента.
10. Композиция по п. 9, отличающаяся тем, что по меньшей мере один из активных ингредиентов представляет собой солнцезащитный агент.
11. Композиция по п. 9, содержащая по меньшей мере два ретиноидных соединения.
12. Композиция по п. 9, содержащая по меньшей мере одно неретиноидное соединение.
13. Композиция по п. 11, дополнительно содержащая неретиноидное соединение.
14. Композиция по п. 6, отличающаяся тем, что указанное соединение обеспечено в концентрации приблизительно от 0,01% приблизительно до 10% (мас./мас.).
15. Композиция по п. 14, отличающаяся тем, что концентрация указанного соединения составляет от 0,1 до 3,0% (мас./мас.).
16. Композиция по п. 6, отличающаяся тем, что указанная композиция составлена для перорального введения.
17. Композиция по п. 16, отличающаяся тем, что указанная композиция представлена в форме таблетки.
18. Композиция по п. 16, отличающаяся тем, что указанная композиция представлена в форме капсулы.
19. Композиция по п. 16, содержащая по меньшей мере два активных ингредиента.
20. Композиция по п. 19, содержащая по меньшей мере два ретиноидных соединения.
21. Композиция по п. 19, содержащая по меньшей мере одно неретиноидное соединение.
22. Применение композиции по любому из пп. 16-21 для лечения, предупреждения или улучшения не связанного с новообразованиями кожного состояния, отличающееся тем, что соединение формулы III вводят в дозе от 0,01 до 300 мг/кг массы тела, при этом указанное не связанное с новообразованиями кожное состояние или расстройство выбрано из группы, состоящей из обыкновенных угрей, псориаза, актинического кератоза, розовых угрей, себорейного дерматита, актинического лентигиноза, экземы, бородавок, кератоза, ксероза, ихтиоза, лишая, кератодермии, фолликулита, витилиго и мелазмы.
23. Применение по п. 22, отличающееся тем, что доза составляет от 0,1 до 30 мг/кг массы тела.
| WO 2011141822 A2, 17.11.2011 | |||
| US 20080194534 A1, 14.08.2008 | |||
| СКРИПКИН Ю.К | |||
| Кожные и венерические болезни | |||
| М.:"Триада-Х", 2000, С | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
Авторы
Даты
2019-05-13—Публикация
2013-07-01—Подача