ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет по временной заявке США 61/752688, поданной 15 января 2013 года, которая включена в настоящее описание в полном объеме.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Соматические клетки перепрограммируют в плюрипотентное состояние посредством ядерного переноса (Gurdon, J. B. et al., Nature 182:64-65 (1958); Eggan, K. et al., Nature) 428:44-49 (2004), Noggle, S. et al, Nature 478:70-75 (2011)), слияния клеток (Tada, M. et al., Curr Biol 11:1553-1558 (2001); Cowan, C. A. et al., Science 309:1369-1373 (2005); Blau, H. M. et al., Semin Cell Dev Biol 10:267-272 (1999)) и принудительной экспрессии факторов транскрипции (Takahashi, K. et al., Cell 131:861-872 (2007); Chen, M. J. et al., Cell Stem Cell 9:541-552 (2011)). Соматические клетки также перепрограммируют в терминально дифференцированные клетки, такие как миобласты (Davis, R. L. et al, Cell 51:987-1000 (1987)), макрофаг-подобные клетки (Xie, H. et al., Cell 117:663-676 (2004)), бета-клетки (Zhou, Q. et al., Nature 455:627-632 (2008)), гепатоцит-подобные клетки (Sekiya, S. et al., Nature 475:390-393 (2011)), нейроны (Vierbuchen, T. et al., Nature 463:1035-1041 (2010)) и эндотелиальные клетки (Ginsberg, M. et al., Cell 151:559-575 (2012)). Несколько групп недавно сообщили о прямом перепрограммирование фибробластов в нейральные стволовые клетки /нейральные предшественники множественных линий дифференцировки (Han, D. W. et al., Cell Stem Cell 10:465-472 (2012); Lujan, E. et al., Proc Natl Acad Sci U S A 109:2527-2532 (2012); Thier, M. et al., Cell Stem Cell 10:473-479 (2012)). Однако прямого преобразования соматических клеток в функциональные поддающиеся трансплантации гемопоэтические стволовые клетки и клетки-предшественники множественных линий дифференцировки (HSPC) было трудно достигнуть (Szabo, E. et al. Nature 468:521-526 (2010); Chambers, S. M. et al., Cell 145:827-830 (2011); Pereira, C. F. et al., Cell Stem Cell 13:205-218 (2013)).
[0003] В процессе развития мышей, дефинитивные гемопоэтические стволовые клетки (HSC) происходят из дорсальной аорты в области аорты-гонад-мезонефроса (AGM) (North, T. E. et al., Immunity 16:661-672 (2002); de Bruijn, M. F. et al., EMBO J 192:465-2474 (2000); Medvinsky, A. et al., Cell 86:897-906 (1996)). Полагают, что у позвоночных, включая данио-рерио, мышь и, возможно, человека, HSC появляются из слоя гемогенных клеток сосудов, выстилающих дно дорсальной аорты и пупочные артерии (Zovein, A. C. et al., Cell Stem Cell 3:625-636 (2008); Boisset, J. C. et al., Nature 464:116-120 (2010); Bertrand, J. Y. et al., Nature 464:108-111 (2010); Kissa, K. et al., Nature 464:112-115 (2010)). Этот процесс зависит от экспрессии фактора транскрипции (TF) RUNX1 (Chen, M. J. et al., Nature 457:887-891 (2009)). Тесная связь развивающихся эндотелиальных клеток (EC) и HSPC в концептусе привела к теории EC-гемопоэтического перехода при гемопоэзе (Zovein, A. C. et al., Cell Stem Cell 3:625-636 (2008)).
[0004] Хотя известно, что HSC и дефинитивные эритроидные/миелоидные предшественники (EMP) появляются из множества областей, содержащих гемогенные EC, является трудной охарактеризация молекулярных программ, запускающих самопроизвольный онтогенетический переход первичных гемогенных EC в гемопоэтические предшественники (Chen, M. J. et al., Nature 457:887-891 (2009); North, T. E. et al., Cell 137:736-748 (2009)), поскольку идентичность ключевых молекул и последовательность их активности остаются неясными (Orkin, S. H. et al., Cell 132:631-644 (2008)). Дифференциальная экспрессия TF в потомках гемогенных EC связана с ранним принятием решения в процессе развития о формировании дефинитивных HSPC или EC (Chen, M. J. et al. Cell Stem Cell 9:541-552 (2011)) Однако неясно, контролируют ли TF эти решения о клеточной судьбе или они просто инициируют заданные программы в гемогенных EC. Сигналы микроокружения, обеспечиваемые анатомически различными нишами - такие как сигналы в AGM, печени эмбриона и плаценте - также требуются для физиологической экспансии первичных HSC и эффективного гемопоэтического развития (Gekas, C. et al., Dev Cell 8:365-375 (2005)).
[0005] Современные способы лечения нарушений крови основаны на трансплантации здоровых HSPC. В настоящее время существует два основных способа получения достаточного количества аллогенных и аутологичных HSPC, оба из которых имеют ограничения: (1) экспансия HSPC ex-vivo (например HSPC из пуповинной крови); и (2) прямая дифференцировка плюрипотентных клеток в HSPC. Экспансия ex-vivo здоровых HSPC ограничивается доступностью донора и осложняется способами очистки в случае аутологичного трансплантата и подбором HLA в случае аллогенной трансплантации. Направленная дифференцировка плюрипотентных клеток ограничивается современным пониманием развития гемопоэтической системы, а также образования стабильных EC, и пока еще получением достаточных количеств взрослых трансплантируемых HSPC.
КРАТКОЕ ОБОБЩЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] Изобретение относится к получению гемопоэтических предшественников множественных линий дифференцировки (HMLP) из эндотелиальных клеток (EC) путем обеспечения принудительной экспрессии определенных факторов транскрипции в EC и культивирования EC в бессывороточной среде в присутствии эндотелиальных фидерных клеток. HMLP, полученные в соответствии с настоящим описанием, могут образовывать эритроидные, лимфоидные, миелоидные и мегакариоцитарные клетки. Эти образованные HMLP могут быть пересажены мышам и, таким образом, их можно использовать для терапевтического лечения нарушений, включая гемопоэтические состояния.
[0007] Таким образом, настоящее изобретение относится к способам получения гемопоэтичских клеток-предшественников множественных ростков (HMLP) человека из эндотелиальных клеток (EC) человека. Способы вовлекают культивирование EC, которые трансформированы для экспрессии каждого из следующих факторов транскрипции: гомолог B вирусного онкогена остеосаркомы мыши Finkel-Biskis-Jinkins (FOSB), независимый от факторов роста репрессор транскрипции 1 (GFI1), Runt-связанный фактор транскрипции 1 (RUNX1), провирусный онкоген интеграции вируса, образующего очаги в селезенке, (SPI1) или функциональные гомологи или производные FOSB, GFI1, RUNX1 и SPI1, в бессывороточной среде с эндотелиальными фидерными клетками.
[0008] EC, которые можно использовать для получения HMLP, включают фетальные, неонатальные, взрослые EC и EC-предшественники. В некоторых вариантах осуществления EC выбирают из эндотелиальных клеток пупочных сосудов человека (HUVEC) или взрослых эндотелиальных клеток микрососудов дермы (hDMEC).
[0009] В некоторых вариантах осуществления принудительной экспрессии факторов транскрипции достигают путем трансдукции EC одним или несколькими векторами, контролирующими экспрессию FOSB, GFI1, RUNX1 и SPI1. По меньшей мере в один или более из этих векторов также можно включать селективный маркер, такой как маркер устойчивости к антибиотику, ферментативный маркер, эпитопный маркер или визуальный маркер. Перед культивированием в присутствии эндотелиальных фидерных клеток EC можно увеличивать в количестве для экспрессии FOSB, GFI1, RUNX1 и/или SPI1 путем селекции клеток, экспрессирующих по меньшей мере один или более селективный маркер. В некоторых вариантах осуществления экспрессия одного или нескольких из FOSB, GFI1, RUNX1 и SPI1 является индуцибельной и/или временной.
[0010] Эндотелиальные фидерные клетки можно выбирать из множества EC. В некоторых вариантах осуществления фидерные клетки представляют собой эндотелиальные клетки пупочных сосудов человека (HUVEC), трансформированные для экспрессии гена, выбранного из: гена открытой рамки считывания 1 E4 аденовируса (E4ORF1) или гена Akt.
[0011] EC можно выращивать в присутствии эндотелиальных фидерных клеток в бессывороточной гемопоэтической среде, такой как бессывороточная среда для гемопоэтических стволовых клеток. Бессывороточная гемопоэтическая среда может включать факторы роста и/или цитокины, в частности bFGF, EGF, SCF, FLT3, TPO и IL-6. Бессывороточная гемопоэтическая среда также может включать IGF-1, IGF-2 и IL-3. Для получения HMLP EC можно культивировать в течение по меньшей мере пяти суток. HMLP можно выделять из клеточной культуры на основе селекции CD45+ клеток. В некоторых вариантах осуществления HMLP выбирают путем селекции CD45+CD34+ клеток. Полученные HMLP, как правило, представляют собой гетерогенную смесь клеток, однако в конкретных вариантах осуществления смесь HMLP включает клетки, которые представляют собой CD45+Lin─CD45RA─CD38─CD90+CD34+ и/или CD45+Lin─CD45RA─CD38─CD90─CD34+.
[0012] Кроме того, в рамках настоящего изобретения предусматриваются популяции HMLP, полученные в соответствии с описанными способами. Композицию, содержащую HMLP, получают согласно способу по п.1 в фармацевтически приемлемом носителе.
[0013] Также в рамках настоящего изобретения предусматриваются способы лечения гемопоэтических нарушений, вовлекающие введение полученных из EC HMLP индивидууму, нуждающемуся в лечении. После трансплантации реципиенту HMLP могут дифференцироваться в гемогенные клетки. Гемопоэтическое нарушение может быть выбрано, например, из лейкоза или лимфомы. HMLP, вводимые индивидууму, могут быть аутологичными для индивидуума или аллогенными для индивидуума. HMLP, полученные в соответствии с описанными способами, не вызывают злокачественной трансформации у реципиента.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0014] Фиг. 1A-1E. A. Схема платформы перепрограммирования HUVEC в гемопоэтических предшественников множественных линий дифференцировки (rEC-HMLP). HUVEC выделяли из удаленной пуповины, сортировали для получения чистой популяции фенотипически маркированных CD45─CD133─cKit─CD31+ эндотелиальных клеток (EC) и увеличивали в количестве для дальнейшего экспериментирования (сутки с -14 по 0). HUVEC трансдуцировали FGRS и позволяли экспрессии трансгенов в них стабилизироваться (сутки 1-3). Трансдуцированные HUVEC высевали с плотностью 1/6 (4 сутки) и выращивали на слое, подобном сосудистой нише E4ORF1+ HUVEC (E4-HUVEC) в бессывороточной среде (сутки 12-40). Приблизительно через две недели после посева трансдуцированных клеток на слой, подобный сосудистой нише, наблюдали различные плоские колонии (сутки 12-16). С течением времени (сутки 21-29) некоторые из этих колоний дали начало трехмерным похожим на виноград структурам, соответствующим предполагаемым rEC-HMLP. Через месяц (сутки 29-40) rEC-HMLP значительно увеличились в количестве, давая начало прототипным гемопоэтическим колониям. Процесс перепрограммирования подразделяют на две фазы: фаза I - специализация и фаза II - экспансия. Культуры после экспансии анализировали стандартными способами в отношении морфологических изменений, числа клеток и экспрессии общего гемопоэтического маркера CD45. Кривая серого цвета соответствует динамике числа клеток при перепрограммировании HUVEC в rEC-HMLP. Черная линия иллюстрирует низкий потенциал к экспансии при дифференцировке клеток hES-EC в гемопоэтических предшественников. B. Появление округлых подобных гемопоэтическим CD45+ клеток через две-три недели после трансдукции HUVEC набором TF (белые стрелки). Масштабная метка соответствует 200 мкм. C. Получение подобных гемопоэтическим кластеров из HUVEC, трансдуцированных FGRS, усиливается сокультивированием с сосудистой нишей и бессывороточной средой и блокируется присутствием сыворотки. D. Удаление TF по одному выявило минимальный набор факторов (FOSB, GFI1, RUNX1 и SPI1), способных образовывать подобные гемопоэтическим колонии в культуре HUVEC. Набор из 26 TF минус один или более TF оценивали в отношении способности вызывать образование подобных гемопоэтическим кластеров (n=3). Звездочки указывают на статистически значимое (p<0,05) уменьшение количества подобных гемопоэтическим кластеров в трансдуцированных HUVEC по сравнению с полным набором TF. Контроль соответствует нетрансдуцированным HUVEC. Трансдуцированные клетки культивировали на слое нетрансдуцированных E4-HUVEC в бессывороточной гемопоэтической среде. E. Удаление по одному факторов FGRS демонстрирует, что все четыре фактора FGRS являются необходимыми и достаточными для получения длительных подобных гемопоэтическим колоний.
[0015] Фиг. 2A-2E. A. Анализ FACS смешанного монослоя фидерных клеток сосудов GFP E4-HUVEC и HUVEC, трансдуцированных GFP+ FGRS, демонстрирует, что образующиеся GFP+ гемогенные клетки утрачивают экспрессию CD31 (маркер зрелых эндотелиальных клеток) и приобретают гемопоэтический фенотип CD45+ и CD45+CD34+. Проценты на точечных диаграммах шрифтом серого цвета относятся к окну на верхней левой точечной диаграмме (GFP+ клетки). Проценты на точечных диаграммах шрифтом черного цвета относятся к GFP- клеткам. B. Иммунофенотипические анализы HUVEC, перепрограммированных посредством FGRS. Появляющиеся гемогенные клетки исследовали в отношении экспрессии маркеров линий дифференцировки: CD45RA, CD45, CD34, CD90 и CD38. Представлены две популяции клеток CD45+Lin-CD45RA-CD38-CD90+CD34+ и CD45+Lin-CD45RA-CD38-CD90-CD34+, удовлетворяющих фенотипическим критериям для клеток, подобных гемопоэтическим стволовым клеткам, или мультипотентных предшественников, соответственно. C. В конце фазы I, через четыре недели после трансдукции FGRS и индукции сосудистой ниши, GFPCD45CD34 клетки сортировали и высевали для анализа CFU. Типичные гемопоэтические колонии появлялись в анализе CFU (увеличение x4); в широкопольных (левая колонка) и соответствующих флуоресцентных изображениях (правая колонка). Сверху вниз: гранулоцитарно-эритроидно-моноцитарно-мегакариоцитарные (GEMM), эритроидно/миелоидные и гранулоцитарно-макрофагальные (GM) колонии. На изображениях нижней панели представлены гемоглобинизированные колонии. На графике представлено количественное определение с использованием анализа CFU. D. Окрашивание красителем Wright-Giemsa осажденных с использованием цитоцентрифуги клеток, полученных из колоний после анализа CFU, подтвердило специализацию линии дифференцировки дифференцирующихся rEC-HMLP (увеличение x60). Авторы изобретения обнаружили клетки с типичными морфологическими признаками эритроидного, макрофагального, гранулоцитарного и мегакариоцитарного предшественников. E. Иммунофенотипический анализ клеточного роста в анализе CFU выявил присутствие CD235+, CD11b+, CD14+, CD83+ и CD45+ клеток, что указывает на то, что rEC-HMLP дифференцировались в эритроидных, макрофагальных, моноцитарных потомков и дендритные клетки.
[0016] Фиг.3A-3G. A. Перепрограммированные клетки (1,5X106 клеток CD45+GFP+) ретроорбитально инъецировали облученным сублетальной дозой (275 рад) мышам (n=9; одни сутки после облучения). B. Циркулирующие CD45+ клетки человека выявляли в периферической крови мышей после инъекции через 2, 5, 12 и 16 недель. Циркулирующие CD45+ клетки человека обнаруживали через 2 (n=7; 17,38±7,73%), 5 (n=6; 15,1±13,39%), 12 (n=6; 14,14±5,44%) и 22-40 (n=6; 21,23±22,27%) недель. Для дальнейшего анализа миелодисплазии и фиброзных изменений использовали мышей через 22-44 недель (вплоть до 10 месяцев) после трансплантации. C. Анализ периферической крови, костного мозга и селезенки через 16 недель после трансплантации выявил присутствие CD45+ клеток человека во всех трех тканях и hCD45-hCD235+ эритроидных клеток в периферической крови. Представлены результаты для BM. BM и селезенка были населены миеломдными потомками rEC-HMLP (CD45+CD33+) с небольшим, но легко поддающимся обнаружению количеством CD41a+ (мегакариоциты) клеток. D. Анализ FACS культуры в метилцеллюлозе выявил, что CD45- компартмент содержал CD235+ (гликофорин A) и не содержал Ter119+ клеток мыши, что указывает на устойчивую эритроидную дифференцировку CD45+CD34+ клеток человека в анализе CFU. E. Фенотипический анализ пересаженных in vivo rEC-HMLP в костном мозге, демонстрирующий небольшую популяцию клеток человека, которые фенотипически маркированы как CD45+Lin─CD45RA─CD38─CD90─CD34+ и удовлетворяют определению мультипотентных предшественников (MPP). F. Идентификация вирусной интеграции на уровне единичных колоний. Lin-CD45RA-CD38-CD90-CD34+ клетки использовали для анализа CFU. Через четырнадцать суток после начала анализа CFU было выявлено 3 различных агрегата клеток/колоний. Для каждой амплифицированной колонии проводили четыре реакции ПЦР с использованием их геномной ДНК в качестве матрицы. Они выявили встраивание всех четырех вирусных векторов FGRS, использованных для перепрограммирования (нижнее изображение; буквы F-FOSB, G-GFI1, R-RUNX1, S-SPI1 демонстрируют продукты ПЦР, специфичные для каждого из этих факторов, в первой колонии). G. Идентификация вирусной интеграции на уровне единичных клеток. Полногеномная амплификация (WGA) 21 CD45+ клеток человека, выделенных из мыши-хозяина через 22 недели после трансплантации. Клетки распределяли в 96-луночный планшет по 1 клетке на лунку, непосредственно в лизирующий буфер для WGA на основе Phi29. После WGA следовала реакция ПЦР с праймерами, специфичными к промотору CMV и трансгену. Представлено количественное определение в анализе. Девятнадцать клеток продемонстрировали встраивание всех четырех вирусов (FGRS). Две клетки продемонстрировали встраивание трех вирусов: FGS (RUNX1 не обнаруживался) и GRS (FOSB не обнаруживался).
[0017] Фиг.4A-4F. A. Схематическое представление функциональных тестов in vitro и in vivo для rEC-HMLP, происходящих из hDMEC. В конце фазы I через четыре недели после трансдукции FGRS rEC-HMLP сортировали и высевали для анализа CFU. В анализе CFU появлялись типичные гемопоэтические колонии CFU (масштабная метка представляет собой 200 мкм); широкое поле (нижний ряд). Изображения на нижней панели демонстрируют гемоглобинизированные колонии. В нижнем ряду представлено окрашивание Wright-Giemsa осаженных на цитоцентрифуге клеток, полученных из колоний из анализа CFU (увеличение ×60). На графике на правой панели представлено количественное определение в анализе CFU (n=3). B. Иммунофенотипический анализ клеток, выращенных в анализе CFU. На правом графике представлено количественное определение поверхностного маркера экспрессии в клетках из анализа CFU (n=3). hDMEC дифференцировались в несколько линий дифференцировки, включая эритроидных CD235+, макрофагальных CD11b+, моноцитарных CD14+, миелоидных CD33+, эндотелиальных CD144+ потомков и CD83+ потомков-дендритных клеток. C. Новорожденных иммунодефицитных мышей NSG в возрасте двух недель подвергали сублетальному облучению (100 рад) и им трансплантировали rEC-HMLP, происходящие из hDMEC (5×104 клеток). Анализ периферической крови мышей через 4, 6 и 12 недель после первичной трансплантации выявил циркулирующие CD45+ человека, а также их миеломидных и эритроидных потомков (n=6). D. Анализ селезенки мышей через 14 недель после первичной трансплантации выявил присутствие CD45+ человека, а также их лимфоидных (CD19+ и CD56+) и миелоидных (CD11b+ и CD41a+) потомков (n=3). Дальний правый график: первая колонка - измеренный hCD45+ (%) по левой оси y; следующие четыре колонки - измеренный log2 (%hCD45+) по правой оси y. E. Анализ костного мозга мышей через 14 недель после первичной трансплантации выявил присутствие CD45+ клеток человека с небольшими популяциями как CD45+Lin─CD45RA─CD38─CD90+CD34+ клеток, так и/или CD45+Lin─CD45RA─CD38─CD90─CD34+ клеток, которые удовлетворяют фенотипическому определению HSC человека и мультипотентных предшественников (MPP), соответственно (n=3). F. Через 12 недель целый костный мозг мышей, трансплантированный rEC-HMLP, происходящими из hDMEC, вторично трансплантировали взрослым (в возрасте 6-8 недель) мышам NSG. Анализ периферической крови мышей через 3 и 5 недель после вторичной трансплантации выявил циркулирующие CD45+ человека, а также их миелоидных потомков (n=6). Дальний правый график: первые две колонки измеренный hCD45+ (%) по левой оси y; последняя колонка: измеренный hCD33+ (%) по правой оси y.
[0018] Фиг.5A-5C. A. Определение глобального профиля транскрипции генов раскрывает гемопоэтические гены, которые включены, и сосудистые гены, которые подавлены в CD45+ rEC-HLMP, а также в пересаженных in vivo CD45+CD34+ rEC-HMLP через 22 недели после трансплантации. Обе популяции сравнивают с экспрессией генов в HUVEC и CD34+Lin- клетках пуповинной крови. Данные представлены в качестве log2 (уровень транскрипции). B. Сравнение экспрессии прототипных генов плюрипотентности в HUVEC, CD45+ rEC-HLMP, CD45+CD34+ rEC-HMLP через 22 недели после трансплантации, и CD34+Lin-клеток с эмбриональными стволовыми клетками человека (hESC). Прототипные гены плюрипотентности, такие как Oct4, Nanog, Sox2 и Myc, не активировались в перепрограммированных клетках по сравнению с hESC и наивными HUVEC, что указывает на то, что перепрограммирование HUVEC в rEC-HMPL достигалось без перехода через плюрипотентное состояние. C. Анализ генной онтологии (GO) для участков, связываемых SPI1 вместе с GFI1, и SPI1 отдельно. На каждом графике представлены группы генов GO, которые могут быть вовлечены в изменение типа клеток с EC на rEC-HMLP. Ниже графика для каждой группы представлены консенсусные ДНК-связывающие мотивы (p<0,01) для перепрограммирующих факторов и возможные кандидаты. Все величины активированных или подавленных генов соответствуют |log2 (rEC-HMLP/HUVEC)| ≥2.
[0019] Фиг. 6A-6B. A. rEC-HMLP дифференцируются в CD3+, CD19+ и CD14+ гемогенные клетки в отсутствие экзогенной экспрессии SPI1. Перепрограммированные клетки переносили на слой стромальных клеток костного мозга (OP9), экспрессирующих Delta-подобный 4 (OP9-DL4), и выращивали в присутствии бессывороточной гемопоэтической среды (см. способы), дополненной IL-7 (10 нг/мл), IL-11 (10 нг/мл) и IL-2 (5 нг/мл) и в отсутствие доксицилина. B. Макрофаги, дифференцированные из rEC-HMLP, способны к фагоцитозу. Изображения демонстрируют группы прочно прикрепившихся к пластмассе CD11b+GFP+ клеток с отчетливо видными поглощенными гранулами. Колонки изображения слева направо: флуоресценция GFP; ядра клеток, окрашенных DAPI, флуоресцентные гранулы; окрашивание CD11b; комбинированное изображение четырех панелей слева. Масштабная метка соответствует 15 мкм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] В рамках настоящего изобретения предусматриваются способы перепрограммирования эндотелиальных клеток (EC) в гемопоэтических предшественников множественных линий дифференцировки (HMLP или rEC-HMLP). Способы включают культивирование клеток EC с набором факторов транскрипции (TF) -включая FOSB, GFI1, RUNX1 и SPI1 (FGRS) - которые эффективно перепрограммируют EC, такие как EC пупочной вены человека (HUVEC) и взрослые микрососудистые EC человека (hDMEC), в HMLP.
[0021] Гемопоэтические предшественники множественных линий дифференцировки (HMLP) человека, как упоминается в настоящем описании, представляют собой клетки, которые обладают способностью или потенциалом к образованию или дифференцировке в множество типов клеток гемопоэтической линии дифференцировки. Гемопоэтические линии дифференцировки и дифференцированные клетки, охватываемые этими линиями дифференцировки, представляют собой клетки миелоидной линии дифференцировки, которые включают эритроциты, моноциты, макрофаги, мегакариоциты, миелобласты, дендритные клетки и гранулоциты (базофилы, нейтрофилы, эозинофилы и тучные клетки); и клетки лимфоидной линии дифференцировки, которые включают T-лимфоциты/T-клетки, B-лимфоциты/B-клетки, и естественные киллеры. HMLP, полученные способами, описанными в настоящем описании, обладают способностью образовывать гемогенные клетки миелоидной и лимфоидной линий дифференцировки, включая T-клетки, B-клетки, эритроциты, моноциты, макрофаги, мегакариоциты, миелобласты, дендритные клетки и гранулоциты.
[0022] HMLP, как описано в настоящем описании, обладают способностью приживлению (обеспечивают заселение) и обеспечивают длительную репопуляцию гемогенных клеток после трансплантации пациентов. Описанные HMLP сохраняют их потенциал к множественным линиям дифференцировки после трансплантации и их также можно подвергать последующей трансплантации от одного реципиента к одному или нескольким дополнительным реципиентам с сохранением потенциала к множественным линиям дифференцировки. Каждое из способности к длительному приживлению (например, в течение 4 недель, 8 недель, 12 недель, 16 недель или 20 недель или более после трансплантации), поддержанию потенциала к множественным линиям дифференцировки и вторичному приживлению является высокожелательным для применения популяции клеток для лечения гемопоэтических нарушений.
[0023] HMLP могут быть определены по экспрессии маркеров клеточной поверхности. Хотя HMLP представляют собой гетерогенную популяцию клеток, клетки частично характеризуются экспрессией CD45 (т.е. клетки являются CD45+). В конкретном варианте осуществления HMLP представляют собой CD45+CD34+. HMLP, кроме того, могут быть CD90+ и/или CD38+.
[0024] HMLP, полученные в соответствии с настоящим изобретением, являются негомогенными и содержат смесь типов клеток, причем каждый тип клеток обладает обособленными клеточными маркерами, обособленной морфологией и/или обособленными уровнями дифференцировки. В конкретных вариантах осуществления HMLP содержат по меньшей мере одну клетку-предшественника, способную дифференцироваться в клетку миелоидной и/или лимфоидной линии дифференцировки. В конкретном варианте осуществления популяция HMLP содержит от по меньшей мере 0,01% до по меньшей мере 0,4% от общего числа клеток в популяции или по меньшей мере от 10 клеток на миллион до по меньшей мере 250 клеток на миллион в популяции клеток-предшественников, экспрессирующих маркеры CD45+Lin-CD45RA-CD38-CD90+CD34+, и/или клеток-предшественников, экспрессирующих маркеры CD45+Lin-CD45RA-CD38-CD90-CD34+.
Способы получения HMLP
[0025] В способах, описанных в настоящем описании, HMLP получают путем перепрограммирования эндотелиальных клеток (EC) для получения перепрограммированных происходящих из эндотелиальных клеток HMLP (rEC-HMLP, также обозначаемые в настоящем описании как HMLP). Как используют в рамках изобретения, "перепрограммирование" относится к генетическому процессу, посредством которого дифференцированные соматические клетки конвертируются в дедифференцированные клетки, обладающие более высокой эффективностью, чем клетки, из которых они происходят. EC перепрограммируют, вынуждая клетки экспрессировать определенные факторы транскрипции, которые изменяют состояние дифференцировки клеток на тип гемопоэтических клеток-предшественников.
[0026] Эндотелиальные клетки, которые можно использовать для получения HMLP, включают зрелые EC (например, неонатальные, фетальные и взрослые EC) и эндотелиальные клетки-предшественники (EPC). Иллюстративные источники EC включают EC микрососудов дермы человека (HDMEC) из взрослой дермы или из неонатальной крайней плоти, EC пупочной вены/пуповинной крови человека (HUVEC), EC пупочной артерии человека (HUAEC), EC аорты человека (HAoEC), EC коронарной артерии человека (HCAEC), EC легочной артерии человека (HPAEC), EC подкожной вены человека (HSVEC), EC крови дермы человека (HDBEC), EC лимфы кожи человека (HDLEC), EC микрососудов мочевого пузыря человека (HBMEC), EC микрососудов сердца человека (HCMEC), EC микрососудов легкого человека (HPMEC), EC микрососудов матки человека (HUMEC), EC микрососудов головного мозга человека (HBMEC) и EC микрососудов фетальной плаценты (HPMEC). Эти клетки являются положительными по фактору Виллебранда (vWF), CD31-положительными, CD144-положительными, отрицательными по альфа-актину гладких мышц (SMA). EC фетальных микрососудов далее определяют как клетки фетальных микрососудов, имеющие маркеры CD34+CD133+VEGFR2+CD45─ (см., Sölder E. et al., Microvasc. Res. 84:65-73 (2012)). Эндотелиальные клетки-предшественники включают клетки-предшественники, способные дифференцироваться в зрелые эндотелиальные клетки и характеризующиеся CD34+VEGFR2+ и также возможно CD133+CD45─ (Urbich C. and Dimmeler S., Circ. Res. 95:343-353 (2004)). В предпочтительном варианте осуществления EC представляют собой HUVEC или hDMEC.
[0027] EC, используемые в рамках изобретения, могут быть аллогенными (происходящими из донора, который является генетических сходным, но не идентичным, реципиенту перепрограммированных клеток, например, он принадлежит тому же виду), сингенными (происходящими из донора, который является генетически идентичным или близкородственным реципиенту перепрограммированных клеток) или аутологичными (донор и реципиент являются одним и тем же индивидуумом).
Факторы перепрограммирования
[0028] Экспрессия (в том числе сверхэкспрессия и принудительная экспрессия) факторов транскрипции (TF), описанных в настоящем описании, может перепрограммировать EC в HMLP. Для получения HMLP из EC требуется экспрессия по меньшей мере FOSB, GFI1, RUNX1 и SPI1 (эти четыре фактора в совокупности обозначают в настоящем описании как "FGRS" или "факторы перепрограммирования") или их соответствующих функциональных гомологов или функциональных производных.
[0029] FOSB (гомолог B вирусного онкогена остеосаркомы мыши Finkel-Biskis-Jinkins) представляет собой белок лейциновой молнии, который димеризуется с белками семейства JUN с образованием комплекса факторов транскрипции AP-1. FOSB также известен как AP-1, G0S3, GOS3 или GOSB. FOSB имеет по меньшей мере шесть изоформ-вариантов по сплайсингу. В качестве примера последовательность для конкретного варианта FOSB человека, изоформы 1 FOSB, указана в GenBank под номером доступа № CAG46898.
[0030] GFI1 (независимый от факторов роста репрессор транскрипции 1) является представителем семейства ядерных белков цинковых пальцев, которые функционируют в качестве репрессоров транскрипции. Репрессоры с цинковыми пальцами семейства GFI формируют гетеротримерные комплексы, такие как EHMT2-GFI1-HDAC1, AJUBA-GFI1-HDAC1 и RCOR-GFI-KDM1A-HDAC, которые осуществляют репрессию через привлечение деацетилазой гистонов ряда генов, ответственных за специализацию развития клеток крови множественных линий дифференцировки. GFI1 также известен как SCN2, GFI-1, GFI1A и ZNF163. Существует по меньшей мере четыре изоформы GFI1, являющихся вариантами по сплайсингу. В качестве примера последовательность для конкретного варианта GFI1 человека - изоформы 1 - указана в GenBank под номером доступа № AAH32751.
[0031] RUNX1 (Runt-связанный фактор транскрипции 1) представляет собой альфа-субъединицу кор-связывающего фактора (CBF), гетеродимерный фактор транскрипции, который связывается с центральным элементом многих энхансеров и промоторов. Семейство RUNX включает ряд TF, связывающих CBF, таких как RUNX2, RUNX3, CBFB, CEBP/Z, NFY/B, NFA/A, NFY/C и RBPJ. Существует по меньшей мере три изоформы RUNX1, являющихся вариантами по сплайсингу. RUNX1 также известен как AML1, AML1-EVI-1, AMLCR1, CBFA2, EVI-1 и PEBP2aB. В качестве примера, последовательность для конкретного варианта RUNX1 человека - изоформы 1 - указана в GenBank под номером доступа № AAI36381.
[0032] SPI1 (провирусный онкоген интеграции вируса, образующего очаги в селезенке, (SFFV)) представляет собой фактор транскрипции с доменом ETS. SPI1 принадлежит семейству факторов транскрипции, кодирующих ETS-домен, которое включает SPIB, ETV6, ETS1, ETV2 и ERG. Существует по меньшей мере три варианта SPI1. SPI1 также известен как hCG_25181, OF, PU.1, SFPI1, SPI-1 и SPI-A. В качестве примера, последовательность конкретного варианта SPI1 человека - изоформы 1 - указана в GenBank под номером доступа № EAW67924.
[0033] Кроме того, для применения в описанных способах предусматриваются функциональные производные и гомологи факторов транскрипции, упоминаемых в настоящем описании. Как используют в рамках изобретения, "функциональное производное" представляет собой молекулу, которая обладает способностью выполнять биологическую функцию TF, описанного в настоящем описании, т.е. молекулу, которая способна функционально заменить описанный TF, например, при перепрограммировании EC в HMLP. Функциональные производные включают фрагменты, части, участки, эквиваленты, аналоги, мутанты, миметики из природных, синтетических или рекомбинантных источников, включающих слитые белки. Производные могут быть получены путем встраивания, делеции или замены аминокислот. Производные со вставкой аминокислот включают N- и/или C-концевые слитые конструкции, а также вставки внутрь последовательности одной или нескольких аминокислот. Варианты аминокислотной последовательности со вставкой представляют собой варианты, в которых один или несколько аминокислотных остатков внесены в заданный участок в белке, хотя также возможно случайное встраивание с соответствующим скринингом полученного продукта. Варианты с делециями характеризуются удалением одной или нескольких аминокислот из последовательности. Варианты аминокислот с заменой представляют собой варианты, в которых по меньшей мере один остаток в последовательности удален и другой остаток встроен на его место. Вставки в аминокислотные последовательности включают слитые конструкции с другими пептидами, полипептидами или белками.
[0034] Вариант молекулы относится к молекуле, по существу сходной по структуре и функции либо с целой молекулой, либо с ее фрагментом. Таким образом, как термин "вариант" используют в настоящем описании, две молекулы представляют собой варианты друг друга, если они обладают сходной активностью, даже если структура одной из молекул не встречается в другой, или если последовательность аминокислотных остатков не является идентичной. Термин "вариант" включает, например, варианты по сплайсингу или изоформы гена. Следует понимать, что "эквиваленты" включают молекулы, которые могут действовать в качестве функционального аналога или агониста. Эквиваленты необязательно могут происходить из рассматриваемой молекулы, однако они могут обладать некоторым конформационным сходством. Эквиваленты также включают пептидные миметики.
[0035] "Гомолог" представляет собой белок, родственный второму белку вследствие происхождения из общей анцестральной последовательности ДНК. Гомологом может быть представитель того же семейства белков (например, семейство FOS, семейство GFI, семейство SPI или семейство RUNX). "Функциональный гомолог" представляет собой родственный белок или его фрагмент, который способен иметь биологическую активность желаемого гена, т.е. способен функционально заменять описанный TF при перепрограммировании EC в HMLP. Гомологии и функциональные гомологии, описанные в настоящем описании, включают, но не ограничиваются ими, белки, происходящие из различных видов.
[0036] Функциональное производное или гомолог могут иметь 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с известной аминокислотной последовательностью FOSB, GFI1, RUNX1 или SPI1 или 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с представителем семейства FOSB, GFI1, RUNX1 или SPI1 или его вариантом. Функциональное производное или гомолог FOSB может иметь, например, 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с GenBank под номером доступа № CAG46898. Функциональное производное или гомолог GFI1 может иметь, например, 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с GenBank под номером доступа № AAH32751. Функциональное производное или гомолог RUNX1 может иметь, например, 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с GenBank под номером доступа № AAI36381. Функциональное производное или гомолог SPI1 может иметь, например, 75%, 80%, 85%, 90%, 95% или более идентичность аминокислотной последовательности с GenBank под номером доступа № EAW67924.
[0037] В дополнение к факторам перепрограммирования FGRS можно использовать другие TF. Например, в дополнение к FGRS можно использовать любой один или несколько из следующих TF: ZPF36 (белок с цинковыми пальцами тристетрапролин), FOS (гомолог вирусного онкогена остеосаркомы мыши FBJ), JUNB (протоонкоген jun B), GMFG (фактор созревания глии гамма), KLF2 (Kruppel-подобный фактор 2), NFE2 (ядерный фактор, эритроидный 2), KLF1 (Kruppel-подобный фактор 1), KLF4 (Kruppel-подобный фактор 4), LYL1 (происходящая из лимфобластного лейкоза последовательность 1), LMO2 (только домен LIM 2), TAL1 (T-клеточный острый лимфоцитарный лейкоз 1), GATA1 (GATA-связывающий белок 1), IKZF1 (цинковый палец 1 семейства IKAROS), GFI1B (независимый от факторов роста репрессор транскрипции 1B), VAV2 (фактор обмена гуаниновых нуклеотидов vav 2), MEIS1 (гомеобокс 1 Meis), MYB (гомолог вирусного онкогена миелобластоза птиц v-myb), MLLT3 (миелоидный/лимфоидный лейкоз или лейкоз смешенной линии дифференцировки (гомолог триторакса, Drosophila); транслоцированный, 3), HLF (фактор лейкоза печени), BEX1 (экспрессируемый в головном мозге, X-сцепленный 1), BEX2 (экспрессированный в головном мозге, X-сцепленный 2), и/или PBX1 (гомеобокс 1 пре-B-клеточного лейкоза) или функциональные производные или гомологи любого из этих TF.
Векторы для экспрессии факторов перепрограммирования
[0038] Экспрессия факторов перепрограммирования FGRS осуществляется путем внесения экзогенных нуклеиновых кислот в EC для запуска экспрессии желаемых факторов в EC. Каждый фактор перепрограммирования можно вносить в EC в качестве полинуклеотидного трансгена в векторе, который кодирует фактор перепрограммирования, функционально связанный с гетерологичным промотором, который может запускать экспрессию полинуклеотида в EC.
[0039] Доступно множество факторов, пригодных для переноса экзогенных генов в клетки млекопитающих, являющиеся мишенями. Векторы могут быть эписомальными, например плазмиды или происходящие из вирусов векторы, такие как цитомегаловирусный вектор, аденовирусный вектор, вектор на основе аденоассоциированного вируса (AAV) и т.д., или векторы могут быть встраивающимися, например, встраивающими ген перепрограммирвоания в геном клетки-мишени посредством гомологичной рекомбинации или случайного встраивания, например, происходящие из ретровирусов векторы, такие как MMLV (вирус лейкоза мышей Молони), ВИЧ-1, ALV (вирус лейкоза птиц) или лентивирусные векторы. В конкретном варианте осуществления вектор представляет собой лентивирусный вектор.
[0040] В одном варианте осуществления вектор для экспрессии фактора перепрограммирования содержит промотор, функционально связанный с геном фактора перепрограммирования. Выражение "функционально связанный" или "под контролем транскрипции", как используют в рамках изобретения, означает, что промотор находится в правильном положении и ориентации относительно полинуклеотида для контроля инициации транскрипции РНК-полимеразой и экспрессии полинуклеотида. Для применения в векторах для экспрессии фактора перепрограммирования пригодно несколько промоторов, включая, но не ограничиваясь ими, промотор РНК pol I, промотор РНК pol II, промотор РНК pol III и промотор цитомегаловируса (CMV). Другие пригодные промоторы очевидны специалисту в данной области. В некоторых вариантах осуществления промотор представляет собой индуцибельный промотор, который позволяет контролировать наличие экспрессии фактора перепрограммирования. Подходящие примеры индуцибельных промоторов включают тетрациклин-регулируемые промоторы (tet on или tet off) и регулируемые стероидами промоторы, происходящие из рецепторов глюкокортикоидов или эстрогенов. Конститутивной экспрессии TF можно достигать с использованием, например, экспрессирующих векторов с промоторами CMV, CAG (промотор бета-актина курицы с энхансером CMV) или промотором PGK (фосфоглицераткиназа 1). Индуцибельной экспрессии TF можно достигать с использованием, например, отвечающего на тетрациклин промотора, такого как индуцибельный промотор TRE3GV (отвечающий на Tet элемент 3-го поколения) (Clontech Laboratories, Mountain View, CA). Альтернативно промотор, функционально связанный с трансгеном, может представлять собой промотор, который активируется в конкретных типах клеток и/или в конкретные моменты развития.
[0041] В зависимости от используемого промотора экспрессия любого одного или всех из факторов перепрограммирования FGRS может быть конститутивной (непрерывная экспрессия фактора) или индуцибельной (способной к включению и выключению). Экспрессия также может быть временной, а именно, временной экспрессией представляющего интерес гена перепрограммирования в EC в течение ограниченного промежутка времени. Временной экспрессии можно достигать с использованием не встривающегося вектора, где вектор утрачивается из клетки или из популяции клеток с течением времени, или с использованием индуцибельного промотора во встраивающемся или не встраивающемся векторе, которым можно манипулировать для остановки экспрессии гена перепрограммирования после некоторого периода времени. В конкретном варианте осуществления временную экспрессию одного или нескольких из факторов перепрограммирования FGRS используют для обеспечения экспрессии не более чем на трое суток, не более чем на пять суток, не более чем на 10 суток или не более чем на одну, две или три недели.
[0042] Пригодные векторы могут содержать маркеры для идентификации и/или селекции трансформированных клеток. Примеры селективных маркеров включают визуальные маркеры, такие как зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP) или флуоресцеин; эпитопные маркеры, такие как метки His, c-myc, GST, Flag или HA; ферментативные/алиментарные маркеры, такие как DHFR (дигидрофолатредуктаза); или маркеры устойчивости к антибиотикам, таким как неомицин, пуромицин, бластицидин или гигромицин.
Трансформация эндотелиальных клеток факторами перепрограммирования
[0043] Для трансфекции и трансдукции эндотелиальных клеток факторами перепрограммирования можно использовать любые подходящие средства. Для различных способов трансформации или трансфекции клеток млекопитающих см. Keown et al., 1990, Methods Enzymol. 185: 527-37; Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, N.Y. Векторы, содержащие FOSB, GFI1, RUNX1 и SPI1, можно трансфицировать в клетки с использованием стандартных способов, известных в данной области, включая, но не ограничиваясь ими, опосредуемую липосомами трансфекцию, опосредуемую полибреном трансфекцию, опосредуемую DEAE-декстраном трансфекцию, электропорацию, осаждение с фосфатом кальция, микроинъекцию или бомбардировку микрочастицами. Аналогично, FOSB, GFI1, RUNX1 и SPI1 можно доставлять в эндотелиальные клетки с использованием вирусной системы доставки, такой как система доставки на основе лентивируса, аденовируса, ретровируса, аденоассоциированного вируса или вируса герпеса. В предпочтительном варианте осуществления EC трансфицируют одним, двумя, тремя или четырьмя лентивирусными векторами, запускающими экспрессию FOSB, GFI1, RUNX1 и SPI1.
[0044] EC, экспрессирующие один, два, три или все четыре из факторов перепрограммирования FGRS, могут быть увеличены в количестве в популяции путем селекции клеток, экспрессирующих маркеры, указывающие на трансформированные клетки. Например, каждый фактор перепрограммирования может быть помещен в отдельный вектор с определенным селективным маркером (например, векторы могут обеспечивать устойчивость к различным антибиотикам, различным визуальным маркерам и/или к различным алиментарным маркерам). Путем селекции каждого маркера, соответствующего трансформации различными векторами, популяция EC, трансформированная всеми четырьмя факторами, может быть увеличена. В конкретном примере различные векторы, где каждый вектор кодирует отличающийся фактор перепрограммирования, маркированы устойчивостью к антибиотику или зеленым флуоресцентным белком (GFP), соответственно.
Условия культивирования для перепрограммирования EC
[0045] EC, трансформированные FGRS, предпочтительно культивируют с минимальным количеством сыворотки или без сыворотки в культуральной среде ("бессывороточная среда"). Авторы настоящего изобретения обнаружили, что присутствие сыворотки в среде снижает продукцию HMLP. Трансформированные EC можно культивировать в бессывороточной среде, пригодной для культивирования и экспансиии гемогенных клеток. Такие среды могут быть основаны, например, на модифицированной способом Искова среде Дульбекко (IMDM) или другой подходящей культуральной среде, и они могут включать добавки, такие как стандартный бычий сывороточный альбумин, инсулин, 2-меркаптоэтанол и/или трансферрин (например, STEMSPAN SFEM, Stemcell Technologies, Vancouver, Канада). Дополнительные добавки могут включать добавку-заменитель сыворотки с определенным составом для выращивания недифференцированных клеток, например, заменитель сыворотки KNOCKOUT (GIBCO). EC можно культивировать в течение трех суток, пяти суток, десяти суток, двенадцати суток, одной недели, двух недель или трех недель или более для перепрограммирования EC в HMLP.
[0046] Дополнительные добавки в среду для обеспечения перепрограммирования EC могут включать факторы роста и/или цитокины, такие как 2-8 нг/мл bFGF, 5-15 нг/мл EGF, 15-25 нг/мл SCF, 15-25 нг/мл FLT3, 15-25 нг/мл TPO, 15-25 нг/мл IGF-1, 5-15 нг/мл IGF-2, 5-15 нг/мл IL-3, и/или 5-15 нг/мл IL-6. В предпочтительном примере культуральная среда включает 2-8 нг/мл bFGF, 5-15 нг/мл EGF, 15-25 нг/мл SCF, 15-25 нг/мл FLT3, 15-25 нг/мл TPO, и 5-15 нг/мл IL-6.
Эндотелиальные фидерные клетки
[0047] EC, экспрессирующие по меньшей мере факторы FGRS, культивируют с эндотелиальными фидерными клетками. Эти фидерные клетки обеспечивают AGM-подобную (подобную аорте-гонадам-мезонефросу) нишу, которая сходна с физиологической средой, в которой происходит перепрограммирование EC. Предпочтительно, эндотелиальные фидерные клетки выращивают до формирования смыкающегося монослоя на дне емкости для культивирования тканей, а затем в емкость для культивирования высевают трансформированные EC. В качестве фидерной клетки можно использовать любую эндотелиальную клетку, такую как зрелые EC (например, неонатальные, фетальные и взрослые EC) и эндотелиальные клетки-предшественники (EPC). Иллюстративные источники EC включают EC микрососудов дермы человека (hDMEC) из взрослой дермы или неонатальной крайней плоти, EC пупочной вены / пуповинной крови человека (HUVEC) и EC микрососудов фетальной плаценты (hPMEC). В предпочтительном варианте осуществления в качестве эндотелиальных фидерных клеток используют HUVEC.
[0048] Фидерные клетки предпочтительно способны расти и выживать в бессывороточных условиях, чтобы было возможно культивировать их с EC в бессывороточной среде. Многие типы эндотелиальных клеток не могут поддерживаться в культуре в отсутствие сыворотки. Модификация эндотелиальных клеток для обеспечения выживания и пролиферации для применения в качестве фидерных клеток в бессывороточной культуре может преодолеть этот барьер в эндотелиальных клетках, для которых в ином случае может потребоваться сыворотка.
[0049] Эндотелиальные клетки можно модифицировать, например, путем трансформации клеток генами, которые запускают рост и пролиферацию в отсутствие сыворотки. Примеры генов, которые поддерживают выживание эндотелиальных клеток в культуре без сыворотки, включают ген Akt (протеинкиназа B или PKB) и ген E4ORF1 аденовируса. В конкретном варианте осуществления HUVEC трансформируют для экспрессии гена, выбранного из Akt или гена E4ORF1 аденовируса. Трансформация HUVEC посредством E4ORF1 описана в патенте США № 8465732, содержание которого включено в настоящее описание в качестве ссылки. Трансформация HUVEC посредством Akt описана, например, в Fujio and Walsh, J. Biol. Chem. 274:16349-16354 (1999), содержание которой включено в настоящее описание в качестве ссылки.
[0050] Можно использовать любые подходящие средства трансферкции и трансдукции эндотелиальных клеток генами, которые обеспечивают выживание и пролиферацию в бессывороточной среде. Например, ген E4ORF1 или Akt можно трансфицировать в клетки с использованием стандартных способов, известных в данной области, включая, но не ограничиваясь ими, опосредуемую липосомами трансфекцию, опосредуемую полибреном трансфекцию, опосредуемую DEAE-декстраном трансфекцию, электропорацию, осаждение с фосфатом кальция, микроинъекцию или бомбардировку микрочастицами. Аналогично, ген E4ORF1 или Akt можно доставлять в эндотелиальные клетки с использованием вирусной системы доставки, такой как система доставки на основе лентивируса, аденовируса, ретровируса, аденоассоциированного вируса или вируса герпеса. В одном варианте осуществления ген E4ORF1 или Akt доставляют в эндотелиальные клетки с использованием лентивирусной системы доставки генов.
[0051] Фидерные клетки можно культивировать в среде для роста эндотелия (например, Medium 199, Thermo Scientific: #FB-01), с 10-30% эмбриональной телячьей сывороткой (Omega Scientific), 15-25 мкг/мл добавки для эндотелиальных клеток (доступна, например, от Biomedical Technologies: #BT-203), 0,5-2X Pen/Strep, и 15-25 единиц/мл гепарина (например, Sigma: # H3149-100KU). Фидерные клетки можно высевать в слое на поверхности емкости для культивирования и, предпочтительно, после получения смыкающегося слоя фидерных клеток на емкости для культивирования, среду для роста эндотелия заменяют бессывороточной средой и EC, экспрессирующие факторы перепрограммирования, можно высевать сверху фидерного слоя.
[0052] Например, зрелые HUVEC (или hDMEC) можно трансдуцировать факторами перепрограммирования FGRS, а затем через 2-3 суток промывать и повторно высевать на полученные монослои фидерных клеток E4-HUVEC. Трансдукция 5x104 зрелых EC может обеспечить множество различных колоний HMLP в процессе бессывороточного сокультивирования с E4-HUVEC.
Выделение HMLP из культуры
[0053] HMLP можно выделять из культуры для дальнейшего применения. В одном варианте осуществления HMLP выделяют путем выделения CD45+ клеток. В другом варианте осуществления HMLP выделяют путем выделения CD45+CD34+ клеток. HMLP можно выделять, например, посредством сортировки клеток и отделения CD45+ клеток от сокультуры HMLP с эндотелиальными фидерными клетками (которые представляют собой CD45-).
[0054] HMLP можно выделять из культуры в качестве гетерогенной/смешанной популяции (например, популяция клеток, где различные клетки в популяции экспрессируют различные маркеры, помимо экспрессии CD45+ или CD45+CD34+), или в качестве относительно гомогенной/по существу чистой популяции (например, популяция клеток, где более 50%, более 60%, более 70%, более 75%, более 80%, более 85%, более 90%, более 95% или более 98% клеток экспрессируют общий набор маркеров в дополнение к экспрессии CD45+ или CD45+CD34+).
Фармацевтические композиции и способы лечения
[0055] Кроме того, настоящее изобретение относится к фармацевтическим композициям HMLP, образованных из EC, с фармацевтически приемлемым носителем. Такая фармацевтическая композиция может содержать, в дополнение к клеткам, физиологически приемлемый матрикс или физиологически приемлемый носитель. Тип матрикса и/или носителя зависит, среди прочего, от предполагаемого пути введения. Подходящие матриксы и/или носители известны в данной области. Такие композиции можно замораживать и хранить, например, в жидком азоте, с использованием общепринятых способов хранения стволовых клеток или клеток пуповинной крови. В предпочтительном примере предусматриваются фармацевтические композиции для внутривенной инфузии пациенту.
[0056] Кроме того, предусматриваются способы лечения с использованием HMLP, образованных из EC, и фармацевтических композиций, описанных в настоящем описании. HMLP, описанные в настоящем описании, пригодны для восстановления гемогенных клеток у индивидуума и для предоставления популяций клеток, обогащенных желаемыми типами гемопоэтических клеток. HMLP по настоящему изобретению можно использовать для восстановления полного диапазона гемогенных клеток у индивидуума с иммунодефицитом после терапии, такой как, но не ограничиваясь ими, лучевая терапия и химиотерапия. Введение описанных HMLP, например, путем инфузии или трансплантации индивидууму, может дополнить или заменить стволовые клетки или клетки-предшественники печени, поджелудочной железы, почки, легкого, нервной системы, мышечной системы, кости, костного мозга, тимуса или селезенки. Трансплантаты HMLP могут быть аутологичными или аллогенными, включая гемопоэтические трансплантаты, совпадающие и не совпадающие по типу HLA. Понятно, что может быть необходимым лечение хозяина для уменьшения иммунологического отторжения донорных клеток.
[0057] Субъект или индивидуум может представлять собой любое животное, нуждающееся в клеточной терапии. В некоторых вариантах осуществления индивидуумом является млекопитающее. Млекопитающие включают, но не ограничиваются ими, людей, не являющихся человеком приматов, мышей, коров, лошадей, собак, кошек и т.п. В предпочтительном варианте осуществления млекопитающим является человек.
[0058] Что касается введения увеличенных в количестве клеток, описанных в настоящем описании, пациенту, эффективное количество увеличенных в количестве клеток может находиться в диапазоне от нескольких сотен или меньше до нескольких миллионов или более. Будет понятно, что количество увеличенных в количестве клеток, подлежащих введению, варьирует в зависимости от специфики нарушения, подвергаемого лечению, включая, но не ограничиваясь ими, размер или общий объем, подвергаемый лечению, а также потребности и состояние реципиента, среди других факторов, известных медицинскому специалисту. В некоторых вариантах осуществления субъекту или индивидууму вводят или трансплантируют от 103 до 1010 клеток на индивидуума массой 100 кг. Способы введения или трансплантации хорошо известны в данной области и включают, например, инфузию. Увеличенные в количестве клетки, описанные в настоящем описании, можно вводить, например, посредством внутривенной инфузии.
[0059] В одном варианте осуществления HMLP используют для дополнения или замены клеток костного мозга при трансплантации костного мозга. Аутологичные и аллогенные трансплантаты костного мозга в настоящее время используют в качестве способов терапии заболеваний, таких как лейкоз, лимфома и другие угрожающие жизни нарушения. Однако недостатком этих процедур является то, что большое количество донорского костного мозга должно быть извлечено, чтобы обеспечить достаточное клеток для пересадки. Настоящее изобретение уменьшает или устраняет потребность в крупном донорстве костного мозга путем замещения или дополнения донорства костного мозга HMLP, образованными из EC, для инфузии или трансплантации реципиенту.
[0060] В некоторых вариантах осуществления предусматривается однократное введение клеток. В других вариантах осуществления используют многократное введение. Многократное введение может быть осуществлено периодически, как например, первоначальный режим лечения в течение от 3 до 7 последовательных дней, а затем повторение в другое время.
ПРИМЕРЫ
[0061] Культура клеток. Эндотелиальные клетки пупочной вены человека (HUVEC) получали, как описано в Goldberg, A. D. et al., (Cell) 140:678-691 (2010). HUVEC культивировали в среде для роста эндотелия (EM): Medium 199 (Thermo Scientific: #FB-01), 20% эмбриональной телячьей сыворотке (Omega Scientific), 20 мкг/мл добавки для эндотелиальных клеток (Biomedical Technologies: #BT-203), 1X Pen/Strep, и 20 единиц/мл гепарина (Sigma: # H3149-100KU). Взрослые первичные эндотелиальные клетки микрососудов кожи человека (hDMEC) приобретали от ScienCell Research Laboratories (каталожный номер № 2020). Бессывороточную гемопоэтическую среду изготавливали из StemSpan SFEM (Stemcell Technologies), 10% заменителя сыворотки KnockOut (Invitrogen), 5 нг/мл bFGF, 10 нг/мл EGF, 20 нг/мл SCF, 20 нг/мл FLT3, 20 нг/мл TPO, 20 нг/мл IGF-1, 10 нг/мл IGF-2, 10 нг/мл IL-3, 10 нг/мл IL-6 (все от Invitrogen, eBioscience или Peprotech).
[0062] Очистка предшественников пуповинной крови человека. Пуповинную кровь человека получали согласно протоколу IRB "Stage Specific Differentiation of Hematopoietic Stem Cells into Functional Hemangiogenic Tissue" (Weill Cornell Medical College IRB # 09060010445). Мононуклеарные клетки пуповинной крови очищали с использованием градиента плотности Ficoll-Paque (GE) и CD34+ предшественников увеличивали в количестве с помощью магнитного разделения с использованием микрогранул с антителом против CD34 (Miltenyi). Дальнейшую очистку проводили посредством отрицательной селекции клеток Lin+ с использованием набора Human Progenitor Cell Enrichment Kit (StemCell Technologies). РНК экстрагировали из клеток Lin-CD34+CD45+, выделенных с помощью FACS с использованием набора для выделения РНК Arcturus PicoPure RNA isolation kit (Applied Biosystems; этот набор использовали для всех методик экстракции РНК).
[0063] Проточная цитометрия. Анализ с использованием проточной цитометрии проводили на Becton Dickenson LSRII SORP, и активированную флуоресценцией сортировку клеток (FACS) проводили на Aria II SORP. Использованные антитела индуцировали против CD45, CD34, CD14, CD31, CD43, CD90, CD41a, CD33, CD19, CD3, CD4, CD8, CD235, CD45RA, CD83, CD11b, CD38, коктейля LIN, CD117, CD133, CD144 (BD Pharmingen, eBioscience) человека или CD45 мыши (eBioscience.). Регулировку и стабилизацию напряжения проводили с использованием CompBeads (BD Pharmingen), и установку окна проводили на контролях флуорофор минус один или более (FMO) и неокрашенных контролях.
[0064] Идентификация факторов транскрипции, которые дифференциально экспрессируются между эндотелиальными клетками и гемопоэтическими клетками-предшественниками. Для идентификации условий, которые являются необходимыми для гемопоэтической специализации, авторы настоящего изобретения провели секвенирование РНК свежевыделенных HUVEC и Lin-CD34+ гемопоэтических предшественников пуповинной крови человека для идентификации дифференциально экспрессируемых TF. Было идентифицировано 26 дифференциально экспрессируемых TF (таблица 1).
Факторы транскрипции (TF), которые дифференциально экспрессируются между HUVEC и Lin-CD34+ гемопоэтическими клетками-предшественниками пуповинной крови (CB) человека.
[0065] Лентивирусные векторы. Факторы транскрипции-кандидаты субклонировали либо в лентивирусный вектор pLVX-IRES-Zs Green1 (Clontech), либо в лентивирусный вектор pLOC (OpenBiosystems), либо в лентивирусный вектор LV105 (Genecopoeia). Лентивирусные частицы упаковывали, как описано в Sandler, V. M. et al., PLoS One 6:e18265 (2011). В кратком изложении, клетки почки эмбриона человека 293FT (HEK293FT) сотрансфицировали лентивирусным вектором и двумя плазмидами-помощниками, psPAX2 и pMD2.G (Trono Lab через Addgene), в равном молярном соотношении. Супернатант собирали через 48-52 часов после трансфекции, фильтровали и концентрировали с использованием концентратора Lenti-X (Clontech). Титры вируса определяли в экспериментах с лимитирующими разведениями с использованием HUVEC в качестве клеток-мишеней. Авторы изобретения использовали либо число GFP+ клеток, либо число колоний, образовавшихся в присутствии селективных антибиотиков (пуромицин) в качестве считываемых данных для количества инфекционных вирусных частиц на объем. Авторы настоящего изобретения использовали MOI 5-10 для инфицирования HUVEC или EC, происходящих из клеток hES, и 10-25 для инфицирования фибробластов.
[0066] HUVEC и HEF (фибробласты эмбриона человека) трансдуцировали лентивирусом, экспрессирующим SPI1, и увеличивали в количестве в присутствии пуромицина (от 0,5 до 1 мкг/мл) в течение 10-14 суток для получения достаточного количества клеток. Все четыре экспрессирующих FGRS лентивируса ресуспендировали в среде для культивирования эндотелиальных клеток и наносили на фидерные клетки. Через 12-24 часов трансдуцированные EC подпитывали дополнительной культуральной средой для EC. Через 2-3 суток после трансдукции трансдуцированные EC пересевали сверху фидерных клеток.
[0067] Авторы настоящего изобретения провели скрининг различных комбинаций из 26 идентифицированных TF, чтобы идентифицировать комбинации, способные перепрограммировать HUVEC в гемогенные клетки. Для устранения потенциальной контаминации исходных культур HUVEC гемогенными клетками, авторы настоящего изобретения сортировали свежевыделенные HUVEC для получения зрелых CD45-CD133-cKit-CD31+ EC (фиг.1A). В отсутствие экзогенно экспрессированных TF эти HUVEC никогда не дают начало CD45+ гемогенным клеткам. Таким образом, авторы настоящего изобретения использовали появление CD34+CD45+ клеток в качестве исходных данных для идентификации клеток, которые приобрели гематологический потенциал. Для трансдукции HUVEC использовали лентивирусные векторы, экспрессирующие идентифицированные TF либо с зеленым флуоресцентным белком (GFP) в качестве маркера, либо с геном устойчивости к пуромицину (фиг.1A). Затем трансдуцированные HUVEC увеличивали в количестве без сыворотки в присутствии гемопоэтических цитокинов (TPO, KITL, FLT3L; см. способы). Приблизительно через 2 недели после трансдукции в культурах HUVEC было выявлено появление округлых GFP+CD45+ клеток (фиг.1B) и округлые похожие на виноград колонии GFP+CD45+ начали появляться из эндотелиального монослоя (фиг.1A, сутки 12-16).
[0068] Идентификация необходимых факторов транскрипции для перепрограммирования EC. HUVEC трансформировали 25 TF за один или более раз, причем каждая трансформация была лишена отличного TF, как указано в таблице 1. Это систематическое "устранение по одному" TF-кандидатов продемонстрировало, что гемопоэтическое перепрограммирование требовало принудительной экспрессии FOSB, GFI1, RUNX1 и SPI1 (эта комбинация обозначается как "FGRS") (фиг.1D, n=3). Другие TF-кандидаты не требовались. Авторы настоящего изобретения обнаружили, что TF FGRS отдельно был достаточным для образования подобных гемопоэтическим колоний (фиг.1E, n=3). Удаление какого-либо одного фактора FGRS не полностью устраняло образование подобных гемопоэтическим кластеров, но значимо уменьшало количество кластеров (p<0,05), и появляющиеся клетки, подобные гемопоэтическим, делились неактивно.
[0069] Конструирование фидерного слоя для усиления и поддержания роста EC, трансдуцированных FGRS. EC и HSPC совместно развиваются в области аорты-гонад-мезонефроса (AGM). Поскольку первичные HSC требуют подходящей ниши для экспансии в развивающемся плоде, фидерные клетки сосудистой ниши могут усиливать выживаемость и сохранять специализацию появляющихся клеток, подобных гемопоэтическим. Для исследования этой гипотезы авторы настоящего изобретения использовали модель сосудистой ниши in vitro для обеспечения свободной от сыворотки и факторов роста культуры HUVEC путем экспрессии гена E4ORF1 комплекса E4 аденовируса (E4-HUVEC), как описано Butler, J. M. et al., (Blood) 120:1344-1347 (2012). Группа авторов настоящего изобретения и другие группы продемонстрировали, что E4-HUVEC сохраняют их подобную нише подложку для первичных гемогенных клеток, cKit+Lin-Sca1+CD34-Flt3- клеток мыши и Lin-CD45RA-CD38-CD34+ CD49f+ HSPC человека, которые могут приживаться у летально облученных первичных и вторичных реципиентов.
[0070] С использованием этой системы сокультивирования в сосудистой нише авторы настоящего изобретения разработали свободную от ксенобиотиков платформу, в которой зрелые HUVEC (или hDMEC) трансдуцировали факторами перепрограммирования FGRS, а затем через 2-3 суток, промывали и повторно высевали на сформировавшиеся монослои фидерных клеток E4-HUVEC. Трансдукция 5×104 зрелых HUVEC обеспечила 32,3±10,5 (n=8) отдельных колоний в процессе бессывороточного сокультивирования с E4-HUVEC, но не наблюдали колоний, если добавляли сыворотку. Наивные HUVEC были непригодны в качестве сосудистой ниши, поскольку они не могли выжить в бессывороточной культуре в течение более чем 1-2 недель, препятствуя пользе для FGRS-EC от подложки в виде сосудистой ниши в процессе перепрограммирования. Действительно, GFP+ подобные гемопоэтическим колонии, появившиеся из сокультур с наивными HUVEC (3,4±3,2 колоний на 5×104 трансдуцированных HUVEC; n=5) были не более распространенными, чем продукт FGRS-EC в отсутствие фидерных клеток.
[0071] E4-HUVEC обеспечивают необходимые окружающие условия для культивирования FGRS-EC. Сокультура EC, трансдуцированных FGRS, (FGRS-EC) с E4-HUVEC значительно увеличивала выход и поддержание подобных гемопоэтическим колоний, что в конечном итоге проявлялось морфологическими и молекулярными признаками rEC-HMLP. Таким образом, эффективное образование гемогенных клеток из FGRS-EC требовало длительных поддерживающих сигналов от EC с функцией, подобной функции ниши.
[0072] По этим причинам авторы настоящего изобретения использовали E4-HUVEC, платформу фидерных клеток сосудистой ниши, для дальнейшей охарактеризации гемопоэтического перепрограммирования EC, трансдуцированных FGRS. Трансдукция 5×104 EC в течение 2 суток и последующее сокультивирование с E4-HUVEC в течение 3 недель привели к появлению 32,3±10,5 (n=8) отдельных колоний (фиг.1C). Эти данные указывают на то, что поддерживающие сосудистые клетки необходимы для появления гемогенных клеток из EC, трансдуцированных FGRS.
[0073] Подтверждение экспрессии TF FGRS в культивируемых клетках. в случае FGRS, которые вносили в наивные EC без учета соответствующей стехиометрии, эффективность перепрограммирования была очень низкой и достигала менее 0,07%. Таким образом, для повышения эффективности перепрограммирования авторы настоящего изобретения разработали стратегию селекции подгрупп EC, трансдуцированных FGRS, которые были трансдуцированы с надлежащей стехиометрией TF. Сначала авторы настоящего изобретения сфокусировались на получении EC с надлежащей стехиометрией TF GFI1, SPI1 и FOSB, поскольку их наивная экспрессия в EC несущественна (см. таблица 1). Для этого авторы настоящего изобретения трансдуцировали 5×106 EC лентивирусным "коктейлем" FGRS, маркированным устойчивостью к пуромицину (SPI1) или GFP (FOSB и GFI1). Затем авторы настоящего изобретения использовали селекцию с пуромицином в течение 2 суток для увеличения содержания SPI1-экспрессирующих клеток и сортировали их по экспрессии GFP для увеличения содержания SPI1+GFP+ (FOSB/GFI1) EC. Затем авторы настоящего изобретения посеяли эти GFP+ клетки в 12-луночные планшеты и увеличивали их в количестве в течение двух суток в бессывороточной культуре (105 клеток на планшет, n=3).
[0074] Затем авторы пересевали 104 GFP+ устойчивых к пуромицину клеток на фидерный слой E4-HUVEC в гемопоэтической среде и определяли число гемопоэтических кластеров после сокультивирования в течение ~20 суток. Авторы настоящего изобретения обнаружили, что эти устойчивые к пуромицину GFP+ клетки обеспечили 156,0±3,6 (n=3) подобных гемопоэтическим колоний на 104 пересеянных клеток, что указывает на то, что эффективность перепрограммирования составляла по меньшей мере 1,5%. Это вычисление позволяет предположить, что каждая колония происходит из отдельной перепрограммированной клетки и что каждая из трансдуцированных EC - которые, как известно, экспрессируют два из факторов (SPI1 и либо/оба из FOSB или GFI1) - экспрессируют все четыре TF FGRS. Эффективность, вероятно, является значительно более высокой в клетках, экспрессирующих соответствующие стехиометрические количества каждого фактора. Таким образом, очень маловероятно, что подход перепрограммирования авторов настоящего изобретения является результатом самопроизвольной дифференцировки очень немногочисленной заранее существующей популяции гемогенных/гемангиобластных EC, присутствующих в монослоях HUVEC.
[0075] Поддерживающая сосудистая ниша способствует перепрограммированию FGRS-EC в пролиферирующие эритроидно-мегакариоцитарно-миелоидные предшественники множественных линий дифференцировки. После сокультивирования с E4-HUVEC в течение от трех до четырех недель, FGRS-EC начали быстро пролиферировать и образовывать похожие на виноград GFP+ кластеры, прикрепленные к монослоям E4-HUVEC. Окрашивание Wright-Giemsa похожих на виноград кластеров выявило клетки, морфологически сходные с гемопоэтическими предшественниками и их потомками (фиг.1B, правая панель). Авторы настоящего изобретения временами также наблюдали образование крупных подобных нишам структур с множеством колоний, которые физически отделяли развивающиеся гемопоэтические колонии от их окружения (n=4). Проточная цитометрия продемонстрировала, что большинство потомков FGRS-EC (GFP+ клетки) утрачивали экспрессию маркера зрелых EC CD31, а их подгруппа приобретала экспрессию общего гемопоэтического маркера CD45, иногда совместно с соэкспрессией CD34 (фиг.2A, n=9). Напротив, GFP- E4-HUVEC сохраняли высокий уровень экспрессии CD31 и оставались CD34+CD45-. Подгруппа потомков GFP+CD45+ FGRS-EC экспрессировала другие гемопоэтические маркеры, такие как CD43+ (8,96%±2,3; n=3), CD90+ (Thy-1+) (6,15%±1,13; n=3) и CD14+ (40,0%±4,95; n=3). Пролиферация GFP+ клеток увеличивалась под конец сокультивирования в течение от четырех до пяти недель с E4-HUVEC, что приводило к образованию вплоть до 20x106 GFP+CD45+ клеток, что соответствует экспансии исходных EC приблизительно в 400 раз (фиг.3A; 17,2×106±2,4; n=6). Через от трех до пяти суток как скорость пролиферации, так и число жизнеспособных клеток, быстро снижались, хотя образование GFP+CD45+ продолжалось со сниженной скоростью. Таким образом, поддерживающая сосудистая ниша из клеток E4-HUVEC способствует перепрограммированию FGRS-EC в пролиферирующих эритроидно-мегакариоцитарно-миелоидных предшественников множественных линий дифференцировки (rEC-HMLP).
[0076] rEC-HMLP могут образовывать эритроидные, макрофагальные, гранулоцитарные и мегакариоцитарные клетки-предшественники. Для оценки функциональности rEC-HMLP авторы настоящего изобретения провели анализы колониеобразующих единиц (CFU) с использованием стандартных анализов в метилцеллюлозе. Если бы HUVEC действительно преобразовались в функциональные rEC-HMLP, тогда эти клетки должны быть способными дифференцироваться по меньшей мере в две различных гемопоэтических линии дифференцировки в анализе CFU. Через четыре недели после трансдукции HUVEC посредством FGRS и сокультивирования с сосудистой нишей GFP+CD45+CD34+ rEC-HMPL сортировали и высевали с плотностью клеток 1200-1600 клеток/см2 (5000-7000 клеток/35-мм чашка) для анализов CFU (n=3). В течение 14 суток клетки дали начало агрегатам GFP+ клеток, морфологически сходным с CFU-GM (гранулоцитарные/макрофагальные колониеобразующие единицы), CFU-GEMM (гранулоцитарные/эритроцитарные/моноцитарные/мегакариоцитарные колониеобразующие единицы), и частично гемоглобинизированным гемопоэтическим колониям типа BFU-E (взрывообразующая еденица -эритроный тип, тип эритроных предшественников) (фиг.2C). Специализацию линий дифференцировки в анализе CFU подтверждали окрашиванием колоний красителем Wright-Giemsa (фиг.2D). Авторы настоящего изобретения были способны обнаружить клетки с типичными морфологическими признаками эритроидных, макрофагальных, гранулоцитарных и мегакариоцитарных предшественников, как определено в Beutler, E., ed., Williams Hematology; McGraw Hill, Inc. (Fifth Edition, 1995).
[0077] Иммунофенотипический анализ колоний, полученных из культур с метилцеллюлозой, выявил присутствие CD235, CD11b, CD14, CD83 и CD45 клеток, что указывает на то, что rEC-HMLP дифференцировались в эритроидных, макрофагальных, моноцитарных потомков и потомков-дендритных клеток. CD235+ (гликофорин A) клетки также были CD45-, что указывает на эритроидную дифференцировку (фиг.2E).
[0078] Взрослые эндотелиальные клетки микрососудов человека способны образовывать аутологичные HSC. Для исследования того, является ли способ авторов настоящего изобретения применимым для перепрограммирования EC, отличных от HUVEC, авторы настоящего изобретения использовали взрослые эндотелиальные клетки микрососудов дермы человека (hDMEC). Перепрограммирование hDMEC в трансплантируемые rEC-HMLP является более значимым для потенциальных будущих клинических применений, поскольку оно может позволить образование трансплантируемых аутологичных гемопоэтических предшественников для восстановления костного мозга. Кроме того, поскольку взрослые EC могут содержать уменьшенное низкое количество гемогенных EC, этот подход демонстрирует, что зрелые EC, но не гемогенные или не гемангиобластные EC, перепрограммируются в гемогенные клетки.
[0079] hDMEC трансдуцировали факторами FGRS и подвергали сосудистой индукции в бессывороточной среде (тот же протокол, который использовали для перепрограммирования HUVEC). Для оценки in vitro функциональности перепрограммированных hDMEC авторы настоящего изобретения провели анализ CFU. Через четыре недели после трансдукции hDMEC посредством FGRS, GFP+CD45+CD34+ клетки сортировали и высевали с плотностью 1200-1600 клеток/см2 для анализов CFU (n=3). В течение 12-14 суток клетки давали начало агрегатам клеток, морфологически сходным с CFU-GM, CFU-GEMM, частично гемоглобинизированными BFU-E, и смешанными колониями (фиг.4A). Специализацию линий дифференцировки в анализе CFU подтверждали путем окрашивания колоний красителем Wright-Giemsa. Авторы настоящего изобретения были способны обнаружить клетки с типичной морфологией эритроидных, макрофагальных, гранулоцитарных и мегакариоцитарных предшественников (фиг.4A). Иммунофенотипический анализ колоний, полученных из культур с метилцеллюлозой, выявил способность rEC-HMLP, происходящих из hDMEC, дифференцироваться с несколько линий дифференцировки, включая эритроидных CD235+ (58,66±3,47%), макрофагальных CD11b+ (10,39±3,05%), моноцитарных CD14+ (10,87±1,28) потомков и потомков-дендритных клеток CD83+ (7,94±0,80%) (фиг.4B).
[0080] HUVEC не могут спонтанно образовывать rEC-HMLP-подобные клетки. Для исключения возможности того, что HUVEC могут содержать гемогенные или гемангиобрастные клетки, которые могут спонтанно образовывать rEC-HMLP-подобные клетки, авторы настоящего изобретения провели два набора экспериментов.
[0081] Сначала авторы получали клональные культуры путем сортировки фенотипически маркированных зрелых HUVEC с плотностью одна клетка, две клетки, пять клеток и 10 клеток на лунку. Для этого авторы настоящего изобретения провели многоцветную проточную цитометрию и распределили CD144 (VE-кадгерин)+CD31+E-селектин+CD45- HUVEC в конфигурации 1, 2, 5 и 10 клеток в 96-луночных планшетах. E-селектин (CD62E) экспрессируется только на зрелых EC и отсутствует на каких-либо гемопоэтических и несосудистых клетках. Затем эти колонии увеличивали в количестве до культур >10000 клеток (для клонов из 5 и 10 клеток), >5000 клеток (для клона 1 №1 и клонов 2 клеток), и >3000 клеток (для клона 1 клетки №2). Трансдукция культур из одной клетки, двух клеток, пяти клеток и десяти клеток посредством FGRS с последующим сокультивированием с E4-HUVEC привела к появлению подобных гемопоэтическим колоний, сходных с колониями, наблюдаемых в экспериментах со смешанной культурой HUVEC. Поскольку E-селектин экспрессируется только на зрелых терминально дифференцированных активированных EC, маловероятно, что контаминирующие "гемогенные или гемангиоблатстные" EC присутствовали в клональных популяциях HUVEC, трансдуцированных FGRS, и что они могли дать начало гемогенным клеткам.
[0082] Во втором наборе экспериментов авторы настоящего изобретения выращивали HUVEC в бессывороточной среде, которую использовали для экспериментов по перепрограммированию. Авторы настоящего изобретения сравнили пролиферацию, а также экспрессию CD45 и CD34 в HUVEC в ответ на удаление сыворотки и комбинированное добавление гемопоэтических цитокинов в культуральную среду. Ни удаление сыворотки, ни добавление оптимальных коктейлей гемопоэтических цитокинов не вызывало никакой поддающейся обнаружению экспрессии CD45 в HUVEC. Однако как устранение сыворотки отдельно, так и/или в комбинации с ингибированием передачи сигнала TGFβ, вызывало значительную активацию экспрессии CD34 в HUVEC, сохраняя их сосудистую принадлежность. В совокупности, эти данные указывают на то, что маловероятно, что FGRS перепрограммируют заранее существующие гемогенные или гемангиобластные клетки-предшественники в HUVEC, а скорее TF FGRS + протокол индукции сосудов запускает преобразование терминально дифференцированных D144+CD31+E-селектин+CD45- EC в гемогенные клетки.
[0083] rEC-HMLP могут образовывать фенотипически правильные HSPC и мультипотентные клетки-предшественники. Более детальный фенотипический анализ rEC-HMLP выявил небольшие популяции клеток, которые были CD45+Lin-CD45RA-CD38-CD90+CD34+ или CD45+Lin-CD45RA-CD38-CD90-CD34+, что, таким образом, удовлетворяло критериям фенотипически маркированных HSPC или мультипотентных предшественников, соответственно, как определено Chao, M. P. et al., (Cold Spring Harb Symp Quant Biol) 73:439-449 (2008) (фиг.2B, n=3).
[0084] CD45+ клетки обладают потенциалом к экспансии. Авторы настоящего изобретения сравнили потенциал к экспансии CD45+ и CD45- клеток в бессывороточной гемопоэтической среде. CD45+ (12×103) и CD45- (60×103) клетки сортировали в отдельные лунки и увеличивали в количестве в течение двух суток. Авторы изобретения наблюдали 5-кратную экспансию CD45+ клеток (56,6×103±7,9×103; n=3) и значительное снижение CD45- клеток (4,6×103±1,0×103; n=3). Для исследования потенциала CD45+ и CD45- клеток в отношении клональной экспансии, их сортировали в 96-луночные планшеты с плотностью 1 или 2 клеток/лунка. После культивирования в течение семи суток авторы настоящего изобретения наблюдали увеличение в количестве CD45+ клеток в 6,3±2,1 лунках (93,1±14,5 клеток/лунка) при сортировке по 1 клетке и в 29,0±4,3 лунках (112,1±21,2 клеток/лунка) при сортировке 2 клеток (n=3). Разность между числом клеток/лунка при сортировке по 1 и 2 клеткам была статистически незначимой (p=0,78), что указывает на то, что число лунок с обнаруженной экспансией клеток было следствием выживания сортированных клеток, а не отражало число клеток, отсортированных в лунку. Авторы настоящего изобретения не выявили какой-либо значительной экспансии CD45- клеток.
[0085] Дифференцировка и попытка перепрограммирования эмбриональных стволовых клеток человека. Авторы настоящего изобретения использовали трансгенную репортерную линию hESC, которая специфически идентифицирует дифференцированные производные EC посредством флуоресцентного репортера, запускаемого фрагментом промотора VE-кадгерина человека, как описано в Rafii, S. et al., Blood 121:770-780 (2013). Для усиления эндотелиального коммитирования, дифференцировку hESC инициировали в сокультуре с сосудистыми фидерными клетками. В кратком изложении, HUVEC выделяли и трансдуцировали лентивирусным AdE4ORF1, как описано в Seandel, M. et al., Proc Natl Acad Sci U S A 105:19288-19293 (2008). За сутки до посева hESC для начала дифференцировки кондиционированную MEF среду заменяли культуральной средой hESC без FGF-2 и дополняли 2 нг/мл BMP4. На следующие сутки hESC высевали прямо на слой с 80% смыканием E4ORF1+ EC в культуральной среде hESC (без FGF-2, плюс 2 нг/мл BMP4) и оставляли стоять в течение 48 часов. Этот момент культивирования считали нулевым днем дифференцировки. Клетки последовательно стимулировали рекомбинантными цитокинами в следующем порядке: 0-7 сутки - дополнение 10 нг/мл BMP4; 2-14 сутки - дополнение 10 нг/мл VEGFA; 2-14 сутки - дополнение 5 нг/мл FGF-2; 7-14 сутки - дополнение 10 мкМ SB-431542. Фракцию происходящих из hESC клеток, коэкспрессирующих специфический для сосудов репортер и CD31, собирали на 14 сутки с использованием FACS. Эти клетки трансдуцировали коктейлем и через 2-3 суток высевали на слой E4ORF1 HUVEC. Степень перепрограммирования оценивали с использованием проточной цитометрии.
[0086] Эмбриональные стволовые клетки человека лишены способности образовывать высокопролиферативные HSC. В настоящее время дифференцировка плюрипотентных стволовых клеток, включая эмбриональные стволовые клетки (ES) и индуцированные плюрипотентные стволовые клетки (iPSC) в репопулирующие гемогенные клетки, демонстрирует ограниченный успех. Таким образом, FGRS могут быть недостающими факторами, которые могут усиливать дифференцировку EC, запускаемую из ES человека, в HSC. Для этого авторы настоящего изобретения дифференцировали hES в EC (hES-EC)38. Затем авторы настоящего изобретения очистили положительные по VEGFR2 hES-EC и трансдуцировали их FGRS. Примечательно, что hES-EC, трансдуцированные FGRS, могли образовывать значительное количество CD45+CD144- клеток. Однако эти CD45+CD144- клетки не образовывали обособленные стабильные подобные гемопоэтическим колонии и не входили в фазу высокопролиферативного роста. Эти результаты указывают на то, что hES-EC не являются настолько же пермиссивными, как и HUVEC, в отношении перепрограммирования в rEC-HMPL.
[0087] rEC-HMLP, образованные из EC, могут быть трансплантированы и могут функционировать in vivo, заменяя гемогенные клетки. Для определения того, являются ли rEC-HMLP способными к приживлению in vivo, авторы настоящего изобретения трансплантировали 1,5×106 CD45+GFP+ rEC-HMLP посредством ретроорбитальной инъекции взрослым облученным сублетальной дозой (275 рад) иммунодефицитным мышам с дефицитом NOD-SCID-IL2γ-рецептора (NSG) (n=9; одни сутки после облучения). Периферическую кровь мышей после инъекции исследовали через 2, 5, 12, 16 и 22-44 недель после трансплантации в отношении присутствия CD45+ клеток человека (фиг.3B). Авторы настоящего изобретения обнаружили циркулирующие CD45+ клетки человека через 2 (n=7; 17,38±7,73%), 5 (n=6; 15,1±13,39%), 12 (n=6; 14,14±5,44%), 16 (n=6; 22,36±17,95%) и 22-44 (n=6, 21,23±22,27%) недель. Анализ периферической крови, костного мозга (BM) и селезенки через 16 недель после трансплантации показал присутствие CD45+ клеток человека во всех трех тканях и CD45-CD235+ эритроидных клеток человека в периферической крови. BM и селезенка были заселены миелоидным потомством rEC-HMLP (CD45+CD33+) с небольшим, но поддающимся обнаружению количеством CD41a+ (мегакариоциты) клеток (фиг.3C).
[0088] Трансплантированные rEC-HMLP сохраняют их способность образовывать эритроидные, мегакариоцитарные, макрофагальные, моноцитарные потомки и потомки-дендритные клетки. Для определения того, сохраняли ли пересаженные rEC-HMLP, выделенные из хозяина, их потенциал в отношении множественных линий дифференцировки, авторы настоящего изобретения провели вторичный анализ CFU. Авторы настоящего изобретения выделили CD45+ человека (hCD45+) из костного мозга мышей с трансплантатами через 22 (n=1) и 24 (n=4) недели после трансплантации. Эти клетки увеличивали в количестве in vitro в течение 24 часов и из них отсортировывали hCD45+hCD34+ клетки для анализа CFU. В течение 14 суток посеянные клетки дали начало колониям с морфологией, сходной с CFU-GM, CFU-GEMM и BFU-E. Окрашивание красителем Wright-Giemsa осажденных с помощью цитоцентрифуги клеток выявило типичную морфологию человеческих миелоидных потомков анализируемых клеток. Иммунофенотипический анализ культуры в метилцеллюлозе выявил, что CD45+ компартмент человека содержал CD41a+, CD14+, CD83+ и CD33+ клетки, что указывает на присутствие мегакариоцитарных, макрофагальных, моноцитарных потомков и потомков-дендритных клеток. CD45-компартмент содержал CD235+ и не содержал Ter119+ клеток мыши, что указывает на устойчивую эритроидную дифференцировку CD45+CD34+ клеток человека в анализе CFU (фиг.3E).
[0089] Анализ rEC-HMLP, пересаженных в костный мозг мышей NSG, выявил небольшую популяцию Lin-CD45RA-CD38-CD90-CD34+ клеток, которые удовлетворяют определению человеческих мультипотентных предшественников (фиг.3E). Для подтверждения того, что эти клетки сохраняют их потенциал в отношении множественных линий дифференцировки и что они являются производными перепрограммированных rEC-HMLP, авторы настоящего изобретения посеяли их для анализа CFU и проверили в отношении встраивания вируса в единичных колониях. Геномную ДНК, выделенную из отдельных колоний, анализировали в отношении присутствия четырех перепрограммирующих факторов. Все исследованные колонии (n=3) были положительными в отношении лентивирусных векторов, экспрессирующих FOSB, GFI1, RUNX1 и SPI1 (фиг.3F). Для количественного определения частоты вирусной интеграции на уровне единичных клеток, авторы настоящего изобретения проанализировали CD45+ клетки человека из костного мозга хозяина. Клетки распределяли в 96-луночный планшет (1 клетка/лунка) для полногеномной амплификации (WGA). Амплифицированную геномную ДНК исследовали в отношении вирусной интеграции. Все клетки (n=21) были положительными в отношении встраивания вирусного вектора. Две клетки продемонстрировали встраивание трех (FGS с не поддающимся обнаружению RUNX1 и GRS с не поддающимся обнаружению FOSB) из четырех вирусов, использованных для перепрограммирования (фиг.3G). Результаты вирусной интеграции для единичных клеток и единичных колоний подтвердили, что гемогенные клетки человека, выделенные из мышей-хозяев, происходят из rEC-HMLP, трансплантированных мышам NSG.
[0090] Трансплантированные rEC-HMLP сохраняют геномную целостность. Для оценки геномной целостности CD45+ rEC-HMLP (на 35 сутки после трансдукции), и CD45+CD34+ rEC-HMLP, пересаженных в костный мозг мышей NSG (через 24 недели после трансплантации), авторы настоящего изобретения провели сравнительный анализ геномной гибридизации (CGH) с использованием микрочипа Agilent SurePrint G3 Human CGH Microarray (1 M зонды). Анализ не выявил генетических аномалий, что указывает на то, что пролиферирующие rEC-HLMP остаются генетически стабильными как in vitro, так и in vivo.
[0091] Трансплантированные rEC-HMLP не приводят к злокачественной трансформации in vivo. Для решения проблемы возможной злокачественной трансформации трансплантированных rEC-HMLP, включая предрасположенность к миелодиспластическому синдрому (MDS), авторы настоящего изобретения анализировали костный мозг, селезенку и печень мышей-реципиентов в течение вплоть до 10 месяцев после трансплантации (фиг.3A). Периферическую кровь сначала анализировали в отношении присутствия циркулирующих hCD45+ клеток. Мышей, демонстрирующих приживление, умерщвляли и их селезенку, печень и большую берцовую кость анализировали в отношении признаков MDS. Ни одна из мышей не проявляла макроскопических признаков лейкоза и лимфомы, таких как лимфаденопатия, спленомегалия или органомегалия. Также авторы настоящего изобретения провели всесторонний анализ с использованием панели окрашивания костного мозга, селезенки и печени мышей с прижившимися rEC-HMLP. Авторы настоящего изобретения не наблюдали никаких признаков избытка отложения коллагена или десмина. Также, микроскопическая архитектура костного мозга не проявляет признаков фиброзного ремоделирования, напоминающих миелодиспластический синдром. Остеобластные, сосудистые и околососудистые области были морфологически интактными. Авторы настоящего изобретения сделали заключение, что их подход не приводит к индукции гемогенных клеток с потенциалом к возникновению лейкоза.
[0092] Трансплантированные rEC-HMLP образуют лимфоидные клетки. Количество лимфоидных потомков трансплантированных rEC-HMLP, происходящих из HUVEC (в селезенке, костном мозге и периферической крови) было ничтожно малым, что указывает на то, что трансплантированные rEC-HMLP не вносили достаточного вклада в химеризм T-клеток in vivo. Для изучения возможности того, что конститутивная остаточная экспрессия SPI1 препятствует дифференцировке rEC-HMLP в T-клетки, авторы настоящего изобретения использовали комбинацию конститутивно экспрессируемого фактора FGR и индуцибельного SPI1 (SPI1-Tet-On). HUVEC трансдуцировали лентивирусами FGR+SPI1-Tet-On и выращивали на монослоях фидерных клеток HUVEC в течение 27 суток в присутствии доксицилина. Авторы настоящего изобретения наблюдали образование подобных гемопоэтическим колоний и увеличение числа CD45+ клеток. Фидерные клетки HUVEC были устойчивыми к доксицилину и сохраняли их функцию сосудистой ниши на протяжении индукции образующихся гемогенных клеток. Далее перепрограммированные клетки переносили на слой стромальных клеток костного мозга (OP9), экспрессирующих Delta-подобный 4 (OP9-DL4) и выращивали в присутствии быссывороточной гемопоэтической среды, дополненной IL-7 (10 нг/мл), IL-11 (10 нг/мл) и IL-2 (5 нг/мл). Клетки исследовали в отношении экспрессии CD3, CD19 и CD14 (3 недели сокультуры OP9-DL4; фиг.6A). Примечательно, авторы настоящего изобретения были способны достоверно обнаружить небольшую фракцию CD3+ клеток (0,16±0,01%; n=3), большое количество CD19+ (1,17±0,13%; n=3) и очень значительную популяцию клеток, экспрессирующих CD14 (16,46±1,02%; n=3), что указывает на образование T-клеток.
[0093] Трансплантированные rEC-HMLP образуют функциональные макрофаги. Для проведения функциональной оценки макрофагов, дифференцированных из rEC-HMLP, авторы настоящего изобретения провели анализ фагоцитоза. rEC-HMLP культивировали в присутствии M-CSF (10 нг/мл), SCF (10 нг/мл), Flt-3 (10 нг/мл), TPO (10 нг/мл) и 10% FBS в течение двух недель без фидерного слоя E4-HUVEC. Авторы настоящего изобретения наблюдали увеличение размера и гранулярности культивируемых клеток. Культуру промывали PBS два раза для удаления не прикрепляющихся клеток. Среду для роста, смешанную с красными флуоресцентными гранулами в низкой концентрации, составляющей 1 мкл/мл, наносили на прикрепленные клетки в течение одного часа при 37°C. После инкубации клетки промывали два раза PBS и живые клетки окрашивали антителом против CD11b. Клетки фиксировали и окрашивали DAPI для визуализации ядра. Конфокальная микроскопия выявила группы прочно прикрепленных CD11b+GFP+ клеток с отчетливо заметными поглощенными гранулами (фиг.6B). Таким образом, rEC-HMLP могут давать начало функциональным макрофагам.
[0094] rEC-HMLP, полученные из hDMEC, можно трансплантировать, и они могут функционировать in vivo, заменяя гемогенные клетки. Для определения того, способны ли rEC-HMLP, полученные из hDMEC, к приживлению in vivo, авторы настоящего изобретения трансплантировали 1×105 CD45+GFP+ rEC-HMLP посредством ретроорбитальной инъекции сублетально облученным (100 рад) новорожденным мышам NSG в возрасте две недели. Периферическую кровь мышей после инъекции исследовали через 4, 6 и 12 недель после трансплантации в отношении присутствия CD45+ клеток человека (фиг.4C). Авторы настоящего изобретения обнаружили циркулирующие CD45+ клетки человека через 4 (2,09±1,27%, n=6), 6 (4,46±3,66%, n=6) и 12 (4,05±3,50%, n=6) недель. Анализ периферической крови, костного мозга и селезенки через 14 недель после трансплантации выявил присутствие CD45+ клеток человека во всех трех тканях и CD45-CD235+ эритроидные клетки человека в периферической крови (фиг.4C, D, E). Анализ селезенки через 14 недель после трансплантации показал небольшие, но отчетливые популяции CD19+ (10,13±4,98%; B-клетки) и CD56+ (1,62±0,67%; NK-клетки) клеток лимфоидного происхождения. Они присутствовали в дополнение к CD11b+ (27,66±8,92%; макрофаг) и CD41a+ (4,90±1,51%; мегакариоциты) миелоидным клеткам (фиг.4D).
[0095] Трансплантированные происходящие из hDMEC rEC-HMLP также сохраняют способность образовывать функциональные HSC-подобные клетки in vivo. Для функционального исследования того, образовывали ли трансплантированные rEC-HMLP, происходящие из hDMEC, функциональные HSC-подобные клетки in vivo, авторы настоящего изобретения провели вторичные трансплантации. Авторы настоящего изобретения трансплантировали целый костный мозг из бедра мышей после первичной трансплантации через 12 недель после трансплантации (n=10). Фенотипический анализ rEC-HMLP, пересаженных в костный мозг донорных мышей через 14 недель после первичной трансплантации выявил значительные популяции как CD45+Lin─CD45RA─CD38─CD90+CD34+ (10,37±2,55%), так и CD45+Lin─CD45RA─CD38─CD90─CD34+ (13,83±2,14%) клеток, которые удовлетворяют фенотипическому определению HSPC человека и мультипотентных предшественников (MPP), соответственно (фиг.4E). Авторы настоящего изобретения обнаружили hCD45+ в PB (периферическая кровь) вторичных реципиентов через три (n=6; 14,61±15,7%) и пять (n=6; 2,01±1,5%) недель после трансплантации со значительной популяцией миелоидных потомков (n=6; 44,32±23,21%) (фиг.4F). Долговременное первичное приживление и успешное кратковременное вторичное приживление указывают на существование HSPC-подобных клеток/самообновляющихся MPP в популяции перепрограммированных hDMEC.
[0096] rEC-HMLP демонстрируют активацию гемопоэтических генов и подавление сосудистых генов. Далее, авторы настоящего изобретения сравнили полногеномные профили транскрипции rEC-HMLP с профилями экспрессии генов культивируемых HUVEC и свежевыделенных гемогенных CD34+CD45+Lin- клеток пуповинной крови для оценки степени перепрограммирования на уровне полногеномного транскриптома (фиг.5A). Анализ выявил активацию гемопоэтических генов и подавление экспрессии сосудистых генов в CD45+ клетках перед трансплантацией и в CD45+CD34+ rEC-HMLP через 22 недели после трансплантации по сравнению с наивными HUVEC и Lin-CD34+ CB клетками. Прототипные гены плюрипотентности, такие как Oct4, Nanog, Sox2 и Myc, не активировались в перепрограммированных клетках по сравнению с эмбриональными стволовыми клетками человека (hESC) и наивными HUVEC, что указывает на то, что перепрограммирование HUVEC в rEC-HMPL достигалось без перехода через плюрипотентное состояние (фиг.5B). Иерархическая кластеризация полных транскриптомов HUVEC, CD45+ rEC-HMLP, CD45+CD34+ rEC-HMLP через22 недели после трансплантации, и CD34+Lin- клеток с более плотной кластеризацией CD45+CD34+ rEC-HMLP и CB-клеток указывала на дополнительное "обучение/перепрограммирование" rEC-HMLP in vivo.
ChIP-Seq и анализ данных. ChIP-Seq проводили, как описано в Goldberg, A. D. et al., Cell 140:678-691 (2010). В кратком изложении, клетки сшивали в течение 15 мин в 1% параформальдегиде, промывали и лизировали. Хроматин расщепляли с использованием Bioruptor на фрагменты размером приблизительно 150 пар оснований, промывали и элюировали. Элюированный хроматин подвергали обратному сшиванию и очищали на колонке (антитела против SPI1 и GFI приобретали от Santa Cruz Biotechnology; каталожные номера sc-352 и sc-8558.). Образцы ChIP для секвенирования получали с использованием набора Illumina TruSeq DNA Sample Preparation Kit в соответствии со стандартным протоколом получения (Illumina). Секвенирование проводили на секвенаторе Illumina Hiseq 2000 в соответствии со стандартным протоколом Illumina. Считанные данные ChIP-seq выравнивали с эталонным геномом человека (hg19, NCBI Build 37) с использованием программы BWA (Li, H. et al., Bioinformatics 25:1754-1760 (2009)) и дубликаты ПЦР удаляли с использованием Picard (доступной через Интернет от sourceforge). Уникальные данные считывания, картированные на одной наиболее совпадающей области с не более чем двумя несоответствиями оснований, сохраняли и использовали для получения геномного распределения связывания SPI1 и GFI1 и для идентификации пиков. Программное обеспечение ChIPseeqer 2.0 (Giannopoulou, E.G. et al., BMC Bioinformatics 12:277 (2011)) использовали для данных ChIP-Seq с данными секвенирования из входной ДНК в качестве контроля для идентификации геномного усиления сигналов ChIP для SPI1 и GFI1 с FDR<0,005. Усиление в пределах +/- 2 т.п.н. от участка начала транскрипции (TSS) определяли как пики промоторов. Выбранные гены предоставляли для анализа генной онтологии (GO) с использованием DAVID (доступна через Интернет от National Institute of Allergy and Infectious Diseases (NIAID), NIH) и анализа мотивов с использованием HOMER (доступна через Интернет от biowhat, University of California, San Diego).
[0097] Идентификация участков связывания ДНК SPI1 и GFI1. Для установления возможных механизмов транскрипционного опосредуемого FGRS перепрограммирования EC в rEC-HMLP авторы настоящего изобретения сравнили полногеномное связывание ДНК SPI1 и GFI1 в HUVEC с использованием сопряженного с иммунным осаждением с хроматина глубокого секвенирования (ChIP-Seq). Авторы настоящего изобретения идентифицировали 23587 связанных с SPI1 и 10999 связанных с GFI1 геномных участков в промоторной области +/- 2 т.п.н. от участков начала транскрипции (TSS). Примечательно, что 91,6% из связанных с GFI1 TSS (10079 из 10999) перекрывались со связанными с SPI1 TSS. Однако 57,3% связанных с SPI1 промоторов не были заняты GFI. Сравнение уровней транскрипции генов, связанных SPI1, GFI1 или SPI1 и GFI1 вместе (общие мишени или "CT") показало, что большинство генов, которые связываются только GFI1, проявляют сниженные уровни экспрессии, в то время как гены, которые связываются либо SPI1 отдельно, либо SPI1 в комбинации с GFI1, активируются. Анализ генной онтологии (GO) связанных участков выявил ряд кластеров генов, которые могли быть вовлечены в изменение типа клеток с EC на rEC-HMLP (фиг.5C). GO выявил активированные CT (log2 (rEC-HMLP/HUVEC) ≥2), принадлежащие кластерам генов с известной функцией при развитии гемопоэтической системы и миелоидной дифференцировке, в то время как известно, что большое количество ингибированных CT вовлечено в развитие сосудов (фиг.5C). Поиск известных ДНК-связывающих мотивов, занимаемых мишенями TSS SPI1 и GFI1, выявил, что ингибированные CT ((log2 (HUVEC/rEC-HMLP) ≥2) содержали подгруппу генов с GFI1b (72 гена, p=0,001) и FOSB-связывающие мотивы (64 гена, p=0,0001). Подгруппа TSS активированных (log2 (rEC-HMLP/HUVEC) ≥2) генов, связываемых SPI1, содержала известные ДНК-связывающие мотивы RUNX1 (133 гена, p=0,0001) и FLI1 (264 гена, p=0,01). Кроме того, подгруппа CT содержала известный ДНК-связывающий мотив EBF (ранний B-клеточный фактор) (130 генов, p=0,01).
[0098] Полногеномный профиль связывания SPI1 и GFI1 в комбинации с поиском ДНК-связывающего мотива и полнотранскриптомным анализом экспрессии указывает на то, что SPI1 отдельно и SPI1 в комбинации с GFI1 активируют экспрессию гемопоэтических генов. Примечательно, что экспрессия сосудистых генов подавлялась как SPI1, так и GFI1, а также возможно FOSB. Активация гемопоэтических генов зависит от экспрессии SPI1, которая синергична с экспрессией RUNX1 и FLI1. Следует отметить, что FLI1 в равной степени экспрессируется в наивных HUVEC, CD45+ rEC-HMLP, CD45+CD34+ rEC-HMLP через 22 недели после трансплантации, и в Lin─CD34+ CB-клетках; нормализованная экспрессия составляет 7,4, 7,9, 7,2 и 7,6, соответственно.
[0099] Для определения того, запускает ли индуцируемое FGRS перепрограммирование эндогенную экспрессию TF FGRS, авторы настоящего изобретения определили экспрессию 5’- и 3’-нетранслируемых областей (UTR) посредством РНК-Seq. Поскольку лентивирусные конструкции, использованные для перепрограммирования, экспрессируют открытые рамки считывания факторов FGRS без UTR, авторы настоящего изобретения были способны идентифицировать эндогенно экспрессируемые транскрипты по присутствию их последовательностей UTR. Анализ 5’ и 3’-факторов FGRS пересаженных rEC-HMLP человека с использованием полнотранскриптомного РНК-Seq выявил активацию эндогенной экспрессии всех четырех факторов FGRS. Эндогенную экспрессию TF FGRS вычисляли из данных РНК-Seq, полученных для UTR, в качестве частного (%)=UTR /(UTR+ORF), где UTR представляет собой число результатов РНК-seq, выравнивающихся с 5’- и 3’-UTR, ORF представляет собой число результатов РНК-seq, выравнивающихся с открытой рамкой считывания представляющего интерес гена. Этот анализ указывает на то, что эндогенная экспрессия факторов FGRS активируется в перепрограммированных клетках как in vitro (CD45+ rEC-HMLP), так и после периода опосредуемого микроокружением обучения in vivo (CD45+CD34+ in vivo).
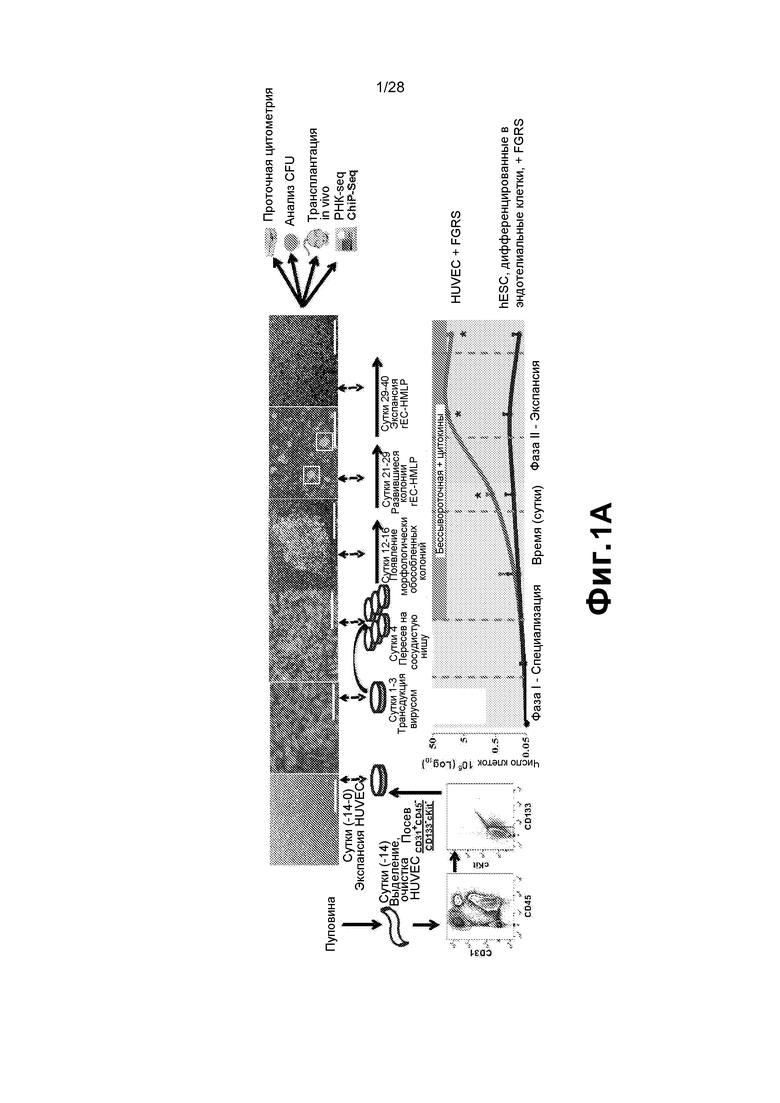


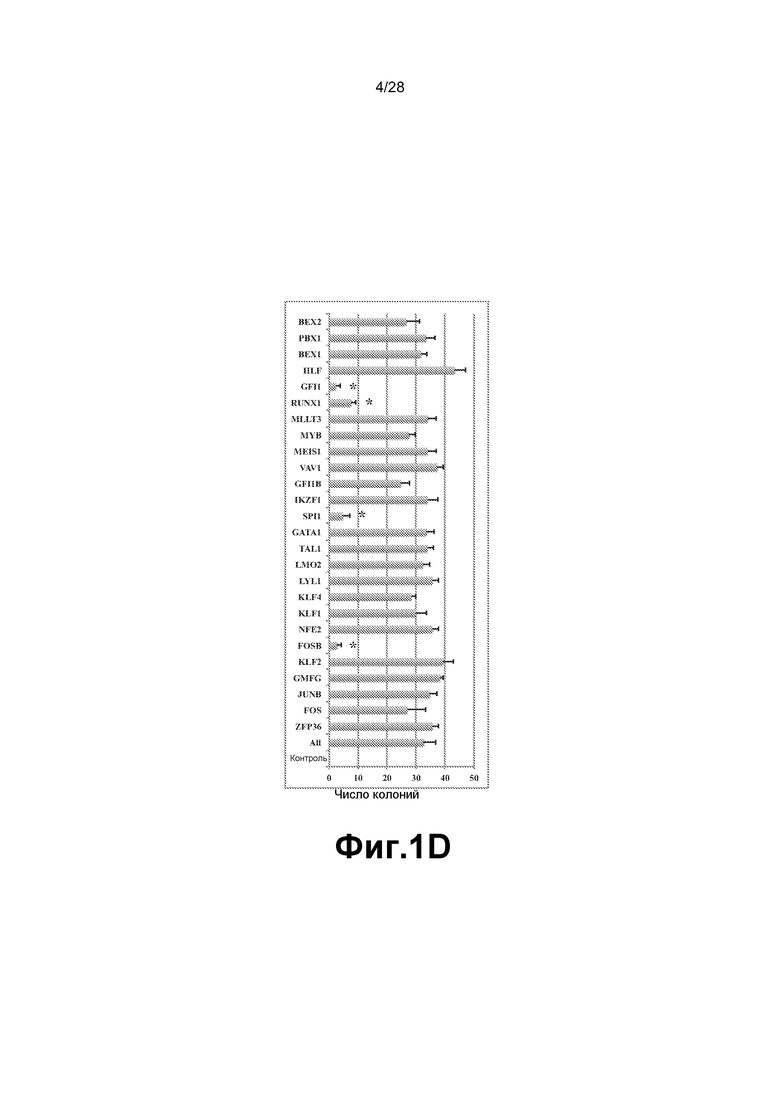
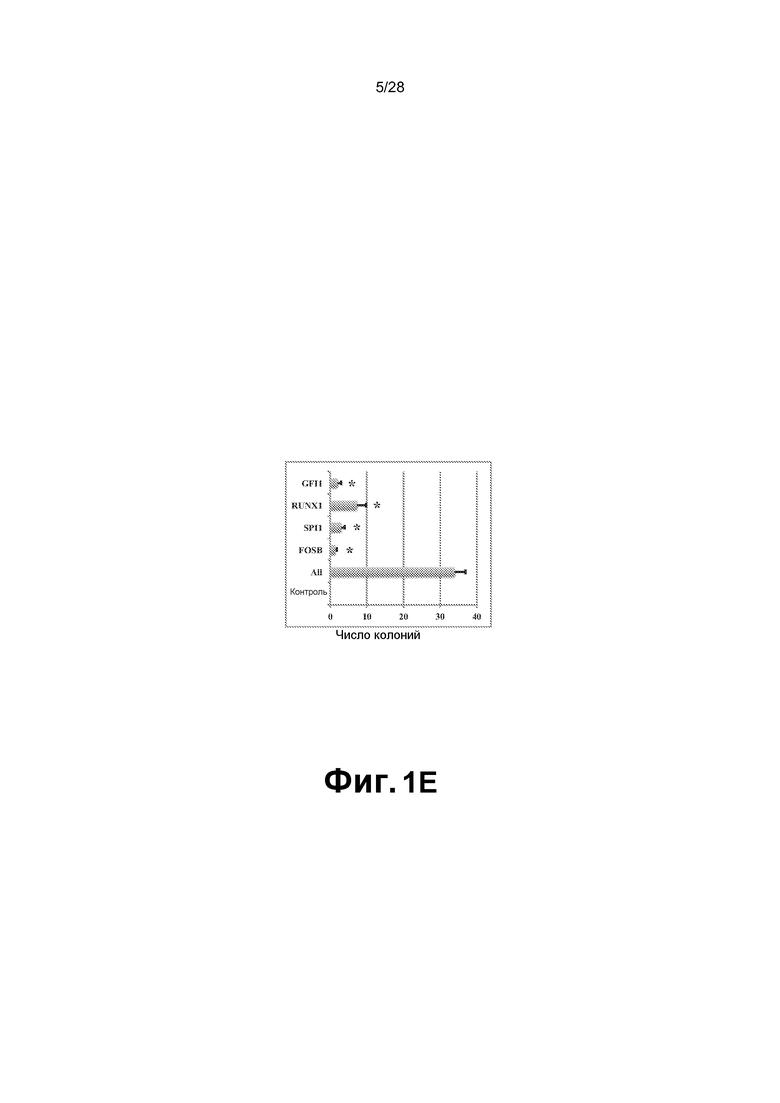
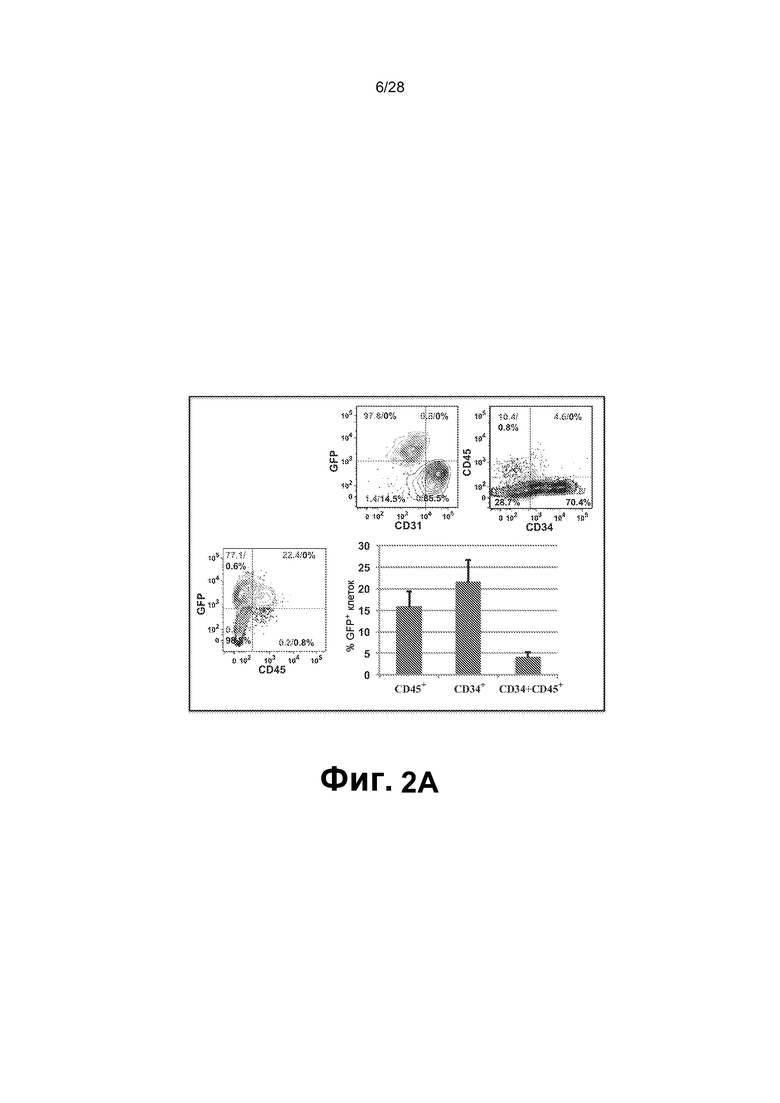
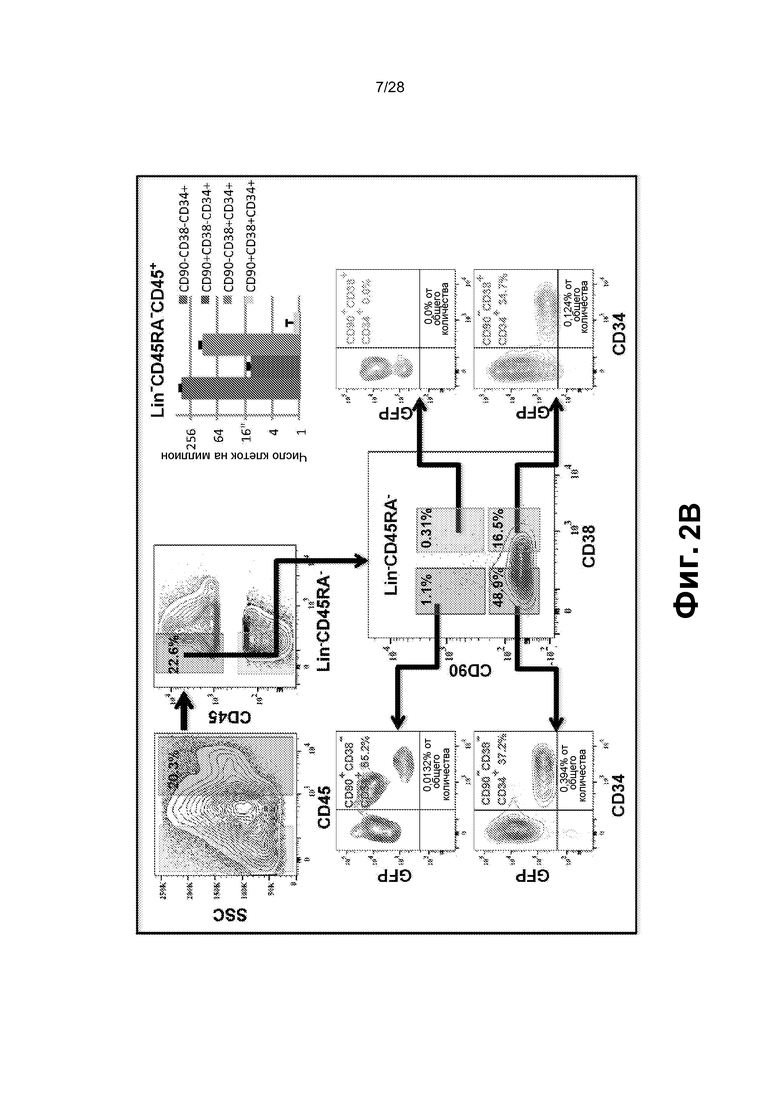
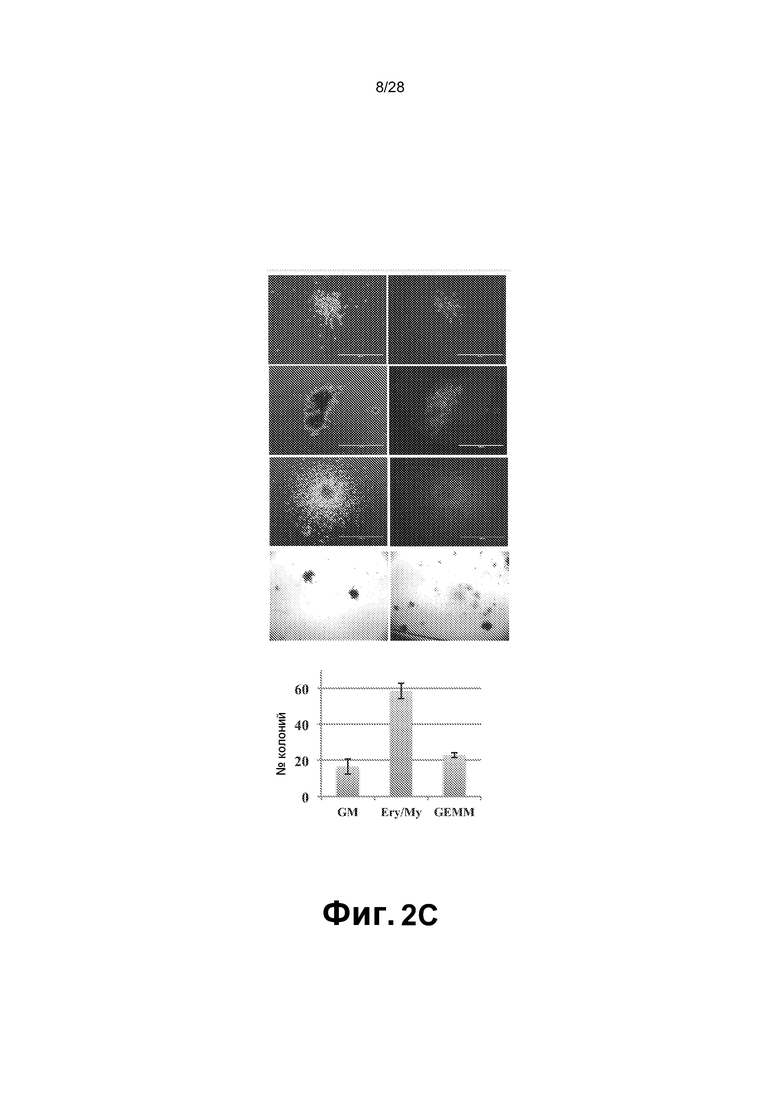

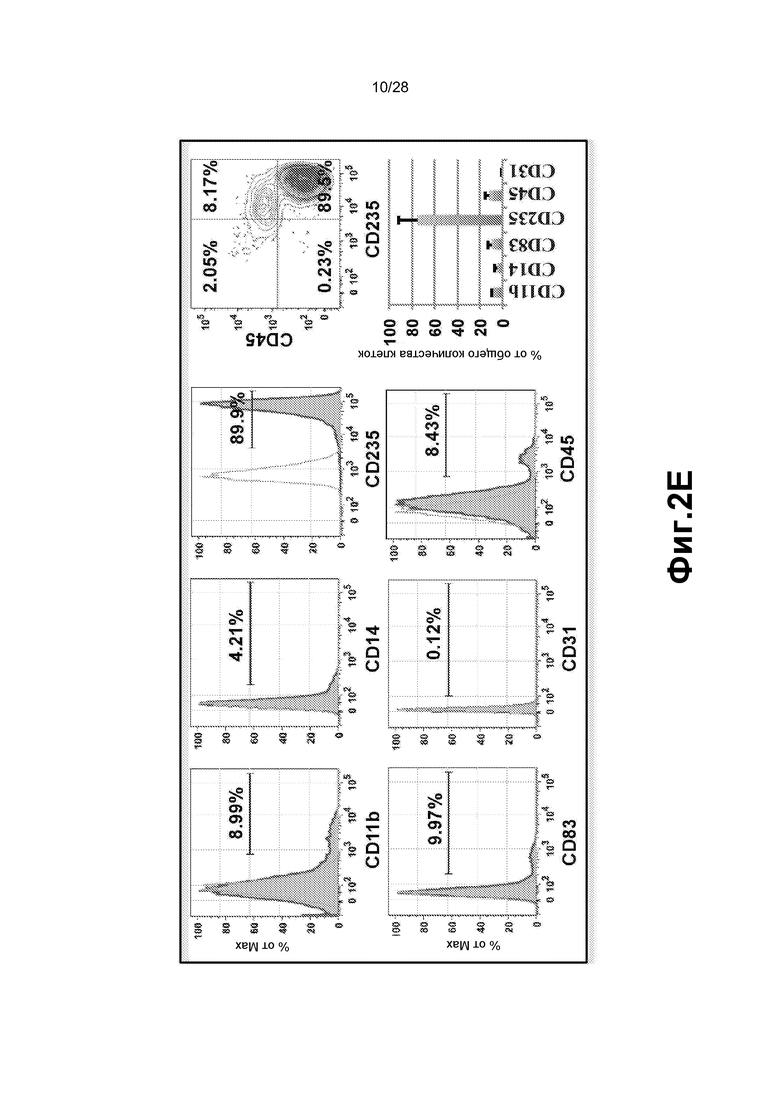
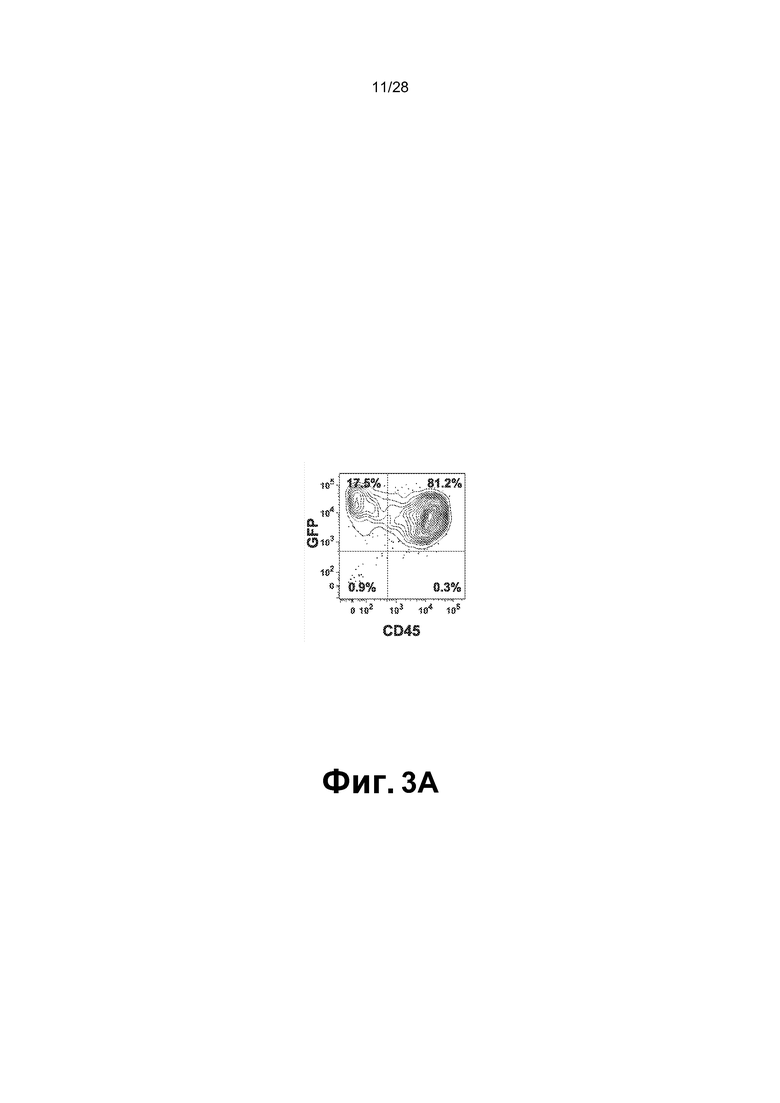

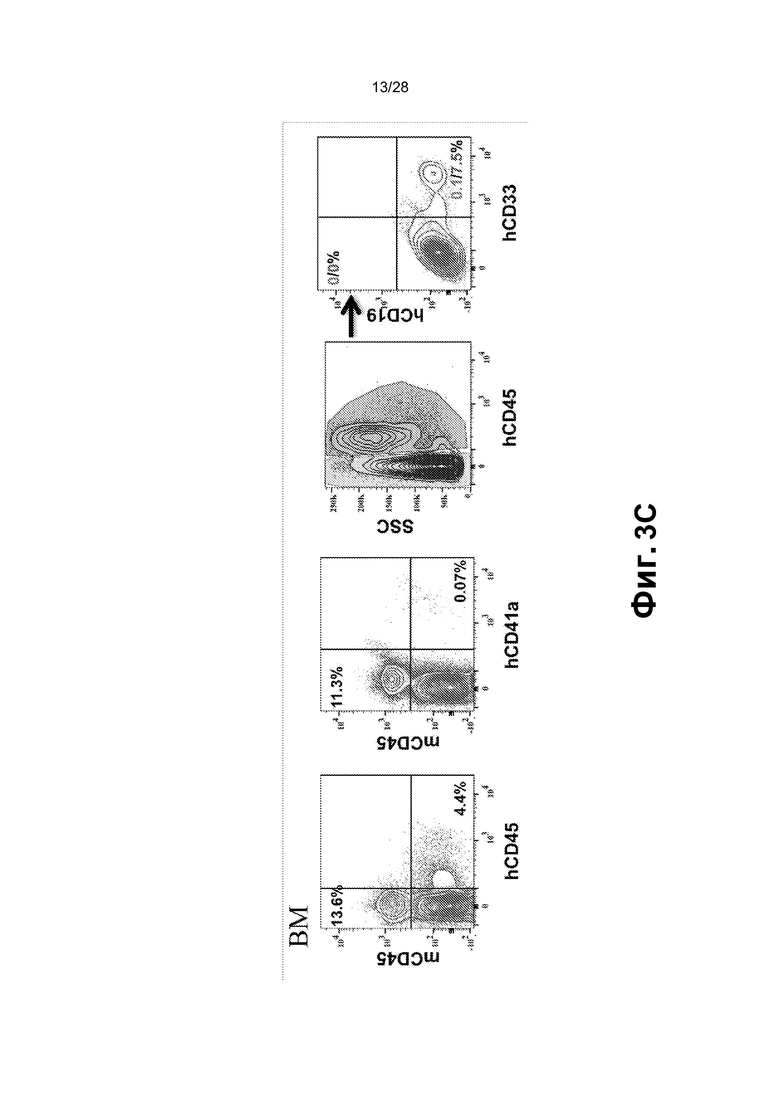
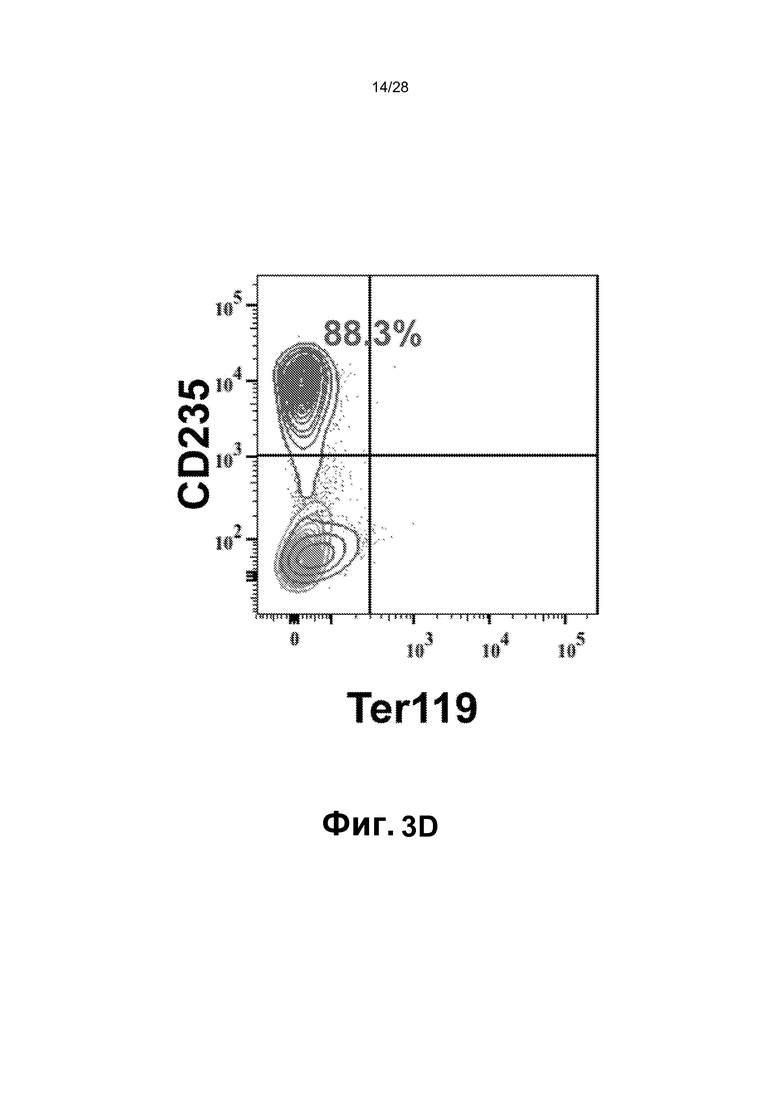
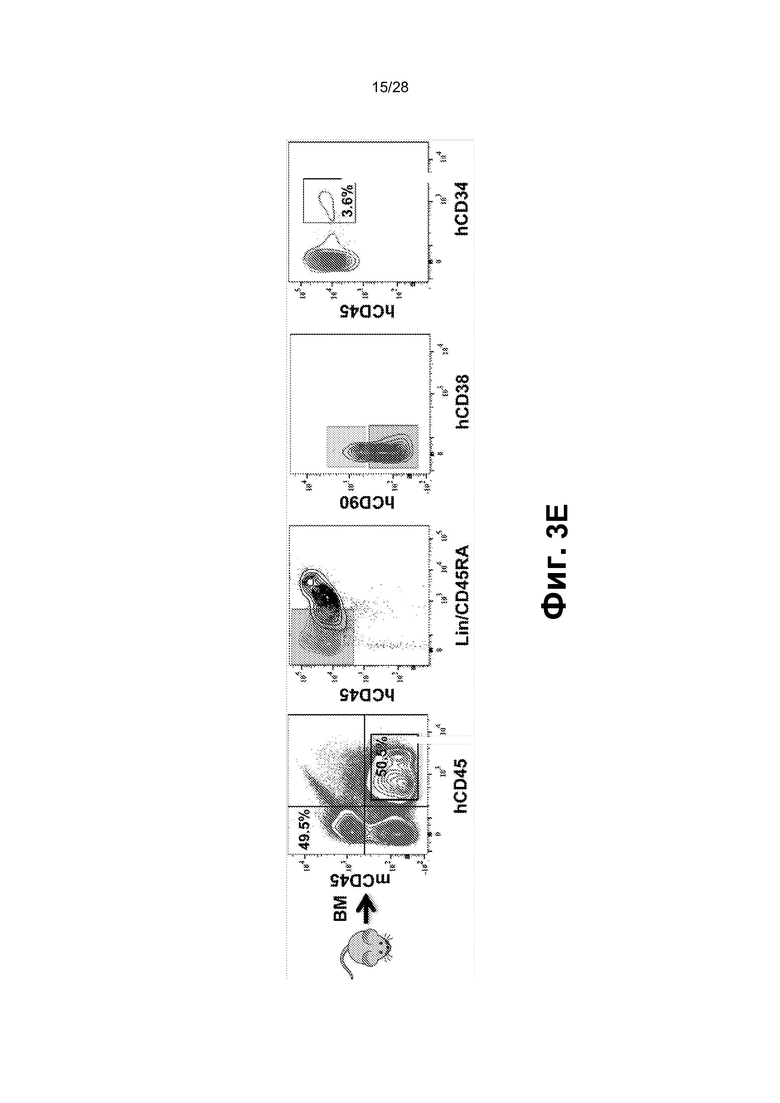

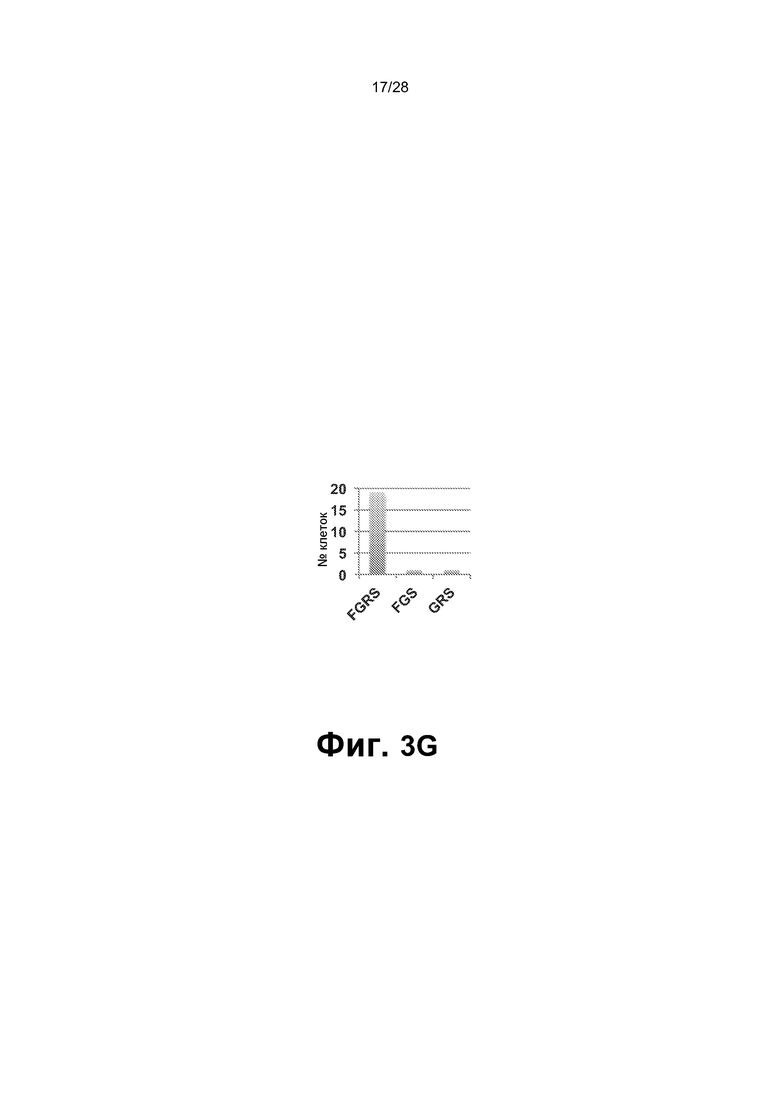
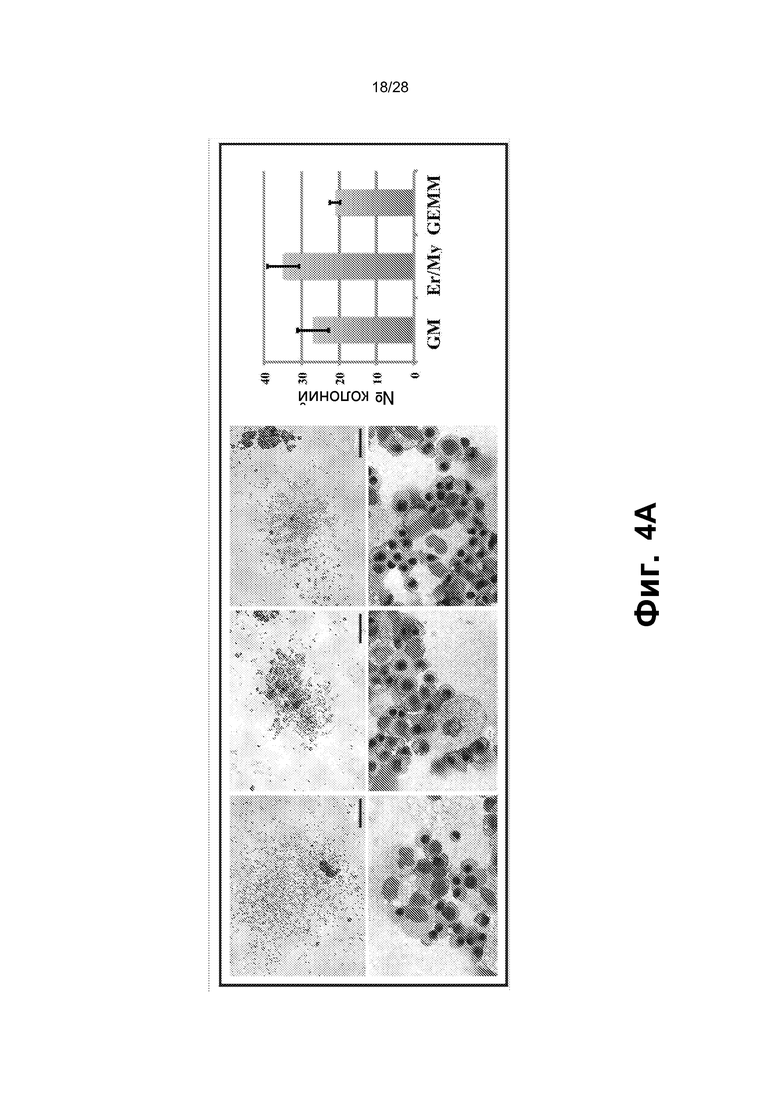
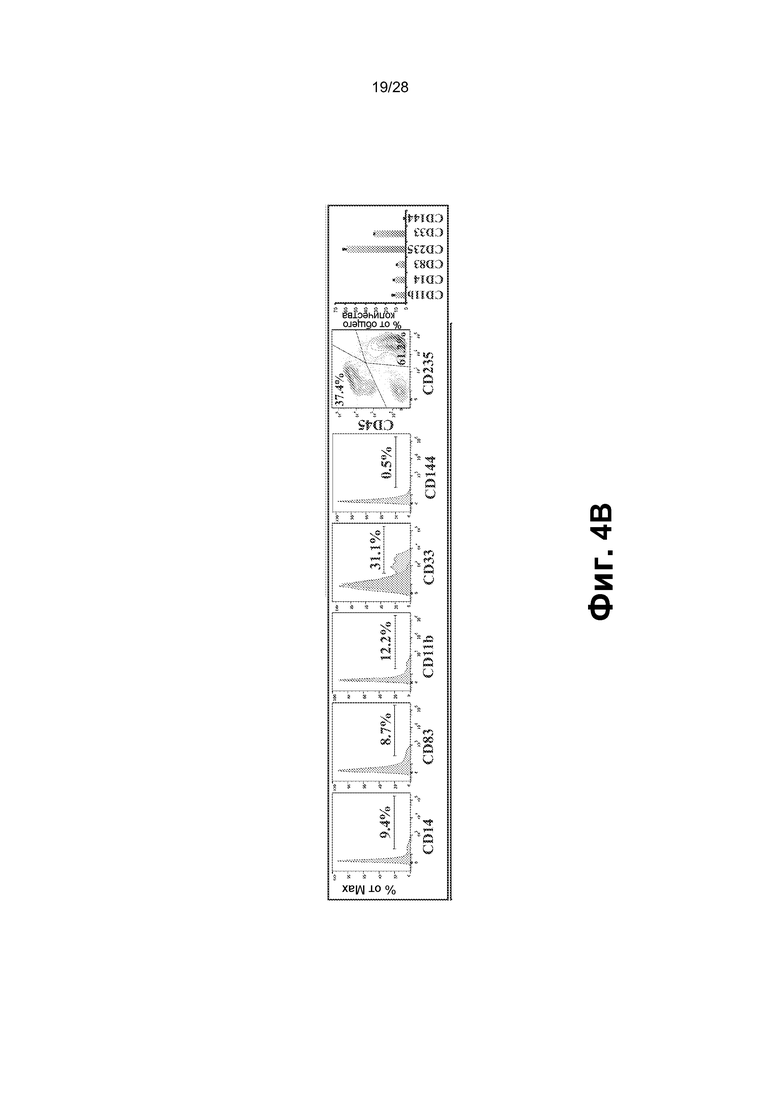
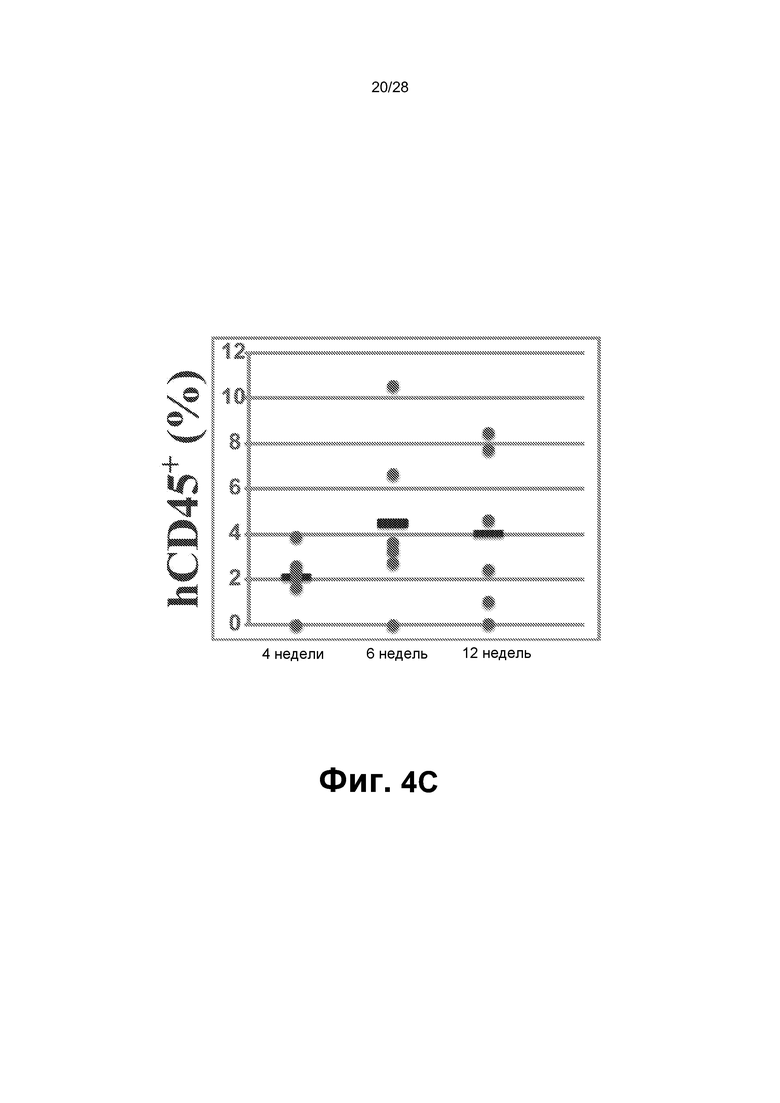
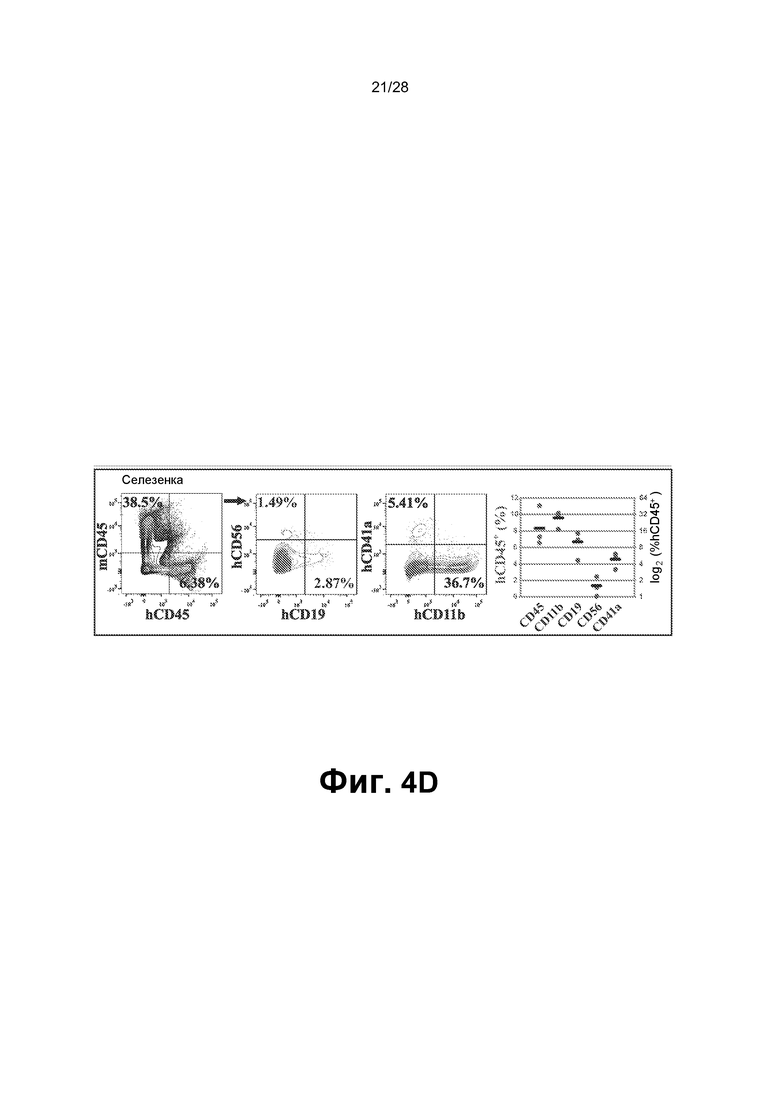
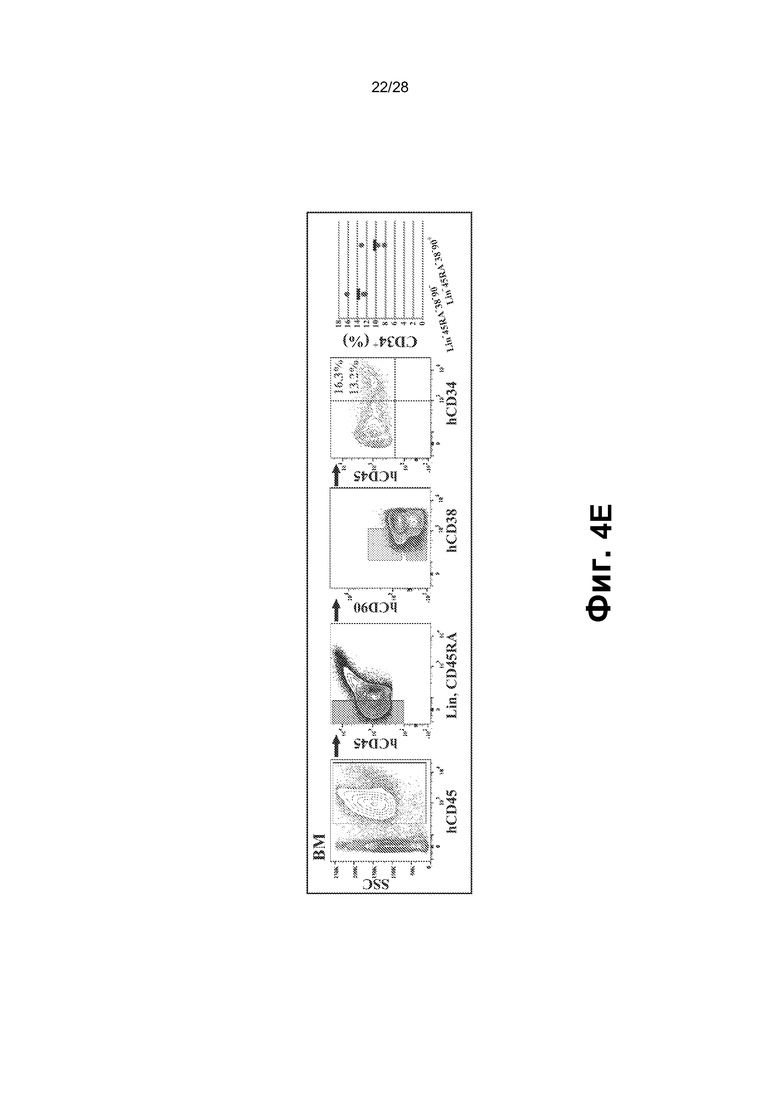
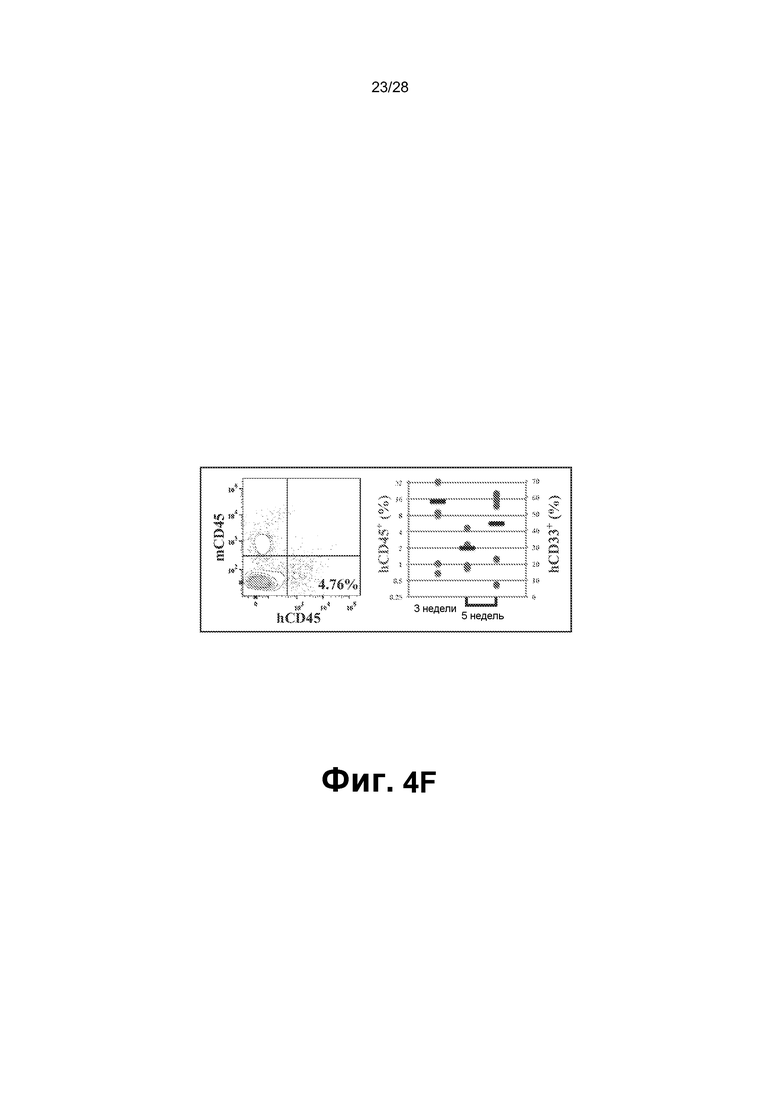
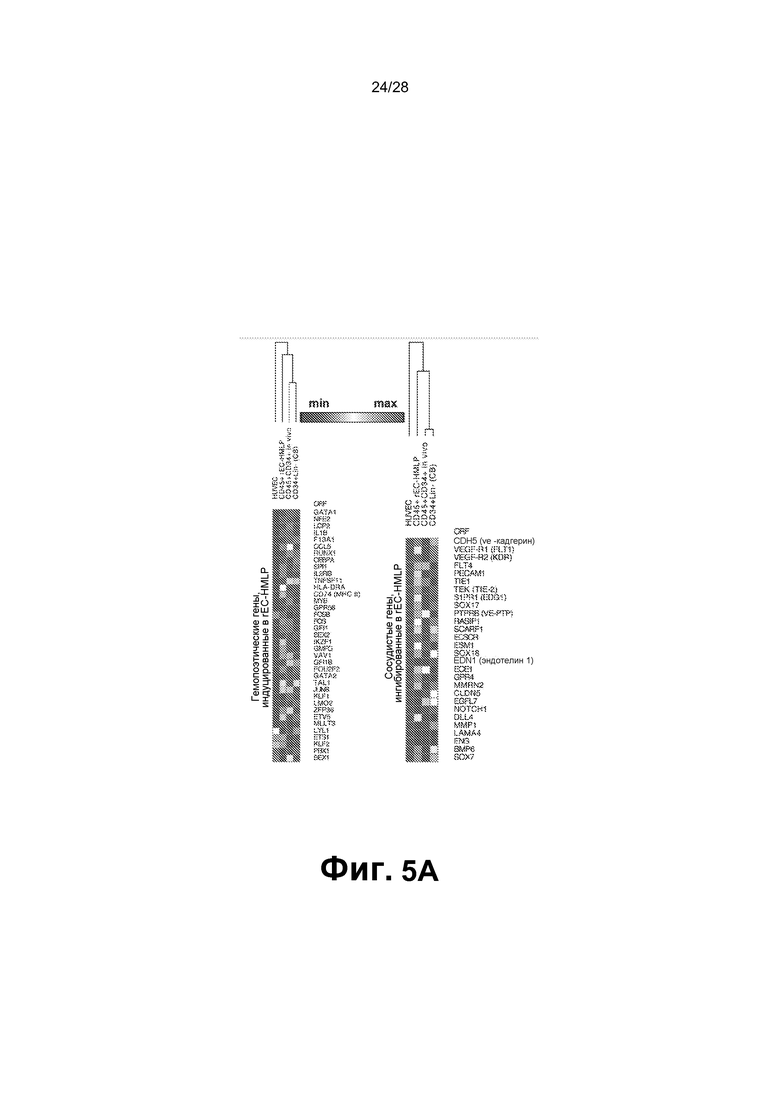
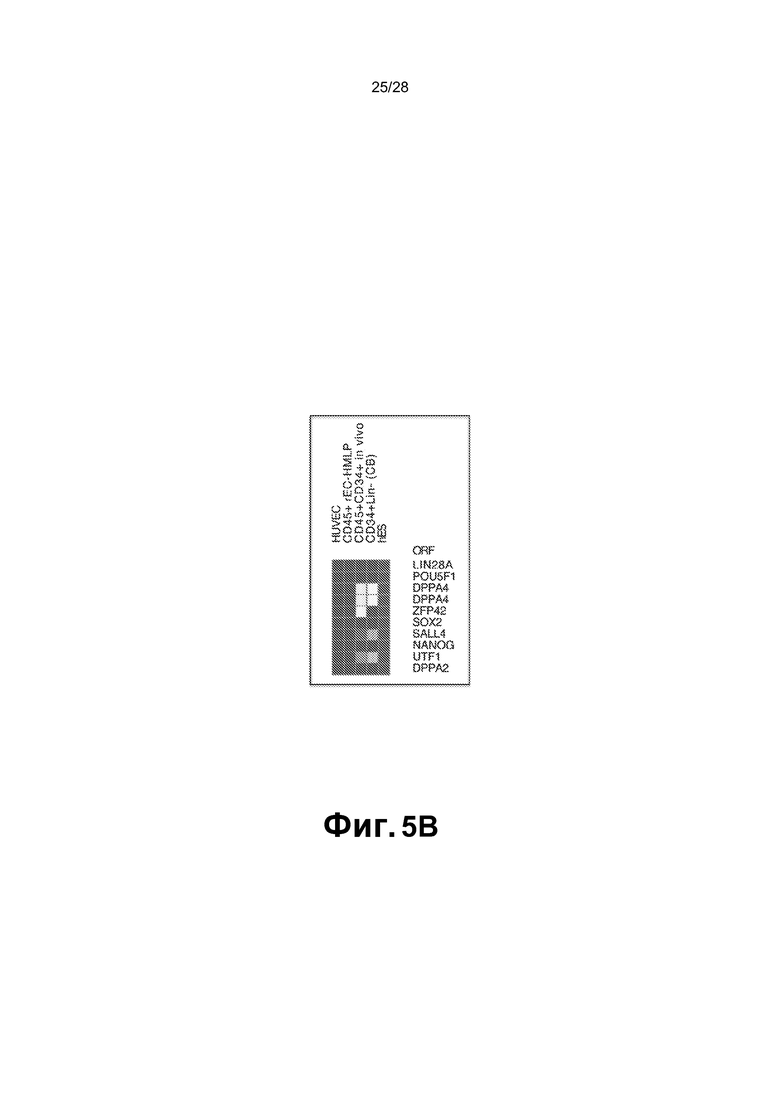

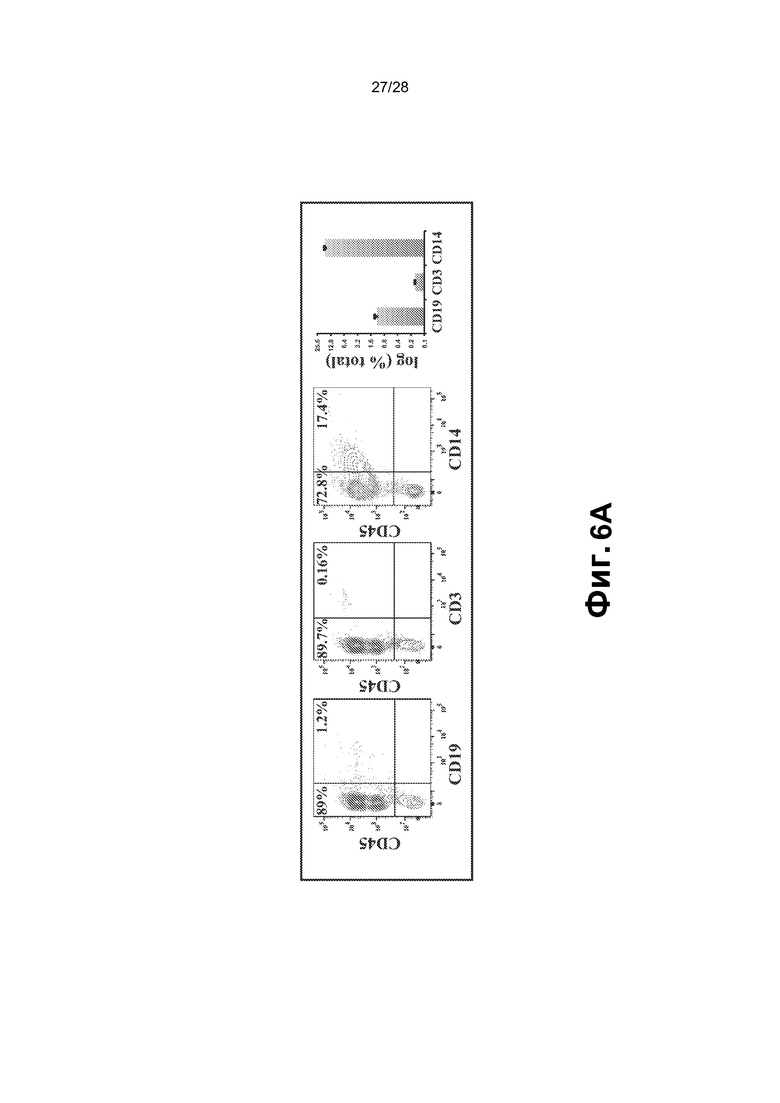

Изобретение относится к фармацевтической промышленности, а именно к способу получения гемопоэтических предшественников множественных линий дифференцировки (HMLP) из эндотелиальных клеток (EC). Способ получения HMLP человека из EC человека, включающий культивирование EC, трансдуцированных одним или более векторами, запускающими экспрессию каждого из факторов транскрипции: гомолог B вирусного онкогена остеосаркомы мыши Finkel-Biskis-Jinkins (FOSB) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности FOSB, независимый от факторов роста репрессор транскрипции 1 (GFI1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности GFI1, Runt-связанный фактор транскрипции 1 (RUNX1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности RUNX1, провирусный онкоген интеграции вируса, образующего очаги в селезенке, (SPI1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности SPI1, в бессывороточной гемопоэтической среде с эндотелиальными фидерными клетками, трансформированными для экспрессии либо гена открытой рамки считывания 1 E4 аденовируса (E4ORF1), либо гена Akt. Популяция HMLP для внутривенной инфузии пациенту с гемопоэтическим нарушением. Композиция для внутривенной инфузии пациенту с гемопоэтическим нарушением. Способ лечения гемопоэтического нарушения. Заявленный способ позволяет получить HMLP с содержанием смеси типов клеток, причем каждый тип клеток обладает обособленными клеточными маркерами и/или обособленным уровнем дифференцировки. 4 н. и 19 з.п. ф-лы, 28 ил., 1 табл.
1. Способ получения гемопоэтичских клеток-предшественников множественных ростков (HMLP) человека из эндотелиальных клеток (EC) человека, включающий культивирование EC, трансдуцированных одним или более векторами, запускающими экспрессию каждого из факторов транскрипции: гомолог B вирусного онкогена остеосаркомы мыши Finkel-Biskis-Jinkins (FOSB) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности FOSB, независимый от факторов роста репрессор транскрипции 1 (GFI1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности GFI1, Runt-связанный фактор транскрипции 1 (RUNX1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности RUNX1, провирусный онкоген интеграции вируса, образующего очаги в селезенке, (SPI1) или его функциональное производное, имеющее по меньшей мере 90% идентичности аминокислотной последовательности SPI1, в бессывороточной гемопоэтической среде с эндотелиальными фидерными клетками, трансформированными для экспрессии либо гена открытой рамки считывания 1 E4 аденовируса (E4ORF1), либо гена Akt.
2. Способ по п.1, где указанные EC выбраны из фетальных, неонатальных, взрослых EC или EC-предшественников.
3. Способ по п.2, где EC выбраны из эндотелиальных клеток пупочных сосудов человека (HUVEC) или взрослых эндотелиальных клеток микрососудов дермы человека (hDMEC).
4. Способ по п.1, где по меньшей мере один из указанных векторов дополнительно содержит селективный маркер.
5. Способ по п.4, где указанный селективный маркер представляет собой маркер устойчивости к антибиотику, ферментный маркер, эпитопный маркер или визуальный маркер.
6. Способ по п.4, где перед культивированием в присутствии эндотелиальных фидерных клеток проводят увеличение содержания EC с экспрессией FOSB, GFI1, RUNX1 и/или SPI1 путем селекции клеток, экспрессирующих по меньшей мере один селективный маркер.
7. Способ по п.1, где экспрессия одного или более из FOSB, GFI1, RUNX1 и SPI1 является индуцибельной.
8. Способ по п.1, где экспрессия одного или более из FOSB, GFI1, RUNX1 и SPI1 является временной.
9. Способ по п.1, где указанные HMLP могут продуцировать эритроидные, лимфоидные, миелоидные и мегакариоцитарные клетки.
10. Способ по п.1, дополнительно включающий выделение HMLP на основе селекции CD45+ клеток.
11. Способ по п.10, где HLMP представляют собой CD45+CD34+.
12. Способ по п.1, где HMLP включают клетки, которые представляют собой CD45+Lin-CD45RA-CD38CD90+CD34+ или CD45+Lin-CD45RA-CD38-CD90-CD34+.
13. Способ по п.1, где указанные HMLP могут дифференцироваться в гемогенные клетки после трансплантации реципиенту.
14. Способ по п.1, где указанные EC культивируют в течение по меньшей мере пяти суток для получения HMLP.
15. Способ по п.1, где указанная бессывороточная гемопоэтическая среда содержит bFGF, EGF, SCF, FLT3, TPO и IL-6.
16. Способ по п.15, где указанная среда дополнительно содержит IGF-1, IGF-2 и IL-3.
17. Способ по п.15, где указанная среда представляет собой среду для гемопоэтических стволовых клеток.
18. Популяция HMLP для внутривенной инфузии пациенту с гемопоэтическим нарушением, полученная способом по п.1.
19. Композиция для внутривенной инфузии пациенту с гемопоэтическим нарушением, содержащая HMLP, полученные способом по п.1, в фармацевтически приемлемом носителе.
20. Способ лечения гемопоэтического нарушения, включающий введение HMLP, полученных способом по п.1, индивидууму, нуждающемуся в этом.
21. Способ по п.20, где гемопоэтическое нарушение выбрано из лейкоза или лимфомы.
22. Способ по п.20, где указанные HMLP являются аутологичными для указанного реципиента.
23. Способ по п.20, где указанные HMLP не вызывают злокачественной трансформации у указанного реципиента.
| KAMONNAREE CHOTINANTAKUL ET AL, Hematopoietic Stem Cell Development, Niches, and Signaling Pathways//NE MARROW RESEARCH, vol | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| D WISNIEWSKI ET AL, Further phenotypic characterization of the primitive lineage- CD34+CD38-CD90+CD45RA- hematopoietic stem cell/progenitor cell sub-population isolated from cord blood, mobilized peripheral blood and patients with chronic myelogenous leukemia//LEUKEMIA., vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| MICHAL AMIT EN AL | |||
| Ротационный колун | 1919 |
|
SU227A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА (ВАРИАНТЫ) | 2008 |
|
RU2359030C1 |
| US 20080241171 А1, 02.10.2008. | |||
Авторы
Даты
2019-06-10—Публикация
2014-01-15—Подача