ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Настоящее изобретение поддержано Национальными институтами здоровья - грант NIH № CA103846-02. Правительство Соединенных Штатов Америки имеет определенные права на изобретение.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США с регистрационными No. 60/785968, озаглавленной «Способ модулирования роста гематопоэтических стволовых клеток», поданной 24 марта 2006 Leonard I. Zon и Trista E. North, которая включена в данное описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В описанных вариантах осуществления изобретения предлагаются модуляторы, которые либо увеличивают, либо уменьшают популяции гематопоэтических стволовых клеток in vitro, in vivo и ex vivo.
УРОВЕНЬ ТЕХНИКИ
Исследование стволовых клеток создает исключительную возможность для разработки способов терапии, которые могут изменить будущее людей, страдающих от таких заболеваний, как лейкоз, диабет и анемия. Многие исследования сфокусированы на изучении биологии стволовых клеток в качестве ключа к лечению заболеваний. Благодаря выяснению роли стволовых клеток в нормальном развитии исследователи стремятся собрать и направить природные возможности стволовых клеток на лечение многих состояний. В настоящее время исследования одновременно проводятся в ряде областей: исследование генетических и молекулярных пусковых механизмов, которые побуждают эмбриональные стволовые клетки к развитию в различные ткани; изучение того, как подтолкнуть такие клетки к делению и образованию специализированных тканей; культивирование эмбриональных стволовых клеток и разработка новых линий для работы с ними; поиск путей отмены или контроля болезни «трансплантат против хозяина» посредством устранения необходимости в донорах; и создание линии универсальных трансплантируемых клеток.
Гематопоэтические стволовые клетки (HSC) образуются во время эмбриогенеза в определенных областях, в которых специфичные явления индукции превращают мезодерму в стволовые клетки крови и клетки-предшественники. Сохраняется необходимость в выяснении взаимосвязей между конкретными биомолекулами, химическими агентами и другими факторами в указанных явлениях индукции. Например, сохраняется необходимость в идентификации того, какие биологические молекулы или химические агенты являются перспективными при обработке популяции HSC для достижения требуемой цели, такой как увеличение популяции HCS для исследования или терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Композиции и способы согласно вариантам осуществления настоящего изобретения относятся к модуляторам HCS, которые представляют собой средства, которые либо увеличивают количества HSC, либо уменьшают количества HSC, в зависимости от того, что является необходимым в случае конкретного симптома. Например, обнаружено, что модуляторы HSC, которые увеличивают количества HSC, включают простагландин E2 (PGE2) и агенты, которые стимулируют путь PGE2. Наоборот, модуляторы HSC, которые предотвращают синтез PGE2, уменьшают количества HSC.
В одном варианте предлагается способ стимулирования роста гематопоэтических стволовых клеток у субъекта, включающий в себя введение, по меньшей мере, одного модулятора гематопоэтических стволовых клеток (HSC) и фармацевтически приемлемого носителя.
В другом варианте модулятор HSC увеличивает количество HSC путем модификации пути простагландина. Модулятором HSC, который увеличивает популяции HCS посредством модификации простагландинового пути, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из PGE2, dmPGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Cay 1039, агониста рецептора PGE2 и производного любого из указанных агентов. В более конкретном варианте модулятором HSC является производное PGE2, выбранное из группы, состоящей из 16,16-диметил-PGE2, 19(R)-гидрокси-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16,16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, бутапроста, сульпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-PGE2, 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
В другом варианте модулятор HSC увеличивает количество HSC посредством модификации пути Wht. Модулятором HSC, который увеличивает популяции HCS посредством модификации пути wnt, может быть, по меньшей мере, соединение, выбранное из группы, состоящей из PGE2, dmPGE2, BIO, LiCl и производных указанных соединений.
В еще одном варианте модулятор HSC увеличивает количество HSC посредством модификации вторичного мессенджера cAMP/P13K/AKT. Модулятором HSC, который увеличивает популяции HCS посредством модификации вторичного мессенджера cAMP/P13K/AKT, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из 8-бром-cAMP, форсколина и производных указанных агентов.
В еще одном варианте модулятор HSC увеличивает популяции HCS посредством модификации вторичного мессенджера Ca2+. Модулятором HCS, который увеличивает популяции HCS посредством модификации вторичного мессенджера Ca2+, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из бапта-AM, фендилина, никардипина и производных указанных соединений.
В другом варианте модулятор HSC увеличивает популяции HSC посредством модификации передачи сигнала NO/ангиотензин. Модулятором HCS, который увеличивает популяции HCS посредством модификации передачи сигнала NO/ангиотензин, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из L-Arg, нитропруссида натрия, ванадата натрия, брадикинина и их производных.
В еще одном варианте модулятором HSC, который увеличивает популяции HCS, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из мебеверина, флурандренолида, атенолола, пиндолола, габоксадола, кинуреновой кислоты, гидралазина, тиабендазола, бикукллина, везамикола, перувосида, имипрамина, хлорпропамида, 1,5-пентаметилентетразола, 4-аминопиридина, диазоксида, бенфотиамина, 12-метоксидодеценовой кислоты, N-формил-Met-Leu-Phe, галламина, IAA 94, хлортрианизена и производных указанных соединений.
В другом варианте предлагается способ стимулирования роста HSC посредством контактирования возникающей популяции стволовых клеток, по меньшей мере, с одним соединением, выбранным из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Cay1039, агониста рецептора PGE2, 16,16-диметил-PGE2, 19(R)-гидрокси-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16,16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, бутапроста, сульпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-PGE2, 15(S)-15-метил-PGE2, 15(R)-15-метил-PGE2, BIO, 8-бром-cAMP, форсколина, бапта-AM, фендилина, никардипина, нифедипина, пимозида, строфантидина, ланатозида, L-Arg, нитропруссида натрия, ванадата натрия, брадикинина, мебеверина, флурандренолида, атенолола, пиндолола, габоксадола, кинуреновой кислоты, гидралазина, тиабендазола, бикукллина, везамикола, перувосида, имипрамина, хлорпропамида, 1,5-пентаметилентетразола, 4-аминопиридина, диазоксида, бенфотиамина, 12-метоксидодеценовой кислоты, N-формил-Met-Leu-Phe, галламина, IAA 94, хлортрианизена и их производных. Новообразованная популяция стволовых клеток может быть собрана из периферической крови, пуповинной крови, ворсин хориона, амниотической жидкости, плацентарной крови или костного мозга.
В другом варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, включающий инкубацию HSC в присутствии, по меньшей мере, одного модулятора HSC. В другом варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, включающий сбор образца источника HSC (например, периферической крови, пуповинной крови, амниотической жидкости, плацентарной крови, костного мозга, ворсинок хориона) и хранении образца в присутствии, по меньшей мере, одного модулятора HSC, такого как PGE2. В конкретном варианте предлагается набор, содержащий емкость, подходящую для хранения образца HCS-источника, при этом в емкость предварительно вносят, по меньшей мере, один модулятор HSC, который увеличивает количество HCS. В дополнительном варианте предлагается набор, содержащий емкость, подходящую для хранения образца источника HCS, и флакон, содержащий подходящее количество, по меньшей мере, одного модулятора HSC, который увеличивает количество HSC. В следующем варианте осуществления настоящего изобретения предлагается способ стимулирования размножения HSC ex vivo, в котором полученный источник HSC подвергают контакту с PGE2 или его производным при начальном сборе, во время обработки, при хранении, после оттаивания или во время трансфузии.
В другом варианте осуществления настоящего изобретения модулятор HSC ингибирует HSC посредством модификации простагландинового пути. Модулятором HSC, который ингибирует популяции HCS посредством модификации простагландинового пути, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из индометацина, фенбуфена, NS398, SC560, сулиндака, суксибузона, аспирина, напроксена, ибупрофена, целекоксиба, PGJ2, аристолохиевой кислоты, AH6809, AH23848 и их производных.
В другом варианте модулятор HSC ингибирует HSC посредством модификации пути Wnt. Модулятором HSC, который ингибирует популяции HCS посредством модификации пути Wnt, может быть, по меньшей мере, одно из средств, выбранное из группы, состоящей из ингибиторов простагландина, кенпауллона, вальпроевой кислоты или их производных.
В еще одном варианте осуществления настоящего изобретения модулятор HSC ингибирует HSC посредством модификации вторичного мессенджера cAMP/P13K/AKT. Модулятором HSC, который ингибирует популяции HCS посредством модификации вторичного мессенджера cAMP/P13K/AKT, может быть одно или несколько соединений, выбранных из группы, состоящей из PD98059, KT5720, H89, U0126, вортманнина и их производного.
В другом варианте модулятор HSC ингибирует HSC посредством модификации вторичного мессенджера Ca2+. Модулятором HSC, который ингибирует популяции HCS посредством модификации вторичного мессенджера Ca2+, может быть, по меньшей мере, одно средство, выбранное из группы, состоящей из BayK-8644, тиоридазина и производного таких средств.
В еще одном варианте модулятор HSC ингибирует HSC посредством модификации передачи сигнала NO/ангиотензина. Модулятором HSC, который ингибирует популяции HCS посредством модификации передачи сигнала NO/ангиотензина, может быть, по меньшей мере, одно соединение, выбранное из группы, состоящей из L-NAME, эналаприла, каптоприла, AcSDKP, лозартана, AcSDKP, лозартана, телимазартана, гистамина, амброксола, хризина, циклогексимида, метиленового синего, эпинефрина, дексаметазона, проадифена, бензилизотиоцианата, эфедрина и их производных.
В дополнительном варианте осуществления изобретения модулятором HSC, который ингибирует популяции HCS, является, по меньшей мере, одно соединение, выбранное из группы, состоящей из парагилина, пропранолола, этанидазола, метимазола, циноксацина, пеницилламина, фуросемида, эбурнамининона, акларубицина, варфарина, гамма-аминомасляной кислоты, норэтиндрона, лупинидина, гидрохинидина, тодралазина, метоксамина, гидроксимочевины, дигидроэрготамина, антазолина, 3-нитропропионовой кислоты, N-фенилантраниловой кислоты, феназопиридина, дихлоркинуреновой кислоты, 3-эстрадиола, L-Leu, феноксибензамина, мефентермина, гувацина, гвайзулена, имидазола, бета-каротина, клофибрата и производных указанных соединений.
В еще одном варианте предлагается способ ингибирования роста HSC у субъекта, включающий введение, по меньшей мере, одного модулятора HSC и фармацевтически приемлемого носителя. В конкретном варианте модулятором HSC является одно или несколько из соединений, выбранных из группы, состоящей из индометацина, целекоксиба, фенбуфена, простагландина J2, суксибузона, сулиндака и их производных.
В другом варианте предлагается способ снижения роста HSC посредством осуществления контакта новообразованной популяции стволовых клеток, по меньшей мере, с одним соединением, выбранным из группы, состоящей из индометацина, фенбуфена, NS398, SC560, сулиндака, суксибузона, аспирина, напроксена, ибупрофена, целекоксиба, PGJ2, аристолохиевой кислоты, AH6809, AH23848, кенпауллона, вальпроевой кислоты, PD98059, KT5720, H89, U0126, вортманнина, BayK-8644, тиридазина, L-NAME, эналаприла, каптоприла, AcSDKP, лозартана, AcSDKP, лозартана, телимазартана, гистамина, амброксола, хризина, циклогексимида, метиленового синего, эпинефрина, дексаметазона, проадифена, бензилизотиоцианата, эфедрина, парагилина, пропранолола, этанидазола, метимазола, циноксацина, пеницилламина, фуросемида, эбурнамининона, акларубицина, варфарина, гамма-аминомасляной кислоты, норэтиндрона, лупинидина, гидрохинидина, тодралазина, метоксамина, гидроксимочевины, дигидроэрготамина, антазолина, 3-нитропропионовой кислоты, N-фенилантраниловой кислоты, феназопиридина, дихлоркинуреновой кислоты, 3-эстрадиола, L-Leu, феноксибензамина, мефентермина, гувацина, гвайзулена, имидазола, бета-каротина, клофибрата, антагониста рецептора PGE2 и производных указанных соединений.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлена схема скрининга химических веществ, которые влияют на стволовые клетки в AGM, с использованием эмбрионов рыб данио.
Фиг. 2A и 2B относятся к агонистам и антагонистам простагландина, которые изменяют экспрессию runx1/cmyb, не влияя при этом на развитие сосудов. На фиг. 2A показаны профили экспрессии на микроматрице отсортированных с помощью FACS популяций клеток, выделенных во время примитивного (gata1 и Imo2) и дефинитивного (Imo2 и cd41) гематопоэза. Показана относительная экспрессия ЦОГ-1 (светло серый) и ЦОГ-2 (темно-серый) в каждой отсортированной фракции GFP+ по сравнению с клетками GFP-. На фиг. 2B показаны профили кПЦР эндотелиальной и HSC-специфичной экспрессии генов после воздействия dmPGE2 длительного действия (10 мкм, второй столбик в каждой комбинации из трех столбиков, темно серый) или неспецифичного ингибитора ЦОГ индометацина (10 мкМ, третий из трех столбиков) по сравнению с контролем (первый из трех столбиков). Обе обработки приводили к статистически значимым отличиям от контролей в случае каждого исследуемого гена (ANOVA, p<0,05, n=8).
На фиг. 3 изображены данные, показывающие, что агонисты и антагонисты простагландина изменяют экспрессию runx1/cmyb, полученные при количественном анализе HSC в бигенных эмбрионах рыб данио, выявляемых конфокальной микроскопией: ДМСО 23,3±5,0 (среднее±SD), dmPGE2 (10 мкМ 38,0±2,2, индометацин (10 мкМ) (ANOVA, p<0,00001, n=10/обработку).
На фиг. 4A и 4B показано, что обработка dmPGE2 усиливает восстановление гематопоэтических клеток у сублетально облученных взрослых особей данио. Проводили эксперименты по восстановлению после облучения целого мозгового вещества данио. Звездочками (*) указаны статистически значимые различия: *=50 мкМ по сравнению с контролем, **=50 мкМ по сравнению с 10 мкМ, и 50 мкМ по сравнению с контролем, ***=все переменные значимы (ANOVA, p<0,05, n=15/переменную). На фиг. 4A показаны типичные профили FACS FSC/SSC гематопоэтических линий клеток в KM в 0, 4, 7, 10 и 14 день восстановления после облучения у обработанных ДМСО и обработанных dmPGE2 (50 мкМ) данио. На фиг. 4B показана кинетика восстановления в KM клеток-предшественников, лимфоидных и миелоидных клеток у контрольных рыб (треугольники) и рыб, обработанных dmPGE2 (квадраты, 10 мкМ; кружки, 50 мкМ).
На фиг. 5A и 5B изображено модулирование пути PG, которое изменяет экспрессию связанных с HSC генов и восстановление у сублетально облученных взрослых рыб данио. На фиг. 5A показано влияние обработки dmPGE2 на маркеры стволовых клеток и эндотелиальных клеток, которое измеряли с помощью кПЦР на целых KM, выделенных на третий день после облучения. Звездочками (*) указано статистически значимое различие (двухсторонний t-критерий, n=15, runx1: p=0,0001; Imo2: p=0,014; fli1: p=0,049). На фиг. 5B изображено влияние ингибирования ЦОГ-1 (SC560, 10 мкМ) и ЦОГ-2 (NS398, 10 мкМ) на восстановление после облучения (n=5/обработку). В случае рыб, обработанных SC560 или NS398, нельзя было провести анализ на четырнадцатый день вследствие повышенной гибели у указанных группах обработки.
На фиг. 6A и 6B показано, что dmPGE2 модулирует количество колоний и дифференцировку гематопоэтических клеток в ES клетках мышей. Осуществляли анализы образования колоний ES-клеток на M3434 и OP9; количества указаны на 100000 посеянных клеток. Столбиками указаны ES-клетки с контрольной обработкой и ES-клетки, обработанные возрастающими дозами dmPGE2 (10 мкМ, 20 мкМ, 100 мкМ) или обработанные индометацином (10 мкМ, 100 мкМ). Звездочкой (*) указано статистически значимое различие (двухсторонний t-критерий, n=5/переменную). Фиг. 6 A: Влияние возрастающих доз dmPGE2 и ингибирования активности циклооксигеназы индометацином на гематопоэтическую дифференцировку в метилцеллюлозе; показаны количества колоний дефинитивных эритроидных клеток (E), смешанных гранулоцитов/моноцитов (GM) и мультипотентных (GEMM) предшественников (10 мкМ dmPGE2: GM p=0,005, GEMM p=0,017; 20 мкМ dmPGE2: dE p=0,04, GM p=0,007, GEMM 0,016; 100 мкМ индометацина: GM p=0,024). Фиг. 6B: Влияние dmPGE2 и индометацина на количество гематопоэтических колоний на OP9 (20 мкМ: p=0,047).
На фиг. 7A и 7B изображено влияние PGE2 на количество колоний. Более конкретно фиг. 7A и 7B иллюстрируют dmPGE2-опосредованную (10 мкМ) защиту образования колоний от ингибирования индометацином (100 мкМ) в анализах в (A) метилцеллюлозе и (B) OP9.
На фиг. 8A-8F показано, что воздействие на BM мышей dmPGE2 увеличивает количество CFU-S и репопулирующих HSC. Звездочками (*) указано статистически значимое различие. Фиг. 8A и 8B: Влияние обработки ex vivo WBM (2 часа на льду) контрольным EtOH или dmPGE2 (1 мкМ/106 клеток) на CFU-S8 и CFU-S12 (60000 клеток/реципиент; CFU-S12: двухсторонний t-критерий, n=10, p<0,0001). Фиг. 8С: Влияние на CFU-S12 после обработки ex vivo индометацином (1 мкМ/106 клеток) (100000 клеток/реципиент; двухсторонний t-критерий, n=10, p=0,0002). Фиг. 8D: Оценка CFU-S12 после обработки стволовых клеток ckit+sca1+lineage-dmPGE2 или контрольным EtOH (двухсторонний t-критерий, 100 клеток: n=10, p=0,013; 300 клеток: p=0,0003). Фиг. 8E и 8F: Анализ конкурентного репопулирования при лимитирующем разведении. Количество негативных реципиентов, которое определяли в FACS-анализе (e) относительно общего количества трансплантированных клеток в случае контрольных (квадраты) или dmPGE2-обработанных (кружки) образцов клеток показаны через 12 недель. Частота приживления трансплантата (панель F) через 6, 12 и 24 недели после трансплантации у реципиентов обработанных EtOH по сравнению с dmPGE2-обработанными WBM, рассчитанная с использованием статистики Пуассона (ANOVA, n=10/переменную, 6 недель: p=0,005; 12 недель: p=0,002; 24 недели: p=0,05); количество реципиентов, выживших к моменту анализа в каждой временной точке, показано в Таблице 6 - Таблице 8.
На фиг. 9A-9N изображены данные, показывающие, что при воздействии на BM мышей dmPGE2 увеличивается масса селезенки и приживление трансплантатов HSC. Фиг. 9A и 9B: Влияние обработки ex vivo WBM и изолированных HSC контрольным EtOH или dmPGE2 на массу селезенки на (a) восьмой день и (b) двенадцатый день (двухсторонний t-критерий, CFU-S8: n=5, p=0,339; CFU-S12: n=9, p<0,00001). Фиг. 9C: Масса селезенки после обработки индометацином (зеленые) по сравнению с контролем (двухсторонний t-критерий: n=10, p=0,00026). Фиг. 9D: количество колоний в селезенке после обработки dmPGE2 клеток KSL (двухсторонний t-критерий, 100 клеток: n=4, p=0,0013; 300 клеток: n=5, p=0,009). Фиг. 9E: Типичные графики FACS, иллюстрирующие уровни приживления трансплантатов CD45.1 (верхний левый квадрант) у реципиентов контрольных и обработанных dmPGE2 клеток BM. Фиг. 9F-9J: Средний химеризм (F, H, I) и рассчитанная частота приживления трансплантатов (фиг. 9G и 9J) у реципиентов dmPGE2-обработанного WBM (кружки) по сравнению с контролем (квадраты). Фиг. 9K и 9L: Влияние обработки ex vivo WBM ингибиторами ЦОГ-1 (SC560, 10 мкМ) и ЦОГ-2 (NS398, 10 мкМ) в анализе CFU-S12 на количество колоний (парный t-критерий, n=10, SC560 p=0,00016, NS398 p<0,00001) и массу селезенки (парный t-критерий, n=10, SC560 p=0,025, NS398 p=0,00075). Фиг. 9M и 9N: Количества лейкоцитов в периферической крови (14 день после обработки) и костном мозге (16 день после обработки) после повреждения костного мозга 5-FU; воздействие in vivo SC560 или NS398 значимо ингибировало восстановление лейкоцитов, тогда как dmPGE2 увеличивал количества лейкоцитов.
На фиг. 10 представлена диаграмма пути передачи сигнала Wnt.
На фиг. 11A и 11B изображены данные о том, что модулирование активности wnt влияет на гомеостаз во взрослом организме. На фиг. 11A показана схема анализа с использованием облучения; на фиг. 11B показан FACS-анализ цельного мозгового вещества почек на десятый день после облучения у взрослых животных wt, hs:wnt8, hs:dkk и hs:dnTCF.
На фиг. 12 показана основанная на кПЦР количественная оценка изменений активности wnt в развивающемся эмбрионе, вызванных передачей сигнала простагландина, в анализе Top:dGFP in vivo.
На фиг. 13 представлена модель, изображающая вероятные точки взаимодействия путей PG и wnt. (1) PGE2 не может спасать dkk, axin, dnTCF; индометацин не может блокировать wnt8. (2) PGE2 спасает dkk, но не axin и dnTCF; индометацин может блокировать wnt8; PGE2 спасает dkk и axin, но не dnTCF; индометацин может блокировать wnt8. (4) PGE2 спасает dkk, axin и dnTCF; индометацин может блокировать wnt8.
На фиг. 14 показан процент GFP-позитивных клеток в мозговом веществе почек взрослых животных Top:dGFP на третий день после облучения и обработки dmPGE2 или индометацином.
ПОДРОБНОЕ ОПИСАНИЕ
Если не оговорено особо, научные и технические термины, используемые в связи с настоящей заявкой будут иметь значения, которые обычно подразумеваются специалистами в данной области. Кроме того, если иное не указано в контексте, то формы единственного числа будут включать формы множественного числа, а формы множественного числа будут включать формы единственного числа.
Следует понимать, что настоящее изобретение не ограничено конкретной методикой, протоколами и реагентами и т.д., указанным в данном описании, и могут варьировать. Терминология использована в данном описании только в целях описания конкретных вариантов и не предназначена для ограничения объема настоящего изобретения, который определен только формулой изобретения.
Кроме случаев рабочих примеров или случаев, когда указанно иное, все числа, выражающие количества ингредиентов или условия реакции, используемые в данном описании, следует понимать во всех остальных случаях как определяемые термином «примерно». Термин «примерно» при использовании в связи с процентным содержанием может означать ± 1%.
Все патенты и другие указанные публикации специально включены в данное описание в виде ссылки в целях описания и раскрытия, например, методики, описанной в таких публикациях, которая может быть использована в настоящем изобретении. Такие публикации предлагаются только в отношении раскрытия уровня техники до даты подачи настоящей заявки. В этом отношении их не следует рассматривать как допущение того, что авторы изобретения не имеют права датировать более ранним числом такое раскрытие на основании предшествующего изобретения или по какой-либо другой причине. Все утверждения в отношении даты или изложение содержания таких документов основано на информации, доступной заявителям, и не являются признанием корректности дат или содержания таких документов.
Гомеостаз гематопоэтических стволовых клеток (HSC) строго контролируется факторами роста, передающими сигналы молекулами и факторами транскрипции. Дефинитивные HSC, получаемые во время эмбриогенеза в области аорто-гонадного мезонефроса (AGM), впоследствии колонизируют нишу в гематопоэтических органах плода и взрослого организма. Dzierzak, 12 Curr. Opin. Hematol. 197-202 (2004); Galloway and Zon, 53 Curr. Top. Devel. Biol. 139-58 (2003).
В настоящем изобретении предлагаются способы модулирования роста и обновления HSC in vitro, in vivo или ex vivo. Способ включает осуществление контакта новообразованной популяции стволовых клеток, по меньшей мере, с одним модулятором HSC. Такая популяция может находиться в периферической крови, пуповинной крови, костном мозге, амниотической жидкости, ворсинах хориона, плаценте или других гематопоэтических нишах стволовых клеток. В одном варианте осуществления изобретения предлагаются способы стимулирования роста гематопоэтических стволовых клеток и восстановления популяции клеток. В другом варианте осуществления изобретения предлагаются способы ингибирования роста гематопоэтических стволовых клеток и восстановления популяции клеток.
Настоящее изобретение частично основано на открытии того, что PGE2 и агенты, которые усиливают синтез PGE2, вызывают увеличение количества HSC. Наоборот, агенты, которые блокируют синтез PGE2, уменьшают количество HSC. В этой связи агенты, влияющие на синтез PGE2, можно считать модуляторами HSC. Например, циклооксигеназы (ЦОГ), ответственные за синтез PGE2, могут быть необходимы для образования HSC. Кроме того, сосудорасширяющие средства стимулируют размножение HSC, наоборот, сосудосуживающие средства уменьшают количество HSC. Например, гидралазин, противогипертоническое сосудорасширяющее средство, увеличивает количество HSC, тогда как фенбуфен, нестероидное противовоспалительное сосудосуживающее лекарственное средство уменьшает количество HSC. Соответственно, такие средства также считаются модуляторами HSC.
В используемом в данном описании смысле модуляторы HSC могут либо стимулировать, либо ингибировать рост и восстановление HSC. Модуляторы HSC влияют на количество HSC в популяции клеток. Модуляторы HSC влияют на размножение HSC в культуре (in vitro), во время кратковременной инкубации (ex vivo) или in vivo. Смотри Таблицу 1 ниже. Модуляторы HSC, которые увеличивают количество HSC, включают средства, которые осуществляют повышающую регуляцию синтеза PGE2. Увеличение количества HSC может составлять увеличение примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более по сравнению с количеством HSC, имеющимся у субъекта до обработки.
Модуляторы HSC, которые вызывают уменьшение количества HSC, осуществляют понижающую регуляцию синтеза PGE2 и/или стимулируют сужение кровеносных сосудов. Смотри, например, Таблицу 2 ниже. Уменьшение количества HSC может представлять собой уменьшение примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более по сравнению с количеством HSC, имеющимся у субъекта до обработки. Количества HSC можно оценить по уменьшению симптомов заболевания, например, повышенному количеству тромбоцитов, повышенному гематокриту, при этом количество тромбоцитов или гематокрит увеличиваются примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более. Влияние количества HSC можно оценить по ослаблению симптомов заболевания, например, повышенному количеству тромбоцитов, повышенному гематокриту, при этом количество тромбоцитов или гематокрит увеличиваются примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 90%, примерно на 100%, примерно на 150%, примерно на 200% или более.
В одном варианте PGE2 или dmPGE2 используют в качестве модуляторов HSC, чтобы увеличить популяцию HSC.
Модуляторы HSC согласно настоящему изобретению также включают производные модуляторов HSC. Производные в используемом в данном описании смысле включают химически модифицированное соединение, при этом предполагается, что модификация является стандартной для специалиста в области химии, такая как дополнительные химические остатки (например, сложный эфир или амид кислоты, защитные группы, такие как бензильная группа в случае спирта или тиола и трет-бутоксикарбонильная группа для амина). Производные также включают радиоактивно меченые модуляторы HSC, конъюгаты модуляторов HSC (например, с биотином или авидином, с ферментами, такими как пероксидаза хрена и тому подобные, с биолюминсцентными агентами, хемилюминесцентными агентами или флуоресцирующими агентами). Кроме того, к модулятору HCS или его части могут быть добавлены остатки для увеличения времени полужизни in vivo. Производные в используемом в данном описании смысле также охватывают аналоги, такие как соединение, которое содержит химически модифицированную форму конкретного соединения или класса, и которое сохраняет фармацевтические и/или фармакологические активности, характерные для указанного соединения или класса, такие производные также входят в объем настоящего изобретения. Производные в используемом в данном описании смысле также охватывают пролекарства модуляторов HCS, которые, как известно усиливают различные требуемые качества фармацевтических средств (например, растворимость, биодоступность, обработку и т.д.).
Прямое введение ex vivo модуляторов HSC может обеспечивать значительную экспансию in vivo гематопоэтических стволовых клеток, так что даже небольшие количества гематопоэтических стволовых клеток затем могут быть достаточны для трансплантации. Следовательно, в таком случае трансплантацию стволовых клеток пуповинной крови, например, можно применять не только для детей, но и для взрослых. Такие стволовые клетки могут быть собраны из источников, включая, например, периферическую кровь, пуповинную кровь, костный мозг, амниотическую жидкость или плацентарную кровь. Альтернативно образец HSC-содержащего источника можно собрать и затем хранить непосредственно в присутствии модулятора HSC, такого как PGE2, и сначала инкубировать (перед дифференцировкой) в присутствии модулятора HSC перед введением субъекту.
Кроме того, один или несколько модуляторов HSC можно использовать in vivo для увеличения количества стволовых клеток в костном мозге или других источниках (таких как пуповинная кровь). Благодаря увеличению количества стволовых клеток можно значительно увеличить общий сбор стволовых клеток из организма субъекта. Кроме того, благодаря увеличению количества стволовых клеток, собранных из организма субъекта, количество стволовых клеток, доступных для обратной трансплантации субъекту или трансплантации другому субъекту, также может быть значительно увеличено, тем самым возможно сокращение периода времени для приживления трансплантата и, следовательно, это приводит к сокращению периода времени, в течение которого субъект имеет недостаточное количество нейтрофилов и тромбоцитов, тем самым предотвращая инфекции, кровотечение или другие осложнения.
Кроме того, настоящее изобретение может уменьшать долю субъектов, у которых иным образом невозможна мобилизация достаточного количества клеток для сбора стволовых клеток, чтобы продолжить лечение их первичного заболевания, например, при химиотерапии и других разрушающих костный мозг обработках. Следовательно, доля пациентов с замедленным первичным приживлением трансплантата также может быть уменьшена. Кроме того, настоящее изобретение позволяет стимулировать восстановление после разрушающих костный мозг обработок посредством увеличения количества HSC.
Модуляторы HSC, такие как модуляторы, указанные в Таблице 1 и раскрытые в описании, можно применять in vivo для увеличения продукции HSC и ex vivo для увеличения количества HSC. Это осуществляют путем введения одного или нескольких соединений субъекту или к стволовым клеткам.
Модуляторы HSC также можно применять для получения аутологичных для субъекта HSC. Обычно для этого используют стадии введения модуляторов HSC субъекту, нуждающемуся в аутологичных HSC, чтобы увеличить экспансию популяции стволовых клеток в костном мозге и/или мобилизовать стволовые клетки в периферическое кровообращение; сбора одной или нескольких стволовых клеток костного мозга или одной или нескольких стволовых клеток из периферического кровообращения; и трансплантации одной или нескольких собранных стволовых клеток снова в организм субъекта.
Кроме того, стволовые клетки, полученные в результате сбора способом согласно настоящему изобретению, описанным выше, могут быть подвергнуты криоконсервации с использованием способов, известных в данной области для криоконсервации стволовых клеток. Соответственно, используя криоконсервацию, стволовые клетки можно хранить, так что как только определяют, что субъекту необходима трансплантация стволовых клеток, стволовые клетки можно разморозить и трансплантировать снова в организм субъекта. Как указано ранее, применение одного или нескольких модуляторов HSC, например PGE2, во время криоконсервации может увеличивать популяцию HSC.
Более конкретно другой вариант осуществления настоящего изобретения относится к увеличению количества HSC, собранных из пуповинной крови, или эквивалентного неонатального или фетального источника стволовых клеток, который можно криоконсервировать, для терапевтических применений таких стволовых клеток после размораживания. Такую кровь можно собрать несколькими способами, известными в данной области. Например, поскольку кровь пуповины является богатым источником HSC (смотри Nakahata and Ogawa, 70 J. Clin. Invest. 1324-28 (1982); Prindull et al., 67 Acta. Paediatr. Scand. 413-16 (1978); Tchernia et al., 97(3) J. Lab. Clin. Med. 322-31 (1981)), то прекрасным источником неонатальной крови являются пуповина и плацента. Неонатальная кровь может быть получена прямым сливанием из пуповины и/или отсасыванием через иглу из плаценты после родов у корня и из расширенных вен. Смотри, например, патенты США № 7160714, № 5114672, № 5004681; заявку на выдачу патента США с регистрационным № 10/076180, № публикации 20030032179.
Действительно, стволовые клетки пуповинной крови применяли для восстановления гематопоэза у детей со злокачественными и незлокачественными заболеваниями после обработки дозами химио- и лучевой терапии, разрушающими миелоидные клетки. Sirchia and Rebulla, 84 Haematologica 738-47 (1999). Также смотри Laughlin 27 Bone Marrow Transplant. 1-6 (2001); патент США № 6852534. Кроме того, сообщалось, что стволовые клетки и клетки-предшественники в пуповинной крови по-видимому обладают более высокой пролиферативной способностью в культуре, чем клетки в костном мозге взрослого организма. Salahuddin et al., 58 Blood 931-38 (1981); Cappellini et al., 57 Brit. J. Haematol. 61-70 (1984).
Альтернативно кровь плода можно собрать из кровообращения плода у корня плаценты с использованием иглы, управляемой ультразвуком (Daffos et al., 153 Am. J. Obstet. Gynecol. 655-60 (1985); Daffos et al., 146 Am. J. Obstet. Gynecol. 985-87 (1983), пункцией плаценты (Valenti, 115Am. J. Obstet. Gynecol. 851-53 (1973); Cao et al., 19 J. Med. Genet. 81-87 (1982)), фетоскопией (Rodeck, in PRENATAL DIAGNOSIS, (Rodeck and Nicolaides, eds., Royal College of Obstetricians and Gynaecologists, London, 1984)). Действительно, ворсинки хориона и амниотическая жидкость в дополнение к пуповиной крови и плаценте являются источниками плюрипотентных фетальных стволовых клеток (смотри WO 2003 042405), которые могут быть обработаны модуляторами HCS согласно настоящему изобретению.
Известны различные наборы и устройства для сбора, обработки и хранения пуповинной крови. Смотри, например, патенты США № 7147626, № 7131958. Сбор следует осуществлять в стерильных условиях, и кровь может быть обработана антикоагулянтом. К таким антикоагулянтам относятся растворы цитрат-фосфат-декстроза, кислый цитрат-декстроза, раствор Олсвера (Alsever and Ainslie, 41 N. Y. St. J. Med. 126-35 (1941), раствор ДеГовина (DeGowin et al., 114 J.A.M.A. 850-55 (1940)), эдглугат-Mg (Smith et al., 38 J. Thorac. Cardiovasc. Surg. 573-85 (1959)), раствор Рауса-Тюрнера (Rous and Turner 23 J. Exp. Med. 219-37 (1916)), другие смеси с глюкозой, гепарин или этилбискумацетат. Смотри Hum Storage of Blood 26-160 (Acad. Press, NY, 1968).
Различные способы известны в данной области и могут быть использованы для обогащения собранной пуповинной крови клетками HCS. Такие способы включают без ограничения равновесное центрифугирование в градиенте плотности, гравитационное осаждение при скоростном центрифугировании, иммунное розеткообразование и иммунную адгезию, сепарация при проточном центрифугировании, истощение по T-лимфоцитам и сортировку клеток с активированной флуоресценцией, отдельно или в комбинации. Смотри, например, патент США № 5004681.
Обычно собранную кровь готовят для криогенного хранения добавлением криопротекторных средств, таких как ДМСО (Lovelock and Bishop, 183 Nature 1394-95 (1959); Ashwood-Smith 190 Nature 1204-05 (1961)), глицерин, поливинилпирролидин (Rinfret 85 Ann. N. Y. Acad. Sci. 576-94 (I960)), полиэтиленгликоль (Sloviter and Ravdin 196 Nature 899-900 (1962)), альбумин, декстран, сахароза, этиленгликоль, i-эритрит, D-рибит, D-маннит (Rowe, 3(1) Cryobiology 12-18 (1966)), D-сорбит, i-инозит, D-лактоза, хлорид холина (Bender et al., 15 J. Appl. Physiol. 520-24 (I960)), аминокислоты (Phan and Bender, 20 Exp. Cell Res. 651-54 (I960)), метанол, ацетамид, моноацетат глицерина (Lovelock, 56 Biochem. J. 265-70 (1954)) и неорганические соли (Phan and Bender, 104 Proc. Soc. Exp. Biol. Med. (I960)). Добавление плазмы (например, до концентрации 20-25%) может усиливать защитный эффект ДМСО.
Собранную кровь охладить с контролируемой скоростью для криогенного хранения. Различные криопротекторные средства и различные типы клеток имеют разные оптимальные скорости охлаждения. Смотри, например, Rapatz, 5(1) Cryobiology 18-25 (1968), Rowe and Rinfret, 20 Blood 636-37 (1962); Rowe, 3(1) Cryobiology 12-18 (1966); Lewis et al., 7(1) Transfusion 17-32 (1967); Mazur 168 Science 939-49 (1970). Принципы и способы обработки, криоконсервации и длительного хранения источников HSC известны в данной области. Смотри, например, патенты США № 4199022, № 3753357, № 4559298, № 5004681. Также имеются различные устройства с прилагаемыми к ним протоколами для хранения крови. Патенты США № 6226997, № 7179643.
Принципы размораживания и восстановления источников HCS также известны в данной области. Патенты США № 7179643, № 5004681. Кровь из источника HCS также может быть подвергнута обработке для предотвращения агрегации (смотри Spitzer, 45 Cancer 3075-85 (1980); Stiff et al., 20 Cryobiology 17-24 (1983) и для удаления токсичных криопротекторных агентов (патент США № 5004681). Кроме того, существуют различные способы определения дозы прививаемых клеток, составляющей единицу трансплантации HSC. Смотри патент США № 6852534; Kuchler Biochem. Methods in cell culture and virology 18-19 (Dowden, Hutchinson and Ross, Strodsburg, PA, 1964); 10 Methods in Medical Research 39-47 (Eisen, et al., eds., Year Book Med. Pub., Inc., Chicago, IL, 1964).
Таким образом, не ограничиваясь какими-либо конкретными протоколами сбора, обработки или хранения, вариант осуществления настоящего изобретения относится к добавлению модулятора HSC, такого как PGE2 или dmPGE2, к неонатальной крови. Такое добавление можно осуществлять во время сбора или во время обработки для хранения или при размораживании и перед инфузией.
Например, стволовые клетки, выделенные из организма субъекта, например, с предварительной обработкой субъекта модулятором HCS или без такой обработки, можно инкубировать в присутствии модуляторов HSC, например, такого модулятора HSC, как PGE2 или модуляторы, перечисленные в Таблице 1, чтобы увеличить количество HSC. Размноженные HSC затем можно снова ввести в организм субъекта, из которого они были получены, или можно ввести другому субъекту.
Модуляторы HSC, включая PGE2 и соединения, указанные в Таблице 1 и раскрытые в данном описании, затем можно использовать, наряду с прочим, для: сокращения периода времени приживления трансплантата после повторной инфузии стволовых клеток в организм субъекта; уменьшения частоты замедленного первичного приживления; уменьшения частоты вторичной недостаточности продукции тромбоцитов; и сокращения периода времени восстановления тромбоцитов и/или нейтрофилов после повторной инфузии стволовых клеток в организм субъекта. Указанные способы обычно включают в себя стадии введения модулятора HSC, нуждающемуся в таком введении субъекту, чтобы увеличить экспансию популяции стволовых клеток в костном мозге и/или мобилизовать стволовые клетки в периферическое кровообращение, и затем сбора одной или нескольких стволовых клеток костного мозга или стволовых клеток из периферического кровообращения и затем трансплантации собранной стволовой клетки снова в организм субъекта в подходящий момент времени, который определяется в зависимости от конкретных нужд субъекта.
Модуляторы HSC, например, модуляторы HSC, которые вызывают увеличение количества HSC, могут обеспечивать возможность удобной терапии с использованием однократной дозы, чтобы повысить эффективность трансплантации стволовых клеток, обеспечить более агрессивное лечение солидных опухолей, миеломы и лимфомы и чтобы увеличить количество кандидатов для трансплантации стволовых клеток.
Способ согласно изобретению также можно использовать для увеличения количества стволовых клеток, получаемых от донора (включая клетки костного мозга или клетки пуповиной крови), клетки которого затем используют для спасения реципиента, который получал разрушающую костный мозг химиотерапию или лучевую терапию.
В используемом в данном описании смысле субъектом называют того, кто является кандидатом для трансплантации аутологичных стволовых клеток или трансплантации костного мозга в ходе лечения злокачественного заболевания или в качестве компонента генной терапии. Другими возможными кандидатами являются субъекты, которые отдают стволовые клетки или костный мозг субъектам для аллогенной трансплантации в случае злокачественного заболевания или генной терапии. Субъекты могут быть подвергнуты лучевой терапии, например, в качестве лечения злокачественного поражения другого типа клеток, отличных от гематопоэтических клеток. Субъекты могут болеть анемией, например, серповидно-клеточной анемией, талассемией, апластической анемией или другими заболеваниями, связанными с недостаточностью производных HSC.
Таким образом, способ согласно изобретению обеспечивает следующие преимущества: (1) позволяет проводить трансплантацию пациентам, которых в противном случае не рассматривали бы как кандидатов вследствие неприемлемо высокого риска неудачного приживления; (2) уменьшает количество процедур афереза, необходимых для минимального приемлемого сбора; (3) уменьшает частоту первичных и вторичных неблагоприятных исходов приживления трансплантатов благодаря увеличению количества HSC, доступных ля трансплантации; и (4) сокращает период времени, необходимый для первичного приживления трансплантата благодаря увеличению количества коммитированных предшественников важных гематопоэтических линий.
Модуляторы HSC согласно изобретению могут иметь клинические преимущества при трансплантации стволовых клеток, которые заключаются в повышении выходов афереза и увеличении эффективности приживления полученных аферезом клеток.
Модуляторы HSC согласно изобретению, например, модуляторы HSC, которые вызывают уменьшение количества HSC, также могут быть применимы для лечения субъектов, страдающих гиперпролиферативными расстройствами гематопоэтической системы. Гиперпролиферативные расстройства могут включать без ограничения истинную полицитемию, идиопатическую тромбоцитемию, миелофиброз с миелоидной метаплазией и хронический миелогенный лейкоз.
Соединения или агенты согласно настоящему изобретению могут находится в фармацевтически приемлемых препаратах. Такой фармацевтически приемлемый препарат может содержать фармацевтически приемлемый носитель(ли) и/или эксципиент(ты). В используемом в данном описании смысле «фармацевтически приемлемый носитель» означает любой и все растворитель, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, средства для изотоничности и средства, замедляющие всасывание, и тому подобные средства, которые являются физиологически совместимыми. Например, носителем может быть подходящий для инъекции в спинномозговую жидкость носитель. Эксципиенты включают фармацевтически приемлемые стабилизаторы. Настоящее изобретение имеет отношение к любым фармацевтически приемлемым препаратам, включая синтетические или природные полимеры в форме макромолекулярных комплексов, нанокапсул, микросфер или шариков, и основанные на липидах препараты, включая эмульсии типа «масло в воде», мицеллы, смешанные мицеллы, синтетические мембранные везикулы и заполненные тени эритроцитов.
В том случае, когда агенты или соединения доставляют пациенту, они могут быть введены любым подходящим путем, включая, например, пероральное (например, в капсулах, суспензиях или таблетках) или парентеральное введение. Парентеральное введение может включать, например, внутримышечное, внутривенное, внутрисуставное, внутриартериальное, интратекальное, подкожное или внутрибрюшинное введение. Средство также можно вводить перорально, трансдермально, местно, путем ингаляции (например, внутрибронхиальной, интраназальной, пероральной ингаляции или с использованием интраназальных капель) или ректально. Введение может быть местным или системным в зависимости от показаний. Средства также можно доставлять с использованием вирусных векторов, которые известны специалистам в данной области.
Изобретение охватывает как местное, так и системное введение. Необходимые особенности местного введения включают достижение эффективных локальных концентраций активного соединения, а также избегание неблагоприятных побочных эффектов системного введения активного соединения. В предпочтительном варианте антагонист вводят местно. Способы локализованной доставки описаны, например, в 51 J. Biomed. Mat. Res. 96-106 (2000); 100(2) J. Control Release 211-19 (2004); 103(3) J. Control Release 541-63 (2005); 15(3) Vet. Clin. North Am. Equine Pract. 603-22 (1999); 1(1) Semin. Interv. Cardiol. 17-23 (1996).
Фармацевтически приемлемые композиции могут быть суспендированы в водном наполнителе и введены через обычные иглы для подкожных введений или с использованием инфузионных насосов.
Количество средства, вводимого человеку, зависит от характеристик пациента, таких как общее состояние здоровья, возраст, пол, масса тела и переносимость лекарственных средств, а также степени, тяжести и типа отторжения. Специалист в данной области сможет определить подходящие дозы в зависимости от указанных или иных факторов.
Модуляторы HSC, входящие в объем настоящего изобретения, могут быть идентифицированы различными способами, например с использованием генетической системы рыб данио. Данио представляет собой прекрасную генетическую систему для исследования развития и заболеваний позвоночных. Смотри, например, Hsia and Zon, 33(9) Exp. Hematol. 1007-14 (2005); de Jong and Zon; 39 Ann. Rev. Genet. 481-501 (2005); Paffert-Lugassy and Zon, 105 Meth. Mol. Med. 171-98 (2005); Haffher and Nusslein-Volhard, 40 Int'l J. Devel. Biol. 221-27 (1996). Развитие эмбриона видно снаружи напросвет, и органы могут быть легко визуализированы. Данио и млекопитающие имеют много одинаковых генетических программ развития. Спаривание рыб данио приводит к образованию большого количества (100-200 еженедельно) прозрачных эмбрионов. Большое количество эмбрионов можно поместить в относительно небольшое пространство, и имеет место короткий период времени генерации (примерно 3 месяца). Крупномасштабные скрининги дали более чем 2000 генетических мутантов с конкретными дефектами, которые влияют фактически на каждый аспект эмбриогенеза. Driever et al., 123 Devel. 37-46 (1996); Eisen, 87 Cell 969-77 (1996). Многие мутантны, связанные с нарушением крови, оказались полезными для описания ключевых событий гематопоэза. Dooley and Zon, 10 Curr. Op. Genet. Devel. 252-56 (2000). Рыб данио использовали для осуществления основанного на целом организме скрининга малых молекул, поскольку можно расположить большие количества эмбрионов на планшетах для микротитрования, содержащих соединения из химической библиотеки. Например, Peterson и соавторы испытывали 1100 соединений по отношению к дефектам развития. Peterson et al., 97 P.N.A.S. USA 12965-69 (2000). На основании такого скрининга примерно 2% соединений оказывали летальное действие, и 1% вызывали конкретный фенотип. Например, одно соединение подавляло образование структур внутреннего уха, называемых отолитами, но не вызывало других дефектов.
Также можно проводить скрининг в отношении химических супрессоров мутантных фенотипов. Peterson et al., 22 Nat. Biotech. 595-99 (2004); Stern et al., 1 Nat. Chem. Biol. 366-70 (2005). В одном таком скрининге обнаружены химические вещества, которые спасают мутант gridlock, модель врожденной коарктации аорты. Peterson et al., 2004. Механизм такого спасения заключается в индукции VEGF, который корректирует дефект ангиогенеза. Полученные данные показывают, что высокоэффективные и специфичные соединения могут быть идентифицированы с использованием раб данио.
Кроме того, что касается рыб данио, сконструированы генетические карты, имеющие высокую плотность, которые включают в себя маркеры микросателлитов, гены и экспрессирующиеся маркерные последовательности (EST). Knapuk et al., 18 Nat. Genet. 338-43 (1998); Shimoda et al., 58 Genomic 219-32 (1999); Kelly et al., 10 Genome Res. 558-67 (2000); Woods et al., 20 Genome Res. 1903-14 (2000). Предпринято осуществление проекта получения полноразмерной кДНК в качестве расширения проекта EST данио. Сконструирована плотная карта RH и объединена с данными, полученными при осуществлении проекта секвенирования генома в центре Сэнджера. Важным web-ресурсом, поддерживаемым NIH, является информационная сеть по рыбам данио (ZFIN), являющаяся центром для общения. Основной центр и вспомогательная лаборатория, названные Zebrafish International Resource Center (ZIRC), также оказывают большую помощь в данной области. В центре Сэнджера проводят секвенирование генома рыб данио, которое может быть завершено в 2007.
Проявления дефинитивного гематопоэза исследовано у различных видов позвоночных. В работе с зародышами видов птиц показано, что у химер курица-перепел не появляются дефинитивные гематопоэтические стволовые клетки в желточном мешке, но появляются в эмбрионе. Dieterien-Lievre 33 J. Embryol. Exp. Morphol. 607-19 (1975). В сходных исследованиях на эмбрионах Xenopus с использованием химер диплоид/триплоид выяснено, что брюшной кроветворный пузырек (эквивалент желточного мешка) играет незначительную роль в гематопоэзе у взрослых по сравнению с дорсолатеральной пластиной. Kau and Turpen 131 J. Immunol. 2262-66 (1983). На основании данных о том, что мезодерма дорсолатеральной пластины содержала предполагаемые гематопоэтические клетки, которые приводили к дефинитивному гематопоэзу, несколько групп дополнительно исследовали развивающуюся область аорто-гонадного мезонефроса (AGM). Medvinsky et al., 364 Nature 64-67 (1993); Godin et al., 364 Nature 67-70 (1993). В указанной области имеются кластеры клеток в вентральной стенке аорты, которые исходно обнаружены у свиньи. Sabin, 9 Contrib. to Embryol. 213-62 (1920). Другие исследователи указывали, что такие кластеры представляют собой ранние гематопоэтические стволовые клетки, которые получены из «кроветворных» эндотелиальных клеток.
Процесс AGM-гематопоэза является консервативным у позвоночных. Galloway and Zon, 53 Curr. Topics Dev. Biol. 139-58 (2003). У мыши появление стволовых клеток происходит на 8,5 - 9 день, тогда же, когда начинается кровообращение. Гематопоэтические стволовые клетки области AGM на одиннадцатый день могут быть трансплантированы, однако клетки на десятый день не будут приводить к долгосрочному приживлению трансплантата. В дополнительных исследованиях было выяснено, что аорта поляризована, и факторы из вентральной и дорсальной областей будут модифицировать поведение клеток. Например, дорсальная область аорты происходит из мезодермы сомитов. На нее влияют TGFα, BMP и передача звукового сигнала у ежей. Parnanud and Dieterien-Lievre, 126 Devel., 617-27 (1999).
Основанные на мечении клеток исследования показали, что предполагаемые HSC в AGM обладают способностью к инвазии в субаортальную мезенхиму, а также в различные ткани. Jaffredo et al., 125 Devel. 4575-83 (1998); Jaffredo et al., 224 Devel. Biol. 204-14 (2000). В таких исследованиях, основанных на мечении клеток, использовали тушь или клетки, инфицированные ретровирусами, мечеными LacZ, инфузированные в сосудистую систему. Такие эксперименты по картированию зачатков показали мечение гематопоэтических клеток в тканях. В таких исследованиях выяснено появление гематопоэтических стволовых клеток в аорте эмбриона позвоночных.
Обнаружено, что для гематопоэза в AGM требуется несколько генов. Ген runx1 (ранее онкобелок AML1) экспрессируется в стенке аорты в вентральной области, где обнаружены гематопоэтические клетки; функционирование указанного гена необходимо для AGM-гематопоэза. Cal et al., 13 Immunity 423-31 (2000). У мыши, мутантной по runx1, отсутствует AGM, и нарушен гематопоэз. Дефект у мутанта runx1 может быть восстановлен трансгеном runx1, управляемым промотором Tie2, что свидетельствует о том, что эндотелиальная и гематопоэтическая управляемая экспрессия runx1 достаточна для регуляции AGM-гематопоэза. Miller et al., 32 Nature Genet. 645-49 (2002). При изменении (нокин) гена runx1 имеются субаортальные мезенхимные клетки, которые мечены LacZ, и такое наблюдение интерпретировали так, что некоторые субаортальные клетки могут давать начало гематопоэтическим стволовым клеткам. North et al., 126 Devel. 2563-75 (1999). Недавние исследования показали, что субаортальные эндотелиальные клетки проталкиваются через эндотелиальный слой и образуют гематопоэтические кластеры. Bertrand et al., 102 P.N.A.S. USA 134-39 (2005); Tavian and Peault, 33 Exp. Hemat. 1062-69 (2005); Tavian and Peault, 49 Int'l J. Devel. Biol. 243-50 (2005); Tavian et al., 1044 Ann. NY Acad. Sci. 41-50 (2005).
Таким образом, может быть спорным, являются ли кроветворные эндотелиальные клетки или субаортальные мезодермальные клетки настоящими предшественниками HSC. После того как гематопоэтические стволовые клетки отпочковываются из эндотелиальной стенки, они представляют собой клетки CD45+ и экспрессируют транскрипционные факторы runx1 и c-myb. Клетки AGM также находятся под контролем пути передачи сигнала notch. У нокаутированных по notch1 мышей отсутствуют гематопоэтические стволовые клетки AGM и экспрессия runx1 и c-myb в области аорты. Kumano et al., 18 Immunity 699-711 (2003); Robert-Moreno et al., 132 Devel. 1117-26 (2005). Кроме того, фактор транскрипции coupTF также отсутствует в гематопоэтических стволовых клетках AGM, хотя он был исследован не очень тщательно. You et al., 435 Nature 98-104 (2005). Хотя runx1, cymb, notch и coup, по-видимому, важны для AGM-гематопоэза, взаимодействие, временная и пространственная взаимосвязь указанных факторов и роль других возможных неизвестных факторов не выяснена. Очевидно, необходимо лучше понять генетическую программу начала гематопоэза.
Проводили химический генетический скрининг для идентификации новых путей, которые модулируют образование дефинитивных HSC во время эмбриогенеза рыб данио. Фиг. 1. Такие гены, как runx1 и cmyb, необходимые для развития HSC во время гематопоэза млекопитающих, экспрессируются в вентральной стенке дорсальной аорты в области, аналогичной AGM млекопитающих через тридцать шесть часов после оплодотворения (hpf). North et al., 16 Immunity 661-72 (2002); Mukouyarna et al., 9 Curr. Biol. 833-86 (1999); Kalev-Zylinska et al., 129 Devel. 2015-30 (2002); Burns et al., 30 Exp. Hematol. 1381-89 (2002). Эмбрионы дикого типа инкубировали с отдельными соединениями, начиная со стадии трех сомитов вплоть до тридцати шести часов после оплодотворения. Зонды для runx1 и cmyb объединяли и использовали для выявления HSC посредством гибридизации in situ. Большинство химических веществ, 2275 из 2357 (91,7%), не обладали способностью изменять экспрессию runx1/cmyb, тогда как 35 (1,4%) и 47 (1,9%) приводили к повышенному или пониженному количеству HSC AGM, соответственно.
Из восьмидесяти двух веществ, которые изменяли экспрессию runx1/cmyb, десять влияют на путь простагландина (PG). Простагландины образуются из арахидовной кислоты ферментами ЦОГ-1, ЦОГ-2 и тканеспецифичными изомеразами. По меньшей мере, пять соединений, влияющих на путь PG, повышали экспрессию генов HSC (Таблица 1) и пять уменьшали экспрессию генов HSC (таблица 2). Через тридцать шесть часов после оплодотворения HSC runx1/cmyb+ содержатся в линии уплощенных эндотелиальных клеток и гематопоэтических кластерах в аорте. Линолевая кислота (10 мкМ, предшественник PG, увеличивала количество HSC runx1/cmyb+ (22 измененных/30 просчитанных), тогда как целекоксиб (20 мкМ, избирательный ингибитор ЦОГ-2 уменьшал количество HSC (26/31). Маркер сосудов flk1 оставался относительно без изменений. Простагландин E2 является основным эффекторным простаноидом, продуцируемым у рыб данио (Grosser et al., 99 P.N.A.S. USA 8418-23 (2002)), и регулируется ЦОГ-1 и ЦОГ-2. На эмбрионы данио действовали ингибиторами синтеза простагландина, а также экзогенными простаноидами. Обработка PGE2 (25/49) приводила к более сильной экспрессии runx1/cmyb, чем PGI2 (28/47) при 20 мкМ, тогда как избирательное по отношению к изоформе ингибирование активности ЦОГ SC560 (ЦОГ-1, 10 мкМ, 30/36) и NS398 (ЦОГ-2, 20 мкМ, 35/44), а также неспецифичные ингибиторы ЦОГ приводили к снижению количества HSC. Полученные данные убедительно доказывают специфичную роль PG в образовании HSC AGM.
Примеры модуляторов HSC, которые увеличивают количество HSC
Соединения пути PG, идентифицированные в качестве модулирующих runx1/cmyb+ HSC, перечислены в первой колонке. Во второй колонке указана частота, с которой идентифицировали конкретное соединение. В третьей колонке показано влияние соединения на экспрессию генов HSC (количество измененных эмбрионов/количество оцениваемых эмбрионов).
Примеры модуляторов HSC, которые уменьшают количество HSC
Соединения пути PG, идентифицированные в качестве модулирующих runx1/cmyb+ HSC, перечислены в первой колонке. Во второй колонке указана частота, с которой идентифицировали конкретное соединение. В третьей колонке показано влияние соединения на экспрессию генов HSC (количество измененных эмбрионов/количество оцениваемых эмбрионов).
Дополнительные модификаторы простагландинового пути HSC идентифицировали, используя способ скрининга рыб данио, описанный в данной публикации, например такие модификаторы, которые показаны в Таблице 3:
Примеры модификаторов простагландинового пути
Экспрессия ЦОГ-1 в сосудистой системе описана ранее; подавление активности ЦОГ-1 ингибировало развитие эндотелиальной границы между аортой и веной. Cha et al., 282 Devel. Biol. 274-83 (2005). Так как HSC возникают из популяции кроветворных эндотелиальных клеток, то утрата функции ЦОГ-1 может влиять на развитие HSC. Гибридизация in situ показала, что ЦОГ-2 диффузно экспрессируется в хвостовой области, охватывающей AGM, через тридцать шесть часов после оплодотворения. В выделенных при FACS-анализе популяциях клеток крови и эндотелиальных клеток обнаружено, что ЦОГ-1 и ЦОГ-2 подвергаются повышающей регуляции во время переключения с примитивного на дефинитивный гематопоэз. Высокие уровни экспрессии ЦОГ-1 выявлены как в эндотелиальных клетках Imo2+, так и в HSC CD41+, тогда как ЦОГ-2 подвергалась повышающей регуляции только во фракции HSC (фиг. 2, панель A). Полученные результаты свидетельствуют, что ЦОГ-1 и ЦОГ-2 принимают участие в индукции HSC в AGM посредством регуляции ниши стволовых клеток, а также HSC как таковых.
Линолевая кислота и кислота Мида могут действовать в качестве субстратов для продукции простагландина, и указанные кислоты выделены при скрининге в качестве агентов, которые вызывают повышающую регуляцию образования HSC. Чтобы определить, какой простагландин опосредовал увеличение количества HSC в AGM, на рыб данио воздействовали экзогенными очищенными простагландинами от стадии трех сомитов до 36 часов после оплодотворения и красили как описано ранее. У рыб данио основными физиологически активными простагландинами являются PGE2, PGI2 и PGF2. Pini et al., 25 Arterioscler. Thromb. Vase. Biol. 315-20 (2005); Grosser et al., 2002. Каждый из простагландинов тестировали в отношении их влияния на HSC в AGM. Обнаружено, что PGE2 и PGI2 в умеренной степени увеличивают количества клеток Runx1+Cmyb+ в AGM, тогда как PGF2 не оказывал влияния. Вследствие строгой регуляции продукции и распада простагландина in vivo, также исследовали медленно метаболизируемый вариант PGE2.
Длительное действующее производное, 16,16-диметил-PGE2 (dmPGE2, 10 мкМ), вызывал увеличение количества HSC runx1/cmyb+ в AGM в 78% исследованных эмбрионов (97/124). HSC AGM подвергались ингибированию обработкой индометацином (10 мкМ) в 90% анализируемых эмбрионов (92/102). PGE2 был наиболее широко представленным PG, судя по измерению масс-спектрометрией, в эмбрионах через 36 часов после оплодотворения (18±6 пг/50 эмбрионов; n=4), и обработка индометацином подавляла образование PGE2 ниже регистрируемых уровней (<2 пг/50 эмбрионов; n=3). Обработка dmPGE2 оказывала минимальное влияние на сосудистую систему, судя по окрашиванию flk1; индометацин слегка изменял сосуды между сомитами в 30% исследованных эмбрионов (15/49). Трансгенных рыб данио cmyb:GFP с имеющими зеленую флуоресценцию HSC и миелоидными клетками-предшественниками скрещивали с рыбами lmo2:dsRed, которые имеют эндотелиальные клетки и HSC с красной флуоресценцией, чтобы визуализировать влияние химического воздействия in vivo. Через 36 часов после оплодотворения в живых эмбрионах, изображение которых получали с помощью конфокальной микроскопии, наблюдали значительно уменьшенное количество HSC вдоль дна аорты после обработки индометацином и значительное увеличенное количество HSC после воздействия dmPGE2. Фиг. 3. На этой фигуре показано, что PG влияет на общее количество HSC, образованных вдоль дорсальной стенки аорты; индукция HSC в аномальных положениях не выражена. По данным количественной ПЦР экспрессия runx1 была в 3 раза повышена после добавления dmPGE2, тогда как индометацин вызывал значимое 50% снижение экспрессии runx1; также наблюдали значимые изменения экспрессии cmyb (фиг. 2, панель B).
Чтобы подтвердить необходимость активности PGE2 использовали низкую дозу (40 мкМ) морфолиноолигонуклеотидов (MO), чтобы подавить экспрессию ЦОГ-1 и ЦОГ-2; ингибирование активности ЦОГ-1 низкой дозой позволяло эмбрионам проходить гаструляцию, при этом имитируя зависимые от ЦОГ пороки развития. Grosser et al., (2002). Ингибирование ЦОГ под действием MO уменьшало количество HSC в AGM (ЦОГ-1 54/74; ЦОГ-2 60/71). Анализ масс-спектроскопией показал, что PGE2 был ниже регистрируемых уровней в таких эмбрионах, что согласуется с MO-опосредованным подавлением эндогенного синтеза простагландина (n=4). Влияние на HSC было обратимо посредством инкубации эмбрионов, в которые инъецировали MO, с 10 мкМ dmPGE2 (ЦОГ-1/dmPGE2 спасено 29/52; ЦОГ-2/dmPGE2 43/60). Подавление MO синтеза PGE2 вызвало уменьшение количества HSC (35/50), от которого спасало добавление dmPGE2 (25/45), что свидетельствует о том, что передача сигнала через PGE2 достаточная дл модулирования образования HSC. Передача сигнала PGE2 происходит через несколько рецепторов, EP1-4, которые все присутствуют в геноме данио. Cha et al., 20 Genet. Devel. 77-86 (2002). MO-нокдаун рецепторов EP2 и EP4 приводил к снижению экспрессии runx1/cmyb (EP2 39/63; EP444/67), которое не было обратимо при действии экзогенного dmPGE2. Анализ количественной ПЦР показал, что EP2 и EP4 присутствуют в отсортированных с помощью FACS HSC CD41+ и нестволовых клетках CD41- через 36 часов после оплодотворения. Указанные эксперименты подтверждают, что PGE2-опосредованная передача сигнала регулирует образование HSC в области AGM.
Для дальнейшего исследования взаимодействий между простагландинами и продукцией HSC проводили скрининг многочисленных производных простагландина, используя описанный в данной публикации способ анализа эмбрионов данио. В общем, анализы показали, что производные, которые повышали стабильность PGE2, увеличивали количество HSC. Те производные, в случае которых не наблюдали увеличения по сравнению с контролями имели тенденцию представлять собой соединения, которые предпочтительно связываются с рецепторами, которые являются неактивными в HSC. Влияние таких соединений на количество HSC показано в Таблице 4:
Производные простагландина, влияющие на продукцию HSC
Чтобы исследовать роль PGE2 в гомеостазе HSC у взрослых рыб данио осуществляли анализ восстановления после облучения мозгового вещества почек (KM). Burns et al., 19 Genes and Devel. 2331-42 (2005). Рыб дикого типа подвергали облучению сублетальными дозами, воздействию dmPGE2 и оценивали кинетику восстановления KM с помощью FACS 11 (фиг. 4A). Степень восстановления гематопоэтических клеток KM значимо возрастала у рыб, обработанных 50 мкМ dmPGE2, по сравнению с ДМСО-обработанными контролями (фиг. 4A, B). Повышение в процентах количества предшественников предшествовало восстановлению миелоидной и лимфоидной популяций, соответственно. При исследовании уровней экспрессии маркеров стволовых клеток, клеток-предшественников и эндотелиальных клеток с помощью кПЦР, проводимой на PGE2-обработанном KM на третий день после облучения, показано значимая повышающая регуляция runx1 и Imo2 (фиг. 5). Ингибирование активности ЦОГ неизбирательными и избирательными ингибиторами значимо снижало восстановление KM и влияло на общую жизнеспособность (фиг. 5). Полученные авторами результаты показывают, что PGE2 играет важную роль в гомеостазе KM.
Также оценивали влияние пути простагландина на популяции HSC и клеток-предшественников млекопитающих. Добавление dmPGE2 к ES-клеткам во время образования эмбриоидных телец увеличивало количество гематопоэтических колоний на слое стромальных клеток OP9 и в анализах образования колоний на метилцеллюлозе (фиг. 6A, B). Nakano et al., 272 Sci. 722-24 (2002). Количество колоний OP9, дефинитивных эритроидных клеток (dE) и гранулоцитов/моноцитов (GM) возрастало зависимым от дозы образом после воздействия 10 мкМ (GM p=0,005) и 20 мкМ (OP9 p=0,047; dE p=0,04; GM p=0,007) dmPGE2. Количество мультипотентных колоний гранулоцитов/эритроцитов/моноцитов/макрофагов (GEMM) увеличивалось в 2,9 раза после обработки dmPGE2 (10 мкМ: p=0,017; 20 мкМ: p=0,016). В дозе 100 мкМ dmPGE2 был токсичным для ES-клеток. Количественную ПЦР осуществляли для того, чтобы определить, присутствуют ли компоненты пути PG в ES-клетках: ЦОГ-1, ЦОГ-2, PGE2-синтаза и рецепторы PGE 1-4 присутствовали на всех исследованных стадиях. Индометацин ингибировал рост колоний в дозе 20 мкМ (OP9 p=0,047) и 100 мкМ (GM p=0,024) (фиг. 6A, B); ингибирующее влияние отменяли, используя экзогенный dmPGE2, в обоих анализах образования колоний (фиг. 7 A,B). Полученные данные свидетельствуют, что роль простагландинового пути в гематопоэзе консервативна у рыб данио и млекопитающих.
Альтернативно экспансия гематопоэтических или эндотелиальных клеток в области AGM (аорто-гонадного мезонефроса) может быть исследована при скрещивании мышей с последующим введением доз PGE2 новым беременным самкам с питьевой водой, начиная с 8,5 дня эмбрионального развития. Уровни PGE2 могут влиять на имплантацию мышиных эмбрионов; ожидание до 8,5 дня, чтобы начать обработку, позволяет протекать имплантации, и при этом еще остается время для того, чтобы лекарственное средство повлияло на популяцию стволовых клеток, которая может быть обнаружена в области AGM, начиная с 10,5 дня. Беременных самок умерщвляют с использованием CO2 на 11,5 день эмбрионального развития, и эмбрионы выделяют из матки и фиксируют в параформальдегиде. Фиксированные эмбрионы могут быть обработаны для получения тотального препарата для гибридизации in situ в отношении маркеров HSC, таких как Runx1, c-myb или Sea1, или подвергнуты иммуногистохимии с использованием антител к HSC, чтобы найти доказательства увеличения популяции стволовых клеток. Можно использовать разные дозы, например, 10-1, 10-3 и 10-5 микрограмм/г массы тела. Для каждой из указанных выше доз и для не подвергнутых обработке контролей можно использовать три беременных самки мыши. Затем эффективную дозу используют в экспериментах по трансплантации, в которых используют клетки, вырезанных из области AGM эмбрионов.
У мышей также может быть исследована экспансия CFU-S и длительно репопулирующих HSC. Однократную дозу PGE2, которая, как обнаружено, приводит к экспансии потенциальных стволовых клеток в области AGM, можно давать беременным самкам после имплантации (примерно E8,5) в питьевой воде. Контрольных самок подвергают обработке параллельно. Беременных самок умерщвляют на 11,5 dpc. Эмбрионы собирают из матки, область AGM выделяют микрохирургическим способом и клетки AGM готовят для трансплантации. Комбинация эквивалентных одному эмбриону экспериментальных и/или контрольных клеток будет инъецирована в хвостовую вену облученных реципиентных мышей, где они будут мигрировать в селезенку (кратковременные) и костный мозг (долговременные). Вклад экспериментальных клеток по сравнению с контрольными клетками можно анализировать на двенадцатый день после трансплантации стандартным анализом количества колоний CFU-S в селезенке умерщвленных реципиентных мышей или проточной цитометрией костного мозга через один месяц после трансплантации, чтобы определить конкурентное долговременное репопулирование HSC.
Так как развитие сердечнососудистой системы тесно связано с продукцией гематопоэтических стволовых клеток во время эмбриогенеза, то может быть важным влияние кровяного давления на передачу сигнала PGE2 и индукцию HSC AGM. Наиболее консервативным местом гематопоэза у любого позвоночного является вентральная стенка аорты. Клетки в аорте возникают на тридцатый час развития данио и развиваются в ней примерно до тридцать шестого часа, когда они либо поступают в циркуляцию, либо проникают в ткани. Продукция HSC AGM по времени может происходить после первого сердечного сокращения и когда кровяное давление в сосудистой системе достигает критического уровня. У рыб данио первое сердечное сокращение происходит через двадцать три часа. В этот момент времени сердцебиение медленное, и сокращение сердца относительно слабое. Через тридцать часов устанавливается устойчивое кровообращение. Сигналом для образования стволовых клеток в AGM может быть изменение кровяного давления. Несколько химических соединений, идентифицированных при скрининге на рыбах данио, регулируют кровяное давление и сократимость сердца. Например, известно, что химическое вещество гидралазин, обычно используемой в качестве противогипертонического средства, увеличивает экспрессию простагландина E2. Анализ in situ эмбрионов, на которые действовали гидралазином, показывает очень небольшие изменения в ангиогенезе, но большие изменение количества стволовых клеток крови. Кроме того, лекарственное средство строфантидин, сердечный гликозид, увеличивает сократимость сердца, а также увеличивает количество стволовых клеток в AGM. Более того, бета-блокатор атенолол приводит к расширению сосудов, а также приводит к повышенной продукции стволовых клеток в AGM. Химические вещества, которые нарушают сердцебиение, такие как BDM и эпинефрин, а также молчащие сердечные мутации могут изменять продукцию стволовых клеток AGM, и можно установить, необходимо ли кровообращение для продукции AGM. Для дальнейшего установления взаимосвязи между кровяным давлением и путем простагландина гидралазин, строфантидин и атенолол можно инкубировать с данио в присутствии ингибиторов ЦОГ-2. Подобные исследования могут быть осуществлены с использованием морфолино-ЦОГ-2, чтобы определить, способны ли они блокировать активацию стволовых клеток, опосредованную гидралазином.
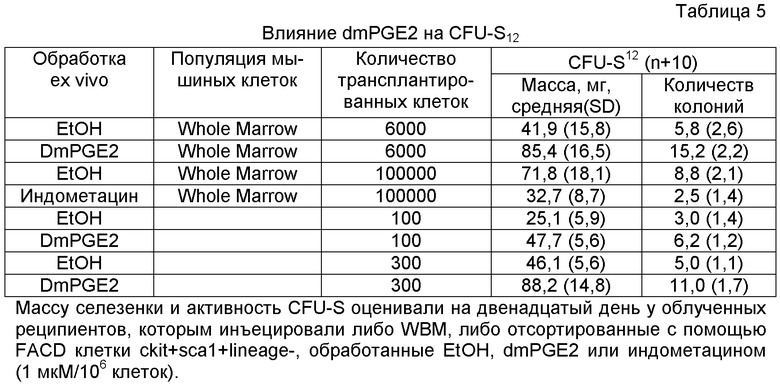
Для исследования эффективности влияния in vivo цельный костный мозг (WBM) мышей экспонировали ex vivo с dmPGE2 (1 мкМ/106 клеток), и облученным реципиентам трансплантировали 6 x 104 обработанных клеток WBM. Количество CFU-S12 взрастало в три раза (p<0,0001) у реципиентов dmPGE2-обработанного WBM (фиг. 8b, фиг. 9A, Таблица 6 - Таблица 8); подобным образом, также возрастало количество более зрелых колоний CFU-S8 (фиг. 9A, Таблица 5). Чтобы оценить потребность в эндогенном PGE2 клетки WBM инкубировали ex vivo с индометацином (1 мкМ/106 клеток). После трансплантации 1 x 105 клеток наблюдали 70% снижение (p=0,0002) количества CFU-S12 у реципиентов обработанных индометацином клеток (фиг. 8C, фиг. 9C, Таблица 4 - Таблица 6); сходные результаты наблюдали при специфичном ингибировании ЦОГ-1 и ЦОГ-2 (фиг. 9K, L). Полученные результаты свидетельствуют, что обработка PGE2 не только усиливает образование гематопоэтических стволовых клеток, но и требуется для активности CFU-S.
Влияние dmPGE2 на радиопротекторное конкурентное репопулирование BM
число анализи-руемых реципиен-тов CD45.2
Влияние dmPGE2 на радиопротекторное конкурентное репопулирование BM
Влияние dmPGE2 на радиопротекторное конкурентное репопулирование BM
Компоненты пути PG присутствуют как популяции стромальных клеток, так и в популяции HSC у мышей и человека (Princeton Stem Cell and Stromal cell databases). Ivanova et al., 298 Sci. 601-04 (2002); Nakano et al., 101 Blood 383-89 (2003). ЦОГ-1, ЦОГ-2, PGE2-синтаза и рецепторы EP2 и EP4 присутствуют в HSC печени плода и в HSC BM после повреждения 5-фторурацилом (5FU), что свидетельствует об использовании передачи сигнала PGE2 клетками HSC. Venezia et al., PLoS Biol. 2, e301 (2004). Чтобы определить, является ли увеличение количества CFU-S следствием прямого влияния PGE2 на популяцию стволовых клеток, выделенные с помощью FACS клетки BM ckit+sca1+lineage- (KSL) обрабатывали dmPGE2 и трансплантировали по 100 или 300 клеток облученному реципиенту. И масса селезенки (фиг. 9D) и CFU-S12 значимо возрастали у реципиентов dmPGE2-обработанных клеток (фиг. 9D, Таблица 6 - Таблица 8). Полученные результаты свидетельствуют, что dmPGE2 может приводить к автономной активации клеток HSC и незрелых предшественников.
Чтобы определить может ли воздействие dmPGE2 усиливать восстановление HSC, проводили анализ конкурентного репопулирования при лимитирующем разведении. Zhang and Lodish, 103 Blood 2513-21 (2004). WBM (CD45.1), обработанный dmPGE2 ex vivo, независимо смешивали в разных дозах с фиксированным количеством необработанных конкурирующих клеток (CD45.1/CD45.2) и инъецировали конгенным реципиентным мышам (CD45.2). Периферическую кровь получали на шестой, двенадцатой и двадцать четвертой неделе после трансплантации и исследовали с помощью FACS, чтобы определить вклад обработанных тестируемых клеток в гематопоэтическое репопулирование (фиг. 9E-9J). Позитивное восстановление определяли в случае химеризма в нескольких линиях тестируемых клеток >5% (фиг. 9F, H, I). Значимое увеличение количества репопулирующих клеток, которое определяли, используя статистический анализ Пуассона, наблюдали в dmPGE2-обработанном BM (фиг. 8E, фиг. 9G, 9J). На шестой неделе рассчитанная частота приживляемых клеток на 106 клеток WBM возрастала в 3,3 раза (p=0,005) у реципиентов dmPGE2-обработанного WBM, и частота кратковременного репопулирования HSC была в 4 раза (p=0,002) выше на двенадцатой неделе после трансплантации (фиг. 8E, 8F, фиг. 9G). На двадцать четвертой неделе частота долговременного репопулирования HSC была в 2,3 раза повышена (p=0,05) у реципиентов dmPGE2-обработанных клеток (фиг. 8F, фиг. 9J). В анализах через двенадцать недель и через двадцать четыре недели восстановление у всех реципиентов было по нескольким линиям, свидетельствуя о том, что временная обработка dmPGE2 увеличивала частоту репопулирующих HSC у мыши без нарушения способности к дифференцировке. Не наблюдали уменьшения вклада dmPGE2-обработанных HSC в гематопоэз. Чтобы определить, усиливает ли обработка dmPGE2 миграцию в нишу BM, WBM метили прижизненным красителем, CDFA, затем обрабатывали dmPGE2 и трансплантировали. Через двенадцать часов после трансплантации не наблюдали значимого различия в миграции между контрольными и dmPGE2-обработанными клетками (p=0,83).
Пытаясь более точно охарактеризовать необходимость простагландинового пути в продуцировании стволовых клеток, использовали несколько дополнительных коммерчески доступных ингибиторов циклооксигеназы (ЦОГ). Общие ингибиторы ЦОГ индометацин, напроксен, ибупрофен и аспирин, а также специфичный ингибитор ЦОГ-2 NS-398, тестировали в отношении влияния на HSC AGM с помощью описанного выше анализа. Каждый химический ингибитор ЦОГ-1 или ЦОГ-2 уменьшал количество стволовых клеток в аорте. ЦОГ ответствена за процессинг PG в результате изменения арахидоновой кислоты. Образование сосудов и характеристики аорты оставались интактными в обработанных эмбрионах, как видно по окрашиванию эфрином B2 и Flk1, однако некоторые аспекты ангиогенеза, в частности морфология кровеносных сосудов между сомитами, были нарушены под влиянием некоторых химических веществ. Антисмысловые морфолино-олигонуклеотиды для ЦОГ-1 и ЦОГ-2 также инъецировали по отдельности в эмбрионы данио, чтобы подтвердить, что уменьшение количества стволовых клеток в аорте является следствием ингибирования ЦОГ. Количество клеток Runx1+Cmyb+ было снижено в области AGM в случае любых морфолино-олигонуклеотидов. Как сообщалось ранее, очень высокие концентрации МО ЦОГ-1 вызывали нарушения характеристик аорты и вены, тогда как морфолино-олигонуклеотиды ЦОГ-2 вызывали задержку гаструляции при высоких концентрациях. Cha et al., 20 Genes and Devel. 77-86 (2006); Cha et al., 282 Devel. Biol. 274-83 (2005). Уменьшение количества HSC наблюдали при более низких концентрациях любого из MO, и структуры сосудов в хвостовой области серьезно не изменялись. Кроме того, трансгенных рыб данио fli1-GFP с точно установленной сосудистой системой использовали для оценки влияния морфолино-олигонуклеотидов и химических веществ на ангиогенез. Ингибирование ЦОГ-1 или ЦОГ-2 не влияло на развитие аорты при действии химических веществ или морфолино-олигонуклеотидов. Межсомитные кровеносные сосуды при некоторых обработках изменяются.
Простагландин E2 является основным простагландином, который образуется во время эмбриогенеза рыб данио и регулирует ткани сосудов. Pini et al., 25 Arterioscler. Thromb. Vase Biol. 315-20 (2005); Grosser et al., 99 P.N.A.S. USA 8418-23 (2002). На какие именно простагландины влияет ингибирование компонентов простагландинового пути химическими веществами и/или морфолино-олигонуклеотидами, можно анализировать с использованием масс-спектроскопического анализа. Подобным образом, масс-спектроскопия может подтвердить индукцию E2 после воздействия на субстраты простагландинового пути, такие как линолевая кислота или кислота Мида. Анализ роли PGE2 в образовании HSC AGM логически приводит к анализу того, какие рецепторы являются активными в распространении передачи сигнала простагландина на эффекторы ниже. У рыб данио идентифицировали четыре рецептора PGE2. такой идентификации способствуют специфичные агонисты и антагонисты рецепторов PGE. Кроме того, специфичные рецепторы, которые опосредуют индукцию HSC, могут быть исследованы с помощью функционального нокдауна с использованием морфолино-олигонуклеотидов, которые описаны ранее. Экспрессию каждого из рецепторов простагландина, а также обеих циклооксигеназ, можно исследовать с помощью гибридизации in situ, чтобы оценит локализацию указанных генных продуктов в ходе развития, особенно обращая внимание на область AGM.
Настоящее изобретение показывает, что PGE2 увеличивает количество гематопоэтических стволовых клеток и мультипотентных предшественников у двух видов позвоночных, данио и мышей. В предыдущих исследованиях подтверждено, что немодифицированный PGE2 может влиять на созревание клеток крови у мыши (Boer et al., 100 Blood 467-73 (2002); Rocca et al., 99 P.N.A.S. USA 7634-39 (2002)), и стимуляцию клеточного цикла у предшественников CFU-S8 (Feher and Gidali, 247 Nature 550-551 (1974)); влияние PG-опосредованной передачи клеточных сигналов на HSC ранее не исследовали, однако ЦОГ-1 и ЦОГ-2, по-видимому, выполняют разные функции в образовании HSC AGM: ЦОГ-1 важна для образования гематопоэтической ниши, особенно кроветворного эндотелия, тогда как ЦОГ-2 вероятно вовлечена в самовосстановление и пролиферацию самих HSC. В отличие от этого гомозиготные нокаутированные по ЦОГ-1 или ЦОГ-2 мыши являются жизнеспособными без видимых дефектов в образовании HSC (Langenbach et al., 58 Biochem. Pharmacol. 1237-46 (1999)); предполагают, что это обусловлено материнским и сибсовым вкладом PGE2. Cha et al., 282 Devel. Biol. 274-83 (2005); Langenbach et al., 83 Cell 483-92 (1995).
Важно, что анализы мышей ЦОГ-2-/- показали изменения в уровнях гематокрита и неспособность восстанавливаться после 5-FU-индуцированного повреждения BM (Lorenz et al., 27 Exp. Hematol. 1494-502 (1999); полученные данные свидетельствуют о наличии дефектов HSC у взрослых мышей ЦОГ-2-/-, что согласуется с предполагаемой авторами ролью PG в гомеостазе HSC. Для выяснения роли ЦОГ-1 и ЦОГ-2 в регулировании гомеостаза HSC во взрослом организме авторы осуществляли анализ CFUS12 (фиг. 9k,l) и восстановления костного мозга после 5-FU, используя избирательные химические ингибиторы либо ЦОГ-1 (SC560), либо ЦОГ-2 (NS398). Обнаружено, что ингибирование любого фермента значительно изменяет активность CFUS, а также восстановление количества лейкоцитов периферической крови и BM (фиг. 9 m,n) по сравнению с контролями. Кроме того, введение dmPGE2 после обработки 5FU значимо усиливало восстановление BM. Вместе взятые полученные данные свидетельствуют, что ЦОГ-1 и ЦОГ-2 сохраняют свою роль в регулировании гомеостаза HSC у взрослой мыши, также как у рыб данио, и что PGE2 является медиатором такой регуляции HSC.
У пациентов, подвергнутых трансплантации BM, наблюдаются повышенные уровни эндогенного PGE2. Cayeux et al., 12 Bone Marrow Transplant 603-08 (1993). Хотя ингибиторы ЦОГ обычно не дают после трансплантации из-за ингибирования тромбоцитов, исследования авторов установили вероятность того, что введение таких агентов после трансплантации BM человека может нарушать приживление HSC. PGE2 и его аналоги благополучно вводили человеку. Talosi et al., 32 J. Perinat. Med. 368-74 (2004); Thanopoulos et al., 146 Eur. J. Pediatrics 279-82 (1987). Они могут быть применимы для размножения HSC ex vivo или in vivo. Концентрация dmPGE2, используемого для размножения мышиных HSC, находится в физиологическом диапазоне PGE2 в сыворотке человека. Hertelendy et al., 3 Prostaglandins 223-37 (1973). Настоящее описание демонстрирует, что PGE2 функционирует в качестве сильного регулятора HSC у позвоночных и может быть пригодным для лечения пациентов с недостаточностью костного мозга или после трансплантации.
Исследование гематопоэза у рыб данио ранее было сфокусировано на первой волне гематопоэза, называемого примитивным, и происхождении дефинитивных гематопоэтических стволовых клеток в аорте, гонадах и области мезонефроса (AGM) эмбриона данио. Мало известно о продуцировании стволовых клеток AGM у позвоночных, но показано, что runx1 и notch1 необходимы для образования HSC AGM. Также существует генетическая взаимосвязь, при этом notch регулирует runx1. Крупномасштабный химико-генетический скрининг эффекторов индукции стволовых клеток с использованием библиотеки, состоящей примерно из 2500 соединений с известным действием, показал, что химические вещества, которые приводят к продукции простагландина (PG)E2, вызывали увеличение количества стволовых клеток, тогда как химические вещества, которые предотвращали синтез PGE2, приводили к уменьшению количества стволовых клеток. Также обнаружено, что другие химические вещества, такие как сосудорасширяющие средства и сосудосуживающие средства, изменяют количество стволовых клеток, что порождает гипотезу о том, что тонус сосудов во время эмбриогенезе является пусковым механизмом для продуцирования стволовых клеток. Была выдвинута гипотеза о том, что представители пути передачи сигнала Wnt регулируют количества гематопоэтических стволовых клеток, хотя до настоящего времени в таких исследованиях изучали только гомеостаз костного мозга взрослого организма. Исследуется роль передачи сигнала Wnt в продуцировании AGM эмбриона, чтобы идентифицировать возможные генетические взаимодействия с путем notch-runx или с простагландинами. Чтобы определить дополнительные гены, которые принимают участие в образовании стволовых клеток AGM, продолжают крупномасштабный скрининг мутантов с дефектами продукции AGM. Выделено, по меньшей мере, двенадцать мутантов. Идентифицированные гены и пути могут оказать значительное влияние на наше понимание фундаментальной биологии стволовых клеток и могут привести к новым способам лечения таких заболеваний, как серповидноклеточная анемия, талассемия и апластическая анемия.
Способы характеристики путей передачи сигналов, вовлеченных в образование дефинитивных гематопоэтических стволовых клеток во время эмбриогенеза, с использованием в качестве модели рыб данио, включают оценку гипотезы о том, что простагландины регулируют продукцию стволовых клеток AGM, с использованием мутантов, морфантов, трансгенных организмов и химических веществ, и исследование роли пути wnt в образовании HSC AGM и исследование возможных взаимодействий с другими путями передачи сигналов, которые, как известно, активны в области AGM. Генетика рыб данио может быть использована для определения новых путей, вовлеченных в образование HSC AGM во время эмбриогенеза, и позволяет осуществлять крупномасштабный скрининг мутантов в отношении пороков дефинитивного гематопоэза у рыб данио. Она обеспечивает возможность выделения и характеристики некоторых мутантных генов, ответственных за нормальную продукцию HSC AGM.
Работа по определению новых путей, регулирующий эмбриональный гематопоэз, пролила свет на путь CDX-HOX. Обнаружен дефектный ген, ответственный за пониженное количество HSC у мутантов рыб данио kugelig. Davidson et al., 425 Nature 300-06 (2003). Мутант kgg имеет дефицит гематопоэтических стволовых клеток SCL+ во время раннего эмбриогенеза и не имеет экспрессии маркеров предшественников, GATA-1 и runx1. Сосудистая система у мутантных эмбрионов образуется нормально, но в сосудистой системе циркулирует очень мало эритроцитов. Мутантный ген кодирует CDX4, представителя каудального семейства. Млекопитающие имеют три гена CDX, включая CDX1, 2 и 4. Известно, что каудальные гены действуют посредством регуляции генов HOX. «Задние» гены HOX имеют сниженную экспрессию у мутантов kgg. Установлено, что гены HOX действуют ниже CDX4 в развитии крови. Сверхэкспрессия hoxb7 или hoxa9 приводила к эффективному восстановлению гематопоэтического дефекта у мутантов kgg. Чтобы оценить, достаточно ли присутствие CDX4 для определения пути гематопоэтических стволовых клеток во время эмбриогенеза, мРНК CDX4 инъецировали в эмбрионы рыб данио. Обнаружено несколько SCL-позитивных клеток в областях эмбриона, которые в норме не могут образовывать кровь. Тот факт, что наличие cdx4 достаточно для эктопической индукции стволовых клеток крови, позволяет перенести такую работу на систему млекопитающих.
Показано, что несмотря на значительную кроветворную способность in vitro мышиных эмбриональных стволовых клеток (ESC) получение гематопоэтические стволовых клеток (HSC), которые могут восстанавливать облученных мышей, является проблематичным. Исследователи успешно трансплантировали взрослым мышам, облученным летальным дозами, ESC, сконструированные так, чтобы они эктопически экспрессировали hoxB4. Kyba et al., 109 Cell 29-37 (2002). При восстановлении крови наблюдали преобладание миелоидных клеток, вероятно вследствие неспособности полностью формировать HSC взрослого организма из таких эмбриональных популяций. Совместная экспрессия CDX4 и hoxb4 стимулирует мощную экспансию гематопоэтических бластных клеток на поддерживающих стромальных культурах OP9. При внутривенной инъекции летально облученным мышам такие популяции клеток обеспечивают мощную противолучевую защиту и восстанавливают высокий уровень химеризма за счет лимфоидных-миелоидных клеток донора. Wang et al., 102 P.N.A.S. USA 1981-86 (2005).
Чтобы исследовать пути, которые могут проходить ниже пути cdx-hox, использовали анализ на микроматрицах, идентифицируя гены, по-разному экспрессируемые у мутантов kgg и в эмбрионах дикого типа. Raldh2, фермент, необходимый для продукции ретиноевой кислоты (RA), сверхэкспрессируется у мутантов kgg во время ранних стадий кроветворения. Perz-Edwards et al., 229 Devel. Biol. 89-101 (2001); Begemann et al., 128 Devel. 3081-94 (2001). Полученные данные привели к гипотезе о том, что RA может действовать, подавляя кроветворение, и что путь CDX-HOX функционирует, ограничивая продукцию RA, тем самым позволяя проткать кроветворению. Другими словами, путь cdx-hox контролирует передачу сигнала ретиноевой кислоты.
Чтобы это проверить эмбрионы рыб данио дикого типа обрабатывали RA, и, действительно, в них развивалась тяжелая анемия. Обработка эмбрионов kgg DEAB (Perz-Edwards, 2001), химическим веществом, которое блокирует активность raldh2, восстанавливала гематопоэз у мутантов kgg. Обработка DEAB не спасала экспрессию hoxa9a, что свидетельствует о том, что RA действует ниже генов hox. DEAB также индуцировал экспансию эритроидных клеток в эмбрионах дикого типа. DEAB и RA также влияли на образование гематопоэтических предшественников у мышей, возникающих из эмбриоидных телец (EB), происходящих из ES-клеток. Добавление DEAB к EB в период со второго по третий день развития приводило к пяти-восьмикратному увеличению количества «примитивных» эритроидных колоний (CFU-EP), аналогично результатам, полученным на рыбах данио. Наблюдалась сходная стимуляция примитивных эритроидных клеток желточного мешка при действии DEAB. Напротив, обработка RA вызывала общее ингибирование роста колоний всех типов. Вместе взятые полученные результаты свидетельствуют о новой модели, в которой супрессия RA путем CDX-HOX необходима для протекания гематопоэза в желточном мешке. Смотри также Davidson et al., 425 Nature 300-06 (2003); Davidson and Zon, 292(2) Devel. Biol. 506-18 (2006).
Следующим идентифицированным геном является moonshine, ген, который необходим для нормального примитивного и дефинитивного эритропоэза. Мутантным геном является Tif1γ, предполагаемый регулятор хроматина. Ransom et al., 2 PloS 1188-96 (2004). Указанный фактор содержит PHD-палец, бромсодержащий домен, кольцевой палец, и недавно был связан с передачей сигнала BMP посредством взаимодействия с SMAD2 и SMAD437. Dupont et al., 121 Cell 87-99 (2005). Роль указанного фактора в гематопоэзе может быть определена с использованием скрининга супрессоров и энхансеров.
Следующий мутант назван bloodless. Указанный ген необходим как для примитивного гематопоэза, так и для гематопоэза в AGM, хотя дефинитивный гематопоэз восстанавливается. Фенотип bloodless, по-видимому, не является автономным для клетки, и кроме того bloodless контролирует экспрессию SCL и GATA1. Существуют затруднения в картировании такого мутантного гена. Liao et al., 129 Devel. 649-59 (2002).
Работа по выяснению механизма переключения с эритроидного на миелоидный путь показывает, что GATA1 необходим для супрессии миелоидной линии. Galloway et al., 8(1) Devel. Cell 109-16 (2005). Более конкретно, исследование мутанта рыб данио, дефицитного по GATA1, известного как vlad tepes, выявило, что полный кровяной островок трансформировался в миелоидный путь. Указанное интересное изменение судьбы клетки иллюстрирует, что GATA1 и PU.1 антагонизируют активность друг друга. Они могут образовывать комплекс, который регулирует миелоидную и эритроидную программу. Следующая работа показал, что нокдаун PU.1 приводит к изменению предшественников миелоидных клеток в эритроидные клетки. 39 Rhose et al., 8 Devel. Cell 97-108 (2005). Указанное исследование дает обоснование пластичности в гематопоэтической системе. Исследуя зависимость экспрессии генов-мишеней в эритроидных клетках GATA1 и GATA2, показали, что большинство генов абсолютно зависимы от GATA1, для полной экспрессии некоторых генов необходимы и GATA1 и GATA2. Обнаружено, что несколько новых генов абсолютно независимы от GATA.
Характеристика дефицитных по SCL морфантов показала, что такой фенотип SCL MO очень сходен с фенотипом при нокауте по SCL в биологии млекопитающих. SCL необходим для раннего развития гематопоэтических клеток. Аномальная регуляция SCL выражена у мутантов cloche и spadetail, которые имеют дефекты нормального гематопоэза. Dooley et al., 277(2) Devel. Biol. 522-36 (2005).
Пытаясь понять развитие кровяных островков исследователи выдели промотор LMO2 и показали, что проксимальные 163 пары оснований промотора достаточны для индукции экспрессии GFP в развивающемся кровяном островке, а также сосудистой системе. Указанные трансгенные линии рыб были неоценимы для экспериментов по трансплантации. DsRed, а также GFP связывали с промотором LMO2, обеспечивая конструирование двойных трансгенных линий. Такие LMO2-позитивные клетки примитивной линии не дают долговременного восстановления в моделях трансплантации ранних эмбрионов или во взрослом организме. Zhu et al., 281(2) Devel. Biol. 256-269 (2005); Mead et al., 128 Devel. 2301-08 (2001); Oates et al., 98 Bloodl?92-1801 (2001); Pratt et al., 11 Physiological Genomics 91-98 (2002); Huber et al., 11 Current Biology 1456-61 (2001).
Основная цель заключалась в разработке трансплантации гематопоэтических клеток для системы рыб данио. Анализы гематопоэтических популяций проточной цитометрией показал, что с помощью прямого рассеяния и бокового рассеяния можно разделять все линии гематопоэтической системы у рыб данио. Можно разделять эритроидные, миелоидные и лимфоидные клетки, а также фракцию предшественников. Это обеспечило трансплантацию специфичных популяций клеток в мутантные эмбрионы, не имеющие крови. GFP-позитивное мозговое вещество почек от донора инъецировали в такие эмбрионы, которые обычно бескровны. Через шесть месяцев после трансплантации все клетки в кровообращении были зелеными, что свидетельствует о том, что они получены от донора. Эмбрионы vlad tepes и bloodless, по-видимому, являются прекрасными хозяевами. Кроме того, вторичные трансплантаты проявляли долговременную восстанавливающую активность в мозговом веществе почек. Также показано, что мозговое вещество взрослого организма можно использовать для восстановления гематопоэза у летально облученных взрослых рыб данио. Traver et al., 104 Blood 1298-1305 (2004). Такой протокол трансплантации оказался очень полезным для последующих исследований в области биологии стволовых клеток. Смотри также Traver et al., 4 Nature Immunol. 1238-46 (2003).
Анализы клеток целого мозгового вещества почек (WKM) рыб данио на основе ограничивающего разведения могут показать концентрацию HSC в мозговом веществе почек данио. Поскольку в таких исследованиях определяют количество трансплантируемых стволовых клеток, то они обеспечивают функциональный анализ для сравнения функции стволовых клеток у рыб данио дикого типа по сравнению с мутантными рыбами. С этой целью осуществляли исследования восстановления посредством удаления гематолимфоидной системы немеченого реципиента с использованием сублетальных доз гамма-излучения и затем трансплантации разведений в диапазоне от 5000 до 500000 GFP-меченых клеток WKM хозяину. Периферическую кровь использовали в качестве клеток-носителей в анализе разведения WKM, и она служила в качестве негативного контроля при инъекции отдельно. Через три месяца после трансплантации WKM вырезали из хозяина и анализировали проточной цитометрией, чтобы измерить процентное содержание донорных клеток GFP+ в миелоидном гейте. Реципиентов оценивали либо как «успешные», либо как «неудачные» в отношении приживления трансплантата от донора. Используя биномиальную статистику максимальных пределов, определили, что частота встречаемости HSC в WKM рыб данио составляет 1 на 61910 клеток с 95% доверительным интервалом 50798-79244 клеток. Указанное количество очень сходно с количеством у мыши, которая имеет ~ 1 на 50000-130000 HSC на клеточный объем костного мозга. Smith at al., 88 P.N.A.S. USA 2788-92 (1991). Следовательно, полученные данные свидетельствуют о том, что количество стволовых клеток в популяции мозгового вещества является эволюционно консервативным.
В работе также исследовали продукцию стволовых клеток AGM рыб данио и путь notch. AGM, как предполагают, формируется из латеральной мезодермы, присутствующей в раннем сомитогенезе. Ткань экспрессирует flk1. По мере того, как он мигрирует, он начинает экспрессировать специфичный для артерии маркер, названный gridlock. Позднее, на стадии восемнадцати сомитов, клетки экспрессируют tie1 и tie2 и продолжают медиально мигрировать и образуют твердый тяж. Тяж становится полым и превращается в аорту. Через тридцать часов транскрипционный фактор runx1 сначала экспрессируется вентрально. Немного позже обнаруживают c-myb-позитивные гематопоэтические клетки в вентральной стенке аорты. Дорсальная часть аорты экспрессирует транскрипционный фактор T-бокса, называемый tbx20. Процесс, происходящий у рыб данио по-видимому очень сходен с процессом у других позвоночных, включая человека, мышей, цыплят и лягушек. Galloway and Zon, 53 Curr. Topics Devel. Biol. 139-58 (2002).
Также исследовали роль runx1 в развитии AGM. Подобно нокауту у мышей нокдаун runx1 у рыб данио приводил к уменьшению количества клеток в AGM, которые экспрессируют c-myb. Сверхэкспрессия runx1 приводила к увеличению количества стволовых клеток в аорте и эктопической экспрессии c-myb в вене. Примитивный гематопоэз протекает нормально у морфанта runx1. Полученные данные обеспечивают доказательство необходимости runx1 для образования AGM и дополнительно доказывают, что runx1 является фактором, который достаточен для образования дефинитивных стволовых клеток. Оценка роли пути notch в образовании AGM выявила, что runx1 действует ниже или параллельно передаче сигнала notch.
У мутанта mindbomb отсутствует убиквитинлигаза E3 для дельта-лиганда рецепторов notch. По существу у мутантов mindbomb полностью отсутствует передача сигнала notch, и не образуются гематопоэтические стволовые клетки в AGM. Itoh et al., 4 Devel. Cell 67-82 (2003). Сверхэкспрессия runx1 восстанавливает количество c-myb-позитивных клеток в AGM у мутанта mindbomb. Это свидетельствует о том, что runx является важной мишенью notch. В предварительных исследованиях при добавлении длительно действующего простагландина E2 к мутанту mindbomb не выявлено какого-либо типа спасения. Это может быть обусловлено нарушением способности клеток отвечать на простагландин E2; передача сигнала notch вероятно необходима в более ранний период развития AGM, чем простагландин E2. Кривые зависимости от дозы простагландина E2, полученные для мутанта mindbomb, могут пролить свет на этот вопрос. Напротив, эмбрионы Notch IC, которые имеют повышенное количество стволовых клеток через 36 часов после оплодотворения можно инкубировать с ингибиторами ЦОГ, чтобы определить, играет ли роль передача сигнала простагландина в опосредовании повышающей регуляции HSC AGM. Подобным образом можно исследовать другие гематопоэтические мутанты.
Можно использовать уникальную трансгенную систему для исследования пути notch. Одну трансгенную линию, несущую промотор теплового шока (HS), управляющий gal4, спаривали с другой линией, которая имеет последовательности UAS, управляющие внутриклеточным доменом notch (активированная форма, названная NICD). Lawson et al., 128 Devel. 3675-83 (2001). При этом эмбрион получают сигнал активированного notch при тепловом шоке. Показано, что после теплового шока в AGM таких эмбрионов c-myb и runx1 экспрессируются с повышенной интенсивностью и на большей площади, в которую входят дорсальная и вентральная аорта и вена. Такая эктопическая экспрессия не сопровождалась изменением пролиферации клеток, что показано на основании иммуноокрашивания антителом против фосфогистона H3 или мечения BrdU. Такое изменение пути можно предотвратить морфолино-олигонуклеотидами runx1,что свидетельствует о том, что runx1 действует ниже notch.
Играет ли активация notch подобную роль в гематопоэзе во взрослом организме, исследовали с использованием дважды трансгенных рыб, сверхэкспрессирующих notch в зависимости от условий. Рыб облучали сублетальными дозами 2000 рад и затем подвергали тепловому шоку, активируя notch. Гематопоэз в мозговом веществе анализировали с использованием FACS при прямом и боковом рассеянии, чтобы исследовать фракции миелоидных, лимфоидных клеток и клеток-предшественников. На седьмой день после теплового шока рыбы, экспрессирующие NICD, имели увеличенные фракции миелоидных клеток и клеток-предшественников, а на четырнадцатый день имело место увеличение количества лимфоидных клеток по сравнению с диким типом. Восстановление после облучения было более быстрым после активации notch. Кроме того, runx1, scl и Imo2 подвергаются повышающей регуляции во взрослом организме сразу после теплового шока. Полученные данные подтверждают, что путь notch-runx, который авторы изобретении обнаружили в эмбрионах, также работает у взрослых рыб данио. Смотри Burns et al., 19(19) Genes and Devel. 2331-42 (2005).
Также доказано, что рыбы данио применимы для характеристики заболеваний. Разработаны несколько мутантов рыб, которые имеют нарушения, эквивалентные заболеванию человека. Смотри, например, Dooley and Zon, 10 Curr. Op. Genet. Devel. 252-56 (2000). Например, обнаружены некоторые дефекты мембран в системе, основанной на рыбах данио, которые влияют на эритропоэз. В исследованиях идентифицировали мутантные гены BAND 3, BAND 4.1 и ген спектрина. Интересно, что мутант BAND 3, по-видимому имеет дефект, который очень сходен с HEMPAS или CDA типа 2. BAND 3 локализуется в полюсах веретена деления в делящихся эритроидных предшественниках, где он регулирует возникновение врожденной дисэритропоэтической анемии. Смотри, например, Liao et al., 127(3) Devel. 127(3): 5123-32 (2000); Paw et al., 34(1) Nature Genet. 59-64 (2003).
Недавно выделили grx5 в качестве мутантного гена shiraz. Shaw et al., 440 Nature 96-100 (2006). Глутаредоксин 5 локализован в митохондриях и необходим для образования кластеров железо-сера. Также выделен митохондриальный ген импортера железа, дефектный у мутанта frascati, и у нокаутированной по frascati мыши развивается анемия, сходная с анемией у рыб. Смотри также Donovan et al., 403 Nature 776-81 (2000); Donovan et al., 100 Blood 4655-60 (2002); Wingert et al., 131(24) Devel. 6225-35 (2004); Fraenkel et al., 115 J. Clin. Invest. 1532-41.(2005); Wingert et al., 436 Nature 1035-39 (2005).
В качестве части работы по проекту расшифровки генома данио Trans-NIH Zebrafish Genome Initiative сконструировали чип Affyrnetrix. Изучали более десяти мутантов, влияющих на гематопоэз у рыб данио, посредством исследования картин экспрессии генов у мутантов и рыб дикого типа в разных временных точках. Weber et al., 106(2) Blood 521-30 (2005). Авторы также провели оценку крупномасштабных профилей экспрессии с помощью отдельных скринингов, основанных на гибридизации in situ. В указанном исследовании идентифицировали более 160 генов, участвующих в специфичной для крови программе.
Роль пути wnt в образовании HSC AGM и возможно взаимодействие с другими путями передачи сигналов, которые, как известно, активны в области AGM, также имеют значение. На основании изящной работы по выяснению роли пути wnt в самовосстановлении HSC в мозговом веществе взрослого организма (Reya et al. 423 Nature 409-14 (2003)) показано, что путь wnt может регулировать продукцию HSC AGM. Канонический путь передачи сигнала wnt заключается в активации GSKβ и последующей транслокации β-катенина в ядро, где он взаимодействует с одним из двух сходных транскрипционных факторов, TCF или LEF1, активируя регулируемые wnt гены (фиг. 10). Путь wnt подвергается отрицательной регуляции факторами dickkopf и APC. Экспрессия wnt3 в три раза стимулирует экспансию HSC у мышей (Reya, 2003; Wilbert et al., 423 Nature 448-52 (2003)), но неожиданно нокаут β-катенина в HSC не приводит к дефекту самовосстановления. Cobas et al., 199 J. Exp. Med. 221-29 (2004). В более поздних исследованиях показано, что ингибиторы GSK3B приводят к уменьшению дифференцировки HSC.
Несмотря на то, что известно о действии передачи сигнала wnt на регуляцию самовосстановления стволовых клеток, мало информации существует о wnt-индукции дефинитивных стволовых клеток в AGM. В поддержку гипотезы о том, что передача сигнала wnt играет роль в индукции HSC с помощью способов ОТ-ПЦР в дифференциальном дисплее идентифицировали β-катенин как дифференцированно экспрессируемый в области AGM во время образования HSC у мыши (REF). Чтобы определить роль передачи сигнала wnt в AGM можно исследовать линии трансгенных рыб, у которых можно специфично индуцировать путь wnt. Получено несколько трансгенных рыб, у которых промотор теплового шока запускает экспрессию различных представителей пути wnt. Примеры рыб для исследования включают: тепловой шок-wnt8, тепловой шок-dickkopf и тепловой шок-доминантно-негативные мутанты TCF. Простой импульс тепла, сходный с импульсом, используемым в исследованиях notch, можно использовать для изучения влияния ингибирования или повышения передачи сигнала wnt на продукцию HSC AGM.
Пытаясь лучше понять роль передачи сигнала wnt в образовании AGM, исследовали рыб «тепловой шок-wnt8». wnt8 экспрессируется с задней стороны эмбрионы в области хвостовой почки. Воздействие тепловым шоком на эмбрион на стадии 18-22 сомитов приводит к значительному увеличению популяций стволовых клеток в AGM, судя по экспрессии runx1 и c-myb. Активация wnt8 приводила к экспансии стволовых клеток, но в этом процессе сходную роль могут играть другие wnt. Может быть важно определить, какие белки wnt экспрессируются в развивающейся области AGM. Клетки CDX4+ будут исследованы с помощью анализа на микроматрицах. Можно использовать информатику для оценки идентичности wnt и рецепторов wnt, экспрессируемых в таких HSC. Кроме того, будут исследованы кДНК wnt 3, wnt5 и wnt8 с помощью гибридизации in situ. Другие wnt, установленные с использованием микроматриц, будут исследованы в ISH. Используя полное временное исследование воздействия теплового шока в ходе развития можно точно определить период времени, в котором передача сигнала wnt необходима для образования HSC. Также можно исследовать линии тепловой шок-доминантно-негативный TCF и тепловой шок-dickkopf, чтобы ингибировать передачу сигнала wnt в AGM. Доминантно-негативный TCF элиминирует классический путь, тогда как конструкция dickkopf-тепловой шок ингибирует и классический и неклассический пути wnt. Гематопоэтические стволовые клетки полностью отсутствовали после теплового воздействия на указанные линии. Чтобы дополнительно проанализировать, необходим ли wnt для образования HSC AGM, можно тестировать несколько агонистических и антагонистических по отношению к wnt химических веществ, например, способами, описанными в данной публикации.
Исследования экспрессии генов после теплого шока в трансгенных эмбрионах HS wnt8, HS dkk и HS-DN TCF проводили с использованием способов оценки экспрессии на основе гибридизации и кПЦР-анализа. Маркеры гематопоэтических стволовых клеток, включая SCL, LMO2, GATA-2, GATA-1, runx1, PU.1 и ikaros, могут быть полезны для определения влияния передачи сигнала wnt на популяцию HSC. Подобным образом, экспрессия маркеров терминально дифференцированных лимфоидных (rag1, LCK, иммуноглобулин, T-клеточные), миелоидных (миелопероксидаза, L-пластин) и эритроидных (рецептор эритропоэтина, Erb2) популяций клеток крови, а также эндотелиальных (fli1, flk1, tie2 и tie1) клеток будет исследована после индукции и ингибирования wnt. Кроме того, экспрессию wnt в области AGM можно непосредственно наблюдать, используя линию рыб данио TOP-FLASH. Рыбы, имеющие репортер TOP-FLASH, экспрессируют GFP под контролем индуцируемого промотора, в который входят полимеризованные сайты связывания LEF1. Dorsky et al., 241 Devel. Biol. 229-37 (2002). Известно, что репортер активен при образовании задней мезодермы. Вероятно, что cdx4, описанный ранее, конкурирует с wnt. Экспрессию репортера TOP-FLASH можно тщательно исследовать в развивающейся области AGM. Рыбы, на путь wnt у которых действуют тепловым шоком, применимы для дополнительного исследования роли передачи сигнала wnt в гомеостазе мозгового вещества во взрослом организме. Оценка восстановления мозгового веществ почек после облучения у трансгенных рыб HS-wnt8 и HS-DN TCF помогла бы понять необходимость передачи сигнала wnt в пролиферации и поддержании HSC. Кроме того, полезны исследования с использованием лимитирующего разведения и исследования конкурентной репопуляции в случае индуцированного тепловым шоком мозгового вещества по сравнению с нормальным мозговым веществом.
Взаимосвязь путей wnt и notch с индукцией простагландином стволовых клеток AGM также может иметь важной значение для гематопоэза. Эмбриональные фенотипы потери функции notch и потери функции wnt очень сходны, в обоих случаях утрата функции приводит к существенной недостаточности стволовых клеток AGM. Это приводит к гипотезе о том, что один путь может перекрестно регулировать другой. Авторы изобретения планируют оценку того, будет ли конструкция тепловой шок-wnt8 спасать мутант mindbomb, а также может ли доминантно-негативный мутант TCF быть спасен активацией notch ICD. Указанный тип анализа должен привести к лучшему пониманию точного периода времени активации указанных путей в ходе эмбриогенеза. Это также позволит авторам изобретения больше разобраться во взаимодействии указанных путей. Мутантных рыб (и/или рыб, которым инъецированы морфолино-олигонуклеотиды) также можно использовать для объединения недостаточности по notch и недостаточности по wnt, а также увеличения количества функциональных фенотипов. Исследование молекулярных маркеров, которые описаны выше, и характеристика Notch должны установить, взаимодействуют ли оба пути в регуляции индукции стволовых клеток и/или пролиферации, восстановлении и дифференцировке стволовых.
Показано, что представители пути wnt взаимодействуют с простагландинами. Например, в случае моделей злокачественной опухоли ободочной кишки, индуцированной wnt, нестероидные средства, которые блокируют ЦОГ-1 или 2, предотвращают образование злокачественной опухоли. Как описано выше, PGE2 приводит к увеличению количества стволовых клеток в AGM. PGE2 может спасать дефицитные по wnt эмбрионы. Ингибитор ЦОГ-2 может блокировать эффекты HS-wnt8. Другие модификаторы HSC согласно настоящему изобретению включают модификаторы пути Wnt. Примерами модификаторов пути Wnt, которые, как обнаружено, ингибируют HCS, являются кенпауллон (влияние на HDAC, но не на GSK3b) и вальпроевая кислота (влияние на HDAC, но не на GSK3b). Обнаружено, что усилителями HSC, модифицирующими путь Wnt, являются хлорид лития и BIO.
Используя трансгенных рыб данио, экспрессирующих активаторы или репрессоры wnt, исследовали влияние передачи сигнала wnt на развитие HSC в области аорто-гонадного мезонефроса (AGM). Индукция передачи сигнала wnt приводила к повышению образования HSC, тогда как ингибирование снижало продукцию HSC. У взрослых рыб данио повышенная активность wnt увеличивала количество клеток-предшественников во время восстановления мозгового вещества почек после облучения. Поскольку (PG) E2 регулирует образование и гомеостаз HSC у позвоночных, то исследовали взаимодействие путей wnt и PG во время образования HSC и при восстановлении мозгового вещества, воздействуя на эмбрионы TOP:dGFP лекарственными средствами, которые регулируют передачу сигнала простагландина. Обнаружено, что диметил-PGE2 (dmPGE2), сильный индуктор образования HSC, усиливает передачу сигнала wnt, тогда как ингибитор циклооксигеназы индометацин (indo) фактически приводил к отсутствию активности wnt. Ингибирование образования HSC при подавлении wnt частично восстанавливали обработкой dmPGE2, тогда как индукция HSC при сверхэкспрессии wnt была обратима при воздействии индометацина. Индометацин также блокировал wnt-опосредованное увеличение количества предшественников в мозговом веществе почек после облучения у взрослых рыб. PGE2 индуцировал активность wnt в AGM мышей of TOP:gal, свидетельствуя о молекулярном консерватизме взаимодействия wnt и PG и роли wnt в образовании HSC.
Более конкретно, передача сигнала Wnt через его основной транскрипционный медиатор β-катенин играет важную роль в регулировании формирования тканей, в решении судьбы клеток и пролиферации во многих ситуациях эмбрионального развития, включая развитие и дифференцировку органов. Смотри фиг. 10. Показано, что активность Wnt усиливает самовосстановление HSC во взрослом организме и усиливает репопуляцию стволовых клеток после трансплантации HSC мышам NOD/SCID. Также обнаружено, что β-катенин дифференциально экспрессируется в областях AGM у эмбрионах мышей в период e10-12. Играет ли роль передача сигнала wnt во время образования HSC у рыб данио, определяли, используя индуцируемые тепловым шоком активаторы и репрессоры пути wnt. Коротко, wnt-индуцируемые эмбрионы собирали и подвергали воздействию теплового шока в течение двадцати минут при 38°C. Генотипы сортировали по экспрессии GFP и анализировали HSC AGM по экспрессии runx1/cmyb in situ. Индукция wnt8 тепловым шоком на стадии пяти сомитов приводила к повышенному образованию HSC в AGM через 36 часов после оплодотворения, тогда как отмена передачи сигнала wnt посредством индукции dkk и dnTCF в значительной степени ингибировала экспрессию runx1/cmyb экспрессия. Полученные данные являются первым доказательством, полученным для какого-либо организма, того, что передача сигнала wnt необходима для образования HSC AGM.
Анализ восстановления после облучения также использовали для того, чтобы исследовать роль передачи сигнала wnt в гематопоэтическом гомеостазе у рыб данио. Трансгенных рыб, экспрессирующих связанные с wnt гены, облучали сублетальными дозами и инициировали индукцию генов теплового шока посредством инкубации в течение ночи при 38°C на второй день после облучения. Мозговое вещество почек собирали в разных временных точках после облучения, которые указаны ранее в случае экспериментов с простагландином. Фиг. 11. Использование рыб тепловой шок-wnt8 показало, что увеличение популяции предшественников по сравнению с контролями на десятый день после облучения сходно с увеличением, наблюдаемым в случае PGE2. Ингибирование передачи сигнала wnt в случае теплового шока dkk или dnTCF, существенно изменяет кинетику восстановления мозгового вещества и может приводить к полному отсутствию регенерации мозгового вещества и летальному исходу.
Клинические испытания на пациентах с мутациями APC показали, что ингибирование синтеза простагландина приводит к снижению wnt-опосредованного образования полипов. Кроме того, недавние исследования на линиях клеток рака ободочной кишки свидетельствуют о взаимодействии между простагландином и путем передачи сигнала wnt. Такие взаимодействия исследовали in vivo, используя трансгенную линию рыб данио с репортером wnt, TOP:dGFP. При пятидесяти процентной эпиболии эмбрионы либо не подвергали воздействию (контроль), либо подвергали воздействию индометацином или PGE2, и количественно оценивали передачу сигнала wnt, активированную в эмбрионах по индукции GFP, запускаемой с сайта связывания wnt. Анализ изменений экспрессии GFP в голове проводили гибиридизацией in situ. По сравнению с контролем обработка PGE2 заметно усиливала активность wnt, тогда как индометацин сильно уменьшал экспрессию GFP. Фиг. 12. Полученные данные представляют собой первое документальное подтверждение, полученное in vivo, взаимодействии путей wnt и простагландина во время эмбрионального развития.
Кроме того, индометацин и dmPGE2 использовали для исследования взаимодействия путей wnt и простагландина во время развития HSC и при восстановлении мозгового вещества после повреждения. На фиг. 13 показаны возможные точки взаимодействия путей PG и wnt. Wnt-опосредованное усиление экспрессии runx1/cmyb в эмбрионах wnt8, подвергнутых тепловому шоку на стадии пяти сомитов, может быть блокировано обработкой индометацином. Кроме того, dmPGE2 может спасать от ингибирующего влияния активации dkk на образование HSC AGM через 36 часов после оплодотворения, как показано гибридизацией in situ в отношении runx1/cmyb. Однако предварительные результаты показывают, что обработка dmPGE2 не достаточна для спасения образования HSC в эмбрионах, сверхэкспрессирующих dnTCF.
Чтобы определить, может ли обработка, влияющая на путь простагландина, изменять активность wnt при репопуляции мозгового вещества почек во взрослом организме, дополнительно исследовали влияние dmPGE2 и индометацина в линиях Top:dGFP. DmPGE2 значимо усиливал активность wnt на третий день после облучения, тогда как индометацин ингибировал экспрессию GFP. Фиг. 14. Чтобы выяснить, может ли модулирование передачи сигнала простагландина модифицировать wnt-опосредованное влияние на восстановление мозгового вещества почек после облучения, гены wnt активировали тепловым шоком при 38°C на второй день после облучения и затем действовали на путь простагландина лекарственными средствами в первый день после теплового шока. Рыб hs:wnt8-GFP подвергали воздействию индометацином, тогда как на трансгенных рыб dkk1, axin и dnTCF действовали dmPGE2. Цельное мозговое вещество почек анализировали с помощью FACS на десятый день после облучения. Обнаружили, что обработка индометацином сильно снижает wnt-опосредованное увеличение популяции клеток-предшественников, что свидетельствует о том, что уровни PGE2 могут непосредственно модулировать передачу сигнала wnt in vivo.
Указанные эксперименты свидетельствуют о том, что фармакологическая обработка, влияющая на активность wnt, посредством модулирования передачи сигнала PG обеспечит новый способ терапевтического регулирования гомеостаза HSC.
Далее описано несколько вариантов с использованием не ограничивающих примеров.
ПРИМЕРЫ
Пример 1. Дизайн химического скрининга и подтверждающая проверка.
Совпадающие по возрасту эмбрионы дикого типа распределяли в 48-луночных планшетах (~5 эмбрионов/лунку) с отдельными тестируемыми соединениями и выдерживали от стадии 3 сомитов до 36 часов после оплодотворения. Использовали три библиотеки соединений: NINDS Custom Collection (1040), SpecPlus Collection (960) и BIOMOL ICCB Known Bioactives (480). Пять процентов (123/2480) соединений были токсичными, приводя к гибели или тяжелым морфологическим нарушениям. Осуществляли гибридизацию in situ в отношении runx1 и cmyb, чтобы оценить HSC. Соединения тестировали в концентрации 10 мкМ, 20 мкМ и 50 мкМ. Специфичность стволовых клеток оценивали, используя flk1 через 36 часов после оплодотворения. PGE2, PGI2, dmPGE2 и все ингибиторы ЦОГ (Sigma) использовали в концентрации 10 мкМ-20 мкМ.
Количественную оценку (количество эмбрионов с изменениями в HSC/количество оцениваемых эмбрионов) runx1/cmyb проводили, используя следующие критерии: нормальные/неизмененные=непрерывная линия эндотелиальных клеток runx1/cmyb+ и редкие гематопоэтические кластеры. Уменьшено/отсутствует=уменьшение количества клеток runx1/cmyb+, включая наличие больших пробелов в линии HSC, изолированные позитивные клетки или отсутствие экспрессии. Увеличено/избыток=увеличение количеств клеток runx1/cmyb+, включая много кластеров HSC, загущенная линия HSC или эктопическая экспрессия.
Конфокальная визуализация
Прижизненно обработанные бигенные эмбрионы рыб данио через 36 часов после оплодотворения заливали в 1% агарозу с низкой температурой плавления, содержащую 0,4 мг/мл трикаина-S для конфокальной визуализации. Трансгенные репортерные линии cmyb-GFP создавали, используя BAC, содержащую геномную последовательность промотора cmyb (Galloway, Zhu, Lin, Zon, не опубликовано); рыб lmo2:DsRed создавали как описано 27. Для количественной оценки HSC подсчитывали cmyb/lmo2+-позитивные клетки в проекциях из стопки изображений z-stack (n=10/обработку).
Нокдаун морфолино-олигонуклеотидами
Морфолино-олигонуклеотиды (GeneTools), направленные против ЦОГ-1 и ЦОГ-2, PGE2-синтазы и EP2 и EP4 рыб данио (Grosser et al., 2002; Cha et al., 2006, Pina et al., 25 Arterioscler. Thromb. Vase. Biol. 315-20 (2005)), инъецировали (40 мкМ) в эмбрионы рыб данио на стадии одной клетки. В экспериментах по спасению эмбрионы на стадии 3 сомитов, в которые инъецировали MO, обрабатывали 10 мкМ dmPGE2.
Профили экспрессии генов на микроматрицах
Клети, позитивные по gata1:GFP (12 сомитов), lmo2:GFP (12 сомитов и 35 часов после оплодотворения) и cd41:GFP (35 часов после оплодотворения) сортировали с помощью FACS; суммарную ДНК очищали и анализировали, используя чипы генов рыб данио Affymetrix, как описано ранее. Weber et al., 106 Blood 521-30 (2005).
Количественная ПЦР
кПЦР осуществляли, используя ранее описанные наборы праймеров. Bums et al., 19 Genet Devel. 2331-42 (2005). Эмбрионы (n=50) обрабатывали как описано. кПЦР (отжиг при 60°C) осуществляли, используя SYBR Green Supermix в системе регистрации ОТ-ПЦР iQ5 Multicolor (BioRad) (n=10 повторов), и определяли относительные уровни экспрессии. Пары праймеров для EP2 и EP4 определяли способами, хорошо известными в данной области. кПЦР РНК цельного KM (n=15/переменную) осуществляли на третий день после облучения как описано. Burns et al., 19 Genes Devel. 2331-42 (2005). кПЦР РНК S-клеток (собранных в Stat-60, Tel-Test) осуществляли, используя набор Stratagene Sybrgreen на приборе для кПЦР Stratagene. Последовательности праймеров PG определяли способами, хорошо известными в данной области.
Масс-спектроскопия
PGE2 и стабильный метаболит PGI2, 6-кето-PGF1α, измеряли, используя ВЭЖХ-тандемную масс-спектрометрию. Этилацетатные экстракты гомогенизированных эмбрионов снабжали соответствующими мечеными стабильными изотопами внутренними стандартами (d4-PGE2 и d4-6-кето-PGF1α) и давали возможность взаимодействовать с метоксиламином. Наблюдали следующие массовые переходы: m/z 384→272 (PGE), m/z 398→368 (6-кето-PGF1α и TxB2).
Анализ восстановления после облучения
Взрослых рыб данио подвергали воздействию 23 Гр γ-излучения. На второй день после облучения рыб обрабатывали в течение ночи контрольным ДМСО, dmPGE2 (10 или 50 мкМ), индометацином (10 мкМ), SC560 (10 мкМ) или NS398 (10 мкМ) в воде, в которой содержали рыб. Цельный KM, выделенный в 0, 2, 4, 7, 10, 14 день, подвергали анализу FACS FSC/SSC, чтобы идентифицировать гематопоэтические линии (n=5/обработку x 3 повтора). Traver et al., 104 Blood 12980305 (2004).
Анализы дифференцировки клеток ES
Анализы дифференцировки гематопоэтических клеток ES осуществляли, как описано ранее. Kyba et al. 100(1) P.N.A.S. USA 11904-10 (2003); Wang et al., 102 P.N.A.S. USA 19081-86 (2005). dmPGE2 (10, 20 или 100 мкМ) или индометацин (20, 100 мкМ) добавляли на четвертый день и на пятый день во время экспансии EB. Анализы образования колоний на метилцеллюлозе M3434 и анализы колоний на OP9 проводили на 6 день и анализировали на 8 и 5 день, соответственно. Тип колоний идентифицировали с помощью морфологического анализа; повторяющиеся химические воздействия усредняли, определяя количество репортерных колоний (n=3 повтора минимум).
Мышиные колониеобразующие единицы - селезенка (CFU-S)
Клетки WBM из бедра мышей C57B1/6 8-недельного возраста инкубировали ex vivo с (1 мкМ/106 клеток) dmPGE2, индометацином, SC560, NS398 или контрольным EtOH на льду в течение двух часов. Два независимых образца BM обрабатывали (n=5/обработку x 2 повтора) для каждой переменной. Реципиентных мышей летально облучали дробной дозой 10 Гр. 6×104 нефракционированных клеток BM, обработанных dmPGE2 или контрольных, инъецировали в ретроорбитальную область облученным реципиентным мышам. Селезенку вырезали на десятый или двенадцатый день, взвешивали и фиксировали в растворе Буэна; подсчитывали гематопоэтические колонии на селезенку. 1×105 клеток/реципиента трансплантировали после обработки ингибиторами ЦОГ. Отсортированные с помощью FACS клетки BM ckit+sca1+lineage- обрабатывали как указано выше и трансплантировали в дозе либо 100 клеток/реципиента или 300 клеток/реципиента.
Повреждение костного мозга 5-фторурацилом
Мышей обрабатывали 5-FU (150 мг/кг), как описано. Venezia et al., 2004. SC560, NS398, dmPGE2 (1 мг/кг) или контрольный EtOH вводили посредством в/б-инъекции в 1, 5, 9, 13 и 17 день после инъекции. Периферическую кровь получали на седьмой день и четырнадцатый день, количественно оценивали и подвергали FACS-анализу по нескольким линиям (eBioscience) в отношении B220/IgM (B-лимфоидная), CD4/8 (T-лимфоидная), Mac1/Gr1 (миелоидная), Ter119/CD71 (эритроидная) и ckit/sca1 (стволовые/предшественники). Мышей умерщвляли на 16 день и костный мозг выделяли, количественно оценивали и анализировали, используя FACS.
Конкурентная трансплантация при лимитирующем разведении
WBM мышей CD45.1 C57B1/6 инкубировали с dmPGE2 или контрольным EtOH ex vivo, как описано. Обработанные тестируемые клетки независимо трансплантировали облученным реципиентам CD45.2 (n=5/переменную x 2) с необработанными конкурирующими клетками CD45.1/CD45.2 в следующих соотношениях: 15000:200000 (0,075:1), 50000:200000 (0,25:1), 200000:200000 (1:1), 2000000:200000 (10:1). Периферическую кровь (PB) получали на шестой, двенадцатой и двадцать четвертой неделе после трансплантации и лейкоциты анализировали, используя FACS, чтобы определить восстановление в тесте для каждой серии обрабатываемых популяций. Частоту химеризма PB>5% использовали для расчета количества репопулирующих клеток с помощью программы L-Calc (Stem Cell Technologies). В случае образцов PB, полученных через двенадцать недель и через двадцать четыре недели измеряли восстановление по нескольким линиям, используя FACS, как описано выше.
Пример 2. Дополнительные модуляторы HSC.
Эмбрионы рыб данио подвергали скринингу, как описано выше. Другая группа модификаторов HSC, идентифицированных способами, описанными в данной публикации, и входящих в объем настоящего изобретения, включает в себя модификаторы вторичных мессенджеров цАМФ/P13K/AKT, которые могут быть ниже пути передачи сигнала PG. Модификаторы, которые ингибируют HSC, включают PD9805, KT5720, H89, U0126 и вортманнин. Модификаторы, которые увеличивают количество HSC, включают 8-бром-цАМФ и форсколин. К другой группе модификаторов HSC, которые также могут действовать ниже пути передачи PG, относятся модификаторы вторичного мессенджера Ca2+. Модификаторы включают ингибиторы HSC и усилители HSC, перечисленные в Таблице 9:
Примеры модификаторов вторичного мессенджера Ca2+
Следующая группа модификаторов HSC, идентифицированных способами скрининга, описанными в данной публикации, и входящих в объем настоящего изобретения, включает в себя модификаторы передачи сигнала NO/ангиотензин, которые могут взаимодействовать с путями передачи сигналов PG и wnt. Такие модификаторы включают ингибиторы HSC и усилители HSC, перечисленные в Таблице 10:
Примеры модификаторов передачи сигнала NO/ангиотензин
Способы скрининга рыб данио согласно настоящему изобретению также применяли для идентификации других модуляторов HSC, взаимодействие которых с путями передачи сигналов PG или wnt в настоящее время неясно. Такие соединения, также входящие в объем настоящего изобретения, включают соединения, которые либо ингибируют, либо увеличивают количество HCS, которые показаны в Таблице 11:
Примеры модуляторов HSC
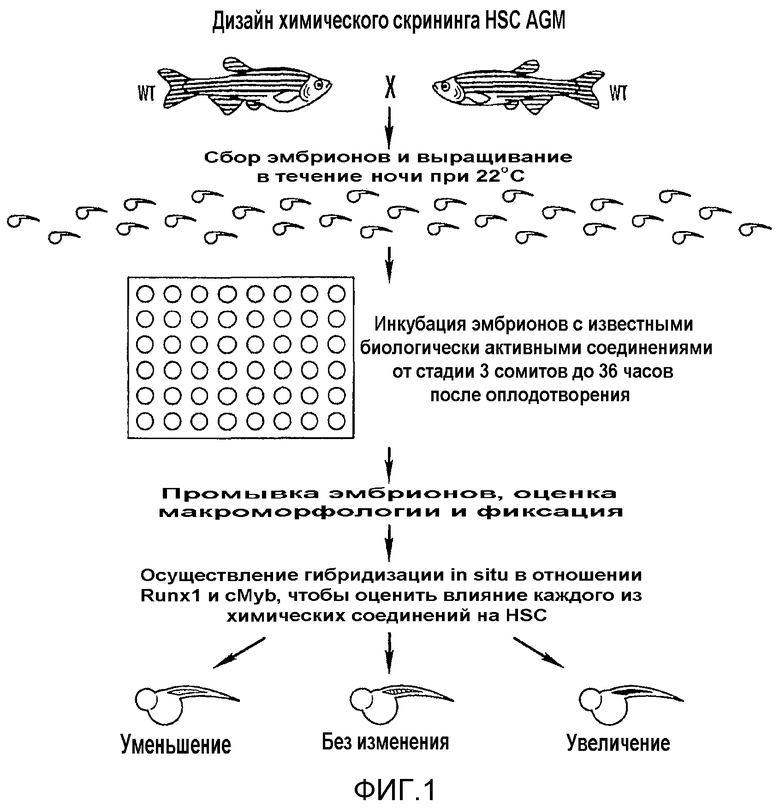
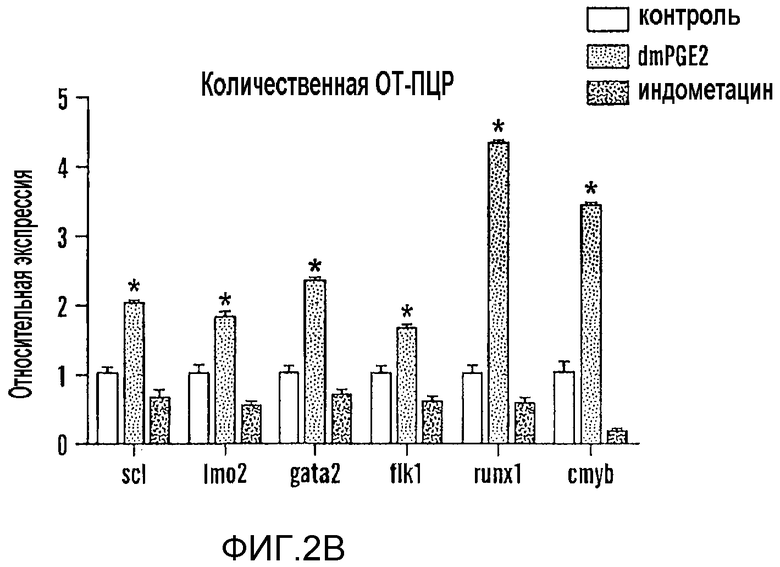
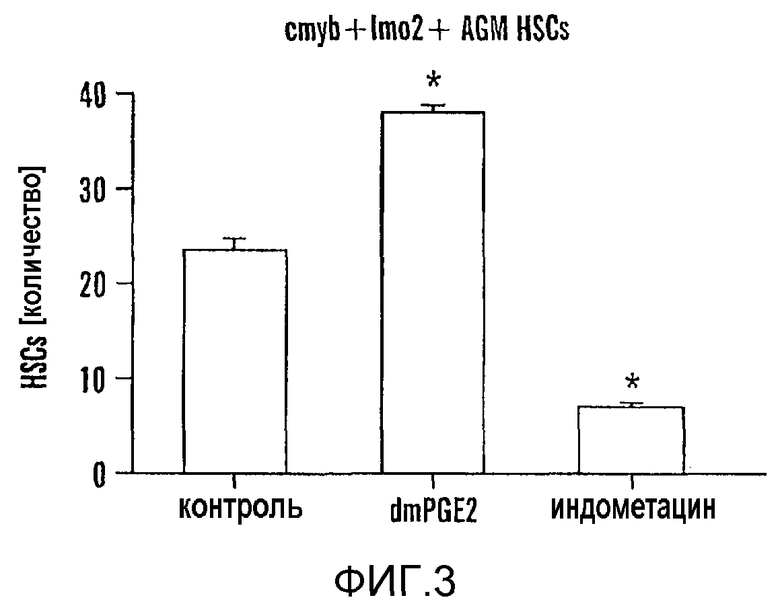
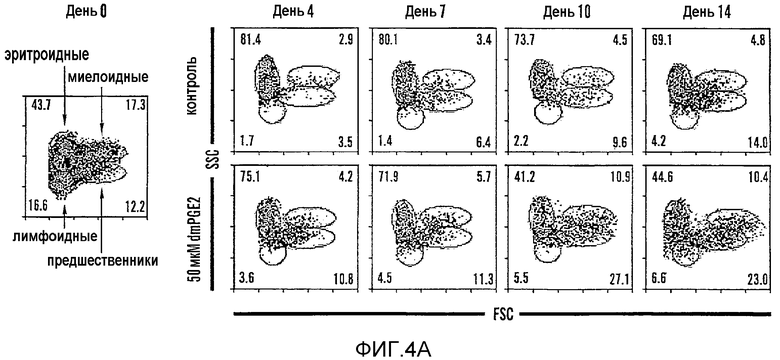

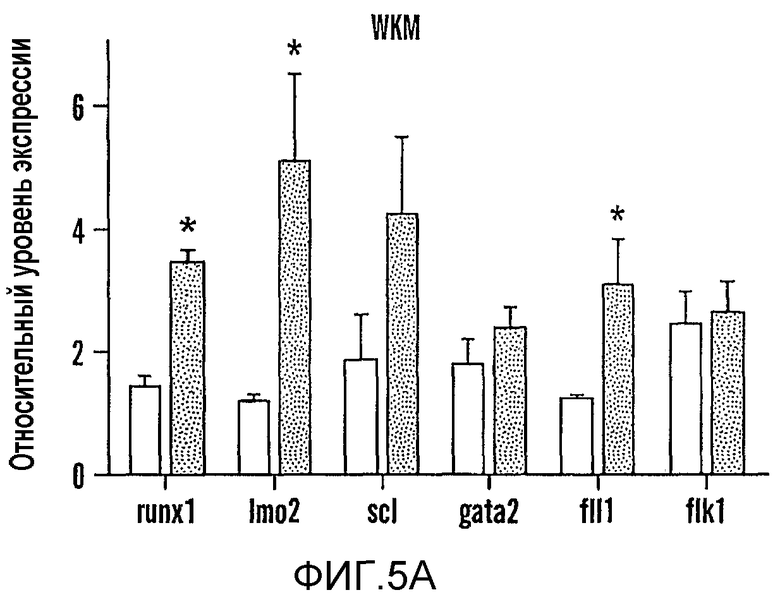
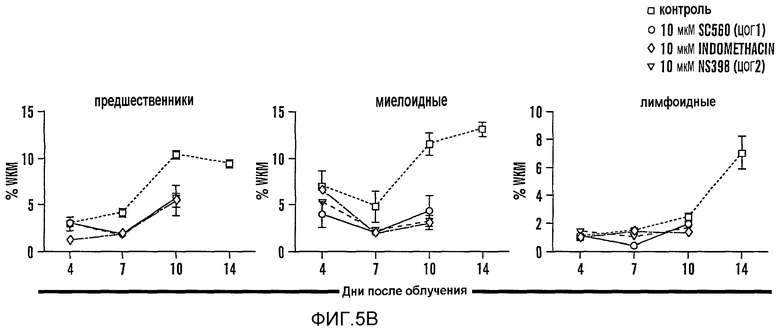
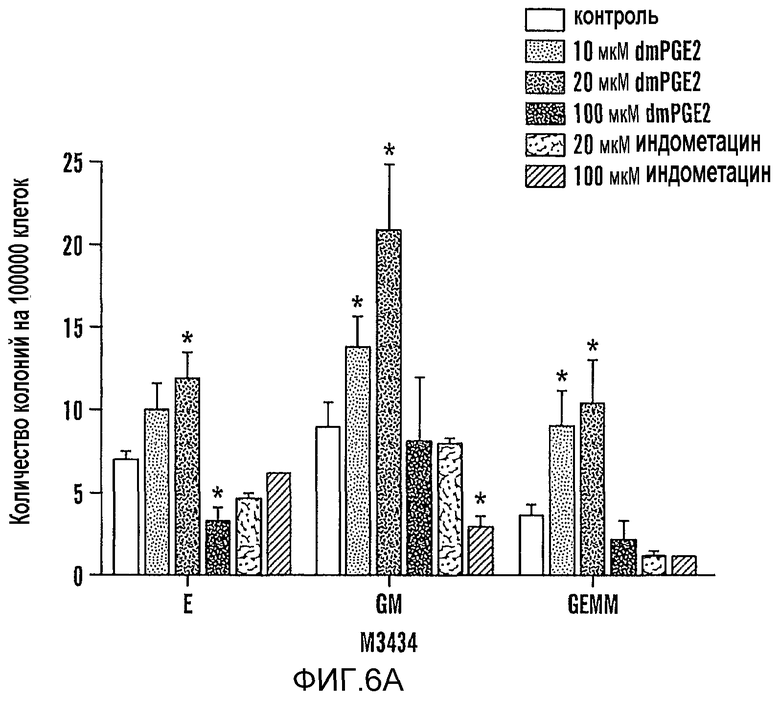
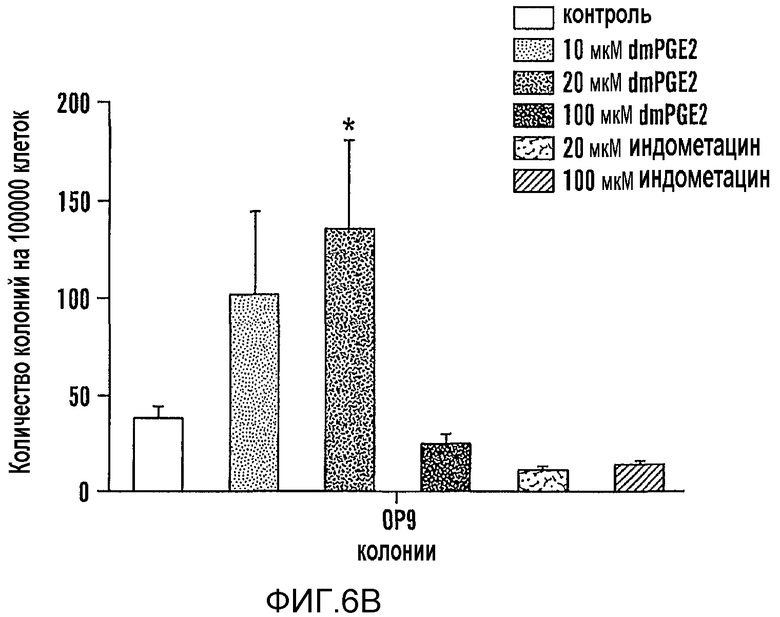
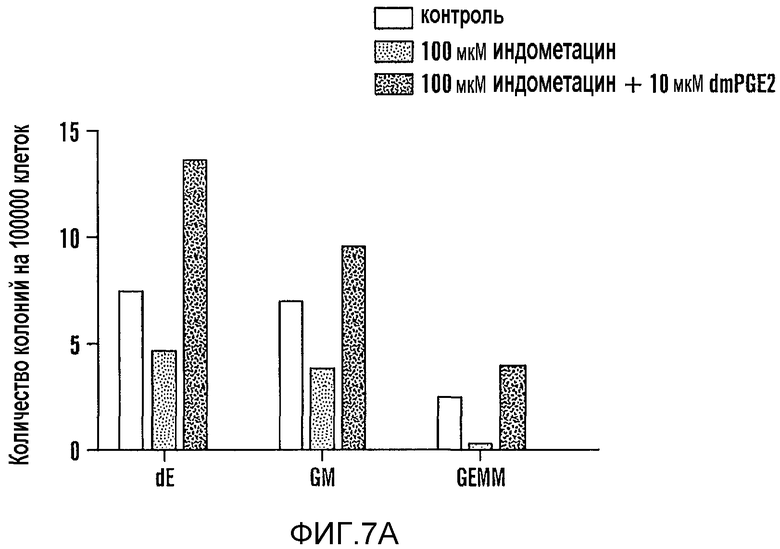
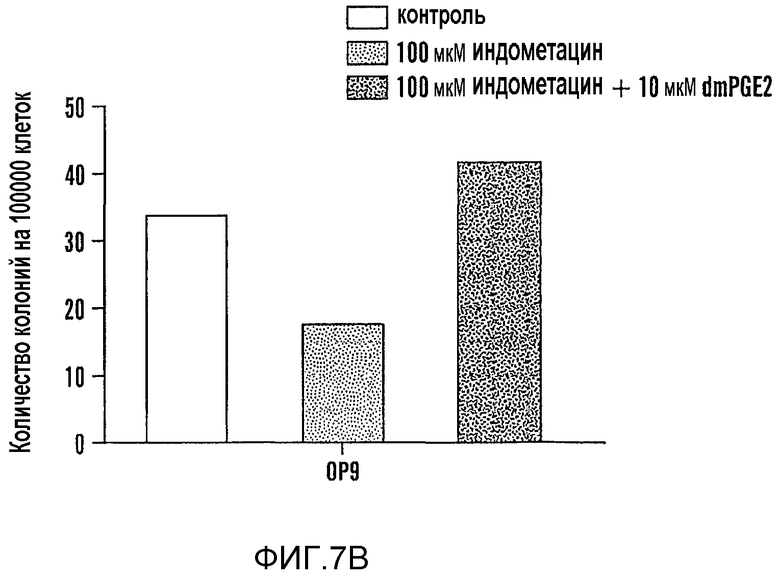
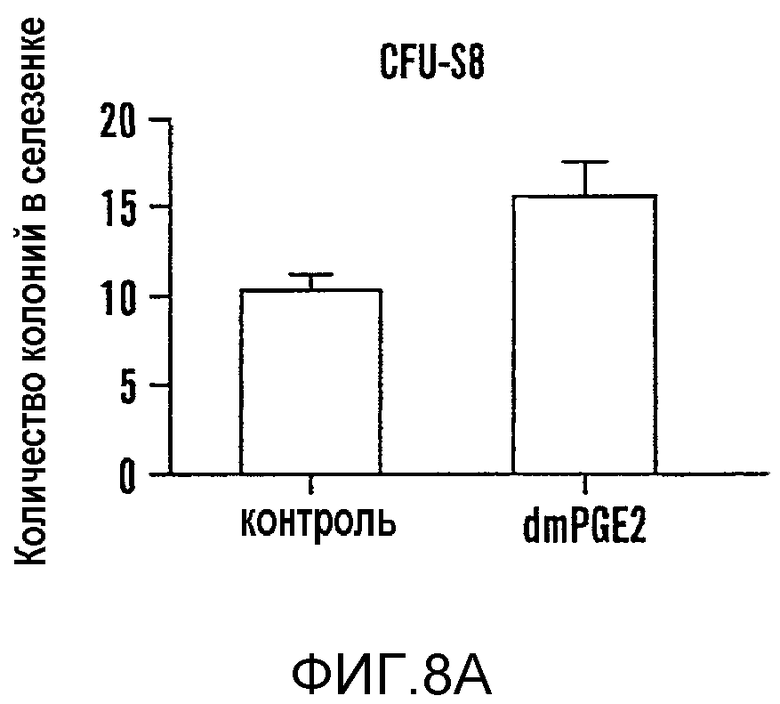
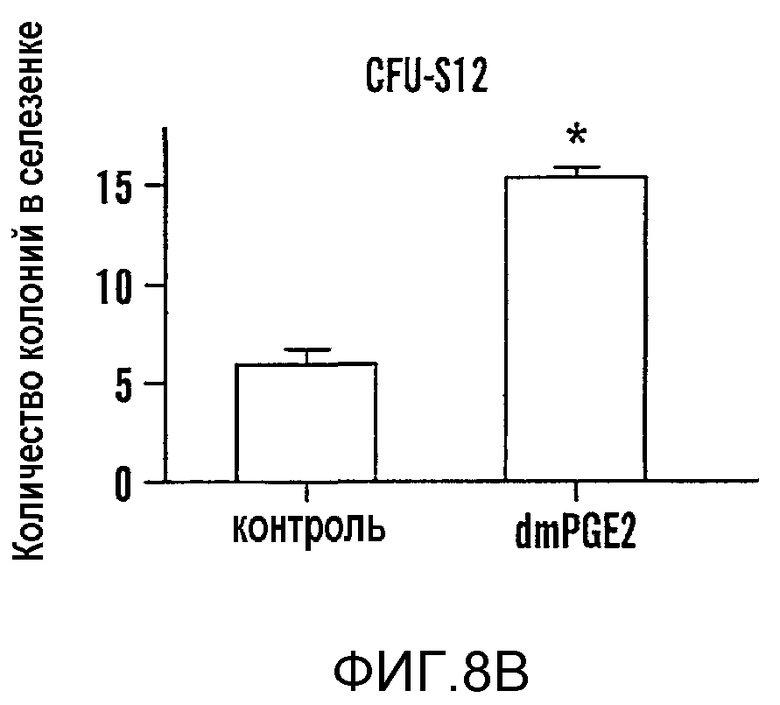

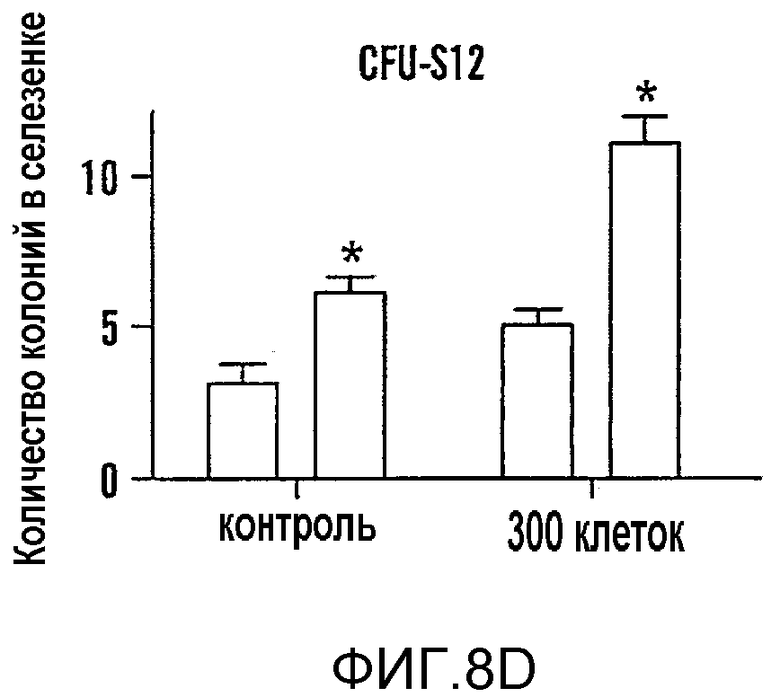
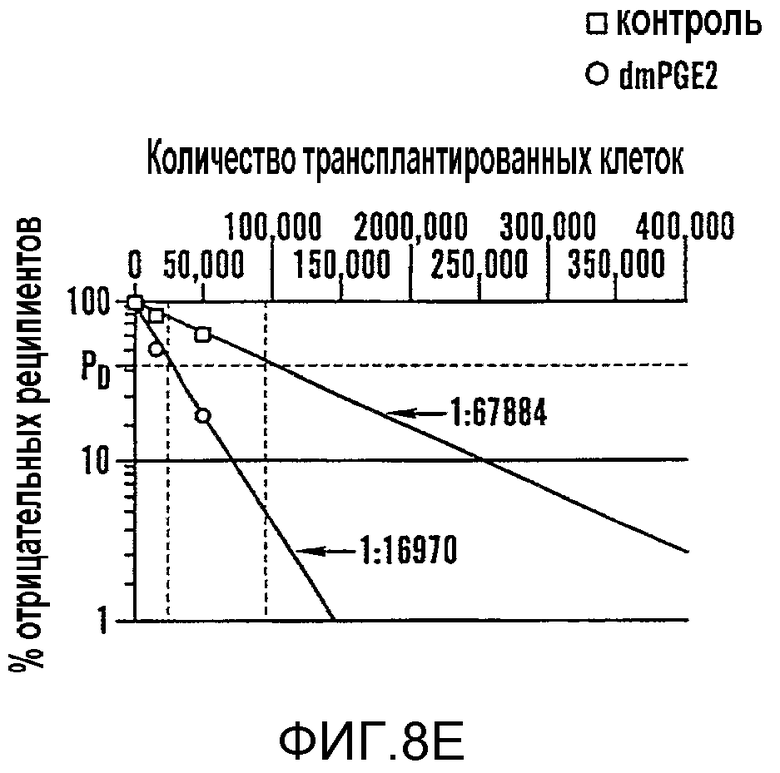
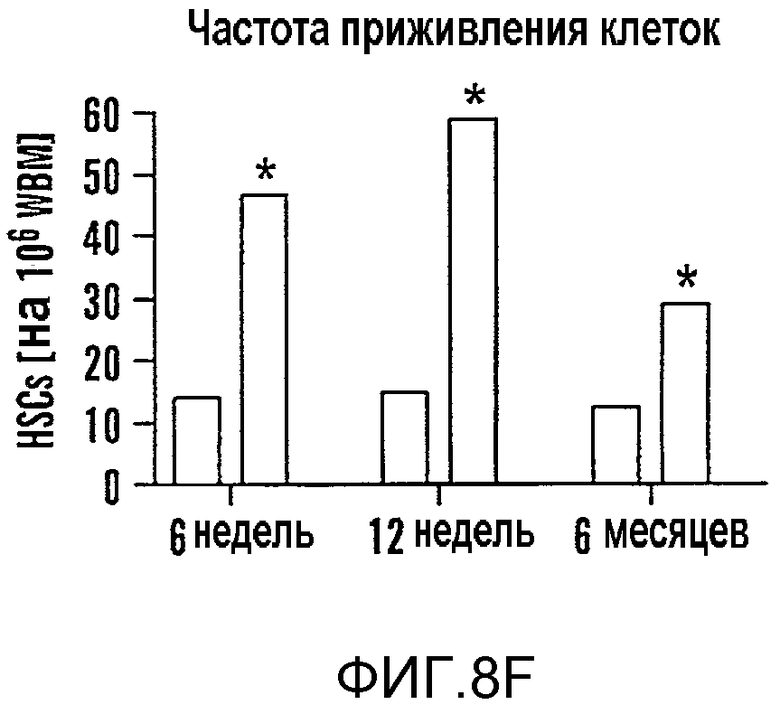
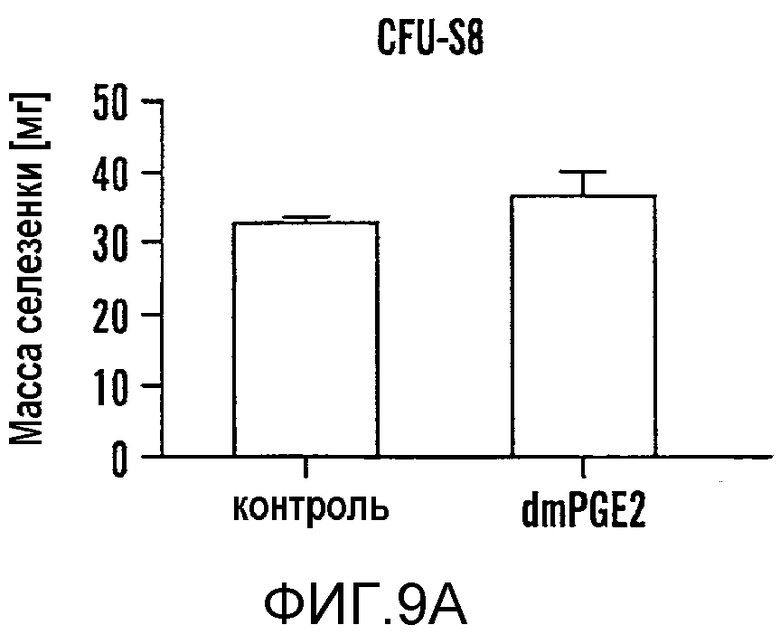
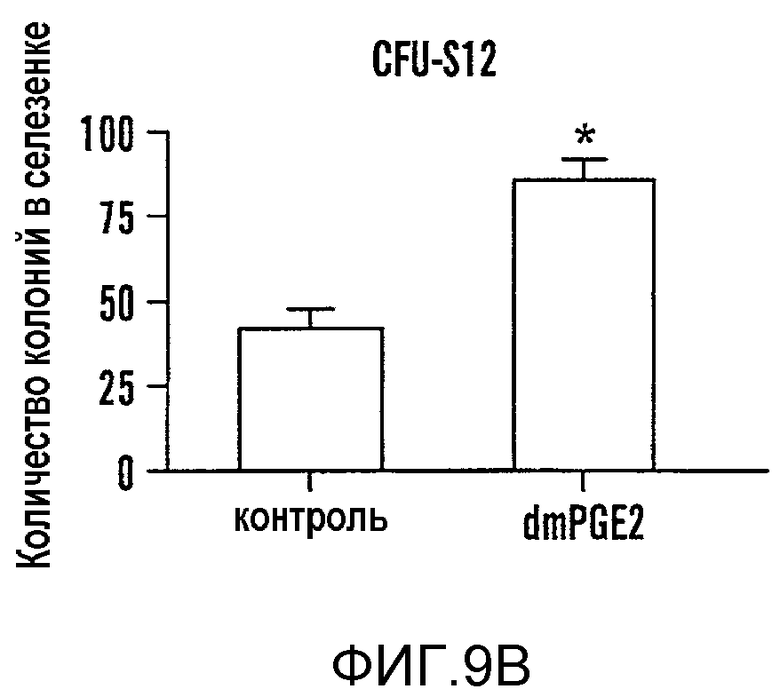
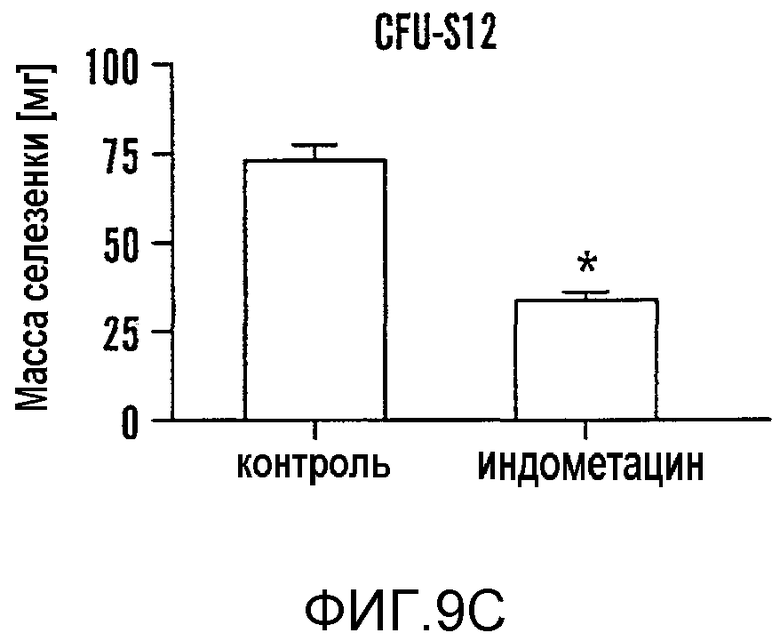
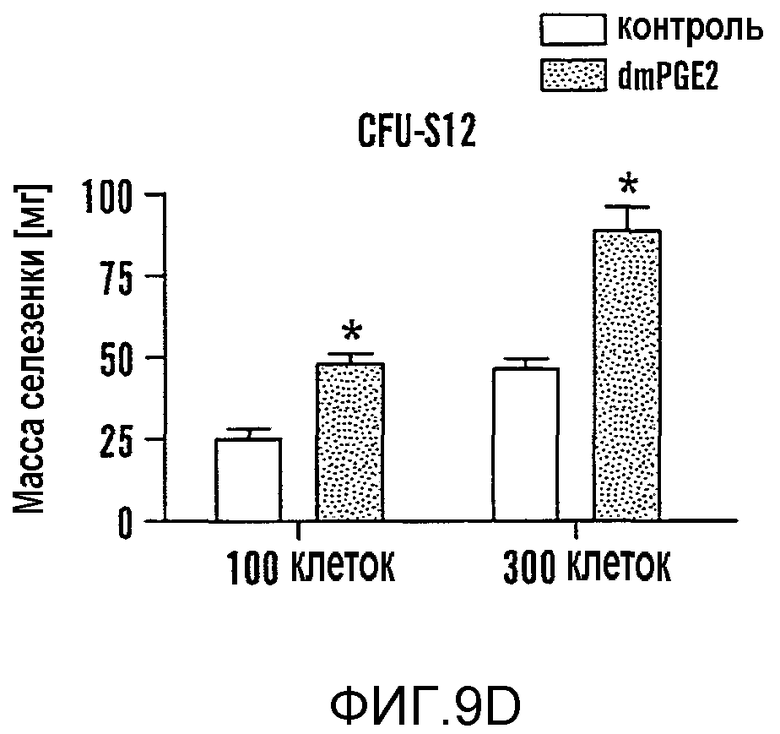
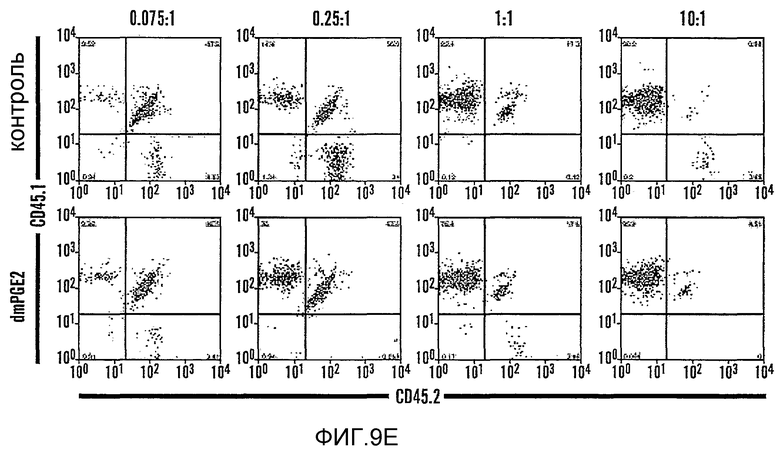
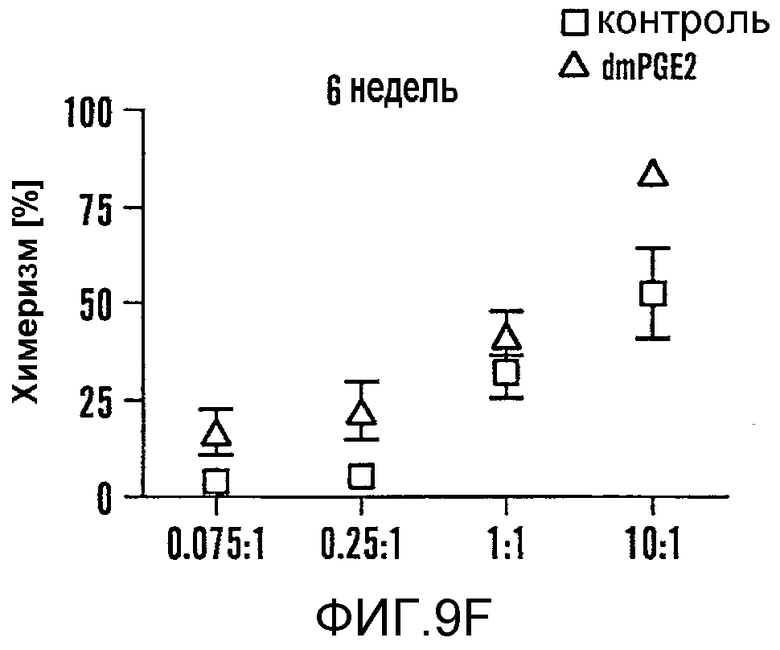
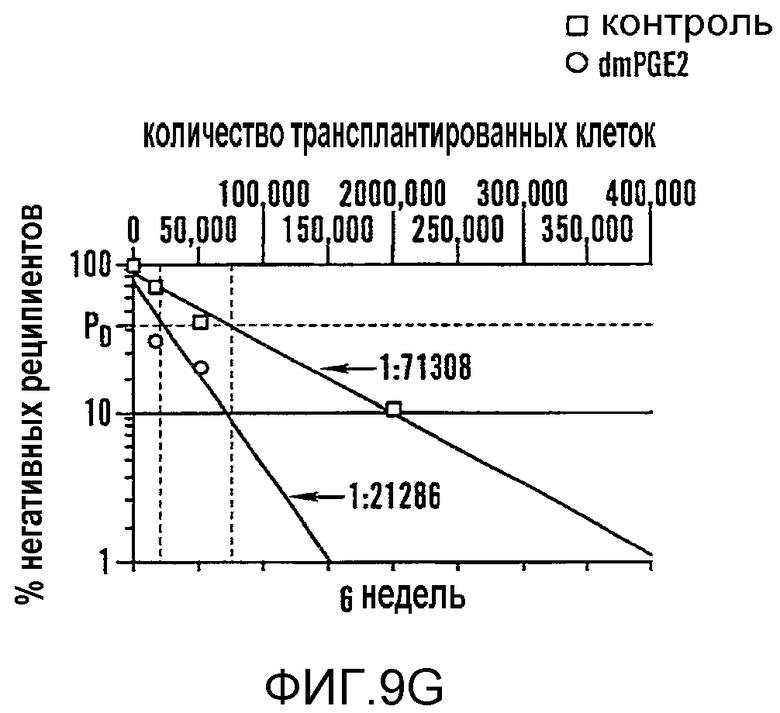
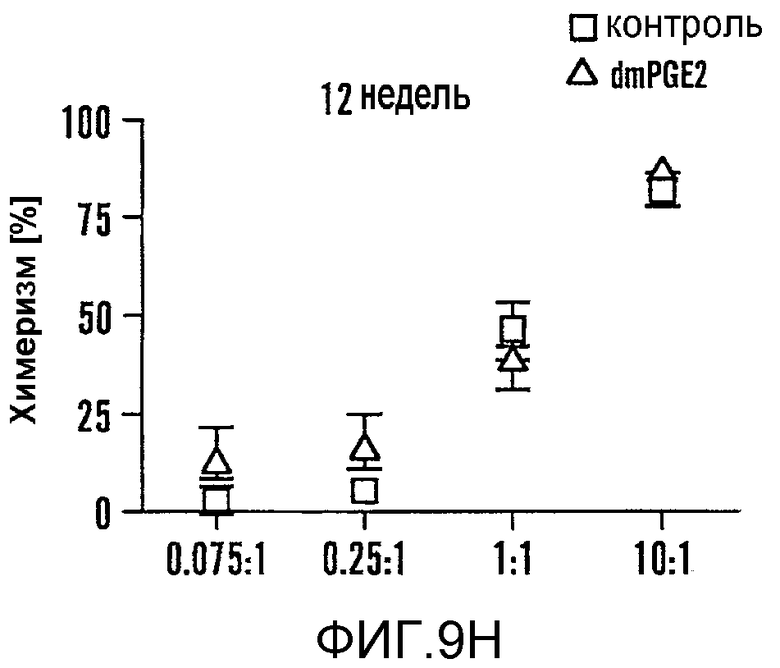


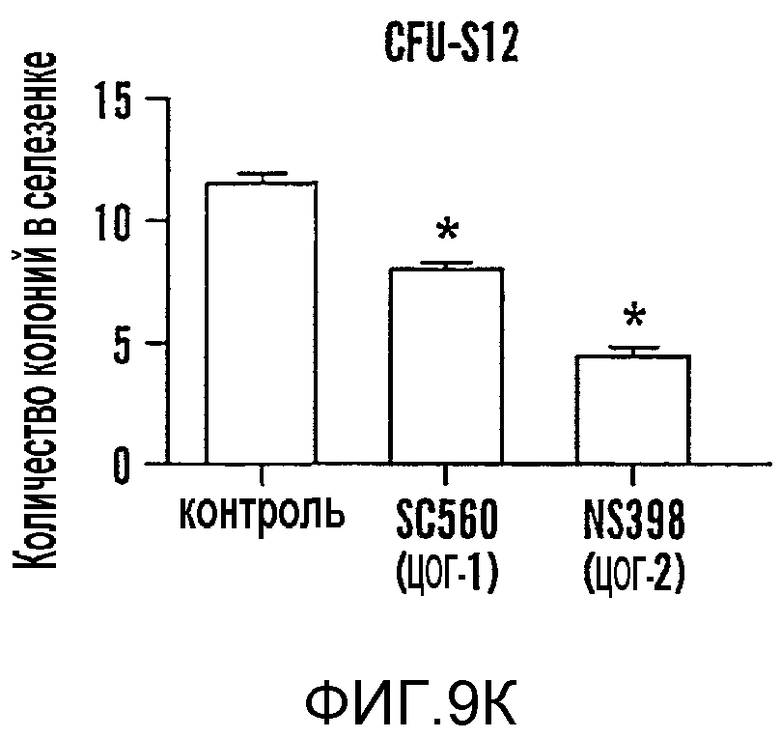
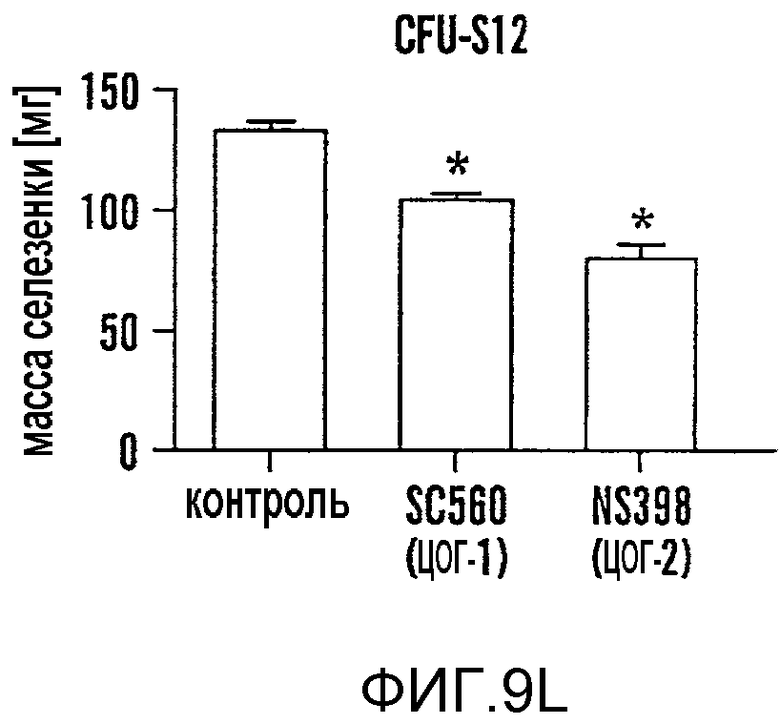
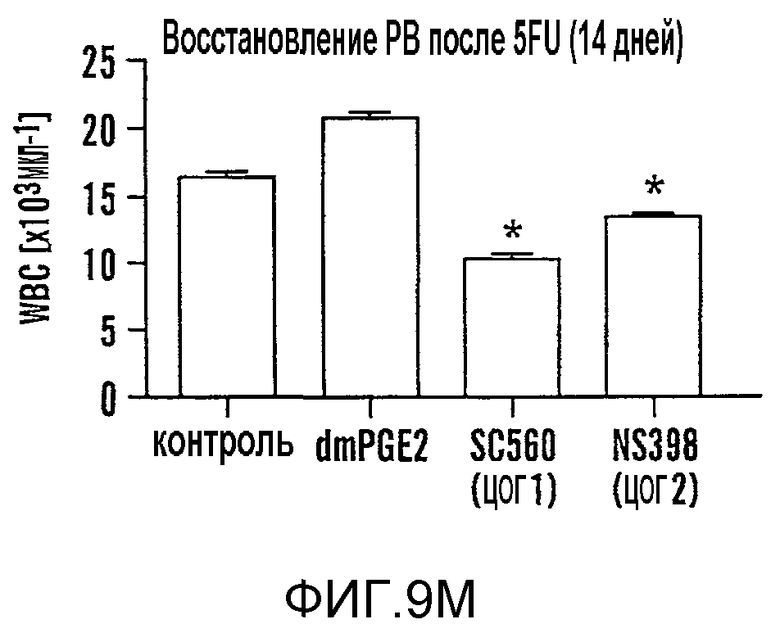
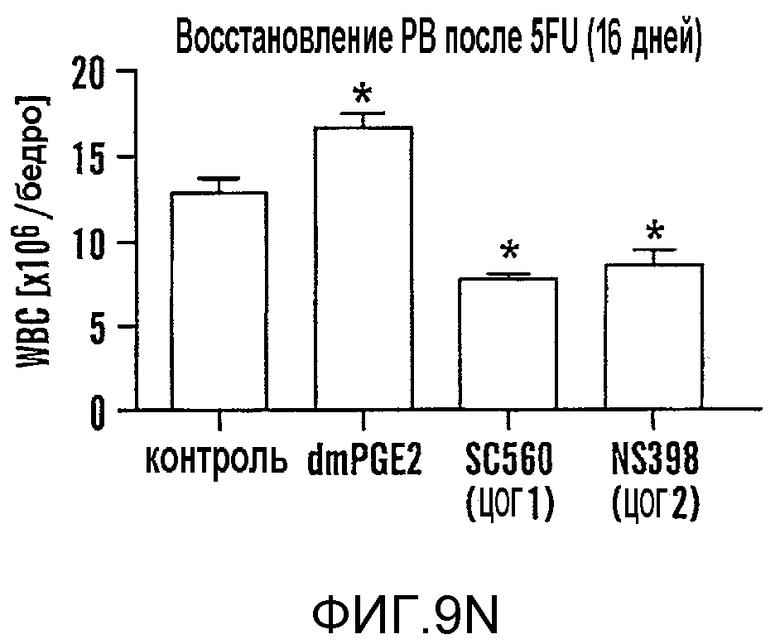
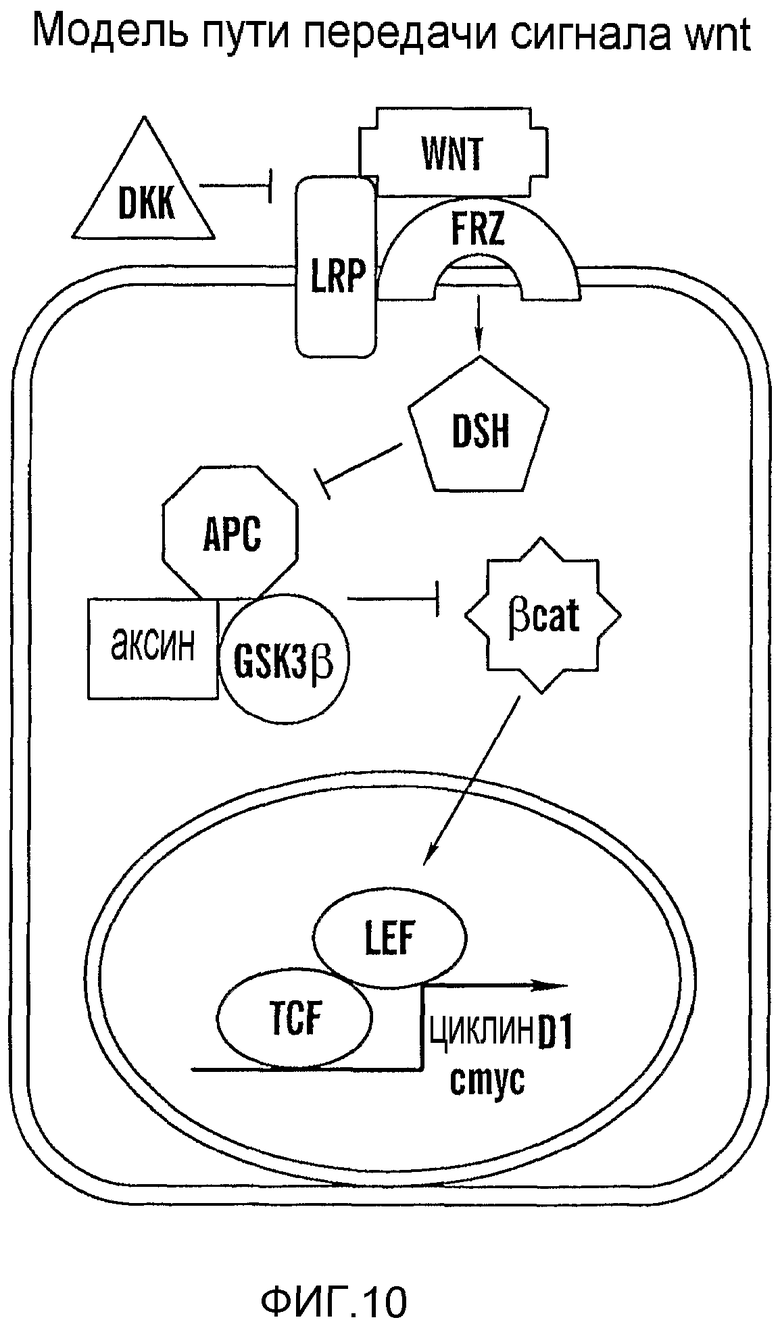
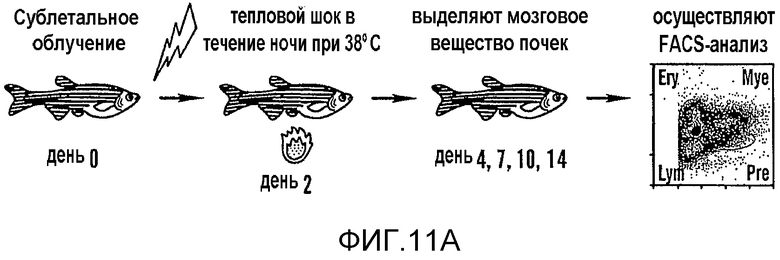
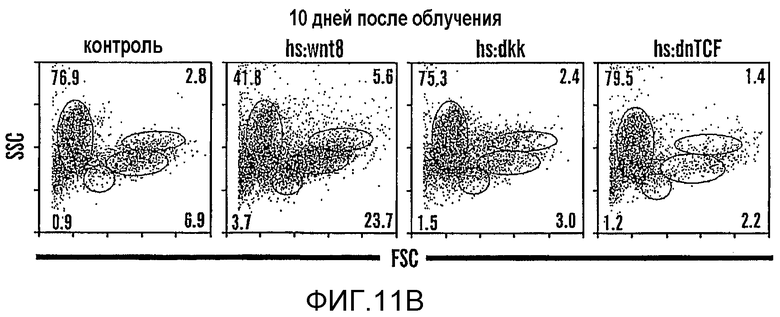
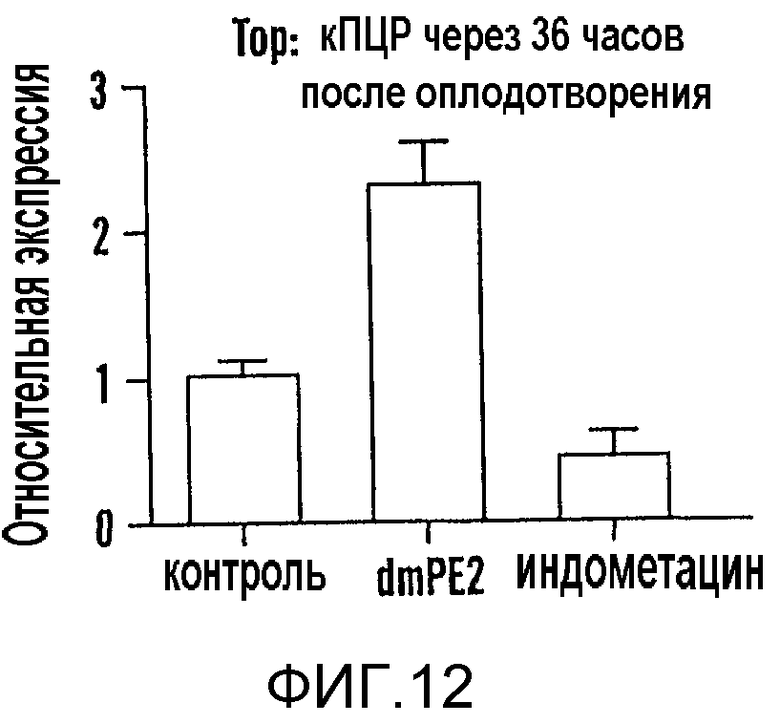
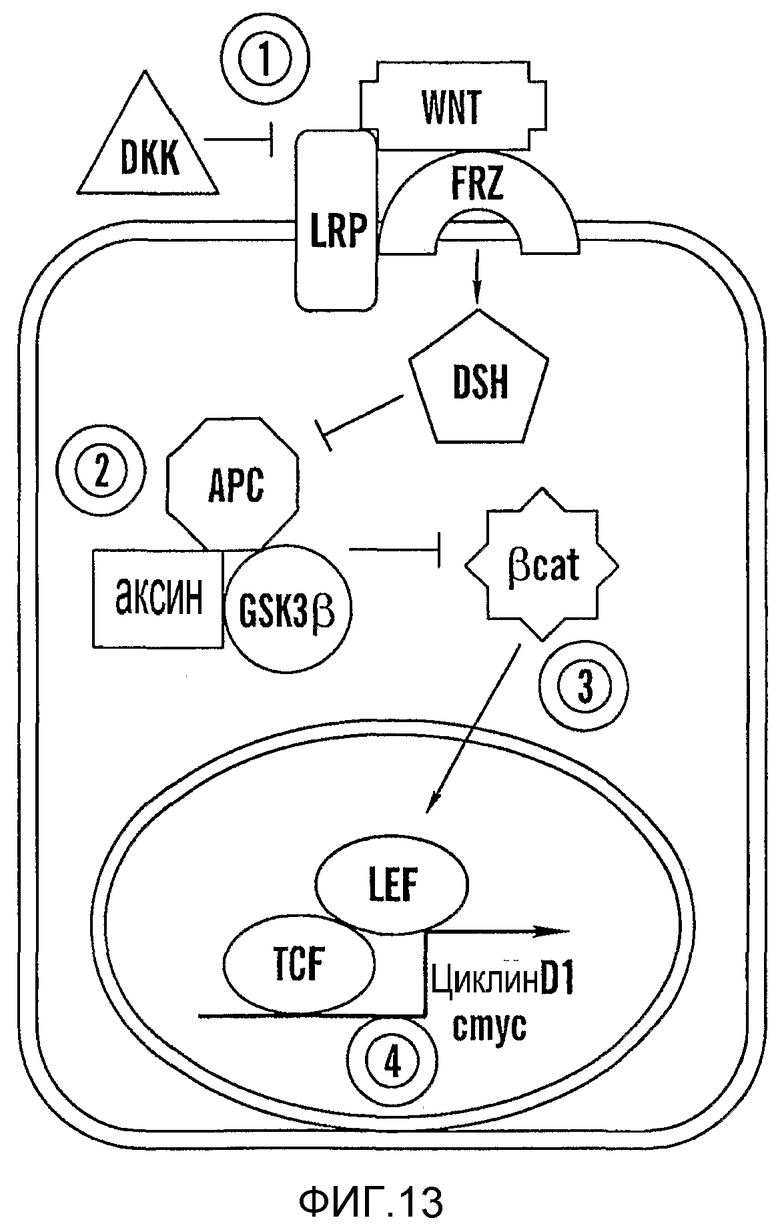
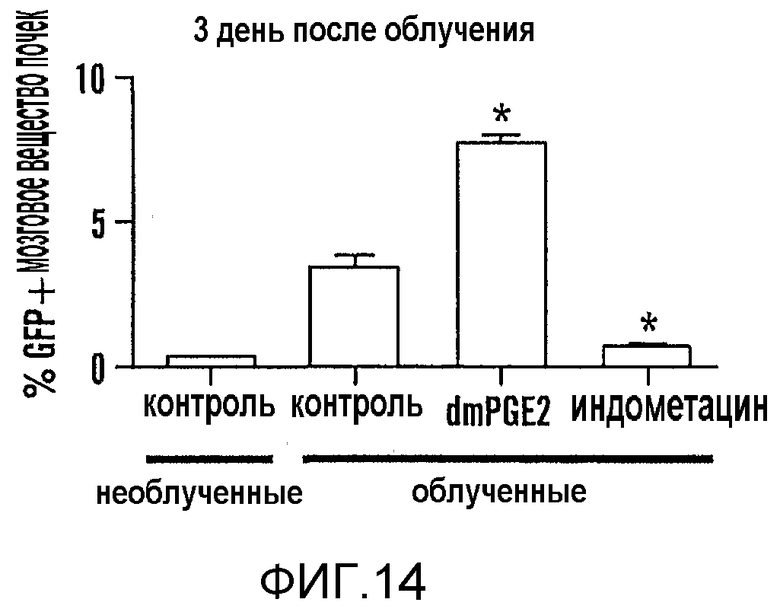
Изобретение относится к биотехнологии. Описан способ стимулирования экспансии гематопоэтических стволовых клеток (HSC) in vitro или in vivo. Проводят инкубацию популяции клеток, содержащей HSC, в присутствии, по меньшей мере, одного модулятора HSC, при этом модулятор HSC выбран из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY 171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сульпростона, сериноламида PGE2, сложного метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-РGЕ2. Предложен способ усиления приживления HSC, а также способ усиления восстановления гематопоэтических стволовых клеток, которые включают инкубацию HSC в присутствии, по меньшей мере, одного модулятора HSC. Изобретение расширяет арсенал методов для стимулирования роста гематопоэтических стволовых клеток у субъекта. 6 н. и 23 з.п. ф-лы, 38 ил., 11 табл., 2 пр.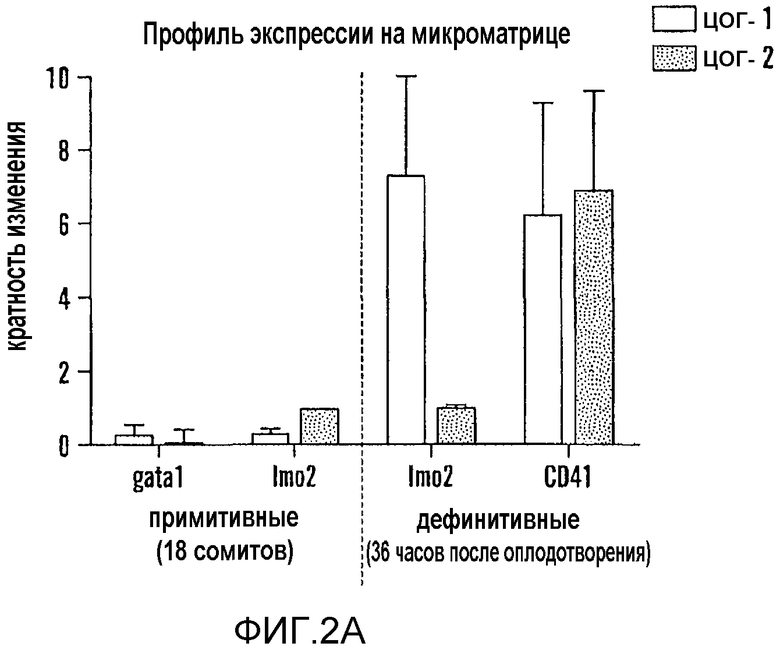
1. Способ стимулирования экспансии гематопоэтических стволовых клеток (HSC) in vitro или in vivo, включающий инкубацию популяции клеток, содержащей HSC, в присутствии, по меньшей мере, одного модулятора HSC, выбранного из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY 171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РОЕ2, 19(R)-гидрокси-РОЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
2. Способ по п.1, в котором популяцию клеток инкубируют, по меньшей мере, с одним модулятором HSC in vitro.
3. Способ по п.1, в котором популяцию клеток инкубируют, по меньшей мере, с одним модулятором HSC in vivo.
4. Способ по п.1, в котором, по меньшей мере, один модулятор HSC выбран из группы, включающей PGE2, 16,16-диметил-РGЕ2, PGI2, линолевую кислоту, 13(s)-HODE, LYI71883, кислоту Мида, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039 и агонист рецептора PGE2.
5. Способ по п.1, в котором, по меньшей мере, одним модулятором HSC является 16,16-диметил-РGЕ2.
6. Способ по п.1, в котором популяцию клеток собирают из периферической крови, пуповинной крови, костного мозга, ампиотической жидкости или плацентарной крови.
7. Способ по п.1, в котором популяцию клеток собирают из пуповинной крови.
8. Способ по п.6, в котором популяцию клеток получают от человека.
9. Способ по п.7, в котором популяцию клеток получают от млекопитающего.
10. Способ по п.1, в котором популяцию клеток хранят при криогенной температуре.
11. Способ по п.10, в котором популяцию клеток хранят при криогенной температуре перед инкубацией, по меньшей мере, с одним модулятором HSC.
12. Способ по любому из пп.1-11, в котором популяцию клеток, содержащую HSC, вводят субъекту.
13. Способ по п.12, в котором популяцию хранят при криогенной температуре перед введением субъекту.
14. Способ по п.12, в котором субъект является донором костного мозга или стволовых клеток, является кандидатом для трансплантации костного мозга или стволовых клеток или получил разрушающую костный мозг химиотерапию или лучевую терапию.
15. Способ усиления приживления HSC, включающий контактирование популяции клеток, содержащей HSC, с по меньшей мере, одним модулятором HSC, выбранным из группы, состоящей из: PGE2, PGI2, липолевой кислоты, 13(s)-HODE, LY 171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фепилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16, 16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-PGE2.
16. Способ по п.15, в котором популяция клеток контактирует, по меньшей мере, с одним модулятором HSC ex vivo.
17. Способ по п.15, в котором, по меньшей мере, один модулятор HSC выбран из группы, включающей PGE2, 16,16-диметил-РСЕ2, PGI2, линолевую кислоту, 13(s)-HODE, LYI71883, кислоту Мида, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039 и агонист рецептора PGE2.
18. Способ по п.15, в котором, по меньшей мере, одним модулятором HSC является 16,16-диметил-РGЕ2.
19. Способ по п.15, в котором популяцию клеток собирают из периферической крови, пуповинной крови, костного мозга, амниотической жидкости или плацентарной крови.
20. Способ по п.15, в котором популяцию клеток, содержащую HSC, собирают из периферической крови, пуповинной крови, костного мозга, амниотической жидкости или плацентарной крови, контактируют ех vivo с по меньшей мере одним модулятором HSC, выбранным из группы, включающей PGE2, 16,16-диметил-РGЕ2, PGI2, линолевую кислоту, 13(s)-HODE, LYI71883, кислоту Мида, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039 и агонист рецептора PGE2 и затем вводят субъекту, при этом субъект является донором костного мозга или стволовых клеток, является кандидатом для трансплантации костного мозга или стволовых клеток или получил разрушающую костный мозг химиотерапию или лучевую терапию.
21. Способ усиления восстановления гематопоэтических стволовых клеток, включающий контактирование популяции клеток, содержащей HSC, по меньшей мере, с одним модулятором HSC, выбранным из группы, состоящей из: PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LYI71883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-РGЕ2.
22. Способ по п.21, в котором популяция клеток контактирует, по меньшей мере, с одним модулятором HSC ex vivo.
23. Способ по п.21, в котором, по меньшей мере, один модулятор HSC выбран из группы, включающей PGE2, 16,16-диметил-РGЕ2, PGI2, линолевую кислоту, 13(s)-HODE, LYI71883, кислоту Мида, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039 и агонист рецептора PGE2.
24. Способ по п.21, в котором, по меньшей мере, одним модулятором HSC является 16,16-диметил-РGЕ2.
25. Способ по п.21, в котором популяцию клеток собирают из периферической крови, пуповинной крови, костного мозга, амниотической жидкости или плацентарной крови.
26. Способ по п.21, в котором популяцию клеток, содержащую HSC, собирают из периферической крови, пуповинной крови, костного мозга, амниотической жидкости или плацентарной крови, контактируют ех vivo с по меньшей мере одним модулятором HSC, выбранным из группы, включающей PGE2, 16,16-диметил-РGЕ2, PGI2, линолевую кислоту, 13(s)-HODE, LYI71883, кислоту Мида, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039 и агонист рецептора PGE2, и затем вводят субъекту, при этом субъект является донором костного мозга или стволовых клеток, является кандидатом для трансплантации костного мозга или стволовых клеток или получил разрушающую костный мозг химиотерапию или лучевую терапию.
27. Применение модулятора HSC, выбранного из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LYI71883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РСЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулиростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-PGE2, для стимулирования экспансии гематопоэтических стволовых клеток (HSC).
28. Применение модулятора HSC, выбранного из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулпростона, сериполамида PGE2, метилового эфира PGE2, 16-фенилтетранор-РGЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-PGE2, для усиления восстановления гематопоэтических стволовых клеток.
29. Применение модулятора HSC, выбранного из группы, состоящей из PGE2, PGI2, линолевой кислоты, 13(s)-HODE, LY171883, кислоты Мида, эйкозатриеновой кислоты, эпоксиэйкозатриеновой кислоты, ONO-259, Сау 1039, агониста рецептора PGE2, 16,16-диметил-РGЕ2, 19(R)-гидрокси-РGЕ2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-РGЕ2, 11-дезокси-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-16,16-диметил-РGЕ2, 9-дезокси-9-метилен-РGЕ2, бутапроста, сулпростона, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранор-РСЕ2, 15(S)-15-метил-РGЕ2 и 15(R)-15-метил-PGE2, для усиления приживления HSC.
| FEHER I | |||
| еt al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| US 20050054103 A1, 10.03.2005 | |||
| HANSON W R et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Клапанный регулятор для паровозов | 1919 |
|
SU103A1 |
Авторы
Даты
2013-09-20—Публикация
2007-03-26—Подача