Изобретение относится к способу синтеза полиядерных тетрааминов, содержащих мостиковые атомы, общей формулы:
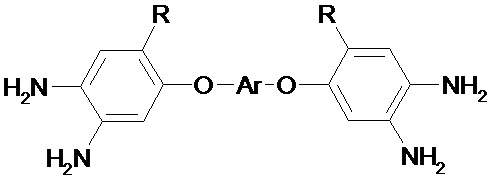
где I R= H, Ar =  ,
,
II R = H, Ar = 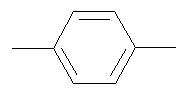 ,
,
III R = H, Ar =  ,
,
IV R = CF3, Ar = 
которые используются в качестве мономеров для синтеза различных классов полигетероариленов: полифенилхиноксалинов, полинафтоиленбензимидазолов, полибензимидазолов (Zhang, X.-M., Liu, J.-G., Yang, S.-Y. // Reviews on Advanced Materials Science, Vol. 46 (1), 2016, pp 22-38; Li, C., Li, Z., Liu, J., Zhao, X., Yang, H., & Yang, S. // Polymer, Vol. 51(17), 2010, pp 3851–3858; Merlet, S., Marestin, C., Schiets, F., Romeyer, O., & Mercier, R. // Macromolecules, Vol. 40 (6), 2007, pp 2070–2078; J.-C. Chen, Chen, P.-Y., Liu, Y.-C., Chen, K.-H. // Journal of Membrane Science, Vol. 513, 2016, pp 270-279; Olvera-Mancilla J., Palacios-Alquisira J., Alexandrova L. // High Performance Polymers, Vol. 30 (6), 2017, pp 699–709). Данные полимеры обладают комплексом уникальных свойств: термо-, тепло-, огне-, хемостойкостью, высокими гидролитическими, радиационными свойствами (B. Sillion, G. C. Eastmond, A. Ledwith, S. Russo, P. Sigwalt // Comprehensive Polymer Science, Vol. 5, Pergamon Press, Oxford, 1989, p 499; P. M. Hergenrother, H. F. Mark, N. M. Bikales, C. G. Overberger, G. Menges, J. I. Kroschwitz // Encyclopedia of Polymer Science and Engineering, Vol. 13, Wiley, New York, 1988, p 55; Rabilloud G. // High performance polymers, Editions Technip, Paris, 1999, p 350; Lindley P.M., Reinhardt B.A. // J. Polym. Sci., Part A: Polym. Chem., Vol. 29, 1991, p 1061; Chen J.-C., Chen, P.-Y., Liu, Y.-C., Chen, K.-H., Journal of Membrane Science, Vol. 513, 2016, pp 270-279; Huang B., Wang, X., Fang, H., Jiang, S., Hou, H. // Materials Letters, Vol. 234, 2019, pp 354-356). В последнее время постепенно выявляются различные специфические свойства данных классов полимеров, такие как протонная проводимость (X.-B Yang, Meng, L.-H., Sui, X.-L., Wang, Z.-B // Journal of Materials Science, 2019, Vol. 54, pp 1640-1653; Hsu S.L., Liu, C.-W., Tu, C.-H., Chuang, H.-Y., Bulycheva, E., Belomoina, N. // Polymer Bulletin, Vol. 75, 2018, pp 5321-5331), низкая диэлектрическая проницаемость (Liu J., Zhang, X., Tian, F., Yang, S., Diangong Jishu Xuebao/Transactions of China Electrotechnical Society, Vol. 32, 2017, pp 14-24) что значительно расширяет их применение в высокотехнологичных областях, таких как водородная энергетика (Ni H. J., Liu J.G., Yang S.Y. // Chem. Lett., Vol. 45, 2016, p 75; Li N., Zhang S., Liu J., Zhang F. // Macromolecules , Vol. 41, 2008, p 4165; Mao H., Zhang S. // Polymer, , Vol. 55, 2014, p 102; Belomoina N. M., Rusanov A. L., Bruma M., Polym. Sci. Ser. C, Vol. 49, 2007, p 386), интегрированная оптика (Ksianzou V., Velagapudi R.K., Grimm B., Schrader S. // Journal of Applied Physics, Vol. 100, 2006, № 063106), хранение импульсной энергии (Liu J., Zhang, X., Tian, F., Yang, S. // Diangong Jishu Xuebao/Transactions of China Electrotechnical Society, Vol. 32, 2017, pp 14-24), формирование наноматериалов (Merlet S., Marestin C., Schiets F., Romeyer O., Mercier R. // Macromolecules, Vol. 40, 2007, pp. 2070-2078; Asadi Tashvigh A., Chung, T.-S. // Journal of Membrane Science, Vol. 572, 2019, pp 580-587).
Известен двухстадийный способ синтеза 1,4-бис-(3,4-диаминофенокси)бензола (II) (Wang J., Li N., Zhang F., Zhang S., Liu J. // Polymer, Vol. 50, 2009, p 810), заключающийся во взаимодействии гидрохинона с 5-хлор-2-нитроанилином в ДМАА в присутствии К2СО3 при температуре 120-140 °С в течение 24 ч и последующем восстановлении полученного
1,4-бис-(3-амино-4-нитрофенокси)бензола гидразин моногидратом в этаноле в присутствии 10% Pd/C в течение 12 ч. Общий выход продукта 72%. Аналогично были синтезированы другие полиядерные тетраамины.

Недостатками известного способа получения полиядерных тетрааминов являются: длительность и жесткие условия синтеза, низкий общий выход продукта.
Цель изобретения – уменьшение времени и температуры реакций ароматического нуклеофильного замещения и восстановления, повышение общего выхода целевых продуктов.
Поставленная цель достигается тем, что процесс взаимодействия бисфенолов с 5-хлор-4-R-2-нитроанилином осуществляют при микроволновой активации. Причем ароматическое нуклеофильное замещение атома хлора проводят в 1-бутил-3-метилимидазолий тетрафторборате в присутствии ацетата калия при мощности микроволнового излучения 160 Вт и температуре 100 °С в течение 2 мин при молярном соотношении 5-хлор-4-R-2-нитроанилин : бисфенол = 1 : 0.5. Восстановление полиядерных динитродиаминов осуществляют в условиях гетерогенного катализа. Причем процесс проводят в изопропиловом спирте при 60 ºС, давлении 20 бар в присутствии катализатора 10 % Pd/C в течении 30 мин. Генерация водорода осуществляется в ходе электролиза воды.
Реализация предложенной схемы синтеза полиядерных тетрааминов, содержащих мостиковые атомы, позволяет уменьшить время с 24 ч до 2 мин и температуру с 140 °С до 100 °С процесса ароматического нуклеофильного замещения, а также время реакции восстановления с 12 ч до 30 мин и получить не содержащих посторонних примесей целевые продукты с общим выходом 85-87 %.
Строение и чистоту продуктов анализировали методами 1Н ЯМР, 19F ЯМР спектроскопии, масс-спектрометрии, определением температуры плавления и элементного состава.
Изобретение иллюстрируется следующим примерами.
Пример 1. 1,3-бис(3-амино-4-нитрофенокси)бензол.
Реакционную смесь, содержащую 0.274 г (0.0028 моль) CH3COOK, 0.483 г (0.0028 моль) 5-хлор-2-нитроанилина и 0.154 г (0.0014 моль) 1,3-дигидроксибензола в 2 мл 1-бутил-3-метилимидазолий тетрафторбората, подвергали действию микроволнового излучения при 100 ºС в течение 2 мин. После охлаждения смесь выливали в воду, выпавший продукт отфильтровывали и сушили. Выход 0.515 г (96 %), т.пл. 195-197 °С.
Найдено (%): С, 56.29; Н, 3.61; N, 14.86. C18H14N4O6.
Вычислено (%): С, 56.54; Н, 3.66; N, 14.66.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 6.33 (дд, 2Н, Н (6',6''), J = 2.7, J = 9.5), 6.45 (д, 2Н, Н (2',2''), J = 2.7), 7.01 (д, 1Н, Н (1), J = 2.3), 7.08 (дд, 2Н, H (3,5), J = 2.3, J = 8.2), 7.48 (c, 4Н, (NH2)2), 7.57 (т, 1Н, Н (4), J = 8.2), 8.01 (д, 2Н, Н (5',5''), J = 9.5).
Найдено: m/z 383.0984 [M+H]+. C18H14N4O6. Вычислено: 383.0992.
Пример 2. 1,4-бис(3-амино-4-нитрофенокси)бензол получают аналогично примеру 1.
Выход 1,4-бис(3-амино-4-нитрофенокси)бензола 0.498 г 93 %, т.пл. 280-282 °С.
Найдено (%): С, 56.39; Н, 3.62; N, 14.81. C18H14N4O6.
Вычислено (%): С, 56.54; Н, 3.66; N, 14.66.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 6.33 (дд, 2Н, Н (6',6''), J = 2.5, J = 9.0), 6.46 (д, 2Н, Н (2',2''), J = 2.0), 7.27 (д, 4Н, Н (2,3,5,6), J=8.0), 7.56 (с, 4Н, (NH2)2), 8.03 (д, 2Н, Н (5',5'''), J = 9.0).
Найдено: m/z 383.0986 [M+H]+. C18H14N4O6. Вычислено: 383.0992.
Пример 3. 2,2-бис[4-(3-амино-4-нитрофенокси)фенил]гексафторпропан получают аналогично примеру 1.
Выход 2,2-бис[4-(3-амино-4-нитрофенокси)фенил]гексафторпропана 0.801 г 94 %, т.пл. 182-184 °С.
Найдено (%): C, 53.30; H, 2.93; N, 9.24. C27H18F6N2O6.
Вычислено (%): C, 53.21; H, 2.96; N, 9.20.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 6.35 (дд, 2Н, Н (6'',6''), J = 1.3, J = 8.2), 6.52 (д, 2Н, Н (2'',2''), J = 1.5), 7.28 (д, 4H, H (3',3'5',5'), J = 8.5), 7.45 (д, 4H, H (2',2',6',6'), J = 8.4), 7.53 (с, 4H, (NH2)2), 8.05 (д, 2Н, Н (5'',5''), J = 8.8).
Спектр ЯМР 19F (ДМСО-d6, δ, м.д., J/Гц): -63.33.
Найдено: m/z 609.1201 [M+H]+. C27H18F6N4O6. Вычислено: 609.1210.
Пример 4. 2,2-бис{4-[5-амино-4-нитро-2-(α,α,α-трифторметил)фенокси]фенил}
гексафторпропан получают аналогично примеру 1.
Выход 2,2-бис{4-[5-амино-4-нитро-2-(α,α,α-трифторметил)фенокси]фенил}
гексафторпропана 1.022 г 98 %, т.пл. 112-115 °С.
Найдено (%): C, 46.67; H, 2.12; N. 7.56. C29H16F12N4O6.
Вычислено (%): C, 46.71; H, 2.15; N, 7.52.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 6.51 (с, 2Н, Н (6'',6''), 7.37 (д, 4H, Н (3',3',5',5'), J = 8.5), 7.5 (д, 4H, Н (2',2',6',6'), J = 8.5), 7.90 (с, 4H, (NH2)2), 8.32 (с, 2Н, Н (3'',3'')).
Спектр ЯМР 19F (ДМСО-d6, δ, м.д., J/Гц): -57.56, -63.49.
Найдено: m/z 745.0951 [M+H]+. C29H16F12N4O6. Вычислено: 745.0957.
Пример 5. 1,3-бис(3,4-диаминофенокси)бензол
В реактор H-Cube Pro помещали картридж, содержащий катализатор 10% Pd/C. Сначала через реактор пропускали изопропанол в течение 5 минут для удаления воздуха из системы. Раствор реагента готовили растворяя 0.5 г 1,3-бис(3-амино-4-нитрофенокси)бензола в 25 мл изопропанола. Задавали на приборе H-Cube температуру 60 ºC и давление 20 бар. Когда в реакторе устанавливались стабильные условия, переключали впускную систему с растворителя на реагент и пропускали вещество через катализатор в течение 25 мин. После сбора всего раствора впускной клапан переключали обратно на растворитель и промывали систему ещё 5 минут. Реакционный раствор пропускали через колонку с активированным углем, после чего большую часть растворителя упаривали и после охлаждения выпавший осадок отфильтровывали. Выход 0.38 г 91%, т.пл. 169-171 °С.
Найдено (%): C, 66.89; H, 5.52; N, 17.36. C18H18N4O2.
Вычислено (%): C, 67.10; H, 5.57; N, 17.34.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 4.49 (c, 8H, (3,4-NH2)4), 6.09 (дд, 2H, H (6',6'), J = 1.8, J = 8.6), 6.24 (д, 2H, H (2',2'), J = 1.6), 6.36 (т, 1H, H (2), J = 7.3), 6.44 (дд, 2H, H (2,6), J = 1.7, J = 8.8), 6.49 (д, 2H, H (5',5'), J = 9.1), 7.15 (т, 1H, H (2), J = 9.2).
Найдено: m/z 323.1506 [M+H]+.C18H18N4O2. Вычислено: 323.1509.
Пример 6. 1,4-бис(3,4-диаминофенокси)бензол получают аналогично примеру 5.
Выход 1,4-бис(3,4-диаминофенокси)бензола 0.39 г 93%, т.пл. 224-227 °С.
Найдено (%): C, 66.95; H, 5.51; N, 17.38. C18H18N4O2.
Вычислено (%): C, 67.10; H, 5.57; N, 17.34.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 4.42-4.51 (c, 8H, 4NH2), 6.08 (дд, 2H, H (6',6'), J = 1.8, J = 8.6), 6.26 (д, 2H, H (2',2'), J = 1.6), 6.49 (д, 2H, H (5',5'), J = 9.1), 6.83 (4H, H (2,3,5,6)).
Найдено: m/z 323.1508 [M+H]+ . C18H18N4O2. Вычислено: 323.1509.
Пример 7. 2,2-бис[4-(3,4-диаминофенокси)фенил]гексафторпропан получают аналогично примеру 5.
Выход 2,2-бис[4-(3,4-диаминофенокси)фенил]гексафторпропана 0.649 г 91%, т.пл. 154-157 °С.
Найдено (%): C, 58.94; H, 3.98; N, 10.23. C27H22F6N4O2.
Вычислено (%): C, 59.01; H, 4.01; N, 10.20.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 4.37 (c, 4H, (4-NH2)2), 4.66 (c, 4H, (3-NH2)2), 6.14 (дд, 2H, H (6'',6''), J = 1.6, J = 8.5), 6.28 (д, 2Н, Н (2'',2''), J = 1.5), 6.51 (д, 2Н, Н (5'',5''), J = 8.8), 6.92 (д, 4H, H (3',3',5',5'), J = 8.5), 7.24 (д, 4H, H (2',2',6',6'), J = 8.4).
Спектр ЯМР 19F (ДМСО-d6, δ, м.д., J/Гц): -63.49.
Найдено: m/z 549.1713 [M+H]+. C27H22F6N4O2. Вычислено: 549.1726.
Пример 8. 2,2-бис{4-[4,5-диамино-2-(α,α,α-трифторметил)фенокси]фенил} гексафторпропан получают аналогично примеру 5.
Выход 2,2-бис{4-[4,5-диамино-2-(α,α,α-трифторметил)фенокси]фенил} гексафторпропана 0.792 г 89%, т.пл. 232-235 °С.
Найдено (%): C, 50.76; H, 2.89; N, 8.20. C29H20F12N4O2.
Вычислено (%): C, 50.80; H, 2.92; N, 8.18.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 4.76 (c, 4H, (4-NH2)2), 5.27 (c, 4H, (5-NH2)2), 6.29 (с, 2Н, Н (6'',6''), 6.85 (с, 2Н, Н (3'',3''), 6.95 (д, 4H, Н (3',3',5',5'), J = 8.5), 7.29 (д, 4H, Н (2',2',6',6'), J = 8.5).
Спектр ЯМР 19F (ДМСО-d6, δ, м.д., J/Гц): -57.53, -63.46.
Найдено: m/z 685.1463 [M+H]+. C29H20F12N4O2. Вычислено: 685.1474.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРГИДРАТА 1,3-БИС(3,4-ДИАМИНОФЕНОКСИ)БЕНЗОЛА | 2010 |
|
RU2439052C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ 4-(3,4-ДИАМИНОФЕНОКСИ)БЕНЗОЙНОЙ КИСЛОТЫ | 2009 |
|
RU2409555C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-{4-АМИНО-2-ХЛОРО-5-[(5-ХЛОРО-2-МЕТИЛ-1Н-БЕНЗИМИДАЗОЛ-6-ИЛ)АМИНО]ФЕНОКСИ}БЕНЗОЙНОЙ КИСЛОТЫ | 2012 |
|
RU2506259C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(3,4-ДИАМИНОФЕНОКСИ)БЕНЗОЙНОЙ КИСЛОТЫ | 2009 |
|
RU2409554C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,2-БИС[4-(4-НИТРОФЕНОКСИ)ФЕНИЛ]ГЕКСАФТОРПРОПАНА ПОД ДЕЙСТВИЕМ УЛЬТРАЗВУКА | 2015 |
|
RU2577544C1 |
| Способ получения 1,3-бис- и 1,4-бис(4,5-ди[тиофен-3-ил]-1Н-имидазол-2-ил)бензолов | 2016 |
|
RU2614447C1 |
| Способ синтеза 4,4'-бис(3-аминофенокси)бифенила | 2021 |
|
RU2783104C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ-1Н-БЕНЗО[f]ХРОМЕНОВ | 2014 |
|
RU2597363C2 |
| БИС[1,2,4]ТРИАЗОЛО[4,3-b:3',4'-f][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ, АНТИГЛИКОКСИДАЦИОННОЙ И АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2755897C1 |
| ПРОИЗВОДНЫЕ 4Н-БИС[1,2,5]ОКСАДИАЗОЛО[3,4-b:3',4'-f]АЗЕПИН-8,9-ДИАМИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2499799C2 |
Изобретение относится к способу получения полиядерных тетрааминов, содержащих мостиковые атомы, указанной ниже общей формулы, где R=H, Ar= (I); R=H, Ar=
(I); R=H, Ar= (II); R=H, Ar=
(II); R=H, Ar= (III); R=CF3, Ar=
(III); R=CF3, Ar= (IV), которые могут найти применение в качестве мономеров для синтеза различных полигетероариленов - полифенилхиноксалинов, полинафтоиленбензимидазолов и полибензимидазолов. Способ включает процессы взаимодействия бисфенолов с 5-хлор-4-R-2-нитроанилином при микроволновой активации и восстановления полиядерных динитродиаминов в условиях гетерогенного катализа. При этом ароматическое нуклеофильное замещение атома хлора проводят в 1-бутил-3-метилимидазолий тетрафторборате в присутствии ацетата калия при мощности микроволнового излучения 160 Вт и температуре 100°С в течение 2 мин при молярном соотношении 5-хлор-4-R-2-нитроанилин:бисфенол=1:0.5. Процесс восстановления проводят в изопропиловом спирте при 60°С, давлении 20 бар в присутствии катализатора 10% Pd/C в течение 30 мин. Предлагаемый способ позволяет уменьшить время и температуру реакций ароматического нуклеофильного замещения и восстановления, а также повысить общий выход целевых продуктов. 8 пр.
(IV), которые могут найти применение в качестве мономеров для синтеза различных полигетероариленов - полифенилхиноксалинов, полинафтоиленбензимидазолов и полибензимидазолов. Способ включает процессы взаимодействия бисфенолов с 5-хлор-4-R-2-нитроанилином при микроволновой активации и восстановления полиядерных динитродиаминов в условиях гетерогенного катализа. При этом ароматическое нуклеофильное замещение атома хлора проводят в 1-бутил-3-метилимидазолий тетрафторборате в присутствии ацетата калия при мощности микроволнового излучения 160 Вт и температуре 100°С в течение 2 мин при молярном соотношении 5-хлор-4-R-2-нитроанилин:бисфенол=1:0.5. Процесс восстановления проводят в изопропиловом спирте при 60°С, давлении 20 бар в присутствии катализатора 10% Pd/C в течение 30 мин. Предлагаемый способ позволяет уменьшить время и температуру реакций ароматического нуклеофильного замещения и восстановления, а также повысить общий выход целевых продуктов. 8 пр.

Способ получения полиядерных тетрааминов, содержащих мостиковые атомы, общей формулы
 ,
,
где R=H, Ar=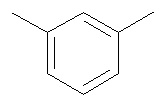 (I), R=H, Ar=
(I), R=H, Ar= (II),
(II),
R=H, Ar= (III), R=CF3, Ar=
(III), R=CF3, Ar= (IV),
(IV),
включающий процессы взаимодействия бисфенолов с 5-хлор-4-R-2-нитроанилином при микроволновой активации, восстановления полиядерных динитродиаминов в условиях гетерогенного катализа, причем ароматическое нуклеофильное замещение атома хлора проводят в 1-бутил-3-метилимидазолий тетрафторборате в присутствии ацетата калия при мощности микроволнового излучения 160 Вт и температуре 100°С в течение 2 мин при молярном соотношении 5-хлор-4-R-2-нитроанилин:бисфенол=1:0.5, процесс восстановления проводят в изопропиловом спирте при 60°С, давлении 20 бар в присутствии катализатора 10% Pd/C в течение 30 мин.
| Р.С | |||
| БЕГУНОВ и др | |||
| Эффективный способ синтеза полиядерных тетрааминов - мономеров для полигетероариленов, ИЗВЕСТИЯ АКАДЕМИИ НАУК | |||
| СЕРИЯ ХИМИЧЕСКАЯ, 2018, No | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ЦЕНТРОБЕЖНЫЙ ВЕНТИЛЯЦИОННЫЙ ПЫЛЕ- И ДЫМООТДЕЛИТЕЛЬ | 1924 |
|
SU1072A1 |
| J | |||
| WANG et al | |||
| Synthesis and properties of soluble poly[bis(benzimidazobenzisoquinolinones)] based on novel aromatic tetraamine monomers, POLYMER, 2009, Vol | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Телефонная трансляция | 1923 |
|
SU810A1 |
| CN 101693667 A, 14.04.2010. | |||
Авторы
Даты
2019-06-18—Публикация
2018-12-25—Подача