Изобретение относится к способу синтеза полиядерных орто-фенилендиаминов, в частности к получению сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты общей формулы
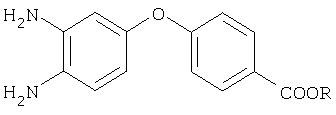
где R=СН3, СН(СН)3,
которые используются в качестве полупродуктов в синтезе термостабильных полимерных материалов (US 4452972, 5.06.1984; US 4463167, 31.07.1984; US 4535144, 13.08.1985).
Известен способ получения сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты (Фокин Е.П., Сивакова И.Г., Матошина К.И. // Известия Сибирского отделения АН СССР. Серия химических наук. Вып.3, №7, 1969, с.92-95), включающий следующие стадии: нуклеофильное замещение атома хлора при взаимодействии 4-нитрохлорбензола с 4-гидроксибензойной кислотой в ДМФА в присутствии К2СО3 при температуре 150°С в течение 10 ч, образование метилового эфира, получаемого при нагревании 4-(4-нитрофенокси)бензойной кислоты в метаноле в присутствии серной кислоты, восстановление метил 4-(4-нитрофенокси)бензоата чугунными стружками в этиленгликоле при температуре 140-150°С в течение 6 ч, ацилирование метил 4-(4-аминофенокси)бензоата уксусным ангидридом в уксусной кислоте при температуре 120°С в течение 3 ч, нитрование метил 4-(4-ацетиламинофенокси)бензоата в уксусной кислоте дымящей азотной кислотой при температуре 15-20°С в течение 3-4 ч, снятие ацильной защиты гидроксидом калия при кипячении в метаноле в течение 2-3 минут, восстановление метил 4-(4-амино-3-нитрофенокси)бензоата чугунными стружками в этиленгликоле при температуре 120°С в течение 2 ч.
Недостатками известного способа синтеза сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты являются: применение агрессивных, вредных для здоровья реагентов (концентрированная HNO3), продолжительное время протекания каждой из стадий процесса, а также необходимость создания жестких условий проведения процессов, что неизбежно приводит к снижению степени чистоты и выходов получаемых соединений.
Цель изобретения - сокращение количества стадий, оптимизация условий реакций - уменьшение времени и температуры проведения процесса, повышение чистоты и выходов целевых продуктов.
Поставленная цель достигается тем, что в качестве исходного субстрата вместо 4-нитрохлорбензола используется 2-нитро-5-хлоранилин. В результате отпадает необходимость в проведении реакции нитрования и сокращается количество процессов восстановления с двух до одного. Это приводит к уменьшению количества стадий получения сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты с 6 до 4. Для уменьшения времени и температуры процесса нуклеофильного замещения галогена в 2-нитро-5-хлоранилине проводится снижение дезактивирующего влияния аминогруппы путем ее ацилирования. В качестве восстанавливающего агента используется SnCl2·2H2O, что позволяет снизить температуру и время процесса восстановления в два раза. Ацилирование 2-нитро-5-хлоранилина осуществляют уксусным ангидридом при температуре 90°С в течение 1 ч и мольном соотношении 2-нитро-5-хлоранилин: уксусный ангидрид =1:2, нуклеофильное замещения атома хлора проводят при взаимодействии N-ацетил-5-хлор-2-нитроанилина с 4-гидроксибензойной кислотой в ДМСО в присутствии К2СО3 в течение 8 часов при температуре 105°С и мольном соотношении N-ацетил-5-хлор-2-нитроанилин: 4-гидроксибензойная кислота =1:1.05, снятие ацильной защиты аминогруппы осуществляют в результате щелочного гидролиза в течение 0.5 часа при температуре 60°С в 20% водном растворе КОН, восстановление с одновременным образованием сложноэфирной связи 4-(3-амино-4-нитрофенокси)бензойной кислоты проводят в алифатическом спирте действием раствора SnCl2·2H2O в концентрированной соляной кислоте при температуре кипения спирта в течение 1 ч и мольном соотношении 4-(3-амино-4-нитрофенокси)бензойная кислота: SnCl2·2H2O=1:3.35. В результате суммарный выход целевого продукта увеличивается с 27.5% до 74.5%.
Строение и чистоту промежуточных соединений и целевых продуктов анализировали методами ЯМР 1Н - и масс-спектрометрии, определением температуры плавления и элементного состава.
Изобретение иллюстрируется следующими примерами.
Пример 1. N-ацетил-5-хлор-2-нитроанилин
17.3 г (0.1 моль) 5-хлор-2-нитроанилина и 18.9 мл (0.2 моль) уксусного ангидрида нагревали при 90°С 1 ч. После охлаждения реакционной массы выпавший осадок отфильтровывали и промывали холодным изопропиловым спиртом. Выход 19.95 г (93%),
Тпл 117-119°С.
Вычислено %: С 44.77; Н 3.29; N 16.52. С8Н7ClN2О3.
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.11 (с) (3Н, СН3), 7.42 (дд) (1Н, Н4, J=8.5 Гц, J=1.0 Гц), 7.83 (д) (1Н, Н6, J 1.5 Гц), 8.00 (д) (1Н, Н3, J=10.0 Гц), 10.33 (с) (1Н, NH). Пример 2. 4-(3-ацетамидо-4-нитрофенокси)бензойная кислота
20.7 г (0.15 моль) К2СО3 и 7.2 г (0.0525 моль) 4-гидроксибензойной кислоты в 200 мл ДМСО нагревается при 75°С 0.2 ч. После чего прибавляется 10.73 г (0.05 моль) N-ацетил-5-хлор-2-нитроанилина. Реакционная масса перемешивается 8 ч при 105°С. После охлаждения реакционная смесь выливается в воду и обрабатывается уксусной кислотой до рН=6. Выход 14.38 г (91%), Тпл=212-214°С.
Найдено %: С 56.59; Н 3.73; N 9.01. С15Н12N2О6.
Вычислено %: С 56.96; Н 3.80; N 8.86.
Спектр ЯМР 1Н, δ, м.д.: 2.1 (с) (3Н, СН3), 6.95 (дд) (1Н, Н6', J=9.5 Гц, J=1.0 Гц), 7.25 (д) (2Н, Н3,5, J=10.0 Гц), 7.45 (д) (1Н, Н2', J=1.5 Гц), 8.05 (д) (2Н, Н2,6, J=9.0 Гц), 8.10 (д) (1Н, Н5', J=9.5 Гц), 10.30 (с) (1Н, NH), 13.05 (с) (1Н, СООН). Масс-спектр, m/z (Iотн, %): 316 (100) [М]+, 273 (85), 227 (49), 123 (91), 76 (57), 43 (100).
Пример 3. 4-(3-амино-4-нитрофенокси)бензойная кислота 12.64 г (0.04 моль) 4-(3-ацетамидо-4-нитрофенокси)бензойной кислоты перемешивается в 200 мл 20%-ном водном растворе КОН при 60°С. Выпавший осадок отфильтровывается и обрабатывается уксусной кислотой. Выход 10.8 г (99%), Тпл=243-245°С.
Найдено %: С 57.06; Н 3.61; N 10.19. С13Н10N2O5.
Вычислено %: С 56.93; Н 3.65; N 10.22.
Спектр ЯМР 1Н, δ, м.д.: 6.30 (дд) (1Н, Н6', J=10.0 Гц, J=1.0 Гц), 6.35 (д) (1Н, Н2', J=1.5 Гц), 7.00 (д) (2Н, Н3,5, J=9.5 Гц), 7.55 (с) (2Н, NH2), 7.90 (д) (2Н, Н2,6, J=10.0 Гц), 8.00 (д) (1Н, Н5', J=10.0 Гц), 13.00 (с) (1Н, СООН). Масс-спектр, m/z (Iотн, %): 274 (84) [М]+, 227 (37), 123 (100), 90 (89), 76 (92).
Пример 4. Изопропил 4-(3,4-диаминофенокси)бензоат
8.22 г (0.03 моль) 4-(3-амино-4-нитрофенокси)бензойной кислоты кипятятся в смеси 80 мл изопропилового спирта и 70 мл 36% НСl 1 ч. Затем к кипящему раствору прибавляется 22.6 г (0.10 моль) SnCl2·2H2O в 40 мл 36% НСl. Через 0.5 ч реакционная масса охлаждается и обрабатывается 25%-ным водным раствором аммиака до рН 7-8. Продукт реакции выделяется экстракцией хлороформом и его дальнейшей отгонкой. Выход 7.20 г (84%), Тпл=92-94°С.
Найдено %: С 67.98; Н 6.31; N 9.89. С16Н18N2О3.
Вычислено %: С 67.13; Н 6.29; N 9.80.
Спектр ЯМР 1Н, δ, м.д.: 1.30 (д) (6 Н, СН3, J=6.5 Гц), 4.40 (с) (2Н, NH2), 4.70 (с) (2Н, NH2), 5.15 (м) (1 Н, СН), 6.15 (дд) (1Н, Н6', J=10.0 Гц, J=1.5 Гц), 6.30 (д) (1Н, Н2', J=1.0 Гц), 6.55 (д) (1H, Н5', J=10.0 Гц), 6.95 (д) (2Н, Н3,5, J=9.5 Гц), 7.85 (д) (2Н, Н2'6, J=10.0 Гц). Масс-спектр, m/z (Iотн, %): 286 (48) [М]+, 244 (83), 227 (14), 199 (10), 154 (7), 123 (100), 114 (49), 95 (100), 90 (14), 80 (43), 76 (52), 63 (31), 43 (100).
Пример 5. Метил 4-(3,4-диаминофенокси)бензоат получают аналогично примеру 4. Выход 89%. Тпл=88-90°С.
Найдено, %: С 65.21; Н 5.40; N 10.67. C14H14N2О3.
Вычислено, %: С 65.11; Н 5.42; N 10.85.
Спектр ЯМР 1Н, δ, м.д.: 3.60 (с) (3 Н, СН3, J=6.5 Гц), 4.45 (с) (2Н, NH2), 4.75 (с) (2Н, NH2), 6.15 (дд) (1H, Н6', J=10.0 Гц, J=1.5 Гц), 6.30 (д) (1H, Н2', J=1.5 Гц), 6.55 (д) (1Н, Н5', J=10.0 Гц), 6.95 (д) (2Н, Н3,5, J=9.5 Гц), 7.90 (д) (2Н, Н2,6, J=10.0 Гц). Масс-спектр, m/z (Iотн, %): 258 (73) [М]+, 243 (89), 227 (17), 199 (19), 154 (9), 123 (100), 114 (43), 95 (100), 90 (11), 80 (39), 76(61).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 4-(3,4-ДИАМИНОФЕНОКСИ)БЕНЗОЙНОЙ КИСЛОТЫ | 2009 |
|
RU2409554C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРГИДРАТА 1,3-БИС(3,4-ДИАМИНОФЕНОКСИ)БЕНЗОЛА | 2010 |
|
RU2439052C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-{4-АМИНО-2-ХЛОРО-5-[(5-ХЛОРО-2-МЕТИЛ-1Н-БЕНЗИМИДАЗОЛ-6-ИЛ)АМИНО]ФЕНОКСИ}БЕНЗОЙНОЙ КИСЛОТЫ | 2012 |
|
RU2506259C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(3-АМИНО-4-НИТРОФЕНОКСИ)БЕНЗОЙНОЙ КИСЛОТЫ ПОД ДЕЙСТВИЕМ УЛЬТРАЗВУКА | 2015 |
|
RU2577545C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3- И 1,4-БИС(2-АМИНО-4-(ТРИФТОРМЕТИЛ)ФЕНОКСИ)БЕНЗОЛА | 2011 |
|
RU2453533C1 |
| Способ получения полиядерных тетрааминов, содержащих мостиковые атомы | 2018 |
|
RU2691737C1 |
| Способ получения N-арилзамещенных 3H-имидазо[4,5-b]пиридинов | 2016 |
|
RU2642456C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,4-БИС(2-АМИНО-4-(ТРИФТОРМЕТИЛ)ФЕНИЛ)ПИПЕРАЗИНА | 2011 |
|
RU2448962C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4'-ДИАМИНО-4-R-БЕНЗОФЕНОНОВ | 2006 |
|
RU2318799C1 |
| Способ получения N-[2-амино-4-(трифторметил)фенил]-N-фенил-4-(трифторметил)бензол-1,2-диамина и его производных | 2016 |
|
RU2645922C2 |
Изобретение относится к улучшенному способу получения сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты общей формулы

где R=СН3, СН(СН)3,
которые используются в качестве полупродуктов в синтезе термостабильных полимерных материалов. Целевые соединения получают путем ацилирования 2-нитро-5-хлоранилина уксусным ангидридом, нуклеофильного замещения атома хлора, при взаимодействии с 4-гидроксибензойной кислотой в ДМСО в присутствии К2СО3, снятии ацильной защиты аминогруппы в результате щелочного гидролиза, одновременного восстановления и образования сложноэфирной связи 4-(3-амино-4-нитрофенокси)бензойной кислоты. Причем ацилирование 2-нитро-5-хлоранилина проводят при температуре 90°С в течение 1 ч и мольном соотношении 2-нитро-5-хлоранилин: уксусный ангидрид =1:2, нуклеофильное замещение атома хлора проводят в течение 8 часов при температуре 105°С и мольном соотношении N-ацетил-5-хлор-2-нитроанилин: 4-гидроксибензойная кислота =1:1.05, снятие ацильной защиты осуществляют в течение 0.5 часа при температуре 60°С в 20% водном растворе КОН, восстановление с одновременным образованием сложноэфирной связи проводят в алифатическом спирте действием раствора SnCl2·2H2O в концентрированной соляной кислоте при температуре кипения спирта в течение 1 ч и мольном соотношении 4-(3-амино-4-нитрофенокси)бензойная кислота: SnCl2·2H2O=1:3.35. Способ позволяет уменьшить количество стадий и температуру процесса, а также повысить чистоту и выходы целевых продуктов.
Способ получения сложных эфиров 4-(3,4-диаминофенокси)бензойной кислоты общей формулы

где R=СН3, СН(СН)3,
включающий ацилирование 2-нитро-5-хлоранилина уксусным ангидридом, нуклеофильное замещение атома хлора, при взаимодействии с 4-гидроксибензойной кислотой в ДМСО в присутствии К2СО3, снятие ацильной защиты аминогруппы в результате щелочного гидролиза, одновременное восстановление и образование сложноэфирной связи 4-(3-амино-4-нитрофенокси)бензойной кислоты, отличающийся тем, что ацилирование 2-нитро-5-хлоранилина проводят при температуре 90°С в течение 1 ч и мольном соотношении 2-нитро-5-хлоранилин: уксусный ангидрид =1:2, нуклеофильное замещение атома хлора проводят в течение 8 ч при температуре 105°С и мольном соотношении N-ацетил-5-хлор-2-нитроанилин: 4-гидроксибензойная кислота =1:1.05, снятие ацильной защиты осуществляют в течение 0,5 ч при температуре 60°С в 20% водном растворе КОН, восстановление с одновременным образованием сложноэфирной связи проводят в алифатическом спирте действием раствора SnCl2·2H2O в концентрированной соляной кислоте при температуре кипения спирта в течение 1 ч и мольном соотношении 4-(3-амино-4-нитрофенокси)бензойная кислота: SnCl2·2H2O=1:3.35.
| Е.П.ФОКИН и др | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Известия Сибирского отделения АН СССР, Серия хим | |||
| наук, вып.3, №7, 1969, с.92-95 | |||
| 0 |
|
SU242906A1 | |
| 0 |
|
SU182167A1 | |
| СПОСОБ ПОЛУЧЕНИЯ АМИНОЭФИРОВ ДИФЕНИЛОВОГОРЯДА | 0 |
|
SU259077A1 |
Авторы
Даты
2011-01-20—Публикация
2009-06-23—Подача