Область техники
Изобретение относится к области медицинской биотехнологии и может быть использовано при получении моновакцины против ветряной оспы и ассоциированных вакцин, содержащих компонент вируса ветряной оспы.
Уровень техники
Из уровня техники известен вирусный штамм ветряной оспы MAV/06, используемый для производства вакцины Suduvax. Вирус был выделен из везикул пациента возрастом 33 месяца из Кореи, заразившегося ветряной оспой в 1989 году. Выделенный вирус культивировали 55 раз в человеческих эмбриональных клетках легкого и морской свинки при температуре 34-360С. Аттенуированный вирусный штамм назван MAV/06. Однако, до настоящего времени культуральной живой вакцины на основе аттенуированного вирусного штамма MAV/06 на рынке нет. Для данного вирусного штамма не изучены основные маркеры биологической аттенуации (ts - маркер, температурочувствительность, то есть, неспособность размножаться при высокой температуре, 390С; са - маркер, холодоадаптируемость, то есть, способность размножаться при низкой температуре, 300С). Учитывая, что выделенный вирусный изолят культивировали в течение 55 пассажей в клеточных культурах, весьма вероятно, что данный вакцинный штамм гиператтенуирован и не может быть кандидатом для создания живой культуральной вакцины против ветряной оспы. Как правило, гиператтенуированные вирусные штаммы характеризуются слабой иммуногенностью.
В документе Всемирной организации здравоохранения (ВОЗ) сформулированы требования, предъявляемые к живой культуральной вакцине для профилактики ветряной оспы, где отмечается, что эти требования относятся только к штамму «vOka» вируса Varicella zoster, поскольку ни один другой штамм вируса Varicella zoster в настоящее время не считается подходящим для производства вакцины.
Как правило, коммерческие вакцины культуральные живые аттенуированные, производимые в США (OKA/MERCK Research Laboratories), в Бельгии (OKAAVARILRIX/GlaxoSmithKline Biologicals) и в Японии (OKAVAX/BIKEN), изготовлены основе японского аттенуированноного штамма vOKA. Данный вирус изолирован в 1974 году в Японии от 6-летнего здорового мальчика по имени Ока, заболевшего ветряной оспой (Takahashi М. Clinical overview of varicella vaccine: development and early studies. Pediatrics 1986; 78: 736-741). Сиквенс вакцинного штамма vOka показал, что он представляет смесь геномов и имеет нуклеотидный полиморфизм на 31 сайте (.Gomi., Sunamachi Н., Mori Y., et al. Comparison of the complete DNA sequences of the OKA varicella vaccine and its parental virus. J.Virol 2002; 76: 11447-11459). Сравнение последовательностей вакцинного штамма vОка с его диким родительским штаммом рОка выявил 42 нуклеотидных различия, которые предполагают 20 аминокислотных замен.
Вышеуказанный японский вакцинный вирусный штамм vOka является наиболее близким к заявляемому.
Для Российской Федерации предпочтительно иметь вакцинные штаммы, изолированные на ее территории.
В качестве такого штамма мы предлагаем аттенуированный штамм Varicella zoster «vFiraVax», депонированный в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под номером 2891 12 декабря 2018 года, предназначенный для получения живой культуральной вакцины для профилактики ветряной оспы и ассоциированных вакцин, содержащих компонент вируса ветряной оспы.
Клинический изолят Varicella zoster был выделен из корочки от пустул здоровой девочки 6-и лет, заболевшей ветряной оспой в 2014 г. Клиническому изоляту после завершения этапов аттенуации при низких температурах присвоено название «vFiraVax». Штамм «vFiraVax» Varicella zoster (Master seed) прошел при низких температурах культивирования (300С) 12 пассажей в культуре диплоидных клеток ЛЭЧ - 3, 6 пассажей в первичной культуре клеток эмбрионов морской свинки и 2 пассажа в клеточной культуре диплоидных клеток ЛЭЧ - 3.
Штамм депонирован в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под номером 2891 12 декабря 2018 года.
Краткое описание чертежей и иных поясняющих материалов.
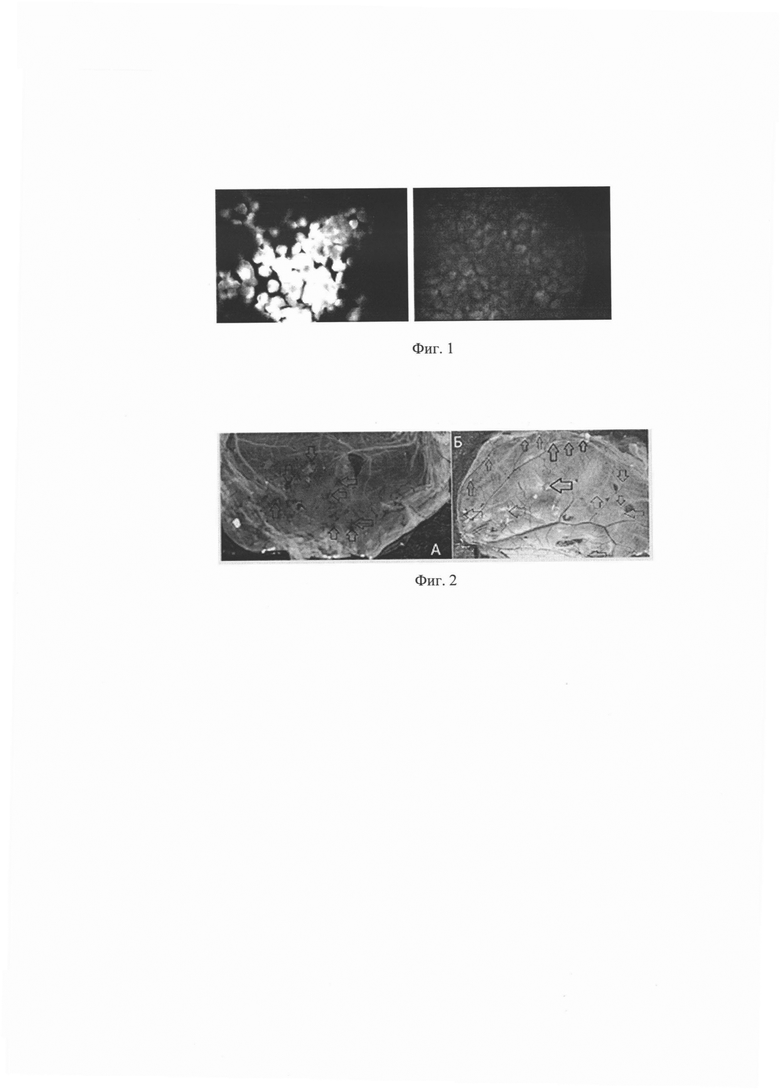
Фиг. 1 - результат непрямого иммунофлуоресцентного анализа инфицированных клеток ЛЭЧ - 3. Слева - инфицированные клетки, справа - контрольные
Фиг. 2 - морфологическая картина 12 - дневных куриных эмбрионов и хорион - аллантоисной оболочки при заражении родительским диким вариантом вируса и аттенуированным штаммом. А - pFiraVax,2п. (геморрагия), Б - vFiraVax,20п. (оспины)
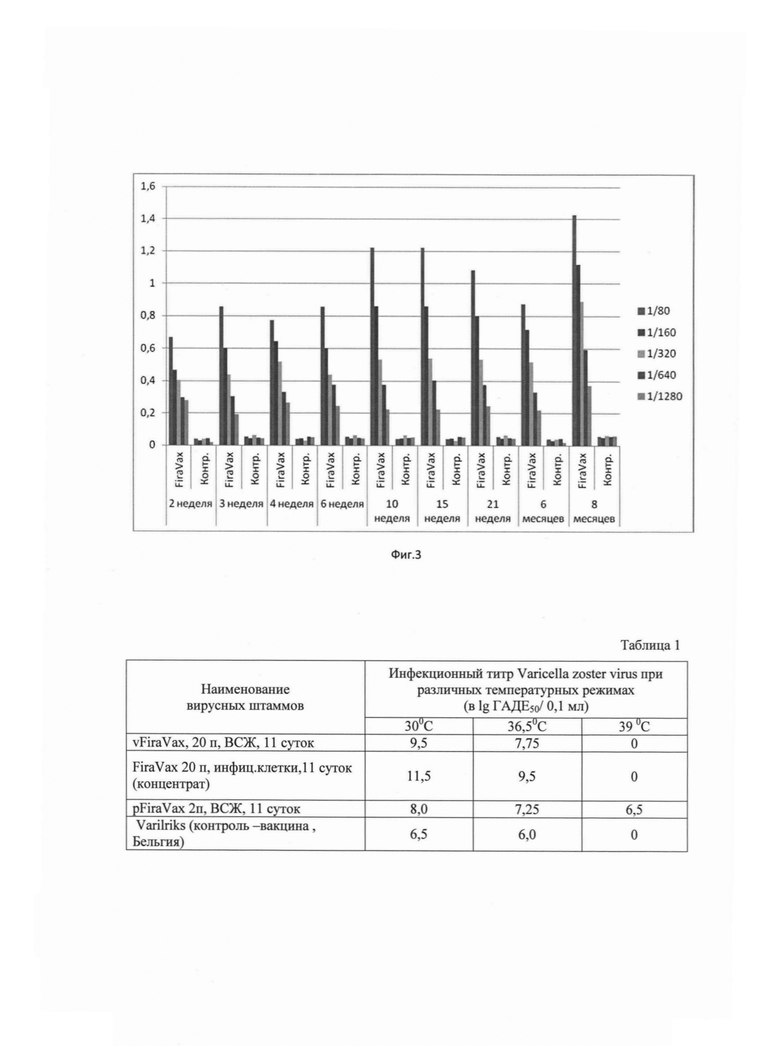
Фиг. 3 - Иммунный ответ SPF - мышей линии BALB/c на аттенуированный штамм Varicella zoster «vFiraVax» По оси абцисс указаны сроки исследования нескольких разведений сывороток опытной («FiraVax») и контольной (контр) групп с момента введения препарата. Справа указаны разведения сывороток. По оси ординат - значения оптической плотности при 450 нм.
Таблица 1 - определение ts и са маркеров биологической аттенуации кандидатов в вакцинные штаммы Varicella zoster на клетках М-27
Таблица 2 - определение ts и са маркеров биологической аттенуации кандидатов в вакцинные штаммы Varicella zoster на клетках ФЭМС.
Таблица 3 - оценка иммуногенности аттенуированного штамма «vFiraVax» Varicella zoster
Таблица 4 - сравнительная оценка результатов непрямой иммунофлуоресценции отечественного вакцинного штамма Varicella zoster с иммунными морских свинок
Таблица 5 - перекрестная реакция нейтрализации аттенуированных штаммов Varicella zoster иммунными сыворотками морских свинок
Таблица 6 - индекс перекрестной нейтрализации иммунной и нормальной сыворотки морских свинок в отношении вакцинных штаммов вируса
Таблица 7 - гемагглютинирующая активность иммунных сывороток морских свинок в отношении аттенуирующих штаммов вируса Varicella zoster
Таблица 8 - уровень инфекционности аттенуированных вирусных штаммов до и после обработки нейрорецепторами мозга SpF мышей.
Ракрытие сущности изобретения
Штамм v FiraVax характеризуется следующими признаками.
Морфологические признаки - вирионы являются сферическими, от 150-200 nm в диаметре и состоят из внутреннего икосадельтаэдрического капсида из 162 капсомеров, окруженных тегументом и оболочкой, состоящей из двух или более мембран. Оболочка содержит липиды.
Культуральные признаки - холодоадаптированный вакцинный штамм «vFiraVax» в субстратной клеточной линии легких эмбриона человека ЛЭЧ - 3 не вызывает цитопатического действия в отличие от родительского дикого типа, что позволяет получать многократные сливы вируссодержащей жидкости, начиная с 4-х суток с момента инфицирования.
Инфекционная активность вирусного штамма в культуре клеток - в чувствительных клеточных культурах легких эмбриона человека ЛЭЧ - 3, кожно-мышечной ткани эмбриона человека КМ - 27, кожно-мышечной ткани морских свинок ФЭМС инфекционная активность достигает 7,5-8,5 lg ГАДЕ50/0,5 мл.
Антигенные свойства - аттенуированный вирусный штамм индуцирует выработку специфических антител в сыворотке SpF мышей линии BALB/c и в сыворотке морских свинок, выявляемых в иммуноферментном анализе (ИФА), в иммунофлуоресценции (ИФ), реакции нейтрализации (РН), в реакции торможения гемагглютинации (РТГА).
На фиг. 1 представлен результат непрямого иммунофлуоресцентного анализа инфицированных клеток ЛЭЧ - 3. Инфицированные и неинфицированные вакцинным вирусным штаммом «vFiraVax» диплоидные клетки ЛЭЧ - 3 были сняты с культуральных флаконов и на предметном стекле приготовлены образцы клеток для непрямого иммунофлуоресцентного анализа. Клетки зафиксированы 2% параформальдегидом. В качестве специфической сыворотки была использована сыворотка человека, переболевшего ветряной оспой.
Вирулентные свойства - вакцинный холодоадаптированный вирусный штамм «vFiraVax» не обладает вирулентными свойствами в отличие от родительского штамма. При заражении хорион - аллантоисной оболочки 12 - дневных куриных эмбрионов родительским диким вариантом вируса возникает гибель эмбрионов или обширная геморрагия, а при заражении аттенуированным штаммом на хорион - аллантоисной оболочке обнаруживаются белые оспины (фиг. 2).
Молекулярно-генетическая особенность штамма.
Для получения молекулярных доказательств генетической идентичности полученного вирусного изолята было проведено клонирование амплифицированных фрагментов гена ORF 29 ДНК HHV3, выделенного из отечественных холодо-адаптированного вакцинного штамма «vFiraVax», в плазмиде pAL-2T (Евроген, Москва, Россия) с последующим секвенированием клонированных фрагментов. Был амплифицирован фрагмент orƒ29 длиной 78 пар нуклеотидных остатков (н.о.). В качестве положительного контроля в ПЦР использовали ДНК штамма vOka, выделенную из вакцинного препарата Varilrix. Амплифицированную ДНК очищали на колонках Евроген, лигировали с вектором, полученными лигазными смесями трансформировали компетентные клетки E.Coli СС001 (Евроген) с последующей селекцией клонов по цвету и устойчивости к ампициллину. Белые колонии (со вставкой) выращивали в питательной среде, плазмидную ДНК выделяли на колонках Евроген и определяли последовательность вставки (секвенирование в фирме Синтол). Все проанализированные клоны содержали уникальную последовательность длиной 29 пар н.о., полностью совпадающую с последовательностью положительного контроля.
Условия хранения - хранится при температуре не ниже 700С.
Стабильность основных свойств штамма - сохраняются в течение 5 лет (период наблюдения).
Осуществление изобретения.
Биологические свойства штамма иллюстрируются следующими примерами.
Пример 1.
Уровень размножения в чувствительной культуре клеток при температуре 390С. В табл. 1 и 2 представлены результаты титрования аттенуированных и диких штаммов Varicella zoster на штаммах диплоидных клеток М-27 и ФЭМС - 1 при различных температурных режимах.
Как видно из табл. 1 и 2, кандидаты в вакцинные штаммы «vFiraVax», как внеклеточный вирус так и внутриклеточный вирус не репродуцируются при высокой температуре 390 в отличие от дикого вируса, то есть аттенуированные штаммы обладают температурочувствительностью - ts фенотипом. В тоже время аттенуированные штаммы более активно репродуцируются при субоптимальной температуре при 300С по сравнению с дикими, то есть обладают холодоадаптируемостью-са-фенотипом.
Из табл. 2 видно, что аттенуированные штаммы обладают более высокой репродуктивной активностью в клетках эмбрионов морской свинки в сравнении с дикими штаммами - это еще один биологический маркер аттенуированных штаммов для живых вирусных вакцин.
Пример 2.
На фиг. 3 представлены результаты исследования сывороток SPF - мышей линии BALB/c в двух группах: 1 группа - контроль (интактные животные), вторая группа - опытная. Мышей опытной группы иммунизировали подкожно вируссодержащей жидкостью аттенуированного штамма «vFiraVax». Мышам вводили подкожно по 0,5 мл ВСЖ Varicella zoster, сыворотки от мышей собирали из хвостовой вены в различные интервалы времени, начиная с 2-х недель и в течение 8 месяцев (период наблюдения). Иммунные сыворотки исследовали в ИФА в твердофазном варианте иммунного анализа, где на твердой фазе был сорбирован лизат клеток КМ-27, инфицированных лабораторным штамм VZV «Ellen». Иммунный комплекс детектировали антимышиным пероксидазным конъюгатом в рабочем разведении (фирма Sigma). Значения оптической плотности оценивали при 450 нм на фотометре Thermo Scientific Varioskan Flash.
Как видно из диаграмм на фиг. 3, аттенуированный вирусный штамм обладает оптимальной антигенностью, вызывая высокий иммунный ответ на протяжении 8 месяцев периода наблюдения.
Пример 3.
Для оценки иммуногенности аттенуированного штамма «vFiraVax» вируса Varicella zoster, проведена иммунизация морских свинок. Морским свинкам ввели подкожно в холку по 0, 5 мл (одна прививочная доза) вируссодержащей жидкости аттенуированного штамма «vFiraVax» на 20 пассажном уровне. Иммунные сыворотки собраны через 2, 3 и 5 месяцев после иммунизации (забор крови проведен из сердца). В табл. 3 представлены результаты исследования в реакции торможения гемагглютинации (РТГА) и в реакции нейтрализации (РН).
По результатам исследования четко установлено, что аттенуированный штамм «vFiraVax» Varicella zoster в организме морских свинок индуцирует уровень антигемагглютинов (результаты РТГА) и нейтрализинов (результаты РН). При этом необходимо отметить, что нейтрализины держатся стабильно на высоком уровне в течение 5 месяцев (период наблюдения).
На следующем этапе мы расширили эксперименты с целью сравнения иммуногенности холодоадаптированного отечественного штамма с иммуногенностью зарубежного вакцинного штамма «vOka/Merk».
С этой целью иммунизировали морских свинок подкожно одной прививочной дозой двумя штаммами вируса Varicella zoster: «vFiraVax», 20 пассаж аттенуации и «vOka/Merk» (вакцина VariVax, США) и оценивали иммунные сыворотки в различных серологических реакциях.
В табл. 4 представлены результаты непрямой реакции иммунофлуоресценции иммунных сывороток морских свинок, полученных на 37 и 80 дни с момента иммунизации. Антигены приготовлены на диплоидных клетках морских свинок, инфицированных вакцинными вирусными штаммами «vFiraVax» и «vOka» разных производителей.
Как видно из представленной таблицы, все 3 иммунные сыворотки к вакцинному штамму «vFiraVax» и к вакцинному штамму «vOka» разных производителей выявляли вирусные антигены, приготовленные из отечественных штаммов «vFiraVax». При этом необходимо отметить, что иммунные сыворотки, полученные в более поздние сроки выявляли большее количество инфекционных фокусов.
Пример 4.
Сравнительная перекрестная реакция нейтрализации аттенуированных штаммаов Varicella zoster иммунными сыворотками морских свинок, полученных на 37 и 80 дни с момента иммунизации. Эксперимент поставлен на диплоидных клетках кожно-мышечной ткани эмбрионов человека М - 27. Нейтрализующие вирусы Varicella zoster были использованы в дозе 1000 ГАДЕ50/0,1 мл, т.е. одна прививочная доза для детей.
В табл. 5 представлены результаты эксперимента.
Иммунная сыворотка к отечественному штамму «vFiraVax», полученная на 37 день с момента иммунизации нейтрализовала гомологичный штамм со 100% защитой в разведении 1:6400, вирусный штамм опоясывающего герпеса - 1:3200, а вирусный штамм «vOka /Merk» (США) нейтрализовался иммунной сывороткой к штамму «vFiraVax» в разведении 1:1600. Нейтрализующие титры иммунной сыворотки к отечественному штамму «vFiraVax», полученные на 80 день с момента иммунизации не изменились.
Иммунные сыворотки к зарубежному штамму «vOka/Merk» (США), полученные на 37 день с момента иммунизации при нейтрализации тремя вирусными штаммами «vFiraVax», «vZelVax» и «vOka/Merk» имели одинаковый титр и составляли 1:3200.
Нейтрализующие титры иммунной сыворотки к зарубежному штамму «vOka/Merk» (США), полученные на 80 день с момента иммунизации, увеличились и нейтрализовали отечественный штамм «vFiraVax» и гомологичный штамм в разведении 1:6400, а вирусный штамм «vZelVax» - в разведении 1:3200.
Пример 5. Определение индекса нейтрализации иммунных сывороток. Индекс нейтрализации представляет собой отношение дозы вируса в смеси с нормальной сывороткой к дозе вируса в смеси с иммунной сывороткой или, что то же самое, что разности логарифмических показателей титра вируса в присутствии нормальной и иммунной сывороток.
Индекс нейтрализации 10 считается отрицательным, от 11 до 49 - сомнительным, а 50 и выше - положительным.
В таблице 6 представлены результаты эксперимента.
Как видно из представленной таблицы, индекс нейтрализации иммунных сывороток к вирусным штаммам «VFiraVax» 679,2 и 1096,0, а к вирусному штамму «vOka» равен 100.
Пример 6. В табл. 7 представлены результаты постановки реакции торможения гемагглютинирующей активности иммунных сывороток морской свинки, собранных на 37 и 80 дни с момента иммунизации. Нейтрализация сывороток проведена гемагглютинином, полученным по Norrby из культур клеток М-27, инфицированных лабораторным штаммом «ELLEN» вируса Varicella zoster, полученной из американской вирусной коллекции.
Как видим из полученных результатов гемааглютинирующие титры иммунных сывороток высокие и составляли 1 12800.
Пример 7. Изучение нейротропности аттенуированных вирусных штаммов «vFiraVax» оценивали способом, описанным в патенте «Способ аттенуации вирусов» (Авторы: Баррет А., Райман К., НИ Хаолин (США). Способ заключается в смешивании вируса с мембранными рецепторами мозга, центрифугировании смеси и определении остаточной вирусной инфекционности. Мембранные рецепторы получали из мозга 4-недельных SPF мышей линии BALB/c
Известно, что вирус не может заражать восприимчивую клетку, если его вирусный белок прикрепления не соединяется на клеточной поверхности с молекулой, которая служит в качестве рецептора для данного вируса.
Если вирус соединяется с мембранными рецепторами мозга, то после осаждения мембранных рецепторов центрифугированием, в надосадочной жидкости должен снизиться показатель инфекционности исследуемого вируса. По остаточной вирусной инфекционности судят о степени нейротропности исследуемого вируса. Остаточную вирусную инфекционность определяли методом предельного разведения на чувствительных к вирусу Varicella zoster клеточных культурах ФЭМС (фибробласты эмбрионов морских свинок). Результаты инфекционности оценивали на 7-е сутки с момента инфицирования клеточной культуры и выражали в lg ГАДЕ50/0,1 мл. В табл. 8 представлены средние показатели по результатам 2-х экспериментов.
Как видим из представленных результатов оценки инфекционности аттенуированных штаммов Varicella zoster до и после обработки нейрорецепторами мозга мышей, инфекционность отечественного вирусного штамма «vFiraVax» не изменилась. Американский вариант вирусного штамма «vOka/Merk» после обработки нейрорецепторами мозга мышей, снизил инфекционность на 1 lg ГАДЕ50/0,1 мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| Вирусный штамм для получения аттенуированной живой культуральной вакцины для профилактики и лечения опоясывающего герпеса для взрослого населения | 2020 |
|
RU2750818C1 |
| Способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы | 2016 |
|
RU2637093C1 |
| Способ получения четырехкомпонентной культуральной живой вакцины против кори, ветряной оспы, эпидемического паротита, краснухи | 2019 |
|
RU2717769C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ХОЛОДОАДАПТИРОВАННОЙ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2010 |
|
RU2465006C2 |
| Способ получения аттенуированных штаммов вируса гриппа а - кандидатов в живые гриппозные вакцины | 2017 |
|
RU2670514C1 |
| ШТАММ ВИРУСА ГРИППА А/Гонконг/1/68/162/35 (H3N2)-УНИВЕРСАЛЬНЫЙ ДОНОР ВНУТРЕННИХ ГЕНОВ ДЛЯ РЕАССОРТАНТОВ И РЕАССОРТАНТНЫЕ ШТАММЫ А/СПБ/ГК/09 (H1N1) И А/НК/Astana/6:2/2010 (H5N1), ПОЛУЧЕННЫЕ НА ЕГО ОСНОВЕ | 2011 |
|
RU2511431C2 |
| АТТЕНУИРОВАННЫЙ ХОЛОДОАДАПТИРОВАННЫЙ ШТАММ ВИРУСА ГРИППА А/КРАСНОДАР/101/59/35 (H2N2) ДЛЯ ПОЛУЧЕНИЯ ШТАММОВ ЖИВОЙ ИНТРАНАЗАЛЬНОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2007 |
|
RU2354695C1 |
| ХОЛОДОАДАПТИРОВАННЫЙ ШТАММ ВИРУСА ГРИППА В-В/ВИКТОРИЯ/2/63/87, ПРЕДНАЗНАЧЕННЫЙ В КАЧЕСТВЕ ШТАММА-ДОНОРА АТТЕНУАЦИИ ДЛЯ ПОЛУЧЕНИЯ РЕАССОРТАНТОВ ХОЛОДОАДАПТИРОВАННЫХ ШТАММОВ ДЛЯ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2013 |
|
RU2529772C1 |
| ПРОИЗВОДНЫЕ ОЛИГОХИТОЗАНА В КАЧЕСТВЕ АДЪЮВАНТОВ ДЛЯ ВАКЦИН | 2015 |
|
RU2589702C1 |
| НОВЫЕ ШТАММЫ ВИРУСА ВЕТРЯНОЙ ОСПЫ И ПРОТИВОВИРУСНАЯ ВАКЦИНА ПРОТИВ ВЕТРЯНОЙ ОСПЫ И ОПОЯСЫВАЮЩЕГО ЛИШАЯ, В КОТОРОЙ ПРИМЕНЯЮТСЯ ТАКИЕ ШТАММЫ | 2012 |
|
RU2580003C2 |



Изобретение относится к области биотехнологии. Изобретение представляет собой холодоадаптированный штамм вируса ветряной оспы «vFiraVax», депонированный в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под номером 2891 12 декабря 2018 года, предназначенный для получения живой культуральной вакцины для профилактики ветряной оспы и ассоциированных вакцин, содержащих компонент вируса ветряной оспы. Изобретение позволяет получать моновакцины против ветряной оспы и ассоциированные вакцины, содержащие компонент вируса ветряной оспы из штамма, изолированного на территории Российской Федерации. 3 ил., 7 пр., 8 табл.
Холодоадаптированный штамм вируса ветряной оспы «vFiraVax», депонированный в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под номером 2891 12 декабря 2018 года, предназначенный для получения живой культуральной вакцины для профилактики ветряной оспы и ассоциированных вакцин, содержащих компонент вируса ветряной оспы.
| YASUYUKI Gomi et al., Complete DNA Sequenes of the Oka Varicella Vaccine and Its Parental Virus, Journal of Virology,Vol.76, N 2, 2002, p.11447-11459, DOI: 10.1128/JVI.76.22.11447-11459.2002 | |||
| ХАРИТ С.М | |||
| и др | |||
| Вакцинопрофилактика ветряной оспы | |||
| Эффективность и безопасность вакцин на основе штамма Ока | |||
| Эпидемиология и Вакцинопрофилактика, N 6 (55), 2010, с.45-49. |
Авторы
Даты
2019-07-02—Публикация
2019-02-21—Подача