Изобретение относится к медицине, а именно к медицинской вирусологии и биотехнологии, и может быть использовано для создания средств специфической профилактики, в частности для получения моно-вакцины для профилактики ветряной оспы у детей.
Вирусы вызывают различные заболевания, такие как корь, краснуха, эпидемический паротит, ветряная оспа, геморрагическая лихорадка с почечным синдромом, японский энцефалит В, детский полиомиелит, гепатит А, гепатит В, гепатит С и натуральная оспа, приводящие к тяжелым последствиям для инфицированного вплоть до летального исхода.
Ветряная оспа является высоко контагиозным заболеванием, которое поражает детей, пожилых людей и пациентов со сниженным иммунитетом вследствие инфицирования вирусом Varicella zoster (VZV). Более чем 90% населения заболевает этой болезнью в течение первых двух десятилетий своей жизни. Это заболевание трудно поддается лечению у людей с пониженным иммунитетом и у взрослых людей. В большинстве случаев, VZV становится латентным в клетках спинномозгового ганглия.
Как правило, вирусные заболевания можно предотвратить путем введения в организм вакцин, полученных из инактивированных или ослабленных патогенных вирусов. Так, в целях профилактики заболеваний ветряной оспой предусматривается проведение мероприятий по всеобщей вакцинации детей с использованием, например, живого аттенуированного вакцинного вируса ветряной оспы.
Из уровня техники известен патент США №3985615, опубликован 12.10.1976, который раскрывает получение вакцины VZV путем многократной аттенуации вирусного штамма «vOKA» на клетках первичной эмбриональной ткани морских свинок (GPEC).
Основным недостатком предложенного способа является то, что выход VZV при использовании клеток GPEC очень мал.
Для повышения выхода VZV, и соответственно, для производства вакцин принято использовать в качестве клеток-хозяев куриные эмбрионы, клетки мозга крысят, диплоидные клетки млекопитающих. Несмотря на то, что куриные эмбрионы или клетки мозга крысят могут использоваться в качестве клеток-хозяев для снижения стоимости производства, их использование невыгодно из-за низкой восприимчивости к вирусам, сложных способов очистки и побочных эффектов, возникающих вследствие наличия контаминантов в виде чужеродных белков. Использование же нормальных диплоидных клеток человека может уменьшить побочные эффекты, вызываемые чужеродными белками, и, следовательно, они являются более предпочтительными для получения вирусных вакцин.
Типичными диплоидными клетками человека являются клеточный штамм MRC-5 (АТСС, CCL 171), клеточный штамм WI-38 (АТСС, CCL 75) и клеточный штамм HEL 299 (АТСС, CCL 137). Клеточный штамм MRC-5 получен из легочной ткани 14-недельных эмбрионов мужского пола (Proc. Symp. Human Diploid Cells, Yugoslavia. Acad. Sci. Arts. Zagreb., стр. 43-45 (1970); и Nature (London), 227, стр. 168-170 (1970)); WI-38 получен из легочной ткани 3-месячных эмбрионов женского пола (Exp. Cell Res., 25, стр. 585 (1961) и Am.J.Hyg., 75, стр. 240 (1962)) и клеточный штамм HEL 299 получен из легочной ткани эмбрионов мужского пола (W.D. Peterson, Jr. et al., Proc. Soc. Exp. Biol. Med., 128, стр. 772 (1968)).
Из уровня техники известен патент США №4000256, опубликован 28.12.1976, который описывает получение вакцины VZV путем субкультивирования от 10 до 80 раз клеточного штамма эмбриональных фибробластов человека WI-38, содержащего вирус VZV, и патент США №5360736, опубликован 01.11.1994, который раскрывает способ получения вакцины VZV на клеточном штамме MRC-5.
Однако недостатками предлагаемых способов является то, что клеточные штаммы WI-38 и MRC-5 многократно пассируются, снижая, таким образом, свою способность вырабатывать VZV, и поэтому эти способы не могут применяться для широкомасштабного производства вакцины VZV.
Таким образом, в основном разработка вакцины направлена на использование или создание новых штаммов, которые могут использоваться для их получения.
Так, в частности, из уровня техники известен (патент РФ за №2146289 С1, опубликован 10.03.2000) штамм диплоидных клеток фибробластов легких эмбриона человека LBHEL получен из ткани легких 20-недельного эмбриона. Штамм депонирован под номером КСТС 0127 BP. Штамм отличается быстрым ростом, высокой восприимчивостью к вирусам, особенно к вирусу VZV. Штамм хорошо растет на среде, содержащей сыворотку плода коровы в концентрации 5%. На основе данного штамма разработан способ получения вакцины VZV с использованием вирусного штамма «vOKA».
Однако использование данного штамма в промышленном производстве не описано и пригодность для данных целей не подтверждена.
Необходимо отметить, что на сегодняшний день отечественного способа получения монокомпонентной живой культуральной вакцины, аттенуированной для профилактики ветряной оспы, не существует.
Известные вакцины против ветряной оспы и соответственно способы их получения: «Варилрикс», производства фирмы «ГлаксоСмит-Кляйн Байоложикалс», Бельгия и «Окавакс», производства «Исследовательского Фонда по инфекционным заболеваниям Университета Осака (БИ - КЕН)», Япония, связаны с иностранными компаниями (World Health Organization, WHO Technical Report Series, No. 848, 1994, p. 22-52. Requiremenrs for varicella vaccine (live), Varicella zoster virus vaccine WO 2006094756A2, Glaxosmithkline Biologicals S/A)).
Недостатки зарубежной технологии получения компонента моновакцины против ветряной оспы из японского аттенуированного штамма «vOKA» вируса VZV заключаются в следующем:
1. Необходимость получения внеклеточного вируса Varicella zoster исключительно из инфицированных клеток путем многоэтапных способов извлечения (сбор урожая клеток механическим способом; ультразвуковая дезагрегация клеток; дифференциальное центрифугирование клеточной массы для получения внеклеточного вируса).
2. Использование в качестве посевного вируса (master seed) инфицированных клеток, содержащихся в криопротекторе и хранящихся при низких температурах (минус 196°С).
3. Проведение оценки инфекционности внеклеточного вируса методом псевдобляшкообразующих единиц с использованием в качестве вирусного инокулюма инфицированных клеток, что позволяет только косвенно судить о показателях инфекционности полученного внеклеточного вируса.
4. Зарубежная технология позволяет получать однократный урожай внеклеточного вируса Varicella zoster в процессе создания вакцины, содержащей кроме вируса Varicella zoster остаточные компоненты субстратных клеток MRC-5, включая ДНК и белки, что значительно снижает качество вакцины.
5. Данная технология создает высокую стоимость вакцинного препарата.
Поэтому основной задачей, решаемой предлагаемым изобретением, является разработка как вакцины, так и оригинального способа ее получения на основании отечественных штаммов клеток с учетом устранения указанных выше недостатков.
Поставленная задача решается, а технический результат достигается следующим образом.
Предложен способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы, включающий заражение вирусом ветряной оспы штаммом «vOKA» диплоидных клеток ЛЭЧ -3 с последующей репродукцией и выходом вирусов в культуральную среду, после чего осуществляют, по меньшей мере, от 7 до 15 сборов вируссодержащей жидкости, с внесением в них стабилизатора и получение вакцины.
При этом дополнительно проводят определение инфекционной активности индивидуальных вирусных сборов вируссодержащей жидкости.
Также дополнительно проводят объединение вирусных сборов.
При этом штамм диплоидных клеток ЛЭЧ -3 пассируется с помощью 0,4% тринатрийцитрата (ТНЦ) на изотоническом растворе моновалентных солей и глюкозы (6,0 грамм на литр).
Также штамм диплоидных клеток культивируют в питательной среде ДМЕМ/F12 с 0,13% NaHCO3 и 10 мМ HEPES, обогащенной ростовыми добавками ОПИ (оксалоацетат, пируват, бычий инсулин) и ростстимулирующим фактором 0,08% ТНЦ с 5% ЭТС, инактивированной прогреванием и разбавленной поровну кондиционированной средой с растущих клеток ЛЭЧ-3 (4-5 сутки роста).
Другим аспектом изобретения является применение штамма диплоидных клеток ЛЭЧ-3 для получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы.
Другим аспектом изобретения является живая культуральная аттенуированная вакцина для профилактики ветряной оспы, полученная вышеописанным способом.
Технические результаты отечественной технологии получения компонента моновакцины против ветряной оспы заключаются в следующем:
1. Получение внеклеточного вируса Varicella zoster путем многократных индивидуальных сборов с однократно инфицированных диплоидных клеток ЛЭЧ-3.
2. Использование в качестве посевного вируса (master seed) вируссодержащей жидкости (ВСЖ), а не инфицированных клеток.
3. Оценка инфекционности внеклеточного вируса проводится методом гемадсорбции на чувствительных к вирусу Varicella zoster клеточных культурах, что позволяет более точно и однозначно оценить инфекционную активность внеклеточного вируса.
4. Накопление вакцинного штамма VZV (штамм «vOKA») в инфицированных диплоидных клетках ЛЭЧ-3 с использованием ТНЦ, увеличивается на 0,75-1,5 lg инфекционных доз выше, чем в аналогичных культуральных моделях при использовании в качестве диспергента трипсина.
5. За счет повышенной природной адгезивности диплоидных клеток ЛЭЧ-3, пассируемых с помощью ТНЦ, увеличивается количество внеклеточных вируссодержащих сливов с ростовой поверхности инфицированных клеток от 7 до 15, что значительно снижает себестоимость конечного целевого продукта - противовирусной вакцины.
Краткая характеристика линии ЛЭЧ-3.
Способ получения данной линии разработан в лаборатории клеточных культур ЕНИИВИ Н.П. Глинских с соавторами в 1980 году. Число генераций и пассажей: до начала анализа прошла не более 20 пассажей. Монослой образуется на 4-5 сутки с момента посадки. Морфологические характеристики: клетки фибробластоподобного типа с четкими границами. Кариологическая характеристика: по структуре кариотипа клетки соответствуют кариотипу человека. Модальный класс содержит 87% клеток с нормальным диплоидным набором хромосом человека. Видовая принадлежность: человек, подтверждено кариологически и изоэнзимным методом. Сведения о контаминации: бактерий, грибов, микоплазм не выявлено. Сохраняется в среде роста + 10% глицерина в жидком азоте. При размораживании восстанавливается 70% клеток. Чувствительность к вирусам: культура высокочувствительна к полиовирусам 1,2,3 типов, Коксаки В3, ECHO 3, 6, 11, 13, 19, 20, 24, 28, PC-вирусам, вирусу простого герпеса. Учитывая возможность длительного поддержания штаммов клеток легкого эмбриона человека (ЛЭЧ-3) с сохранением основных параметров, присущих культуре диплоидных клеток человека, ниже приведена оптимальная упрощенная схема получения таких культур. Клетки ЛЭЧ формировали плотный монослой фибробластоподобных клеток на 3-4 сутки роста. Субкультивирование проводили по мере формирования монослоев с коэффициентом рассева 1:2. Среда культивирования имеет рН в пределах 7.2-7.4. Продолжительность жизни диплоидного штамма клеток ЛЭЧ составляет 40-50 пассажей. Фаза активного роста клеток начинается с 4-5 пассажа и продолжается до 35-40 пассажа. Формирование сплошного клеточного монослоя на этой фазе развития культуры происходило на 3-4 сутки. Коэффициент рассева клеток в этот период составляет 1:2. Фаза старения начиналась, как правило, после 35-40 пассажа. Для создания фонда этих культур, клетки необходимо было накопить и заморозить при -196°С на ранних этапах до 10-12 пассажа. Клеточные штаммы, замороженные в период активного роста, с использованием оптимального режима и условий консервации, обладают высокой жизнеспособностью - до 90-92%, а по своим биологическим свойствам не отличаются от исходной культуры. Для культивирования диплоидных клеток рекомендовано использование питательных сред постоянного состава. Оптимальной средой для клеток ЛЭЧ является среда Игла или Игла MEM с добавлением сыворотки крови плодов крупного рогатого скота. Антибиотики не используют, при рН среды - 7.2-7.4. Данные по выделяемости и накоплению вирусов и скорости развития ЦПД на диплоидных клетках ЛЭЧ показал, что наиболее целесообразным является использование диплоидных клеток для вирусологических исследований с 5 до 30 пассажей (Малыгин А.С., Оценка метаболизма интактных и зараженных вирусом клеток методом динамической спекл-интерферометрии, автореф. дисс. к.т.н., Екатеринбург, Томск, 2015).
Заявленный способ осуществляется следующим образом:
Индивидуальные вирусные сборы (ИВС) вакцинного штамма «vOKA» получают путем репродукции вирусов в монослойной культуре диплоидных клеток ЛЭЧ-3. Для увеличения репродукции указанных выше штаммов вируса VZV, диплоидные клетки ЛЭЧ-3 выращивают в питательной среде ДМЕМ/ F12 с 0,13% NAHCO3 и 10мМ HEPES, обогащенной ростовыми добавками (оксалоацетат, пируват, инсулин - ОПИ) и ростстимулирующим фактором тринатрийцитратом (ТНЦ) (0,001%-0,01%) с 5% эмбриональной телячьей сывороткой (ЭТС), инактивированной прогреванием, 1-2 мМ глутамина, 40 мкг/мл гентамицина. Культуру диплоидных клеток ЛЭЧ-3 пассируют с помощью 0,4% раствора ТНЦ с глюкозой (6,0 грамм/ литр). По достижении плотного монослоя диплоидных клеток, как правило, на 4-5 сутки роста, ростовую среду удаляют, клеточный монослой осторожно 3-х кратно промывают фосфатно-буферным раствором, содержащим ионы Са и Mg2+, и на монослой клеток ЛЭЧ-3 вносят вируссодержащую жидкость (ВСЖ) ветряной оспы с множественностью инфицирования 0,02. Контакт вирусов с клетками продолжается 2 часа при температуре 30°С, при этом, через каждые 15 минут культуральные флаконы с инфицированными клетками покачивают для равномерного распределения ВСЖ. Через два часа, не удаляя неадсорбировавшегося вируса, в культуральные флаконы вносят поддерживающую среду ДМЕМ без сыворотки, с 1-2 мМ глутамина и 40 мкг/ мл гентамицина в объеме, в 2 раза меньшем, чем ростовая среда. Вирусные индивидуальные сборы собирают через определенные интервалы времени (3-6 суток). Инфекционную активность вирусных сборов оценивают на чувствительных к вирусу Varicella zoster клеточных культурах. Наиболее чувствительными клеточными культурами к вирусу VZV являются диплоидные клетки из кожно-мышечной ткани эмбрионов человека М-27 и диплоидные клетки из ткани эмбрионов морской свинки ФЭМС-1 и ФЭМС-2 (фибробластоподобные). Клеточные линии выращивают на 2-х 24-луночных планшетах, посевная доза клеток 70-100×103 клеток на лунку в среде ДМЕМ/ F12 с 5% ЭТС, с 1-2 мМ глутамина и 40 мкг/ мл гентамицина. На следующие или через 2-е суток роста из монослоя, не достигшего высокой плотности, ростовую среду из лунок планшет удаляют, клеточный монослой в лунках дважды промывают фосфатно-буферным раствором (ФБР) и в лунки каждой из 2-х планшет вносят по 0,1 мл десятикратных разведений ВСЖ VZV (с 10-1 до 10-10) в среде ДМЕМ с 2% ЭТС.
В контрольные неинфицированные лунки вносят по 0,1 мл среды ДМЕМ с 2% ЭТС.
Инфекционную активность вируса VZV оценивают на 7 сутки с момента инфицирования в реакции гемадсорбции с 0,25% взвесью эритроцитов морской свинки, или куриных эритроцитов или эритроцитов человека «0» группы и результат выражают в гемадсорбирующих единицах в 0,1 мл (ГАДЕ50/0,1 мл).
Получение эритроцитов. У морских свинок берут кровь из сердца шприцем вместимостью 5,0 мл и отмывают три раза 0,9% раствором натрия хлорида с последующим центрифугированием в течение 10 мин при 1500 об/мин. Осадок разводят 0,9% раствором натрия хлорида до 0,25% концентрации.
Проведение реакции гемадсорбции. На 6-7 сутки с момента инфицирования из планшеты с инфицированными и контрольными (неинфицированными) клеточными культурами сливают культуральную жидкость, монослой дважды отмывают ФБР и в каждую лунку вносят по 0,5 мл 0,25% взвеси эритроцитов морской свинки. Планшеты инкубируют 30 мин при температуре от 3° до 5°С, а затем 30 мин при температуре от 20° до 22°С. Взвесь эритроцитов удаляют из планшеты и монослой клеток отмывают 3 раза ФБР и исследуют под световым микроскопом (окуляр 10х, объектив 20х). Титр вируса в ГАДЕ50/0,1 мл определяется как наибольшее разведение, которое вызывает гемадсорбирующий эффект в 50% зараженных клеточных культур при отсутствии гемадсорбирующего эффекта в контрольных незараженных клеточных культурах. Рассчитывается титр вируса по формуле Кербера:
lg ГАДЕ50=L-d(S-0,5),
где L - lg наименьшего разведения, используемого в титровании;
d - интервал в lg между двумя последовательными разведениями;
S - сумма пропорций положительных тест-единиц (т.е. лунок с культурой клеток, где проявился гемадсорбирующий эффект) в каждом разведении.
Полученные результаты можно проиллюстрировать на следующем примере.

lg ГАДЕ50=-1-(8-0,5)=-8,5
Таким образом, инфекционная активность вируссодержащего материала (титр вируса) составляет 10-8,5 ГАДЕ50 в 0,1 мл, т.е. титр вируса равен 8,5 lg ГАДЕ50/0,1 мл.
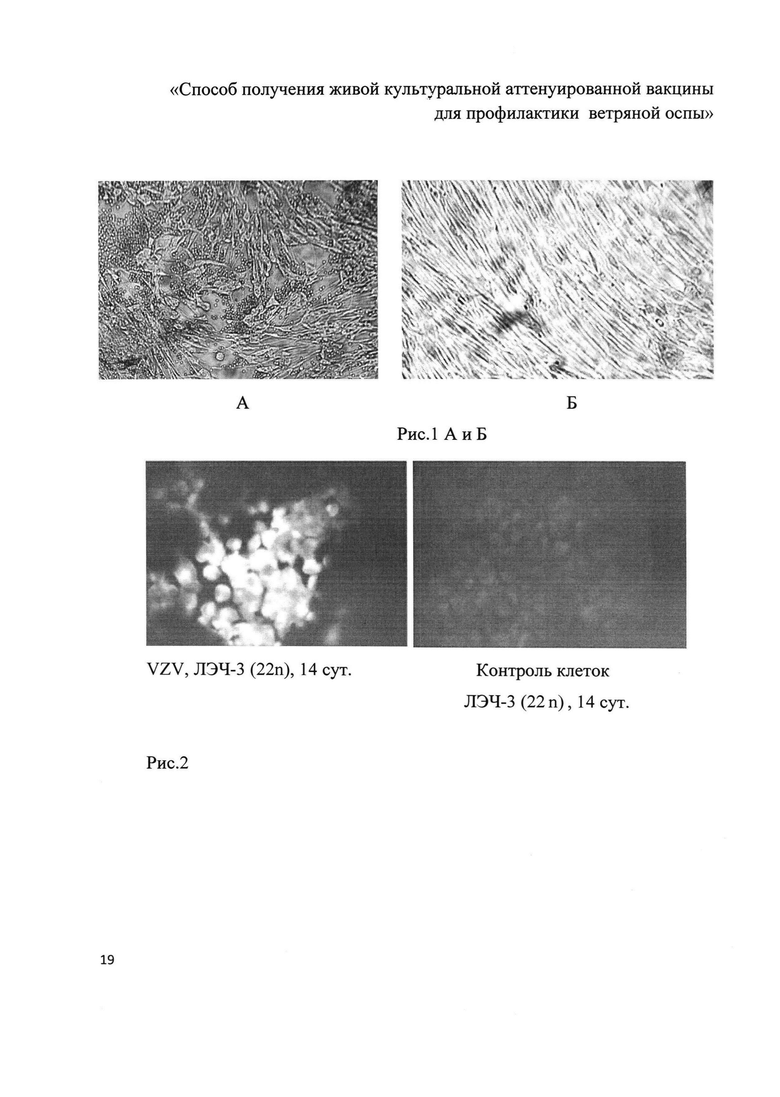
Также данные результаты проиллюстрированы на рис. 1, где отражена гемадсорбция на клетках ЛЭЧ-1 (А) на 7-е сутки с момента инфицирования при разведении вируса 10-6, Б - контроль неинфицированных клеток ЛЭЧ-3.
Далее гемадсорбирующую активность вирусов VZV подтверждают в реакции иммунофлуоресценции со специфическими антивирусными иммуноглобулинами.
Постановка реакции непрямой иммунофлуоресценции:
Вторую 24-х луночную планшету с десятикратными разведениями ВСЖ VZV на ночь переносят на минус 20°С, затем размораживают и из каждой лунки готовят препарат из инфицированных клеток на обезжиренных предметных стеклах, высушивают при комнатной температуре, фиксируют 3% параформальдегидом (фирма «Sigma», США) в течение 20-30 мин при комнатной температуре. После фиксации промывают водопроводной водой, подсушивают при комнатной температуре и на каждое пятно наносят 30-50 мкл иммунной антиветряночной сыворотки в разведении 1:100. Препараты помещают во влажную камеру и инкубируют при 36,5°С в течение 45 мин. После инкубации с иммунной сывороткой препараты промывают водопроводной водой, подсушивают при комнатной температуре и на каждое пятно наносят ФИТЦ-конъюгат - это белок А, меченый ФИТЦ (фирма «Sigma», США) в разведении 1:50. Препараты вновь помещают во влажную камеру и инкубируют 45 мин при 36,5°С. После инкубации с белком А-ФИТЦ препараты промывают, подсушивают и подсчитывают количество инфекционных фокусов в люминесцентном микроскопе «Optica» (Италия) при длине волны 520 нм. Титр ВСЖ VZV определяют по такой же схеме, как и для реакции гемадсорбции. Непрямая иммунофлуоресценция клеток ЛЭЧ-3, инфицированных VZV, визуально показана на рис. 2 (картина слева) и контроль неинфицированных клеток ЛЭЧ-3 (картина справа).
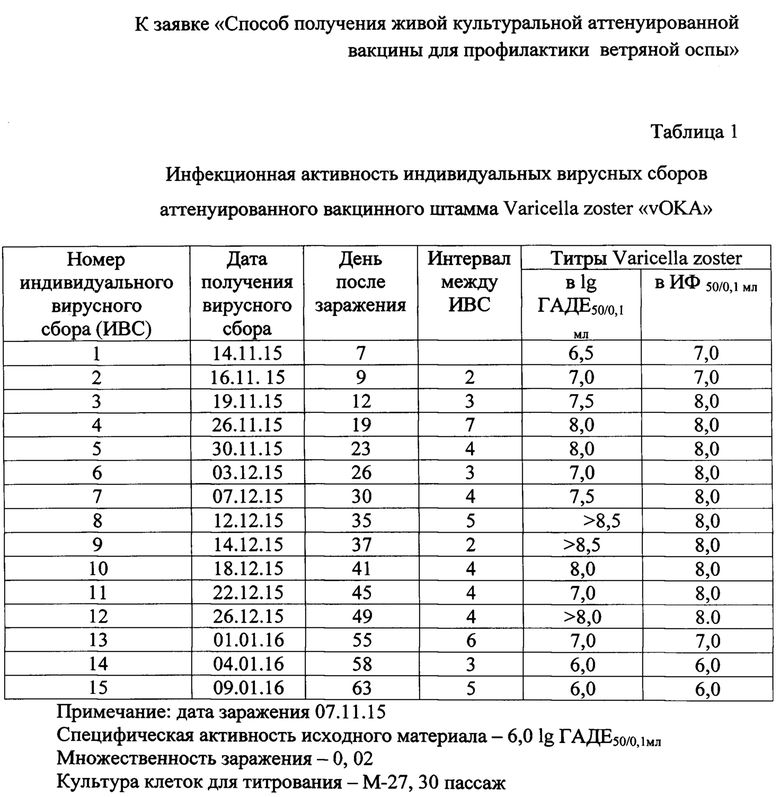
В табл. 1 представлены результаты оценки инфекционной активности 15 индивидуальных вирусных сборов, полученных с инфицированных клеток ЛЭЧ- 3, выращенных в культуральных флаконах площадью 175 см2 и инфицированных аттенуированным штаммом «vOKA».
Как видим из представленной таблицы, с инфицированных клеток ЛЭЧ - 3 было сделано 15 индивидуальных вирусных сборов, и титры вируса Varicella zoster колебались в пределах 7.0-8,5 lg ГАДЕ50/01 мл.
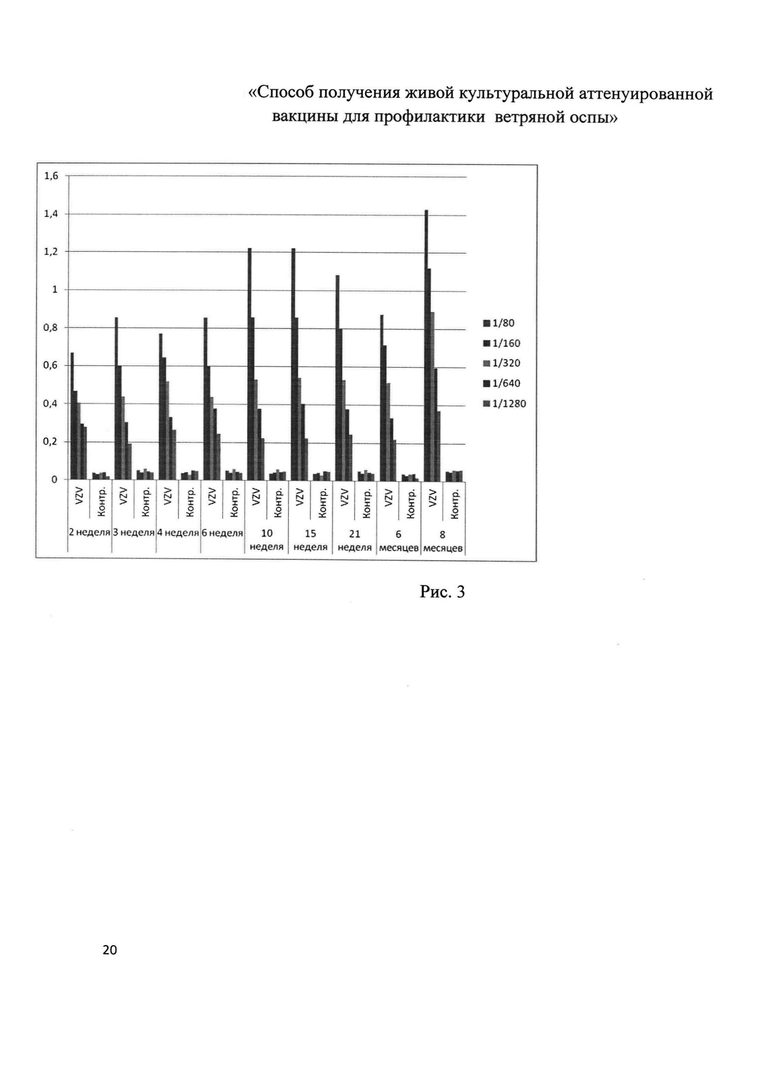
На рис. 3 представлены результаты исследования сывороток SPF-мышей линии BALB/c, иммунизированных подкожно вируссодержащей жидкостью, полученной с индивидуального вирусного сбора (N 15). Мышам вводили подкожно 0,5 мл ВСЖ Varicella zoster, сыворотки от мышей собирали из хвостовой вены в различные интервалы времени, начиная с 2-х недель и в течение 8 месяцев (период наблюдения). Иммунные сыворотки исследовали в ИФА в твердофазном варианте иммунного анализа, где на твердой фазе был сорбирован лизат инфицированных клеток М-27. Иммунный комплекс детектировали антимышиным пероксидазным конъюгатом в рабочем разведении (фирма Sigma).
При этом на рис. 3 по оси абсцисс указаны сроки исследования сывороток с момента введения препарата, по оси ординат - значения ОП450. Показатели оценены на фотометре Thermo Scientific Varioskan Flash, справа на цветных квадратах указаны разведения сывороток.
Как видно из диаграммы на рис. 3, аттенуированный вирусный штамм вызывает высокий иммунный ответ на протяжении 8 месяцев периода наблюдения.
После определения инфекционной активности индивидуальных вирусных сборов их объединяют, добавляют стабилизатор, разливают во флаконы по 0,5 мл и лиофилизируют.
Состав стабилизатора:
Смесь 0, 100 мл раствора ЛС-18* и 0,025 мл 10% раствора желатина.
Примечание: * в состав водного раствора ЛС-18 входит сахароза - 250 мг, лактоза - 50 мг, натрий глутаминовокислый - 37,5 мг, глицин - 25 мг, L-пролин - 25 мг, Хенкса сухая смесь с феноловым красным - 7,15 мг, вода для инъекций до 1 мл.
До лиофилизации вакцину, разлитую в 2-х миллилитровые флаконы, замораживают до минус 70°С.
Сублимационное высушивание проводят согласно инструкции - «Инструкция по сублимационному высушиванию» по схеме:
1. Запуск сублимационной установки и проверка работы основных функциональных систем;
2. Загрузка кассет с замороженной вакциной в сублимационную установку;
3. Сублимационное высушивание.
Кассеты с замороженной вакциной ставят на предварительно охлажденные до температуры 0+2°С полки сублиматора. После установки кассеты материал выдерживают в течение 2-х часов при температуре полок 0 +2°С. Затем полки охлаждают до - 52°С - 55°С и выдерживают не менее 8 часов.
Камеру сублиматора вакуумируют до давления 75-80 μbar (микробар). Этап сублимации. Включают нагрев полок. Температуру полок доводят до минус 20°С за 5 часов, которую поддерживают в течение последующих 45 часов. Температуру полок доводят в течение 1 часа до -15°С и выдерживают 12 часов. Температура материала при сублимации в диапазоне от 40°С до -32°С. По истечении 63 часов от начала сублимации температуру полок повышают со скоростью 5°С/ час до температуры полок +25°С - +27°С. Этап досушивания. При достижении температуры материала +25°С - +27°С ее поддерживают 15-18 часов. Вакуум можно довести до 4-60 μbar (микробар).
После завершения этапа досушивания флаконы укупоривают под вакуумом. Вакуумированные укупоренные флаконы обкатывают алюминиевыми колпачками.
Закатанные флаконы дополнительно просматривают на качество закатки. Ставят в полиэтиленовые поддоны и отправляют в холодильник.
Таким образом, заявленное техническое решение позволяет упростить технологию получения моновакцины для профилактики против ветряной оспы детского контингента, совершенствовать их качество и снизить стоимость конечного целевого продукта.
Группа изобретений относится к медицине, в частности к иммунологии, и может быть использована для получения моновакцины против ветряной оспы. Способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы включает заражение вирусом ветряной оспы штаммом «ОКА» диплоидных клеток ЛЭЧ-3 с последующей репродукцией и выходом вирусов в культуральную среду. После чего осуществляют, по меньшей мере, один сбор вируссодержащей жидкости, внесение в нее стабилизатора и получение вакцины. Группа изобретений относится также к применению штамма диплоидных клеток ЛЭЧ-3 для получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы. Использование диплоидных клеткок штамма ЛЭЧ-3 с высокой адгезивностью к поверхности роста позволяет получать от 7 до 15 индивидуальных вирусных сборов с высоким содержанием внеклеточного вакцинного вируса Varicella zoster. Получение внеклеточного вируса Varicella zoster путем индивидуальных сборов с инфицированных диплоидных клеток ЛЭЧ-3 с использованием тринатрийцитрата обеспечивает увеличение урожая вируса Varicella zoster на 0,75-1,5 lg инфекционных доз выше, чем в аналогичных культуральных моделях при использовании в качестве диспергента трипсина. 3 н. и 4 з.п. ф-лы, 1 табл., 3 ил.
1. Способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы, включающий заражение вирусом ветряной оспы штаммом «ОКА» диплоидных клеток ЛЭЧ-3 с последующей репродукцией и выходом вирусов в культуральную среду, после чего осуществляют, по меньшей мере, один сбор вируссодержащей жидкости, внесение в нее стабилизатора и получение вакцины.
2. Способ по п. 1, отличающийся тем, что дополнительно проводят определение инфекционной активности индивидуальных вирусных сборов вируссодержащей жидкости.
3. Способ по п. 1, отличающийся тем, что при приготовлении вакцины дополнительно проводят объединение вирусных сборов.
4. Способ по п. 1, отличающийся тем, что штамм диплоидных клеток ЛЭЧ-3 пассируется с помощью 0,4% тринатрийцитрата (ТНЦ) на изотоническом растворе моновалентных солей и глюкозы (6,0 грамм на литр).
5. Способ по п. 1, отличающийся тем, что штамм диплоидных клеток культивируют в питательной среде ДМЕМ/F12 с 0,13% NaHCO3 и 10 мМ HEPES, обогащенной ростовыми добавками ОПИ (оксалоацетат, пируват, бычий инсулин) и ростстимулирующим фактором 0,08% ТНЦ с 5% ЭТС, инактивированной прогреванием и разбавленной поровну кондиционированной средой с растущих клеток ЛЭЧ-3, 4-5 сутки роста.
6. Применение штамма диплоидных клеток ЛЭЧ-3 для получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы.
7. Живая культуральная аттенуированная вакцина для профилактики ветряной оспы, полученная способом по любому из пп. 1-5.
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ, СПОСОБ ПОЛУЧЕНИЯ СВОБОДНОЙ ОТ КЛЕТОК ВАКЦИНЫ, СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК, ПИТАТЕЛЬНАЯ СРЕДА | 1993 |
|
RU2126269C1 |
| WO 1997030147 A1, 21.08.1997 | |||
| WO 2014062060 A1, 24.04.2014 | |||
| WO 2012018973 A1, 09.02.2012. | |||
Авторы
Даты
2017-11-29—Публикация
2016-12-20—Подача