Область техники.
Изобретение относится к области медицинской биотехнологии и может быть использовано при получении моновакцины против опоясывающего герпеса (герпес зостер - HZ).
Уровень техники.
Вирус Varicella zoster (VZV) относится к семейству герпесвирусов и является причиной болезни с двумя различными симптомами (ветряная оспа и опоясывающий лишай или опоясывающий герпес). После перенесенной первичной инфекции ветряной оспы вирус локализуется в чувствительных нервных ганглиях. При определенных обстоятельствах он рецидивирует и переходит в латентное состояние. Опоясывающий герпес проявляется такими симптомами, как высыпания на теле различной локализации, развитие ганглионеврита с поражением задних корешков межпозвоночных ганглиев.
Как правило, вирусные заболевания можно предотвратить путем введения в организм вакцин, полученных из инактивированных или живых ослабленных патогенных вирусов.
Из уровня техники известен вирусный штамм VZV (название штамма не указано), продуцируемый в клетках китайского хомячка, антигенные компоненты этого штамма вируса входят в состав рекомбинантной субъединичной вакцины против опоясывающего герпеса - вакцина Shingrix для профилактики HZ и постгерпетической невралгии (PHN) для взрослых в возрасте старше 50 лет. Вакцина Shingrix состоит из гликопротеина Е, получаемого из вируса VZV, и адъювантной системы (AS018), состоящей из Quillaja saponaria Molina, фракции 21 (QS - 21) и 3-0-деацил -4 -монофосфориллипида A (MPL) от Salmonella Minnesota. Антиген gE (гликопротеин Е) - лиофилизированный порошок должен быть восстановлен с адъювантом (липосомальная композиция) непосредственно перед использованием; после восстановления каждая доза 0,5 мл содержит 50 мкг каждого из gE, QS - 21 и MPL.
Субъединичная вакцина вызывает сильный иммунный ответ, будучи безопасной для людей, которым противопоказаны живые ослабленные вакцины (Yahiya Y. Syed // Recombinant zoster vaccine (Shingrix): A review in Herpes zoster. Drugs et aging, https: // doi.org/10.1007/s40266-018-0603-x).
Авторы обращают внимание на побочные эффекты указанной вакцины в виде реакции в месте инъекции, миалгии, усталости. Это вакцина инактивированная и, как правило, инактивированные вакцины обладают более слабой иммуногенностью в отличие от живых аттенуированных вакцин.
Учитывая, что вирусный гликопротеин Е вируса ветряной оспы является основным индуктором специфического иммунитета в этой вакцине, а он экспрессируется из опухолевых клеток китайского хомячка, в связи с этим нельзя полностью исключить безопасность этой вакцины для респондентов.
Известен также штамм MAV/06, получен при выделении вируса Varicella из везикул пациента в возрасте 33 месяца из Кореи, зараженного ветряной оспой в 1989 году, и первичное культивирование выделенного VZV проведено в человеческих эмбриональных клетках легкого (Hwang, K.K., Park, S.Y., Kim, S.J., Ryu, Y.W., & Kim, K.H., Restriction Fragment Length Polymorphism Analysis of Varicella-Zoster Virus isolated in Korea. J. Kor. Soc. Virol. 21, 201-210, 1991).
Белковые молекулы данного штамма входят в вакцинную композицию против ветряной оспы и опоясывающего лишая в качестве активного компонента (патент RU 2580003 С2, опубл. 10.04.2016).
Основным недостатком этой вакцины, на наш взгляд, считается то, что вирусный штамм ветряной оспы MAV/06 культивировали 55 раз в человеческих эмбриональных клетках легкого и морской свинки при температуре 34-36°С. В связи с этим данный вакцинный штамм является гиператтенуированным и не может быть кандидатом для создания живой культуральной вакцины против ветряной оспы и опоясывающего герпеса. Как правило, гиператтенуированные вирусные штаммы характеризуются слабой иммуногенностью.
Наиболее близким к заявляемому является японский аттенуированный штамм vОка/ Мегк (США). Данный вирус изолирован в 1974 году в Японии от 6-летнего здорового мальчика по имени Ока, заболевшего ветряной оспой (Takahashi М. Clinical overview of varicella vaccine: development and early studies. Pediatrics 1986; 78: 736-741). Сиквенс вакцинного штамма vOka показал, что он представляет смесь геномов и имеет нуклеотидный полиморфизм на 31 сайте (Gomi., Sunamachi Н., Mori Y., et al. Comparison of the complete DNA sequences of the OKA varicella vaccine and its parental virus. J.Virol 2002; 76: 11447-11459). Сравнение последовательностей вакцинного штамма vOka с его диким родительским штаммом рОка выявил 42 нуклеотидных различия, которые предполагают 20 аминокислотных замен. На основе этого штамма изготавливается также вакцина для опоясывающего герпеса под названием Zostavax путем увеличения детской дозы в 14 раз.
Вакцина Zostavax вводится подкожно или внутримышечно, и одна прививочная доза в 0,65 мл содержит 19400 бляшкообразующих единиц (БОЕ) штамма vOka/Merk вируса Varicella-zoster (VZV). Вакцина Zostavax включена в списки вакцинации в нескольких европейских странах, включая Великобританию, Францию и Австрию.
Zostavax была одобрена ВОЗ после завершения исследования по профилактике HZ в двойном слепом плацебо - контролируемом исследовании, в котором приняли участие 38 546 человек в возрасте старше 60 лет. Результаты исследования показали, что Zostavax снизил заболеваемость HZ на 51%, a PHN и связанную с ней боль на 66,5% у субъектов в возрасте 60 лет. Эффективность этой вакцины против HZ снижается с увеличением возраста и составляет 18% для лиц в возрасте более 80 лет.
Побочные реакции вакцины Zostavax включают, в основном, боль и воспаление в месте инъекции (Gillian М. Keating // Shingles (Herpes Zoster) vaccine (Zostavax): A review in the prevention of herpes zoster and postherpetic neuralgia. BioDrugs (2016) 30: 243 -254/ DOi 10. 1007/ s40259 -016-0180-7).
Основным недостатком данного проторототипа является выявленная нейротпопность вирусного штамма, из которого производится эта вакцина (Нагиева Ф.Г., Баркова Е.П., Строева А.Д., Сидоров А.В., Лотте В.Д.. Звереа В.В. Характеристика связывания вакцинных штаммов вируса Varicella zoster с препаратами мембранных рецепторов мозга мышей. ЖМЭИ, 2020; 97(2), с. 125 -133).
Задачей настоящего изобретения является создание отечественного вакцинного штамма, изолированного непосредственно от пациента с рецидивирующим опоясывающим герпесом. Аналога такому вирусному штамму, как в России, так и за рубежом не существует.
Для Российской Федерации предпочтительно иметь вакцинные штаммы, изолированные на ее территории.
Для решения данной задачи мы предлагаем холодоадаптированный штамм «vZelVax» вируса опоясывающего герпеса, депонированный в Государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского Минздравсоцразвития России под номером 2936, предназначенный для получения живой культуральной вакцины для профилактики и лечения опоясывающего герпеса у взрослого населения.
Клинический изолят HZ был выделен в Москве в 2013 г. из корочки от везикул пациента 63 лет в период реактивации HZ. В 2016 г. клиническому изоляту lpZel (latent parent) после завершения этапов аттенуации при низких температурах дали название «vZelVax». Штамм «vZelVax» HZ (Master seed) прошел при низких температурах культивирования (300°С) 12 пассажей в культуре диплоидных клеток ЛЭЧ - 3, 6 пассажей в первичной культуре клеток эмбрионов морских свинок (ФЭМС) и еще 2 пассажа в клеточной культуре диплоидных клеток ЛЭЧ - 3.
Штамм депонирован в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под номером 2936 03.03.2020.
Технический результат предлагаемого изобретения состоит в следующем:
Заявляемый аттенуированный штамм для живой культуральной вакцины обладает следующими биологическими маркерами:
- отсутствием размножения в чувствительной культуре клеток при температуре 39°С (ts мутация) и более высоким уровнем размножения в чувствительной культуре клеток при низкой температуре 30°С (самутация);
- имеет более выраженный иммунный ответ по сравнению с латентным вариантом вируса при иммунизации морских свинок;
- более высокой репродуктивностью по сравнению с латентным вариантом вируса в культуре клеток фибробластов эмбриона морских свинок (ФЭМС);
Краткое описание чертежей и иных поясняющих материалов.
Таблица 1 - Определение ts и са маркеров биологической аттенуации кандидата в вакцинный штамм «vZelVax» HZ на клетках кожно-мышечной ткани эмбриона человека (КМ-27).
Таблица 2 - Определение ts и са маркеров биологической аттенуации кандидата в вакцинный штамм «vZelVax» HZ на клетках ФЭМС.
Рис. 1 - Иммунный ответ SPF - мышей линии BALB/c на аттенуированный штамм «vZelax» HZ. По оси абцисс указаны сроки исследования сывороток с момента введения препарата. По оси ординат -значения ОП450. Показатели оценены на фотометре Thermo Scientific Varioskan Flash. Справа на цветных квадратах указаны разведения сывороток.
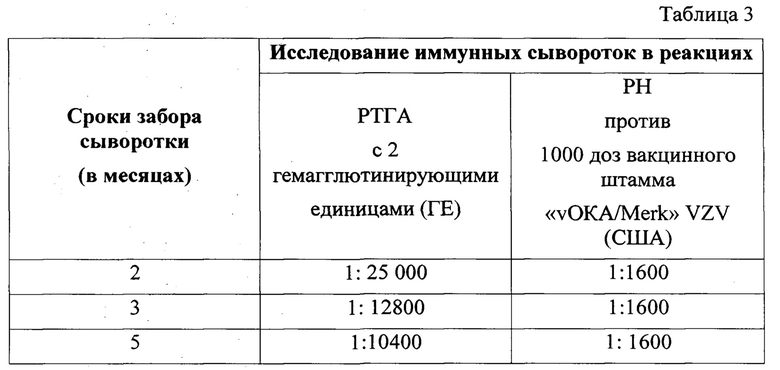
Таблица 3 - Оценка иммуногенности аттенуированного штамма «vZelVax» HZ.
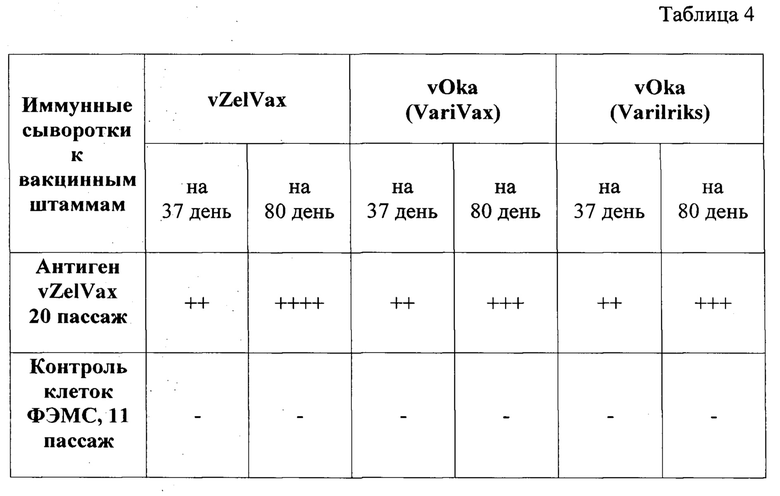
Таблица 4 - Сравнительная оценка результатов непрямой иммунофлуоресценции отечественного вакцинного штамма «vZelVax» HZ с сыворотками морских свинок, иммунизированных различными штаммами VZV.
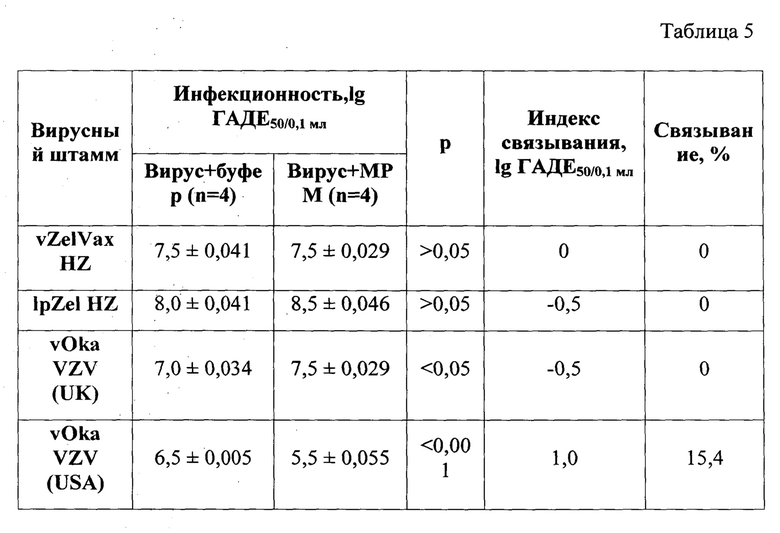
Таблица 5 - Сравнительная оценка связывания штаммов VZV с препаратами МРМ SPF мышей линии BALB/c
Ракрытие сущности изобретения.
Штамм vZelVax характеризуется следующими признаками.
Морфологические признаки - вирионы VZV являются сферическими, от 150 - 200 nm в диаметре и состоят из внутреннего икосадельтаэдрического капсида из 162 капсомеров, окруженных тегументом и оболочкой, состоящей из двух или более мембран, содержит липиды.
Культуральные признаки - при репродукции вирусного штамма в пермиссивной клеточной культуре типа КМ 27, Me Wo (меланома человека), Vero, вирус вызывает дегенеративные изменения в виде цитолиза клеток.
Инфекционная активность вирусного штамма в культуре клеток - 7,5-8,0 lg ГАДЕ50/0,1 мл.
Антигенные свойства - вирус индуцирует выработку специфических антител в организме SPF мышей линии BALB/c и в организме морских свинок при подкожном, внутримышечном и внутрибрюшинном введениях. Вирусспецифические антитела выявляются в иммуноферментном анализе (ИФА), в иммунофлуоресцентном анализе (ИФ), в реакции нейтрализации (РН) и реакции торможения гемагглютинации (РТГА).
Вирулентные свойства (att- фенотип) - аттенуированный вирусный штамм авирулентен, вызывая на хорион-аллантоисной оболочке развивающихся куриных эмбрионов белые оспины, в отличие от его родительского варианта, вызывающего при введении на хорион-аллантоисную оболочку развивающихся куриных эмбрионов гибель куриных эмбрионов или обширную геморрагию.
Молекулярно-генетическая особенность штамма -
Частичное секвенирование консервативного участка гена Orf 0-1:
(133)AACCCGCGCCTTTTGCGTCCACCCCTCGTTTACTGCTCGGATGGCG
ACCGTGCACTACTCCCGCCGACCTGGGACCCCGCCGGTCACCCTCACGT
CGTCCCCCAGCATGGATGACGTTGCGACCCCCATCCCCTACCTACCCAC
ATACGCCGAGGCCGTGGCAGACGCGCCCCCCCCTTACAGAAGCCGCGA
GAGTCTGGTGTTCTCCCCGCCTCTTTTTCCTCACGTGGAGAATGGCACC
ACCCAACAGTCTTACGATTGCCTAGACTGCGCTTATGATGGAATCCACA
GACTTCAGCTGGCTTTTCTAAGAATTCGCAAATGCTGTGTACCGGCTTT
TTTAATTCTTTTTGGTATTCTCACCCTTACTGCTGTCGTGGTCGCCATTG
TTGCCGTTTTTCCCGAGGAACCTCCCAACTCAACTACA(559)
Сравнительный генетический анализ показал, что по нуклеотидной последовательности он принадлежит европейскому варианту Varicella zoster.
Условия хранения - хранится при температуре не ниже 70°С.
Стабильность основных свойств вирусного штамма - сохраняются в течение 5 лет (период наблюдения).
Осуществление изобретения.
Биологические свойства штамма иллюстрируются следующими примерами.
Пример 1. Сравнительная характеристика ts и са маркеров биологической аттенуации кандидата в вакцинный штамм «vZelVax» HZ, установленная на клеточных культурах КМ 27 (кожно-мышечная ткань эмбриона человека) и ФЭМС (фибробласты эмбрионов морских свинок) при различных температурных режимах.
Представленные в табл.1 и 2 результаты показали, что кандидат в вакцинный штамм «vZelVax», как внеклеточный вирус, так и внутриклеточный вирус не репродуцировался при высокой температуре 39° в отличие от латентного варианта вируса, то есть аттенуированный при низкой температуре штамм «vZelVax» обладал температурочувствительностью - ts фенотипом. В то же время аттенуированный штамм более активно репродуцировался при субоптимальной температуре при 30°С по сравнению с латентным вариантом, то есть обладал холодоадаптируемостью - са -фенотипом.
Результат представленный в табл.2 также показал, что аттенуированный штамм «vZelVax» обладал более высокой репродуктивной активностью в клетках эмбрионов морской свинки в сравнении с латентным вариантом - это еще один биологический маркер аттенуированных штаммов для живых вирусных вакцин, названный нами cell - фенотипом.
Пример 2. Сравнительная оценка вирулентности (att - фенотип) кандидата в вакцинный штамм «vZelVax» HZ, установленная путем инфицирования хорион-аллантоисной оболочки (ХАО) 12-дневных развивающихся куриных эмбрионов.
Аттенуированный вакцинный штамм «vZelVax» оказался авирулентным в отличие от его родительского варианта lpZel. Хорион- аллантоисные оболочки развивающихся куриных эмбрионов, инфицированные родительским вариантом вируса, вызывали гибель эмбрионов, а инфицированные аттенуированным вакцинным штаммом «vZelVaz» вызывали на хорион - аллантоисных оболочках белые оспины.
Пример 3. Оценка антигенности кандидата в вакцинный штамм «vZelVax» HZ, установленная путем подкожной иммунизации SPF мышей линии BALB/c. одной прививочной дозой для человека.
На рис. 1 представлены результаты исследования сывороток SPF -мышей линии BALB/c, иммунизированных подкожно вируссодержащей жидкостью (ВСЖ) аттенуированного штамма «vZelVax» HZ. Мышам линии BALB/c вводили подкожно по 0,5 мл ВСЖ HZ, сыворотки от мышей собирали из хвостовой вены в различные интервалы времени, начиная с 2-х недель и в течение 8 месяцев (период наблюдения). Иммунные сыворотки исследовали в ИФА в твердофазном варианте иммунного анализа, где на твердой фазе был сорбирован лизат клеток КМ-27, инфицированных лабораторным штамм «Ellen» VZV. Иммунный комплекс детектировали антимышиным пероксидазным конъюгатом в рабочем разведении (фирма Sigma).
Представленные на рис. 1 результаты исследования показали, что аттенуированный вирусный штамм «vZelVax» HZ обладал оптимальной антигенностью на 8 месяцев периода наблюдения в организме иммунизированных мышей.
Пример 4. Характеристика иммуногенности кандидата в вакцинный штамм «VZelVax»
Для оценки иммуногенности аттенуированного штамма «vZelVax» HZ, проведена иммунизация морских свинок подкожно одной прививочной дозой. Морским свинкам ввели подкожно в холку по 0,5 мл (одна прививочная доза) ВСЖ аттенуированного штамма «vZelVax» HZ на 20 пассажном уровне. Иммунные сыворотки собраны через 2, 3 и 5 месяцев после иммунизации (забор крови проведен путем кардиальной пункции).
В табл. 3 представлены результаты исследования в реакции торможения гемагглютинации (РТГА) и в реакции нейтрализации (РН).
По результатам исследования четко установлено, что аттенуированный штамм «vZelVax» HZ в организме морских свинок индуцирует высокий уровень антигемагглютинов (результаты РТГА) и нейтрализинов (результаты РН). При этом необходимо отметить, что нейтрализины стабильно сохраняются на высоком уровне в течение 5 месяцев (период наблюдения) в отличие от гемолизинов.
В табл.4 представлены результаты непрямой реакции иммунофлуоресценции иммунных сывороток морских свинок, полученных на 37 и 80 дни с момента иммунизации. Антигены приготовлены на диплоидных клетках морских свинок, инфицированных вакцинными вирусными штаммами «vZelVax» и «vOka» разных производителей.
Результаты, представленные в таблице 4, показывали, что все 3 иммунные сыворотки к вакцинному штамму «vZelVax» и к вакцинному штамму «vOka» разных производителей выявляли вирусные антиген, приготовленный из отечественного штамма «vZelVax». При этом необходимо отметить, что иммунные сыворотки, полученные в более поздние сроки, выявляли большее количество инфекционных фокусов.
Пример 5. Сравнительная характеристика нейротропности различных штаммов вируса Varicella zoster.
Изучение нейротропности аттенуированных вирусных штаммов «vZelVax» оценивали способом, описанным в патенте «Способ аттенуации вирусов» (Авторы: Баррет А., Райман К., НИ Хаолин (США). Способ заключался в смешивании вируса с мембранными рецепторами мозга, центрифугировании смеси и определении остаточной вирусной инфекционности. Мембранные рецепторы получали из мозга 4- недельных SPF мышей линии BALB/c
Известно, что вирус не может заражать восприимчивую клетку, если его вирусный белок прикрепления не соединяется на клеточной поверхности с молекулой, которая служит в качестве рецептора для данного вируса.
Если вирус соединяется с мембранными рецепторами мозга (МРМ), то после осаждения мембранных рецепторов центрифугированием, в надосадочной жидкости должен снизиться показатель инфекционности исследуемого вируса. По остаточной вирусной инфекционности судят о степени нейротропности исследуемого вируса. Остаточную вирусную инфекционность определяли методом предельного разведения на чувствительных к вирусу Varicella zoster клеточных культурах ФЭМС. Результаты инфекционности оценивали на 7-е сутки с момента инфицирования клеточной культуры и выражали в lg ГАДЕ50/ 0,1 мл. В табл. 5 представлены средние показатели по результатам 2-х экспериментов.
Эксперименты по связыванию холодоадаптированного вакцинного вирусного штамма vZelVax и его латентного родительского вируса lpZel показали, что оба вируса утратили тропизм к нервной ткани мозга мышей линии BALb/c. Американский вариант вирусного штамма «vOka/Мегк» после обработки нейрорецепторами мозга мышей, снизил инфекционность на 1,0 lg ГАДЕ50/0Д мл, то есть оказался нейротропным.
Таким образом, заявляемый нами отечественный штамм, изолированный на территории России (г.Москва) со свойствами холодоадаптированности, то есть, обладающий основными маркерами биологической аттенуации (ts и са фенотипом, cell -фенотипом, att- фенотипом), обладающий высокой антигенностью и иммуногенностью, и не имеющий тропизма к нейрорецепторам мозга SPF мышей линии BALB/c и по частичному генетическому секвенированию основного гена VZV, принадлежащий европейскому варианту Varicella zoster, может применяться для создания вакцинных препаратов против опоясывающего герпеса.


| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм "vFiraVax" для получения аттенуированной живой культуральной вакцины для профилактики ветряной оспы | 2019 |
|
RU2693440C1 |
| Способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы | 2016 |
|
RU2637093C1 |
| Способ получения четырехкомпонентной культуральной живой вакцины против кори, ветряной оспы, эпидемического паротита, краснухи | 2019 |
|
RU2717769C1 |
| НОВЫЕ ШТАММЫ ВИРУСА ВЕТРЯНОЙ ОСПЫ И ПРОТИВОВИРУСНАЯ ВАКЦИНА ПРОТИВ ВЕТРЯНОЙ ОСПЫ И ОПОЯСЫВАЮЩЕГО ЛИШАЯ, В КОТОРОЙ ПРИМЕНЯЮТСЯ ТАКИЕ ШТАММЫ | 2012 |
|
RU2580003C2 |
| ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ ПРОТИВ ВИРУСА ВЕТРЯНОЙ ОСПЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2633058C2 |
| ХОЛОДОАДАПТИРОВАННЫЙ ШТАММ ВИРУСА ГРИППА В-В/ВИКТОРИЯ/2/63/87, ПРЕДНАЗНАЧЕННЫЙ В КАЧЕСТВЕ ШТАММА-ДОНОРА АТТЕНУАЦИИ ДЛЯ ПОЛУЧЕНИЯ РЕАССОРТАНТОВ ХОЛОДОАДАПТИРОВАННЫХ ШТАММОВ ДЛЯ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2013 |
|
RU2529772C1 |
| ШТАММ ДИПЛОИДНЫХ КЛЕТОК ФИБРОБЛАСТОВ ЛЕГКИХ ЭМБРИОНА ЧЕЛОВЕКА, ИСПОЛЬЗУЕМЫЙ ДЛЯ ВЫРАЩИВАНИЯ ВИРУСА | 1997 |
|
RU2146289C1 |
| Способ получения аттенуированных штаммов вируса гриппа а - кандидатов в живые гриппозные вакцины | 2017 |
|
RU2670514C1 |
| Рекомбинантная вакцина против вируса ветряной оспы (VZV) | 2020 |
|
RU2772902C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ХОЛОДОАДАПТИРОВАННОЙ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2010 |
|
RU2465006C2 |

Изобретение относится к области медицинской биотехнологии. Изобретение представляет собой холодоадаптированный штамм «vZelVax» вируса опоясывающего герпеса, депонированный в Государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского Минздравсоцразвития России под номером 2936 от 03.03.2020, предназначенный для получения живой культуральной вакцины для профилактики и лечения опоясывающего герпеса у взрослого населения. Изобретение может применяться для создания вакцинных препаратов против опоясывающего герпеса. 1 ил., 5 табл., 5 пр.
Холодоадаптированный штамм «vZelVax» вируса опоясывающего герпеса, депонированный в Государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского Минздравсоцразвития России под номером 2936 от 03.03.2020, предназначенный для получения живой культуральной вакцины для профилактики и лечения опоясывающего герпеса у взрослого населения.
| РЫЧАЖНОЕ ПРИСПОСОБЛЕНИЕ ДЛЯ ПЕРЕМЕЩЕНИЯ ТЯГИ ЗАТВОРОВ ЖЕЛЕЗНОДОРОЖНЫХ ПЛАТФОРМ В ОДНОМ НАПРАВЛЕНИИ, НЕЗАВИСИМО ОТ НАПРАВЛЕНИЯ ПОВОРОТА РЫЧАГОВ | 1928 |
|
SU11884A1 |
| DE 122007000003 I1, 24.05.2007 | |||
| US 20160008458 A1, 14.01.2016 | |||
| СПОСОБ ПРИГОТОВЛЕНИЯ ФОРМОВОЧНЫХ СМЕСЕЙ | 2004 |
|
RU2281831C1 |
| US 20200046827 A1, 13.02.2020. | |||
Авторы
Даты
2021-07-05—Публикация
2020-11-19—Подача