Изобретение относится к медицине и ветеринарии и касается создания на основе хиназолинового алкалоида триптантрина фармацевтических композиций, обладающих лечебным действием при различных кожных патологиях. Заявляемая композиция сможет найти широкое применение при лечении различных видов воспалительных заболеваний кожи человека и животных, в частности аллергических дерматозов.
По данным ВОЗ за последние десять лет значительно возрос уровень заболеваемости различными воспалительными патологиями кожи, из которых наиболее распространенными считаются аллергические дерматозы. Аллергические заболевания кожи имеют полиэтиологическое происхождение и сложные механизмы развития патологического процесса. Наиболее известными заболеваниями являются псориаз, контактный дерматит, экзема, хроническая крапивница и др. Патогенез развития этих заболеваний включает в себя, прежде всего, повреждение эпидермального барьера, вследствие развития избыточной воспалительной реакции со стороны иммунной системы, в ответ на действие различных раздражителей: механическое повреждение кожи, контакт с химическими, пищевыми, бытовыми аллергенами, стафилококковые и грибковые инфекции и другие.
Использование существующих противоаллергических препаратов (глюкокортикоиды, антигистаминные и антимикробных агенты, стабилизаторы тучных клеток и иммуносупрессоры) затруднено из-за их недостаточной эффективности, отсутствия универсальности и узкой направленности фармакологического действия [Е. Roekevisch et. al. / Efficacy and safety of systemic treatments for moderate-to-severe atopic dermatitis: A systematic review / J. of Allergy and Clinical Immunology. 2014. V. 133 (2). P. 429-438]. В связи с этим наблюдается нарастающая потребность в эффективных лекарственных средствах комплексного действия, то есть обладающих одновременно противоаллергической, противовоспалительной, противомикробной и ранозаживляющей активностью.
Хиназолиновый алкалоид триптантрин, сочетающий в себе перечисленные выше виды фармакологической активности, постоянно привлекает внимание исследователей, разрабатывающих новые лекарственные препараты. Триптантрин был выделен в качестве природного антибиотика из целого ряда таких высших растений, как Isatis tinctoria, Polygonum tinctorium, Indigo Naturalis, дрожжевидных грибов Candida lypolitica [Jahng Y. et. al. Progress in the studies on tryptanthrin, an alkaloid of history // Arch. Pharm. Res. 2013. V. 36(5). P. 517-535] и морских микроорганизмов Oceanibulbus indolifex [ I., et. al. Oceanibulbus indolifex gen. nov., sp.nov., a North Sea alphaproteobacterium that produces bioactive metabolites // Int. J. System. Evol. Microbial. 2004. V. 54. P. 1177-1184].
I., et. al. Oceanibulbus indolifex gen. nov., sp.nov., a North Sea alphaproteobacterium that produces bioactive metabolites // Int. J. System. Evol. Microbial. 2004. V. 54. P. 1177-1184].
Несколько лет назад триптантрин был найден в дрожжевых грибах рода Malassezia, которые являются частью естественного микробиома кожи человека. [Vlachos С. et al. Malassezia-derived indoles activate the aryl hydrocarbon receptor and inhibit Toll-like receptor-induced maturation in monocyte-derived dendritic cells // Br. Assoc. Dermatol. 2012. V. 167. P. 496-505]. Важное патобиологическое значение триптантрина как вторичного метаболита этих дрожжей, возможно, состоит в том, что он, как и естественные компоненты иммунной системы кожи человека, принимает участие в ингибировании патологических воспалительных процессов, например, при разноцветном лишае и себорейном дерматите [Gaitanis G. et al. The Malassezia genus in skin and systemic diseases // Clin. Microbiol. Rev. 2012. V. 25. P. 106-141; Hay R.J. Malassezia, dandruff and seborrhoeic dermatitis: an overview // Br. J. Dermatol. 2011. V. 165 (Suppl. 2). P. 2-8].
Многократно отмечено, что триптантрин обладает выраженной терапевтической активностью при лечении дерматологических заболеваний. В составе экстракта из растения Indigo naturalis триптантрин применяется в Восточной медицине для лечения различных кожных заболеваний, в частности псориаза [Lin Y.K. et. al. Indigo naturalis upregulates claudin-1 expression in human keratinocytes and psoriatic lesions. J. Ethnopharmacol. 2013. V. 145(2). P. 614-620]. Было показано, что дерматопротекторный эффект данного экстракта достигается не только за счет его противовоспалительного и антиаллергического действия, но и за счет повышения синтеза важного функционального белка кожи клаудина-1, восстанавливающего функцию плотных контактов у кератиноцитов [Lin Y.K., et. al. Indigo naturalis upregulates claudin-1 expression in human keratinocytes and psoriatic lesions // J. Ethnopharmacol. 2013. V. 30, №145(2). P. 614-620].
Триптантрин обладает качествами сильного противовоспалительного агента. Препарат способен тормозить каскад арахидоновой кислоты, ингибируя синтез провоспалительных лейкотриенов и простагландинов, например, простогландина Е и лейкотриена В4. [Ishihara Т. et. al. Tryptanthrin inhibits nitric oxide and prostaglandin E(2) synthesis by murine macrophages // Eur. J. Pharmacol., 2000; 407, 197-204].
Триптантрин также проявляет ингибирующую активность в отношении ряда провоспалительных цитокинов, участвующих в развитии кожных воспалительных заболеваний [Han N.R., Moon P.D et. al. Tryptanthrin ameliorates atopic dermatitis through down-regulation of TSLP. Arch Biochem Biophys. 2014. V. 542. P. 14-20].
Известно о проявлении триптантрином противоаллергических свойств [JP 2006241080, 2006.09.14]. Являясь антагонистом толл-подобных рецепторов (TLR) и супрессором сигнальных трансдукторов и активаторов транскрипции (СТАТ и NF-kB), триптантрин блокирует ответ иммунокомпетентных клеток на действие индукторов воспаления, препятствуя прогрессии воспалительного процесса при аллергических и других аутоиммунных заболеваниях [Hui-Man Cheng et. al. // Clinical efficacy and IL-17 targeting mechanism of Indigo naturalis as a topical agent in moderate psoriasis // BMC Complementary and Alternative Medicine 2017 V. 17, №439].
Очень важным также является то, что триптантрин, подобно β-лактамным антибиотикам, проявляет выраженное противомикробное действие [Chiang Y.R, Li A et. al. An in vitro study of the antimicrobial effects of indigo naturalis prepared from Strobilanthes formosanus Moore // Molecules. 2013. V. 18 (11). P. 14381-14396]. Триптантрин также является высокоспецифическим антифунгальным агентом, особенно против дерматофитов, в частности Trichophyton mentagraphites, вызывающих стригущий лишай [Honda G. et. al. The antimicrobial specificity of tryptanthrin // Planta Med. 1979. V. 37. P. 172-174].
Таким образом, триптантрин обладает широким спектром фармакологического действия, а именно: противовоспалительной, противомикробной, противоаллергической и ранозаживляющей активностью, что позволяет создавать на его основе лекарственные средства, которые можно успешно использовать при различных дерматологических заболеваниях.
Еще одним важным преимуществом триптантрина перед другими природными соединениями является то, что разработаны его относительно доступные и дешевые способы получения путем органического синтеза, включая одностадийный синтез из изатина [Московкина Т.В. Новый синтез 6,12-дигидро-6,12-диоксоиндоло[2.1-b]хиназолина (триптантрина, коуропитина) // Жур. орг. хим. 1997. Т. 33. С. 138-139]. В последствии был разработан другой одностадийный синтез - окислением изатина, что делает более безопасным полученный таким образом триптантрин из-за отсутствия в нем хлорорганических примесей [Московкина Т.В. и др. Синтез соединений ряда триптантрина путем окисления изатина // (2013) ЖОрХ., 49, 1760-1763].
Недостатком триптантрина является его плохая биодоступность, связанная с низкой растворимостью в воде и биологических жидкостях. Эта проблема решается применением триптантрина в составе различных фармацевтических композиций.
В результате разработки биодоступной формы на основе триптантрина нами ранее была создана гелевая лекарственная форма препарата, в состав которой в заданном соотношении входит триптантрин и морской биогликан хитозан [RU 2366408 С1, 10.09.2009]. Хитозан является одним из лучших транспортных носителей различных гидрофобных лекарственных средств, обладающий высокой абсорбирующей способностью и обеспечивающий их пролонгирующий эффект [Гафуров Ю.М. Хитозан: свойства, опыт применения», Владивосток, Дальнаука, 2011]. Важно также и то, что хитозан нетоксичен, биоусвояем и характеризуется широким спектром биологической активности.
Однако в процессе работы с гелевой формой триптантрина наблюдалось ее расслоение при хранении, что создавало трудности при наружном применении композиции. При этом отмечалось снижение эффективности процесса эпителизации и регенерации раневого повреждения.
Затем была создана мазевая форма триптантрина, являющаяся прототипом заявляемой композиции, содержащая триптантрин, хитозан, ланолин-вазелиновую смесь, белково-нуклеиновый гидролизат молок лососевых рыб и дистиллированную воду, при определенном соотношении компонентов [RU 2549475 С1, 27.04.2015]. Экспериментально установлено, что для лечения кожных патологий разной этиологии мазевая форма оказалась более эффективной по сравнению с гелевой композицией, в частности, наблюдалось улучшение адсорбции раневого экссудата хитозаном.
Однако из-за повышенной плотности мазевой формы, обусловленной гидрофобными свойствами, как жировых компонентов композиции, так и хитозана, затруднена биодоступность триптантрина в более глубокие слои эпидермиса и дерму. Вследствие этого эффективность лечебного действия мазевой формы снижена.
Задача изобретения - расширение арсенала фармацевтических композиций, обладающих лечебным действием при различных кожных патологиях.
Технический результат заключается в реализации указанного назначения.
Указанный технический результат достигается фармацевтической композицией, обладающей лечебным действием при различных кожных патологиях, включающей триптантрин с биосовместимым носителем, и дистиллированную воду, которая согласно изобретению в качестве биосовместимого носителя содержит хитоолигосахариды и дополнительно содержит аспарагиновую кислоту, глицерин и диметилсульфоксид, при следующем соотношении компонентов, мас. %:
Для приготовления заявляемой композиции используют триптантрин, полученный окислением изатина, в оптимальном количественном соотношении 0,1-0,16 мас. % для проявления им максимального фармакологического действия. Повышение содержания триптантрина (более 0,16 мас. %) может привести к угнетению метаболических процессов в нормальных клетках и, тем самым, к нарушению эффективности его действия на стадии грануляции и эпителизации раневых повреждений. Снижение концентрации триптантрина (менее 0,1 мас. %) также не соответствует оптимальным дозам его фармакологической активности, а, следовательно, не позволяет достичь нужного фармакологического эффекта у заявляемой композиции.
В качестве биосовместимого носителя триптантрина используют низкомолекулярные производные хитозана - хитоолигосахариды, хорошо растворимые в воде, обеспечивающие его доставку ие только в поверхностные, но и в более глубокие слои эпидермиса и дерму. Как и хитозан, хитоолигосахариды проявляют иммуноадъювантные и иммуномодуляторныс свойства, используются как антибактериальные, антигрибковые, противовирусные агенты. Обнаружена противовоспалительная активность хитоолигосахаридов [Joao С. Fernandes et. al. Antiinflammatory activity of chitooligosaccharides in vivo // Marin Drugs 2010, 8, 1763-1768].
Выбранный интервал концентраций хитоолигосахаридов является оптимальной для проявления максимальной фармакологической активности.
Получение хитоолигосахаридов, используемых для приготовления заявляемой композиции, приведено в примере 1.
Аспарагиновая кислота - детоксифицирующее и дополнительное противовоспалительное средство. Препарат является нейромедиатором, обладает ранозаживляющим действием.
Глицерин - стабилизирующий и эмульгирующий компонент, сохраняющий консистенцию средства. Также является смягчающим кожу ингредиентом.
Диметилсульфоксид (DMSO) - растворитель триптантрина. В медицине применяется в виде водных растворов (10-50%), как местное противовоспалительное и обезболивающее средство, а также в составе мазей - для увеличения трансдермального переноса действующих веществ. За счет способности мгновенно проникать в слои эпидермиса облегчает трансдермальный перенос триптантрина.
Содержание компонентов в предлагаемой фармацевтической композиции установлено экспериментально и позволяет получить композицию с требуемыми структурно-механическими и реологическими показателями.
Совместное применение компонентов в заявляемой композиции обеспечивает синергетический эффект композиции, заключающийся в том, что каждый компонент проявляет характерные для него фармакологические свойства при действии на раневые повреждения и патологические воспалительные процессы кожи с большей эффективностью.
Заявляемая фармацевтическая композиция позволяет повысить эффективность лечения кожных патологий разной этиологии и расширить арсенал фармацевтических композиций, обладающих лечебным действием при различных кожных патологиях.
Способ получения заявляемой композиции состоит в следующем.
В емкость вносят хитоолигосахариды, глицерин, аспарагиновую кислоту, дистиллированную воду и перемешивают до растворения сухих ингредиентов, затем прибавляют триптантрин, предварительно растворенный в диметилсульфоксиде, и смесь тщательно перемешивают. Получают композицию в форме линимента (жидкий гель), имеющую устойчивую консистенцию, которую можно хранить при комнатной температуре в течение 18 месяцев без потери биологической активности и физико-химических свойств.
Повышение эффективности использования заявляемой композиции для лечения кожных патологий разной этиологии в сравнении с прототипом и базовыми коммерческими препаратами доказано экспериментами in vivo.
Эксперименты выполнены на белых беспатогенных мышах линии CD-1, которые были получены из питомника лабораторных животных «Пущино» и разведены в виварии ТИБОХ ДВО РАН. Животных содержали в стандартных условиях вивария с естественным световым режимом на полнорационной сбалансированной по содержанию питательных веществ диете для лабораторных животных (ГОСТ Р 50258-92). Эксперименты были выполнены согласно методическим руководствам и нормативным документам, правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ Р 53434-2009).
В качестве препарата сравнения при моделировании атопического кожного дерматита (АКД) использовали коммерческий препарат «Синафлан» (АО «Нижфарм», Россия), представляющий собой 0,025%-ную мазь синтетического глюкокортикоидного гормона - флуоцинолона ацетонида, обладающий противовоспалительным, противоаллергическим и противозудным действием.
При моделировании термических ран в качестве препарата сравнения использовали «Метилуроцил» (АО «Нижфарм», Россия), представляющий собой 10%-ную мазь диоксометилтетрагидропиримидина. Препарат проявляет иммуностимулирующие свойства, способствует нормализации обмена нуклеиновых кислот и грануляционному созреванию тканей, ускоряя тем самым процессы клеточной регенерации и эпителизацию в ранах.
При моделировании системного воспаления использовали коммерческий противовоспалительный препарат «Дексаметазон» (АО «Сантэн», Финляндия), представляющий собой синтетический глюкокортикостероид, обладающий системным противовоспалительным и иммунодепрессивным действием.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Состав фармацевтической композиции, мас. %: триптантрин - 0,12; хитоолигосахариды - 0,54; аспарагиновая кислота - 4,0; глицерин - 4,0; диметилсульфоксид - 10,0; дистиллированной вода - остальное.
1.1 Приготовление хитоолигосахаридов.
Хитозан (степень деацетилирования 85%, молекулярная масса 100000 Да) суспендируют в дистиллированной воде перемешиванием и прибавляют уксусную кислоту. После растворения хитозана приливают трехводный уксуснокислый натрий, далее прибавляют хлористый кальций безводный и дистиллированную воду, содержащую коллагеназу камчатского краба. Смесь инкубируют при 43°С в течение 48 ч при постоянном перемешивании. Образуется невязкий прозрачный раствор слегка желтоватой опалесценции, содержащий хитоолигосахариды.
Для освобождения ферментативного гидролизата хитозана от белковых примесей проводят его фильтрацию через сорбент хитозан-глицин, приготовленный по известной методике [Гафуров Ю.М., Василенко С.К. Способ получения сорбентов для хроматографического разделения полимеров. SU 1811178 A1, 17.04.1989]. Для этого ферментативный гидролизат хитозана дотитровывают до рН 4,5-5,0 70% уксусной кислотой и фильтруют через сорбент хитозан-глицин, уравновешенный ацетатным буфером. Фильтрат, содержащий хитоолигосахариды, подвергают распылительной сушке и получают сухой порошок хитоолигосахаридов. Молекулярна масса хитоолигосахаридов составляет 5-35 кДа (определена по восстанавливающему концу).
1.2 Приготовление заявляемой композиции.
В емкость вносят 0,5 г хитоолигосахаридов, 4 г глицерина, 4 г аспарагиновой кислоты, 80 мл дистиллированной воды и смесь тщательно перемешивают до растворения сухих ингредиентов. Затем этой смеси прибавляют 100 мг триптантрина, предварительно растворенного в 10 мл диметилсульфоксиде, и смесь тщательно перемешивают. Получают фармацевтическую композицию со следующими физико-химическими характеристиками:
консистенция - линимент (жидкий гель);
тип - линимент-суспензия;
рН - 5,0;
цвет - светло-желтый;
стабильность - расслоение отсутствует;
абсорбция - полная;
срок годности - 18 месяцев;
условия хранения - хранить при комнатной температуре в закрытой таре без доступа воздуха.
Пример 2. Оценка противоаллергической активности заявляемой фармацевтической композиции, обозначенной, как ТРл/с (линимент-суспензия), при экспериментальном моделировании аллергического контактного дерматита.
Модель АКД воспроизводили согласно [Yuan X.Y. et. al. Effects and mechanisms of aloperine on 2, 4-dinitrofluorobenzene-induced allergic contact dermatitis in BALB/c mice // Eur. J. Pharm. 2010. V. 629, №1-3, P. 147-152]. В качестве индуктора АКД использовали облигатный аллерген 2,4-динитрофторбензол (ДНФБ) (Sigma, США), который применяли в виде масло-ацетоновой смеси (ацетон : оливковое масло 4:1, по объему).
Животные были разделены на 4 группы по 7 животных в каждой: К(и) - интактный контроль; К(-) - отрицательный контроль; К(+) - положительный контроль; ТРм/ф - мазевая форма триптантрина; ТРл/с - заявляемая композиция.
Для сенсибилизации на выбритый участок брюшины однократно наносили 0,5% раствор ДНФБ, после чего 0,2% смесь двукратно наносили на внутреннюю и внешнюю поверхность уха экспериментальных животных. Лечение препаратами начинали спустя час после повторной индукции аллергена на уши. ТРл/с и ТРм/ф, содержащих 0,01% действующего вещества, применяли топикально 1 раз в сутки в течение 3-х дней.
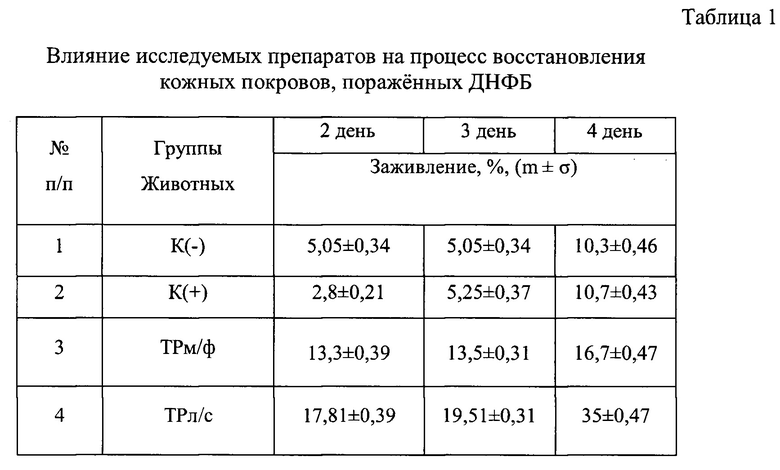
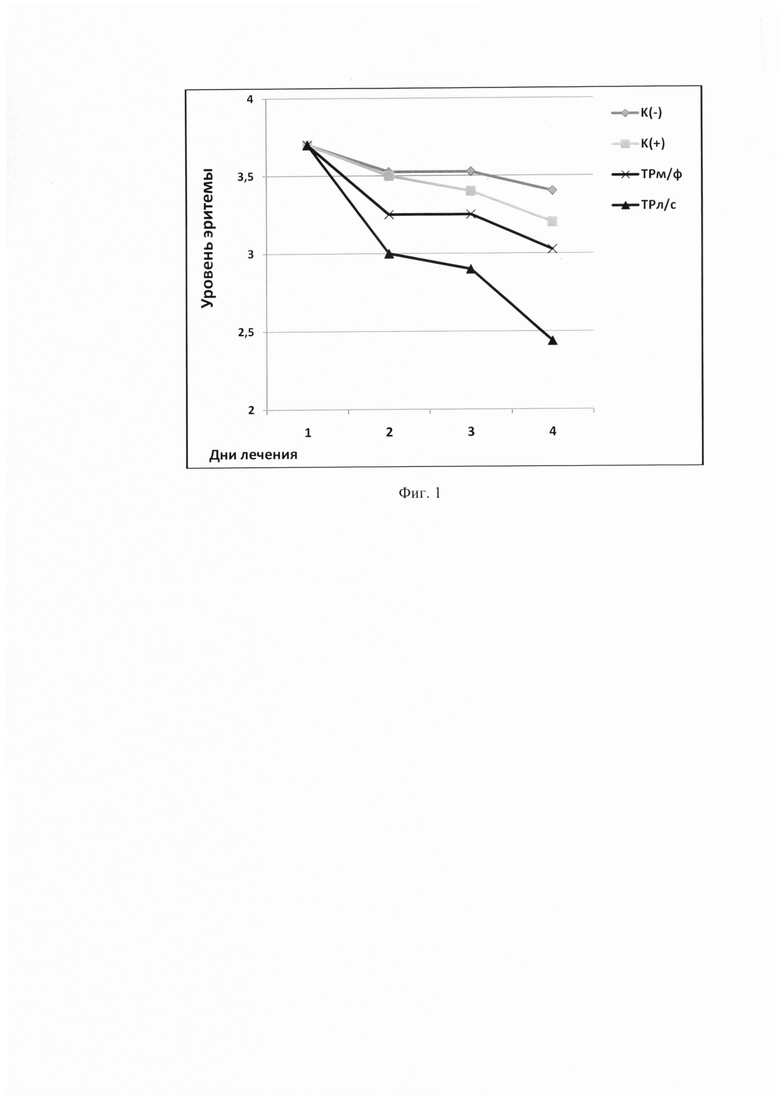
В процессе эксперимента у каждой группы животных проводили ежедневную оценку состояния кожного покрова: степень заживления пораженных участков эпидермиса и уровень эритемы (гиперемия, лихенизация часто с образованием участков некроза). Выраженность эритемы оценивали визуально по линейке С.В. Суворова в баллах: 0 - отсутствие эритемы; 1 - слабая (розовый тон); 2 - умеренно выраженная (розово-красный тон); 3 - выраженная (красный тон); 4 - резко выраженная (ярко-красный тон). Результаты представлены в таблице 1 и на фигурах 1 и 2.
На фиг. 1 представлен график сравнительных результатов исследования влияния испытуемых препаратов на уровень эритемы, вызванной ДНФБ.
К(-) - отрицательный контроль; К(+) - синафлан; ТРм/ф - мазевая форма триптантрина; ТРл/с - заявляемая композиция.
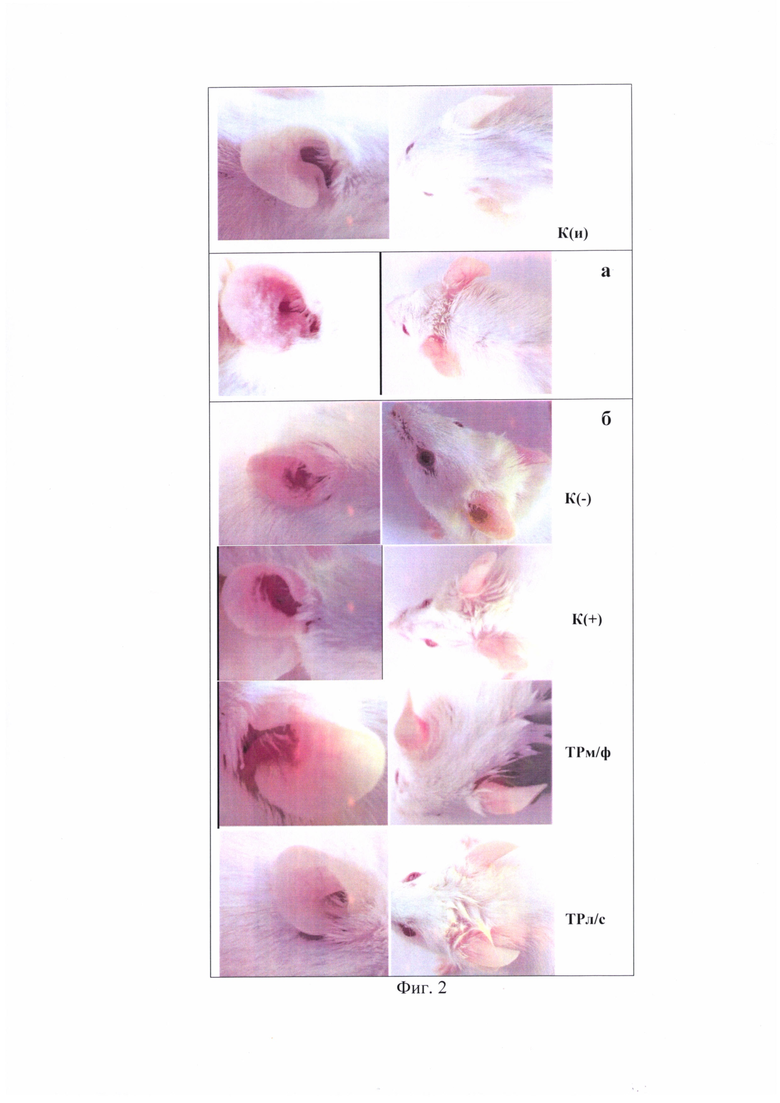
На фиг. 2 представлен фотоматериал на котором зафиксировано состояние эпидермиса у животных после двукратной аппликации ДНФБ (а) и после курса лечения заявляемой композицией (б), мазевой формой триптантрина и мазью «Синафлан» в сравнении с группой К(-) (4-й день после аппликации ДНФБ).
К(и) - интактный контроль; К(-) - отрицательный контроль; К(+) - синафлан; ТРм/ф -мазевая форма триптантрина; ТРл/с -заявляемая композиция.
Можно видеть (таблица 1 и фиг. 1 и 2), что курс лечения заявляемой композицией приводит к частичному восстановлению исходных параметров кожного покрова: уровень эритемы снижается в 2 раза относительно группы К(-), а индекс уменьшения тяжести кожных патологических проявлений составляет 35%, в то время, как таковой при лечениии ТРм/ф - 16,75%, синафланом - 10,7%, К(-) - 10,3%.
В день терминации эксперимента получали цельную кровь для гематологического анализа с использованием анализатора CELL-DYN 3700 (USA). В таблице 2 представлены результаты гематологического анализа крови
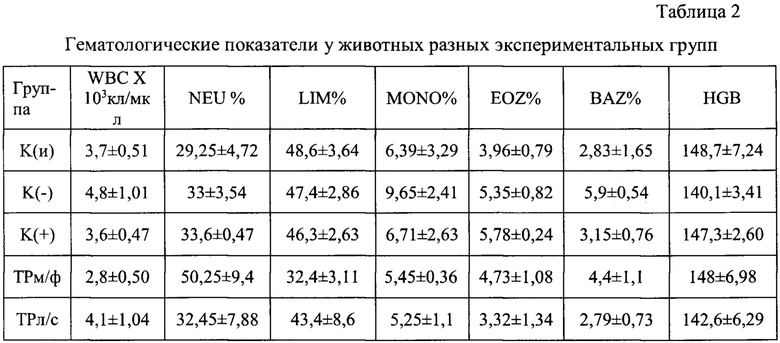
Примечание: HGB - гемоглобин; WBC - общее количество лейкоцитов; Процентное соотношение основных видов лейкоцитов: LIM - лимфоциты; NEU - нейтрофилы; MONO -моноциты; EOZ - эозинофилы; BAZ - базофилы.
Гематологический анализ крови показал, что относительно интактных животных в группе К(-) значительно повышается процентное содержание базофилов и эозинофилов, играющих одну из ведущих ролей в развитии аллергических реакций. Кроме того, практически в 1,5 раза увеличивается уровень моноцитов, которые являются предшественниками макрофагов, участвующих в патогенезе гиперчувствительности замедленного типа. Терапия заявляемой композицией способствовала коррекции лейкоцитограммы, доводя содержание указанных выше клеток до уровня близкого к группе К(и).
При этом у всех групп животных не было выявлено достоверных различий в показателях гемоглобина, общего количества лейкоцитов, а также процентного содержания лимфоцитов и нейтрофилов. Хотя в группе прошедшей терапию мазевой формой триптантрина, наблюдалась тенденция к более высоким показателям нейтрофилов (фагоцитарные клетки раннего реагирования), при одновременном снижении содержания лимфоцитов.
В день терминации эксперимента получали гомогенат кожи ушей животных для иммунологического анализа (определение уровня цитокинов методом иммуноферментного анализа (ИФА)). Для ИФА использовали диагностические наборы BD Bioscience OptEIA, US.
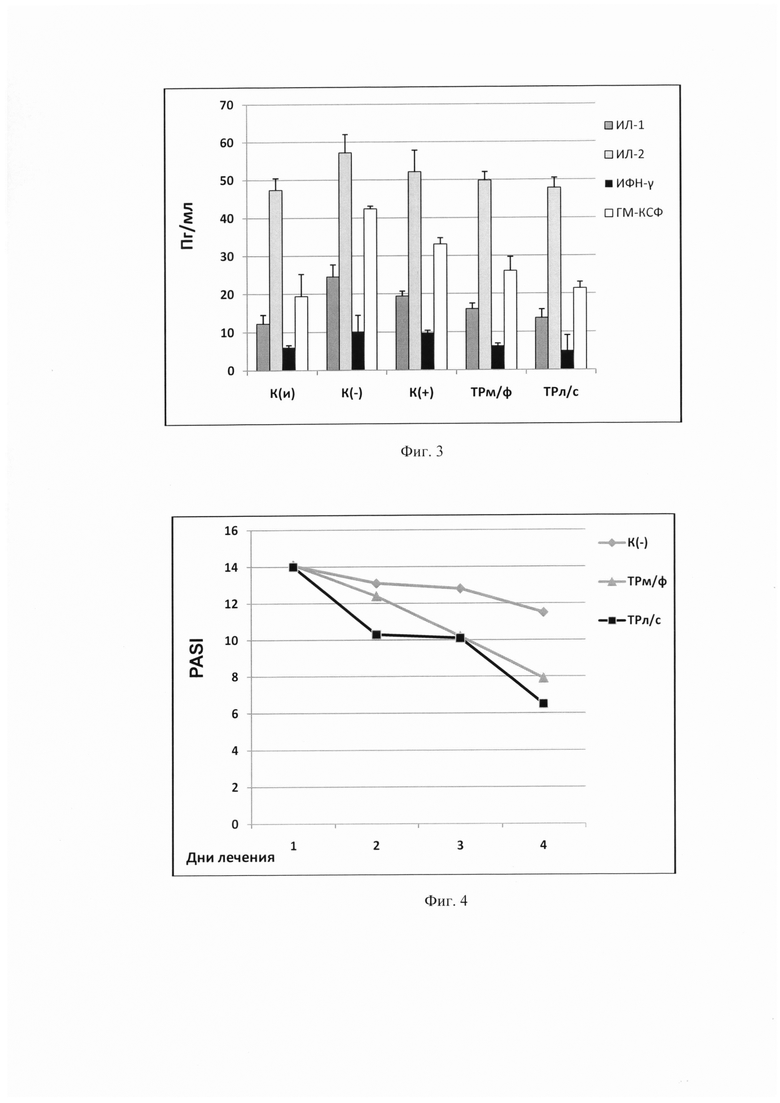
На фиг. 3 представлен сравнительный анализ действия заявляемой композиции, мазевой формы триптантрина и мази «Синафлан» на экспрессию цитокиновых белков в гомогенате кожи экспериментальных животных при АКД, индуцированного ДНФБ. По оси ординат обозначена концентрация цитокинов (в Пг) в 1 мл биообразца.
Сокращения:
ИЛ-1, 2 - интерлейкины - 1 и 2;
ИФН-γ - интерферон-гамма;
ГМ-КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор.
Иммунологический анализ гомогената кожи показал, что триптантрин в составе заявляемой композиции сохраняет свои цитокин-ингибирующие свойства. Как видно из фиг. 3, при аллергическом контактном дерматите ТРл/с, также как и ТРм/ф, достоверно снижает уровень основных провоспалительных цитокинов, участвующих в патогенезе аллергических заболеваний, уровень которых повышается в группе К(-).
Зарегистрированные в ходе эксперимента внешние патологические и биохимические показатели свидетельствуют о том, что при аллергическом контактном дерматите терапия заявляемой композицией способствует коррекции гематологических показателей, заметно уменьшает признаки воспалительного процесса, оказывая ранозаживляющее и противозудное действие.
Это обусловлено сочетанным действием триптантрина и хитоолигосахаридов, в результате которого происходит ингибирование производства противовоспалительных цитокинов. Кроме того, хитоолигосахариды повышают эффективность связывания триптантрина с иммунокомпетентными клетками, отвечающих за воспаление, тем самым значительно повышается лекарственная эффективность заявляемой фармацевтической композиции.
Пример 3. Оценка противоаллергической активности заявляемой композиции на модели имиквимод-индуцированного псориаза.
Животные были разделены на 4 группы по 7 животных в каждой: К(и) - интактный контроль; К(-) - отрицательный контроль; К(+) - положительный контроль; ТРм/ф - мазевая форма триптантрина; ТРл/с - заявляемая композиция.
Экспериментальное моделирование псориаза проводили согласно [J. Zhao et. al. Paeoniflorin inhibits imiquimod-induced psoriasis in mice by regulating Th17 cell response and cytokine secretion / // Eur. J. Pharmacol. - 2016. - Vol. 772. - P. 131-143]. В качестве индуктора использовали имиквимод в виде 5% коммерчески доступного крема - «Алдара» (3М Хелс Кеа Лтд, Великобритания), который наносили на выбритый в дорсакоудальной области участок кожи. Аппликации аллергена проводили 1 раз в сутки на протяжении 9 дней. После появления ярко-выраженных псориатических признаков (гиперкератоз, шелушение, появление чешуйчатого эпителия с некротическими очагами) начинали лечение исследуемыми препаратами, содержащими 0,01% действующего вещества, которые наносили на пораженный участок кожи 1 раз в сутки в течение трех дней.
Степень аллергического поражения эпидермиса у животных разных экспериментальных групп определяли по индексу PASI (Psoriasis Area and Severity Index), который рассчитывали по формуле:
PASI=PA × SI, где
PA площадь псориатического поражения и SI тяжесть поражения (визуальная оценка выраженности псориатического проявления).
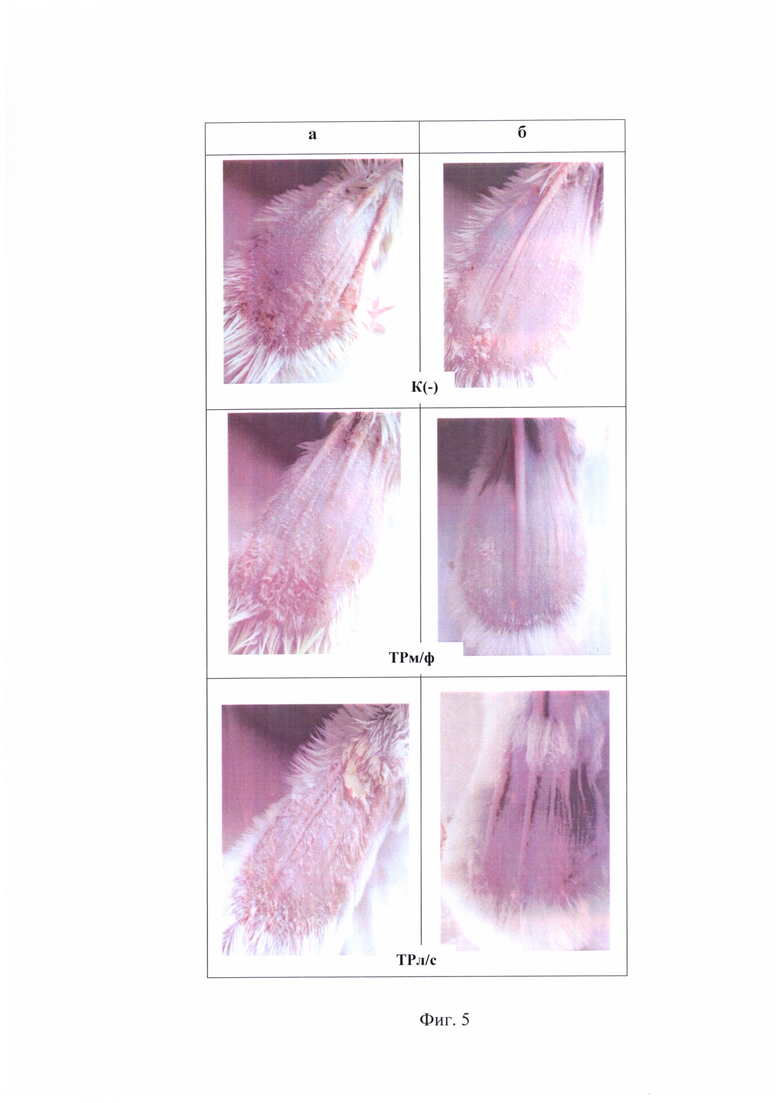
На фиг. 4 показано влияние заявляемой композиции и прототипа на индекс PASI при псориазе, индуцированного имиквимодом.
На фиг. 5 представлен фотоматериал, на котором зафиксировано состояние эпидермиса у животных после 9 аппликаций имиквимода (а) и после 3-х дневного курса лечения заявляемой композицией и мазевой формой триптантрина (б) в сравнении с группой К(-).
Из представленных материалов следует то, что применение исследуемой композиции приводит к облегчению степени тяжести псориатического поражения кожи, что проявляется в снижении уровня PASI в 2 раза после 3-х дневного курса лечения (фиг. 4). При этом заявляемая композиция по терапевтической эффективности превосходит мазевую форму, так как в группе животных ТРл/с наблюдается более выраженное снижение гиперкератоза и возобновление роста шерстяного покрова на пораженном участке кожи (фиг. 5 б.).
Пример 4. Оценка ранозаживляющего действия заявляемой композиции в отношении термических ран.
Для нанесения термических ран медный стержень с плоским торцом диаметром 6 мм нагревали на кипящей водяной бане в течении 15 сек, затем на 5-6 сек прижимали торцом к выбритому участку кожи животных на боковой стороне между позвоночником и бедром. Аппликации ТРл/с, ТРм/ф и мазью «Метилурацил» начинали спустя 24 ч после нанесения ожога, курс лечения составлял 2 дня. Для оценки действия препаратов на регенеративные процессы в эпидермисе животных измеряли площадь раны на 1, 3, 7 и 11 день после нанесения ожога и рассчитывали степень заживления (в %) по формуле:
(S1-Sn/S1)×100,
где S1 - площадь термической раны до лечения (спустя 24 часа после нанесения ожога), Sn - площадь термической раны на 3, 7 и 11 дни эксперимента. Результаты представлены в таблице 3.
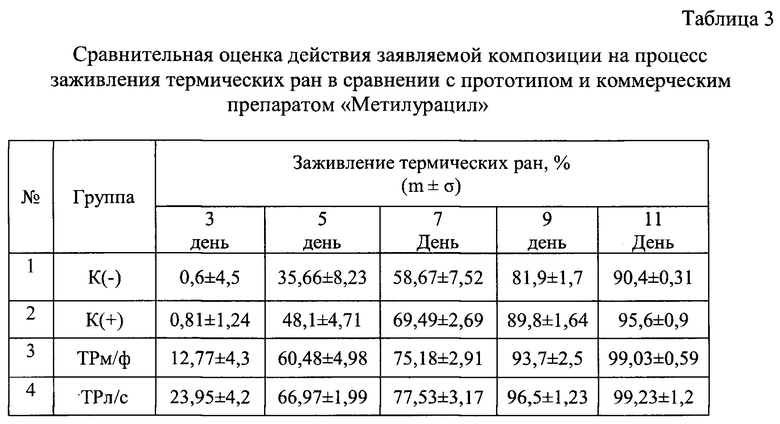
Показано, что ТРл/с и ТРм/ф обладают выраженным противоожоговым действием, способствуя практически полному заживлению термических ран к 11-ому дню эксперимента. При этом ТРл/с проявляет более высокую ранозаживляющую активность, чем ТРм/ф и метилурацил, ускоряя репаративные процессы в эпидермисе. Особенно четко эти различия в ранозаживляющем действии проявляется на 3-й и 5-й день после индуцирования ожога.
Результаты эксперимента говорит о способности заявляемой композиции стимулировать восстановление эпидермиса на ранних стадиях раневого процесса, что существенно сокращает время заживление ран.
Пример 5. Оценка противовоспалительной активности заявляемой композиции на модели системного воспаления.
Системное воспаление индуцировали липополисахаридом (ЛПС) из Е. coli (Sigma, США) в дозе 0,1 мг/кг. Исследуемую композицию, содержащую 0,01% триптантрина и дексаметазон, вводили животным за один час до индукции ЛПС. Через полтора часа после индукции системного воспаления проводили заборы крови для иммунологического анализа. Функциональное состояние иммунной системы оценивали путем определения уровня цитокинов в ИФА, используя диагностические наборы BD Bioscience OptEIA, US.
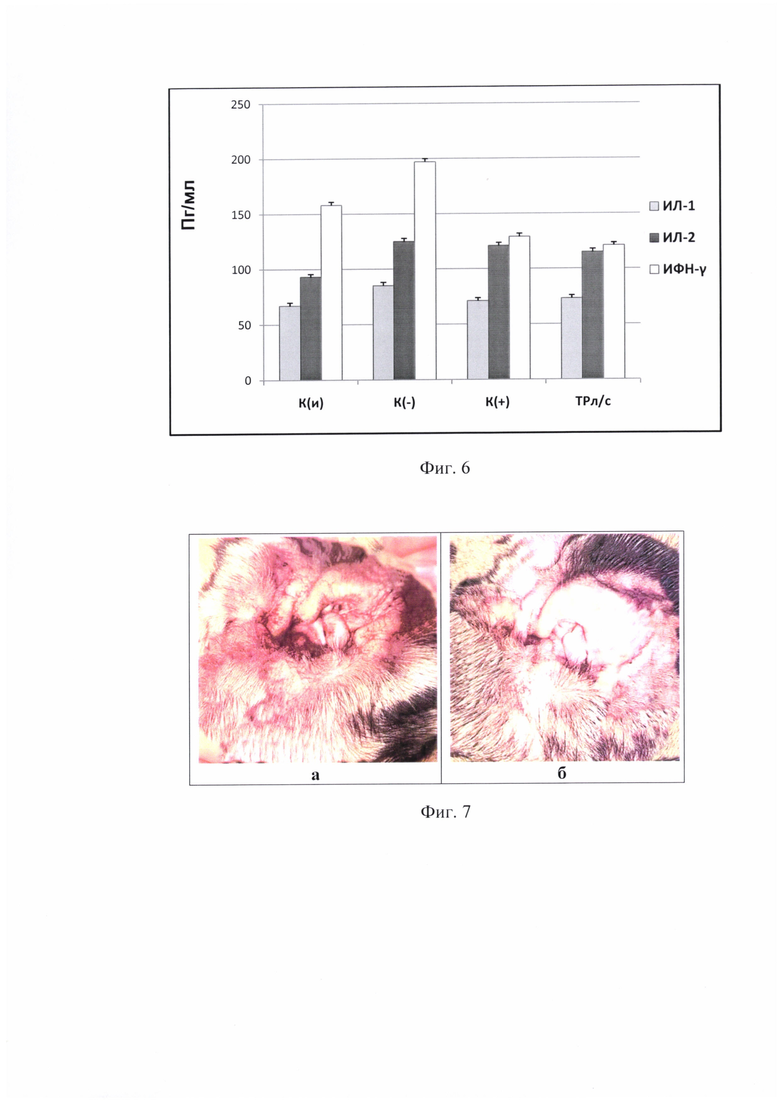
Иммунологический анализ крови при моделировании системного воспаления показал, что противовоспалительное действие заявляемой композиции сравнимо с действием коммерческого противовоспалительного препарата «Дексаметазон». ТР-л/с и дексаметазон не оказывают достоверного влияния на сывороточный уровень ИЛ-1 и ИЛ-2 в сравнении с группой К(-). Однако, известно, что ЛПС является индуктором преимущественно ИФН-γ, уровень которого снижался в 1,5 раза относительно группы К(-) в результате лечения ТРл/с и дексаметазоном.
На фиг. 6 представлен уровень провоспалительных цитокинов ИФН-γ, ИЛ-1 и ИЛ-2 в сыворотке крови животных при экспериментальном моделировании системного воспаления, индуцированного липополисахаридом. К(и) - интактный контроль, К(-) - отрицательный контроль, К(+) - положительный контроль - дексаметазон, ТРл/с - заявляемая композиция, По оси ординат обозначена концентрация цитокинов (в Пг) в 1 мл биообразца.
Полученные данные подтверждают наличие у заявляемой композиции цитокинингибирующего действия при воспалительных процессах.
Пример 6. Оценка эффективности применения заявляемой композиции в ветеринарной практике.
Анализ терапевтической эффективности заявляемой композиции при лечении собак с кожной аллергией проводили в условиях ветеринарного учреждения г. Владивостока. Собакам с атопическим дерматитом на ушах топикально наносили ТРл/с, содержащий 0,01% действующего вещества. Курс лечения составлял 3 дня. Проводили анализ состояние кожных покровов до и после лечения.
На фиг. 7 представлен фотоматериал, на котором зафиксировано состояние эпидермиса у собак с атопическим дерматитом на ушах до лечения (а) и после лечения заявляемой композицией (б).
Экспериментальные данные свидетельствуют о высокой лечебной активности заявляемой композиции. Трехкратная локальная аппликация ТРл/с приводит к практически полному восстановлению кожного покрова и устраняет признаки воспалительного процесса в эпидермисе.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ЛЕЧЕБНЫМ ДЕЙСТВИЕМ ПРИ РАЗЛИЧНЫХ КОЖНЫХ ПАТОЛОГИЯХ | 2014 |
|
RU2549475C1 |
| Водорастворимое производное триптантрина, обладающее противоопухолевой, противовоспалительной и противомикробной активностью, и повышающее терапевтическую активность противоопухолевых антибиотиков | 2019 |
|
RU2694058C1 |
| ГЕЛЕВАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ РАНОЗАЖИВЛЯЮЩИМ, ПРОТИВООЖОГОВЫМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ, ГЕПАТОПРОТЕКТОРНЫМ, ПРОТИВОДИАБЕТИЧЕСКИМ И ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2366408C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ РАНОЗАЖИВЛЯЮЩИМ И ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 1999 |
|
RU2153352C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2009 |
|
RU2440108C2 |
| ПОЛИВИТАМИННАЯ МАЗЬ ДЛЯ СМЯГЧЕНИЯ, ПИТАНИЯ И ЗАЖИВЛЕНИЯ КОЖИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2397770C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2009 |
|
RU2420266C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ ИЛИ ИХ КОМПОНЕНТЫ, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2017 |
|
RU2699540C2 |
| Ранозаживляющая мазь для лечения термических ожогов | 2022 |
|
RU2787377C1 |
| ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ СУКЦИНАТА ХИТОЗАНА И ЭКСТРАКТА КАЛЕНДУЛЫ | 2019 |
|
RU2694372C1 |
Изобретение относится к медицине и ветеринарии, а именно к фармацевтической композиции, обладающей лечебным действием при различных кожных патологиях. Фармацевтическая композиция, обладающая лечебным действием при различных кожных патологиях, содержит триптантрин, хитоолигосахариды, аспарагиновую кислоту, глицерин и диметилсульфоксид при определенном соотношении компонентов. Вышеописанная композиция позволяет повысить эффективность лечения кожных патологий разной этиологии и расширить арсенал фармацевтических композиций, обладающих лечебным действием при различных кожных патологиях. 3 табл., 7 ил., 6 пр.
Фармацевтическая композиция, обладающая лечебным действием при различных кожных патологиях, включающая триптантрин с биосовместимым носителем и дистиллированную воду, отличающаяся тем, что в качестве биосовместимого носителя она содержит хитоолигосахариды,и дополнительно содержит аспарагиновую кислоту, глицерин и диметилсульфоксид при следующем соотношении компонентов, мас.%:
| ГЕЛЕВАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ РАНОЗАЖИВЛЯЮЩИМ, ПРОТИВООЖОГОВЫМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ, ГЕПАТОПРОТЕКТОРНЫМ, ПРОТИВОДИАБЕТИЧЕСКИМ И ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2366408C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ЛЕЧЕБНЫМ ДЕЙСТВИЕМ ПРИ РАЗЛИЧНЫХ КОЖНЫХ ПАТОЛОГИЯХ | 2014 |
|
RU2549475C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОЛИГОМЕРОВ ХИТОЗАНА | 2006 |
|
RU2316592C1 |
| Петровичева С.Е | |||
| и др., ОСОБЕННОСТИ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ НОВОГО ПРЕПАРАТА "КОУРОХИТИН", Здоровье | |||
| Медицинская экология | |||
| Наука, 4-5, стр | |||
| Раздвижной паровозный золотник со скользящими по его скалке поршнями и упорными для них шайбами | 1922 |
|
SU147A1 |
Авторы
Даты
2019-07-09—Публикация
2019-02-26—Подача