ОБЛАСТЬ ТЕХНИКИ
Предложены антитело к CD43 или его антигенсвязывающий фрагмент, связывающиеся с внеклеточным доменом CD43, композиция для лечения рака, содержащая антитело к CD43 или его антигенсвязывающий фрагмент в качестве активного ингредиента, композиция для ингибирования раковой стволовой клетки, содержащая антитело к CD43, связывающееся с внеклеточным доменом CD43, в качестве активного ингредиента, и способ скрининга агента ингибирования раковой стволовой клетки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CD43 представляет собой белок клеточной поверхности, экспрессируемый в различных гематобластах за исключением эритроцитов. В состав CD43 человека, известного как сиалофорин или лейкосиалин, входит муциноподобный внеклеточный домен, состоящий из 235 аминокислот, трансмембранный домен, состоящий из 23 аминокислот, и внутриклеточный домен, состоящий из 123 аминокислот, и релевантная генетическая информация закодирована в одном экзоне. Во внеклеточном домене CD43 человека содержится много аминокислотных остатков серина (46 остатков) и треонина (47 остатков), и большая часть из них имеет О-присоединенный гликан (О-гликан). Кроме того, N-гликан также присоединен к CD43. Известно, что структура О-гликана сильно варьирует в зависимости от типа клетки. Ген CD43 имеет интрон, состоящий из 378 пар оснований, который разделяет экзон на два участка, и полная информация о транскрибируемом материале закодирована во втором экзоне.
CD43 синтезируется в виде предшественника размером примерно 40 килодальтон (кДа), включая N-гликан, и превращается в продукт с молекулярной массой от 115 кДа до 200 кДа в ходе последовательно происходящих процессов гликозилирования. Благодаря строго контролируемому процессу гликозилирования, после транскрипции образуются изоформы белков с характерной молекулярной массой в зависимости от типа клетки, и они могут экспрессироваться по-разному в зависимости от типа клетки.
Гликозилированный эпитоп CD43 известен как специфический маркер, характерный для лейкоцитов, и выявлена его специфическая полезность в качестве маркера гематологического злокачественного заболевания. По этой причине во многих исследованиях была протестирована возможность использования связывания антител с гликозилированным эпитопом CD43 для диагностических или терапевтических целей. Известно, что моноклональное антитело грызунов, распознающее CD43, индуцирует апоптоз костномозговых гематопоэтических клеток-предшественников, негативных по соответствующему маркеру клеточной линии, которые сверхэкспрессируют CD34 (Bazil et al. (1996) Blood, 87(4): 1272-81), и Т-лимфобластоидных клеток человека (Brown et al. (1996) J. Biol. Chem., 271: 27686-95). Однако, эти антитела не представляются эффективными для обнаружения или обработки раковых клеток, поскольку большинство из них взаимодействует с гликозилированным эпитопом, расположенным во внеклеточном домене CD43, экспрессируемого в зрелых (нераковых) гематопоэтических клетках. Таким образом, существует необходимость в разработке улучшенного вещества, связывающегося с гликозилированным эпитопом CD43, для диагностики, отслеживания и лечения гематологического злокачественного заболевания.
С другой стороны, известна гипотеза раковых стволовых клеток, согласно которой аномальные стволовые клетки вовлечены в возникновение и рецидив ракового заболевания в иерархической модели.
Все ткани организма человека берут начало из органоспецифических стволовых клеток. Органоспецифические стволовые клетки обладают способностью к самообновлению и дифференцировке во все клетки, составляющие каждый орган. Эти органоспецифические стволовые клетки отличаются от эмбриональных стволовых клеток тем, что только они могут дифференцироваться в типичные для конкретного органа клетки.
Гипотеза раковых стволовых клеток состоит в основном из двух элементов. Во-первых, опухоль возникает из стволовой клетки в ткани и, во-вторых, опухоль, возникающая из стволовой клетки, обладает основными свойствами стволовых клеток.
Раковая стволовая клетка как раковая клетка, обладающая неограниченной способностью к регенерации, определяется как клетка, из которой в случае введения мышам с ослабленным иммунитетом фактически может образовываться опухоль и которая может проявлять свою уникальную гетерогенность, которой в образовавшейся опухоли в полной мере обладает первичная опухоль.
Гипотеза раковых стволовых клеток стала более реальным фактом в связи с недавно разработанной биологией стволовых клеток. Гипотеза раковых стволовых клеток сделала шаг вперед благодаря сообщению, что лейкоз человека передавался мыши с ослабленным иммунитетом, которой пересаживали возможные раковые стволовые клетки от пациента с острым миелоцитарным лейкозом в 1997 г. (Bonnet D, Dick JE, Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 1997, 3: 730-7).
Отличающаяся гетерогенность, которую демонстрирует злокачественная опухоль, согласуется с различной способностью к дифференцировке стволовых клеток и повторно возникающей лекарственной устойчивостью раковой клетки, и несмотря на целый ряд направленных схем лечения также согласуется с основным свойством стволовых клеток. Поскольку из раковой стволовой клетки путем самообновления может образовываться новая опухолевая масса, то даже если опухолевые клетки, отличающиеся от раковых стволовых клеток, полностью удалены хирургическим и химиотерапевтическим путем, то раковое заболевание возникает вновь в случае сохранения раковой стволовой клетки.
Таким образом, чтобы полностью излечиться от рака, необходимо разработать технологию ингибирования или удаления раковых стволовых клеток.
ОПИСАНИЕ
ТЕХНИЧЕСКАЯ ЗАДАЧА
В другом воплощении предложена фармацевтическая композиция для лечения солидного рака, содержащая антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
В другом воплощении предложен способ лечения солидного рака, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, субъекту, нуждающемуся в лечении солидного рака.
В другом воплощении предложено применение антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, для лечения солидного рака.
Эпитопом может быть полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131. Антитело к CD43 или его антигенсвязывающий фрагмент может представлять собой вышеупомянутое антитело к CD43 или его антигенсвязывающий фрагмент.
Фармацевтическая композиция, способ и применение для лечения солидного рака могут характеризоваться, например, проявлением ингибирующего эффекта в отношении раковых стволовых клеток при гематологическом злокачественном заболевании или солидном раке. В одном из воплощений солидный рак может представлять собой рак желудка, а гематологическое злокачественное заболевание может представлять собой лейкоз.
В другом воплощении предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащая в качестве активного ингредиента антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
В другом воплощении предложен способ ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, субъекту, нуждающемуся в лечении гематологического злокачественного заболевания или солидного рака.
В другом воплощении предложено применение для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
Эпитоп может представлять собой полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131. Антитело к CD43 или его антигенсвязывающий фрагмент могут представлять собой вышеупомянутое антитело к CD43 или его антигенсвязывающий фрагмент. В одном из воплощений солидный рак может представлять собой рак желудка.
В другом воплощении предложен конъюгат между антителом к CD43 или его антигенсвязывающим фрагментом, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и раковой стволовой клеткой, например, раковой стволовой клеткой при гематологическом злокачественном заболевании или солидном раке. В другом воплощении предложен способ получения конъюгата между антителом к CD43 или его антигенсвязывающим фрагментом, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и раковой стволовой клеткой, например, раковой стволовой клеткой при гематологическом злокачественном заболевании или солидном раке, причем данный способ может включать стадию введения антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, в образец раковой опухоли, например, образец солидной раковой опухоли, или раковому пациенту, такому как пациент с диагнозом солидного рака. Конъюгат или способ его получения можно использовать для различных клинических, диагностических и/или экспериментальных задач, а также для лечения рака.
В другом воплощении предложен агент для скрининга агента для лечения солидного рака, содержащий эпитоп, локализованный во внеклеточном домене CD43. В другом воплощении предложен способ скрининга агента для лечения солидного рака с использованием эпитопа, локализованного во внеклеточном домене CD43. В другом воплощении предложено применение эпитопа, локализованного во внеклеточном домене CD43, для скрининга агента для лечения солидного рака. Эпитоп может представлять собой полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131. Агент для лечения солидного рака, обнаруженный посредством описанного выше скрининга, может характеризоваться проявлением ингибирующего эффекта в отношении раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке. В одном из воплощений солидный рак может представлять собой рак желудка.
В другом воплощении предложен агент для скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащий эпитоп, локализованный во внеклеточном домене CD43. В другом воплощении предложен способ скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, с использованием эпитопа, локализованного во внеклеточном домене CD43. В другом воплощении предложено применение эпитопа, локализованного во внеклеточном домене CD43, для скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке. Эпитоп может представлять собой полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131. В одном из воплощений солидный рак может представлять собой рак желудка.
В другом воплощении предложены новое антитело к CD43 или его антигенсвязывающий фрагмент. Антитело к CD43 или его антигенсвязывающий фрагмент может связываться с эпитопом, локализованным во внеклеточном домене CD43. Эпитоп может представлять собой полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131.
Антитело к CD43 или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL).
Вариабельная область тяжелой цепи может содержать первый определяющий комплементарность участок (CDR) (CDR1H), второй CDR (CDR2H) и третий CDR (CDR3H) в порядке расположения от N-конца к С-концу.
В одном из воплощений существенным компонентом антитела к CD43 или его антигенсвязывающего фрагмента является вариабельная область тяжелой цепи, и она может содержать CDR1H, включающий аминокислотную последовательность GYX1MN (SEQ ID NO: 110; X1 может быть выбран из всех аминокислот и, например, может представлять собой F или Y) (например, GYFMN (SEQ ID NO: 111) или GYYMN (SEQ ID NO: 112)), CDR2H, включающий аминокислотную последовательность RINPNX2GDSFYNQKFX3G (SEQ ID NO: 113; X2 и X3 могут быть выбраны из всех аминокислот, соответственно, и, например, Х2 может представлять собой N или S, а Х3 может представлять собой Q или K) (например, RINPNNGDSFYNQKFQG (SEQ ID NO: 114), RINPNSGDSFYNQKFQG (SEQ ID NO: 115), RINPNNGDSFYNQKFKG (SEQ ID NO: 116) или RINPNSGDSFYNQKFKG (SEQ ID NO: 117)), и CDR3H, включающий аминокислотную последовательность EGYYGGRGYALDY (SEQ ID NO: 118).
Вариабельная область легкой цепи может содержать первый CDR (CDR1L), второй CDR (CDR2L) и третий CDR (CDR3L) в порядке расположения от N-конца к С-концу.
В одном из воплощений существенным компонентом антитела к CD43 или его антигенсвязывающего фрагмента является вариабельная область легкой цепи, и она может содержать CDR1L, включающий аминокислотную последовательность RTSQDISNYLN (SEQ ID NO: 119); CDR2L, включающий аминокислотную последовательность X4TX5RLHS (SEQ ID NO: 120; Х4 и Х5 могут быть выбраны из всех аминокислот, соответственно, и, например, Х4 может представлять собой N, Q или А, а Х5 может представлять собой S или А) (например, NTSRLHS (SEQ ID NO: 121, NTARLHS (SEQ ID NO: 122), QTSRLHS (SEQ ID NO: 123) или ATSRLHS (SEQ ID NO: 124)); и CDR3L, включающий аминокислотную последовательность QQSNMFPY (SEQ ID NO: 125).
В другом воплощении предложена фармацевтическая композиция для предупреждения и/или лечения рака, содержащая антитело к CD43 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель.
В другом воплощении предложен способ предупреждения и/или лечения рака, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в предупреждении и/или лечении рака.
В другом воплощении предложено применение антитела к CD43 или его антигенсвязывающего фрагмента для предупреждения и/или лечения рака либо для изготовления противораковых средств.
В одном конкретном воплощении, касающемся фармацевтической композиции, способа и применения для предупреждения и/или лечения рака, антитело к CD43 или его антигенсвязывающий фрагмент могут быть предложены в качестве единственного активного ингредиента, совместно вводимого с цитотоксическим веществом, таким как противораковые средства, или могут быть предложены в форме конъюгата, объединенного с цитотоксическим веществом, таким как противораковые средства (конъюгат антитело-лекарственное средство; ADC).
В другом воплощении предложен способ детектирования раковой клетки в образце с использованием антитела к CD43 или его антигенсвязывающего фрагмента. Способ детектирования может включать стадию приведения в контакт образца с антителом к CD43 или его антигенсвязывающим фрагментом и стадию детектирования взаимодействия антигена с антителом в образце.
В другом воплощении предложена молекула нуклеиновой кислоты, кодирующая антитело к CD43 или его антигенсвязывающий фрагмент.
В другом воплощении предложен рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты. Рекомбинантный вектор может быть использован в качестве экспрессирующего вектора для экспрессии молекулы нуклеиновой кислоты в клетке-хозяине.
В другом воплощении предложена рекомбинантная клетка, содержащая молекулу нуклеиновой кислоты или рекомбинантный вектор. Рекомбинантная клетка может быть получена путем трансформации клетки-хозяина молекулой нуклеиновой кислоты или рекомбинантным вектором.
В другом воплощении предложен способ получения антитела к CD43 или его антигенсвязывающего фрагмента. Способ получения может включать стадию экспрессирования молекулы нуклеиновой кислоты в клетке-хозяине. Стадия экспрессирования может включать стадию культивирования рекомбинантной клетки и произвольным образом может дополнительно включать стадию выделения и/или очистки антитела из полученных клеточных культур.
В одном из конкретных воплощений способ получения может включать:
(а) стадию получения рекомбинантной клетки, трансформированной молекулой нуклеиновой кислоты или рекомбинантным вектором;
(б) стадию культивирования рекомбинантной клетки в условиях и/или в течение периода времени, достаточных для осуществления экспрессии молекулы нуклеиновой кислоты; и
(в) стадию выделения и/или очистки антитела к CD43 или его антигенсвязывающего фрагмента из культур, полученных на стадии (б).
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Как описано выше, необходимо разработать технологию ингибирования или удаления раковой стволовой клетки, чтобы полностью вылечить рак, и для этого необходимо выбрать маркер раковой стволовой клетки, с помощью которого можно отделять раковые стволовые клетки от других клеток.
В данном описании впервые утверждается, что CD43 экспрессируется на поверхности раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке. CD43 известен как специфический маркер лейкоцитов, характерный для большинства лейкоцитов, гематопоэтических стволовых клеток и тромбоцитов, за исключением эритроцитов, но не было известно, что он экспрессируется на раковой стволовой клетке, например, раковой стволовой клетке при гематологическом злокачественном заболевании или солидном раке.
Помимо этого, утверждается, что антитело к CD43, которое специфично распознает конкретный участок и/или связывается с конкретным участком внеклеточного домена CD43, обладает эффективностью с точки зрения ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке.
CD43 (кластер дифференцировки 43) называют лейкосиалином или сиалофорином, и он представляет собой основной трансмембранный белок, экспрессируемый на поверхности большинства гематобластов, за исключением эритроцитов. Источником CD43 могут быть млекопитающие, в том числе приматы, такие как человек (Homo sapiens) и так далее, грызуны, такие как мышь (Mus. musculus) и так далее. Например, CD43 может представлять собой CD43 человека (например, с № доступа в NCBI (Национальный центр биотехнологической информации) ААА51949.1 (ген (матричная РНК (мРНК)): М61827.1), NP_001025459.1 (ген (мРНК): NM_001030288.1), NP_003114.1 (ген: NM_003123.3) и т.д.), CD43 мыши (например, с № доступа в NCBI NP_001032899.1 (ген: NM_001037810.1), NP 033285.1 (ген: NM_009259.4) и т.д.) и так далее. В этом воплощении CD43 может представлять собой CD43 человека (белок: № доступа в NCBI ААА51949.1 (SEQ ID NO: 130); ген (мРНК): М61827.1).
Согласно одному из воплощений настоящего изобретения предложена фармацевтическая композиция для лечения солидного рака, содержащая в качестве активного ингредиента антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
В другом воплощении предложен способ лечения солидного рака, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, субъекту, нуждающемуся в лечении солидного рака.
В другом воплощении предложено применение антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, для лечения солидного рака.
Антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, характеризуется проявлением ингибирующей активности в отношении раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке.
Таким образом, согласно другому воплощению настоящего изобретения предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащая в качестве активного ингредиента антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
В другом воплощении предложен способ ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, субъекту, нуждающемуся в лечении солидного рака.
В другом воплощении предложено применение для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43.
В данном описании, если не указано иное, эпитоп, локализованный во внеклеточном домене CD43, может означать полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131:
SEQ ID NO: 131: Pro Leu Trp Thr Ser Ile.
Эпитоп может быть локализован во внеклеточном домене белка CD43, однако не может экспонироваться во внешнее окружение в нормальном состоянии и может экспонироваться наружу, если клетка становится раковой клеткой или раковой стволовой клеткой. В связи с этим, антитело или его антигенсвязывающий фрагмент, специфично распознающие такой эпитоп и/или специфично связывающиеся с ним, могут оказывать специфично направленное действие на раковую клетку и/или раковую стволовую клетку и/или ингибировать ее.
Внеклеточный домен CD43, в котором локализован эпитоп, может представлять собой участок, состоящий из аминокислот, начиная от 73-ей до 81-ой, в CD43 (ААА51949.1; SEQ ID NO: 130) (SEQ ID NO: 134). Так, эпитопом может быть участок из 6-9 следующих друг за другом аминокислот, содержащий SEQ ID NO: 131 в SEQ ID NO: 134 CD43(AAA51949.1).
Эпитоп может иметь аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 131-134, и, например, может иметь аминокислотную последовательность с SEQ ID NO: 134:
SEQ ID NO: 132: Ser Pro Leu Trp Thr Ser Ile;
SEQ ID NO: 133: Gly Ser Pro Leu Trp Thr Ser Ile;
SEQ ID NO: 134: Glu Gly Ser Pro Leu Trp Thr Ser Ile.
Антитело к CD43 или его антигенсвязывающий фрагмент могут представлять собой одну или более разновидностей, выбранных из группы, состоящей из всех антител или антигенсвязывающих фрагментов, которые распознают вышеупомянутый эпитоп или специфично связываются с ним.
В данном описании термин «JL-1» используется для обозначения CD43 или вышеупомянутого эпитопа CD43.
В данном изобретении антитело или его антигенсвязывающий фрагмент могут быть выбраны из группы, состоящей из антитела, имеющего происхождение из животного, химерного антитела, гуманизированного антитела и их антигенсвязывающих фрагментов. Антитело может быть получено рекомбинантным или синтетическим путем.
В том случае, когда антитело, полученное путем иммунизации животного желаемым антигеном, вводят человеку с терапевтической целью, обычно может иметь место иммунное отторжение. Чтобы ингибировать иммунное отторжение, было разработано химерное антитело. В этом химерном антителе константная область антитела, имеющего происхождение из животного, которая вызывает антиизотипическую реакцию, заменена на константную область человеческого антитела методом генной инженерии. Такое химерное антитело значительное лучше с точки зрения антиизотипической реакции по сравнению с антителом, имеющим происхождение из животного, но оно все еще обладает возможными побочными эффектами антиидиотипической реакции вследствие присутствия в вариабельной области аминокислот антитела животного происхождения. Гуманизированное антитело разработано для улучшения этих побочных эффектов. Его конструируют путем привития CDR (определяющего комплементарность участка), играющего важную роль для связывания антигена, в вариабельной области химерного антитела в каркасе на основе человеческого антитела.
Самым важным моментом для технологии привития CDR с целью конструирования гуманизированного антитела является выбор оптимизированного человеческого антитела, которое по меньшей мере может приобрести CDR антитела, имеющего происхождение из животного, и для этого используют привлечение базы данных по антителам, анализ кристаллической структуры, технологию молекулярного моделирования и так далее. Однако, применение дополнительной технологии конструирования антител для сохранения антигенсвязывающей способности представляется существенным, поскольку аминокислоты, составляющие каркас антитела, имеющего происхождение из животного, могут воздействовать на связывание с антигеном, несмотря на привитие CDR антитела, имеющего происхождение из животного, к оптимизированному каркасу на основе человеческого антитела, и поэтому имеется много случаев, когда не удалось сохранить антигенсвязывающей способности.
Антитело или антигенсвязывающий фрагмент могут быть выделены из живого организма (до иммунизации не присутствуют в живом организме) или могут иметь неприродное происхождение, например, могут быть получены синтетическим или рекомбинантным путем.
Использованный в данном описании термин «антитело» означает вещество, продуцируемое в иммунной системе в ответ на действие антигена, его вид особо не ограничен, и оно может быть получено природным или неприродным (например, синтетическим или рекомбинантным) путем. Антитело имеет преимущества в случае масштабной экспрессии и продуцирования, поскольку оно очень стабильно in vitro и in vivo и обладает длительным полупериодом своего существования. Кроме того, антитело имеет димерную структуру, и поэтому его авидность очень высока.
Антитело целиком имеет структуру, составленную из двух полноразмерных легких цепей и двух полноразмерных тяжелых цепей, и каждый раз легкая цепь соединена с тяжелой цепью дисульфидными связями. Константная область антитела подразделяется на константную область тяжелой цепи и константную область легкой цепи, и константная область тяжелой цепи имеет цепи гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε) типов и имеет цепи гамма1 (γ1), гамма2 (γ2), гамма3 (γ3), гамма4 (γ4), альфа1 (α1) и альфа2 (α2) в качестве подклассов. Константная область легкой цепи имеет цепи каппа (κ) и лямбда (λ) типов.
Термин «тяжелая цепь» интерпретируется как включающий в себя все полноразмерные тяжелые цепи, содержащие домен вариабельной области VH, включая аминокислотную последовательность, содержащую последовательность вариабельной области, достаточную для придания специфичности антигену, 3 домена константной области CH1, CH2 и CH3 и шарнирную область и их фрагменты. При этом, термин «легкая цепь» интерпретируется как включающий в себя все полноразмерные легкие цепи, содержащие домен вариабельной области VL, включая аминокислотную последовательность, содержащую последовательность вариабельной области, достаточную для придания специфичности антигену, и домен константной области CL и их фрагменты.
Термин «CDR (определяющий комплементарность участок)» означает аминокислотную последовательность гипервариабельного участка тяжелой цепи и легкой цепи иммуноглобулина. Тяжелая цепь и легкая цепь могут содержать по 3 CDR, соответственно (CDRH1, CDRH2, CDRH3 и CDRL1, CDRL2, CDRL3). В CDR может присутствовать остаток, обуславливающий основной контакт при связывании CDR с антигеном или эпитопом. С другой стороны, использованный в данном описании термин «специфическое связывание» или «специфическое распознавание» означает одно и тоже, что является общеизвестным фактом для специалиста в данной области техники и означает, что антиген и антитело взаимодействуют специфично, и осуществляется иммунологическая реакция.
Термин «антигенсвязывающий фрагмент» относится к фрагменту в полной структуре иммуноглобулина и означает часть полипептида, содержащего ту часть, с которой может связываться антиген. Например, он может представлять собой scFv (одноцепочечный Fv), (scFv)2, scFv-Fc, Fab, Fab' или F(ab')2, но этим не ограничиваться.
Fab или антигенсвязывающий фрагмент представляет собой структуру, содержащую вариабельные области легкой цепи и тяжелой цепи, константную область легкой цепи и первую константную область тяжелой цепи (CH1), и имеет 1 антигенсвязывающий сайт. Fab' отличается от Fab тем, что он имеет шарнирную область, содержащую один или более остатков цистеина на С-конце CH1-домена тяжелой цепи. В результате образования связи между остатками цистеина в шарнирной области антигенсвязывающего фрагмента получается F(ab')2 фрагмент антитела. Fv представляет собой минимальный фрагмент антитела, имеющий только вариабельную область тяжелой цепи и вариабельную область легкой цепи, и рекомбинантная технология получения Fv фрагмента широко известна специалистам в данной области техники. В двухцепочечном Fv вариабельная область тяжелой цепи и вариабельная область легкой цепи соединены нековалентными связями, а в одноцепочечном Fv вариабельная область тяжелой цепи и вариабельная область одной легкой цепи соединены ковалентными связями, обычно через пептидный линкер, или соединены непосредственно по С-концу, таким образом он может образовывать такую же структуру, что и двухцепочечный Fv. Линкером может быть пептидный линкер, состоящий из 1-100 или 2-50 любых аминокислот, и соответствующие последовательности известны в данной области техники. Антигенсвязывающий фрагмент может быть получен с использованием протеиназы (например, если целое антитело специфически расщепляется под действием папаина, то может быть получен Fab, а в случае расщепления под действием пепсина может быть получен F(ab')2 фрагмент) и может быть сконструирован с использованием технологии генетической рекомбинации.
Термин «шарнирная область» относится к участку тяжелой цепи антитела, который находится между СН1 и СН2 участками и обозначает участок, функция которого заключается в придании гибкости антигенсвязывающему фрагменту в антителе. Например, такой шарнир может иметь происхождение из человеческого антитела и, конкретно, может иметь происхождение из IgA, IgE или IgG, например, IgG1, IgG2, IgG3 или IgG4.
Антитело к CD43 может представлять собой поликлональное антитело или моноклональное антитело и, например, может представлять собой моноклональное антитело. Моноклональное антитело может быть получено методом, широко известным в данной области техники. Например, оно может быть получено с использованием метода фагового дисплея.
С другой стороны, можно провести скрининг отдельных моноклональных антител, используя типичный формат ELISA (иммуноферментный твердофазный анализ), основанный на способности связываться с CD43. Ингибирующую активность можно протестировать с использованием функциональных анализов для определения молекулярного взаимодействия ансамбля, таких как конкурентный ELISA, клеточный анализ, анализ Скетчарда или поверхностный плазмонный резонанс и так далее. Затем, с учетом сильной ингибирующей активности, можно протестировать аффинность к CD43 (значения Kd (константа диссоциации)) для каждого из выбранных моноклональных антител.
Например, антитело к CD43 или его антигенсвязывающий фрагмент может иметь аффинность связывания (Kd; например, измеренную в анализе Скетчарда) с CD43 (например, с CD43 человека, CD43 мыши и так далее) или эпитопом, локализованным во внеклеточном домене CD43, составляющую 1 мМ или меньше, 100 нМ или меньше, 10 нМ или меньше, 5 нМ или меньше либо 3 нМ или меньше, например, от 1 пМ до 1 мМ, от 1 пМ до 100 нМ, от 1 пМ до 10 нМ, от 1 пМ до 5 нМ, от 1 пМ до 3 нМ, от 10 пМ до 1 мМ, от 10 пМ до 100 нМ, от 10 пМ до 10 нМ, от 10 пМ до 5 нМ, от 10 пМ до 3 нМ, от 100 пМ до 1 мМ, от 100 пМ до 100 нМ, от 100 пМ до 10 нМ, от 100 пМ до 5 нМ, от 100 пМ до 3 нМ, от 1 нМ до 1 мМ, от 1 нМ до 100 нМ, от 1 нМ до 10 нМ, от 1 нМ до 5 нМ или от 1 нМ до 3 нМ.
В другом воплощении предложена гибридомная клеточная линия, продуцирующая моноклональное антитело к CD43. Гибридомной клеточной линией может быть клеточная линия H-JL1 с номером доступа KCLRF-BP-00010.
Антитело к CD43 или его антигенсвязывающий фрагмент могут быть применены вместе с одним или более выбранными из группы, состоящей из цитотоксических веществ и так далее.
Таким образом, фармацевтическая композиция может дополнительно содержать одно или более выбранных из группы, состоящей из цитотоксических веществ и так далее, в дополнение к антителу к CD43 или его антигенсвязывающему фрагменту. Кроме того, способ лечения и/или ингибирования может дополнительно включать стадию введения одного или более выбранных из группы, состоящей из цитотоксических веществ и так далее, в дополнение к стадии введения антитела к CD43 или его антигенсвязывающего фрагмента.
Конкретно, согласно другому воплощению настоящего изобретения предложена фармацевтическая композиция для лечения солидного рака, содержащая (1) антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и (2) одно или более выбранных из группы, состоящей из цитотоксических веществ и так далее, в качестве активного ингредиента.
В другом воплощении предложен способ лечения солидного рака, включающий (1) стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, субъекту, нуждающемуся в лечении солидного рака, и (2) стадию введения фармацевтически эффективного количества одного или более выбранных из группы, состоящей из цитотоксических веществ и так далее, субъекту, нуждающемуся в лечении солидного рака.
В другом воплощении предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащая (1) антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и (2) одно или более выбранных из группы, состоящей из цитотоксических веществ и так далее, в качестве активного ингредиента.
В другом воплощении предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающего (1) стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, раковому пациенту, например, пациенту с диагнозом солидного рака, и (2) стадию введения фармацевтически эффективного количества одного или более выбранных из группы, состоящей из цитотоксических веществ и так далее, раковому пациенту, например, пациенту с диагнозом солидного рака.
Что касается фармацевтической композиции, то на основе антитела к CD43 или его антигенсвязывающего фрагмента и одного или более выбранных из группы, состоящей из цитотоксических веществ и так далее, может быть изготовлена единая композиция путем конъюгирования всех друг с другом или смешивания, либо могут быть изготовлены отдельные композиции, соответственно, и смешаны. Что касается способа, то стадии введения антитела к CD43 или его антигенсвязывающего фрагмента и одного или более выбранных из группы, состоящей из цитотоксических веществ и так далее, могут быть выполнены одновременно или в любом порядке.
Цитотоксические вещества могут представлять собой все такие вещества, которые обладают токсичностью к раковой клетке, в особенности, клетке солидного рака, и могут представлять собой одно или более выбранных из группы, состоящей из радиоактивного изотопа, цитотоксического соединения (низкомолекулярного), цитотоксического белка, противоракового средства и так далее, но этим не ограничиваться. Цитотоксический белок может представлять собой один или более выбранных из группы, состоящей из рицина, сапорина, гелонина, момордина, дебуганина, дифтерийного токсина, псевдомонадного токсина и так далее, но этим не ограничиваться. Радиоактивный изотоп может представлять собой один или более выбранных из группы, состоящей из 131I, 188Rh, 90Y и так далее, но этим не ограничиваться. Цитотоксическое соединение может представлять собой одно или более, выбранных из группы, состоящей из дуокармицина, монометилауристатина Е (ММАЕ), монометилауристатина F (MMAF), N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)майтанзина (DM1), димера PBD (пирролобензодиазепин) и так далее, но этим не ограничиваться.
Антитело к CD43 или его антигенсвязывающий фрагмент и одно или более выбранных из группы, состоящей из цитотоксических веществ и так далее, могут быть использованы в форме конъюгата или слитого белка (в случае, когда цитотоксическое вещество и/или маркерное вещество представляют собой белки), в соединенном друг с другом виде (например, посредством ковалентной связи, пептидной связи и так далее). Конъюгирование антитела (или антигенсвязывающего фрагмента) и цитотоксического вещества может быть осуществлено в соответствии с технологией, хорошо известной в области техники, к которой принадлежит настоящее изобретение.
Активный ингредиент (антитело к CD43 или его антигенсвязывающий фрагмент, и/или цитотоксическое вещество, и/или маркерное вещество) можно применять (вводить) вместе с фармацевтически приемлемым носителем, и такой фармацевтически приемлемый носитель обычно используется для приготовления лекарственного средства и может представлять собой один или более выбранных из группы, состоящей из лактозы, декстрозы, сахарозы, сорбита, маннита, крахмала, гуммиарабика, фосфата кальция, альгината, желатина, силиката кальция, микрокристаллической целлюлозы, поливинилпирролидона, целлюлозы, воды, сиропа, метилцеллюлозы, метилгидроксибензоата, пропилгидроксибензоата, талька, стеарата магния, минерального масла и так далее, но этим не ограничиваться. Вместе с антителом к CD43 могут быть быть дополнительно включены один или более выбранных из группы, состоящей из разбавителя, эксципиента, смазывающего вещества, смачивающего агента, подсластителя, корригента, эмульгирующего агента, суспендирующего агента, консерванта и так далее, обычно используемых для приготовления фармацевтической композиции с другими, нежели эти, компонентами.
Активный ингредиент или фармацевтическую композицию можно вводить перорально или парентерально. В случае парентерального введения их можно вводить посредством внутривенной инъекции, подкожной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, эндодермального введения, местного введения, интраназального введения, внутрилегочного введения или интраректального введения и так далее. В случае перорального введения пероральные композиции должны иметь покрытие или должны быть приготовлены такими, чтобы активное лекарственное средство было защищено от деградации в желудке, поскольку белок или пептид подвержены расщеплению. Помимо этого, антитело к CD43 или его антигенсвязывающий фрагмент можно вводить посредством любого устройства, с помощью которого активное вещество может быть доставлено к клетке-мишени.
Использованный в данном описании термин «фармацевтически эффективное количество» означает количество лекарственного средства, достаточное для проявления фармацевтически значимого эффекта. Фармацевтически эффективное количество активных ингредиентов для разовой дозы может быть различным в зависимости от таких факторов, как способ приготовления композиции, введение, возраст, масса тела, пол, заболеваемость пациента, питание, продолжительность введения, интервал введения, путь введения, скорость экскреции и восприимчивость. Например, фармацевтически эффективное количество активных ингредиентов (например, антитела к CD43 или его антигенсвязывающего фрагмента) для разовой дозы может находиться в диапазоне 0,001-100 мг/кг или 0,02-10 мг/кг, но этим не ограничиваться. Фармацевтически эффективное количество как разовую дозу можно приготовить в виде одной композиции в стандартной лекарственной форме, приготовить в надлежащих количествах или приготовить путем внесения в многодозовый контейнер.
Солидный рак может означать любое негематологическое злокачественное заболевание, отличающееся от гематологического злокачественного заболевания. Например, солидный рак может представлять собой рак одного или более видов, выбранных из группы, состоящей из рака легкого (например, плоскоклеточной карциномы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточной карциномы легкого), перитонеального рака, рака кожи, меланомы кожи или глазного яблока, рака прямой кишки, раковой опухоли возле анального отверстия, рака пищевода, рака тонкой кишки, рака эндокринных желез, рака паращитовидной железы, рака надпочечников, саркомы мягких тканей, рака уретры, рака желудочно-кишечного тракта, рака желудка, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичника, рака печени, рака желчного пузыря, рака мочевого пузыря, рака молочной железы, рака толстой кишки, рака толстого кишечника, рака матки, рака эндометрия, рака шейки матки, рака слюнных желез, рака почки, рака предстательной железы, рака вульвы, рака щитовидной железы, рака головы и шеи, рака головного мозга, остеосаркомы и так далее, но этим не ограничиваться. Например, солидный рак может представлять собой рак желудка, рак молочной железы, рак легкого, рак толстого кишечника, рак печени, рак желчного пузыря, рак почки, рак поджелудочной железы, рак щитовидной железы, рак яичника, рак шейки матки, рак предстательной железы или рак мочевого пузыря. Такой рак включает не только первичный рак, но также метастазирующий рак. Кроме того, солидный рак может представлять собой рак, обладающий устойчивостью к традиционным противораковым средствам (например, низкомолекулярному противораковому средству (противораковому химическому средству), антиметаболиту, алкилирующему агенту, антибиотикам, алкалоиду барвинка, ферменту, гормону, терапевтическому агенту с направленным действием и/или терапевтическому агенту на основе антител и так далее), и может представлять собой рак, рецидивирующий после лечения традиционными противораковыми средствами (например, низкомолекулярным противораковым средством (противораковым химическим средством), антиметаболитом, алкилирующим агентом, антибиотиком, алкалоидом барвинка, ферментом, гормоном, терапевтическим агентом с направленным действием и/или терапевтическим агентом на основе антител и так далее).
Лечебный эффект в отношении солидного рака включает не только ингибирование роста (уменьшение количества) и апоптоз раковых клеток (в частности, раковых стволовых клеток) или пораженной раком ткани, содержащей такие клетки, но также ингибирующий эффект в отношении ухудшения ракового заболевания путем ингибирования миграции, инвазии, метастазирования и так далее.
Использованный в данном описании термин «ингибирование раковой стволовой клетки» означает все варианты количественного и/или функционального ингибирования раковой стволовой клетки, такие как ингибирование роста (уменьшение количества), апоптоз и так далее, и/или излечение от рака и/или улучшение течения рака, в который вовлечены раковые стволовые клетки.
Использованный в данном описании термин «пациент» означает пациента, нуждающегося в лечении рака (например, солидного рака или гематологического злокачественного заболевания) и/или в ингибировании раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, и может относиться ко всем млекопитающим, например, человеку, и может относиться к пациенту, страдающему от рака, имеющему симптомы рака или с риском развития рака, либо к клеткам, тканям, жидкостям организма или выделенным из них культивируемым смесям.
В другом воплощении предложен конъюгат, в состав которого входят антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и раковая стволовая клетка, например, раковая стволовая клетка при гематологическом злокачественном заболевании или солидном раке, при этом антитело или антигенсвязывающий фрагмент связывается с раковой стволовой клеткой. В другом воплощении предложен способ получения конъюгата, в состав которого входят антитело к CD43 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, и раковая стволовая клетка, например, раковая стволовая клетка при гематологическом злокачественном заболевании или солидном раке, при этом антитело или антигенсвязывающий фрагмент связывается с раковой стволовой клеткой, включающий стадию приведения в контакт антитела к CD43 или его антигенсвязывающего фрагмента, которые связываются с эпитопом, локализованным во внеклеточном домене CD43, с образцом раковой опухоли, например, образцом солидной раковой опухоли, или введения его раковому пациенту, такому как пациент с диагнозом солидного рака. Данный способ может быть осуществлен in vivo или in vitro. Конъюгат или способ его получения можно использовать для различных клинических, диагностических и/или экспериментальных задач, а также для лечения солидного рака. Например, его можно использовать для подтверждения присутствия раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, и/или для визуализации раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, путем детектирования того, образуется ли такой комплекс в случае, когда антитело к CD43 или его антигенсвязывающий фрагмент контактируют с образцом раковой опухоли. Далее, антитело к CD43 или его антигенсвязывающий фрагмент могут дополнительно содержать маркерное вещество. Это маркерное вещество может представлять собой одно или более выбранных из группы, состоящей из радиоактивного изотопа, флуоресцентного вещества, хромогена, красителя и так далее. Флуоресцентным веществом могут быть все наиболее распространенные флуоресцентные вещества и, например, могут быть одно или более выбранных из группы, состоящей из флуоресцеинизотиоцианата (FITC), фикоэритрина (РЕ), аллофикоцианина (АРС) или биотина, но этим не ограничиваются. Маркерное вещество может быть объединено (связано) с антителом или антигенсвязывающим фрагментом общепринятыми методами (например, посредством химических связей, таких как ковалентная связь, координационная связь, ионная связь и так далее). Объединение антитела (или антигенсвязывающего фрагмента) и маркерного вещества может быть осуществлено в соответствии с технологией, хорошо известной в области техники, к которой принадлежит настоящее изобретение.
Образец раковой опухоли может представлять собой линию раковых клеток или раковую клетку, ткань, жидкость организма и так далее, выделенную из ракового пациента или культивируемую искусственным путем. Образец солидной раковой опухоли может представлять собой линию клеток или клетку солидного рака, ткань, жидкость организма и так далее, выделенную из пациента с диагнозом солидного рака или культивируемую искусственным путем.
В другом воплощении предложено применение в качестве маркера для обнаружения раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, CD43, конкретно эпитопа, локализованного во внеклеточном домене CD43. Конкретно, в одном из воплощений предложена композиция для обнаружения раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащая вещество, взаимодействующее с CD43, конкретно с эпитопом, локализованным во внеклеточном домене CD43. В другом воплощении предложен способ обнаружения раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающий стадию приведения в контакт вещества, взаимодействующего с CD43, конкретно с эпитопом, локализованным во внеклеточном домене CD43, и стадию определения факта взаимодействия CD43, конкретно эпитопа, локализованного во внеклеточном домене CD43, с данным веществом, или степени этого взаимодействия. В этом случае, когда имеет место взаимодействие между CD43, конкретно эпитопом, локализованным во внеклеточном домене CD43, и данным веществом или его уровень оказывается высоким, может быть вынесено решение (определено), что клеточный образец содержит раковую стволовую клетку, например, раковую стволовую клетку при гематологическом злокачественном заболевании или солидном раке. Взаимодействующее вещество может представлять собой одно или более выбранных из группы, состоящей из всех веществ, которые могут взаимодействовать с CD43, конкретно с эпитопом, локализованным во внеклеточном домене CD43, например, представлять собой химическое вещество (низкомолекулярное химическое вещество), антитело, антигенсвязывающий фрагмент антитела, аптамер и так далее. Факт наличия взаимодействия может быть определен общими методами анализа белков с использованием взаимодействующего вещества, например, методом иммунохроматографии, иммуноферментного твердофазного анализа (ELISA), радиоиммуноанализа (RIA), иммуноферментного анализа (EIA), иммунофлуоресцентного анализа (FIA), иммунолюминесцентного анализа (LIA), вестерн-блоттинга, флуоресцентной гибридизации in situ (FISH), проточной цитометрии, с применением микрочипов и так далее, но этим не ограничиваться. Образец клеток может представлять собой клетку, ткань или их культивируемую смесь, выделенную из млекопитающих, например, человека, и, например, может представлять собой раковую клетку, пораженную раком ткань или их культивируемую смесь, выделенную из ракового пациента, например, пациента с диагнозом солидного рака.
В другом воплощении предложено применение эпитопа, локализованного во внеклеточном домене CD43, для скрининга средств для лечения солидного рака.
В другом воплощении предложен агент для скрининга агентов для лечения солидного рака, содержащий эпитоп, локализованный во внеклеточном домене CD43.
В другом воплощении предложен способ скрининга агентов для лечения солидного рака, включающий стадию приведения в контакт соединения-кандидата с эпитопом, локализованным во внеклеточном домене CD43, и стадию отбора соединения-кандидата, связывающегося с этим эпитопом, с целью определения его в качестве кандидата для лечения солидного рака.
Терапевтический агент для лечения солидного рака, обнаруженный в результате проведенного выше скрининга, может характеризоваться проявлением эффекта ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке.
Так, в другом воплощении предложено применение эпитопа, локализованного во внеклеточном домене CD43, для скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке.
В другом воплощении в качестве агента для скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, предложен эпитоп, локализованный во внеклеточном домене CD43.
В другом воплощении предложен способ скрининга агента для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающий стадию приведения в контакт соединения-кандидата с эпитопом, локализованным во внеклеточном домене CD43, и стадию отбора соединения-кандидата, связывающегося с этим эпитопом, с целью определения его в качестве агента-кандидата для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке.
Соединение-кандидат, связывающееся с эпитопом, может иметь аффинность связывания с эпитопом (Kd; например, измеренную в анализе Скетчарда), составляющую 1 мМ или меньше, 100 нМ или меньше, 10 нМ или меньше, 5 нМ или меньше либо 3 нМ или меньше, например, от 1 пМ до 1 мМ, от 1 пМ до 100 нМ, от 1 пМ до 10 нМ, от 1 пМ до 5 нМ, от 1 пМ до 3 нМ, от 10 пМ до 1 мМ, от 10 пМ до 100 нМ, от 10 пМ до 10 нМ, от 10 пМ до 5 нМ, от 10 пМ до 3 нМ, от 100 пМ до 1 мМ, от 100 пМ до 100 нМ, от 100 пМ до 10 нМ, от 100 пМ до 5 нМ, от 100 пМ до 3 нМ, от 1 нМ до 1 мМ, от 1 нМ до 100 нМ, от 1 нМ до 10 нМ, от 1 нМ до 5 нМ или от 1 нМ до 3 нМ.
Эпитоп является таким, как указано выше, и может иметь аминокислотную последовательность, выбранную из SEQ ID NO: 131-134. Такой эпитоп может быть представлен в составе целого белка CD43 или части, содержащей эпитоп, или может быть синтезирован химическим путем или получен рекомбинантным путем.
Соединение-кандидат может быть искусственно синтезированным или может представлять собой одно или более выбранных из группы, состоящей из природных различных разновидностей соединений, полипептида, олигопептида, пептидной структуры или белковой структуры (например, антитела, антигенсвязывающего фрагмента антитела, пептид-ассоциированного антитела, нанотела и так далее), полинуклеотида, олигонуклеотида, антисмысловой рибонуклеиновой кислоты (РНК), мшРНК (малая шпилечная РНК), миРНК (малая интерферирующая РНК), аптамера, природного экстракта и так далее.
Сочетание соединения-кандидата и эпитопа может быть выполнено с подтверждением образования комплекса соединения-кандидата и эпитопа, и это может быть осуществлено различными методами, общепризнанными в данной области техники. Например, это можно оценить посредством детекции с использованием обычной ферментативной реакции, флуоресценции, люминесценции и/или излучения и, конкретно, можно оценить методом, выбранным из группы, состоящей из иммунохроматографии, иммуногистохимии, иммуноферментного твердофазного анализа (ELISA), радиоиммуноанализа (RIA), иммуноферментного анализа (EIA), иммунофлуоресцентного анализа (FIA), иммунолюминесцентного анализа (LIA), вестерн-блоттинга и так далее, но этим не ограничиваться.
В одном из воплощений агент для лечения солидного рака или агент для ингибирования раковой стволовой клетки, обнаруженный в результате проведенного выше скрининга, может представлять собой один или более выбранных из группы, состоящей из антитела, антигенсвязывающего фрагмента антитела, антителоподобной белковой структуры (например, пептид-ассоциированного антитела, нанотела) и так далее.
В другом воплощении предложена фармацевтическая композиция для лечения солидного рака, содержащая агент для лечения солидного рака, обнаруженный в результате проведенного выше скрининга. В другом воплощении предложен способ лечения солидного рака, включающий стадию введения фармацевтически эффективного количества обнаруженного в результате скрининга агента для лечения солидного рака пациенту, нуждающемуся в лечении солидного рака. В одном из воплощений солидный рак может представлять собой рак желудка.
В другом воплощении предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, содержащая агент для ингибирования раковой стволовой клетки, обнаруженный в результате проведенного выше скрининга. В другом воплощении предложен способ ингибирования раковой стволовой клетки, например, раковой стволовой клетки при гематологическом злокачественном заболевании или солидном раке, включающий стадию введения фармацевтически эффективного количества агента для ингибирования раковой стволовой клетки, указанного выше, раковому пациенту, например, пациенту с диагнозом солидного рака. В одном из воплощений солидный рак может представлять собой рак желудка.
В другом воплощении предложены новое антитело к CD43 или его антигенсвязывающий фрагмент. Антитело к CD43 или его антигенсвязывающий фрагмент может связываться с эпитопом, локализованным во внеклеточном домене CD43. Эпитоп может представлять собой полипептид, содержащий 6-9 следующих друг за другом аминокислот во внеклеточном домене CD43, имеющий аминокислотную последовательность с SEQ ID NO: 131.
Антитело к CD43 или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL). Антитело к CD43 или его антигенсвязывающий фрагмент может представлять собой антитело, имеющее происхождение из животного (например, мышиное антитело), химерное антитело или гуманизированное антитело, и может представлять собой моноклональное антитело или поликлональное антитело, и может быть получено неприродным путем (например, посредством химического или биологического синтеза, рекомбинантного метода и так далее).
Вариабельная область тяжелой цепи может содержать первый определяющий комплементарность участок (CDR) (CDR1H), второй CDR (CDR2H) и третий CDR (CDR3H) в порядке расположения от N-конца к С-концу.
В одном из воплощений антитело к CD43 или его антигенсвязывающий фрагмент может содержать CDR1H, включающий аминокислотную последовательность GYX1MN (SEQ ID NO: 110; X1 может быть выбран из всех аминокислот и, например, может представлять собой F или Y) (например, GYFMN (SEQ ID NO: 111) или GYYMN (SEQ ID NO: 112)), CDR2H, включающий аминокислотную последовательность RINPNX2GDSFYNQKFX3G (SEQ ID NO: 113; Х2 и Х3 могут быть выбраны из всех аминокислот, соответственно, и, например, Х2 может представлять собой N или S, а Х3 может представлять собой Q или K) (например, RINPNNGDSFYNQKFQG (SEQ ID NO: 114), RINPNSGDSFYNQKFQG (SEQ ID NO: 115), RINPNNGDSFYNQKFKG (SEQ ID NO: 116) или RINPNSGDSFYNQKFKG (SEQ ID NO: 117)), и CDR3H, включающий аминокислотную последовательность EGYYGGRGYALDY (SEQ ID NO: 118), в качестве существенного компонента вариабельной области тяжелой цепи.
Вариабельная область тяжелой цепи может дополнительно содержать каркас иммуноглобулина на N-конце и/или С-конце вышеупомянутых определяющих комплементарность участков (CDR). Более конкретно, вариабельная область тяжелой цепи может содержать первый каркас (FR1H), первый определяющий комплементарность участок (CDR) (CDR1H), второй каркас (FR2H), второй CDR (CDR2H), третий каркас (FR3H), третий CDR (CDR3H) и четвертый каркас (FR4H) в порядке расположения от N-конца к С-концу.
В одном конкретном воплощении антитело к CD43 или его антигенсвязывающий фрагмент является гуманизированным и
(1) FR1H может содержать последовательность аминокислот от №1 до №30 в одной из последовательностей с номерами от SEQ ID NO: 83 до SEQ ID NO: 94 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше;
(2) CDR1H может содержать аминокислотную последовательность GYX1MN (SEQ ID NO: 110; X1 может быть выбран из всех аминокислот и, например, может представлять собой F или Y) и, например, может содержать аминокислотную последовательность GYFMN (SEQ ID NO: 111) или GYYMN (SEQ ID NO: 112);
(3) FR2H может содержать последовательность аминокислот от №36 до №49 в одной из последовательностей с номерами от SEQ ID NO: 83 до SEQ ID NO: 94 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с указанной выше аминокислотной последовательностью;
(4) CDR2H может содержать аминокислотную последовательность RINPNX2GDSFYNQKFX3G (SEQ ID NO: 113; каждый из Х2 и Х3 может быть независимо выбран из всех аминокислот и, например, Х2 может представлять собой N или S, Х3 может представлять собой Q или K) и, например, может содержать аминокислотную последовательность RINPNNGDSFYNQKFQG (SEQ ID NO: 114), RINPNSGDSFYNQKFQG (SEQ ID NO: 115), RINPNNGDSFYNQKFKG (SEQ ID NO: 116) или RINPNSGDSFYNQKFKG (SEQ ID NO: 117);
(5) FR3H может содержать последовательность аминокислот от №67 до №98 в одной из последовательностей с номерами от SEQ ID NO: 83 до SEQ ID NO: 94 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с указанной выше аминокислотной последовательностью;
(6) CDR3H может содержать аминокислотную последовательность EGYYGGRGYALDY (SEQ ID NO: 118);
(7) FR4H может содержать последовательность аминокислот от №112 до №122 в одной из последовательностей с номерами от SEQ ID NO: 83 до SEQ ID NO: 94 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с указанной аминокислотной последовательностью.
Вариабельная область легкой цепи может содержать первый CDR (CDR1L), второй CDR (CDR2L) и третий CDR (CDR3L) в порядке расположения от N-конца к С-концу.
В одном из воплощений антитело к CD43 или его антигенсвязывающий фрагмент может содержать CDR1L, включающий аминокислотную последовательность RTSQDISNYLN (SEQ ID NO: 119); CDR2L, включающий аминокислотную последовательность X4TX5RLHS (SEQ ID NO: 120; Х4 и Х5 может быть выбран из всех аминокислот, соответственно, и, например, Х4 может представлять собой N, Q или А, а Х5 может представлять собой S или А) (например, NTSRLHS (SEQ ID NO: 121, NTARLHS (SEQ ID NO: 122), QTSRLHS (SEQ ID NO: 123) или ATSRLHS (SEQ ID NO: 124)); и CDR3L, включающий аминокислотную последовательность QQSNMFPY (SEQ ID NO: 125), в качестве существенного компонента вариабельной области легкой цепи.
Вариабельная область легкой цепи может дополнительно содержать каркас иммуноглобулина на N-конце и/или С-конце вышеупомянутых определяющих комплементарность участков (CDR). Более конкретно, вариабельная область легкой цепи может содержать первый каркас (FR1L), первый определяющий комплементарность участок (CDR) (CDR1L), второй каркас (FR2L), второй CDR (CDR2L), третий каркас (FR3L), третий CDR (CDR3L) и четвертый каркас (FR4L) в порядке от N-конца к С-концу.
В одном конкретном воплощении
(8) FR1L может содержать последовательность аминокислот от №1 до №23 в одной из последовательностей с номерами от SEQ ID NO: 95 до SEQ ID NO: 109 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше;
(9) CDR1L может содержать аминокислотную последовательность RTSQDISNYLN (SEQ ID NO: 119);
(10) FR2L может содержать последовательность аминокислот от №35 до №49 в одной из последовательностей с номерами от SEQ ID NO: 95 до SEQ ID NO: 109 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше;
(11) CDR2L может содержать аминокислотную последовательность X4TX5RLHS (SEQ ID NO: 120; каждый из Х4 и Х5 может быть независимо выбран из всех аминокислот, и, например, Х4 может представлять собой N, Q или А, а Х5 может представлять собой S или А) и, например, может содержать NTSRLHS (SEQ ID NO: 121, NTARLHS (SEQ ID NO: 122), QTSRLHS (SEQ ID NO: 123) или ATSRLHS ((SEQ ID NO: 124);
(12) FR3L может содержать последовательность аминокислот от №57 до №88 в одной из последовательностей с номерами от SEQ ID NO: 95 до SEQ ID NO: 109 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше;
(13) CDR3L может содержать аминокислотную последовательность QQSNMFPY (SEQ ID NO: 125);
(14) FR4L может содержать последовательность аминокислот от №97 до №108 в одной из последовательностей с номерами от SEQ ID NO: 95 до SEQ ID NO: 109 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с указанной выше аминокислотной последовательностью.
В одном из воплощений антитело к CD43 или его антигенсвязывающий фрагмент может содержать вариабельную область тяжелой цепи и вариабельную область легкой цепи. Вариабельная область тяжелой цепи может содержать аминокислотную последовательность с SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 или 94. Вариабельная область легкой цепи может содержать аминокислотную последовательность с SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 или 109.
Например, антитело к CD43 или его антигенсвязывающий фрагмент могут быть гуманизированными и могут быть проиллюстрированы как содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, определенные как указано ниже:
(а) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 83, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 95;
(б) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 84, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 96;
(в) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 85, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 97;
(г) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 86, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 98;
(д) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 87, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 99;
(е) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 88, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 100;
(ж) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 89, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 101;
(з) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 90, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 102;
(и) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 91, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 103;
(к) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 93, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 103;
(л) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 94, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 106;
(м) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 91, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 97;
(н) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 85, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 103;
(о) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 93, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 107;
(п) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 93, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 108; или
(р) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 93, и вариабельная область легкой цепи, содержащая аминокислотную последовательность с SEQ ID NO: 109.
В одном из конкретных воплощений аминокислотная последовательность каркаса, содержащегося в гуманизированном антителе к CD43 или его антигенсвязывающем фрагменте, может быть проиллюстрирована как показано ниже, но этим не ограничивается:
(1) FR1H может содержать аминокислотные остатки от №1 до №30 в одной из SEQ ID NO: 83-94;
(2) FR2H может содержать аминокислотные остатки от №36 до №49 в одной из SEQ ID NO: 83-94;
(3) FR3H может содержать аминокислотные остатки от №67 до №98 в одной из SEQ ID NO: 83-94;
(4) FR4H может содержать аминокислотные остатки от №112 до №122 в одной из SEQ ID NO: 83-94;
(5) FR1L может содержать аминокислотные остатки от №1 до №23 в одной из SEQ ID NO: 95-109;
(6) FR2L может содержать аминокислотные остатки от №35 до №49 в одной из SEQ ID NO: 95-109;
(7) FR3L может содержать аминокислотные остатки от №57 до №88 в одной из SEQ ID NO: 95-109;
(8) FR4L может содержать аминокислотные остатки от №97 до №108 в одной из SEQ ID NO: 95-109.
В другом примере антитело к CD43 или его антигенсвязывающий фрагмент может дополнительно содержать константную область тяжелой цепи иммуноглобулина человека и/или константную область легкой цепи иммуноглобулина человека, происходящие из иммуноглобулина человека. Иммуноглобулин человека может быть выбран из группы, состоящей из IgA, IgD, IgE, IgG (IgG1, IgG2, IgG3, IgG4), IgM и так далее. Например, константная область тяжелой цепи иммуноглобулина человека может содержать аминокислотную последовательность с №№ остатков 123-452 в SEQ ID NO: 40 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше; и константная область легкой цепи иммуноглобулина человека может содержать аминокислотную последовательность с №№ остатков 108-214 в SEQ ID NO: 48 или аминокислотную последовательность, имеющую 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,1% или больше, 99,2% или больше, 99,3% или больше, 99,4% или больше, 99,5% или больше, 99,6% или больше, 99,7% или больше, 99,8% или больше, 99,9% или больше гомологии последовательности с аминокислотной последовательностью, указанной выше.
В другом воплощении антитело к CD43 или его антигенсвязывающий фрагмент может характеризоваться тем, что входящие в его состав аминокислотные остатки не являются гликозилированными. Для этого случая, когда в антителе, в частности, вариабельной области тяжелой цепи и/или вариабельной области легкой цепи имеется мотив гликозилирования, например, мотив N-гликозилирования (например, «N-X-S/T» (X может представлять собой все аминокислотные остатки)), этот мотив может быть модифицирован. Например, когда мотив N-гликозилирования представляет собой «N-X-S/T» (X может представлять собой все аминокислотные остатки), «N», «S/Т» или оба из них в таком мотиве могут быть заменены на аминокислоту, отличающуюся от первоначальных, соответственно. В одном из воплощений негликозилированное антитело к CD43 или его антигенсвязывающий фрагмент может содержать NTARLHS (SEQ ID NO: 122), QTSRLHS (SEQ ID NO: 123) или ATSRLHS (SEQ ID NO: 124) в качестве CDR2L. Что касается другого воплощения, то негликозилированное антитело к CD43 или его антигенсвязывающий фрагмент может содержать аминокислотную последовательность с SEQ ID NO: 107, 108 или 109 в качестве вариабельной области легкой цепи.
Антитело к CD43 или его антигенсвязывающий фрагмент специфично связываются с вышеупомянутым специфическим эпитопом CD43 и могут быть выбраны из группы, состоящей из антитела животного происхождения (например, мышиного антитела), химерного антитела, гуманизированного антитела и их антигенсвязывающих фрагментов. Антитело животного происхождения может иметь происхождение из вида животного, отличающегося от человека, и, например, может происходить из крысы, мыши, козы, морской свинки, осла, кролика, лошади, ламы, верблюда, птиц (например, цыпленка, утки и так далее) и других, но этим не ограничиваться. Метод конструирования химерного антитела и/или гуманизированного антитела из антитела животного происхождения хорошо известен в данной области техники. Гуманизированным антителом могут быть IgG (IgG1, IgG2, IgG3, IgG4), IgM, IgA, IgD, IgE или антитело любого соответствующего изотипа, например, любого подкласса.
В данном описании специфичность связывания антитела с CD43 может означать то, что антитело обладает более высокой аффинностью в отношении CD43, нежели пептида, не являющегося CD43, или обладает более высокой аффинностью в отношении вышеупомянутого эпитопа CD43 по сравнению с другим участком CD43 или другим внеклеточным участком.
Связывание антитела с антигеном (более конкретно, эпитопом) (связывание антиген-антитело) можно оценить всеми методами, известными в данной области техники. Например, связывание антиген-антитело можно оценить с использованием одного или более методов, выбранных из группы, состоящей из ELISA, проточной цитометрии, иммунохимического окрашивания, метода BIAcore с применением оптического биосенсора и так далее, но этим не ограничиваются.
Термин «антигенсвязывающий фрагмент», использованный в данном описании, означает часть (фрагмент) антитела, обладающую способностью специфично распознавать антиген (CD43) или вышеупомянутый эпитоп CD43 и/или специфично связываться с ним. Например, антигенсвязывающий фрагмент может быть выбран из группы, состоящей из фрагментов Fab, F(ab)2, Fv, scFv, scFv-Fc и т.д.
В одном из воплощений эпитоп, распознаваемый антителом к CD43, может представлять собой эпитоп, распознаваемый scFv антитела к CD43. Фрагмент scFv антитела к CD43 может содержать вышеупомянутый CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 или содержать вышеупомянутые вариабельную область тяжелой цепи и вариабельную область легкой цепи.
Что касается scFv антитела к CD43, то вышеупомянутые вариабельная область тяжелой цепи и вариабельная область легкой цепи могут быть соединены посредством соответствующего линкера. Линкером может быть пептидный линкер, состоящий из 1-100 или 2-50 любых аминокислот, и соответствующие последовательности известны в данной области техники. В одном из воплощений пептидный линкер может быть представлен в виде GGGX6S (Х6 представляет собой G или A; SEQ ID NO: 126) или (GGGX6S)n (n представляет собой целое число от 1 до 5, и Х6 включенный в каждую повторяющуюся единицу независимо представляет собой G или А) и, например, может содержать аминокислотную последовательность GGGASGGGGSGGGGS (SEQ ID NO: 127) или GGGGSGGGGSGGGAS (SEQ ID NO: 128), но этим не ограничиваться.
В одном из воплощений scFv антитела к CD43 может содержать аминокислотную последовательность с SEQ ID NO: 50, 52, 54, 56 или 58, но этим не ограничиваться.
В одном из воплощений антитело к CD43 или его антигенсвязывающий фрагмент могут проявлять цитотоксичность в отношении клетки-мишени в результате конъюгирования с цитотоксическим веществом, которое может вызывать гибель клеток (например, включая программируемую клеточную смерть, такую как апоптоз). Цитотоксическое вещество может представлять собой одно или более веществ, выбранных из группы, состоящей из всех соединений (низкомолекулярного соединения; противоракового средства и так далее), белка, пептида, олигонуклеотида, полинуклеотида и так далее, которые, как известно в данной области техники, проявляют токсичность в отношении клеток, в частности, раковых клеток, и, например, может представлять собой одно или более выбранных из группы, состоящей из радиоактивного изотопа, цитотоксического соединения (низкомолекулярного), цитотоксического белка, противоракового средства и так далее. Цитотоксический белок может представлять собой один или более выбранных из группы, состоящей из рицина, сапорина, гелонина, момордина, дебуганина, дифтерийного токсина, псевдомонадного токсина и так далее, но этим не ограничиваться. Радиоактивный изотоп может представлять собой один или более выбранных из группы, состоящей из 131I, 188Rh, 90Y и так далее, но этим не ограничиваться. Цитотоксическое соединение может представлять собой одно или более выбранных из группы, состоящей из дуокармицина, монометилауристатина Е (ММАЕ), монометилауристатина F (MMAF), N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)-майтанзина (DM1), димера PBD (пирролобензодиазепин) и так далее, но этим не ограничиваться.
В другом воплощении антитело к CD43 или его антигенсвязывающий фрагмент могут быть представлены в форме конъюгата, причем в составе этого конъюгата находится детектируемый маркер. Такой конъюгат можно с пользой применять для обнаружения присутствия CD43 или вышеупомянутого эпитопа CD43 in vitro или in vivo. Детектируемый маркер может быть выбран из всех маркерных веществ, общеизвестных в данной области техники, и, например, может представлять собой один или более выбранных из группы, состоящей из радиоактивного маркера (например, 3Н, 14С, 35S, 90Y, 99Тс, 111In, 125I, 131I, 177Lu, 166Ho, 153Sm и так далее), фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки, химических веществ, таких как биотин, и так далее, но этим не ограничиваться. Выбор соответствующей метки для случая применения антитела или эпитопа очевиден специалисту в данной области техники.
В другом воплощении предложена фармацевтическая композиция для предупреждения и/или лечения рака, содержащая антитело к CD43 или его антигенсвязывающий фрагмент в качестве активного ингредиента. В другом воплощении предложена фармацевтическая композиция для ингибирования раковой стволовой клетки, содержащая антитело к CD43 или его антигенсвязывающий фрагмент в качестве активного ингредиента. В другом воплощении предложен способ предупреждения и/или лечения рака, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в предупреждении и/или лечении рака. В другом воплощении предложен способ ингибирования раковой стволовой клетки, включающий стадию введения фармацевтически эффективного количества антитела к CD43 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в предупреждении и/или лечении рака. Фармацевтически эффективное количество означает количество, эффективное для получения желаемого противоракового эффекта, например, терапевтического эффекта (например, усиления процесса гибели раковых клеток, уменьшения пораженных раком тканей в размере, ингибирования метастазирования рака и так далее) у субъекта, подлежащего введению. Что касается фармацевтической композиции и способа, то антитело к CD43 или его антигенсвязывающий фрагмент можно использовать в том виде, как они есть, или в форме конъюгата с присоединенным цитотоксическим веществом. Цитотоксическим веществом является то же самое вещество, которое описано выше.
Рак может представлять собой конкретный тип среди всех типов рака, экспрессирующих вышеупомянутый эпитоп CD43. В одном из воплощений рак может представлять собой гематологическое злокачественное заболевание и, например, может представлять собой одно или более выбранных из группы, состоящей из острого миелоидного лейкоза, острого лимфобластного лейкоза, острого моноцитарного лейкоза, лимфомы Ходжкина, неходжкинской лимфомы и так далее. В другом воплощении рак может представлять собой одну или более разновидностей, выбранных из упомянутых далее видов солидного рака.
Антитело или антигенсвязывающий фрагмент можно вводить в количестве, достаточном для связывания с CD43 на клеточной поверхности, в частности, с вышеупомянутым CD43 или эпитопом CD43 на опухолевой клетке, экспрессирующей CD43 эпитоп, и данное количество может быть легко определено специалистом в данной области техники.
Вышеупомянутое фармацевтически эффективное количество или достаточное количество означает количество, необходимое для получения ожидаемого эффекта у субъекта, которому оно должно быть введено. Ожидаемый эффект будет сопровождать связывание антитела с CD43 (или эпитопом CD43), экспрессированным на клеточной поверхности, и в результате такого связывания может проявляться цитотоксичность (например, антителозависимая клеточная цитотоксичность (ADCC) или комплементзависимая цитотоксичность (CDC)) благодаря присутствию антитела, антигенсвязывающего фрагмента или цитотоксического вещества, конъюгированного с антителом или фрагментом. В другом воплощении ожидаемый эффект вызывается связыванием антитела с CD43, экспрессированным на поверхности клетки, при незначительной или при отсутствии цитотоксичности, обусловленной другими антителами, и тем самым такое связывание может позволить специалисту в данной области техники обнаружить и избирательно удалить (например, посредством лейкафереза) CD43+ клетки и CD43+ клетки у пациента (например, когда антитело или фрагмент мечены детектируемым маркером). Количество необходимых молекул антитела может быть разным в зависимости от пациента, расы, возраста и общего состояния здоровья пациента, введения конкретного соединения, способа введения и так далее, применяемого для пациента. Поэтому определение «точного достаточного количества» может оказаться неосуществимым. Однако, в любом отдельном случае соответствующее количество может быть определено обычным методом с использованием систематического экспериментирования. Кроме того, доза может быть скорректирована с учетом экстренности ситуации и может быть скорректирована с целью расчета оптимальной дозировки. Например, несколько доз можно принимать один раз в сутки, один раз в неделю, один раз в месяц или с другим соответствующим временным интервалом.
Вышеупомянутое фармацевтически эффективное количество или достаточное количество может быть определено путем мониторинга связывания антитела с клеткой в биологическом образце (например, образце жидкости организма (например, образце крови и так далее), образце клетки/ткани (например, образце опухолевой клетки/ткани и так далее) и так далее, полученном от пациента, которому вводят или которому надлежит ввести антитело или его антигенсвязывающий фрагмент. Биологический образец может быть отобран у пациента в конкретный момент времени после введения антитела или фрагмента (например, примерно через 5, 10, 15 или 20 мин после введения). Присутствие антитела или фрагмента на клеточной поверхности в образце (то есть, антитела или антигенсвязывающего фрагмента, связавшегося с CD43 или его эпитопом на клеточной поверхности в результате взаимодействия антигена с антителом) может быть проанализировано с использованием хорошо известных в данной области техники методов. Кроме того, полученный биологический образец может быть использован для общего анализа для измерения жизнеспособности клеток или числа живых клеток в образце. Исходя из того факта, что число CD43-положительных клеток уменьшается после введения антитела или фрагмента (например, число живых клеток в образце, в который введено антитело или фрагмент, уменьшается по сравнению с контрольным образцом, подобным образцу, полученному до введения антитела или фрагмента, и так далее), можно определить антителоопосредуемую цитотоксичность. Цитотоксичность может опосредоваться антителом как таковым (например, неконъюгированным антителом, которое не связано с цитотоксическим веществом, или его антигенсвязывающим фрагментом) и/или может опосредоваться цитотоксическим веществом, конъюгированным с антителом или фрагментом.
Антитело к CD43 или его антигенсвязывающий фрагмент, которые специфично связываются с эпитопом CD43, предложенные в данном изобретении, могут уменьшать на 10% или больше, 20% или больше, 30% или больше, 40% или больше, 50% или больше, 60% или больше, 70% или больше, 80% или больше либо 90% или больше уровень CD43-положительных клеток-мишеней в образце от пациента, которому вводили антитело или фрагмент, по сравнению с уровнем CD43-положительных клеток в контрольном образце (например, образце, полученном от пациента перед введением антитела или фрагмента). В одном из воплощений CD43-положительная клетка может представлять собой раковую клетку, например, злокачественную гематопоэтическую клетку (например, лейкозную клетку) и/или раковую стволовую клетку.
В другом воплощении дозировку (фармацевтически эффективное количество) антитела или антигенсвязывающего фрагмента можно оценить и определить в клеточном анализе in vitro. Например, чтобы определить концентрацию антитела или фрагмента, необходимую для снижения числа CD43-положительных клеток, которые представляют собой мишень для антитела или фрагмента, можно провести клеточный анализ in vitro с использованием CD43-положительной клетки (например, клеточной линии СЕМ7). Концентрацию антитела или фрагмента, определенную для случая уменьшения числа клеток in vitro (например, уменьшения по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с числом клеток в отсутствие антитела или фрагмента), можно принять за основу при определении дозировки, достаточной для уменьшения числа CD43-положительных клеток, необходимого in vivo. Помимо этого, данная дозировка может быть определена с учетом таких факторов, как масса тела пациента, объем крови, скорость клиренса и так далее.
«Субъект или пациент», как использовано в данном описании, может быть выбран из животных, в том числе млекопитающих, подобным человеку, горилле, шимпанзе и так далее, или может представлять собой клетку, ткань, жидкость организма, выделенную из животных, или их культуры. Млекопитающие могут включать человека. Изобретение, изложенное в данном описании, может быть применено в области медицины или ветеринарии для специфичного направленного воздействия на CD43-положительные клетки, и оно имеет содержание, ясно понимаемое специалистом в данной области техники. Как правило, термин «животное» используют для совместного определения не только приматов, подобных человеку, обезьяне и так далее, но также домашних питомцев и домашних животных, подобных корове, лошади, овце, свинье, верблюду, козе, ослу, собаке, кошке и так далее, и лабораторных животных, подобных мыши, крысе и так далее. В отношении лошади, лошадь представляет собой используемую в отрасли разведения скаковых лошадей, а также в индустрии развлечений или разведения домашних животных.
В случае необходимости, способ, предложенный в данном изобретении, может дополнительно включать использование второго терапевтического средства (например, терапевтического агента). Например, при необходимости способ по настоящему изобретению может включать введение субъекту другого химиотерапевтического соединения (второго активного ингредиента). Введение второго активного ингредиента может быть осуществлено одновременно с введением антитела или антигенсвязывающего фрагмента, предложенного в данном изобретении, или может быть осуществлено в любом порядке (до или после введения антитела и так далее).
Согласно другому аспекту данного изобретения предложены: применение для лечения рака; получение противоракового средства; ингибирование раковой стволовой клетки; и/или получение агента для ингибирования раковой стволовой клетки на основе антитела к CD43 или антигенсвязывающего фрагмента.
В отношении фармацевтической композиции, способа и применения, описанных в данной заявке, рак может представлять собой солидный рак или гематопоэтический рак и может представлять собой первичный рак или метастазирующий рак. В одном из воплощений рак может представлять собой гематологическое злокачественное заболевание. Гематологическим злокачественным заболеванием может быть острый миелоидный лейкоз, острый лимфобластный лейкоз, острый моноцитарный лейкоз или лимфома Ходжкина, но этим не ограничиваться. Гематологическое злокачественное заболевание может представлять собой рак с включением раковых стволовых клеток.
В другом воплощении рак может представлять собой солидный рак. Солидный рак может представлять собой одну или более разновидностей, выбранных из группы, состоящей из рака легкого (например, плоскоклеточной карциномы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточной карциномы легкого), перитонеального рака, рака кожи, меланомы кожи или глазного яблока, рака прямой кишки, раковой опухоли возле анального отверстия, рака пищевода, рака тонкой кишки, рака эндокринных желез, рака паращитовидной железы, рака надпочечников, саркомы мягких тканей, рака уретры, рака желудочно-кишечного тракта, рака желудка, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичника, рака печени, рака желчного пузыря, рака мочевого пузыря, рака молочной железы, рака толстой кишки, рака толстого кишечника, рака матки, рака эндометрия, рака шейки матки, рака слюнных желез, рака почки, рака предстательной железы, рака вульвы, рака щитовидной железы, рака головы и шеи, рака головного мозга, остеосаркомы и так далее, но этим не ограничиваться. Например, солидный рак может представлять собой рак желудка, рак молочной железы, рак легкого, рак толстого кишечника, рак печени, рак желчного пузыря, рак почки, рак поджелудочной железы, рак щитовидной железы, рак яичника, рак шейки матки, рак предстательной железы или рак мочевого пузыря. Такой рак включает не только первичный рак, но также метастазирующий рак. Кроме того, солидный рак может представлять собой рак, обладающий устойчивостью к традиционным противораковым средствам (например, низкомолекулярному противораковому средству (противораковому химическому средству), антиметаболиту, алкилирующему агенту, антибиотикам, алкалоиду барвинка, ферменту, гормону, терапевтическому агенту с направленным действием и/или терапевтическому агенту на основе антител и так далее), и может представлять собой рак, рецидивирующий после лечения традиционными противораковыми средствами (например, низкомолекулярным противораковым средством (противораковым химическим средством), антиметаболитом, алкилирующим агентом, антибиотиками, алкалоидом барвинка, ферментом, гормоном, терапевтическим агентом с направленным действием и/или терапевтическим агентом на основе антител и так далее). Солидный рак может представлять собой рак с включением раковых стволовых клеток.
Эффект лечения солидного рака включает не только ингибирование роста (уменьшение количества) и апоптоз раковых клеток (в частности, раковых стволовых клеток) или пораженной раком ткани, содержащей такие клетки, но также ингибирующий эффект в отношении ухудшения ракового заболевания путем ингибирования миграции, инвазии, метастазирования и так далее.
Антитело к CD43 или его антигенсвязывающий фрагмент, предложенные в данном изобретении, можно вводить различными путями и можно вводить перорально или парентерально. Например, в качестве надлежащих примеров путей введения представляются внутривенная инъекция, интраартериальная инъекция, внутримышечная инъекция или инфузия и так далее, и в одном из воплощений введение может быть осуществлено путем внутривенной инъекции, но этим не ограничиваться.
В одном из воплощений на основе антитела к CD43 или его антигенсвязывающего фрагмента может быть приготовлена композиция в форме, подлежащей введению в том виде, как она есть, или вместе со вторым терапевтическим соединением (например, химиотерапевтическим соединением).
Согласно другому аспекту предложена фармацевтическая композиция, содержащая антитело к CD43 или его антигенсвязывающий фрагмент, предложенные в данном изобретении, и одно или более вспомогательных веществ, выбранных из группы, состоящей из фармацевтически приемлемого носителя, разбавителя и эксципиента. В одном из воплощений антитело, содержащееся в фармацевтической композиции, может иметь форму, в которой цитотоксическое вещество находится в связанном или конъюгированном состоянии. Соответствующие фармацевтически приемлемые носитель, разбавитель и эксципиент хорошо известны специалисту в данной области техники, и в качестве примеров рассматриваются физиологический раствор, растворитель (например растворитель для инъекций), диспергирующая среда, противогрибковый и/или антимикробный агент, поверхностно-активное вещество, изотонический агент, адсорбирующее вещество и так далее, но этим не ограничиваются.
В одном из воплощений фармацевтическая композиция может быть приготовлена в виде различных форм, присущих композициям, например, в различных стандартных лекарственных формах, присущих инъекционной композиции, и так далее.
Приготовление и последующее введение фармацевтической композиции может быть выполнено в соответствии с традиционными методами в данной области техники. Введение зависит от состояния субъекта до лечения, реакционной способности лекарственного средства и так далее, но его необходимо продолжать, если желаемый эффект прекратился. Дозировка, способ введения и частота повторного введения фармацевтической композиции могут быть определены с учетом возраста, пола, тяжести заболевания, реакционной способности лекарственного средства и так далее, и это считается очевидным для специалиста в данной области техники.
В другом воплощении предложен способ получения антитела к CD43 или его антигенсвязывающего фрагмента. Способ получения может включать стадию экспрессирования молекулы нуклеиновой кислоты в клетке-хозяине. Стадия экспрессирования может включать стадию культивирования рекомбинантной клетки и произвольным образом может дополнительно включать стадию выделения и/или очистки антитела из полученных клеточных культур.
В одном из конкретных воплощений способ получения может включать:
стадию культивирования рекомбинантной клетки, трансформированной нуклеиновой кислотой, кодирующей антитело к CD43 или его антигенсвязывающий фрагмент, или рекомбинантным вектором, содержащим указанную нуклеиновую кислоту, в условиях и/или в течение периода времени, достаточных для осуществления экспрессии данной нуклеиновой кислоты; и
стадию выделения и/или очистки антитела к CD43 или его антигенсвязывающего фрагмента из культивируемых клеток или полученных культивируемых смесей.
Рекомбинантная клетка может быть получена путем трансформации клетки-хозяина нуклеиновой кислотой, кодирующей антитело к CD43 или его антигенсвязывающий фрагмент, или рекомбинантным вектором, содержащим указанную нуклеиновую кислоту.
В другом воплощении предложены очищенные антитело к CD43 или его антигенсвязывающий фрагмент, полученные со стадии выделения и/или очистки. Полученные антитело или антигенсвязывающий фрагмент могут представлять собой рекомбинантую молекулу, отделенную от других компонентов, с которыми она связана при экспрессии в клетке или секретируется во внеклеточное пространство. В одном из воплощений выделенные и/или очищенные антитело или антигенсвязывающий фрагмент могут иметь чистоту 50% или больше, 60% или больше, 70% или больше, 75% или больше, 80% или больше, 85% или больше, 90% или больше, 95% или больше, 96% или больше, 97% или больше, 98% или больше либо 99% или больше. Специалист в данной области техники может четко понимать, что степень выделения и/или очистки зависит от цели применения и/или формы применения антитела или антигенсвязывающего фрагмента. Например, когда предполагается введение животному, в частности, введение в организм человека, то может потребоваться относительно высокий уровень чистоты очищенного антитела или антигенсвязывающего фрагмента, а при использовании для экспериментов in vitro могут содержаться, в приемлемых количествах, примеси (например, компоненты, происходящие из клеток хозяина и/или культивируемых смесей (белок и так далее) и другие).
В другом воплощении предложена молекула нуклеиновой кислоты, кодирующая антитело к CD43 или его антигенсвязывающий фрагмент. В одном из конкретных воплощений нуклеиновая кислота может включать молекулу нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи (связывающий домен VH) антитела или антигенсвязывающего фрагмента, молекулу нуклеиновой кислоты, кодирующую вариабельную область легкой цепи (связывающий домен VL) или их комбинации. Молекула нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи, может содержать нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 5, 9, 13, 17, 21, 25 и 29. Молекула нуклеиновой кислоты, кодирующая вариабельную область легкой цепи, может содержать нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 7, 11, 15, 19, 23, 27 и 31.
Нуклеиновая кислота может содержаться в соответствующем экспрессирующем векторе. Экспрессирующим вектором могут быть все векторы, обычно используемые для экспрессии чужеродного гена в клетке-хозяине, и они могут быть проиллюстрированы, например, как рТТ5, рАРЕХ3р, pcDNA3.2(-) и так далее, но этим не ограничиваться.
В другом воплощении предложена рекомбинантная клетка, содержащая молекулу нуклеиновой кислоты, кодирующую антитело к CD43 или его антигенсвязывающий фрагмент, или рекомбинантный вектор, содержащий указанную молекулу (или экспрессирующий вектор). Рекомбинантную клетку получают путем введения молекулы нуклеиновой кислоты или рекомбинантного вектора в клетку-хозяин и в клетку, которая может экспрессировать молекулу нуклеиновой кислоты. В качестве примера клетки-хозяина можно назвать прокариотическую клетку (например, Е. coli и так далее) или клетку простейших и эукариотическую клетку, такую как клетка животного происхождения (например, клетка яичника китайского хомячка (СНО), COS, почки человеческого эмбриона HEK-293Е, HEK-293Т, клетка с модификацией по конкретному гену (например, клетка с делецией гена и так далее), растительную клетку, клетку грибов (например, Saccharomyces cerevisiae и так далее), клетку насекомых (например, клетку Sf9 (линию, выделенную из клеток Spodoptera frugiperda) и так далее), но этим не ограничиваться, и она может быть выбрана среди всех клеток, которые могут экспрессировать чужеродный ген.
В другом воплощении предложен способ детектирования CD43 или способ детектирования CD43-положительной клетки, включающий стадию приведения в контакт антитела к CD43 или его антигенсвязывающего фрагмента с клеточным образцом и стадию подтверждения того, имеет ли место в данном образце связывание антиген-антитело. С использованием этого способа может быть подтверждено, экспрессируется ли CD43 на клеточной поверхности в клеточном образце, и поэтому данный способ может быть применен для диагностики заболевания, обусловленного экспрессией CD43. Таким образом, в другом воплощении предложен способ диагностики CD43-ассоциированного заболевания или способ получения информации для диагностики CD43-ассоциированных заболеваний, включающий стадию приведения антитела к CD43 или его антигенсвязывающего фрагмента в контакт с клеточным образцом и стадию подтверждения того, имеет ли место в данном образце связывание антиген-антитело. CD43-ассоциированным заболеванием считается заболевание, связанное с присутствием CD43 или возрастанием количества CD43, и им может быть рак, и этот рак может представлять собой солидный рак или гематологическое злокачественное заболевание и, в частности, может представлять собой гематологическое злокачественное заболевание, связанное с возрастанием количества CD43 (например, острый лимфобластный лейкоз, острый миелоидный лейкоз). В другом конкретном воплощении CD43-ассоциированным заболеванием может быть рак с включением раковых стволовых клеток.
В данном способе связывание антиген-антитело может быть подтверждено путем детектирования того, образуется ли комплекс между антителом (или его антигенсвязывающим фрагментом) и белком CD43 (то есть, когда детектируется образование комплекса антитело-белок CD43, это подтверждает, что имеет место связывание антиген-антитело). Затем, для относительного сравнения, можно выполнить сравнение с результатом, полученным для тестируемого клеточного образца, посредством проведения того же эксперимента для контрольного клеточного образца. Контрольный клеточный образец может быть выбран из хорошо известной CD43-негативной клетки или нормальной клетки (нераковых или неопухолевых клеток).
В одном из воплощений способ детектирования или способ диагностирования может включать:
(1) стадию приведения в контакт антитела или антигенсвязывающего фрагмента с тестируемым клеточным образцом и контрольным клеточным образцом; и
(2) стадию определения факта образования комплекса между антителом или антигенсвязывающим фрагментом и данной клеткой, или его уровня. Затем, когда определено наличие комплекса в тестируемом клеточном образце или относительно высокий уровень образования комплекса по сравнению с контрольным клеточным образцом, тогда может быть подтвержден факт присутствия CD43 в тестируемом клеточном образце или что такая клетка представляет собой клетку, экспрессирующую CD43 (то есть, CD43-положительную клетку). Клеточный образец может быть выделен из живого организма, а способ может быть осуществлен in vitro.
В другом воплощении предложена композиция для детектирования или визуализации (индикации) CD43, содержащая антитело к CD43 или его антигенсвязывающий фрагмент. В другом воплощении предложен способ детектирования или визуализации (индикации) CD43 посредством использования антитела к CD43 или его антигенсвязывающего фрагмента. Композицию и способ можно применять для детектирования и/или визуализации CD43 in vivo, а также in vitro. Что касается композиции и способа, то антитело или антигенсвязывающий фрагмент могут быть в форме конъюгата с детектируемой меткой, и детектируемая метка может представлять собой, например, одну или более выбранных из группы, состоящей из радиоактивной метки (например, 3Н, 14С, 35S, 90Y, 99Тс, 111In, 125I, 131I, 177Lu, 166Но, 153Sm и так далее), фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки, химического вещества, подобного биотину, и так далее, но этим не ограничиваться, и может представлять собой все метки, детектируемые общепринятыми методами детектирования, хорошо известными в данной области техники. Как описано выше, детектирование и/или визуализацию CD43 in vitro и/или in vivo можно применять для диагностики заболеваний, связанных с возрастанием количества CD43-положительных клеток, например, раковых клеток, более конкретно, ракового или гематологического злокачественного заболевания с включением раковых стволовых клеток.
Способ детектирования и/или визуализации CD43 (in vivo) может включать следующее:
(1) стадию введения антитела к CD43 или его антигенсвязывающего фрагмента тестируемому субъекту; и
(2) стадию оценки образования комплекса антитела или антигенсвязывающего фрагмента или измерения степени (уровня) образования комплекса.
Такой комплекс может представлять собой комплекс антитела или его антигенсвязывающего фрагмента и CD43, экспрессируемого на поверхности клеток в организме тестируемого субъекта, или комплекс, образуемый в результате связывания антиген-антитело, осуществляемого между антителом или его антигенсвязывающим фрагментом и клетками, экспрессирующими CD43 (CD43-положительными клетками). Антитело или его антигенсвязывающий фрагмент можно использовать в форме конъюгата с вышеупомянутой детектируемой меткой. Для визуализации клетки, экспрессирующей CD43, например, раковой стволовой клетки, может быть применен конкретный метод визуализации.
Для факта образования комплекса на основе антитела или антигенсвязывающего фрагмента при введении субъекту или уровня образования можно провести относительную оценку путем сравнения, образуется ли такой комплекс у контрольного субъекта (например, субъекта, не имеющего CD43-ассоциированного заболевания, или субъекта, не содержащего клеток, (сверх)экспрессирующих CD43) или каков уровень его образования. Для проведения такого сравнения способ может включать
(1-1) стадию введения антитела к CD43 или его антигенсвязывающего фрагмента тестируемому субъекту и контрольному субъекту, соответственно;
(2-1) стадию определения факта образования комплекса на основе антитела или антигенсвязывающего фрагмента, или степени (уровня) его образования у тестируемого субъекта и контрольного субъекта, соответственно; и
(3) стадию сравнения результата измерения для тестируемого субъекта с результатом для контрольного субъекта.
Данный способ может быть применен для диагностики CD43-ассоциированных заболеваний у тестируемого субъекта или для подтверждения наличия (для детектирования) раковых стволовых клеток, экспрессирующих CD43. В случае, когда оценивают образование комплекса или возрастание уровня образования комплекса по сравнению с контрольным субъектом на стадии (2) или (2-1), тестируемый субъект может быть определен как пациент, имеющий CD43-ассоциированное заболевание, или может быть определено, что у тестируемого субъекта имеются раковые стволовые клетки.
Образование in vivo или in vitro комплекса антигена (или клетки, экспрессирующей антиген на поверхности) и антитела может быть оценено с использованием средств, общепризнанных в данной области техники, и эти общепризнанные средства очевидны специалисту в данной области техники. Например, присутствие такого комплекса может быть подтверждено посредством использования мечения антитела или антигенсвязывающего фрагмента соответствующей детектируемой меткой и измерения сигнала от этой метки или посредством надлежащих методов детектирования. Надлежащими методами детектирования могут быть все общепризнанные в данной области техники методы, и ими могут быть, например, ELISA, система проточной цитометрии (FACS), иммуногистохимическое окрашивание и так далее, но этим не ограничиваться.
Специалисту в данной области техники будет четко понятно, что могут быть выполнены дополнительные изменения и/или модификации в отношении изложенного в данном описании изобретения, отличающиеся от описанных выше. Следует понимать, что изложенное в данном описании изобретение включает все изменения и/или модификации в пределах описанных сущности и/или объема. Помимо этого, изложенное в данном описании изобретение может соответственно или полностью включать все стадии, характеристики, композиции и/или соединения, четко описанные или упомянутые в данном описании.
Конкретные воплощения будут описаны со ссылкой на следующее далее воплощение, но эти примеры разработаны только в целях иллюстрации и не ограничивают вышеупомянутый объем изобретения.
Следует понимать, что, нуклеотидные последовательности, разработанные и описанные в данной заявке, модифицированы хорошо известными в данной области техники методами, например, методом созревания аффинности или методом, основанном на ослаблении иммуногенности и повышении связывающей способности посредством предсказания и удаления мотива для связывания с МНС (главный комплекс гистосовместимости) класса 2. Полезность терапевтического агента на основе нуклеотидных последовательностей, разработанных и описанных в данной заявке, можно повысить, регулируя функциональные свойства посредством изменения антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC), полупериода существования в сыворотке крови, изотипа, связывания с Fc-рецептором или комбинации этих действий. Эти изменения могут быть выполнены методами белковой инженерии, конструирования гликан-содержащей части или химическими методами. В соответствии с необходимым применением терапевтического агента предпочтение может быть отдано повышению или снижению этих активностей.
В данной области техники известны многочисленные методы созревания аффинности антител. Большинство из них основаны на общей стратегии получения библиотеки панели мутантов или модифицированного белка и скрининга и отбора с целью повышения аффинности. Зачастую мутагенез осуществляется на уровне дезоксирибонуклеиновой кислоты (ДНК), например, с использованием допускающей ошибки ПЦР (полимеразная цепная реакция), с использованием перетасовки генов, с использованием мутагенных химических реагентов или облучения, с использованием штаммов-«мутаторов» с механизмом допускающей ошибки репликации или с использованием подходов, связанных с соматической гипермутацией, в которых задействован механизм природного созревания аффинности. Кроме того, мутагенез может быть осуществлен на уровне РНК, например, с применением репликазы. Методы с применением библиотек, позволяющие отобрать улучшенные варианты белков, могут быть основаны на различных технологиях с применением дисплея, таких как фаговый дисплей, дрожжевой дисплей, рибосомный дисплей, дисплей с использованием клеток бактерий или млекопитающих, и они хорошо известны в данной области техники. Созревания аффинности можно достичь посредством применения более направленных/прогностических методов, например, путем сайт-специфического мутагенеза или синтеза генов, основанного на данных трехмерной структуры белка. Способы повышения ADCC или CDC известны специалистам в данной области техники.
Целый ряд способов модулирования полупериода существования в сыворотке крови и распределения антитела в живом организме изменяет взаимодействие между антителом и неонатальными Fc-рецепторами (FcRn), что играет важную роль в отношении предупреждения катаболизма IgG и поддержания высокой концентрации антитела в сыворотке крови. Например, можно упомянуть патенты США №№6277375, 6821505, 7083784, патент США №7217797 и заявку WO 2000/4207. Другой пример замены аминокислот в константных областях, регулирующей способность связывания с Fc-рецептором и опосредуемую этим рецептором функцию, такую как способность связывания с FcRn и полупериод существования в сыворотке крови, описан в заявках на патент США №№2009/0142340, 2009/0068175 и 2009/0092599.
Гликан, присоединенный к молекуле антитела, влияет на активность антитела, в том числе на полупериод существования в сыворотке крови, затрагивая взаимодействие Fc-рецептора и гликанового рецептора. В связи с этим, тип гликана, регулирующего активность антитела, может предоставлять преимущества с точки зрения терапевтического агента. Способ получения гликана регулируемого типа хорошо известен в данной области техники, но не ограничивается описанными в патентах США №№6602684, 7326681, 7388081 и заявке WO 2008/006554.
Для увеличения полупериода существования белка в сыворотке крови используют метод увеличения полупериода существования посредством добавления полиэтиленгликоля (ПЭГ).
Термин «% идентичности» используется в данном описании для описания ряда последовательностей. Очевидно, что термин «% идентичности» означает, что при сравнении двух последовательностей в пределах конкретного участка эти две последовательности имеют конкретное число идентичных остатков в одном и том же положении.
% идентичности одного полипептида по отношению к другому полипептиду можно определить, используя анализ GAP со штрафом за открытие разрыва (гэпа), составляющим 5, и штрафом за удлинение разрыва, составляющим 0,3. Запрашиваемая последовательность составлена по меньшей мере из 50 аминокислот, и с использованием анализа GAP выполняют выравнивание участка двух последовательностей, составленного по меньшей мере из 50 аминокислот. Более предпочтительно, длина запрашиваемой последовательности составляет по меньшей мере 100 аминокислот, и с использованием анализа GAP выполняют выравнивание участка двух последовательностей, составленного по меньшей мере из 100 аминокислот. Еще более предпочтительно, длина запрашиваемой последовательности составляет по меньшей мере 250 аминокислот, и с использованием анализа GAP выполняют выстраивание двух последовательностей на участке, составленном по меньшей мере из 250 аминокислот. Наиболее предпочтительно, с использованием анализа GAP выполняют выстраивание аминокислотной последовательности полной длины для двух рассматриваемых полипептидов.
В отношении определенного полипептида будет очевидно, что количественные показатели % идентичности, превышающие представленные, будут соответствовать предпочтительным воплощениям. Поэтому, если это возможно, то предпочтительно, чтобы с учетом по меньшей мере % идентичности полипептид содержал аминокислотную последовательность, относящуюся к последовательности с SEQ ID NO, имеющей идентичность аминокислотной последовательности, составляющую предпочтительно по меньшей мере 95% или больше, более предпочтительно по меньшей мере 97% или больше, еще более предпочтительно по меньшей мере 98% или больше, и еще более предпочтительно по меньшей мере 99% или больше, более предпочтительно по меньшей мере 99,1% или больше, более предпочтительно по меньшей мере 99,2% или больше, более предпочтительно по меньшей мере 99,3% или больше, более предпочтительно по меньшей мере 99,4% или больше, более предпочтительно по меньшей мере 99,5% или больше, более предпочтительно по меньшей мере 99,6% или больше, более предпочтительно по меньшей мере 99,7% или больше, более предпочтительно по меньшей мере 99,8% или больше, еще более предпочтительно по меньшей мере 99,9% или больше.
Описанная в данной заявке вариация аминокислотной и нуклеотидной последовательности может быть введена и получена благодаря изменению нуклеотидов в результате мутации нуклеиновой кислоты in vivo посредством химической или радиоактивной обработки. Пример этой мутации включает делецию, вставку или замену остатков в аминокислотной последовательности. Полинуклеотиды по изобретению могут быть подвергнуты методам перетасовки ДНК, которые описаны Harayama в 1998 г., или другим методам in vitro с целью получения измененных полинуклеотидов, кодирующих варианты полипептидов. В этом методе перетасовки ДНК можно применять последовательность гена, относящуюся к настоящему изобретению, такую как Rht-B1 из вида растений, отличающегося от пшеницы. Продукты, полученные исходя из мутантной/модифицированной ДНК, можно подвергнуть скринингу с использованием метода, изложенного в данном описании, с целью определения, обладают ли они, например, фенотипом избыточного роста. Например, делеция аминокислотной последовательности может включать делецию, обычно составляющую примерно 1-15 аминокислотных остатков, например, 1-10 аминокислотных остатков или 1-5 следующих друг за другом аминокислотных остатков.
Например, замена в аминокислотной последовательности может включать ситуацию, когда один или несколько аминокислотных остатков в полипептиде делетированы и в это положение встроены один или несколько аминокислотных остатков, отличающихся от первоначальных аминокислотных остатков.
Использованный в данном описании термин «содержат (содержит или содержащий)» можно использовать в качестве «открытого» значения (open type meaning), содержащего описанные компоненты, стадии, численные значения и так далее, и это не следует интерпретировать как намерение исключить компоненты, стадии, численные значения и так далее, отличающиеся от них, и в зависимости от обстоятельств он не может быть исключен, чтобы означать «состоящий по существу из».
Все литературные источники, упомянутые в данном описании, включены в данное описание в качестве ссылки.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителу, которое способно лечить раковые стволовые клетки, а также гематологическое злокачественное заболевание или солидный рак, и эпитопу, который распознается этим антителом, и антителу, распознающему этот эпитоп, или его антигенсвязывающему фрагменту, тем самым к более интенсивному и радикальному лечению рака и содействию разработке эффективных противораковых терапевтических агентов.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 представляет результат подтверждения экспрессии CD43 в линии клеток рака желудка человека NCI-N87 (слева) и AGS (справа) методом иммуноокрашивания (ось X: уровень экспрессии CD43; ось Y: подсчет количества клеток).
ФИГ. 2а-2с представляет результат подтверждения экспрессии CD43 в различных линиях клеток солидного рака методом иммуноокрашивания (2а: линия клеток рака желудка; 2b: линия клеток ректального рака; 2с: линия клеток рака печени).
ФИГ. 3 представляет результат подтверждения цитотоксичности конъюгата (антитело к CD43)-MMAE в отношении линий клеток рака желудка человека NCI-N87, SNU-719 и AGS.
ФИГ. 4 представляет результат подтверждения цитотоксичности конъюгата (антитело к CD43)-DM1 в отношении линий клеток рака желудка человека NCI-N87, SNU-719 и AGS.
ФИГ. 5 представляет результат подтверждения цитотоксичности конъюгата (антитело к СВ43)-дуокармицин в отношении линий клеток рака желудка человека NCI-N87 и AGS.
ФИГ. 6 представляет результат подтверждения противоракового эффекта самого антитела к CD43 (DNP001) и конъюгата (антитело к CD43)-дуокармицин (D-Duo) в животной модели рака желудка, в которой использована трансплантированная линия клеток рака желудка человека.
ФИГ. 7 представляет результат подтверждения экспрессии CD43 эпитопа в различных пораженных солидным раком тканях, происходящих из человека, иммуногистохимическим методом (М: медуллярное вещество, С: корковое вещество).
ФИГ. 8 представляет результат подтверждения экспрессии CD43 эпитопа, связанной с заболеванием различными видами солидного рака, имеющимися у человека, иммуногистохимическим методом (А: перстневидноклеточный рак (перстневидноклеточный рак желудка), В: инфильтрирующая протоковая аденокарцинома молочной железы, С: аденокарцинома поджелудочной железы, D: почечноклеточная карцинома почки, Е: аденокарцинома легкого, F: плоскоклеточная карцинома гортани, G: рак желчного пузыря, Н: плоскоклеточная карцинома шейки матки, I: плоскоклеточная карцинома матки, J: рак мочевого пузыря, K: плоскоклеточная карцинома легкого, L: гранулоцитарная саркома среднего уха).
ФИГ. 9 представляет результат подтверждения экспрессии CD43, CD44 и CD133 в раковых стволовых клетках из линии клеток рака желудка человека NCI-N87 методом иммуноокрашивания.
ФИГ. 10 представляет результат иммуногистохимического окрашивания тимусной ткани с использованием моноклонального антитела к CD43 (YG5).
ФИГ. 11 представляет график, полученный с применением системы проточной цитометрии при измерении реакционной способности моноклонального антитела к CD43 (YG5) в отношении тимусной клетки.
ФИГ. 12 представляет фигуру, схематично показывающую 11 разновидностей мутантов CD43 с делецией.
ФИГ. 13 представляет результат вестерн-блоттинга, подтвержающий реакционную способность моноклонального антитела к CD43 (YG5) в отношении 11 разновидностей мутантов CD43 с делецией.
ФИГ. 14 представляет схематичную диаграмму, иллюстративно показывающую способ получения плазмид, экспрессирующих тяжелую цепь и легкую цепь антитела к CD43.
ФИГ. 15 представляет график, показывающий способность антитела к CD43 связываться с эпитопом CD43 после обработки нейраминидазой нормальных клеток крови.
ФИГ. 16 представляет график, показывающий результат измерения перекрестной реактивности антител к CD43 в отношении рекомбинантных СЕАСАМ5 (родственная канцероэмбриональному антигену молекула 5 клеточной адгезии) и СЕАСАМ6.
ФИГ. 17 представляет график, показывающий степень экспрессии CD43 эпитопа в опухолевых стволовых клетках (опухолевых сферах).
ФИГ. 18 представляет график, показывающий цитотоксичность антитела к CD43 по отношению к клеткам СЕМ7 или CCRF-CEM (с низкой степенью экспрессии CD43 эпитопа) и показывает, что антитело к CD43 напрямую не обладает цитотоксичностью.
ФИГ. 19 представляет график, показывающий жизнеспособность клетки-мишени, обработанной антителом к JL-1 с присоединенным к нему токсином (антителом к JL-1, конъюгированным с сапорином), и демонстрирует, что под действием конъюгированного с сапорином антитела к JL-1 наблюдается апоптоз.
ФИГ. 20 представляет график, показывающий явление интернализации антител к JL-1 (антител к CD43) (обоих антител, и грызунов, и человека) в тесте на апоптоз, описанном на ФИГ. 19, и результат, полученный в анализе с применением устройства для проточной цитометрии. Для этого мышиными антителами к JL-1 обрабатывают клетки в холодильнике в течение 30 мин и переносят в условия 37°С, затем отбирают по 106 клеток в каждый момент времени, отмеченный на оси X графика, проводят обработку вторичными конъюгированными с РЕ антителами к IgG мыши при температуре холодильника в течение 10 мин и клетки промывают и фиксируют.
На ФИГ. 21 представлено изображение, показывающее явление гомотипической агрегации, индуцированной антителами к JL-1 в клетках, экспрессирующих антиген CD43. Изображение получают, делая снимки с использованием микроскопа в установленный момент времени после обработки 300000 клеток антителами к JI-1, соответственно, в исходной концентрации 40 мкг/мл и культивирования их в условиях 37°С и 5% CO2, и на ФИГ. 21 представлено изображение, полученное через 2 часа после обработки антителами.
ФИГ. 22 представляет результат, показывающий низкий уровень гетерогенной экспрессии антигена JL-1 в нормальных клетках костного мозга. Моноциты из обычного костного мозга окрашивают с использованием мышиных антител к JL-1, затем окрашивают с использованием антител козы к F(ab)2 IgG мыши, конъюгированных с РЕ, и исследуют. Наложение гистограмм представляет собой ограниченное число лимфоцитов.
На ФИГ. 23 показан уровень экспрессии антигена JL-1 в клетках периферической крови. Два образца нормальных РВМС (мононуклеарные клетки периферической крови) человека окрашивали с использованием антитела мыши к JL-1 человека (голубая линия: (d)) и наблюдали низкий уровень экспрессии антигена JL-1.
ФИГ. 24 представляет график, показывающий результат измерения уровня образования колоний субпопуляций клеток костного мозга в случае предварительной обработки нормальных клеток костного мозга связанными с сапорином антителами к IL-1 (JL1+) и в случае без обработки. Получено подтверждение, что образования колоний субпопуляций клеток костного мозга не происходит в случае предварительной обработки нормальных клеток костного мозга конъюгированными с сапорином антителами к JL-1. Данный результат получен посредством измерения после выделения костного мозга и сбора лейкоцитов и выделения и сбора CD34+ клеток путем классификации их на JL1-положительные и JL1-отрицательные и помещения собранных клеток в среду MethoCult с цитокином.
ФИГ. 25 представляет график, показывающий терапевтический эффект самого антитела к JL1 и конъюгированного с токсином антитела к JL1 в модели гетеротрансплантатов острого лимфоцитарного лейкоза (ALL), на ФИГ. 25А показан результат в модели лейкоза с использованием клеток СЕМ7, а на ФИГ. 25В показан результат в модели с использованием NALM-6 (клеточная линия: NALM6 (В-ALL (В-клеточный ALL))), соответственно. Тестирование проводили в следующих условиях: мыши: NOD-SCID (с тяжелым комбинированным иммунодефицитом и диабетом без ожирения) (8/группа); инокуляция: в 0-е сутки 107 клеток; введение: 15 мкг/инъекция + 100 мкг суммарного IgG, внутривенно (в.в.), 1х/неделя, начиная с 8-х суток; конечная точка: состояние паралича.
На ФИГ. 26 показан уровень экспрессии JL-1 в бластных клетках и субпопуляциях при выраженном AML (острый миелоидный лейкоз).
ФИГ. 27 представляет график, показывающий апоптотический эффект под действием химерного гуманизированного JL-1 (ADCC и CDC), а ФИГ. 27А представляет результат оценки цитотоксичности с использованием CellTiterGlo. Клеточную линию СЕМ7 культивировали вместе с эффекторными клетками (РВМС) и затем добавляли химерные антитела к JL-1 или контрольные антитела. ФИГ. 27В представляет результат оценки цитотоксичности путем использования CellTiterGlo. Клеточную линию СЕМ7 культивировали в культуральной среде и добавляли химерные антитела к JL1 вместе с комплементом кролика. В контрольной группе используют антитела IgG1 изотипа, являющиеся нерелевантными для данного эксперимента.
ФИГ. 28 представляет результат, показывающий, что ADCC активность химерного антитела к JL-1 возрастает при дефукозилировании.
ФИГ. 29 представляет график, показывающий эффект, оказываемый неконъюгированным химерным антителом в клеточной линии СЕМ7 in vivo.
ФИГ. 30 представляет результат, показывающий экспрессию JL1 в субпопуляции лейкозных стволовых клеток (LSC).
ФИГ. 31 представляет график, показывающий результат анализа образования колоний in vitro (среднее число колоний) под действием антител к JL1, конъюгированных с токсином (сапорином: SAP) (ССС), и он демонстрирует усиление апоптотического эффекта в отношении антиген-положительных клеток в случае AML. Данные клетки помещали на панель колоний стволовых клеток вместе с конъюгатами JL1-сапорин или (IgG1 мыши)-сапорин и наблюдали образование колоний.
ФИГ. 32 представляет график, показывающий тот эффект, что антитело к JL1, конъюгированное с токсином (сапорином: SAP) (ССС), влияет на прогрессирование in vitro антиген-положительного выраженного AML.
ФИГ. 33 представляет график, показывающий ингибирующий эффект в отношении роста раковых клеток при выраженном AML под действием антитела, связанного с токсином, на мышах NSG (мышах NOD/SCID с дефицитом общей гамма-цепи) (in vitro). У пациента с JL-1+ AML отбирали 5×107 костномозговых клеток и вводили внутривенной инъекцией 30 облученным мышам NSG. Через 8 недель мышам каждую неделю вводили в дозе 45 мкг JL1-дебуганин (DB), hIgG1-DB или PBS (забуференный фосфатом физиологический раствор), извлекали костный мозг и селезенку, подвергали пересадке и наблюдали за образованием опухолей.
На ФИГ. 34 и ФИГ. 35 показаны результаты, подтверждающие, что различные гуманизированные/оптимизированные модифицированные антитела демонстрируют одинаковый профиль связывания по сравнению с исходным (мышиным) антителом к JL-1. Для наблюдения проводили окрашивание клеток СЕМ7 с использованием родительского исходного антитела к JL-1 или 3-х разновидностей антител, модифицированных посредством гуманизации. В результате ФИГ. 34 указывает на то, что модифицированный «Combo А» показал самый лучший профиль, а все другие тестируемые антитела показали значительный уровень цитотоксичности в клетках СЕМ7. На ФИГ. 35 показан результат анализа интернализации и цитотоксичности для 3-х конечных модифицированных антител, и цитотоксичность оценивали на 3-й сутки после смешивания с антителами или конъюгатами (антитело к IgG человека)-сапорин.
На ФИГ. 36 показаны результаты выстраивания аминокислотных последовательностей самых лучших клонов из 2 раунда и 3 раунда, которые представляют собой сравнение аминокислотных последовательностей родительского клона и более гуманизированного клона, соответственно. Среди них, 153-28 происходит из 36-10 Q6R, а 257-10 происходит из 45-37. CDR представлены жирным и подчеркнутым шрифтами.
ФИГ. 37а представляет график, показывающий с использованием проточной цитометрии уровень связывания основного кандидата ART140 с IgG в JL1-положительных СЕМ7 клетках, а ФИГ. 37b представляет график, показывающий результат в группе отрицательного контроля, в U937 клетках.
ФИГ. 38а представляет график, показывающий уровень связывания основного кандидата с IgG в JL1-положительных СЕМ7 клетках с использованием клеточного ELISA (живых клеток в суспензии), а ФИГ. 38b представляет график, показывающий результат в группе отрицательного контроля, в U937 клетках.
ФИГ. 39а представляет график, показывающий уровень связывания группы основных кандидатов и IgG, имеющих мутации, внесенные с применением набора QuikChange, с JL1-положительными СЕМ клетками с использованием проточной цитометрии, а ФИГ. 39b представляет график, показывающий результат в группе отрицательного контроля, в U937 клетках.
ФИГ. 40а-40с представляют графики, показывающие уровень связывания IgG, имеющего мутации, внесенные с применением набора QuikChange, с JL1-положительными СЕМ клетками с использованием проточной цитометрии.
ФИГ. 41а-41с представляют графики, показывающие результат подтверждения того, что IgG, имеющий мутации, внесенные с применением набора QuikChange, связывается с JL1 -положительными СЕМ7 клетками с использованием клеточного ELISA (живых клеток в суспензии).
ФИГ. 42 представляет график, показывающий активность химерного антитела DNP001 в отношении связывания с эпитопом.
На ФИГ. 43 иллюстративно показаны аминокислоты гликан-содержащего участка в вариабельной области легкой цепи, где должна быть произведена замена с целью получения антитела с вариацией, в котором аминокислотные остатки гликан-содержащего участка гуманизированного антитела делетированы.
На ФИГ. 44 показан результат вестерн-блоттинга вариантов с использованием связывания конъюгата (конкавалин A)-HRP (пероксидаза хрена) с гликан-содержащим участком для антитела с вариацией, в котором аминокислотные остатки гликан-содержащего участка гуманизированного антитела делетированы.
ФИГ. 45 представляет график, показывающий связывающую способность антитела с вариацией, в котором аминокислотные остатки гликан-содержащего участка гуманизированного антитела делетированы.
ФИГ. 46 представляет график, показывающий способность химерного антитела к CD43 и гуманизированного антитела к CD43, в которых аминокислотные остатки гликан-содержащего участка делетированы, связываться с антиген(CD43)-положительной клеткой, СЕМ7 клеткой.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ
Далее настоящее изобретение будет описано более подробно на примерах, но эти примеры приводятся только для иллюстративной цели и не предназначены для ограничения объема данного изобретения. Специалисту в данной области техники очевидно, что описанные ниже примеры могут быть модифицированы без отклонения от сущности изобретения.
Пример 1. Получение антител к CD43
1-1. Получение мышиных антител
1-1-1. Получение клеток, продуцирующих моноклональные антитела
Данные клетки получали посредством слияния спленоцитов белой мыши Balb/c, в которую вводили тимоциты человека в качестве антигена, и клеточной линии миеломы SP2/0-Ag14 (АТСС (Американская коллекция типовых культур), CRL-1581) из устойчивой к 8-азагуанину мыши.
Тимоциты человека (госпиталь Сеульского Национального университета) в количестве 107 клеток вводили внутрибрюшинной инъекцией белой мыши Balb/c один раз в 2 недели в течение 6 недель для индуцирования иммунного ответа и через 3 суток после последнего дополнительного введения селезенку извлекали для приготовления клеточной суспензии. Слияние клеток в количестве 108 спленоцитов и 107 клеток миеломы проводили согласно методу Koeler & Milstein (1975), используя полиэтиленгликоль 400. После проведения слияния клетки промывали и затем суспендировали в культуральном растворе на основе DMEM (модифицированная по Дульбекко среда Игла), дополненном 100 мкМ гипоксантином, 0,44 мкМ аминоптерином и 16 мкМ тимидином (в культуральном растворе HAT (гипоксантин, аминоптерин, тимидин)), в 96-луночный планшет вносили аликвоты суспензии клеток и культивировали в культуральной среде, в которой поддерживали 37°C, 5% CO2.
Когда через 2 недели наблюдали образование колоний, собирали супернатант и измеряли титр антител с использованием иммуногистохимического окрашивания и проточной цитометрии.
Положительная группа соответствовала случаю, когда в одной лунке образовывалось 105 или более клеток. Собирали клетки с высоким титром моноклональных антител, отбирая клетки из тех лунок, в которых образовывались колонии с высоким титром антител в супернатанте, и субклонировали в соответствии с методом предельного разведения. Для проведения последующих экспериментов отбирали и хранили супернатант из культивируемой суспензии клеток, продуцирующих моноклональные антитела.
1-1-2. Скрининг клеток, продуцирующих моноклональные антитела к белкам клеточной поверхности тимоцитов
Перед использованием готовили срезы замороженных образцов тканей тимуса (госпиталь Сеульского Национального университета) и залитых парафином образцов тканей (госпиталь Сеульского Национального университета) толщиной 4 микрометра.
После проведения процесса удаления парафина и последующего добавления нормальной сыворотки крови козы (продукта компании BioGenex) залитые парафином образцы тканей оставляли стоять в течение 1 ч при комнатной температуре. После добавления каждого из первичных антител (Dinona) к образцам тканей и последующего их выдерживания в холодной камере при 4°C в течение ночи для осуществления взаимодействия на следующий день их промывали 3 раза забуференным фосфатом физиологическим раствором. Их инкубировали в течение 1 ч при комнатной температуре с биотинилированными антителами козы к иммуноглобулину мыши (2 капли, DAKO) в качестве вторичного антитела, затем промывали 3 раза забуференным фосфатом физиологическим раствором и обрабатывали конъюгатом стрептавидин-HRP. После добавления раствора Н2О2-аминоэтилкарбазола (20 мин) их промывали 3 раза забуференным фосфатом физиологическим раствором и развитие окраски наблюдали с использованием оптического микроскопа.
В результате этого оказалось возможным отобрать клеточную линию H-JL1, продуцирующую моноклональные антитела, которые специфически взаимодействуют только с тимоцитами человека. Полученная клеточная линия была передана в Корейский исследовательский фонд клеточных линий (KCLRF), расположенный по адресу Yeongeon-dong, Jongno-gu, Сеул, Корея, 13 января 1997 года, и ей присвоен номер доступа KCLRF-ВР-00010.
Проводили иммуногистохимическое окрашивание образцов тканей тимуса, используя супернатант отобранной клеточной линии, продуцирующей моноклональные антитела, и получили подтверждение тому, что тимоциты окрашивались положительно (ФИГ. 10). Помимо этого положительно окрашенные тимоциты демонстрировали свойство сильно окрашиваться на периферии клетки, и тем самым было продемонстрировано, что данная клеточная линия продуцировала моноклональные антитела к белку клеточной поверхности.
Чтобы подтвердить реакцию антитела на стадиях развития тимоцитов, применяли проточную цитометрию. Образец тимуса человека, извлеченный при операции на сердце, разрезали на небольшие фрагменты, растирали с использованием предметного стекла и собирали тимоциты. После взаимодействия антител (1*105 клеток/антитело в концентрации 10 мкг/мл) в течение 30 мин при 4°C с выделенными тимоцитами выполняли промывку холодным забуференным фосфатом физиологическим раствором и проводили взаимодействие с FITC (флуоресцеинизотиоцианат)-связанными антителами козы к иммуноглобулину мыши (Jackson ImmunoResearch) в течение 30 мин при 4°C.
Далее выполняли промывку холодным забуференным фосфатом физиологическим раствором, добавляли РЕ(фикоэритрин)-связанные антитела к CD8 (BD Bioscience) и АРС-связанные антитела к CD4 (BD Bioscience), и те и другие по 5 мкл, и проводили взаимодействие в течение 30 мин при 4°C. Выполняли промывку холодным забуференным фосфатом физиологическим раствором и проводили проточную цитометрию, используя FACSCalibur (Becton Dickinson, Mountain View, CA). Тимоциты классифицировали на CD4-CD8- тимоциты →CD4+CD8+тимоциты→CD4+CD8- или CD4-CD8+ тимоциты в зависимости от показателя экспрессии CD4 и CD8, и данные антитела взаимодействовали со всеми 4 разновидностями тимоцитов, но особенно сильно они взаимодействовали с CD4+CD8+ тимоцитами (см. ФИГ. 11). Серая область на ФИГ. 11 относится к группе с отрицательным контролем, а площадь, ограниченная сплошной линией, относится к графику, отражающему окрашивание с использованием отобранных антител.
1-1-3. Получение моноклональных антител из отобранной клеточной линии, продуцирующей моноклональные антитела
Мышам Balb/c заранее за 3 недели вводили внутрибрюшинной инъекцией 0,5 мл пристана; 107 клеток, продуцирующих моноклональные антитела культивировали в среде DMEM, содержащей 10% фетальной телячьей сыворотки, вводили этим мышам в брюшную полость, а затем через 2-3 недели проводили отбор мышей hydrops abdominis. Из hydrops abdominis получали антитела в высокой концентрации 5-10 мг/мл.
Для очистки антител из hydrops abdominis проводили хроматографию на Q-сефарозе (продукте Pharmacia) и гидроксиапатите (Bio-gel НТР Gel, продукте Pharmacia). Добавляли 3,14 г сульфата аммония ((NH4)2SO4) на 10 мл hydrops abdominis и медленно растворяли на льду (осаждение 50%-ным (NH4)2SO4). Эту смесь центрифугировали при 15000 об/мин в течение 30 мин, осадок растворяли в деионизованной воде и затем диализовали против 1 л буферного раствора (20 мМ фосфата, рН 7,4).
Этот раствор пропускали через колонку с Q-сефарозой, предварительно уравновешенной буферным раствором (20 мМ фосфатом, рН 7,4), выполняя адсорбцию, затем пропускали раствор NaCl с линейным градиентом концентрации от 0 М до 0,8 М, используя буферный раствор I (20 мМ фосфат, рН 7,4) и буферный раствор II (20 мМ фосфат; 0,5 М NaCl, рН 7,4), и получали элюаты. Каждая собранная фракция представляла собой фракцию, содержащую большое количество антител по данным 15% SDS-PAGE (электрофорез в 15%-ном полиакриламидном геле в присутствии додецилсульфата натрия). Фракции диализовали против буферного раствора (20 мМ фосфата, рН 6,8), адсорбировали, пропуская через колонку с гидроксиапатитом, предварительно уравновешенным буферным раствором (20 мМ фосфатом, рН 6,8), и затем пропускали раствор фосфата с линейным градиентом концентрации от 0 М до 0,3 М, используя буферный раствор III (20 мМ фосфат, рН 6,8) и буферный раствор IV (300 мМ фосфат, рН 6,8), и получали элюаты. Собирали только фракции, содержащие антитела с чистотой 95% или больше по данным 15% SDS-PAGE. В результате данного эксперимента можно было собрать 5-10 мг моноклональных антител из расчета на 1 мл hydrops abdominis.
Полученное антитело обозначили как YG5.
1-1-4. Анализ эпитопа CD43
Конструирование структуры, содержащей частичный фрагмент CD43
Как показано на ФИГ. 12, конструировали каждый из делеционных мутантов CD43, тестировали реакционную способность антитела YG5 в отношении таких делеционных мутантов и проводили анализ в отношении эпитопа CD43. Белок CD43 (№ доступа в NCBI М61827.1) состоял в общей сложности из 400 аминокислот, и последовательность аминокислот от №1 до №19 представляла собой сигнальную последовательность, последовательность аминокислот от №20 до №254 представляла собой внеклеточный домен, последовательность аминокислот от №255 до №277 представляла собой трансмембранный домен, а последовательность аминокислот от №278 до №400 представляла собой внутриклеточный домен.
После конструирования структуры ДНК, в которой каждый делеционный мутант экспрессировался на С-конце глутатион-S-трансферазы (GST), ее встраивали в вектор pGEX-2T (Pharmacia Biotech Inc., Piscataway, NJ). Далее, вектору, содержащему последовательность, соответствующую аминокислотам от №1 до №253 в белке CD43, дали название pGEX1-253, вектору, содержащему последовательность, соответствующую аминокислотам от №1 до №87, дали название pGEX1-87, вектору, содержащему последовательность, соответствующую аминокислотам от №1 до №81 в белке CD43, дали название pGEX1-81, вектору, содержащему последовательность, соответствующую аминокислотам от №11 до №75 в белке CD43, дали название GEX1-75, вектору, содержащему последовательность, соответствующую аминокислотам от №1 до №70 белка CD43, дали название pGEX1-70, вектору, содержащему последовательность, соответствующую аминокислотам от №70 до №98 в белке CD43, дали название pGEX70-98, и векторам pGEX71-81, pGEX76-81, pGEX73-81 и pGEX73-80 дали названия по тому же принципу, что и выше.
Последовательность, кодирующую делеционный мутант, амплифицировали на основе кДНК CD43 человека, ПЦР праймеры конструировали на основе последовательности из Genebank и вводили сайты для ферментов рестрикции BamHI/EcoRI или BamHI/BglII. Продукты ПЦР «разрезали», используя BamHI/EcoRI или BamHI/BglII, встраивали в pGEX-2T по тому же самому сайту для фермента рестрикции и затем осуществляли трансформацию компетентных клеток Е. coli TOP10F' (F' [lacIq, Tn10(TetR)], mcrA, D(mrr-hsdRMS-mcrBC), 80lacZDM15, lacX74, deoR, recA1, araD139 D(ara-leu)7697, galK, rpsL(StrR), endA1, nupG). Последовательность трансформантов анализировали, вновь подтверждая тем самым последовательность делеционных мутантов.
Экспрессия слитого белка GST-делеционный мутант CD43
Трансформированные клетки Е. coli ТОР10 культивировали при 37°C в лизогенной среде (LB), в которую добавляли ампициллин в концентрации 50 мкг/мл, в течение ночи, культивируемые клетки разбавляли в 20 раз средой LB и затем их культивировали в течение 3-4 часов до достижения OD (оптическая плотность) 0,6. В культивируемые смеси добавляли IPTG (изопропилтиогалактозид) (Sigma Chemical Co., St. Louis, МО) в конечной концентрации 1 мМ, проводили их культивирование в течение еще 4 часов и затем центрифугирование при 6000 об/мин в течение 15 мин. После сбора клеток только в клетки, которые суспендировали с 3 мл буферного раствора для лизиса (50 мМ трис, рН 8,0; 1 мМ EDTA (этилендиаминтетрауксусная кислота), 100 мМ NaCl) из расчета на 1 г клеток, добавляли фенилметилсульфонилфторид в конечной концентрации 0,2 мМ (Sigma Chemical Co.) и затем помещали на лед на 30 мин.
Анализ эпитопа CD43
После того как лизаты каждого из трансформантов, экспрессирующих в общей сложности 11 разновидностей делеционных мутантов, были подвергнуты 10% SDS-PAGE, проводили вестерн-блоттинг с использованием антитела YG5 и антитела к GST, соответственно.
ФИГ. 13 представляет результаты вестерн-блоттинга, подтверждающие реакционную способность антитела YG5 в отношении 11 разновидностей делеционных мутантов, где А относится к случаю использования антитела YG5, а В относится к случаю использования антитела к GST. Помимо этого, дорожка 1 соответствовала pGEX1-253, дорожка 2 соответствовала pGEX1-98, дорожка 3 соответствовала pGEX1-87, дорожка 4 соответствовала pGEX1-81, дорожка 5 соответствовала pGEX1-75, дорожка 6 соответствовала pGEX1-70, дорожка 7 соответствовала pGEX70-98, дорожка 8 соответствовала pGEX71-81, дорожка 9 соответствовала pGEX73-81, дорожка 10 соответствовала pGEX76-81, дорожка 11 соответствовала pGEX73-80, дорожка 12 соответствовала pGEX-2T, и дорожка 13 соответствовала тимоцитам человека. Как показано на ФИГ. 13, минимальной единицей делеционного мутанта, обладающего реакционной способностью в отношении антитела YG5, является pGEX73-81, и тем самым было продемонстрировано, что антигенная детерминанта CD43 представляла собой последовательность аминокислот от №73 до №81 (Glu Gly Ser Pro Leu Trp Thr Ser Ile; SEQ ID NO: 4).
В итоге, в данных примерах продемонстрировано, что YG5 непосредственно распознавало последовательность аминокислот от №73 до №81, но не углеводный компонент гликопротеина CD43, что отличается от других традиционных антител. Эта последовательность экспонирована главным образом в клетках-предшественниках лимфоцитов и в тимоцитах на стадиях развития гемобластов, и поэтому антитело YG5 распознавало ее, и она экранируется в результате гликозилирования или структурных изменений вблизи последовательности аминокислот от №73 до №81 в гематопоэтических стволовых клетках, но не в зрелых лейкоцитах и тромбоцитах, и поэтому в этих случаях антитело YG5 не могло распознавать ее.
1-2. Получение химерных антител
На основании аминокислотной последовательности сконструированного анти-CD43 мышиного антитела YG5 получали химерное антитело к CD43.
1-2-1. Получение плазмид
Чтобы осуществить экспрессию химерных антител к CD43, создавали плазмиду для экспрессии тяжелой цепи и экспрессии легкой цепи, соответственно. В качестве плазмиды для экспрессии тяжелой цепи использовали вектор pOptiVEC (компании Invitrogen), а в качестве плазмиды для экспрессии легкой цепи использовали вектор pcDNA3.3 (компании Invitrogen). Чтобы осуществить экспрессию антител, клонировали кДНК, кодирующую вариабельные области тяжелой цепи и легкой цепи, используя наборы Ig-Primer (компании Novagen), встраивали ее в вектор pGem-T (компании Promega) и затем подтверждали последовательность ДНК путем секвенирования, а последовательность гена мышиного антитела подтверждали, используя сайт IMGT (Иммуногенетика) (www.imgt.org).
Чтобы осуществить экспрессию кДНК, кодирующей вариабельную область, и кДНК, кодирующей константную область, для каждого антитела в виде последовательности следующих друг за другом аминокислот без вставки дополнительной аминокислоты, синтезировали (Bioneer Inc.) фрагменты гена, в которые входили последовательность, кодирующая клонированную вариабельную область, соединенную с известной константной областью (тяжелой цепи), и последовательность, кодирующая каппа-константную область (легкой цепи) IgG1 человека, соответственно. Затем гены, экспрессирующие тяжелую цепь и легкую цепь, синтезированные как указано выше, «разрезали», используя ферменты рестрикции Xho I и Sal I, фрагмент гена тяжелой цепи лигировали в вектор pOptiVec, а фрагмент гена легкой цепи лигировали в вектор pcDNA3.3, соответственно, конструируя тем самым полную плазмиду для экспрессии антитела (плазмиду pcDNA3.3 для экспрессии легкой цепи антитела к CD43 и плазмиду pOptiVEC для экспрессии тяжелой цепи антитела к CD43). Способ конструирования плазмид для экспрессии тяжелой цепи и легкой цепи схематично показан на ФИГ. 14.
2-1-2. Трансформация
Процесс трансформации осуществляли посредством трансфекции плазмиды pcDNA3.3, сконструированной для экспрессии легкой цепи антитела к CD43, и плазмиды pOptiVEC, сконструированной для экспрессии тяжелой цепи антитела к CD43, в клетки DG44 (Invitrogen), имеющие происхождение из СНО.
Сначала, за 3 суток до осуществления трансфекции, суспендированные клетки DG44 адаптировали к среде МЕМα (минимальная поддерживающая среда в альфа-модификации), содержащей 5% FBS (фетальная телячья сыворотка), тем самым превращая их в адсорбированные клетки, адаптированные для повышения эффективности трансфекции. Трансфекцию проводили в 6-луночном планшете, используя реагент для трансфекции Effectene (компании QIAGEN). Адаптированные клетки DG44 пересевали в количестве 1×105 клеток/лунка за одни сутки до проведения трансфекции и использовали одно и то же количество ДНК, составляющее 2 мкг, в случае как плазмиды pcDNA3.3 для экспрессии легкой цепи антитела к CD43, так и плазмиды pOptiVEC для экспрессии тяжелой цепи антитела к CD43. Трансфекцию проводили в течение 48 часов. Для отбора группы трансфицированных клеток использовали проточный цитометр и проводили иммуноферментный твердофазный анализ (ELISA), в результате были отобраны два клона Е №4, Е №5. Отобранную группу клеток культивировали в селективной среде МЕМα, содержащей 5% диализованной фетальной телячьей сыворотки, 30 нМ метотрексат (МТХ) и G418 (генетицин) в концентрации 400 мкг/мл, и концентрацию МТХ и G418 постепенно повышали для отбора группы трансформированных клеток.
2-1-3. Культура трансформированных клеток и очистка антител
Отобранную выше группу трансфицированных клеток (24,0×105 клеток/мл или больше, жизнеспособность (%) 90% или больше) культивировали до достижения уровня экспрессии 600 мг/л (в соответствии со стандартом IPC (контроль в ходе технологического процесса)) в среде PowerCHO-2 CDM (Lonza; конечное количество среды 880 л) в условиях 37°C и 5% CO2.
По окончании процесса осветления суспензии клеток (с использованием POD фильтра (1,1/0,2 мкм)) после сбора 800 л культивируемого раствора, полученного как приведено выше, антитела очищали, применяя 3-стадийный процесс с использованием колонок (для аффинной хроматографии на иммобилизованном белке А (неподвижная фаза: белок А; уравновешивающий буферный раствор: 50 мМ фосфат натрия, 50 мМ хлорид натрия, рН 7,5, элюирующий буферный раствор: 20 мМ цитрат натрия, рН 3,0); для катионообменной хроматографии (неподвижная фаза: SP FF (сульфопропилсефароза быстрого протекания); уравновешивающий буферный раствор: 20 мМ цитрат натрия, рН 5,5; элюирующий буферный раствор: 20 мМ цитрат натрия, 150 мМ, хлорид натрия, рН 6,1); для анионообменной хроматографии (неподвижная фаза: Q FF (Q Сефароза FF), уравновешивающий буферный раствор: 20 мМ цитрат натрия, рН 6,5)).
Условия хроматографии приведены ниже:
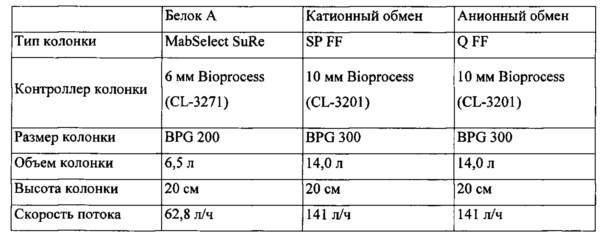
Состав конечной неочищенной жидкости окончательно устанавливали, выполняя одновременного процессы смены буфера и концентрирования методом ультрафильтрации/диафильтрации (UF/DF), и конечную концентрацию белка доводили до 11,5 мг/мл.
Химерное антитело к CD43 получали описанным выше способом и обозначили его как DNP001.
2-1-4. Подтверждение способности химерного антитела связываться с эпитоп-содержащим участком
Для подтверждения того, что полученное химерное антитело DNP001 (имеющее тот же участок CDR, что и мышиное антитело) связывается с тем же эпитопом, что и мышиное антитело, синтезированный содержащий эпитоп пептид объединяли химическим путем с белком бычьим сывороточным альбумином (BSA) и затем проводили ELISA.
- последовательность содержащего эпитоп синтетического пептида (обозначенного как DN2):
EGSPLWTSIGASTGSC (SEQ ID NO: 129; эпитоп отмечен подчеркиванием).
Конъюгат (пептид DN2)-BSA получали путем конъюгирования синтезированного пептида DN2 с белком BSA через линкер EDC (N-(3-диметиламинопропил)-N'-этилкарбодиимид). При этом молярное соотношение пептид : белок BSA составляло 15:1.
После нанесения на поверхность лунок раствора полученного конъюгата (пептид DN2)-BSA из расчета 50 мкг/мл на одну лунку проводили инкубирование с ним химерного антитела DNP001 в различных градиентных концентрациях. Далее осуществляли детектирование антитела, связавшегося с конъюгатом, измеряя реакционную способность химерного антитела в отношении конъюгата (пептид DN2)-BSA. Связавшееся антитело детектировали с использованием конъюгированного с HRP антитела к Ig человека ((антитело к Ig человека)-HRP), измеряли значения OD при 450 нм, и эти значения представлены в приведенной далее Таблице и на ФИГ. 42.
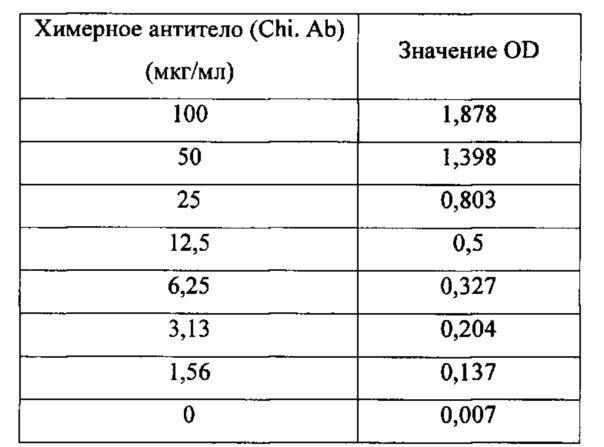
Результаты, показанные в Таблице и на ФИГ. 42, продемонстрировали, что химерное антитело DNP001 связывалось с содержащим эпитоп пептидом зависимым от концентрации образом.
Пример 2. Исследование уровня экспрессии эпитопа CD43 в линиях клеток солидного рака человека
Чтобы исследовать уровень экспрессии CD43 в различных линиях клеток солидного рака, проводили иммуноокрашивание и проточную цитометрию.
Информация относительно клеточных линий, использованных для анализа, приведена ниже.
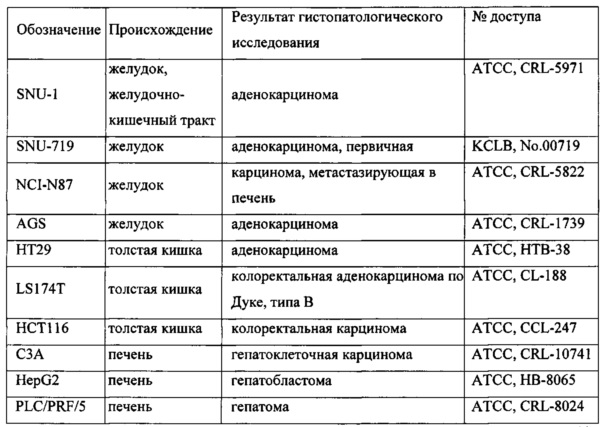
Конкретно, каждую из клеточных линий инокулировали и культивировали в 100 мм контейнере для клеточных культур, и когда культивируемые клетки занимали приблизительно 70-80% поверхности, эти культивируемые клетки промывали забуференным фосфатом физиологическим раствором и затем обрабатывали раствором трипсина в EDTA (Invitrogen), отделяли и далее центрифугировали. Осажденные клетки снова суспендировали в буферном растворе, отбирали аликвоты по 1×105 каждая, добавляли по 1,5 мкл раствора конъюгированных с фикоэритрином (РЕ) антител к CD43 (YG5), полученных в примере 1-1, и проводили взаимодействие в холодильнике при 4°C в течение 20 мин. После проведения взаимодействия при 4°C в течение 20 мин клетки снова промывали, используя 4 мл буферного раствора (1× забуференного фосфатом физиологического раствора, PBS буфера), затем анализировали с применением проточного цитометра (Becton, Dickinson and Company, Franklin Lakes, NJ, USA). Для сравнения этот же тест проводили с использованием антитела DFT-1 (2 мкл, Ancell Corporation) вместо антитела к CD43.
Полученные результаты показаны на ФИГ. 1 и ФИГ. 2а-2с. На ФИГ. 1 по оси X показан уровень экспресии антигена CD43, который взаимодействует с антителом YG5 в анализируемой клеточной линии, а по оси Y указаны подсчитанные количества клеток (количества). Как показано на ФИГ. 1 и ФИГ. 2а-2с, в случае аденокарциномы прямой кишки по Дуке, типа В (LS174T) был продемонстрирован уровень экспрессии приблизительно 60%, в случае НСТ116, НТ29 был продемонстрирован уровень экспрессии приблизительно 50, 37%, и факт экспрессии CD43 (эпитопа) подтверждали в случае других разновидностей линий клеток солидного рака.
Пример 3. Тестирование цитотоксичности антитела к CD43 в отношении раковых клеток (in vitro)
3-1. Получение конъюгата антитело-токсин
Конъюгирование сапорина (Sigma, St. Louis, МО) с моноклональным антителом проводили в соответствии с традиционным способом (Polito et al., 2004). После растворения антитела (DNP001; полученного в примере 1-2) и сапорина в концентрации 2 мг/мл (концентрация антитела) и 8 мг/мл (концентрация сапорина), соответственно, в 50 мМ натрийборатном буфере (рН 9,0) проводили обработку 2-иминотиоланом (Sigma) в концентрации 0,4 мМ и 1,0 мМ, соответственно. Потом антитела и сапорин смешивали в соотношении 10:1, проводили взаимодействие при комнатной температуре в течение 16 часов и конъюгат антитело-сапорин очищали гельфильтрацией. Далее, полученный конъюгат описывали как конъюгат (антитело к CD43)-сапорин.
Руководствуясь описанным выше способом, получали конъюгат (антитело к CD43)-MMAE, который готовили конъюгированием антитела к CD43 (DNP001; полученное в примере 1-2) и монометилауристатина Е (ММАЕ; Creative Biolabs), конъюгат (антитело к CD43)-DM1, который готовили конъюгированием антитела к CD43 (DNP001) и N2'-диацетил-N2'-(3-меркапто-1-оксопропил)майтанзина (DM1; The Chemistry Research Solution LLC), и конъюгат (антитело к CD43)-дуокармицин, который готовили конъюгированием антитела к CD43 (DNP001) и дуокармицина (The Chemistry Research Solution LLC), и конъюгат (антитело к CD43 (DNP001))-DM1, соответственно.
3-2. Цитотоксичность конъюгатов (антитело к CD43)-токсин в отношении клеток рака желудка
Тестировали цитотоксичность конъюгатов антитело-токсин, полученных в примере 3-1 (конъюгата (антитело к CD43)-сапорин, конъюгата (антитело к CD43)-DM1, конъюгата (антитело к CD43)-MMAE и конъюгата (антитело к CD43)-дуокармицин), в отношении клеток рака желудка.
За сутки до проведения тестирования линии клеток рака желудка NCI-N87, AGS и SNU719, соответственно, высевали в количестве 4×103 из расчета на одну лунку. Каждым конъюгатом антитело-токсин в концентрации 10000 нг/мл (в случае конъюгата (антитело к CD43)-MMAE и конъюгата (антитело к CD43)-DM1) или 1000 нг/мл (в случае конъюгата (антитело к CD43)-дуокармицин) обрабатывали каждую клеточную линию рака желудка. После этого, через 24 часа, 48 часов и 72 часа в каждую лунку добавляли по 10 мкл EzCytox (Daeil lab, Korea), клетки культивировали в контейнере с CO2 при 37°C и затем измеряли их жизнеспособность с использованием микроспектрофотометрии.
Цитотоксичность каждого полученного конъюгата показана на ФИГ. 3 (конъюгата (антитело к CD43)-MMAE), на ФИГ. 4 (конъюгата (антитело к CD43)-DM1) и на ФИГ. 5 (конъюгата (антитело к CD43)-дуокармицин). Цитотоксичность рассчитывали в соответствии со следующим уравнением:
цитотоксичность (%)=[1 - (число выживших клеток/исходное число клеток)] × 100.
Показаные на ФИГ. 3, 4 и 5 результаты подтвердили, что конъюгат (антитело к CD43)-DM1 и конъюгат (антитело к CD43)-MMAE продемонстрировали цитотоксичность в отношении всех 3 разновидностей клеточных линий, а конъюгат (антитело к CD43)-дуокармицин продемонстрировал цитотоксичность в линиях NCI-N87 и AGS.
Пример 4. Тестирование противоракового эффекта антител к CD43 в животной модели (in vivo)
4-1. Подготовка животной модели рака желудка (онкогенеза)
Модель рака желудка готовили, используя клеточные линии, осуществление экспрессии CD43 в которых было подтверждено данными из примера 2 (NCI-N87; АТСС, CRL-5822). Сначала получали 2,8×107 клеток NCI-N87. Полученные клетки подкожно инокулировали в количестве 5×106 клеток/100 мкл (среды от Мемориального института Розуэлла Парка (RPMI)) в правый бок бестимусных мышей. Подвергнутых инокуляции бестимусных мышей распределяли в контрольную группу (с введением PBS) и тестируемую группу и, через 3 суток после инокулирования раковых клеток, вводили 2 раза в неделю в течение 3 недель в хвостовую вену антитела к CD43 (DNP001), полученные в примере 1-2, в количестве 12 мг/кг, или внутрибрюшинной инъекцией один раз в неделю в течение 3 недель вводили конъюгат (антитело к CD43)-дуокармицин (DNP001-дуокармицин), полученный в примере 3-1, в количестве 0,2 мг/кг. Размер опухоли измеряли перед введением терапевтического агента 2 раза в неделю и размер опухоли рассчитывали в соответствии со следующим уравнением:
размер опухоли (мм3)=(основная ось×минорная ось2)/2.
Полученный результат показан на ФИГ. 6. Как показано на ФИГ. 6, было подтверждено, что рост опухоли начинал подвергаться ингибированию в группе с введением конъюгата DNP001-дуокармицин (D-Duo) по сравнению с контрольной группой на 7-е сутки после начала тестирования. Через 26 суток после начала тестирования средние размеры опухолей у мышей, которым вводили конъюгат DNP001-дуокармицин, только антитело DNP001 и только PBS, составляли 447,2 мм3, 510,9 мм3 и 784,6 мм3, соответственно. В случае групп, которым вводили конъюгат (антитело к CD43)-дуокармицин и антитело к CD43, рост опухоли подавлялся приблизительно на 43% и 34%, соответственно, по сравнению с контрольной группой. Этот результат демонстрировал значительный ингибирующий эффект, оказываемый на развитие рака желудка антителом к CD43 как таковым и конъюгатом (антитело к CD43)-дуокармицин.
Пример 5. Исследование распределения CD43 в пораженных солидным раком тканях человека
Помимо рака желудка, для подтверждения экспрессии CD43 и возможности тестирования терапевтической эффективности в случае различных видов солидного рака (рака желудка, перстневидноклеточного рака желудка, рака молочной железы, инфильтрующей протоковой аденокарциномы среди других видов рака молочной железы, рака почки, рака поджелудочной железы, рака желчного пузыря, рака шейки матки, рака мочевого пузыря, гранулоцитарной саркомы) с направленным воздействием на CD43 проводили иммуногистохимическое исследование на различных опухолевых тканях человека.
Иммуногистохимическое окрашивание проводили в следующем порядке. В качестве пораженной солидным раком ткани использовали образец залитой парафином пораженной солидным раком ткани (госпиталь Национального университета Чхунбук). Сначала срезы залитой парафином пораженной солидным раком ткани подвергали процессу депарафинизации, обрабатывая 3 раза ксилолом, каждый раз в течение 10 мин, два раза 100%-ным спиртом, каждый раз в течение 5 мин, 80%-ным спиртом в течение 3 мин, 50%-ным спиртом в течение 1 мин, 20%-ным спиртом в течение 1 мин и затем дважды промывали водопроводной водой. Затем их вымачивали в 1×TBS (забуференный трисом физиологический раствор) в течение 10 мин. Чтобы регенерировать антиген в ткани, добавляли буфер на основе 10 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота, рН 8,0), выдерживали в микроволновой печи в течение 15 мин, быстро охлаждали в водопроводной воде и затем срезы вымачивали в 1×TBS в течение 20 мин. Эндогенную пероксидазу удаляли, используя смесь 0,1% Н2О2+100% метанола в течение 10 мин и дважды промывая водопроводной водой. Далее, чтобы исключить неспецифическое взаимодействие биотина и комплекса антиген-антитело, осуществляли процесс блокирования. Процесс блокирования проводили, добавляя 4 капли раствора биотина и проводя взаимодействие при комнатной температуре в течение 15 мин. После добавления к образцу ткани 4 капель раствора авидина (VECTOR Laboratories) проводили взаимодействие при комнатной температуре в течение 15 мин и затем выполняли промывку, используя 1×PBS.
Антитела к CD43 (YG5) (10 мкг/мл) и антитела DFT-1 (5 мкг/мл; контрольная группа; Ancell Corporation), полученные в примере 1-1, суспендировали в 150 мкл 1×TBS, чтобы затем нанести на образцы ткани, и проводили взаимодействие при комнатной температуре в течение 30 мин. После промывки с использованием 1×TBST (1×TBS+0,1% твина 20) 3 раза, каждый раз в течение 15 мин, на образцы ткани наносили каждый раз по 2 капли раствора вторичных антител (конъюгированных с HRP антител кролика к иммуноглобулину мыши; DAKO) и проводили взаимодействие при комнатной температуре в течение 30 мин. Далее, после промывки с использованием 1×TBST (1×TBS+0,1% твина 20) 3 раза, каждый раз в течение 15 мин, проводили реакцию с развитием окраски, используя DAB (диаминобензидин). После промывки с использованием 1×TBS два раза в течение 5 мин и контрастирующего окрашивания проводили промывку водопроводной водой. Затем, после проведения процесса дегидратации ткань закрепляли.
Полученный результат показан на ФИГ. 7 и ФИГ. 8 и в Таблице 1. Критерии определения положительного взаимодействия с CD43 в каждой ткани приведены ниже: отрицательный результат: 0; положительный результат: классифицированный в диапазоне от 1 до 3 баллов в соответствии с уровнем окрашивания YG5 в области опухоли.

(В Таблице 1:
«доля положительных результатов» означает численное значение, полученное путем деления числа тканей с положительным взаимодействием, без учета тканей с отрицательным взаимодействием, в которых не наблюдали окрашивания под действием YG5, на общее число тканей, пораженных соответствующим раком;
«всего» означает общее число тканей, использованных для окрашивания;
«число положительных результатов» означает число тканей, демонстрирующих положительное взаимодействие с YG5 среди использованных тканей, соответственно).
Как подтверждено в Таблице 1, на ФИГ. 7 и ФИГ. 8, было продемонстрировано, что CD43 экспрессировались в опухолях, которые встречаются главным образом в эпителиальных клетках, таких как рак желудка, перстневидноклеточный рак желудка, рак молочной железы, инфильтрующая протоковая аденокарцинома среди других видов рака молочной железы, рак почки, рак поджелудочной железы, рак желчного пузыря, рак шейки матки, рак мочевого пузыря, гранулоцитарная саркома и так далее.
Пример 6. Экспрессия CD43 в раковых стволовых клетках при раке желудка
Тестировали уровень экспрессии CD43 в раковых стволовых клетках различных опухолей. CD44 и CD133 (проминин-1) представляли собой общеизвестные маркеры раковых стволовых клеток. Для подтверждения экспрессии CD43 проводили трехкратное окрашивание на маркеры раковых стволовых клеток CD44 и CD 133, демонстрируя тем самым, что CD43 экспрессировался в положительной по CD44 или CD44+CD133+ группе. Вносили клетки NCI-N87 и культивировали в 100 мм контейнере для клеточных культур, и когда культивируемые клетки занимали приблизительно 70-80% поверхности, эти культивируемые клетки промывали забуференным фосфатом физиологическим раствором и затем обрабатывали раствором трипсина в EDTA (Invitrogen), отделяли и далее центрифугировали. Осажденные клетки снова суспендировали в буферном растворе. После их взаимодействия с конъюгатом (антитело к CD44)-аллофикоцианин (АРС) (10 мкл, Miltenyi Biotec), конъюгатом (антитело к CD133)-флуоресцеинизотиоцианат (FITC) (10 мкл, Miltenyi Biotec) и конъюгатом антитела к CD43 (полученного в примере 1; YG5) и фикоэритрина (РЕ; 1,5 мкл, Dinona) в холодильнике при 4°C в течение 20 мин непрореагировавшие антитела отмывали и фиксировали 1%-ным параформальдегидом. Затем клетки анализировали с применением проточного цитометра (Becton, Dickinson and Company, Franklin Lakes, NJ, USA). Этот же тест проводили с использованием в качестве группы отрицательного контроля мышиного IgG1 вместо антитела к CD44 и антитела к CD133.
Полученный результат показан на ФИГ. 9.
Показанные на ФИГ. 9 данные, как результат подтверждения экспрессии CD43 в раковых стволовых клетках при раке желудка, свидетельствовали о том, что CD43 был положительным в тех клетках, в которых оказались положительными маркеры для различения раковых стволовых клеток при раке желудка (CD44 или CD133). Этот результат показал, что антитело к CD43 по настоящему изобретению может специфически связываться с CD43, экспрессируемым на поверхности раковых стволовых клеток при раке желудка.
Пример 7. Исследование экспрессии CD43 в стволовых клетках, пораженных солидным раком различного вида
Факт экспрессии CD43 в раковых стволовых клетках при CD43-положительном солидном раке, анализируемых в примере 5, подтверждали способом, аналогичным приведенному в примере 6.
Использовали клетки, имеющие происхождение из каждой CD43-положительной ткани, описанной в примере 5 (клеточные линии, происходящие из рака молочной железы, рака легкого, рака прямой кишки, рака печени и рака желчного пузыря, рака почки, рака поджелудочной железы, рака щитовидной железы, рака предстательной железы, рака шейки матки, рака мочевого пузыря). Каждую из клеточных линий инокулировали и культивировали в 100 мм контейнере для клеточных культур, и когда культивируемые клетки занимали приблизительно 70-80% поверхности, эти культивируемые клетки промывали забуференным фосфатом физиологическим раствором и затем обрабатывали раствором трипсина в EDTA (Invitrogen), отделяли и далее центрифугировали. Осажденную клеточную массу снова суспендировали в буферном растворе и приводили во взаимодействие с разбавленными в 100 раз растворами конъюгатов (антитело к CD44)-аллофикоцианин (АРС), (антитело к CD44)-аллофикоцианин (АРС), (антитело к CD326 (ЕрСАМ (молекула адгезии эпителиальных клеток)))-аллофикоцианин (АРС), (антитело к CD133)-флуоресцеинизотиоцианат (FITC), (антитело к CD43)-фикоэритрин (РЕ) в холодильнике при 4°C в течение 20 мин. Непрореагировавшие антитела отмывали и фиксировали 1%-ным параформальдегидом и после этого клетки анализировали с применением проточного цитометра (Becton, Dickinson and Company, Franklin Lakes, NJ, USA).
Таким образом, результат подтверждения экспрессии CD43 в раковых стволовых клетках CD43-положительных тканей, происхождение которых указано в примере 5, свидетельствовал о том, что те клетки, которые были положительными по маркерам для различения каждой из раковых стволовых клеток (CD44, CD133 или ЕрСАМ), оказались положительными по CD43.
Пример 8. Тестирование экспрессии CD43 в раковых стволовых клетках из свежевыделенной пораженной раком ткани пациента
Основываясь на результате примера 5, тестировали экспрессию CD43 после классификации с использованием маркеров раковых стволовых клеток в пораженных раком тканях пациента.
Свежевыделенную пораженную раком ткань пациента микронизировали. Опухолевые клетки из микронизированной ткани центрифугировали при 1700 об/мин в течение 3 мин, затем супернатант удаляли, клетки ресуспендировали в 10 мл среды, содержащей 10% FBS, и затем центрифугировали при 1700 об./мин в течение 3 мин. Супернатант удаляли и клетки ресуспендировали, используя 10 мл 1×PBS, и затем подсчитывали. Клетки распределяли в пробирки для FACS, затем, после их взаимодействия с конъюгатами (антитело к CD44)-аллофикоцианин (АРС), (антитело к CD44)-аллофикоцианин (АРС), (антитело к CD326(ЕрСАМ))-аллофикоцианин (АРС), (антитело к CD133)-флуоресцеинизотиоцианат (FITC), (антитело к CD43)-фикоэритрин (РЕ) в холодильнике при 4°C в течение 20 мин, непрореагировавшие антитела отмывали и фиксировали 1%-ным параформальдегидом и после этого клетки анализировали с применением проточного цитометра (Becton, Dickinson and Company, Franklin Lakes, NJ, USA).
Так же как и выше, результат тестирования экспрессии CD43 в раковых стволовых клетках при раке желудка, в раковых стволовых клетках из пораженных раком тканей пациента, подтверждал, что раковые стволовые клетки, имеющие происхождение из пораженных раком тканей пациента, оказались положительными по CD43.
Пример 9. Ингибирование образования колоний раковых стволовых клеток под действием антитела к CD43 (in vitro)
В примере 6 было подтверждено, что образование колоний CD43-положительных стволовых клеток в CD43-положительной солидной опухоли, представленное в примере 5, ингибировалось антителами к CD43. Использовали клетки, имеющие происхождение из каждой CD43-положительной ткани, описанной в примере 5 (клеточные линии, происходящие из рака молочной железы, рака легкого, рака прямой кишки, рака печени и рака желчного пузыря, рака почки, рака поджелудочной железы, рака щитовидной железы, рака предстательной железы, рака шейки матки, рака мочевого пузыря). Вносили каждую из клеточных линий и культивировали в 100 мм контейнере для клеточных культур, и когда культивируемые клетки занимали приблизительно 70-80% поверхности, эти культивируемые клетки промывали забуференным фосфатом физиологическим раствором и затем обрабатывали раствором трипсина в EDTA (Invitrogen), отделяли и далее центрифугировали. Осажденную клеточную массу снова суспендировали в буферном растворе, добавляли антитело к CD43 в концентрации 20 мкг/мл из расчета на 107 опухолевых клеток, взаимодействие проводили в холодильнике при 4°C в течение 20 мин и затем непрореагировавшее антитело отмывали 1×PBS. После добавления 20 мкл связанного с магнитными гранулами IgG проводили взаимодействие в холодильнике при 4°C в течение 15 мин, затем промывали 1×PBS и CD43-положительные клетки классифицировали с использованием системы разделения методом MACS (сортировка магнитно-активированных клеток).
После взаимодействия клеток, классифицированных как CD43-положительные клетки или CD43-отрицательные клетки, с конъюгатами (антитело к CD44)-аллофикоцианин (АРС), (антитело к CD326(ЕрСАМ))-аллофикоцианин (АРС), (антитело к CD133)-флуоресцеинизотиоцианат (FITC), (связанное с магнитными гранулами антитело)-фикоэритрин (РЕ, 20 мкл, Miltenyi Biotec) в холодильнике при 4°С в течение 15 мин осуществляли промывку и фиксацию 1%-ым параформальдегидом и затем проводили анализ с применением проточного цитометра (Becton, Dickinson and Company, Franklin Lakes, NJ, USA).
CD43-положительные клетки или CD43-отрицательные клетки, полученные в примерах, добавляли в количестве 5000 на одну лунку в лунки 6-луночных планшетов с сверхнизким прикреплением (Corning Inc., Corning, NY, USA), содержащие бессывороточные среды (с пенициллином G - 100 международных единиц (IU)/мл; стрептомицином - 100 мкг/мл, рекомбинантным эпидермальным ростовым фактором человека (hrEGF) - 20 нг/мл, рекомбинантным основным фактором роста фибробластов человека (hrbFGF) - 10 нг/мл, 2% добавки В27 без витамина А, 1% добавки N2 (Invitrogen, Carlsbad, СА, USA)). Затем добавляли антитела к CD43 и контрольные антитела в концентрации 100 мкг/мл для тех и других и осуществляли культивирование. Потом наблюдали за опухолевыми сферами. Такой же эксперимент проводили, классифицируя CD43-положительные клетки в свежевыделенных пораженных раком тканях пациента.
Таким образом, было подтверждено, что в результате введения антител к CD43 в CD43-положительные раковые стволовые клетки из различных опухолей и пораженных раком тканей пациента онкогенез раковых стволовых клеток ингибировался по сравнению с контрольной группой. Этот результат показал наличие значительного ингибирующего воздействия антител к CD43 на онкогенез раковых стволовых клеток.
Пример 10. Тестирование противоракового эффекта антител к CD43 в различных животных моделях рака (in vivo)
Животную модель создавали, используя клеточные линии, в которых экспрессия CD43 была подтверждена результатами примеров 7 и 8, и свежевыделенные пораженные раком ткани и способ были такими как в примере 4. Мышей случайным образом распределяли на контрольную группу (с введением PBS) и тестируемую группу и, через 3 суток после инокулирования раковых клеток, вводили 2 раза в неделю в течение 3 недель в хвостовую вену антитела к CD43 (mAb (моноклональные антитела) DNP001), полученные в примере 2, в количестве 8 мг/кг, или внутрибрюшинной инъекцией один раз в неделю в течение 3 недель вводили конъюгаты антитела к CD43 с сапорином, DM1, ММАЕ, дуокармицином, полученные в примере 3-1, в количестве 0,2 мг/кг, 0,5 мг/кг, 1 мг/кг, 5 мг/кг.
Пример 11. Тестирование изменения способности связываться с нормальными клетками крови после обработки нейраминидазой
Проверяли, происходило ли изменение способности связываться с нормальными лимфоцитами в том случае, когда антитело (DFT-1), распознающее CD43, экспрессируемый в нормальной крови, и антитело к CD43 (YG5), распознающее опухолеспецифичный CD43, обрабатывали нейраминидазой.
У здоровых людей отбирали по 10 мл крови, в эти образцы крови добавляли по 40 мл раствора для лизиса эритроцитов (раствора для лизиса RBC; NH4Cl, NaHCO3, EDTA, рН 8,0) и осуществляли лизис при комнатной температуре в течение 10 мин. Кровь с лизированными эритроцитами центрифугировали при 1700 об/мин в течение 5 мин, затем супернатант удаляли и дважды промывали 10 мл PBS. Лимфоциты в количестве 3*106 суспендировали в 130 мкл полученного выше раствора для лизиса эритроцитов и добавляли 50 мкл раствора нейраминидазы (ELPIS, Korea) и 20 мкл буфера. И далее осуществляли взаимодействие с клетками при 37°C в течение 50 мин и проводили промывку, используя PBS. Чтобы удостовериться, что под действием нейраминидазы происходило изменение эпитопа CD43, распознаваемого антителом, к клеткам добавляли связанные с FITC и РЕ антитела DFT-1 и YG5 и после взаимодействия при 4°C в течение 15 мин клетки далее промывали 4 мл PBS. Затем проводили анализ клеток с применением проточной цитометрии и определяли титр нормальных лимфоцитов.
Результат, подтверждающий значения титров для двух полученных выше антител к CD43 (DFT-1 и YG5), показан на ФИГ. 15. Как показано на ФИГ. 15, было подтверждено, что DFT-1 демонстрировало высокое значение титра до обработки нейраминидазой, но не после обработки нейраминидазой, в то время как YG5 не демонстрировало никакого титра до обработки нейраминидазой, но показало титр 16,16% после обработки нейраминидазой. Таким образом, было подтверждено, что антитело к CD43 (YG5) по настоящему изобретению не распознавало сиалированный эпитоп белка CD43, и это означало, что антитело к CD43 по настоящему изобретению не связывалось с нормальными клетками и специфически связывалось с раковыми клетками, в частности, раковыми стволовыми клетками.
Пример 12. Тестирование перекрестной реактивности в отношении СЕАСАМ5 и СЕАСАМ6
Известно, что клон 5F1, распознающий белок CD43, распознает одновременно и CD43, и CEACAM6 и связывается с фукозилированным сайтом этих двух белков. Было установлено, что данное антитело к CD43 демонстрировало перекрестную реактивность по отношению к СЕАСАМ5 и CEACAM6, а также обнаружено изменение связывающей способности антитела к CD43 в результате изменения характера гликозилирования эпитопа CD43 под действием кифунензина и фукозидазы.
В планшет MaxiSorp для ELISA добавляли рекомбинантные белки rCEACAM5-hFC (Sinobiologics, № по каталогу: 11077-Н03Н-50) и rCEACAM6-hFC (Dinona Inc.) по 200 мкл на одну лунку и проводили взаимодействие при 37°C в течение 1 часа, тем самым осуществляя блокирование. В лунки, покрытые белками rCEACAM5-hFC и rCEACAM6-hFC, добавляли IgG1 и моноклональные антитела YG5, DFT-1, 9А6 или 8F5 (8F5: Biomaterials, 2015 Oct, 67, 32-41, 9А6: SantaCruz Biotechnology, № по каталогу: SC-59899) в количестве 100 нг на одну лунку, соответственно, проводили взаимодействие при 37°C в течение 1 часа и затем промывали PBS для удаления несвязавшихся антител. После этого добавляли разбавленные конъюгированные с HRP антитела козы к IgG мыши (Jackson) и проводили взаимодействие в течение 30 мин, затем промывали PBS, добавляли раствор ТМВ (тетраметилбензидин) в объеме 50 мкл на одну лунку и проводили взаимодействие в течение 10 мин, затем добавляли 50 мкл серной кислоты для остановки реакции и измеряли поглощение при 450 нм.
Полученный результат показан на ФИГ. 16. Как показано на ФИГ. 16, было продемонстрировано, что антитело к CD43 (YG5) обладало слабой реакционной способностью в отношении рекомбинантных белков СЕАСАМ5 и CEACAM6.
Кроме того, не было обнаружено никакого изменения в отношении способности антитела к CD43 связываться с обработанными фукозидазой и кифунензином клетками СЕМ7 (клетками, отобранными как имеющие более высокий, на 50% или больше, уровень экспрессии CD43 на поверхности клеток по сравнению с исходными клетками посредством культивирования клеток CCRF-CEM методом культирования из одной клетки, полученных из АТСС (CCL-119); такие же будут упомянуты далее). Данный результат показал, что антитело, предложенное в настоящем изобретении (например, антитело к CD43 (YG5)), сохраняло способность связываться с CD43 даже в условиях изменения вида сахара в CD43, и это означает, что связывание антитела с эпитопом не было зависимым от сахара. С другой стороны, известно, что традиционное антитело к CD43, 5F1, демонстрирует зависимую от сахара способность связываться с эпитопом, и тем самым было продемонстрировано, что антитело, предложенное в настоящем изобретении, отличалось от традиционного антитела.
Пример 13. Эксперимент с объемным (3D) культивированием клеток рака желудка (анализ опухолевых сфер)
Готовили линию клеток NCI-N87 рака желудка, так чтобы клетки перед проведением эксперимента занимали 80-90% поверхности чашки диаметром 150 мм. Клетки NCI-N87 суспендировали, обрабатывая смесью 1×трипсин⋅EDTA (ТЕ), и затем промывали. Подготовленные клетки NCI-N87 ресуспендировали в среде (DMEM/F12 (DMEM с питательной смесью Хэма F12) (GIBCO), В27 (Invitrogen), EGF и bFGF (Invitrogen)), затем в 6-луночный планшет (планшет со сверхнизким прикреплением) вносили аликвоты по 1*105/2 мл и далее культивировали в инкубаторе с CO2 при 37°C в течение 5 суток. После фотографирования клеток в каждой лунке с применением оптического микроскопа клетки разделяли на отдельные клетки, используя 200 мкл 1×ТЕ, и затем промывали PBS. К клеткам добавляли разведенную 1/50 нормальную сыворотку крови мыши и осуществляли блокирование при 4°C в течение 10 мин. После этого в пробирки для проточной цитометрии вносили аликвоты клеток по 100 мкл каждая, добавляли по 10 мкл раствора антитела к CD44 (eBioscience, № по каталогу: 17-0441-82) и по 1 мкл раствора антитела к CD43 (YG5, DFT-1), соответственно, и проводили взаимодействие при 4°C в течение 25 мин. После промывки с использованием того же способа, как указано выше, в каждый образец добавляли параформальдегид в количестве 1% (масс./об.) для фиксации клеток и затем проводили проточную цитометрию.
Полученный результат показан на ФИГ. 17а (результат до культивирования) и 17b (результат после культивирования в течение 5 суток). В верхней части каждой фигуры приведено полученное с помощью микроскопа изображение, а в нижней части приведен график, показывающий результат проточной цитометрии. Как показано на ФИГ. 17а и 17b, факт увеличения числа клеток, положительных по обоим CD44 и CD43, проверяли на опухолевых сферах NCI-N87, культивированных в течение 5 суток, с использованием проточной цитометрии, и было подтверждено, что за этот период времени образовывались колонии опухолевых клеток. Помимо этого было подтверждено, что экспрессия CD43 возрастала благодаря образованию опухолевых сфер. Этот результат показал, что экспрессия CD43 возрастала специфически в опухолевых стволовых клетках.
Пример 14. Протокол ELISA для измерения связывающей способности модифицированных клеток с использованием суспендированных клеток в суспензии
Этот анализ был разработан как пилотное исследование для подтверждения способности scFv или IgG связываться с суспендированными клетками в суспензии с использованием эксперимента с ELISA со сниженным фоновым сигналом в покрытом поли-D-лизином планшете.
Методика:
1. Стадия сбора клеток:
а) клетки собирали центрифугированием, помещая клетки в пробирку фирмы Falcon емкостью 50 мл и центрифугируя при 500×g в течение 5 мин (осаждение центрифугированием);
б) клетки собирали центрифугированием с однократной промывкой полученных клеточных осадков с использованием 10 мл PBS и центрифугированием при 500×g в течение 5 мин (осаждение центрифугированием);
в) клетки подсчитывали после ресуспендирования клеток с использованием 1 мл PBS (подсчет клеток);
г) клетки разбавляли блокирующим буфером (PBS+3% FCS (фетальная телячья сыворотка)) (концентрация разбавленных клеток): 5×105 клеток/лунка (10×106 клеток/мл));
д) полученную суспензию клеток из расчета по 50 мкл на одну лунку добавляли в лунки с V-образным дном 96-луночного планшета.
2. Добавляли цитоплазматический экстракт (scFv антитела к CD43) или IgG1 из расчета по 50 мкл на одну лунку (используя для получения желаемой конечной концентрации 2-кратный концентрированный раствор; например, если была необходима конечная концентрация 25 мкг/мл, то готовили концентрированный раствор 50 мкг/мл) (в соответствии со схемой анализа готовили в двух повторах или трех повторах). Образцы перемешивали 4 раза путем осторожного пипетирования.
3. Культивирование проводили при комнатной температуре в течение 1 часа.
4. Центрифугирование осуществляли при 500×g в течение 5 мин для осаждения клеток.
5. Супернатант удаляли, переворачивая планшет, или посредством аспирации.
6. Клетки промывали, используя по 200 мкл блокирующего буфера, и образцы перемешивали 4 раза посредством пипетирования.
7. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
8. Супернатант удаляли, осторожно переворачивая планшет, или посредством аспирации.
9. По 100 мкл раствора конъюгированного с HRP антитела к Flag, разбавленного 1:1500 в блокирующем буфере, добавляли к клеточным осадкам после центрифугирования, осторожно ресуспендировали и культивировали при комнатной температуре в течение 30 мин.
10. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
11. Супернатант удаляли, осторожно переворачивая планшет, или посредством аспирации.
12. Клетки осторожно промывали, добавляя по 200 мкл блокирующего буфера, и полученные образцы перемешивали 4 раза посредством пипетирования.
13. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
14. Супернатант удаляли, осторожно переворачивая планшет, или посредством аспирации.
15. Клетки осторожно промывали, добавляя по 200 мкл блокирующего буфера, и полученные образцы перемешивали 4 раза посредством пипетирования.
16. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
17. Клетки осторожно ресуспендировали в 80 мкл раствора субстрата пероксидазы для микролунок SureBlue™ ТМВ, культивировали при комнатной температуре в течение 5 мин и затем реакцию останавливали 1 М раствором HCl.
18. Образцы по 100 мкл каждый переносили в стандартный 96-луночный планшет.
19. Считывали планшет (поглощение) при 450 нм.
Пример 15. Протокол FACS для измерения способности связываться с модифицированными клетками с использованием суспендированных клеток в суспензии
Этот анализ был разработан как еще один способ проведения FACS-эксперимента с целью снижения фонового сигнала на покрытом поли-D-лизином планшете и оценки связывающей способности scFv или IgG.
Методика:
1. Проточная цитометрия
а) Стадия сбора клеток:
1) клетки собирали центрифугированием в пробирку фирмы Falcon емкостью 50 мл, центрифугируя при 500×g в течение 5 мин (осаждение центрифугированием);
2) клетки собирали центрифугированием с однократной промывкой полученных клеточных осадков с использованием 10 мл PBS и центрифугированием при 500×g в течение 5 мин (осаждение центрифугированием);
3) клетки подсчитывали после ресуспендирования клеток с использованием 1 мл PBS (подсчет клеток);
4) клетки разбавляли блокирующим буфером (PBS+3% FCS) (концентрация разбавленных клеток): 5×105 клеток/лунка (10×106 клеток/мл));
д) полученную суспензию клеток из расчета по 50 мкл на одну лунку добавляли в лунки с V-образным дном 96-луночных планшетов.
2. В соответствии со схемой анализа к клеткам добавляли IgG из расчета по 50 мкл на одну лунку двух повторах или трех повторах (используя для получения желаемой конечной концентрации 2-кратный концентрированный раствор; например, если была необходима конечная концентрация 25 мкг/мл, то готовили концентрированный раствор 50 мкг/мл), полученные образцы перемешивали 4 раза посредством пипетирования.
3. Проводили инкубирование при комнатной температуре в течение 30 мин.
4. Добавляли по 200 мкл блокирующего буфера.
5. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
6. Супернатант удаляли, осторожно переворачивая планшет, или посредством аспирации.
7. Добавляли по 200 мкл блокирующего буфера, клетки осторожно промывали и затем равномерно перемешивали примерно 4 раза с использованием пипетки.
8. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
9. Среду удаляли.
10. К клеточным осадкам после центрифугирования добавляли по 200 мкл раствора конъюгированных с Alexa Fluor 488 антител козы к IgG человека, разбавленных 1:20 в блокирующем буфере, их осторожно ресуспендировали и оставляли на льду в течение 1 часа с защитой от света.
11. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
12. Среду удаляли.
13. Добавляли по 200 мкл блокирующего буфера, клетки осторожно промывали и затем равномерно перемешивали с использованием пипетки примерно 4 раза.
14. Клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин.
15. Добавляли по 200 мкл блокирующего буфера и клетки осторожно ресуспендировали.
16. Планшет считывали, используя проточный цитометр.
Пример 16. Проточная цитометрии с использованием растворимых препаратов scFv
В настоящем примере тестировали уровень связывания scFv с клетками СЕМ7 и U937 (АТСС® CRL1593.2™), при этом использовали растворимые scFv, экспрессированные в периплазму Е. coli, и предназначенные для анализа связывания scFv с клетками посредством проточной цитометрии.
Методика:
1-е сутки: инокуляция клонов
1. Планшет со стартовыми культурами:
а) по 200 мкл 2YT (2×дрожжевой экстракт) + 5% (масс./об.) глюкозы + ампициллин (Amp) вносили в 96-луночный культуральный планшет;
б) scFv, которые могут быть группой сравнения, вместе с желаемыми клонами (ДНК, кодирующая scFv антитела к CD43 (mJL1): SEQ ID NO: 49; ДНК, кодирующая scFv Sh741-112: SEQ ID NO: 51; ДНК, кодирующая scFv Sh145-112: SEQ ID NO: 53; ДНК, кодирующая scFv Sh146-112: SEQ ID NO: 55; или ДНК, кодирующая scFv Sh434-112: SEQ ID NO: 57), вносили в лунки.
2. Проводили культивирование в течение ночи со встряхиванием в условиях 650 об./мин, 37°C.
2-е сутки: экспрессия scFv
Культивирование периплазматических экстрактов
3. В соответствии с конечным применением планшетов для экспрессии с использованием инокулятов: периплазматический экстракт, один образец может быть внесен в одну или более лунок:
а) 96-луночный планшет с глубокими лунками заполняли смесью 2YT + Amp (без глюкозы) в количестве 1,0 мл/лунка;
б) После разбавления стартовых культур до значения OD600, равного 0,1, их вносили в 96-луночный планшет. Культивирование проводили со встряхиванием в условиях 650 об/мин, 30°C в течение 2-4 часов. Периодически определяли мутность посредством отбора образцов и измерения OD600. Клетки промывали до получения значения OD600 от 0,7 до 1,0.
4. Индуцирование экспрессии scFv в планшетах для экспрессии:
а) чтобы индуцировать экспрессию в культуре периплазматического экстракта, в каждый планшет для экспрессии добавляли по 100 мкл смеси 2YT + Amp, в которую был добавлен IPTG (с разбавлением концентрированного раствора IPTG в соотношении 1:100);
б) культивирование проводили в течение ночи со встряхиванием в условиях 650 об/мин и 22°C.
3-и сутки: подготовка периплазматического экстракта и проточная цитометрия
Периплазматические экстракты:
5. Подготовка периплазматического экстракта:
а) клетки собирали центрифугированием, проводя центрифугирование при 2000×g в течение 10 мин;
б) супернатант из планшета для экспрессии вытряхивали в контейнер, содержащий отбеливающий агент, и оставшуюся в планшете среду удаляли, помещая планшет на бумажное полотенце;
в) по 75 мкл холодного РРВ (буфер на основе фосфата калия) + ингибиторов протеаз (1 таблетка на 50 мл; полный набор; Roche, № по каталогу: 04693116001) вносили в каждую лунку, ресуспендировали 4 раза посредством пипетирования и затем культивировали в условиях 1000 об./мин и 4°C в течение 10 мин;
г) вносили в каждую лунку, ресуспендировали 4 раза посредством пипетирования и затем культивировали в условиях 1000 об./мин и 4°C в течение 1 часа при встряхивании;
д) планшет центрифугировали при 3000×g в течение 10 мин;
е) переносили периплазматические экстракты (приблизительно по 270 мкл) и помещали фильтр в стопку (соблюдая ориентацию, соответствующую А1):
1) верхняя часть: 96-луночный фильтровальный планшет с размером пор 1,2 мкм;
2) средняя часть: 96-луночный фильтровальный планшет (100 K);
3) нижняя часть: 96-луночный стандартный планшет с плоским основанием;
ж) планшет центрифугировали при 4000 об/мин в течение 20 мин.
з) (при необходимости) для проведения анализа с использованием проточной цитометрии собирали образцы для каждого клона.
6. Проточная цитометрия:
а) образцы scFv: применение периплазматических экстрактов;
б) сбор клеток:
1) клетки собирали центрифугированием, помещая клетки в пробирку фирмы Falcon емкостью 50 мл и центрифугируя при 500×g в течение 5 мин (осаждение центрифугированием);
2) клетки собирали центрифугированием с однократной промывкой полученных клеточных осадков с использованием 10 мл PBS и центрифугированием при 500×g в течение 5 мин (осаждение центрифугированием);
3) клетки подсчитывали после ресуспендирования клеток с использованием 1 мл PBS (подсчет клеток);
4) клетки разбавляли до 0,5×105 клеток/лунка (2,5×106 клеток/мл);
5) по 20 мкл полученной суспензии клеток из расчета на одну лунку добавляли в лунки с V-образным дном 96-луночных планшетов;
в) добавляли периплазматический экстракт из расчета 20 мкл на одну лунку в двух повторах (scFv). Затем образцы осторожно смешивали посредством пипетирования примерно 4 раза;
г) образцы оставляли при комнатной температуре на 30 мин;
д) добавляли по 180 мкл блокирующего буфера;
е) клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин;
ж) супернатант удаляли, переворачивая планшет, или посредством аспирации;
з) обавляли по 200 мкл блокирующего буфера, клетки осторожно промывали и затем равномерно смешивали посредством пипетирования примерно 4 раза;
и) клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин;
к) среду удаляли;
л) клетки осторожно ресуспендировали, добавляя 50 мкл раствора конъюгированного с РЕ антитела к Flag в концентрации 5 мкг/мл (BioLegend, № по каталогу: 637310) к свежеприготовленному буферу для связывания. Планшеты должны быть максимально защищены от света, поскольку антитело чувствительно к свету. Их оставляли на льду на 30 мин в условиях защищенности от света;
м) клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин;
н) среду удаляли;
о) добавляли по 200 мкл блокирующего буфера, клетки осторожно промывали и затем равномерно смешивали посредством пипетирования примерно 4 раза;
п) клетки собирали центрифугированием, проводя центрифугирование при 500×g в течение 5 мин;
р) добавляли по 200 мкл блокирующего буфера и клетки осторожно ресуспендировали;
с) планшет считывали, используя проточный цитометр Guava (Merckmillipore). Проточный цитометр должен быть подготовлен заранее для регистрации желтой флуоресценции.
Пример 17. Функциональные свойства мышиного антитела к CD43, служащего в качестве основы
Настоящий эксперимент проводили с целью демонстрации того, что данный целевой эпитоп (JL-1) подходит для обработки антителами. В настоящем эксперименте использовали мышиное моноклональное антитело к CD43, связывающееся с данным эпитопом (тяжелая цепь: SEQ ID NO: 34; ДНК, кодирующая тяжелую цепь: SEQ ID NO: 33; экспрессирующий вектор для тяжелой цепи (на основе рТТ5): SEQ ID NO: 35; легкая цепь: SEQ ID NO: 37; ДНК, кодирующая легкую цепь: SEQ ID NO: 36; экспрессирующий вектор для легкой цепи (на основе рТТ5): SEQ ID NO: 37).
Было подтверждено, что значительное количество антигена не выбрасывалось из клеток, когда клетки, положительные по антигену JL-1 (CD43), культивировали при 37°C в течение 4 часов. Было продемонстрировано отсутствие большой разницы в плане размера, когда антитело к CD43 в смеси с буфером и антитело к CD43 в составе супернатанта фактических клеток Molt-4 (линия CD43+ клеток острого лимфоцитарного лейкоза; АТСС, CRL-1582) или HL-60 (АТСС) сравнивали в анализе с использованием вестерн-блоттинга.
В дополнение к этому было подтверждено, что количество антигена JL-1 (CD43), циркулирующего в сыворотке крови здорового человека, было недостаточным для того, чтобы существенно помешать связыванию антитела к CD43 с данной мишенью. Влияние 50%-ной сыворотки крови человека на связывание антитела к CD43 с лейкозной клеткой оценивали in vitro (путем измерения реакционной способности по IF (иммунофлуоресценция)). Полученные результаты показаны в Таблице 2.
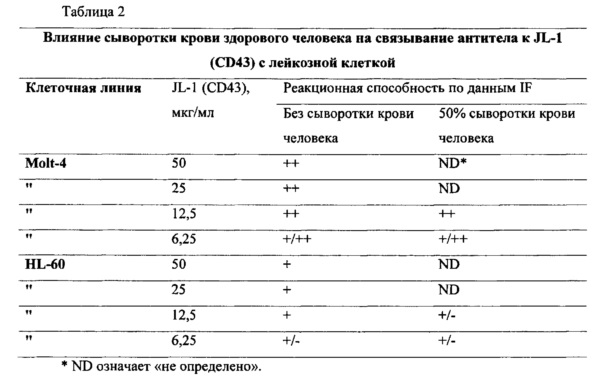
Результаты, показанные в Таблице 2, подтверждали, что сыворотка крови не мешала связыванию антител к CD43 с клетками Molt-4 или клетками HL-60.
Помимо этого было проверено, что «свободные» антитела к CD43, которые были неконъюгированными, не оказывали никакого непосредственного цитотоксического эффекта на выделенные клетки-мишени. Для этого, CD43+ СЕМ7 клетки (представляющие собой клетки СЕМ7 с высоким уровнем антигена) и CCRP-CEM клетки (исходные клетки СЕМ (АТСС), представляющие собой клетки СЕМ7 со средним уровнем) добавляли в 96-луночный планшет в количестве 40000 клеток/лунка, соответственно, обрабатывали мышиными антителами к CD43 (полученными заранее мышиными моноклональными антителами к CD43) в серийных разведениях и на третьи сутки культивирования определяли цитотоксичность, применяя CellTiterGlo (PromegaTM). Для сравнения проводили такой же эксперимент с клетками H9K (клетками H9K с низким уровнем антигена), экспрессирующими CD43 в низкой концентрации.
Полученный результат показан на ФИГ. 18. Как показано на ФИГ. 18, было продемонстрировано, что мышиные антитела к CD43 не проявляли цитотоксичности к CD43+ СЕМ7 клеткам (клеткам СЕМ7 с высоким уровнем антигена) или CCRF-CEM клеткам (клеткам СЕМ7 со средним уровнем антигена; при этом CD43 экспрессировались в меньшей степени по сравнению с клетками СЕМ7).
Клеточные линии, такие как СЕМ7, CCRRF-CEM, Nalm6 (АТСС, CRL-3273) и HL-60 (АТСС, CCL-240) и так далее, демонстрировали в индивидуальном порядке разный уровень экспрессии антигена JL-1 (CD43) (от сильной экспрессии до слабой экспрессии в приведенном порядке). Все эти клеточные линии (по 20000 клеток) обрабатывали конъюгированными с сапорином антителами к CD43 (для конструирования конъюгатов см. пример 3-1; антитела к CD43 представляли собой полученные заранее мышиные моноклональные антитела к CD43) или изотипическим контролем в виде разбавленных растворов, начиная от раствора с концентрацией 20 мкг/мл, и жизнеспособность клеток измеряли с использованием CellTiterGlo на третьи сутки культивирования. Мышиный IgG1 использовали в качестве изотипического контроля для сравнения.
Полученный результат показан на ФИГ. 19. Как показано на ФИГ. 19, было обнаружено, что после обработки конъюгированными с сапорином антителами к CD43 (представленными как mJL-1 на ФИГ. 19) в наибольшей степени жизнеспособность снижалась у клеток СЕМ7 и за ними следовали клетки СЕМ и NALM6. Самую низкую цитотоксичность (наименьшее снижение жизнеспособности клеток) наблюдали в случае клеток HL-60, которые не экспрессировали данной мишени. Как показано на ФИГ. 19, соединенное с токсином антитело к CD43 индуцировало гибель клеток-мишеней. Эффективность гибели обработанных антителами к CD43 клеток СЕМ7, CCRF-CEM, NALM6 и HL-60 соответствовала уровню экспрессии присутствующего в клетках антигена. Сапорин проявлял цитотоксический эффект только в случае индуцирования внутри клетки.
Тестировали интернализацию антител к CD43. Мышиными антителами к CD43 (полученными заранее мышиными моноклональными антителами к CD43) обрабатывали клетки (СЕМ7) при охлаждении в условиях холодильника в течение 30 мин, переносили в условия 37°C, затем отбирали по 106 клеток в соответствующие моменты времени, представленные на оси X на ФИГ. 20, обрабатывали вторичными конъюгированными с РЕ антителами к IgG мыши (Santa Cruz Biotechnology, № по каталогу: SC3738) при температуре холодильника в течение 10 мин, клетки промывали и фиксировали и затем анализировали с применением проточной цитометрии (см. пример 15).
Полученный результат показан на ФИГ. 20. Как показано на ФИГ. 20, антитело к CD43 проникало в клетку после связывания с антигеном, и соответствующие данные показали уровень, при котором антитело на поверхности клетки проникало в клетку и со временем исчезало. Эти данные демонстрировали факт интернализации антитела к CD43 (как мышиного антитела, так и гуманизированного антитела) в случае анализа апоптоза, как указано на ФИГ. 19.
С другой стороны, тестировали явление гомотипической агрегации, индуцированной антителами к CD43 в клетках, экспрессирующих антиген. Для этого антителами к CD43 (мышиными моноклональными антителами к CD43, полученными заранее) в исходной концентрации 40 мкг/мл обрабатывали по 300000 клеток (СЕМ7, CCRRF-CEM или HL-60), культивировали в условиях 37°C, 5% CO2 и затем получали изображения, делая снимки с использованием микроскопа в установленный момент времени (через 2 часа после обработки антителами). Полученное изображение показано на ФИГ. 21. На ФИГ. 21 представлено изображение, показывающее явление гомотипической агрегации, индуцированной антителом к CD43 (представленным как антитело к JL-1), указывающее на то, что антитело к CD43 индуцировало гомотопическую агрегацию клеток, и уровень гомотипической агрегации соотносился с уровнем экспрессии антигена (CD43).
Помимо этого проверяли осуществление экспрессии CD43 в нормальных клетках костного мозга человека. Моноциты из нормального костного мозга окрашивали с использованием мышиных антител к CD43 (полученных заранее мышиных моноклональных антител к CD43), затем окрашивали с использованием конъюгированных с РЕ антител козы к F(ab)2 IgG мыши (Jackson, № по каталогу: 115-035-072) и наблюдение осуществляли методом, изложенным в примере 15.
Полученный результат показан на ФИГ. 22. Наложение гистограмм на ФИГ. 22 представляло ограниченное число лимфоцитов. Как показано на ФИГ. 22, факт низкого уровня гетерогенной экспрессии CD43 подтверждали на различных образцах нормального костного мозга путем окрашивания с использованием антител к CD43 (представленных как JL-1) и также подтверждали на различных клетках периферической крови. Другими словами, данный результат показывает низкий уровень гетерогенной экспрессии CD43 в нормальных клетках костного мозга.
С другой стороны, уровень экспрессии CD43 измеряли в CD34+CD38- клетках (гематопоэтических клетках, отобранных путем тестирования с использованием FACS как клетки, экспрессирующие CD43 и не экспрессирующие CD38; такие же будут упомянуты далее) из различных образцов нормального костного мозга человека (госпиталь Сеульского Национального университета) с применением проточной цитометрии, и было подтверждено, что экспрессия белка CD43 отсутствовала в гематопоэтических стволовых клетках и клетках-предшественниках, которые образовывали колонии в костном мозге. Данный способ подтверждения доступно описан ниже. Гематопоэтические стволовые клетки из пуповины инокулировали 30 мышам NSG (NOD/SID с дефицитом общей гамма-цепи) в 0-е сутки. Через 12 недель у всех мышей с окончательно дифференцированными иммунными клетками проводили анализ на PBL (лимфоциты периферической крови). У всех использованных в этом тестировании мышей иммунные клетки оказались привитыми, и в течение 4 недель мышам вводили конъюгированные с токсином (сапорином) антитела к CD43 (полученные заранее мышиные моноклональные антитела к CD43) или разбавитель (PBS). Через 4 недели после обработки проводили анализ присутствия иммунных клеток человека в иммунизированных животных. Для сравнения такой же тест проводили с использованием конъюгата (мышиный IgG1)-токсин (сапорин) вместо антитела к CD43.
Полученный результат показан в приведенной ниже Таблице 3.
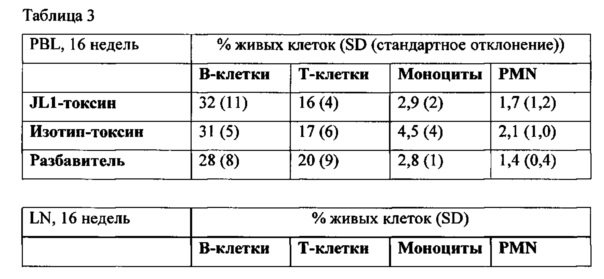
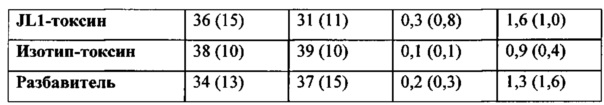
(В этой таблице JL1 представляетсобой CD43; PMN: полиморфноядерный лейкоцит; LN: лимфатический узел)
Как показано в Таблице 3, когда мышам NSG прививали нормальные гематопоэтические стволовые клетки (HSC) человека, полученные из стволовых клеток пуповинной крови, и обработку конъюгатом (антитело к CD43)-токсин (сапорин) проводили в течение 4 недель, то не наблюдали никакой потери в гематопоэтической фракции. Этот результат показал, что конъюгат (антитело к CD43)-токсин (сапорин) не вызывал гибели гематопоэтических стволовых клеток или промежуточных клеток-предшественников.
Используя мышиные антитела к CD43, проводили иммуногистохимическое (IHC) окрашивание в различных нормальных тканях человека, и полученный результат показан в приведенной ниже Таблице 4.
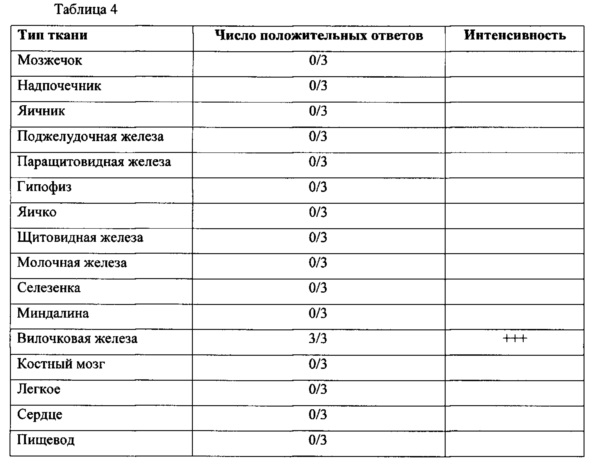
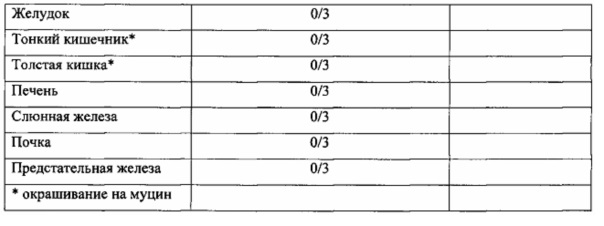
Как показано в Таблице 4, CD43-специфичное окрашивание не обнаруживали ни в каких других тканях, кроме тимуса.
Уровень экспрессии антигена CD43 измеряли, применяя окрашивание двух типов нормальных РВМС (мононуклеарные клетки периферической крови) человека с использованием мышиных антител к CD43 человека (представленных как JL-1: (d)) (см. пример 15 (FACS)), и результат показан на ФИГ. 23. Показанный на ФИГ. 23 результат подтвердил низкий уровень экспрессии CD43.
Конъюгироваными с сапорином мышиными антителами к CD43 (10 мкл/мл) заранее обрабатывали (JL1+) и не обрабатывали (JL1-) нормальные клетки костного мозга и измеряли уровень образования колоний в таких субпопуляциях клеток костного мозга. Клетки костного мозга отделяли от человеческих лейкоцитов и выделяли и собирали CD34+ клетки, разделяя их на положительные и отрицательные по JL-1 (CD43). Затем собранные клетки помещали в среду MethoCult, содержащую цитокины, и измеряли образование колоний. Полученный результат показан на ФИГ. 24. Показанный на ФИГ. 24 результат подтвердил, что колонии в субпопуляциях клеток костного мозга не образовывались в случае предварительной обработки конъюгироваными с сапорином мышиными антителами к CD43 (10 мкл/мл) (JL1+).
С другой стороны, терапевтический эффект антитела к CD43 самого по себе (неконъюгированного) и конъюгата (антитело к CD43)-токсин (дебуганин) тестировали в мышиной модели ксенотрансплантатов ALL, созданной с использованием клеточной линии (в мышиной модели острого лейкоза, созданной путем привития мышам клеток СЕМ7). В качестве антитела к CD43 использовали мышиное моноклональное антитело к CD43, полученное заранее. Полученный результат показан на ФИГ. 25. Антитело к CD43 на ФИГ. 25 представлено как JL1. На ФИГ. 25 (А) показан результат в модели лейкоза с клетками СЕМ7, а на (В) показан результат в модели с NALM-6 (клеточная линия: NALM6 (В-ALL)), соответственно, и тестирование проводили в следующих условиях: мыши: NOD-SCID (8/группа); инокуляция: в 0-е сутки 107 клеток; введение: 15 мкг/инъекция + 100 мкг суммарного IgG, в.в.,  , начиная с 8-х суток; конечная точка: состояние паралича. Как показано на ФИГ. 25, когда мышей в модели ксенотрансплантатов ALL с использованием инокулирования клетками СЕМ7 или NALM-6 обрабатывали «свободными» (неконъюгированным) антителами к CD43, заболевания не возникало или его начало отсрочивалось.
, начиная с 8-х суток; конечная точка: состояние паралича. Как показано на ФИГ. 25, когда мышей в модели ксенотрансплантатов ALL с использованием инокулирования клетками СЕМ7 или NALM-6 обрабатывали «свободными» (неконъюгированным) антителами к CD43, заболевания не возникало или его начало отсрочивалось.
С другой стороны, измеряли уровень экспрессии CD43 в бластных клетках и субпопуляциях при выраженном AML (острый миелоидный лейкоз). Результат показан на ФИГ. 26. Как показано на ФИГ. 26, проводили анализ экспрессии белка CD43 (представленного как JL-1) в бластных клетках при первичном AML и ее распространенность в конкретных субпопуляциях. CD43 экспрессировался приблизительно в 60% случаев в группе с AML.
Пример 18. Конструирование гуманизированного моноклональноого антитела к CD43
На основании последовательности белка гремлин (gremlin), поддерживающего структуру мышиного антитела к CD43 (тяжелая цепь: SEQ ID NO: 34; ДНК, кодирующая тяжелую цепь: SEQ ID NO: 33; экспрессирующий вектор для тяжелой цепи: SEQ ID NO: 35, легкая цепь: SEQ ID NO: 37; ДНК, кодирующая легкую цепь: SEQ ID NO: 36; экспрессирующий вектор для легкой цепи (на основе рТТ5): каждая из последовательностей участка CDR тяжелой цепи и легкой цепи SEQ ID NO: 38) (CDRH1: SEQ ID NO: 111 (GYFMN); CDRH2: SEQ ID NO: 114 (RINPNNGDSFYNQKFQG); CDRH3: SEQ ID NO: 118 (EGYYGGRGYALDY); CDRL1: SEQ ID NO: 119 (RTSQDISNYLN); CDRL2: SEQ ID NO: 121 (NTSRLHS); CDRL3: SEQ ID NO: 125 (QQSNMFPY)), и последовательности гена человеческого антитела конструировали библиотеку рекомбинантных гуманизированных антител по типу scFv, в которых были подвергнуты рекомбинации последовательности участка, относящегося к каркасной области.
Конструированную библиотеку антител на основе scFv экспрессировали и подвергали скринигу, используя общепризнанный метод фагового дисплея, и положительные клоны конструировали как подбиблиотеку, экспрессирующую варианты с заменами в областях за исключением CDR или частично в последовательностях участка CDR, повторяя при этом скрининг.
Путем повторения различных циклов получения таких конструкций библиотеки и применения метода дисплея, обеспечивали получение вариантов последовательности гуманизированного антитела, демонстрирующих аффинность к антигену, очень близкую к таковой для родительского клона.
Последовательности тяжелой цепи полученного гуманизированного антитела к CD43 показаны в SEQ ID NO: 40, 42, 44 и 46, последовательность легкой цепи показана в SEQ ID NO: 48, вариабельные области тяжелой цепи и вариабельные области легкой цепи показаны в SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30 и 83 (вариабельная область тяжелой цепи) и SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32 и 83 (вариабельная область легкой цепи), соответственно.
Помимо этого вариабельные области тяжелой цепи и вариабельные области легкой цепи мутантного гуманизированного антитела к CD43 из модифицированной SEQ ID NO: 83 (вариабельная область тяжелой цепи) и SEQ ID NO: 95 (вариабельная область легкой цепи) показаны в SEQ ID NO: 84-94 (вариабельная область тяжелой цепи) и SEQ ID NO: 96-106 (вариабельная область легкой цепи), соответственно.
Антитело по типу scFv создавали посредством соединения полученных вариабельной области тяжелой цепи и вариабельной области легкой цепи с использованием GGGASGGGGSGGGGS (SEQ ID NO: 127) или GGGGSGGGGSGGGAS (SEQ ID NO: 128).
Пример 19. Антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC), обусловленные гуманизированным или химерным моноклональным антителом к CD43
Тестировали апоптотический эффект (ADCC и CDC), обусловленный полученным химерным антителом к CD43 (DNP001; пример 2-1-3). Сначала клеточную линию СЕМ7 вместе с эффекторными клетками (РВМС; мононуклеарные клетки периферической крови) совместно культивировали с добавлением химерных антител к CD43 или контрольных антител (IgG1 человека) в течение 4 часов и затем измеряли цитотоксичность с использованием CellTiterGlo, и результат показан на ФИГ. 27А. Клеточную линию СЕМ7 культивировали в культуральной среде с химерными антителами к CD43 вместе с комплементом кролика (Cedarlane, № по каталогу: CL3051) и затем измеряли цитотоксичность с использованием CellTiterGlo, и результат показан на ФИГ. 27В. Химерное антитело к CD43 было представлено как JL-1 на ФИГ. 27. Показанный на ФИГ. 27 результат подтвердил, что химерное антитело к CD43 индуцировало эффектор-опосредуемый цитолиз (ADCC и CDC) на уровне in vitro по сравнению с контрольным антителом, IgG1 человека.
На ФИГ. 28 показано, что дефукозилированное (дефукозилированное посредством обработки антитела кифунензином) химерное антитело к CD43 (представленное как JL-1) повышает ADCC активность по отношению к СЕМ7 на уровне in vitro.
ФИГ. 29 представляет график, показывающий эффект, оказываемый неконъюгированным химерным антителом, которое само по себе не связывалось ни с чем, в клеточной линии СЕМ7 in vivo. Показанный на ФИГ. 29 результат подтвердил, что «свободные» (неконъюгированные) и конъюгированные с дебуганином химерные антитела к CD43 повышали выживаемость иннокулированного клетками СЕМ7 животного (в модели лейкоза ALL (острый лимфоцитарный лейкоз)).
Экспрессию CD43 тестировали в субпопуляциях лейкозных стволовых клеток (LSC). Костный мозг пациента с AML (острый миелоидный лейкоз) окрашивали с использованием антител к CD45 (BD), антител к CD34 (BD), антител к CD38 (BD), антител к CD43 (DNP001) или mIgG1 (контроль) с Alexa488 и уровень экспрессии CD43 оценивали, отбирая CD34+CD38- лейкозные стволовые клетки, и проводили сравнение с контрольной группой. Результат показан на ФИГ. 30 (JL1: CD43). Как показано на ФИГ. 30, антиген CD43 экспрессировался в субпопуляциях инициирующих лейкоз клеток (LSC) (CD34+/CD38-).
Измеряли среднее число колоний после обработки in vitro химерными антителами к CD43, конъюгированными с токсином (сапорином: SAP) (ССС), и результат показан на ФИГ. 31. Данный результат продемонстрировал апоптотический эффект, оказываемый на антиген-положительные клетки в случае AML, которые добавляли вместе с конъюгатами (антитело к CD43)-сапорин или конъюгатами (мышиный IgG1)-сапорин на панель колоний стволовых клеток.
Помимо этого измеряли in vitro влияние химерного конъюгированного с токсином (сапорином: SAP) антитела к CD43 (ССС) на прогрессирование антиген-положительного выраженного AML, и результат показан на ФИГ. 32. Данный результат показал, что антитела ССС ослабляли прогрессирование выраженного AML. Данный результат получали путем помещения бластных клеток в случае выраженного AML в культуральную среду, содержащую конъюгат (антитело к CD43)-сапорин или конъюгат (мышиный IgG1)-сапорин, и измерения уровня пролиферации клеток через 3 суток, и на основании этого результата было подтверждено, что рост клеток замедлялся при культивировании в среде, содержащей конъюгат JL1-сапорин (А), а доля погибших клеток увеличивалось (В).
Как показано на ФИГ. 31 и 32 и подтверждено результатами анализа образования колоний (ФИГ. 31) и анализа пролиферации (ФИГ. 32) in vitro, конъюгированное с токсином гуманизированное химерное антитело обладало цитотоксичностью по отношению к CD43-положительному первичному AML.
Тестировали ингибирующий эффект, оказываемый конъюгированным с токсином антителом, на рост раковых клеток в случае выраженного AML у NSG мышей (in vivo). У пациента с CD43+ AML отбирали 5×107 костномозговых клеток, вводили внутривенной инъекцией 30 облученным NSG мышам и через 8 недель этим мышам каждую неделю в течение 4 недель вводили в дозе 45 мкг конъюгат (химерное антитело к CD43)-дебуганин (DB) (представленный как JL1-DB), конъюгат hIgG1-DB (представленный как изотип-DB) или PBS (разбавитель). Затем у этих мышей отбирали образцы крови, костного мозга и селезенки и наблюдали за приживлением трансплантата и образованием опухолей. Полученный результат показан на ФИГ. 33. Как показано на ФИГ. 33, рост раковых клеток в случае первичного AML ингибировался конъюгированными с токсином гуманизированными химерными антителами к CD43 у мышей NSG на уровне in vivo.
Результаты, показанные на ФИГ. 34 и ФИГ. 35, подтверждали, что различные гуманизированные/оптимизированные модифицированные антитела демонстрировали одинаковый профиль связывания по сравнению с взятым в качестве основы (мышиным) антителом к CD43. Окрашивание СЕМ7 клеток проводили с использованием родительского взятого в качестве основы антитела к CD43 (ART140, JL1; мышиного антитела к CD43; тяжелая цепь: SEQ ID NO: 34; легкая цепь: SEQ ID NO: 37) и 3-х разновидностей гуманизированных антител (257-10 (SEQ ID NO: 93 & 105); 456-D10 (SEQ ID NO: 94 & 106); ComboA (SEQ ID NO: 2 & 4)) и измерения интенсивности флуоресценции, и результат показан на ФИГ. 34. Показанный на ФИГ. 43 результат подтвердил, что модифицированный вариант «Combo A» показал самый лучший профиль, а все другие тестируемые антитела показали значительный уровень цитотоксичности в клетках СЕМ7. Чтобы протестировать интернализацию антител, конъюгированных с цитотоксическими веществами, в клетках, проводили обработку СЕМ7 клеток 3-мя разновидностями гуманизированных антител, предварительно объединенными в комплекс с конъюгатом (антитело к IgG человека)-сапорин, через 3 суток оценивали цитотоксичность, и результаты показаны на ФИГ. 35. Как показано на ФИГ. 35, когда использовали конъюгат на основе 3-х разновидностей модифицированных антител и сапорина, цитотоксичность была значительно высокой.
Как показано на ФИГ. 34 и 35, уровень связывания и уровень цитотоксичности in vitro различных вариантов гуманизированных антител к CD43 были одинаковыми по сравнению с мышиным антителом к CD43 (ART140, JL1). В качестве контрольной группы использовали синагис (Medimmune Company), представляющий собой гуманизированное моноклональное антитело (IgG) к антигенной детерминанте на антигенном сайте A F-белка RSV (респираторно-синцитиальный вирус).
На ФИГ. 37а и 37b с использованием проточной цитометрии показан ряд вариантов гуманизированных антител к CD43 (см. ФИГ. 36), связанных с антигеном CD43 на клеточной поверхности, по сравнению с мышиным антителом к CD43 (ART140, JL1). В качестве отрицательного контроля использовали клетки U937, дефицитные по экспрессии антигена CD43 на поверхности.
На ФИГ. 38а и 38b с использованием иммуноферментного твердофазного анализа (ELISA) показано, что ряд вариантов гуманизированного антитела к CD43 (см. ФИГ. 36), связывался с антигеном CD43 на клеточной поверхности по сравнению с мышиным антителом к CD43 (ART140, JL1). В качестве отрицательного контроля использовали клетки U937, дефицитные по экспрессии антигена CD43 на поверхности.
На ФИГ. 39а и 39b с использованием проточной цитометрии показано, что варианты гуманизированного антитела к CD43, имеющие мутации, внесенные с применением набора QuikChange (Combo A (SEQ ID NO: 91 (вариабельная область тяжелой цепи); SEQ ID NO: 103 (вариабельная область легкой цепи)), Combo В (SEQ ID NO: 91 (вариабельная область тяжелой цепи); SEQ ID NO: 103 (вариабельная область легкой цепи)), Combo С (SEQ ID NO: 85 (вариабельная область тяжелой цепи); SEQ ID NO: 97 (вариабельная область легкой цепи))), связывались с CD43 на клеточной поверхности по сравнению с мышиным антителом к CD43 (ART 140, JL1) и антителом с родительской каркасной областью из раунда 3.
На ФИГ. 41а-41с показано, что варианты гуманизированного антитела к CD43, имеющие мутации, внесенные с применением набора QuikChange (Combo A, Combo В, Combo С), связывались с антигеном JL1 на клеточной поверхности по сравнению с мышиным антителом к CD43 (ART 140, JL1) и антителом с родительской каркасной областью из раунда 3.
Пример 20. Получение модифицированного антитела посредством удаления аминокислотного остатка в участке гликозилирования гуманизированного антитела
Было обнаружено присутствие аминокислотной последовательности, обладающей способностью к гликозилированию, в вариабельной области легкой цепи (SEQ ID NO: 105) гуманизированного антитела к CD43, полученного в примере 18 (257-10, содержащего SEQ ID NO: 93 (вариабельную область тяжелой цепи) + SEQ ID NO: 105 (вариабельную область легкой цепи)) и с целью ее удаления получали мутантное антитело.
Поскольку гликозилирование связывающегося с эпитопом участка легкой цепи (вариабельной области легкой цепи), весьма вероятно окажет отрицательное влияние на антигенсвязывающую способность и физические свойства антитела и может привести к ухудшению продуктивности при последующем массовом производстве, вероятность разработки антитела как терапевтического агента повышали путем замены аминокислоты, которая может быть гликозилирована, на другие аминокислоты.
Остаток аминокислоты аспарагин (Asn, N) в положении 50 и остаток аминокислоты серии (Ser, S) в положении 52 были выбраны как аминокислоты, которые могут быть гликозилированы в вариабельной области легкой цепи (SEQ ID NO: 105) гуманизированного антитела к CD43 (см. ФИГ. 43). Мутантное антитело получали путем замены в положении 50 остатка аминокислоты аспарагин (Asn, N) в SEQ ID NO: 8 на глутамин (Gln, Q) или аланин (Ala, А) и/или замены в положении 52 остатка аминокислоты серии (Ser, S) на аланин (Ala, А), и вариабельные области легкой цепи мутантного антитела, полученные как описано выше, показаны в SEQ ID NO: 107 (S52A), 108 (N50Q) и 109 (N50A).

Получали антитело IgG1 типа, содержащее вариабельную область тяжелой цепи (SEQ ID NO: 93) и вариабельную область легкой цепи полученного модифицированного антитела 55, и проводили вестерн-блоттинг, используя конъюгат (конкавалин A)-HRP (Sigma-Aldrich), связывающийся с участком гликозилирования.
Полученный результат показан на ФИГ. 44. Показанный на ФИГ. 44 результат подтвердил, что конкавалин А связывался и с участком легкой цепи, и с участком тяжелой цепи в антителе, у которого аминокислоты в участке гликозилирования не были модифицированы (содержащем SEQ ID NO: 93 и SEQ ID NO: 105; дикий тип), но связывания с участком легкой цепи не происходило в случае трех разновидностей модифицированных антител (scFv). Этот результат означает, что участок гликозилирования легкой цепи антитела был удален.
Помимо этого анализировали антигенсвязывающую способность посредством измерения способности антител связываться с CD43-положительными клетками, клетками СЕМ7. Полученный результат показан на ФИГ. 45. Как показано на ФИГ. 45, модифицированное антитело демонстрировало антигенсвязывающую способность, аналогичную таковой для антитела дикого типа.
Химерное антитело (DNP001) и модифицированное гуманизированное антитело с удаленным участком гликозилирования (вариабельная область тяжелой цепи; SEQ ID NO: 93; вариабельная область легкой цепи: SEQ ID NO: 109) связывали с антиген(CD43)-положительными клетками, клетками СЕМ7, и их анализ проводили с применением проточной цитометрии. Полученный результат показан на ФИГ. 46. Как показано на ФИГ. 46, было подтверждено, что модифицированное гуманизированное антитело проявляло более выраженную способность к связыванию с CD43-экспрессирующими клетками, чем химерное антитело.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитело, связывающееся с карбоангидразой, и его применение | 2017 |
|
RU2727682C1 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2627176C2 |
| АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С MUC1, И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2746413C1 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |
| АНТИТЕЛА ПРОТИВ ВСПОМОГАТЕЛЬНОГО БЕЛКА РЕЦЕПТОРА ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-1 (IL1RAP) И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2710787C2 |
| Конъюгаты "антитело-лекарственное средство" | 2012 |
|
RU2624141C2 |
| КОНЪЮГАТЫ АНТИ-РТК7 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2708075C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2008 |
|
RU2571923C2 |
| АНТИТЕЛА, УЗНАЮЩИЕ УГЛЕВОДСОДЕРЖАЩИЙ ЭПИТОП НА CD43 И СЕА, ЭКСПРЕССИРУЕМЫХ НА РАКОВЫХ КЛЕТКАХ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2528738C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
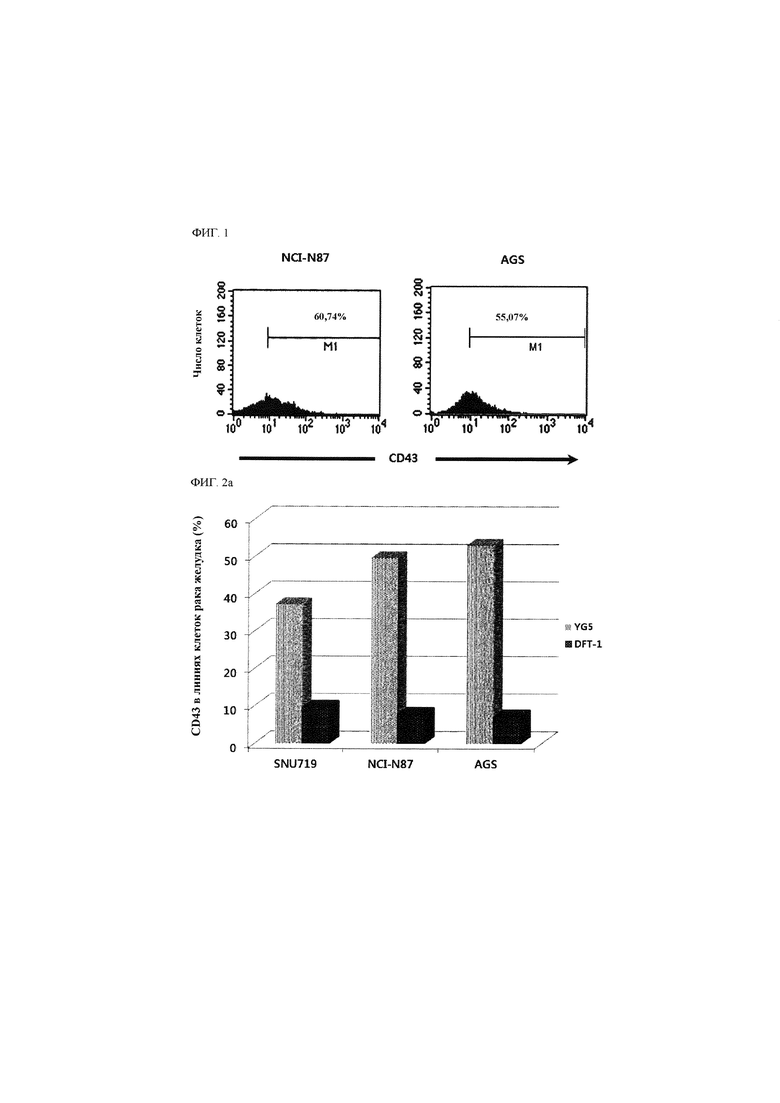
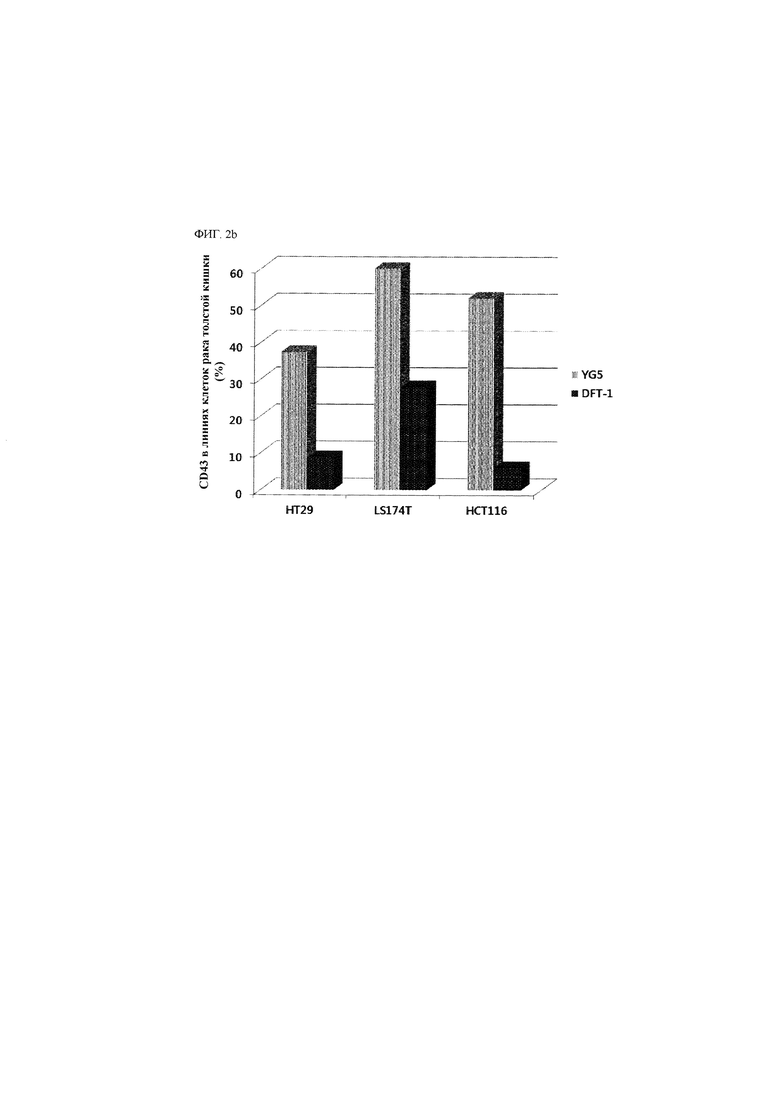
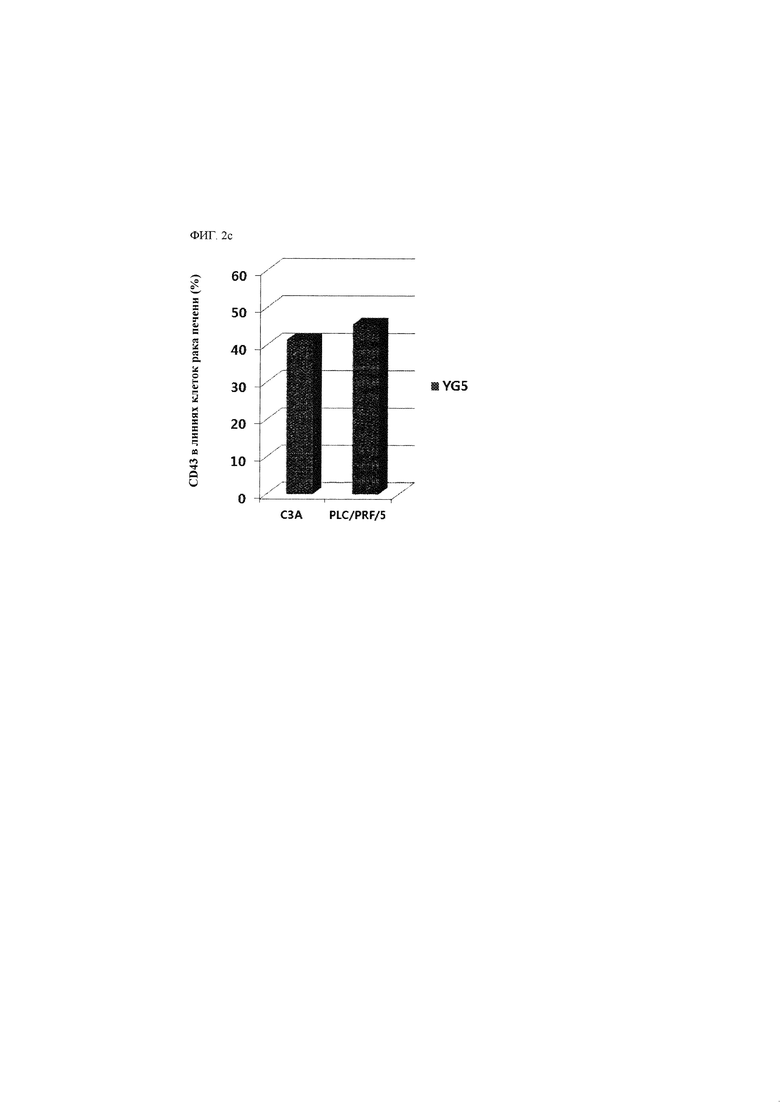
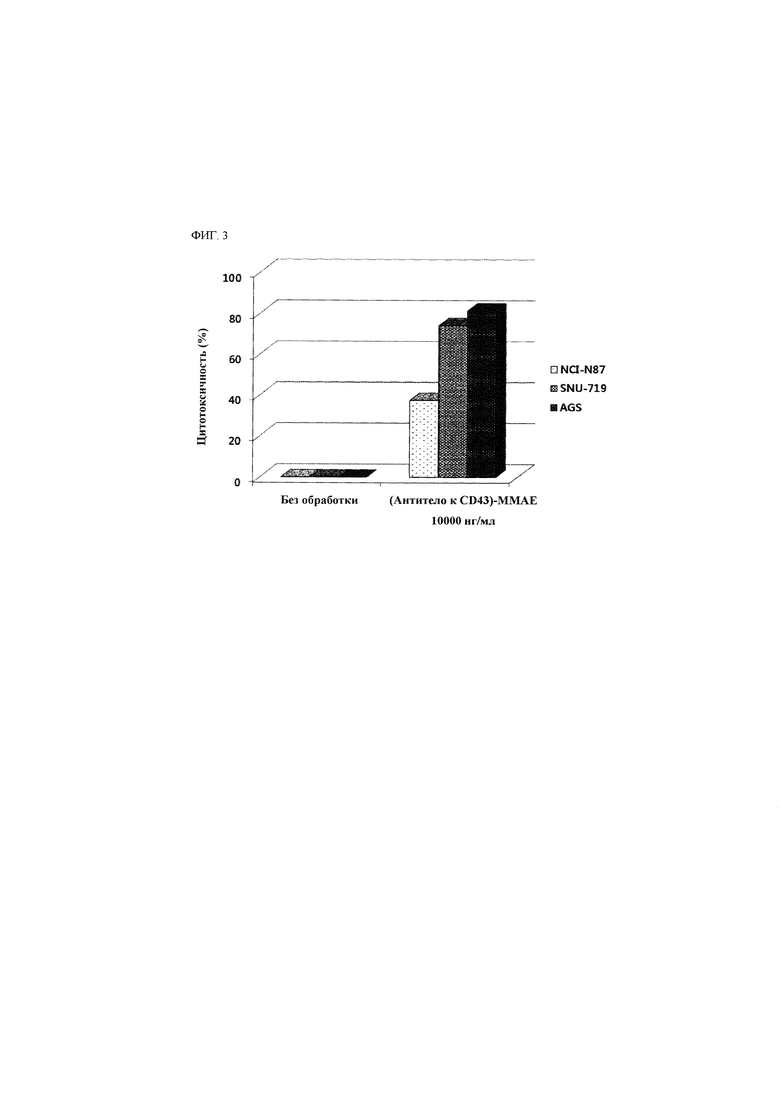
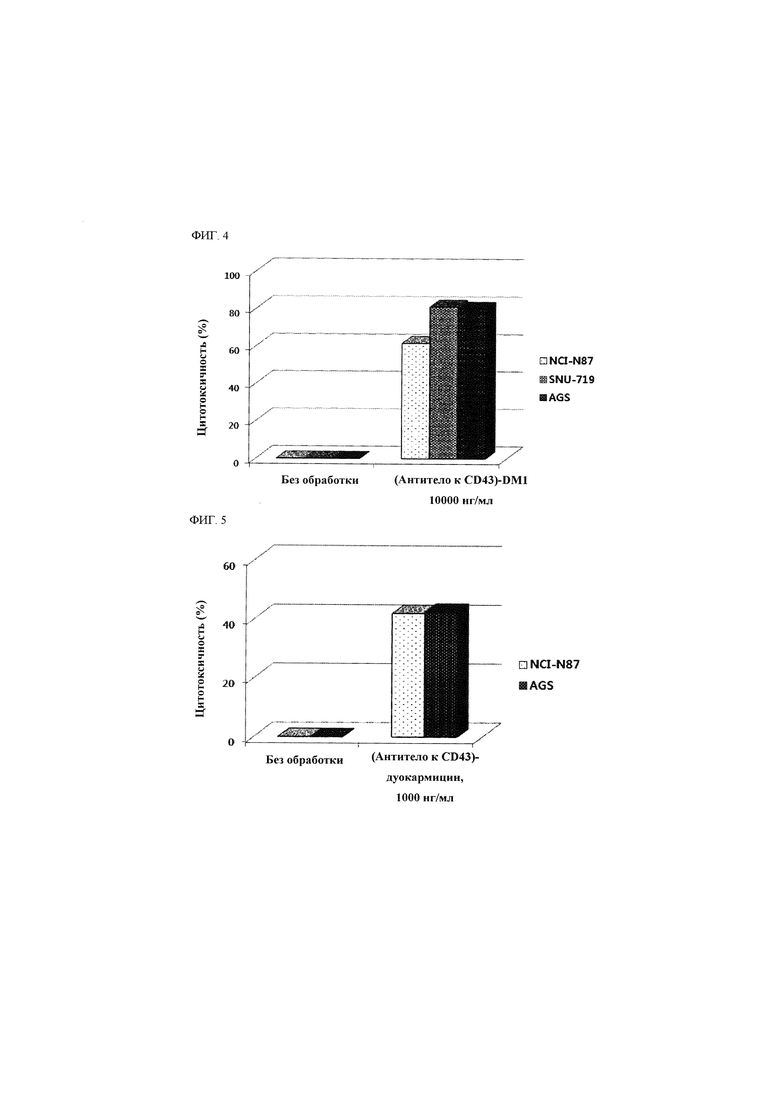

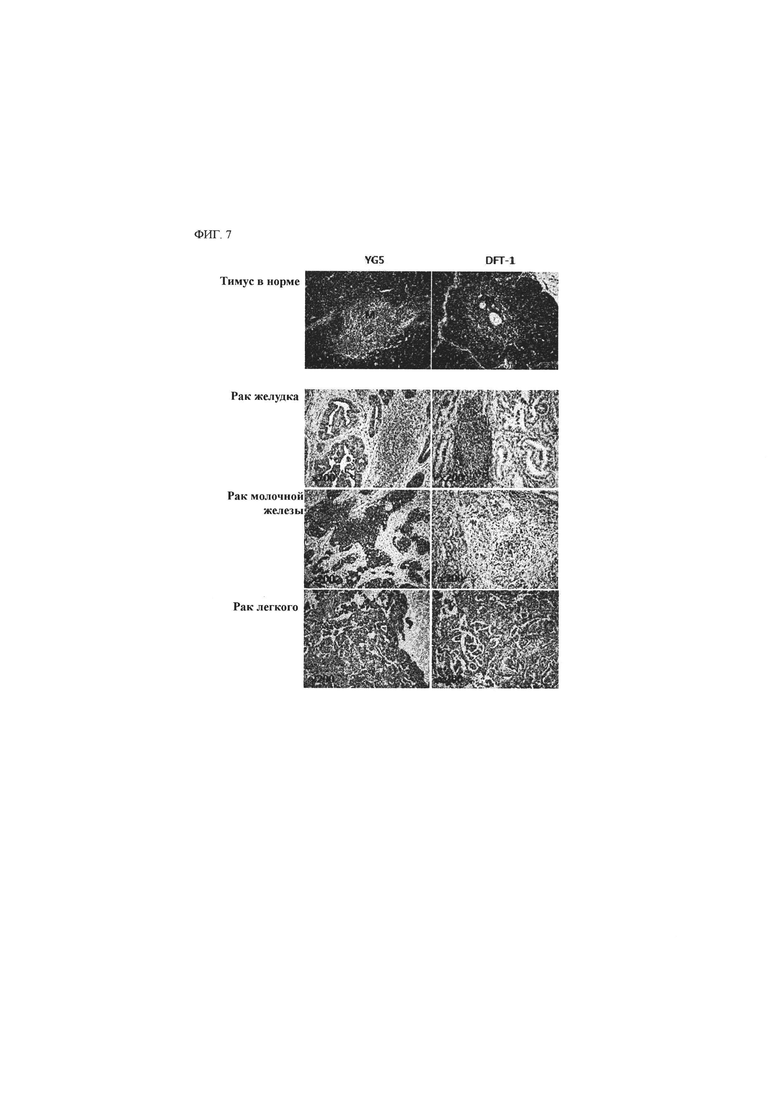

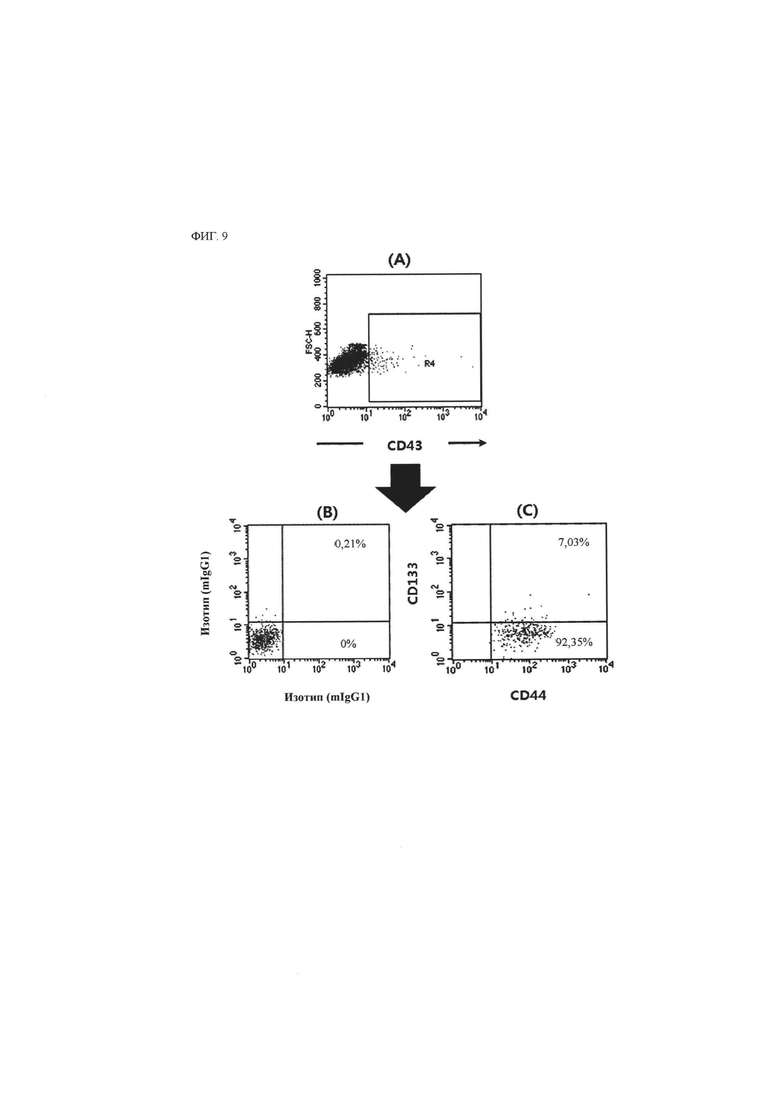
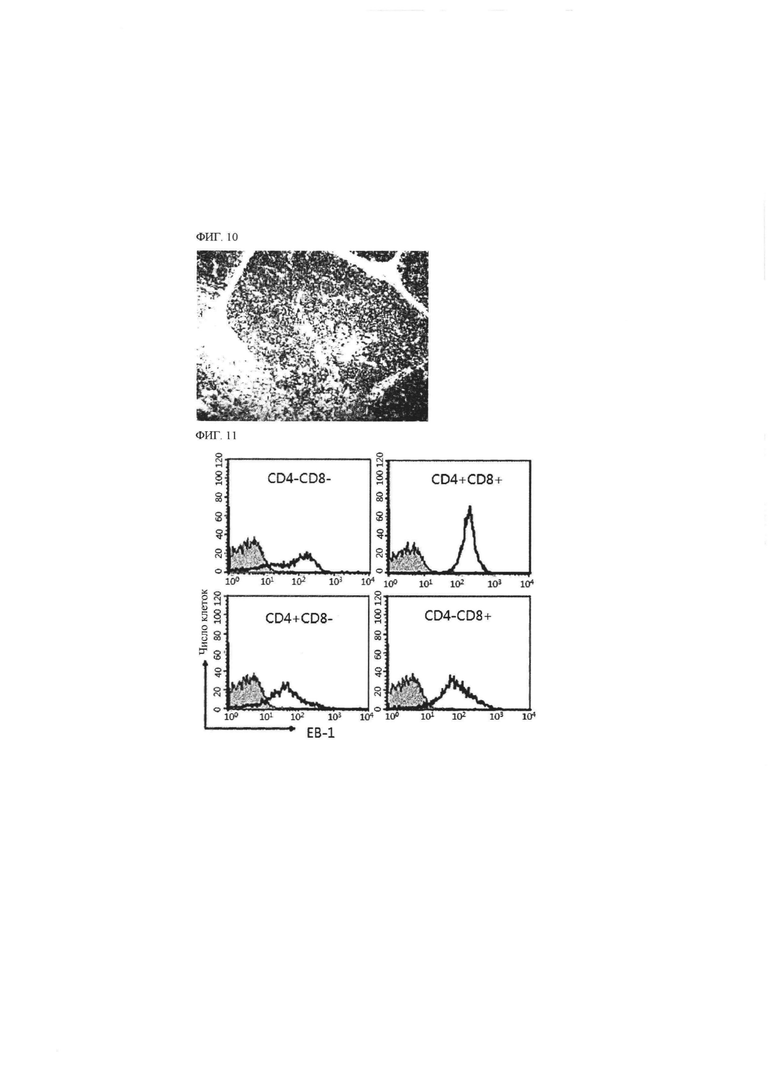


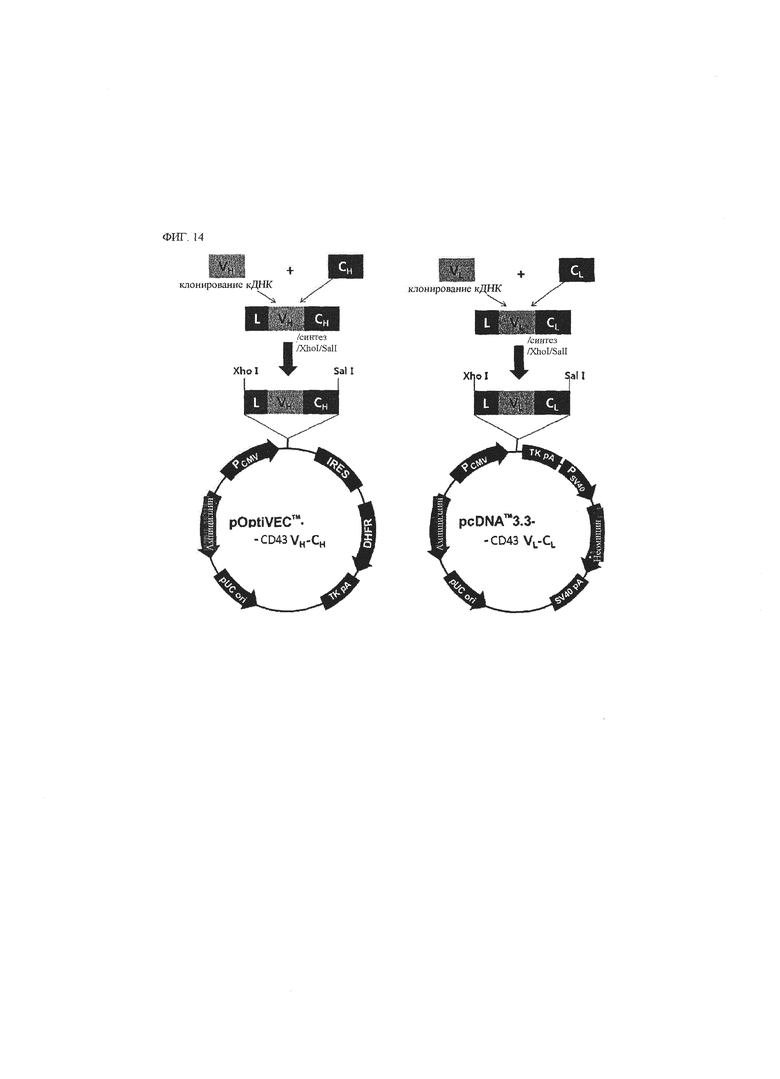
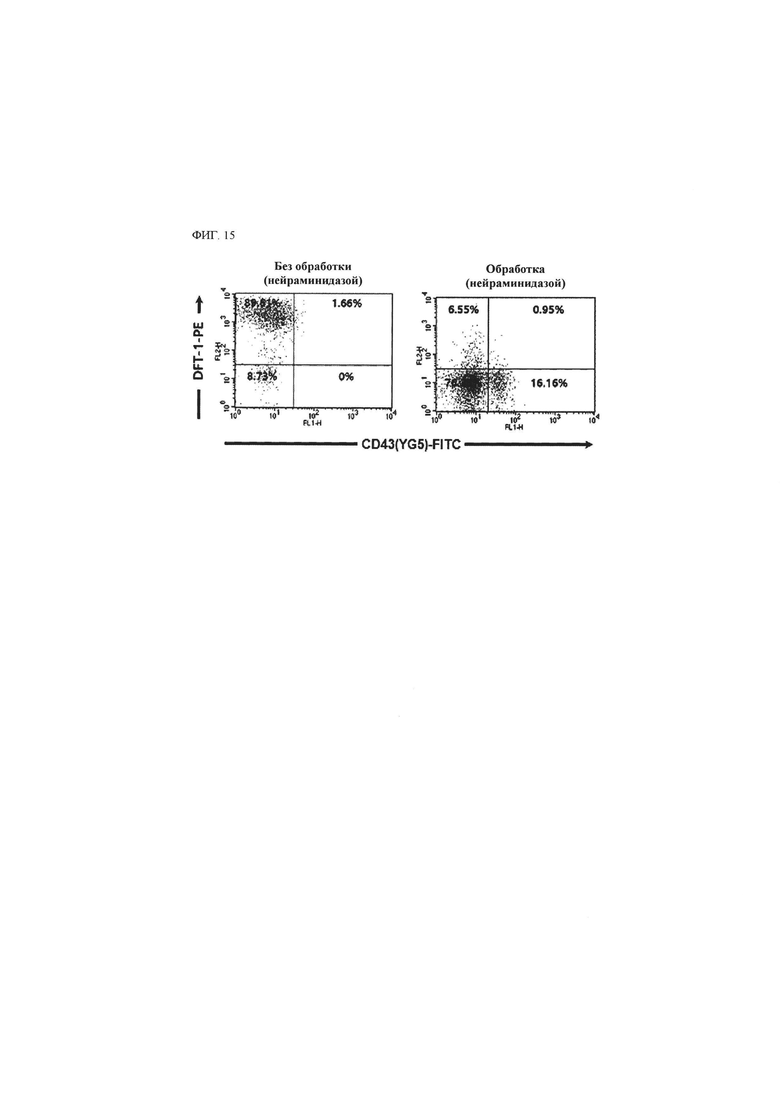
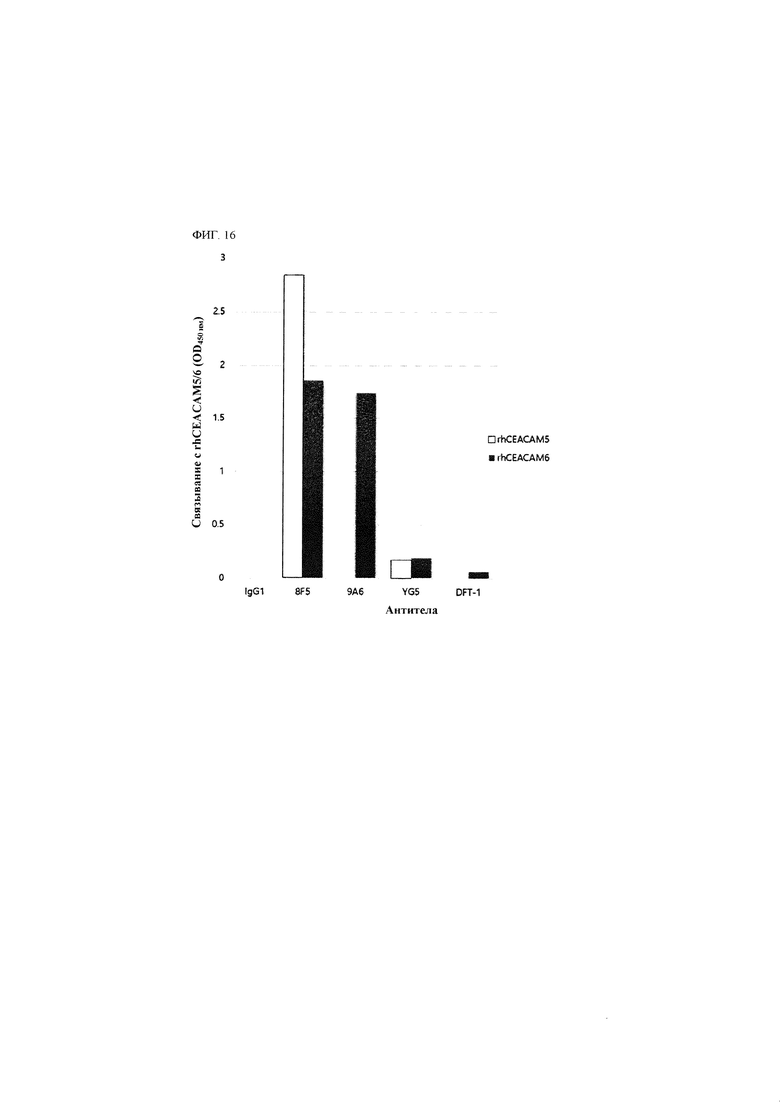

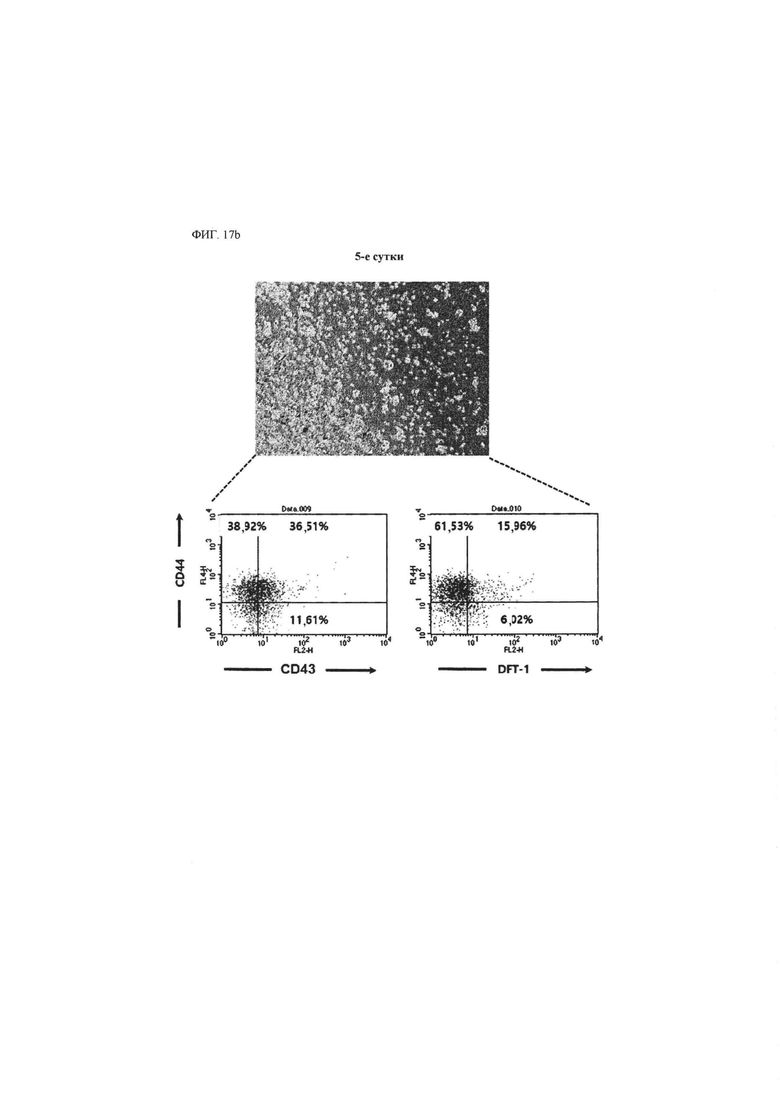

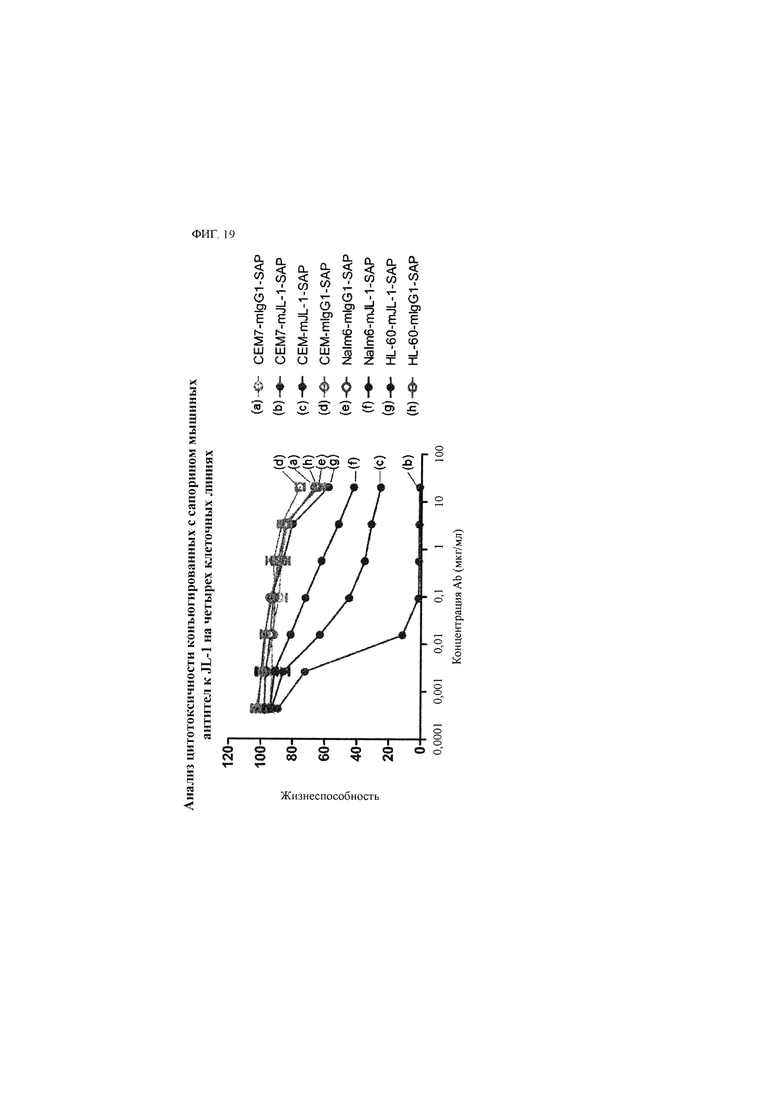
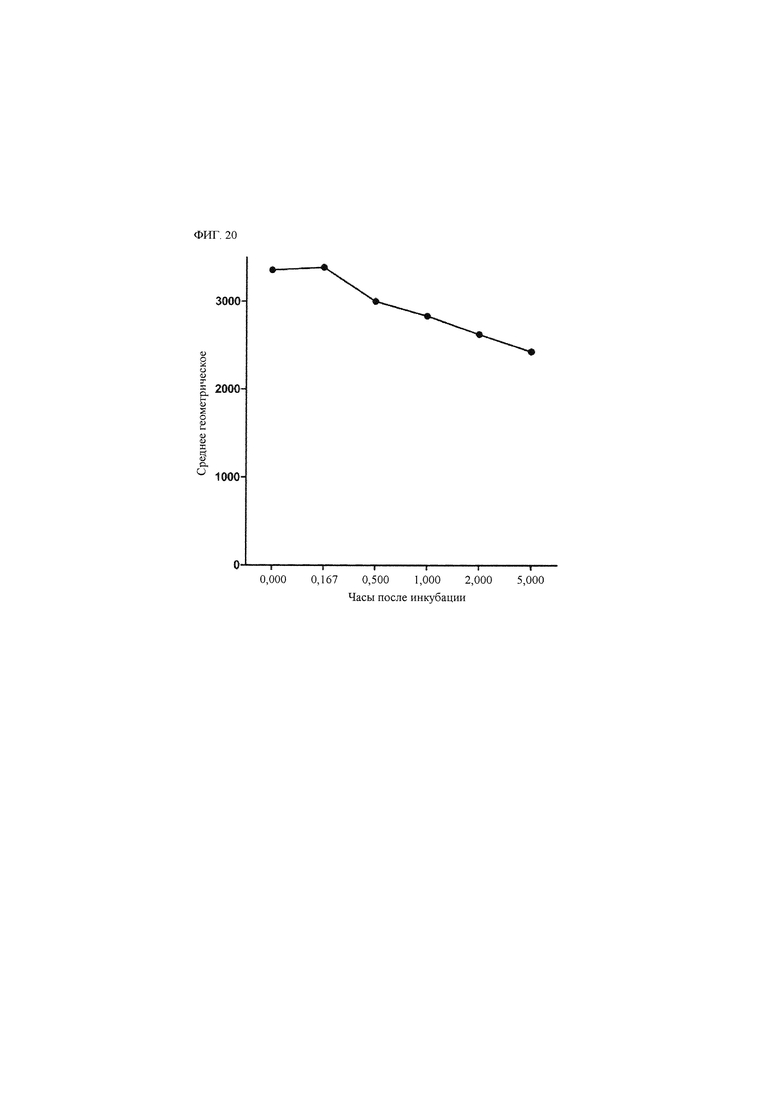

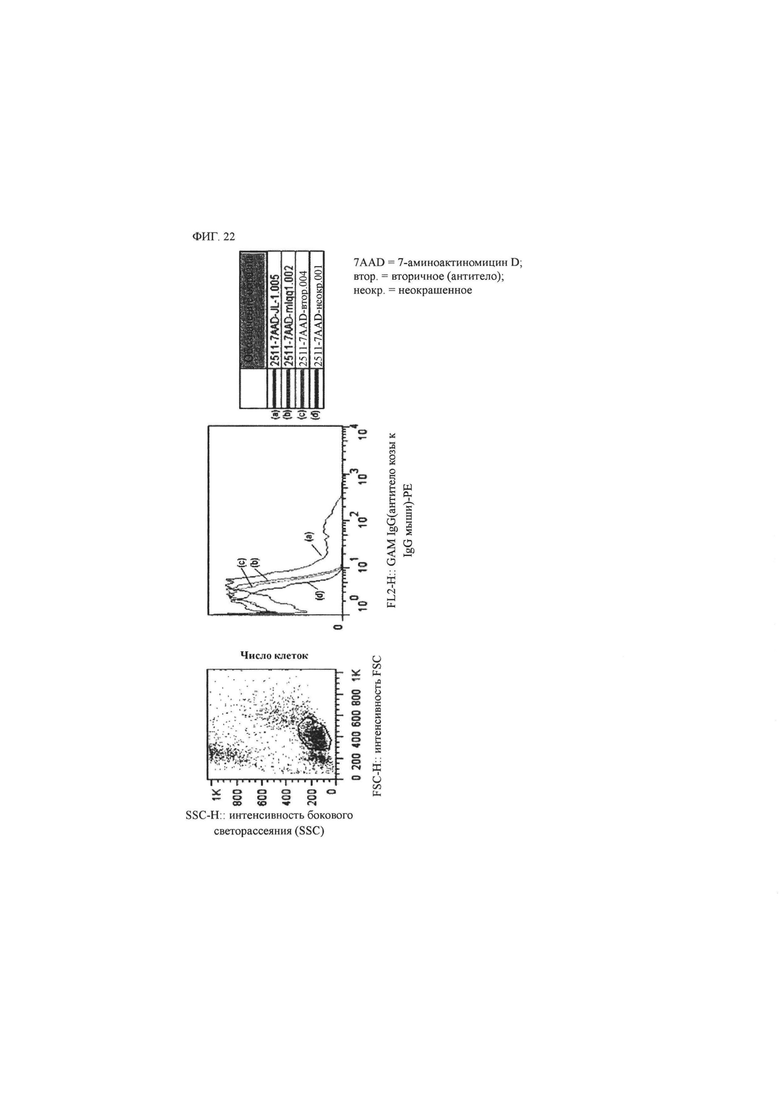
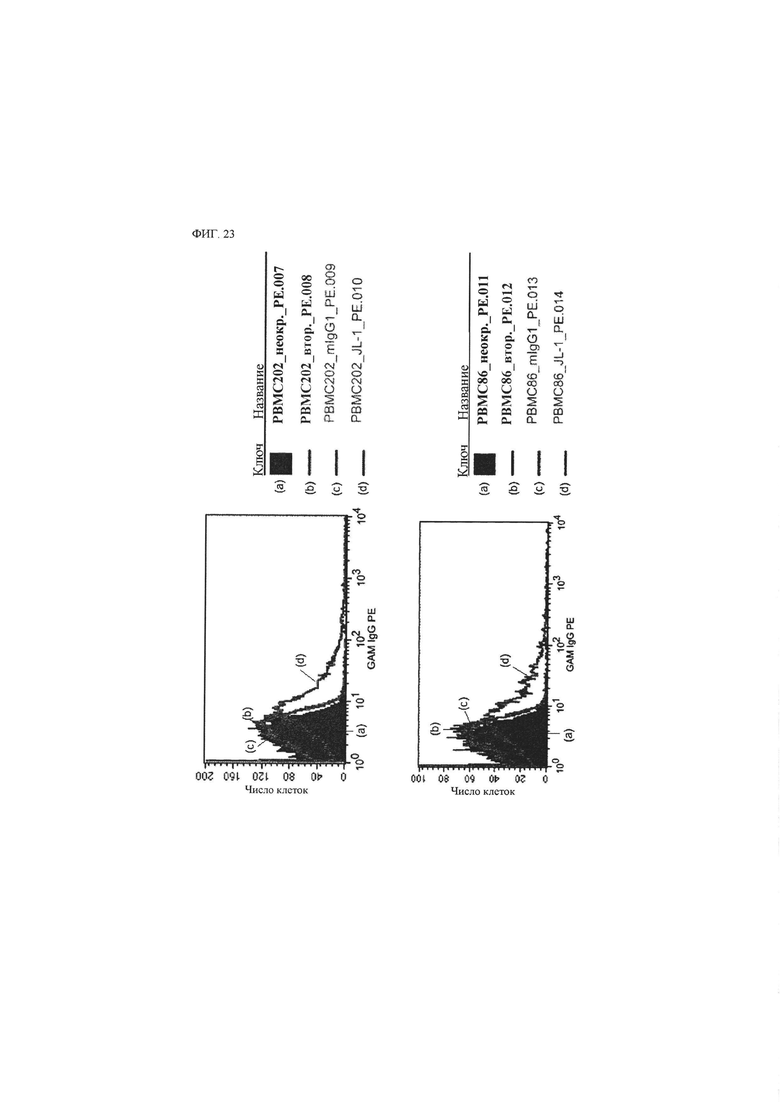
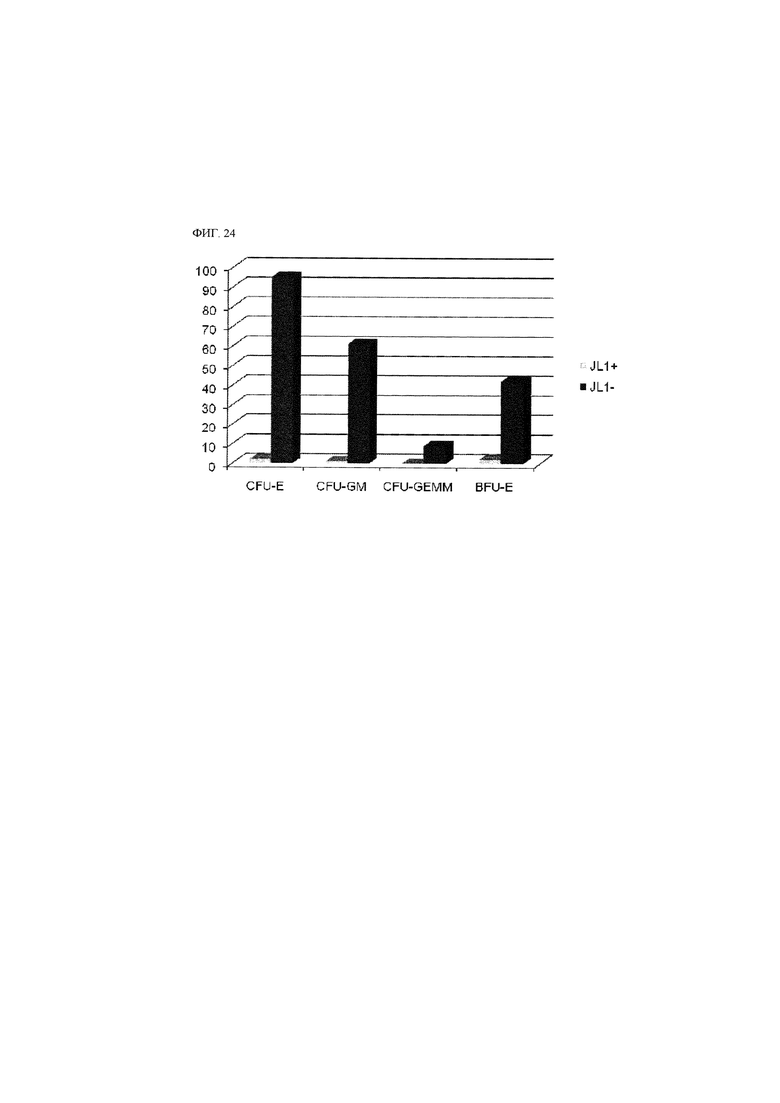
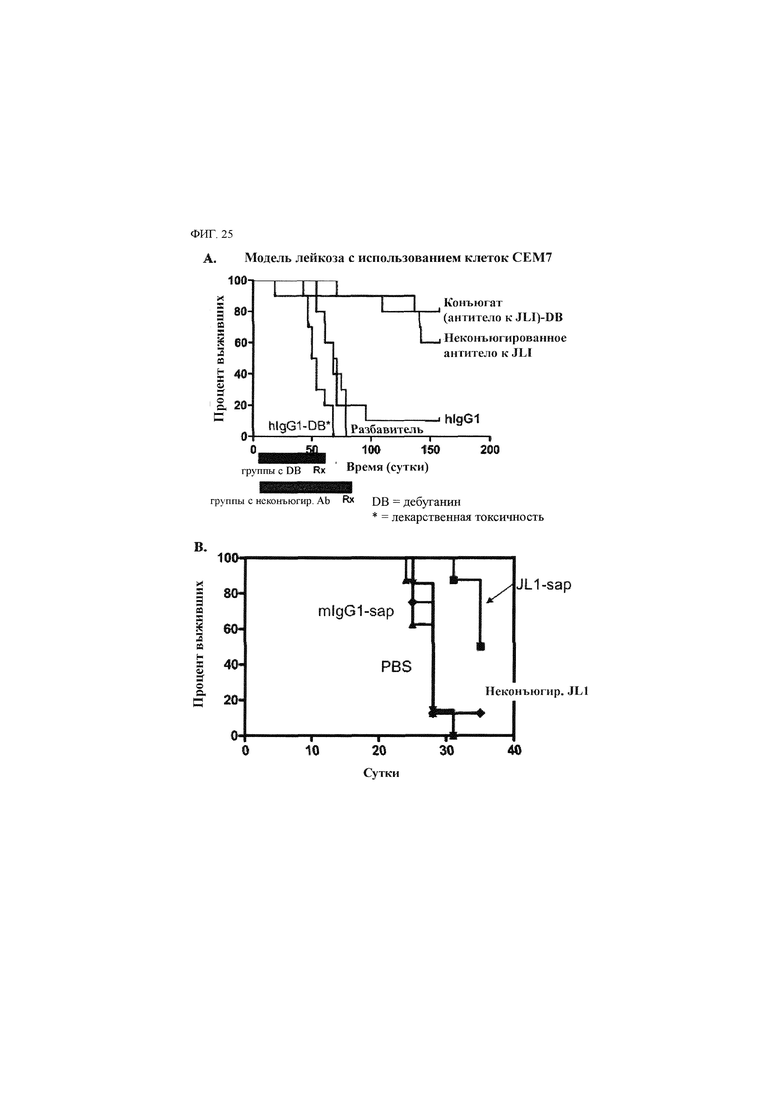
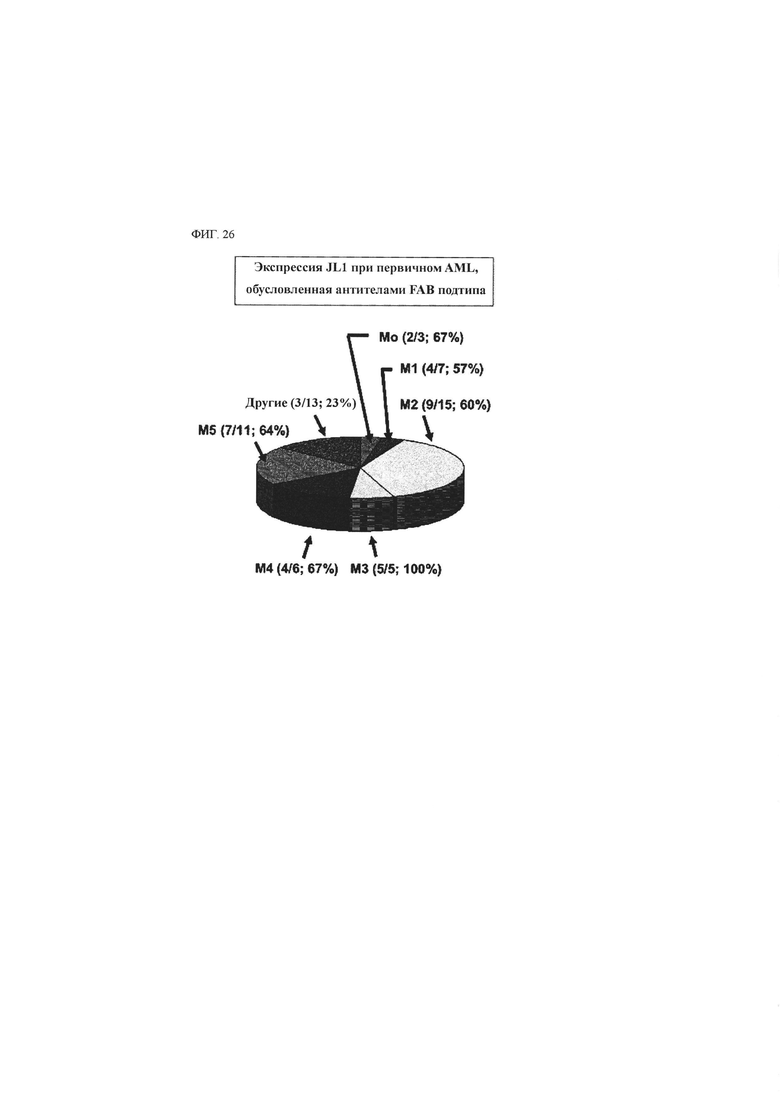
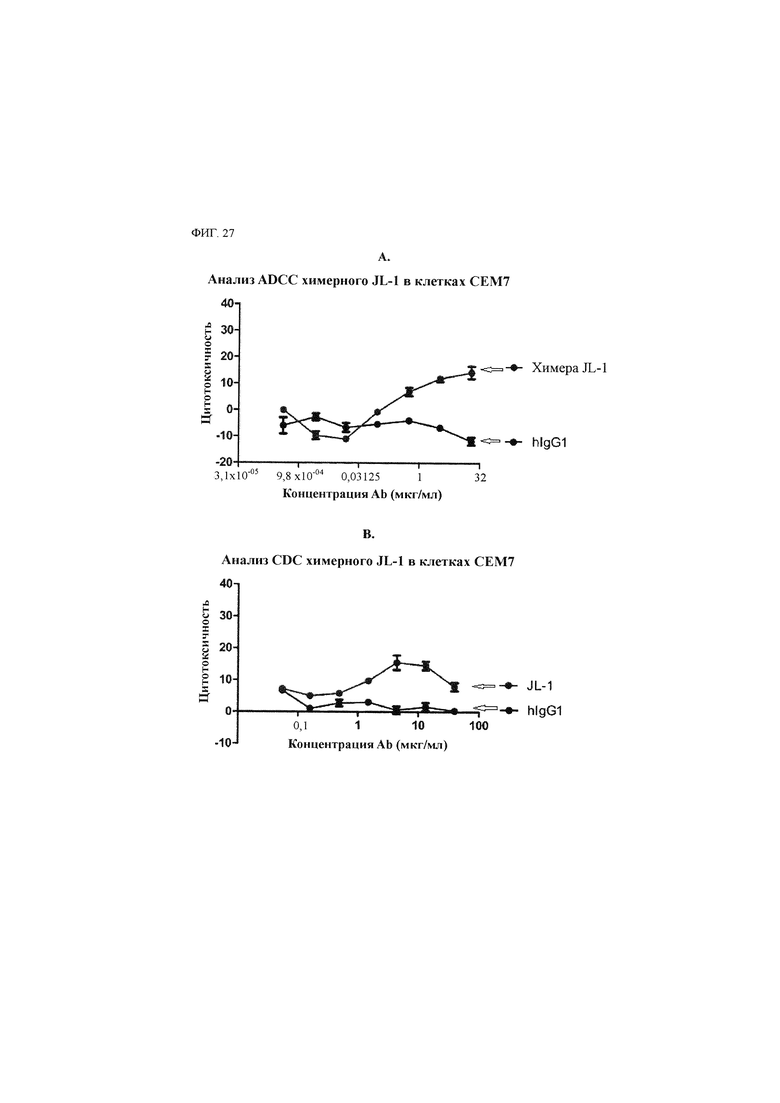
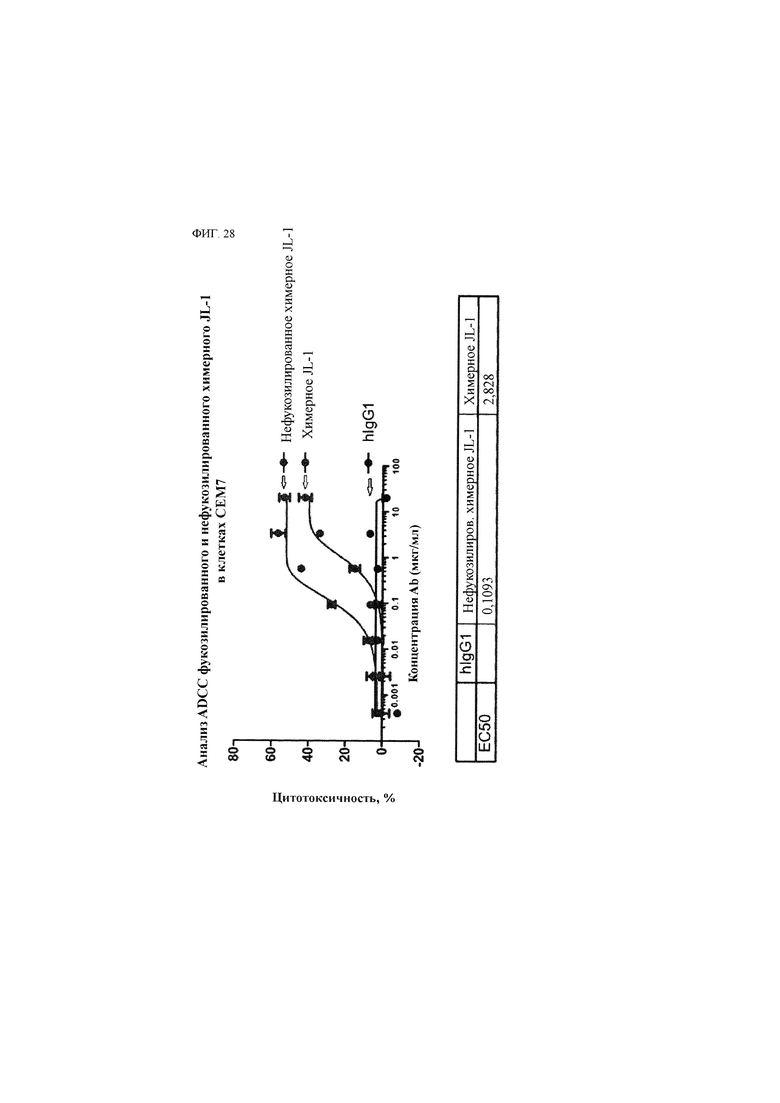
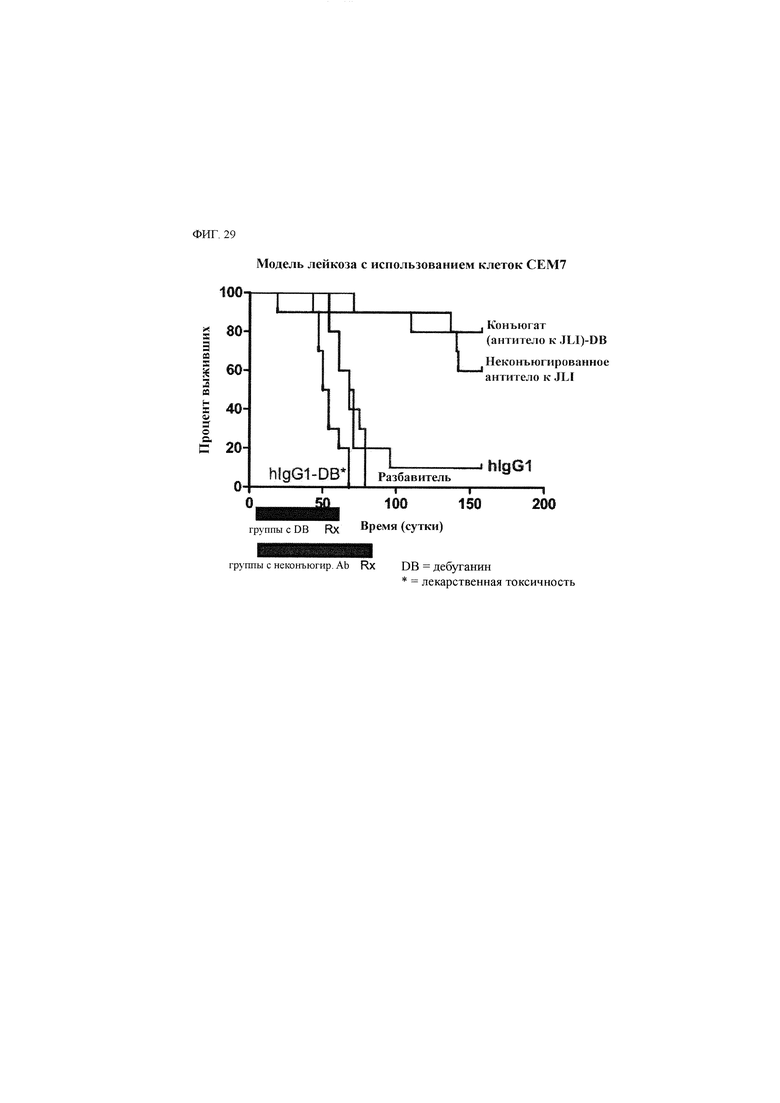
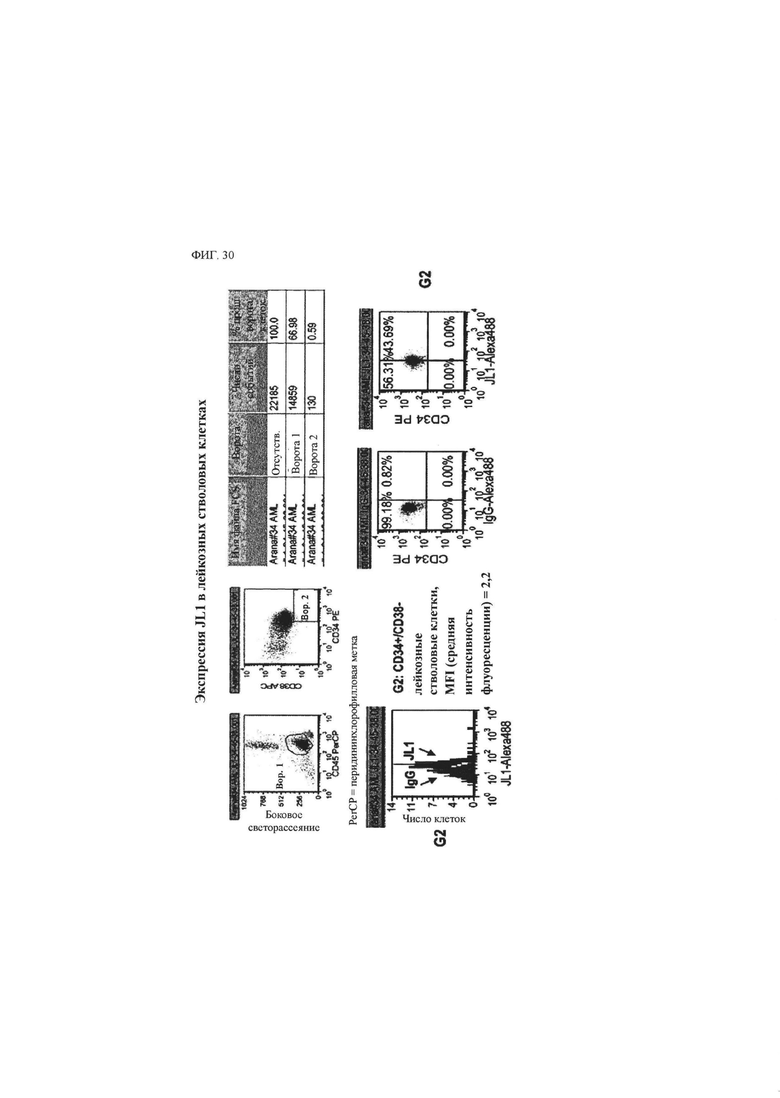
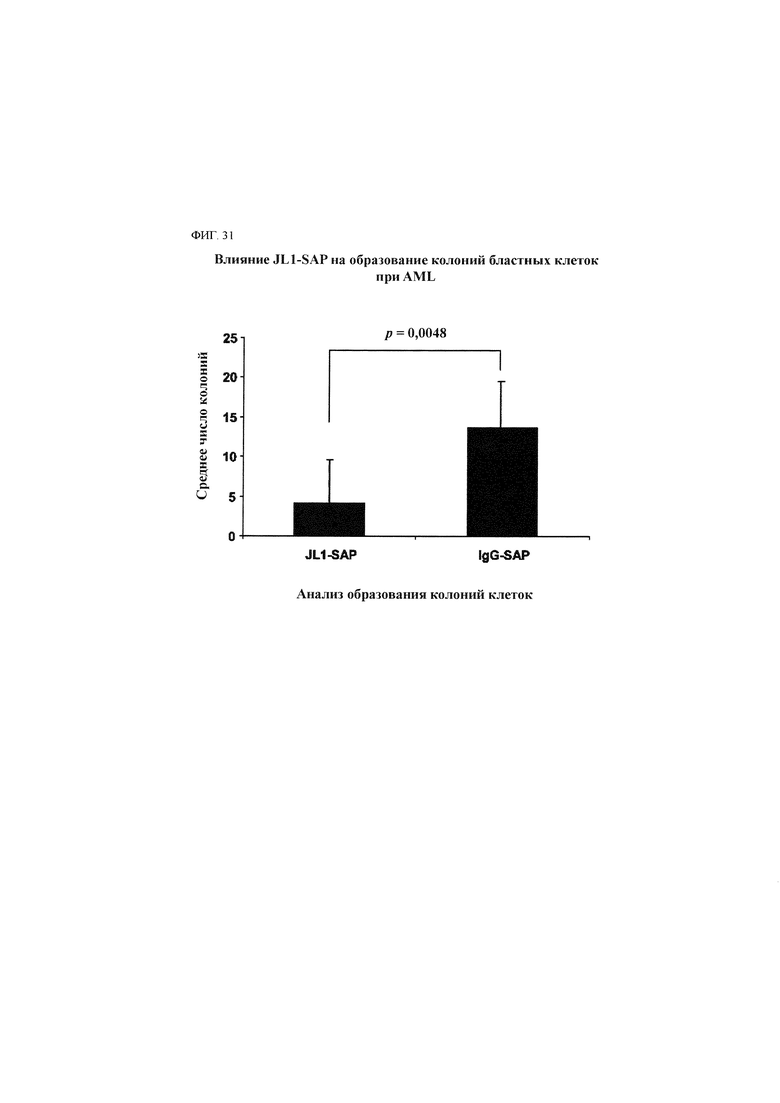
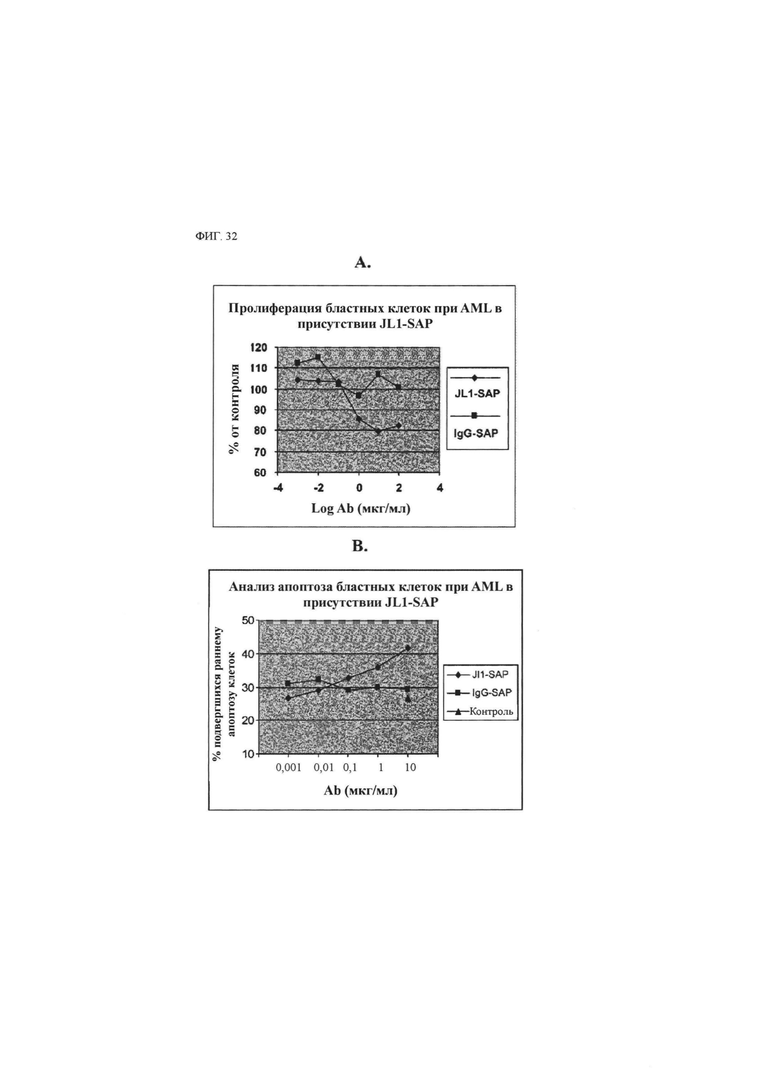
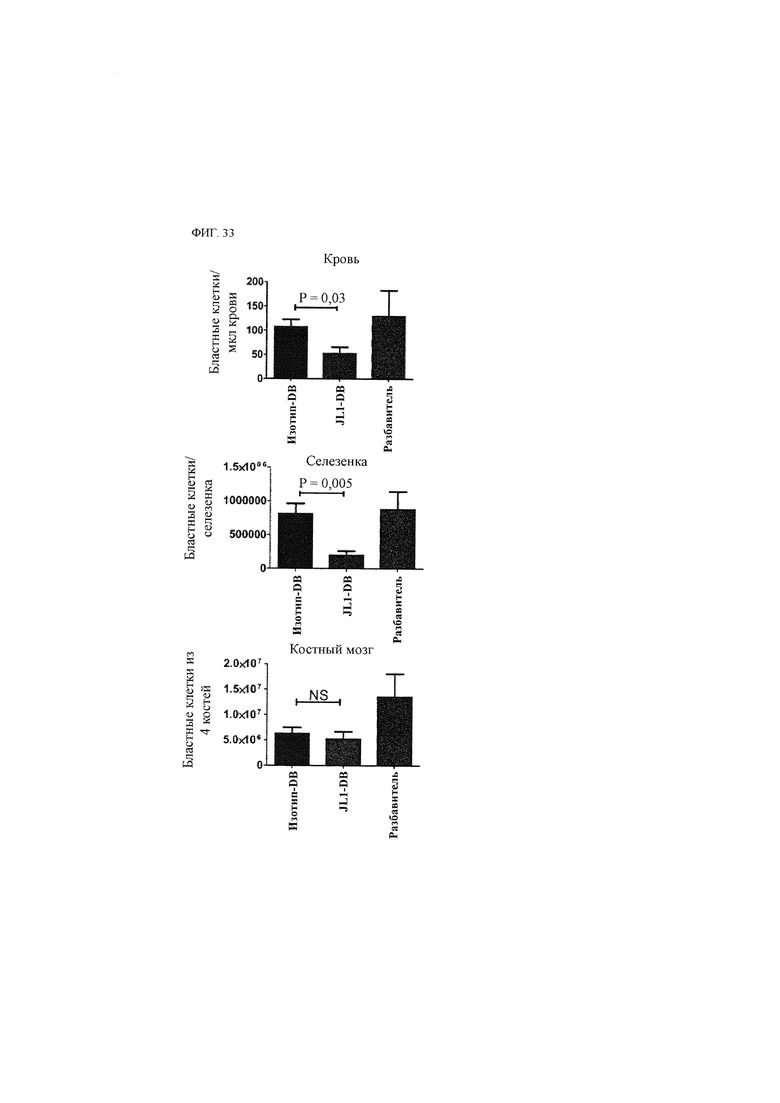
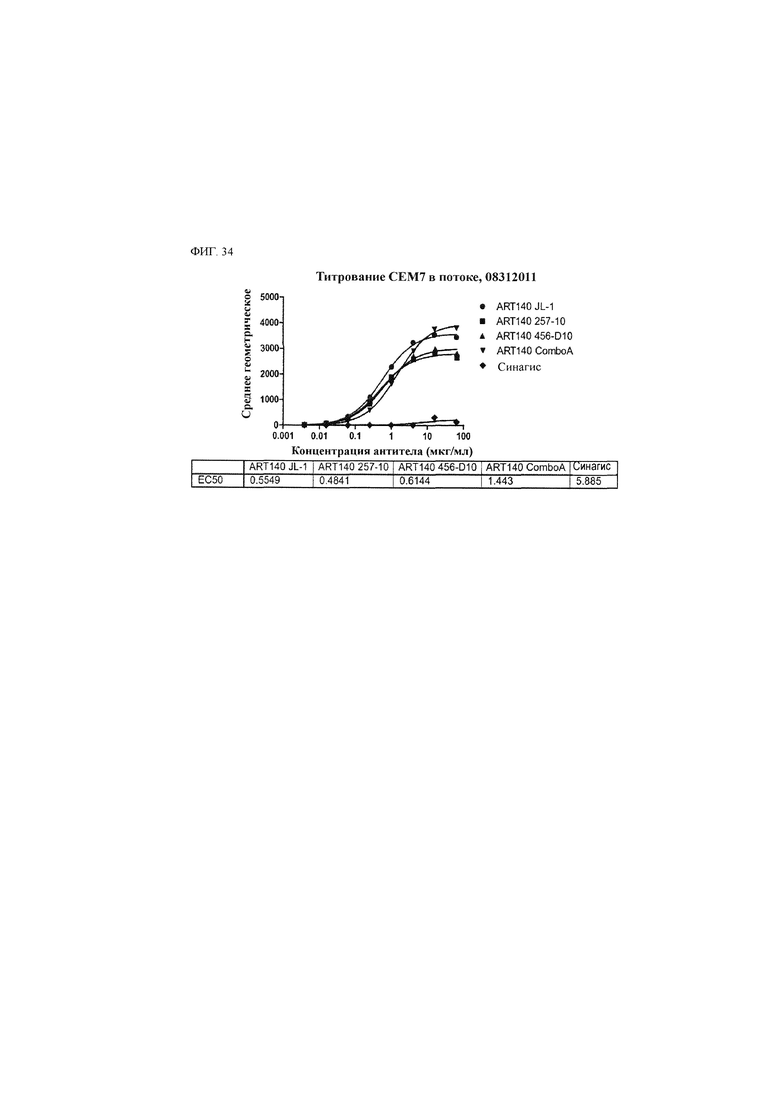
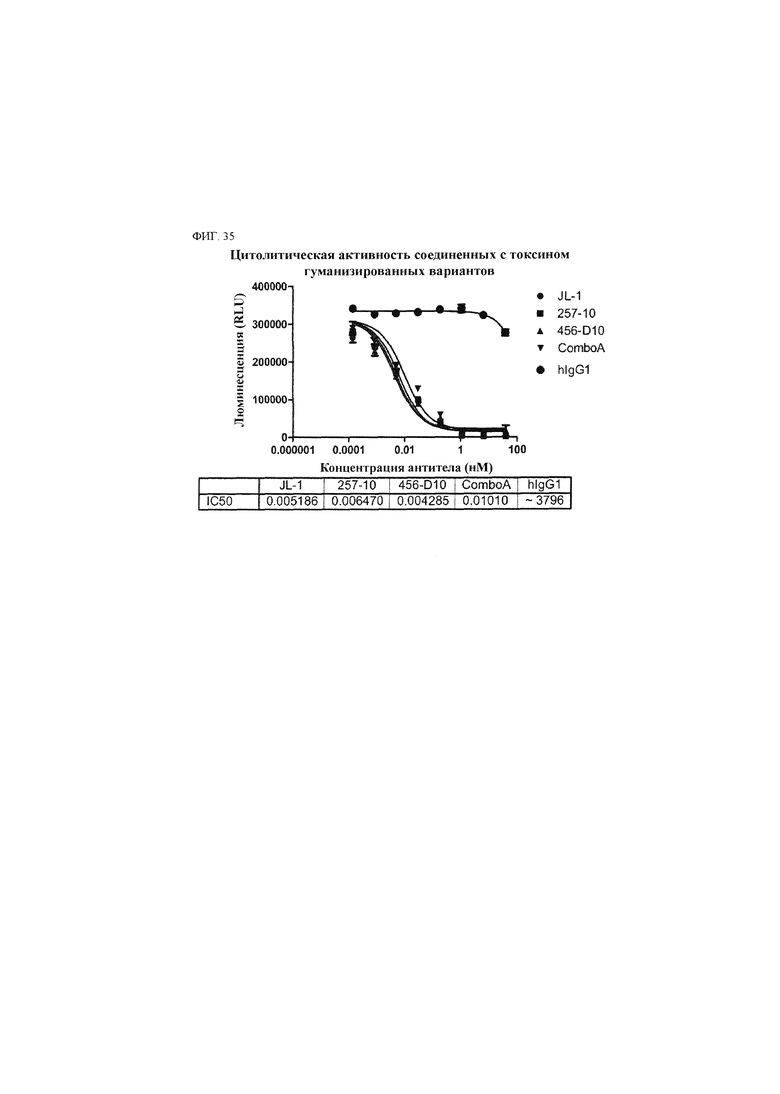

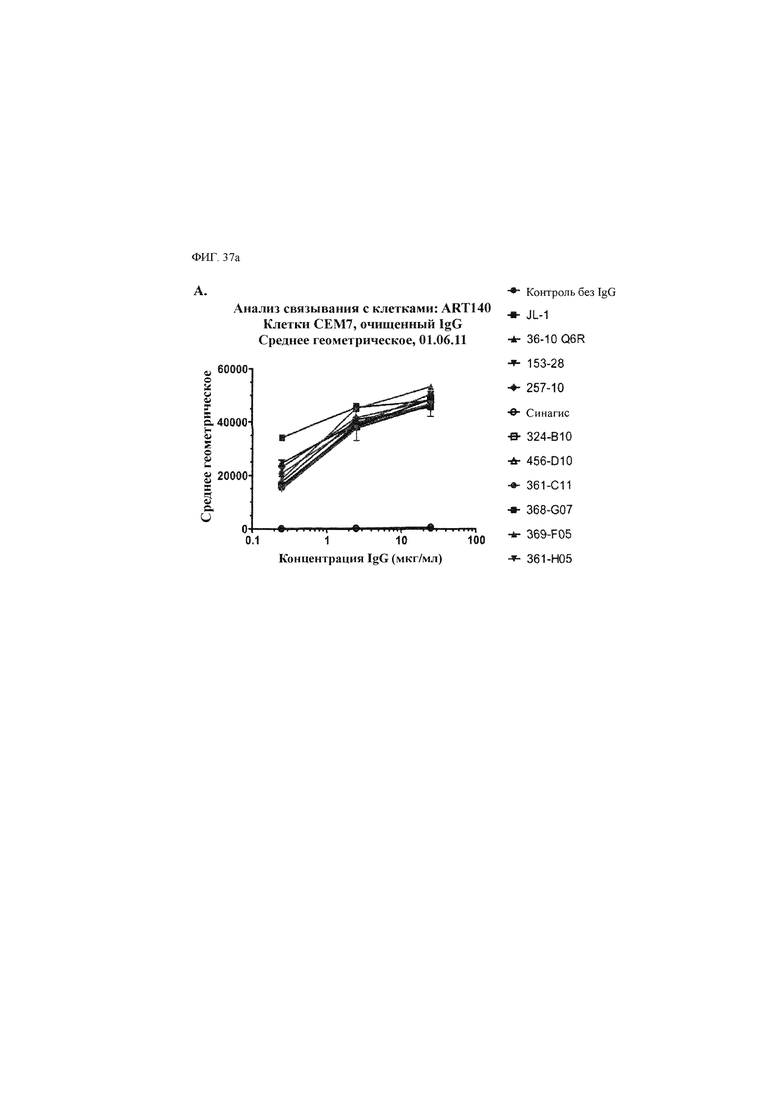
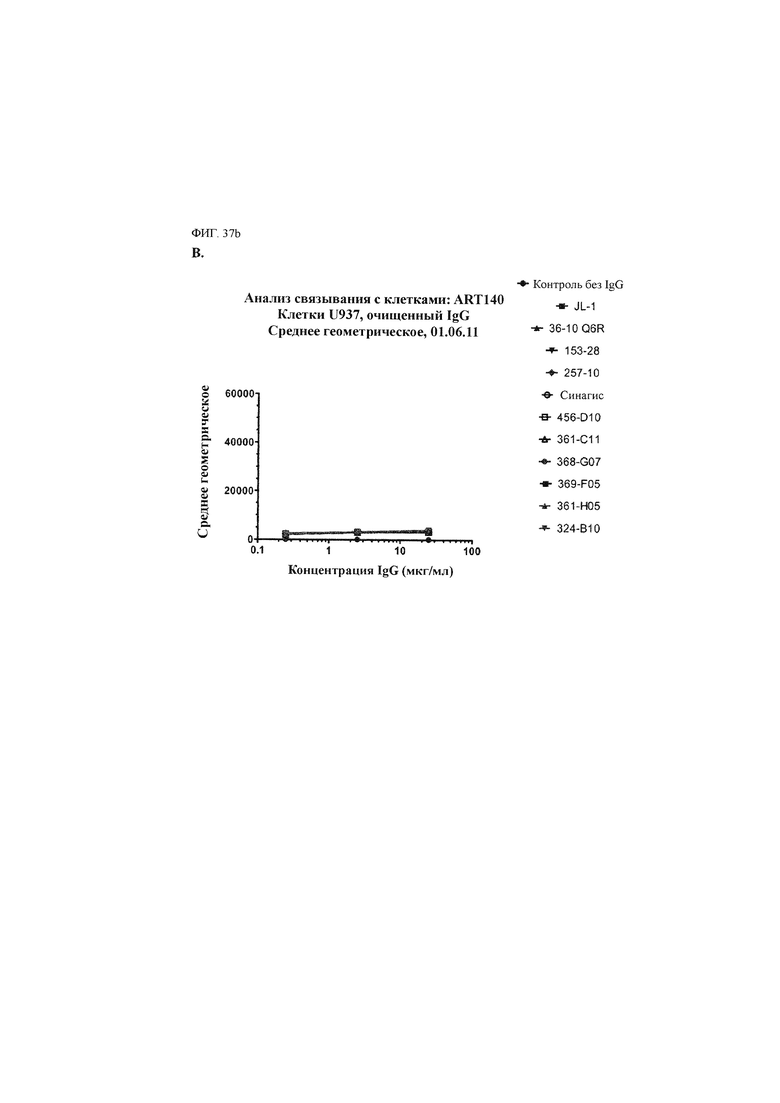
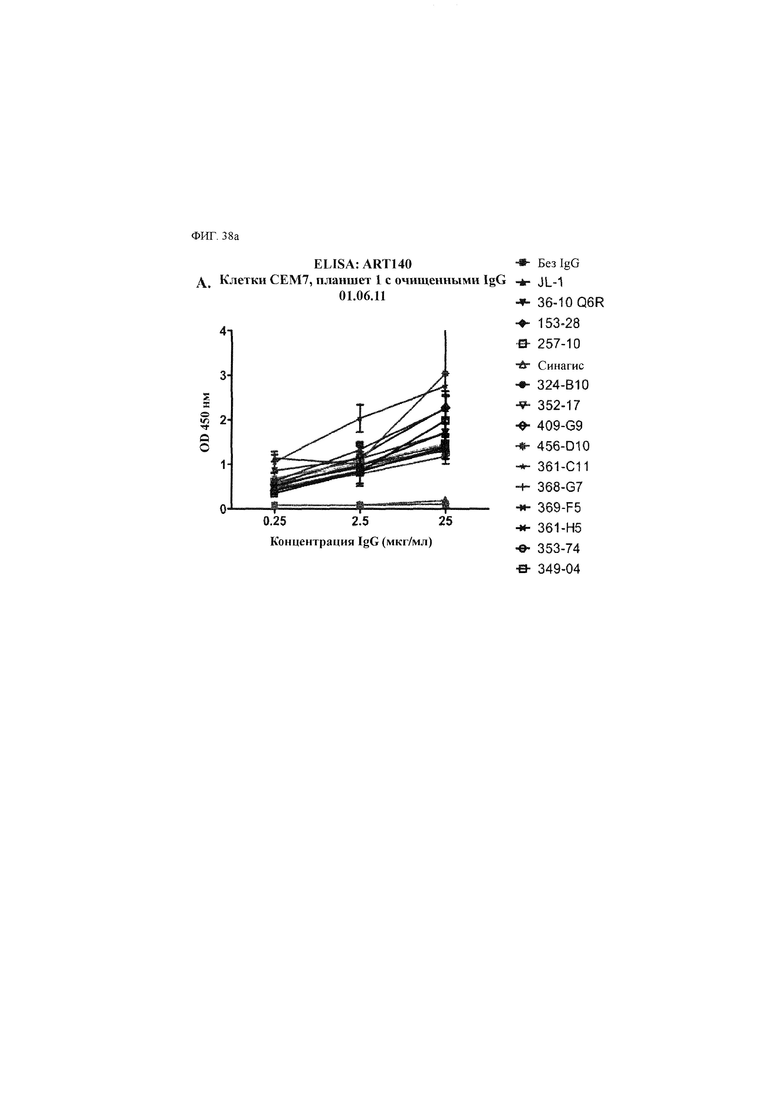
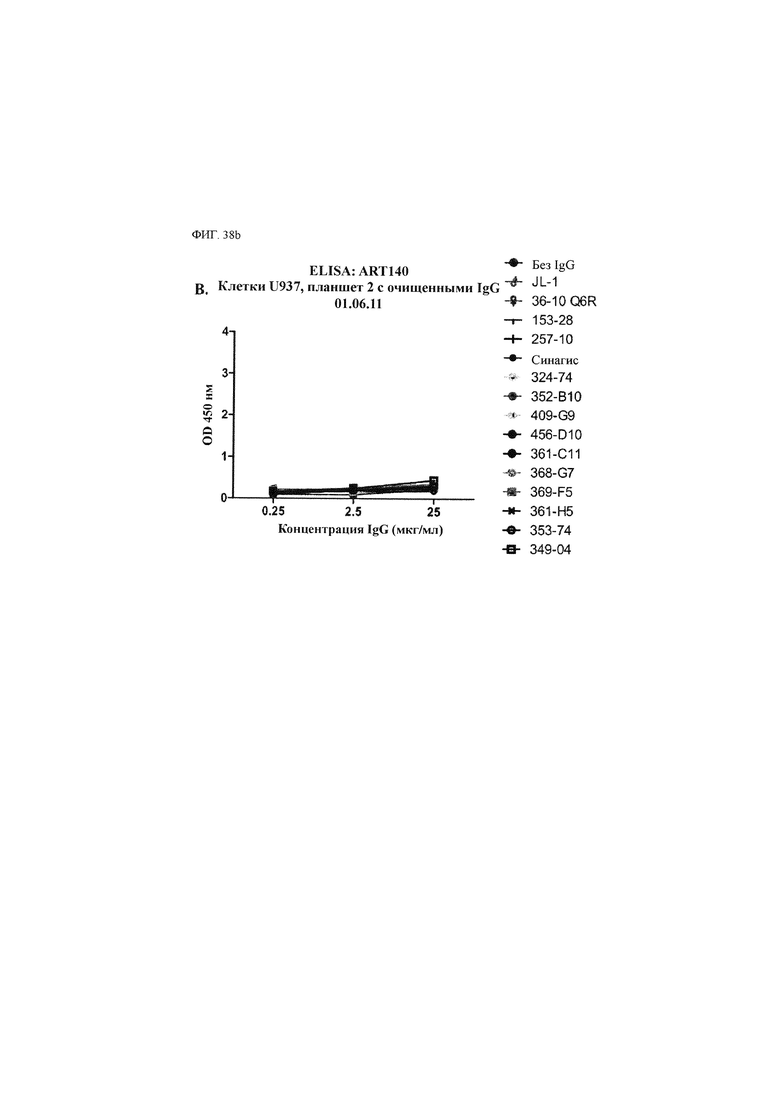
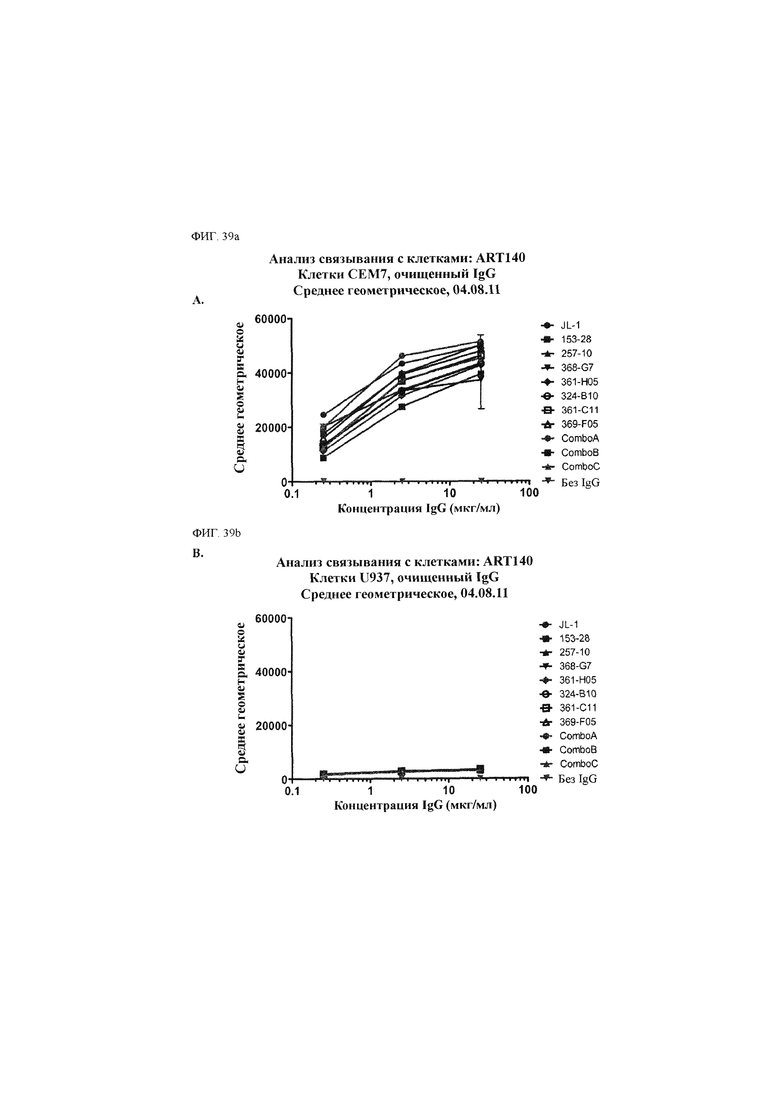
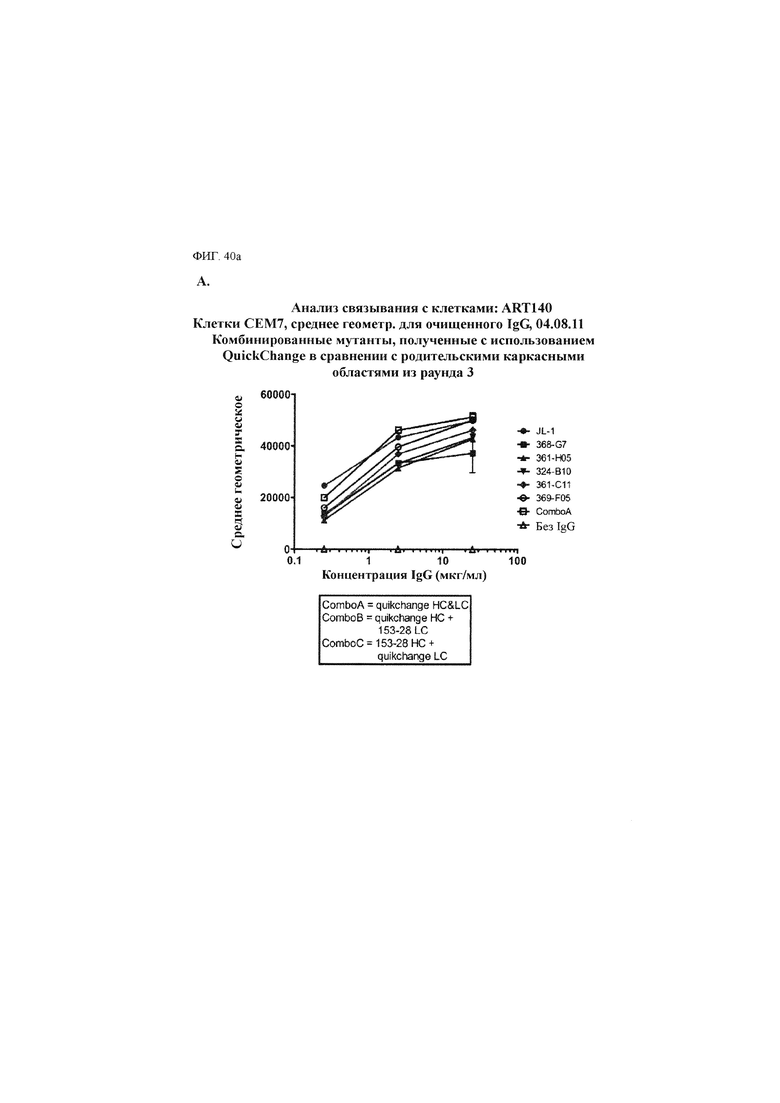
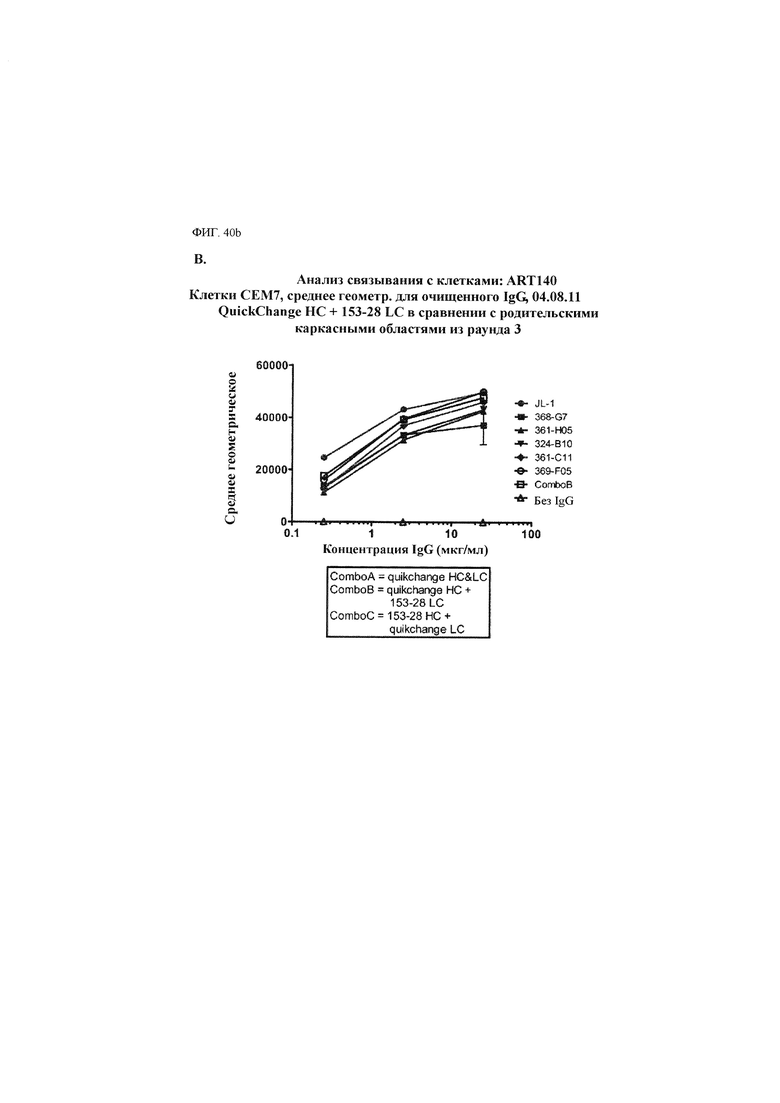
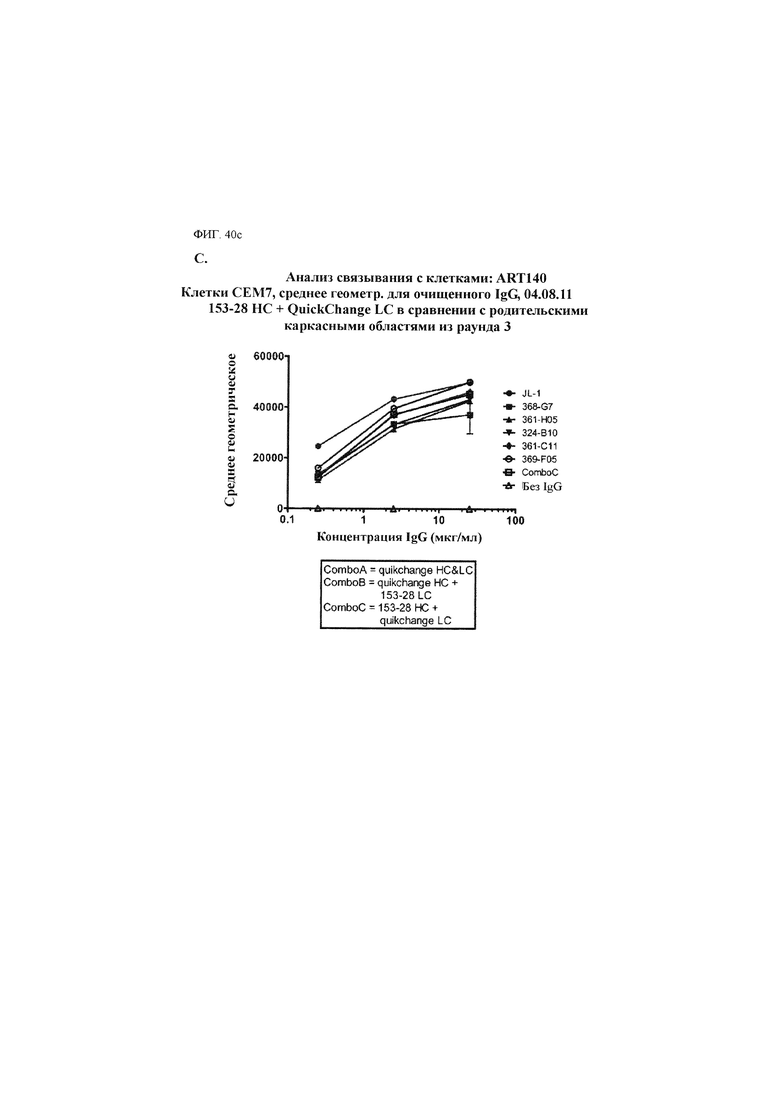
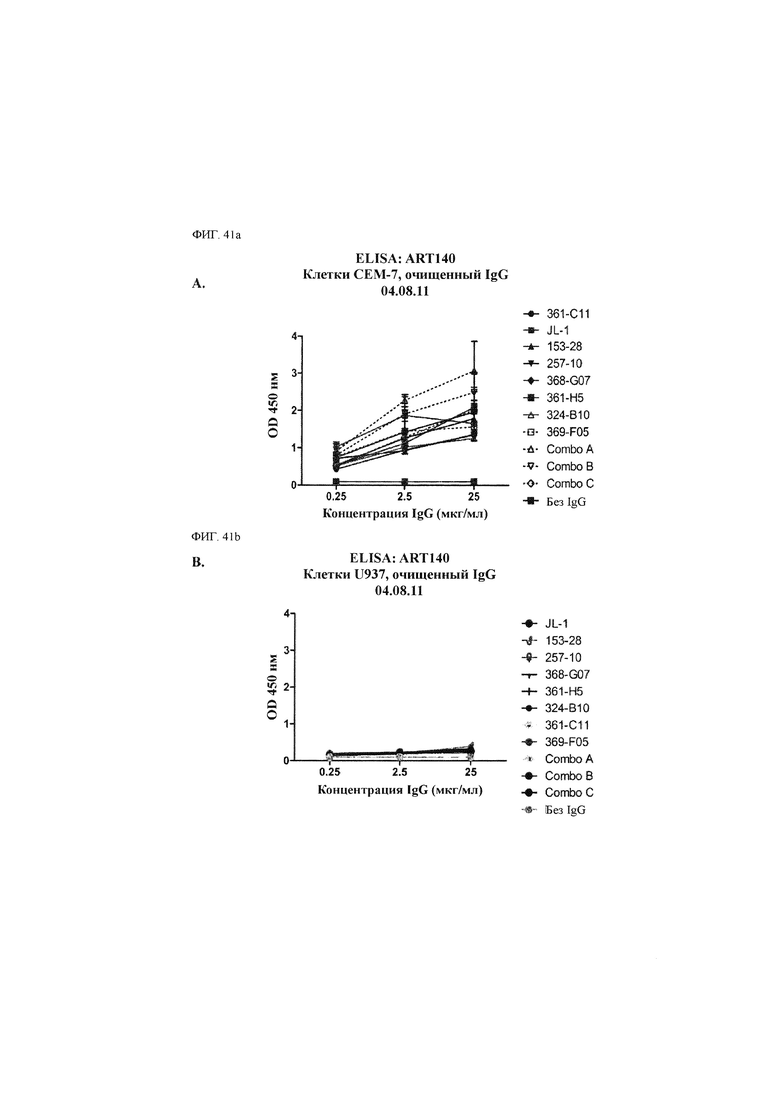
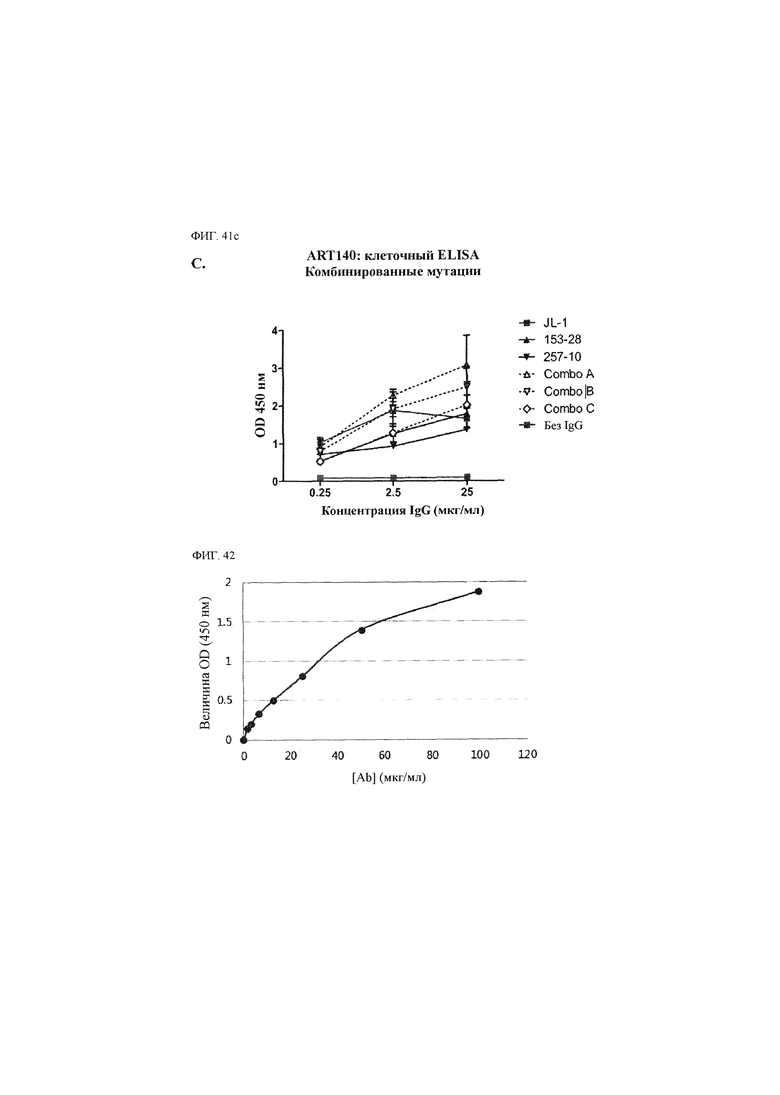
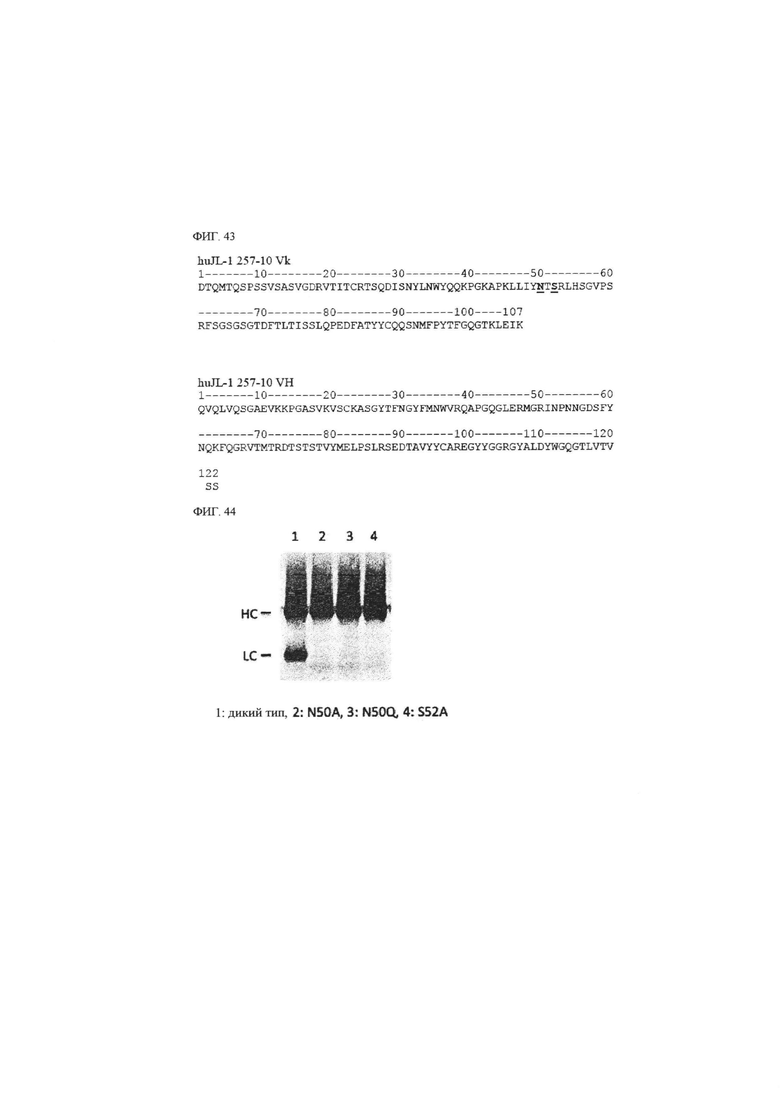
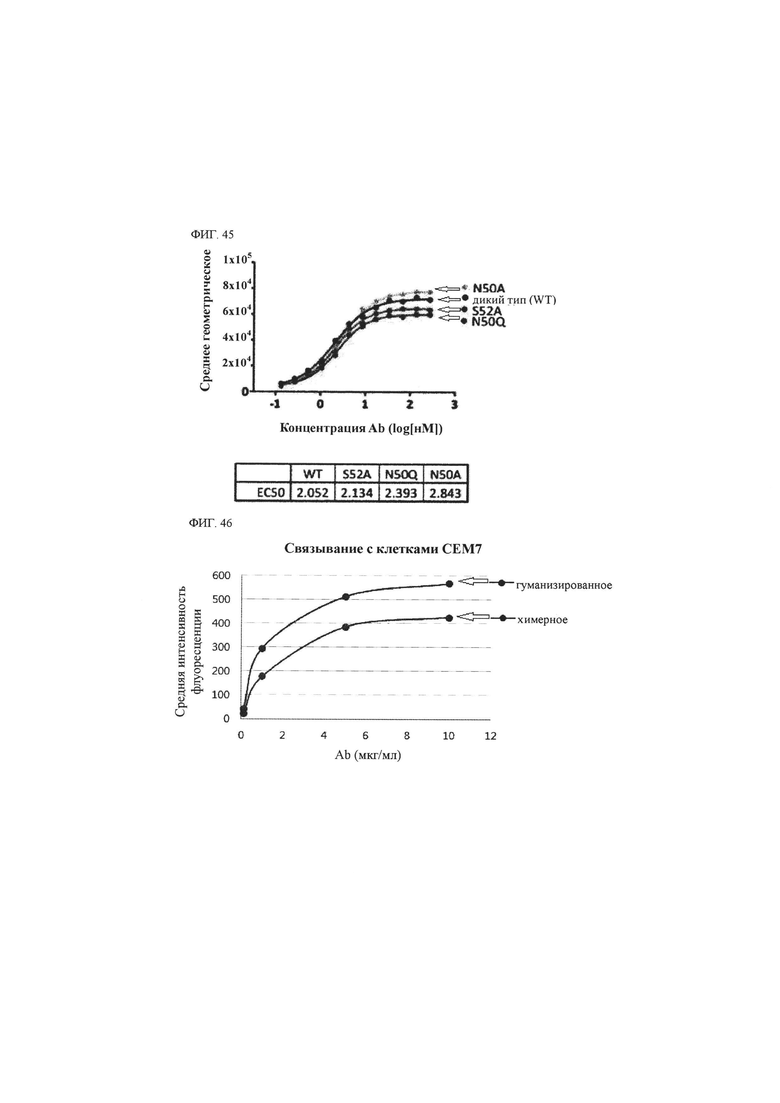
Группа изобретений относится к медицине и касается фармацевтической композиции для лечения солидного рака или ингибирования раковой стволовой клетки, содержащей антитело к CD43 (кластер дифференцировки 43) или его антигенсвязывающий фрагмент, где указанное антитело к CD43 или его антигенсвязывающий фрагмент содержит CDR1H с SEQ ID NO: 110, CDR2H с SEQ ID NO: 113, CDR3H с SEQ ID NO: 118, CDR1L с SEQ ID NO: 119, CDR2L с SEQ ID NO: 120 и CDR3L с SEQ ID NO: 125, где указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом, состоящим из 6-9 следующих друг за другом аминокислот в аминокислотной последовательности SEQ ID NO: 134, и где указанные 6-9 следующих друг за другом аминокислот содержат аминокислотную последовательность SEQ ID NO: 131. Группа изобретений также касается способа скрининга агента для лечения солидного рака или ингибирования раковой стволовой клетки; молекулы нуклеиновой кислоты, кодирующей указанное антитело к CD43 или его антигенсвязывающий фрагмент; рекомбинантного вектора, содержащего указанную молекулу нуклеиновой кислоты. Группа изобретений обеспечивает лечение солидного рака или ингибирование раковой стволовой клетки. 9 н. и 15 з.п. ф-лы, 20 пр., 46 ил., 4 табл.
1. Фармацевтическая композиция для лечения солидного рака или ингибирования раковой стволовой клетки, содержащая антитело к CD43 (кластер дифференцировки 43) или его антигенсвязывающий фрагмент, где указанное антитело к CD43 или его антигенсвязывающий фрагмент содержит CDR1H (первый определяющий комплементарность участок тяжелой цепи) с SEQ ID NO: 110, CDR2H с SEQ ID NO: 113, CDR3H с SEQ ID NO: 118, CDR1L (первый CDR легкой цепи) с SEQ ID NO: 119, CDR2L с SEQ ID NO: 120 и CDR3L с SEQ ID NO: 125, где указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом, состоящим из 6-9 следующих друг за другом аминокислот в аминокислотной последовательности SEQ ID NO: 134, и где указанные 6-9 следующих друг за другом аминокислот содержат аминокислотную последовательность SEQ ID NO: 131.
2. Композиция по п. 1, где антитело к CD43 или его антигенсвязывающий фрагмент связывается с эпитопом, состоящим из аминокислотной последовательности, выбранной из SEQ ID NO: 131, 132, 133 и 134.
3. Композиция по п. 1, где антитело к CD43 или его антигенсвязывающий фрагмент содержит CDR1H с SEQ ID NO: 111 или 112, CDR2H с SEQ ID NO: 114, 115, 116 или 117, CDR3H с SEQ ID NO: 118, CDR1L с SEQ ID NO: 119, CDR2L с SEQ ID NO: 121, 122, 123 или 124 и CDR3L с SEQ ID NO: 125.
4. Композиция по п. 1, где антитело к CD43 или его антигенсвязывающий фрагмент имеет модификацию в мотиве гликозилирования в вариабельной области.
5. Композиция по любому из пп. 1-4, где солидный рак представляет собой рак желудка, рак молочной железы, рак легкого, рак толстой кишки, рак печени, рак желчного пузыря, рак почки, рак поджелудочной железы, рак щитовидной железы, рак предстательной железы, рак яичника, рак шейки матки или рак мочевого пузыря.
6. Композиция по любому из пп. 1-4, дополнительно содержащая по меньшей мере одно вещество, выбранное из группы, состоящей из цитотоксического вещества и вещества для мечения.
7. Композиция по п. 6, где цитотоксическое вещество представляет собой по меньшей мере одно вещество, выбранное из группы, состоящей из рицина, сапорина, гелонина, момордина, дебуганина, дифтерийного токсина, псевдомонадного токсина, радиоактивных изотопов, дуокармицина, монометилауристатина E (MMAE), монометилауристатина F (MMAF), N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)- майтанзина (DM1) и димера пирролобензодиазепина (PBD).
8. Композиция по любому из пп. 1-4, где раковая стволовая клетка представляет собой раковую стволовую клетку при гематологическом злокачественном заболевании или солидном раке.
9. Способ скрининга агента для лечения солидного рака или ингибирования раковой стволовой клетки, включающий приведение в контакт соединения-кандидата с эпитопом, состоящим из 6-9 следующих друг за другом аминокислот в аминокислотной последовательности SEQ ID NO: 134, где указанные 6-9 следующих друг за другом аминокислот содержат аминокислотную последовательность SEQ ID NO: 131; и отбор соединения-кандидата, которое связывается с этим эпитопом, и определение отобранного соединения-кандидата в качестве агента-кандидата для лечения солидного рака или ингибирования раковой стволовой клетки.
10. Способ по п. 9, где эпитоп состоит из аминокислотной последовательности, выбранной из SEQ ID NO: 131, 132, 133 и 134.
11. Способ по п. 9 или 10, где раковая стволовая клетка представляет собой раковую стволовую клетку при солидном раке.
12. Антитело к CD43 или его антигенсвязывающий фрагмент, способные специфично связываться с внеклеточным доменом CD43, содержащие CDR1H с SEQ ID NO: 110, CDR2H с SEQ ID NO: 113, CDR3H с SEQ ID NO: 118, CDR1L с SEQ ID NO: 119, CDR2L с SEQ ID NO: 120 и CDR3L с SEQ ID NO: 125, где указанные антитело или его антигенсвязывающий фрагмент связываются с эпитопом, состоящим из 6-9 следующих друг за другом аминокислот в аминокислотной последовательности SEQ ID NO: 134, и где указанные 6-9 следующих друг за другом аминокислот содержат аминокислотную последовательность SEQ ID NO: 131.
13. Антитело к CD43 или его антигенсвязывающий фрагмент по п. 12, содержащие: CDR1H с SEQ ID NO: 111 или 112, CDR2H с SEQ ID NO: 114, 115, 116 или 117, CDR3H с SEQ ID NO: 118, CDR1L с SEQ ID NO: 119, CDR2L с SEQ ID NO: 121, 122, 123 или 124 и CDR3L с SEQ ID NO: 125.
14. Антитело к CD43 или его антигенсвязывающий фрагмент по п. 12, модифицированные посредством замены аминокислоты, способной гликозилироваться, в вариабельной области легкой цепи, на другую аминокислоту, не способную гликозилироваться.
15. Антитело к CD43 или его антигенсвязывающий фрагмент по п. 12, содержащие вариабельную область тяжелой цепи с SEQ ID NO: 2, 6, 14, 18, 26, 30, 83, 84, 86, 91, 92 или 93 и вариабельную область легкой цепи с SEQ ID NO: 4, 8, 12, 16, 20, 24, 95, 96, 97, 99, 100, 103, 107, 108 или 109.
16. Конъюгат для специфичного направленного воздействия на CD43-положительную клетку, содержащий антитело к CD43 или его антигенсвязывающий фрагмент по любому из пп. 12-15 и по меньшей мере одно вещество, выбранное из группы, состоящей из цитотоксического вещества и вещества для мечения.
17. Конъюгат по п. 16, где цитотоксическое вещество представляет собой по меньшей мере одно вещество, выбранное из группы, состоящей из рицина, сапорина, гелонина, момордина, дебуганина, дифтерийного токсина, псевдомонадного токсина, радиоактивных изотопов, дуокармицина, монометилауристатина E (MMAE), монометилауристатина F (MMAF), N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)-майтанзина (DM1) и димера пирролобензодиазепина (PBD).
18. Фармацевтическая композиция для лечения или предупреждения рака, содержащая антитело к CD43 или его антигенсвязывающий фрагмент по любому из пп.12-15 или конъюгат по п. 17 и фармацевтически приемлемый носитель.
19. Композиция по п. 18, где рак представляет собой гематологическое злокачественное заболевание.
20. Композиция по п. 19, где гематологическое злокачественное заболевание представляет собой острый миелоидный лейкоз, острый лимфобластный лейкоз, острый моноцитарный лейкоз, лимфому Ходжкина или неходжкинскую лимфому.
21. Молекула нуклеиновой кислоты, кодирующая антитело к CD43 или его антигенсвязывающий фрагмент по любому из пп. 12-15.
22. Рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты по п. 21.
23. Рекомбинантная клетка, содержащая рекомбинантный вектор по п. 22.
24. Способ получения антитела к CD43 или его антигенсвязывающего фрагмента по любому из пп. 12-15, включающий культивирование рекомбинантной клетки по п. 23.
| EP 1879916 B1, 23.04.2014 | |||
| KR 1020100107300 A, 05.10.2010 | |||
| JEON YK., et al., Targeting of a developmentally regulated epitope of CD43 for the treatment of acute leukemia | |||
| Cancer Immunol Immunother | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| KIM HJ., et al., CD43 cross-linking increases the Fas-induced apoptosis through induction of Fas aggregation in Jurkat T-cells | |||
| Exp Mol Med | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| KIM S., et al., Characterization of Two Novel mAbs Recognizing Different Epitopes on CD43 | |||
| Immune Netw | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2019-07-18—Публикация
2016-10-12—Подача