Уровень техники
Иммунотерапия на основе адоптивного переноса клеток (ACT) в широком смысле может быть определена как форма пассивной иммунизации сенсибилизированными ранее T-клетками, которые переносятся неиммунным реципиентам или аутологичному хозяину после экспансии ex vivo от низкого содержания предшественников до клинически значимого количества клеток. Применение подходов генной инженерии для вставки нацеленных на антиген рецепторов с определенной специфичностью в T-клетки сильно расширило потенциальные возможности ACT. Химерные рецепторы антигена (CAR) представляют собой тип нацеленных на антиген рецепторов, состоящих из внутриклеточных T-клеточных сигнальных доменов, слитых со внеклеточными антигенсвязывающими доменами, чаще всего с одноцепочечными вариабельными фрагментами (scFv) из моноклональных антител. CARs напрямую распознают поверхностные антигены клетки, независимо от опосредованной MHC презентации.
Попытки лечения рака при помощи генетически модифицированных T-клеток, нацеленных на антигены, экспрессируемые на опухолевых клетках, посредством экспрессии CAR, имели весьма ограниченный успех. Несмотря на значительные реакции у пациентов с B-клеточными злокачественными опухолями, успешные клинические реакции после обработки солидных опухолей T-клетками CAR с различными специфичностями оказались гораздо более ограниченными.
Терапия солидных опухолей T-клетками CAR сталкивается со многими проблемами. Они включают физические барьеры, иммуносупрессивное микроокружение опухолей и, что важно, отсутствие действительно специфичных и безопасных мишеней в опухолях.
Таким образом, в данной области существует настоятельная потребность в эффективных композициях и способах лечения рака с помощью CARs. Настоящее изобретение удовлетворяет эту потребность.
Для реализации терапии на основе CAR для лечения солидного рака мы выбрали онкофетальный антиген CLDN6 (Claudin 6), который обладает всеми признаками идеальной мишени для терапии на основе CAR. CLDN6 представляет собой мембранный белок 4 раза пересекающий мембрану, который участвует в формировании примитивных плотных контактов во время органогенеза и поэтому экспрессируется на значительном уровне исключительно при развитии плода и отсутствует во взрослых здоровых тканях, но сильно гиперэкспрессируется при различных раковых заболеваниях, в том числе раке яичников, эндометрия, раке яичек и легких.
CLDN6 имеет подверженные лекарствам внеклеточные петли, а его уровни на клеточной поверхности достаточно высоки и способствуют распознаванию СAR T-клетками. Кроме того, экспрессия CLDN6 коррелирует с прогрессированием заболевания, так как он обнаруживается с большей частотой в метастатических очагах и дедифференцированных клетках, что предполагает роль в онкогенных процессах. О безопасности воздействия на CLDN6 свидетельствует клиническое исследование фазы I/II с использованием моноклонального антитела IMAB027 против CLDN6 у пациентов с карциномой яичников на поздней стадии (OVAR, NCT02054351), в котором не было обнаружено отрицательных эффектов, связанных с IMAB027.
Исходя из результатов наших экспериментов in vitro и in vivo, мы выбрали CAR второго поколения с доменом 4-1BB (CLDN6-CAR-CD8h-BBz) в качестве ведущей структуры для доклинических и клинических испытаний. Мы смогли продемонстрировать высокоспецифичное и чувствительное распознавание экспрессирующих CLDN6 клеток мишени, а также высокий потенциал выживания и повторной стимуляции T-клеток CAR.
Далее оценивали противоопухолевый потенциал CLDN6-CAR in vivo на модели ксенотрансплантатов карциномы яичников и оказалось, что адоптивный перенос T-клеток, трансдуцированных CLDN6-CAR, приводит к полному искоренению развитых опухолей. Более того, эти результаты воспроизводились с криоконсервированными T-клетками CAR, которые были получены на GMP-предприятии.
Поскольку в прошлом было установлено, что клинический результат терапии CAR-T-клетками положительно коррелирует с персистенцией введенных T-клеток CAR в организме (Robbins et al. (2004) J Immunol. 173(12): 7125-30; Huang et al. (2005) 28(3): 258-67), то мы объединили терапию CLDN6-CAR с нашей инновационной концепцией экпансии CAR in-vivo с помощью заключенной в липосомы мРНК, кодирующей антиген CAR (WO 2016/180778).
Наконец, мы смогли показать на различных моделях опухолей, что комбинация адоптивного переноса T-клеток CAR вместе с вакцинацией на основе РНК (LIP) ускоряет текущие противоопухолевые реакции, а также может восстанавливать противоопухолевое действие недостаточных доз CAR T-клеток.
Сущность изобретения
Настоящим изобретением предусмотрены молекулы химерных рецепторов антигенов (CAR), включающие:
i) антигенсвязывающий домен для CLDN6;
ii) трансмембранный домен; и
iii) внутриклеточный домен, который включает костимулирующий домен 4-1BB и сигнальный домен CD3-дзета.
В одном воплощении антигенсвязывающий домен для CLDN6 включает антитело, фрагмент антитела, scFv, Fv, Fab, (Fab')2, однодоменное антитело (SDAB), домен VH или VL либо верблюжий домен VHH. В одном воплощении антигенсвязывающий домен для CLDN6 включает scFv. В одном воплощении антигенсвязывающий домен для CLDN6 включает аминокислотную последовательность по SEQ ID NO:35 либо ее функциональный вариант.
В одном воплощении костимулирующий домен 4-1BB включает аминокислотную последовательность по SEQ ID NO: 30 или ее функциональный вариант. В одном воплощении молекула CAR по изобретению не содержит других костимулирующих доменов.
В одном воплощении сигнальный домен CD3-дзета включает аминокислотную последовательность по SEQ ID NO: 31 или ее функциональный вариант.
В одном воплощении трансмембранный домен включает трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD154, KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD160, CD19, IL2R-бета, IL2R-гамма, IL7Ra, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRT AM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKp44, NKp30, NKp46, NKG2D и NKG2C либо их функциональных вариантов.
В одном воплощении трансмембранный домен включает трансмембранный домен CD8α. В одном воплощении трансмембранный домен включает аминокислотную последовательность по SEQ ID NO: 28 или ее функциональный вариант.
В одном воплощении антигенсвязывающий домен соединяется с трансмембранным доменом через шарнирный домен. В одном воплощении шарнирный домен представляет собой шарнирный домен CD8α. В одном воплощении шарнирный домен включает аминокислотную последовательность по SEQ ID NO: 27 или ее функциональный вариант.
В одном воплощении молекула CAR по изобретению включает:
i) антигенсвязывающий домен для CLDN6;
ii) шарнирный домен CD8α;
iii) трансмембранный домен CD8α; и
iv) внутриклеточный домен, который включает костимулирующий домен 4-1BB и сигнальный домен CD3-дзета.
В одном воплощении молекула CAR по изобретению дополнительно включает лидерную последовательность.
В одном воплощении молекула CAR по изобретению включает аминокислотную последовательность по SEQ ID NO: 36 или ее функциональный вариант.
Настоящим изобретением также предусмотрена нуклеиновая кислота, кодирующая молекулы CAR по изобретению. В одном воплощении нуклеиновая кислота представляет собой ДНК или РНК.
Настоящим изобретением также предусмотрены векторы, содержащие нуклеиновые кислоты по изобретению. В одном воплощении вектор выбран из группы, состоящей из ДНК-векторов, РНК-векторов, плазмид, лентивирусных векторов, аденовирусных векторов и ретровирусных векторов. В одном воплощении вектор дополнительно содержит промотор. В одном воплощении промотор выбран из промотора EF-1, промотора гена IE CMV, промотора EF-1α, промотора убиквитина C или промотора фосфоглицераткиназы (PGK).
Настоящим изобретением также предусмотрены иммуноэффекторные клетки, содержащие:
молекулы CAR по изобретению;
нуклеиновую кислоту по изобретению; или
вектор по изобретению.
В одном воплощении иммуноэффекторные клетки генетически модифицированы для экспрессии CAR. В одном воплощении иммуноэффекторные клетки выбраны из группы, состоящей из T-клеток, клеток естественных киллеров (NK) и цитотоксических T-лимфоцитов (CTL). В одном воплощении иммуноэффекторные клетки представляют собой T-клетки CD8+. В одном воплощении иммуноэффекторные клетки представляют собой человеческие клетки.
Настоящим изобретением также предусмотрены популяции иммуноэффекторных клеток, включающие множество иммуноэффекторных клеток по изобретению.
В одном воплощении иммуноэффекторные клетки по изобретению или популяции иммуноэффекторных клеток по изобретению лишены экспрессии или имеют низкий уровень экспрессии функционального TCR или функционального HLA.
Настоящим изобретением также предусмотрен способ получения иммуноэффекторных клеток или популяции иммуноэффекторных клеток, включающий введение нуклеиновой кислоты по изобретению или вектора по изобретению в иммуноэффекторные клетки в условиях, при которых экспрессируются молекулы CAR.
Настоящим изобретением также предусмотрен способ стимуляции клеточного иммунного ответа на экспрессирующую CLDN6 популяцию целевых клеток или тканей у субъекта, который включает предоставление субъекту эффективного количества иммуноэффекторных клеток по изобретению или популяции иммуноэффекторных клеток по изобретению. Иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены ex vivo и введены субъекту либо иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены у субъекта.
Настоящим изобретением также предусмотрен способ лечения субъектов с заболеваниями, связанными с экспрессией CLDN6, включающий предоставление субъекту эффективного количества иммуноэффекторных клеток по изобретению или популяции иммуноэффекторных клеток по изобретению. Иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены ex vivo и введены субъекту либо иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены у субъекта. В одном воплощении заболевания, связанные с экспрессией CLDN6, выбирают из группы, состоящей из пролиферативных заболеваний, предраковых состояний, рака и не связанных с раком показаний, связанных с экспрессией CLDN6. В одном воплощении рак выбирают из группы, состоящей из рака яичников, рака легких, рака желудка, рака молочной железы, рака печени, рака поджелудочной железы, рака кожи, меланомы, рака головы и шеи, саркомы, рака желчных протоков, почечно-клеточного рака и рака мочевого пузыря.
Настоящим изобретением также предусмотрен способ обеспечения противоопухолевого иммунитета у субъектов, включающий предоставление субъекту эффективного количества иммуноэффекторных клеток по изобретению или популяции иммуноэффекторных клеток по изобретению. Иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены ex vivo и введены субъекту либо иммуноэффекторные клетки или популяции иммуноэффекторных клеток могут быть получены у субъекта. В одном воплощении опухоль представляет собой экспрессирующую CLDN6 опухоль.
В одном воплощении способов по изобретению иммуноэффекторные клетки или популяции иммуноэффекторных клеток являются аутологичными или аллогенными для субъекта.
В одном воплощении способов по изобретению способ дополнительно включает введение средства, повышающего эффективность иммуноэффекторных клеток или популяции иммуноэффекторных клеток. В одном воплощении такое средство выбирают из одного или нескольких из:
ингибиторов протеинфосфатаз;
ингибиторов киназ;
цитокинов;
ингибиторов иммуноингибирующих молекул; или
средств, снижающих уровень или активность клеток Treg.
В одном воплощении способов по изобретению способ дополнительно включает стадию контактирования иммуноэффекторных клеток или популяции иммуноэффекторных клеток, ex vivo или у субъекта, с молекулой родственного антигена, связывающегося с антигенсвязывающим доменом для CLDN6. В одном воплощении молекула родственного антигена выбрана из группы, состоящей из CLDN6 или его фрагментов либо вариантов CLDN6 или фрагментов CLDN6. В одном воплощении иммуноэффекторные клетки или популяции иммуноэффекторных клеток контактируют с молекулой родственного антигена в таких условиях, что происходит экспансия и/или активация иммуноэффекторных клеток или популяции иммуноэффекторных клеток. В одном воплощении стадия контактирования иммуноэффекторных клеток или популяции иммуноэффекторных клеток имеет место in vivo или ex vivo.
В одном воплощении способов по изобретению способ включает стадию введения субъектам молекул родственного антигена или кодирующей его нуклеиновой кислоты. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, экспрессируется в клетках субъекта, обеспечивая молекулы родственного антигена. В одном воплощении экспрессия молекул родственного антигена происходит на поверхности клетки. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, кратковременно экспрессируется в клетках субъекта. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, представляет собой РНК. В одном воплощении иммуноэффекторные клетки или популяции иммуноэффекторных клеток и/или молекулы родственного антигена или кодирующая их нуклеиновая кислота вводятся системно. В одном воплощении, после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, происходит экспрессия нуклеиновой кислоты, кодирующей молекулы родственного антигена, в селезенке. В одном воплощении, после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, происходит экспрессия нуклеиновой кислоты, кодирующей молекулы родственного антигена, в антигенпрезентирующих клетках, предпочтительно профессиональных антигенпрезентирующих клетках. В одном воплощении антигенпрезентирующие клетки выбраны из группы, состоящей из дендритных клеток, макрофагов и B-клеток. В одном воплощении, после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, совсем или почти не происходит экспрессии нуклеиновой кислоты, кодирующей молекулы родственного антигена, в легких и/или печени. В одном воплощении, после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, экспрессия в селезенке нуклеиновой кислоты, кодирующей молекулы родственного антигена, по меньшей мере в 5 раз превышает уровень экспрессии в легких.
В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, входит в состав носителя для доставки. В одном воплощении средство доставки включает частицы. В одном воплощении средство доставки включает по меньшей мере один липид. В одном воплощении такой по меньшей мере один липид включает по меньшей мере один катионный липид. В одном воплощении липид образует комплекс с и/или инкапсулирует нуклеиновую кислоту, кодирующую молекулы родственного антигена. В одном воплощении липид содержится в везикулах, инкапсулирующих нуклеиновую кислоту, кодирующую молекулы родственного антигена. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, входит в состав липосом.
В одном воплощении иммуноэффекторных клеток по изобретению, популяций иммуноэффекторных клеток по изобретению или способа по изобретению, иммуноэффекторные клетки или популяции иммуноэффекторных клеток представляют собой экспрессирующие CAR иммуноэффекторные клетки или экспрессирующие CAR популяции иммуноэффекторных клеток.
Настоящим изобретением также предусмотрены молекулы CAR по изобретению, нуклеиновые кислоты по изобретению, векторы по изобретению, иммуноэффекторные клетки по изобретению или популяции иммуноэффекторных клеток по изобретению для применения в качестве лекарственных средств.
Настоящим изобретением также предусмотрены молекулы CAR по изобретению, нуклеиновые кислоты по изобретению, векторы по изобретению, иммуноэффекторные клетки по изобретению или популяции иммуноэффекторных клеток по изобретению для применения при лечении заболеваний, экспрессирующих CLDN6.
Настоящим изобретением также предусмотрены наборы, содержащие молекулы CAR по изобретению, нуклеиновые кислоты по изобретению, векторы по изобретению, иммуноэффекторные клетки по изобретению или популяции иммуноэффекторных клеток по изобретению. В одном воплощении набор дополнительно содержит молекулы родственного антигена, связывающегося с антигенсвязывающим доменом для CLDN6, или кодирующей его нуклеиновой кислоты. В одном воплощении набор дополнительно содержит инструкции по применению набора в способах по изобретению.
В следующем аспекте изобретения предусмотрены средства и композиции типа описанных здесь иммуноэффекторных клеток для применения в описанных здесь способах.
Другие особенности и преимущества настоящего изобретения станут ясными из следующего подробного описания и формулы изобретения.
Краткое описание фигур
Фиг. 1. Получение и характеристика различных CLDN6-CAR.
A) Было разработано и получено четыре различных CAR, нацеленных на CLDN6, на основе вариабельных доменов тяжелой (VH) и легкой (VL) цепи CLDN6-специфичного антитела IMAB206-C46S. IgG1ΔFc: IgG1 человека с шарнирным и CH2-CH3-Fc-доменом с мутированными сайтами связывания IgG с рецептором FcγR (FcγR) для предотвращения активации экспрессирующими FcγR клетами врожденного иммунитета (Hombach A. et al. (2010) Gene Therapy 17, 1206-1213); CD28ΔLck: трансмембранный и цитоплазматический домен CD28 с делецией в связывающей Lck части эндодомена CD28, устраняющей индукцию IL-2 при привлечении CAR для предотвращения нежелательной экспансии клеток Treg на месте опухоли (Kofler D.M. et al. (2011) Molecular Therapy 19 (4), 760-767); 4-1BB: костимулирующий эндодомен 4-1BB; CD3ζ: сигнальный домен CD3ζ; CD3ζ*: CD3ζ с мутацией Q14 → K; CD8α: шарнирный домен CD8α человека. B) Функциональное тестирование различных CLDN6-CAR методом опухолевых сфероидов PA1-SC12-A2-eGFP. Лизис опухолевых сфероидов анализировали по экспрессии eGFP после 24 ч совместного культивирования (E:T = 10:1) с помощью системы визуализации живых клеток IncuCyte®. Изображения лунок сканировали с помощью линз объектива с 4-кратным увеличением в начале совместного культивирования (0 часов) и через 24 часа после этого, и они представляют гибель опухолевых сфероидов в трех технических повторах.
Фиг. 2. Дозозависимое опосредованное CAR распознавание и лизис экспрессирующих CLDN6 клеток-мишеней.
A) Экспрессия CLDN6-CAR-BBz на поверхности трансдуцированных T-клеток при анализе после окрашивания конъюгированным с флуорохромом специфичным для идиотипа антителом IMAB206. В качестве отрицательного контроля служили нетрансдуцированные T-клетки. Клетки гейтировали по отдельным лимфоцитам CD4+ или CD8+. Указанные цифры представляют частоту исходной популяции (в %). B) Экспрессия CLDN6 на поверхности клеток Colo699-N, трансфицированных титрованными количествами CLDN6-РНК, при анализе методом проточной цитометрии. C) Специфический лизис трансфицированных РНК клеток Colo699-N трансдуцированными CLDN6-CAR-BBz T-клетками при анализе после 12 ч совместного культивирования при соотношении Е:Т = 20:1 на приборе xCELLigence. Данные представлены в виде среднего значения ± SD из трех технических повторов.
Фиг. 3. Специфический опосредованный CLDN6-CAR лизис CLDN6-экспрессирующих клеток опухолевых линий.
Трансдуцированные CLDN6-CAR-BBz T-клетки человека анализировали методом проточной цитометрии и культивировали вместе с комплектом CLDN6-положительных и отрицательных линий опухолевых клеток человека различного происхождения. A) Экспрессия CAR на поверхности при оценке методом проточной цитометрии перед началом совместного культивирования. Указанные цифры представляют частоту исходной популяции (в %). B) При соотношении E:T = 10:1. C) Специфический лизис при анализе на установке xCELLIigence после 12 ч совместного культивирования по формуле % лизиса = (CI eGFP - CI эффектора)/CI eGFP × 100; CI: клеточный индекс. Данные представлены в виде среднего значения ± SD из трех технических повторов. D) Экспрессия CLDN6 на поверхности клеток опухолевых линий при анализе методом проточной цитометрии после окрашивания специфичным к CLDN6 антителом. Приведен процент исходной популяции. E) Относительные уровни экспрессии мРНК CLDN6 в клетках опухолевых линий, используемых в (A-D), при оценке методом qRT-PCR после нормализации по хозяйственному гену HPRT1. Столбики представляют средние значения ± SD из трех технических повторов.
Фиг. 4. Дозозависимая пролиферация, опосредованная CLDN6-CAR-BBz, в ответ на экспрессирующие CLDN6 клетки мишени.
Трансдуцированные CAR T-клетки метили CFSE и культивировали вместе с аутологичными DC, трансфицированными титрованными количествами липоплексов CLDN6-РНК (РНК(LIP)). Анализировали пролиферацию по CFSE после 5 дней совместного культивирования и окрашивания с помощью конъюгированных с флуорохромом антител против CD4, CD8 и CAR. A) Экспрессия CAR на поверхности при оценке методом проточной цитометрии перед началом совместного культивирования. Указанные цифры представляют частоту исходной популяции (в %). B) Экспрессия CLDN6 на поверхности трансфицированных DC при оценке методом проточной цитометрии с помощью конъюгированного с флуорохромом антитела, специфичного к CLDN6. C) Специфическая пролиферация при анализе методом проточной цитометрии по разбавлению красителя пролиферации CFSE. Столбики представляют содержание в % пролиферирующих CAR-экспрессирующих T-клеток CD8+ и CD4+.
Фиг. 5. Противоопухолевая активность трансдуцированных CLDN6-CAR-BBz T-клеток на модели ксенотрансплантатов поздней стадии рака яичников (OV90).
По 5×106 опухолевых клеток OV90-SC12 прививали подкожно за 25 дней до адоптивного переноса клеток (ACT) в виде однократной внутривенной дозы 1×107 трансдуцированных CLDN6-CAR-BBz или eGFP T-клеток человека (n = 10 на группу). Ко времени обработки T-клетками у мышей уже появлялись развитые опухоли в среднем по 170 мм3. Объем опухолей определяли по три раза в неделю с помощью штангенциркуля и рассчитывали по формуле V = 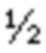 (длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия трансгена (GFP или CAR) в трансдуцированных T-клетках CD4+ и CD8+ человека при анализе методом проточной цитометрии в день ACT. Указанные цифры обозначают частоту исходной популяции (в %). C) Представлены средние объемы опухолей у животных, обработанных T-клетками с CLDN6-CAR-BBz и eGFP, после ACT (обозначено пунктирной линией) до 44-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 3 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
(длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия трансгена (GFP или CAR) в трансдуцированных T-клетках CD4+ и CD8+ человека при анализе методом проточной цитометрии в день ACT. Указанные цифры обозначают частоту исходной популяции (в %). C) Представлены средние объемы опухолей у животных, обработанных T-клетками с CLDN6-CAR-BBz и eGFP, после ACT (обозначено пунктирной линией) до 44-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 3 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
Фиг. 6. Повторное удаление опухолевых сфероидов культивировавшимися 7 дней и 10 дней T-клетками CLDN6-CAR.
Трансдуцированные CLDN6-CAR T-клетки, полученные в течение 7 и 10 дней, соответственно, оценивали на их способность многократно уничтожать опухолевые сфероиды, экспрессирующие CLDN6 и eGFP, по данным визуализации живых клеток. A) Экспрессия CAR на поверхности культивированных 7 дней и 10 дней T-клеток CLDN6-CAR при анализе на трансдуцированных T-клетках после окрашивания конъюгированным с флуорохромом специфичным для идиотипа антителом IMAB206. В качестве отрицательного контроля служили нетрансдуцированные T-клетки. Клетки гейтировали по отдельным лимфоцитам CD4+ или CD8+. Указанные цифры представляют частоту исходной популяции (в %). B) Функциональное тестирование культивировавшихся 7 дней и 10 дней T-клеток CLDN6-CAR при анализе на опухолевых сфероидах PA1-SC12-A2-eGFP. Лизис опухолевых сфероидов анализировали по экспрессии eGFP на установке для визуализации живых клеток IncuCyte® в общем на протяжении 10 дней. Через 5 дней вносили новые опухолевые сфероиды. Значения представляют интегрированные интенсивности зеленых объектов по трем техническим повторам в виде среднего значения ± SD.
Фиг. 7. Противоопухолевое действие полученных по GMP T-клеток CLDN6-CAR.
По 5×106 опухолевых клеток OV90-SC12 прививали подкожно за 35 дней до адоптивного переноса в виде одной дозы внутривенно 1×107 трансдуцированных CLDN6-CAR-BBz или нетрансдуцированных T-клеток человека (n = 12 на группу). Используемые препараты T-клеток получали на GMP-предприятии либо по стандартной (10 дней культивирования in vitro), либо по сокращенной производственной процедуре (сбор уже через 7 дней). В качестве отрицательного контроля использовали нетрансдуцированные T-клетки, которые обрабатывали таким же образом, как и трансдуцированные T-клетки. Указанные препараты T-клеток оттаивали, промывали PBS и напрямую вводили мышам, у которых уже появлялись развитые опухоли в среднем по 160 мм3. Объем опухолей определяли по три раза в неделю с помощью штангенциркуля и рассчитывали по формуле V = 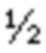 (длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия CAR на поверхности трансдуцированных T-клеток CD4+ и CD8+ человека при анализе методом проточной цитометрии в день ACT. Указанные цифры представляют частоту исходной популяции (в %). C) Представлены объемы опухолей у животных, обработанных T-клетками с CLDN6-CAR-BBz и контрольными T-клетками до 57-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 2 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
(длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия CAR на поверхности трансдуцированных T-клеток CD4+ и CD8+ человека при анализе методом проточной цитометрии в день ACT. Указанные цифры представляют частоту исходной популяции (в %). C) Представлены объемы опухолей у животных, обработанных T-клетками с CLDN6-CAR-BBz и контрольными T-клетками до 57-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 2 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
Фиг. 8. Экспансия in vivo с помощью РНК(LIP) ведет к усилению персистенции T-клеток CLDN6-CAR-BBz.
Мышам C57BL/6BrdCrHsd-Tyrc, облученным при 2,5 Гр (XRAD320) (n = 2-3 на группу), вводили внутривенно по 5×106 трансдуцированных CLDN6-CAR-BBz-Luc-GFP T-клеток C57BL/6-Thy1.1+. Через 8 дней после ACT мышам вводили мРНК, кодирующую hCLDN6 или OvaI (контрольная РНК), в виде липоплексной вакцинации (РНК(LIP); 20 мкг, внутривенно), с последующим внутрибрюшинным введением модифицированной по нуклеозидам формы РНК, кодирующей мышиный альбумин (1 мкг мРНК на мышь). Вакцинацию повторяли на 15, 22, 50 и 85-й день. Для отслеживания роста и персистенции проводили последовательную биолюминесцентную визуализацию в день 1 (исходно) и вплоть до 92-го дня после ACT. A) Схематический обзор проводившегося на мышах эксперимента. B) Пример биолюминесцентной визуализации мышей в боковом положении в указанный момент времени после ACT и обработки антигенной РНК(LIP). Полутоновые изображения представляют интенсивность света (черный: наименьшая; от белого до темно-серого: наибольшая), которая была наложена на стандартные полутоновые изображения. C) Представлена количественная оценка биолюминесценции во время и после раундов экспансии с CLDN6-RNA(LIP)/ctrl-RNA(LIP) в присутствии указанных модифицированных по нуклеозидам форм РНК цитокинов (среднее ± SEM). Серые вертикальные линии обозначают моменты времени вакцинации РНК(LIP). ACT: адоптивный перенос T-клеток; TBI: облучение всего тела; BLI: визуализация по биолюминесценции; Luc: эффективная люцифераза светлячков; BBz: 4-1BB; z: CD3ζ.
Фиг. 9. Повышение противоопухолевой активности у экспансировавших in vivo T-клеток CLDN6-CAR-BBz.
Мышам Balb/c прививали подкожно по 5×105 опухолевых клеток CT26 за 20 дней до облучения всего тела при 4 Гр и за 26 дней до ACT в виде однократной дозы 1×106 трансдуцированных CLDN6-CAR-BBz или ctrl-CAR-BBz T-клеток Balb/c-Thy1.1+ внутривенно (n = 10 на группу). Ко времени обработки T-клетками у мышей уже появлялись привитые опухоли в среднем по 80 мм3. Объем опухолей определяли по три раза в неделю с помощью штангенциркуля и рассчитывали по формуле V = 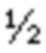 (длина × ширина2) по максимальной длине и ширине опухолей. A) Схематический обзор проводившегося на мышах эксперимента. B) Представлены средние объемы опухолей у животных, получавших T-клетки CLDN6-CAR-BBz или ctrl-CAR-BBz до 40-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. ACT обозначен пунктирной линией, а обработка РНК(LIP) - серой линией.
(длина × ширина2) по максимальной длине и ширине опухолей. A) Схематический обзор проводившегося на мышах эксперимента. B) Представлены средние объемы опухолей у животных, получавших T-клетки CLDN6-CAR-BBz или ctrl-CAR-BBz до 40-го дня. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. ACT обозначен пунктирной линией, а обработка РНК(LIP) - серой линией.
Фиг. 10. Восстановление противоопухолевого действия при низких дозах экспансируемых in vivo T-клеток CLDN6-CAR.
По 5×106 опухолевых клеток OV90-SC12 прививали подкожно за 30 дней до ACT в виде однократной дозы при низкой дозе (1×105) или при высокой дозе (1×106) трансдуцированных CLDN6-CAR-BBz либо по 1×107 нетрансдуцированных T-клеток человека внутривенно (n = 9 на группу). Используемые препараты T-клеток получали на GMP-предприятии по сокращенному процессу трансдукции (собирали уже через 7 дней). В качестве отрицательного контроля использовали нетрансдуцированные T-клетки, которые обрабатывали таким же образом, как и трансдуцированные T-клетки. Указанные препараты T-клеток оттаивали, промывали PBS и напрямую вводили несущим опухоли мышам. Кроме того, мышей, получавших низкие дозы T-клеток CAR, дополнительно вакцинировали 20 мкг РНК(LIP), кодирующей либо CLDN6, либо контрольный антиген, как указано. Объем опухолей определяли по три раза в неделю с помощью штангенциркуля и рассчитывали по формуле V = 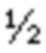 (длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия CAR на поверхности трансдуцированных T-клеток CD4+ и CD8+ человека при анализе методом проточной цитометрии в день адоптивного переноса. Указанные цифры представляют частоту исходной популяции (в %). C) Кривые роста опухолей у животных, получавших различные дозы CLDN6-CAR-BBz ± РНК(LIP) или контрольных T-клеток. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. ACT обозначен пунктирной линией, а обработка РНК(LIP) - серой линией. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 2,5 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
(длина × ширина2) по максимальной длине и ширине опухолей. Животных забивали, когда объем опухоли превышал 1500 мм3 или при изъязвлении опухоли. A) Схематический обзор проводившегося на мышах эксперимента. B) Экспрессия CAR на поверхности трансдуцированных T-клеток CD4+ и CD8+ человека при анализе методом проточной цитометрии в день адоптивного переноса. Указанные цифры представляют частоту исходной популяции (в %). C) Кривые роста опухолей у животных, получавших различные дозы CLDN6-CAR-BBz ± РНК(LIP) или контрольных T-клеток. Данные представлены в виде среднего значения ± SEM от всех мышей в группе. ACT обозначен пунктирной линией, а обработка РНК(LIP) - серой линией. D) Персистенция T-клеток и экспрессия CAR на поверхности при анализе в периферической крови через 2,5 недели после ACT методом проточной цитометрии. Представлены репрезентативные точечные графики. Цифрами обозначена частота исходных популяций.
Раскрытие сущности изобретения
Изобретение касается композиций и способов лечения рака, включая, без ограничения, солидные опухоли. Настоящее изобретение касается стратегии адоптивного переноса клеток типа T-клеток, трансдуцированных для экспрессии CAR. CAR представляют собой молекулы, в которых сочетается специфичность в отношении требуемого антигена (напр., опухолевого антигена), предпочтительно на основе антител, с внутриклеточным доменом, активирующим T-клеточные рецепторы, образуя химерный белок, который проявляет специфическую клеточную иммунную активность (напр., специфическую клеточную иммунную активность против опухолей). Предпочтительно клетки могут быть генетически модифицированы для стабильной экспрессии CAR на своей поверхности, придавая им новую антигенную специфичность, не зависящую от MHC. Настоящее изобретение в общем касается T-клеток, генетически модифицированных для стабильной экспрессии требуемых CAR. T-клетки, экспрессирующие CAR, именуются здесь T-клетками CAR или модифицированными CAR T-клетками.
CAR по изобретению объединяет в себе антигенсвязывающий домен для CLDN6, предпочтительно домен специфического антитела, и внутриклеточный домен, который включает костимулирующий домен 4-1BB и домен дзета-цепи CD3, в одном химерном белке. В одном воплощении CAR по изобретению содержит внеклеточный домен, включающий антигенсвязывающий домен для CLDN6, трансмембранный домен и внутриклеточный домен, который включает костимулирующий домен 4-1BB и домен дзета-цепи CD3. В одном воплощении трансмембранный домен не связан естественным образом ни с одним из доменов в CAR. В одном воплощении трансмембранный домен связан естественным образом с одним из доменов в CAR. В одном воплощении трансмембранный домен модифицирован путем аминокислотной замены, чтобы избежать связывания такого домена с трансмембранными доменами таких же или других поверхностных мембранных белков, минимизируя взаимодействия с другими членами рецепторного комплекса. Предпочтительно трансмембранный домен происходит из CD8α.
Изобретением также предусмотрены T-клетки CAR и способы их применения для адоптивной терапии. В одном воплощении T-клетки с CAR по изобретению могут быть получены путем введения в клетки ретровирусного типа лентивирусного вектора, содержащего требуемый CAR, например, CAR, содержащий анти-CLDN6, шарнирный и трансмембранный домен CD8α, а также сигнальные домены 4-1BB и CD3-дзета. T-клетки CAR по изобретению предпочтительно способны реплицироваться in vivo, что ведет к долгосрочной персистенции и может привести к устойчивому контролю над опухолями.
В одном воплощении изобретения предусмотрено введение генетически модифицированных T-клеток, экспрессирующих требуемый CAR, для лечения пациентов, страдающих раком или подверженных риску заболевания раком. Предпочтительно при лечении используются аутологичные клетки. В одном воплощении у нуждающихся в лечении пациентов выделяют аутологичные PBMC и активируют и экспансируют T-клетки способами, описанными здесь и известными в данной области, а затем вводят обратно пациентам.
В одном воплощении изобретения вообще предусмотрено лечение пациентов, страдающих или подверженных риску заболевания экспрессирующим CLDN6 раком. Изобретение включает применение T-клеток, экспрессирующих анти-CLDN6-CAR, включающий и CD3-дзета, и костимулирующий домен 4-1BB. T-клетки с CAR по изобретению могут подвергаться сильной экспансии in vivo, в частности, при контакте со своим родственным антигеном, и могут персистировать на высоком уровне в течение продолжительного времени. В некоторых случаях T-клетки CAR по изобретению при введении пациентам могут устранять раковые клетки in vivo у пациентов.
Определения
Хотя настоящее изобретение подробно описано ниже, однако следует иметь в виду, что оно не ограничивается конкретными методологиями, методиками и реагентами, описанными здесь, так как они могут варьироваться. Также следует иметь в виду, что используемая здесь терминология предназначена только для описания конкретных воплощений и не должна ограничивать объем настоящего изобретения, которое должно ограничиваться только прилагаемой формулой изобретения. Если не указано иначе, все используемые здесь технические и научные термины имеют те значения, которые обычно понимаются рядовыми специалистами в данной области.
В дальнейшем будут описаны элементы настоящего изобретения. Эти элементы приводятся с конкретными воплощениями, однако следует понимать, что они могут комбинироваться любым способом и в любом количестве с получением дополнительных воплощений. Различные описанные примеры и предпочтительные воплощения не следует толковать как ограничивающие настоящее изобретение только явно описанными воплощениями. Следует иметь в виду, что это описание поддерживает и охватывает воплощения, которые объединяют явно описанные воплощения с любым количеством раскрытых и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных элементов в этой заявке следует рассматривать как раскрытые при описании настоящей заявки, если контекстом не указано иначе.
Если не указано иначе, все используемые здесь технические и научные термины имеют те значения, которые обычно понимаются рядовыми специалистами в той области, к которой относится изобретение. Хотя на практике для тестирования настоящего изобретения могут использоваться любые методы и материалы, подобные или эквивалентные описанным здесь, однако предпочтительны материалы и методы, описанные здесь. При описании и оформлении настоящего изобретения будет применяться следующая терминология.
По всему описанию и следующей за ним формуле изобретения, если контекстом не требуется иначе, слово "включает" и его варианты типа "включают" и "включающий" следует понимать как подразумевающие включение указанного члена, целого числа, стадии или группы членов, целых чисел или стадий, но не исключение любых других членов, целых чисел, стадий или группы членов, целых чисел или стадий, хотя в некоторых воплощениях такие другие члены, целые числа, стадии или группы членов, целых чисел или стадий могут исключаться, т.е. вопрос заключается во включении указанных членов, целых чисел, стадий или группы членов, целых чисел или стадий.
Формы единственного числа используются здесь для обозначения одного или более чем одного (то есть по меньшей мере одного) грамматического объекта статьи. В качестве примера "элемент" означает один элемент или более чем один элемент.
"Примерно" в настоящем изобретении при описании измеряемых величин типа количества, продолжительности времени и т.п. означает, что они охватывают отклонения в ± 20% или ± 10%, более предпочтительно ± 5%, еще более предпочтительно ± 1 % и даже еще более предпочтительно ± 0,1% от указанного значения.
Термин "антитело" в настоящем изобретении относится к молекулам иммуноглобулина, которые связываются, предпочтительно специфически связываются с антигеном. Антитела могут представлять собой интактные иммуноглобулины, происходящие из природных источников или из рекомбинантных источников, а также иммунореактивные части или фрагменты интактных иммуноглобулинов. Антитела обычно представляют собой тетрамеры молекул иммуноглобулинов. В настоящем изобретении антитела могут существовать в различных формах, включая, к примеру, поликлональные антитела, моноклональные антитела, Fv, Fab и F(ab)2, а также одноцепочечные антитела и гуманизованные антитела (Harlow et al., 1999, in: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, in: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
Антитела, экспрессируемые B-клетками, иногда именуются как BCR (B-клеточные рецепторы) или антигеновые рецепторы. В этот класс белков входят пять представителей: IgA, IgG, IgM, IgD и IgE. IgA - это первичные антитела, которые присутствуют в таких выделениях организма, как слюна, слезы, грудное молоко, желудочно-кишечные выделения и слизистые выделения дыхательных и мочеполовых путей. IgG - самые распространенные антитела в кровотоке. IgM - основной иммуноглобулин, который вырабатывается при первичном иммунном ответе у большинства субъектов. Это наиболее эффективный иммуноглобулин в агглютинации, фиксации комплемента и других антительных ответах, и он важен для защиты от бактерий и вирусов. IgD - иммуноглобулин, который не имеет никакой известной функции антител, но может служить рецептором антигенов. IgE - иммуноглобулин, который опосредует гиперчувствительность немедленного типа, вызывая высвобождение медиаторов из тучных клеток и базофилов при воздействии аллергена.
Термин "фрагмент антитела" означает часть интактного антитела и обычно включает определяющие антигенность вариабельные области интактных антител.
Примеры фрагментов антител включают, без ограничения, фрагменты Fab, Fab', F(ab')2 и Fv, линейные антитела, scFv-антитела и мультиспецифичные антитела, образованные из фрагментов антител.
"Тяжелая цепь антител" в настоящем изобретении означает большую из двух типов полипептидных цепей, присутствующих в молекулах антител в своих естественных конформациях.
"Легкая цепь антител" в настоящем изобретении означает меньшую из двух типов полипептидных цепей, присутствующих в молекулах антител в своих естественных конформациях, а легкие цепи κ и λ означают два основных изотипа легкой цепи антител.
Термин "антиген" или "Ag" в настоящем изобретении определяется как молекула, которая вызывает иммунный ответ. Этот иммунный ответ может включать либо выработку антител, либо активацию определенных иммунологически компетентных клеток, либо и то, и другое. Специалистам должно быть известно, что антигеном может служить любая макромолекула, включая практически все белки или пептиды. Кроме того, антигены могут быть природными или рекомбинантными антигенами.
В контексте настоящего изобретения термин "опухолевый антиген" относится к антигенам, которые являются общими для определенных гиперпролиферативных заболеваний типа рака.
Клаудины - интегральные мембранные белки, находящиеся в плотных контактах эпителия и эндотелия. Предполагается, что клаудины содержат четыре трансмембранных сегмента с двумя внеклеточными петлями, а также N- и C-концы, расположенные в цитоплазме. Первая внеклеточная петля, обозначаемая как EC1 или ECL1, состоит в среднем из 53 аминокислот, а вторая внеклеточная петля, обозначаемая как EC2 или ECL2, состоит примерно из 24 аминокислот. Семейство трансмембранных белков клаудинов (CLDN) играет решающую роль в поддержании эпителиальных и эндотелиальных плотных контактов, а также может играть роль в поддержании цитоскелета и в клеточной сигнализации.
Клаудин 6 (CLDN6) - онкофетальный ген, который экспрессируется в стволовых клетках мыши и человека, а также в эмбриоидных тельцах, коммитированных в зачатки эпителиальных клеток (Turksen K. et al. (2001) Dev Dyn. 222, 292-300; Anderson WJ. et al. (2008) Dev Dyn. 237, 504-12; Turksen K. et al. (2002) Development, 129, 1775-84; Assou S. et al. (2007) Stem Cells 25, 961-73). В качестве связанного с опухолями антигена он может быть классифицирован как дифференцировочный антиген из-за его экспрессии на ранней стадии эпидермального морфогенеза, где он необходим для дифференцировки эпидермиса и формирования барьера. Кроме того, отмечалась экспрессия в эпителиальных тканях или нормальной эпителиальной ткани языка, кожи, желудка и молочной железы новорожденных (Abuazza G. et al. (2006), Am J Physiol Renal Physiol 291, 1132-1141; Troy T.C. et al. (2007), Molecular Biotechnology 36, 166-74; Zhao L. et al. (2008), Am J Physiol Regul Integr Comp Physiol 294, 1856-1862). Кроме этого, собственные данные также показали низкую или очень низкую экспрессию CLDN6 в плаценте, мочевом пузыре, эндометрии, предстательной железе и периферических нервах человека и частую гиперэкспрессию CLDN6 при различных раковых заболеваниях. Было показано, что CLDN6 гиперэкспрессируется в опухолях, в том числе в опухолях головного мозга у детей, аденокарциномах желудка и опухолях стволовых клеток, а также висцеральных карциномах типа карциномы яичников. Также было показано, что гиперэкспрессия CLDN6 в раковых клетках желудка приводит к повышенной инвазивности, миграции и пролиферации, свидетельствуя о том, что CLDN6 является маркером плохого прогноза и может играть какую-то роль в поддержании злокачественного фенотипа. Кроме того, было показано, что CLDN6 действует в качестве супрессора рака посредством ингибирования пролиферации клеток и запуска апоптоза в раковых линиях клеток молочной железы.
Было обнаружено, что CLDN6 экспрессируется, к примеру, при раке яичников, раке легких, раке желудка, раке молочной железы, раке печени, раке поджелудочной железы, раке кожи, меланомах, раке головы и шеи, саркомах, раке желчных протоков, почечно-клеточном раке и раке мочевого пузыря. CLDN6 является особенно предпочтительной мишенью для профилактики и/или лечения рака яичников, в частности аденокарциномы яичников и тератокарциномы яичников, рака легких, в том числе мелкоклеточного рака легких (SCLC) и немелкоклеточного рака легких (NSCLC), в частности плоскоклеточной карциномы и аденокарциномы легких, рака желудка, рака груди, рака печени, рака поджелудочной железы, рака кожи, в частности базальноклеточной карциномы и плоскоклеточной карциномы, злокачественной меланомы, рака головы и шеи, в частности злокачественной плеоморфной аденомы, саркомы, в частности синовиальной саркомы и карциносаркомы, рака желчных протоков, рака мочевого пузыря, в частности переходно-клеточной карциномы и папиллярной карциномы, рака почек, в частности почечно-клеточной карциномы, в том числе светлоклеточной почечно-клеточной карциномы и папиллярной почечно-клеточной карциномы, рака толстой кишки, рака тонкой кишки, в том числе рака подвздошной кишки, в частности аденокарциномы тонкой кишки и аденокарциномы подвздошной кишки, эмбриональной карциномы яичек, хориокарциномы плаценты, рака шейки матки, рака яичек, в частности семиномы яичек, тератомы яичек и эмбрионального рака яичек, рака матки, опухолей зародышевых клеток типа тератокарциномы или эмбриональной карциномы, в частности опухолей половых клеток яичек, и их метастатических форм. В одном воплощении раковое заболевание, связанное с экспрессией CLDN6, выбирают из группы, состоящей из рака яичников, рака легких, метастатического рака яичников и метастатического рака легких. Предпочтительно рак яичников представляет собой карциному или аденокарциному. Предпочтительно рак легких представляет собой карциному или аденокарциному, а предпочтительно это бронхиолярный рак типа бронхиолярной карциномы или бронхиолярной аденокарциномы.
Термин "CLDN6" предпочтительно относится к CLDN6 человека, в частности, к белку, включающему, а предпочтительно состоящему из аминокислотной последовательности по SEQ ID NO: 1 или SEQ ID NO: 2 из списка последовательностей, или к варианту такой аминокислотной последовательности. Первая внеклеточная петля CLDN6 предпочтительно включает аминокислоты 28-80, более предпочтительно аминокислоты 28-76 из аминокислотной последовательности, приведенной в SEQ ID NO: 1, или аминокислотной последовательности, приведенной в SEQ ID NO: 2. Вторая внеклеточная петля CLDN6 предпочтительно включает аминокислоты 138-160, предпочтительно аминокислоты 141-159, более предпочтительно аминокислоты 145-157 из аминокислотной последовательности, приведенной в SEQ ID NO: 1, или аминокислотной последовательности, приведенной в SEQ ID NO: 2. Данные первая и вторая внеклеточные петли предпочтительно образуют внеклеточную часть CLDN6.
Термин "экспрессируется на поверхности клетки" или "связанная с поверхностью клетки" означает, что молекула типа CLDN6 связана с плазматической мембраной клетки и располагается в ней, причем по меньшей мере часть молекулы обращена во внеклеточное пространство данной клетки и доступна извне от данной клетки, напр., для антител, находящихся вне клетки. При этом часть предпочтительно означает по меньшей мере 4, предпочтительно по меньшей мере 8, предпочтительно по меньшей мере 12, более предпочтительно по меньшей мере 20 аминокислот. Связь может быть прямой или непрямой. Например, такая связь может быть посредством одного или нескольких трансмембранных доменов, одного или нескольких липидных якорей или путем взаимодействия с любым другим белком, липидом, сахаридом или другой структурой, которая может находиться на наружном слое плазматической мембраны клетки. Например, молекула, связанная с поверхностью клетки, может быть трансмембранным белком, содержащим внеклеточную часть, или же белком, связанным с поверхностью клетки посредством взаимодействия с другим белком, который является трансмембранным белком.
"Клеточная поверхность" или "поверхность клетки" применяется в соответствии со своим обычным значением в данной области и тем самым включает внешнюю часть клетки, которая доступна для связывания с белками и другими молекулами.
"Клеточно-опосредованный иммунитет", "клеточный иммунитет", "клеточный иммунный ответ" или аналогичные термины служат для обозначения клеточного ответа, направленного на клетки, характеризующиеся экспрессией антигена, в частности, характеризующиеся презентацией антигена с MHC класса I или класса II. Клеточный ответ относится к клеткам, называемым T-клетками или T-лимфоцитами, которые действуют в качестве "хелперов" или "киллеров". Хелперные T-клетки (также называются Т-клетками CD4+) играют главную роль, регулируя иммунный ответ, а клетки-киллеры (также называемые цитотоксическими T-клетками, цитолитическими T-клетками, T-клетками CD8+ или CTL) уничтожают больные клетки типа раковых клеток, предотвращая образование новых больных клеток.
Термин "эпитоп" относится к антигенной детерминанте в молекулах типа антигенов, т.е. к той части или фрагменту молекулы, которая распознается, то есть связывается иммунной системой, к примеру, распознается антителом или CAR. Например, эпитопы - это дискретные трехмерные участки антигена, которые распознаются иммунной системой. Эпитопы обычно состоят из химически активных поверхностных группировок молекул типа аминокислот или боковых цепей сахаров и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первыми, но не со вторыми, теряется в присутствии денатурирующих растворителей. Предпочтительно эпитоп способен вызвать иммунный ответ против антигена или клетки, экспрессирующей антиген. Предпочтительно термин относится к иммуногенной части антигена. Эпитоп белка типа опухолевого антигена предпочтительно включает непрерывную или прерывистую часть данного белка предпочтительно длиной от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30 и наиболее предпочтительно от 10 до 25 аминокислот, к примеру, эпитоп предпочтительно может быть длиной в 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот.
"Процессинг антигена" означает расщепление антигена на продукты процессинга, которые являются фрагментами данного антигена (напр., расщепление белка на пептиды), и ассоциацию одного или нескольких таких фрагментов (напр., посредством связывания) с молекулами MHC для презентации клетками, предпочтительно антигенпрезентирующими клетками, определенным T-клеткам.
Антигенпрезентирующие клетки (APC) - это клетки, которые экспонируют антиген в контексте главного комплекса гистосовместимости (MHC) на своей поверхности. T-клетки могут распознавать этот комплекс при помощи своего T-клеточного рецептора (TCR). Антигенпрезентирующие клетки осуществляют процессинг антигенов и презентируют их T-клеткам. Согласно изобретению, термин "антигенпрезентирующие клетки" включает профессиональные антигенпрезентирующие клетки и непрофессиональные антигенпрезентирующие клетки.
Профессиональные антигенпрезентирующие клетки очень эффективно интернализируют антигены либо посредством фагоцитоза, либо путем опосредованного рецептором эндоцитоза, а затем экспонируют на своей мембране фрагменты антигена, связанные с молекулами MHC класса II. T-клетки распознают комплекс молекулы MHC класса II с антигеном на мембране антигенпрезентирующей клетки и взаимодействуют с ним. Затем антигенпрезентирующая клетка вырабатывает дополнительный костимулирующий сигнал, вызывающий активацию T-клеток. Экспрессия костимулирующих молекул является отличительным признаком профессиональных антигенпрезентирующих клеток. Основными типами профессиональных антигенпрезентирующих клеток являются дендритные клетки, которые имеют самый широкий спектр презентации антигенов и наверно являются наиболее важными антигенпрезентирующими клетками, макрофаги, B-клетки и некоторые активированные эпителиальные клетки.
Термин "макрофаги" относится к подгруппе фагоцитарных клеток, образующихся при дифференцировке моноцитов. Макрофаги, которые активируются при воспалении или иммунными цитокинами либо микробными продуктами, неспецифически поглощают и уничтожают чужеродные патогены внутри макрофагов путем гидролитической и окислительной атаки, вызывающей деградацию патогена. Пептиды из деградированных белков экспонируются на клеточной поверхности макрофагов, где они могут распознаваться T-клетками, а также могут напрямую взаимодействовать с антителами на поверхности B-клеток, вызывая активацию T- и B-клеток и дальнейшую стимуляцию иммунного ответа. Макрофаги относятся к классу антиген-презентирующих клеток. В одном воплощении макрофаги представлены макрофагами селезенки.
Термин "дендритные клетки" (DC) относится к другому подтипу фагоцитарных клеток, принадлежащих к классу антигенпрезентирующих клеток. В одном воплощении дендритные клетки происходят из предшественников кроветворных клеток костного мозга. Эти клетки-предшественники сначала превращаются в незрелые дендритные клетки. Эти незрелые клетки характеризуются высокой фагоцитарной активностью и низким потенциалом активации T-клеток. Незрелые дендритные клетки постоянно проверяют окружающую среду на наличие патогенов типа вирусов и бактерий. Как только они вступают в контакт с презентируемым антигеном, они активируются и превращаются в зрелые дендритные клетки, которые начинают мигрировать в селезенку или лимфатические узлы. Незрелые дендритные клетки фагоцитируют патогены и расщепляют их белки на мелкие кусочки, а после созревания презентируют эти фрагменты на своей клеточной поверхности с помощью молекул MHC. Одновременно у них повышается уровень рецепторов на клеточной поверхности, действующих в качестве корецепторов при активации T-клеток типа CD80, CD86 и CD40, значительно повышая их способность активировать T-клетки. Также у них повышается уровень хемотаксических рецепторов CCR7, побуждающих дендритные клетки перемещаться через кровоток в селезенку либо через лимфатическую систему в лимфатические узлы. Здесь они действуют в качестве антигенпрезентирующих клеток и активируют T-клетки-хелперы и T-клетки-киллеры, а также B-клетки путем презентации им антигенов наряду с неспецифичными для антигенов костимулирующими сигналами. Таким образом, дендритные клетки могут активно индуцировать связанный с T-клетками или B-клетками иммунный ответ. В одном воплощении дендритные клетки представлены дендритными клетками селезенки.
Согласно изобретению, термин "CAR" (или "химерный рецептор антигена") относится к искусственным рецепторам, включающим одну молекулу или некий комплекс молекул, которые распознают, т.е. связываются с целевой структурой (напр., антигеном) на клетках мишени типа раковых клеток (напр., путем связывания антигенсвязывающего домена с антигеном, экспрессируемым на поверхности клеток мишени), и могут придавать специфичность иммуноэффекторным клеткам типа T-клеток, экспрессирующих такой CAR на клеточной поверхности. Предпочтительно распознавание CAR целевой структуры приводит к активации иммуноэффекторных клеток, экспрессирующих данный CAR. CAR может включать одну или несколько белковых единиц, причем такие белковые единицы содержат один или несколько доменов, как описано здесь. Термин "CAR" не включает T-клеточные рецепторы.
Терапия методом адоптивного переноса клеток с помощью T-клеток со встроенным CAR, экспрессирующих химерные рецепторы антигенов, является перспективным средством противораковой терапии, так как T-клетки со встроенным CAR могут быть нацелены практически на любой опухолевый антиген. Например, T-клетки пациента можно подвергнуть генной инженерии (генетически модифицировать) для экспрессии CAR, специфически направленных против антигенов на опухолевых клетках пациента, а затем ввести обратно пациенту.
Термин "противоопухолевый" в настоящем изобретении относится к таким биологическим эффектам, которые могут проявляться уменьшением объема опухолей, снижением количества опухолевых клеток, снижением количества метастазов, предотвращением возникновения опухолей в первую очередь, увеличением продолжительности жизни или ослаблением различных физиологических симптомов, связанных с раковым заболеванием.
В настоящем изобретении термин "аутологичный" служит для обозначения любого материала, полученного от одного и того же индивида, который позже будет снова введен тому же индивиду.
"Аллогенный" означает то, что трансплантат получен от другого животного того же вида.
"Ксеногенный" означает то, что трансплантат получен от животного другого вида.
Термин "сингенный" применяется для описания того, что происходит от индивида или ткани, имеющей идентичный генотип, т.е. идентичных близнецов или животных одной и той же инбредной линии либо их тканей.
Термин "рак" в настоящем изобретении определяется как заболевание, характеризующееся быстрым и неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных раковых заболеваний включают, без ограничения, рак молочной железы, рак простаты, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почек, рак печени, рак мозга, лимфому, лейкоз, рак легких и др.
В настоящем изобретении термины "пептид", "полипептид" и "белок" применяются взаимозаменяемо и относятся к соединениям, состоящим из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по крайней мере две аминокислоты, а максимальное количество аминокислот, которые могут входить в последовательность белка или пептида, ничем не ограничено. Полипептиды включают любые пептиды или белки, состоящие из двух и более аминокислот, связанных друг с другом пептидными связями. В настоящем изобретении этот термин относится как к коротким цепям, которые также обычно именуются в данной области пептидами, олигопептидами и олигомерами, к примеру, так и к более длинным цепям, которые обычно именуются в данной области белками, которых существует много типов. "Полипептиды" включают, к примеру, биологически активные фрагменты, практически гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки, среди прочего. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды либо их комбинации.
Термин "полинуклеотид" в настоящем изобретении определяется как цепочка нуклеотидов. Кроме того, нуклеиновые кислоты представляют собой полимеры нуклеотидов. Таким образом, нуклеиновые кислоты и полинуклеотиды в настоящем изобретении взаимозаменяемы. Специалистам в данной области в общем известно, что нуклеиновые кислоты представляют собой полинуклеотиды, которые можно гидролизовать до мономерных "нуклеотидов". А мономерные нуклеотиды можно гидролизировать до нуклеозидов. В настоящем изобретении полинуклеотиды включают, без ограничения, все последовательности нуклеиновых кислот, которые получены любыми способами, доступными в данной области, включая, без ограничения, рекомбинантные способы, т.е. клонирование последовательностей нуклеиновых кислот из рекомбинантной библиотеки или клеточного генома по обычной технологии клонирования и ПЦР и т.д., а также методами синтеза. Термин "полинуклеотид", который применяется здесь, следует интерпретировать в широком смысле, включая ДНК и РНК, в том числе модифицированные ДНК и РНК.
В настоящем изобретении термин "РНК" относится к молекулам нуклеиновой кислоты, включающим рибонуклеотидные остатки. В предпочтительных воплощениях РНК содержит все или большинство рибонуклеотидных остатков. В настоящем изобретении "рибонуклеотид" означает нуклеотид с гидроксильной группой в положении 2' у β-D-рибофуранозильной группы. РНК охватывает, без ограничения, двухцепочечную РНК, одноцепочечную РНК, выделенную РНК типа частично очищенной РНК, практически чистую РНК, синтетическую РНК, полученную рекомбинантно РНК, а также модифицированную РНК, которая отличается от природной РНК вставкой, делецией, заменой и/или изменением одного или нескольких нуклеотидов. Такие изменения могут означать добавление ненуклеотидного материала к внутренним нуклеотидам РНК или к концам РНК. При этом также предусматривается, что нуклеотиды в РНК могут быть нестандартными нуклеотидами типа химически синтезированных нуклеотидов или дезоксинуклеотидов. В настоящем изобретении такие измененные РНК считаются аналогами природной РНК.
В некоторых воплощениях настоящего изобретения РНК представляет собой матричную РНК (мРНК), связанную с РНК-транскриптами, кодирующими пептид или белок. Как установлено в данной области, мРНК обычно содержит 5'-нетранслируемую область (5'-UTR), область, кодирующую пептид, и 3'-нетранслируемую область (3'-UTR). В некоторых воплощениях РНК получают путем транскрипции in vitro или химического синтеза. В одном воплощении мРНК получают путем транскрипции in vitro с использованием матрицы ДНК, причем ДНК означает нуклеиновую кислоту, содержащую дезоксирибонуклеотиды.
В одном воплощении РНК представляет собой транскрибируемую in vitro РНК (IVT-РНК), которая может быть получена путем транскрипции in vitro соответствующей ДНК-матрицы. Промотором для контроля транскрипции может быть любой промотор для любой РНК-полимеразы. ДНК-матрица для транскрипции in vitro может быть получена путем клонирования нуклеиновой кислоты, в частности кДНК, и введения ее в соответствующий вектор для транскрипции in vitro. кДНК может быть получена путем обратной транскрипции РНК.
В одном воплощении РНК может содержать модифицированные рибонуклеотиды. Примеры модифицированных рибонуклеотидов включают, без ограничения, 5-метилцитидин, псевдоуридин и/или 1-метил-псевдоуридин.
В некоторых воплощениях РНК по настоящему изобретению содержит 5'-кэп. В одном воплощении РНК по настоящему изобретению не содержит некэпированных 5'-трифосфатов. В одном воплощении РНК может быть модифицирована аналогом 5'-кэпа. Термин "5'-кэп" относится к структуре, находящейся на 5'-конце молекулы мРНК, которая обычно состоит из гуанозинового нуклеотида, соединенного с мРНК через 5'-5'-трифосфатную связь. В одном воплощении этот гуанозин метилирован в положении 7. Получение РНК с 5'-кэпом или аналогом 5'-кэпа может осуществляться путем транскрипции in vitro, при которой 5'-кэп котранскрипционно экспрессируется в цепи РНК, или же он может присоединяться к РНК посттранскрипционно с помощью кэппирующих ферментов.
В некоторых воплощениях РНК по настоящему изобретению содержит 5'-UTR и/или 3'-UTR. Термин "нетранслируемая область" или "UTR" означает такую область в молекуле ДНК, которая транскрибируется, но не транслируется в аминокислотную последовательность, или же соответствующую область в молекуле РНК типа молекулы мРНК. Нетранслируемая область (UTR) может находиться с 5'-стороны (вышерасположенная) от открытой рамки считывания (5'-UTR) и/или с 3'-стороны (нижерасположенная) от открытой рамки считывания (3'-UTR). 5'-UTR, если она есть, располагается на 5'-конце впереди от стартового кодона кодирующей белок области. 5'-UTR находится позади от 5'-кэпа (если он есть), напр., непосредственно примыкает к 5'-кэпу. 3'-UTR, если она есть, располагается на 3'-конце после кодона терминации кодирующей белок области, но термин "3'-UTR" предпочтительно не включает поли(A)-хвост. Таким образом, 3'-UTR находится впереди от последовательности поли(A) (если она есть), напр., непосредственно примыкает к последовательности поли(A).
В некоторых воплощениях РНК по настоящему изобретению содержит последовательность 3'-поли(A). Термин "последовательность поли(A)" относится к последовательности остатков аденила (A), которая обычно располагается на 3'-конце молекулы РНК. Согласно изобретению, в одном воплощении последовательность поли(A) включает по меньшей мере 20, по меньшей мере 40, по меньшей мере 80 или по меньшей мере 100 и вплоть до 500, до 400, до 300, до 200 или до 150 нуклеотидов A и особенно примерно 120 нуклеотидов A.
"Кодирующий" означает неотъемлемое свойство определенных последовательностей нуклеотидов в полинуклеотидах типа генов, кДНК или мРНК служить матрицей для синтеза других полимеров и макромолекул в биологических процессах, имеющих определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК) или определенную последовательность аминокислот и вытекающие из этого биологические свойства. Так, ген кодирует белок, если при транскрипции и трансляции мРНК, соответствующей этому гену, образуется белок в клетке или другой биологической системе. И кодирующая нить, нуклеотидная последовательность которой идентична последовательности мРНК и обычно приводится в перечнях последовательностей, и некодирующая нить, если она используется в качестве матрицы для транскрипции гена или кДНК, может именоваться кодирующей белок или другой продукт этого гена или кДНК.
В настоящем изобретении "эндогенный" означает такой материал, который получен или вырабатывается внутри организма, клетки, ткани или системы.
В настоящем изобретении "экзогенный" означает такой материал, который вводится извне или вырабатывается вне организма, клетки, ткани или системы.
Термин "экспрессия" в настоящем изобретении определяется как транскрипция и/или трансляция определенной последовательности нуклеотидов.
"Экспрессирующий вектор" означает вектор, содержащий рекомбинантный полинуклеотид, включающий последовательности контроля экспрессии, функционально связанные с экспрессируемой последовательностью нуклеотидов. Экспрессирующий вектор содержит достаточное количество цис-элементов для экспрессии; другие элементы для экспрессии могут поступать из клеток хозяина или из системы экспрессии in vitro. Экспрессирующие векторы включают все известные в данной области векторы, как-то космиды, плазмиды (напр., "голые" или содержащиеся в липосомах) и вирусы (напр., лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые содержат в себе рекомбинантный полинуклеотид.
"Гомологичные" означает сходство последовательностей или идентичность последовательностей между двумя полипептидами или между двумя молекулами нуклеиновой кислоты. Когда одно положение в обеих сравниваемых последовательностях занято одним и тем же основанием или одной и той же аминокислотой, напр., если одно положение в каждой из двух молекул ДНК занято аденином, то молекулы гомологичны в этом положении. Степень гомологичности между двумя последовательностями является функцией количества совпадающих или гомологичных положений, общих для двух последовательностей, деленного на количество сравниваемых положений × 100. Например, если 6 из 10 положений в двух последовательностях совпадают или гомологичны, то эти две последовательности гомологичны на 60%. Как правило, сравнение проводится при выравнивании двух последовательностей для получения максимальной гомологии. Гомологичные последовательности по изобретению проявляют идентичность аминокислотных или нуклеотидных остатков по меньшей мере на 40%, в частности, по меньшей мере на 50%, на 60%, на 70%, на 80%, на 90% и предпочтительно по меньшей мере на 95%, на 98 или на 99%.
"Фрагмент" в отношении аминокислотной последовательности (пептида или белка) означает часть аминокислотной последовательности, то есть последовательность, которая представляет аминокислотную последовательность, укороченную на N-конце и/или на C-конце. Фрагмент, укороченный на С-конце (N-концевой фрагмент), можно получить, к примеру, путем трансляции усеченной открытой рамки считывания, лишенной 3'-конца открытой рамки считывания. Фрагмент, укороченный на N-конце (C-концевой фрагмент), можно получить, к примеру, путем трансляции усеченной открытой рамки считывания, лишенной 5'-конца открытой рамки считывания, если только усеченная открытая рамка считывания содержит стартовый кодон, служащий для инициации трансляции. Фрагмент аминокислотной последовательности включает, напр., по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% аминокислотных остатков из аминокислотной последовательности. Фрагмент аминокислотной последовательности предпочтительно содержит по меньшей мере 6, в частности, по меньшей мере 8, по меньшей мере 12, по меньшей мере 15, по меньшей мере 20, по меньшей мере 30, по меньшей мере 50 или по меньшей мере 100 последовательных аминокислот из аминокислотной последовательности.
"Вариант", "вариант белка" или "вариант полипептида" означает такой белок, который отличается от исходного белка наличием по меньшей мере одной модификации аминокислоты. Исходным полипептидом может быть природный или полипептид дикого типа (WT) или же модифицированная версия полипептида дикого типа. Предпочтительно вариант полипептида содержит по меньшей мере одну модификацию аминокислоты по сравнению с исходным полипептидом, напр., от 1 до 20 аминокислотных модификаций, а предпочтительно от 1 до 10 или от 1 до 5 аминокислотных модификаций по сравнению с исходным.
"Исходный полипептид", "исходный белок", "предшественник полипептида" или "предшественник белка" в настоящем изобретении означает немодифицированный полипептид, который впоследствии подвергается модификации для создания варианта. Исходным полипептидом может быть полипептид дикого типа либо вариант или искусственная версия полипептида дикого типа.
"Дикого типа", "WT" или "нативная" означает такую аминокислотную последовательность, которая встречается в природе, включая аллельные варианты. Белок или полипептид дикого типа имеет такую аминокислотную последовательность, которая не была преднамеренно модифицирована.
В настоящем изобретении "варианты" аминокислотной последовательности (пептида, белка или полипептида) включают варианты со вставкой аминокислот, варианты с добавлением аминокислот, варианты с делецией аминокислот и/или варианты с заменой аминокислот. Термин "вариант" включает все мутанты, сплайс-варианты, модифицированные посттрансляционно варианты, конформации, изоформы, аллельные варианты, видовые варианты и видовые гомологи, в частности такие, которые встречаются в природе.
Варианты со вставкой аминокислот содержат вставки одной, двух или нескольких аминокислот в определенную аминокислотную последовательность. В случае вариантов аминокислотной последовательности со вставкой, в определенный сайт аминокислотной последовательности вставляется один или несколько аминокислотных остатков, хотя возможны и случайные вставки с соответствующим скринингом полученных продуктов. Варианты с добавлением аминокислот включают присоединение к N- и/или C-концу одной или нескольких аминокислот типа 1, 2, 3, 5, 10, 20, 30, 50 и более аминокислот. Варианты с делецией аминокислот характеризуются удалением из последовательности одной или нескольких аминокислот типа удаления 1, 2, 3, 5, 10, 20, 30, 50 и более аминокислот. Делеции могут находиться в любом положении белка. Варианты с делецией аминокислот, которые включают делеции на N-конце и/или C-конце белка, также называют вариантами с усечением на N-конце и/или C-конце. Варианты с заменой аминокислот характеризуются тем, что из последовательности удаляется по меньшей мере один остаток и на его место вставляется другой остаток. Предпочтение отдается модификациям в тех положениях аминокислотной последовательности, которые не являются консервативными между гомологичными белками или пептидами, и/или замене аминокислот на другие с близкими свойствами. Предпочтительно замены аминокислот у пептидных и белковых вариантов представляют собой консервативные замены аминокислот, то есть замены одинаково заряженных или незаряженных аминокислот. Консервативные замены аминокислот включают замены в пределах одного семейства аминокислот, родственных по своим боковым цепям. Встречающиеся в природе аминокислоты обычно подразделяются на 4 семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют вместе как ароматические аминокислоты. В одном воплощении консервативные замены аминокислот включают замены в пределах следующих групп:
глицин, аланин;
валин, изолейцин, лейцин;
аспарагиновая кислота, глутаминовая кислота;
аспарагин, глутамин;
серин, треонин;
лизин, аргинин; и
фенилаланин, тирозин.
Предпочтительно степень сходства, предпочтительно идентичности между данной аминокислотной последовательностью и аминокислотной последовательностью, которая является вариантом данной аминокислотной последовательности, должна составлять по меньшей мере 60%, 65%, 70%, 80%, 81%, 82 %, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Степень сходства или идентичности предпочтительно приводится для аминокислотной области, которая составляет по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или примерно 100% от всей длины сравниваемой аминокислотной последовательности. Например, если сравниваемая аминокислотная последовательность состоит из 200 аминокислот, то степень сходства или идентичности предпочтительно приводится по меньшей мере для 20, по меньшей мере 40, по меньшей мере 60, по меньшей мере 80, по меньшей мере 100, по меньшей мере 120, по меньшей мере 140, по меньшей мере 160, по меньшей мере 180 или примерно 200 аминокислот, предпочтительно непрерывных аминокислот. В предпочтительных воплощениях степень сходства или идентичности приводится для всей длины сравниваемой аминокислотной последовательности. Выравнивание для определения сходства последовательностей, предпочтительно идентичности последовательностей, может осуществляться с помощью известных в данной области инструментов, предпочтительно с наилучшим выравниванием последовательностей, например, с помощью Align, используя стандартные настройки, предпочтительно EMBOSS::needle, матрица: Blosum62, открытие пробела 10,0, расширение пробела 0,5.
"Сходство последовательностей" означает процент таких аминокислот, которые либо идентичны, либо представляют собой консервативные замены аминокислот. "Идентичность последовательностей" между двумя аминокислотными последовательностями означает процент таких аминокислот, которые идентичны между последовательностями.
Термин "степень идентичности" служит для обозначения процента таких аминокислотных остатков, которые идентичны между двумя сравниваемыми последовательностями, полученного после наилучшего выравнивания, причем этот процент является чисто статистическим, а различия между двумя последовательностями распределяются случайным образом по всей их длине. Сравнение последовательностей между двумя аминокислотными последовательностями обычно проводится путем сравнения этих последовательностей после их оптимального выравнивания, причем такое сравнение проводится по сегментам или по "окнам сравнения" с тем, чтобы идентифицировать и сравнивать локальные участки сходства последовательностей. Оптимальное совмещение последовательностей для сравнения может проводиться, помимо ручного, с помощью алгоритма локальной гомологии Smith and Waterman, 1981, Ads App. Math. 2, 482, с помощью алгоритма локальной гомологии Needleman and Wunsch, 1970, J. Mol. Biol. 48, 443, методом поиска сходства Pearson and Lipman, 1988, Proc. Natl Acad. Sci. USA 85, 2444, либо с помощью компьютерных программ, использующих эти алгоритмы (GAP, BESTFIT, FASTA, BLASTP, BLASTN и TFASTA in Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wis.).
Степень идентичности рассчитывается путем определения количества идентичных положений между двумя сравниваемыми последовательностями, деления этого числа на количество сравниваемых положений и умножения полученного результата на 100 с тем, чтобы получить степень идентичности между этими двумя последовательностями в процентах.
Термин "функциональный вариант" в настоящем изобретении означает такой вариант молекулы или последовательности, который включает аминокислотную последовательность, измененную по одной или нескольким аминокислотам в сравнении с аминокислотной последовательностью исходной молекулы или последовательности и все еще способную выполнять одну или несколько функций исходной молекулы или последовательности, напр., связываться с молекулой мишени или способствовать связыванию с молекулой мишени. В одном воплощении функциональный вариант, сам по себе или в комбинации с другими элементами, конкурирует с исходной молекулой или последовательностью за связывание с молекулой мишени. Иными словами, модификации аминокислотной последовательности исходной молекулы или последовательности не влияют существенно или не изменяют характеристики связывания этой молекулы или последовательности. В других воплощениях связывание функционального варианта может уменьшаться, но все же будет значительным, напр., связывание функционального варианта может составлять по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% от исходной молекулы или последовательности. Однако еще в других воплощениях связывание функционального варианта может усиливаться по сравнению с исходной молекулой или последовательностью.
То, что аминокислотная последовательность (пептида, белка или полипептида) "происходит из" указанной аминокислотной последовательности (пептида, белка или полипептида), относится к происхождению первой аминокислотной последовательности. Предпочтительно аминокислотная последовательность, которая происходит от определенной аминокислотной последовательности, имеет такую аминокислотную последовательность, которая идентична, практически идентична или гомологична этой конкретной последовательности или ее фрагменту. Аминокислотные последовательности, полученные из определенной аминокислотной последовательности, могут быть вариантами этой конкретной последовательности или ее фрагмента.
В настоящем изобретении "обучающий материал" или "инструкции" включает публикации, записи, диаграммы или любые другие средства выражения, которые можно использовать для осведомления о полезности композиций и способов по изобретению. Обучающий материал набора по изобретению, к примеру, может быть прикреплен к контейнеру, содержащему композиции по изобретению, или может быть отправлен вместе с контейнером, содержащим композиции. С другой стороны, материал может быть отправлен отдельно от контейнера с тем, чтобы инструктивный материал и композиции использовались получателем совместно.
"Выделенный" означает измененный или извлеченный из естественного состояния. Например, нуклеиновая кислота или пептид, который естественным образом присутствует у живого животного, не является "выделенным", но та же самая нуклеиновая кислота или пептид, частично или полностью отделенные от существующих вместе с ними материалов в их естественном состоянии, являются "выделенными". Выделенная нуклеиновая кислота или белок может существовать в практически очищенном виде или же может существовать в неестественном окружении типа, к примеру, клеток хозяина.
В настоящем изобретении применяются следующие сокращения для обычно встречающихся оснований нуклеиновых кислот: "A" означает аденозин, "C" означает цитозин, "G" означает гуанозин, "T" означает тимидин, а "U" означает уридин.
"Лентивирус" в настоящем изобретении означает род семейства Retroviridae. Лентивирусы уникальны среди ретровирусов тем, что способны инфицировать неделящиеся клетки; они могут вносить значительный объем генетической информации в ДНК клеток хозяина, поэтому они являются одним из наиболее эффективных векторов для доставки генов. HIV, SIV и FIV - все это примеры лентивирусов. Векторы, полученные из лентивирусов, являются средством достижения значительных уровней переноса генов in vivo.
Термин "функционально связанный" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты находится в функциональном отношении со второй последовательностью нуклеиновой кислоты. К примеру, промотор функционально связан с кодирующей последовательностью, если он влияет на транскрипцию или экспрессию кодирующей последовательности. Обычно функционально связанные последовательности ДНК являются смежными, а при необходимости они соединяют две кодирующие белки области в одной и той же рамке считывания.
Термин "гиперэкспрессированный" опухолевый антиген или "гиперэкспрессия" опухолевого антигена служит для обозначения аномального уровня экспрессии опухолевого антигена в клетках из пораженного участка типа солидной опухоли в определенной ткани или органе пациента относительно уровня экспрессии в нормальных клетках этой ткани или органа.
Термин "промотор" в настоящем изобретении определяется как последовательность ДНК, распознаваемая синтетическим аппаратом клетки или введенным синтетическим аппаратом, необходимая для инициации специфической транскрипции полинуклеотидной последовательности.
В настоящем изобретении термин "промоторная/регуляторная последовательность" означает последовательность нуклеиновой кислоты, которая необходима для экспрессии продукта гена, функционально связанного с промоторной/регуляторной последовательностью. В некоторых случаях такая последовательность может быть последовательностью базового промотора, а в других случаях такая последовательность может также включать последовательность энхансера и другие регуляторные элементы, необходимые для экспрессии продукта гена. Промоторная/регуляторная последовательность, к примеру, может быть такой, которая экспрессирует продукт гена тканеспецифичным образом.
"Конститутивный" промотор - это последовательность нуклеотидов, которая, если она функционально связана с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает образование продукта гена в клетках при большинстве или при всех физиологических условиях клетки.
"Индуцибельный" промотор - это последовательность нуклеотидов, которая, если она функционально связана с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает образование продукта гена в клетках практически только тогда, когда в клетках присутствует индуктор, который соответствует промотору.
"Тканеспецифичный" промотор - это последовательность нуклеотидов, которая, если она функционально связана с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает образование продукта гена в клетках практически только, если клетки являются клетками того типа ткани, который соответствует промотору.
Термин "специфически связывается" в настоящем изобретении означает то, что молекула типа антитела или CAR распознает определенный антиген, но практически не распознает или не связывает другие молекулы в образце или у субъекта. Например, антитело, которое специфически связывается с антигеном из одного вида, может также связываться с этим же антигеном из одного или нескольких других видов. Но такая межвидовая реактивность сама по себе не меняет классификацию антитела как специфичного. В другом примере антитело, которое специфически связывается с антигеном, может также связываться с различными аллельными формами антигена. Однако такая перекрестная реактивность сама по себе не меняет классификацию антитела как специфичного. В некоторых случаях термины "специфическое связывание" или "специфически связывается" могут применяться в отношении взаимодействия антитела, белка или пептида со вторым химическим веществом, а это значит, что взаимодействие зависит от присутствия определенной структуры (напр., антигенной детерминанты или эпитопа) у этого химического вещества; к примеру, антитело распознает и связывается с определенной белковой структурой, а не с белками вообще. Если антитело специфично для эпитопа "A", то присутствие молекулы, содержащей эпитоп A (или свободного немеченого A), в реакции, содержащей меченый "A" и антитело, будет уменьшать количество меченого A, связавшегося с антителом.
Термин "трансфицированные" или "трансформированные" или "трансдуцированные" относится к процессу, при котором экзогенная нуклеиновая кислота переносится или вводится в клетки хозяина. "Трансфицированные" или "трансформированные" или "трансдуцированные" клетки - это клетки, которые были трансфицированы, трансформированы или трансдуцированы экзогенной нуклеиновой кислотой. Клетки включают первичные клетки субъекта и их потомство.
Выражение "под транскрипционным контролем" или "функционально связанный" в настоящем изобретении означает то, что промотор находится в правильном положении и ориентации относительно полинуклеотида, чтобы контролировать инициацию транскрипции РНК-полимеразой и экспрессию полинуклеотида.
"Вектор" представляет собой сложное вещество, которое включает выделенную нуклеиновую кислоту и может применяться для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области известны различные векторы, включая, без ограничения, линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор" включает автономно реплицирующиеся плазмиды или вирусы. Термин также следует понимать как включающий неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, как-то, к примеру, соединения полилизина, липосомы и др. Примеры вирусных векторов включают, без ограничения, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы и др.
Описание
Настоящим изобретением предусмотрены композиции и способы лечения рака, среди прочих заболеваний. Рак может представлять собой солидную опухоль, первичную или метастазирующую опухоль. В одном воплощении рак представляет собой рак, экспрессирующий CLDN6. В одном воплощении рак выбран из группы, состоящей из рака яичников, в частности аденокарциномы яичников и тератокарциномы яичников, рака легких, в том числе мелкоклеточного рака легких (SCLC) и немелкоклеточного рака легких (NSCLC), в частности плоскоклеточной карциномы и аденокарциномы легких, рака желудка, рака молочной железы, рака печени, рака поджелудочной железы, рака кожи, в частности базальноклеточной карциномы и плоскоклеточной карциномы, злокачественной меланомы, рака головы и шеи, в частности злокачественной плеоморфной аденомы, саркомы, в частности синовиальной саркомы и карциносаркомы, рака желчных протоков, рака мочевого пузыря, в частности переходно-клеточной карциномы и папиллярной карциномы, рака почек, в частности почечно-клеточной карциномы, в том числе светлоклеточной почечно-клеточной карциномы и папиллярной почечно-клеточной карциномы, рака толстой кишки, рака тонкой кишки, в том числе рака подвздошной кишки, в частности аденокарциномы тонкой кишки и аденокарциномы подвздошной кишки, эмбриональной карциномы яичек, хориокарциномы плаценты, рака шейки матки, рака яичек, в частности семиномы яичек, тератомы яичек и эмбрионального рака яичек, рака матки, опухолей зародышевых клеток типа тератокарциномы или эмбриональной карциномы, в частности опухолей половых клеток яичек, и их метастатических форм. В одном воплощении раковое заболевание, связанное с экспрессией CLDN6, выбрано из группы, состоящей из рака яичников, рака легких, метастатического рака яичников и метастатического рака легких. Предпочтительно рак яичников представляет собой карциному или аденокарциному. Предпочтительно рак легких представляет собой карциному или аденокарциному, а предпочтительно это бронхиолярный рак типа бронхиолярной карциномы или бронхиолярной аденокарциномы.
Настоящим изобретением предусмотрены химерные рецепторы антигенов (CAR), включающие внеклеточный и внутриклеточный домен. Внеклеточный домен содержит специфичный для мишени связывающий элемент, также именуемый антигенсвязывающим фрагментом или доменом. Внутриклеточный домен или цитоплазматический домен включает костимулирующую сигнальную область 4-1BB и часть дзета-цепи CD3. Костимулирующая сигнальная область 4-1BB является частью CAR, содержащей внутриклеточный домен костимулирующей молекулы 4-1BB. Костимулирующие молекулы - это молекулы клеточной поверхности, отличные от антигеновых рецепторов либо их лигандов, которые необходимы для эффективного ответа лимфоцитов на антиген.
Между внеклеточным доменом и трансмембранным доменом CAR или между цитоплазматическим доменом и трансмембранным доменом CAR может находиться спейсерный домен или область. В различных воплощениях спейсерный домен обеспечивает гибкость антигенсвязывающего домена. В настоящем изобретении термин "спейсерный домен" в общем означает любой олиго- или полипептид, который функционирует для связывания трансмембранного домена либо с внеклеточным доменом, либо с цитоплазматическим доменом в полипептидной цепи. Спейсерный домен может включать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот и наиболее предпочтительно от 25 до 50 аминокислот. В различных воплощениях спейсерный домен содержит от 10 до 300 аминокислот, от 10 до 200 аминокислот, от 10 до 175 аминокислот, от 10 до 150 аминокислот, от 10 до 125 аминокислот, от 10 до 100 аминокислот, от 10 до 75 аминокислот, от 10 до 50 аминокислот, от 10 до 40 аминокислот, от 10 до 30 аминокислот, от 10 до 20 аминокислот или от 10 до 15 аминокислот, включая любые целые числа между конечными точками любых из перечисленных диапазонов. В некоторых воплощениях спейсерный домен происходит из шарнирной области молекулы типа иммуноглобулина. В различных воплощениях спейсерный домен включает всю или же часть шарнирной области из IgG1 человека, IgG2 человека, IgG3 человека или IgG4 человека и может содержать одну или несколько замен аминокислот. В некоторых воплощениях спейсерный домен происходит из последовательности шарнирной области CD8α.
В одном воплощении изобретения предусмотрены клетки (напр., T-клетки), предназначенные для экспрессии CAR, причем клетки со сконструированным CAR проявляют противоопухолевые свойства. CAR по изобретению при экспрессии в клетках способен перенастраивать распознавание антигена на основе специфичности связывания антигена у CAR. В одном воплощении на клетках приведенных здесь типов рака экспрессируется CLDN6. Клетки со сконструированным CAR при связывании со своим родственным антигеном воздействуют на опухолевые клетки так, что опухолевые клетки не могут расти, побуждаются к гибели или иным образом поражаются с тем, что опухолевое бремя у пациента уменьшается или устраняется.
Согласно изобретению, связывающий антиген CLDN6 фрагмент через происходящий из CD8α шарнирный домен соединяется с внутриклеточными доменами, включающими комбинацию сигнального домена 4-1BB (CD137) и сигнального домена CD3-дзета. Включение сигнального домена 4-1BB (CD137) значительно повышает противоопухолевую активность и персистенцию T-клеток CAR in vivo по сравнению с идентичными в остальном T-клетками CAR, не предназначенными для экспрессии 4-1BB (CD137) (Milone M.C. et al. (2009) Molecular Therapy 17(8), 1453-1464).
Антигенсвязывающий домен
CAR по изобретению содержит специфичный для мишени связывающий элемент, также именуемый антигенсвязывающим фрагментом или антигенсвязывающим доменом, который обычно является частью внеклеточного домена CAR. Антигенсвязывающий домен распознает лиганд, действующий в качестве маркера клеточной поверхности на клетках-мишенях, связанных с определенным заболеванием. В частности, CAR по изобретению нацелен на опухолевый антиген CLDN6 в опухолевых клетках.
В одном воплощении связывающий CLDN6 домен в CAR по изобретению специфически связывается с CLDN6. В одном воплощении CLDN6, с которым связывается домен связывания CLDN6 в CAR по изобретению, экспрессируется в раковых клетках. В одном воплощении CLDN6 экспрессируется на поверхности раковых клеток. В одном воплощении связывающий CLDN6 домен связывается со внеклеточным доменом или с эпитопом во внеклеточном домене CLDN6. В одном воплощении связывающий CLDN6 домен связывается с нативными эпитопами CLDN6, присутствующими на поверхности живых клеток. В одном воплощении связывающий CLDN6 домен связывается с первой внеклеточной петлей CLDN6, предпочтительно с аминокислотами в положениях 28-76 CLDN6, или со второй внеклеточной петлей CLDN6, предпочтительно с аминокислотами в положениях 141-159 CLDN6. В определенных воплощениях связывающий CLDN6 домен связывается с таким эпитопом на CLDN6, которого нет на CLDN9. Предпочтительно связывающий CLDN6 домен связывается с таким эпитопом на CLDN6, которого нет на CLDN4 и/или CLDN3. Наиболее предпочтительно связывающий CLDN6 домен связывается с таким эпитопом на CLDN6, которого нет на белках CLDN, отличных от CLDN6. Связывающий CLDN6 домен предпочтительно связывается с CLDN6, но не с CLDN9, и предпочтительно не связывается с CLDN4 и/или CLDN3. Предпочтительно связывающий CLDN6 домен специфичен для CLDN6. Предпочтительно связывающий CLDN6 домен связывается с CLDN6, экспрессированным на клеточной поверхности.
В одном воплощении изобретения антигенсвязывающий домен для CLDN6 включает вариабельную область тяжелой цепи иммуноглобулина (VH) со специфичностью к CLDN6 и вариабельную область легкой цепи иммуноглобулина (VL) со специфичностью к CLDN6. В одном воплощении такая вариабельная область тяжелой цепи (VH) и соответствующая вариабельная область легкой цепи (VL) соединяются через пептидный линкер, предпочтительно пептидный линкер, включающий аминокислотную последовательность (GGGGS)3.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область легкой цепи (VL), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность по SEQ ID NO: x либо ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность по SEQ ID NO: x+1 либо ее функциональный вариант;
где x выбран из 3, 5, 7 и 9.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, либо ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность по SEQ ID NO: 5 или ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность по SEQ ID NO: 4 или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность по SEQ ID NO: 5 или ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность по SEQ ID NO: 23 или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность по SEQ ID NO: 5 или ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность по SEQ ID NO: 24 или ее функциональный вариант.
В некоторых предпочтительных воплощениях связывающий домен для CLDN6 содержит комбинацию вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), выбранную из следующих возможностей (i)-(xi):
(i) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 3, или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 4 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(ii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 6 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(iii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 7 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 8 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(iv) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 9 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 10 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(v) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 4 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(vi) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 23 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта,
(vii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 24 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта.
В особенно предпочтительном воплощении связывающий домен для CLDN6 содержит следующую комбинацию вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL):
VH содержит аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта, а VL содержит аминокислотную последовательность, представленную SEQ ID NO: 24 или ее функциональный вариант, либо фрагмент этой аминокислотной последовательности или функционального варианта.
Термин "фрагмент" относится, в частности, к одному или нескольким определяющим комплементарность участкам (CDR), предпочтительно по меньшей мере к CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL). В одном воплощении данные один или несколько определяющих комплементарность участков (CDR) выбирают из комплекта определяющих комплементарность участков CDR1, CDR2 и CDR3. В особенно предпочтительном воплощении термин "фрагмент" относится к определяющим комплементарность участкам CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL).
В одном воплощении связывающий домен для CLDN6, содержащий один или несколько CDR, комплект CDR или комбинацию комплектов CDR, как описано здесь, включает данные CDR вместе с их промежуточными каркасными участками. Предпочтительно эта часть должна также включать по меньшей мере 50% одного из или обоих первого и четвертого каркасных участков, причем эти 50% составляют 50% С-концевой части первого каркасного участка и 50% N-концевой части четвертого каркасного участка. Конструирование связывающих доменов, проводимое методами рекомбинантной ДНК, может привести к введению N- или C-концевых остатков в вариабельные области, кодируемых линкерами, введенными для облегчения клонирования или других стадий манипуляции, включая введение линкеров для соединения вариабельных областей или для соединения вариабельных областей с другими белковыми последовательностями, включая описанные здесь последовательности.
В одном воплощении связывающий домен, содержащий один или несколько CDR, комплект CDR или комбинацию комплектов CDR, как описано здесь, содержит данные CDR в каркасе антител человека.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область тяжелой цепи (VH), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR описанной здесь вариабельной области тяжелой цепи (VH), напр., вариабельной области тяжелой цепи (VH), включающей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, или ее функционального варианта.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область легкой цепи (VL), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR описанной здесь вариабельной области легкой цепи (VL), напр., вариабельной области легкой цепи (VL), включающей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, или ее функционального варианта.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области тяжелой цепи (VH) из описанной здесь комбинации вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), напр., комбинации, в которой VH включает аминокислотную последовательность, представленную SEQ ID NO: 5 или ее функциональный вариант, а VL включает аминокислотную последовательность, представленную SEQ ID NO: 6 или ее функциональный вариант, и
(ii) вариабельную область легкой цепи (VL), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области легкой цепи (VL) из описанной здесь комбинации вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL).
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области тяжелой цепи (VH) по SEQ ID NO: x или ее функционального варианта, и
(ii) вариабельную область легкой цепи (VL), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области легкой цепи (VL) по SEQ ID NO: x+1 или ее функционального варианта;
где x выбран из 3, 5, 7 и 9.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области тяжелой цепи (VH) по SEQ ID NO: 5 или ее функционального варианта, и
(ii) вариабельную область легкой цепи (VL), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области легкой цепи (VL) по SEQ ID NO: 6 или ее функционального варианта.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области тяжелой цепи (VH) по SEQ ID NO: 5 или ее функционального варианта, и
(ii) вариабельную область легкой цепи (VL), включающую по меньшей мере одну, а предпочтительно две, более предпочтительно все три последовательности CDR вариабельной области легкой цепи (VL) по SEQ ID NO: 4 или ее функционального варианта.
Термин "по меньшей мере одна, а предпочтительно две, более предпочтительно все три последовательности CDR" предпочтительно означает по меньшей мере последовательность CDR3, необязательно в комбинации с последовательностью CDR1 и/или последовательностью CDR2.
CDR1 вариабельной области тяжелой цепи (VH), выбранной из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, предпочтительно включает аминокислоты 26-33 из последовательностей, приведенных в SEQ ID NO: 3, 5, 7 и 9, соответственно. CDR2 вариабельной области тяжелой цепи (VH), выбранной из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, предпочтительно включает аминокислоты 51-58 из последовательностей, приведенных в SEQ ID NO: 3, 5, 7 и 9, соответственно. CDR3 вариабельной области тяжелой цепи (VH), выбранной из группы, состоящей из SEQ ID NO: 3, 5, 7 и 9, предпочтительно включает аминокислоты 97-106 из последовательностей, приведенных в SEQ ID NO: 3, 5, 7 и 9, соответственно.
CDR1 вариабельной области легкой цепи (VL), выбранной из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, предпочтительно включает аминокислоты 27-31 из последовательностей, приведенных в SEQ ID NO: 4, 6, 8, 10, 23 и 24, соответственно. CDR2 вариабельной области легкой цепи (VL), выбранной из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, предпочтительно включает аминокислоты 49-51 из последовательностей, приведенных в SEQ ID NO: 4, 6, 8, 10, 23 и 24, соответственно. CDR3 вариабельной области легкой цепи (VL), выбранной из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 23 и 24, предпочтительно включает аминокислоты 88-97 из последовательностей, приведенных в SEQ ID NO: 4, 6, 8, 10, 23 и 24, соответственно.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область тяжелой цепи (VH), включающую последовательность CDR3: Xaa1 Gly Xaa2 Val Xaa3, где Xaa1 означает любую аминокислоту, предпочтительно ароматическую аминокислоту, более предпочтительно Phe или Tyr, наиболее предпочтительно Tyr, Xaa2 означает любую аминокислоту, предпочтительно ароматическую аминокислоту, более предпочтительно Phe или Tyr, наиболее предпочтительно Tyr, и Xaa3 означает любую аминокислоту, предпочтительно Leu или Phe, более предпочтительно Leu. В одном воплощении связывающий домен для CLDN6 включает вариабельную область тяжелой цепи (VH), содержащую последовательность CDR3: Asp Xaa1 Gly Xaa2 Val Xaa3 или Xaa1 Gly Xaa2 Val Xaa3 Asp, где Xaa1, Xaa2 и Xaa3 уже определены выше. В одном воплощении связывающий домен для CLDN6 содержит вариабельную область тяжелой цепи (VH), включающую последовательность CDR3: Asp Xaa1 Gly Xaa2 Val Xaa3 Asp, где Xaa1, Xaa2 и Xaa3 уже определены выше. В одном воплощении связывающий домен для CLDN6 содержит вариабельную область тяжелой цепи (VH), включающую последовательность CDR3: Ala Arg Asp Xaa1 Gly Xaa2 Val Xaa3 Asp Tyr, где Xaa1, Xaa2 и Xaa3 уже определены выше. В одном воплощении связывающий домен для CLDN6 согласно вышеприведенным воплощениям содержит вариабельную область тяжелой цепи (VH), включающую последовательность CDR1 по SEQ ID NO: 16 или ее функциональный вариант и/или последовательность CDR2 по SEQ ID NO: 17 или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит вариабельную область легкой цепи (VL), включающую последовательность CDR3: Arg Xaa1 Xaa2 Xaa3 Pro, где Xaa1 означает любую аминокислоту, предпочтительно Ser или Asn, наиболее предпочтительно Ser, Xaa2 означает любую аминокислоту, предпочтительно Tyr, Ser, Ile, Asn или Thr, более предпочтительно Tyr, Ser или Asn, наиболее предпочтительно Asn, и Xaa3 означает любую аминокислоту, предпочтительно Ser или Tyr, более предпочтительно Tyr. В одном воплощении связывающий домен для CLDN6 содержит вариабельную область легкой цепи (VL), включающую последовательность CDR3: Gln Arg Xaa1 Xaa2 Xaa3 Pro Pro, где Xaa1, Xaa2 и Xaa3 уже определены выше. В одном воплощении связывающий домен для CLDN6 содержит вариабельную область легкой цепи (VL), включающую последовательность CDR3: Gln Gln Arg Xaa1 Xaa2 Xaa3 Pro Pro Trp Thr, где Xaa1, Xaa2 и Xaa3 уже определены выше. В одном воплощении связывающий домен для CLDN6 согласно вышеприведенным воплощениям содержит вариабельную область легкой цепи (VL), включающую последовательность CDR1 по SEQ ID NO: 21 или ее функциональный вариант и/или последовательность CDR2 по SEQ ID NO: 22 или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 содержит:
(i) вариабельную область тяжелой цепи (VH), включающую последовательность CDR3, выбранную из группы, состоящей из Xaa1 Gly Xaa2 Val Xaa3, Asp Xaa1 Gly Xaa2 Val Xaa3, Xaa1 Gly Xaa2 Val Xaa3 Asp, Asp Xaa1 Gly Xaa2 Val Xaa3 Asp и Ala Arg Asp Xaa1 Gly Xaa2 Val Xaa3 Asp Tyr, где Xaa1 означает любую аминокислоту, предпочтительно ароматическую аминокислоту, более предпочтительно Phe или Tyr, наиболее предпочтительно Tyr, Xaa2 означает любую аминокислоту, предпочтительно ароматическую аминокислоту, более предпочтительно Phe или Tyr, наиболее предпочтительно Tyr, и Xaa3 означает любую аминокислоту, предпочтительно Leu или Phe, более предпочтительно Leu, и
(ii) вариабельную область легкой цепи (VL), включающую последовательность CDR3, выбранную из группы, состоящей из Arg Xaa1 Xaa2 Xaa3 Pro, Gln Arg Xaa1 Xaa2 Xaa3 Pro Pro и Gln Gln Arg Xaa1 Xaa2 Xaa3 Pro Pro Trp Thr, где Xaa1 означает любую аминокислоту, предпочтительно Ser или Asn, наиболее предпочтительно Ser, Xaa2 означает любую аминокислоту, предпочтительно Tyr, Ser, Ile, Asn или Thr, более предпочтительно Tyr, Ser или Asn, наиболее предпочтительно Asn, и Xaa3 означает любую аминокислоту, предпочтительно Ser или Tyr, более предпочтительно Tyr.
В одном воплощении связывающий домен для CLDN6 согласно вышеприведенным воплощениям содержит (i) вариабельную область тяжелой цепи (VH), включающую последовательность CDR1 по SEQ ID NO: 16 или ее функциональный вариант и/или последовательность CDR2 по SEQ ID NO: 17 или ее функциональный вариант и/или (ii) вариабельную область легкой цепи (VL), включающую последовательность CDR1 по SEQ ID NO: 21 или ее функциональный вариант и/или последовательность CDR2 по SEQ ID NO: 22 или ее функциональный вариант.
В одном воплощении связывающий домен для CLDN6 конкурирует за связывание CLDN6 с описанным выше связывающим доменом для CLDN6 и/или обладает специфичностью к CLDN6 из описанного выше связывающего домена для CLDN6. В этих и других воплощениях связывающий домен для CLDN6 может быть высоко гомологичным описанному выше связывающему домену для CLDN6. Предусматривается, что предпочтительно связывающий домен для CLDN6 содержит участки CDR, идентичные или высоко гомологичные участкам CDR описанного выше связывающего домена для CLDN6. Под "высоко гомологичными" подразумевается то, что в каждом участке CDR может быть сделано от 1 до 5, предпочтительно от 1 до 4, как-то от 1 до 3 либо 1 или 2 замены.
Термин "конкурировать" относится к конкуренции между двумя связывающими молекулами за связывание с целевым антигеном. Если две связывающие молекулы не блокируют друг друга при связывании с целевым антигеном, то такие связывающие молекулы не являются конкурирующими, а это значит, что данные связывающие молекулы не связываются с одной и той же частью, т.е. эпитопом целевого антигена. Специалистам в данной области хорошо известно, как проверяется конкуренция связывающих молекул типа антител за связывание с целевым антигеном. Примером такого метода является так называемый метод перекрестной конкуренции, который, напр., может проводиться в виде ELISA или при помощи проточной цитометрии. Например, анализ на основе ELISA может проводиться путем покрытия лунок планшета для ELISA одним из антител; добавления конкурирующего антитела и помеченного His антигена/мишени и определения того, ингибирует ли добавленное антитело связывание меченного His антигена с фиксированным антителом, напр., добавлением биотинилированного антитела против His, а затем стрептавидина-поли-HRP, а далее проявлением реакции с помощью ABTS и измерением оптической плотности при 405 нм. Например, анализ методом проточной цитометрии может проводиться путем инкубации клеток, экспрессирующих антиген/мишень, с избытком немеченого антитела, инкубации клеток при субоптимальной концентрации меченного биотином антитела, а затем инкубации с флуоресцентно меченным стрептавидином и анализа методом проточной цитометрии.
Две связывающие молекулы обладают "одинаковой специфичностью", если они связываются с одним и тем же антигеном и с одним и тем же эпитопом. Будет ли тестируемая молекула распознавать тот же самый эпитоп, что и определенная связывающая молекула, т.е. что эти связывающие молекулы связываются с одним и тем же эпитопом, можно проверить различными методами, известными специалистам, напр., по конкуренции связывающих молекул типа антител за один и тот же эпитоп. Конкуренция между связывающими молекулами может выявляться по методу перекрестного блокирования. К примеру, в качестве метода перекрестного блокирования можно использовать конкурентный метод ELISA. Например, можно фиксировать целевой антиген на лунках микропланшета и добавить связывающее этот антиген антитело и предполагаемое конкурирующее исследуемое антитело. Количество связывающего антиген антитела, связавшегося с антигеном в лунке, косвенно коррелирует со связывающей способностью предполагаемого конкурирующего исследуемого антитела, которое конкурирует с ним за связывание с одним и тем же эпитопом. В частности, чем больше сродство у предполагаемого конкурирующего исследуемого антитела к тому же эпитопу, тем меньше количество связывающего антиген антитела, связавшегося с лункой, покрытой антигеном. Количество связавшегося с лункой связывающего антиген антитела можно измерить, пометив антитело детектируемым или измеряемым несущим метку веществом.
Предпочтительно антигенсвязывающая часть CAR по изобретению представляет собой scFV против CLDN6, причем scFV против CLDN6 предпочтительно включает последовательность, приведенную в SEQ ID NO: 35, или ее функциональный вариант.
Трансмембранный домен
CAR по изобретению составлен так, чтобы он содержал трансмембранный домен, слитый со внеклеточным доменом CAR. В одном воплощении трансмембранный домен не связан естественным образом ни с одним из доменов в CAR. В одном воплощении трансмембранный домен связан естественным образом с одним из доменов CAR. В одном воплощении трансмембранный домен модифицирован путем аминокислотной замены, чтобы избежать связывания такого домена с трансмембранными доменами таких же или других поверхностных мембранных белков, минимизируя взаимодействия с другими членами рецепторного комплекса. Трансмембранный домен может происходить из природного либо из синтетического источника. Если источник природный, то домен может происходить из любого мембраносвязанного или трансмембранного белка. Трансмембранные области, которые предпочтительны в данном изобретении, могут происходить из (т.е. содержать по крайней мере трансмембранную область) альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. С другой стороны, трансмембранный домен может быть синтетическим, тогда он должен содержать преимущественно гидрофобные остатки типа лейцина и валина. Предпочтительно на каждом конце синтетического трансмембранного домена должен находиться триплет фенилаланина, триптофана и валина.
Предпочтительным трансмембранным доменом в CAR по изобретению является трансмембранный домен CD8α. В одном воплощении этот трансмембранный домен CD8α включает аминокислотную последовательность по SEQ ID NO: 28 или ее функциональный вариант.
В некоторых случаях CAR по изобретению содержит шарнирный домен CD8α, который образует связь между трансмембранным доменом и внеклеточным доменом. В одном воплощении шарнирный домен CD8α включает аминокислотную последовательность по SEQ ID NO: 27 или ее функциональный вариант.
Цитоплазматический домен
Цитоплазматический домен или же внутриклеточный сигнальный домен CAR по изобретению отвечает за активацию по крайней мере одной из нормальных эффекторных функций тех иммунных клеток, в которые был введен CAR. Термин "эффекторная функция" означает специализированную функцию клетки. Эффекторной функцией T-клетки, к примеру, может быть цитолитическая активность или хелперная активность, в том числе секреция цитокинов. Таким образом, термин "внутриклеточный сигнальный домен" обозначает ту часть белка, которая передает сигнал эффекторной функции и направляет клетку на выполнение специализированной функции. Хотя обычно используется весь внутриклеточный сигнальный домен, однако во многих случаях нет необходимости использовать всю эту цепь. При использовании усеченной части внутриклеточного сигнального домена такая усеченная часть может использоваться вместо интактной цепи, только если она передает сигнал эффекторной функции. Таким образом, термин внутриклеточный сигнальный домен включает и любые укороченные части внутриклеточного сигнального домена, достаточные для передачи сигнала эффекторной функции.
Известно, что сигналы, генерируемые только через TCR, недостаточны для полной активации T-клеток, поэтому также требуется вторичный или костимулирующий сигнал. Таким образом, можно сказать, что активация T-клеток опосредуется двумя различными классами цитоплазматических сигнальных последовательностей: теми, что инициируют антигензависимую первичную активацию через TCR (первичные цитоплазматические сигнальные последовательности), и теми, что действуют независимым от антигена образом, вырабатывая вторичные или костимулирующие сигналы (вторичные цитоплазматические сигнальные последовательности).
CAR по изобретению содержат первичную цитоплазматическую сигнальную последовательность, происходящую из CD3-дзета. Кроме того, цитоплазматический домен CAR по изобретению разработан так, чтобы он содержал сигнальный домен CD3-дзета в сочетании с костимулирующей сигнальной областью, происходящей из 4-1BB.
Термин "4-1BB" относится к мембранному рецепторному белку, также именуемому CD137, который является представителем суперсемейства рецепторов фактора некроза опухолей (TNFR) и экспрессируется на поверхности активированных T-клеток в качестве типа вспомогательной молекулы. 4-1BB имеет молекулярную массу 55 кДа и находится в виде гомодимера.
Белок дзета-цепи поверхностного гликопротеина CD3 T-клеток, также известной как дзета-цепь T-клеточного рецептора T3 или CD247, кодируется геном CD247 у человека. Дзета-цепь (ζ) T-клеточного рецептора, вместе с гетеродимерами альфа/бета и гамма/дельта T-клеточного рецептора и CD3-гамма, -дельта и -эпсилон образуют комплекс T-клеточного рецептора с CD3. Дзета-цепь играет важную роль в сопряжении распознавания антигена с несколькими внутриклеточными путями передачи сигналов. Низкая экспрессия антигена приводит к нарушению иммунного ответа.
Цитоплазматические сигнальные последовательности в цитоплазматической сигнальной части CAR по изобретению могут соединяться друг с другом в случайном или заданном порядке. Необязательно их соединение может образовывать короткий олиго- или полипептидный линкер, предпочтительно длиной от 2 до 10 аминокислот. Особенно подходящим линкером является дублет глицин-серин.
Итак, цитоплазматический домен в CAR по изобретению составлен так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен 4-1BB. В одном воплощении цитоплазматический домен в CAR по изобретению содержит сигнальный домен 4-1BB и сигнальный домен CD3-дзета, причем сигнальный домен 4-1BB включает аминокислотную последовательность по SEQ ID NO: 30 или ее функциональный вариант, а сигнальный домен CD3-дзета включает аминокислотную последовательность по SEQ ID NO: 31 или ее функциональный вариант.
В одном воплощении CAR по изобретению включает сигнальный пептид, который направляет растущий белок в эндоплазматический ретикулум. В одном воплощении сигнальный пептид предшествует антигенсвязывающему домену. В одном воплощении сигнальный пептид происходит из иммуноглобулина типа IgG. В одном воплощении сигнальный пептид включает последовательность по SEQ ID NO: 25 или ее функциональный вариант.
В одном воплощении CAR по изобретению содержит следующие элементы в следующем порядке: NH2 - антигенсвязывающий домен для CLDN6 - трансмембранный домен - костимулирующий домен 4-1BB - сигнальный домен CD3-дзета - COOH.
В одном воплощении CAR по изобретению содержит следующие элементы в следующем порядке: NH2 - антигенсвязывающий домен для CLDN6 - шарнир CD8α - трансмембранный домен CD8α - костимулирующий домен 4-1BB - сигнальный домен CD3-дзета - COOH.
В одном воплощении CAR по изобретению включает аминокислотную последовательность по SEQ ID NO: 36 или ее функциональный вариант.
Векторы
Настоящим изобретением предусмотрены конструкции из нуклеиновой кислоты типа конструкций из ДНК, содержащих последовательности, кодирующие CAR по изобретению.
Настоящим изобретением также предусмотрены векторы, в которые вставлена ДНК по настоящему изобретению. Подходящими инструментами для долгосрочного переноса генов являются векторы, происходящие из ретровирусов типа лентивирусов, так как они позволяют долгосрочное стабильное встраивание трансгена и его размножение в дочерних клетках. Лентивирусные векторы обладают дополнительным преимуществом перед векторами, происходящими из онко-ретровирусов типа вируса лейкемии мышей в том, что они могут трансдуцировать непролиферирующие клетки типа гепатоцитов. Они также обладают дополнительным преимуществом в виде низкой иммуногенности.
Вкратце, экспрессия природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно осуществляется путем функционального соединения нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором и включения этой конструкции в экспрессирующий вектор. Векторы могут подходить для репликации и интеграции в эукариотах. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, инициирующие последовательности и промоторы, применимые для регуляции экспрессии требуемой последовательности нуклеиновой кислоты.
Нуклеиновую кислоту по изобретению можно клонировать в различные типы векторов. Например, нуклеиновую кислоту можно клонировать в векторы, включая, без ограничения, плазмиды, фагмиды, производные фагов, вирусы животных и космиды или транспозоны. Векторы, представляющие особый интерес, включают экспрессионные векторы, репликационные векторы, векторы для получения зондов и секвенирующие векторы. Кроме того, экспрессионные векторы можно вводить в клетки в виде вирусных векторов. Технология вирусных векторов хорошо известна в данной области и описана, к примеру, в Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York), а также в других руководствах по вирусологии и молекулярной биологии. Вирусы, применимые в качестве векторов, включают, без ограничения, ретровирусы, аденовирусы, аденоассоциированные вирусы, герпесвирусы и лентивирусы. В общем, подходящий вектор содержит начало репликации, функционирующее по меньшей мере в одном организме, последовательность промотора, удобные сайты для рестрикционных эндонуклеаз и один или несколько отборочных маркеров (напр., WO 01/96584; WO 01/29058 и U.S. Pat. No. 6,326,193).
Для переноса генов в клетки млекопитающих был разработан целый ряд вирусных систем. Например, удобной платформой для систем доставки генов служат ретровирусы. Выбранный ген можно вставить в вектор и упаковать в ретровирусные частицы известными в данной области методами. Затем можно выделить рекомбинантный вирус и доставить в клетки субъекта in vivo либо ex vivo. В данной области известен целый ряд ретровирусных систем. В некоторых воплощениях применяются аденовирусные векторы. В данной области известен целый ряд аденовирусных векторов. В одном воплощении применяются лентивирусные векторы.
Другие промоторные элементы, напр., энхансеры, регулируют частоту инициации транскрипции. Обычно они располагаются в районе на 30-110 п.н. выше стартового сайта, хотя недавно было показано, что целый ряд промоторов также содержат функциональные элементы ниже стартового сайта. Интервалы между промоторными элементами зачастую бывают гибкими, так что функция промотора сохраняется при инвертировании или перемещении элементов относительно друг друга. У промотора тимидинкиназы (tk) расстояние между элементами промотора можно увеличить до 50 п.н., прежде чем активность начнет снижаться. В зависимости от промотора оказывается, что для активации транскрипции отдельные элементы могут функционировать как совместно, так и независимо. Одним из примеров подходящего промотора является последовательность немедленно раннего промотора цитомегаловируса (CMV). Эта последовательность промотора представляет собой последовательность сильного конститутивного промотора, способного запускать высокий уровень экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Другим примером подходящего промотора является промотор фактора элонгации 1α (EF-1α). Однако можно использовать и другие последовательности конститутивных промоторов, включая, без ограничения, ранний промотор обезьяньего вируса 40 (SV40), вируса опухолей молочной железы мыши (MMTV), промотор длинных концевых повторов (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкемии птиц, самый ранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, как-то, без ограничения, промотор актина, промотор миозина, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не должно ограничиваться применением конститутивных промоторов, в рамках изобретения также предусмотрены индуцибельные промоторы. Применение индуцибельных промоторов обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или выключать экспрессию, когда экспрессия нежелательна. Примеры индуцибельных промоторов включают, без ограничения, промотор металлотионеина, промотор глюкокортикоидов, промотор прогестерона и промотор тетрациклина.
Для оценки экспрессии полипептида CAR или его частей, вводимый в клетки экспрессирующий вектор также может содержать ген отборочного маркера либо репортерный ген, либо то и другое, чтобы облегчить идентификацию и отбор экспрессирующих клеток из популяции клеток, подлежащих трансфекции или инфицированию вирусными векторами. В других аспектах отборочный маркер может находиться на отдельной части ДНК и использоваться в процедуре котрансфекции. И отборочные маркеры, и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках хозяина. Подходящие отборочные маркеры включают, к примеру, гены устойчивости к антибиотикам типа neo и др.
Репортерные гены применяются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. В общем, репортерным геном является ген, который не присутствует в организме или ткани реципиента или не экспрессируется в них и кодирует полипептид, экспрессия которого проявляется неким легко детектируемым свойством, напр., ферментативной активностью. Экспрессию репортерного гена анализируют в подходящее время после введения ДНК в клетки-реципиенты. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, β-галактозидазу, хлорамфеникол-ацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка. Подходящие системы экспрессии хорошо известны и могут быть получены по известным методикам или приобретены коммерчески.
Методы введения и экспрессирования генов в клетках известны в данной области. В контексте экспрессирующих векторов такой вектор можно легко ввести в клетки хозяина, напр., в клетки млекопитающих, бактерий, дрожжей или насекомых, любым известным в данной области способом. Например, экспрессирующий вектор можно перенести в клетки хозяина физическим, химическим или биологическим способом.
Физические методы введения полинуклеотидов в клетки хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекции, электропорацию и др. Предпочтительным методом введения полинуклеотидов в клетки хозяина является трансфекция фосфатом кальция.
Биологические методы введения представляющих интерес полинуклеотидов в клетки хозяина включают применение ДНК- и РНК-векторов. Вирусные векторы, особенно ретровирусные векторы, стали наиболее распространенным методом встраивания генов в клетки млекопитающих, напр., в клетки человека. Другие вирусные векторы могут происходить из лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и др.
Химические средства для введения полинуклеотидов в клетки хозяина включают коллоидные дисперсионные системы, как-то комплексы с макромолекулами, нанокапсулы, микросферы, гранулы и липидные системы, включая эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для применения в качестве средства доставки in vitro и in vivo являются липосомы (напр., искусственные мембранные везикулы).
Клетки
Клетки, используемые в связи с системой CAR по настоящему изобретению и в которые можно вводить нуклеиновые кислоты (ДНК или РНК), кодирующие систему CAR по настоящему изобретению, включают любые клетки с литическим потенциалом, в частности лимфоидные клетки, а предпочтительно это T-клетки, в частности цитотоксические лимфоциты, предпочтительно выбранные из цитотоксических T-клеток, клеток натуральных киллеров (NK) и активируемых лимфокинами киллеров (LAK). При активации каждый из этих цитотоксических лимфоцитов запускает разрушение клеток мишени. Например, цитотоксические T-клетки запускают разрушение клеток мишени одним или обоими из следующих способов. Во-первых, при активации T-клетки выделяют такие цитотоксины, как перфорин, гранзимы и гранулизин. Перфорин и гранулизин образуют поры в клетках мишени, а гранзимы проникают в клетки и запускают каспазный каскад в цитоплазме, который индуцирует апоптоз (запрограммированную смерть) клеток. Во-вторых, может индуцироваться апоптоз при взаимодействии Fas с лигандом Fas между T-клетками и клетками мишени. Цитотоксические лимфоциты предпочтительно должны быть аутологичными, хотя можно использовать и гетерологичные клетки или аллогенные клетки.
Термины "T-клетки" и "T-лимфоциты" применяются здесь взаимозаменяемо и охватывают Т-клетки-хелперы (T-клетки CD4+) и цитотоксические T-клетки (CTL, T-клетки CD8+), которые включают цитолитические T-клетки. Термин "антиген-специфичные T-клетки" или аналогичные термины относятся к T-клеткам, распознающим тот антиген, на который нацелены T-клетки, и предпочтительно выполняющим эффекторные функции T-клеток. T-клетки считаются специфичными к антигену, если они уничтожают клетки мишени, экспрессирующие антиген. Специфичность T-клеток можно определить любым из многих стандартных методов, к примеру, методом анализа высвобождения хрома или анализа пролиферации. В качестве альтернативы можно измерять синтез лимфокинов (типа γ-интерферона).
В настоящем изобретении термин "NK-клетки" или "клетки натуральные киллеры" относится к подгруппе лимфоцитов периферической крови, определяемой экспрессией CD56 или CD16 и отсутствием T-клеточных рецепторов (CD3). Предусматривается, что NK-клетки также могут дифференцироваться из стволовых клеток или клеток-предшественников.
Термин "эффекторные функции" в контексте настоящего изобретения охватывает любые функции, опосредованные компонентами иммунной системы, которые приводят, например, к уничтожению больных клеток типа опухолевых клеток или к ингибированию роста опухолей и/или подавлению развития опухолей, включая подавление распространения и метастазирования опухолей. Предпочтительно эффекторные функции в контексте настоящего изобретения представляют собой опосредованные T-клетками эффекторные функции. Такие функции в случае хелперных T-клеток (T-клеток CD4+) включают высвобождение цитокинов и/или активацию лимфоцитов CD8+ (CTL) и/или B-клеток, а в случае CTL - устранение клеток, т.е. клеток, характеризующихся экспрессией антигена, например, посредством апоптоза или опосредованного перфорином лизиса клеток, продукции цитокинов типа IFN-γ и TNF-α и специфического цитолитического уничтожения экспрессирующих антиген клеток мишени.
Термин "иммуноэффекторные клетки" или "иммунореактивные клетки" в контексте настоящего изобретения относится к таким клеткам, которые выполняют эффекторные функции во время иммунной реакции. "Иммуноэффекторные клетки" предпочтительно способны связывать антигены типа антигенов, экспрессируемых на поверхности клетки, и опосредовать иммунный ответ. Например, иммуноэффекторные клетки включают T-клетки (цитотоксические T-клетки, хелперные T-клетки, T-клетки, инфильтрирующие опухоли), B-клетки, клетки натуральные киллеры, нейтрофилы, макрофаги и дендритные клетки. Предпочтительно в контексте настоящего изобретения "иммуноэффекторными клетками" являются T-клетки, предпочтительно T-клетки CD4+ и/или CD8+. Согласно изобретению, термин "иммуноэффекторные клетки" также включает клетки, из которых могут созревать иммунные клетки (типа T-клеток, в частности хелперных T-клеток или цитолитических T-клеток) при соответствующей стимуляции. Иммуноэффекторные клетки включают гемопоэтические стволовые клетки CD34+, незрелые и зрелые T-клетки, незрелые и зрелые B-клетки. Дифференцировка предшественников T-клеток в цитолитические T-клетки при воздействии антигена аналогична клональному отбору в иммунной системе.
Предпочтительно "иммуноэффекторные клетки" распознают антигены с некоторой степенью специфичности, в частности, если те находятся на поверхности больных клеток типа раковых клеток. Предпочтительно такое распознавание позволяет клеткам, которые распознают антигены, быть восприимчивыми или реагирующими. Если клетки являются хелперными T-клетками (T-клетками CD4+), то такая восприимчивость или реактивность может включать высвобождение цитокинов и/или активацию лимфоцитов CD8+ (CTL) и/или B-клеток. Если же клетки представляют собой CTL, то такая восприимчивость или реактивность может включать устранение клеток, т.е. клеток, характеризующихся экспрессией антигена, к примеру, посредством апоптоза или опосредованного перфорином лизиса клеток. Согласно изобретению, реактивность CTL может включать устойчивый приток кальция, деление клеток, продукцию таких цитокинов, как IFN-γ и TNF-α, повышение уровня маркеров активации типа CD44 и CD69 и специфическое цитолитическое уничтожение экспрессирующих антиген клеток мишени. Реактивность CTL также можно определить с помощью искусственного репортера, который точно указывает реактивность CTL. Такие CTL, которые распознают антиген и являются восприимчивыми или реактивными, также называются здесь "антиген-реактивными CTL".
"Лимфоидные клетки" представляет собой клетки, которые, необязательно после соответствующей модификации, напр., после переноса CAR, способны вызывать иммунные ответы типа клеточных иммунных ответов, или же предшественники таких клеток, и включают лимфоциты, предпочтительно T-лимфоциты, лимфобласты и плазматические клетки. Лимфоидные клетки могут быть иммуноэффекторными клетками, как описано здесь. Предпочтительными лимфоидными клетками являются такие T-клетки, которые могут быть модифицированы для экспрессии CAR на клеточной поверхности. В одном воплощении лимфоидные клетки лишены эндогенной экспрессии T-клеточных рецепторов.
Термины "T-клетки" и "T-лимфоциты" применяются здесь взаимозаменяемо и охватывают хелперные Т-клетки (T-клетки CD4+) и цитотоксические T-клетки (CTL, T-клетки CD8+), которые включают цитолитические T-клетки.
T-клетки относятся к группе белых кровяных телец, известных как лимфоциты, и играют главную роль в клеточном иммунитете. Они отличаются от других типов лимфоцитов типа B-клеток и клетки натуральных киллеров наличием на их клеточной поверхности специального рецептора, называемого T-клеточным рецептором (TCR). Главным органом, ответственным за созревание T-клеток, является тимус. Было обнаружено несколько различных подгрупп T-клеток, каждая из которых выполняет свою функцию.
T-клетки-хелперы содействуют другим лейкоцитам в иммунологических процессах, включая созревание B-клеток в плазматические клетки и активацию цитотоксических T-клеток и макрофагов, среди прочих функций. Эти клетки также известны как T-клетки CD4+, так как они экспрессируют белок CD4 на своей поверхности. Хелперные T-клетки активируются при презентации пептидных антигенов молекулами MHC класса II, которые экспрессируются на поверхности антигенпрезентирующих клеток (APC). После активации они быстро делятся и выделяют небольшие белки, называемые цитокинами, которые регулируют активные иммунные ответы или способствуют им.
Цитотоксические T-клетки разрушают инфицированные вирусами клетки и опухолевые клетки, а также участвуют в отторжении трансплантатов. Эти клетки также известны как T-клетки CD8+, так как они экспрессируют гликопротеин CD8 на своей поверхности. Эти клетки распознают свои мишени при связывании с антигенами, связанными с MHC класса I, которые находятся на поверхности почти каждой клетки организма.
Большинство T-клеток содержат T-клеточный рецептор (TCR), существующий в виде комплекса из нескольких белков. Фактически T-клеточный рецептор состоит из двух отдельных пептидных цепей, которые образуются из независимых генов альфа и бета T-клеточных рецепторов (TCRα и TCRβ) и называются α- и β-цепями TCR. T-клетки γΔ (T-клетки гамма-дельта) составляют небольшую подгруппу T-клеток, обладающих особым T-клеточным рецептором (TCR) на своей поверхности. Однако в T-клетках γΔ TCR состоит из одной γ-цепи и одной Δ-цепи. Эта группа T-клеток встречается гораздо реже (2% от общего количества T-клеток), чем T-клетки αβ.
Все T-клетки происходят из гемопоэтических стволовых клеток костного мозга. Гемопоэтические предшественники, происходящие из гемопоэтических стволовых клеток, заселяют тимус и размножаются путем деления клеток с образованием большой популяции незрелых тимоцитов. Самые ранние тимоциты не экспрессируют ни CD4, ни CD8, поэтому они классифицируются как дважды отрицательные (CD4−CD8−) клетки. По мере своего развития они становятся дважды положительными тимоцитами (CD4+CD8+) и, наконец, созревают до одно положительных (CD4+CD8− или CD4−CD8+) тимоцитов, которые затем высвобождаются из тимуса в периферические ткани.
T-клетки обычно получают in vitro или ex vivo по стандартным методикам. Например, T-клетки можно выделить из костного мозга, периферической крови или фракции костного мозга или периферической крови млекопитающих типа пациентов с помощью коммерчески доступной системы разделения клеток. С другой стороны, T-клетки могут быть получены от родственных или неродственных людей, других животных, клеточных линий или культур. Образцами, содержащими T-клетки, могут быть, к примеру, мононуклеарные клетки периферической крови (PBMC).
T-клетки для применения согласно изобретению могут экспрессировать эндогенный T-клеточный рецептор или могут быть лишены экспрессии эндогенных T-клеточных рецепторов.
Термин "CAR, нацеленный на антиген" означает такой CAR, который, когда он находится на иммуноэффекторных клетках типа T-клеток, распознает антиген типа на поверхности антигенпрезентирующих клеток или больных клеток типа раковых клеток, при этом иммуноэффекторные клетки стимулируются, примируются и/или экспансируют либо выполняют эффекторные функции иммуноэффекторных клеток, как описано выше.
Источники T-клеток
Перед экспансией и генетической модификацией T-клеток по изобретению получают источник T-клеток от субъекта. T-клетки можно получить из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асциты, плевральные выпоты, ткань селезенки и опухоли. В некоторых воплощениях настоящего изобретения можно использовать любое количество линий T-клеток, доступных в данной области. В некоторых воплощениях настоящего изобретения T-клетки можно получить из порции крови, взятой у субъекта, с помощью целого ряда методов, известных специалистам, типа разделения в Ficoll™. В одном предпочтительном воплощении получают клетки из циркулирующей крови индивида методом афереза. Продукты афереза обычно содержат лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие содержащие ядра лейкоциты, эритроциты и тромбоциты. В одном воплощении клетки, полученные методом афереза, можно промыть для удаления фракции плазмы и поместить клетки в соответствующий буфер или среду для последующих этапов обработки. В одном воплощении изобретения клетки промывают фосфатно-солевым буфером (PBS). В альтернативном воплощении в промывочном растворе отсутствует кальций и может отсутствовать и магний или же могут отсутствовать многие, если не все двухвалентные катионы. Опять же, вне ожидания, начальные стадии активации в отсутствие кальция ведут к усилению активации. Как должно быть хорошо известно рядовым специалистам в данной области, стадия промывки может осуществляться способами, известными специалистам в данной области, как-то с помощью полуавтоматической "проточной" центрифуги (напр., процессора клеток Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) согласно инструкциям производителя. После промывки клетки можно ресуспендировать в различных биосовместимых буферах, таких, к примеру, как PBS без Ca2+, без Mg2+, PlasmaLyte A, или в другом солевом растворе с буфером или без него. С другой стороны, из образца афереза можно удалить нежелательные компоненты, а клетки ресуспендировать прямо в культуральной среде.
В другом воплощении T-клетки выделяют из лимфоцитов периферической крови путем лизиса эритроцитов и истощения моноцитов, например, при центрифугировании в градиенте Percoll™ или при центрифугировании с сепарацией в противотоке. Далее еще можно выделить отдельные субпопуляции T-клеток типа T-клеток CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ методами положительного или отрицательного отбора. Например, в одном воплощении T-клетки выделяют путем инкубации с гранулами, конъюгированными с анти-CD3/анти-CD28 (т.е. 3x28) типа Dynabeads® M-450 CD3/CD28 T, в течение времени, достаточного для положительного отбора требуемых T-клеток. В одном воплощении период времени составляет от 30 минут до 36 часов или больше. Специалистам должно быть понятно, что в контексте данного изобретения также можно использовать и несколько раундов отбора.
Обогащение популяции T-клеток путем отрицательного отбора может осуществляться с помощью комбинации антител против поверхностных маркеров, уникальных для подвергаемых отрицательному отбору клеток. Один из методов заключается в сортировке и/или отборе клеток методом отрицательной магнитной иммуноадгезии или проточной цитометрии, в котором используется коктейль из моноклональных антител против маркеров клеточной поверхности, присутствующих на подвергаемых отрицательному отбору клетках. Например, для обогащения по клеткам CD4+ путем отрицательного отбора коктейль моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых воплощениях может потребоваться обогащение или положительный отбор регуляторных T-клеток, которые обычно экспрессируют CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. С другой стороны, в некоторых воплощениях регуляторные T-клетки истощают при помощи конъюгированных с антителом против CD25 гранул или другим аналогичным методом отбора.
Для введения конструкций CAR в T-клетки можно использовать различные методы, включая трансфекцию ДНК на безвирусной основе, системы на основе транспозонов, вирусные системы и системы на основе РНК. Трансфекция ДНК на безвирусной основе имеет низкий риск инсерционного мутагенеза. Системы на основе транспозонов могут встраивать трансгены более эффективно, чем плазмиды, не содержащие интеграционных элементов. Вирусные системы включают γ-ретровирусные векторы и лентивирусные векторы. γ-Ретровирусы сравнительно легко получаются, они эффективно и на постоянной основе трансдуцируют T-клетки и предварительно оказались безопасными с точки зрения встраивания в первичные T-клетки человека. Лентивирусные векторы также эффективно и на постоянной основе трансдуцируют T-клетки, но их получение обходится дороже. Они также потенциально более безопасны, чем системы на основе ретровирусов.
В одном воплощении изобретения T-клетки или предшественники T-клеток трансфецируют ex vivo либо in vivo нуклеиновой кислотой, кодирующей CAR, чтобы получить T-клетки, генетически модифицированные для экспрессии CAR.
T-клетки CAR можно получить in vivo, причем почти мгновенно, с помощью наночастиц, нацеленных на T-клетки. Например, можно конъюгировать наночастицы на основе поли(β-аминоэфира) с F(ab)-фрагментами антител против CD3e для связывания с CD3 на T-клетках. При связывании с T-клетками эти наночастицы подвергаются эндоцитозу. Их содержимое, к примеру, плазмидную ДНК, кодирующую противоопухолевый антиген CAR, можно направить в ядро T-клетки путем включения пептидов, содержащих связанные с микротрубочками последовательности (MTAS) и сигналы ядерной локализации (NLS). Включение транспозонов с инвертированными повторами (IR), фланкирующих кассету, экспрессирующую ген CAR, и отдельной плазмиды, кодирующей гиперактивную транспозазу, может обеспечить эффективное встраивание вектора CAR в хромосомы. Такая система, позволяющая получать T-клетки с CAR in vivo после инфузии наночастиц, описана в Smith et al. (2017) Nat. Nanotechnol. 12:813-820.
Другая возможность - использовать метод CRISPR/Cas9 для преднамеренного введения кодирующей CAR последовательности в определенный локус. Например, можно подвергнуть нокауту существующие T-клеточные рецепторы (TCR) и в то же время вставить CAR и поместить его под динамический регуляторный контроль эндогенного промотора, который при этом мог бы сдерживать экспрессию TCR; напр., см. Eyquem et al. (2017) Nature 543:113-117.
В одном воплощении всех аспектов изобретения T-клетки, генетически модифицированные для экспрессии CAR, стабильно или временно трансфецируют нуклеиновой кислотой, кодирующей CAR. При этом нуклеиновая кислота, кодирующая CAR, встраивается или не встраивается в геном T-клеток.
В одном воплощении всех аспектов изобретения T-клетки или предшественники T-клеток получены от субъекта, подлежащего лечению. В одном воплощении всех аспектов изобретения T-клетки или предшественники T-клеток получены от субъекта, который отличается от подлежащего лечению субъекта.
В одном воплощении всех аспектов изобретения T-клетки могут быть аутологичными, аллогенными или сингенными по отношению к субъекту, подлежащему лечению. T-клетки могут быть генетически модифицированными in vitro для экспрессии химерного антигенового рецептора (CAR).
В одном воплощении всех аспектов изобретения T-клетки, генетически модифицированные для экспрессии CAR, инактивированы по экспрессии эндогенного T-клеточного рецептора и/или эндогенного HLA.
Активация и экспансия T-клеток
И до и после генетической модификации T-клеток для экспрессии требуемого CAR, T-клетки можно активировать и размножить, как правило, методами, известными в данной области.
Обычно T-клетки по изобретению размножают путем контакта с поверхностью, к которой прикреплен реагент, стимулирующий сигнал, связанный с комплексом CD3/TCR, и лиганд, стимулирующий костимулирующую молекулу на поверхности T-клеток. В частности, можно стимулировать популяции T-клеток, как описано здесь, как-то при контакте с антителом против CD3 или его антигенсвязывающим фрагментом, либо с антителом против CD2, иммобилизованным на поверхности, или же при контакте с активатором протеинкиназы C (напр., бриостатином) в сочетании с кальциевым ионофором. Для костимуляции вспомогательных молекул на поверхности T-клеток используются лиганды, связывающиеся с вспомогательными молекулами. Например, популяцию T-клеток можно проконтактировать с антителом против CD3 и антителом против CD28 в условиях, подходящих для стимуляции пролиферации T-клеток.
В некоторых воплощениях первичный стимулирующий сигнал и костимулирующий сигнал для T-клеток могут обеспечиваться по разным методикам. Например, агенты, обеспечивающие каждый сигнал, могут находиться в растворе или конъюгированы с поверхностью. При конъюгировании с поверхностью агенты могут быть конъюгированы с одной и той же поверхностью (т.е. в "цис"-формации) или с отдельными поверхностями (т.е. в "транс"-формации). С другой стороны, один агент может быть конъюгирован с поверхностью, а другой агент - в растворе. В одном воплощении агент, обеспечивающий костимулирующий сигнал, связан с поверхностью клетки, а агент, обеспечивающий первичный сигнал активации, находится в растворе или конъюгирован с поверхностью. В некоторых воплощениях оба агента могут находиться в растворе.
В одном воплощении оба агента иммобилизованы на гранулах, либо на одних и тех же гранулах, т.е. "in cis", либо на отдельных гранулах, то есть "in trans". В качестве примера агент, обеспечивающий первичный сигнал активации, представляет собой антитело против CD3 или его антигенсвязывающий фрагмент, а агент, обеспечивающий костимулирующий сигнал, представляет собой антитело против CD28 или его антигенсвязывающий фрагмент; и оба агента иммобилизованы на одних и тех же гранулах. В одном воплощении соотношение антител к CD3:CD28, связанных с гранулами, составляет от 100:1 до 1:100.
Для стимуляции T-клеток или других целевых клеток можно использовать соотношения частиц к клеткам от 1:500 до 500:1. Как должно быть хорошо известно рядовым специалистам в данной области, соотношение частиц к клеткам может зависеть от размера частиц относительно целевых клеток. Например, гранулы небольшого размера могут связывать лишь несколько клеток, а гранулы большего размера могут связывать много. В некоторых воплощениях соотношение клеток к частицам составляет от 1:100 до 100:1, а в других воплощениях это соотношение составляет от 1:9 до 9:1.
Условия, подходящие для культивирования T-клеток, включают подходящую среду (напр., Minimal Essential Media или среду RPMI 1640 или X-vivo 15 (Lonza), которая может содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (напр., фетальную телячью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалистам. Другие добавки для роста клеток включают, без ограничения, поверхностно-активные вещества, плазманаты и восстановительные реагенты типа N-ацетилцистеина и 2-меркаптоэтанола. Целевые клетки содержатся в условиях, необходимых для поддержания роста, например, при соответствующей температуре (напр., 37°C) и атмосфере (напр., воздух плюс 5% CO2).
Терапевтическое применение
Настоящим изобретением предусмотрены клетки (напр., T-клетки), содержащие молекулы CAR по изобретению, напр., трансдуцированные ретровирусом типа лентивирусного вектора (LV), кодирующего CAR по изобретению. Следовательно, в некоторых случаях трансдуцированные T-клетки могут вызывать опосредованный CAR T-клеточный ответ.
Изобретением предусмотрено применение CAR для перенастройки специфичности первичных T-клеток на опухолевый антиген CLDN6. Так, настоящим изобретением также предусмотрен способ стимуляции опосредованного T-клетками иммунного ответа на популяцию целевых клеток или ткань у млекопитающих, включающий стадию введения им T-клеток, экспрессирующих CAR по изобретению, причем этот CAR содержит связывающий фрагмент, специфически взаимодействующий с CLDN6 в качестве предопределенной мишени.
В одном воплощении настоящего изобретения предусмотрен тип клеточной терапии, при которой T-клетки подвергаются генетической модификации для экспрессии CAR по изобретению, а T-клетки с CAR вводятся нуждающимся в этом реципиентам. Введенные клетки способны уничтожать опухолевые клетки у реципиента. В отличие от терапии антителами, T-клетки CAR способны реплицироваться in vivo, что приводит к длительной персистенции, которая может привести к устойчивому контролированию опухолей.
В одном воплощении T-клетки CAR по изобретению могут подвергаться сильной экспансии T-клеток in vivo и персистировать в течение длительного времени. В другом воплощении T-клетки CAR по изобретению превращаются в специфичные T-клетки памяти, которые могут реактивироваться для подавления любого дополнительного образования или роста опухолей.
Раковые заболевания, которые подлежат лечению, включают опухоли, которые не васкуляризованы или практическм еще не васкуляризованы, а также васкуляризованные опухоли. Раковые заболевания могут включать солидные опухоли. Типы рака, которые подлежат лечению с помощью CAR по изобретению, включают, без ограничения, карциномы, бластомы и саркомы, а также некоторые лейкемии или лимфоидные новообразования, доброкачественные и злокачественные опухоли и новообразования, напр., саркомы, карциномы и меланомы. В том числе и взрослые опухоли/раковые заболевания и детские опухоли/раковые заболевания.
Солидные опухоли - это аномальные массы ткани, которые обычно не содержат кист или жидких участков. Солидные опухоли могут быть доброкачественными и злокачественными. Различные типы солидных опухолей именуются по типу клеток, которые их образуют (как-то саркомы, карциномы и лимфомы). Примеры солидных опухолей типа саркомы и карциномы включают фибросаркому, миксосаркому, липосаркому, хондросаркому, остеосаркому и другие саркомы, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, лимфоидные новообразования, рак поджелудочной железы, рак молочной железы, рак легких, рак яичников, рак простаты, гепатоцеллюлярную карциному, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, феохромоцитому, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, рак яичек, семиному, карциному мочевого пузыря, меланому и опухоли ЦНС типа глиомы (типа глиомы ствола мозга и смешанной глиомы), глиобластомы (также известной как мультиформная глиобластома), астроцитомы, лимфомы ЦНС, герминомы, медуллобластомы, шванномы, краниофарингиомы, эпендимомы, пинеаломы, гемангиобластомы, акустической невромы, олигодендроглиомы, менангиомы, нейробластомы, ретинобластомы и метастазов головного мозга).
В одном воплощении раковые заболевания, которые подлежат лечению, представляют собой раковые заболевания, экспрессирующие CLDN6, типа описанных здесь.
В одном воплощении изобретения выделяют клетки из млекопитающих (предпочтительно человека) и подвергают их генетической модификации (т.е. трансдуцируют или трансфецируют in vitro) описанным здесь вектором, экспрессирующим CAR. Модифицированные CAR клетки можно вводить млекопитающим-реципиентам для получения терапевтического эффекта. Млекопитающим-реципиентом может быть человек, а модифицированные CAR клетки могут быть аутологичными по отношению к реципиенту. С другой стороны, клетки могут быть аллогенными, сингенными или ксеногенными по отношению к реципиенту.
Модифицированные клетки с CAR по настоящему изобретению можно вводить либо отдельно, либо в комбинации с другими компонентами типа IL-2 или других цитокинов или популяций клеток. В одном воплощении модифицированные CAR клетки по настоящему изобретению вводятся в комбинации с молекулой родственного антигена или с нуклеиновой кислотой, в частности РНК, кодирующей молекулы родственного антигена. Молекулами родственного антигена могут быть CLDN6, рекомбинантный CLDN6, фрагменты CLDN6 или варианты любых из вышеприведенных. В одном воплощении вводится нуклеиновая кислота, в частности РНК, кодирующая молекулу родственного антигена (напр., CLDN6, рекомбинантного CLDN6, фрагмента CLDN6 или варианта любого из вышеприведенных). Предпочтительно нуклеиновая кислота, кодирующая молекулы родственного антигена, экспрессируется в клетках субъекта, которому вводятся модифицированные CAR клетки по настоящему изобретению и нуклеиновая кислота, кодирующая молекулы родственного антигена, обеспечивая молекулы родственного антигена для связывания с антигенсвязывающим доменом для CAR. В одном воплощении экспрессия молекул родственного антигена из антигенсвязывающего домена для CAR происходит на поверхности клетки. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, кратковременно экспрессируется в клетках субъекта. В одном воплощении нуклеиновая кислота, кодирующая молекулы родственного антигена, представляет собой РНК. Предпочтительно контактирование модифицированных CAR клеток по настоящему изобретению с молекулами родственного антигена приводит к экспансии и/ или активации клеток.
Пептидные и белковые антигены, пригодные для применения по изобретению, обычно включают пептиды или белки, содержащие эпитоп, с которым связывается антигенсвязывающий домен для CLDN6 у CAR по изобретению. Пептид или белок или эпитоп может происходить из CLDN6. Например, пептидный или белковый антиген или эпитоп, содержащийся в пептидном или белковом антигене, может представлять собой CLDN6 либо фрагмент или вариант CLDN6.
Пептидный или белковый антиген, предоставляемый субъекту по изобретению (путем введения пептидного или белкового антигена либо нуклеиновой кислоты, в частности РНК, кодирующей пептидный или белковый антиген), то есть вакцинный антиген, предпочтительно приводит к стимуляции, примированию и/или экспансии модифицированных CAR клеток у субъекта, которому вводятся модифицированные CAR клетки и антиген или нуклеиновая кислота. Такие стимулированные, примированные и/или экспансия модифицированные CAR клетки предпочтительно направлены против целевого антигена CLDN6, в частности целевого антигена, экспрессируемого больными клетками, тканями и/или органами, то есть связанного с заболеванием антигена. Таким образом, вакцинный антиген может включать связанный с заболеванием антиген либо его фрагмент или вариант. В одном воплощении такой фрагмент или вариант иммунологически эквивалентен связанному с заболеванием антигену. В контексте настоящего изобретения термин "фрагмент антигена" или "вариант антигена" означает такой агент, который приводит к стимуляции, примированию и/или экспансии модифицированных CAR клеток, причем стимулированные, примированные и/или размножаемые модифицированные CAR клетки нацелены на связанный с заболеванием антиген, в частности, когда он экспрессируется на поверхности больных клеток, тканей и/или органов. Таким образом, вакцинный антиген, вводимый по изобретению, может соответствовать или включать связанный с заболеванием антиген, может соответствовать или включать фрагмент связанного с заболеванием антигена либо может соответствовать или включать антиген, который гомологичен связанному с заболеванием антигену или его фрагменту. Если вакцинный антиген, вводимый по изобретению, включает фрагмент связанного с заболеванием антигена или аминокислотную последовательность, которая гомологична фрагменту связанного с заболеванием антигена, то такой фрагмент или аминокислотная последовательность может содержать эпитоп связанного с заболеванием антигена или последовательность, которая гомологична эпитопу связанного с заболеванием антигена, причем модифицированные CAR клетки связываются с данным эпитопом. Таким образом, согласно изобретению, антиген может включать иммуногенный фрагмент связанного с заболеванием антигена или аминокислотную последовательность, гомологичную иммуногенному фрагменту связанного с заболеванием антигена. "Иммуногенный фрагмент антигена" по изобретению предпочтительно означает такой фрагмент антигена, который способен стимулировать, примировать и/или размножить модифицированные CAR клетки. Предпочтительно вакцинный антиген (аналогично связанному с заболеванием антигену) обеспечивает соответствующий эпитоп для связывания с антигенсвязывающим доменом для CLDN6, присутствующим в CAR у модифицированных CAR клеток. Также предпочтительно вакцинный антиген (аналогично связанному с заболеванием антигену) экспрессируется на поверхности клеток типа антиген-презентирующих клеток, обеспечивая соответствующий эпитоп для связывания с CAR. Вакцинный антиген по изобретению может быть рекомбинантным антигеном.
Термин "иммунологически эквивалентный" означает то, что иммунологически эквивалентная молекула типа иммунологически эквивалентной аминокислотной последовательности проявляет такие же или практически такие же иммунологические свойства и/или оказывает такие же или практически такие же иммунологические эффекты, например, в отношении типа иммунологического эффекта. В контексте настоящего описания термин "иммунологически эквивалентный" предпочтительно применяется в отношении иммунологических эффектов или свойств антигенов либо их вариантов. Например, аминокислотная последовательность иммунологически эквивалентна эталонной аминокислотной последовательности, напр., CLDN6, если такая аминокислотная последовательность при контакте с модифицированными CAR клетками, связывающимися с эталонной аминокислотной последовательностью, или с клетками, экспрессирующими эталонную аминокислотную последовательность, вызывает иммунную реакцию с такой же специфичностью, что и эталонная аминокислотная последовательность, в частности стимуляцию, примирование и/или экспансию модифицированных CAR клеток. Таким образом, молекула, которая иммунологически эквивалентна антигену, проявляет такие же или практически такие же свойства и/или оказывает такие же или практически такие же эффекты в отношении стимуляции, примирования и/или экспансии модифицированных CAR клеток, как и тот антиген, на который нацелены модифицированные CAR клетки.
"Активация" или "стимуляция" в настоящем изобретении относится к состоянию таких T-клеток, которые подвергались достаточной стимуляции, вызывающей ощутимую пролиферацию клеток. Активация также может быть связана с индуцированной продукцией цитокинов и детектируемыми эффекторными функциями. Термин "активированные T-клетки" означает, среди прочего, такие T-клетки, которые претерпевают деление клеток.
Термин "примирование" означает такой процесс, при котором T-клетки впервые контактируют со своим специфичным антигеном, что вызывает их дифференцировку в эффекторные T-клетки.
Термин "клональная экспансия" или "размножение" означает такой процесс, при котором размножается определенный объект. В контексте настоящего изобретения термин предпочтительно применяется в контексте иммунологического ответа, при котором лимфоциты стимулируются антигеном, пролиферируют и размножаются определенные лимфоциты, распознающие данный антиген. Предпочтительно клональная экспансия ведет к дифференцировке лимфоцитов.
Согласно изобретению, особенно предпочтительно, чтобы родственный антиген вводился в виде РНК, кодирующей этот антиген. После введения РНК по крайней мере часть РНК попадает в целевые клетки. В одном воплощении по крайней мере часть РНК попадает в цитозоль клеток мишени. В одном воплощении РНК транслируется в клетках мишени с образованием кодируемого пептида или белка. Некоторые воплощения включают адресную доставку РНК в определенные ткани. В одном воплощении доставка включает доставку в лимфатическую систему, в частности, во вторичные лимфоидные органы, более конкретно в селезенку. В одном воплощении целевыми клетками являются клетки селезенки. В одном воплощении целевыми клетками являются антигенпрезентирующие клетки типа профессиональных антигенпрезентирующих клеток в селезенке. В одном воплощении целевыми клетками являются дендритные клетки в селезенке.
"Лимфатическая система" является частью системы кровообращения и составляет важную часть иммунной системы, включающую сеть лимфатических сосудов, переносящих лимфу. Лимфатическая система состоит из лимфатических органов, проводящей сети лимфатических сосудов и циркулирующей лимфы. Первичные или главные лимфоидные органы генерируют лимфоциты из незрелых клеток-предшественников. Тимус и костный мозг составляют первичные лимфоидные органы. Вторичные или периферические лимфоидные органы, которые включают лимфатические узлы и селезенку, поддерживают зрелые наивные лимфоциты и запускают адаптивный иммунный ответ.
РНК можно вводить в селезенку при помощи так называемых липоплексных составов, в которых РНК связана с липосомами, содержащими катионный липид и необязательно дополнительный или вспомогательный липид, образуя инъекционные составы наночастиц. Липосомы могут быть получены путем инъекции раствора липидов в этаноле в воду или подходящую водную фазу. РНК-липоплексные частицы могут быть получены путем смешивания липосом с РНК. РНК-липоплексные частицы, нацеленные на селезенку, описаны в WO 2013/143683, включенном сюда путем ссылки. Было обнаружено, что РНК-липоплексные частицы, имеющие суммарный отрицательный заряд, могут применяться для преимущественного внедрения в ткань селезенки или клетки селезенки типа антигенпрезентирующих клеток, в частности, в дендритные клетки. Соответственно, после введения РНК-липоплексных частиц происходит накопление РНК и/или экспрессия РНК в селезенке. Таким образом, РНК-липоплексные частицы по изобретению можно использовать для экспрессии РНК в селезенке. В одном воплощении после введения РНК-липоплексных частиц совсем или почти не происходит накопления РНК и/или экспрессии РНК в легких и/или печени. В одном воплощении после введения РНК-липоплексных частиц происходит накопление РНК и/или экспрессия РНК в антигенпрезентирующих клетках типа профессиональных антигенпрезентирующих клеток в селезенке. Таким образом, РНК-липоплексные частицы по изобретению можно использовать для экспрессии РНК в таких антигенпрезентирующих клетках. В одном воплощении антигенпрезентирующие клетки представляют собой дендритные клетки и/или макрофаги.
В контексте настоящего описания термин "РНК-липоплексные частицы" относится к частицам, которые содержат липид, в частности катионный липид, и РНК. Электростатические взаимодействия между положительно заряженными липосомами и отрицательно заряженной РНК приводят к комплексообразованию и спонтанному образованию РНК-липоплексных частиц. Положительно заряженные липосомы обычно синтезируют с использованием катионного липида типа DOTMA и дополнительных липидов типа DOPE. В одном воплощении РНК-липоплексные частицы представляют собой наночастицы.
В настоящем изобретении "катионный липид" означает липид, имеющий суммарный положительный заряд. Катионные липиды связываются с отрицательно заряженной РНК при электростатическом взаимодействии с липидным матриксом. Обычно катионные липиды содержат липофильную группировку типа стерола, ацильную или диацильную цепь, а головная группа липида обычно несет положительный заряд. Примеры катионных липидов включают, без ограничения, 1,2-ди-O-октадеценил-3-триметиламмоний-пропан (DOTMA), диметилдиоктадециламмоний (DDAB); 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP); 1,2-диолеоил-3-диметиламмоний-пропан (DODAP); 1,2-диацилокси-3-диметиламмоний-пропан; 1,2-диалкилокси-3-диметиламмонийпропан; диоктадецилдиметиламмонийхлорид (DODAC), 2,3-ди(тетрадецокси)пропил-(2-гидроксиэтил)-диметилазаний (DMRIE), 1,2-димиристоил-sn-глицеро-3-этилфосфохолин (DMEPC), 1,2-димиристоил-3-триметиламмонийпропан (DMTAP), 1,2-диолеилоксипропил-3-диметил-гидроксиэтиламмоний бромид (DORIE) и 2,3-диолеоилокси-N-[2(сперминкарбоксамид)этил]-N,N-диметил-1-пропанамий трифторацетат (DOSPA). Предпочтительными являются DOTMA, DOTAP, DODAC и DOSPA. В определенных воплощениях катионным липидом является DOTMA и/или DOTAP.
Для доведения общего соотношения положительных и отрицательных зарядов и физической стабильности РНК-липоплексных частиц можно ввести дополнительный липид. В некоторых воплощениях дополнительный липид представляет собой нейтральный липид. В настоящем изобретении "нейтральный липид" означает липид, имеющий суммарный заряд, равный 0. Примеры нейтральных липидов включают, без ограничения, 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфоэтаноламин (DOPE), 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), диацилфосфатидилхолин, диацилфосфатидилэтаноламин, церамид, сфингомиелин, цефалин, холестерин и цереброзид. В определенных воплощениях нейтральным липидом является DOPE, холестерин и/или DOPC.
В некоторых воплощениях РНК-липоплексные частицы включают и катионный липид, и дополнительный липид. В типичном воплощении катионным липидом является DOTMA, а дополнительным липидом - DOPE.
В некоторых воплощениях молярное соотношение по меньшей мере одного катионного липида к по меньшей мере одному дополнительному липиду составляет от 10:0 до 1:9, от 4:1 до 1:2 или от 3:1 до 1:1. В определенных воплощениях молярное соотношение может составлять примерно 3:1, примерно 2,75:1, примерно 2,5:1, примерно 2,25:1, примерно 2:1, примерно 1,75:1, примерно 1,5:1, примерно 1,25:1 или примерно 1:1. В типичном воплощении молярное соотношение по меньшей мере одного катионного липида к по меньшей мере одному дополнительному липиду составляет примерно 2:1.
РНК-липоплексные частицы, описанные здесь, имеют средний диаметр, который в одном воплощении составляет от 200 нм до 1000 нм, от 200 нм до 800 нм, от 250 до 700 нм, от 400 до 600 нм, от 300 нм до 500 нм или от 350 нм до 400 нм. В определенных воплощениях РНК-липоплексные частицы имеют средний диаметр около 200 нм, около 225 нм, около 250 нм, около 275 нм, около 300 нм, около 325 нм, около 350 нм, около 375 нм, около 400 нм, около 425 нм, около 450 нм, около 475 нм, около 500 нм, около 525 нм, около 550 нм, около 575 нм, около 600 нм, около 625 нм, около 650 нм, около 700 нм, около 725 нм, около 750 нм, около 775 нм, около 800 нм, около 825 нм, около 850 нм, около 875 нм, около 900 нм, около 925 нм, около 950 нм, около 975 нм или около 1000 нм. В одном воплощении РНК-липоплексные частицы имеют средний диаметр, который составляет от 250 нм до 700 нм. В другом воплощении РНК-липоплексные частицы имеют средний диаметр, который составляет от 300 нм до 500 нм. В типичном воплощении РНК-липоплексные частицы имеют средний диаметр примерно 400 нм.
Электрический заряд РНК-липоплексных частиц по настоящему изобретению составляет сумму электрических зарядов у по меньшей мере одного катионного липида и электрических зарядов у РНК. Соотношение зарядов - это отношение положительных зарядов у по меньшей мере одного катионного липида к отрицательным зарядам у РНК. Соотношение положительных зарядов у по меньшей мере одного катионного липида к отрицательным зарядам у РНК рассчитывается по следующему уравнению: соотношение зарядов = [(концентрация катионного липида (моль)) × (общее число положительных зарядов у катионного липида)] / [(концентрация РНК (моль)) × (общее число отрицательных зарядов у РНК)].
Нацеленные на селезенку РНК-липоплексные частицы, описанные здесь, при физиологическом pH предпочтительно имеют суммарный отрицательный заряд типа соотношения положительных зарядов к отрицательным зарядам от 1,9:2 до 1:2. В определенных воплощениях соотношение положительных зарядов к отрицательным зарядам у РНК-липоплексных частиц при физиологическом pH составляет примерно 1,9:2,0, примерно 1,8:2,0, примерно 1,7:2,0, примерно 1,6:2,0, примерно 1,5:2,0, примерно 1,4:2,0, примерно 1,3:2,0, примерно 1,2:2,0, примерно 1,1:2,0 или примерно 1:2,0.
Модифицированные CAR клетки и другие описанные здесь средства можно вводить в виде фармацевтических композиций или лекарственных средств для терапевтического или профилактического лечения, которые могут вводиться в виде любой подходящей фармацевтической композиции.
Термин "фармацевтическая композиция" относится к формам, содержащим терапевтически эффективное средство, предпочтительно вместе с фармацевтически приемлемыми носителями, разбавителями и/или наполнителями. Такие фармацевтические композиции применимы для лечения, профилактики или уменьшения тяжести заболевания или расстройства путем введения таких фармацевтических композиций субъектам. Фармацевтические композиции также известны в данной области как лекарственные формы.
Фармацевтические композиции по настоящему изобретению могут содержать один или несколько адъювантов или могут вводиться с одним или несколькими адъювантами. Термин "адъювант" относится к соединениям, которые продлевают, усиливают или ускоряют иммунный ответ. Адъюванты включают гетерогенную группу соединений типа масляных эмульсий (напр., адъюванты Фрейнда), минеральных соединений (типа квасцов), бактериальных продуктов (типа токсина Bordetella pertussis) или иммуностимулирующих комплексов. Примеры адъювантов включают, без ограничения, LPS, GP96, олигодезоксинуклеотиды CpG, факторы роста и цитокины типа монокинов, лимфокинов, интерлейкинов, хемокинов. Хемокины бывают IL1, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL12, IFNα, IFNγ, GM-CSF, LT-a. Другие известные адъюванты - гидроксид алюминия, адъювант Фрейнда или масло типа Montanide® ISA51. Другие подходящие адъюванты для применения в настоящем изобретении включают липопептиды типа Pam3Cys.
Фармацевтические композиции по настоящему изобретению обычно применяются в "фармацевтически эффективном количестве" и в виде "фармацевтически приемлемых препаратов".
Термин "фармацевтически приемлемый" относится к нетоксичности материала, который не мешает действию активного компонента фармацевтической композиции.
Термин "фармацевтически эффективное количество" или "терапевтически эффективное количество" означает такое количество, которое обеспечивает требуемую реакцию или требуемый эффект по отдельности или вместе с дополнительными дозами. При лечении конкретного заболевания требуемая реакция предпочтительно означает торможение течения заболевания. Это включает замедление развития заболевания, в частности, прерывание развития или регрессию заболевания. Требуемая реакция при лечении заболеваний также может означать замедление возникновения или предотвращение возникновения данной болезни или данного заболевания. Эффективное количество описанных здесь композиций будет зависеть от подлежащего лечению заболевания, тяжести заболевания, индивидуальных параметров пациента, включая возраст, физиологическое состояние, размер и вес, продолжительности лечения, типа сопутствующей терапии (если она есть), конкретного способа введения и аналогичных факторов. Соответственно, вводимые дозы описанных здесь композиций могут зависеть от различных таких параметров. В случае, если при начальной дозе реакция пациента недостаточна, можно использовать большие дозы (или эффективно большие дозы, достигаемые при другом, более локализованном способе введения).
Фармацевтические композиции по настоящему изобретению могут содержать соли, буферы, консерванты и необязательно другие терапевтические средства. В одном воплощении фармацевтические композиции по настоящему изобретению содержат один или несколько фармацевтически приемлемых носителей, разбавителей и/или наполнителей.
Подходящие консерванты для применения в фармацевтических композициях по настоящему изобретению включают, без ограничения, бензалкония хлорид, хлорбутанол, парабен и тимеросал.
Термин "наполнитель" в настоящем изобретении означает вещество, которое может присутствовать в фармацевтической композиции по настоящему изобретению, но не является активным ингредиентом. Примеры наполнителей включают, без ограничения, носители, связующие, разбавители, смазывающие, загустители, поверхностно-активные вещества, консерванты, стабилизаторы, эмульгаторы, буферы, ароматизаторы или красители.
Термин "разбавитель" означает разбавляющее и/или разжижающее вещество. Более того, термин "разбавитель" включает любую одну или несколько из текучих, жидких или твердых суспензий и/или смесительных сред. Примеры подходящих разбавителей включают этанол, глицерин и воду.
Термин "носитель" означает такой компонент, который может быть натуральным, синтетическим, органическим, неорганическим, с которым смешивается активный компонент с тем, чтобы облегчить, усилить или обеспечить введение фармацевтической композиции. В настоящем изобретении носителем может быть один или несколько совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые подходят для введения субъектам. Подходящие носители включают, без ограничения, стерильную воду, раствор Рингера, Рингер с лактатом, стерильный раствор хлорида натрия, изотонический солевой раствор, полиалкиленгликоли, гидрированные нафталины и особенно биосовместимые лактидные полимеры, сополимеры лактида/гликолида или сополимеры полиоксиэтилена/полиоксипропилена. В одном воплощении фармацевтические композиции по настоящему изобретению включают изотонический солевой раствор.
Фармацевтически приемлемые носители, наполнители или разбавители для терапевтического применения хорошо известны в области фармацевтики и описаны, к примеру, в Remington’s Pharmaceutical Sciences, Mack Publishing Co. (A.R Gennaro, ed., 1985).
Фармацевтические носители, наполнители или разбавители можно выбирать с учетом предполагаемого способа введения и стандартной фармацевтической практики.
В одном воплощении описанные здесь фармацевтические композиции можно вводить внутривенно, внутриартериально, подкожно, интрадермально или внутримышечно. В некоторых воплощениях фармацевтические композиции составляются для местного или системного введения. Системное введение может включать энтеральное введение, которое включает всасывание через желудочно-кишечный тракт, или парентеральное введение. В настоящем изобретении "парентеральное введение" означает введение не через желудочно-кишечный тракт, а любым другим способом типа внутривенной инъекции. В одном предпочтительном воплощении фармацевтические композиции составляют для системного введения. В другом предпочтительном воплощении системное введение осуществляется путем внутривенного введения. Композиции можно вводить непосредственно в опухоль или лимфатический узел.
Термин "совместное введение" в настоящем изобретении означает процесс, при котором разные соединения или композиции вводятся одному и тому же пациенту. Например, модифицированные CAR клетки и антиген или кодирующая его нуклеиновая кислота, описанные здесь, могут вводиться одновременно, практически в одно и то же время или последовательно. Если введение происходит последовательно, то модифицированные CAR клетки можно вводить до или после введения антигена или кодирующей его нуклеиновой кислоты. Если введение происходит одновременно, то модифицированные CAR клетки и антиген или кодирующую его нуклеиновую кислоту не обязательно вводить в одной и той же композиции. Модифицированные CAR клетки и антиген или кодирующую его нуклеиновую кислоту можно вводить один или несколько раз, а количество введений каждого компонента может быть одинаковым или разным. Кроме того, модифицированные CAR клетки и антиген или кодирующую его нуклеиновую кислоту не обязательно вводить в одно и то же место.
Термин "заболевание" означает такое аномальное состояние, которое поражает организм человека. Заболевание часто понимается как медицинское состояние, связанное с определенными симптомами и признаками. Заболевание может быть вызвано факторами, исходящими из внешнего источника, типа инфекционных заболеваний, или же может быть вызвано внутренними дисфункциями, типа аутоиммунных заболеваний. У людей "заболевание" часто применяется в более широком смысле для обозначения таких состояний, которые вызывают боль, дисфункцию, недомогание, социальные проблемы или смерть человека, страдающего этим заболеванием, либо аналогичные проблемы для тех, кто находится в контакте с этим человеком. В таком широком смысле оно иногда включает травмы, инвалидность, расстройства, синдромы, инфекции, отдельные симптомы, девиантное поведение и атипичные варианты структуры и функции, тогда как в других контекстах и для других целей их можно рассматривать как отдельные категории. Заболевания обычно поражают людей не только физически, но и эмоционально, так как появление многих болезней и жизнь с ними может изменить взгляды на жизнь и личность человека.
В настоящем изобретении термин "лечение", "лечат" или "терапевтическое вмешательство" означает ведение субъекта и уход за ним с целью борьбы с заболеванием типа болезни или расстройства. Термин служит для обозначения полного спектра терапии для того заболевания, которым страдает субъект, типа введения терапевтически эффективного соединения для ослабления симптомов или осложнений, для замедления развития болезни, расстройства или заболевания, для ослабления или снятия симптомов или осложнений и/или для излечения или устранения болезни, расстройства или заболевания, а также для профилактики заболеваний, причем профилактику следует понимать как ведение индивида и уход за ним с целью борьбы с болезнью, заболеванием или расстройством, что включает введение активных соединений для предотвращения появления симптомов или осложнений.
Термин "терапевтическое лечение" означает такое лечение, которое улучшает состояние здоровья и/или продлевает (увеличивает) продолжительность жизни индивида. Такое лечение может устранить заболевание у индивида, остановить или замедлить развитие заболевания у индивида, подавить или замедлить развитие заболевания у индивида, уменьшить частоту или тяжесть симптомов у индивида и/или уменьшить рецидивы у индивида, у которого в настоящее время есть или ранее было заболевание.
Термин "профилактическое лечение" или "превентивное лечение" означает такое лечение, которое предназначено для предотвращения возникновения заболевания у индивида. Термины "профилактическое лечение" или "превентивное лечение" применяются здесь взаимозаменяемым образом.
Термины "индивид" и "субъект" применяются здесь взаимозаменяемо. Они относятся к людям или другим млекопитающим (напр., мышам, крысам, кроликам, собакам, кошкам, крупному рогатому скоту, свиньям, овцам, лошадям или приматам), которые могут быть поражены или подвержены заболеванию или расстройству (напр., раку), но у них может и не быть заболевания или расстройства. Во многих воплощениях индивидом является человек. Если не указано иначе, термины "индивид" и "субъект" не обозначают конкретный возраст, поэтому они охватывают взрослых, пожилых, детей и новорожденных. В воплощениях настоящего изобретения "индивид" или "субъект" является "пациентом".
Термин "пациент" означает индивида или субъекта для лечения, в частности, больного индивида или субъекта.
Комбинированные стратегии при лечении рака могут быть желательными из-за результирующего синергического эффекта, который может быть значительно сильнее, чем воздействие при монотерапии. В одном воплощении фармацевтические композиции вводятся вместе с иммунотерапевтическим средством. В настоящем изобретении "иммунотерапевтическое средство" означает такое средство, которое может участвовать в активации специфического иммунного ответа и/или иммуноэффекторной функции. Настоящим изобретением предусмотрено применение антител в качестве иммунотерапевтических средств. Не придерживаясь какой-либо теории, антитела способны обеспечить терапевтические эффекты против раковых клеток по различным механизмам, включая индукцию апоптоза, блокировку компонентов путей передачи сигналов или ингибирование пролиферации опухолевых клеток. В некоторых воплощениях антитела представляют собой моноклональные антитела. Моноклональные антитела могут вызывать гибель клеток посредством антителозависимой клеточной цитотоксичности (ADCC) или связываться с белками комплемента, что ведет к прямой токсичности для клеток, известной как комплемент-зависимая цитотоксичность (CDC). Неограничительные примеры противораковых антител и потенциальных мишеней антител (в скобках), которые можно использовать в комбинации с настоящим изобретением, включают: абаговомаб (CA-125), абциксимаб (CD41), адекатумумаб (EpCAM), афутузумаб (CD20), алацизумаб-пегол (VEGFR2), альтумомаб-пентетат (CEA), аматуксимаб (MORAb-009), анатумомаб-мафенатокс (TAG-72), аполизумаб (HLA-DR), арцитумомаб (CEA), атезолизумаб (PD-L1), бавитуксимаб (фосфатидилсерин), бектумомаб (CD22), белимумаб (BAFF), бевацизумаб (VEGF-A), биватузумаб-мертансин (CD44 v6), блинатумомаб (CD19), брентуксимаб-ведотин (CD30 TNFRSF8), кантузумаб-мертансин (муцин CanAg), кантузумаб-равтансин (MUC1), капромаб пендетид (клетки карциномы простаты), карлумаб (CNT0888), катумаксомаб (EpCAM, CD3), цетуксимаб (EGFR), цитатузумаб-богатокс (EpCAM), циксутумумаб (рецептор IGF-1), клаудиксимаб (клаудин), кливатузумаб-тетраксетан (MUC1), конатумумаб (TRAIL-R2), дацетузумаб (CD40), далотузумаб (рецептор инсулиноподобного фактора роста I), деносумаб (RANKL), детумомаб (клетки B-лимфомы), дрозитумаб (DR5), экромексимаб (ганглиозид GD3), эдреколомаб (EpCAM), элотузумаб (SLAMF7), энаватузумаб (PDL192), энситуксимаб (NPC-1C), эпратузумаб (CD22), эртумаксомаб (HER2/neu, CD3), этарацизумаб (интегрин ανβ3), фарлетузумаб (рецептор фолата 1), FBTA05 (CD20), фиклатузумаб (SCH 900105), фигитумумаб (рецептор IGF-1), фланвотумаб (гликопротеин 75), фрезолимумаб (TGF-β), галиксимаб (CD80), ганитумаб (IGF-I), гемтузумаб-озогамицин (CD33), гевокизумаб (IL1β), гирентуксимаб (карбоангидраза 9 (CA-IX)), глембатумумаб-ведотин (GPNMB), ибритумомаб-тиуксетан (CD20), икрукумаб (VEGFR-1), иговомаб (CA-125), индатуксимаб-равтансин (SDC1), интетумумаб (CD51), инотузумаб-озогамицин (CD22), ипилимумаб (CD152), иратумумаб (CD30), лабетузумаб CEA), лексатумумаб (TRAIL-R2), либивирумаб (поверхностный антиген гепатита B), линтузумаб (CD33), лорвотузумаб-мертансин (CD56), лукатумумаб (CD40), лумиликсимаб (CD23), мапатумумаб (TRAIL-R1), матузумаб (EGFR), меполизумаб (IL5), милатузумаб (CD74), митумомаб (ганглиозид GD3), могамулизумаб (CCR4), моксетумомаб-пасудотокс (CD22), наколомаб-тафенатокс (антиген C242), наптумомаб-эстафенатокс (5T4), наматумаб (RON), нецитумумаб (EGFR), нимотузумаб (EGFR), ниволумаб (IgG4), офатумумаб (CD20), оларатумаб (PDGF-Ra), онартузумаб (киназа рецептора человеческого фактора рассеяния), опортузумаб-монатокс (EpCAM), ореговомаб (CA-125), окселумаб (OX-40), панитумумаб (EGFR), патритумаб (HER3), пемтумомаб (MUC1), пертузумаб (HER2/neu), пинтумомаб (антиген аденокарциномы), притумумаб (виментин), ракотумомаб (N-гликозилнейраминовая кислота), радретумаб (экстрадомен-B фибронектина), рафивирумаб (гликопротеин вируса бешенства), рамуцирумаб (VEGFR2), рилотумумаб (HGF), ритуксимаб (CD20), робатумумаб (рецептор IGF-1), самализумаб (CD200), сибротузумаб (FAP), силтуксимаб (IL6), табалумаб (BAFF), такатузумаб-тетраксетан (α-фетопротеин), таплитумомаб-паптокс (CD19), тенатумомаб (тенасцин C), тепротумумаб (CD221), тицилимумаб (CTLA-4), тигатузумаб (TRAIL-R2), TNX-650 (IL13), тоситумомаб (CD20), трастузумаб (HER2/neu), TRBS07 (GD2), тремелимумаб (CTLA-4), тукотузумаб-целмолейкин (EpCAM), ублитуксимаб (MS4A1), урелумаб (4-1BB), волоциксимаб (интегрин α5β1), вотумумаб (опухолевый антиген CTAA 16.88), залутумумаб (EGFR) и занолимумаб (CD4).
Цитирование приведенных здесь документов и исследований не означает признания того, что что-нибудь из вышеизложенного относится к предшествующему уровню техники. Все утверждения насчет содержания этих документов основываются на информации, доступной заявителям, и не означают признания правильности содержания этих документов.
ПРИМЕРЫ
Далее изобретение описано подробно на следующих экспериментальных примерах. Эти примеры приводятся только в целях иллюстрации и не предназначены для ограничения, если не указано иначе. Таким образом, изобретение никоим образом не следует рассматривать как ограниченное следующими примерами, а скорее следует рассматривать как охватывающее всевозможные вариации, которые станут очевидными с учетом приведенных здесь сведений.
И без дальнейшего описания полагаем, что рядовой специалист в данной области сможет, используя предыдущее описание и следующие иллюстративные примеры, получать и использовать соединения по настоящему изобретению и применять заявленные способы на практике. Таким образом, следующие рабочие примеры конкретно указывают на предпочтительные воплощения настоящего изобретения и не должны рассматриваться как ограничивающие каким-либо образом оставшуюся часть описания.
Пример 1. Материалы и методы
Используемые здесь методы и методики описаны здесь или выполняются известным способом и как описано, к примеру, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Все методы, включая использование наборов и реагентов, выполняются в соответствии с информацией производителя, если специально не указано иначе.
Конструкция для CAR
Использовали γ-ретровирусный самоинактивирующийся (SIN) вектор pES.12-6 для стабильной гиперэкспрессии CLDN6-CAR-BBz в T-клетках человека под контролем внутреннего эукариотического промотора, короткой безинтронной версии промотора фактора элонгации 1α человека (EFS -213/+31). Остов вектора содержит последовательности MLV дикого типа из участков R и U5 в 5'- и 3'-LTR, а также упаковочную область (psi и psi+). Для предотвращения инициации транскрипции из участка U3 в 3'-LTR удаляли энхансерные элементы (включая CAAT-Box), а последовательность TATA-Box подвергали мутации. Для предотвращения экспрессии нежелательных вирусных белков использовали усеченную версию посттранскрипционного регуляторного элемента (PRE) вируса гепатита сурка (WHV).
CLDN6-CAR-BBz содержит сигнальный пептид IgG человека, одноцепочечный Fv-фрагмент специфичного к CLDN6 антитела IMAB206 (Ganymed Pharmaceuticals) с линкером (G4S)3 между тяжелой (VH) и легкой (VL) цепью, содержащий замену цистеина на серин в положении 46 у VL (в положении 45 у VL, приведенного в списке последовательностей). scFv-фрагмент слит с шарнирным и трансмембранным доменом CD8α человека, за которым следуют сигнальные фрагменты 4-1BB человека и CD3ζ (Q14K) человека.
Клеточные линии и реагенты
Клетки линии PA-1-SC12_A0201_luc_gfp тератомы, экспрессирующие CLDN6 человека, культивировали в среде MEM-GlutaMAX с добавлением 10% (об/об) FCS (Biochrom), 1 мМ пирувата натрия (Gibco), 1 мМ раствора незаменимых аминокислот MEM (Gibco) и 2% (об/об) раствора бикарбоната натрия (Gibco). Клетки этой линии гиперэкспрессируют HLA-A*0201, люциферазу и GFP.
Клетки линии OV-90-SC12 карциномы яичников культивировали в смеси из 41,5% (об/об) среды MCDB 105 (Sigma-Aldrich) и 41,5% (об/об) среды 199 (Sigma Aldrich) с добавлением 15% (об/об) FCS и 2% (об/об) раствора бикарбоната натрия.
Культуральная среда для клеток линии SK-MEL-37 меланомы человека состоит из 90% DMEM GlutaMAX™ (Gibco) с добавлением 10% (об/об) FCS.
Культуральная среда для MDA-MB-231 состоит из 88% (об/об) RPMI 1640 GlutaMAX™ (Gibco) с добавлением 10% FCS, 1 мМ пирувата натрия, 1 мМ раствора незаменимых аминокислот MEM.
Клетки линии 23132-87 аденокарциномы человека и клетки линии MEL-526 меланомы человека культивировали в 90% (об/об) RPMI 1640 GlutaMAX™ (Gibco) с добавлением 10% (об/об) инактивированной нагреванием FCS.
Культуральная среда для HEK-293 состоит из 90% (об/об) минимальной эссенциальной среды Игла (EMEM) (ATCC) и 10% (об/об) FCS.
SKOV-3 культивировали в 90% (об/об) среде McCoy 5A (ATCC) с добавлением 10% (об/об) FCS.
Клетки линии NIH-OVCAR-3 из яичников человека культивировали в 80% (об/об) RPMI 1640 GlutaMAX™ (Gibco, кат. № 61870) с добавлением 20% (об/об) FCS и 0,1% (вес/об) инсулина (Sigma-Aldrich).
Клетки раковых линий LCLC-103H, COLO-699-N, JAR и NEC-8 человека культивировали в 90% (об/об) RPMI 1640 GlutaMAX™ (Gibco) с добавлением 10% (об/об) FCS.
Через каждые 2 или 3 дня проводили пересев и/или разделение клеточных линий.
Мононуклеарные клетки периферической крови (PBMC) и дендритные клетки (DC)
PBMC выделяли путем центрифугирования в градиенте плотности Ficoll®-Hypaque (1,077 г/мл, Amersham Biosciences) из лейкоцитных пленок. Моноциты обогащали с помощью микрошариков с антителами против CD14 (Miltenyi Biotec). Незрелые DC (iDCs) подвергали дифференцировке путем культивирования в среде для DC, состоящей из RPMI 1640 GlutaMAX™, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 1 мМ пирувата натрия, незаменимых аминокислот и 5% (об/об) инактивированной нагреванием человеческой сыворотки AB (все от Invitrogen, Karlsruhe, Германия), с добавлением 1000 ед./мл hGM-CSF (Essex, Lucerne, Швейцария) и 1000 ед./мл hIL-4 (Strathmann Biotech, Hamburg, Германия).
Трансдукция T-клеток
T-клетки выделяли из PBMC посредством магнитного разделения T-клеток CD3+/ CD28high+ с помощью Dynabeads® Human T-Expander CD3/CD28 CTS. Клетки инкубировали с гранулами при соотношении 3:1 к T-клеткам CD3+ и отделяли с помощью магнита CTS DynaMag. Обогащенные T-клетки культивировали в среде X-VIVO 15 с добавлением 5% (об/об) человеческой сыворотки в присутствии 450 ед./мл rhIL-7 и 50 ед./мл rhIL-15 (оба от Miltenyi Biotec). Через три дня удаляли гранулы CD3/CD28 с помощью магнита и трансдуцировали предварительно активированные T-клетки ретровирусными векторами в присутствии Protransduzin®-A в конечной концентрации 25 мкг/мл. Клетки размножали до 7 или 10 дней в полной культуральной среде и либо использовали непосредственно для оценки поверхностной экспрессии CAR, фенотипа T-клеток и эффекторных функций, либо подвергали криоконсервации.
Анализ методом проточной цитометрии культивируемых in vitro клеток
Экспрессию трансдуцированных CAR на клеточной поверхности анализировали с помощью конъюгированного с Alexa-Fluor-647 специфичного к идиотипу антитела (Ganymed Pharmaceuticals), распознающего scFv-фрагмент, содержащийся во всех конструкциях CLDN6-CAR. Экспрессию CLDN6 на поверхности искомых клеток анализировали путем окрашивания с помощью конъюгированного с Alexa-Fluor-647 специфичного для CLDN6 антитела IMAB027 (Ganymed Pharmaceuticals). Измерения по проточной цитометрии проводили на проточном цитометре FACSCanto™ II с помощью программного обеспечения FACSDiva™ (BD Biosciences) и проводили анализ с помощью FlowJo® V10 (Treestar Inc.).
Количественный метод ПЦР в реальном времени (qRT-PCR)
Выделяли тотальную РНК из клеток указанных линий с помощью набора RNeasy® Mini Kit (QIAGEN). При обратной транскрипции РНК для получения кДНК для qRT-PCR использовали набор PrimeScript™ RT Reagent Kit with gDNA Eraser (TAKARA), начиная с 1 мкг тотальной РНК. Количественная ПЦР в реальном времени проводилась с помощью набора QuantiTect SYBR® Green PCR kit (QIAGEN) со следующими праймерами (5'-3'): CLDN6-for: CTT ATC TCC TTC GCA GTG CAG, CLDN6-rev: AAG GAG GGC GAT GAC ACA GAG; HPRT1-for: TGA CAC TGG CAA AAC AAT GCA, HPRT1-rev: GGT CCT TTT CAC CAG CAA GCT (температура отжига: 62°C).
Анализ цитотоксичности на xCELLigence
Для оценки опосредованной CAR цитотоксичности использовали установку xCELLigence (OMNI Life Science). Измерения клеточного индекса (CI) по импедансу проводили согласно инструкциям поставщика. Для каждой линии опухолевых клеток определяли оптимальную плотность клеток, дающую экспоненциальную кривую роста. Клетки-мишени высеивали при концентрации 2×104 клеток на лунку в планшеты E-plate 96 PET (ACEA Biosciences Inc.). Через 24 ч добавляли различное количество трансдуцированных CAR T-клеток в конечном объеме 200 мкл и отслеживали каждые 30 мин на протяжении вплоть до 48 ч на установке xCELLigence.
Степень специфического лизиса рассчитывали следующим образом:
(CI Lmin - CIобразца)/CI Lmin × 100.
Стандартное отклонение рассчитывали следующим образом:
100 × (CIобразца/CI Lmin) × { [(СТ.Откл. CIобразца/CIобразца)2 + (СТ.Откл. CI Lmin/CI Lmin)2]}.
[(СТ.Откл. CIобразца/CIобразца)2 + (СТ.Откл. CI Lmin/CI Lmin)2]}.
Максимальный клеточный индекс, соответствующий минимальному лизису (Lmin), определяли после инкубации клеток-мишеней с эффекторными T-клетками, экспрессирующими контрольный антиген (напр., eGFP, контрольный CAR).
Анализ пролиферации по CFSE (сукцинимидиловому эфиру карбоксифлуоресцеина)
Чтобы определить содержание пролиферирующих T-клеток после антигенспецифической стимуляции, CAR-экспрессирующие T-клетки метили 1,6 мкМ флуоресцентного красителя сукцинимидилового эфира карбоксифлуоресцеина диацетата (CFSE) в течение 10 мин при 37°C (защищая от света). Для удаления свободного красителя к клеткам добавляли очищенную FCS и инкубировали еще 5 мин. Клетки промывали, ресуспендировали в культуральной среде и культивировали вместе с клетками мишени при различных соотношениях эффектора к мишени (E:T) в общем объеме 200 мкл среды DC в 96-луночных круглодонных планшетах. После 5 дней совместного культивирования клетки окрашивали с помощью конъюгированных с флуорохромом антител, напр., против CD4, CD8 и CAR. Содержание пролиферирующих T-клеток определяли методом проточной цитометрии на основе прогрессирующего снижения наполовину флуоресценции CFSE в дочерних клетках после деления клеток на проточном цитометре BD FACSCanto™ II (Becton Dickinson).
Анализ сфероидов (IncuCyte®)
Опухолевые сфероиды получали путем культивирования 1×104 клеток PA1-SC12-A2-eGFP на лунку в среде MEM-GlutaMAX с добавлением 10% (об/об) FCS, 1% (об/об) Na-пирувата, 1% (об/об) MEM NEAA и 2% (об/об) Na-бикарбоната в 96-луночных круглодонных планшетах Corning® Costar® Ultra-Low Attachment в течение 48 ч после центрифугирования. Добавляли T-клетки CAR (1×105 на лунку) и визуализировали опухолевые сфероиды, экспрессирующие eGFP, при 4-кратном увеличении и времени экспозиции 300 мсек, детектируя зеленую флуоресценцию в системе визуализации живого содержимого IncuCyte Zoom Live-content (Essen Bioscience) при 37°C, 5% CO2. Получали изображения каждый час в течение 10 дней. Данные анализировали с помощью программного обеспечения IncuCyte для детектирования и количественной оценки общей интегрированной интенсивности зеленых объектов (GCU×мкм² на 1 изображение). Наносили на графики среднее количество зеленых объектов ±SD в каждый момент времени с помощью программы для анализа IncuCyte.
Получение транскрибируемой in vitro (IVT) мРНК
Транскрипция in vitro мРНК, кодирующих антигены, была на основе каркаса плазмиды pST1-T7-GG-hAg-MCS-2hBg-A30LA70 и производных ДНК-конструкций. Эти плазмидные конструкции содержат, помимо полноразмерной ORF, 5'-UTR α-глобина человека, две последовательных 3'-UTR β-глобина человека и поли(A)-хвост из 100 нуклеотидов с линкером после 70 нуклеотидов. Кодирующие антигены мРНК получали путем транскрипции in vitro, как описано в Holtkamp S. et al. (2006) Blood 108(13):4009-17. Транскрипция in vitro всех описанных конструкций с мРНК проводилась на фирме BioNTech RNA Pharmaceuticals GmbH.
Получение кодирующей антигены IVT-РНК в составе липосом (РНК(LIP)) и трансфекция дендритных клеток in vitro
Получение комплексов кодирующей антигены IVT-РНК с липосомами было ранее описано в Kranz et al. (2016) Nature 534(7607):396-401. Использовали соотношение зарядов катионного DOTMA и РНК, равное 1,3:2. Помимо DOTMA, липидная фракция еще содержит вспомогательный липид DOPE в молярном соотношении DOTMA к DOPE = 2:1.
Экспериментальные методы на животных
Животные
Для исследований in vivo использовали 9-21-недельных самок иммунодефицитных мышей NOD Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG). Пары для размножения приобретали у фирмы Jackson Laboratory (Bar Harbor, ME, США) и разводили в виварии фирмы BioNTech AG, Германия. Мышей C57BL/6BrdCrHsd-Tyrc приобретали у Envigo Labs. Во всех экспериментах использовали подобранных по возрасту (8-10 недель) и полу (самцов или самок) животных. Конгенных мышей C57BL/6-Thy1.1 разводили в виварии фирмы BioNTech AG, Германия. Все эксперименты проводились в условиях отсутствия определенных патогенов (SPF) и в соответствии с немецкими правилами проведения экспериментов на животных.
Прививание опухолевых клеток
В правый задний бок мышей вводили подкожно 5×106 опухолевых клеток OV90-SC12 либо 5×105 опухолевых клеток CT26 (в 100 мкл PBS). Отслеживали рост опухолей и определяли их объем с помощью штангенциркуля по формуле V =  (длина × ширина2). Перед адоптивным переносом T-клеток со встроенным CAR человека проводили стратификацию несущих опухоли мышей с помощью надстройки Daniels’ XL Toolbox Add-in для Microsoft Excel для достижения однородного распределения объема опухолей между различными опытными группами.
(длина × ширина2). Перед адоптивным переносом T-клеток со встроенным CAR человека проводили стратификацию несущих опухоли мышей с помощью надстройки Daniels’ XL Toolbox Add-in для Microsoft Excel для достижения однородного распределения объема опухолей между различными опытными группами.
Адоптивный перенос клеток (ACT) для T-клеток человека
В ретробульбарное сплетение внутривенно вводили различные количества трансдуцированных γ-ретровирусом общих T-клеток человека (количество и частота T-клеток, экспрессирующих трансген CAR или GFP, указаны на соответствующих фигурах) в 200 мкл PBS. В зависимости от условий эксперимента использовали трансдуцированные T-клетки непосредственно после активации и процесса трансдукции in vitro или же оттаивали криоконсервированные трансдуцированные T-клетки и проводили адаптивный перенос их мышам после 2-кратной промывки в PBS, соответственно. Жизнеспособность каждого препарата T-клеток, используемого в эксперименте, составляла >90%.
Мониторинг T-клеток с CAR человека in vivo в крови
В указанные моменты времени из ретроорбитальной вены отбирали 50 мкл периферической крови и собирали в специальные пробирки, содержащие гепарин (Sarstedt). Эритроциты подвергали лизису с помощью лизирующего раствора BD FACS (BD). Экспрессию CAR на поверхности перенесенных T-клеток человека анализировали с помощью антител к hCD45-PE-Cy7 (HI30, BD), hCD4-APC-Cy7 (OKT4, BioLegend), hCD8-BV421 (RPA-T8, BD) и конъюгированного с Alexa-Fluor 647 специфичного к идиотипу антитела (Ganymed Pharmaceuticals). Из анализа исключали мертвые клетки с помощью 7-AAD (Beckmann Coulter). Измерения по проточной цитометрии проводили на проточном цитометре FACSCanto™ II с помощью программного обеспечения FACSDiva™ (BD Biosciences) и проводили анализ с помощью FlowJo® V10 (Treestar Inc.).
Манипуляции с ретровирусными генами и подготовка T-клеток с CAR для адоптивного переноса T-клеток
Выделяли спленоциты из наивных мышей C57BL/6-Thy1.1+ либо Balb/c-Thy1.1+ и предварительно активировали при помощи Dynabeads™ Mouse T-Activator CD3/CD28 при соотношении гранул к T-клеткам 1:1 (Invitrogen) в присутствии 5 нг/мл рекомбинантного человеческого (rh) IL-7 и 5 нг/мл rhIL-15 (Miltenyi Biotec). Для трансдукции мышиных клеток супернатанты ретровируса MLV псевдотипа E вносили в покрытые RetroNectin (2 мкг/см2) лунки, не обработанные для тканевой культуры согласно инструкциями производителя (Takara Bio Inc., Otsu, Япония), с 3 повторными циклы внесения вируса и центрифугирования (1300×g, 15°C, 15 мин) для усиления связывания. Через 24 ч после предварительной активации осаждали 0,5-0,6×106 клеток/см2 центрифугированием (300×g, 37°C, 1 ч) на лунки, покрытые вирусными частицами. После культивирования в течение ночи повторяли трансдукцию с осаждением в новых планшетах, покрытых вирусными частицами. Через 72 ч после предварительной активации удаляли из культуры гранулы Dynabeads™ Mouse T-Activator CD3/CD28 и размножали клетки в присутствии 5 нг/мл rhIL-7 и 5 нг/мл rhIL-15. После очистки через Ficoll клетки дважды промывали PBS для удаления белков сыворотки, а затем готовили для адоптивного переноса клеток (ACT). Для трансдукции использовали ретровирусные векторы на основе pES12.6, содержащие CLDN6-CAR-BBz, а также кодирующие гены репортеров: усиленной люциферазы светлячка (effLuc; Rabinovich BA et al., PNAS (2008) 105(38):14342-6) и eGFP (усиленного зеленого флуоресцентного белка), который экспрессировался отдельно с помощью сплайс-элементов 2А (Szymczak AL et al., Nat Biotechnol. (2004) 22(5):589-94).
Адоптивный перенос клеток для мышиных T-клеток и вакцинация с помощью РНК(LIP)
Трансдуцированные γ-ретровирусом с CAR конгенные T-клетки Thy1.1+ вводили внутривенно (i.v.) подвергнутым облучению всего тела (XRAD320) мышам C57BL/6BrdCrHsd-Tyrc или мышам-донорам BALB/c, соответственно. После этого мышей вакцинировали внутривенно (i.v.) кодирующей антиген РНК(LIP) при соотношении F12:РНК = 1,3:2 в различные моменты времени после ACT. Экспрессию CAR in vivo анализировали методом биолюминесцентной визуализации всего тела, а противоопухолевое действие анализировали путем мониторинга опухолей.
Визуализация люциферазы in vivo (BLI)
Оценивали экспансию и распределение T-клеток, трансдуцированных CAR-effLuc-GFP, методом биолюминесцентной визуализации in vivo с помощью системы визуализации IVIS Lumina (Caliper Life Sciences). Вкратце, в указанные моменты времени после адоптивного переноса трансдуцированных T-клеток вводили внутрибрюшинно (i.p.) водный раствор D-люциферина (80 мг/кг веса тела; Perkin Elmer). Через 5 мин после этого измеряли количество испускаемых фотонов (время интегрирования: 1 мин, разбиение на 8). Биолюминесценцию in vivo в представляющих интерес участках (ROI) определяли в виде общего потока (фотоны/сек) с помощью программы IVIS Living Image 4.0 Software. Интенсивность проходящего света от экспрессирующих люциферазу клеток у животных представлена в виде полутоновых изображений, где черным представлены наименее интенсивные, а от белого до темно-серого - наиболее интенсивные сигналы биолюминесценции. Контрольные полутоновые изображения мышей получали при слабом светодиодном освещении. Изображения были наложены с помощью программы Living Image 4.0.
Статистический анализ и представление данных
Все результаты представлены в виде среднего ± SD из технических повторов или среднего ± SEM из биологических повторов. Количество повторных образцов указано при описании рисунков для каждого эксперимента. Для сравнения площади под кривой (AUC) между двумя группами использовали непарный двусторонний t-критерий Стьюдента. Все статистические анализы проводили с помощью GraphPad PRISM 6.04. *** P ≤ 0,001, **** P ≤ 0,0001.
Пример 2. Получение и характеристика in vitro CLDN6-специфичных CAR
Для выбора перспективной структуры мы создавали различные остовы CAR, которые все содержат один и тот же scFv-фрагмент, происходящий из CLDN6-специфичного антитела IMAB206-C46S, но различаются своими шарнирными и костимулирующими доменами (фиг. 1A). Поскольку было показано, что костимуляция 4-1BB повышает устойчивость и противоопухолевое действие T-клеток CAR, мы включили остовы CAR 2-го и 3-го поколения, содержащие эндодомен 4-1BB. Наряду с этим включили и модифицированный домен CD28 (Kofler D.M. et al. (2011) Molecular Therapy 19(4), 760-767), который вызывает опосредованную CD28 костимуляцию генно-инженерных T-клеток в отсутствие агонистических лигандов CD28 типа B7.1 и B7.2. ScFv-фрагменты сливали с костимулирующими доменами 4-1BB или CD28 либо через модифицированный Fc IgG (Hombach A. et al. (2010) Gene Therapy 17, 1206-1213), либо через шарнирную область CD8α.
Проводили всестороннее изучение различных CLDN6-CAR in vitro на их способность точно и специфически распознавать и уничтожать опухолевые клетки, экспрессирующие CLDN6. Среди других экспериментов проводили анализ опухолевых сфероидов, используя CAR-трансдуцированные T-клетки в комбинации с экспрессирующими eGFP опухолевыми сфероидами PA1. Действительно, проявлялся ускоренный лизис экспрессирующих CLDN6 опухолевых сфероидов под действием содержащих 4-1BB CARs по сравнению с CAR, несущим домен CD28, при визуализации на IncuCyte® в реальном времени (фиг. 1B).
Исходя из суммарных результатов исследования различных функциональных характеристик, мы выбрали CLDN6-CAR-CD8h-BBz в качестве ведущей структуры для доклинических и клинических испытаний, так как было продемонстрировано высокоспецифичное и чувствительное распознавание CLDN6, а также высокий потенциал выживания и многократной стимуляции T-клеток со встроенным CAR. Важно отметить, что этот остов CAR уже успешно применялся в нескольких испытаниях T-клеток с CD19-CAR. Для устойчивого встраивания нашего CLDN6-CAR в геном T-клеток мы выбрали γ-ретровирусный самоинактивирующийся (SIN) вектор pES12.6 для стабильного встраивания терапевтического CLDN6-CAR в геном T-клеток (Loew et al., Gene Therapy (2010) 17, 272-280).
Пример 3. Чувствительность CLDN6-CAR-BBz
Для более подробного анализа чувствительности опосредованного CAR распознавания проводили эксперимент по титрованию CLDN6-РНК. Для этой цели клетки CLDN6-отрицательной линии Colo699-N карциномы легких трансфецировали титрованными количествами CLDN6-РНК и определяли опосредованный CLDN6-CAR лизис клеток мишени методом анализа цитотоксичности xCELLigence. Экспрессию CLDN6-CAR на поверхности трансдуцированных T-клеток (фиг. 2A) и уровни экспрессии белка CLDN6 на трансфицированных клетках Colo699-N (фиг. 2B) определяли методом проточной цитометрии после окрашивания с помощью антител, специфичных для CLDN6-CAR и CLDN6. Наблюдалось специфическое уничтожение трансфицированных CLDN6-РНК клеток мишени под действием экспрессирующих CLDN6-CAR T-клеток в зависимости от дозы CLDN6-РНК, используемой для трансфекции клеток Colo699-N, что коррелирует с количеством молекул CLDN6 на поверхности клеток мишени по данным проточной цитометрии (фиг. 2C). T-клетки CAR вызывали лизис, даже если на поверхности клеток мишени экспрессировалось очень небольшое количество молекул CLDN6 после трансфекции всего лишь 0,01 мкг CLDN6-РНК, которое с трудом обнаруживалось при проточной цитометрии.
Пример 4. Безопасность CLDN6-CAR-BBz
Для оценки безопасности CLDN6-CAR-BBz проводили скрининг клеточных линий. Для этой цели T-клетки, трансдуцированные CLDN6-CAR-BBz (фиг. 3A), культивировали вместе с комплектом CLDN6-положительных и CLDN6-отрицательных линий опухолевых клеток, происходящих из различных тканей (фиг. 3B), и анализировали распознавание и лизис клеток-мишеней методом анализа цитотоксичности xCELLigence (фиг. 3C). Параллельно определяли уровень экспрессии мРНК и белка CLDN6 в линиях клеток-мишеней методом qRT-PCR и проточной цитометрии, соответственно (фиг. 3D, E). Видно, что распознавание и лизис в линиях клеток-мишеней строго коррелирует с уровнями экспрессии мРНК и белка CLDN6.
Пример 5. Пролиферация T-клеток с CAR
Главной предпосылкой противоопухолевой эффективности T-клеток со встроенным CLDN6-CAR-BBz является их способность к пролиферации и персистированию у пациентов. Для того, чтобы установить, что T-клетки CLDN6-CAR эффективно пролиферируют в ответ на эктопическую экспрессию CLDN6 в iDC, проводили анализ на основе CFSE при совместном культивировании in vitro. T-клетки, трансдуцированные CLDN6-CAR, метили CFSE и культивировали совместно с аутологичными iDC, трансфицированными титрованными количествами РНК-липоплексов (РНК(LIP)), кодирующих CLDN6 или же контрольный антиген. Экспрессию CLDN6-CAR на поверхности T-клеток и CLDN6 на поверхности клеток-мишеней проверяли методом проточной цитометрии (фиг. 4A, B). После 5 дней совместного культивирования анализировали антиген-специфичную пролиферацию помеченных CFSE экспрессирующих CAR T-клеток CD4+ и CD8+ методом проточной цитометрии (фиг. 4C).
Опосредованная CLDN6-CAR зависимая от дозы пролиферация коррелирует с количеством трансфицируемой CLDN6-RNA(LIP), тогда как при трансфекции контрольной РНК(LIP) наблюдалась лишь пролиферация на уровне фона. Эти данные подтверждают, что после антиген-специфичной стимуляции индуцируется эффективная антиген-специфичная экспансия T-клеток с CLDN6-CAR-BBz.
Пример 6. Противоопухолевое действие CLDN6-CAR-BBz in vivo
После того, как была продемонстрирована опосредованная CAR антиген-специфичная индукция эффекторных функций in vitro, исследовали терапевтический потенциал T-клеток CLDN6-CAR-BBz человека in vivo на модели развитых опухолей-ксенотрансплантатов. Для этого иммунодефицитным мышам NOD Cg-Prkdcscid IL2rgtm1Wjl/SzJ (NSG) подкожно прививали экспрессирующие эндогенный CLDN6 клетки карциномы яичников человека (OV90). Затем несущим опухоли OV90 мышам NSG вводили внутривенно однократную дозу 1×107 T-клеток, трансдуцированных CLDN6-CAR или eGFP (примерно 5×108 T-клеток/кг) (фиг. 5A). CLDN6-CAR экспрессировался примерно у 16-18% T-клеток CD4+ и CD8+ человека (фиг. 5B). Отметим, что адоптивный перенос T-клеток с CLDN6-CAR приводил к полной регрессии больших опухолей со средним объемом 170 мм3 в день адоптивного переноса, тогда как в контрольной группе не наблюдалось противоопухолевого эффекта (фиг. 5C). Этот значительный противоопухолевый эффект коррелирует с персистенцией T-клеток CLDN6-CAR-BBz в периферической крови обработанных мышей (фиг. 5D).
Пример 7. Функциональность T-клеток с CAR при краткосрочном и долгосрочном культивировании in vitro
Поскольку воспроизводимое производство высококачественных препаратов клинического уровня T-клеток CAR является предпосылкой для клинических испытаний, GMP-процесс производства оптимизировали для достижения высокой эффективности трансдукции и достаточного количества и качества T-клеток, экспрессирующих CLDN6-CAR. Также упростили процедуру трансдукции за счет уменьшения числа трансдукций с двух до одной и сокращения времени культивирования ex vivo с 10 до 7 дней. Было показано, что T-клетки при коротком времени культивирования проявляют улучшение эффективности по сравнению с T-клетками, истощенными при длительной экспансии (PMID: 30030295). Соответственно, сокращение времени культивирования не только экономит время и снижает издержки, но и, что наиболее важно, должно приводить к повышению способности генно-инженерных T-клеток к экспансии и персистированию у пациентов.
Для того, чтобы сравнить противоопухолевое действие in vitro при краткосрочном (7 дней) и долгосрочном (10 дней) культивировании T-клеток CLDN6-CAR-BBz, проводили долгосрочный эксперимент со сфероидами. Оценка поверхностной экспрессии CAR методом проточной цитометрии показала почти сравнимые уровни экспрессии CAR, тогда как частота CAR-положительных T-клеток была немного ниже в образце T-клеток, культивируемых в течение 7 дней (фиг. 6A). Чтобы оценить способность к повторному уничтожению, T-клетки CAR культивировали совместно с экспрессирующими CLDN6 и eGFP опухолевыми сфероидами PA1-SC12-A2-eGFP и отслеживали уничтожение опухолевых сфероидов в реальном времени по сигналам eGFP на установке IncuCyte®. После полного уничтожения опухолевых сфероидов добавляли новые опухолевые сфероиды (фиг. 6B). Как оказалось, T-клетки CAR при краткосрочном культивировании обладают сравнимой способностью к повторному уничтожению, как у T-клеток при долгосрочном культивировании.
Пример 8. Функциональность размороженных GMP-произведенных T-клеток с CAR in vivo
Поскольку GMP-процесс трансдукции, предназначенный для клинического применения, дает криоконсервированные препараты T-клеток с CAR, то было очень важно проверить противоопухолевый потенциал размороженных T-клеток CLDN6-CAR-BBz, полученных на GMP-предприятии. Кроме того, поскольку окончательный GMP-процесс производства можно сократить (собирать через 7 дней вместо 10-ти), то такую модификацию в окончательной методике следовало оценить путем проведения исследования in vivo. Наиболее важно то, что размороженные T-клетки с CLDN6-CAR-BBz человека проявляли существенное противоопухолевое действие, сравнимое со свежеполученными T-клетками с CAR, и устраняли развитые опухоли со средним объемом 160 мм3 на модели ксенотрансплантатов карциномы яичников (фиг. 7A). Кроме того, T-клетки CAR, собранные через 7 или 10 дней и проявляющие одинаковую поверхностную экспрессию CAR (фиг.7B), сравнивали по их противоопухолевому действию в этом эксперименте (фиг. 7C). В соответствии с результатами долгосрочного эксперимента с опухолевыми сфероидами, оба препарата T-клеток CAR вызывали полное устранение опухолей со сравнимой кинетикой. Противоопухолевые реакции обоих препаратов коррелировали с персистенцией T-клеток CLDN6-CAR-BBz в периферической крови через две недели после адоптивного переноса (фиг. 7D).
Пример 9. Повышенная персистенция T-клеток, трансдуцированных CLDN6-CAR-BBz
Клинический успех терапии с адоптивным переносом реагирующих на опухоли T-клеток также положительно коррелирует с персистенцией этих клеток in vivo (Robbins et al. (2004) J Immunol. 173(12): 7125-30; Huang et al. (2005) 28(3): 258-67). Поэтому мы проверили, может ли контакт с антигеном in situ повысить персистенцию T-клеток с CLDN6-CAR-BBz in vivo. Поскольку модель ксенотрансплантатов недостаточна для изучения долгосрочной персистенции T-клеток CAR из-за реакции "трансплантат против хозяина" T-клеток человека к тканям мыши, а также отсутствия конкурирующих эндогенных иммунных клеток, то исследования персистенции T-клеток CLDN6-CAR-BBz проводили на модели у сингенных мышей. При этом проводили адоптивный перенос трансдуцированных CAR мышиных T-клеток, экспрессирующих люциферазу вместе с CLDN6-CAR-BBz, подвергнутым легкому облучению (2,5 Гр) мышам, а затем повторно вводили РНК(LIP), кодирующие либо CLDN6, либо контрольный антиген, и последовательно отслеживали экспансию популяции T-клеток с CAR методом биолюминесцентной визуализации (фиг. 8A).
T-клетки с CLDN6-CAR-BBz способны персистировать (более 3 месяцев) in vivo после повторной вакцинации антигеном CAR в составе липосом in vivo. В контрольной группе T-клетки с CAR со временем исчезают, тогда как при повторной стимуляции антиген-специфичные T-клетки CAR пролиферируют после каждой обработки РНК(LIP), даже после 3-4-недельного перерыва в обработке после 3-го и 4-го повторного цикла (фиг. 8B и 8C). Эти данные свидетельствуют, что технология РНК(LIP) фирмы BioNTech поддерживает адекватную активацию и пролиферацию T-клеток CLDN6-CAR-BBz, обеспечивая естественную костимуляцию in situ, что и ведет к повышенной персистенции экспансировавших in vivo T-клеток с CLDN6-CAR-BBz.
Пример 10. Усиление противоопухолевой активности у размножаемых in vivo T-клеток с CLDN6-CAR-BBz
После того, как была продемонстрирована опосредованная CAR антиген-специфичная экспансия и персистенция, возникает вопрос, будут ли размножаемые in vivo T-клетки CLDN6-CAR-BBz также проявлять повышенный противоопухолевый потенциал по сравнению с таковыми без размножения. Для этого мышам Balb/c инокулировали клетки экспрессирующей CLDN6dim линии CT26 карциномы толстой кишки, а затем вводили умеренную дозу 1×106 трансдуцированных CLDN6-CAR-BBz или контрольным CAR-BBz мышиных T-клеток (3-4×105 экспрессирующих CAR T-клеток). После внутривенного введения T-клеток CAR мыши получали дополнительную вакцинацию 20 мкг РНК(LIP), кодирующей либо полноразмерный CLDN6, либо полноразмерный контрольный антиген (фиг. 9A). У животных, получавших контрольный CAR-BBz, а затем CLDN6-РНК(LIP), не наблюдалось никакого противоопухолевого эффекта, а у мышей, получавших умеренную дозу T-клеток с CLDN6-CAR-BBz в комбинации с посторонней контрольной РНК(LIP), отмечалась лишь небольшая регрессия опухолей. Однако у мышей, получавших умеренную дозу T-клеток CAR в сочетании с вакцинацией CLDN6-РНК(LIP) для размножения in vivo T-клеток с CLDN6-CAR-BBz, проявлялось заметное усиление регрессии опухолей (фиг. 9B).
Пример 11. Восстановление противоопухолевого действия при низких дозах размножаемых in vivo T-клеток с CAR
Помимо возможности размножать T-клетки CAR in vivo на основе РНК(LIP) для усиления текущего противоопухолевого ответа также можно показать, что эта технология хорошо подходит для восстановления противоопухолевого потенциала при недостаточных дозах T-клеток CAR. Несущим опухоли мышам вводили в 10 раз меньшую дозу T-клеток CAR, чем это нужно для регрессии опухолей (фиг. 10A). В то время как у мышей, получавших контрольную РНК(LIP), наблюдалось разрастание опухолей, у всех животных, получавших РНК(LIP), кодирующую антиген CAR, после первоначальной трансплантации отмечалась регрессия опухолей (фиг. 10C). Соответственно, частота трансплантированных T-клеток CAR в периферической крови была значительно выше после вакцинации (фиг. 10D). Компенсация недостаточности дозы T-клеток CAR после трансплантации путем дополнительной обработки РНК(LIP) для их размножения in vivo может быть очень полезной, по крайней мере при двух различных сценариях: 1) низкий выход произведенного по GMP препарата T-клеток с CAR (напр., вследствие низкого количества лимфоцитов при исходном аферезе или по другим независимым причинам) или 2) избежание SAEs за счет снижения начальной дозы T-клеток CAR (особенно если известно, что требуемый CAR вызывает токсичность или в случае первой дозы при исследованиях с возрастанием дозы для человека).
Содержание всевозможных патентов, патентных заявок и публикаций, цитируемых здесь, тем самым включено сюда путем ссылки во всей полноте. Хотя это изобретение было изложено со ссылкой на конкретные воплощения, однако другие специалисты в данной области могут разработать и другие воплощения и варианты этого изобретения, не отходящие от истинной сути и не выходящие за рамки изобретения. Предполагается, что прилагаемая формула изобретения должна охватывать все такие воплощения и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BioNTech Cell & Gene Therapies GmbH
<120> CHIMERIC ANTIGEN RECEPTOR-MODIFIED CELLS FOR THE TREATMENT OF
CLDN6 EXPRESSING CANCER
<130> 674-260 PCT2
<150> PCT/EP2019/053156
<151> 2019-02-08
<160> 40
<170> PatentIn version 3.5
<210> 1
<211> 220
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Ser Ala Gly Met Gln Ile Leu Gly Val Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Gly Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Val Ala Leu Phe Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp
100 105 110
Ser Lys Ala Arg Leu Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ala Ile Ile
130 135 140
Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
180 185 190
Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
195 200 205
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215 220
<210> 2
<211> 220
<212> PRT
<213> Homo sapiens
<220>
<221> VARIANT
<222> (143)..(143)
<223> human claudin 6 I143V polymorphism
<400> 2
Met Ala Ser Ala Gly Met Gln Ile Leu Gly Val Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Gly Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Val Ala Leu Phe Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp
100 105 110
Ser Lys Ala Arg Leu Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ala Val Ile
130 135 140
Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
180 185 190
Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
195 200 205
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215 220
<210> 3
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH sequence
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ile Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Tyr Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 4
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL sequence
<400> 4
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Leu His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Val Tyr Ser
35 40 45
Thr Ser Asn Leu Pro Ser Gly Val Pro Ala Arg Phe Gly Gly Ser Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ile Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH sequence
<400> 5
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Phe Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 6
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL sequence
<400> 6
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Cys Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 7
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH sequence
<400> 7
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Ile Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Phe Tyr Cys
85 90 95
Ala Arg Asp Phe Gly Tyr Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 8
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL sequence
<400> 8
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Thr Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 9
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH sequence
<400> 9
Glu Val Gln Leu Gln Gln Ser Arg Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Leu Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Tyr Val Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 10
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL sequence
<400> 10
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Asn Tyr Met His
20 25 30
Trp Phe Gln Leu Lys Pro Gly Thr Ser Pro Lys Leu Leu Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Asn Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 11
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Any amino acid, preferably Leu or Phe, more preferably Leu
<400> 11
Xaa Gly Xaa Val Xaa
1 5
<210> 12
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Any amino acid, preferably Leu or Phe, more preferably Leu
<400> 12
Asp Xaa Gly Xaa Val Xaa
1 5
<210> 13
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Any amino acid, preferably Leu or Phe, more preferably Leu
<400> 13
Xaa Gly Xaa Val Xaa Asp
1 5
<210> 14
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Any amino acid, preferably Leu or Phe, more preferably Leu
<400> 14
Asp Xaa Gly Xaa Val Xaa Asp
1 5
<210> 15
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Any amino acid, preferably an aromatic amino acid, more
preferably Phe or Tyr, most preferably Tyr
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Any amino acid, preferably Leu or Phe, more preferably Leu
<400> 15
Ala Arg Asp Xaa Gly Xaa Val Xaa Asp Tyr
1 5 10
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR1 sequence
<400> 16
Gly Tyr Ser Phe Thr Gly Tyr Thr
1 5
<210> 17
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VH CDR2 sequence
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Any amino acid, preferably Thr, Ser or Ile, most preferably Thr
<400> 17
Ile Asn Pro Tyr Asn Gly Gly Xaa
1 5
<210> 18
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Any amino acid, preferably Ser or Asn, most preferably Ser
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Any amino acid, preferably Tyr, Ser, Ile, Asn or Thr, more
preferably Tyr, Ser, or Asn, most preferably Asn
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably Ser or Tyr, more preferably Tyr
<400> 18
Arg Xaa Xaa Xaa Pro
1 5
<210> 19
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Any amino acid, preferably Ser or Asn, most preferably Ser
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably Tyr, Ser, Ile, Asn or Thr, more
preferably Tyr, Ser, or Asn, most preferably Asn
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Any amino acid, preferably Ser or Tyr, more preferably Tyr
<400> 19
Gln Arg Xaa Xaa Xaa Pro Pro
1 5
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL CDR3 sequence
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably Ser or Asn, most preferably Ser
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Any amino acid, preferably Tyr, Ser, Ile, Asn or Thr, more
preferably Tyr, Ser, or Asn, most preferably Asn
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Any amino acid, preferably Ser or Tyr, more preferably Tyr
<400> 20
Gln Gln Arg Xaa Xaa Xaa Pro Pro Trp Thr
1 5 10
<210> 21
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL CDR1 sequence
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Any amino acid, preferably Ser or Asn, most preferably Ser
<400> 21
Ser Ser Val Xaa Tyr
1 5
<210> 22
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL CDR2 sequence
<400> 22
Ser Thr Ser
1
<210> 23
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL Sequence
<400> 23
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Gly Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 24
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody VL Sequence
<400> 24
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Ser Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 25
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Signal peptide of human IgG
<400> 25
Met Asp Trp Ile Trp Arg Ile Leu Phe Leu Val Gly Ala Ala Thr Gly
1 5 10 15
Ala His Ser
<210> 26
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> GS-Linker
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 27
<211> 47
<212> PRT
<213> Artificial Sequence
<220>
<223> Human CD8 hinge domain
<400> 27
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr
35 40 45
<210> 28
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Human CD8 transmembrane domain
<400> 28
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
1 5 10 15
Val Ile Thr Leu Tyr Cys
20
<210> 29
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Human CD8 hinge and transmembrane domain
<400> 29
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys
65
<210> 30
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> Human 4-1BB signalling domain
<400> 30
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 31
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Human CD3zeta signalling domain
<400> 31
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 32
<211> 235
<212> PRT
<213> Artificial Sequence
<220>
<223> human IgG1 hinge-Ch2-CD3 Fc domain
<400> 32
Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
20 25 30
Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val
35 40 45
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
50 55 60
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
65 70 75 80
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
85 90 95
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
100 105 110
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
115 120 125
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
130 135 140
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
145 150 155 160
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
165 170 175
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
180 185 190
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
195 200 205
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
210 215 220
Leu Ser Leu Ser Pro Gly Lys Lys Asp Pro Lys
225 230 235
<210> 33
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> human CD28 transmembrane and signalling domain
<400> 33
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
20 25 30
Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
35 40 45
Pro Thr Arg Lys His Tyr Gln Ala Tyr Ala Ala Ala Arg Asp Phe Ala
50 55 60
Ala Tyr Arg Ser
65
<210> 34
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> human CD28 transmembrane domain
<400> 34
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 35
<211> 244
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CLDN6 scFv
<400> 35
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Phe Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser
130 135 140
Val Ser Pro Gly Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Val Ser Tyr Met His Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Leu Ser Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Arg Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
195 200 205
Val Ala Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn
210 215 220
Tyr Pro Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
225 230 235 240
Ser Asp Pro Ala
<210> 36
<211> 486
<212> PRT
<213> Artificial Sequence
<220>
<223> CLDN6-CAR
<400> 36
Met Asp Trp Ile Trp Arg Ile Leu Phe Leu Val Gly Ala Ala Thr Gly
1 5 10 15
Ala His Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Gly Tyr Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu
50 55 60
Glu Trp Ile Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Asp Tyr Gly Phe Val Leu Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ser
145 150 155 160
Ile Met Ser Val Ser Pro Gly Glu Lys Val Thr Ile Thr Cys Ser Ala
165 170 175
Ser Ser Ser Val Ser Tyr Met His Trp Phe Gln Gln Lys Pro Gly Thr
180 185 190
Ser Pro Lys Leu Ser Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val
195 200 205
Pro Ala Arg Phe Ser Gly Arg Gly Ser Gly Thr Ser Tyr Ser Leu Thr
210 215 220
Ile Ser Arg Val Ala Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln
225 230 235 240
Arg Ser Asn Tyr Pro Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu
245 250 255
Ile Lys Arg Ser Asp Pro Ala Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 37
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide
<400> 37
cttatctcct tcgcagtgca g 21
<210> 38
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide
<400> 38
aaggagggcg atgacacaga g 21
<210> 39
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide
<400> 39
tgacactggc aaaacaatgc a 21
<210> 40
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide
<400> 40
ggtccttttc accagcaagc t 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2816850C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| ВАРИАНТЫ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-2 (IL2R) И ИНТЕРЛЕЙКИНА-2 (IL2) ДЛЯ СПЕЦИФИЧЕСКОЙ АКТИВАЦИИ ИММУННЫХ ЭФФЕКТОРНЫХ КЛЕТОК | 2020 |
|
RU2832154C2 |
| ГЛИКАНЗАВИСИМЫЕ ИММУНОТЕРАПЕВТИЧЕСКИЕ МОЛЕКУЛЫ | 2016 |
|
RU2754661C2 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2798990C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ B-КЛЕТОК | 2013 |
|
RU2766608C2 |
| ВВЕДЕНИЕ СКОНСТРУИРОВАННЫХ Т-КЛЕТОК ДЛЯ ЛЕЧЕНИЯ РАКА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2017 |
|
RU2757308C2 |
| НОВЫЕ АНТИ-HLA-А2 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2805674C2 |
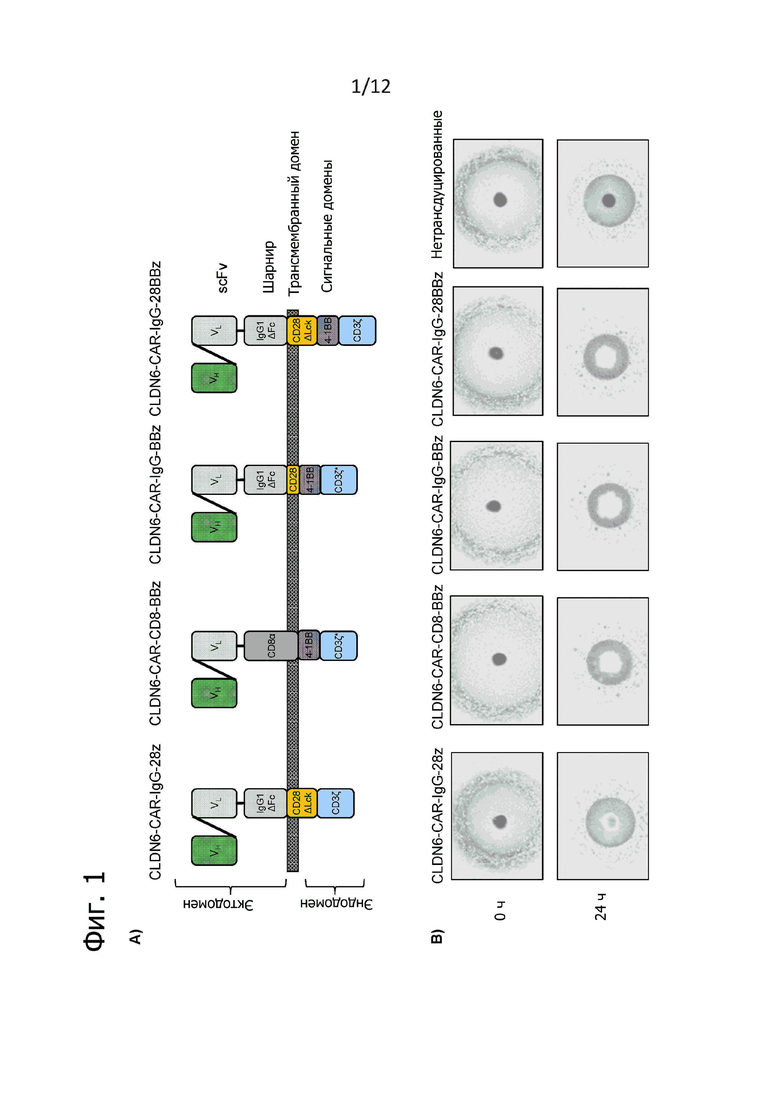
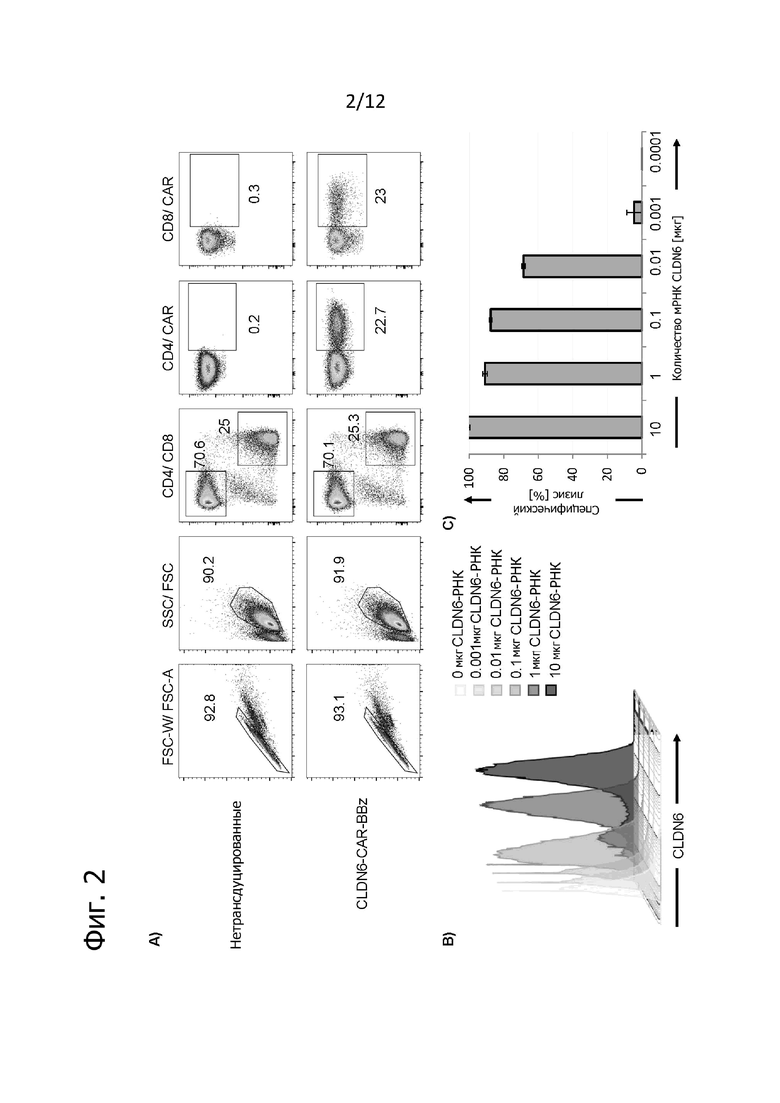

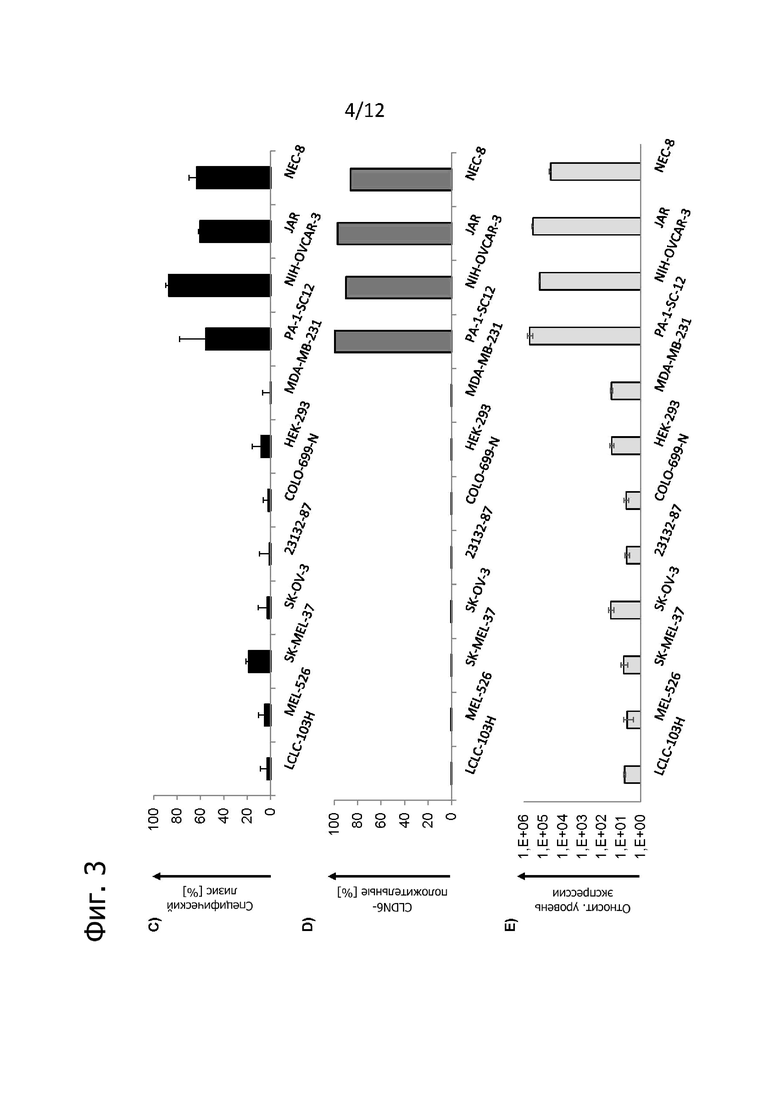
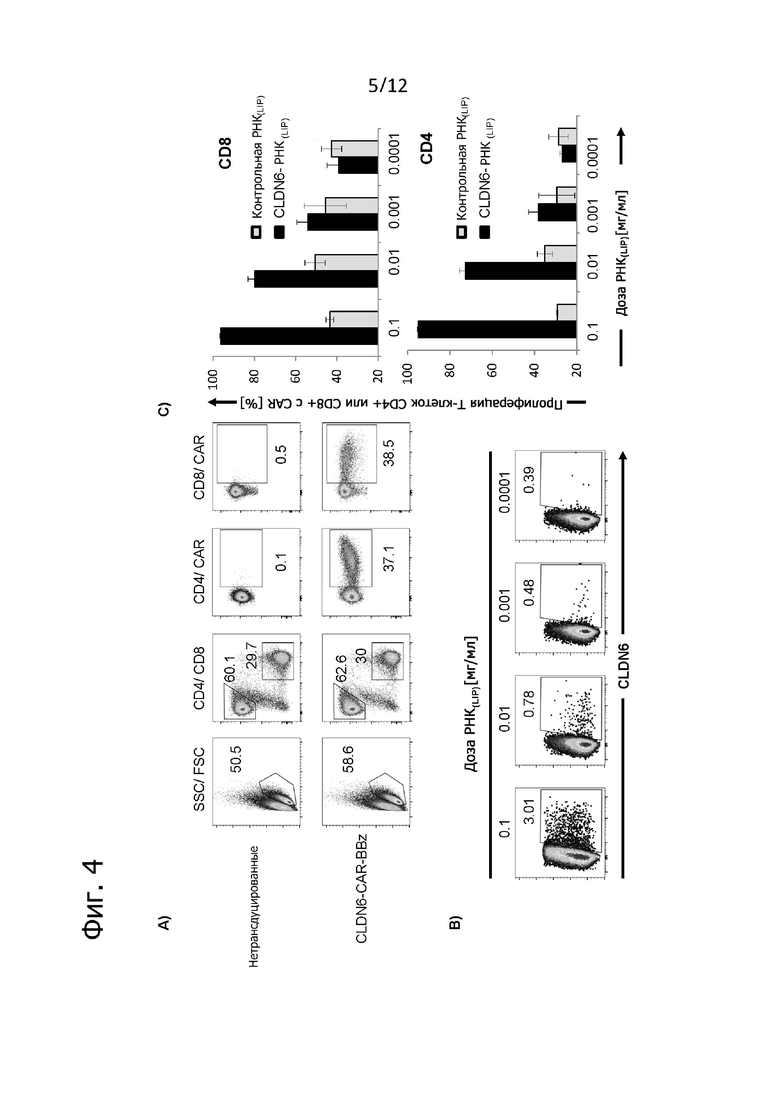
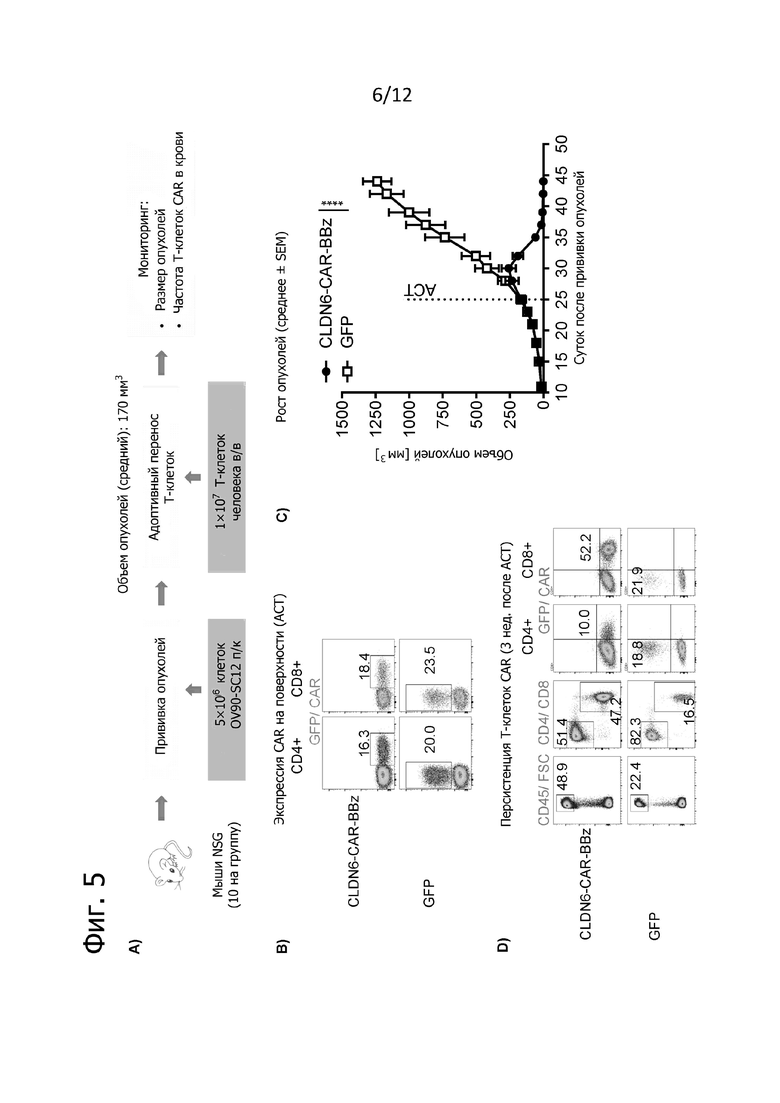
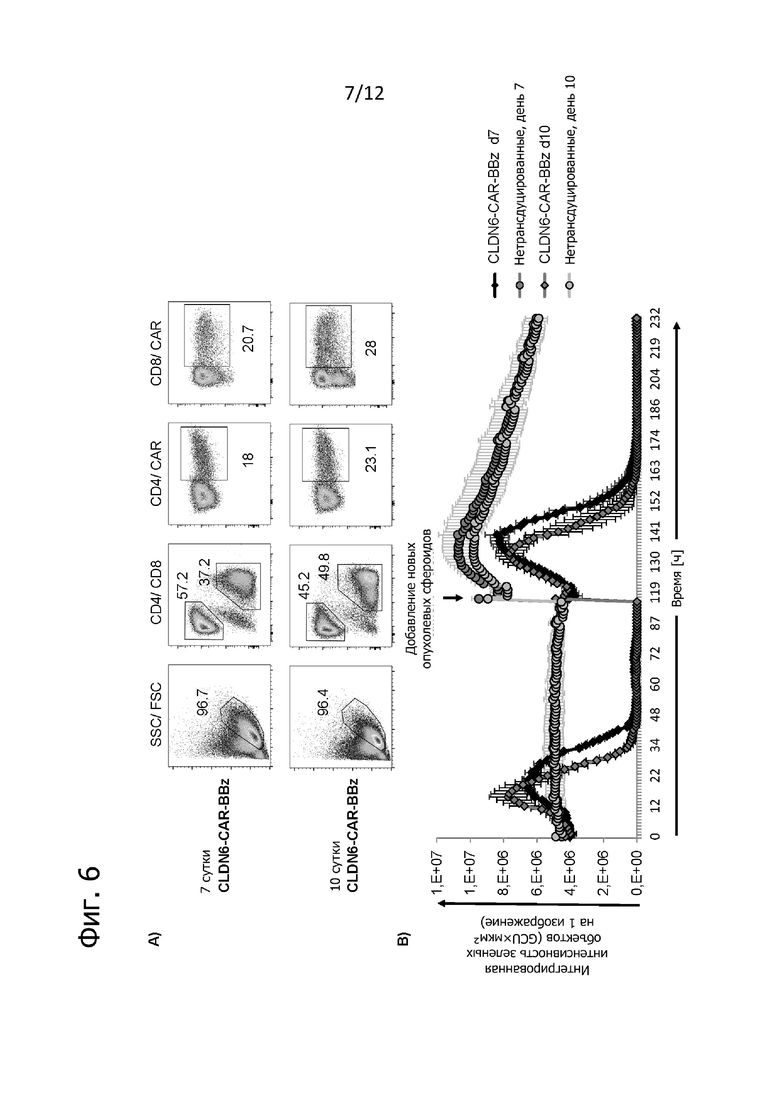
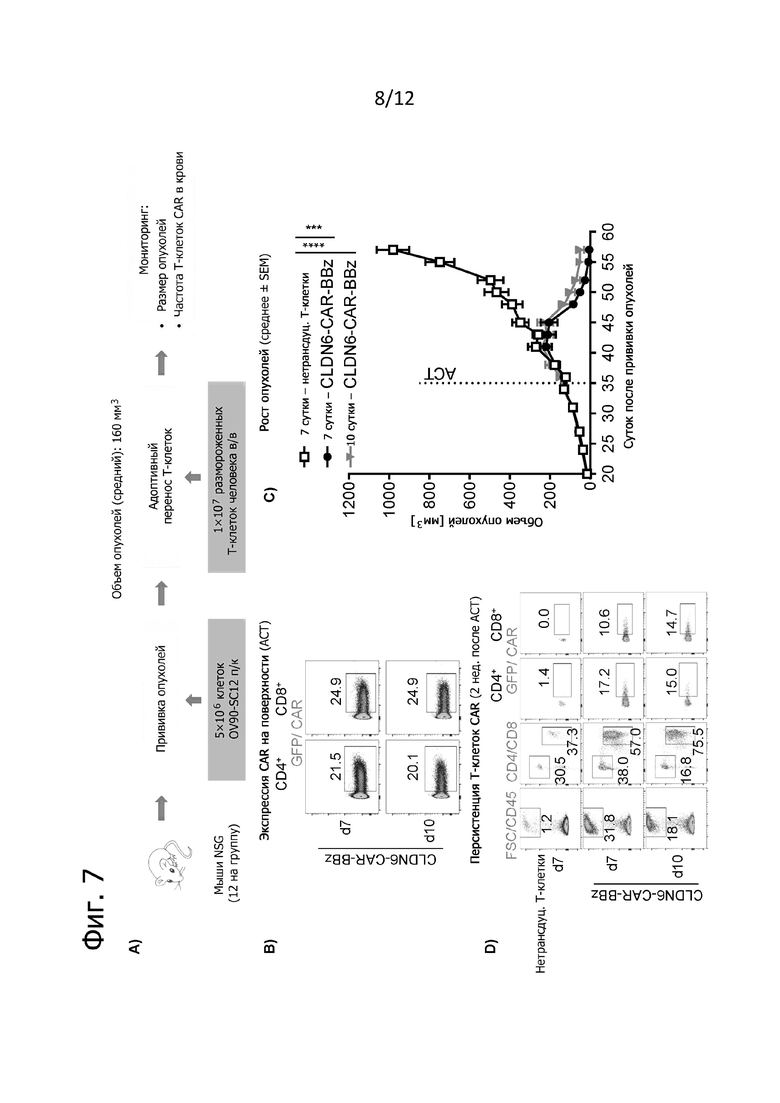
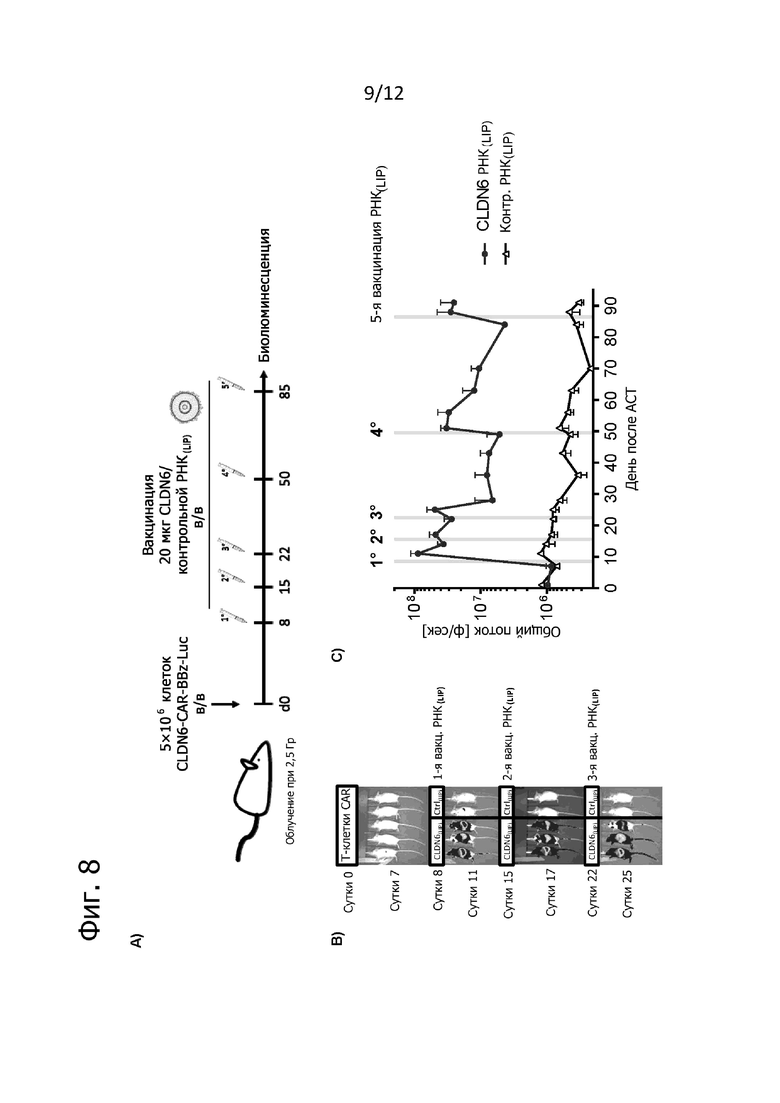
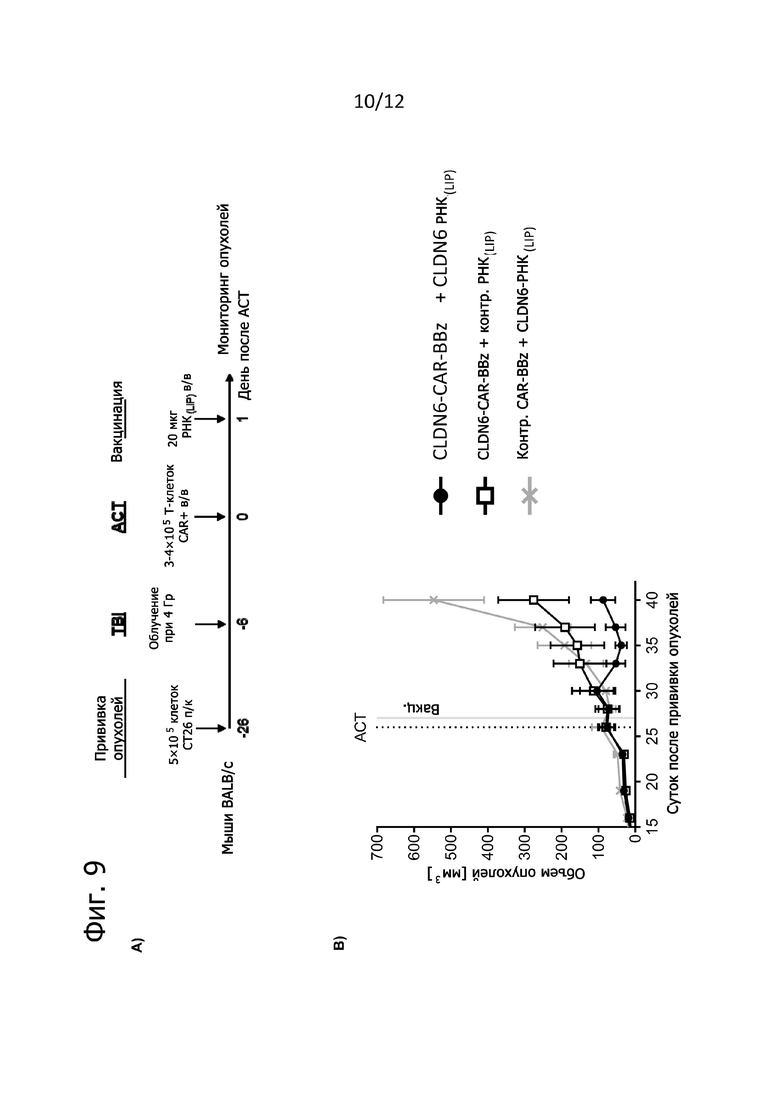
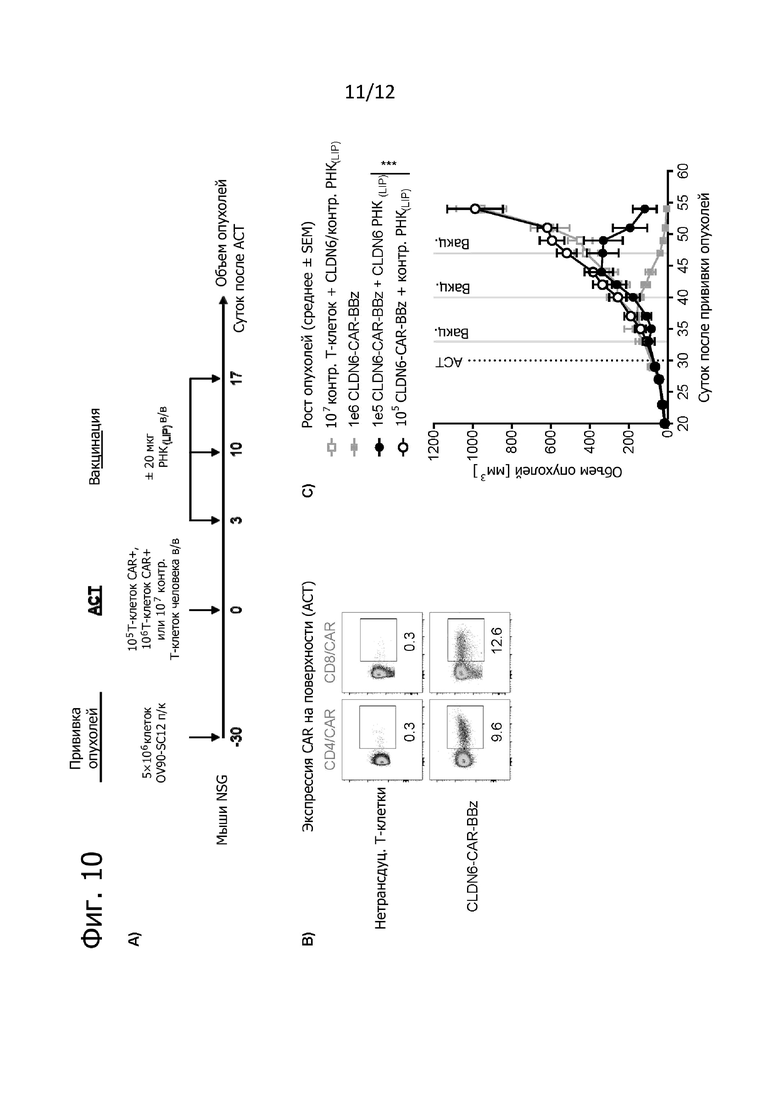

Изобретение относится к области биотехнологии, а именно к молекуле химерного антигенового рецептора (CAR), распознающей CLDN6, набору, ее содержащей, а также к нуклеиновой кислоте, ее кодирующей. Также раскрыты вектор, клетка и популяция клеток, содержащие вышеуказанную нуклеиновую кислоту. Изобретение эффективно для лечения заболевания, связанного с экспрессией CLDN6, а также для стимуляции клеточно-опосредованного иммунного ответа на экспрессирующую CLDN6 популяцию целевых клеток или ткань у субъекта. 10 н. и 41 з.п. ф-лы, 10 ил., 11 пр.
1. Молекула химерного антигенового рецептора (CAR) распознающая CLDN6, и включающая по меньшей мере следующее:
i) антигенсвязывающий домен для CLDN6;
ii) трансмембранный домен; и
iii) внутриклеточный домен, который включает костимулирующий домен 4-1BB и сигнальный домен CD3-дзета,
где молекула CAR содержит аминокислотную последовательность SEQ ID NO: 36
2. Нуклеиновая кислота, кодирующая молекулу CAR по п.1,
где молекула CAR распознает CLDN6, и включает по меньшей мере следующее:
i) антигенсвязывающий домен для CLDN6;
ii) трансмембранный домен; и
iii) внутриклеточный домен, который включает костимулирующий домен 4-1BB и сигнальный домен CD3-дзета,
где молекула CAR содержит аминокислотную последовательность SEQ ID NO: 36.
3. Нуклеиновая кислота по п. 2, которая представляет собой ДНК или РНК.
4. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п. 2 или 3.
5. Вектор по п. 4, при этом вектор выбран из группы, состоящей из ДНК-вектора, РНК-вектора, плазмиды, лентивирусного вектора, аденовирусного вектора и ретровирусного вектора.
6. Вектор по п. 4 или 5, дополнительно включающий промотор.
7. Вектор по п. 6, при этом промотор выбран из промотора EF-1, промотора гена IE CMV, промотора EF-1α, промотора убиквитина C или промотора фосфоглицераткиназы (PGK).
8. T-клетка для распознавания целевой клетки, экспрессирующей CLDN6, содержащая:
молекулу CAR по п.1;
нуклеиновую кислоту по п. 2 или 3; или
вектор по любому из пп. 4-7.
9. Т-клетка по п. 8, которая генетически модифицирована для экспрессии CAR.
10. Т-клетка по п. 8 или 9, которая представляет собой цитотоксический T-лимфоцит (CTL).
11. Т-клетка по любому из пп. 8-10, которая представляет собой T-клетку CD8+.
12. Т-клетка по любому из пп. 8-11, которая представляет собой человеческую клетку.
13. Популяция Т-клеток для распознавания целевых клеток, экспрессирующих CLDN6, включающая множество Т-клеток по любому из пп. 8-12.
14. Т-клетка по любому из пп. 8-12 или популяция Т-клеток по п. 13, при этом клетки лишены экспрессии или имеют низкий уровень экспрессии функционального TCR или функционального HLA.
15. Способ получения Т-клетки, включающий введение нуклеиновой кислоты по п. 2 или 3 либо вектора по любому из пп. 4-7 в Т-клетку в условиях, при которых экспрессируются молекулы CAR.
16. Способ стимуляции клеточно-опосредованного иммунного ответа на экспрессирующую CLDN6 популяцию целевых клеток или ткань у субъекта, который включает предоставление субъекту эффективного количества Т-клетки по любому из пп. 8-12 и 14 либо популяции Т-клеток по п. 13 или 14.
17. Способ лечения заболевания, связанного с экспрессией CLDN6, включающий предоставление субъекту эффективного количества Т-клетки по любому из пп. 8-12 и 14 либо популяции Т-клеток по п. 13 или 14.
18. Способ по п. 17, при этом заболевание, связанное с экспрессией CLDN6, выбрано из группы, состоящей из пролиферативных заболеваний, предраковых состояний, рака и не связанных с раком показаний, связанных с экспрессией CLDN6.
19. Способ по п. 18, при этом рак выбран из группы, состоящей из рака яичников, рака легких, рака желудка, рака молочной железы, рака печени, рака поджелудочной железы, рака кожи, меланомы, рака головы и шеи, саркомы, рака желчных протоков, почечно-клеточного рака и рака мочевого пузыря.
20. Способ обеспечения противоопухолевого иммунитета у субъекта, включающий предоставление субъекту эффективного количества Т-клетки по любому из пп. 8-12 и 14 либо популяции Т-клеток по п. 13 или 14.
21. Способ по п. 20, при этом опухоль представляет собой опухоль, экспрессирующую CLDN6.
22. Способ по любому из пп. 16-21, при этом Т-клетка или популяции Т-клеток являются аутологичными или аллогенными для субъекта.
23. Способ по любому из пп. 16-22, который дополнительно включает введение средства, повышающего эффективность Т-клетки или популяции Т-клеток.
24. Способ по п. 23, при этом такое средство выбрано из одного или нескольких из:
ингибиторов протеинфосфатаз;
ингибиторов киназ;
цитокинов;
ингибиторов иммуноингибирующих молекул; или
средств, снижающих уровень или активность клеток Treg.
25. Способ по любому из пп. 16-24, дополнительно включающий стадию контактирования Т-клетки или популяции Т-клеток с молекулами родственного антигена, связывающегося с антигенсвязывающим доменом для CLDN6.
26. Способ по п. 25, при этом молекулы родственного антигена выбраны из группы, состоящей из CLDN6 или его фрагментов либо вариантов CLDN6 или фрагментов CLDN6.
27. Способ по п. 25 или 26, при этом Т-клетка или популяции Т-клеток контактируют с молекулами родственного антигена в таких условиях, что происходит размножение и/или активация Т-клетки или популяции Т-клеток.
28. Способ по любому из пп. 25-27, при этом стадия контактирования Т-клетки или популяции Т-клеток с молекулами родственного антигена имеет место in vivo или ex vivo.
29. Способ по любому из пп. 25-28, который включает стадию введения субъекту молекул родственного антигена или кодирующей его нуклеиновой кислоты.
30. Способ по п. 29, при этом нуклеиновая кислота, кодирующая молекулы родственного антигена, экспрессируется в клетках субъекта, обеспечивая молекулы родственного антигена.
31. Способ по п. 30, при этом экспрессия молекул родственного антигена происходит на поверхности клетки.
32. Способ по любому из пп. 29-31, при этом нуклеиновая кислота, кодирующая молекулы родственного антигена, временно экспрессируется в клетках субъекта.
33. Способ по любому из пп. 29-32, при этом нуклеиновая кислота, кодирующая молекулы родственного антигена, представляет собой РНК.
34. Способ по любому из пп. 16-33, при этом Т-клетка или популяции Т-клеток и/или молекулы родственного антигена или кодирующая его нуклеиновая кислота вводятся системно.
35. Способ по п. 34, при этом после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, происходит экспрессия нуклеиновой кислоты, кодирующей молекулы родственного антигена, в селезенке.
36. Способ по п. 34 или 35, при этом после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, происходит экспрессия нуклеиновой кислоты, кодирующей молекулы родственного антигена, в антигенпрезентирующих клетках, предпочтительно в профессиональных антигенпрезентирующих клетках.
37. Способ по п. 36, при этом антигенпрезентирующие клетки выбраны из группы, состоящей из дендритных клеток, макрофагов и B-клеток.
38. Способ по любому из пп. 34-37, при этом после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, совсем или почти не происходит экспрессии нуклеиновой кислоты, кодирующей молекулы родственного антигена, в легких и/или печени.
39. Способ по любому из пп. 34-38, при этом после системного введения нуклеиновой кислоты, кодирующей молекулы родственного антигена, экспрессия нуклеиновой кислоты, кодирующей молекулы родственного антигена, в селезенке по меньшей мере в 5 раз превышает уровень экспрессии в легких.
40. Способ по любому из пп. 29-39, при этом нуклеиновая кислота, кодирующая молекулы родственного антигена, входит в состав носителя для доставки.
41. Способ по п. 40, при этом носитель для доставки включает частицы.
42. Способ по п. 40 или 41, при этом носитель для доставки включает по меньшей мере один липид.
43. Способ по п. 42, при этом такой по меньшей мере один липид включает по меньшей мере один катионный липид.
44. Способ по п. 42 или 43, при этом липид образует комплекс с и/или инкапсулирует нуклеиновую кислоту, кодирующую молекулы родственного антигена.
45. Способ по любому из пп. 42-44, при этом липид содержится в везикулах, инкапсулирующих нуклеиновую кислоту, кодирующую молекулы родственного антигена.
46. Способ по любому из пп. 29-45, при этом нуклеиновая кислота, кодирующая молекулы родственного антигена, входит в состав липосом.
47. Т-клетка по любому из пп. 8-12 и 14, популяция Т-клеток по п. 13 или 14 либо способ по любому из пп. 15-46, при этом Т-клетка или популяция Т-клеток представляют собой экспрессирующую CAR Т-клетку или экспрессирующую CAR популяцию Т-клеток.
48. Молекулы CAR по п.1, нуклеиновая кислота по п. 2 или 3, вектор по любому из пп. 4-7, Т-клетка по любому из пп. 8-12, 14 и 47 или популяция Т-клеток по любому из пп. 13, 14 и 47 для применения при лечении заболевания, экспрессирующего CLDN6.
49. Набор для использования при получении Т-клетки, характеризующийся тем, что одним из его компонентов является молекула CAR по п.1, нуклеиновая кислота по п. 2 или 3, вектор по любому из пп. 4-7, Т-клетка по любому из пп. 8-12, 14 и 47 или популяция Т-клеток по любому из пп. 13, 14 и 47.
50. Набор для использования по п. 49, дополнительно содержащий молекулы родственного антигена, связывающегося с антигенсвязывающим доменом для CLDN6, или кодирующей его нуклеиновой кислоты.
51. Набор для использования по п. 49 или 50, который дополнительно содержит инструкции по применению набора в способе по любому из пп. 15-47.
| WO 2016150400 A1, 29.09.2016 | |||
| WO 2015150327 A1, 08.10.2015 | |||
| WO 2016180778 A1, 17.11.2016 | |||
| SABA GHASSEMI et al., Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells, Cancer Immunol Res., 2018; 6(9), pp | |||
| СТРЕЛОЧНЫЙ СТЫК ДЛЯ ВИНЬОЛЕВСКИХ РЕЛЬСОВ | 1914 |
|
SU1100A1 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2676731C2 |
Авторы
Даты
2024-09-03—Публикация
2020-02-05—Подача