ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к порошку для перорального приема, включающему деферазирокс в качестве активного ингредиента, и способу его приготовления, и более конкретно - к содержащему деферазирокс порошку для перорального приема, который содержит достаточное количество активного ингредиента, чрезвычайно удобен при приеме внутрь, не вызывает значительных опасений в отношении побочного действия и стабильности и характеризуется отличной биодоступностью и отличными свойствами частиц порошка, и способу его приготовления.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Деферазирокс, представляющий собой принимаемое перорально активное комплексообразующее средство, связывающее железо при лечении перегрузки железом, является лекарственным средством, которое назначают для лечения гемахроматоза - наиболее часто встречающегося типа перегрузки железом или назначают при лечении перегрузки железом при трансфузионно-зависимых анемиях, требующих большого числа гемотрансфузий (например, при большой талассемии, талассемии и серповидно-клеточной анемии).
[0003] При гемохроматозе - наследственном расстройстве, которое является наиболее распространенной формой заболевания, связанного с избытком железа в организме, происходит слишком активное всасывание железа и накапливание его организмом. Избыток железа накапливается в органах и повреждает их. Без лечения заболевание может вывести из строя эти органы.
[0004] Пациенты с трансфузионно-зависимыми анемиями нуждаются в терапии комплексообразующими средствами для удаления накопленного вследствие большого числа гемотрансфузий железа из организма.
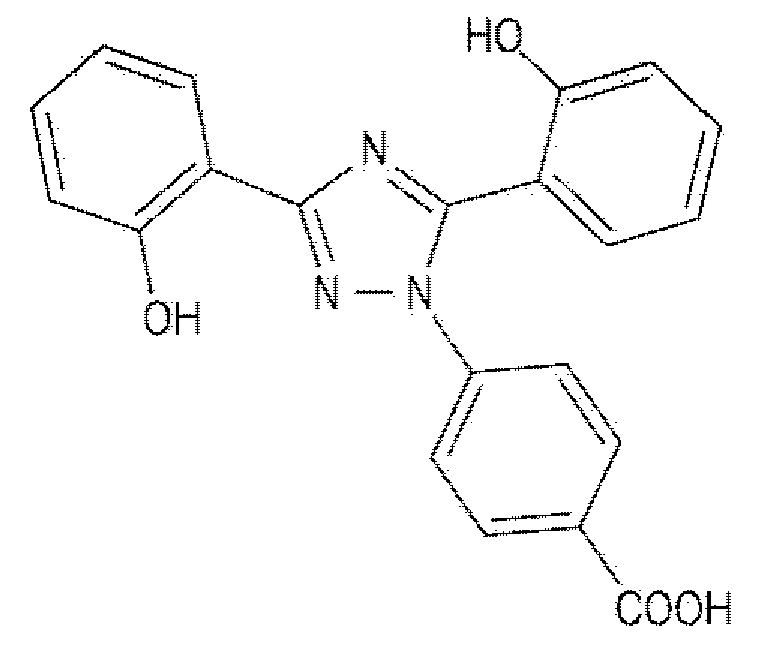
[0005] Деферазирокс имеет структуру, представленную Формулой 1 ниже, и его соли и его кристаллические формы раскрыты в Патентном литературном источнике 1.
[0006] [Формула 1]
[0007]
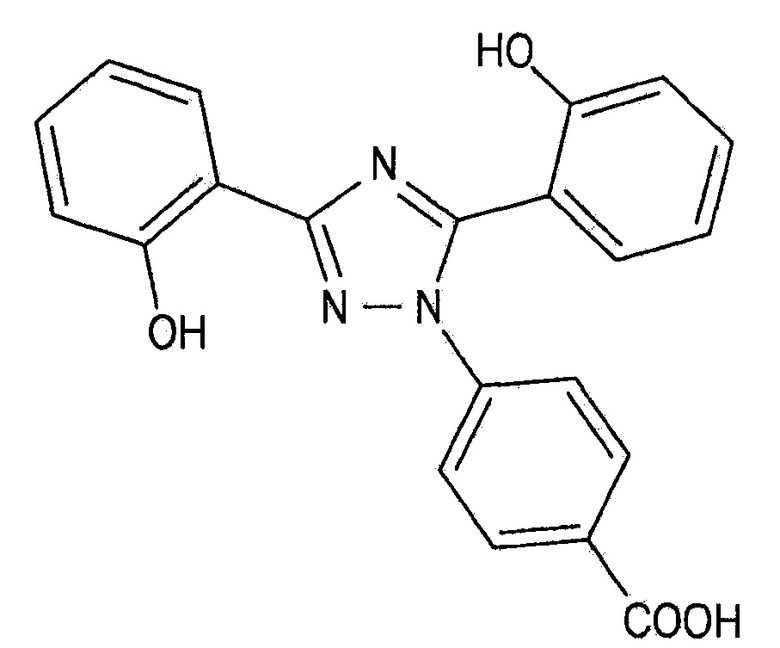
[0008] В общем случае, при лечении талассемии применяется большая суточная доза деферазирокса, например, от 5 мг/кг (веса тела)/в день до 40 мг/кг (веса тела)/в день для взрослых или детей. Из-за такой большой дозы, при составлении таблетки, содержащей суточную дозу, размер такой таблетки слишком велик для проглатывания взрослыми или детьми, что делает невозможным составление таких таблеток. Чтобы решить эту проблему были разработаны диспергируемые таблетки для перорального приема, которые содержат суточную дозу и удобны для приема взрослыми и детьми (Патентный литературный источник 2). Содержание фармацевтических добавок в диспергируемой таблетке очень высоко в пересчете на общий вес таблетки.
[0009] Диспергируемые таблетки в настоящее время можно приобрести в продаже под торговым названием Exjade® (Эксиджад) диспергируемая таблетка 125 мг, 250 мг и 500 мг (NOVARTIS), при этом общий вес таблетки, содержащей 500 мг деферазирокса свободную кислоту, составляет 1700 мг, где процентная доля добавок очень высока. Несмотря на то, что применяемые добавки являются фармацевтически приемлемыми, у некоторых чувствительных к ним людей эти добавки могут вызывать нежелательные явления, такие как расстройство пищеварения, например, вздутие живота, метеоризм и т.п., поэтому предпочтительно использовать добавки в малых количествах.
[0010] Кроме того, было установлено, что при приготовлении суспензии в водной фазе (например, воде) из диспергируемых таблеток для лучшего усвоения, активный ингредиент имеет плохую стабильность, поэтому, если пациент в силу разных причин принимает суспензию, приготовленную заранее, а не немедленно после ее приготовления, невозможно обеспечить достаточную действенность лекарственного средства вследствие низкой стабильности активного ингредиента (см. Патентный литературный источник 3). Действительно, при высокой занятости в современных условиях, прием диспергируемой таблетки в ее растворенном виде часто откладывается или забывается вследствие выполнения более срочных задач.
[0011] Кроме того, деферазирокс имеет очень низкую растворимость в воде, и поэтому при пероральном приеме деферазирокса важно обеспечить быструю скорость растворения, чтобы получить достаточную биодоступность.
[0012] [Литературные источники предшествующего уровня техники]
[0013] [Патентные литературные источники]
[0014] (Патентный литературный источник 1) W097/49395
[0015] (Патентный литературный источник 2) WO04/035026
[0016] (Патентный литературный источник 3) W012/003987
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0017] Задачей настоящего изобретения является предложить порошок деферазирокса, который может содержать суточную эффективную дозу деферазирокса, чрезвычайно удобен при приеме внутрь, не вызывает значительных опасений в отношении побочных явлений, ассоциированных с добавками, благодаря невысокому процентному содержанию добавок, и обеспечивает стабильность и действенность лекарственного средства.
[0018] Другой задачей настоящего изобретения является предложить способ получения порошка деферазирокса.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
[0019] В одном аспекте настоящего изобретения предложен
[0020] порошок, содержащий массовую долю от 20% до 45% комбинации лактозы и сахарозы от общей массы порошка и содержащий в качестве активного ингредиента соединение, представленное Формулой 1 ниже, или его фармацевтически приемлемую соль:
[0021] [Формула 1]
[0022]
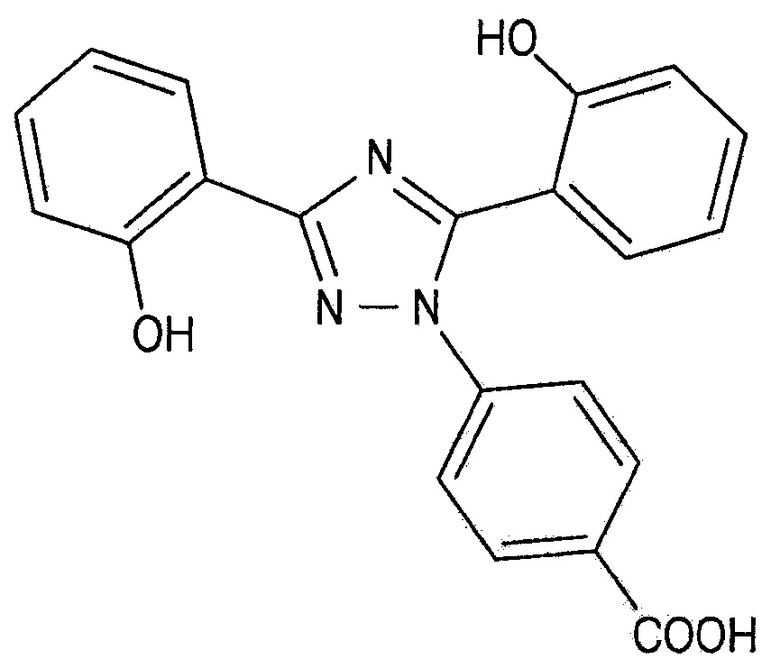
[0023] Согласно другому аспекту настоящего изобретения предложен способ получения порошка согласно одному аспекту настоящего изобретения, включающийся в себя:
[0024] взвешивание исходных материалов, включающих соединение, представленное Формулой 1 выше, или его фармацевтически приемлемую соль в качестве активного ингредиента, лактозу и сахарозу; и
[0025] Смешивание, перемешивание, гранулирование и размол взвешенных исходных материалов.
ПОЛЕЗНЫЙ ЭФФЕКТ ОТ ИЗОБРЕТЕНИЯ
[0026] Порошок деферазирокса согласно настоящему изобретению можно принимать непосредственно или принимать в форме суспензии в водной фазе и вследствие этого он может содержать суточную дозу деферазирокса, для которой требуется высокая концентрация дозы, и который чрезвычайно удобен для приема внутрь, поскольку не создает опасности подавиться им, как при проглатывании таблеток. Кроме того, процентное содержание добавок в порошке деферазирокса ниже, чем в имеющихся в широкой продаже диспергируемых таблетках, и поэтому он может иметь меньше побочных явлений, ассоциированных с добавками. Помимо этого, порошок деферазирокса можно принимать непосредственно без суспендирования в водной фазе в отличие от имеющихся в продаже диспергируемых таблеток, и, таким образом, без опасения, связанного с ухудшением стабильности лекарственного средства вследствие приготовления суспензии и отложенного использования суспензии. К тому же, порошок деферазирокса согласно настоящему изобретению может иметь такую же скорость растворения, как и имеющиеся в продаже диспергируемые таблетки, и может быть приготовлен в виде порошка с отличными характеристиками.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
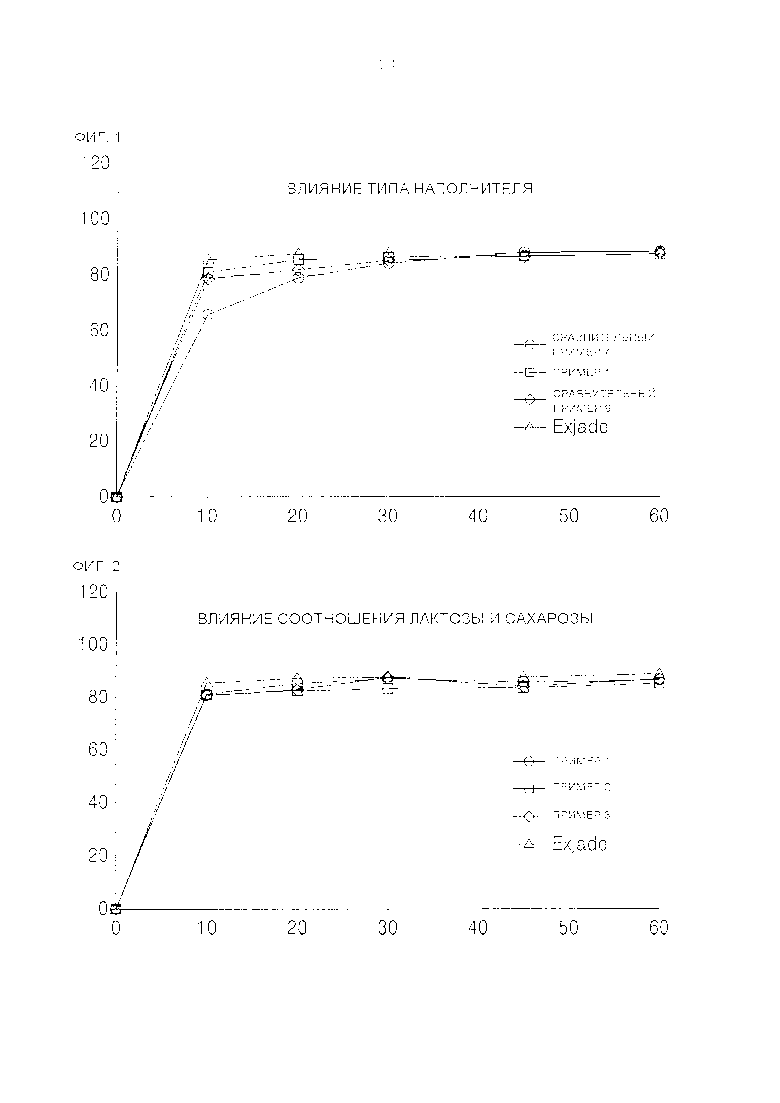
[0027] ФИГ. 1 представляет собой кривые, отражающие результаты сравнительного исследования растворения содержащих деферазирокс порошков от времени и типа наполнителя с Exjade в качестве контроля.
[0028] ФИГ. 2 представляет собой кривые, отражающие результаты сравнительного исследования растворения содержащих деферазирокс порошков от времени, где в качестве наполнителя использовали комбинации лактозы и сахарозы с различным соотношением, в качестве контроля использовали Exjade.
[0029] ФИГ. 3 представляет собой кривые, отражающие результаты сравнительного исследования растворения содержащих деферазирокс порошков от времени, где в качестве наполнителя использовали комбинации лактозы и микрокристаллической целлюлозы с различным соотношением, в качестве контроля использовали Exjade.
[0030] ФИГ. 4 представляет собой кривые, отражающие результаты сравнительного исследования растворения порошков деферазирокса от времени и типа поверхностно-активного вещества с Exjade в качестве контроля.
[0031] ФИГ. 5 представляет собой кривые, отражающие результаты сравнительного исследования растворения порошков деферазирокса от времени, где изменяли содержание Tween 80, использованного в качестве поверхностно-активного вещества, в качестве контроля использовали Exjade.
[0032] ФИГ. 6 представляет собой кривые, отражающие результаты сравнительного исследования растворения порошков деферазирокса от времени, где изменяли содержание лаурилсульфата натрия, использованного в качестве поверхностно-активного вещества, в качестве контроля использовали Exjade.
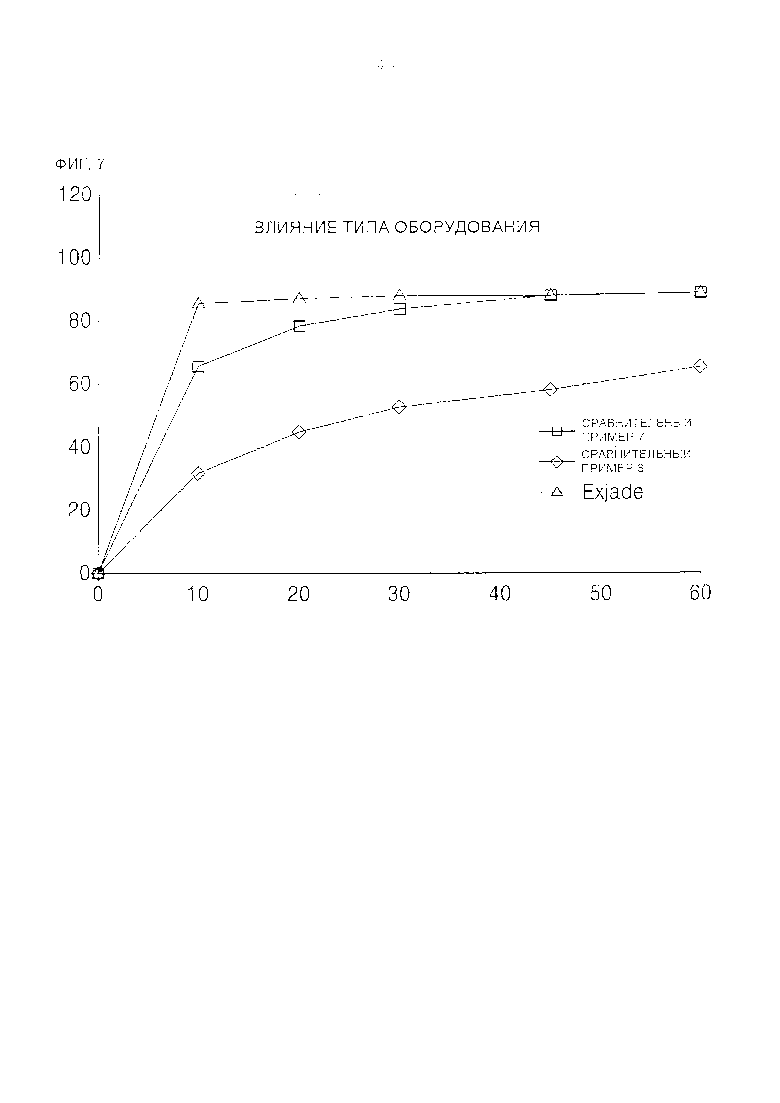
[0033] ФИГ. 7 представляет собой кривые, отражающие результаты сравнительного исследования растворения порошков деферазирокса от времени, которые готовили, используя высокоскоростной смеситель или экструдер, в качестве контроля использовали Exjade.
ТЕХНИЧЕСКОЕ ВЫПОЛНЕНИЕ ИЗОБРЕТЕНИЯ
[0034] Все технические термины, используемые в настоящем изобретении, используются в таком смысле, в котором они обычно понимаются специалистами в данной области техники, к которой относится настоящее изобретение, если не указано иное. Кроме того, предпочтительные способы или образцы описаны в настоящем описании, но аналогичные или эквивалентные им также входят в объем настоящего изобретения. Содержание всех публикаций, описанных в настоящем описании, включено в настоящее описание посредством ссылки во всей своей полноте.
[0035] В одном варианте осуществления настоящего изобретения предложен
[0036] порошок, содержащий массовую долю комбинации лактозы и сахарозы в размере от 20% до 45% от общей массы порошка и содержащий в качестве активного ингредиента соединение, представленное Формулой 1 ниже, или его фармацевтически приемлемую соль:
[0037] [Формула 1]
[0038]

[0039] Деферазирокс является непатентованным названием соединения Формулы 1, а соединение Формулы 1, его соли и кристаллические формы раскрыты в Международной патентной заявке № WO 97/49395, включенной в данный документ ссылкой. В одном варианте осуществления соединение Формулы 1 имеет кристаллическую форму, описанную в Примере 5 документа WO 97/49395.
[0040] В порошке, комбинация лактозы и сахарозы выполняет роль наполнителя, и было получено подтверждение тому, что по сравнению с использованием других типов наполнителей, в данном случае скорость растворения активного ингредиента значительно выше и эквивалентна скорости растворения имеющихся в продаже диспергируемых таблеток (см. ФИГ. 1). В одном варианте осуществления содержание наполнителя может входить массовую долю от примерно 20% до примерно 45%, более конкретно - от 25% до 42%, от общей массы порошка. В случае включения лактозы и микрокристаллической целлюлозы вместо комбинации лактозы и сахарозы, было показано, что повышение скорости растворения зависит от повышения массовой доли лактозы, но при этом скорость растворения значительно ниже, чем скорость растворения имеющихся в продаже диспергируемых таблеток деферазирокса (см. ФИГ. 3).
[0041] Соотношение содержания лактозы к сахарозе в комбинации конкретно не ограничивается, и в массовом отношении может изменяться, например, от примерно 1:4 до примерно 4:1. Было получено подтверждение тому, что в пределах указанного выше соотношения скорость растворения активного ингредиента практически не изменялась вне зависимости от изменения массовой доли сахарозы (см. ФИГ. 2), но было показано, что поскольку такие проблемы, как получение большого количества мелкодисперсного порошка и т.п., возникают при низкой массовой доле сахарозы, по мере увеличения процентного содержания сахарозы улучшаются свойства частиц, из которых состоит порошок. Так, в одном варианте осуществления соотношение содержания лактозы к сахарозе в комбинации в массовом отношении может изменяться от 1:1 к 1:4, более конкретно - от 1:2,5 до 1:3,5.
[0042] Лактоза представляет собой лактозу, моногидрат лактозы, моногидрат лактозы (200 меш) или лактозу, высушенную распылением.
[0043] Порошок может содержать фармацевтически эффективное количество комплексообразующего средства, связывающего железо, содержание активного ингредиента может составлять (в массовых долях), в частности, от примерно 35% до 50%, более конкретно - от примерно 35% до примерно 42% от общей массы порошка. Порошок содержит высокую по отношению к общему весу препарата массовую долю активного ингредиента и может характеризоваться скоростью растворения, равной скорости растворения имеющихся в продаже в настоящее время диспергируемых таблеток деферазирокса, тем самым проявлять действенность, эквивалентную действенности последних. Кроме того, процентное содержание добавок в препарате порошка меньше, чем в имеющихся в продаже в настоящее время диспергируемых таблетках деферазирокса (Exjade®: 30% или менее активного ингредиента) и поэтому препарат может иметь меньше побочных явлений, ассоциированных с добавками.
[0044] Порошок может дополнительно включать известные дополнительные добавки, которые обычно используются для составления порошков, и в частности, может дополнительно содержать разрыхлитель, связующее, поверхностно-активное вещество и любую их комбинацию.
[0045] Разрыхлителем может быть любой известный разрыхлитель, который можно использовать в составе порошков в данной области техники, и в одном варианте осуществления его можно выбирать из группы, состоящей из кросповидона, кроскармеллозы натрия, натрия гликолята крахмала, низкозамещенной гидроксипропилцеллюлозы и их комбинаций. Содержание разрыхлителя (в массовых долях) может варьироваться от примерно 15% до примерно 30% от общей массы порошка.
[0046] Связующим может быть любое известное связующее, которое можно использовать в составе порошков в данной области техники, и в одном варианте осуществления его можно выбирать из группы, состоящей из поливинилпирролидона (например, PVP K30), гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, безводной кремниевой кислоты, натрий карбоксиметилцеллюлозы, полиэтиленгликоля 6000, полипропиленгликоля, сложных эфиров глицерина и жирных кислот, карбоната кальция и их комбинаций. Содержание связующего (в массовых долях) может варьироваться от примерно 1,5% до примерно 5% от общей массы порошка.
[0047] Поверхностно-активным веществом (ПАВ) может быть любое известное ПАВ, которое можно использовать в составе порошков в данной области техники, и в одном варианте осуществления его можно выбирать из группы, состоящей из лаурилсульфата натрия (SLS), сложных эфиров полиоксиэтилена и жирных кислот (Tween®, например, Tween 80) и их комбинаций. Содержание ПАВ (в массовых долях) может варьироваться от примерно 0,2% до примерно 10%, в частности, от примерно 0,2% до примерно 1,5%, и более конкретно - от примерно 0,2% до примерно 0,5% от общей массы порошка.
[0048] Поверхностно-активное вещество (ПАВ) в порошке выполняет роль средства, способствующего растворению.
[0049] В одном варианте осуществления ПАВ представляет собой лаурилсульфат натрия.
[0050] В результате проведения экспериментов было обнаружено, что в случае использования лаурилсульфата натрия в качестве ПАВ, скорость растворения значительно выше, чем в случае использования Tween 80 в качестве ПАВ (см. ФИГ. 4). В результате проведения экспериментов было обнаружено, что с увеличением содержания Tween 80 увеличивается скорость растворения порошка, но при этом она значительно ниже скорости растворения имеющихся в продаже диспергируемых таблеток деферазирокса (см. ФИГ. 5).
[0051] Специалист в области техники может соответственно подобрать содержание лаурилсульфата натрия с учетом количества, которое позволит лаурилсульфату натрия выполнять функцию средства, способствующего растворению, и его массовая доля может варьироваться от примерно 0,2% до примерно 10%, более конкретно - от 0,2% до 1,5% от общей массы порошка. В результате проведения экспериментов было обнаружено, что скорость растворения активного ингредиента практически не изменяется при изменении содержания лаурилсульфата натрия, и было показано, что она равна скорости растворения контрольного образца даже при таком низком содержании лаурилсульфата натрия, как 0,5% (см. ФИГ. 6). Поскольку наличие ПАВ вызывает опасения в отношении побочных явлений, то содержание ПАВ можно снижать с учетом приведенных выше экспериментальных результатов. В одном варианте осуществления содержание лаурилсульфата натрия может находиться в пределах массовой доли от 0,2% до 0,5% от общей массы порошка. По сути, вследствие включения его в малом количестве, содержание лаурилсульфата натрия в порошке может составлять примерно 6 мг или меньше в пересчете на 500 мг свободной кислоты в качестве активного ингредиента, и таким образом, содержание ПАВ по отношению к активному ингредиенту значительно снижается по сравнению с имеющимися в продаже обычными диспергируемыми таблетками деферазирокса (в 500 мг таблетке Exjade содержится примерно 8,4 мг SLS). Соответственно, можно уменьшить опасения в отношении возникновения побочных явлений, ассоциированных с ПАВ.
[0052] В одном варианте осуществления порошок содержит кросповидон в качестве разрыхлителя, поливинилпирролидон в качестве связующего и лаурилсульфат натрия в качестве ПАВ.
[0053] В одном варианте осуществления порошок может содержать (в массовых долях): от 15% до 55% активного ингредиента, от 5% до 24% лактозы гидрата, от 7% до 30% сахарозы, от 15% до 30% кросповидона, от 1,5% до 5% поливинилпирролидона и от 0,5% до 10% лаурилсульфата натрия.
[0054] В другом варианте осуществления порошок может содержать (в массовых долях): от 35% до 55% активного ингредиента, от 5% до 24% лактозы гидрата, от 7% до 30% сахарозы, от 15% до 30% кросповидона, от 1,5% до 5% поливинилпирролидона и от 0,2% до 1,5% лаурилсульфата натрия. Преимущество порошка заключается в том, что в порошке высокое процентное содержание активного ингредиента относительно общего веса препарата, и он может характеризоваться скоростью растворения, равной скорости растворения имеющихся в продаже в настоящее время диспергируемых таблеток деферазирокса, тем самым проявлять действенность, эквивалентную действенности последних, и поскольку процентное содержание добавок в препарате ниже, чем в имеющихся в настоящее время в продаже диспергируемых таблетках деферазирокса, то уменьшаются побочные явления, ассоциированные с добавками. Кроме того, порошок может содержать небольшое количество лаурилсульфата натрия и тем самым включать небольшое количество поверхностно-активного вещества (ПАВ) и, соответственно, опасения, связанные с побочными явлениями, ассоциированными с ПАВ, могут уменьшаться.
[0055] Порошок в стандартной лекарственной форме может содержать суточную дозу, необходимую для лечения гемохроматоза или перегрузки железом при трансфузионно-зависимых анемиях. Суточная доза может меняться в зависимости от конкретного заболевания, возраста, пола, веса тела и т.п., и может варьироваться, например, от 5 мг/кг (веса тела) до 40 мг/кг (веса тела), более конкретно - примерно 30 мг/кг.
[0056] В одном варианте осуществления порошок в стандартной
лекарственной форме может содержать активный ингредиент в виде свободной кислоты в количестве от примерно 100 мг до примерно 1500 мг, более конкретно -от примерно 100 мг до примерно 1000 мг.
[0057] В одном варианте осуществления порошок в стандартной лекарственной форме содержит активный ингредиент в виде свободной кислоты в количестве примерно 125 мг, примерно 250 мг, примерно 500 мг или примерно 1000 мг.
[0058] Порошок содержит относительно небольшие количества добавок по сравнению с имеющимися в продаже обычными диспергируемыми таблетками, и может содержать активный ингредиент в количестве вплоть до 1000 мг в стандартной лекарственной форме благодаря фармацевтическим свойствам самих порошков, которые легко принимать внутрь в отличие от больших таблеток. Например, пациентам с весом тела 35 кг или более следует принимать внутрь 1000 мг или больше активного ингредиента, и тем самым должны принимать две таблетки Exjade по 500 мг каждая в качестве имеющихся в продаже диспергируемых таблеток, но преимущество порошка согласно настоящему изобретению в том, что его можно принимать в виде стандартной лекарственной формы.
[0059] Порошок можно принимать непосредственно перорально или принимать в форме порошка для суспензии, который суспендируется в водной фазе (например, в воде) перед приемом внутрь.
[0060] В другом варианте осуществления настоящего изобретения предложен
[0061] способ получения порошка, включающий в себя: взвешивание исходных материалов, включающих активный ингредиент, лактозы гидрат и сахарозу; и
[0062] смешивание, перемешивание, гранулирование и размол взвешенных исходных материалов.
[0063] Подробное описание порошка согласно варианту осуществления настоящего изобретения можно непосредственно применять к подробному описанию способа получения порошка.
[0064] Способ получения порошка с использованием высокоскоростного смесителя, известного в области техники, можно применять к процессам смешивания, перемешивания, гранулирования и размола, выполняемых с использованием высокоскоростного смесителя.
[0065] В результате экспериментирования, после выполнения смешивания, перемешивания, гранулирования и размола на высокоскоростном смесителе, скорость растворения активного ингредиента была значительно выше, чем скорость растворения при использовании экструдера (см. ФИГ. 7)
[0066]
[0067] [Примеры]
[0068] Далее настоящее изобретение будет описано еще более подробно со ссылкой на следующие примеры. Однако эти примеры приведены только для иллюстративных целей, и не предназначены ограничивать объем настоящего изобретения.
[0069]
[0070] Примеры 1-6 и Сравнительные примеры 1-9: Получение порошков в соответствии с различными переменными
[0071] Порошки деферазирокса получали в соответствии с составами, указанными в Таблицах 1-3 ниже.
[0072] Компоненты, соответствующие каждому из примеров и сравнительных примеров, показанные в Таблицах 1-3 ниже, взвешивали в весовых частях и затем помещали в высокоскоростной смеситель и выполняли в нем смешивание, перемешивание, гранулирование и размол, а затем выполняли смешивание в барабанном смесителе, тем самым завершая получение порошков деферазирокса. Порошок деферазирокса согласно Сравнительному примеру 8 получали таким же образом, как и описано выше, за исключением того, что использовали экструдер вместо высокоскоростного смесителя.
[0073] [Таблица 1]
[0074]
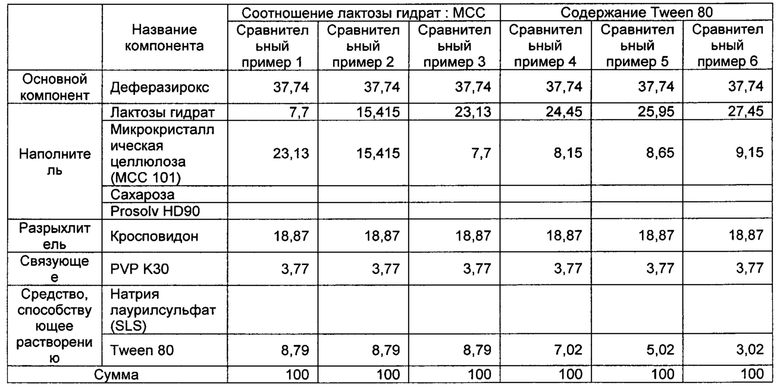
[0075] [Таблица 2]
[0076]

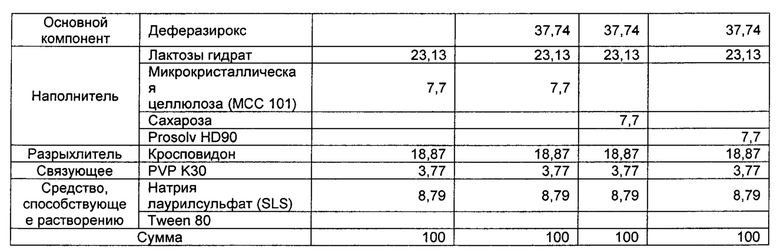
[0077] [Таблица 3]
[0078]

[0079]
[0080] Экспериментальный пример 1: Оценка растворимости
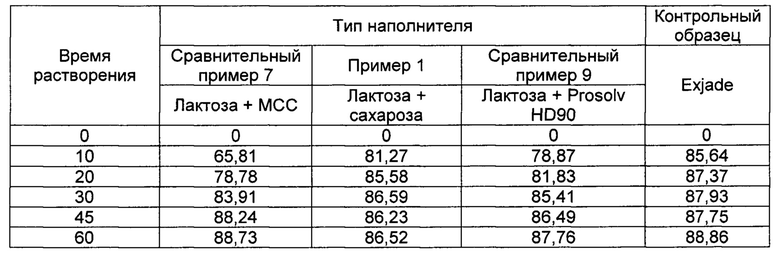
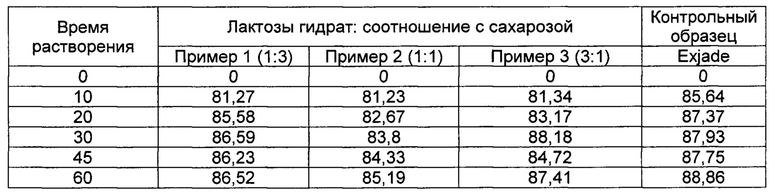
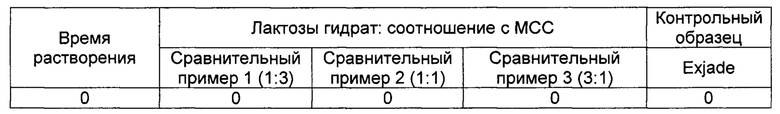
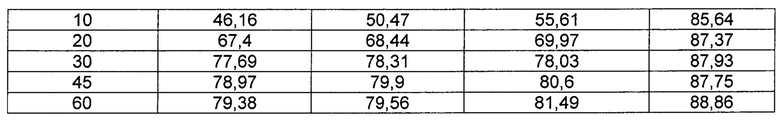
[0081] Оценку растворимости проводили на каждом из порошков деферазирокса из Примеров 1-6 и Сравнительных примеров 1-9, полученных согласно Таблицам 1-3 выше. Испытание на растворение выполняли на каждом из порошков в следующих условиях испытания и рассчитывали среднюю скорость растворения в массовых процентах. Результаты испытаний показаны в Таблицах 4-9 ниже в зависимости от типа наполнителя (Таблица 4), соотношения лактозы гидрата и сахарозы в качестве наполнителя (Таблица 5), соотношения лактозы гидрата и микрокристаллической целлюлозы (МСС) в качестве наполнителя (Таблица 6), типа поверхностно-активного вещества (ПАВ) (Таблица 7), содержания Tween 80 (Таблица 8), содержания SLS (Таблица 9) и типа оборудования (Таблица 10), а кривые скоростей растворения приведены на ФИГУРАХ 1-6.
[0082] <Условия в испытании на растворение>
[0083] Метод испытания на растворение: Метод 2 испытания на растворение (метод с лопастной мешалкой) в Корейской фармакопее
[0084] Среда для растворения: рН 6,8 среды + 1% Tween 20
[0085] Количество среды для растворения: 900 мл
[0086] Температура среды для растворения: 37,5°С
[0087] Скорость вращения лопастной мешалки: 50 об/мин
[0088] Количество испытуемых образцов: 6
[0089] Время отбора проб: 10 минут, 20 минут, 30 минут, 45 минут и 60 минут
[0090] [Таблица 4]
[0091]
[0092] [Таблица 5]
[0093]
[0094] [Таблица 6]
[0095]
[0096] [Таблица 7]
[0097]
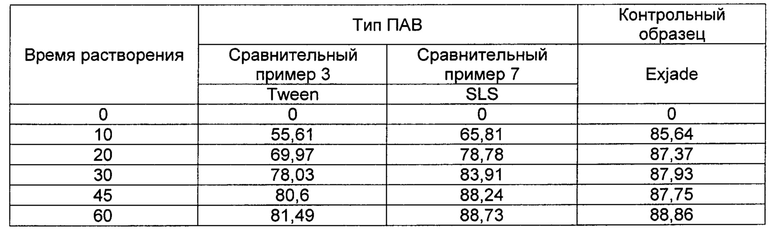
[0098] [Таблица 8]
[0099]
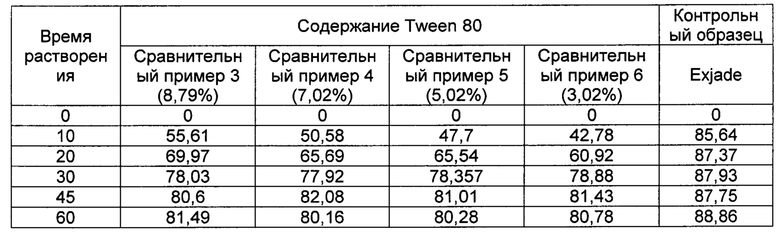
[00100] [Таблица 9]
[00101]
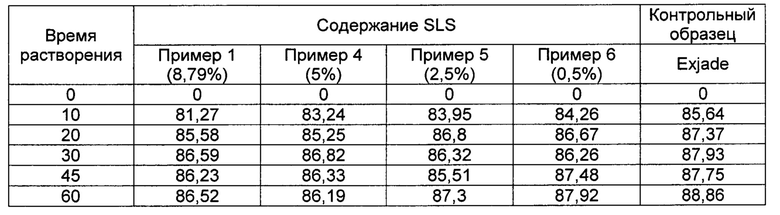
[00102] [Таблица 10]
[00103]
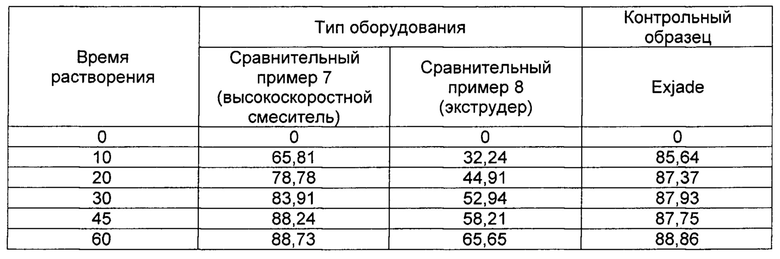
[00104] Как следует из ФИГ. 1 и Таблицы 4, среди наполнителей комбинация лактозы и сахарозы проявляет самую высокую скорость растворения по сравнению с комбинацией лактозы и микрокристаллической целлюлозы (МСС) и комбинацией лактозы и силикатированной микрокристаллической целлюлозы (Prosolv HD90), и ее скорость растворения практически такая же, как и у Exjade.
[00105] Как следует из ФИГ. 2 и Таблицы 5, скорость растворения практически не зависит от соотношения содержания лактозы и сахарозы.
[00106] Как следует из ФИГ. 3 и Таблицы 6, изменение соотношений содержания лактозы и микрокристаллической целлюлозы не дало в результате значительного приближения к скорости растворения Exjade.
[00107] Как следует из ФИГ. 4 и Таблицы 7, порошок, который содержит лаурилсульфат натрия (SLS) в качестве поверхностно-активного вещества, обладает значительно более высокой скоростью растворения по сравнению с порошком, содержащим Tween 80.
[00108] Как следует из ФИГ. 5 и Таблицы 8, изменение процентного содержания Tween 80 не дало в результате значительного приближения к скорости растворения Exjade.
[00109] Как следует из ФИГ. 6 и Таблицы 9, скорость растворения практически не зависит от процентного содержания SLS.
[00110] Как следует из ФИГ. 7 и Таблицы 10, при приготовлении порошка на высокоскоростном смесителе скорость его растворения значительно выше, чем у порошка, приготовленного с использованием экструдера.
[00111] Настоящее изобретение описано со ссылкой на иллюстративные варианты его осуществления. Специалисту в области техники, к которой относится настоящее изобретение, будет понятно, что изобретение может быть воплощено в различных модифицированных формах без отхода от его основных характеристик. Таким образом, описанные здесь варианты осуществления следует рассматривать только в иллюстративном смысле, а не в целях ограничения. Объем настоящего изобретения определяется следующей формулой изобретения, а не приведенным выше описанием, и все изменения или модифицированные формы, эквивалентные ему, должны толковаться как входящие в объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2589842C2 |
| Таблетки ибупрофена натрия и способы изготовления фармацевтических композиций, включающих ибупрофен натрия | 2010 |
|
RU2715680C2 |
| КОМПОЗИЦИИ НАНОСТРУКТУРИРОВАННОГО АПРЕПИТАНТА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2011 |
|
RU2595841C2 |
| КОМПОЗИЦИИ ТЕЛМИСАРТАНА В ФОРМЕ НАНОЧАСТИЦ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2526914C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ В ФОРМЕ ТАБЛЕТКИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2747525C2 |
| СОСТАВ НА ОСНОВЕ АБИРАТЕРОНА АЦЕТАТА | 2014 |
|
RU2732136C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ МОНТЕЛУКАСТА И ЛЕВОЦЕТИРИЗИНА | 2013 |
|
RU2677649C2 |
| ДИСПЕРГИРУЕМЫЕ КОМПОЗИЦИИ | 2017 |
|
RU2826218C2 |
| ГЕМФИБРОЗИЛ-СОДЕРЖАЩИЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1995 |
|
RU2152209C1 |
| КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ЭЗЕТИМИБ И РОЗУВАСТАТИН | 2014 |
|
RU2683937C2 |


Изобретение относится к фармацевтической композиции для лечения перегрузки железом в форме порошка, содержащего от 25 масс. % до 45 масс. % комбинации лактозы и сахарозы по отношению к общей массе порошка и содержащего в качестве активного ингредиента от 35 масс. % до 40 масс. % соединения, представленного Формулой 1, или его фармацевтически приемлемой соли и от 0,2 масс. % до 10 масс. % лаурилсульфата натрия по отношению к общей массе порошка. Изобретение также относится к способу получения фармацевтической композиции в форме порошка. Технический результат: получена фармацевтическая композиция в форме порошка, включающая деферазирокс в качестве активного ингредиента и невысокое процентное содержание добавок, которую можно принимать без суспензирования в водной фазе, кроме того, полученная фармацевтическая композиция проявляет высокую скорость растворения. 2 н. и 10 з.п. ф-лы, 7 ил., 10 табл., 7 пр.
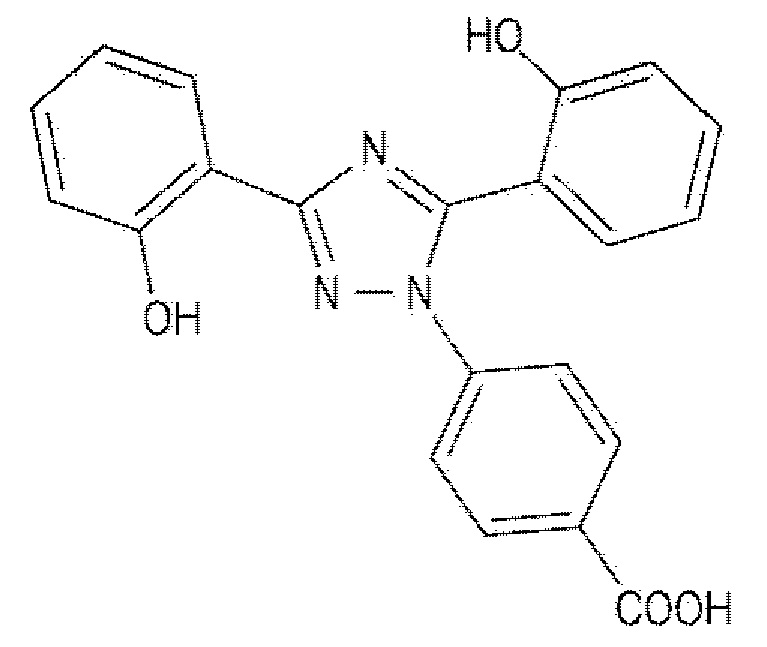 [Формула 1]
[Формула 1]
1. Фармацевтическая композиция для лечения перегрузки железом, в форме порошка, содержащего от 25 масс. % до 45 масс. % комбинации лактозы и сахарозы по отношению к общей массе порошка и содержащего в качестве активного ингредиента от 35 масс. % до 40 масс. % соединения, представленного ниже Формулой 1, или его фармацевтически приемлемой соли и от 0,2 масс. % до 10 масс. % лаурилсульфата натрия по отношению к общей массе порошка:
[Формула 1]
2. Композиция по п. 1, где содержание комбинации лактозы и сахарозы составляет от 25% до 42%.
3. Композиция по п. 1, где комбинация лактозы и сахарозы находится в пределах массового отношения от 1:1 к 1:4.
4. Композиция по п. 3, где комбинация лактозы и сахарозы находится в пределах массового отношения от 1:2,5 к 1:3,5.
5. Композиция по п. 1, дополнительно содержащая фармацевтическую добавку, выбранную из группы, состоящей из разрыхлителя, связующего, поверхностно-активного вещества и их комбинаций.
6. Композиция по п. 5, где разрыхлитель выбирают из группы, состоящей из кросповидона, кроскармеллозы натрия, натрия гликолята крахмала, низкозамещенной гидроксипропилцеллюлозы и их комбинаций,
связующее выбирают из группы, состоящей из поливинилпирролидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, легкой безводной кремниевой кислоты, силиката алюминия, силиката кальция, гидрофосфата кальция, карбоната кальция и их комбинаций, и
поверхностно-активное вещество представляет собой сложные эфиры полиоксиэтилена и жирных кислот.
7. Композиция по п. 1, где содержание лаурилсульфата натрия составляет от 0,2 масс. % до 0,5 масс. % от общей массы порошка.
8. Композиция по п. 5, где разрыхлителем является кросповидон и связующим является поливинилпирролидон.
9. Композиция по п. 8, где порошок содержит от 5 масс. % до 24 масс. % лактозы гидрата, от 7 масс. % до 30 масс. % сахарозы, от 15 масс. % до 30 масс. % кросповидона, от 1,5 масс. % до 5 масс. % поливинилпирролидона и от 0,2 масс. % до 1,5 масс. % лаурилсульфата натрия.
10. Композиция по п. 1, где в качестве активного ингредиента порошок содержит фармацевтически эффективное количество комплексообразующего средства, связывающего железо, для стандартной лекарственной формы.
11. Композиция в форме порошка по п. 1, где порошок принимают внутрь непосредственно в виде порошка или принимают внутрь в виде суспензии.
12. Способ получения фармацевтической композиции в форме порошка согласно любому из пп. 1-11, включающий:
взвешивание исходных материалов, включающих активный ингредиент, лактозу, сахарозу и лаурилсульфат натрия; и
смешивание, перемешивание, гранулирование и размол взвешенных исходных материалов; причем
смешивание, перемешивание, гранулирование и размол выполняют используя высокоскоростной смеситель.
| RU 238532 C2, 20.11.2008 | |||
| RU 2013120275 A, 20.11.2014 | |||
| WO 2009067557 A1, 28.05.2009 | |||
| WO 2010035282 A1, 01.04.2010 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), ПРОИЗВОДНЫЕ 3,5-ДИФЕНИЛ-1,2,4-ТРИАЗОЛОВ, В НЕЕ ВХОДЯЩИЕ | 1997 |
|
RU2208010C2 |
| WO 2009016359 A1 05.02.2009. | |||
Авторы
Даты
2019-07-24—Публикация
2016-07-25—Подача