Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики, возбудителей респираторных вирусных инфекций вирусов парагриппа 3 типа, как в практике ветеринарной службы, так и для научных исследований.
Известно техническое решение, в котором вирус парагриппа 3 типа определяют методом ПЦР с детекцией в режиме реального времени (патент РФ №2515911, C12Q 1/68, 2014 г.), продукты ПЦР разделяли методом электрофореза в 2% агарозном геле в присутствии бромистого этидия. Детекцию интенсивности флуоресценции проводили по каналам - по каналам FAM (470/510 нм) и Су5 (625/660 нм) с помощью приборов «Rot or Gene 6000» (Corbe t Researc h, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флюоресценции до 30 цикла.
Также известен способ выявления вирусных инфекций парагриппа 3 типа методом мультиплексной ПЦР с детекцией в режиме реального времени (патент РФ №2460803, C12Q 1/68, 2014 г.- прототип), включающий выделение РНК из биологического материала по выбору: мазки из носа, горла, носоглотки, носоглоточные аспираты, назальные смывы, мокроту, бронхоальвеолярный лаваж, секционный материал, образцы культуральной жидкости от инфицированных особей сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной с добавлением внутреннего положительного контроля мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вирусного возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией Threshold.
Общим недостатком известных технических решений является отсутствие возможности получения достоверной диагностики инфекции парагриппа 3 типа у КРС.
Техническим результатом является получение достоверной диагностики инфекции парагриппа-3 типа у КРС с помощью ОТ - ПЦР в реальном времени.
Технический результат достигается тем, что в способе выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота, включающем выделение РНК из биологического материала по выбору: мазки из носа, горла, носоглотки, носоглоточные аспираты, назальные смывы, мокроту сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной с добавлением внутреннего и положительного контрольных образцов мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вирусного возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией Threshold, согласно изобретению для выделения РНК используют биологический материал, взятый от животных инфицированных возбудителем вируса парагриппа 3 типа, а для внутреннего контрольного образца - суспензию бактериофага MS2 с концентрацией 5×103/мл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса парагриппа 3 типа BPI и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
BPIF 5'-TCGACATCATTGAATTCATAC-3' - прямой праймер
BPIR 5'-TCAAGTTGGTAGATTGTCGTGC-3' - обратный праймер
BPI-z 5'-JOE-TGCCGTGTTCTCTTGGGAGTCG-BHQ1-зонд
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер
MS2P, 5'-Су5-CACATCGATAGATCAAGGTGCCTACAAGC-3' BHQ2-зонд, при этом накопление флуоресцентного сигнала измеряют по каналам: JOE/ Yellow для специфического сигнала; Су5/Red для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считают положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики инфекции парагриппа 3 типа у животных используют две последовательные реакции: обратной транскрипции вирусной РНК для получения кДНК и полимеразной цепной реакции для амплификации фрагмента полученной кДНК матрицы. Обе реакции проводятся последовательно в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома возбудителя парагриппа-3 типа олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага MS2: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ОТ-ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации и возможность ошибки при переносе кДНК в другую пробирку для ПЦР. Кроме того, детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, а именно к средствам диагностики инфекции парагриппа 3 типа у животных, как в практике ветеринарной службы, так и для научных исследований, что соответствует критерию «промышленная применимость».
Способ выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота осуществляется следующим образом. Предварительно выделяют РНК от инфицированных животных биологический материал по выбору: мазки из носа, горла, носоглотки, носоглоточные аспираты, назальные смывы, мокроту сорбционным методом. Проводят синтез кДНК на матрице РНК путем постановки одноэтапной мультиплексной реакции обратной транскрипции с использованием внутреннего контрольного образца - суспензию бактериофага MS2 и положительного контрольного образца в качестве, которого используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса парагриппа-3 типа и фрагмент генома бактериофага MS2 со следующими нуклеотидными последовательностями:
BPIF 5'-TCGACATCATTGAATTCATAC-3' - прямой праймер
BPIR 5'-TCAAGTTGGTAGATTGTCGTGC-3' - обратный праймер
BPIP 5'-JOE-TGCCGTGTTCTCTTGGGAGTCG-BHQ1 - зонд
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер
MS2P, 5'-Су5-CACATCGATAGATCAAGGTGCCTACAAGC-3' - BHQ2-зонд и полимеразной цепной реакции - с проведением 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома возбудителя парагриппа 3 типа олигонуклеотидных праймеров и флуоресцентно-меченного зонда.
Затем измеряют накопление флуоресцентного сигнала по каналам: JOE/ Yellow для специфического сигнала; Су5/Red для сигнала внутреннего контроля и интерпретируют результаты на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold). Если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование заявляемых олигонуклеотидных праймеров BPIF и BPIR флуоресцентно-меченного зонда BPIP обеспечивает специфическое выявление РНК парагриппа 3 типа у животных.
Использование для разных видов контроля различные формы материала бактериофага MS2: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения РНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Проведен сравнительный анализ доступных в базе данных GenBank нуклеотидных последовательностей Р гена BPI, кодирующего один из шести главных структурных белков вирусов (Phosphoprotein Р) парагриппа, относящихся к роду Respirovirus. Как и другие представители этого семейства Paramyxoviridae, геном BPI представлен однонитевой нефрагментированной РНК негативной полярности, размером порядка 15500 оснований. Р белок является фосфопротеином размером 596 аминокимлотных остатков, который взаимодействуя с геномной РНК образует вирусный нуклеокапсид.
С помощью программы «Bio Edit 7.0» выравнены нуклеотидные последовательности Р гена BPI-представителей рода Respirovirus (1-5 типов) нуклеотидной последовательностью гена Р генома парогриппа изолята 910N (Bovine parainfluenza virus 3 DNA, complete genome (код доступа D84095). В результате анализа построенного элайнмента внутри гена белка Р выбран участок между 1800 и 2000 нуклеотидами, содержащий уникальные нуклеотидные последовательности.
С помощью программы «Oligo 6.0» рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд BPIP, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров BPIF, и BPIR. Используя программу «Oligo 6.0» описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
С помощью программы «Oligo 6.0» проанализирована нуклеотидная последовательность бактериофага MS2 (Enterobacteria phage MS2 isolate ST4, complete genome. ACCESSION EF204940). Бактериофаг MS2 содержит однонитевую позитивно ориентрованную РНК размером 3569 оснований. В результате анализа внутри гена белка "созревания" (maturation protein) выбран участок между 200 и 350 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд MS2P, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров MS2F и MS2R. Используя программу «Oligo 6.0» описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Пример конкретного осуществления способа выявления генома возбудителя вируса парагриппа-3 типа у животных
Для осуществления способа используют набор (ИНСТРУКЦИЯ по применению «ПЦР-ПАРАГРИПП-3-КРС-ФАКТОР», набора реагентов для выявления РНК вируса парагриппа-3 крупного рогатого скота (Bovine parainfluenza virus 3) в биологическом материале методом обратной транскрипции и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ОТ-ПЦР-РВ), ТУ 21 10.60-133-51062356-2017, http://www.vetfaktor.ru/), который позволяет специфически амплифицировать фрагмент генома вируса парагриппа-3 и внутреннего положительного контроля (бактериофага MS2) в мультиплексной полимеразной цепной реакции.
Набор состоит из комплекта реагентов для проведения мультиплексной ОТ-ПЦР РВ (Таблица 1, Комплект №1) и контрольных образцов (Таблица 2, Комплект №2). Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы)
2) Для анализа 110 образцов (включая контрольные образцы). Состав набора приведен в таблицах 1 и 2.
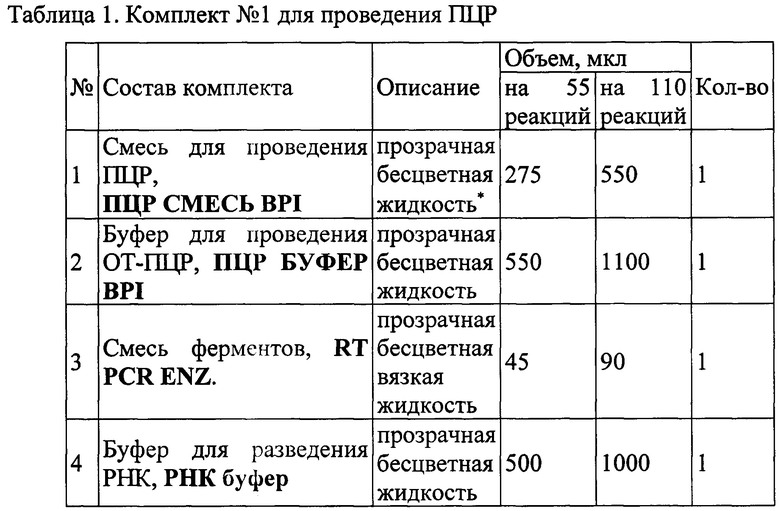

В набор не входят реактивы для экстракции НК. Выделение РНК может проводиться, например, с помощью наборов на основе сорбционного метода, в состав которых входит силика или микроцентрифужные колонки, наборов на основе фенол-хлороформной экстракции и т.п.Рекомендуется использовать набор «ДНК/РНК-С-ФАКТОР» либо аналогичный. Для исследования используют следующий биологический материал:
• Выделения из носоглотки и трахеи, мазки со слизистой носовой полости, снимают с помощью стерильного зонда, зонд помещают в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора/фосфатного буфера/транспортной среды.
• Фарингеальные смывы помещают в стерильный контейнер. Смывы, мазки берут на исследование без предварительной подготовки.
Вязкую по консистенции мокроту обрабатывают реагентами типа муколизин, с целью снижения вязкости.
Далее проводят анализ с помощью набора реагентов «ПЦР-ПАРАГРИПП-3-КРС-ФАКТОР» состоящий из трех этапов:
• экстракция НК;
• проведение реакции ОТ-ПЦР РВ с флуоресцентной детекцией в режиме реального времени;
• учет результатов анализа.
Реакция ОТ-ПЦР РВ проводится в одной пробирке.
Для экстракции (выделения) РНК из исследуемых проб отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для ОКО (отрицательный контрольный образец), по 10 мкл ВКО (внутренний контрольный образец - суспензия бактериофага MS2) BPI.
Далее подготавливают образцы к проведению ПЦР
Общий объем реакционной смеси - 25 мкл, объем РНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием ПКО BPI, ВКО BPI и РНК буфера.
Буфер для проведения ОТ-ПЦР, ПЦР буфер BPI; состав: 2,5х ПЦР-буфер (хлорид калия, 100 мМ, Трис-HCl, рН 8,8 100 мМ, глицерол 1%, Tween-20 0.02%); хлорид магния, 5 мМ; деионизированная вода.
Смесь для проведения ПЦР, ПЦР-смесь BPI состав: эквимолярная смесь дезоксинуклеозидтрифосфатов (дНТФ) в концентрации 0,25 мМ; деионизированная вода, смесь праймеров и флуоресцентного зонда на парагрипп 3 типа (прямой и обратный праймеры BPIF и BPIR в концентрации 0,2 мкМ, зонд BPIP - FAM в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5), смесь праймеров и флуоресцентного зонда на ПКО (прямой и обратный праймеры MS2F и MS2R в концентрации 0,2 мкМ, зонд MS2P-Су5 в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5).
Смесь ферментов, RT PCR ENZ, состав: ДНК полимераза с антителами, ингибирующими активность фермента, TAQ POLYMERASE (5 ед/мкл), обратная транскриптаза MMLV REVERSE TRANSCRIPTASE (100 ед/мкл).
Буфер для разведения РНК, РНК буфер, состав: деионизованная вода.
Внутренний контрольный образец, ВКО BPI состав: суспензия бактериофага MS2 (5×103/мл)
- Отрицательный контрольный образец, ОКО (ТЕ буфер); состав: ТЕ буфер (10 мМ Tris-HCl, 0,5 мМ EDTA, рН 8,0)
- Положительный контрольный образец, ПКО BPI; состав: смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса BPI и фрагмент генома бактериофага MS2, взяты в соотношении 1:1.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР СМЕСЬ BPI;
10 мкл ПЦР БУФЕР BPI;
0,75 мкл смеси ферментов RT PCR ENZ
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Расчет объемов реагентов на различное количество реакций указан в Таблице 3.
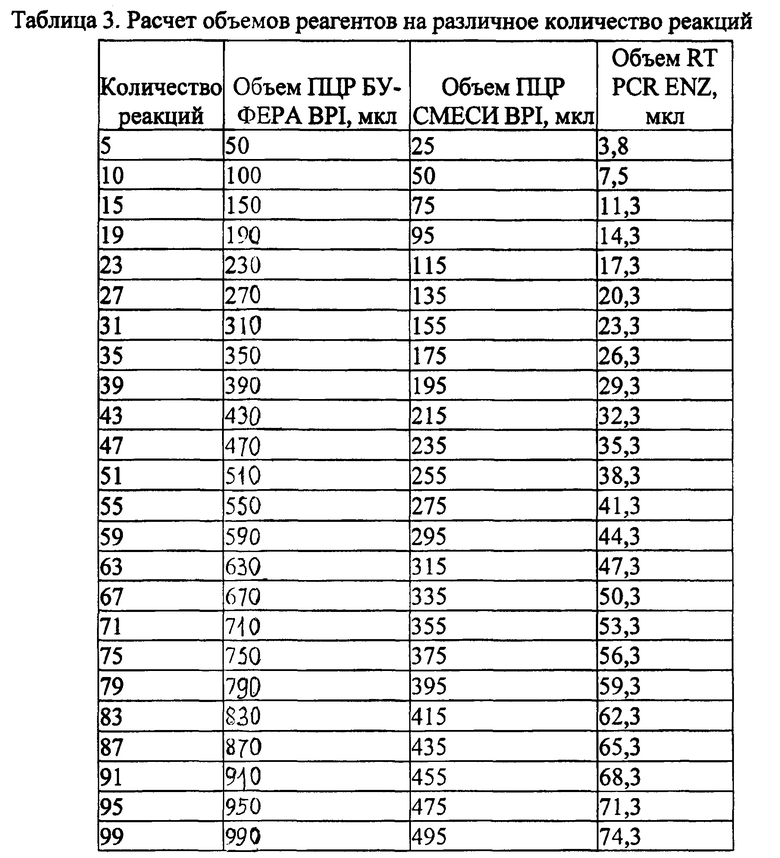
Отбирают необходимое количество пробирок для амплификации НК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки вносят
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл РНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую внести по 10 мкл НК соответствующей пробы, включая пробу ВК;
в) в пробирку с положительным контролем ПЦР (К+) 10 мкл ПКО BPI.
Проведение реакции ПЦР с флюоресцентной детекцией
Параметры температурно-временного режима амплификации на приборах «Rotor-Gene Q» и «ДТ-96» указаны в таблице 4.

Интерпретация результатов анализа.
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производи геля к прибору. Учет результатов ОТ-ПЦР проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции НК в соответствии с таблицей 5.
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- на канале JOE (HEX)/Yellow и для отрицательного контроля это па ОТ-ПЦР К- на любом из каналов свидетельствует о наличии контаминации реактивов или образцов.
В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
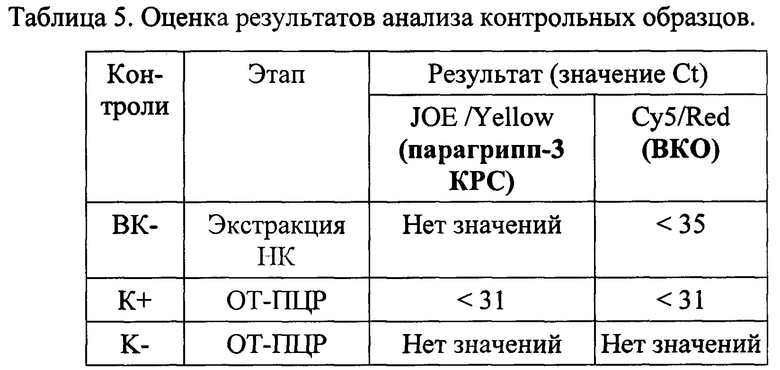
Образцы, для которых по каналу Су5/Red значение Ct отсутствует или превышает 35 цикл (при этом по каналу JOE (HEX)/Yellow значение Ct также отсутствует) требуют повторного проведения исследования с этапа ПЦР. Задержка в значениях пороговых циклов для исследуемых образцов на канале Су5/Red указывает на присутствие ингибиторов в пробах или на ошибки при постановке реакции ОТ-ПЦР. Требуется провести исследование, начиная с этапа экстракции НК.
Образец считается положительным, РНК вируса парагриппа 3 присутствует, если наблюдается экспоненциальный рост сигнала на канале JOE (HEX)/Yellow, при этом значения Ct контрольных образцов находятся в пределах нормы (см. Табл. 5). Если для исследуемого образца по каналу JOE (HEX)/Yellow значение Ct определяется позднее 37 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct на канале JOE (HEX)/Yellow более 37), требуется повторное взятие материала от того же животного для проведения ОТ-ПЦР-исследования и (или) использование альтернативных методов диагностики. Образец считается отрицательным (РНК вируса пара-гриппа-3 КРС отсутствует) если не определяется значение Ct (не наблюдается рост специфического сигнала) на канале JOE (HEX)/Yellow, при этом значения Ct по каналу Су5/Rcd и Ct контрольных образцов находятся в пределах нормы (Табл. 5).
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для обнаружения генома вируса парагриппа 3 типа у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2681473C1 |
| Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703394C1 |
| Способ выявления РНК вируса болезни Шмалленберга у сельскохозяйственных животных | 2018 |
|
RU2696306C1 |
| Тест-система для выявления РНК вируса болезни Шмалленберга у сельскохозяйственных животных | 2018 |
|
RU2694719C1 |
| Способ выявления генома возбудителя ротовирусной инфекции у сельскохозяйственных животных | 2018 |
|
RU2689718C1 |
| Тест-система для выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703401C1 |
| Тест-система для обнаружения генома возбудителя ротовируса типа А у сельскохозяйственных животных с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694501C1 |
| Способ выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов | 2020 |
|
RU2740097C1 |
| Способ выявления генома возбудителя коронавирусной инфекции у крупного рогатого скота | 2018 |
|
RU2694558C1 |
| Тест-система для обнаружения генома возбудителя коронавирусной инфекции у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694499C1 |
Изобретение относится к области биохимии. Описан способ выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота, включающий выделение РНК из биологического материала сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной с добавлением внутреннего и положительного контрольных образцов мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вирусного возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов. Фрагмент генома возбудителя вируса парагриппа-3 типа имеет следующие нуклеотидные последовательности: BPIF 5'-TCGACATCATTGAATTCATAC-3' - прямой праймер; BPIR 5'-TCAAGTTGGTAGATTGTCGTGC-3' - обратный праймер; BPI-z 5'-JOE-TGCCGTGTTCTCTTGGGAGTCG-BHQ1 - зонд. Изобретение расширяет арсенал способов выявления генома возбудителя вируса парагриппа 3 у крупного рогатого скота. 5 табл., 1 пр.
Способ выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота, включающий выделение РНК из биологического материала по выбору: мазки из носа, горла, носоглотки, носоглоточные аспираты, назальные смывы, мокроту сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной с добавлением внутреннего и положительного контрольных образцов мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вирусного возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией Threshold, согласно изобретению для выделения РНК используют биологический материал, взятый от животных, инфицированных возбудителем вируса парагриппа 3 типа, а для внутреннего контрольного образца - суспензию бактериофага МS2 с концентрацией 5×103/мл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса парагриппа 3 типа ВРI и фрагмент генома бактериофага МS2, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
BPIF 5'-ТСGАСАТСАТTGAATTСАТАС-3' - прямой праймер
BPIR 5'-ТСААGТТGGTAGАТТGТСGТGС-3' - обратный праймер
BPI-z 5'-JОЕ-ТGССGТGТТСТСТТGGGАGТСG-ВНQ1 - зонд
МS2F, 5'-ТGGСАСТAСCССТСТССGТАТТСАС-3' - прямой праймер
МS2R, 5'-GТАСGGGCGAСCССАСGАТGАС-3' - обратный праймер
МS2Р, 5'- Су5-САСAТСGAТАGАТCААGGТGССТАСААGС-3'-ВНQ2 - зонд,
при этом накопление флуоресцентного сигнала измеряют по каналам: JOE/Yellow для специфического сигнала; Cy5/Red для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считают положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
| ТЕСТ-СИСТЕМА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ Streptococcus agalactiae В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2010 |
|
RU2435853C1 |
| ВЫГРУЗНОЕ УСТРОЙСТВО СЕЛЬСКОХОЗЯЙСТВЕННОЙ УБОРОЧНОЙ МАШИНЫ | 2021 |
|
RU2780477C1 |
| US 2006099226 A1, 11.05.2006. | |||
Авторы
Даты
2019-07-30—Публикация
2018-01-16—Подача