Изобретение относится к области медицины, конкретно, к онкологии и может быть использовано для оценки риска развития неблагоприятного исхода у больных НМРЛ после радикальной операции.
Рак легкого в структуре общей онкологической заболеваемости у мужчин занимает 1-е место и составляет 25%, доля рака легкого среди женского населения - 4,3%. Рак легкого относится к новообразованиям с высоким уровнем летальности - более 20% от всех умерших от злокачественных новообразований [1]. Несмотря на внедрение новых методов лечения, основанных на комбинировании радикального оперативного вмешательства с лучевой и/или лекарственной противоопухолевой терапией, пятилетняя выживаемость больных НМРЛ не превышает 55% [2]. В связи с этим в последние годы активно разрабатываются диагностические подходы, направленные на выявление признаков прогрессирования заболевания. Помимо проведения стандартных клинико-инструментальных исследований, существенную помощь при прогнозировании исхода у больных НМРЛ оказывают молекулярные маркеры, определяемые в крови или ткани.
Наиболее близким к предлагаемому способу прогноза неблагоприятного исхода заболевания у больных НМРЛ является способ, выбранный за прототип (RU 2519647 С2), основанный на мультиплексном детектировании методом ELISA активационных состояний компонентов путей передачи сигналов в раковых клетках, включающих Her3 (ErbB3). Метод, взятый за прототип, позволяет спрогнозировать исход болезни у субъекта, страдающего раком легких; осуществить выбор подходящего противоракового лекарственного средства; спрогнозировать реакцию опухоли на лечение противораковым лекарственным средством. Предложенный метод осуществляется следующим образом: проводится выделение клеток опухоли легких после введения противоракового лекарственного средства или до инкубации с противораковым лекарственным средством; лизирование выделенных клеток для получения клеточного экстракта; детектирование активационного состояния одного или более анализируемых веществ в клеточном экстракте методом анализа, включающем несколько серийных разведений захватывающих антител, специфичных к одному или более анализируемых веществ, при этом захватывающие антитела фиксируются на твердой подложке; и прогнозирование исхода болезни у субъекта, получающего это противораковое лекарственное средство, путем сравнения активационного состояния, обнаруженного у одного или более анализируемых веществ, со стандартным активационным профилем, полученным в отсутствие противоракового лекарственного средства.
Недостатком метода, выбранного за прототип, при использовании его для прогнозирования исхода НМРЛ является:
- отсутствие данных о чувствительности и специфичности;
- при его осуществлении не учитываются клинические характеристики пациента, а оцениваются только метаболические компоненты;
- область применения способа ограничена, что обусловлено тем, что способ применяют только пациентам, которым проводили специализированное лечение.
Новая техническая задача - повышение точности и достоверности способа за счет применения новых высокочувствительных, высокоспецифичных и более универсальных прогностических критериев для оценки исхода заболевания у больных НМРЛ.
Для решения поставленной задачи в способе прогнозирования неблагоприятного исхода немелкоклеточного рака легкого (НМРЛ) путем биохимического исследования биологического материала пациентов, исследуют ткань первичной опухоли, взятую во время операционного вмешательства, в ней определяют химотрипсинподобную (ХПА) и каспазаподобную (КПА) активность протеасом и при ХПА выше 48,8*103 Ед/мг белка и КПА выше 31,2*103 Ед/мг белка прогнозируют высокую вероятность развития неблагоприятного исхода.
Способ осуществляют следующим образом: для прогнозирования развития неблагоприятного исхода НМРЛ проводят флюориметрическое определение ХПА и КПА протеасом в опухолевой ткани. Для этого в течение 1-2 часов после операции из операционного материала берут образец опухолевой ткани, очищают от участков некроза, кровоизлияний и помещают в жидкий азот. Образец ткани до определения активности протеасом хранят не более 3 месяцев при температуре -80°С и размораживают не более 1 раза для исследования маркеров. Перед определением активности протеасом из замороженной опухолевой ткани готовят осветленный гомогенат. Для этого ткань гомогенизируют до порошкообразного состояния с использованием ультразвукового, гомогенизатора, затем ресуспендируют в 50 мМ трис-HCl буфере (рН=7,5), содержащем 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугируют 60 минут при 10000g и 4°С.
Активность протеасом определяют в осветленном гомогенате опухолевой ткани по гидролизу флуорогенного олигопептида Suc-LLVY-AMC для ХПА и Cbz-LLG-AMC для КПА [3]. Реакционная смесь для определения активности протеасом должна содержать 20 мМ Tris-HCl (pH 7,5), 1 мМ дитиотрейтола, 30 мкМ Cbz-LLG-AMC, 5 мМ MgCl2 и 1 мМ АТФ. Реакцию проводят при 37°С в течение 20 мин. Образовавшийся продукт регистрируют на флуориметре при длине волны возбуждения 380 нм и эмиссии 440 нм. За единицу активности протеасом принимают количество фермента, при котором гидролизуется 1 нмоль субстрата в течение 1 мин. Для оценки активности примесных протеаз применяют специфический ингибитор протеасом - MG132 (Sigma). Удельную активность протеасом выражают в единицах активности на 1 мг белка. Содержание белка определяют по методу Лоури [4]. При значении ХПА выше 48,8*103 Ед/мг белка и КПА выше 31,2*103 Ед/мг белка прогнозируют высокую вероятность развития неблагоприятного исхода, при этом, при увеличении ХПА на каждую 1*103 Ед/мг белка риск неблагоприятного исхода увеличивается в 1,5 раза; при увеличении КПА на каждую 1*103 Ед/мг белка риск неблагоприятного исхода увеличивается в 2,2 раза.
Такой подход к оценке прогноза в отношении риска развития неблагоприятного исхода при НМРЛ обусловлен рядом предпосылок:
Возникновение и развитие злокачественных новообразований связано с активацией пролиферации, ингибированием процесса апоптоза, нарушением клеточного цикла, а также стимуляции выработки факторов роста, что в свою очередь связано с функционированием протеасомной системы, поскольку эффективная регуляция количества и функции многих белков, зависит и от процессов, связанных с их деградацией [5]. Протеасомная система принимает участие в разрушении многих регуляторных белков, в том числе молекул путей передачи сигналов от ростовых факторов и, частично, самих рецепторов ростовых факторов, осуществляет протеолиз белков, превращает неактивные белки-предшественники в активные, участвует в презентации комплекса гистосовместимости I типа, регулирует транскрипцию генов [6].
При НМРЛ, как и при любом патологическом процессе, протеолитические системы играют важную роль, т.к. осуществляют регуляцию ключевых процессов в клетке. На клеточной культуре НМРЛ подтверждено участие протеасом в деградации Вах и Bim белков при регуляции апоптоза [7]. Методами сравнительной геномной гибридизации и микрочиповыми исследованиями показана важная роль субъединицы каталитического ядра протеасомы в регуляции клеточного цикла клеток рака легкого [8].
В ряде исследований продемонстрировано участие протеасомной системы в развитии опухолей различных локализаций [9; 10]. Показано, что дисбаланс в функционировании протеасомной системы способствует формированию опухолевой прогрессии в отдаленные сроки при опухолях эндометрия и молочной железы [11; 12].
Предлагаемые маркеры подобраны на основании исследования связи активности протеасом с неблагоприятным исходом при НМРЛ у больных в течение 2х лет после операции. Общее количество пациентов, включенных в анализ, составило 36 человек. Стадия заболевания T2-3N0-2M0, возраст больных от 44 до 77 лет (средний возраст 58,9±1,1 лет). У всех больных диагноз был морфологически верифицирован. Все пациенты получали комбинированное лечение: на первом этапе выполнялось радикальное оперативное вмешательство, затем адьювантная химиотерапия по показаниям. Неоадъювантное лечение не проводилось. В анализируемой выборке в течение 2-летнего периода после операции 78% пациентов были живы, а у 22% пациентов был зарегистрирован летальный (неблагоприятный) исход. Опухолевая ткань легкого забиралась из операционного материала в течении 1-2 часов после операции и замораживалась в жидком азоте. Затем в опухолевой ткани определялась ХПА и КПА протеасом.
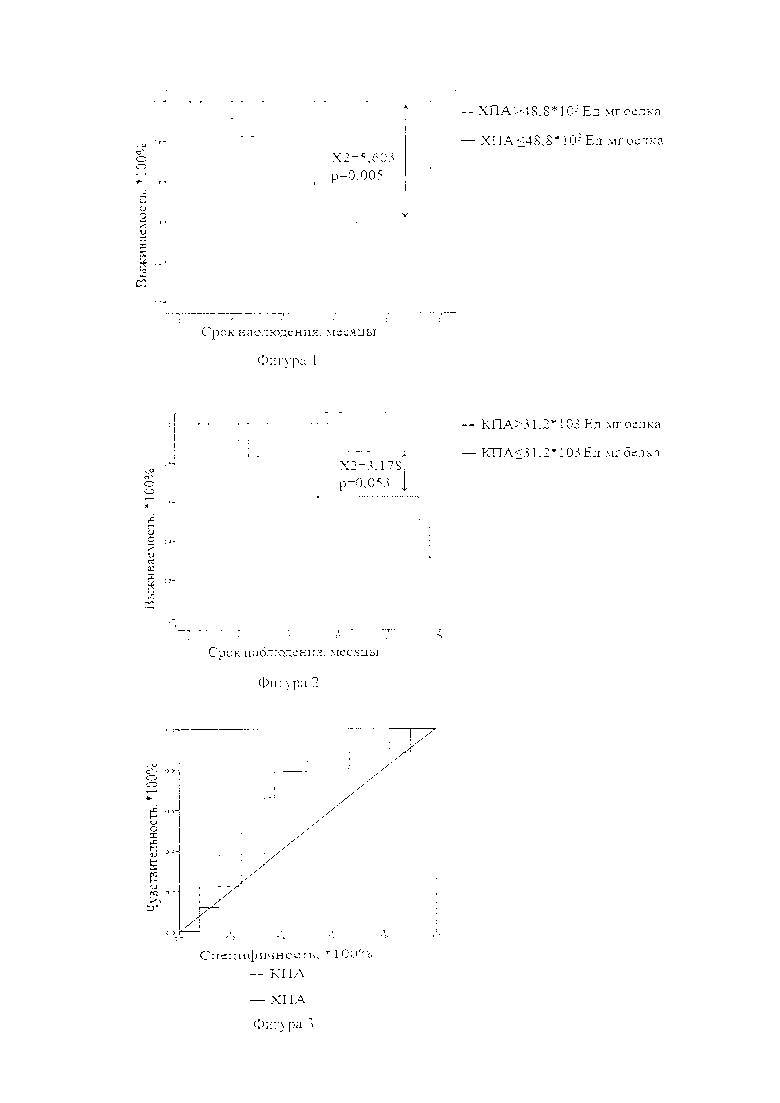
Прогностическая значимость признаков в отношении общей выживаемости у больных НМРЛ оценена с использованием обобщенного критерия Гехана-Вилкоксона (для ХПА χ2=5,603, р=0,005; для КПА χ2=3,176, р=0,053). Кривые кумулятивной выживаемости строились по методу Каплана-Майера (рисунок 1-2). Выживаемость больных определялась с помощью динамического (актуариального) метода. Расчет выживаемости проводился на второй год после окончания лечения с учетом выбывших из-под наблюдения больных и умерших от сопутствующих не онкологических заболеваний. Продолжительность жизни исчисляли с момента операции. Проверка специфичности и чувствительности показателей, показавших статистически значимый результат в отношении общей выживаемости, осуществлялась с помощью ROC-анализа (рисунок 3, таблица 1).
Для ХПА протеасом чувствительность 80%, специфичность 90%. Для КПА протеасом чувствительность 83%, специфичность 88%. Для определения относительного риска влияния активности протеасом на исход заболевания оценивалась переменная Меры риска при построении таблиц сопряженности (для ХПА Относительный риск=1,5, р=0,015; для КПА Относительный риск=2,2, р=0,033).
Клинические примеры.
Пример 1. Больной К., 58 лет. Центральный рак нижнедолевого бронха левого легкого с переходом на главный бронх. Стадия IIIA, T3N2M0. Гистология - умереннодифференцированный неороговевающий плоскоклеточный рак с метастазами в 6 медиастинальных лимфоузлов. Выполнена операция - Расширенно-комбинированная левосторонняя пневмонэктомия с интраперикардиальной обработкой сосудов, резекцией перикарда, адвентиции пищевода, медиастинальной лимфодиссекцией D3. В течение 1-2 часов после проведения радикального хирургического вмешательства из операционного материала был взят образец опухолевой ткани, в которой исследованы ХПА и КПА протеасом согласно предлагаемому способу. Химотрипсинподобная активность протеасом в опухолевой ткани составила 126,0*103 Ед/мг белка, каспазаподобная активность протеасом - 44,1*103 Ед/мг белка, что соответствовало неблагоприятному прогнозу в отношении общей выживаемости пациента. Проведено 5 курсов адъювантной химиотерапии по схеме Цисплатин/Этопозод. При контрольном обследовании через 21 месяц выявлено прогрессирование - метастатическое поражение печени, забрюшинных лимфатических узлов, обоих надпочечников. От проведения курсов паллиативной химиотерапии пациент отказался. Спустя 8 месяцев после контрольного обследования и 29 месяцев после операции наступила смерть пациента.
Пример 2. Больной В., 48 лет. Периферический рак верхней доли левого легкого. Стадия ША, T3N2M0. Гистология - высокодифференцированная аденокарцинома с 7 метастазами в средостенные лимфоузлы. Выполнена операция - Расширенно-комбинированная левосторонняя пневмонэктомия с резекцией перикарда, левого блуждающего нерва, медиастинальная лимфаденэктомия D3. В течение 1-2 часов после проведения радикального хирургического вмешательства из операционного материала был взят образец опухолевой ткани, в которой исследованы ХПА и КПА протеасом. согласно предлагаемому способу Химотрипсинподобная активность протеасом в опухолевой ткани составила 32,5*103 Ед/мг белка, каспазаподобная активность протеасом - 12,2*103 Ед/мг белка, что соответствовало благоприятному прогнозу в отношении общей выживаемости пациента в отдаленном периоде. Проведено 6 курсов послеоперационной химиотерапии по схеме Цисплатин/Этопозид. При контрольном исследовании спустя 38 месяцев пациент жив.
Таким образом, применение предлагаемого способа позволяет с высокой чувствительностью и специфичностью предполагать возможный исход заболевания у больных НМРЛ и использовать его для расчета риска развития неблагоприятного исхода у больных НМРЛ после радикальной операции.
Источники информации, принятые во внимание при составлении описания:
1. Злокачественные новообразования в России в 2016 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава Россию. - 2018. - 250 с.
2. Postmus, Р. Е., Kerr K. М., Oudkerk М. et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. - 2017. - Vol. 28, Suppl. 4. - P. iv1-iv21.
3. Ben-Shahar S., Komlosh A., Nadav E. et al. 26S Proteasome-mediated Production of an Authentic Major Histocompatibility Class I-restricted Epitope from an Intact Protein Substrate // J. Biol. Chem. - 1999. - Vol. 274(31). - P. 2196-2197.
4. Lowry O.H., Rosenbrough N.J., Randall R.J. Protein measurement with the folin reagent // J. Biol. Chem. - 1951. - Vol. 193. - P. 265-275.
5. van Kasteren S.I., Overkleeft H., Ovaa H. et al. Chemical biology of antigen presentation by MHC molecules // Curr. Opin. Immunol. - 2014. - Vol. 26. - P. 21-31.
6. Бунеева O.A., Медведев A.E. Убиквитин-независимая деградация белков в протеасомах // Биомедицинская химия. - 2018. - Т. 64, №2. - С. 134-148.
7. Geng Y., Zhou Y., Wu S. et al. Sulforaphane Induced Apoptosis via Promotion of Mitochondrial Fusion and ERK1/2-Mediated 26S Proteasome Degradation of Novel Pro-survival Bim and Upregulation of Bax in Human Non-Small Cell Lung Cancer Cells // J. Cancer. - 2017. - Vol. 8(13). - P. 2456-2470.
8. Kakumu Т., Sato M., Goto D. et al. Identification of proteasomal catalytic subunit PSMA6 as a therapeutic target for lung cancer // Cancer Sci. - 2017. - Vol. 108(4). - P. 732-743.
9. Кондакова И.В., Спирина Л.В., Коваль В.Д. и др. Химотрипсинподобная активность и субъединичный состав протеасом в злокачественных опухолях человека // Молекулярная биология. - 2014. - Т. 48, №3. - С. 444-451.
10. Ding F., Xiao Н., Wang М. et al. The role of the ubiquitin-proteasome pathway in cancer development and treatment // Front. Biosci. (Landmark Ed). - 2014. - Vol. 19. - P. 886-895.
11. Спирина Л.В., Кондакова И.В., Коваль В.Д. и др. Активность протеасом и их субъединичный состав в ткани рака эндометрия: связь с клинико-морфологическими параметрами // Бюллетень экспериментальной биологии и медицины. - 2012. - Т. 153, №4. - С. 491-494.
12. Шашова Е.Е., Тарабановская Н.А., Бондарь Л.Н. Связь показателей протеасомной системы с прогнозом прогрессирования различных молекулярных подтипов рака молочной железы // Бюллетень сибирской медицины. - 2018. - Т. 17, №3. - С. 180- 187.
Приложение
Фигура 1 - Показатели 2х-летней общей выживаемости в зависимости от уровня химотрипсинподобной активности (ХПА) протеасом в опухолевой ткани при немелкоклеточном раке легкого
Фигура 2 - Показатели 2х-летней общей выживаемости в зависимости от уровня каспазаподобной активности (КПА) протеасом в опухолевой ткани при немелкоклеточном раке легкого
Фигура 3 - ROC-кривые для определения оценки качества бинарной классификации уровня химотрипсинподобной (ХПА) и каспазаподобной (КПА) активности протеасом в отношении развития неблагоприятного исхода
Таблица 1 - Значимость химотрипсинподобной (ХПА) и каспазаподобной (КПА) активности протеасом в опухолевой ткани в отношении развития неблагоприятного исхода
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы | 2020 |
|
RU2733697C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ ЛЮМИНАЛЬНЫМ В И ТРИЖДЫ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТОК, НЕ ПОЛУЧАВШИХ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ХИМИО- ИЛИ ГОРМОНОТЕРАПИЮ | 2017 |
|
RU2648523C1 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ РИСКА НЕБЛАГОПРИЯТНОГО ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ РАКОМ ЖЕЛУДКА | 2016 |
|
RU2662085C1 |
| Способ прогнозирования риска рецидива заболевания плоскоклеточным раком легкого IIб - IIIа стадии у пациентов, получивших адъювантную полихимиотерапию после радикальной операции | 2023 |
|
RU2815575C1 |
| Способ определения риска злокачественной трансформации эпителиальных клеток гортани у больных предопухолевыми заболеваниями гортани | 2022 |
|
RU2803858C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА МЫШЕЧНО-ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ ПОСЛЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ | 2012 |
|
RU2538632C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА РАЗВИТИЯ ОТДАЛЕННЫХ МЕТАСТАЗОВ У БОЛЬНЫХ РАКОМ ОБОДОЧНОЙ КИШКИ | 2016 |
|
RU2623119C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ГЕМАТОГЕННЫХ МЕТАСТАЗОВ ПОСЛЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ РАКА ПОЧКИ | 2013 |
|
RU2528100C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ЛИМФОГЕННЫХ МЕТАСТАЗОВ ПРИ ПЛОСКОКЛЕТОЧНЫХ КАРЦИНОМАХ ГОЛОВЫ И ШЕИ ПОСЛЕ ПРОВЕДЕНИЯ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ | 2013 |
|
RU2527338C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ РАКОМ ЖЕЛУДКА ПОСЛЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ | 2018 |
|
RU2696054C1 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для оценки риска развития неблагоприятного исхода у больных немелкоклеточным раком легкого (НМРЛ). Способ включает исследование ткани первичной опухоли, взятой во время операционного вмешательства, в которой определяют химотрипсинподобную (ХПА) и каспазаподобную (КПА) активность протеасом. При ХПА выше 48,8*103 Ед/мг белка и КПА выше 31,2*103 Ед/мг белка прогнозируют высокую вероятность развития неблагоприятного исхода. Использование изобретения позволяет повысить точность прогнозирования, с высокой чувствительностью и специфичностью предположить возможный исход заболевания у больных НМРЛ и рассчитать риск развития неблагоприятного исхода после радикальной операции. 1 табл., 3 ил., 2 пр.
Способ прогнозирования неблагоприятного исхода немелкоклеточного рака легкого (НМРЛ) путем биохимического исследования биологического материала пациентов, отличающийся тем, что исследуют ткань первичной опухоли, взятую во время операционного вмешательства, в которой определяют химотрипсинподобную (ХПА) и каспазаподобную (КПА) активность протеасом, и при ХПА выше 48,8*103 Ед/мг белка и КПА выше 31,2*103 Ед/мг белка прогнозируют высокую вероятность развития неблагоприятного исхода.
Авторы
Даты
2019-08-07—Публикация
2019-04-11—Подача