Изобретение относится к области медицины, онкологии и касается способов прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы, комбинированное лечение которых было начато с хирургического этапа.
В настоящее время при планировании терапии с целью персонификации выделяют несколько молекулярных подтипов РМЖ: люминального А, люминального В, HER-2-позитивного и тройного негативного. При этом учитывается экспрессия опухолью рецепторов эстрогенов (ER), рецепторов прогестерона (PR), рецепторов эпидермального фактора роста 2-го типа (HER-2) и маркера пролиферативной активности Ki67. Данные молекулярные подтипы РМЖ отличаются по механизмам развития, прогрессии и исходом заболевания. Кроме того, учитываются традиционные факторы, такие как: размеры новообразования, характер и степень распространенности процесса. Тем не менее, даже внутри одного молекулярного подтипа РМЖ наблюдается гетерогенность как по патогенетическим особенностям, так и в прогностическом плане. Более того, прогностическая ценность перечисленных факторов далеко не всегда является однозначной и достаточной. В связи с этим необходим поиск иных информативных дополнительных способов прогноза, которые будут учитывать сочетанное влияние традиционно оцениваемых факторов, и отражать метаболические процессы в опухоли.
Известен способ прогнозирования течения люминального без гиперэкспрессии HER-2 первично-операбельного РМЖ у женщин в постменопаузе (патент РФ №2694843, опубл. 17.07.2019) [3]. Указанный способ основан на иммуногистохимическом определении в опухолевой ткани уровня экспрессии рецепторов андрогенов. При экспрессии андрогенов на уровне 0-4% и 5-20% прогнозируют агрессивное течение люминального без гиперэкспрессии Неr2nеu первично-операбельного РМЖ. Однако для применения данного метода существуют ограничения: метод не может быть применен при трижды негативном молекулярном подтипе РМЖ, либо у пациенток с сохраненной менструальной функцией. Взятый за прототип метод может быть использован только у пациенток с люминальным молекулярным подтипом рака молочной железы, и находящихся в состоянии постменопаузы. Кроме того, у пациенток не должна выявляться гиперэкспрессия рецептора HER-2.
Новый технический результат - разработка нового способа прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы, обладающего высокой специфичностью и информативностью.
Для достижения нового технического результата в способе прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы, путем определяют молекулярно-биологические параметры опухоли в образцах тканей молочной железы и оценивают показатели в баллах, при этом определяют степень вовлеченности в процесс метастазирования регионарных лимфатических узлов (X1), причем, при вовлечении в процесс от 1 до 3 лимфатических узлов оценивают в 0 баллов, а при вовлечении в процесс 4-х и более лимфатических узлов оценивают в 1 балл; определяют значение маркера пролиферативной активности в опухоли Ki67(%) (Х2); также определяют экспрессию рецептора HER-2 (Х3), при этом, при ее выявлении оценивают в 1 балл, а при ее отсутствии оценивают как 0 баллов; определяют экспрессию рецепторов эстрогенов (Х4), при этом, при наличии положительной экспрессии оценивают в 1 балл, в случае отрицательной экспрессии оценивают как 0 баллов; далее определяют экспрессию рецепторов прогестерона (Х5), причем, при положительной экспрессии оценивают в 1 балл, в случае отрицательной экспрессии оценивают как 0 баллов; также определяют значение химотрипсинподобной активности протеасом в опухолевой ткани (ХПА) (УЕ*103 МЕ/мг белка) (X6); а также в опухолевой и условно неизмененной ткани определяют значения каспазаподобной активности протеасом (КПА) (УЕ*103 МЕ/мг белка) и активности кальпаинов (АК) (УЕ*103 МЕ/мг белка), затем определяют коэффициент каспазаподобной активности протеасом (кКПА) (Х7), и коэффициент активности кальпаинов (кАК) (Х8), которые рассчитывают, как отношение соответствующей активности в опухолевой ткани к активности в условно неизмененной ткани; затем определяют значение уравнения логистической регрессии Y по формуле (1), которая имеет следующий вид:
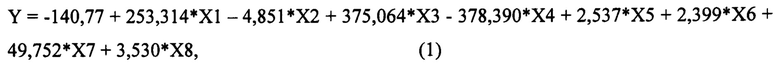
где
-140,77 - значение коэффициента регрессии свободного члена;
X1 - степень вовлеченности в процесс метастазирования регионарных лимфоузлов; в случае вовлечении в процесс метастазирования от 1 до 3 регионарных лимфатических узлов Х1=0; при поражении метастазами 4 и более регионарных лимфоузлов, X1=1;
253,314 - значение коэффициента регрессии признака X1;
Х2 - значение маркера пролиферативной активности в опухоли Ki67 (%);
-4,851 - значение коэффициента регрессии признака Х2;
Х3 - экспрессия рецептора HER-2, в случае выявления экспрессия рецептора HER-2 Х3=1; при отсутсвии экспрессия рецептора HER-2 Х3=0);
375,064 - значение коэффициента регрессии признака Х3;
Х4 - экспрессия рецепторов эстрогенов, при положительной экспрессии эстрогенов Х4=1; при отрицательной экспрессия рецепторов эстрогенов Х4=0;
-378,390 - значение коэффициента регрессии признака Х4;
Х5 - экспрессия рецепторов прогестерона, при положительной экспрессия рецепторов прогестерона Х5=1; при отрицательной экспрессия рецепторов прогестерона Х5=0;
2,537 - значение коэффициента регрессии признака Х5;
Х6 - значение ХПА протеасом в опухоли (УЕ*103 МЕ/мг белка);
2,399 - значение коэффициента регрессии признака Х6;
Х7 - значение кКПА протеасом;
49,752 - значение коэффициента регрессии признака Х7;
Х8 - значение кАК;
3,530 - значение коэффициента регрессии признака Х8,
вероятность развития гематогенных метастазов в отдаленном периоде у больных раком молочной железы Р определяют по формуле (2):

где е - математическая константа, равная 2,72,
и при Р≥50% определяют высокий, а при Р<50% - низкий риск развития отдаленных метастазов.
Показания к применению метода: способ предназначен для прогнозирования исхода заболевания в отдаленные сроки наблюдения у больных с первично операбельным инвазивным раком молочной железы с метастазами в регионарные лимфоузлы, комбинированное лечение которых было начато с хирургического этапа.
Критерии исключения: пациентки без метастазов в регионарных лимфоузлах (N0), метастатическая форма РМЖ (M1), проведение неоадьювантной химио- или гормонотерапии.
Способ осуществляют следующим образом:
Для прогнозирования риска развития отдаленных метастазов рака молочной железы определяют показатели вовлеченности в процесс метастазирования регионарных лимфоузлов (N), значение маркера пролиферативной активности в опухоли Кi67(%), экспрессию рецептора HER-2, экспрессию рецепторов к эстрогену, экспрессию рецептора к прогестерону, дополнительно в опухолевой ткани молочной железы проводят флюориметрическое определение химотрипсиноподобной активности протеасом (ХПА) (УЕ*103 МЕ/мг белка), в опухолевой ткани и в условно неизмененной ткани молочной железы проводят флюориметрическое определение каспазаподобной активности проеасом (КПА) (УЕ*103 МЕ/мг белка), активности кальпаинов (АК) (УЕ*103 МЕ/мг белка).
Для этого в течение 1-2 часов после операции из операционного материала берут образцы опухолевой и неизмененной ткани, располагающейся на расстоянии 1-3 см от первичного опухолевого узла, очищают от участков некроза, кровоизлияний и помещают в жидкий азот. Образцы тканей до определения активности протеасом и кальпаинов хранят не более 3 месяцев при температуре -70°С и размораживают не более 1 раза для исследования активности маркеров. Перед определением активности протеасом и кальпаинов из замороженной опухолевой и неизмененной ткани готовят осветленные гомогенаты. Для этого ткани измельчают до порошкообразного состояния с использованием ультразвукового гомогенизатора, затем ресуспендируют в 50 мМ трис-HCl буфере (рН=7,5), содержащем 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугируют 60 минут при 10000g и 4°С.
Химотрипсинподобную и каспазаподобную активности протеасом определяют в осветленных гомогенатах тканей, взятых от больных РМЖ, по гидролизу флуорогенного олигопептида Suc-LLVY-AMC и Cbz-LLG-AMC (Sigma, США), соответственно. Реакционная смесь для определения химотрипсинподобной и каспазаподобной активности протеасом должна содержать 20 мМ Tris-HCl (рН 7,5), 1 мМ дитиотрейтола, 30 мкМ субстрата, 5 мМ MgCl2 и 1 мМ АТФ. Образовавшийся продукт регистрируют на флуориметре при длине волны возбуждения 380 нм и эмиссии 440 нм. За единицу активности протеасом принимают количество фермента, при котором гидролизуется 1 нмоль соответствующего субстрата в течение 1 мин. Для оценки активности примесных протеаз применяют специфический ингибитор протеасом - MG132 (Sigma).
Определение активности кальпаинов (АК) проводят в осветленных гомогенатах по гидролизу Suc-LLVY-AMC (Sigma, США). Реакционная смесь для определения активности кальпаинов должна содержать 100 мМ Tris-HCl (рН 7,3), 145 mM NaCl, 1 мМ дитиотрейтола и 30 мкМ Suc-LLVY-AMC, с добавлением 10 mM CaCl2 или без него с 30 мкМ ингибитора кальпаинов ALLN (N-ацетил-лейцин-лейцин-норлейциналь) (Sigma). Активность протеасом и кальпаинов выражают в единицах активности на 1 мг белка (103 Ед/мг белка). Содержание белка определяют по методу Лоури.
Далее, с учетом определения соответствующих активностей протеасом и кальпаинов в опухолевой и условно неизмененной тканях РМЖ, оценивают соответствующие коэффициенты: кКПА, кАК. Коэффициенты рассчитывают как отношение соответствующей активности в опухолевой ткани к активности в условно неизмененной ткани.
На следующем этапе определяют значение уравнения логистической регрессии Y по формуле (1), которая имеет следующий вид:

где Y - значение уравнения регрессии;
-140,77 - значение коэффициента регрессии свободного члена;
X1 - степень вовлеченности в процесс метастазирования регионарных лимфоузлов; в случае вовлечении в процесс метастазирования от 1 до 3 регионарных лимфатических узлов Х1=0; при поражении метастазами 4 и более регионарных лимфоузлов, X1=1;
253,314 - значение коэффициента регрессии признака X1;
Х2 - значение маркера пролиферативной активности в опухоли Ki67 (%);
-4,851 - значение коэффициента регрессии признака Х2;
Х3 - экспрессия рецептора HER-2, в случае выявления экспрессия рецептора HER-2 Х3=1; при отсутствии экспрессия рецептора HER-2 Х3=0;
375,064 - значение коэффициента регрессии признака Х3;
Х4 - экспрессия рецепторов эстрогенов, при положительной экспрессии эстрогенов Х4=1; при отрицательной экспрессия рецепторов эстрогенов Х4=0;
-378,390 - значение коэффициента регрессии признака Х4;
Х5 - экспрессия рецепторов прогестерона, при положительной экспрессия рецепторов прогестерона Х5=1; при отрицательной экспрессия рецепторов прогестерона Х5=0;
2,537 - значение коэффициента регрессии признака Х5;
Х6 - значение ХПА протеасом в опухоли (УЕ*103 МЕ/мг белка);
2,399 - значение коэффициента регрессии признака Х6;
Х7 - значение кКПА протеасом;
49,752 - значение коэффициента регрессии признака Х7;
Х8 - значение кАК;
3,530 - значение коэффициента регрессии признака Х8,
вероятность развития отдаленных метастазов у больных раком молочной железы Р определяют по формуле (2):

где е - математическая константа, равная 2,72,
и при Р≥50% определяют высокий, а при Р<50% - низкий риск развития отдаленных метастазов.
Такой подход к оценке прогноза в отношении риска развития отдаленных метастазов при раке молочной железы обусловлен рядом предпосылок:
Прогрессирование опухолей является важной проблемой при лечении РМЖ [38]. В ряде работ распространенность процесса на регионарные лимфатические узлы ассоциирована с показателями отдаленной безметастатической выживаемости [24, 25, 35, 41]. Кроме того, характерная для данного заболевания высокая гетерогенность, обусловленная различными патогенетическими особенностями, осложняет контроль над поведением опухоли. В связи с этим необходим поиск иных информативных дополнительных маркеров прогноза, которые будут отражать метаболические процессы в опухоли.
Новые предлагаемые прогностические маркеры должны быть ассоциированы с патогенетическими особенностями различных молекулярных подтипов рака молочной железы. В настоящий момент известно, что при реализации ответа на терапевтическое воздействие при люминальном А типе РМЖ зачастую отмечается активация сигнального каскада опосредованного рецепторами эстрогенов, что и определяет чувствительность большинства данных опухолей к эндокринной терапии [30, 31]. Прогноз при люминальном В РМЖ менее благоприятный и сравним с трижды негативными опухолями [34, 39, 53]. Для люминальных В опухолей характерна активация либо ER, либо HER-2 - опосредованных сигнальных каскадов [26]. Трижды негативные раки (ТНР) составляют 15-20% вновь диагностированных случаев инвазивного рака молочной железы [13, 54], характеризуются отсутствием специфических мишеней терапевтического воздействия для проведения гормональной и таргетной терапии, имеют специфический характер метастазирования (чаще в легкие и головной мозг) [15, 33, 44, 57], агрессивное течение и неблагоприятный прогноз в отношении безрецидивной и общей выживаемости [31]. При трижды-негативных опухолях описывается вероятное участие р53-зависимого сигнального пути [12]. Ген р53 мутирует примерно у 80% пациентов с ТНР и является потенциальной терапевтической мишенью для пациентов с этой формой РМЖ. Показано, что ингибирование мутантного р53 изменяет экспрессию генов, вовлеченных в процессы регулируемой гибели клеток, регуляции апоптоза, сигнальной трансдукции, рефолдинга белков и локомоции [40, 52]. Исследования механизмов прогрессии РМЖ так или иначе связаны с существующими и потенциальными мишенями терапевтического воздействия и путей, регулирующих их активность и доступность.
Характеризуя процессы регуляции уровня и активности молекулярных маркеров, используемых в настоящее время для выделения молекулярных подтипов рака молочной железы с целью определения тактики лечения пациентов, выявлено, что внутриклеточные протеолитические системы, такие как протеасомная и кальпаиновая, активно вовлечены в данные процессы. В частности, рецепторы эстрогенов играют важную роль в передаче эстрогенного сигнала и в реализации эффектов гормонов. Большое значение в регуляции содержания рецепторов эстрогенов принадлежит убиквитин-протеасомной и кальпаиновой внутриклеточным протеолитическим системам, которые оказывают влияние на деградацию самих рецепторов и регуляторов их транскрипции, а также на экспрессию генов рецепторов [27, 36, 58]. Рецепторы прогестерона являются ключевыми модификаторами генов-мишеней рецепторов эстрогенов. Общее содержание рецепторов прогестерона является индикатором функциональной активности ER [26, 28, 45]. В опухолях рецепторы прогестерона действуют как молекулярные сенсоры для ненормально повышенных или активных сигнальных путей [18]. Деградация рецепторов прогестерона также частично опосредована протеасомами. Лиганд-зависимое снижение экспрессии прогестероновых рецепторов осуществляется через механизм, включающий фосфорилирование рецептора, его убиквитинирование и разрушение 26S протеасомами [57]. Показано, что активированные фосфо-PR рецепторы прогестерона подвержены более быстрому подавлению лиганд-зависимых рецепторов убиквитин-протеасомной системой по сравнению с дефосфорилированными видами PR [22, 23, 32]. HER-2 (human epidermal growth factor receptor 2, человеческий рецептор эпидермального фактора роста 2 типа, neu, ErbB-2, CD340) - мембранный белок, который является важным биомаркером и терапевтической мишенью рака молочной железы человека. Усиленная экспрессия рецептора HER-2 отмечается в 20-30% случаев этого заболевания, что часто связано с агрессивным течением и неблагоприятным прогнозом [29, 51]. Уровень экспрессии Ki67 является мерой для количественной оценки пролиферации клеток в опухолевых тканях [11]. В активации/инактивации рецептора HER-2 важная роль отводится протеасомной и кальпаиновой системам протеолиза [16]. Предполагается, что HER-2 ингибирует активность кальпаина-1 через повышающую регуляцию кальпастатина, эндогенного ингибитора кальпаина [10]. Показана непрерывная регуляция уровня Ki67 и его деградация протеасомной системой через влияние на циклин-зависимое фосфорилирование и дефосфорилирование [17, 19]. Кальпаины также принимают участие и в контроле клеточного цикла, опосредованно воздействуя на Ki67. Так, одним из субстратов для этих протеиназ является p27Kip1, важный негативный регулятор клеточного цикла, изменения в экспрессии которого при РМЖ описаны в ряде исследований [42, 43, 47]. К значимым субстратам для протеасом и кальпаинов можно отнести продукт протоонкогена р53 [14, 20]. Предполагается, что влияя на активность кальпаинов, можно воздействовать на прохождение клеткой клеточного цикла, способствуя гибели опухолевых клеток, в том числе и при РМЖ [20, 21, 55].
Кроме того, участие убиквитин-протеасомной и кальпаиновой систем доказано на этапах патогенеза при многих онкологических патологиях, таких как рак эндометрия, рак щитовидной железы, рак легкого, рак толстой кишки, опухоли головы и шеи, рак почки, рак мочевого пузыря и др. [1, 2, 4, 5, 46]. Также в ряде работ обсуждается возможность использования компонентов протеасомной и кальпаиновой систем как прогностических или предиктивных маркеров. В частности, при плоскоклеточном раке головы и шеи высокая ХПА активность протеасом является благоприятным прогностическим признаком и ассоциируется с более высокими показателями 2-летней общей выживаемости [7]. У больных эпителиальным раком яичников III стадии со сниженной активностью внутриклеточных протеаз обнаружено прогрессирование заболевания после проведенного лечения и достигнутой стабилизации [8]. У больных раком почки отмечается изменение активности протеасом в опухоли после проводимого лечения эверолимусом и ингибиторами тирозинкиназ [6, 9]. Трансляционные исследования показали, что высокая экспрессия кальпаина-2 коррелирует с неблагоприятными исходами при тройном негативном раке молочной железы [48], а высокая экспрессия кальпаина-1 коррелирует с плохой безрецидивной выживаемостью при HER-2 + раке молочной железы [49]. Кроме того, показано, что потеря кальпаина-1/2 задерживает самопроизвольное возникновение HER-2 положительных опухолей, но не предотвращает прогрессирование в исследованиях, проводимых in vivo на модели HER-2(+) онкогенеза [37]. Высокие уровни кальпаина-2 также были связаны с устойчивостью к платине и низкой общей выживаемостью у пациентов с раком яичников [50]. При раке яичника продемонстрирована взаимосвязь высокой экспрессии кальпаина-2, низкой экспрессии кальпастатина (р=0,010) и кальпаина-4 (р=0,003) с худшими показателями общей и безметастатической выживаемости [56]. Таким образом, для понимания особенности течения различных молекулярных подтипов рака молочной железы, наряду с определением основных клинических параметров, в качестве дополнительных характеристик, вероятно, можно рассматривать показатели протеасомной системы.
Предлагаемый способ разработан на основании исследования связи активности протеасом и кальпаинов с возникновением отдаленных метастазов при раке молочной железы, которое проводилось у 159 пациенток с первично операбельным инвазивным РМЖ (T1-3N0-3M0), при этом люминальный А рак был диагностирован у 73 больных (46%), люминальный В - у 62 (39%) и у 24 человек (15%) был диагностирован трижды негативный молекулярный подтип рака. Комбинированное лечение пациентов начиналось с хирургического этапа, включало проведение оперативного вмешательства, выполняемого в объеме радикальной мастэктомии или органосохранной расширенной операции, и проводилось на базе отделения общей онкологии НИИ онкологии Томского НИМЦ с 2009 по 2019 год. В адъювантном режиме лечение пациентам назначалось по показаниям с учетом молекулярного подтипа опухоли. Адъювантная химиотерапия при люминальном А раке проводилась при большей распространенности процесса по схеме АС и таксотер в монорежиме. При люминальном В HER-2 отрицательном раке проводилась химиотерапия в виде 4-6 курсов по схеме АС или FAC. При люминальном В HER-2 положительном раке проводилась химиотерапия и анти-HER-2 терапия герцептином. Больные ТНР в адъювантном режиме получали 6-8 курсов химиотерапии по схеме АС+таксотер. При этом, обязательным компонентом системного лечения люминального А и люминального В рака являлась гормонотерапия тамоксифеном или ингибиторами ароматазы в течение 5 лет. Лучевая терапия выполнялась по показаниям.
Согласно распространенности опухолевого процесса на регионарные лимфоузлы, все больные были разделены на три группы: первая группа (N0) - пациентки без признаков поражения метастазами регионарных лимфатических узлов; вторая группа (N1) - обнаружено от 1 до 3 метастатически-измененных регионарных лимфоузла, третья группа (N2-3) - больные, у которых обнаружено 4 и более метастатически-измененных регионарных лимфоузла. Следует отметить, что поражение 10 и более лимфатических узлов (N3) у пациентов, включенных в данное исследование, устанавливалось только по результатам планового гистологического исследования после выполнения хирургического вмешательства. При оценке регионарной распространенности процесса выявлено, что в группе больных люминальным А раком у 36% наблюдалось вовлечение 1-3 лимфатических узлов (N1), в 11% случаев метастазами было поражено более 4 лимфатических узлов (N2-3). При люминальном В раке N1 выявлена у 34% пациенток, у 18% больных было обнаружено N2-3. При трижды негативном раке N1 определялась у 21% пациенток, у 8% наблюдалось N2-3. Метастатическое поражение аксиллярных лимфатических узлов отсутствовало (N0) у 53% пациенток с люминальным А раком, у 48% пациенток люминальным В раком, и у 71% пациенток трижды негативным раком молочной железы.
Определение молекулярного подтипа РМЖ проводилось после оценки в биопсийном и операционном материале рецепторного статуса (экспрессия ER и к PR), HER-2 статуса и пролиферативной активности (экспрессия Ki67), которое выполнялось с использованием иммуногистохимического метода исследования.
Опухолевая и условно неизмененная ткань молочной железы забиралась из операционного материала в течении 1-2 часов после операции, замораживалась в жидком азоте. Затем в опухолевой и неизмененной ткани определялась химотрипсинподобная и каспазаподобная активность протеасом, а также активность кальпаинов, исходя из значений которых, рассчитывался коэффициент каспазаподобной активности протеасом кКПА и кАК.
Сроки наблюдения за больными составили от 3 до 60 месяцев. Безметастатическую продолжительность жизни исчисляли в месяцах с момента проведенной радикальной мастэктомии или секторальной резекции молочной железы до времени последнего посещения пациентом онколога или выявления исхода (прогрессирование в виде развития гематогенных метастазов) на этапах динамического наблюдения. Показатели 5-летней общей выживаемости (ОВ) в группе больных РМЖ составили 91%, медиана - 54 месяца. Показатели 5-летней безметастатической выживаемости - 78%, медиана - 46 месяцев. В представленной выборке прогрессирование процесса в виде развития гематогенных метастазов (метастатическое поражение костей таза, костей позвоночника, костей черепа, метастатическое поражение печени, легких, мозга, множественные отдаленные метастазы) в течении 5-летнего периода наблюдалось у 16,5% пациентов люминальным А раком, у 29% пациентов люминальным В раком и у 21% больных ТНР. Построение математических прогностических моделей было выполнено с использованием метода логистической регрессии. При этом модель включает в себя наиболее информативные признаки и представляет собой уравнение логистической регрессии, где зависимая (выходная) переменная является линейной функцией независимых (входных) переменных. Затем на основании значения уравнения логистической регрессии определялась вероятность развития исхода, при этом учитывалась чувствительность и специфичность модели.
При построении моделей рассматривались следующие независимые признаки: возраст, состояние менструальной функции, гистологический тип опухоли, размер первичного опухолевого узла (Т), распространенность процесса на регионарные лимфоузлы (N), наличие или отсутствие экспрессии рецепторов к эстрогену, рецепторов к прогестерону, экспрессии рецепторов HER-2, значение маркера пролиферативной активности в опухоли Кi67 (%), тип проводимого адъювантного лечения; значение химотрипсиноподобной активности протеасом в опухоли (ХПА) (УЕ*103 МЕ/мг белка), значение коэффициента химотрипсиноподобной активности протеасом (кХПА), значение каспазаподобной активности протеасом в опухоли (КПА) (УЕ*103 МЕ/мг белка), значение коэффициента каспазаподобной активности протеасом кКПА, значение активности кальпаинов в опухоли (АК) (УЕ*103 МЕ/мг белка), значение коэффициента активности кальпаинов (кАК).
Из всех рассматриваемых показателей в разработанную модель в качестве независимых признаков были включены следующие параметры: вовлеченность в процесс метастазирования регионарных лимфоузлов (N), значение маркера пролиферативной активности в опухоли Ki67 (%), экспрессия рецептора HER-2 (есть/нет); экспрессия рецепторов к эстрогену (ER) (есть/нет); экспрессия рецептора к прогестерону (PR) (есть/нет); значение химотрипсиноподобной активности протеасом в опухоли (ХПА) (УЕ*103 МЕ/мг белка), значение коэффициента каспазаподобной активности протеасом кКПА, значение коэффициента активности кальпаинов кАК.
На основе этих признаков была разработана прогностическая модель, которая обладает высокими чувствительностью и специфичностью (χ2=30,119; р=0,000; чувствительность 88%, специфичность 96%). Следует отметить, что данная модель применимая только в группе больных с наличием метастазов в регионарные лимфатические узлы (N1-3). Для прогнозирования вероятности развития прогрессирования у больных РМЖ без метастазов в регионарные лимфоузлы (N0) могут быть применимы те же параметры, но модель будет отличаться значениями коэффициента регрессии свободного члена и значениями коэффициента регрессии признаков, при этом чувствительность способа составляет 47%, специфичность - 97%.
Информативность применения разработанного способа иллюстрируется следующими клиническими примерами:
Пример 1: Больная Р., 61 год. В ноябре 2013 года обратилась в НИИ онкологии СО РАМН, где по результатам обследования был поставлен диагноз: рак молочной железы, T1N1M0. После определения иммуногистохимических параметров опухоли (экспрессия ER положительная, экспрессия PR положительная, Ki67-30%, экспрессия HER-2 - 3+-положительная), был установлен люминальный В HER-2 положительный молекулярный подтип опухоли. В январе 2014 г. больной была проведена радикальная мастэктомия. При гистологическом исследовании операционного материала диагностирован инвазивный протоковый рак 2 степени злокачественности. Из 10 исследованых лимфоузлов метастазы обнаружены в 2. Из анамнестических данных известно, что пациентка находится в состоянии постменопаузы (последняя менструация была 9 лет назад). В течение 1-2 часов после проведения радикального хирургического вмешательства из операционного материала были отобраны образцы опухолевой и условно неизмененной ткани молочной железы, в которых исследована химотрипсиноподобная, каспазаподобная активность протеасом и активность кальпаинов. Химотрипсинподобная активность протеасом (ХПА) в опухолевой ткани составила 59,01 (УЕ*103 МЕ/мг белка), каспазаподобная активность протеасом в опухолевой ткани составила 53,15 (УЕ*103 МЕ/мг белка), в неизмененной ткани - 18,38 (УЕ*103 МЕ/мг белка), коэффициент каспазаподобной активности протеасом (кКПА) составил 2,89. Активность кальпаинов в опухолевой ткани составила 599,1 (УЕ*103 МЕ/мг белка), в неизмененной - 322,65 (УЕ*103 МЕ/мг белка), коэффициент активности кальпаинов (кАК) составил 1,86. С учетом определения молекулярных параметров и распространенности опухолевого процесса в адъювантном режиме в составе комплексной терапии пациентке проводилась комбинированная терапия (4 курса адъювантной химиотерапии по схеме FAC, герцептин и гормональное лечение ингибиторами ароматазы).
Далее была проведено исследование согласно предлагаемому способу с использованием прогностических моделей. С учетом молекулярных параметров и распространенности процесса (N+), применили прогностическую модель (формула 1):
Y=-140,77+253,314*Х1-4,851*Х2+375,064*Х3-378,390*Х4+2,537*Х5+2,399*Х6+49,752*Х7+3,530*Х8=-140,77+253,314*0-4,851*30+375,064*1-378,390*1+2,537*1+2,399*59,01+49,752*2,89+3,530*1,86.=4,827.
Далее определили значение вероятности развития гематогенных метастазов в отдаленном периоде по формуле: Р=1/(1+e-Y)=0,99.
Вероятность прогрессирования в послеоперационном периоде у данной пациентки составляла 99%, что свидетельствовало о высоком риске развития отдаленных метастазов. При дальнейшем динамическом наблюдении за больной через 5 месяцев (июнь 2014 года) во время проведения комплексного лечения было выявлено прогрессирование заболевания: метастатическое поражение костей черепа. В дальнейшем пациентке проводилось лечение по поводу прогрессирования заболевания. Общий срок наблюдения за больной составил 23 месяца.
Пример 2: Больная Ю., 56 лет, менопауза 4 года. Образование в левой молочной железе обнаружила в марте 2013 года, обратилась в НИИ онкологии СО РАМН, где после комплексного обследования ей был поставлен диагноз: рак молочной железы ПВ стадия T2N1M0. После определения иммуногистохимических параметров опухоли (экспрессия ER положительная, экспрессия PR положительная, Ki67 - 60%, экспрессия HER-2 - 3+-положительная), был установлен люминальный В HER-2 положительный молекулярный подтип опухоли. 3.09.13 г. была выполнена секторальная резекция молочной железы, интраоперационная лучевая терапия (10ГР), аксиллярная лимфаденектомия. При гистологическом исследовании операционного материала диагностирована инвазивная карцинома неспецифического типа 2 степени злокачественности с метастазами в 3 из 15 лимфоузлов. В операционном материале (опухолевая и неизмененная ткань молочной железы) была исследована химотрипсиноподобная, каспазаподобная активность протеасом и активность кальпаинов. ХПА в опухолевой ткани составила 92,31 (УЕ*103 МЕ/мг белка), каспазаподобная активность протеасом в опухолевой ткани составила 30,20 (УЕ*103 МЕ/мг белка), в неизмененной ткани - 7,90 (УЕ*103 МЕ/мг белка), коэффициент каспазаподобной активности протеасом (кКПА) составил 3,82. Активность кальпаинов в опухолевой ткани составила 40,8 (УЕ*103 МЕ/мг белка), в неизмененной - 41,8 (УЕ*103 МЕ/мг белка), коэффициент активности кальпаинов (кАК) составил 0,98. С учетом определения молекулярных параметров и распространенности опухолевого процесса в адъювантном режиме в составе комплексной терапии пациентке проводилась комбинированная терапия (4 курса адъювантной химиотерапии по схеме FAC, герцептин и гормональное лечение тамоксифеном на протяжении 5 лет).
Для определения вероятности развития отдаленных метастазов для данной пациентки, с учетом молекулярных параметров и распространенности процесса (N+), было проведено исследование согласно предлагаемому способу.
Рассчитано значение уравнения логистической регрессии Y:
Y=-140,77+253,314*Х1-4,851*Х2+375,064*Х3-378,390*Х4+2,537*Х5+2,399*Х6+49,752*Х7+3,530*Х8=-140,77+253,314*0-4,851*60+375,064*1+378,390*1+2,537*1+2,399*92,31+49,752*3,82+3,530*0,98.=739,125.
Далее, определили значение вероятности развития гематогенных метастазов в отдаленном периоде по формуле: Р=1/(1+e-Y)=0,000.
Риск развития отдаленных метастазов в послеоперационном периоде у данной пациентки отмечен крайне низкий. При дальнейшем динамическом наблюдении за больной на протяжении 60 месяцев не было выявлено прогрессирования заболевания. Общий срок наблюдения за больной составил 60 месяцев.
Таким образом, учет вклада показателей протеасомной и кальпаиновой систем дополнительно основными клинико-морфологическими параметрами позволяет с большей степенью вероятности предполагать возможный исход заболевания у больных РМЖ, что увеличивает точность и информативность прогноза.
Источники информации, принятые во внимание при составлении описания:
1. Иванова Э.В. Химотрипсинподобная активность протеасом и общая активность кальпаинов при раке желудка и толстой кишки / Э.В. Иванова, И.В. Кондакова, Л.В. Спирина и др. // Бюллетень экспериментальной биологии и медицины. - 2014. - Т. 157(6). - с. 753-756.
2. Колегова Е.С. Малые белки теплового шока и убиквитин-протеасомная система при злокачественных опухолях / Е.С. Колегова, И.В. Кондакова, А.А. Завьялов // Вопросы онкологии. - 2016. - №3. - с. 401-405.
3. Кит О.И. Способ прогнозирования течения патологического процесса при первично-операбельном люминальном без гиперэкспрессии Her2neu раке молочной железы у женщин в постменопаузе / О.И. Кит, Ю.С. Шатова, Е.П. Ульянова, В.В. Токмаков // патент №2694843 от 17.07.2019. - Бюл. №20.
4. Родоман Г.В. Новый тест дифференциальной диагностики доброкачественных и злокачественных опухолей щитовидной железы / Родоман, И.Р. Сумеди, Т.И. Шалаева [и др.] // Лечебное дело. - 2015. - №3. - с. 72-76.
5. Спирина Л.В. Активность протеасом и их субъединичный состав при гиперпластических процессах и раке эндометрия / Л.В. Спирина, И.В. Кондакова, Л.А. Коломиец и др. // Опухоли женской репродуктивной системы. - 2011. - Т. 4. - с. 64-68.
6. Спирина Л.В. Влияние таргетной терапии на содержание транскрипционных, ростовых факторов, протеинкиназы mTOR и активности внутриклеточных протеиназ у больных диссеменированным раком почки / Л.В. Спирина, Е.А. Усынин, И.В. Кондакова и др. // Бюллетень экспериментальной биологии и медицины. - 2015. - Т. 160(12). - с. 768-772.
7. Чойнзонов Е.Л. Прогностическая значимость определения активности протеасом в тканях плоскоклеточных карцином головы и шеи / Е.Л. Чойнзонов, Л.В. Спирина, И.В. Кондакова и др. // Сибирский научный медицинский журнал. - 2014. - Т. 34(4). - с. 103-108.
8. Юнусова Н.В. Экспрессия и активность протеаз при метастазировании рака яичников / Н.В. Юнусова, Л.В. Спирина, И.В. Кондакова и др. // Известия Российской академии наук. Серия биологическая. - 2014. - №5. - с. 448-455.
9. Юрмазов З.А. Молекулярные показатели, связанные с эффективностью терапии эверолимусом у больных диссеменированным раком почки / З.А. Юрмазов, Л.В. Спирина, Е.А. Усынин, и др. // Сибирский онкологический журнал. - 2016. - т. 15(2)ю - с. 42-47.
10. Ai М. HER-2 regulates Brk/PTK6 stability via upregulating calpastatin, an inhibitor of calpain / M. Ai, S. Qiu, Y. Lu [et al.] // Cell Signal. - 2013. - Vol. 25(9). - p. 1754-1761.
11. Andre F. Ki67 - no evidence for its use in node-positive breast cancer (Review) / F. Andre, M. Arnedos, A. Goubar [et al] // Nature Reviews Clinical Oncology. - 2015. - Vol. 12. - p. 296-301.
12. Asher G. p53 proteasomal degradation: poly-ubiquitination is not the whole story / G. Asher, Y. Shaul // Cell Cycle. - 2005. - Vol. 4(8). - P. 1015.
13. Barton VN. Androgen receptor biology in triple negative breast cancer: a case for classification as AR+ or quadruple negative disease / Horm Cancer. - 2015. - Vol. 6(5-6). - p. 206-213.
14. Bernaudo S. Epidermal growth factor promotes cyclin G2 degradation via calpain-mediated proteolysis in gynaecological cancer cells / S. Bernaudo, S. Khazai, E. Honarparvar [et al.] // PLoS One. - 2017. - Vol. 12(6). - p. e0179906.
15. Biswas T. Inflammatory TNBC breast cancer: demography and clinical outcome in a large cohort of patients with TNBC / T. Biswas // Clin Breast Cancer. - 2016. - Vol. 16(3). - p. 212-216.
16. Castagnola P. Identification of an HSP90 modulated multi-step process for ERBB2 degradation in breast cancer cells / P. Castagnola, G. Bellese, F. Birocchi [et al.] // Oncotarget. - 2016. - Vol. 7(51). - p. 85411-85429.
17. Chierico L. The role of the two splice variants and extranuclear pathway on Ki67 regulation in non-cancer and cancer cells / L. Chierico, L. Rizzello, L. Guan [et al.] // PLoS One. - 2017. - Vol. 12(2). - p. e0171815.
18. Clarke C.L. Non-overlapping progesterone receptor cistromes contribute to cell-specific transcriptional outcomes / C.L. Clarke, J.D. Graham // PLoS One. - 2012. - Vol. 7. - p. e35859.
19. Cortese K. Carnosic acid induces proteasomal degradation of Cyclin B1, RB and SOX2 along with cell growth arrest and apoptosis in GBM cells / K. Cortese, A. Daga, M. Monticone [et al.] // Phytomedicine. - 2016. - Vol. 23(7). - p. 679-685.
20. Cui Q. P53-mediated cell cycle arrest and apoptosis through a caspase-3- independent, but caspase-9-dependent pathway in oridonin-treated MCF-7 human breast cancer cells / Q. Cui, J.H. Yu, J.N. Wu [et al.] // Acta Pharmacol Sin. - 2007. - Vol. 28(7). - p. 1057-1066.
21. Del Carmen Lafita-Navarro M. Identification of calpain-activated protein functions / M. Del Carmen Lafita-Navarro, M. Conacci-Sorrell // Methods Mol Biol. - 2019. - Vol. 1915. - p. 149-160.
22. Daniel A.R. Lange phosphorylation-dependent antagonism of sumoylation derepresses progesterone receptor action in breast cancer cells / A.R. Daniel, E.J. Faivre, C.A. Lange [et al.] // Mol Endocrinol. - 2007. - Vol. 21. - p. 2890-2906.
23. Daniel A.R. Progesterone receptor-B enhances estrogen responsiveness of breast cancer cells via scaffolding PELP1 - and estrogen receptor-containing transcription complexes / A.R. Daniel, A.L. Gaviglio, T.P. Knutson [et al.] // Oncogene. - 2015. - Vol. 34. - p. 506-515.
24. Durak M.G. Prognostic importance of tumor deposits in the ipsilateral axillary region of breast cancer patients / M.G. Durak, T. Canda, B. Yilmaz [et al.] // Pathol Oncol Res. - 2018. - Vol. 27. - p. 1-7.
25. Fu F. Subtype-specific associations between breast cancer risk polymorphisms and the survival of early-stage breast cancer / F. Fu, W. Guo, Y. Lin [et al.] // J Transl Med. - 2018. - Vol. 16(1). - p. 270.
26. Graham J. D. Progesterone receptor A and В protein expression in human breast cancer / J. D. Graham, C. Yeates, R.L. Balleine [et al.] // J. Steroid Biochem. and Mol. Biol. - 1996. - Vol. 56. - №1-6. P. 93-98.
27. Helzer K.T. Ubiquitylation of nuclear receptors: new linkages and therapeutic implications / K.T. Helzer, C. Hooper, S. Miyamoto [et al.] // J Mol Endocrinol. - 2015. - Vol. 54. - p. R151-R167.
28. Hilton H.N. Estrogen and progesterone signalling in the normal breast and its implications for cancer development / H.N. Hilton, C.L. Clarke, J.D. Graham // Mol Cell Endocrinol. - 2018. - Vol. 466. - p. 2-14.
29. Hynes N.E. ErbB receptors and signaling pathways in cancer / N.E. Hynes, G. MacDonald // CurrOpin Cell Biol. - 2009. - Vol. 21. - p. 177-184.
30. Kastrati I. A novel strategy to co-target estrogen receptor and nuclear factor κВ pathways with hybrid drugs for breast cancer therapy / I. Kastrati, M.I. Siklos, S.D. Brovkovych [et al.] // Horm Cancer. - 2017. - Vol. 8(3). - p. 135-142.
31. Kennecke H. Metastatic behavior of breast cancer subtypes / H. Kennecke, R. Yerushalmi, R. Woods [et al.] // J. Clin. Oncol. - 2010. - Vol. 28(20). - P. 3271-3277.
32. Knutson T.P. Phosphorylated and sumoylation-deficient progesterone receptors drive proliferative gene signatures during breast cancer progression / T.P. Knutson, A.R. Daniel, D. Fan [et al.] // Breast Cancer Res. - 2012. - Vol. 14. - p. R95.
33. Kuo W.-H. Molecular characteristics and metastasis predictor genes of triple-negative breast cancer: a clinical study of triple-negative breast carcinomas / W.-H. Kuo, Y.-Y. Chang, L.-C. Lai [et al.] // PLoS One. - 2012. - Vol. 7(9). - p. e45831.
34. Liu F. The ubiquitin ligase CHIP inactivates NF-κВ signaling and impairs the ability of migration and invasion in gastric cancer cells / F. Liu, J. Zhou, P. Zhou // Int J Oncol. - 2015. - Vol. 46(5). - P. 2096-2106.
35. Lim Y.J. A Novel prognostic nomogram for predicting risks of distant failure in patients with invasive breast cancer following postoperative adjuvant radiotherapy / Y.J. Lim, S.W. Lee, N. Choi [et al.] // Cancer Res Treat. - 2018. - Vol. 50(4). - p. 1140-1148.
36. Iizuka M. Intrinsic ubiquitin E3 ligase activity of histone acetyltransferase Hbo1 for estrogen receptor α / M. Iizuka, T. Susa, M. Tamamori-Adachi [et al.] // Proc Jpn Acad Ser В Phys Biol Sci. - 2017. - Vol. 93(7). - p. 498-510.
37. MacLeod J.A. Genetic disruption of calpain-1 and calpain-2 attenuates tumorigenesis in mouse models of HER-2 + breast cancer and sensitizes cancer cells to doxorubicin and lapatinib / J.A. MacLeod, Y. Gao, C. Hall [et al.] // Oncotarget. - 2018. - Vol. 9(70). - p. 33382-33395.
38. van Maaren M.C. 10-year recurrence rates for breast cancer subtypes in the Netherlands: a large population-based study / M.C. van Maaren, L. de Munck, L.J. Strobbe [et al.] // Int J Cancer. - 2019. - Vol. 144(2). - p. 263-272.
39.  LA. Breast carcinoma subtypes show different patterns of metastatic behavior / LA.
LA. Breast carcinoma subtypes show different patterns of metastatic behavior / LA.  ,
,  , L.
, L.  [et al.] // Virchows Arch. - 2017. - Vol. 470(3). - p. 275-283.
[et al.] // Virchows Arch. - 2017. - Vol. 470(3). - p. 275-283.
40. Pan Y. P53 and Ki67 as prognostic markers in triple-negative breast cancer patients / Y. Pan, Y. Yuan, G. Liu [et al] // PLoS One. - 2017. - Vol. 12(2). - p. e0172324.
41. Park M.H. Elevated interleukin-13 receptor alpha 1 expression in tumor cells is associated with poor prognosis in patients with invasive breast cancer / M.H. Park, H.J. Kwon, J.R. Kim [et al.] // Ann Surg Oncol. - 2017. - Vol. 24(12). - p. 3780-3787.
42. Patel P. Dual inhibition of CDK4 and CDK2 via targeting p27 Tyrosine Phosphorylation induces a potent and durable response in breast cancer cells / P. Patel, V. Tsiperson, S.R.S. Gottesman [et al.] // Mol Cancer Res. - 2018. - Vol. 16(3). - p. 361-377.
43. Peng F. PFKFB3 is involved in breast cancer proliferation, migration, invasion and angiogenesis / F. Peng, Q. Li, J.Y. Sun [et al.] // Int J Oncol. - 2018. - Vol. 52(3). - p. 945-954.
44. Rakha E.A. Breast cancer prognostic classification in the molecular era: the role of histological grade / E.A. Rakha, J.S. Reis-Filho, F. Baehner [et al.] // Breast Cancer Res. - 2010. - Vol. 12. - p. 207.
45. Salem K. Sensitivity and isoform specificity of 18F-Fluorofuranylnorprogesterone for measuring progesterone receptor protein response to estradiol challenge in breast cancer / K. Salem, M. Kumar, Y. Yan [et al] // J Nucl Med. - 2018. - Jul 20. - p. 1-29.
46. Sharova N.P. Changes in proteasome pool in human papillary thyroid carcinoma development / N.P. Sharova, T.M. Astakhova, Y.D. Karpova, [et al.] // Central European Journal of Biology. - 2011. - Vol. 6. - №4. - p. 486-496.
47. Seviour E.G. Functional proteomics identifies miRNAs to target a p27/Myc/phospho-Rb signature in breast and ovarian cancer. / E.G. Seviour, V. Sehgal, Y. Lu [et al.] // Oncogene. - 2016. - Vol. 35(6). - p. 691-701.
48. Storr S.J. Calpain system protein expression in basal-like and triple-negative invasive breast cancer / S.J. Storr, K.W. Lee, C.M. Woolston [et al.] // Ann Oncol. - 2012. - Vol. 23(9). - p. 2289-2296.
49. Storr SJ, Woolston CM, Barros FF, Green AR, Shehata M, Chan SY, Ellis IO, Martin SG. Calpain-1 expression is associated with relapse-free survival in breast cancer patients treated with trastuzumab following adjuvant chemotherapy / S.J. Storr, C.M. Woolston, F.F. Barros [et al.] // Int J Cancer. - 2011. - Vol. 129. - p. 1773-1780.
50. Storr S.J. Calpain-2 expression is associated with response to platinum based chemotherapy, progression-free and overall survival in ovarian cancer / S.J. Storr, S. Safuan, C.M. Woolston [et al.] // J.Cell Mol Med. - 2012. - Vol. 16. - p. 2422-2428.
51. Seo Y. PIK3СA Mutations and neoadjuvant therapy outcome in patients with human epidermal growth factor receptor 2-positive breast cancer: a sequential analysis / Y. Seo, Y.H. Park, J.S. Ahn [et al.] // J Breast Cancer. - 2018. - Vol. 21(4). - p. 382-390.
52. Shiba E. Ca²+; -dependent neutral protease (Calpain) activity in breast cancer tissue and estrogen receptor status / E. Shiba, J.I. Kambayashi, M. Sakon, [et. al.] // Breast Cancer. - 1996. - Vol. 3(1). - p. 13-17.
53. Synnott N.C Mutant p53: a novel target for the treatment of patients with triple-negative breast cancer? / N.C. Synnott, A. Murray, P.M. McGowan [et al.] // Int J Cancer. - 2017. - Vol. 140(1). - p. 234-246.
54. Thomas P. Identity of an estrogen membrane receptor coupled to a G protein in human breast cancer cells / P. Thomas, Y. Pang, E.J. Filardo [et al.] // Endocrinology. - 2005. - Vol. 146. - p. 624-632.
55. Yu B.H. Cytoplasmic FOXP1 expression is correlated with ER and calpain II expression and predicts a poor outcome in breast cancer. / B.H. Yu, B.Z. Li, X.Y. Zhou [et al] // Diagn Pathol. - 2018. - Vol. 13(1). - p. 36-44.
56. Zhang S. Calpain system protein expression and activity in ovarian cancer / S. Zhang, S. Deen, S.J. Storr [et al.] // J Cancer Res Clin Oncol. - 2018. - doi: 10.1007/s00432-018-2794-2.
57. Zhang P.J. CUE domain containing 2 regulates degradation of progesterone receptor by ubiquitin-proteasome / P.J. Zhang, J. Zhao, H.Y. Li [et al.] // EMBO J. - 2007. - Vol. 26. - P. 1831-1842.
58. Zhou W. Links between oestrogen receptor activation and proteolysis: relevance to hormone-regulated cancer therapy / W. Zhou, J.M. Slingerland // Nat. Rev. Cancer. - 2014. - Vol. 14. - p. 26-38.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ ЛЮМИНАЛЬНЫМ В И ТРИЖДЫ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТОК, НЕ ПОЛУЧАВШИХ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ХИМИО- ИЛИ ГОРМОНОТЕРАПИЮ | 2017 |
|
RU2648523C1 |
| Способ прогнозирования течения патологического процесса при первично-операбельном люминальном без гиперэкспрессии Her2neu раке молочной железы у женщин в постменопаузе | 2018 |
|
RU2694843C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ АНТИЭСТРОГЕННОЙ ТЕРАПИИ ТАМОКСИФЕНОМ У БОЛЬНЫХ С ЛЮМИНАЛЬНЫМ ТИПОМ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2558857C1 |
| Способ прогнозирования вероятности полной регрессии при проведении неоадъювантной химиотерапии у пациенток с трижды негативным молекулярно-генетическим субтипом рака молочной железы | 2016 |
|
RU2623118C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОЗНИКНОВЕНИЯ МЕСТНЫХ РЕЦИДИВОВ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ У БОЛЬНЫХ МЕСТНО-РАСПРОСТРАНЕННЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2020 |
|
RU2734719C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЛИМФОГЕННОГО МЕТАСТАЗИРОВАНИЯ ПРИ ТРИПЛ НЕГАТИВНОЙ ИНВАЗИВНОЙ КАРЦИНОМЕ НЕСПЕЦИФИЧЕСКОГО ТИПА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2558860C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ГЕМАТОГЕННОГО МЕТАСТАЗИРОВАНИЯ ПРИ ТРИПЛ НЕГАТИВНОЙ ИНВАЗИВНОЙ КАРЦИНОМЕ НЕСПЕЦИФИЧЕСКОГО ТИПА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2558863C1 |
| Способ прогнозирования высокого риска регионарного метастазирования при раке молочной железы | 2023 |
|
RU2816441C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДОСТИЖЕНИЯ ПОЛНЫХ МОРФОЛОГИЧЕСКИХ РЕГРЕССИЙ У БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ ТРИПЛ-НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2560707C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ПРОГРЕССИРОВАНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ НА ФОНЕ ТАМОКСИФЕНА С УЧЕТОМ ЭКСПРЕССИОННЫХ ОСОБЕННОСТЕЙ ОПУХОЛИ | 2023 |
|
RU2823488C1 |
Настоящее изобретение относится к медицине, а именно к онкологии, и касается прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы. Для этого определяют молекулярно-биологические параметры опухоли в образцах тканей молочной железы и оценивают показатели в баллах, учитывая степень вовлеченности в процесс метастазирования регионарных лимфатических узлов (X1), значение маркера пролиферативной активности в опухоли Ki67(%) (Х2); экспрессию рецептора HER-2 (Х3), экспрессию рецепторов эстрогенов (Х4), экспрессию рецепторов прогестерона (Х5), значение химотрипсинподобной активности протеасом в опухолевой ткани (ХПА) (УЕ*103 МЕ/мг белка) (Х6); значения каспазаподобной активности протеасом (КПА) (УЕ*103 МЕ/мг белка) и активности кальпаинов (АК) (УЕ*103 МЕ/мг белка) в опухолевой и неизмененной ткани, коэффициент каспазаподобной активности протеасом (кКПА) (Х7), и коэффициент активности кальпаинов (кАК) (Х8). Определяют значение уравнения логистической регрессии Y:
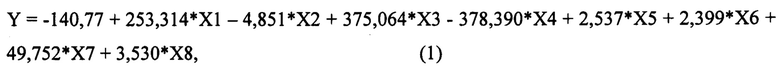
вероятность развития гематогенных метастазов Р определяют по формуле (2):

где е - математическая константа, равная 2,72. При Р≥50% определяют высокий, а при Р<50% - низкий риск развития отдаленных метастазов. Способ обеспечивает высокую точность диагностики за счет учета вовлеченности в патологический процесс указанных патогенетических факторов. 2 пр.
Способ прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы, характеризующийся тем, что определяют молекулярно-биологические параметры опухоли в образцах тканей молочной железы и оценивают показатели в баллах, при этом определяют степень вовлеченности в процесс метастазирования регионарных лимфатических узлов (X1), причем при вовлечении в процесс от 1 до 3 лимфатических узлов оценивают в 0 баллов, а при вовлечении в процесс 4-х и более лимфатических узлов оценивают в 1 балл; определяют значение маркера пролиферативной активности в опухоли Ki67(%) (Х2); также определяют экспрессию рецептора HER-2 (Х3), при этом при ее выявлении оценивают в 1 балл, а при ее отсутствии оценивают как 0 баллов; определяют экспрессию рецепторов эстрогенов (Х4), при этом при наличии положительной экспрессии оценивают в 1 балл, в случае отрицательной экспрессии оценивают как 0 баллов; далее определяют экспрессию рецепторов прогестерона (Х5), причем при положительной экспрессии оценивают в 1 балл, в случае отрицательной экспрессии оценивают как 0 баллов; также определяют значение химотрипсинподобной активности протеасом в опухолевой ткани (ХПА) (УЕ*103 МЕ/мг белка) (Х6); а также в опухолевой и условно неизмененной ткани определяют значения каспазаподобной активности протеасом (КПА) (УЕ*103 МЕ/мг белка) и активности кальпаинов (АК) (УЕ*103 МЕ/мг белка), затем определяют коэффициент каспазаподобной активности протеасом (кКПА) (Х7), и коэффициент активности кальпаинов (кАК) (Х8), которые рассчитывают, как отношение соответствующей активности в опухолевой ткани к активности в условно неизмененной ткани; затем определяют значение уравнения логистической регрессии Y по формуле (1), которая имеет следующий вид:
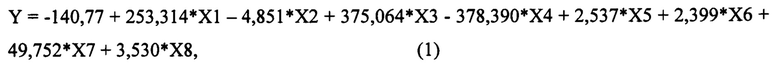
где
-140,77 - значение коэффициента регрессии свободного члена;
X1 - степень вовлеченности в процесс метастазирования регионарных лимфоузлов; в случае вовлечения в процесс метастазирования от 1 до 3 регионарных лимфатических узлов Х1=0; при поражении метастазами 4 и более регионарных лимфоузлов, Х1=1;
253,314 - значение коэффициента регрессии признака X1;
Х2 - значение маркера пролиферативной активности в опухоли Ki67 (%);
-4,851 - значение коэффициента регрессии признака Х2;
Х3 - экспрессия рецептора HER-2, в случае выявления экспрессии рецептора HER-2 Х3=1; при отсутствии экспрессии рецептора HER-2 Х3=0);
375,064 - значение коэффициента регрессии признака Х3;
Х4 - экспрессия рецепторов эстрогенов, при положительной экспрессии эстрогенов Х4=1; при отрицательной экспрессии рецепторов эстрогенов Х4=0;
-378,390 - значение коэффициента регрессии признака Х4;
Х5 - экспрессия рецепторов прогестерона, при положительной экспрессии рецепторов прогестерона Х5=1; при отрицательной экспрессии рецепторов прогестерона Х5=0;
2,537 - значение коэффициента регрессии признака Х5;
Х6 - значение ХПА протеасом в опухоли (УЕ*103 МЕ/мг белка);
2,399 - значение коэффициента регрессии признака Х6;
Х7 - значение кКПА протеасом;
49,752 - значение коэффициента регрессии признака Х7;
Х8 - значение кАК;
3,530 - значение коэффициента регрессии признака Х8,
вероятность развития гематогенных метастазов в отдаленном периоде у больных раком молочной железы Р определяют по формуле (2):

где е - математическая константа, равная 2,72,
и при Р≥50% определяют высокий, а при Р<50% - низкий риск развития отдаленных метастазов.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТДАЛЕННЫХ МЕТАСТАЗОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 1997 |
|
RU2129278C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ГЕМАТОГЕННОГО МЕТАСТАЗИРОВАНИЯ ПРИ ДВУХСТОРОННЕЙ СИНХРОННОЙ ИНВАЗИВНОЙ КАРЦИНОМЕ НЕСПЕЦИФИЧЕСКОГО ТИПА МОЛОЧНЫХ ЖЕЛЕЗ | 2015 |
|
RU2589287C1 |
| US 2015322533 A1, 12.11.2015 | |||
| US 2017010267 A1, 12.01.2017 | |||
| ШАШОВА Е.Е | |||
| и др | |||
| "Протеасомная и кальпаиновая протеолитические системы при различных молекулярных подтипах рака молочной железы" | |||
| Сибирский онкологический журнал, 2017;16(3):33-39 | |||
| ШАШОВА Е.Е | |||
| и др | |||
| Изменение химотрипсиноподобной | |||
Авторы
Даты
2020-10-06—Публикация
2020-03-11—Подача