Область применения изобретения:
Изобретение относится к области биотехнологии и связано с получением производных хитозанадля доставки лекарств к эпителиальным клеткам барьерных органов и тканей, а также для визуализации мембран клеток. Иммобилизация лекарства на производные хитозана обеспечит его лучшую адгезию к мембранам клеток, что увеличит депонирование лекарства на слизистых. Такие производные хитозана с флуоресцентной меткой являются маркерами мембран клеток, что может быть использовано в научно-производственных и научных лабораториях для широкого спектра исследовательских задач, связанных с изучением функции внутриклеточных структур, а также для разработки систем доставки лекарств нового поколения с повышенной адгезией к эпителию.
Общее состояние проблемы:
Разработка носителей для целевой доставки лекарств является одним из приоритетных направлений медицины. Известен ряд заболеваний, для которых требуется локальная доставка терапевтических препаратов, к которым относятся инфекционные и воспалительные заболевания легких (туберкулез, аспергиллез, саркоидоз, опухоли легких, астма и др.), желудочно-кишечного тракта (болезнь Крона, язвы желудка, опухоли и др.), кожи (розацеа, акне, пузырные дерматозы и др.). Локальная доставка также может использоваться для разработки пероральных и сублингвальных вакцин.
Быстрое развитие инструментальных методов анализа, в том числе в области визуализации процессов в живых клетках, приводит к необходимости разработки новых систем доставки лекарств с селективным накоплением в различных клеточных органеллах без потери функции лекарства, для чего требуются маркеры органелл.
Системы локальной доставки лекарств нового поколения должны отвечать ряду требований, среди которых высокая адгезия к поверхностным слоям эпителия барьерных органов, низкая токсичность носителя, способность высвобождать лекарства внутрь клетки, а для флуоресцентных проб - длительное удержание на поверхности клетки и высокий квантовый выход сигнала. Хитозан, ближайшее дезацетилированное производное природного полисахарида хитина, отвечает многим из этих требований. Молекула хитозана, в отличие от многих биосовместимых полимеров, имеет большое количество реакционноспособных групп, что позволяет получать производные с заданными свойствами по гидрофильности/гидрофобности, размеру, заряду, способности присоединять лекарства или флуоресцентные молекулы как ковалентно, так и за счет гидрофобных и/или Ван-дер-Ваальсовых взаимодействий.
Уровень техники
Известен препарат для доставки лекарств для терапии рака полости рта на основе хитозана, на который иммобилизованы полиэтиленгликоль и один и/или несколько диагностических или терапевтических агентов (US 2014234212 А1). Аналогичный патент опубликован от китайской группы (CN 105142619 (А)).
Известно изобретение системы доставки иммуногена (белка или ДНК) через слизистые оболочки с помощью наночастицхитозана (CN 101204364 (А).
В вышеупомянутых изобретениях описано получение наночастиц хитозана путем комлексообразования с низкомолекулярными сшивающими агентами (триполифосфат натрия) или ДНК. Такие способы имеют ограничения, связанные с низким выходом частиц (не более 20%), имеют низкий поверхностный заряд и стабильность в физиологических условиях. На основе предлагаемого нами производного хитозана, возможно получение стабильных наночастиц с высоким выходом путем самоорганизации в растворе.
Известен препарат для доставки иммунизирующего антигена Streptococcus pneumoniae, в котором хитозан используется как адъювант (CN 1816350). Препарат предназначен для интраназального введения в виде капель или спрея. В данном патенте для иммунизации используются смеси различных антигенов с немодифицированным хитозаном.
Известны флуоресцентные агенты на основе гликольхитозана, содержащего гидрофобные группы и биотин для визуализации клеточных мембран (CN 104316500 А). Окрашивание клеток осуществляли в две стадии, путем добавления препарата производного хитозана, а затем ФИТЦ-меченного авидина. Недостатком данного способа является двухстадийность окрашивания, а также необходимость получения авидин- и биотин-меченых молекул.
Известны трекеры клеточной мембраны, получаемые путем карбодиимидной пришивки различных типов звеньев (гидрофобных (холестерол, фосфолипиды, алканы, витамин Е), гидрофильных (PEG), флуоресцентных и др.) к полимерной цепи хитозана с молекулярной массой от 10000 до 100000 Да (CN 104288787 A, CN 104231114 А). В приведенных способах описаны производные хитозана, растворимые только в кислой среде. Нами предложен способ получения кватернизированных производных, содержащих гидрофобные звенья, растворимых в широком диапазоне рН, что является конкурентным преимуществом.
Известны флуоресцентные биопробы, представляющие собой молекулу хитоолигосахаридов, к которой присоединены от 1 до 15 молекул цианина и фолиевая кислота (CN 1975418 А). Авторы предлагают использовать препарат для селективной окраски опухолевых клеток, гиперэкспрессирующих фолатный рецептор. В рамках данного способа сделано предположение о возможности окрашивания клеток такими конъюгатами без указания на селективное накопление препаратов в органеллах.
Наиболее близким по сущности и назначению является патент CN 106589163 А, описывающий способ получения водорастворимых флуоресцентных проб с агрегативно-индуцированной эмиссией, осуществляемый путем синтеза кватернизированного хитозана с последующим присоединением тетрафенилэтилена. От прототипа предлагаемый нами способ отличается 1) дополнительной стадией ацилирования с помощью капронового ангидрида, придающей гидрофобность хитозану, а следовательно, большее сродство к клеточной мембране; 2) природой флуоресцентной метки.
Техническим результатом предлагаемого изобретения
Техническим результатом является получение гидрофобного, малотоксичного положительно заряженного производного хитозана, характеризующегося высокой растворимостью при нейтральных рН, к которому присоединен флуоресцеинизотиоцианат (ФИТЦ), являющийся прототипом лекарственного средства.
Раскрытие изобретения
Сущность изобретения представлена получением производного хитозана с молекулярной массой 20 килодальтон (кДа), модифицированного гидрофобными заместителями для улучшения связывания с мембранами клеток и снижения токсичности и дополнительно кватернизированного для повышения растворимости при нейтральных значениях рН и увеличения положительного заряда. К такому производному присоединен ФИТЦ-отрицательно заряженный флуоресцентный краситель, который использован как прототип лекарства и который также является флуоресцентной пробой для биологических экспериментов.
В основе изобретения лежат ранее полученные нами данные по внутриклеточному трафику производных хитозана с различными физико-химическими свойствами [Zubareva A.A. идр. Intracellular sorting of differently charged chitosan derivatives and chitosan-based nanoparticles // Nanoscale. 2015. T. 7. №17. C. 7942-52]. Клетки млекопитающих имеют суммарный отрицательный заряд, в том числе мембраны клеток.
Мембраны клеток состоят из гидрофобных компонентов - полярных липидов. Таким образом, лучшими мукоадгезивными свойствами обладают положительно заряженные полимеры. Немодифицированный хитозан связывается с мембранами клеток, но не проникает внутрь клеток из-за плохой растворимости при нейтральном рН. Введение в молекулу хитозана четвертичных аммониевых групп приводит к получению положительно заряженных и растворимых при нейтральных рН полимеров, однако такие производные токсичны для клеток [Zubareva et al. European Polymer Journal 93 (2017) 743-749]. Введение гидрофобных звеньев приводит к значительному снижению токсичности таких производных [Свирщевская и др., Прикладная биохимия и микробиология, 2016, том 52, №5, с. 467-475], а также увеличивает сродство полимера к мембранам клеток, таким образом усиливая мукоадгезивные свойства. Системы доставки лекарств, получаемые на основе таких производных хитозана могут использоваться для перорального, сублингвального, интраназального, ректального, ингаляторного или надкожного применения.
Пример 1. Получение флуоресцентных проб для окраски клеточных мембран на основе кватернизированного хитозана, содержащего гидрофобные заместители
Получение производного хитозана осуществляли в три этапа: ацилирование хитозана 20 кДа, присоединение четверичных аммониевых групп к полимерной цепи с последующим введением флуоресцентной пробы флуоресцеинизотиоцианта (ФИТЦ).
Ацилирование хитозана
Хитозан массой 2 г (12,4 ммоль) с ММ 20 кДа и СД 98% растворяли в 120 мл 1%-ной уксусной кислоты и добавляли 200 мл метилового спирта. Затем добавляли (1,5 ммоль) ангидрида капроновой кислоты при интенсивном перемешивании в течение 20 мин, затем подтитровывали 12%-ным раствором аммиака до рН 8,5, полученный осадок диализовали и лиофильно высушивали. Выход ацилированных гидрофобных производных хитозана (ГХ) составлял 50-70%. Спектр исходного хитозана и полученного производного приведен на Рис. 1 (А, Б) соответственно. Стрелками показаны сигналы протонов Н3-Н6 глюкопиранозного звена (черный цвет), Н2 (белый цвет). Скобки демонстрируют сигналы протонов остатка капроновой кислоты (Б).
Синтез кватернизированного ацилированного производного хитозана
Для синтеза кватернизированного производного хитозана, содержащего гидрофобные группы (ГКХ) 1 г ГХ диспергировали в 30 мл дистиллированной воды при температуре 85°С и добавляли 3,55 мл (18,5 ммоль) глицидилтриметиламмоний хлорида тремя равными порциями с интервалом 1 ч. Реакционную массу перемешивали в течение 5 ч при 85°С. Затем приливали реакционную смесь к 33 мл охлажденного ацетона. Образовавшийся осадок отделяли декантацией, растворяли в 17 мл метилового спирта и осаждали в смеси ацетон-этанол (4:1 об./об.). Полученный осадок вновь отделяли декантацией и высушивали лиофильно. Степень замещения (СЗ) кватернизированных производных хитозана определяли кондуктометрическим титрованием, наличие четвертичных аммониевых групп выявляли методом 1Н-ЯМР спектроскопии (Рис. 1 В), скобки на Рисунке 1 В демонстрируют сигналы протонов четвертичных аммониевых групп. СЗ четвертичными аммониевыми группами составила 40-90%, гидрофобными группами 10-15%. Выход производных хитозана составлял 66-97%.
Синтез конъюгата ГКХ с ФИТЦ
Для получения ФИТЦ-меченных образцов 25 нмоль ФИТЦ, растворенного в ДМСО, добавляли к 5 мг ГКХ, растворенного в 1 мл 50 мМ ацетатного буфера. Реакционную смесь инкубировали 1.5 часа при комнатной температуре и перемешивании в отсутствии света, затем диализовали против воды в течение 24 часов с тремя сменами воды. Эффективность иммобилизации ФИТЦ оценивали методом микрофлуориметрии с использованием калибровочной кривой ((λ ex/em=494/518 нм). Полученные препараты использовали для окрашивания клеток как описано ниже.
Пример 3. Связывание ГКХ с мембранами клеток
Для анализа связывания ГКХ с мембранами клеток использовали метод конфокальной микроскопии. Эпителиальные клетки человека PANC-1 и макрофагальные клетки мыши RAW 264.7 культивировали в среде DMEM или RPMI-1640 соответственно с добавлением 7% фетальной сыворотки коров и 100 мкг/мл пенициллина/стрептомицина. После пересева клеток 150 мкл суспензии, содержащей 1×106 клеток/мл, наносили на покровное стекло в стерильном 6-луночном планшете и инкубировали ночь до достижения адгезии клеток и образования плотного монослоя в СО2-инкубаторе при 37°С. Флуоресцентно меченые препараты ГКХ наносили на предметное стекло с клетками на 30 мин - 3 часа и инкубировали при 37°С. За 30 минут до окончания инкубации вносили красители для окрашивания ядер (Hoechst 33342, Sigma), лизосом (LysoTrackRed, Sigma), митохондрий (MitoTrackRed, Sigma), мембран (WGA, Sigma) согласно инструкциям производителей. По окончании инкубации клетки фиксировали 1% раствором параформальдегида и трижды отмывали фосфатным буфером. Клетки на покровных стеклах фиксировали на предметном стекле в среде Mowiol. Полученные препараты анализировали с помощью конфокального микроскопа Nikon.
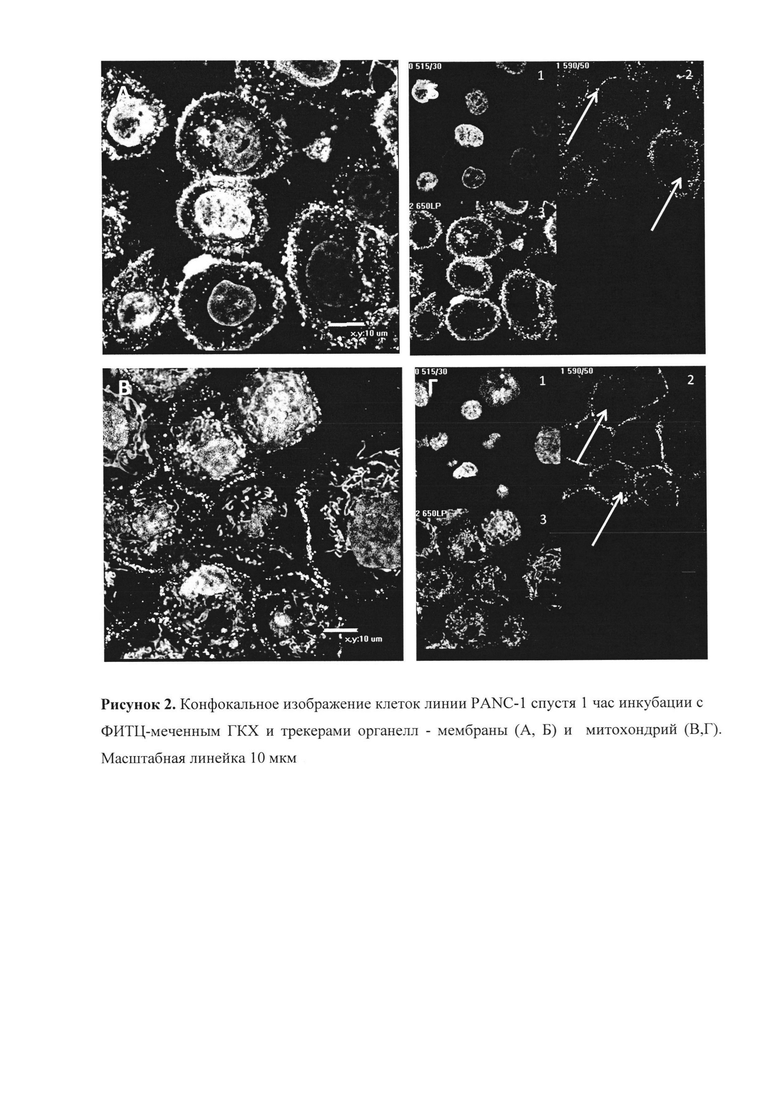
Анализ мембранной локализации ГКХ-ФИТЦ
Результат окрашивания клеток ГКХ-ФИТЦ приведен на рисунке 2, который демонстрирует мембранную локализацию ГКХ-ФИТЦ (белые стрелки), что подтверждает коллокализация с коммерческим трекером мембраны клеток WGA-AlexaFluor 584 (MolecularProbes, США) (рис. 2А, Б). На рисунке 2А показан общий вид клеток после окрашивания, на рисунке 2Б - разделение каналов флуоресенции: 1 - синий (λ=408 нм) (Hoechst - ядра), 2 - зеленый (λ=488 нм) (ГКХ-ФИТЦ - мембраны), 3 - красный (λ=540 нм). (WGA - мембраны). Стрелками показана колокализация ГКХ-ФИТЦ с WGA. Совместной локализации с трекерами лизосом и митохондрий не наблюдали. В качестве примера приведено окрашивание клеток с помощью ГКХ-ФИТЦ и трекера митохондрий MitoTrackerRed (MolecularProbes, США) (рис. 2В, Г). На рисунке 2В показан результат конфокальной микроскопии клеток после окрашивания, на рисунке 2Г - разделение каналов флуоресценции: 1 - синий (Hoechst - ядра), 2 - зеленый (ГКХ-ФИТЦ - мембраны), 3 - красный (MitoTrackerRed - митохондрии). Стрелками на рисунке 2Г показано отсутствие колокализации ГКХ-ФИТЦ с митохондриями.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО ХИТОЗАНА ДЛЯ ИЗБИРАТЕЛЬНОЙ ДОСТАВКИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И БИОЛОГИЧЕСКИ АКТИВНЫХ КОМПЛЕКСОВ | 2013 |
|
RU2561062C2 |
| Способ получения флуоресцентных производных арабиногалактана | 2021 |
|
RU2768707C1 |
| СИСТЕМА ДОСТАВКИ ВЕЩЕСТВА БЕЛКОВОЙ ПРИРОДЫ В ВИДЕ НАНОЧАСТИЦ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2566069C2 |
| Способ доставки биологически активных макромолекул в клетки растений | 2017 |
|
RU2663347C1 |
| ПРИМЕНЕНИЕ ИНДОЦИАНИНА В КАЧЕСТВЕ МАРКЕРА НАНОЧАСТИЦ | 2015 |
|
RU2599488C1 |
| Таргетная неинвазивная трансплантация в мозг функционально активных митохондрий для лечения нейродегенеративных заболеваний | 2019 |
|
RU2744453C2 |
| МИКРОКАПСУЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ АЛЬГИНАТА-АЦИЛЬНЫХ ПРОИЗВОДНЫХ ХИТОЗАНА, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2011 |
|
RU2542509C2 |
| Пероральная система доставки вещества белковой природы (варианты), защитная оболочка системы доставки (варианты) | 2014 |
|
RU2665367C2 |
| Применение мембранных везикул мультипотентных стромальных клеток, индуцированных цитохалазином В, для восстановления и повышения митохондриальной функции | 2019 |
|
RU2727540C1 |
| Способ очистки рекомбинантного ферментного препарата фосфолипазы А2 из штамма продуцента Pichia pastoris | 2019 |
|
RU2746563C1 |

Изобретение относится к способу получения производных хитозана, которые могут использоваться для создания носителей для доставки лекарств к эпителиальным клеткам барьерных органов и тканей, а также для получения флуоресцентных проб для маркирования мембран клеток в медицинской и фармацевтической промышленности. Предложенный способ получения производных хитозана для визуализации клеточных мембран и создания систем доставки лекарств с повышенной мукоадгезией, включает модификацию хитозана путем алкилирования в присутствии глицидилтриметиламмоний хлорида с последующим диализом и лиофильной сушкой продукта и присоединением к нему флуоресцентной метки, и отличается тем что, хитозан с ММ 20 кДа и СД 98% сначала ацилируют капроновым ангидридом, алкилируют, а затем присоединяют флуоресцеин изотиоцианат. Предложен новый способ, позволяющий получить малотоксичное производное хитозана с высоким сродством к клеточным мембранам. 3 пр., 2 ил.
Способ получения производных хитозана для визуализации клеточных мембран и создания систем доставки лекарств с повышенной мукоадгезией, включающий модификацию хитозана путем алкилирования в присутствии глицидилтриметиламмоний хлорида с последующим диализом и лиофильной сушкой продукта и присоединением к нему флуоресцентной метки, отличающийся тем что, хитозан с ММ 20 кДа и СД 98% сначала ацилируют капроновым ангидридом, алкилируют, а затем присоединяют флуоресцеин изотиоцианат (ФИТЦ).
| CN 106589163 A, 26.04.2017 | |||
| US 20140234212 A1, 21.08.2014 | |||
| CN 104231114 A, 24.12.2014 | |||
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ АНТИТЕЛ ИЗ ЦЕЛЬНОЙ КРОВИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2360707C1 |
| Anastasia Zubareva et al, Molecules, 2013, 18, 7848-7864 | |||
| A.A | |||
| Zubareva et al., Nanoscale, 2015, 7, 7942 | |||
| Шагдарова Бальжима Цырендоржиевна, "Получение алкилированных и ацилированных производных хитозана и исследование их биологических свойств", диссертация на соискание ученой степени кандидата биологических наук, Москва, 2016, стр | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
Авторы
Даты
2019-08-21—Публикация
2018-02-21—Подача