ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу отделения фактора VIII от первой композиции, в частности плазмы, содержащей белок фактора VIII и белок фактора фон Виллебранда, и к продуктам способа, то есть к продукту крови со сниженными количествами FVIII и/или комплекса FVIII/vWF.
УРОВЕНЬ ТЕХНИКИ
Гемофилия представляет собой группу наследственных генетических нарушений, которые снижают способность организма управлять свертыванием крови или коагуляцией. При ее наиболее распространенной форме, гемофилии А, имеет место дефицит фактора свертывания VIII (FVIII), гемофилия А приходится приблизительно на 1 из 5000-10000 рождающихся мальчиков. При свертывании крови белок FVIII является необходимым кофактором и обладает многофункциональными свойствами. Дефицит FVIII можно лечить с использованием концентратов FVIII, получаемых из плазмы, или с использованием рекомбинантно получаемого FVIII. Лечение с использованием концентратов FVIII приводит к нормальной жизни пациентов с гемофилией. Исторически гемофилию А лечили с использованием FVIII, получаемого из плазмы крови человека. В плазме крови, при нормальных условиях, молекула FVIII всегда связана с своим кофактором, фактором фон Виллебранда (vWF), который стабилизирует молекулу FVIII от различных форм разрушения.
Описано множество процессов очистки фактора VIII от плазмы или культур, которые рекомбинантно продуцируют фактор VIII (rFVIII) в присутствии или в отсутствии фактора фон Виллебранда. Обычно очищенные продукты FVIII с низким количеством vWF содержат добавочный альбумин человека и или другие стабилизаторы, включая ионы кальция и повышенную концентрацию соли, для стабилизации молекулы FVIII.
Способы, используемые очистки FVIII от плазмы, обычно представляют собой комбинацию различных способов осаждения, таких как криопреципитация, осаждение гидроксидом алюминия и тому подобное, и хроматографических стадий, преимущественно ионообменных, аффинных и гель-фильтрационных стадий. Для улучшения продуктов FVIII использовали аффинную хроматографию, которая эффективно удаляла загрязнения до высокой степени чистоты FVIII, включая также возможность снижения vWF (Farrugia et al. 1993). В 90-е годы на рынок поступили первые продукты рекомбинантного FVIII (rFVIII), получаемые из полноразмерных молекул rFVIII, имитирующих основную форму FVIII в плазме крови, и молекул rFVIII с удаленным B-доменом (Eriksson et al., 2001), из которых удалена одна неактивная часть (B-домен), оба указанные продукта имели высокую степень чистоты (все не содержали vWF). rFVIII также очищают несколькими стадиями очистки, включая аффинную хроматографию, например, как описано в WO 2009/156430 и McCue et al. 2009. В этих документах раскрыто использование стадии аффинной хроматографии для очистки рекомбинантно получаемого фактора VIII (в отсутствие фактора фон Виллебранда), используя аффинную смолу на основе Fab-фрагмента не животного происхождения, где лиганд размером 13 кДа связывается с легкой цепью фактора VIII (см. Winge et al., 2015).
Биологически активный фактор VIII можно измерять с помощью различных аналитических способов in vitro (FVIII:C), например, с помощью хромогенного анализа FVIII и/или одностадийного анализа свертывания (Girma et al., 1998). Хромогенный анализ представляет собой двухстадийный фотометрический способ, в котором измеряют биологическую активность фактора VIII в качестве кофактора FIXa. В этом способе FX активируют до FXa с помощью FIXa в присутствии ионов кальция и фосфолипидов. Образованный FXa расщепляет хромогенный субстрат на продукт, количество которого можно определять спектрофотометрически. Одностадийный анализ свертывания основан на способности образца, содержащего фактор VIII, корректировать время свертывания плазмы с дефицитом фактора VIII в присутствии фосфолипида, контактного активатора и ионов кальция. В течение одной стадии измеряют время появления фибринового свертка.
Для тестирования rFVIII или очищенных образцов FVIII обычно используют плазму с врожденным дефицитом FVIII, такую как наследственную «Factor VIII Deficient Plasma (Congenital)» от Helena Biosciences. Однако доступность этой наследственной плазмы ограничена, поскольку ее получают у пациентов с гемофилией А и, следовательно, количество этой плазмы ограничено. Также плазму с дефицитом FVIII можно получать посредством удаления FVIII из нормальной плазмы, то есть комплекса FVIII/vWF из плазмы с использованием антител, специфичных к комплексу FVIII/vWF, то есть часто аффинного лиганда, направленного на FVIII, который не разрушается при связывании vWF с FVIII. Примером является Factor VIII Deficient Plasma от Affinity BioogicalsTM, Inc.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение, кроме прочего, основано на неожиданном обнаружении того, что лиганд со специфичностью к легкой цепи FVIII, в частности, аффинная смола на основе Fab-фрагмента, продаваемая под названием VIIISelect, при определенных условиях эффективно связывается с комплексом FVIII и vWF. Авторы настоящего изобретения смогли определить конкретные оптимальные условия связывания.
Таким образом, в соответствии с первым аспектом изобретение относится к способу отделения белка FVIII от первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF, способ включает стадии:
- приведения в контакт первой композиции с аффинной смолой, содержащей лиганд и матрицу, где лиганд обладает аффинностью к легкой цепи FVIII, и
- отделения аффинной смолы от смеси с получением модифицированной первой композиции и второй композиции, где вторая композиция содержит аффинную смолу, FVIII и комплекс белка FVIII и белка vWF.
Важно отметить, что не только FVIII связывается с лигандом. Авторы изобретения определили условия для связывания FVIII в комплекс с vWF и, следовательно, для обеспечения возможности отделения комплекса FVIII/vWF от продуктов крови, в частности, плазмы. Таким образом, в соответствии со вторым аспектом, изобретение относится к способу получения модифицированного продукта крови, который включает стадии:
- предоставления первой композиции, содержащей продукт крови, в частности, плазму;
- осуществления отделения FVIII в соответствии с первым аспектом изобретения; и
- сбора модифицированного продукта крови.
Соответственно, в третьем аспекте изобретение относится к модифицированной плазме, получаемой способом в соответствии со вторым аспектом, где концентрация FVIII меньше 4% от усредненной концентрации FVIII в плазме здорового донора-человека.
Модифицированную плазму со сниженным количеством FVIII, в частности, плазму с дефицитом FVIII, можно использовать для лечения заболеваний или нарушений, таких как диссеминированное внутрисосудистое свертывание (DIC) или сепсис. Таким образом, в соответствии с четвертым аспектом изобретение относится к модифицированной плазме для применения в терапии, где модифицированную плазму определяют в соответствии с третьим аспектом изобретения.
Однако альтернативное применение модифицированного продукта крови в соответствии с третьим аспектом представляет собой применение в аналитическом тестировании образцов FVIII. В связи с этим, в соответствии с пятым аспектом изобретение относится к использованию модифицированного продукта крови, в частности модифицированной плазмы в соответствии с третьим аспектом изобретения, для тестирования концентрации и/или активности FVIII в образце.
Способ отделения в соответствии с первым аспектом не только эффективен для отделения FVIII, получаемого из крови, от образца продукта крови, но при этом его также можно применять при очистке FVIII, vWF или их комплекса.
Таким образом, в соответствии с шестым аспектом изобретение относится к способу очистки или обогащения белка FVIII, белка vWF или комплекса белка FVIII и белка vWF, включающему стадии:
- предоставления первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF,
- осуществления способа отделения в соответствии с первым аспектом;
- необязательного осуществления по меньшей мере одной стадии промывки второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF; и
- необязательного элюирования третьей композиции, содержащей vWF, в частности, с помощью элюирующего буфера, содержащего CaCl2; и
- элюирования четвертой композиции, содержащей комплекс белка FVIII и белка vWF или белок FVIII, из аффинной смолы.
Наконец, в соответствии с седьмым аспектом изобретение относится к композиции, содержащей комплекс белка FVIII и белка vWF или очищенный белок FVIII или очищенный белок vWF, получаемой способом в соответствии с шестым аспектом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
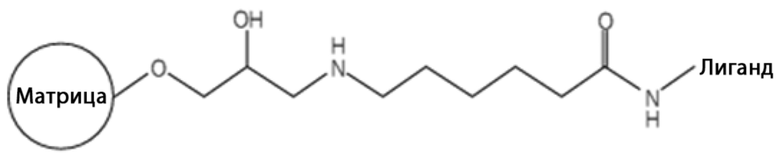
На фиг.1 представлена диаграмма порционной адсорбции, когда измеряли концентрацию FVIII в плазме после различного времени инкубации с аффинной смолой VIIISelect. Концентрация FVIII представлена по оси y, время по оси x. Концентрацию FVIII в образце плазмы измеряли перед смешиванием плазмы с VIIISelect, после четырех часов и после 24 часов. На легенде диаграммы показано соотношение материала VIIISelect в граммах и объема плазмы в мл. Указанная температура (20-25°C) показывает температуру инкубации.
На фиг.2 представлена диаграмма эксперимента порционной адсорбции с использованием VIIISelect и OctaplasTM в качестве исходного материала. Концентрация FVIII в продукте крови показана по оси y, время по оси x. Указаны различные соотношения материала колонки и исходного материала.
На фиг.3 представлена диаграмма эксперимента порционной адсорбции с использованием VIIISelect и криосупернатанта в качестве исходного материала. Концентрация FVIII в продукте крови представлена по оси y, время по оси x. Указаны различные соотношения материала колонки и исходного материала.
На фиг.4 представлена диаграмма с результатами измерения прямой амидолитической активности. По оси y представлена дельта скорости гидролиза OD405нм/ч, по оси x различные тестируемые образцы. Левая колонка каждого образца представляет скорость гидролиза S-2366 и правая колонка скорость гидролиза S-2288. Образцы представляют собой продукты крови, получаемые в соответствии с примерами 1 и 2 и в сравнении с коммерчески доступными продуктами Siemens DP, Helena и Affinity.
На фиг.5 представлены результаты теста стабильности rhFVIII в выбранных продуктах крови, полученных в соответствии с примерами 1 и 2. Колонка каждого образца представляет концентрацию FVIII в образце в различные моменты времени, перед инкубацией, через три часа, через пять часов и через восемь часов.
На фиг.6 представлены результаты оценки удельной активности rhFVIII для трех выбранных продуктов крови, полученных в примерах 1 и 2, и сравнительной коммерчески доступной плазмы с дефицитом FVIII.
На фиг.7 представлен график с результатами тестов скорости потока для непрерывного колоночного отделения FVIII от криосупернатанта. На диаграмме ось y представляет активность FVIII в процентах и ось x представляет скорость потока в см/ч.
На фиг.8 представлены результаты измерения прямой амидолитической активности различной плазмы. В эксперименте протеазные субстраты S-2288 и S-2366 добавляли в различную плазму, а именно модифицированную плазму (Pre-Pilot 1, Pre-Pilot 2 и Pre-Pilot 3, все очищены на хроматографических колонках VIIISelect) или эталонную плазму, то есть измеряли коммерчески доступную врожденную Helena и Siemens. На колоночной диаграмме левая колонка представляет скорость гидролиза S-2238 и правая колонка скорость гидролиза S-2366.
На фиг.9 представлены результаты измерений стабильности rhFVIII, разведенного до 1 МЕ/мл, в плазме с дефицитом FVIII, получаемой в соответствии с изобретением, то есть Pre-Pilot 1, Pre-Pilot 2 и Pre-Pilot 3, а также сравнительной плазме (Siemens, Helena).
На фиг.10 представлены результаты оценки удельной активности rhFVIII для трех модифицированных плазм Pre-Pilot 3, Pre-Pilot 2 и Pre-Pilot 1 и врожденной Helena в виде сравнения с rhFVIII в концентрации 250 МЕ/мл.
На фиг.11 представлены результаты оценки удельной активности rhFVIII для трех модифицированных плазм Pre-Pilot 3, Pre-Pilot 2 и Pre-Pilot 1 и врожденной Helena в виде сравнения с rhFVIII в концентрации 2000 МЕ/мл.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения разработали новый способ связывания белка FVIII в присутствии vWF и, следовательно, отделения комплекса белка FVIII и белка vWF, с использованием лиганда, который специфичен в отношении легкой цепи FVIII. Способ является неожиданным, поскольку известно, что vWF связывается с легкой цепью FVIII (см., например, Wang et al. 2003, стр. 5, левая колонка, и Chiu et al., 2015) и, следовательно, должен препятствовать связыванию специфичных лигандов легкой цепи FVIII с FVIII, если находится в комплексе с vWF. Таким образом настоящее изобретение предусматривает дополнительные возможности для очистки комплекса FVIII/vWF. Кроме того, при определении необязательных условий для связывания получаемых из плазмы комплексов FVIII/vWF, изобретение относится к подходящему способу получения плазмы с дефицитом FVIII.
В соответствии с первым аспектом изобретение относится к способу отделения белка FVIII от первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF, способ включает стадии:
- приведения в контакт первой композиции с аффинной смолой, содержащей лиганд и матрицу, где лиганд обладает аффинностью к легкой цепи FVIII, и
- отделения аффинной смолы от смеси для получения модифицированной первой композиции и второй композиции, где вторая композиция содержит аффинную смолу, FVIII и комплекс белка FVIII и белка vWF.
Белок FVIII в соответствии с изобретением может представлять собой полноразмерный фактор VIII человека или животного и его любой фрагмент, мутант или вариант. Белок FVIII может быть получен из плазмы или рекомбинантным. Кроме того, белок FVIII может быть гликозилированным или негликозилированным. Фактор VIII человека кодируется геном F8, который содержит 187000 пар оснований в шести экзонах. Транскрибированная мРНК имеет длину 9029 пар оснований и транслируется в белок длиной 2351 аминокислот, из которого при посттрансляционной модификации удаляются 19 аминокислот. Молекула FVIII у человека гликозилирована по боковой цепи, состоящей из 31 аминокислоты (25× N-гликозилирование, 6× O-гликозилирование).
После трансляции цепочка аминокислот расщепляется специфичными протеазами по положениям, что веден к образованию тяжелой цепи размером приблизительно 200 кДа и легкой цепи размером приблизительно 80 кДа. Организацию доменов обычно описывают как A1-A2-B-A3-C1-C2. Легкая цепь состоит из доменов A3-C1-C2. Тяжелая цепь в основном состоит из доменов A1-A2-B. Тяжелые цепи, встречаемые в плазме, имеют гетерогенную композицию с молекулярными массами, варьирующими от 90 до 200 кДа. Причиной этого является гетерогенность их гликозилирования, существование сплайсированных вариантов и существование протеолитических продуктов, таких как тяжелая цепь A1 A2, обедненная по B-домену. Аминокислотную последовательность полноразмерного FVIII идентифицируют по аминокислотам с 20 до 2351 P00451 от SwisProt, 21 июля 1986 года. Белок FVIII, в частности, идентичен по аминокислотной последовательности последовательности аминокислот 20-2351 P00451 от SwissProt, 21 июля 1986, по меньшей мере на 80%, 85%, 90%, 95%, 98%, 99% или 100%. Предпочтительно, гомология последовательности с аминокислотной последовательностью, определяемой аминокислотами 20-2351 P00451, составляет по меньшей мере 95%.
Точные условия связывания тяжелых и легких цепей в деталях не известны, но в статьях предполагается участие мостика из ионов металла, который вместе с гидрофобными взаимодействиями формирует и удерживает комплекс вместе. При взаимодействии предполагали участие различных ионов металла, в том числе кальция, меди, цинка, марганца и тому подобное (Wang et al. 2003). Для разработанного в последнее время продукта рекомбинантного фактора VIII с удаленным B-доменом установлено, что молекула содержит три иона металла; кальция, меди и цинка (Svensson et al.).
Способ отделения в соответствии с изобретением ведет к отделению белка FVIII от первой композиции. Поскольку белок vWF также присутствует в образце и содержит FVIII-связывающий домен vWF, по меньшей мере часть белка FVIII, присутствующего в первой композиции, будет в форме комплекса с белком vWF.
В соответствии с одним из вариантов осуществления по первому аспекту, первая композиция содержит продукт крови. Способ в соответствии с изобретением можно использовать для снижения концентрации FVIII в продуктах крови или удаления FVIII из продукта крови.
Как используют в настоящем описании «продукт крови» относится к цельной крови млекопитающего или фракциям цельной крови, в частности плазме, сыворотке или дополнительным фракциям плазмы и сыворотки.
Как используют в настоящем описании, «модифицированный продукт крови» представляет собой продукт крови, прошедший дополнительную стадию обработки, такую как стадия осаждения, в частности, стадия холодового осаждения, инактивация вирусов, химическая или тепловая обработка или/и удаление конкретных компонентов. Соответственно, модифицированную плазму получают посредством обработки плазмы. Модифицированную цельную кровь получают посредством дополнительной стадии обработки цельной крови.
«Плазма», как используют в настоящем описании, относится к плазме крови млекопитающих. Она представляет собой жидкий компонент крови палевого бледного оттенка, иногда желтого, в котором обычно находятся клетки крови цельной крови в суспензии. Плазма главным образом представляет собой воду и содержит растворенные белки, глюкозу, факторы свертывания, электролиты, гормоны и диоксид углерода. Плазму можно получать из крови, например, посредством центрифугирования свежей крови, содержащей антикоагулянт, при котором клетки крови движутся ко дну центрифужной пробирки. Супернатантом этого процесса является плазма крови.
«Фракция цельной крови», как используют в настоящем описании, относится к раствору суспензии, получаемой из цельной крови, которая содержит часть компонентов цельной крови.
«Фактор свертывания», как используют в настоящем описании, относится к белкам, встречаемым в природе в крови, которые являются частью коагуляционного каскада, таким как фибриноген, протромбин, фактор VII, фактор IX или фактор VIII.
«Криопреципитат», как используют в настоящем описании, представляет собой продукт крови, полученный из плазмы. Для получения криопреципитата на плазму, обычно замороженную, воздействуют температурой приблизительно до 0°C, после чего следует центрифугирование и сбор преципитата.
Термин «криосупернатант», как используют в настоящем описании, относится к плазме, из которой удален криопреципитат. Получаемая плазма имеет пониженные уровни, но все еще существенные количества FVIII, vWF, FXIII, фибронектина и фибриногена.
В соответствии с одним из вариантов осуществления, белок FVIII выбран из FVIII, получаемого из плазмы человека, природного FVIII крови, в частности, природного FVIII крови человека, рекомбинантного полноразмерного FVIII человека и рекомбинантного FVIII человека с удаленным B-доменом. В соответствии с предпочтительным вариантом осуществления белок FVIII представляет собой FVIII, получаемый из плазмы человека. FVIII, получаемый из плазмы человека, в частности представляет собой полноразмерный FVIII, содержащий все субдомены A1, A2, B, A3, C1 и C2. В частности, актуально, если способ отделения в соответствии с первым аспектом используют для продукта крови в качестве первой композиции. Таким образом, соответственно белок FVIII может представлять собой любое природное производное FVIII крови, в частности, включая полноразмерный FVIII и FVIII человека с удаленным B-доменом. Альтернативно, способ отделения белка FVIII можно использовать для белка FVIII, получаемого рекомбинантным образом. Белок FVIII, получаемый рекомбинантным образом, может представлять собой FVIII с аминокислотной последовательностью полноразмерного FVIII человека. Альтернативно, рекомбинантный белок FVIII может представлять собой рекомбинантный FVIII человека с удаленным B-доменом.
«Легкая цепь FVIII», как используют в настоящем описании, относится к части фактора VIII. Легкая цепь FVIII, в частности, имеет аминокислотную последовательность, которая гомологична по последовательности аминокислотам 1668-2351 P00451 от SwissProt, 21 июля 1986, по меньшей мере на 80%, 85%, 90%, 95%, 98%, 99% или 100%. Предпочтительно, гомология по последовательности аминокислотной последовательности, определяемой аминокислотами 1668-2351 P00451, составляет по меньшей мере 95%.
Рекомбинантные белки FVIII включают слитые белки FVIII, такие как слитые белки FVIII и альбумина, как описано в Oldenburg et al., 2014, и/или слитые белки FVIII и FC.
Рекомбинантные белки FVIII по изобретению могут быть получены в любой известной рекомбинантной системе экспрессии, включая в качестве неограничивающих примеров дрожжевые системы экспрессии, бакуловирусные системы экспрессии/системы экспрессии клеток насекомых, системы экспрессии млекопитающих, такие как CHO или BHK, и клеточных линий человека, таких как клетки HEK293F. Предпочтительными являются рекомбинантные белки FVIII, экспрессируемые в клеточных линиях человека, поскольку они повторяют характер гликозилирования человека.
Белок vWF по изобретению может представлять собой полноразмерный vWF человека или животного и любой его фрагмент, мутант или вариант. vWF представляет собой мультимерный адгезивный гликопротеин, присутствующий в плазме млекопитающих, который имеет множество физиологических функций. При первичном гемостазе vWF выполняет функцию медиатора между специфичными рецепторами на поверхности тромбоцитов и компонентам внеклеточного матрикса, такими как коллаген. Кроме того, vWF служит в качестве носителя и стабилизирующего белка для прокоагулянтного фактора VIII. VWF синтезируется клетками эндотелия и мегакариоцитами в виде молекулы предшественника, состоящей из 2813 аминокислот. Полипептид-предшественник, пре-про-vWF, состоит из сигнального пептида из 22 остатков, пропептида из 741 остатка и полипептида из 2050 остатков, встречаемого в зрелом факторе фон Виллебранда плазмы (Fischer et al., 1994). Полноразмерный vWF идентифицирован Uniprot P04275.
При секреции в плазму, vWF циркулирует в форме различных частиц с различными молекулярными размерами. Эти молекулы vWF состоят из олиго- и мультимеров зрелой субъединицы, состоящей из 2050 аминокислотных остатков. vWF обычно обнаруживается в плазме в виде мультимеров, размер которых изменяется в диапазоне приблизительно от 500 до 20000 кДа (Furlan et al. 1996). В соответствии с одним из вариантов осуществления белок vWF представляет собой мультимер получаемого из плазмы vWF. В соответствии с одним из вариантов осуществления белок vWF представляет собой мономер получаемого из плазмы vWF. vWF, в частности, имеет аминокислотную последовательность любой последовательности Uniprot P04275 по меньшей мере 80%, 85%, 90%, 95%, 98%, 99% или 100%.
Рекомбинантные белки vWF по изобретению можно получать в любой известной рекомбинантной системе экспрессии, включая в качестве неограничивающих примеров дрожжевые системы экспрессии, бакуловирусные системы экспрессии/системы экспрессии клеток насекомых, системы экспрессии млекопитающих, такие как CHO или BHK, и клеточные линии человека, такие как клетки HEK293F. Предпочтительными являются рекомбинантные белки vWF, экспрессируемые клеточными линиями человека, поскольку они повторяют характер гликозилирования человека.
Лиганд по изобретению может быть любой молекулой или объектом, который обладают аффинностью в отношении легкой цепи FVIII. Как используют в настоящем описании, «аффинность» относится к свойству специфичного связывания с мишенью, в данном случае, с легкой цепью FVIII. Связывание лиганда с FVIII может быть ковалентным или нековалентным, обратимым или необратимым. Предпочтительно, связывание является нековалентным и обратимым. В соответствии с одним из вариантов осуществления, лиганд представляет собой полипептид с аффинностью в отношении легкой цепи FVIII.
«Пептид», как используют в настоящем описании, может состоять из любого числа аминокислот любого типа, предпочтительно природных аминокислот, которые предпочтительно связаны пептидными связями. В частности, пептид содержит по меньшей мере 3 аминокислоты, предпочтительно по меньшей мере 5, по меньшей мере 7, по меньшей мере 9, по меньшей мере 12 или по меньшей мере 15 аминокислот. Кроме того, нет верхнего предела длины пептида. Однако, предпочтительно, длина пептида по изобретению не превышает 500 аминокислот, более предпочтительно длина не превышает 300 аминокислот; даже более предпочтительно длина не превышает 250 аминокислот.
Таким образом, термин «пептид» включает «олигопептиды», которые обычно относятся к пептидам, имеющим длину 2-10 аминокислот, и к «полипептидам», которые обычно относятся к пептидам, имеющим длину больше 10 аминокислот.
Термин «белок» относится к пептиду длиной по меньшей мере 60, по меньшей мере 80, предпочтительно по меньшей мере 100 аминокислот.
Термин «слитый белок» по изобретению относится к белкам, создаваемым посредством соединения двух или более генов, кДНК или последовательностей, которые исходно кодируют отдельные белки/пептиды. Гены могут встречаться в природе у одного и того же организма или у разных организмов, или могут представлять собой синтетические полинуклеотиды.
Сходство двух аминокислотных последовательностей описывает параметр «идентичность последовательностей». Для целей настоящего изобретения, степень идентичности последовательностей двух аминокислотных последовательностей определяют с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), как реализовано в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительна версия 3.0.0 или более поздняя. Необязательными используемыми параметрами являются штраф за открытие пропуска 10, штраф за продолжение пропуска 0,5 и матрица замен EBLOSUM62 (EMBOSS версии BLOSUM62). Выводимые из Needle данные, помеченные «longest identity» (получают с использованием опции thenobrief), используют в виде процента идентичность и вычисляют следующим образом:
(идентичные остатки × 100)/(длина выравнивания - общее число пропусков в выравнивании)
Переходный термин «содержащий», который является синонимом термину «включающий» или «отличающийся тем, что», является инклюзивным или открытым и не исключает дополнительных, не указанных элементов или стадий способа. Переходная фраза «состоящий из» исключает любой элемент, стадию или ингредиент, который конкретно не определен в пункте формулы изобретения, за исключением примесей, как правило, связанных с ним. Если в предложении в пункте формулы изобретения появляется фраза «состоит из», которая не сразу следует после вводной части, то эта фраза ограничивает только элемент, указанный в этой части; другие элементы не исключены из пункта формулы изобретения, рассматриваемого в целом. Переходная фраза «состоящий по существу из» ограничивает объем пункта формулы изобретения до точно определенных веществ или стадий «и того, что не оказывает существенного влияния на основной и новый признак(и)» описываемого в заявке изобретения. Пункт формулы изобретения типа «состоящий по существу из» занимает промежуточное положение между закрытыми пунктами формулы изобретения, которые изложены в формате «состоящий из», и полностью открытыми пунктами формулы изобретения, которые описаны в формате «содержащий».
«Аффинная смола», как используют в настоящем описании, представляет собой хроматографическую среду с аффинностью к конкретному белку. Аффинная смола содержит по меньшей мере матрицу и лиганд с аффинностью к белку.
«Матрица», как используют в настоящем описании, представляет собой вещество, обычно в форме бусин, с которым ковалентно связывают специфичный лиганд. Матрица по изобретению изобретением должна быть
- нерастворимой в растворителях и буферах, используемых в процессе;
- химически и механически стабильной; и
- легко связываться с лигандом или спейсерной группой, с которой можно связывать лиганд. Дополнительно она должна проявлять удовлетворительные реологические свойства и иметь относительно большую площадь поверхности для прикрепления. Предпочтительно матрицу выполняют из агарозы, стекла, целлюлозы или полиакрилимида. В соответствии с одним из вариантов осуществления матрица представляет собой агарозу с высокой степенью перекрестной связи.
Как показано в примерах, VIIISelect допускает эффективное связывание FVIII в присутствии белка vWF и/или комплекса FVIII/vWF. VIIISelect основан на матрице, основанной на агарозе с высокой степенью перекрестной связи. Эту матрицу на основе агарозы сшивают с Fab-фрагментом размером 13 кДа, который специфически связывается с легкой цепью FVIII. Fab-фрагмент 13 кДа соединяют с агарозной матрицей посредством гидрофильного спейсера. Соответственно, лиганд по изобретению предпочтительно представляет собой рекомбинантный полипептид. Согласно одному из вариантов осуществления размер лиганда находится в диапазоне от 2 до 50 кДа. Предпочтительно, молекулярная масса полипептидного лиганда находится в диапазоне от 5 до 30 кДа, более предпочтительно, в диапазоне от 10 до 20 кДа. Размер выше 30 кДа вероятно приведет к стерическому затруднению из-за присутствия vWF на легкой цепи FVIII. Молекулярная масса меньше 5 кДа может иметь недостаток малой специфичности связывания со своей молекулой-мишенью.
В соответствии с предпочтительным вариантом осуществления, полипептид представляет собой Fab-фрагмент антитела. Fab представляет собой антиген-связывающий фрагмент антитела. Антитела и фрагмент антитела проявляют особенно высокие аффинности связывания с их мишенями связывания, то есть антигенами. Таким образом, Fab-фрагмент представляет собой предпочтительный лиганд для отделения FVIII. Полипептид, в частности Fab-фрагмент, предпочтительно представляет собой рекомбинантный полипептид, получаемый не в животном источнике. Преимуществом получения не в животном источнике является минимизация риска наличия вирусов или других токсинов, потенциально проблемных для пациента. В соответствии с предпочтительным вариантом осуществления, лиганд представляет собой рекомбинантный полипептид, получаемый в дрожжевых клетках.
В соответствии с одним из вариантов осуществления лиганд связывают со смолой посредством спейсера. Спейсерную группу по изобретению выбирают так, чтобы она увеличивала вероятность связывания лиганда с легкой цепью FVIII. В частности, спейсер должен иметь определенную длину для того, чтобы снижать стерическое затруднение связывания между лигандом и легкой цепью FVIII со стороны матрицы. В соответствии с предпочтительным вариантом осуществления, спейсер представлен следующей структурой:
В соответствии с одним из вариантов осуществления, спейсер представляет собой гидрофильное соединение. Матрица предпочтительно имеет форму пористых бусин. В соответствии с предпочтительным вариантом осуществления, связанный со смолой лиганд определен как VIIISelect. VIIISelect представляет собой смолу для аффинной очистки, коммерчески доступную от GE Healthcare (файл данных 28-9662-37 AB, GE healthcare). Емкость в целом составляет 20000 МЕ/мл геля. Долгосрочная стабильность pH VIIISelect дана при pH 3-10 краткосрочная стабильность при pH 2-12, что можно использовать для регенерации аффинной смолы, чтобы можно было осуществлять повторные очистки на аффинной смоле VIIISelect.
Аффинную смолу предпочтительно получают перед приведением в контакт первой композиции посредством применения различных буферов. Для уравновешивания аффинную смолу предпочтительно обрабатывают одним или несколькими из следующих буферов: буфер для регенерации, буфер для промывки, элюирующий буфер и/или уравновешивающий буфер.
Аффинную смолу можно обрабатывать буфером для промывки, после чего следует уравновешивающий буфер. В частности, аффинные смолы, котонные не использовали прежде, можно обрабатывать таким образом. Аффинные смолы, которые использовали ранее, можно предпочтительно обрабатывать элюирующим буфером, буфером для регенерации и уравновешивающим буфером в этом порядке.
Буфер для регенерации предпочтительно содержит HAc, более предпочтительно HAc в концентрации 0,1 M. Буфер для промывки предпочтительно содержит NaCl, более предпочтительно в концентрации 0,5-1 M. Предпочтительно, концентрация CaCl2 в буфере для промывки составляет самое большее 50 мМ. Более предпочтительно буфер для промывки не содержит кальций, в частности CaCl2, если он предназначен для получения плазмы с дефицитом FVIII. Элюирующий буфер предпочтительно содержит 50% этиленгликоля или 50% пропиленгликоля или 2 M MgCl2. pH предпочтительно находится в диапазоне 6,2-6,8, более предпочтительно в диапазоне 6,4-6,6. Предпочтительно, концентрация CaCl2 в элюирующем буфере составляет максимально 50 мМ. Уравновешивающий буфер содержит предпочтительно NaCl и цитрат Na. Предпочтительно, концентрация CaCl2 в уравновешивающем буфере составляет максимально 50 мМ. Более предпочтительно уравновешивающий буфер не содержит кальций, в частности CaCl2, когда получают плазму с дефицитом FVIII. Вдобавок все буферы могут содержать: имидазол, гистидин, фосфат натрия, цитрат натрия, Tris, HEPES, глицин, NaCl и Tween80. Более предпочтительно, уравновешивающий буфер содержит 30 г/кг NaCl и 6,0 г/кг цитрат Na при pH 6,4-6,6. Аффинную смолу предпочтительно хранят в этаноле, предпочтительно в 20% этаноле.
Стадию отделения в соответствии с изобретением можно осуществлять непрерывно в колонке или в порционной форме. Как показано в примерах как порционное отделение, так и аффинная хроматография ведут к отделению FVIII от образца.
Однако с помощью непрерывной колоночной хроматографии получали сравнимые или даже более хорошие результаты отделения за более короткое время. Таким образом, в соответствии с предпочтительным вариантом осуществления отделение осуществляют непрерывно, то есть в форме колоночной хроматографии.
В соответствии с одним из вариантов осуществления сопряженный со смолой лиганд предоставляют в колонке, образуя слой смолы для контакта с первой композицией. В соответствии с одним из вариантов осуществления высота слоя смолы составляет по меньшей мере 2 см. При высоте меньше 2 см время контакта/скорость потока будут слишком низкими и время процесса слишком высоким и, следовательно, связывающая способность лиганда, связанного со смолой, будет слишком низкой на единицу времени. Предпочтительно, высота слоя аффинной смолы составляет по меньшей мере 5 см или более предпочтительно по меньшей мере 10 см и в частности по меньшей мере 20 см. Чем больше высота слоя, тем больше время контакта при одной и той же скорости потока и тем выше связывающая способность на единицу времени. Однако с высотой слоя также возрастает обратное давление. Таким образом, высоту слоя предпочтительно выбирают так, чтобы обратное давление не превышало максимум 0,3 МПа. Обратное давление выше 0,3 МПа может вести к коллапсу материала колонки
В целом, для аффинной хроматографии высокая скорость потока предпочтительна, поскольку она минимизирует время стадии процесса. Однако, как показано в примере, скорость потока оказывает большое влияние на эффективность отделения. В колоночной хроматографии скорости потока первой и модифицированной первой композиции идентичны. Первая композиция представляет собой исходный материал и содержит, в частности, продукт крови, содержащий FVIII и vWF. Модифицированная первая композиция представляет собой элюат аффинной хроматографии, получаемый после контакт первой композиции с аффинной смолой.
В соответствии с одним из вариантов осуществления скорость потока первой композиции равна 30 см/ч или ниже. Скорость потока через колонку определяют по объемной скорости потока в л/ч, которая равна скорости потока подвижной фазы в см/ч через колонку. Следующая формула определяет эту зависимость:
объемная скорость потока (л/ч) = скорость потока (см/ч) × площадь поперечного сечения колонки (см2)/1000
Скорость потока 30 см/ч или меньше ведет к отделению FVIII от первой композиции. Скорость потока 15 см/ч или меньше ведет к сильно сниженной концентрации FVIII в третьей композиции. Таким образом, в соответствии с одним из вариантов осуществления скорость потока равна 15 см/ч или ниже. Для полного удаления FVIII из плазмы, как показано в примере, необходима скорость потока, которая равна 10 см/ч или ниже. Таким образом, в соответствии с одним из вариантов осуществления, скорость потока равна 10 см/ч или ниже. В соответствии с дополнительным вариантом осуществления, скорость потока равна 7,5 см/ч или ниже.
В соответствии с одним из вариантов осуществления концентрация белка FVIII в первой композиции равна 1 МЕ/мл или ниже. Как показано в примерах, эффективность отделения FVIII, в частности комплекса FVIII/vWF, может зависеть от концентрации FVIII в первой композиции, в частности, в продукте крови. В экспериментах показано, что концентрация FVIII в этой композиции может быть равна 1 МЕ/мл или ниже. Концентрация 1 МЕ/мл представляет собой нормальную концентрацию FVIII в крови здорового индивидуума. В соответствии с одним из вариантов осуществления, другая концентрация белка FVIII и первой композиции равна 0,7 МЕ/мл или ниже. В соответствии с одним из вариантов осуществления концентрация равна 0,4 МЕ/мл или ниже. Для полного удаления FVIII из первой композиции концентрация белка FVIII в первой композиции предпочтительно равна 0,2 МЕ/мл или ниже. Полное удаление определяют как концентрацию ниже 0,01 МЕ/мл. Плазму с концентрацией ниже 0,01 МЕ/мл обозначают как «плазму с дефицитом FVIII».
Концентрацию белка FVIII в образце приводят в виде активности FVIII/объем.
Как показано в примерах, соотношение объема первой композиции и объема аффинной смолы оказывает влияние на эффективность отделения белка FVIII от первой композиции. Объем аффинной смолы определяют посредством удаления жидкой среды смолы, например, осуществляя отсасывание через фильтрующую мембрану, удерживающую смолу, и измеряя оставшийся объем смолы. В целом, в частности, для смол на основе агарозной матрицы, плотность аффинной смолы составляет приблизительно 1 г/мл. Соответственно, объем аффинной смолы пропорционален количеству матрицы в аффинной смоле и, таким образом, лиганду, связанному с матрицей. В соответствии с одним из вариантов осуществления объем первой композиции к объему аффинной смолы находится в диапазоне от 5:1 до 100:1. Концентрация 100:1 вероятно превышает максимальную емкость нагрузки аффинной смолы и, таким образом, ведет к менее эффективному отделению белка FVIII от первой композиции. При концентрации ниже 5:1 процедура отделения не эффективна по времени и цене, поскольку только небольшие количества продукта можно получать за определенное время для определенного количества аффинной смолы.
Предпочтительно, соотношение объема первой композиции и объема аффинной смолы находится в диапазоне от 10:1 до 70:1. Таким образом, в соответствии с одним из вариантов осуществления соотношение объема первой композиции и объема аффинной смолы находится в диапазоне от 10:1 до 50:1. На основании примеров показано, что для достижения эффективного снижения FVIII в первой композиции, в частности, не следует превышать концентрацию 50:1, определенную в постановке эксперимента.
Экспериментальные данные, предоставленные в экспериментах, показывают, что в выбранной постановке эксперимента соотношение первой композиции и объема аффинной смолы должно находиться в диапазоне от 20:1 до 40:1, чтобы обеспечить достаточный выход плазмы с дефицитом FVIII. Таким образом, в соответствии с предпочтительным вариантом осуществления, соотношение объема первой композиции и объема аффинной смолы находится в диапазоне от 20:1 до 40:1.
Авторы изобретения дополнительно обнаружили, что время осуществления контакта является релевантным параметром эффективности способа отделения. Это обнаружено как для порционного, так и для непрерывного способа отделения. Для непрерывного отделения время контакта зависит от скорости потока и размера, в частности, длины, диаметра колонки и, таким образом, объема слоя аффинной смолы. Для того чтобы достигнуть значимого снижения комплекса FVIII/vWF в первой композиции, время контакта первой композиции и аффинного средства составляет по меньшей мере 5 мин. В соответствии с одним из вариантов осуществления, время контакта первой композиции и аффинного средства составляет по меньшей мере 10 мин. Для удаления комплекса FVIII/vWF из плазмы, то есть достижения концентрации FVIII ниже 0,01 МЕ/мл, время контакта должно составлять по меньшей мере 20 мин. Предпочтительно время контакта составляет по меньшей мере 30 мин.
В случае, когда отделение осуществляют в порционной форме во время непрерывного мягкого перемешивания с использованием, например, волнистой пластины с частотой приблизительно 10-50 волн/минута или другого схожего смесительного устройства, время контакта по меньшей мере 4 ч ведет к значимому снижению FVIII в первой композиции. В соответствии с одним из вариантов осуществления, отделение осуществляют в порционной форме, и время контакта первой композиции и аффинной смолы составляет по меньшей мере 12 ч. Более предпочтительно, время контакта составляет по меньшей мере 24 ч. При времени контакта 24 ч возможно снижать концентрацию ниже активности FVIII 0,01 МЕ/мл.
В соответствии с одним из вариантов осуществления число мономеров/мультимеров белка vWF в первой композиции выше, чем число мономеров белка FVIII. Таким образом, даже если FVIII полностью удаляют из первой композиции, основная часть vWF останется в первой композиции, даже после удаления FVIII. Однако удаленный FVIII все еще будет связывать некоторые молекулы vWF, но из-за большой разницы в начальной концентрации FVIII и vWF (в целом, в крови человека соотношение vWF и FVIII составляет приблизительно 50:1) снижение vWF в первой композиции не будет большим.
В соответствии с одним из вариантов осуществления соотношение белка vWF и белка FVIII составляет по меньшей мере 1:5. Предпочтительно соотношение белка vWF и белка FVIII составляет по меньшей мере 10:1. Более предпочтительно, соотношение белка vWF и белка FVIII в первой композиции составляет по меньшей мере 20:1. В соответствии с одним из вариантов осуществления соотношение мономеров белка vWF и белка FVIII составляет по меньшей мере 50:1. vWF обычно присутствует в крови человека в форме мультимеров. Следовательно, один белок FVIII может связываться больше чем с одним vWF. Соответственно, чтобы сохранить достаточное количество vWF, при этом удаляя FVIII из продукта крови, необходимо иметь высокое соотношение белка vWF и белка FVIII.
Как показано в примерах, эффективность связывания лиганда с FVIII, то есть снижение активности FVIII в модифицированной первой композиции - модифицированной плазме - после аффинной очистки улучшается при более высоких температурах. Таким образом, предпочтительно температура во время стадии контакта первой композиции и аффинной смолы составляет выше 4°C. Более предпочтительно, температура составляет выше 15°C. Как показано, хороших результатов отделения FVIII от первой композиции достигали при температуре в диапазоне 20-25°C. С точки зрения стабильности, температура предпочтительно не должна превышать 37°C. В соответствии с одним из вариантов осуществления способа, температура во время стадии контакта составляет выше 20°C.
В соответствии с одним из вариантов осуществления первая композиция содержит продукт крови. Первая композиция также может состоять из продукта крови. Продукт крови может быть выбран из цельной крови или продуктов крови, плазмы или сыворотки. В соответствии с предпочтительным вариантом осуществления продукт крови представляет собой продукт крови человека. В соответствии с одним из вариантов осуществления первая композиция дополнительно содержит буфер. Буферные вещества могут быть выбраны из HEPES, MES, ацетата натрия, фосфата натрия и гистидина, лизина и аргинина. Буфер, в частности, буферы, имеют диапазон pH 6-8. В соответствии с одним из вариантов осуществления буфер представляет собой HEPES. HEPES, например, может присутствовать в первой композиции в концентрации в диапазоне от 0,001 г/мл до 0,1 г/мл на основании общего объема первой композиции, предпочтительно в диапазоне от 0,005 г/мл до 0,05 г/мл, более предпочтительно приблизительно 0,01 г/мл при pH 6,5-7,5.
В соответствии с одним из вариантов осуществления продукт крови представляет собой плазму, в частности, плазму человека. Плазма может представлять собой предварительно обработанную плазму или плазму с инактивированными вирусами. Предварительно обработанная плазма включает криопреципитат и криосупернатант. Криосупернатант и криопреципитат предпочтительно получают посредством заморозки свежей плазмы и ее оттаивания при температуре приблизительно 0°C, что ведет к осаждению. Осадок представляет собой криопреципитат, супернатант называют криосупернатантом. Плазма наиболее предпочтительно представляет собой криосупернатант.
Плазма с инактивированными вирусами, в частности, представляет собой плазму с химически инактивированными вирусами. Примером плазмы с инактивированными вирусами является плазма, продаваемая под торговым названием «OctaplasTM».
Способ отделения по изобретению может быть использован не только для изменения концентрации FVIII в крови или плазме человека, в частности для удаления FVIII из плазмы, но также в качестве стадии при очистке рекомбинантного комплекса. Таким образом, в соответствии с альтернативным вариантом осуществления белок FVIII или белок vWF представляет собой белок, экспрессируемый рекомбинантным способом. В соответствии с предпочтительным вариантом осуществления, белок FVIII и белок vWF оба представляют собой белки, экспрессируемые рекомбинатным способом. В случае рекомбинантной экспрессии, белок vWF в частности может представлять собой конкретный субдомен vWF человека. Субдомен vWF предпочтительно имеет аминокислотную последовательность, которая гомологична по последовательности аминокислотной последовательности, определяемой аминокислотами 764-1035 P04275-1, по меньшей мере на 80%, 85%, 90%, 95%, 98%, 99% или 100%. Предпочтительно гомология последовательностей составляет по меньшей мере 95%.
Способ отделения в соответствии с первым аспектом, в частности, используют для получения модифицированного продукта крови, в частности, продукта крови с дефицитом FVIII. Таким образом в соответствии со вторым аспектом изобретение относится к способу получения модифицированного продукта крови, включающему стадии:
- предоставления первой композиции, содержащей продукт крови;
- выполнения способа отделения в соответствии с первым аспектом; и
- сбора модифицированного продукта крови.
Продукт крови в связи с этим предпочтительно представляет собой плазму и, таким образом, модифицированный продукт крови предпочтительно представляет собой модифицированную плазму. Модифицированный продукт крови более предпочтительно представляет собой продукт крови с дефицитом FVIII, в частности, плазму с дефицитом FVIII.
Способ в соответствии со вторым аспектом можно непосредственно объединить с получением плазмы для получения модифицированной плазмы, в частности, плазмы с дефицитом FVIII. Таким образом, в соответствии с одним из вариантов осуществления по второму аспекту способ включает одну или несколько следующих стадий:
- предоставления образца цельной крови;
- удаления клеток крови из цельной крови посредством центрифугирования и/или фильтрования для получения плазмы крови;
- заморозки плазмы крови
- необязательного хранения замороженной плазмы крови;
- оттаивания замороженной плазма крови приблизительно до 0°C, что вызывает преципитацию белков;
- удаления белкового преципитата из замороженной плазмы крови посредством центрифугирования и/или фильтрования для получения криопреципитированной плазмы; и
- необязательной заморозки, хранения и оттаивания криосупернатанта перед следующей стадией в процессе
В соответствии с альтернативным вариантом осуществления способ по второму аспекту дополнительно включает все следующие стадии:
- предоставления образца цельной крови;
- удаления клеток крови из цельной крови посредством центрифугирования и/или фильтрования для получения плазмы крови;
- заморозки плазмы крови
- необязательного хранения замороженной плазма крови;
- оттаивания замороженной плазмы крови приблизительно до 0°C, что вызывает преципитацию белков;
- удаления белкового преципитата из замороженной плазмы крови посредством центрифугирования и/или фильтрования для получения криосупернатант; и
- необязательной заморозки, хранения и оттаивания криосупернатанта перед следующей стадией в процессе.
В соответствии с одним из вариантов осуществления способ включает одну или несколько из стадий:
- предоставления образца цельной крови;
- удаления клеток крови из цельной кровь посредством центрифугирования и/или фильтрования для получения плазмы крови;
- заморозки плазмы крови;
- необязательного хранения замороженной плазмы крови;
- оттаивания замороженной плазма крови до температуры в диапазоне приблизительно 10-25°C;
- выполнения химической обработки для получения химически обработанной плазмы;
- удаления химических средств инактивации вирусов, в частности посредством масляного экстрагирования и хроматографии гидрофобного взаимодействия для получения плазмы с инактивированными вирусами и
- необязательной заморозки, хранения и оттаивания плазмы с инактивированными вирусами перед следующей стадией в процессе.
В соответствии с одним из вариантов осуществления способ включает все стадии:
- предоставления образца цельной крови;
- удаления клеток крови из цельной крови посредством центрифугирования и/или фильтрования для получения плазмы крови;
- заморозки плазмы крови;
- необязательного хранения замороженной плазмы крови;
- оттаивания замороженной плазмы крови до температуры в диапазоне приблизительно 10-25°C;
- выполнения химической обработки для получения химически обработанной плазмы;
- удаления химических средств инактивации вирусов, в частности, посредством масляного экстрагирования и хроматографии гидрофобного взаимодействия для получения плазмы с инактивированными вирусами;
- необязательной заморозки, хранения и оттаивания плазмы с инактивированными вирусами перед следующей стадией в процессе.
Химическую обработку предпочтительно осуществляют посредством добавления 1% TNBP и 1% Triton X-100 и аккуратного перемешивания в течение по меньшей мере 30 минут.
При определенных вариантах применения может быть полезно добавить экзогенный белок vWF в продукт крови, в частности, в плазму. Экзогенный vWF по изобретению представляет собой vWF, получаемый не из продукта крови. Экзогенный vWF может быть получен из плазмы или может быть рекомбинантным vWF. Процесс добавления vWF в продукт крови называют внесением. Внесение vWF может быть необходимо для восстановления природных значений концентрации vWF в модифицированной плазме, где во время процесса в плазме в значительной мере удаляют и FVIII до концентрации меньше 0,01 МЕ/мл и vWF.
Используя способ в соответствии со вторым аспектом, можно получить модифицированную плазму с сильно сниженными уровнями FVIII. В соответствии с одним из вариантов осуществления модифицированная плазма, получаемая способом в соответствии со вторым аспектом, имеет концентрацию FVIII, которая меньше 4% усредненной концентрации FVIII в плазме здорового донора. Плазма здорового донора в целом имеет концентрацию плазмы здорового донора в целом имеет концентрацию FVIII приблизительно 1 МЕ/мл. При некоторых вариантах применения может быть желательным получить плазму с еще более низкой концентрацией FVIII. Таким образом, в соответствии с одним из вариантов осуществления, концентрация FVIII составляет меньше 3% усредненной концентрации FVIII в плазме здорового донора. В соответствии с дополнительным вариантом осуществления, концентрация FVIII составляет меньше 2% усредненной концентрации FVIII в плазме здорового донора. Как определено выше, модифицированную плазму определяют как имеющую дефицит FVIII, если она содержит меньше 1% концентрации здорового донора, а именно приблизительно 0,01 МЕ/мл.
Поскольку кровь, в частности, кровь человека, и, следовательно, также плазма, получаемая из крови, содержит количество vWF, которое выше FVIII, vWF истощают не полностью. Например, модифицированную плазму можно использовать для тестирования получаемых из плазмы или рекомбинантных образцов FVIII. Для этого плазма должна содержать все факторы свертывания, помимо FVIII, в частности, модифицированный продукт крови содержит достаточную концентрацию vWF. Предпочтительно, концентрация vWF составляет по меньшей мере 20% от усредненной концентрации vWF плазмы здорового донора-человека. Более предпочтительно концентрация vWF составляет по меньшей мере 30% от усредненной концентрации vWF плазмы здорового донора-человека. Концентрация vWF в модифицированной плазме также может составлять по меньшей мере 40% от усредненной концентрации vWF плазмы здорового донора-человека. В соответствии с предпочтительным вариантом осуществления, концентрация vWF составляет по меньшей мере 50% от усредненной концентрации vWF плазмы здорового донора-человека. При концентрации в 50% от концентрации здорового донора-человека концентрация vWF должна быть достаточной для тестов FVIII.
Однако в модифицированной плазме более высокие концентрации vWF могут быть необходимы по различным причинам, например, во время анализа FVIII для увеличения стабильности среды для продукта FVIII и/или из-за использования модифицированной плазмы в различных специфических терапиях, для которых необходимы более высокие количества vWF. Таким образом, посредством внесения экзогенного vWF, рекомбинантного или получаемого из плазмы vWF в модифицированную плазму, можно получать модифицированную плазму с концентрацией vWF по меньшей мере 75% от усредненной концентрации vWF плазмы здорового донора-человека, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, в частности по меньшей мере приблизительно 100%. Для использования плазмы в аналитических способах обнаружения FVIII и для специфических терапий концентрация FVIII в частности составляет ниже 0,01 МЕ/мл, то есть 1% от концентрации FVIII в плазме здорового донора-человека, и концентрация vWF составляет по меньшей мере 90% от концентрации vWF плазмы здорового донора-человека. Способ в соответствии со вторым аспектом для получения модифицированной плазмы, в частности плазмы со сниженным содержанием FVIII, предпочтительно не ведет к значимому снижению фибриногена в модифицированной плазме.
В соответствии с одним из вариантов осуществления модифицированной плазмы в соответствии с третьим аспектом концентрация фибриногена составляет по меньшей мере 1 г/мл по объему модифицированной плазмы, предпочтительно по меньшей мере 1,3 г/мл, более предпочтительно 1,5 г/мл. Активность FX в модифицированной плазме предпочтительно составляет по меньшей мере 0,5 МЕ/мл, более предпочтительно находится в диапазоне 0,9-1,1 МЕ/мл. Модифицированная плазма предпочтительно должна иметь низкую амидолитическую активность. Амидолитическая активность, например, может быть основана на протеазном субстрате S-2288 или S-2366. Амидолитическую активность на основании субстрата S-2288 определяют, как показано в примере 4. На основании способа определения, приведенного в примере 4, амидолитическая активность в отношении S-2288 предпочтительно равна 1 mOD/мин или ниже, более предпочтительно равна 0,5 mOD/мин или ниже, в частности, предпочтительно равна 0,2 mOD/мин или ниже. Кроме того, на основании способа определения, приведенного в примере 4, амидолитическая активность в отношении S-2366 равна 0,5 mOD/мин или ниже, предпочтительно равна 0,2 mOD/мин или ниже, более предпочтительно равна 0,1 mOD/мин или ниже.
Как рассмотрено выше, существует несколько вариантов применения модифицированной плазмы в соответствии с третьим аспектом. В частности, модифицированную плазму можно использовать в терапии. Таким образом, в соответствии с четвертым аспектом, изобретение относится к модифицированной плазме для применения в терапии. Примером использования модифицированной плазмы является лечение нарушений, которые требуют пониженной активности коагуляции. В частности, это могут конкретные ситуации при диссеминированном внутрисосудистом свертывании (DIC). DIC представляет собой патологический процесс, отличающийся повсеместной активацией коагуляционного каскада, что ведет к формированию сгустков крови в мелких сосудах по всему организму. Это ведет к нарушению тканевого потока крови и, в конечном итоге, может вести к полиорганному поражению. Введение плазмы с дефицитом FVIII ведет к разбавлению FVIII и добавлению ингибиторов протеаз, таких как антитромбин, белка C, белка S и тому подобное, которые также могут иметь противовоспалительный эффект и, следовательно, в комбинации с пониженной активностью свертывания, улучшенную способность организма контролировать DIC.
Во многих случаях сепсис представляет собой фазу, предшествующую DIC. Таким образом, также во время некоторых случаев будет благоприятно снизить концентрацию FVIII и добавить количество свежих протеазных ингибиторов/противовоспалительных веществ во время лечения сепсиса, по профилактическим причинам, чтобы дополнительно имитировать риск развития DIC.
Альтернативно модифицированную плазму с пониженной концентрацией FVIII можно использовать в аналитическом способе для тестирования концентрации и/или активности FVIII в образце. Таким образом, в соответствии с пятым вариантом осуществления, изобретение относится к использованию модифицированной плазмы в соответствии с третьим вариантом осуществления для тестирования концентрации и/или активность FVIII в образце. Для полноразмерного FVIII и его функциональных производных активность представляет собой непосредственную меру концентрации, и в целом ее используют для того, чтобы определять концентрацию. Активность и концентрация FVIII связаны следующим образом: 1 МЕ/мл эквивалентно концентрации 0,1 мкг/мл FVIII с отсутствующим B-доменом и приблизительно в 2 раза выше для полноразмерного FVIII.
Используя способ по изобретению, можно не только удалять FVIII или снижать его концентрацию в образце. Как показано, примеры с FVIII аффинностью к легкой цепи также связываются с комплексом белка FVIII и белка vWF.
Таким образом, в соответствии с шестым аспектом, изобретение относится к способу очистки и/или обогащения белком FVIII, белком vWF или комплексом белка FVIII и белка vWF, который включает стадии:
- предоставления первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF,
- осуществления способа отделения в соответствии с первым аспектом;
- необязательного применения по меньшей мере одной стадии промывки ко второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF; и
- необязательного элюирования третьей композиции, содержащей vWF, в частности, с использованием элюирующего буфера, содержащего CaCl2; и
- элюирования четвертой композиции, содержащей комплекс белка FVIII и белка vWF или только белок FVIII, из аффинной смолы.
В соответствии с одним из вариантов осуществления по шестому аспекту, способ служит для очистки и/или обогащения комплексом белка FVIII и белка vWF и включает стадии:
- предоставления первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF,
- осуществления способа отделения в соответствии с первым аспектом;
- необязательного применения по меньшей мере одной стадии промывки ко второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF; и
- элюирования четвертой композиции, содержащей комплекс белка FVIII и белка vWF, из аффинной смолы.
В соответствии с одним из вариантов осуществления по шестому аспекту способ служит для очистки и/или обогащения белком FVIII и включает стадии:
- предоставления первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF;
- осуществления способа отделения в соответствии с первым аспектом;
- необязательного применения по меньшей мере одной стадии промывки ко второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF;
- элюирования четвертой композиции, содержащей белок vWF, из аффинной смолы; и
- элюирования пятой композиции, содержащей белок FVIII, из аффинной смолы.
В соответствии с одним из вариантов осуществления, аффинную смолу уравновешивают перед контактом с первой композицией с использованием уравновешивающего буфера. Уравновешивающий буфер предпочтительно выбирают из имидазола, гистидина, фосфата натрия, цитрата натрия, Tris, HEPES, глицина, NaCl и Tween80 Предпочтительно, pH уравновешивающего буфера находится в диапазоне от 6,9 до 7,8, предпочтительно в диапазоне от 7,2 до 7,6. В соответствии с одним из вариантов осуществления концентрация имидазола составляет приблизительно 10 мМ, концентрация глицина составляет приблизительно от 0,5 до 1%, концентрация NaCl составляет приблизительно 0,1 M и концентрация Tween составляет приблизительно 0,02%. Предпочтительно pH составляет приблизительно 7,4. Предпочтительно, концентрация CaCl2 в уравновешивающем буфере составляет самое большее 50 мМ. Более предпочтительно уравновешивающий буфер не содержит кальций, в частности CaCl2.
Стадию промывки предпочтительно осуществляют с использованием буфера для промывки. Буфер для промывки предпочтительно выбран из имидазола, гистидина, фосфата натрия, цитрата натрия, Tris, HEPES, глицина, NaCl и Tween 80. Предпочтительно, pH уравновешивающего буфера находится в диапазоне от 6,0 до 7,5, предпочтительно в диапазоне от 6,3 до 6,7. В соответствии с одним из вариантов осуществления концентрация имидазола составляет приблизительно 10-20 мМ, концентрация глицина составляет приблизительно от 0,5 до 1%, концентрация NaCl составляет приблизительно 0,4-1,0 M и концентрация Tween составляет приблизительно 0,02%. Предпочтительно pH составляет приблизительно 6,5. Предпочтительно, концентрация CaCl2 в промывающем буфере составляет самое большее 50 мМ. Более предпочтительно промывающий буфер не содержит кальций, в частности CaCl2.
Для элюирования белка vWF из комплекса, связанного с аффинной смолой, связывание белка FVIII и белка vWF следует разрушить. Такое отделение предпочтительно достигают посредством контакта комплекса, связанного с аффинной смолой, с раствором, содержащим ионы кальция, например, с градиентом от 0 до 0,5 M CaCl2 на протяжении колонки, набитой комплексом, связанным с аффинной смолой, и сбора пика белка vWF, как обнаруживают по поглощению на 280 нм на выпуске колонки. Альтернативно элюирование или белка vWF из аффинной смолы можно осуществлять посредством постепенного увеличения концентрации CaCl2, предпочтительно 0,15 M CaCl2, более предпочтительно 0,25 M CaCl2 и вплоть приблизительно до 0,5 M CaCl2. pH в процессе отделения vWF находится в диапазоне от 6 до 8, предпочтительно составляет 7,4.
В соответствии с одним из вариантов осуществления vWF элюируют с использованием элюирующего vWF буфера. Элюирующий vWF буфер выбирают из имидазола, гистидина, фосфата натрия, цитрата натрия, Tris, HEPES, глицина, NaCl и Tween 80. Предпочтительно в элюирующем буфере концентрация имидазола составляет приблизительно 10 мМ, концентрация глицина составляет приблизительно от 0,5 до 1%, концентрация NaCl составляет приблизительно 0,4 M, концентрация CaCl2 составляет приблизительно 0,25 M и концентрация Tween составляет приблизительно 0,02%. Если фракция, не связывающаяся с аффинной смолой после первого простого нанесения, не предназначена к использованию для плазмы с дефицитом FVIII и тому подобное, обычно 0,25 M CaCl2, как добавляют в элюирующий vWF буфер, можно добавлять в исходный материал и/или уравновешивающий буфер для того, чтобы разрушать взаимодействие между FVIII и vWF и, таким образом, заставлять только FVIII связываться с аффинной смолой.
После удаления и элюирования vWF на второй стадии можно элюировать белок FVIII. В соответствии с другим вариантом осуществления по шестому аспекту, пятую композицию, содержащую FVIII, элюируют посредством контакта аффинной смолы со вторым элюирующим буфером, содержащим спирт, в частности, этиленгликоль, предпочтительно в концентрации 50% и с pH между 6 и 8. Предпочтительно, в связи с этим аффинной смолой является VIIISelect.
В случае, когда только vWF подлежит обогащению/очистке, способ осуществляют без последнего элюирования FVIII. Таким образом, в соответствии с одним из вариантов осуществления по шестому аспекту, способ служит для очистки и/или обогащения белком vWF и включает стадии:
- предоставления первой композиции, содержащей белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок vWF, который содержит по меньшей мере FVIII-связывающий домен vWF, где белок FVIII может формировать комплекс с белком vWF;
- осуществления способа отделения в соответствии с первым аспектом;
- необязательного применения по меньшей мере одной стадии промывки ко второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF; и
- элюирования четвертой композиции, содержащей белок vWF, из аффинной смолы.
В соответствии с использованием способа очистки и/или обогащения согласно шестому аспекту, получают композицию, содержащую белок FVIII, белок vWF или комплекс белка FVIII и белка vWF. Таким образом, в соответствии с седьмым аспектом, изобретение относится к композиции, содержащей комплекс белка FVIII и белка vWF или очищенный белок FVIII или очищенный белок vWF. Таким образом, в соответствии с одним из вариантов осуществления, композиция содержит комплекс FVIII и белка vWF. В соответствии с другим вариантом осуществления, композиция по шестому аспекту содержит очищенный белок FVIII. В соответствии с дополнительным вариантом осуществления, композиция по шестому аспекту содержит очищенный белок vWF. Очищенный vWF можно использовать для добавления в плазму с дефицитом FVIII, в частности, в плазму с дефицитом FVIII, получаемую способом в соответствии с изобретением.
Очищенный белок FVIII или очищенный белок vWF или комплекс белка FVIII и белка vWF можно использовать в терапии.
Таким образом, в соответствии с седьмым аспектом, изобретение относится к композиции в соответствии с шестым аспектом для использования в терапии. В частности, предоставлена композиция для использования в лечении нарушений свертываемости, для которых необходима повышенная активность коагуляции. Примерами таких нарушений свертываемости является другая ситуация с пациентами с гемофилией А и/или пациентами с дефицитом vWF.
Лечение нарушений свертываемости, в частности, может включать подкожное или внутривенное применение композиции.
Следующие примеры дополнительно определяют изобретение.
ПРИМЕРЫ
Материалы, используемые в примерах
Таблица 1: материалы
(предоставлено в Octapharma)
58892-51
Пример 1 - порционное отделение FVIII от различных продуктов крови с использованием смолы VIIISelect
1.1. Общее
VIIISelect представляет собой коммерчески доступный гель с предполагаемой связывающей способностью по меньшей мере 25000 МЕ FVIII/мл. VIIISelect представляет собой аффинную смолу, разработанную для очистки рекомбинантного фактора VIII, обедненного по β-домену.
Тестировали три различных стартовых материала: плазму, OctaplasTM SD и криосупернатант.
Плазму и криосупернатант забуферивали посредством добавления 0,25 г HEPES/25 мл плазмы, что давало pH 6,9-7,5. Hepes не добавляли в OctaplasTM, поскольку его уже забуферивают во время производства. Он содержит 0,39 г дигидрата первичного кислого фосфата натрия/кг плазмы, что составляет приблизительно от 2 до 7,5 ммоль/л в конечном продукте, и 5 г глицина/кг плазмы, что дает pH от 6,9 до 7,4.
1.2. Эксперименты порционной адсорбции
Смолу VIIISelect получали с использованием следующих буферов:
1.Буфер для регенерации
0,1 M HAc
2. Буфер для промывки
0,5 M NaCl
3. Элюирующий буфер
20 мМ L-гистидин,
0,5 M NaCl,
20 мМ CaCl2,
В 50% этиленгликоле, pH 6,4-6,6
4. Уравновешивающий буфер
NaCl 30 г/кг,
Цитрат Na 6,0 г/кг
pH 6,4-6,6
5. Раствор для хранения
20% Этанол.
Не использованные гели обрабатывали буфером 2, после чего следовал буфер 4. Использованные гели обрабатывали с использованием: элюирующего буфера, буфера для регенерации, буфера для промывки и уравновешивающего буфера (буфер 3, 1, 2 и 4) перед использованием. Все гели хранили в 20% этаноле.
2-20 г аффинной смолы обрабатывали 3 раза с использованием 50 мл каждого буфера. Для каждой обработки буфер наносили на смолу и инкубировали с аффинной смолой в течение 1 часа во время мягкого перемешивания. Аффинную смолу отделяли от продукта крови с использованием центрифугирования при комнатной температуре. Исследовали следующие комбинации и образцы изымали в различные моменты времени, чтобы отслеживать связывание FVIII.
Таблица 2: обзор тестируемых образцов при порционной адсорбции смолы VIIISelect
Все три продукта крови отделяли от геля в случае взятия образца с использованием центрифугирования.
Материалы из всех образцов визуально проверяли перед дозированием и заморозкой, и все выглядели оптически прозрачными без склонности к образованию свертков.
1.3. Измерение концентрации FVIII
Анализ активности FVIII осуществляли с использованием наборов Coatest SP FVIII или Coatest SP4 FVIII (Chromogenix), используя ручной способ конечных точек в микропланшете в соответствии с вкладышами в упаковки, за исключением того, что дополнительные стандартные разведения включали в анализ более низких концентраций FVIII, чтобы иметь возможность лучше обнаруживать низкие концентрации FVIII.
1.4. Результаты анализа образцов
В нескольких различных экспериментах порционной адсорбции, в которых изучали эффект концентрации геля, температуры и времени, обнаружено, что связывание FVIII усовершенствовали, когда увеличивали любую из этих трех переменных.
Результаты представлены на фиг. с 1 до 3. Использование 5 г VIIISelect/25 мл плазмы вело к остаточной активности FVIII 1,4% для плазмы и 3% для OctaplasTM после 24 часов инкубации при 20-25°C. Не было возможно удалять всю остаточную активность FVIII в OctaplasTM даже после увеличения концентрации геля до 15 г VIIISelect/25 мл OctaplasTM. Наивысшая концентрация VIIISelect, используемая для плазмы, составляла 5 г/25 мл.
В отличие от этого, было возможно связывать весь FVIII, присутствующий в криосупернатанте, используя гель VIIISelect при концентрации геля 1 г/25 мл криосупернатанта. Скорость связывания возрастала вместе с увеличением температуры.
Пример 2 - эксперименты адсорбции FVIII колоночной хроматографией с использованием смолы VIIISelect
2.1. Процедура
Как в примере 1, три различных продукта крови использовали в качестве исходных материалов. В каждом эксперименте смолу VIIISelect набивали в колонку XK16 (GE LifeScience) до конечного объема колонки в 10 мл смолы, что вело к высоте слоя 5 см. Образцы наносили на колонки с помощью двух насосов P-50 (0,5 мл/мин) и P-1 (0,01-0,05 мл/мин) (Pharmacia Biotech). Материалы элюата собирали, когда достигали стабильного поглощения при 280 нм.
Таблица 3: постановка экспериментов с VIIISelect колонкой
2.2. Результаты
В таблице 4 представлены компилированные результаты. Из данных ясно, что связывание FVIII в OctaplasTM с VIIISelect сильно зависело от используемой скорости потока. Таким образом, остаточная активность FVIII падала от 0,17 до 0,03 МЕ/мл при снижении скорости потока с 0,5 мл/мин до 0,05 мл/мин. Хотя следует отметить, что скорость потока 0,05 мл/мин (1,5 см/ч) слишком низка для использования в предположительном крупномасштабном производственном процессе.
Используя плазму в качестве источника FVIII, тестировали только скорость потока 0,5 мл/мин, и результаты были аналогичны экспериментам порционной адсорбции, то есть достигали несколько более низкой остаточной активности FVIII по сравнению с OctaplasTM (0,13 в сравнении 0,17 МЕ/мл).
В отличие от этого, полного истощения активности FVIII достигали путем VIIISelect хроматографии криосупернатанта также при использовании скорости потока 0,5 мл/мин.
Повторная хроматография OctaplasTM пустого пула, содержащего 0,17 Ед/мл FVIII, при использовании скорости потока 0,5 мл/мин. Здесь остаточная активность FVIII составляла 0,08 МЕ/мл, тогда как при тех же условиях не обнаруживали активность FVIII после хроматографии криосупернатанта, который имел начальную активность FVIII 0,2 МЕ/мл.
Таблица 4 - результаты экспериментов колоночной хроматографии
(15 см/ч)
(15 см/ч)
(0,3-1,5 см/ч)
(15 см/ч)
(не поддается обнаружению)
(15 см/ч)
Пример 3 - подробный анализ продуктов крови из примеров 1 и 2
Выборочные препараты из порционных и хроматографических экспериментов дополнительно тестировали на их пригодность в качестве разбавителя rhFVIII.
3.1. Определение концентрации FVIII
Более экстенсивный анализ FVIII осуществляли на стартовых материалах, эталонной дефицитной плазме и выборочных конечных материалах. Анализ осуществляли в соответствии с вкладышем в упаковку, используя как низкий, так и высокий диапазон. SSC#4 использовали в качестве стандарта и разводили в разбавителе (высокий диапазон), и разбавитель с постоянным уровнем (1/81) врожденной дефицитной плазмы (низкий диапазон). Образцам низкого диапазона присваивали удельную активность в сравнении со стандартом, разведенным во врожденной дефицитной плазме для того, чтобы иметь то же количество плазмы как в стандарте, так и в образцах, чтобы придерживаться принципа сравнения подобного с подобным и для того, чтобы избегать переоценки активности FVIII образца. Образцы анализировали как истинные повторения в двух независимых сериях анализа.
3.2. Результаты определения активности FVIII
Три коммерчески доступные плазмы с дефицитом FVIII использовали в качестве эталона (Siemens, Helena Congenital, Affinity). Все три эталонные плазмы имели остаточные активности FVIII, которые не поддавались обнаружению, или ниже 0,005 МЕ/мл (0,5%).
Результаты сведены в таблице 5.
Дефицитные плазмы, полученные из криосупернатанта посредством порционной адсорбции, имели остаточные активности FVIII, которые не поддавались обнаружению или ниже 0,005 МЕ/мл. Плазма, которую инкубировали с VIIISelect в течение 24 часов при комнатной температуре (5 г/25 мл плазмы), и OctaplasTM, которую инкубировали с VIIISelect (15 г/25 мл), имели остаточные активности 0,012-0,014 МЕ/мл. Истощение FVIII в OctaplasTM посредством хроматографии возможно, только если использовали очень низкие скорости потока 0,3-1,5 см/ч (0,01-0,05 мл/мин), и даже тогда остаточная активность близка к 0,04 при использовании VIIISelect.
Таблица 5 - результаты анализа FVIII с различной плазмой с дефицитом FVIII
3.3. Определение концентрации vWF
Концентрацию vWF измеряли в стартовых материалах, эталонной дефицитной плазме и выборочных материалах из порционных и хроматографических экспериментов, используя автоматизированный иммунологический анализ с латексным усилением Von Willebrand Factor Antigen (Instrumentation Laboratories) или ручную версию того же способа. Способ адаптировали к ручному способу с кинетическим считыванием, и SSC#4 использовали в качестве стандарта. Стандарт разводили от 1:4 до 1:20 в физиологическом растворе, образцы разводили 1:8 в физиологическом растворе. Каждому образцу присваивали удельную активность в повторениях в двух независимых сериях анализов.
3.4. Результаты определения антигена vWF
В таблице 6 представлены результаты измерений концентрации vWF.
Таблица 6 - результаты для антигена vWF, МЕ/мл
CryoCheck, vWF:антиген 0,8-1,08 МЕ/мл
порция 15 г/25 мл, 24 ч, 20-25°C
0,01-0,05 мл/мин, 20-25°C
24 ч, 20-25°C
порция 1 г/25 мл, 5 ч, 20-25°C
порция 1 г/25 мл, 24 ч, 2-8°C
Криосупернатант и дефицитная плазма, которую получали из криосупернатанта, имели низкую концентрацию антигена vWF. Это также уместно для дефицитной плазмы из Affinity Biologicals.
Порционная адсорбция или колоночная хроматография не вызывает какие-либо крупные потери vWF. Плазма, которую инкубировали с VIIISelect (5 г/25 мл), имела более высокое содержание антигена vWF по сравнению с эталонной дефицитной плазмой (1,6 в сравнении с 1,2-1,4 МЕ/мл).
3.5. Определение концентрации фибриногена
Содержание фибриногена определяли с использованием набора Q.F.A. Thrombin (Instrumentation Laboratories), который основан на способе Клаусса. SSC#4 использовали в качестве стандарта. Начальные тесты показывали, что способ Клаусса нельзя использовать при осуществлении способа вручную. Способ Клаусса основан на зарегистрированном времени свертывания, и время свертывания при использовании стандартного анализа Клаусса, составляло <15 с, что ведет к полному свертыванию перед началом измерения поглощения.
Анализ Клаусса
Образец разводят 1:10 до объема 200 мкл и инкубируют при 37°C в течение 3-4 мин. Затем 100 мкл раствора тромбина (концентрация 100 МЕ/мл) и дополнительно инкубируют при 37°C. Измеряют время до формирования свертка.
Взамен анализа Клаусса использовали модифицированный анализ на основании изменения мутности или светорассеяния после полного свертывания плазмы:
Образец разводят 1:10 до объема 250 мкл. Измеряют абсорбцию при 405 нм 50 мкл раствора тромбина (концентрация 25 МЕ/мл). Измерение абсорбции при 405 нм до тех пор, пока поглощение не достигает плато.
Анализ проводили при комнатной температуре и каждому образцу присваивали удельную активность в повторениях в двух независимых сериях анализов.
Этот модифицированный анализ, иногда обозначаемый как способ, производный от протромбинового времени, обычно очень хорошую корреляцию со способом Клаусса (см. ECAT Assay Procedures 2012, Palareti G et al. Clin Chem 1991, Rossi E et al. Thromb Res 1988).
3.6. Результаты определения фибриногена
Результаты для фибриногена представлены в таблице 7.
Похоже, что порционная адсорбция с использованием VIIISelect не вызывает какие-либо потери фибриногена, поскольку приблизительно ту же концентрацию фибриногена обнаруживали до и после порционной адсорбции. Однако для OctaplasTM, который инкубировали с 15 г VIIISelect/25 мл OctaplasTM, имела место потеря больше 70% (от 2,8 до 0,8 мг/мл). Наиболее вероятно это объясняет преципитат/сверток, который находили в оттаявшем образце.
Полученные контрольные значения 2,5 и 2,7 мг/мл находились в присвоенном диапазоне 2,33-3,16 мг/мл.
Таблица 7 - результаты определения фибриногена
CryoCheck, фибриноген 2,33-3,16 мг/мл
24 ч, 20-25°C
0,01-0,05 мл/мин, 20-25°C
24 ч, 20-25°C
порция 1 г/25 мл, 5 ч, 20-25°C
порция 1 г/25 мл, 24 ч, 2-8°C
3.7. Определение концентрации фактора X
Активность фактора X определяли с использованием хромогенного способа на основе RVV, в котором образец FX активируют до FXa с помощью змеиного яда RVV. SSC#4 использовали в качестве стандарта. Стандарт анализировали в разведении от 1:20 до 1:200 и образцы анализировали в разведении 1:40. Все разведения осуществляли в Tris буфере.
Измерение осуществляли в соответствии со следующим протоколом.
мин, 37°C
5 мин, 37°C
10 мин гидролиз, 37°C
3.8. Результаты определения активности фактора X
Результаты анализа фактор X сведены в таблице 8.
В таблице 7 показано, что процесс истощения FVIII не оказывает какие-либо большие эффекты на активность FX. Все образцы, содержащие эталонную дефицитную плазму, имели активности FX значительно выше 0,5 МЕ/мл. Активность FX ниже в OctaplasTM, который инкубировали с 15 г VIIISelect/25 мл OctaplasTM, и этот результат, таким образом, согласуется с результатами анализов vWF и фибриногена.
Таблица 8 - результаты активности фактора X, МЕ/мл
Пример 4 - определение прямой амидолитической активности
4.1 Измерение
Присутствие любой предварительной активации проверяли качественно и в сравнении с SSC#4 посредством инкубации стартовых материалов, эталонной дефицитной плазмы и выборочных материалов из порционных и хроматографических экспериментов с двумя различными хромогенными субстратами, S-2288 (общий субстрат сериновых протеаз) и S-2366 (тромбин, фактор XIa и APC). Все образцы разводили 1:5 и 1:10 в Tris буфере (TB035 Rossix). Скорость гидролиза для образцов сравнивали со скоростью гидролиза для плазмы SSC#4. Осуществляли следующую процедуру, в некоторых случаях с небольшими вариациями в концентрации субстрата и температуре инкубации, чтобы оптимизировать аналитическое сравнение между различными образцами.
4.2. Результаты для прямой амидолитической активности
Результаты сведены в таблице 9 и на фиг. 4.
Присутствие протеаз тестировали качественно посредством инкубации с двумя хромогенными субстратами: S-2288, общий субстрат сериновых протеаз, и S-2366, чувствительный субстрат для тромбина, фактора XIa и APC. Общие результаты (таблица 9) указывают на очень ограниченное присутствие активированных протеаз, за исключением дефицитной плазмы Siemens, которая имела явно более высокие скорости гидролиза по сравнению с другими образцами.
Таблица 9 - результаты для прямой амидолитической активности
405 нм/час
405 нм/час
4.3. Определение стабильности rhFVIII
Степень предварительной активации тестировали неявно в обратном исследовании стабильности посредством определения стабильности чистого rhFVIII, который вносили в эталонную дефицитную плазму и выборочные материалы из порционных и хроматографических экспериментов в соответствии с примером 1 и 2. Постановка эксперимента основана на допущении о том, что увеличение предварительной активации будет вести к активации rhFVIII и при этом к снижению стабильности rhFVIII. rhFVIII разводили до номинальной концентрации 1 МЕ/мл с использованием каждой плазмы с дефицитом FVIII, которые дозировали и замораживали при≤-70°C. Осуществляли обратное исследование стабильности, где образцы оттаивали через 3 ч, 5 ч и 8 ч и сравнивали с образцами, которые оттаивали непосредственно перед началом анализа.
Активность rhFVIII определяли с использованием набора Coatest SP FVIII, используя высокий диапазон и ручной способом с микропланшетом. Каждый образец анализировали в независимо подготовленных повторениях. Стандарт разводили до 1 МЕ/мл во врожденной дефицитной плазме Helena.
4.4. Результаты теста стабильности rhFVIII, разведенного в плазме с дефицитом FVIII
Результаты сведены в таблице 10 и на фиг. 5.
Отсутствовали значимые различия в стабильности rhFVIII при разведении до 1 МЕ/мл в различных дефицитных плазмах.
Почти идентичное восстановление rhFVIII при t=0 в других препаратах, когда присваивали удельную активность, в сравнении со стандартом, разведенным во врожденной дефицитной плазме Helena, подтверждает находку из примера 4.6. что активность в анализах идентична для всех дефицитных плазм.
Таблица 10 - Результаты стабильности
4.5. Оценка удельной активности rhFVIII с использованием различных дефицитных плазм в качестве сред для разведения
Концентрированный раствор rhFVIII разводили до 1 МЕ/мл в семи различных дефицитных плазмах и присваивали удельную активность в сравнении со стандартом, разведенным в той же дефицитной плазме.
Не удавалось наблюдать значимые различия в оценке удельной активности при использовании различных дефицитных плазм в качестве разбавителей (таблица 11, фиг. 6). Средняя присвоенная активность препарата rhFVIII составляла 4213 МЕ/мл и все средние результаты для различных дефицитных плазм находились в пределах±4% от среднего, диапазон 4058-4394 МЕ/мл.
Наклон стандарта не зависел от дефицитной плазмы. Это обусловлено тем, что образец и стандарт разводили в одной и той же дефицитной плазме и, таким образом, активность в анализе снижали для обоих.
В этой постановке эксперимента оценка удельной активности rhFVIII не зависела от степени остаточной активности FVIII в дефицитных плазмах, поскольку стандарт и образец разводили в одной и той же дефицитной плазме. Таким образом, потенциальный вклад остаточной активности FVIII идентичен для образца и стандарта. Во всех случаях вклад любой остаточной активности FVIII настолько низок, что он не оказывал значительного влияния на наклоны калибровочных кривых.
Таблица 11 - Результаты оценки удельной активности rhFVIII
24 ч, 20-25°C
24 ч, 20-25°C
Пример 5 - Очистка vWF, свободного от активности FVIII
Исходный материал для очистки vWF представлял собой Wilate, комплекс FVIII и vWF человека, продаваемый в Octapharma под названием Wilate®.
VIIISelect набивали в колонку XK 16/20 (GE Healthcare) до высоты слоя 4,5 см, равной объему колонки 9 мл. Скорость потока во время эксперимента составляла 0,25 мл/мин, что равно 7,5 см/ч. Колонку уравновешивали с использованием следующего уравновешивающего буфера.
Уравновешивающий буфер:
Wilate® восстанавливали в 4 мл 0,25 M CaCl2 в течение 30 мин, чтобы нарушать взаимодействие между FVIII и vWF. Восстановленный Wilate® наносили на колонку VIIISelect XK 16/20 при скорости потока 0,25 мл/мин, в соответствии с чем основная часть FVIII связывалась с аффинной смолой и собранный элюат содержал vWF и некоторые другие белки, такие как фибриноген и тому подобное
Буфер для преципитации элюата
К 1 объему элюата из колонки VIIISelect в раствор добавляли 3,34 объема буфера элюата и 3,13 г NaCl. Высокая концентрация глицина преципитирует молекулу vWF. Раствор перемешивали в течение 30 мин при комнатной температуре и затем центрифугировали на 600 об/мин в течение 10 мин, чтобы получать vWF-содержащий пеллет.
Пеллет быстро восстанавливали в буфере для восстановления.
Буфер для восстановления
После восстановления, его инкубировали при 28-32°C в течение приблизительно 10 часов для того, чтобы удалять любую остаточную активность FVIII.
Наконец, EDTA удаляли с использованием обессоливающей колонки HiPrep и уравновешивающего буфера с 40 мМ Hepes и 0,15 M NaCl, pH 7.
Приведенный выше протокол приводил к восстановлению vWF 20-25% и остаточной активности FVIII меньше 0,01 МЕ FVIII/100 МЕ vWF Ag.
Пример 6 - тестирование различных скоростей потока
6.1. Процедура
Проводили ограниченное исследование для изучения эффекта скорости потока, оказываемого на остаточную активность FVIII. Криосупернатант наносили на колонку XK16, набитую VIIISelect, высота слоя 4 см, объем колонки 8 мл. Тестировали скорости потока от 120 до 7,5 см/ч (1 мл/мин=30 см/ч). На основании результатов, скорость потока 7,5 см/ч (0,25 мл/мин) выбирали для очистки плазмы с дефицитом FVIII.
6.2. Результаты
Результаты представлены на фиг. 7. Остаточная активность FVIII линейно связана со скоростью потока. Скорость потока ниже 10 см/ч обеспечивает надежное получение плазмы с дефицитом FVIII при активности FVIII меньше 1%.
Используемая скорость потока 7,5 см/ч=0,25 мл/мин на колонке XK16 с диаметром 1,6 см приводила к времени процесса 13 часов, когда вносили 200 мл плазмы. 200 мл плазмы соответствуют 25-кратному объему колонки, и во время процесса не обнаруживали увеличенную утечку FVIII. Давление было стабильно во время всех колоночных очисток.
Пример 7 - получение плазмы с дефицитом FVIII
Три различные порции плазмы с дефицитом FVIII получали из двух различных порций криосупернатанта. Криосупернатант оттаивали на водяной бане при комнатной температуре и забуферивали посредством добавления 0,25 г Hepes/25 мл плазмы, что давало 40 мМ Hepes, за исключением одной порции, которую забуферивали с использованием 20 мМ Hepes (Pre-Pilot 3).
Очистку осуществляли с использованием колонки XK16 (GE Lifesciences), набитой VIIISelect, высота слоя 4 см, объем колонки 8 мл, и хроматографической системы Äkta Pure 150 (GE LifeSciences). В качестве уравновешивающего буфера использовали NaCl 26 г/кг, цитрат Na 6,0 г/кг, pH 6,4-6,6. Использовали скорость потока 7,5 см/ч (0,25 мл/мин) и 200-250 мл криосупернатанта вносили в каждую колонку каждой порции, что вело к времени процесса 13-17 часов.
В плазму с дефицитом FVIII из Pre-Pilot 3 вносили vWF, полученный в соответствии с примером 5, до номинальной концентрации 1 МЕ/мл vWF Ag. Дефицитные плазмы дозировали в подставки 96×1 мл и замораживали при≤70°C.
Пример 8 - определение характеристик плазмы с дефицитом FVIII
8.1. Определение остаточной активности FVIII
Остаточную активность FVIII измеряли с использованием набора Coatest SP4 FVIII (Chromogenix) и анализ осуществляли в соответствии со вкладышем в упаковку Coatest SP4 FVIII, используя низкий диапазон. SSC#4 использовали в качестве стандарта и разводили в буфере из набора. Образцы, полученные в примере 7, анализировали при разведении 1:81.
8.2. Определение концентрации vWF Ag
Концентрацию vWF определяли с использованием von Willebrand Factor Antigen Kit (Instrumentation Laboratories) и анализ осуществляли с использованием коагуляционного прибора ACL TOP 700 со встроенным приложением для набора. SSC#4 использовали в качестве стандарта.
8.3. Определение концентрации фибриногена
Содержание фибриногена определяли с использованием набора Q.F.A. Thrombin (Instrumentation Laboratories) и анализ осуществляли с использованием коагуляционного прибора ACL TOP 700 со встроенным приложением для набора. SSC#4 использовали в качестве стандарта
8.4. Определение концентрации фактора X
Активность фактора X определяли с использованием хромогенного способа на основе RVV, в котором образец FX активируют до FXa с помощью фермента змеиного яда RVV-X. SSC#4 использовали в качестве стандарта. Стандарт анализировали при разведениях от 1:20 до 1:200 и образцы анализировали при разведении 1:40. Все разведения осуществляли в Tris буфере.
В таблице 12 сведен протокол определения концентрации FX.
Таблица 12: хромогенный способ для FX
3 мин, 37°C
5 мин, 37°C
10 мин гидролиз, 37°C
8.5. Измерение поглощения
Поглощение при 280 и 600 нм измеряли с использованием Eppendorf BioPhotometer.
8.6. Результаты
Все образцы имели остаточную активность FVIII < 1%. В Rossix Pre-Pilot 3 вносили vWF приблизительно от 20-30% до уровня приблизительно 100% vWF. Эта концентрация vWF сравнима с тестированной дефицитной плазмой Siemens и приблизительно на 30% выше по сравнению с концентрацией vWF Ag в плазме с врожденным дефицитом FVIII из Helena BioSciences. Pre-Pilot 1 и 2 имели концентрацию vWF между 20-30%.
Плазма Pre-Pilot имела слегка (прибл. На 20%) более низкую концентрацию фибриногена по сравнению с эталонной плазмой. Наиболее вероятная причина состоит в том, что стартовым материалом является криосупернатантная плазма, и во время стадии криопреципитации части молекул фибриногена претерпевают копреципитацию. Активность фактора X является нормальной для всех тестированных дефицитных плазм.
Как можно отметить визуально и ожидать, эталонные плазмы являются более мутными, с OD600 в 1,5-2 раза выше по сравнению с Rossix Pre-Pilot. Это связано с тем фактом, что Pre-Pilot получают из криопреципитатной плазмы и криопреципитат удаляют, используя стадию центрифугирования, которая снижает определенные вещества в криосупернатанте. Поглощение при 280 нм, которое можно использовать в качестве меры концентрации белка, схоже или слегка выше в Rossix Pre-Pilot, что вероятно обусловлено вариациями от порции к порции между различными партиями плазмы.
Таблица 13: аналитическое определение характеристик дефицитной плазмы
Пример 9 - тест предварительной активации
9.1. Прямая амидолитическая активность - экспериментальный протокол
Присутствие какой-либо предварительной активации проверяли качественно посредством инкубации дефицитной плазмы с двумя различными хромогенными субстратами, 4 мМ S-2288 (общий субстрат сериновых протеаз) и 2 мМ S-2366 (тромбин, фактор XIa и APC). Все образцы разводили 1:10 в Tris буфере (TB035 Rossix).
Таблица 14 - способ прямой амидолитической активности
9.2. Прямая амидолитическая активность - результаты
Результаты приведены на фиг. 8. Присутствие протеаз тестировали качественно посредством инкубации с двумя хромогенными субстратами (S-2288, общий субстрат сериновых протеаз, и S-2366, чувствительный субстрат для тромбина, фактора XIa и APC). В целом, результаты указывают на очень ограниченное присутствие активированных протеаз, за исключением дефицитной плазмы Siemens, которая имела явно более высокие скорости гидролиза по сравнению с другими образцами.
9.3. Определение стабильности rhFVIII
Степень предварительной активации тестировали неявно в обратном исследовании стабильности посредством определения стабильности чистого rhFVIII с удаленным B-доменом, который добавляли в дефицитную плазму.
Постановка эксперимента основана на допущении о том, что увеличение предварительной активации приведет к активации rhFVIII и, при этом, к снижению стабильности rhFVIII. Nuwiq®, полученный из Octapharma AB, Sweden, 2000 МЕ/флакон, разводили до номинальной концентрации 1 МЕ/мл с использованием каждой плазмы с дефицитом FVIII, дозировали и замораживали при ≤ -70°C. Осуществляли обратное исследование стабильности, где образцы оттаивали через 3 ч и 6 ч и сравнивали с образцами, которые оттаивали непосредственно перед началом анализа.
Активность rhFVIII определяли с использованием набора Coatest SP FVIII, используя высокий диапазон и ручной способ с микропланшетом. Каждый образец анализировали в истинных четверных повторениях (независимо полученных) и присваивали удельную активность в сравнении со стандартом, полученным из пула образцов t=0.
9.4. Стабильность rhFVIII, разведенного в плазмах с дефицитом FVIII - результаты
Отсутствовали значимые различия в стабильности Nuwiq® 2000 МЕ/флакон при разведении до номинально 1 МЕ/мл в различных дефицитных плазмах. Изменение активности после 6 часов хранения при 20-25°C находилось в диапазоне от -3 до +2%.
Таблица 15: стабильность Nuwiq, разведенного до 1 МЕ/мл в дефицитной плазме
9.5. Оценка удельной активности rhFVIII (Nuwiq®, флакон 250 МЕ и флакон 2000 МЕ) после разведения до 1 МЕ/мл в различных дефицитных плазмах.
Результаты оценки удельной активности приведены в таблицах 15 и 16, а также на фиг. 13 и 14. Все серии анализов одобряли на параллелизм, регрессию и линейность. Отсутствовали значимые различия в вариации или оценке удельной активности для 2000 МЕ/флакон между различными дефицитными плазмами. 250 МЕ/флакон демонстрировал более значительную вариацию и на 2-5% более низкую присвоенную удельную активность, когда предварительно разводили в Pre-Pilot 1 и 2. Они представляют собой два Pre-Pilot с низкой концентрацией vWF Ag, и объяснение слегка более низких результатов может быть в том, что более низкое присутствие vWF Ag ведет к менее стабильным разведениям rhFVIII.
Полученные удельные активности приблизительно 290 МЕ/флакон и 2550 МЕ/флакон отличаются от номинальной активности 250 МЕ/флакон и 2000 МЕ/флакон и составляют +16% и +28%, соответственно.
Эффект дозы для стандарта и образцов схож для всей используемой дефицитной плазмы.
Таблица 15 - оценка удельной активности - флакон 250 МЕ
Таблица 16 - оценка удельной активности - флакон 2000 МЕ
ССЫЛКИ
1. Farrugia et al., Biotechnology and plasma fractionation industry. The impact of advances in the production of coagulation FVIII. Biotechnology, 1993, vol. 3, No. 1.
2. Fay, Factor VIII: Function and structure, International Journal of Hematology vol. 83 2006, pp. 103-108.
3. Metal ion-independent association of Factor VIII subunits and the roles of calcium and copper ions for cofactor activity and inter-sub-unit affinity, Biochemistry 2001, vol. 40, 10293- 10300.
4. Wang et al., Coagulation Factor VIII; structure and stability, International Journal of pharmaceutics 2003, Vol. 259, pp. 1-15.
5. Furlan, Von Willebrand factor: molecular size and functional activity, Ann Hematol. 1996 vol 72(6), pp 341-348.
6. Svensson et al., Evaluation of the metal binding site in a recombinant co-agulation factor VIII identifies two sites with unique metal binding sites, Biological Chemistry 2013; vol. 394(6), pp. 761-765.
7. Eriksson et al., The manufacturing process for B-domain deleted recombinant FVIII, Seminars in Hematology, 2001, VoI 38, No 2, Suppl. 4 pp. 24-31.
8. Girma et al., Assay of Factor VIII antigen (FVIII:CAg) in 294 Haemophilia A patients by a new commercial ELISA using monoclonal antibodies, Haemophilia, 1998, vol. 4, pp. 98-103.
9. Fischer et al., Structural analysis of recombinant von Willebrand factor: identification of hetero- and homo-dimers, FEBS Letters 1994, vol. 351, pp 345-348.
10. ECAT Assay Procedures a Manual of Laboratory Techniques, Springer October 2012.
11. Palareti et al., Fibrinogen assays: a collaborative study of six different methods, Clinical Chemistry, 1991; vol 37 pp 714-19.
12. Rossi et al. Method for the determination of functional (clottable) fibrinogen by the new family of ACL coagulometers. Thromb Res 1988, vol. 52, pp 453-468.
13. McCue et al., Application of a novel affinity adsorbent for the capture and purification of recombinant Factor VIII compounds, Journal of Chromatography A, vol. 1216, 2009, pp7824-7830.
14. Muyldermans, Single domain camel antibodies: current status, Reviews in Moleculer Biotechnology, vol. 74, 2001, pp. 277-302.
15. Rosen, Assay of Factor VIII:C with a chromogenic substrate, Scand J Haemetol-Suppl 40, vol. 33, 1984, pp. 139-145.
16. Winge et al., Development, upscaling and validation of the purification process for human-cl rhFVIII (Nuwiq®), a new generation recombinant factor VIII produced in a human cell-line, Protein Expression and Purification, vol. 115, 2015, pp 165-175.
17. Chiu et al., Mapping the Interaction between Factor VIII and von Willebrand Factor by Electron Microscopy and Mass Spectrometry, Blood, 2015; vol. 126(8), pp. 935-938.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2698392C2 |
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2567811C2 |
| СПОСОБ ПРОИЗВОДСТВА ФАКТОРА VIII, ИМЕЮЩЕГО УЛУЧШЕННОЕ СООТНОШЕНИЕ FVIII:C/FVIII:Ag | 2015 |
|
RU2695428C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК рАР227, КОДИРУЮЩАЯ ПОЛИПЕПТИД РЕКОМБИНАНТНОГО ФАКТОРА VIII СВЕРТЫВАЕМОСТИ КРОВИ ЧЕЛОВЕКА, ЛИНИЯ КЛЕТОК Cricetulus griseus CHO 2H5 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ФАКТОРА VIII СВЕРТЫВАЕМОСТИ КРОВИ ЧЕЛОВЕКА И СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ФАКТОРА VIII | 2012 |
|
RU2500818C1 |
| МОДИФИЦИРОВАННЫЙ ФАКТОР ВИЛЛЕБРАНДА С УДЛИНЕННЫМ ПОЛУПЕРИОДОМ СУЩЕСТВОВАНИЯ IN VIVO, ЕГО ПРИМЕНЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ | 2009 |
|
RU2528855C2 |
| Химерный улучшенный рекомбинантный фактор VIII | 2015 |
|
RU2647769C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКА, СОДЕРЖАЩЕГО БЕЛОК, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ФАКТОР СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА, И ПОЛИМЕР НА ОСНОВЕ МОЛОЧНОЙ КИСЛОТЫ | 2016 |
|
RU2702740C2 |
| СОДЕРЖАЩИЕ ФАКТОР ФОН ВИЛЛЕБРАНДА (vWF) ПРЕПАРАТЫ И СПОСОБЫ, НАБОРЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2010 |
|
RU2579977C2 |
| СПОСОБ ДЛЯ ОЦЕНКИ РЕАКЦИИ КОАГУЛЯЦИИ КРОВИ | 2013 |
|
RU2683933C2 |
| ОЧИСТКА ПОДВИДОВ ФАКТОРА VIII | 2018 |
|
RU2800431C2 |
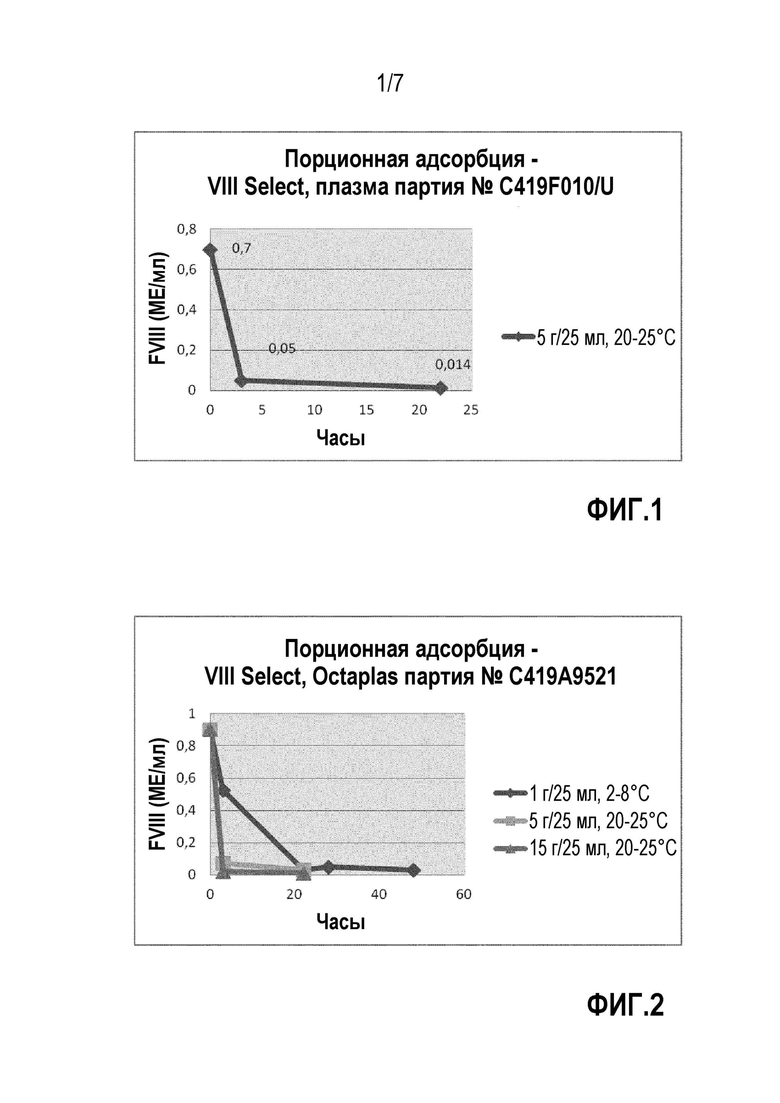
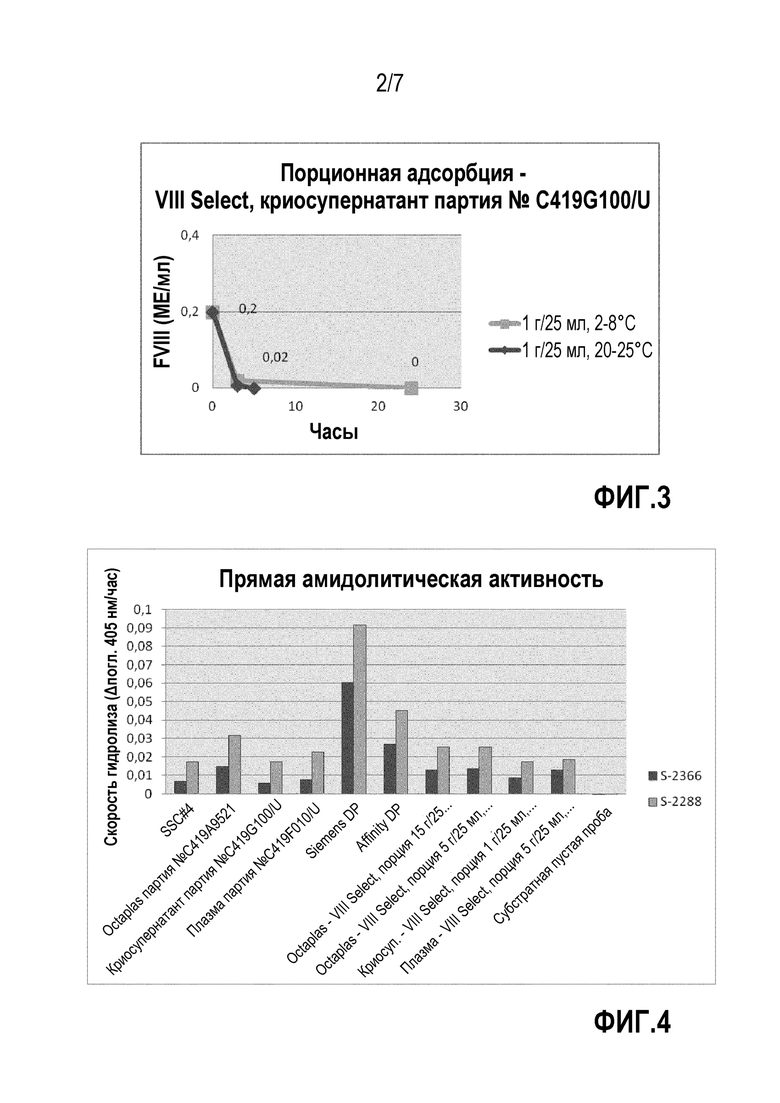

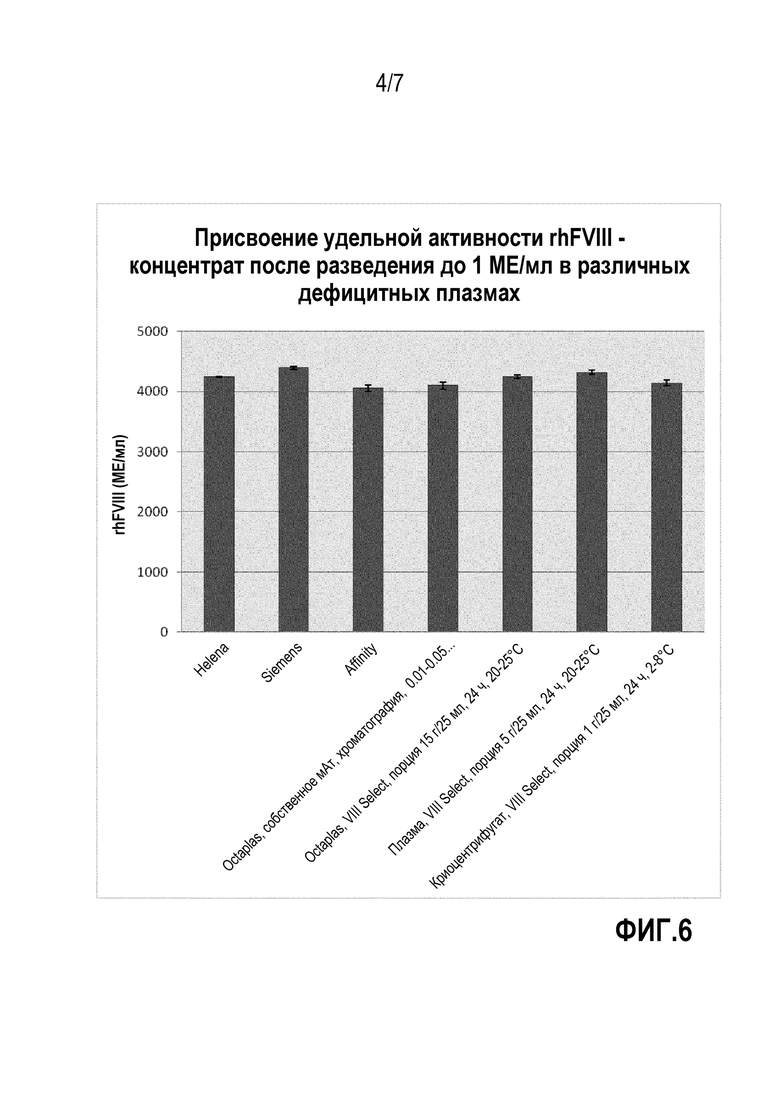
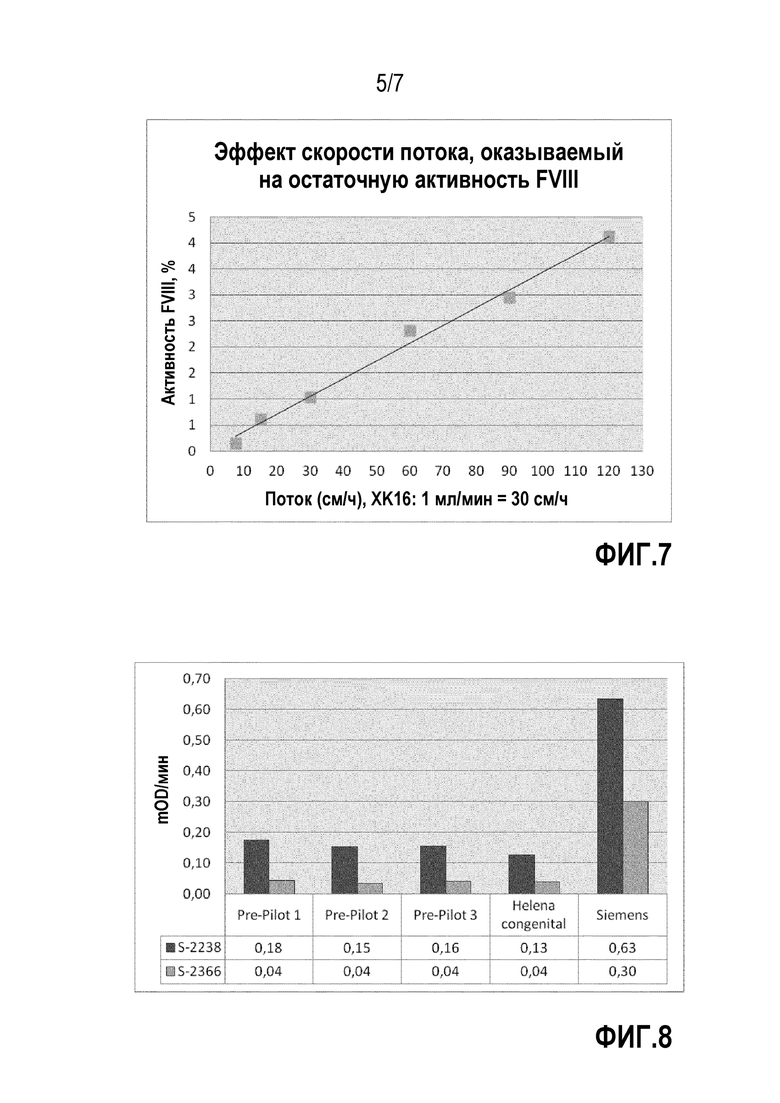
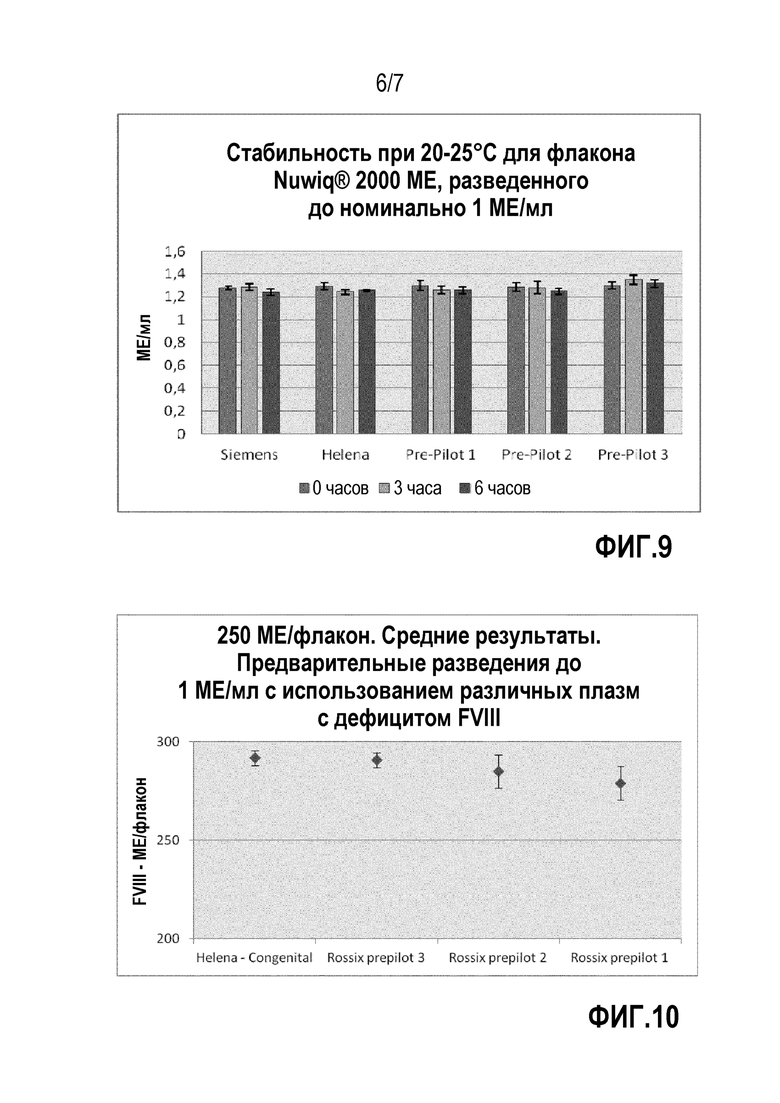
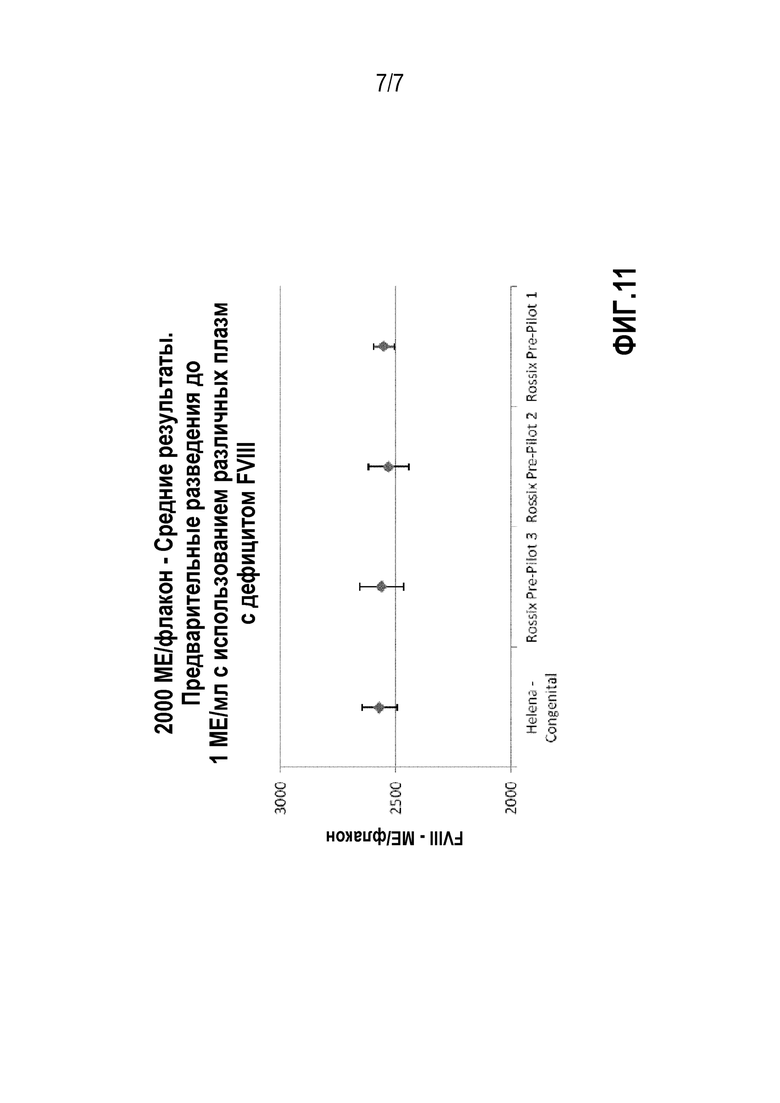
Изобретение относится к области биотехнологии, конкретно к отделению белка фактора VIII (FVIII) от белка фактора фон Виллебранда (vWF) и получению модифицированной плазмы крови, и может быть использовано в медицине для лечения заболеваний, при которых требуется снижение коагуляционной активности, или для определения активности FVIII в образце. Способы включают приведение первой композиции, например, плазмы крови, содержащей FVIII и vWF, в контакт с аффинной смолой VIIISelect, содержащей лиганд, аффинный к FVIII, и матрицу, отделение аффинной смолы от смеси с получением модифицированной первой композиции и второй композиции, содержащей аффинную смолу и комплекс FVIII и vWF. При этом количество VWF в первой композиции выше, чем количество белка FVIII, а отношение объема первой композиции к объему смолы находится в диапазоне от 5:1 до 70:1. Изобретение обеспечивает получение модифицированной плазмы крови, в которой концентрация FVIII составляет меньше 4% от усредненной концентрации FVIII в плазме здорового донора-человека. 7 н. и 9 з.п. ф-лы, 16 табл., 9 пр., 11 ил.
1. Способ отделения белка фактора VIII (FVIII) от первой композиции, где первая композиция содержит белок FVIII, который содержит по меньшей мере легкую цепь FVIII, и белок фактора фон Виллебранда (vWF), который содержит по меньшей мере FVIII-связывающий домен vWF,
где белок FVIII может образовывать комплекс с белком vWF в первой композиции,
где способ включает стадии:
- приведения в контакт первой композиции с аффинной смолой, содержащей лиганд и матрицу, где лиганд обладает аффинностью в отношении легкой цепи FVIII, где аффинной смолой является VIIISelect, и
- отделения аффинной смолы от смеси с получением модифицированной первой композиции и второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF,
где количество белка VWF в первой композиции выше, чем количество белка FVIII, и
где отношение объема первой композиции к объему смолы находится в диапазоне от 5:1 до 70:1.
2. Способ по п.1, в котором белок FVIII выбран из FVIII, полученного из плазмы человека, производного природного FVIII крови человека, рекомбинантного полноразмерного FVIII человека и рекомбинантного FVIII человека с отсутствующим B-доменом.
3. Способ по п.1 или 2, в котором белок vWF выбран из мультимера vWF, полученного из плазмы человека, мономера vWF, полученного из плазмы человека, и рекомбинантного полноразмерного vWF человека.
4. Способ по любому из пп.1-3, в котором отделение осуществляют непрерывно через набитую колонку и скорость потока первой и/или модифицированной первой композиции равна 30 см/ч или ниже.
5. Способ по п.4, в котором концентрация белка FVIII в первой композиции по общему объему первой композиции составляет 1 МЕ/мл или ниже.
6. Способ по п.4, в котором соотношение объема первой композиции и объема смолы находится в диапазоне от 10:1 до 70:1.
7. Способ по любому из пп.1-6, в котором первая композиция содержит продукт крови, и продукт крови выбран из цельной крови, плазмы и сыворотки.
8. Способ по п.7, в котором продукт крови представляет собой плазму.
9. Способ по любому из пп.1-7, в котором белок FVIII и/или белок vWF представляют собой белки, экспрессируемые рекомбинантным способом.
10. Способ получения модифицированной плазмы, включающий стадии:
- приведения первой композиции, содержащей плазму, в контакт с аффинной смолой, содержащей лиганд и матрицу, где лиганд обладает аффинностью в отношении легкой цепи FVIII, где аффинная смола представляет собой VIIISelect, и
- отделения аффинной смолы от смеси с получением модифицированной первой композиции и второй композиции, где вторая композиция содержит аффинную смолу и комплекс белка FVIII и белка vWF, и
- сбора модифицированной первой композиции, содержащей модифицированную плазму,
где отношение объема первой композиции к объему смолы находится в диапазоне от 5:1 до 70:1.
11. Способ по п.10, который дополнительно включает добавление экзогенного белка vWF, по существу не содержащего FVIII, в плазму.
12. Модифицированная плазма, полученная способом по п.10 или 11, для лечения заболеваний, при которых требуется снижение коагуляционной активности, где концентрация FVIII составляет меньше 4% от усредненной концентрации FVIII в плазме здорового донора-человека.
13. Модифицированная плазма, полученная способом по п.10 или 11, для лечения заболеваний, при которых требуется снижение коагуляционной активности, где концентрация vWF составляет по меньшей мере 75% от усредненной концентрации vWF плазмы здорового донора-человека.
14. Модифицированная плазма, полученная способом по п.10 или 11, для определения активности FVIII в образце, содержащем FVIII, где FVIII представляет собой rFVIII или очищенный FVIII, где концентрация FVIII меньше 4% от усредненной концентрации FVIII плазмы здорового донора-человека.
15. Модифицированная плазма, полученная способом по п.10 или 11, для определения активности FVIII в образце, содержащем FVIII, где FVIII представляет собой rFVIII или очищенный FVIII, где концентрация vWF составляет по меньшей мере 75% от усредненной концентрации vWF плазмы здорового донора-человека.
16. Способ очистки белка FVIII, включающий стадии:
- осуществления способа отделения в соответствии с любым из пп.1-9;
- осуществления по меньшей мере одной стадии промывки второй композиции,
- элюирования третьей композиции, содержащей vWF, с использованием элюирующего буфера, содержащего CaCl2; и
- элюирования четвертой композиции, содержащей комплекс белка FVIII и белка vWF или белок FVIII, из аффинной смолы.
| WO 2015107222 A1, 23.07.2015 | |||
| WO 2014147386 А1, 25.09.2014 | |||
| WO 2014083510А1, 05.06.2014 | |||
| BURNOUF-RADOSEVICHM.ET AL., Chromatographic Preparation of a Therapeutic Highly Purified Von Willebrand Factor Concentrate From Human Cryoprecipitate, Vox Sang, 1992, v.62, n.1, p.1-11 | |||
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2567811C2 |
Авторы
Даты
2020-10-23—Публикация
2017-02-10—Подача