Изобретение относится к медицине, а именно к неонатологии, педиатрии и гематологии, и может быть использовано для прогнозирования развития ранней анемии недоношенных в первый месяц жизни у глубоконедоношенных детей, родившихся с массой тела менее 1500 г.
Актуальность разработки способа определяется высокой распространенностью развития ранней анемии недоношенных у детей, родившихся с массой тела менее 1500 г., частота которой по данным разных авторов колеблется от 16,5-91,5%. Критерием диагностики ранней анемии недоношенных является снижение концентрации гемоглобина менее 110 г/л. Выделяют степени тяжести ранней анемии недоношенных: легкая - содержание гемоглобина от 100 до 85 г/л, среднетяжелая - содержание гемоглобина от 84 до 70 г/л, тяжелая - содержание гемоглобина менее 70 г/л. [Рюмина И., Зубков В., Маркелова М. Ранняя анемия недоношенных новорожденных детей: профилактика и лечение // Врач. - 2012. - №1. - С. 61-64.] Развитие у ребенка данной патологии приводит к снижению качества жизни, что обусловлено ухудшением показателей физического и интеллектуального развития в более старшем возрасте [Сахарова Е.С., Кешишян Е.С., Алямовская Г.А. Анемия недоношенных детей: патогенез, диагностика, лечение, профилактика // Медицинский совет. - 2015. - №6. - С. 10-16; Румянцев А.Г., Масчан А.А. Федеральные клинические рекомендации по диагностике и лечению ранней анемии недоношенных детей. - М., 2014. - 19 с.]. Известно, что у недоношенных новорожденных с ранней анемией выше частота апноэ недоношенных, тяжелее протекают такие заболевания как бронхолегочная дисплазия, ретинопатия недоношенных, некротизирующий энтероколит [Anemia, Apnea of Prematurity, and Blood Transfusions / K. Zagol, D.E. Lake, B. Vergales et al. // J. Pediatr. - 2012. - Vol. 161, №3. - P. 417-421]. Разработка способа прогнозирования развития ранней анемии недоношенных позволит своевременно проводить профилактические мероприятия и предотвратить формирование данной патологии в первый месяц жизни у детей, родившихся с массой тела менее 1500 г., что улучшит показатели их здоровья и качества жизни.
Известен способ прогнозирования анемии у детей 6 месяцев, перенесших гемолитическую болезнь новорожденных без операции заменного переливания крови путем определения веса новорожденного, количества тромбоцитов в периферической крови и среднего объема эритроцитов (MCV) в возрасте 12-14 суток жизни с последующим расчетом прогностического индекса D по формуле:
D=A1×0,00153+А2×0,00857+A3×0,04053-12,9658, где:
А1 - вес новорожденного (в граммах), А2 - количество тромбоцитов в возрасте 12-14 суток жизни (в 109 /л), A3 - MCV (средний объем эритроцитов) в возрасте 12-14 суток жизни (в фл или мкм3),
при D≤0 прогнозируют длительное течение анемии до 6 месяцев жизни, а при D>0 - отсутствие анемии к возрасту 6 месяцев. [Пат. №2441239 Российская Федерация. Способ прогнозирования анемии у детей 6 месяцев, перенесших гемолитическую болезнь новорожденных без операции заменного переливания крови / Касаткина Е.В., Якорнова Г.В. // Изобретения. Полезные модели. - 2012. - №3].
Недостатки способа:
1. Способ позволяет прогнозировать развитие анемии только у детей, перенесших гемолитическую болезнь новорожденных, механизм развития которой связан с изоиммунологической несовместимостью крови плода и матери по эритроцитарным антигенам, и не позволяет прогнозировать раннюю анемию недоношенных, механизм которой связан с незавершением к моменту рождения ребенка онтогенеза системы кроветворения и неадекватно низкой продукцией эритропоэтина.
2. Способ не позволяет прогнозировать анемию в первый месяц жизни.
3. Способ предназначен для прогнозирования анемии только у доношенных детей.
Наиболее близким по техническому решению к заявляемому способу является способ прогнозирования развития ранней анемии у новорожденных с перинатальными гипоксическими поражениями центральной нервной системы (ЦНС) в условиях микроэлементоза путем определения микроэлементов в сыворотке крови и моче новорожденных в первый день жизни, с учетом других анамнестических факторов. Для прогнозирования анемии на четырнадцатый день жизни новорожденных суммируют все показатели прогностических коэффициентов до достижения прогнозирующего порога, который для 95%-ного уровня надежности ≤13,0 а для 99,9% уровня надежности ≤30,0. Если сумма прогностических коэффициентов имеет знак «плюс» - прогнозируют развитие анемии, а если знак «минус» - вероятность ее появления отрицается [Патент на изобретение №94344 Украина. Способ прогнозирования развития ранней анемии у новорожденных с перинатальными гипоксическими поражениями центральной нервной системы (ЦНС) в условиях микроэлементоза / Тарасова И.В., Турова Л.О. // 2014. - Бюл. №21].
Недостатки способа:
1. Использование данного способа для прогнозирования ранней анемии у глубоконедоношенных детей с массой тела менее 1500 г. нежелательно в связи с тем, что для его осуществления необходим 1 мл сыворотки крови. При условии того, что форменные элементы крови составляют 60%, а сыворотка крови - 40%, то для осуществления данного способа необходимо 2,5 мл цельной крови. По мнению многих авторов потери крови при флеботомии являются основным фактором в развитии анемии недоношенных [Жетишев Р.А. Анемии новорожденных (клинико-лабораторные варианты, дифференцированная лечебная тактика): автореф. дис… д-ра мед. наук. - СПб., 2002. - 28 с.; Widness J.A. Pathophysiology of anemia during the neonatal period, including anemia of prematurity // NeoReviews. - 2008. - Vol. 9. - P. 31-35]. Заборы крови для лабораторных исследований за первую неделю жизни у новорожденного недоношенного ребенка приводят к потере около 40 мл крови. Относительно общего объема крови (80 мл/кг массы) это - очень большая цифра [Nex Е., Cristensen N.S., Olesen S. Volume of blood removed for analytical purposes during hospitalization of low birth weight infants // Clinical chemistry. - 1981. - №27. - P. 759-761]. В связи с вышеизложенным данный способ не желателен для использования у глубоконедоношенных детей из-за большого объема забираемой крови.
2. Узкое применение способа только для детей с перинатальными гипоксическими поражениями центральной нервной системы.
3. Прогнозирование ранней анемии осуществляется к 14 суткам жизни.
4. Для осуществления способа необходимо определение большого количества показателей в крови и моче, что определяет высокую стоимость необходимых реактивов и оборудования, а также большие временные затраты на выполнение исследований.
5. Для осуществления способа необходимо производить вычисление суммы прогностических коэффициентов большого количества факторов риска, что приводит к большим временным затратам.
6. Для осуществления способа необходим сбор мочи у новорожденного первого дня жизни, что бывает весьма затруднительным, так как до 2 дня жизни у недоношенных детей наблюдается предиуретическая фаза водно-электролитного баланса, которая характеризуется низким диурезом (1 мл/кг/ч) [Морфофукциональные особенности органов мочевой системы у детей, родившихся недоношенными и маловесными / М.А. Даминова, А.И. Сафина, М.А. Сатрутдинов, Г.А. Хамзина // Вестник современной клинической медицины. - 2013. - Т. 6, Вып. 2. - С. 79-86].
7. Не указаны чувствительность и специфичность способа.
Указанные недостатки предлагается устранить в заявляемом способе.
Техническим решением заявляемого способа является упрощение способа и снижение ятрогенных воздействий при прогнозировании ранней анемии недоношенных в первый месяц жизни у глубоконедоношенных детей, родившихся с массой тела менее 1500 г. Технический результат достигается путем определения в периферической венозной крови новорожденного в возрасте 3-5 дней жизни содержания белка-3, связывающего инсулиноподобный фактор роста (IGFBP-3), и при его значении менее или равном 0,766 мкг/мл прогнозируют развитие ранней анемии недоношенных с точностью 83,6%.
Способ осуществляется следующим образом:
Материалом для исследования является венозная кровь, взятая для планового биохимического исследования на 3-5-е сутки жизни новорожденного в количестве 17 мкл. Кровь после образования сгустка центрифугируют при 300 g (1500 об/мин) в течение 10 минут, затем отбирают сыворотку в количестве 10 мкл и разводят разводящей жидкостью (Sample Diluent) в количестве 1000 мкл из набора реагентов фирмы Siemens (USA) для определения белка-3, связывающего инсулиноподобный фактор роста (IGFBP-3). Исследование выполняют методом твердофазного ферментативно усиленного хемилюминесцентного иммунометрического анализа на приборе IMMULITE 1000 той же фирмы согласно инструкции к прибору и инструкции к набору реагентов для определения белка-3, связывающего инсулиноподобный фактор роста (IGFBP-3). Исследование длится 30 минут, результат исследования предоставляется в единицах мкг/мл. При значении IGFBP-3 равном 0,766 мкг/мл или менее прогнозируют развитие ранней анемии недоношенных.
Новизна способа:
Впервые предлагается прогнозировать развитие ранней анемии недоношенных в первый месяц жизни у глубоконедоношенных детей с массой тела при рождении менее 1500 г. по определению содержания в периферической венозной крови новорожденного в возрасте 3-5 дней содержания белка-3, связывающего инсулиноподобный фактор роста (IGFBP-3).
Известно, что уровень белка-3, связывающего инсулиноподобный фактор роста (IGFBP-3) снижается при нарушении питания, при гипотиреозе, при сахарном диабете, нарушении функции печени и повышается при хронической почечной недостаточности [Growth hormone-binding proteins and insulin-like growth factor-binding proteins in protein-energy malnutrition, before and after nutritional rehabilitation / G. Zamboni, D. Dufillot, F. Antoniazzi et al. // Pediatr Res. - 1996. - Vol. 39, №3. - P. 410-414; Thyroid hormone modulates insulin-like growth factor-I (IGF-I) and IGF-binding protein-3, without mediation by growth hormone, in patients with autoimmune thyroid diseases / T. Inukai, K. Takanashi, K. Takebayashi et al. // Horm Metab Res. - 1999. - Vol. 31, №10. - P. 576-579; Kim M.S., Lee D.Y. Serum insulin-like growth factor-binding protein-3 level correlated with glycemic control and lipid profiles in children and adolescents with type 1 diabetes // J Pediatr Endocrinol Metab. - 2014. - Vol. 27, №9-10. - P. 857-861; Adamek A., Kasprzak A. Insulin-Like Growth Factor (IGF) System in Liver Diseases // Int. J. Mol. Sci. - 2018. - Vol. 19, №5. - P. 1308; Characterization of insulin-like growth factor binding protein-3 in chronic renal failure serum / D.R. Powell, F. Liu, B. Baker et al. // Pediatr Res. - 1993. - Vol. 33, №2. - P. 136-143]. Низкий уровень сывороточного IGFBP-3 у недоношенных детей связан с повышенным риском развития тяжелых форм ретинопатии недоношенных [Insulin-like growth factor binding protein-3 in premature newborns with retinopathy of prematurity Indian / M.M. Garebbagi, A. Peyrififar, K. Sadeghi, H. Mostafidi // J. Ophthalmol. - 2012. - Vol. 60, №6. - P. 527-530]. Применение IGFBP-3 для прогнозирования ранней анемии недоношенных из доступных литературных источников не выявлено.
Инсулиноподобные белки, связывающие фактор роста (IGFBP), модулируют биологические действия инсулиноподобного фактора роста, такие как клеточная пролиферация, дифференцировка, увеличение метаболической активности и выживаемость клеток [Firth S.M., Baxter R.C. Cellular actions of the insulin-like growth factor binding proteins // Endocr. Rev. - 2002. - Vol. 23, №6. - P. 824-854]. Белок связывающий инсулиноподобный фактор роста - 3 (IGFBP-3), наиболее распространенный среди всех видов IGFBP в сыворотке крови [Firth S.M., Baxter, R.C. Cellular actions of the insulin-like growth factor binding proteins // Endocr. Rev. - 2002. - Vol. 23, №6. - P. 824-854; Hwa V., Oh Y., Rosenfeld R.G. The insulin-like growth factor-binding protein (IGFBP) superfamily // Endocr. Rev. - 1999. - №20. - P. 761-787]. Классические основные функции IGFBP-3: транспортировка инсулиноподобного фактора роста, защищита его от быстрого разрушения, а также модулирование инсулиноподобного фактора роста и обеспечение его связи с рецепторами к инсулиноподобному фактору роста на клеточной поверхности [Rajaram S., Baylink D.J., Mohan S. Insulin-like growth factor-binding proteins in serum and other biological fluids: regulation and functions // Endocr. Rev. - 1997. - №18. - P. 801-831; Butler A.A., Le Roith D. Control of growth by the somatropic axis: growth hormone and the insulin-like growth factors have related and independent roles // Annu. Rev. Physiol. - 2001. - №63. - P. 141-164].
Известно, что у рецептора к IGFBP-3 (IGFBP-3R) трансмембранный домен содержит семикратное повторение аминокислоты лейцина (трансмембранная лейциновая молния) которое аналогично к рецепторам эритропоэтина [The Interface between Self-assembling Erythropoietin Receptor Transmembrane Segments Corresponds to a Membrane-spanning Leucine Zipper / W. Ruan, V. Becker,  D. Langosch // J. Biol. Chem. - 2004. - №279. - P. 3273-3279; A transmembrane leucine zipper is required for activation of the dimeric receptor tyrosine kinase DDR1 / N.A. Noordeen, F. Carafoli, E. Hohenester et al. // J. Biol. Chem. - 2006. - №281. - P. 22744-22751]. По-видимому, при определенных условиях IGFBP-3 может связываться не только со своим рецептором, но и с рецептором эритропоэтина, что приводит к его блокировке и невозможности его связывании с эритропоэтином. Мы предполагаем, что снижение в сыворотке крови глубоконедоношенных новорожденных содержания циркулирующего IGFBP-3 обусловлено тем, что он связывается с рецепторами эритропоэтина, что приводит к развитию у этих детей анемии.
D. Langosch // J. Biol. Chem. - 2004. - №279. - P. 3273-3279; A transmembrane leucine zipper is required for activation of the dimeric receptor tyrosine kinase DDR1 / N.A. Noordeen, F. Carafoli, E. Hohenester et al. // J. Biol. Chem. - 2006. - №281. - P. 22744-22751]. По-видимому, при определенных условиях IGFBP-3 может связываться не только со своим рецептором, но и с рецептором эритропоэтина, что приводит к его блокировке и невозможности его связывании с эритропоэтином. Мы предполагаем, что снижение в сыворотке крови глубоконедоношенных новорожденных содержания циркулирующего IGFBP-3 обусловлено тем, что он связывается с рецепторами эритропоэтина, что приводит к развитию у этих детей анемии.
Отличительные признаки способа:
Установлен прогностический параметр содержания белка-3, связывающего инсулиноподобный фактор роста, при значении которого менее или равном 0,766 мкг/мл на 3-5 сутки жизни прогнозируют развитие ранней анемии недоношенных в течение первого месяца жизни.
Сущность заявляемого способа поясняется следующими примерами:
Пример 1.
Ребенок М., мужского пола, от 3 беременности, 2 преждевременных родов в срок 32 недели в головном предлежании. Беременность протекала с декомпенсированной плацентарной недостаточностью на фоне резидуальной энцефалопатии, гипертензивного синдрома, эпилепсии с частыми припадками. В родах - дистресс синдром плода, выполнена операция кесарева сечения. При рождении: масса тела - 1480 гр., рост - 39 см, окружность головы - 28 см, окружность груди - 26 см. Оценка по шкале Апгар 4/6 баллов. Оценка по шкале Сильвермана 5 баллов. Состояние с рождения тяжелое по дыхательной недостаточности, незрелости, неврологической симптоматике (синдром угнетения), переведен в отделение реанимации и интенсивной терапии новорожденных. Двигательная активность снижена, диффузная мышечная гипотония. Большой родничок 1,5×1,5 см, не напряжен. Кожа бледно-розовая, цианоз носогубного треугольника, акроцианоз. Пастозность мягких тканей. Дыхание с втяжением межреберий, ослаблено, крепитирующие хрипы. Тоны сердца ритмичные, приглушены. Живот мягкий, безболезненный. Печень выступает на 1,5 см из-под края реберной дуги. Ребенок находился на респираторной поддержке методом СРАР 2 суток 16 час. На 3 сутки жизни была взята венозная кровь и определено содержание IGFBP-3, который составил 1,03 мкг/мл. По заявленному способу было спрогнозировано отсутствие развития анемии на 1 месяце жизни. В отделение патологии новорожденных и недоношенных детей переведен в возрасте 7 дней в тяжелом состоянии. В течение месяца у ребенка проводился контроль периферического анализа крови. При рождении содержание гемоглобина 202 г/л, содержание эритроцитов 6,12×109; на 3 сутки жизни - 190 г/л и 5,7×109, на 8 день жизни - 179 г/л и 5,2×109, на 20 день жизни - 160 г/л и 5,2×109, соответственно. К концу первого месяца жизни содержание гемоглобина 125 г/л, содержание эритроцитов 3,6×109.
Клинический диагноз: врожденная пневмония, тяжелая; перинатальное поражение центральной нервной системы, церебральная ишемия II степени, внутрижелудочковое кровоизлияние 1 степени двустороннее, синдром угнетения; неонатальная желтуха. Недоношенность 32 недели, очень низкая масса тела при рождении.
Ребенок выписан домой в возрасте 1 месяца и 2 дней. Прогноз по заявляемому способу подтвердился.
Пример 2.
Ребенок Т., женского пола, от 1 беременности 1 преждевременных самостоятельных родов в 30 недель. Течение настоящей беременности осложнилось угрозой прерывания, плацентитом, многоводием, на фоне хронического пиелонефрита. При рождении: масса тела 1400 гр., длина тела 42 см, окружность головы - 27 см, окружность груди - 25 см. Оценка по шкале Апгар 5/7 баллов. Оценка по шкале Сильвермана 7 баллов. Состояние при рождении тяжелое по дыхательной недостаточности, неврологической симптоматике (синдром угнетения), незрелости. Из родового зала переведена в отделение реанимации и интенсивной терапии новорожденных. Активность снижена, крик короткий, мышечная гипотония, рефлексы ослаблены, большой родничок 2,0×2,0 см, не напряжен. Сагиттальный шов - щель. Кожные покровы бледно-розовые, цианоз носогубного треугольника, акроцианоз. Общая пастозность. Дыхание с участием вспомогательной мускулатуры. Притупление перкуторного звука паравертебрально и в нижнебоковых отделах. При аускультации дыхание ослаблено, выслушиваются крепитирующие хрипы с обеих сторон. Тоны сердца ритмичные, приглушены. Живот мягкий, умеренно вздут, печень выступает на 2,5 см из-под края реберной дуги. Ребенок находился на респираторной поддержке методом CPAP в течение 3 суток 16 часов, эндотрахеально вводился препарат сурфактанта. На 4 сутки жизни была взята венозная кровь, определено содержание IGFBP-3, которое составило 0,46 мкг/мл. По заявляемому способу было спрогнозировано развитие анемии на 1 месяце жизни. В отделение патологии новорожденных и недоношенных детей ребенок переведен на 15 день жизни в тяжелом состоянии. В течение месяца у ребенка проводился контроль периферического анализа крови. При рождении содержание гемоглобина было 205 г/л, содержание эритроцитов - 6,0×109. На 5 сутки жизни - 156 г/л и 4,6×109, на 16 день жизни - 148 г/л и 4,53×109, на 21 день жизни - 134 г/л и 4,18×109, соответственно. К месячному возрасту содержание гемоглобина было 69 г/л, содержание эритроцитов - 2,63×109. Проводилась трансфузия одногруппной эритроцитарной массы, обедненной лейкоцитами и тромбоцитами.
Клинический диагноз - врожденная пневмония, двусторонняя, тяжелая, острое течение на фоне респираторного дистресс - синдрома; гипоксически - геморрагическое поражение ЦНС, церебральная ишемия 2 степени, внутрижелудочковые кровоизлияния 1 степени двусторонние, синдром угнетения. Недоношенность 30 недель, очень низкая масса тела при рождении. Ранняя анемия недоношенных, тяжелой степени.
Ребенок выписан домой в возрасте 1 месяца и 19 дней. Прогноз по заявленному способу подтвердился.
Пример 3
Ребенок Ф., мужского пола, от 4 беременности, 4 преждевременных родов в срок 28 недель и 3 дня. Беременность протекала с плацентарной недостаточностью, синдромом задержки внутриутробного развития, маловодием. Роды в чистоягодичном предлежании плода. При рождении: масса тела - 880 гр., рост - 37 см, окружность головы - 24 см, окружность груди - 21 см. Оценка по шкале Апгар 2/5 баллов. Оценка по шкале Сильвермана 5 баллов. Состояние с рождения крайне-тяжелое по дыхательной недостаточности, неврологической симптоматике (синдром угнетения), незрелости. Ребенок переведен в отделение реанимации и интенсивной терапии новорожденных. Двигательная активность значительно снижена. Диффузная мышечная гипотония. Большой родничок 1×1 см, не напряжен. Кожа бледно-розовая, сероватый колорит, цианоз носогубного треугольника, акроцианоз. Пастозность мягких тканей. Дыхание с втяжением межреберий, ослаблено, крепитирующие хрипы. Тоны сердца ритмичные, приглушены, систолический шум на верхушке. Живот мягкий, безболезненный. Печень выступает на 1,5 см из-под края реберной дуги. Ребенок находился на респираторной поддержке: искусственная вентиляция легких - 1 сутки 2 часа, метод СРАР - 3 суток 4 час, эндотрахеально вводился препарат сурфактанта. На 5 сутки жизни была взята венозная кровь и определено содержание IGFBP-3, которое составило 0,766 мкг/мл. По заявляемому способу было спрогнозировано развитие анемии на 1 месяце жизни. В отделение патологии новорожденных и недоношенных детей переведен на 8 день жизни в тяжелом состоянии.
В течение месяца ребенку проводился контроль анализов периферической крови. При рождении содержание гемоглобина было 203 г/л, содержание эритроцитов - 5,9×1099. На 8 сутки жизни содержание гемоглобина было 135 г/л, содержание эритроцитов - 4,06×109. На 15 день жизни - 96 г/л и 3,0×10×9, на 25 день жизни - 99 г/л и 3,11×109, соответственно. К месяцу жизни содержание гемоглобина было 80 г/л, содержание эритроцитов - 2,60×109. Проводилась трансфузия одногруппной эритроцитарной массы, обедненной лейкоцитами и тромбоцитами.
Клинический диагноз: Врожденная пневмония, двусторонняя, тяжелая, острое течение. Респираторный дистресс-синдром. Перинатальное поражение центральной нервной системы, церебральная ишемия 2 степени, внутрижелудочковые кровоизлияния 1 степени двусторонние, синдром угнетения. Недоношенность 28 недель, экстремально низкая масса тела при рождении. Ранняя анемия недоношенных, средней степени тяжести. Паховая грыжа справа.
Ребенок выписан домой в возрасте 2 месяцев 9 дней. Прогноз по заявляемому способу подтвердился.
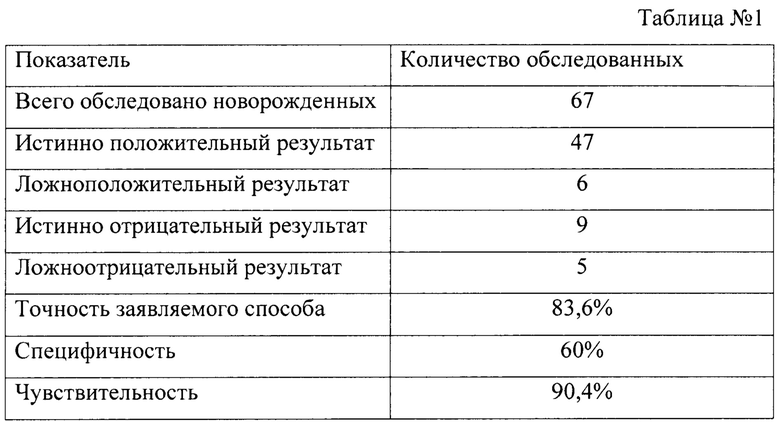
Всего было обследовано 67 глубоконедоношенных новорожденных с массой тела менее 1500 г.
Результаты исследования приведены в таблице №1
Преимущества способа:
1. Для выполнения способа требуется небольшое количество сыворотки крови - 10 мкл.
2. Заявляемый способ прост в выполнении: основывается на определении одного показателя и не требует больших временных затрат, исследования большого числа показателей и сложных математических расчетов (время выполнения 52 мин.)
3. Способ может использоваться как скрининговый.
4. Имеет высокую точность - 83,6% и чувствительность - 90,4%.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования развития ранней анемии недоношенных | 2019 |
|
RU2719657C1 |
| Способ прогнозирования развития ранней анемии недоношенных тяжелой степени, требующей проведения гемотрансфузии | 2019 |
|
RU2719656C1 |
| Способ прогнозирования развития поздней анемии недоношенных | 2020 |
|
RU2741514C1 |
| Способ прогнозирования внутрижелудочковых кровоизлияний у недоношенных новорожденных | 2020 |
|
RU2741722C1 |
| Способ прогнозирования развития экстраретинальной вазопролиферации при экспериментальной ретинопатии недоношенных (РН) | 2020 |
|
RU2751007C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДЕТСКОГО ЦЕРЕБРАЛЬНОГО ПАРАЛИЧА У ГЛУБОКОНЕДОНОШЕННЫХ ДЕТЕЙ | 2023 |
|
RU2804797C1 |
| Способ прогнозирования развития внутрижелудочковых кровоизлияний у недоношенных новорожденных | 2020 |
|
RU2741727C1 |
| Способ прогнозирования функционирования артериального протока у глубоконедоношенных новорожденных | 2019 |
|
RU2707061C1 |
| СПОСОБ РАННЕГО ПРОГНОЗИРОВАНИЯ ПНЕВМОНИЙ У ГЛУБОКОНЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ С РЕСПИРАТОРНЫМ ДИСТРЕСС-СИНДРОМОМ | 2011 |
|
RU2463607C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ БРОНХОЛЕГОЧНОЙ ДИСПЛАЗИИ У НОВОРОЖДЕННЫХ С ОЧЕНЬ НИЗКОЙ И ЭКСТРЕМАЛЬНО НИЗКОЙ МАССОЙ ТЕЛА | 2012 |
|
RU2480766C1 |
Изобретение относится к медицине, а именно к неонатологии, педиатрии и гематологии, и представляет собой способ прогнозирования развития ранней анемии недоношенных в первый месяц жизни у глубоконедоношенных детей, родившихся с массой тела менее 1500 г. Способ заключается в том, что в периферической венозной крови новорожденного в возрасте 3-5 дней определяют содержание белка-3, связывающего инсулиноподобный фактор роста, и при его значении менее или равном 0,766 мкг/мл прогнозируют развитие ранней анемии недоношенных. Изобретение обеспечивает предотвращение формирования ранней анемии недоношенных в первый месяц жизни у детей, родившихся с массой тела менее 1500 г. 1 табл., 3 пр.
Способ прогнозирования развития ранней анемии недоношенных у глубоконедоношенных детей, родившихся с массой тела менее 1500 г, путем исследования периферической венозной крови, отличающийся тем, что на 3-5 сутки жизни определяют содержание белка-3, связывающего инсулиноподобный фактор роста, и при его значении менее или равном 0,766 мкг/мл прогнозируют развитие ранней анемии недоношенных в течение первого месяца жизни.
| СПОСОБ ПРОГНОЗИРОВАНИЯ АНЕМИИ У ДЕТЕЙ 6 МЕСЯЦЕВ, ПЕРЕНЕСШИХ ГЕМОЛИТИЧЕСКУЮ БОЛЕЗНЬ НОВОРОЖДЕННЫХ БЕЗ ОПЕРАЦИИ ЗАМЕННОГО ПЕРЕЛИВАНИЯ КРОВИ | 2010 |
|
RU2441239C1 |
| Пакетная металлическая камера-опалубка | 1951 |
|
SU94344A1 |
| СПОСОБ ДИАГНОСТИКИ АНЕМИИ У ДЕТЕЙ | 1991 |
|
RU2018844C1 |
Авторы
Даты
2019-09-09—Публикация
2019-04-22—Подача