Область изобретения
Изобретение относится к устройству для транспортировки и консервации вне организма (ex vivo) биологического образца, включающее в себя камеру для содержания биологического образца, ограниченную стенками, выполненными из теплоизоляционного материала и охлаждающие средства для поддержания температуры внутри камеры ниже температуры за пределами устройства, а также к соответствующему способу консервации биологического образца.
Изобретение также относится к применению устройства в соответствии с изобретением для транспортировки и консервации ex vivo биологического образца и последующего трансплантата у живого человека или животного или для последующего лабораторного исследования.
Уровень техники
В изобретении понятие ʺ ex vivo биологический образец ʺ относится к органу или ткани, которые можно транспортировать для последующего трансплантата у живого человека или животного или для последующего лабораторного исследования.
Например, в области трансплантатов хорошо известно, что синдром ишемии/реперфузии (И/Р) является одной из основных причин как первичной дисфункции трансплантата (ПДТ), так и первичной недостаточности трансплантата (ПНТ), в последнем случае необходима другая трансплантация. Несмотря на достижения, достигнутые в хирургической технике за последние несколько десятилетий, повреждение, которое трансплантат испытывает в период, в течение которого донорский орган транспортируют до его имплантации реципиенту (время холодовой ишемии), по-прежнему остается социально и клинически значимой актуальной проблемой, которая еще не решена. Процентная доля ПНТ составляет 5-10%, а процентная доля ПДТ составляет 20-30% среди трансплантированных органов. Все это отрицательно сказывается на низком качестве жизни пациента, необходимости повторной трансплантации и дополнительных проблем с пригодностью органов для трансплантата.
Существуют различные способы хранения трансплантата с момента его изъятия у донора до его имплантации реципиенту. В случае динамической нормотермической консервации in vivo условия трансплантата имитируют в максимально возможной степени на протяжении всего периода консервации. С этой целью избегают гипотермии и предусматривают ввод кислорода в трансплантат для предотвращения гипоксии и резервуар для выхода отходов.
При статической гипотермической консервации, которая является обычным способом консервации, до того, как донорский трансплантат трансплантируют реципиенту, донорские орган или органы и ткани подвергаются неотъемлемому времени ишемии (критическое время хранения трансплантата на холоде). В таких условиях способ, используемый для консервации органа и тканей, должен удовлетворять следующим требованиям: удаление крови из трансплантата и быстрое охлаждение трансплантата с помощью перфузии трансплантата раствором при 4°С, покрытие трансплантата льдом для обеспечения холодного состояния (2-6°C) и ишемических состояний. Вследствие этого снижается повреждение, которое трансплантат испытывает во время холодовой ишемии, то есть из-за отсутствия кровоснабжения и доставки кислорода в холодных условиях.
С момента изъятия органа у донора трансплантат помещают в холодильную камеру, погруженную в консервирующий раствор и обычно выдерживают при 4°С до тех пор, пока его не имплантируют реципиенту. Наиболее широко используемым в данной области раствором является раствор Висконсинского Университета, в дальнейшем раствор UW.
Повреждение, которое трансплантат испытывает при транспортировке в холодильной камере до тех пор, пока его не имплантируют реципиенту (время холодовой ишемии, которое обычно составляет не менее 6 часов) является ключевым фактором. Этот фактор отвечает за ПДТ и ПНТ и отрицательно влияет на послеоперационные результаты, качество жизни и выживаемость пациента. Известно, что чем дольше время пребывания органов в холодильной камере, тем ниже жизнеспособность трансплантата, который будет пересажен. Повреждение, которое трансплантат испытывает во время стадии холодовой ишемии, является главной причиной того, что значительное количество органов (35%) нельзя считать подходящими для трансплантата с учетом их патологических состояний (почечные трансплантаты от пожилых, диабетических и/или гипертонических доноров, жировые печеночные трансплантаты, и т.д.). Такие органы крайне уязвимы к повреждению, которое они испытывают во время транспортировки, прежде чем быть имплантированными реципиенту и имеют более высокий риск столкновения с ПДТ и ПНТ. Поэтому они не жизнеспособны для трансплантата. Эти наблюдения указывают на то, что существует необходимость поиска альтернатив для уменьшения повреждения, которое испытывают трансплантаты в течение холодовой ишемии до имплантации реципиенту.
Многие из компонентов, присутствующих в консервирующих жидкостях, целью которых является защита трансплантата в условиях холодовой ишемии в холодильной камере во время его транспортировки до тех пор, пока он не будет имплантирован реципиенту, не вводят в трансплантат, а если это сделают, они не достигнут места действия при оптимальных концентрациях, чтобы защитить его. Фактически, было обнаружено, что, когда некоторые из компонентов удаляют из таких консервирующих жидкостей, послеоперационные и пост-трансплантационные результаты являются такими же, как если бы их не удаляли.
Патентный документ WO 2007/143715 A2 относится к применению ультразвука для обеспечения доставки кислорода к ранам и для способствования заживлению ран. С целью примера патентный документ очень кратко раскрывает устройство для консервации органов после того, как их извлекли у донора. С этой целью орган помещают в сосуд, который снабжен газом или жидкостью, пересыщенной кислородом. Это динамическая система консервации, потому что кислород или жидкие растворы, насыщенные содержащимся в них кислородом, постепенно поступают в контролируемый поток из резервуара для кислорода в сосуд, а отходы постепенно удаляют. Сосуд для органа помещают внутрь полужесткого контейнера. Внешний контейнер дополнительно содержит ультразвуковую систему для направления ультразвука на контейнер. Нет никаких средств для передачи ультразвука между внутренним сосудом и внешним контейнером, поэтому система не может работать так же, как если бы ультразвук был применен непосредственно на рану с целью заживления раны.
Также известны исследования, указывающие, что применение средств ультразвука способствует доставке лекарств и веществ через ткани, такие как кожа и в кровоток. Тем не менее, в упомянутых исследованиях ультразвук применяют in vivo, то есть в присутствии кровотока. Патентный документ US 4767402 А, относящийся к области трансдермальной доставки лекарства посредством применения ультразвука, также относится к рискам, связанным с его использованием. Патентный документ, в частности, информирует в отношении длительного использования ультразвука из-за рисков, связанных с повышением температуры кожи и возможного повреждения, которое может вызвать этот метод. Тот же самый патентный документ также раскрывает, что ультразвук плохо передается через воздух, и поэтому для его предпочтительного применения требуется жидкая среда. Вследствие этого, применение ультразвука для консервации органов и тканей нецелесообразно из-за упомянутых факторов: локального нагрева ткани, трудности в проникновении значительной толщины ткань или орган и трудности передачи в газообразных средах.
Патентный документ US 5267985 А раскрывает способ и устройство для улучшения диффузии вещества в локальную область материала или ткани посредством ультразвука на двух или нескольких отличных частотах. Этот патентный документ также раскрывает, что локальное повышение температуры, когда применяют ультразвук полезно для содействия увеличению проникновения распространяющихся веществ.
В статье (Sen Wang et al., Medial hypothesis, 74, 2010; 147-149) предлагают применять ультразвук средней интенсивности (0,3-1,2 Вт/см2) in vivo, чтобы повредить конкретную область донорского органа, так что активируются только стволовые клетки, и орган может быть регенерирован, образуя гибридный орган, который может быть более совместим с реципиентом.
Патентный документ WO 2005/013799 A1 раскрывает способ, основанный на применении ультразвука in vivo во время реперфузии, то есть кровоснабжение поступает в ткань после времени ишемии. Ультразвук применяют только в течение короткого промежутка времени (не более 15 минут), для того чтобы способствовать проникновению крови и кислорода в ткань и снижению нарушений микроциркуляции, вызванных реперфузией.
Поэтому из уровня техники можно сделать вывод, что применение ультразвука приводит к нагреву, как в водных средах, так и в тканях. Ультразвук, применяемый только в диапазоне 1-10 минут (время, используемое в большинстве медицинских применений) и при частотах и интенсивностях, которые являются обычными в данной области, вызывает нагревание тканей, которое интерпретируют как отрицательный фактор для надлежащего хранения ex vivo биологического образца. Когда температура превышает 38°C, воздействие ультразвуком обычно прерывают, поскольку он повреждает ткани. Например, патентный документ US 5267985 раскрывает возможность использования ультразвука в течение 15-30 минут для достижения тканевого проникновения от 1 до 2 см.
Фактически, ультразвук часто применяли в клинической практике именно в качестве терапии, чтобы вызвать нагревание ткани. Помимо нагревания, вызванного только ультразвуком, керамические преобразователи склонны нагреваться с вибрацией, еще больше увеличивая тепловое воздействие на ткань (Watson T et al., 2008, 48: 321-329; Baker KG, et al., 2001; 81: 1351-1358; Legay M et al.; 2011, ID670108; 1-17).
Сущность изобретения
Целью изобретения является предоставление устройства для транспортировки и консервации ex vivo биологического образца и способа указанного выше типа, который уменьшает повреждение биологического образца и, соответственно, повышает его жизнеспособность по сравнению с тем, что можно получить с помощью известных устройств. Изобретение также рассматривает в случае трансплантатов проблему улучшения качества жизни трансплантатных пациентов, и в худших случаях проблему значительного снижения необходимости в другом трансплантате.
Этой цели достигают посредством устройства для ex vivo транспортировки указанного выше типа, отличающееся тем, что оно дополнительно содержит, по меньшей мере, ультразвуковую систему, подходящую для генерирования и применения ультразвука на упомянутый биологический образец. Применение ультразвука в сочетании с охлаждением внутренней камеры может быть, следовательно, осуществлено таким образом, что предотвращается локальное нагревание биологического образца и последующее повышение температуры, которое могло бы повредить его. В частности, устройство также содержит вспомогательный контейнер, содержащий консервирующий раствор, без внешней подачи кислорода и для содержания упомянутого биологического образца, погруженного в упомянутый консервирующий раствор.
Поэтому, вопреки тому, что ожидали в изобретении было подтверждено, что применение ультразвука, который применяют таким образом, что он не вызывает локального нагревания в образце, не оказывает отрицательного влияния на положительный эффект охлаждения биологического образца и, соответственно, не повреждает его тоже. Кроме того, однако, неожиданно было подтверждено, что весьма существенного улучшения достигают с помощью ультразвука, до такой степени, что, как будет видно ниже в описании можно подтвердить синергетический эффект между применением холодных условий внутри камеры устройства и применением ультразвука. С этой целью существует множество возможных конфигураций, таких как применение ультразвука в непосредственной близости к биологическому образцу при низкой интенсивности, или размещение преобразователей вдали от образца при более высоких интенсивностях и в контакте с консервирующей жидкостью, содержащей образец.
Кроме того, вопреки тому, что ожидалось, проблемы с продолжительностью применения ультразвука не были подтверждены в изобретении. Другими словами, известно о необходимости сохранения образца в условиях холодовой ишемии в течение нескольких часов при транспортировке органа. В соответствии с изобретением ультразвук можно непрерывно применять при подходящих интенсивностях, и, несмотря на то, что ожидали, он также не повреждает биологический образец.
Поэтому, применяя ультразвук и предотвращая локальное нагревание образца, было подтверждено значительное снижение повреждения клеток. Кроме того, на основании проведенных анализов было подтверждено, что защита органа от повреждения, вызванного холодовой ишемией, одновременным применением обеих обработок, неожиданно лучше, чем сумма всей защиты, полученной в результате обработок отдельно.
Кроме того, изобретение охватывает ряд предпочтительных признаков, которые являются объектом зависимых пунктов формулы изобретения, и полезность которых будет подчеркнута ниже в подробном описании варианта осуществления изобретения.
Предпочтительно упомянутый вспомогательный контейнер является закрываемым.
В предпочтительном варианте осуществления было подтверждено, что упомянутая ультразвуковая система подходит для излучения упомянутого ультразвука с частотой, в диапазоне от 25 кГц до 1 МГц и интенсивностью звука в диапазоне от 0,01 до 2 Вт/см2 и предпочтительно от 0,02 до 1 Вт/см2 и особенно предпочтительно от 0,02 до 0,1 Вт/см2. Эти частоты и диапазоны интенсивности были проверены, чтобы быть особенно полезными для снижения повреждения клеток. В частности, при меньшей интенсивности получают лучшие результаты, и требуется меньшее охлаждение образца и/или разделение преобразователей относительно биологического образца, что позволяет устройству быть более компактным.
Можно также предпочтительно предусмотреть, что ультразвук применяют непрерывным способом или, альтернативно, импульсным способом. Кроме того, изобретение не исключает одновременно применение ультразвука, имеющего разные частоты, посредством соответствующего индивидуального управления каждым из преобразователей устройства.
Также было подтверждено, что чем ниже температура, тем больше синергический эффект, полученный с помощью ультразвука. Поэтому в особенно предпочтительном способе охлаждающие средства подходят для поддержания температуры внутри упомянутой камеры от 0 до 15°С и предпочтительно от 2 до 10°С и особенно предпочтительно от 2 до 6°С. Тем более, что как было подтверждено сочетание холодных условий и ультразвука вместе предоставляет лучшие результаты, чем то, что можно было бы ожидать в лучшем случае от суммы эффектов холодных условий и ультразвука отдельно.
В предпочтительном варианте осуществления устройство в соответствии с изобретением содержит листовую опору в упомянутой камере, подходящую для поддержания биологического образца, при этом упомянутая листовая опора способна свободно вибрировать, когда применяют упомянутый ультразвук, и ультразвуковая система содержит, по меньшей мере, один преобразователь, установленный, по меньшей мере, на одной из стенок упомянутой листовой опоры. Как результат эффект затухания опоры минимизируется, и ультразвук вводится в биологический образец более эффективным способом, улучшая его действие в более объемных биологических образцах при условии, что предотвращается чрезмерное локальное нагревание в биологическом образце.
В особенно предпочтительном способе упомянутый, по меньшей мере, один преобразователь установлен на лицевой стороне упомянутой листовой опоры, находящейся напротив опорной поверхности для упомянутого биологического образца, для применения упомянутого ультразвука по направлению к упомянутой опорной поверхности. В связи с этим получают более однородное ультразвуковое поле, что еще больше способствует совместному эффекту холодных условий и ультразвука на биологический образец. Может быть подходящим для листовой опоры быть лотком, и для такого лотка позволительно содержать в себе жидкость, такую как вода, для улучшения передачи применяемого ультразвука. Назначение жидкости, с одной стороны, действовать как охлаждающая жидкость и одновременно способствовать передаче ультразвука в биологический образец.
В особенно предпочтительном способе упомянутая листовая опора выполнена из металла, для того чтобы повысить ее жесткость и в наибольшей степени предотвратить затухание, а также для достижения более прямой передачи ультразвука на биологический образец.
В особенно предпочтительном варианте осуществления устройство содержит закрываемый вспомогательный контейнер, содержащий консервирующий раствор. Опять же, было подтверждено, что сочетание холодных условий и ультразвука плюс погружение биологического образца в консервирующий раствор обеспечивает лучшие результаты, чем сумма их индивидуальных эффектов в отношении снижения повреждения биологического образца.
В варианте осуществления устройства в соответствии с изобретением листовая опора представляет собой лоток, предназначенный для содержания в нем жидкости.
В другом предпочтительном варианте осуществления листовая опора представляет собой лоток, содержащий воду.
В другом варианте осуществления вспомогательный контейнер содержит двойное дно, расположенное вдали от основания упомянутого вспомогательного контейнера, и упомянутое двойное дно сообщается по жидкости с остальной частью упомянутого вспомогательного контейнера.
К тому же, в особенно предпочтительном способе вспомогательный контейнер может содержать двойное дно, предназначенное для хранения биологического образца вдали от опорной поверхности контейнера, причем упомянутое двойное дно сообщается по жидкости с остальной частью вспомогательного контейнера. Вследствие этого, образец может быть помещен во вспомогательный контейнер, как будто бы он плавал в консервирующем растворе. Поэтому образец не получает такого прямого действия ультразвука и можно работать при более высоких интенсивностях.
Кроме того, изобретение также рассматривает способ транспортировки и консервации ex vivo трансплантируемого биологического образца, отличающийся тем, что он включает в себя этапы удаления и промывания крови из биологического образца, помещение биологического образца в камеру, ограниченную стенками, выполненными из теплоизоляционного материала без внешней подачи кислорода и облучения образца ультразвуком. Более конкретно, в способе в соответствии с изобретением биологический образец хранят погруженным в консервирующий раствор без внешней подачи кислорода, помещая упомянутый биологический образец в камеру, ограниченную стенками, выполненными из теплоизоляционного материала.
Предпочтительно, упомянутый биологический образец помещают погруженным во вспомогательный контейнер, который является предпочтительно закрываемым, содержащий упомянутый консервирующий раствор, и упомянутый вспомогательный контейнер помещают в упомянутую камеру.
В одном варианте осуществления способа на этапе облучения для облучения упомянутого биологического образца ультразвук имеет частоты в диапазоне от 25 кГц до 1 МГц и интенсивность звука в диапазоне от 0,01 до 2 Вт/см2 и особенно предпочтительно от 0,02 до 1 Вт/см2, и особенно предпочтительно от 0,02 до 0,1 Вт/см2.
В другом варианте осуществления способ содержит этап охлаждения для охлаждения температуры в камере до температуры от 0 до 15°С и более предпочтительно от 2 до 10°С и особенно предпочтительно от 2 до 6°С.
В другом варианте осуществления способ дополнительно содержит этап, состоящий из хранения упомянутого биологического образца, погруженного в консервирующий раствор.
Наконец, способ дополнительно содержит этап размещения упомянутого вспомогательного контейнера на листовой опоре, которая представляет собой лоток, предназначенный для содержания в нем жидкости, и упомянутый лоток способен свободно вибрировать, когда применяют упомянутый ультразвук.
Изобретение также относится к применению устройства для транспортировки и консервации ex vivo биологического образца. Устройством биологический образец поддерживается погруженным в консервирующий раствор без доставки кислорода в гипотермических условиях, и упомянутый образец облучается ультразвуком, так что жизнеспособность, функциональность и взаимодействие между различными клетками упомянутого биологического образца сохраняются для упомянутого биологического образца, предназначенного в последующем лабораторном исследовании.
Кроме того, изобретение также охватывает другие подробные признаки, проиллюстрированные в подробном описании варианта осуществления изобретения и прилагаемых чертежах.
Краткое описание чертежей
Дополнительные преимущества и признаки изобретения станут очевидными из нижеследующего описания, в котором без какого-либо ограничивающего характера раскрыты предпочтительные варианты осуществления изобретения со ссылкой на прилагаемые чертежи, на которых:
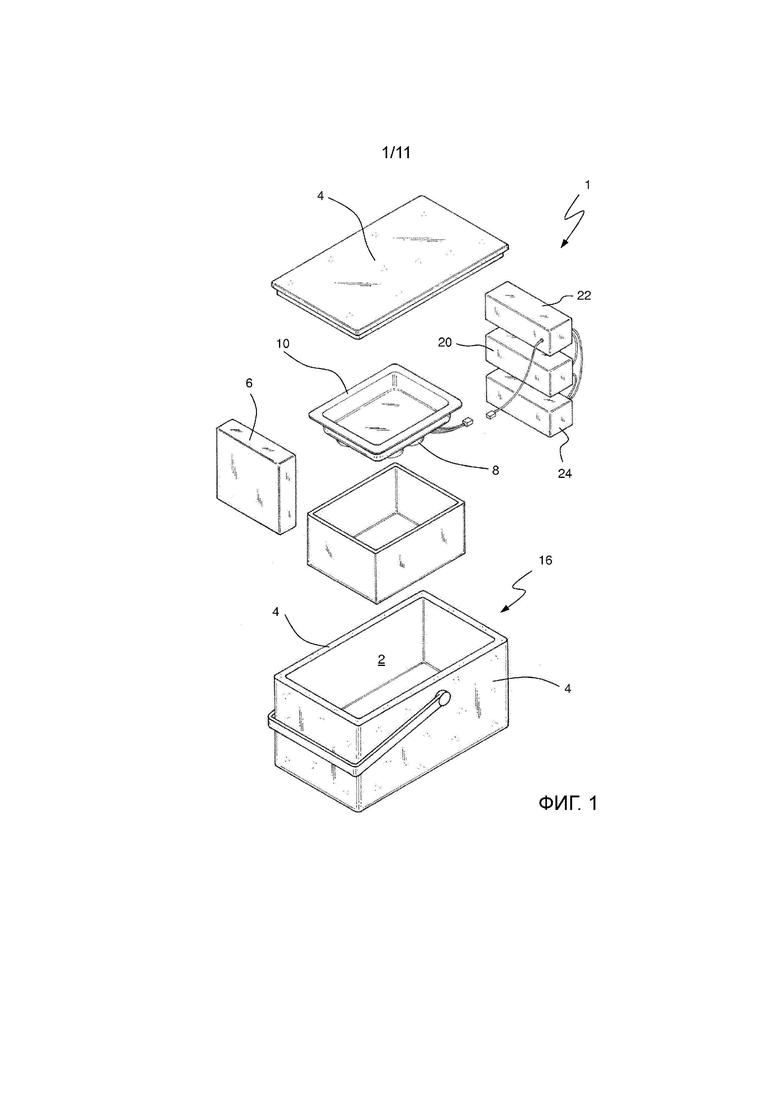
На Фиг. 1 показан детальный перспективный вид первого варианта осуществления устройства для транспортировки ex vivo биологического образца.
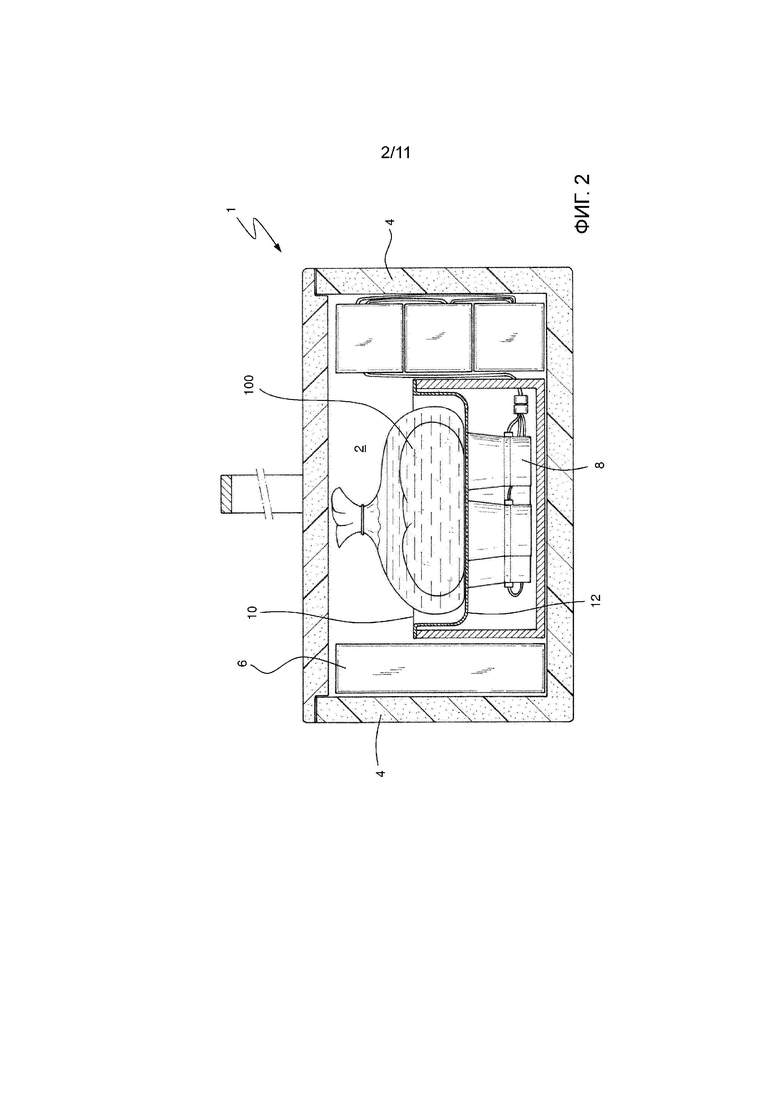
На Фиг. 2 показан вид спереди, представленный в продольном разрезе, устройства фиг. 4.
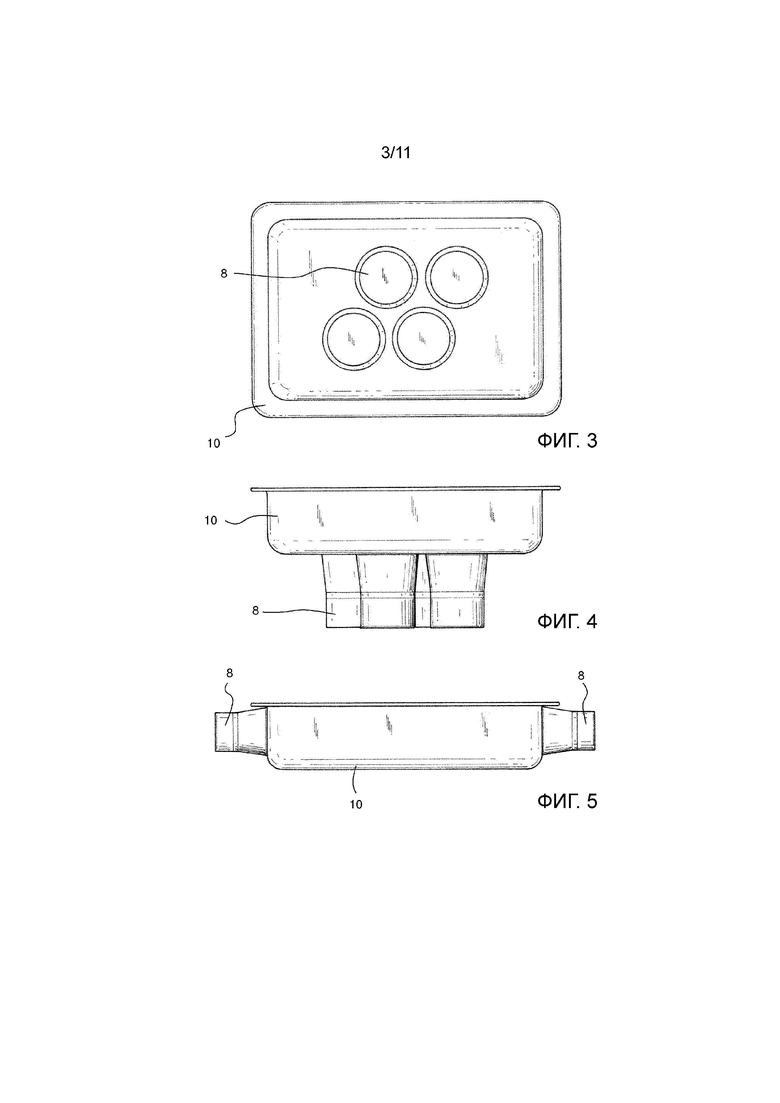
На Фиг. 3 показан вид сверху первого варианта осуществления опорного лотка для биологического образца устройства Фиг. 1.
На Фиг. 4 показан вид сбоку лотка Фиг. 3.
На Фиг. 5 показан второй вариант осуществления опорного лотка для биологического образца.
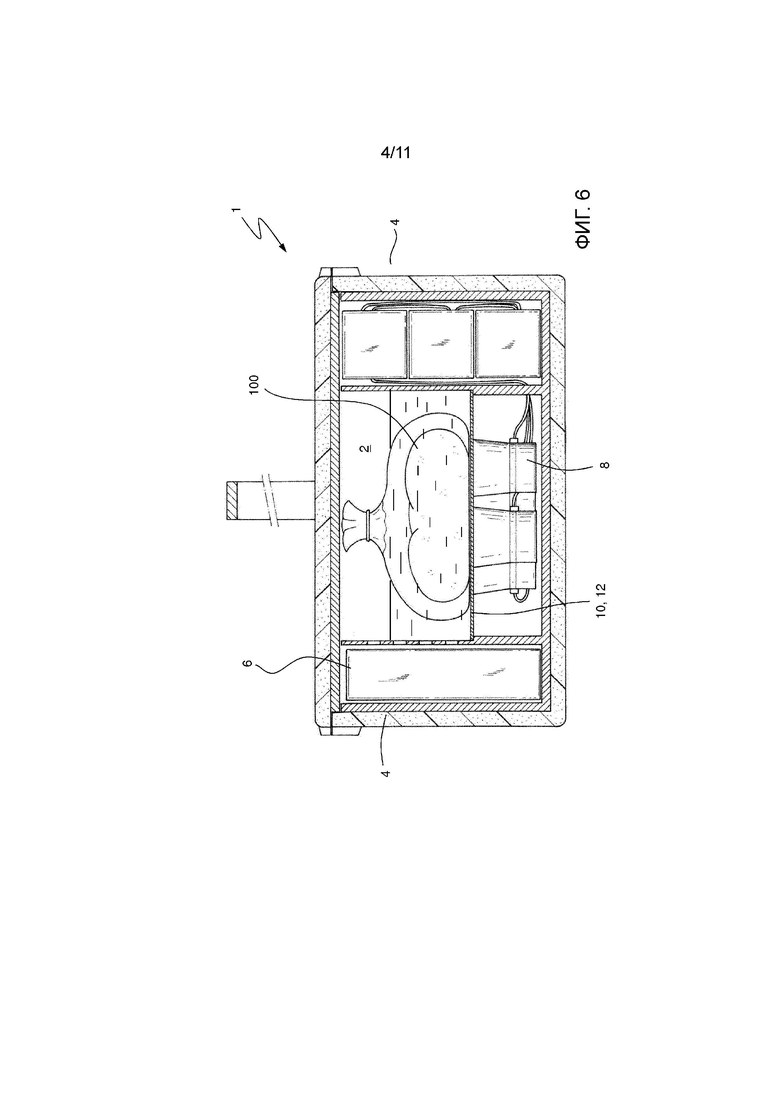
На Фиг. 6 показан второй вариант осуществления устройства для транспортировки в соответствии с изобретением.
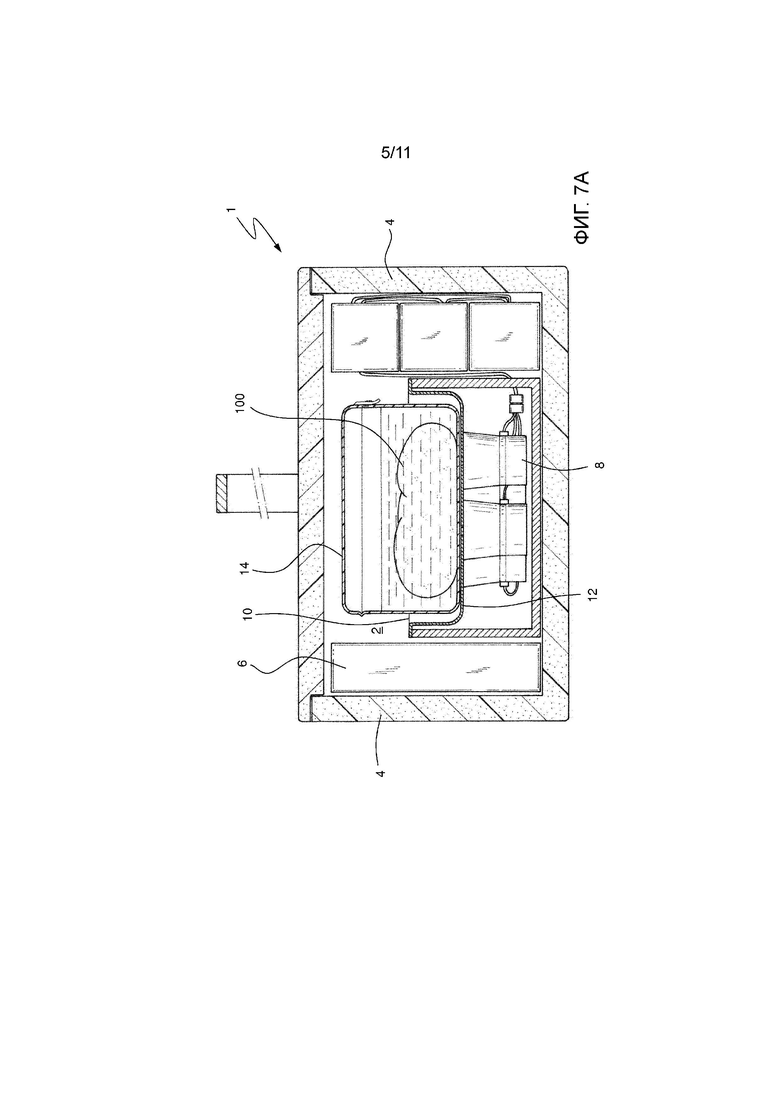
На Фиг. 7А показан третий вариант осуществления устройства для транспортировки в соответствии с изобретением.
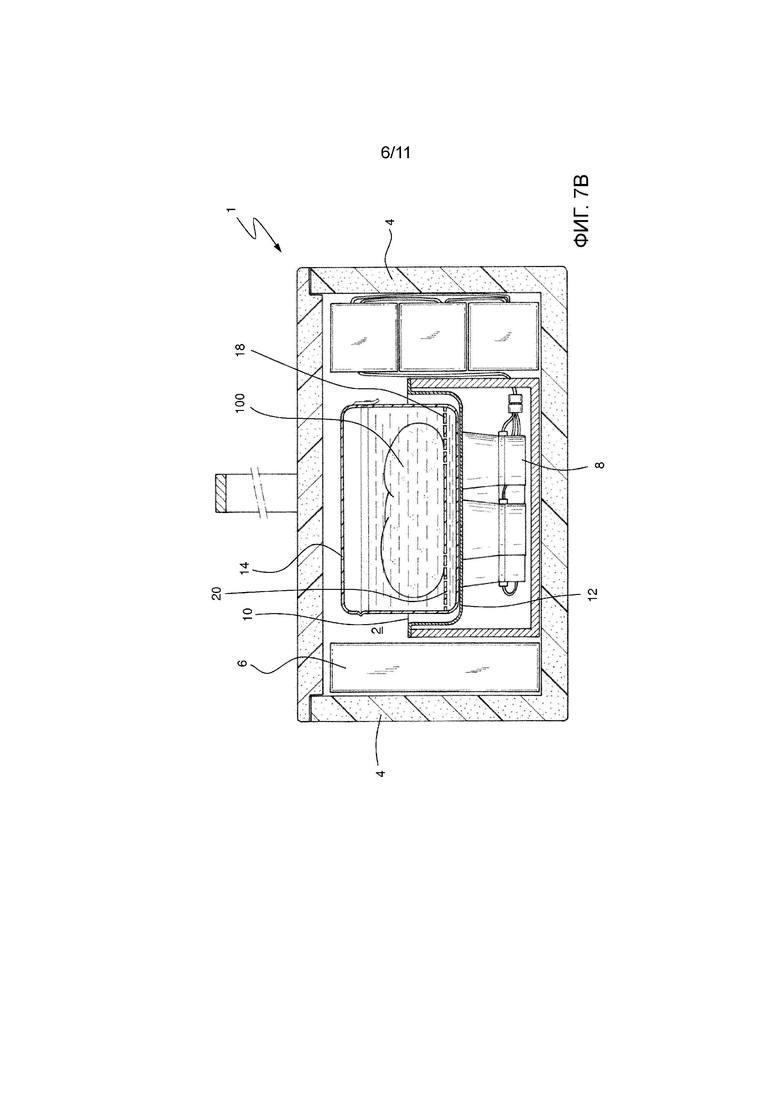
На фиг. 7В показан альтернативный вариант осуществления вспомогательного контейнера устройства Фиг. 7А.
На Фиг. 8А-13 показаны процент защиты биологических образцов печени и почек относительно условий в существующем уровне техники.
Подробное описание вариантов осуществления изобретения
На фиг. 1 и 2 показан первый вариант осуществления устройства 1 для транспортировки и консервации ex vivo трансплантируемого биологического образца 100 в соответствии с изобретением. В особенно предпочтительном способе устройство в соответствии с изобретением представляет собой переносную холодильную камеру.
Как уже указывалось ранее, биологический образец 100 содержит оба органа, которые можно трансплантировать от донора реципиенту, который может быть человеком или животным, и тканями. Кроме того, биологический образец также может быть предназначен для исследований без обязательной его трансплантации.
Устройство 1 для транспортировки и консервации в соответствии с изобретением имеет основной изотермический контейнер 16 в форме параллелепипеда открытый на верхней поверхности. Стены 4, выполненные из теплоизоляционного материала, основного контейнера 16, включая его верхнюю крышку, ограничивают камеру 2, предназначенную для содержания в ней биологического образца 100.
Охлаждающие средства 6, подходящие для поддержания температуры внутри камеры 2 ниже температуры за пределами упомянутого устройства 1, предусмотрены внутри основного контейнера 16. Эти охлаждающие средства 6 могут содержать растворы, такие различные как ледяные блоки, охлаждающие гелевые пакеты или более сложные решения, содержащие компрессор и теплообменник. Устройство 1 также может состоять из переносной холодильной камеры с внешним электроснабжением или без него. Тем не менее, желательно для раствора быть как можно более легким, чтобы не повлиять на транспортируемость сборки. Охлаждающие средства 6 позволяют поддерживать температуру внутри камеры 2 от 0 до 15°C. В другом предпочтительном варианте осуществления температура внутри камеры 2 поддерживается от 2 до 10°С и особенно предпочтительно от 2 до 6°С.
Устройство 1 содержит в центральной части листовую опору 10 в виде металлического лотка, поддерживаемого внутри камеры 2, так что он может свободно вибрировать. Лоток этого первого варианта осуществления можно подробно рассмотреть на Фиг. 3 и 4. В варианте осуществления используют алюминиевый лоток толщиной менее 1 мм и предпочтительно 0,5 мм.
Кроме того, устройство содержит ультразвуковую систему, подходящую для генерирования и применения ультразвука на биологическом образце 100. С этой целью ультразвуковая система согласно чертежам имеет генератор 20 электрических сигналов, усилитель 22, аккумулятор 24 и в этом случае четыре пьезоэлектрических преобразователя 8.
Вибрации направляются на листовую опору 10 в виде алюминиевого лотка через четыре преобразователя 8. Упомянутые преобразователи 8 установлены на нижней поверхности лотка. В результате этой конфигурации передача между преобразователями и биологическим образцом 100 является более прямой, поскольку вибрации генерируются непосредственно ниже нижней части биологического образца. В особенно предпочтительном способе, как можно видеть на Фиг. 6, лоток может дополнительно содержать воду, но для улучшения передачи ультразвука предусматривается, что биологический образец 100 содержится в мешке или контейнере, заполненном консервирующим раствором. Консервирующие растворы, рассматриваемые здесь, представляют собой, например, лактированный раствор Рингера, раствор Celsior или раствор Висконсинского Университета.
В альтернативном варианте осуществления, показанном на Фиг. 5, лоток может иметь преобразователи 8 на боковых стенках для создания бокового колебательного поля. Преобразователи 8 также могут быть альтернативно расположены как на боковых стенках, так и на нижней части лотка.
Ультразвуковые преобразователи 8 передают механические волны, имеющие частоту в диапазоне от 25 кГц до 1 МГц и интенсивность звука в диапазоне от 0,1 до 2 Вт/см2 в упомянутую камеру 2 во время транспортировки упомянутого биологического образца 100. Интенсивность может предпочтительно находиться в диапазоне от 0,02 до 1 Вт/см2 и еще более предпочтительно от 0,02 до 0,1 Вт/см2. Чем выше используемая интенсивность звука, тем дальше будут преобразователи 8 и/или тем большее количество консервирующей жидкости или охлаждающей жидкости будет помещено в устройство 1 для достижения цели предотвращения локального нагрева в биологическом образце 100. Кроме того, в соответствии с изобретением ультразвук можно применять непрерывно. Альтернативно, ультразвук также можно применять периодически, т. е. его не применяют в течение всего времени транспортировки. Альтернативно, его также можно применять импульсным способом и/или при разных частотах, либо непрерывно, либо периодически.
В особенно предпочтительном способе биологический образец 100 содержится в резервуаре, содержащем консервирующий раствор, который улучшает результаты применения ультразвука.
Другие варианты осуществления устройства 1 для транспортировки в соответствии с изобретением, которые разделяют многие из тех же характеристик, описанных в предыдущих параграфах, показаны ниже. Соответственно, в дальнейшем будут описаны только те элементы, которые отличаются друг от друга такими вариантами осуществления, тогда как для общих элементов делается ссылка на описание первого варианта осуществления.
Вариант осуществления устройства 1 на Фиг. 6 отличается в основном тем, что листовая опора 10 встроена непосредственно в стенки 4 основного контейнера 16.
Наконец, в варианте осуществления устройства на Фиг. 7А вспомогательный контейнер 14 предусмотрен внутри основного контейнера 16 с консервирующим раствором. В особенно предпочтительном способе вспомогательный контейнер 14 является закрываемым с жесткими стенками и крышкой, шарнирно соединенной с одной из его стенок. В особенно предпочтительном способе, когда преобразователи расположены в нижней части лотка, вспомогательный контейнер 14 имеет размеры, предназначенные для занимания всей поверхности излучения преобразователей 8. В результате, когда вспомогательный контейнер 14 заполнен консервирующим раствором, ультразвук достигает биологического образца 100 более эффективным образом. В особенно предпочтительном способе вспомогательный контейнер 14 изготовлен посредством термоформования с использованием формуемого пластика, такого как, например, полиэтилен высокой плотности, полипропилен, полиэтилентерефталат или тому подобное. Также в особенно предпочтительном способе материал будет прозрачным, чтобы можно было видеть биологический образец 100 без необходимости открывать вспомогательный контейнер 14.
На Фиг. 7А показан альтернативный вариант осуществления вспомогательного контейнера 14. В этом случае вспомогательный контейнер 14 содержит двойное дно 18, расположенное вдали от основания упомянутого вспомогательного контейнера 14 и упомянутое двойное дно 18 сообщается по жидкости с остальной частью упомянутого вспомогательного контейнера 14. Двойное дно, таким образом, размещает биологический образец 100 вдали от опорной поверхности вспомогательного контейнера 14. В этом случае двойное дно 18 состоит из листа жесткого пластика, поддерживаемого боковыми стенками вспомогательного контейнера 14. Затем для достижения надлежащего движения жидкости в этом случае предусмотрено множество отверстий 20, которые обеспечивают прохождение консервирующего раствора, так что упомянутый раствор получает прямое воздействие ультразвука, поступающего от нижних преобразователей 8.
Наконец, в особенно предпочтительном способе вспомогательный контейнер 14 содержит консервирующую жидкость в стерильных условиях из группы, состоящей из лактированного консервирующего раствора Рингера, консервирующего раствора Celsior или консервирующего раствора Висконсинского Университета. Это позволяет гораздо более гигиенично обрабатывать биологический образец в более подходящих условиях для надлежащей его консервации.
Варианты осуществления, описанные до сих пор, представляют собой неограничивающие примеры, так что специалисту в данной области техники будет понятно, что за пределами примеров, которые показаны в рамках объема изобретения возможно некоторое количество комбинаций заявленных признаков.
Экспериментальные примеры
Ниже описаны различные испытания, проведенные для осуществления способа на практике в соответствии с изобретением.
Методология
Экспериментальный протокол осуществляли из печени и почек свиней породы Ландрас. Почку и печень перфузировали консервирующим раствором при 4°C для удаления крови, содержащейся в органе, и орган хранили в холодных условиях, засыпанный льдом до тех пор, пока органы не были погружены в различные консервирующие растворы. Затем биологические образцы помещали в холодильную камеру и держали в холодильной камере с ультразвуком или без него в течение 8 часов (печень) и 24 часов (почка). Все процедуры проводили под анестезией, и в исследовании соблюдались правила Европейского союза, касающиеся экспериментов с животными (Директива 86/609/EEC).
План эксперимента
Протокол 1
Сформированные экспериментальные группы были следующими:
ГРУППА 1: группа холодовой ишемии в обычной транспортной системе и с консервирующим раствором. Эта группа была разделена на разные подгруппы в зависимости от используемого консервирующего раствора.
1.1) Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в лактированном растворе Рингера при 4°C и консервация таких органов с лактированным раствором Рингера в обычной транспортной системе в течение 8 и 24 часов для печени и почки соответственно, от 2 до 6°С;
1.2). То же самое, как 1.1, но с использованием раствора Celsior для промывания и консервации органа;
1.3) То же самое, как 1.1, но с использованием UW (Университет Висконсина) раствора для промывания и консервации органа.
ГРУППА 2: группа холодовой ишемии в системе с ультразвуком (25 кГц и 0,04 Вт/см2) и без консервирующего раствора: перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в лактированном растворе Рингера при 4°C для промывания органов с целью удаления содержащейся в них крови. После промывания органы хранили в течение 8 и 24 часов для печени и почки, соответственно, и без консервирующего раствора в транспортной системе с ультразвуком (25 кГц и 0,04 Вт/см2) от 2 до 6°C.
ГРУППА 3: группа холодовой ишемии в транспортной системе с ультразвуком (25 кГц и 0,04 Вт/см2) и с консервирующим раствором. Группа была разделена на разные подгруппы в зависимости от используемого консервирующего раствора.
3.1) Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в лактированном растворе Рингера при 4°C. Затем органы хранили в лактированном растворе Рингера в течение 8 и 24 часов для печени и почки, соответственно, в транспортной системе с ультразвуком при температуре в диапазоне 2-6°С;
3.2) То же самое, как 3.1, но с использованием раствора Celsior для промывания и консервации органа;
3.3) То же самое, как 3.1, но с использованием UW раствора для промывания и консервации органа.
Были также проведены эксперименты, чтобы оценить, могут ли другие частоты и/или интенсивности обеспечить большую консервацию, чем то, что было достигнуто с частотами 25 кГц и интенсивностью 0,04 Вт/см2. Для этого были проведены следующие эксперименты.
ГРУППА 4: группа холодовой ишемии в системе с ультразвуком (40, 80, 200, 580 кГц и 1 МГц) и интенсивностью 0,04 Вт/см2 и с консервирующим раствором. Группа была разделена на разные подгруппы в зависимости от используемой частоты.
4.1) Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в UW растворе при 4°C. Затем органы хранили в UW растворе в течение 8 и 24 часов для печени и почки, соответственно, в транспортной системе с ультразвуком в 40 кГц и интенсивностью 0,04 Вт/см2 и от 2 до 6°С;
4,2). То же самое, как 4.1, но с использованием 80 кГц и интенсивности 0,04 Вт/см2 и от 2 до 6°С;
4.3) То же самое, как 4.1, но с использованием 200 кГц и интенсивности 0,04 Вт/см2 и от 2 до 6°С;
4.4) То же самое, как 4.1, но с использованием 580 кГц и интенсивности 0,04 Вт/см2 и от 2 до 6°С;
4.5) То же самое, как 4.1, но с использованием 1 МГц и интенсивности 0,04 Вт/см2 и от 2 до 6°С.
Эксперименты также проводили для проверки влияния ультразвука с интенсивностью более 0,04. Для этой цели были выполнены следующие эксперименты:
ГРУППА 5: группа холодовой ишемии в системе с ультразвуком (25 кГц и интенсивностью 0,1 Вт/см2 и с консервирующим раствором). Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в UW растворе при 4°C. Затем органы хранили в течение 8 и 24 часов для печени и почки, соответственно, в транспортной системе с ультразвуком в 25 кГц и интенсивностью 0,1 Вт/см2 и при температуре, составляющей от 2 до 6°С;
Были дополнительно добавлены следующие экспериментальные группы для оценки влияния консервирующего раствора и холодных условий:
ГРУППА 6: группа холодовой ишемии в обычной транспортной системе, но без консервирующего раствора. Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в лактированном растворе Рингера при 4°C для промывания органов с целью удаления содержащейся в органах крови. После промывания органы хранили без консервирующего раствора в обычной холодильной камере (без ультразвука) в течение 8 и 24 часов для печени и почки, соответственно, от 2 до 6°C.
ГРУППА 7: группа ишемии с нехолодными условиями и в сочетании с ультразвуком (25 кГц и интенсивностью 0,04 Вт/см2) или без него. Группа была разделена на две подгруппы.
7.1) Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в UW растворе при температуре от 20 до 25°C. Затем органы хранили в течение 8 и 24 часов для печени и почки, соответственно, при температуре в диапазоне 20-25°C;
7.2) Перфузия печеночных трансплантатов (n=10) и почечных трансплантатов (n=10) в UW растворе при температуре в диапазоне 20-25°C. Затем органы хранили в течение 8 и 24 часов для печени и почки, соответственно, при температуре в диапазоне 20-25°С и с ультразвуком при 25 кГц и интенсивностью 0,04 Вт/см2.
Сбор и обработка образцов
В конце ишемии и во всех экспериментальных группах и подгруппах были собраны образцы перфузата печени и почки для оценки повреждения печени и почки, вызванного ишемией, с использованием широко стандартизованных методик. Повреждение печени оценивали определением уровней трансаминаз в перфузате и посредством определения активности каспазы 3 в ткани печени. Повреждение почки оценивали посредством определения лактатдегидрогеназы в перфузате и активности каспазы 3 в почечной ткани. Уровни МДА (малондиальдегида) определяли в образцах печеночной и почечной ткани как индекс окислительного (оксидативного) стресса, а уровни АТФ (аденозинтрифосфата) определяли как индекс сохранения энергетического метаболизма органа (Salahudeen AK et al., Am J Transpl 2003; 3:273-280; Omar R et al., Gut 1989;30:510-514; Peralta et al., Am J Physiol.2000; 279:G163-71).
Статистическое исследование проводили посредством дисперсионного анализа (ANOVA), а затем уровень статистической достоверности определяли с помощью теста Стьюдента-Ньюмана-Келса.
Полученные и схематически показанные на чертежах результаты подробно описаны ниже.
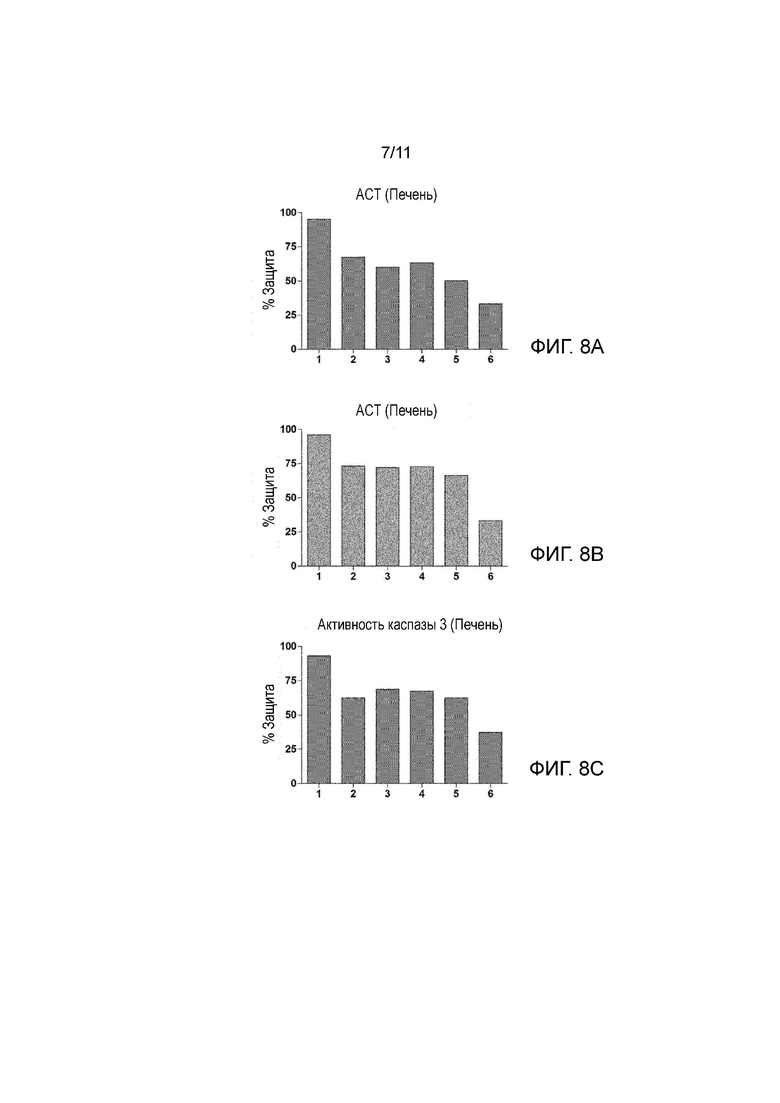
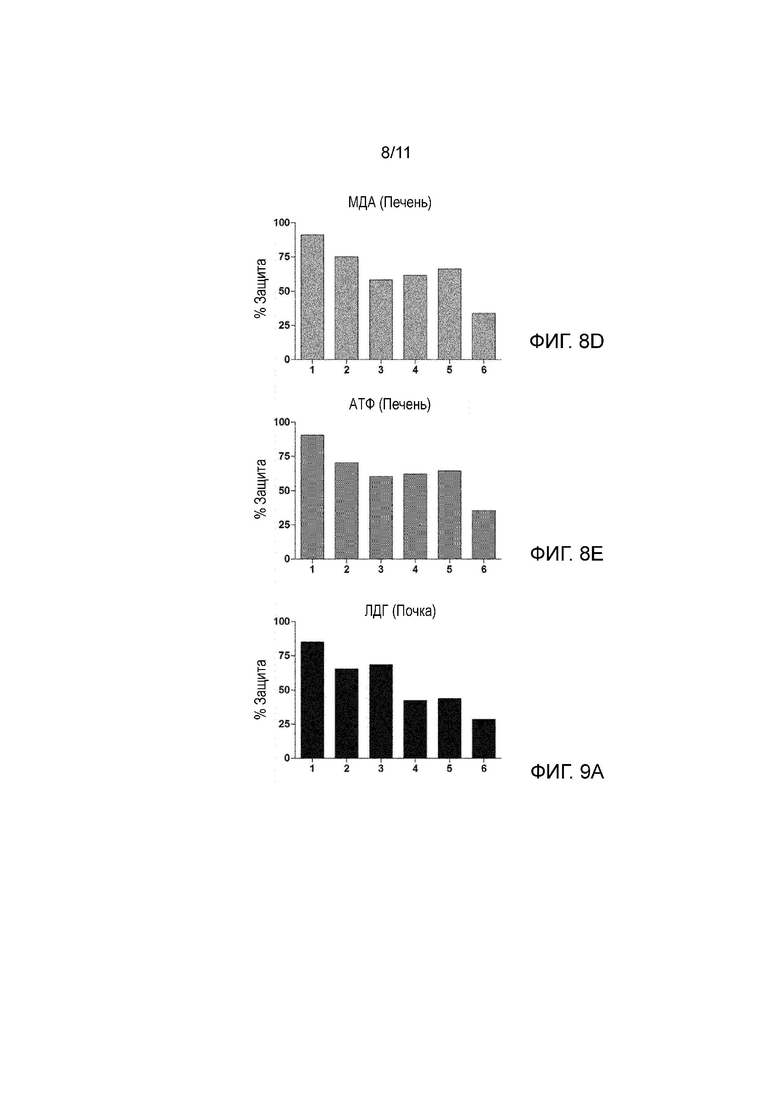
На Фиг. 8A-8E показан процент защиты, или, другими словами, процент уменьшения повреждения печени в биологических образцах, состоящих из печеночных трансплантатов в условиях 1-6, описанных ниже, в сравнении с повреждением, вызванным следующим условием: UW раствор + холодные условия (2-6°C), когда параметры, указывающие на повреждение печени, а именно: АСТ (аспартатаминотрансфераза), АЛТ (аланинаминотрансфераза), активность каспазы 3, МДА (малондиальдегид) и АТФ (аденозинтрифосфат), оценивали в конце 8 часов холодовой ишемии.
Условия (1-6):
1: UW раствор, частота ультразвука 25 кГц и холодные условия (2-6°C).
2: UW раствор, частота ультразвука 40 кГц и холодные условия (2-6°C).
3: UW раствор, частота ультразвука 80 кГц и холодные условия (2-6°C).
4: UW раствор, частота ультразвука 200 кГц и холодные условия (2-6°C).
5: UW раствор, частота ультразвука 580 кГц и холодные условия (2-6°C).
6: UW раствор, частота ультразвука 1 МГц и холодные условия (2-6°C).
Во всех случаях от 1 до 6 применяли интенсивность ультразвука 0,04 Вт/см2.
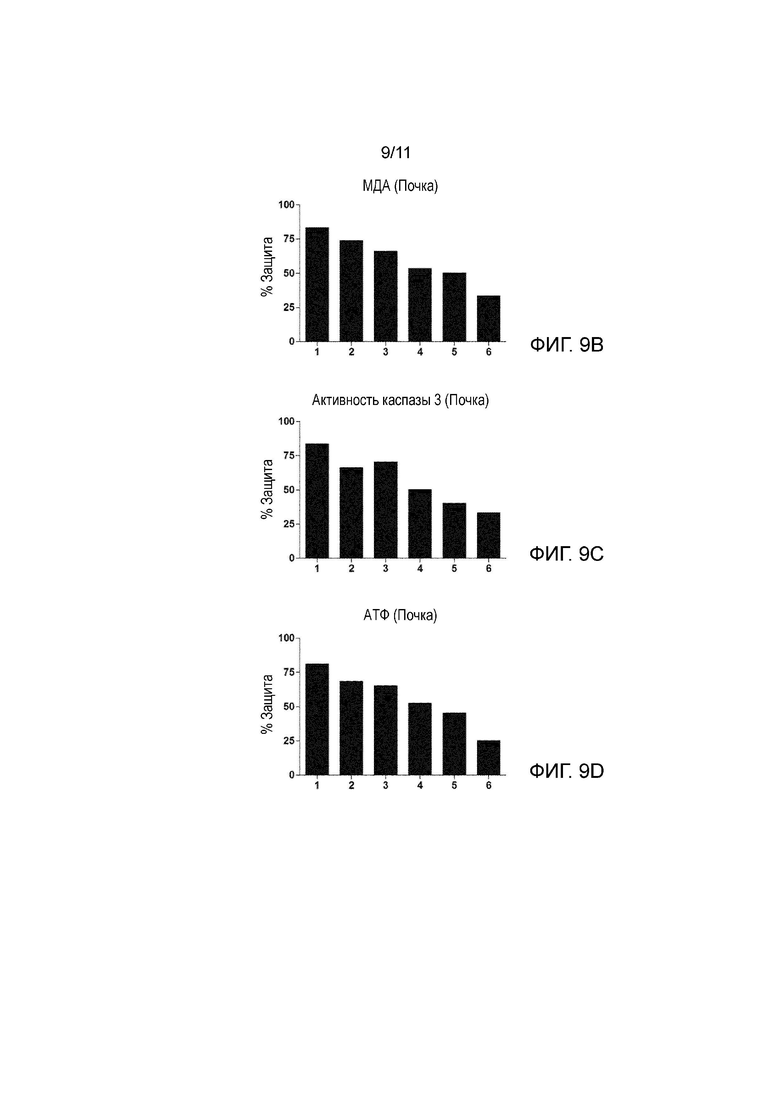
На Фиг. 9A-9D показан процент защиты в биологических образцах, состоящих из почечных трансплантатов в условиях 1-6, описанных ниже, в сравнении с повреждением, вызванным следующим условием: UW раствор + холодные условия (2-6°C), когда параметры, указывающие на повреждение почки, а именно: ЛДГ (лактатдегидрогеназа), активность каспазы 3, МДА и АТФ, оценивали в конце 24 часов холодовой ишемии.
1: UW раствор, частота ультразвука 25 кГц и холодные условия (2-6°C).
2: UW раствор, частота ультразвука 40 кГц и холодные условия (2-6°C).
3: UW раствор, частота ультразвука 80 кГц и холодные условия (2-6°C).
4: UW раствор, частота ультразвука 200 кГц и холодные условия (2-6°C).
5: UW раствор, частота ультразвука 580 кГц и холодные условия (2-6°C).
6: UW раствор, частота ультразвука 1 МГц и холодные условия (2-6°C).
Во всех случаях от 1 до 6 применяли интенсивность ультразвука 0,04 Вт/см2.
На Фиг. 10 показан процент защиты в печени в сравнении с повреждением, вызванным следующим условием: без использования консервирующего раствора + холодные условия (2-6°C) + отсутствие ультразвука, когда параметр, указывающий на повреждение печени, АСТ, оценивали в конце 8 часов холодовой ишемии.
1: Лактированный раствор Рингера без ультразвука и с холодными условиями (2-6°C).
2: Раствор Celsior без ультразвука и с холодными условиями (2-6°C).
3: UW раствор без ультразвука и с холодными условиями (2-6°C).
4: Лактированный раствор Рингера с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
5: Раствор Celsior с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
6: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
Примечание: из используемых консервирующих растворов стандартным раствором в клинической практике является UW (Университет Висконсина) консервирующий раствор. Лактированный раствор Рингера не содержит лекарств и содержит только минеральные соли. Раствор Celsior содержит глутатион, а UW раствор содержит больше лекарств, таких как аденозин, глутатион и аллопуринол.
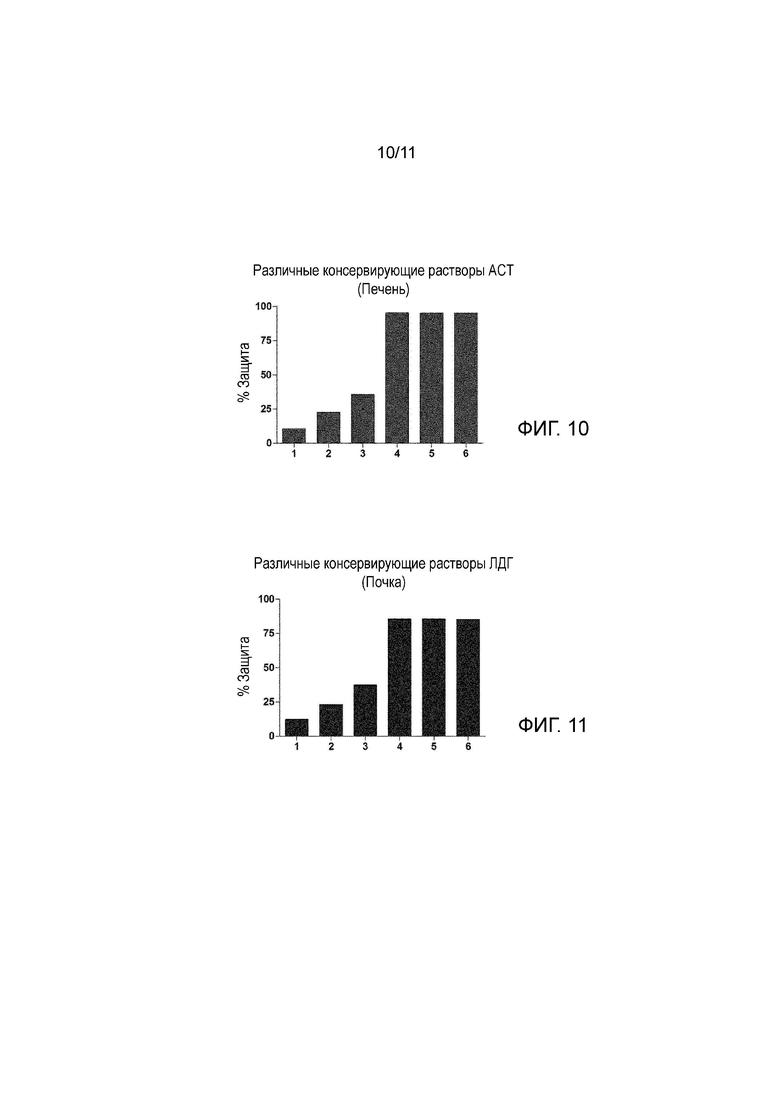
На Фиг. 11 показан процент защиты в почке в сравнении с повреждением, вызванным следующим условием: без использования консервирующего раствора + холодные условия (2-6°C) + отсутствие ультразвука, когда параметр, указывающий на повреждение почки, ЛДГ, оценивали в конце 24 часов холодовой ишемии.
1: Лактированный раствор Рингера без ультразвука и с холодными условиями (2-6°C).
2: Раствор Celsior без ультразвука и с холодными условиями (2-6°C).
3: UW раствор без ультразвука и с холодными условиями (2-6°C).
4: Лактированный раствор Рингера с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
5: Раствор Celsior с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
6: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C).
На Фиг. 12 показан процент защиты в печени в сравнении с повреждением, вызванным следующим условием: UW консервирующий раствор + отсутствие холодных условий (20-25°C) + отсутствие ультразвука, когда параметр, указывающий на повреждение печени, АСТ, оценивают в конце 8 часов холодовой ишемии.
1: UW раствор без ультразвука и с холодными условиями (2-6°C).
2: UW раствор с ультразвуком и без холодных условий (20-25°C).
3: Без консервирующего раствора с ультразвуком и с холодными условиями (2-6°C).
4: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C). Ожидаемый результат: Защита 1 + Защита 2=Защита (1 + 2).
5: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C). Фактически наблюдаемый результат. Защита 1 + Защита 2 < Защита (1 + 2).
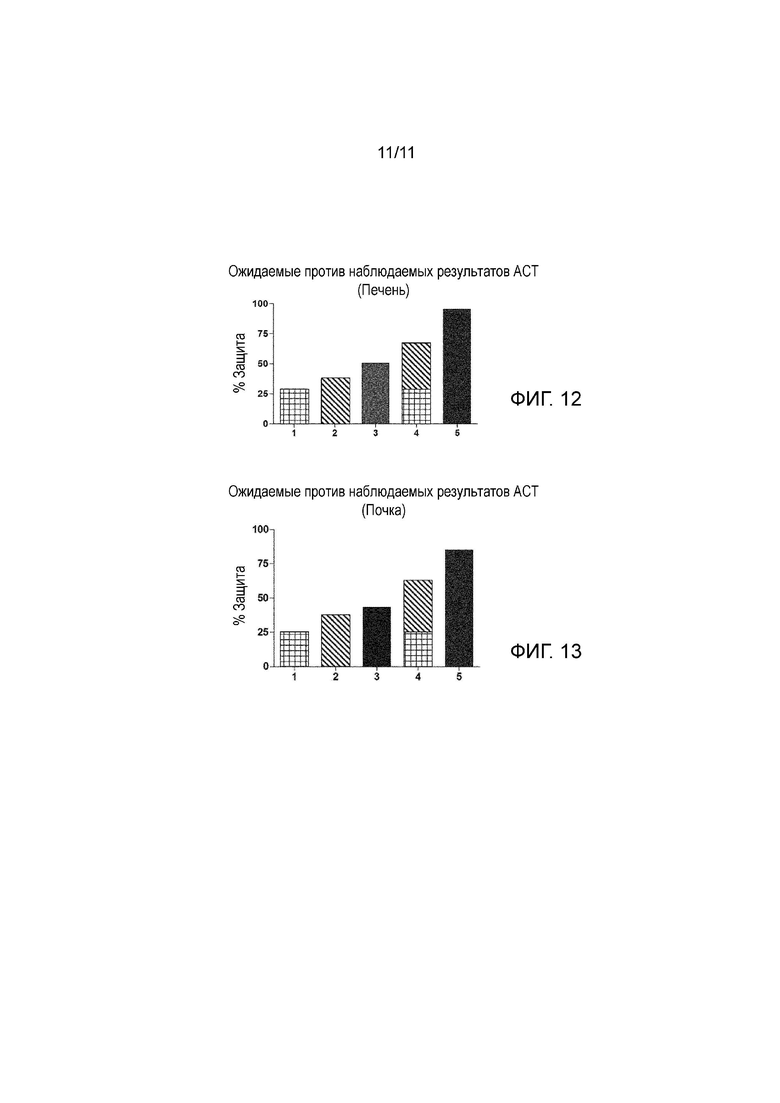
На Фиг. 13 показан процент защиты в почке в сравнении с повреждением, вызванным следующим условием: UW консервирующий раствор + отсутствие холодных условий (20-25°C) + отсутствие ультразвука, когда параметр, указывающий на повреждение почки, ЛДГ, оценивают в конце 24 часов холодовой ишемии.
1: UW раствор без ультразвука и с холодными условиями (2-6°C).
2: UW раствор с ультразвуком и без холодных условий (20-25°C).
3: Без консервирующего раствора с ультразвуком и с холодными условиями (2-6°C).
4: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C). Ожидаемый результат: Защита 1 + Защита 2=Защита (1 + 2).
5: UW раствор с ультразвуком (25 кГц, 0,04 Вт/см2) и с холодными условиями (2-6°C). Фактически наблюдаемый результат. Защита 1 + Защита 2 < Защита (1 + 2).
Обсуждение экспериментальных результатов
Важно отметить, что, как и ожидалось, без применения ультразвука температура колебалась от 2 до 6°C внутри холодильной камеры в консервирующей жидкости и в органе. Кроме того, применение ультразвука в холодных условиях (2-6°C) не изменило температуру внутри холодильной камеры, которая была от 2 до 6°C для всех экспериментов, но охлаждение органа и консервирующего раствора не сохранили.
При применении ультразвука температура находилась в диапазоне от 2 до 6°С внутри холодильной камеры, температура консервирующей жидкости находилась в диапазоне от 14 до 16°С и температуру органа от 16 до 18°С.
Эффект нагрева, вызванный ультразвуком, является ожидаемым результатом в соответствии со справочными документами, представляющими интерес. Тем не менее, вопреки тому, что можно было бы ожидать, принимая во внимание жизненную значимость охлаждения органа (4°C) и поддержания температуры консервирующей жидкости и органа от 2 до 6°C для хранения органов в условиях гипотермической ишемии, результаты показывают, что применение ультразвука не оказывает отрицательного влияния на эффект охлаждения биологического образца и, соответственно, не повреждает его.
Кроме того, тем не менее неожиданно было подтверждено, что достигается очень значительное улучшение, до такой степени, что можно подтвердить синергический эффект между применением холодных условий внутри камеры устройства и применением ультразвука.
Фиг. 8А-8Е: как показано на этих чертежах, во всех условиях (при разных частотах и одной и той же интенсивности 0,04 Вт/см2) применение ультразвука защищает печеночный трансплантат в условиях холодовой ишемии, причем упомянутые защитные эффекты более очевидны при условии 1, т.е. при частоте 25 кГц. Другие результаты, не показанные на чертежах, указывают, что при более высоких интенсивностях, как в случае 0,1 Вт/см2 также получают защиту печеночного трансплантата. Например, процент защиты или уменьшение повреждения в 55% получают при частотах 25 кГц и интенсивности 0,1 Вт/см2 в сравнении с условием: UW раствор + холодные условия (2-6°C), когда параметр для повреждения печени, АСТ оценивают в конце 8 часов холодовой ишемии.
На Фиг. 9А-9D показан тот же самый образец защиты почки, который показан на фиг. 8А-8Е для печени.
На Фиг 10, как и ожидалось, наблюдается защита печени, обеспечиваемая консервирующими растворами без применения ультразвука (условия 1-3); защита печеночного трансплантата лучше, если используют UW консервирующий раствор в отношении обоих растворов (Рингера или Celsior), а защита, полученная при помощи раствора Celsior, лучше, чем защита, полученная при помощи лактированного раствора Рингера. Кроме того, при наблюдении за защитой, обеспечиваемой консервирующими растворами в присутствии ультразвука (условия 4-6), получены неожиданные результаты, указывающие на лучшую защиту ультразвука, но такая защита одинакова при всех условиях (4-6). Другими словами, такую же степень защиты получают независимо от используемого консервирующего раствора, будь то лактированный раствор Рингера, раствор Celsior или UW раствор.
На Фиг. 11 показан тот же самый образец защиты почки, который показан на Фиг. 10 для печени.
На Фиг. 12, как и ожидалось, холодные условия без применения ультразвука (условие 1) и использование UW раствора повышают защиту печеночного трансплантата примерно на 30% по сравнению с консервацией с помощью UW при 4°C и при комнатной температуре (20-25°C). Неожиданно защита, полученная по условию 2 (UW раствор в присутствии ультразвука и при комнатной температуре) лучше, чем защита из условия 1 (UW раствор и холод без ультразвука). Другими словами, в присутствии консервирующего раствора при 4°C лучше применять ультразвук в камере при комнатной температуре, чем при гипотермических условиях (камера при температуре от 2 до 6°C) и без ультразвука. Также являются неожиданными результаты, указывающие на то, что защита, полученная при условии 3 (без консервирующего раствора, в холодных условиях и с ультразвуком) лучше, чем защита, полученная в условиях 1 и 2. Эти результаты указывают на то, что лучше сочетать ультразвук и холодные условия (даже без присутствия консервирующего раствора), чем сочетать присутствие консервирующего раствора с холодными условиями (условие 1) или с ультразвуком (условие 2). Условия 4 и 5 показывают ожидаемую и наблюдаемую защиту, соответственно, при использовании UW раствора, ультразвука и холодных условий. Ожидаемая защита была бы в лучшем случае суммой защиты, полученной в условии 1, и защиты, полученной в условии 2. Другими словами, из-за теплового эффекта, вызванного ультразвуком, защита 1 + 2, как бы не ожидали, соответствует сумме условий 1 и 2, рассматриваемых отдельно. Однако эти результаты не наблюдали. Полученные результаты показали синергический эффект, когда сочетают обе обработки (холодные условия и ультразвук), потому что защита, полученная, когда сочетают обе обработки, намного лучше, чем сумма защит, полученных, когда обе обработки применяют раздельно. Кроме того, защита, полученная, когда сочетают обе обработки и в присутствии консервирующего раствора, намного лучше, чем защита, полученная, когда сочетают обе обработки без консервирующего раствора (условие 3).
На Фиг. 13 показан тот же самый образец защиты почки, который показан на Фиг. 5 для печени.
Соответственно, принимая во внимание все результаты, сочетание консервирующего раствора, ультразвука и холодных условий может быть чрезвычайно эффективной стратегией транспортировки и консервации органов во время холодовой ишемии.
Предлагается способ и оборудование для транспортировки и хранения биологических образцов в условиях гипотермии и без доставки кислорода в лучших условиях, чем те, которые доступны в настоящее время, и с эффективной передачей ультразвука органу или ткани внутри камеры. Все это позволяет уменьшить вредные эффекты холодовой ишемии и повысить жизнеспособность трансплантатов до того, как их имплантируют реципиенту, тем самым, предотвращая быть связанным с другим трансплантатом.
Оборудование и способ консервации также могут быть полезны во вторичных органах; количество органов, доступных для трансплантата, может соответственно увеличиваться, тем самым, уменьшая список ожидающих. Кроме того, поскольку повреждения, вызванные холодовой ишемией во время консервации и транспортировки органов, уменьшаются, время, в течение которого органы транспортируют в холодильную камеру до тех пор, пока их имплантируют реципиенту, может быть увеличено. Кроме того, оборудование легко транспортируется, чтобы предотвратить наряду с другими факторами логистические сложности, вызванные динамической консервацией органа.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВОДНЫЙ РАСТВОР ДЛЯ КОНСЕРВАЦИИ ТКАНЕЙ И ОРГАНОВ | 2009 |
|
RU2479999C2 |
| УСТРОЙСТВО ДЛЯ КОНСЕРВАЦИИ ПЕЧЕНОЧНОГО ТРАНСПЛАНТАТА В УСЛОВИЯХ НОРМОТЕРМИИ | 2009 |
|
RU2489855C2 |
| УСТРОЙСТВО ДЛЯ КОНСЕРВАЦИИ ДОНОРСКИХ ОРГАНОВ | 2020 |
|
RU2741219C1 |
| Способ экстракорпоральной гибкой лазерной литотрипсии трупной донорской почки в условиях холодовой ишемии | 2024 |
|
RU2823461C1 |
| СПОСОБ КОНСЕРВАЦИИ ПЕЧЕНИ ПРИ ТРАНСПЛАНТАЦИИ | 2011 |
|
RU2482674C1 |
| Способ прогнозирования риска возникновения ранней дисфункции трансплантата трупной печени | 2021 |
|
RU2765462C1 |
| СПОСОБ КОНСЕРВАЦИИ ДОНОРСКОГО СЕРДЦА | 2020 |
|
RU2743235C1 |
| РАСТВОР ДЛЯ КОНСЕРВАЦИИ ОРГАНОВ | 2024 |
|
RU2840731C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЧЕЧНЫХ ТРАНСПЛАНТАТОВ ОТ ДОНОРОВ С ВНЕГОСПИТАЛЬНОЙ ОСТАНОВКОЙ КРОВООБРАЩЕНИЯ | 2023 |
|
RU2821024C1 |
| УСТРОЙСТВО ЭКСТРАКОРПОРАЛЬНОЙ АППАРАТНОЙ ПЕРФУЗИИ ДОНОРСКИХ ОРГАНОВ ВНУТРИ ТЕЛА ДОНОРА | 2014 |
|
RU2570391C1 |
Изобретение относится к устройству для транспортировки и консервации вне организма биологического образца и соответствующему способу. Устройство (1) включает в себя камеру (2) для содержания биологического образца (100), ограниченную стенками (4), выполненными из теплоизоляционного материала. Кроме того, устройство включает в себя охлаждающие средства (6), которые поддерживают температуру внутри камеры (2) ниже температуры снаружи устройства (1) и ультразвуковую систему, выполненную с возможностью генерирования и приложения ультразвука на биологический образец (100). Изобретение также предлагает способ транспортировки и консервации, который сочетает применение охлаждения и ультразвука. Предлагаемое устройство обеспечивает уменьшение повреждения клеток в биологическом образце. 3 н. и 17 з.п. ф-лы, 21 ил.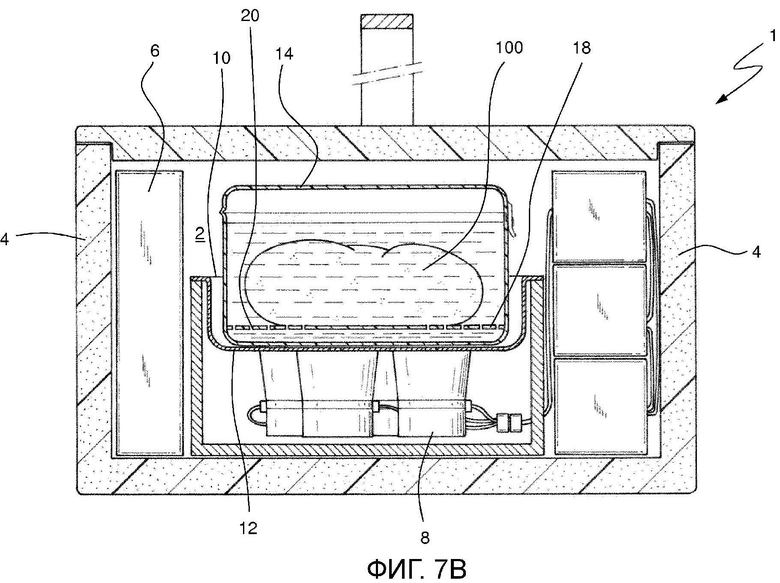
1. Устройство (1) для транспортировки и консервации вне организма биологического образца (100) для последующего трансплантата в живого человека или животное, включающее в себя камеру (2) для содержания упомянутого биологического образца (100), ограниченную стенками (4), выполненными из теплоизоляционного материала и охлаждающие средства (6) для поддержания температуры внутри упомянутой камеры (2) ниже температуры снаружи упомянутого устройства (1),
отличающееся тем, что оно дополнительно содержит вспомогательный контейнер (14) для содержания консервирующего раствора без внешней подачи кислорода и для содержания упомянутого биологического образца (100), погруженного в упомянутый консервирующий раствор, и, по меньшей мере, ультразвуковую систему, подходящую для генерирования и приложения ультразвука на упомянутый биологический образец (100).
2. Устройство (1) по п. 1, отличающееся тем, что упомянутый вспомогательный контейнер (14) выполнен с возможностью закрывания.
3. Устройство (1) по п. 1 или 2, отличающееся тем, что упомянутая ультразвуковая система подходит для излучения упомянутого ультразвука с частотой в диапазоне от 25 кГц до 1 МГц и интенсивностью звука в диапазоне от 0,01 до 2 Вт/см2.
4. Устройство (1) по п. 3, отличающееся тем, что упомянутая интенсивность звука находится в диапазоне от 0,02 до 1 Вт/см2 и особенно предпочтительно от 0,02 до 0,1 Вт/см2.
5. Устройство (1) по любому из пп. 1-4, отличающееся тем, что упомянутые охлаждающие средства (6) пригодны для поддержания температуры внутри упомянутой камеры (2) от 0 до 15°С.
6. Устройство (1) по п. 5, отличающееся тем, что упомянутые охлаждающие средства (6) выполнены с возможностью поддержания температуры внутри упомянутой камеры (2) от 2 до 10°С и в частности предпочтительно от 2 до 6°С.
7. Устройство (1) по любому из пп. 1-6, отличающееся тем, что в упомянутой камере (2) оно содержит листовую опору (10), выполненную с возможностью поддержания упомянутого закрываемого вспомогательного контейнера (14), содержащего упомянутый биологический образец (100), при этом упомянутая листовая опора (10) выполнена с возможностью свободного вибрирования при приложении упомянутого ультразвука, при этом упомянутая ультразвуковая система содержит, по меньшей мере, один преобразователь (8), установленный на, по меньшей мере, одной из стенок (4) упомянутой листовой опоры (10).
8. Устройство (1) по п. 7, отличающееся тем, что упомянутый, по меньшей мере, один преобразователь (8) установлен на лицевой стороне упомянутой листовой опоры (10) напротив опорной поверхности (12) для упомянутого биологического образца (100) для приложения упомянутого ультразвука по направлению к упомянутой опорной поверхности (12).
9. Устройство (1) по п. 7 или 8, отличающееся тем, что упомянутая листовая опора (10) выполнена из металла.
10. Устройство (1) по любому из пп. 7-9, отличающееся тем, что листовая опора (10) представляет собой лоток, предназначенный для содержания в нем жидкости.
11. Устройство (1) по п. 10, отличающееся тем, что листовая опора (10) представляет собой лоток, выполненный с возможностью содержания в нем воды.
12. Устройство (1) по любому из пп. 1-11, отличающееся тем, что упомянутый вспомогательный контейнер (14) содержит второе дно (18), отстоящее от основания упомянутого вспомогательного контейнера (14), и упомянутое второе дно (18) сообщается по текучей среде с остальной частью вспомогательного контейнера (14).
13. Способ для транспортировки и консервации вне организма биологического образца (100) для последующего трансплантата в живого человека или животное, отличающийся тем, что согласно способу:
[a] удаляют кровь из упомянутого биологического образца (100) в холодных условиях и быстро охлаждают упомянутый биологический образец (100),
[b] хранят упомянутый биологический образец (100), погруженным в консервирующий раствор без внешней доставки кислорода путем помещения упомянутого биологического образца, погруженного во вспомогательный контейнер (14), содержащий упомянутый консервирующий раствор, и помещения вспомогательного контейнера (14) в камеру (2), ограниченную стенками (4), выполненными из теплоизоляционного материала и
[c] облучают упомянутый образец ультразвуком.
14. Способ по п. 13, отличающийся тем, что упомянутый вспомогательный контейнер (14) выполнен с возможностью закрывания.
15. Способ по п. 13 или 14, отличающийся тем, что при облучении упомянутого биологического образца (100) ультразвук имеет частоты в диапазоне от 25 кГц до 1 МГц и интенсивность звука в диапазоне от 0,01 до 2 Вт/см2.
16. Способ по п. 15, отличающийся тем, что упомянутый ультразвук имеет интенсивность в диапазоне от 0,02 до 1 Вт/см2 и особенно предпочтительно от 0,02 до 0,1 Вт/см2.
17. Способ по любому из пп. 13-16, отличающийся тем, что согласно способу дополнительно охлаждают камеру (2) до температуры в упомянутой камере (2) от 0 до 15°С.
18. Способ по п. 17, отличающийся тем, что при охлаждении температура в упомянутой камере (2) поддерживается от 2 до 10°С, и в частности предпочтительно от 2 до 6°С.
19. Способ по любому из пп. 13-18, отличающийся тем, что согласно способу дополнительно размещают упомянутый вспомогательный контейнер (14) на листовой опоре (10), которая представляет собой лоток, выполненный с возможностью содержания в нем жидкости, при этом упомянутый лоток выполнен с возможностью свободного вибрирования при приложении ультразвука.
20. Применение устройства (1) для транспортировки и консервации вне организма биологического образца (100) по любому из пп. 1-12 для сохранения биологического образца, предназначенного для последующего лабораторного исследования.
| US 6673594 B1, 06.01.2004 | |||
| WO 2007143715 A2, 13.12.2007 | |||
| WO 2011071727 A2, 16.06.2011 | |||
| ТРАНСПОРТАБЕЛЬНЫЙ КОНТЕЙНЕР ЗАКРЫТОЙ СИСТЕМЫ ДЛЯ ХРАНЕНИЯ БИОЛОГИЧЕСКОГО МАТЕРИАЛА | 1990 |
|
RU2079273C1 |
| Устройство для консервации органов и тканей | 1986 |
|
SU1400575A1 |
Авторы
Даты
2019-09-30—Публикация
2015-12-18—Подача