Объектом настоящего изобретения является способ прогнозирования риска развития рака у индивидуума, который не страдает раком, или альтернативно этому диагностирования рака у индивидуума, заключающийся в том, что:
- определяют уровень протахикинина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма, взятой у указанного индивидуума, и
- устанавливают корреляцию указанного уровня протахикинина или его фрагментов с риском развития рака, при этом пониженный уровень является прогностическим критерием повышенного уровня развития рака, или альтернативно этому диагностирования рака, при этом повышенный уровень коррелирует с диагнозом рака.
Вещество Р (SP) представляет собой нейропептид: ундекапептид, функционирующий в качестве нейромедиатора и нейромодулятора. Он относится к нейропептидам семейства тахикининов. Вещество Р и его близкородственный нейропептид нейрокинин A (NKA) образуются из полипротеина-предшественника после дифференциального сплайсинга гена пре-протахикинина А. В ЦНС вещество Р участвует в системе передачи боли.
Вещество Р играет роль в воспалительных процессах (Ang и др., 2011) и обладает антиапоптозной активностью в раковых клетках (Munoz и др., 2005).
Рецептор вещества Р (рецептор нейрокинина-1) играет решающую роль в развитии рака (Fries и др., 2003; Munoz и др., 2010; Rameshwar, 2007; Schulz и др., 2006). Блокирование пути вещества Р существенно снижает рост опухолевых клеток in vitro (см. обзор Munoz и Rossow, 2009).
У Belting и др., Cancer, Epidemiology, Biomarkes & Prevention описано применение вазоактивных пептидов для прогнозирования риска развития рака у мужчин. Было проведено измерение уровней MR-про-ANP, MR-про-ADM и копептина натощак в плазме у участников проводившегося университетом г. Мальме исследования по изучению диеты и рака ( Diet and Cancer Study), которые не страдали раком до проводившегося в период с 1991 по 1994 г. обследования для определения исходного уровня (1768 мужчин и 2293 женщины). Авторы установили, что у женщин не было выявлено связи между биомаркерами и возникновением рака.
Diet and Cancer Study), которые не страдали раком до проводившегося в период с 1991 по 1994 г. обследования для определения исходного уровня (1768 мужчин и 2293 женщины). Авторы установили, что у женщин не было выявлено связи между биомаркерами и возникновением рака.
В основу настоящего изобретения была положена задача исследовать прогностическую и диагностическую мощность протахикинина для прогнозирования возникновения рака и прогнозирования риска рецидива рака. Для этой цели в ходе указанного выше шведского проспективного группового исследования ( Diet and Cancer Study) проводили измерения уровней стабильных фрагментов протахикинина (Ernst и др., 2006) в плазме натощак и соотносили исходный уровень указанного биомаркера с возникновением рака молочной железы в течение последующего 15-летнего периода наблюдения.
Diet and Cancer Study) проводили измерения уровней стабильных фрагментов протахикинина (Ernst и др., 2006) в плазме натощак и соотносили исходный уровень указанного биомаркера с возникновением рака молочной железы в течение последующего 15-летнего периода наблюдения.
При создании изобретения неожиданно было установлено, что протахикинин является эффективным и высоко значимым биомаркером, позволяющим прогнозировать риск развития рака у индивидуума, не страдающего раком, или альтернативно этому диагностировать рак у индивидуума.
Таким образом, объектом настоящего изобретения является способ прогнозирования развития рака у индивидуума, который не страдает раком, или альтернативно этому диагностирования рака у индивидуума, заключающийся в том, что:
- определяют уровень протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма, взятой у указанного индивидуума, и
- устанавливают корреляцию между указанным уровнем протахикинина, его сплайсинговых вариантов или фрагментов и риском развития рака, при этом пониженный уровень является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень коррелирует с диагнозом рака.
В другом объекте изобретения указанный способ дополнительно заключается в том, что осуществляют следующие стадии, на которых:
- дополнительно определяют уровень пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и
- дополнительно устанавливают корреляцию между указанным уровнем пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, и риском развития рака, при этом повышенный уровень пронейротензина или его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом повышенный уровень пронейротензина или его фрагментов коррелирует с диагнозом рака.
Согласно другому варианту осуществления изобретения указанные выше способы могут дополнительно включать следующие стадии, на которых:
- дополнительно определяют уровень проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и
- дополнительно устанавливают корреляцию между указанным уровнем проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, и риском развития рака, при этом пониженный уровень проэнкефалина или его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень проэнкефалина или его фрагментов коррелирует с диагнозом рака.
Согласно другому варианту осуществления изобретения указанные выше способы могут дополнительно включать следующие стадии, на которых:
- дополнительно определяют уровень инсулина в общей воде организма, взятой у указанного индивидуума, и
- дополнительно устанавливают корреляцию между указанным уровнем инсулина и риском развития рака, при этом пониженный уровень инсулина является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень инсулина коррелирует с диагнозом рака.
Таким образом, способы, предлагаемые в настоящем изобретении, заключаются в том, что определяют уровень протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма и необязательно могут дополнительно заключаться в том, что осуществляют по меньшей мере одно дополнительное определение и установление дополнительной корреляции с риском развития рака, выбранное из группы, включающей:
- определение уровня пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, и
- определение уровня проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, и
- определение уровня инсулина.
В одном из вариантов осуществления изобретения помимо протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, дополнительно определяют по меньшей мере один из указанных выше дополнительных биомаркеров и дополнительно устанавливают корреляцию с указанным риском развития рака. В одном из вариантов осуществления изобретения помимо протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, дополнительно определяют по меньшей мере два из указанных выше дополнительных биомаркеров и дополнительно устанавливают корреляцию с указанным риском развития рака. В одном из вариантов осуществления изобретения определяют все четыре указанных биомаркера.
В одном из конкретных вариантов указанных выше способов, в которых в дополнение к протахикинину, его сплайсинговым вариантам или его фрагментам, состоящим по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, определяют другие биомаркеры и устанавливают корреляцию с указанным риском, выражение «дополнительно устанавливают корреляцию» означает проведение объединенного анализа измеренных уровней биомаркеров путем учета относительных факторов риска развития рака, полученных с использованием индивидуальных биомаркеров.
Объединенный анализ более чем одного маркера осуществляют согласно процедуре, описанной в примере 5. Специалисту в данной области известны статистические методы, с помощью которых можно осуществлять объединенный анализ более чем одного маркера или параметра.
В одном из вариантов указанных выше способов пониженный уровень протахикинина, его сплайсинговых вариантов или его фрагментов представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 100 пмолей/л или менее, предпочтительно примерно 80 пмолей/л или менее, предпочтительно примерно 60 пмолей/л или менее, предпочтительно примерно 50 пмолей/л или менее, предпочтительно примерно 45,6 пмолей/л или менее, предпочтительно примерно 40 пмолей/л.
В одном из вариантов указанных выше способов повышенный уровень пронейротензина или его фрагментов представляет собой уровень, находящийся выше порогового значения, где указанное пороговое значение составляет примерно 78 пмолей/л или более, предпочтительно примерно 100 пмолей/л или более, более предпочтительно примерно 150 пмолей/л.
В одном из вариантов указанных выше способов пониженный уровень проэнкефалина или его фрагментов представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 100 пмолей/л или менее, предпочтительно примерно 75 пмолей/л или менее, предпочтительно примерно 50 пмолей/л или менее, предпочтительно примерно 40,4 пмолей/л.
В одном из вариантов указанных выше способов пониженный уровень инсулина представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 70 пмолей/л.
Пороговые значения следует рассматривать в контексте применяемого метода калибровки, и указанные выше пороговые значения следует рассматривать в контексте анализов и методов калибровки, применявшихся в представленных в настоящем описании примерах 1, 3 и 4.
В одном из конкретных вариантов осуществления изобретения указанный индивидуум представляет собой женщину. В одном из конкретных вариантов осуществления изобретения указанный индивидуум представляет собой женщину, и указанный рак представляет собой рак молочной железы.
В одном из конкретных вариантов осуществления изобретения указанный рак представляет собой рак легкого.
Другие примеры видов рака можно выбирать из группы, состоящей из рака молочной железы, рака легкого, рака поджелудочной железы и рака ободочной кишки.
В настоящем описании понятия протахикинин и протахикинин А (РТА) используют как синонимы. Понятие включает все сплайсинговые варианты протахикинина А, а именно, αРТА, βРТА, γРТА и δРТА. Следует понимать, что в контексте настоящего описания под понятие «фрагменты протахикинина» подпадают также вещество Р и нейрокинин.
Понятие «определяют уровень протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин» означает, как правило, что определяют, иммунореактивность в отношении области, находящейся внутри указанных выше молекул. Это означает, что не является обязательным избирательно измерять определенный фрагмент. Следует понимать, что связывающая молекула, которую используют для определения уровня протахикинина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, связывается с любым фрагментом, который содержит область, связывающуюся с указанной связывающей молекулой. Указанная связывающая молекула может представлять собой антитело или фрагмент антитела, или не-IgG-каркас.
Таким образом, в одном из вариантов осуществления изобретения объектом настоящего изобретения является определение предрасположенности мужчины или женщины к возникновению рака, например, рака молочной железы, рака легкого и т.д.
Данные, полученные в исследовании, проведенном университетом Мальме, позволили выявить корреляцию между риском развития рака у индивидуумов мужского пола и уровнем протахикинина, его сплайсинговых вариантов или его фрагментов в общей воде организма, взятой у указанного индивидуума мужского пола; однако эта корреляция, полученная для имевшегося в распоряжении набора данных, не была статистически значимой, хотя имелась выраженная тенденция к повышенному риску развития рака при пониженных уровнях протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, также и у мужчин. Таким образом, способ, предлагаемый в изобретении, имеет ценность также и для индивидуумов мужского пола, однако выявленный при проведении рассматриваемого исследования эффект для мужчин был не таким выраженным, как для женщин. Это может быть обусловлено в основном тем, что в мужской популяции было малое количество случаев рака.
В контексте настоящего описания понятие «индивидуум» относится к живому человеку или организму кроме человека. Предпочтительно в контексте настоящего описания индивидуум представляет собой человека.
Понятие «пониженный уровень» означает уровень, находящийся ниже определенного порогового уровня. Понятие «повышенный уровень» означает уровень, находящийся выше определенного порогового уровня. Общую воду организма можно выбирать из группы, включающей кровь, сыворотку, плазму, мочу, спинномозговую жидкость (СМЖ) и слюну.
В конкретном варианте осуществления изобретения указанная общая вода организма представляет собой кровь, сыворотку или плазму.
В одном из вариантов осуществления изобретения у указанного индивидуума никогда не диагностировали рак до момента времени взятия у указанного индивидуума образца общей воды организма.
В другом варианте осуществления изобретения у указанного индивидуума был ранее диагностирован рак, и он был излечен к моменту времени взятия у указанного индивидуума образца общей воды организма, и у него определяют риск рецидива развития рака или альтернативно этому прогнозируют рецидив рака.
Протахикинин может иметь следующую(ие) последовательность(и):
SEQ ID NO: 1 (протахикинин А (1-107)

Фрагменты протахикинина, которые можно определять в общей воде организма, можно выбирать, например, из группы следующих фрагментов:
SEQ ID NO: 2 (протахикинин 1-37, Р37)
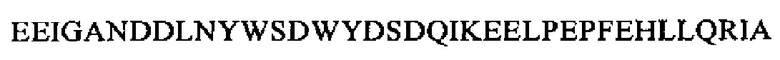
SEQ ID NO: 3 (вещество P)
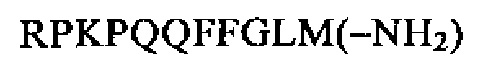
SEQ ID NO: 4 (нейропептид К)
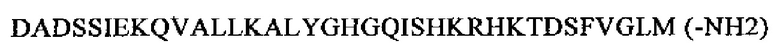
SEQ ID NO: 5 (нейропептид гамма)
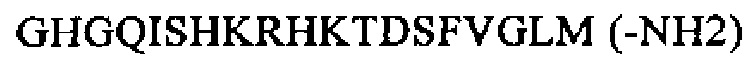
SEQ ID NO: 6 (нейрокинин-1)
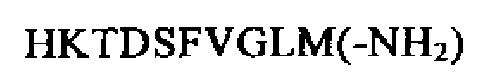
SEQ ID NO: 7 (С-концевой фланкирующий пептид, РТА 1 92-107)
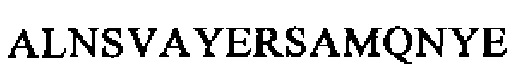
SEQ ID NO: 8 (изоформа альфа РТА)

SEQ ID NO: 9 (изоформа бета РТА)
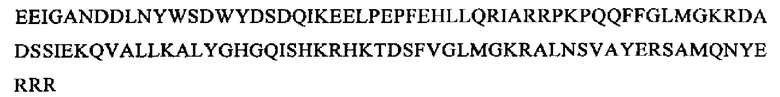
SEQ ID NO: 10 (изоформа дельта РТА)
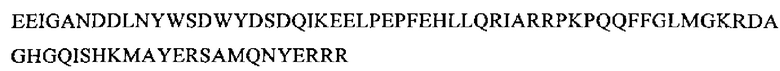
SEQ ID NO: 11 (изоформа гамма РТА)

SEQ ID NO: 12 (PTA3-22)
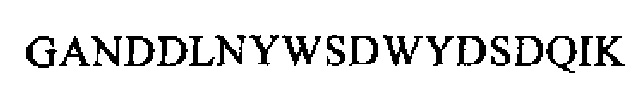
SEQ ID NO: 13 (РТА 21-36)

Определение уровня РТА, его сплайсинговых вариантов или его фрагментов может означать, что определяют иммунореактивность в отношении РТА или его фрагментов, включая вещество Р и нейрокинин. Связывающая молекула, которую применяют для определения РТА, его сплайсинговых вариантов или его фрагментов, в зависимости от области связывания может связываться более чем с одной из указанных выше молекул. Это должно быть очевидно специалисту в данной области.
В более конкретном варианте осуществления способа, предлагаемого в настоящем изобретении, определяют уровень Р37 (РТА 1-37, SEQ ID NO: 2, 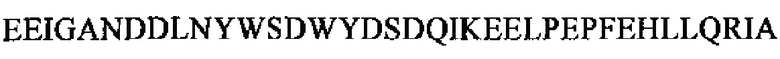 . В еще более конкретном варианте осуществления способа, предлагаемого в настоящем изобретении, применяют по меньшей мере одну или две связывающие молекулы, которые связываются с РТА 1-37, SEQ ID NO: 2,
. В еще более конкретном варианте осуществления способа, предлагаемого в настоящем изобретении, применяют по меньшей мере одну или две связывающие молекулы, которые связываются с РТА 1-37, SEQ ID NO: 2, 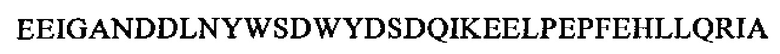 , в случае использования более чем одной связывающей молекулы они предпочтительно связываются с двумя различными областями в РТА 1-37, SEQ ID NO: 2,
, в случае использования более чем одной связывающей молекулы они предпочтительно связываются с двумя различными областями в РТА 1-37, SEQ ID NO: 2, 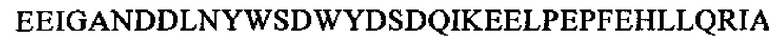 . Указанная(ые) связывающая(ие) молекула(ы) предпочтительно может(гут) представлять собой антитело или его связывающий фрагмент.
. Указанная(ые) связывающая(ие) молекула(ы) предпочтительно может(гут) представлять собой антитело или его связывающий фрагмент.
В еще более конкретном варианте осуществления изобретения для определения РТА, его вариантов и фрагментов применяют связывающую(ие) молекулу(ы), которая(ые) связывается(ются) с одной или обеими из следующих областей в РТА 1-37 соответственно:

В конкретном варианте осуществления изобретения уровень РТА, его сплайсинговых вариантов или его фрагментов измеряют с помощью иммуноанализа с использованием антител или фрагментов антител, которые связываются с РТА, его сплайсинговыми вариантами или его фрагментами. Иммуноанализ, который можно применять для определения уровня РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, может включать стадии, описанные в примере 1. Все пороговые значения и величины должны рассматриваться в контексте теста и калибровки, которые применяли в примере 1. Специалисту в данной области должно быть известно, что абсолютная величина порогового значения может зависеть от применяемой калибровки. Это означает, что все величины и пороговые значения, представленные в настоящем описании, следует рассматривать в контексте использованной в настоящем описании калибровки (пример 1).
Согласно изобретению диагностическую связывающую молекулу, которая связывается с РТА или другими дополнительными биомаркерами, выбирают из группы, включающей антитела, например, IgG, как правило, полноразмерный иммуноглобулин, или фрагменты антител, содержащие по меньшей мере вариабельный (Fv) домен тяжелой и/или легкой цепи, такие, например, как химически сшитые антитела (антигенсвязывающие фрагменты), включая (но, не ограничиваясь только ими) Fab-фрагменты, включая миниантитела в виде Fab, антитело в виде одноцепочечного Fab, одновалентное антитело в виде Fab с эпитопными метками, например, Fab-V5S×2; двухвалентный Fab (мини-антитело), димеризованный с помощью СН3-домена; двухвалентный Fab или многовалентный Fab, например, образованный посредством мультимеризации с помощью гетерологичного домена, например, посредством димеризации dHLX-доменов, например, Fab-dHLX-FS×2; F(ab')2-фрагменты, scFv-фрагменты, мультимеризованные многовалентные и/или мультиспецифические scFv-фрагменты, двухвалентные и/или биспецифические димерные антитела (диабоди), BITE® (биспецифический активатор Т-клеток), три функциональные антитела, многовалентные антитела, например, класса, отличного от G-класса; однодоменные антитела, например, наноантитела, выведенные из верблюжьих или рыбьих иммуноглобулинов.
В конкретном варианте осуществления изобретения уровень РТА, его сплайсинговых вариантов или его фрагментов, или других дополнительных биомаркеров измеряют с помощью анализа с использованием связывающих молекул, выбранных из группы, включающей аптамеры, He-Ig-каркасы, как более подробно описано ниже, которые связываются с РТА, его сплайсинговыми вариантами или его фрагментами, или с дополнительными биомаркерами.
Связывающая молекула, которую можно применять для определения уровня РТА, его сплайсинговых вариантов или его фрагментов, характеризуется константой аффинности к РТА, его сплайсинговым вариантам или его фрагментам, составляющей по меньшей мере 107М-1, предпочтительно 108М-1, предпочтительно константа аффинности превышает 109М-1, наиболее предпочтительно превышает 1010М-1. Специалисту в данной области известно, что для компенсации пониженной аффинности можно рассматривать применение соединений в более высокой дозе, и этот подход не выходит за рамки объема изобретения. Аффинность связывания можно определять с помощью метода Biacore, доступного в виде сервисного анализа, например, на сайте фирмы Biaffin, Кассель, Германия (http://www.biaffin.com/de/).
Константы аффинности
Для оценки аффинности антител определяли кинетические характеристики связывания РТА, его сплайсинговых вариантов или его фрагментов с иммобилизованным антителом с помощью поверхностного плазмонного резонанса без применения метки с использованием системы Biacore 2000 (фирма GE Healthcare Europe GmbH, Фрейбург, Германия). Обратимую иммобилизацию антител осуществляли с использованием антитела к мышиной Fc-области, ковалентно сшитого с высокой плотностью с поверхностью сенсора СМ5, согласно инструкциям производителя (набор для захвата мышиного антитела; фирма GE Healthcare) (Lorenz и др., «Functional Antibodies Targeting IsaA of Staphylococcus aureus Augment Host Immune Response and Open New Perspectives for Antibacterial Therapy»; Antimicrob Agents Chemother., 55(1), январь 2011 г., cc. 165-173).
Контрольный образец человеческого РТА можно получать от фирмы ICI-Diagnostics, Берлин, Германия (http://www.ici-diagnostics.com/). При проведении анализа калибровку можно осуществлять с использованием синтетического (для экспериментов, проведенных при создании настоящего изобретения, применяли синтетический Р37, SEQ ID NO: 2) или рекомбинантного РТА, его сплайсинговых вариантов или его фрагментов.
Пороговое значение для РТА, его сплайсинговых вариантов или его фрагментов для определения риска возникновения рака молочной железы у женщины или диагностирования рака молочной железы у женщины согласно способам, предлагаемым в настоящем изобретении, составляет менее 100 пмолей/л, предпочтительно менее 80 пмолей/л, предпочтительно менее 60 пмолей/л, предпочтительно менее 50 пмолей/л, предпочтительно менее 45,6 пмолей/л, предпочтительно менее 40 пмолей/л. Указанные пороговые значения соответствуют значениям, определенным с использованием указанного выше метода калибровки. Если уровень РТА находится ниже указанного порогового значения, то это означает, что индивидуум имеет повышенный риск возникновения рака или уже имеет рак.
В одном из вариантов осуществления изобретения указанный способ осуществляют более одного раза для мониторинга риска возникновения рака молочной железы у женщины или для мониторинга процесса лечения. В одном из конкретных вариантов осуществления изобретения указанный мониторинг осуществляют для того, чтобы оценивать ответ указанной женщины на предпринятые профилактические и/или терапевтические меры.
В одном из вариантов осуществления изобретения способ применяют для стратификации указанных индивидуумов на группы риска.
Объектом настоящего изобретения является также анализ для определения РТА, его сплайсинговых вариантов или его фрагментов в образце, включающий применение двух связывающих молекул, которые связываются с двумя различными областями в области РТА, которая содержит аминокислоты 3-22 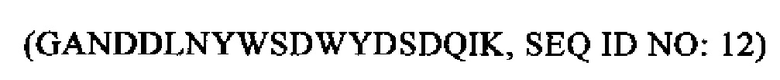 и аминокислоты 21-36
и аминокислоты 21-36 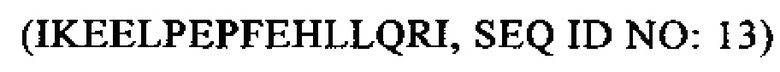 , где каждая из указанных областей содержит по меньшей мере 4 или 5 аминокислот.
, где каждая из указанных областей содержит по меньшей мере 4 или 5 аминокислот.
В одном из вариантов анализов для определения РТА, его сплайсинговых вариантов или его фрагментов в образце, согласно настоящему изобретению аналитическая чувствительность указанного анализа позволяет количественно оценивать уровень РТА, его сплайсинговых вариантов или его фрагментов у здоровых индивидуумов и составляет < 20 пмолей/л, предпочтительно < 10 пмолей/л и более предпочтительно < 5 пмолей/л.
В одном из вариантов анализов для определения РТА, его сплайсинговых вариантов или его фрагментов в образце, согласно настоящему изобретению такой анализ представляет собой сэндвич-иммуноанализ, предпочтительно полностью автоматический анализ. Он может представлять собой ELISA, полностью автоматический анализ или выполняемый вручную анализ. Он может представлять собой так называемый РОС-тест (анализ по месту лечения, point-of-care). Примерами автоматических или полностью автоматических анализов являются анализы, которые можно применять с использованием одной из следующих систем: Roche Elecsys®, Abbott Architect®, Siemens Centauer®, Brahms Kryptor®, Biomerieux Vidas®, Alere Triage®. Примеры форматов тестов представлены выше.
В одном из вариантов анализов для определения согласно настоящему изобретению уровня РТА, его сплайсинговых вариантов или его фрагментов в образце по меньшей мере одну из указанных двух связывающих молекул метят для целей обнаружения. Примеры меток представлены выше.
В одном из вариантов анализов для определения согласно настоящему изобретению РТА, его сплайсинговых вариантов или его фрагментов в образце по меньшей мере одну из указанных двух связывающих молекул связывают с твердой фазой. Примерами твердых фаз являются магнитные гранулы, полистироловые пробирки или микропланшеты. В одном из вариантов осуществления изобретения применяют гомогенный анализ, а именно, применяют технологии усиленного излучения криптата с временным разрешением (Time Resolved Amplified Cryptate Emission (TRACE)).
В одном из вариантов анализов для определения согласно настоящему изобретению уровня РТА, его сплайсинговых вариантов или его фрагментов в образце указанную метку выбирают из группы, включающей хемилюминиецентную метку, ферментную метку, флуоресцентную метку, метку, представляющую собой радиоактивный йод.
Другим объектом настоящего изобретение является набор, содержащий систему анализа, предлагаемого в настоящем изобретении, где компоненты указанной системы анализа могут содержаться в одном или нескольких контейнерах.
Объектом настоящего изобретения является также способ прогнозирования риска развития рака у женщины или идентификации индивидуума, имеющего повышенный риск развития рака, согласно одному из предыдущих вариантов осуществления изобретения, в котором применяют уровень РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, либо индивидуально, либо в сочетании с другими пригодными для прогнозирования лабораторными или клиническими параметрами, для прогнозирования риска возникновения у индивидуума нежелательного явления с помощью способа, который можно выбирать из следующих альтернатив:
- сравнение медианы уровня РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и предварительно определенного уровня в совокупности образцов, взятых из популяции «здоровых» или «по-видимому, здоровых» индивидуумов,
- сравнение квантиля уровня РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и предварительно определенного уровня в совокупности образцов, взятых из популяции «здоровых» или «по-видимому, здоровых» индивидуумов,
- расчет на основе анализа пропорциональных рисков Кокса или расчетов коэффициентов риска, таких как NRI (чистый коэффициент переклассификации, Net Reclassification Index) или IDI (интегральный индекс дискриминации, Integrated Discrimination Index).
В одном из вариантов осуществления изобретения объектом изобретения является также способ прогнозирования риска развития рака у женщины или идентификации индивидуума, имеющего повышенный риск развития рака, по одному из предыдущих вариантов осуществления изобретения, в котором уровень РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, применяют либо индивидуально, либо в сочетании с другими прогностическими биомаркерами.
Таким пригодным дополнительным биомаркером может служить пронейротензин и его фрагменты, состоящие по меньшей мере из 5 аминокислот, или проэнкефалин и его фрагменты, состоящие по меньшей мере из 5 аминокислот, или инсулин.
В одном из конкретных вариантов способа, предлагаемого в настоящем изобретении, определяют уровень пронейротензина 1-117 или его фрагментов в дополнение к определению РТА, его сплайсинговых вариантов или его фрагментов.
Когда в настоящем описании упоминаются фрагменты, то следует иметь в виду, что указанные фрагменты состоят по меньшей мере из четырех или пяти аминокислот.
Таким образом, объектом настоящего изобретения является также способ прогнозирования риска развития рака у индивидуума, который не страдает раком, или альтернативно этому диагностирования рака у индивидуума, заключающийся в том, что:
определяют уровень РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма, взятой у указанного индивидуума; и
определяют уровень пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума; и
устанавливают корреляцию между указанным уровнем РТА, его сплайсинговых вариантов или его фрагментов и пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, с риском развития рака, при этом пониженный уровень РТА, его сплайсинговых вариантов или его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень РТА, его сплайсинговых вариантов или его фрагментов коррелирует с диагнозом рака, и при этом повышенный уровень пронейротензина и его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом повышенный уровень пронейротензина и его фрагментов коррелирует с диагнозом рака.
Пронейротензин и его фрагменты могут иметь следующую последовательность:
SEQ ID NO: 14 (пронейротензин 1-147)

SEQ ID NO: 15 (пронейротензин 1-125 (большой нейромедин N))
SEQ ID NO: 16 (нейромедин N)
SEQ ID NO: 17 (нейротензин)

SEQ ID NO: 18 (пронейротензин 1-117)
SEQ ID NO: 19 (пронейротензин 1-132)

SEQ ID NO: 20 (пронейротензин 120-140)
SEQ ID NO: 21 (пронейротензин 120-147)
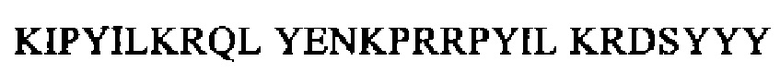
SEQ ID NO: 22
(пронейротензин 128-147)
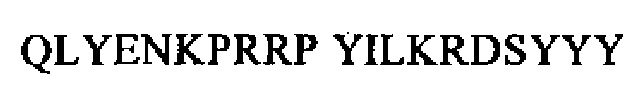
В конкретном варианте осуществления изобретения уровень пронейротензина измеряют с помощью иммуноанализа. Более конкретно, применяют иммуноанализ, описанный у Ernst и др. (Peptides, (27), 2006, сс.1787-1793). Иммуноанализ, который можно применять для определения уровня пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, может включать стадии, описанные в примере 3. Все пороговые значения и величины должны рассматриваться в контексте теста и калибровки, которые применяли в примере 3. Специалисту в данной области должно быть известно, что абсолютная величина порогового значения может зависеть от применяемой калибровки. Это означает, что все величины и пороговые значения, представленные в настоящем описании, следует рассматривать в контексте использованной в настоящем описании калибровки (пример 3). Человеческий пронейротензин-калибратор можно получать от фирмы ICI-Diagnostics, Берлин, Германия. Альтернативно этому анализ можно калибровать также с использованием синтетического или рекомбинантного P-NT 1-117 или его фрагментов (см. также Ernst и др., 2006).
Связывающая молекула, которую можно применять для определения уровня пронейротензина или его фрагментов, характеризуется константой аффинности к пронейротензину или его фрагментам, составляющей по меньшей мере 107М-1, предпочтительно 108М-1, предпочтительно константа аффинности превышает 109М-1, наиболее предпочтительно превышает 1010М-1. Специалисту в данной области известно, что для компенсации пониженной аффинности можно рассматривать применение соединений в более высокой дозе, и этот подход не выходит за рамки объема изобретения. Аффинность связывания можно определять с помощью метода Biacore, доступного в виде сервисного анализа, например, на сайте фирмы Biaffin, Кассель, Германия (http://www.biaffin.com/de/), см. также выше.
Пороговое значение для определения риска возникновения рака у индивидуума или диагностирования рака у индивидуума, прежде всего рака молочной железы у женщины согласно способам, предлагаемым в настоящем изобретении, составляет примерно 78 пмолей/л или более, предпочтительно примерно 100 пмолей/л или более, более предпочтительно примерно 150 пмолей/л или более. В конкретном варианте осуществления изобретения указанное пороговое значение составляет примерно 100 пмолей/л или более. Указанные пороговые значения соответствуют значениям, определенным с использованием указанного ниже метода калибровки. Если уровень PNT превышает указанное пороговое значение, то это означает, что индивидуум имеет повышенный риск развития рака или уже имеет рак.
В дополнение к определению уровня РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма, взятой у указанного индивидуума; и/или определению уровня пронейротензина (PNT) или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума; можно измерять уровень проэнкефалина (PENK) или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума. Следует понимать, что в дополнение к определению уровня РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, можно измерять уровень проэнкефалина (PENK) или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума. Это означает, что измеряют уровень РТА либо индивидуально, либо в комбинации с PENK или PNT, или объединяют результаты измерений РТА и PNT, и PENK и устанавливают корреляцию с указанным риском.
В более конкретном варианте способа, предлагаемого в настоящем изобретении, определяют уровень проэнкефалина (PENK) или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в дополнение к определению уровня пронейротензина 1-117 и в дополнение к определению уровня РТА, его сплайсинговых вариантов или его фрагментов.
Таким образом, объектом настоящего изобретения является также способ прогнозирования риска развития рака у индивидуума, который не страдает раком, или альтернативно этому диагностирования рака у индивидуума, заключающийся в том, что:
определяют уровень РТА, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, включая вещество Р и нейрокинин, в общей воде организма, взятой у указанного индивидуума; и
определяют уровень пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума; и/или
определяют уровень проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума; и
устанавливают корреляцию между указанным уровнем РТА, его сплайсинговых вариантов или его фрагментов и пронейротензина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, и/или уровнем проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, с риском развития рака,
при этом пониженный уровень РТА, его сплайсинговых вариантов или его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень РТА, его сплайсинговых вариантов или его фрагментов коррелирует с диагнозом рака, и при этом повышенный уровень пронейротензина и его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом повышенный уровень пронейротензина и его фрагментов коррелирует с диагнозом рака, и при этом пониженный уровень проэнкефалина и его фрагментов является прогностическим критерием повышенного риска развития рака, или альтернативно этому диагностируют рак, при этом пониженный уровень проэнкефалина и его фрагментов коррелирует с диагнозом рака.
В частности, указанный индивидуум может представлять собой женщину, и рак представляет собой рак молочной железы. Установление корреляции между биомаркером и комбинациями биомаркеров, указанными выше, и случаями возникновения рака молочной железы у женщин представляет собой характерный и отличительный признак всех способов, предлагаемых в настоящем изобретении.
Проэнкефалин и фрагменты могут иметь следующую последовательность:
SEQ ID NO: 23 (проэнкефалин (1-243)
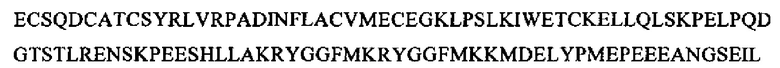
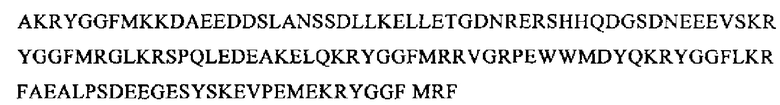
Фрагменты проэнкефалина, которые можно определять в общей воде организма, можно выбирать, например, из группы следующих фрагментов:
SEQ ID NO: 24 (синэнкефалин, проэнкефалин 1-73)

SEQ ID NO: 25 (Met-энкефалин)
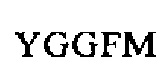
SEQ ID NO: 26 (Leu-энкефалин)
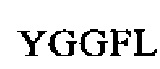
SEQ ID NO: 27 (проэнкефалин 90-109)
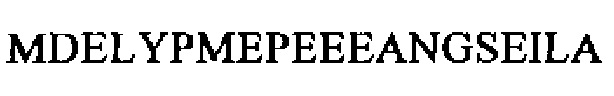
SEQ ID NO: 28 (проэнкефалин 119-159, фрагмент срединной области проэнкефалина, MRPENK)

SEQ ID NO: 29 (Met-энкефалин-Arg-Gly-Leu)
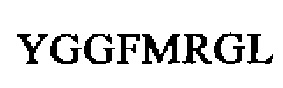
SEQ ID NO: 30 (проэнкефалин 172-183)
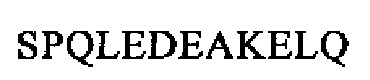
SEQ ID NO: 9 (проэнкефалин 193-203)
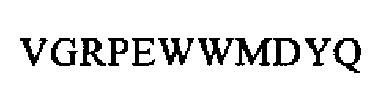
SEQ ID NO: 31 (проэнкефалин 213-234)
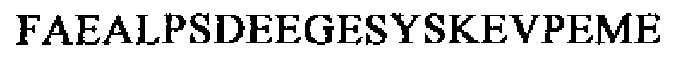
SEQ ID NO: 32 (проэнкефалин 213-241)
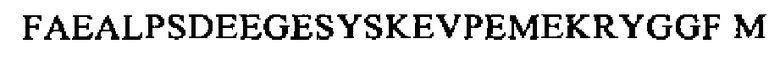
SEQ ID NO: 33 (Met-энкефалин-Arg-Phe)
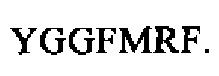
Определение уровня проэнкефалина или его фрагментов, включая Leu-энкефалин и Met-энкефалин, можно осуществлять посредством определения иммунореактивности в отношении проэнкефалина или его фрагментов, включая Leu-энкефалин и Met-энкефалин. В зависимости от области связывания связывающая молекула, которую применяют для определения проэнкефалина или его фрагментов, включая Leu-энкефалин и Met-энкефалин, может связываться с более чем одной из указанных выше молекул. Это должно быть очевидно специалисту в данной области.
В более конкретном варианте способа, предлагаемого в настоящем изобретении, определяют уровень MRPENK (SEQ ID NO: 28: проэнкефалин 119-159, т.е. фрагмент срединной области проэнкефалина, MRPENK), который имеет последовательность 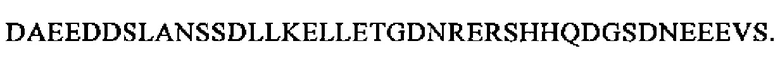
В конкретном варианте осуществления изобретения уровень проэнкефалина или его фрагментов измеряют с помощью иммуноанализа с использованием антител или фрагментов антител, которые связываются с проэнкефалином или его фрагментами. Иммуноанализ, который можно применять для определения уровня проэнкефалина или его фрагментов, состоящих по меньшей мере из 5 аминокислот, может включать стадии, описанные в примере 4. Все пороговые значения и величины должны рассматриваться в контексте теста и калибровки, которые применяли в примере 4. Специалисту в данной области должно быть известно, что абсолютная величина порогового значения может зависеть от применяемой калибровки. Это означает, что все величины и пороговые значения, представленные в настоящем описании, следует рассматривать в контексте использованной в настоящем описании калибровки (пример 4).
Согласно изобретению диагностическую связывающую молекулу, которая связывается с проэнкефалином (и/или пронейротензином и его фрагментами), выбирают из группы, включающей антитела, например, IgG, как правило, полноразмерный иммуноглобулин, или фрагменты антител, содержащие по меньшей мере вариабельный (Fv) домен тяжелой и/или легкой цепи, такие, например, как химически сшитые антитела (антигенсвязывающие фрагменты), включая (но не ограничиваясь только ими) Fab-фрагменты, включая миниантитела в виде Fab, антитело в виде одноцепочечного Fab, одновалентное антитело в виде Fab с эпитопными метками, например, Fab-V5S×2; двухвалентный Fab (мини-антитело), димеризованный с помощью СН3-домена; двухвалентный Fab или многовалентный Fab, например, образованный посредством мультимеризации с помощью гетерологичного домена, например, посредством димеризации dHLX-доменов, например, Fab-dHLX-FS×2; F(ab')2-фрагменты, scFv-фрагменты, мультимеризованные многовалентные и/или мультиспецифические scFv-фрагменты, двухвалентные и/или биспецифические димерные антитела (диабоди), BITE® (биспецифический активатор Т-клеток), трифункциональные антитела, многовалентные антитела, например, класса, отличного от G-класса; однодоменные антитела, например, наноантитела, выведенные из верблюжьих или рыбьих иммуноглобулинов.
В конкретном варианте осуществления изобретения уровень проэнкефалина или его фрагментов (и/или пронейротензина и его фрагментов) измеряют с помощью анализа с использованием связывающих молекул, выбранных из группы, включающей аптамеры, He-Ig-каркасы, которые связываются с проэнкефалином или его фрагментами, что будет более подробно описано ниже.
Связывающая молекула, которую можно применять для определения уровня проэнкефалина или его фрагментов (и/или пронейротензина и его фрагментов), характеризуется константой аффинности к проэнкефалину (и/или пронейротензину и его фрагментам), составляющей по меньшей мере 107М-1, предпочтительно 108М-1, предпочтительно константа аффинности превышает 109М-1, наиболее предпочтительно превышает 1010М-1. Специалисту в данной области известно, что для компенсации пониженной аффинности можно рассматривать применение соединений в более высокой дозе, и этот подход не выходит за рамки объема изобретения. Аффинность связывания можно определять с помощью метода Biacore, доступного в виде сервисного анализа, например, на сайте фирмы Biaffin, Кассель, Германия (http://www.biaffin.com/de/), см. также выше.
Контрольный образец человеческого проэнкефалина можно получать от фирмы ICI-Diagnostics, Берлин, Германия (http://www.ici-diagnostics.com/). При проведении анализа калибровку можно осуществлять с использованием синтетического (для экспериментов, проведенных при создании настоящего изобретения, применяли синтетический MRPENK, SEQ ID NO: 28) или рекомбинантного проэнкефалина или его фрагментов.
Пороговое значение уровня проэнкефалина (PENK) для определения риска возникновения рака, прежде всего рака молочной железы, у индивидуума или диагностирования рака, прежде всего рака молочной железы, у индивидуума согласно способам, предлагаемым в настоящем изобретении, составляет примерно 100 пмолей/л или менее, предпочтительно примерно 75 пмолей/л или менее, предпочтительно примерно 50 пмолей/л или менее, предпочтительно примерно 40,4 пмоля/л. В конкретном варианте осуществления изобретения указанное пороговое значение составляет примерно 40,4 пмолей/л. Указанные пороговые значения определены согласно описанному ниже методу калибровки. Уровень PENK, находящийся ниже указанного порогового значения, означает, что индивидуум имеет повышенный риск развития рака или уже имеет рак.
В одном из вариантов осуществления изобретения указанный способ осуществляют более одного раза для мониторинга риска развития рака у индивидуума, прежде всего рака молочной железы у женщины, или для мониторинга процесса лечения. В одном из конкретных вариантов осуществления изобретения указанный мониторинг осуществляют для оценки ответа указанного индивидуума на предпринимаемые профилактические и/или терапевтические меры.
В одном из вариантов осуществления изобретения, указанный мониторинг осуществляют для стратификации указанных индивидуумов, прежде всего женщин, на группы риска.
Объектом настоящего изобретения является также способ прогнозирования риска развития рака у индивидуума, прежде всего рака молочной железы у женщины, или идентификации индивидуума, прежде всего женщины, имеющей повышенный риск развития рака, прежде всего рака молочной железы, согласно одному из предыдущих вариантов осуществления изобретения, в котором применяют уровень протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, либо индивидуально, либо в сочетании с другими пригодными для прогнозирования лабораторными или клиническими параметрами, для прогнозирования риска развития рака у индивидуума с помощью способа, который можно выбирать из следующих альтернатив:
- сравнение медианы уровня протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и предварительно определенного уровня в совокупности образцов, взятых из популяции «здоровых» или «по-видимому, здоровых» индивидуумов,
- сравнение квантиля уровня протахикинина, его сплайсинговых вариантов или его фрагментов, состоящих по меньшей мере из 5 аминокислот, в общей воде организма, взятой у указанного индивидуума, и предварительно определенного уровня в совокупности образцов, взятых из популяции «здоровых» или «по-видимому, здоровых» индивидуумов,
- расчет на основе анализа пропорциональных рисков Кокса или расчетов коэффициентов риска, таких как NRI (чистый коэффициент переклассификации, Net Reclassification Index) или IDI (интегральный индекс дискриминации, Integrated Discrimination Index).
В одном из вариантов осуществления изобретения указанный способ осуществляют более одного раза для мониторинга риска развития рака у индивидуума, прежде всего рака молочной железы у женщины, или для мониторинга процесса лечения. В одном из конкретных вариантов осуществления изобретения указанный мониторинг осуществляют для оценки ответа указанного индивидуума на предпринимаемые профилактические и/или терапевтические меры.
В одном из вариантов способа, предлагаемого в изобретении, указанный мониторинг осуществляют для стратификации указанных индивидуумов на группы риска.
В одном из вариантов осуществления изобретения, рак выбирают из группы, состоящей из рака молочной железы и рака легкого.
Описание чертежей
На чертежах показано:
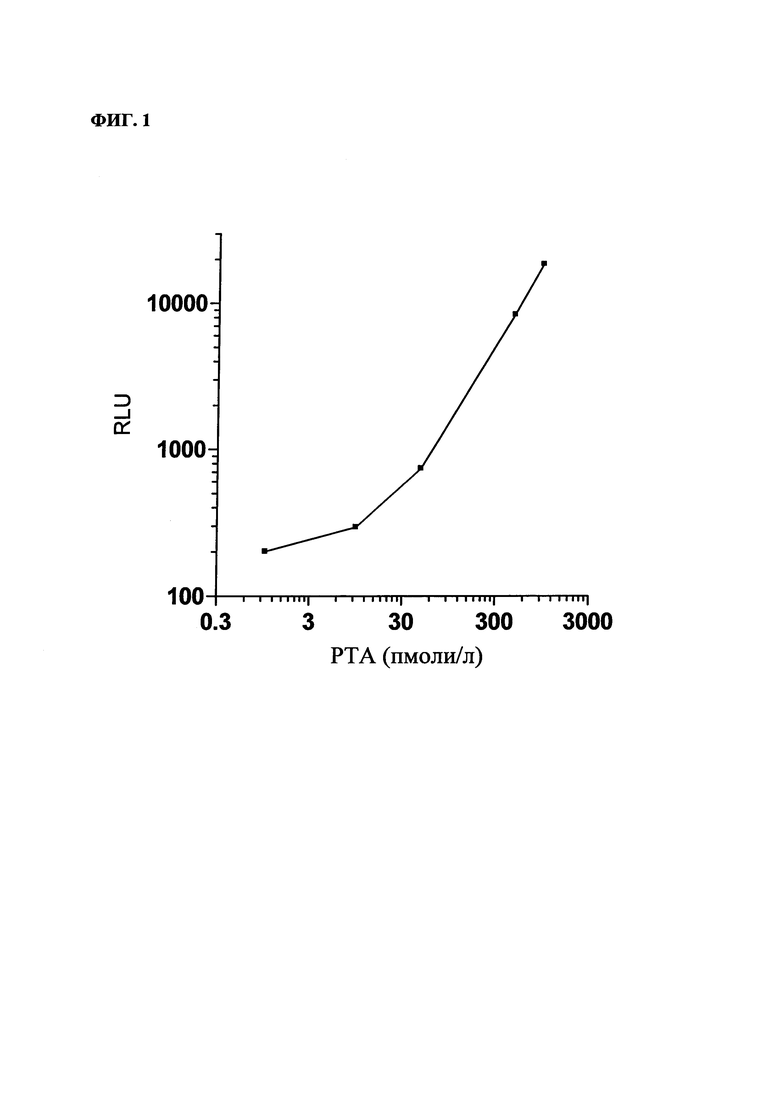
На фиг. 1 - типичная кривая доза РТА/сигнал; стандартная кривая для РТА.
На фиг. 2 - графики Каплана-Мейера, иллюстрирующие кумулятивный диагноз рака молочной железы у женщин из квартиля (Q) 1 (ниже 45,6 пмоля/л), квартиля 2 (45,6-55,3 пмоля/л), квартиля 3 (55,4-65,9 пмоля/л), квартиля 4 (выше 65,9 пмоля/л). Пониженный уровень РТА свидетельствует о повышенном долгосрочном риске развития рака молочной железы. Поскольку все женщины, в истории болезни которых имелся рак, были исключены в день определения исходного уровня (взятие образцов крови), то уровень РТА являлся высоко эффективным прогностическим критерием развития рака молочной железы в будущем. Кроме того, женщины из Q 1 имели более чем в 2,1 раза больший риск развития рака молочной железы, чем женщины из квартиля Q 4;
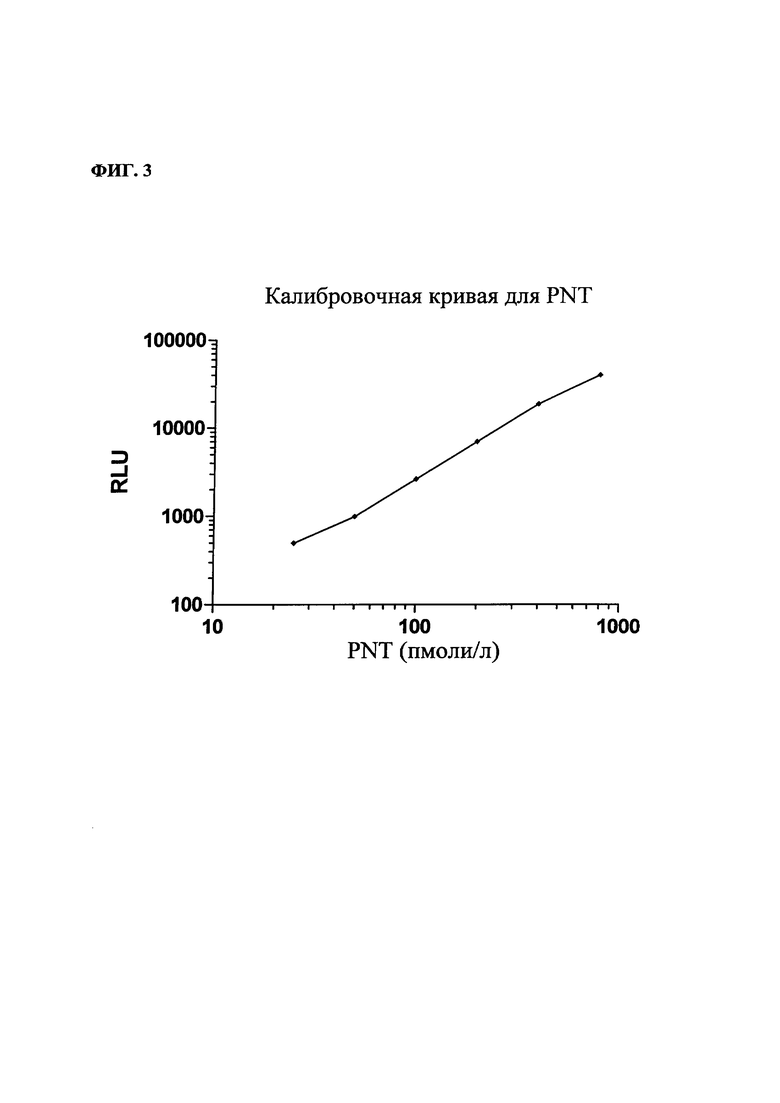
На фиг. 3: - типичная кривая доза PNT/сигнал. Стандартная кривая для PNT;
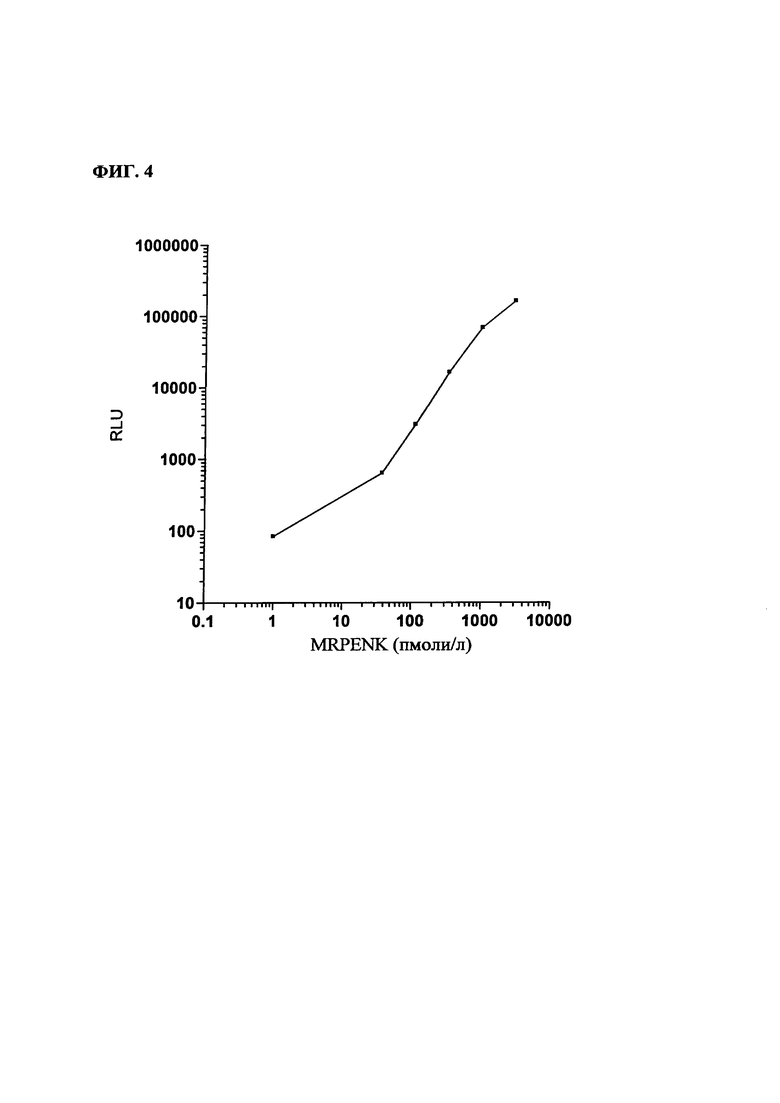
На фиг. 4: - типичная кривая доза MR PENK/сигнал. Стандартная кривая для MR PENK;
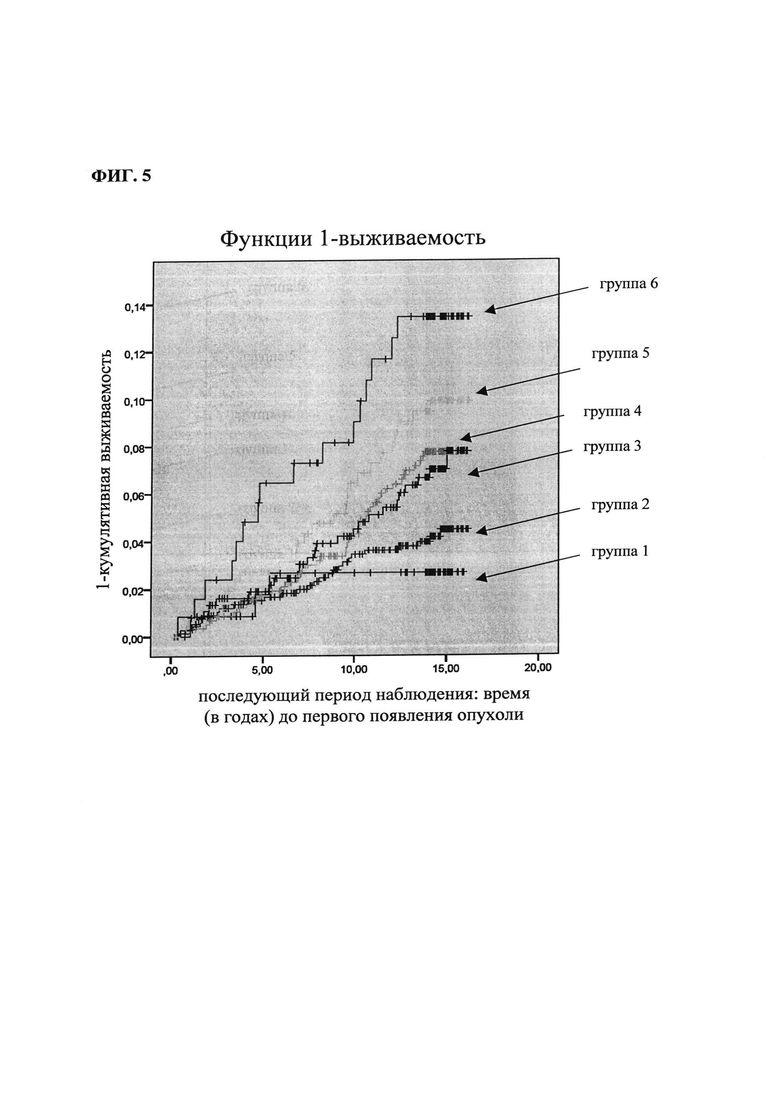
На фиг. 5 - приведенный в качестве иллюстрации пример объединенного анализа с использованием РТА и PNT для прогнозирования рака молочной железы в группах риска, указанных в таблице 9.
Примеры
Пример 1 РТА-иммуноанализ
Создание антител к РТА
Пептиды/конъюгаты для иммунизации:
Пептиды, предназначенные для иммунизации, синтезировали (фирма JPT Technologies, Берлин, Германия) с включением дополнительного N-концевого остатка цистеина для конъюгации пептидов с бычьим сывороточным альбумином (БСА). Пептиды ковалентно сшивали с БСА с использованием сульфо-SMCC (фирма Perbio-science, Бонн, Германия). Процедуру сочетания осуществляли согласно руководству фирмы Perbio.

Антитела создавали согласно следующему методу:
Мышей линии BALB/c иммунизировали путем введения 100 мкг конъюгата пептид-БСА (эмульгированный в 100 мкл полного адъюванта Фрейнда) в дни 0 и 14 и 50 мкг (в 100 мкл неполного адъюванта Фрейнда) в дни 21 и 28. За три дня до осуществления эксперимента по слиянию животному вводили 50 мкг конъюгата, растворенного в 100 мкг физиологического раствора, путем одной внутрибрюшинной и одной внутривенной инъекции.
Осуществляли слияние спленоцитов иммунизированной мыши с клетками миеломы линии SP2/0 с использованием 1 мл 50% полиэтиленгликоля в течение 30 с при 37°С. После промывки клетки высевали в 96-луночные планшеты для клеточных культур. Гибридные клоны отбирали путем выращивания в среде ГАТ (питательная среда RPMI 1640, дополненная 20% сыворотки плода коровы и ГАТ-добавкой (гипоксантин, аминоптерин, тимидин)). Через две недели среду ГАТ заменяли средой ГТ и после осуществления трех пересевов возвращали в стандартную среду для клеточных культур.
Через три недели после осуществления слияния проводили первичный скрининг супернатантов клеточной культуры в отношении антигенспецифических антител IgG-типа. Позитивные по данным теста микрокультуры переносили в 24-луночные планшеты для размножения. После повторного тестирования осуществляли клонирование и повторное клонирование отобранных культур с применением метода серийных разведений и определяли изотипы (Lane R.D. «А short-duration polyethylene glycol fusiontechnique for increasing production of monoclonal antibody-secreting hybridomas», J. Immunol. Meth. 81, 1985, cc. 223-228; Ziegler В. и др., «Glutamate decarboxylase (GAD) is not detectable on the surface of rat islet cells examined by cytofluorometry and complement-dependent antibody-mediated cytotoxicity of monoclonal GAD antibodies», Horm. Metab. Res. 28, 1996, cc. 11-15).
Получение моноклональных антител
Антитела получали согласно стандартным методам получения антител (Marx и др., Monoclonal Antibody Production, ATLA 25, 1997, с. 121) и очищали с помощью хроматографии на белке А. Чистота антител составляла > 95% по данным электрофоретического анализа на геле в присутствии ДСН.
Мечение антител и их применение для сенсибилизации
Все антитела метили с использованием сложного эфира акридиния согласно следующей процедуре:
Несущее метку соединение (трейсер, антитело к РТА 3-22): 100 мкг (100 мкл) антитела (1 мг/мл в ЗФР, рН 7,4), смешивали с 10 мкл сложного NHS-эфира акридиния (1 мг/мл в ацетонитриле, фирма InVent GmbH, Германия) (ЕР 0353971) и инкубировали в течение 20 мин при комнатной температуре. Меченое антитело очищали с помощью ЖХВР-гель-фильтрации на Bio-Sil SEC 400-5 (фирма Bio-Rad Laboratories, Inc., США). Очищенное меченое антитело разводили в 300 ммолей/л фосфата калия, 100 ммолей/л NaCl, 10 ммолей/л Na-ЭДТК, 5 г/л бычьего сывороточного альбумина, рН 7,0. Конечная концентрация меченого соединения соответствовала примерно 800000 относительных световых единиц (RLU) (примерно 20 нг меченого антитела) на 200 мкл. Хемилюминесценцию сложного эфира акридиния измеряли с помощью устройства AutoLumat LB 953 (фирма Berthold Technologies GmbH & Co. KG).
Антитело на твердой фазе (применяемое для сенсибилизации антитело):
Твердая фаза: Полистироловые пробирки (фирма Greiner Bio-One International AG, Австрия) сенсибилизировали (в течение 18 ч при комнатной температуре) антителом к РТА 22-36 (1,5 мкг антитела на 0,3 мл буфера, содержащего 100 ммолей/л NaCl, 50 ммолей/л Трис/HCl, рН 7,8). После блокирования с помощью 5% бычьего сывороточного альбумина, пробирки промывали ЗФР, рН 7,4 и сушили в вакууме.
Иммуноанализ РТА:
С помощью пипетки вносили по 50 мкл образца (или калибратора) в сенсибилизированные пробирки, после добавления меченого антитела (200 мкл) пробирки инкубировали в течение 2 ч при 18-25°С.Несвязанный трейсер удаляли путем 5-кратной промывки (используя каждый раз по 1 мл) промывочным раствором (20 ммолей/л ЗФР, рН 7,4, 0,1% Тритон Х-100). Связанное с пробиркой меченое антитело оценивали с использованием люминометра LB 953, фирма Berthold, Германия.
Калибровка:
При проведении анализа калибровку осуществляли с использованием разведений синтетического Р37, разведенного в растворе, содержащем 20 мМ K2PO4, 6 мМ ЭДТК, 0,5% БСА, 50 мкМ амастин, 100 мкМ леупептин, рН 8,0. Содержащую РТА контрольную плазму получали от фирмы ICI-diagnostics, Берлин, Германия.
На фиг. 1 представлена типичная кривая зависимости сигнала от дозы РТА.
Аналитическая чувствительность анализа (медианная величина сигнала, полученная для 20 определений 0-калибратора (без добавления РТА) + 2SD (2 стандартных отклонения), соответствующую концентрацию РТА рассчитывали с использованием стандартной кривой) составляла 4,4 пмоля/л.
Пример 2. Исследование популяции/РТА
Методы
При создании исследования проводили измерения уровня РТА натощак у 2559 женщин (возраст 58±6 лет), участвовавших в проведенном на популяции индивидуумов в университете г. Мальме исследовании по изучению диеты и рака, которых обследовали на исходном уровне в период с 1991 г. по 1994 г. Применяли скорректированные для учета многих параметров (все традиционные факторы сердечно-сосудистого риска, факторы риска диабета, а для анализа рака также и наследственные факторы) модели пропорционального риска Кокса для установления соответствия между исходным уровнем РТА (отношение рисков на каждое увеличение на величину стандартного отклонения логарифма уровня РТА и промежутком времени до первого события из числа каждой из исследуемых конечных точек в течение последующего периода наблюдения, медиана которого составляла более 12 лет. Информацию о конечных точках получали из Шведского национального регистра выписки из госпиталей, Шведского регистра инфарктов миокарда, Регистра сердечных приступов университета Мальме и Шведского регистра рака. Получение информации о конечных точках было валидировано и признано точным (см. также у Belting и др., Cancer Epidemiol Biomarkers Prev; AACR, 2012, cc. 1-10). Уровень инсулина измеряли с помощью стандартных лабораторных методов.
Распределение РТА в популяции женщин (N=2559):
Среднее значение уровней РТА в популяции женщин составляло 54,3 пмоля/л, стандартное отклонение ±1,4 пмоля/л. Все результаты находились в пределах диапазона измерений анализа, наименьшая концентрация РТА составляла 9,1 пмоля/л. Эти результаты свидетельствуют о пригодности применяемого анализа (чувствительность анализа составляла 4,4 пмоля/л).
РТА и прогнозирование рака молочной железы
При создании изобретения оценивали взаимосвязь между РТА и раком молочной железы (таблица 3). Из анализа исключали всех женщин, у которых ранее был обнаружен рак (N=459). Была выявлена выраженная взаимосвязь между РТА и раком молочной железы у женщин. В полностью скорректированной модели каждое уменьшение уровня РТА на величину SD (в рассматриваемом анализе применяли обратные квартили, revPTA, см. таблицы 3/4) было ассоциировано с увеличением на 28,2% риска развития в будущем рака молочной железы (таблица 3), и сравнение верхнего квартиля РТА с нижним дает более чем 2,1-кратную разницу в величине риска развития рака молочной железы (см. таблицу 5 и фиг. 2). Учет инсулина без РТА в уравнении не позволил выявить его значимую ассоциацию с развитием в будущем рака молочной железы, но неожиданно оказалось, что, когда в уравнении учитывался РТА, то влияние инсулина становилось значимым (р=0,035). Повышенный уровень инсулина был ассоциирован с 34,6%-ным уменьшением риска развития в будущем рака молочной железы на величину SD. Инсулин не оказывал влияния на прогностическую мощность РТА.



Пример 3
Анализ пронейротензина
Антитела создавали согласно описанному выше методу. Антитело для мечения (LA) создавали так, чтобы оно представляло антитело к P-NT 1-19 (Н-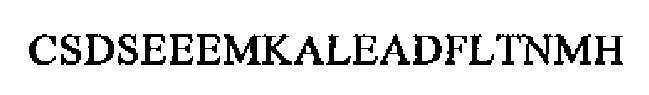 (SEQ ID NO: 33)), а антитело для твердой фазы (SPA) создавали так, чтобы оно представляло собой антитело к пептиду P-NT 44-62
(SEQ ID NO: 33)), а антитело для твердой фазы (SPA) создавали так, чтобы оно представляло собой антитело к пептиду P-NT 44-62 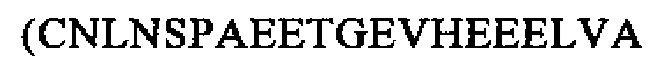 (SEQ ID NO: 34). Антитела конструировали и получали согласно описанному выше методу.
(SEQ ID NO: 34). Антитела конструировали и получали согласно описанному выше методу.
Иммуноанализ для количественной оценки человеческого пронейротензина
Применяемая технология представляла собой люминесцентный сэндвич-иммуноанализ в сенсибилизированной пробирке с использованием мечения сложным эфиром акридиния.
Несущее метку соединение (трейсер): 100 мкг (100 мкл) LA (1 мг/мл в ЗФР, рН 7,4), смешивали с 10 мкл сложного NHS-эфира акридиния (1 мг/мл в ацетонитриле, фирма InVent GmbH, Германия) (ЕР 0353971) и инкубировали в течение 20 мин при комнатной температуре. Меченое LA очищали с помощью ЖХВР-гель-фильтрации на Bio-Sil SEC 400-5 (фирма Bio-Rad Laboratories, Inc., США). Очищенное LA разводили в 300 ммолей/л фосфата калия, 100 ммолей/л NaCl, 10 ммолей/л Na-ЭДТК, 5 г/л бычьего сывороточного альбумина, рН 7,0. Конечная концентрация меченого соединения составляла примерно 800000 относительных световых единиц (RLU) (примерно 20 нг меченого антитела) на 200 мкл. Хемилюминесценцию сложного эфира акридиния измеряли с помощью устройства AutoLumat LB 953 (фирма Berthold Technologies GmbH & Co. KG).
Твердая фаза: Полистироловые пробирки (фирма Greiner Bio-One International AG, Австрия) сенсибилизировали (в течение 18 ч при комнатной температуре) SPA (1,5 мкг SPA на 0,3 мл буфера, содержащего 100 ммолей/л NaCl, 50 ммолей/л Трис/HCl, рН 7,8). После блокирования с помощью 5% бычьего сывороточного альбумина, пробирки промывали ЗФР, рН 7,4 и сушили в вакууме.
Калибровка:
При проведении анализа калибровку осуществляли с использованием разведений человеческой сыворотки, содержащей пронейротензин. Пул человеческой сыворотки с высокой иммунореактивностью пронейротензина (фирма InVent Diagostika, Хеннингсдорф, Германия) разводили лошадиной сывороткой (фирма Biochrom AG, Германия) (стандарты для анализа).
Стандарты калибровали с использованием человеческого пронейротензина-калибратора (фирма ICI-Diagnostics, Берлин, Германия). Альтернативно этому анализ можно калибровать с использованием синтетического или рекомбинантного P-NT 1-117 или его фрагментов (см. также Ernst и др., 2006).
Иммуноанализ про-NT:
С помощью пипетки вносили по 50 мкл образца (или калибратора) в сенсибилизированные SPA пробирки, после добавления меченого LA (200 мкл) пробирки инкубировали в течение 16-22 ч при 18-25°С. Несвязанный трейсер удаляли путем 5-кратной промывки (используя каждый раз по 1 мл) промывочным раствором (20 ммолей/л ЗФР, рН 7,4, 0,1% Тритон Х-100). Связанное с пробиркой LA оценивали с использованием люминометра LB 953. Результаты рассчитывали с использованием калибровочной кривой. Типичная калибровочная кривая представлена на фиг. 3.
Пример 4:
Иммуноанализ проэнкефалина
Конструирование антител
Пептиды/конъюгаты для иммунизации:
Пептиды, предназначенные для иммунизации, синтезировали (фирма JPT Technologies, Берлин, Германия) с включением дополнительного N-концевого статка цистеина для конъюгации пептидов с бычьим сывороточным альбумином (БСА). Пептиды ковалентно сшивали с БСА с использованием сульфо-SMCC (фирма Perbio-science, Бонн, Германия). Процедуру сочетания осуществляли согласно руководству фирмы Perbio

Антитела создавали согласно следующему методу:
Мышей линии BALB/c иммунизировали путем введения 100 мкг конъюгата пептид-BSA (эмульгированный в 100 мкл полного адъюванта Фрейнда) в дни 0 и 14 и 50 мкг (в 100 мкл неполного адъюванта Фрейнда) в дни 21 и 28. За три дня до осуществления эксперимента по слиянию животному вводили 50 мкг конъюгата, растворенного в 100 мкг физиологического раствора, путем одной внутрибрюшинной и одной внутривенной инъекции.
Осуществляли слияние спленоцитов иммунизированной мыши с клетками миеломы линии SP2/0 с использованием 1 мл 50% полиэтиленгликоля в течение 30 с при 37°С. После промывки клетки высевали в 96-луночные планшеты для клеточных культур. Гибридные клоны отбирали путем выращивания в среде ГАТ (питательная среда RPMI 1640, дополненная 20% сыворотки плода коровы и ГАТ-добавкой). Через две недели среду ГАТ заменяли средой ГТ и после осуществления трех пересевов возвращали в стандартную среду для клеточных культур.
Через три недели после осуществления слияния проводили первичный скрининг супернатантов клеточной культуры в отношении антигенспецифических антител IgG-типа. Позитивные по данным теста микрокультуры переносили в 24-луночные планшеты для размножения. После повторного тестирования осуществляли клонирование и повторное клонирование отобранных культур с применением метода серийных разведений и определяли изотипы (Lane R.D. «А short-duration polyethylene glycol fusiontechnique for increasing production of monoclonal antibody-secreting hybridomas», J. Immunol. Meth. 81, 1985, cc. 223-228; Ziegler В. и др., «Glutamate decarboxylase (GAD) is not detectable on the surface of rat islet cells examined by cytofluorometry and complement-dependent antibody-mediated cytotoxicity of monoclonal GAD antibodies», Horm. Metab. Res. 28, 1996, cc. 11-15).

Получение моноклональных антител
Антитела получали согласно стандартным методам получения антител (Marx и др., Monoclonal Antibody Production, ATLA 25, 1997, с. 121) и очищали с помощью хроматографии на белке А. Чистота антител составляла > 95% по данным электрофоретического анализа на геле в присутствии ДСН.
Мечение антител и их применение для сенсибилизации
Несущее метку соединение (трейсер, антитело CT-MRPENK): 100 мкг (100 мкл) антитела (1 мг/мл в ЗФР, рН 7,4), смешивали с 10 мкл сложного NHS-эфира акридиния (1 мг/мл в ацетонитриле, фирма In Vent GmbH, Германия) (ЕР 0353971) и инкубировали в течение 20 мин при комнатной температуре. Меченое антитело очищали с помощью ЖХВР-гель-фильтрации на Bio-Sil SEC 400-5 (фирма Bio-Rad Laboratories, Inc., США). Очищенное меченое антитело разводили в 300 ммолей/л фосфата калия, 100 ммолей/л NaCl, 10 ммолей/л Na-ЭДТК, 5 г/л бычьего сывороточного альбумина, рН 7,0. Конечная концентрация меченого соединения соответствовала примерно 800000 относительных световых единиц (RLU) (примерно 20 нг меченого антитела) на 200 мкл. Хемилюминесценцию сложного эфира акридиния измеряли с помощью устройства AutoLumat LB 953 (фирма Berthold Technologies GmbH & Co. KG).
Антитело на твердой фазе (применяемое для сенсибилизации антитело, антитело CT-MRPENK):
Твердая фаза: Полистироловые пробирки (фирма Greiner Bio-One International AG, Австрия) сенсибилизировали (в течение 18 ч при комнатной температуре) антителом (1,5 мкг антитела на 0,3 мл буфера, содержащего 100 ммолей/л NaCl, 50 ммолей/л Трис/HCl, рН 7,8). После блокирования с помощью 5% бычьего сывороточного альбумина, пробирки промывали ЗФР, рН 7,4 и сушили в вакууме.
Иммуноанализ проэнкефалина:
С помощью пипетки вносили по 50 мкл образца (или калибратора) в сенсибилизированные пробирки, после добавления меченого антитела (200 мкл) пробирки инкубировали в течение 2 ч при 18-25°С. Несвязанный трейсер удаляли путем 5-кратной промывки (используя каждый раз по 1 мл) промывочным раствором (20 ммолей/л ЗФР, рН 7,4, 0,1% Тритон Х-100). Связанное с пробиркой меченое антитело оценивали с использованием люминометра 953.
Калибровка
При проведении анализа калибровку осуществляли с использованием разведений синтетического MRPENK, разведенного в растворе, содержащем 20 мМ К2РО4, 6 мМ ЭДТК, 0,5% БСА, 50 мкМ амастин, 100 мкМ леупептин, рН 8,0. Содержащую проэнкефалин контрольную плазму получали от фирмы ICI-diagnostics, Берлин, Германия.
На фиг. 4 представлена типичная кривая зависимости сигнала от дозы проэнкефалина.
Чувствительность анализа (для 20 определений 0-калибратора (без добавления MRPENK) + 2SD) составляла 5,5 пмоля/л.
Пример 5
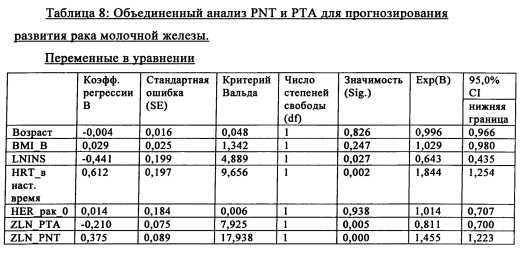
Объединенный анализ РТА, пронейротензина и HRT и РТА, пронейротензина, проэнкефалина и инсулина для прогнозирования рака молочной железы.
Поскольку в исследованиях, проведенных в последнее время, было установлено, что пронейротензин и проэнкефалин позволяют эффективно прогнозировать развитие рака молочной железы, то при создании изобретения для прогнозирования развития рака молочной железы объединяли указанные биомаркеры. При создании изобретения дополнительно учитывали HRT (гормонзаместительная терапия), являющуюся известным фактором риска рака молочной железы, для демонстрации дополнительной ценности РТА.
Сначала объединяли РТА/пронейротензин/HRT/инсулин:
Не было выявлено значимой корреляции между РТА и пронейротензином (р=0,71). При использовании объединенной модели, включающей инсулин и гормонзаместительную терапию (HRT) с использованием РТА и PNT (таблица 8), при создании изобретения было установлено, что они оба являются независимыми маркерами для прогнозирования рака молочной железы. Оба маркера характеризовались высокой значимостью (р=0,005 для РТА и р<0,001 для PNT).
При использовании полностью скорректированной модели каждое увеличение PNT на величину SD было ассоциировано с 45,5%-ным увеличением риска развития в будущем рака молочной железы. Каждое увеличение РТА на величину SD было ассоциировано с 18,9%-ным снижением риска (на единицу SD) развития в будущем рака молочной железы.
Как и ожидалось, HRT оказывала значимое влияние при использовании этой же самой модели, однако неожиданно было установлено, что инсулин оказался наиболее эффективным прогностическим маркером для прогнозирования развития рака молочной железы (р=0,027). Каждое увеличение уровня инсулина на величину SD было ассоциировано с 35,7%-ным снижением риска развития в будущем рака молочной железы.
Эти результаты демонстрируют, что РТА, PNT, инсулин и HRT, каждый вносит значимую информацию для прогнозирования развития рака молочной железы.
В таблице 9 и на фиг. 5 представлены полученные при создании изобретения результаты анализа методом Каплана-Мейера, иллюстрирующие информацию, которую можно получать в результате объединения РТА и PNT:
Были объединены квартили РТА и PNT:
Поскольку низкие уровни РТА свидетельствуют о повышенном риске развития рака молочной железы, то применяли расположенные в обратном порядке квартили РТА (revPTA): 1-й квартиль РТА = 4-й квартиль revPTA; 2-й квартиль РТА = 3-й квартиль revPTA; 3-й квартиль РТА = 2-й квартиль revPTA; 4-й квартиль РТА = 1-й квартиль revPTA (таблица 9).
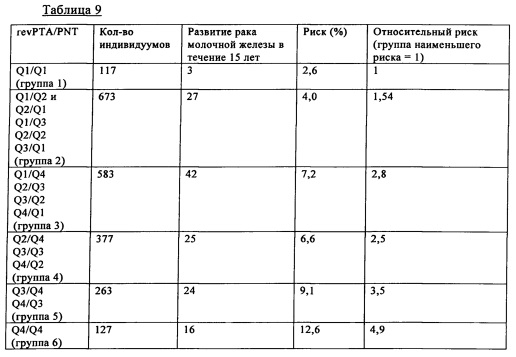
Сравнение объединенных наиболее высокого квартиля PNT и наиболее низкого квартиля РТА (группа 6) с объединенными наиболее низким квартилем PNT и наиболее высоким квартилем РТА (группа 1) дает объединенный риск развития в будущем рака молочной железы, равный 4,9 (см. фиг. 5).
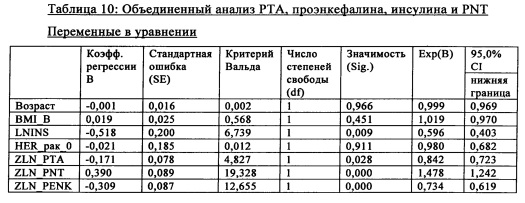
Объединенный анализ РТА, проэнкефалина, HRT, инсулина и PNT для популяции женщин:
Была установлена значимая корреляция между РТА и проэнкефалином (р=<0,001, r=0,35). С использованием объединенной модели, включающей инсулин, РТА, PNT и проэнкефалин, были выявлены все маркеры, которые дают дополнительную информацию для прогнозирования развития рака молочной железы (таблица 10). Все маркеры характеризовались высокой значимостью (р=0,028 для РТА, р<0,001 для PNT, р=0,009 для инсулина и р<0,001 для проэнкефалина). Вклад РТА оставался независимым, хотя он характеризовался высокой корреляцией с проэнкефалином.
При использовании полностью скорректированной модели каждое увеличение PNT на величину SD было ассоциировано с 47,8%-ным увеличением риска развития в будущем рака молочной железы. Увеличение РТА было ассоциировано с 15,8%-ным снижением риска (на единицу SD) развития в будущем рака молочной железы. Увеличение проэнкефалина было ассоциировано с 26,4%-ным снижением (на единицу SD), а увеличение инсулина было ассоциировано с 40,4%-ным снижением (на единицу SD) развития в будущем рака молочной железы.
Эти данные демонстрируют, что учет РТА, PNT, проэнкефалина и инсулина дает важную независимую и дополнительную информацию касательно развития в будущем рака молочной железы.

Изобретение относится к области медицины. Предложен способ прогнозирования риска развития рака молочной железы у индивидуума, который не страдает раком молочной железы. Определяют уровень протахикинина, включающего последовательность SEQ ID NO 2, или его сплайсинговых вариантов, содержащих последовательности SEQ ID NOs 8-11. Устанавливают корреляцию указанного уровня протахикинина или его сплайсинговых вариантов с риском развития рака молочной железы. Пониженный уровень по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы. Изобретение обеспечивает эффективное прогнозирование риска развития рака молочной железы у индивидуума. 16 з.п. ф-лы, 5 ил., 11 табл., 5 пр.
1. Способ прогнозирования риска развития рака молочной железы у индивидуума, который не страдает раком молочной железы, включающий:
 определение уровня протахикинина, включающего последовательность SEQ ID NO 2, или его сплайсинговых вариантов, содержащих последовательности SEQ ID NOs 8-11,
определение уровня протахикинина, включающего последовательность SEQ ID NO 2, или его сплайсинговых вариантов, содержащих последовательности SEQ ID NOs 8-11,
в общей воде организма, взятой у указанного индивидуума, и
 установление корреляции указанного уровня протахикинина или его сплайсинговых вариантов с риском развития рака молочной железы, при этом пониженный уровень по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы,
установление корреляции указанного уровня протахикинина или его сплайсинговых вариантов с риском развития рака молочной железы, при этом пониженный уровень по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы,
где общая вода организма представляет собой кровь или плазму, или сыворотку.
2. Способ по п. 1 дополнительно включает осуществление следующих стадий, на которых:
 определяют уровень пронейротензина в общей воде организма, взятой у указанного индивидуума, и
определяют уровень пронейротензина в общей воде организма, взятой у указанного индивидуума, и
 дополнительно устанавливают корреляцию между указанным уровнем пронейротензина и риском развития рака молочной железы, при этом повышенный уровень пронейротензина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
дополнительно устанавливают корреляцию между указанным уровнем пронейротензина и риском развития рака молочной железы, при этом повышенный уровень пронейротензина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
3. Способ по п. 2 дополнительно включает осуществление следующих стадий, на которых:
 определяют уровень проэнкефалина в общей воде организма, взятой у указанного индивидуума, и
определяют уровень проэнкефалина в общей воде организма, взятой у указанного индивидуума, и
 дополнительно устанавливают корреляцию между указанным уровнем проэнкефалина и риском развития рака молочной железы, при этом пониженный уровень проэнкефалина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
дополнительно устанавливают корреляцию между указанным уровнем проэнкефалина и риском развития рака молочной железы, при этом пониженный уровень проэнкефалина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
4. Способ по п. 3, дополнительно включающий осуществление следующих стадий, на которых:
 определяют уровень инсулина в общей воде организма, взятой у указанного индивидуума, и
определяют уровень инсулина в общей воде организма, взятой у указанного индивидуума, и
 дополнительно устанавливают корреляцию между указанным уровнем инсулина и риском развития рака молочной железы, при этом пониженный уровень инсулина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
дополнительно устанавливают корреляцию между указанным уровнем инсулина и риском развития рака молочной железы, при этом пониженный уровень инсулина по отношению к пороговому значению является прогностическим критерием повышенного риска развития рака молочной железы.
5. Способ по одному из пп. 2-4, в котором дополнительное установление корреляции означает осуществление объединенного анализа определенных уровней биомаркеров с учетом относительных факторов риска развития рака молочной железы, полученных с использованием индивидуальных биомаркеров.
6. Способ по п. 1, в котором пониженный уровень протахикнина, включающего последовательность SEQ ID NO 2, или его сплайсинговых вариантов, содержащих последовательности SEQ ID NOs 8-11, представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 100 пмолей/л или менее, предпочтительно примерно 80 пмолей/л или менее, предпочтительно примерно 60 пмолей/л или менее, предпочтительно примерно 50 пмолей/л или менее, предпочтительно примерно 45,6 пмоля/л или менее, предпочтительно примерно 40 пмолей/л.
7. Способ по п. 2, в котором повышенный уровень пронейротензина представляет собой уровень, находящийся выше порогового значения, где указанное пороговое значение составляет примерно 78 пмолей/л или более, предпочтительно примерно 100 пмолей/л или более, более предпочтительно примерно 150 пмолей/л.
8. Способ по п. 3, в котором пониженный уровень проэнкефалина представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 100 пмолей/л или менее, предпочтительно примерно 75 пмолей/л или менее, предпочтительно примерно 50 пмолей/л или менее, предпочтительно примерно 40,4 пмоля/л.
9. Способ по п. 4, в котором пониженный уровень инсулина представляет собой уровень, находящийся ниже порогового значения, где указанное пороговое значение составляет примерно 70 пмолей/л.
10. Способ по одному из пп. 1-4, в котором у указанного индивидуума в истории болезни никогда не было диагноза рак молочной железы к моменту взятия образца общей воды организма у указанного индивидуума.
11. Способ по одному из пп. 1-4, в котором у указанного индивидуума в истории болезни ранее был диагноз рак молочной железы и он был излечен к моменту времени взятия у указанного индивидуума образца общей воды организма, и у него определяют риск рецидива развития рака молочной железы или альтернативно этому определяют рецидив рака молочной железы.
12. Способ по одному из пп. 1-4, в котором к моменту времени взятия у указанного индивидуума образца общей воды организма у указанного индивидуума было диагностировано сердечно-сосудистое заболевание или диабет.
13. Способ по одному из пп. 1-4, в котором дополнительно определяют по меньшей мере один клинический параметр, выбранный из группы, состоящей из: возраста, наличия сахарного диабета, курения в настоящее время.
14. Способ по одному из пп. 1-4, в котором уровень протахикинина, включающего последовательность SEQ ID NO 2, или его сплайсинговых вариантов, содержащих последовательности SEQ ID NOs 8-11, и пронейротензина и/или проэнкефалина и/или инсулина измеряют с помощью иммуноанализа.
15. Способ по одному из пп. 1-4, где указанный способ осуществляют более одного раза для мониторинга риска возникновения рака молочной железы у индивидуума.
16. Способ по п. 15, в котором указанный мониторинг осуществляют для того, чтобы оценить ответ указанного индивидуума на предпринятые профилактические и/или терапевтические меры.
17. Способ по одному из пп. 1-4, где способ применяют для стратификации указанных индивидуумов на группы риска.
| WO 2005103712 A2, 03.11.2005 | |||
| TURNER G.B | |||
| et al | |||
| Circulating markers of prognosis and response to treatment in patients with midgut carcinoidtumours | |||
| Gut | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ARDILL J.E | |||
| et al | |||
| The importance of the measurement of circulating markers in patients with neuroendocrine tumours of the pancreas and gut | |||
| Endocr Relat Cancer | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| REDDY B.Y | |||
| et al | |||
| Neurokinin receptors as potential targets in breast cancer treatment | |||
| Curr Drug Discov Technol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ЧЕРЕЗОВ А.Е | |||
| Общая теория рака: тканевый подход | |||
| - М | |||
| Изд-во МГУ, 1997, с.9 | |||
| ЯРИЛИН А.А | |||
| Основы иммунологии: Учебник | |||
| - М.: Медицина, 1999, стр.508 | |||
| ERNST A | |||
| et al | |||
| Midregional Proenkephalin A and N-terminal Protachykinin A are decreased in the cerebrospinal fluid of patients with dementia disorders and acute neuroinflammation | |||
| J Neuroimmunol | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2019-10-01—Публикация
2014-01-07—Подача