Настоящее изобретение относится к способу и устройству для электрохимического анализа (sensing) путем зондирования квантовой емкости функционализированного электрода.
УРОВЕНЬ ТЕХНИКИ
Электрохимические методы используют в широком спектре приложений для анализа, например для обнаружения и количественной оценки представляющих диагностический интерес молекул в физиологических образцах, для обнаружения токсичных газов и для регистрации изменений параметров окружающей среды, например, влажности.
Электрохимическая импедансная спектроскопия (ЭИС) представляет собой метод, который регистрирует изменения емкости или сопротивления переноса заряда, связанные с изменениями локальной среды поверхности электрода, модифицированной подходящим образом. Такие изменения могут включать связывание веществ (например, целевых молекул, таких как биомаркер) с поверхностью электрода, а также изменения параметров окружающей среды, например, температуры. Электрохимическая импедансная спектроскопия является эффективным методом для приложений в сфере проведения измерений, ввиду, например, ее конструктивной простоты, чувствительности, избирательности и возможности применения в безмаркерных методиках.
В недавней работе авторами настоящего изобретения было показано, что способы электрохимического импеданса могут применяться для определения диапазона флуктуаций заряда в молекулярных пленках, удерживаемых на поверхностях электродов. Эти диапазоны содержат изменения, связанные с электронно-дипольной флуктуацией и индуцированным полем ионным перемещением, и могут определяться с использованием емкостной спектроскопии электроактивного монослоя в соответствии с их конкретными временными масштабами и зависимостью поверхностного потенциала. Когда эти молекулярные пленки содержат агент с орбитальными состояниями, которые являются энергетически доступными (редокс-активными), перенос электронов, который происходит в/из нижележащего металлического электрода, создает новый и ощутимо зависящий от потенциала процесс зарядки на данной поверхности раздела. Данная фарадическая емкость (известная как редокс-емкость Сr) не является электростатической и может быть (для высококачественных молекулярных пленок с соответствующими высокими скоростями гетерогенного переноса электронов) в сотни раз больше, чем вклад по Гельмгольцу. Было показано, что данный признак Сr может быть интегрирован в пленки, которые дополнительно способны привлекать конкретные целевые объекты, представляющие интерес (например, антигенные партнеры антител). Изменение редокс-емкости может быть затем использовано при создании нового высокочувствительного, стабильного и удобного формата безмаркерного биозондирования. Для более подробной информации может быть сделана ссылка, например, на PCT/GB 2014/051938 и издание «Биосенсоры и Биоэлектроника» 50 (2013) 437-440.
Хотя данные ЭИС-методы предоставляют высокочувствительный, стабильный и удобный способ анализа, можно отметить следующее:
(i) Редокс-емкость Сr по существу указывает (посредством емкости) на электрохимическую активность замкнутых редокс-групп на их оптимальном электрохимическом «потенциале полуволны».
(ii) По каким-либо другим потенциалам никакая информация не собирается.
(iii) Если электрохимическая активность пленки испытывает возмущения, то измеренная величина Сr будет меняться. Возмущения, вызванные явлениями, отличными от специфического события связывания/распознавания (например, побочные реакции/разложение, изменения в прохождении растворителя или электролита), не обязательно должны отличаться от рассматриваемого события связывания/распознавания.
Таким образом, существует потребность в альтернативных, но связанных способах анализа, например, на основе принципов ЭИС. Особенно привлекательным может быть способ анализа, который использует простой экспериментальный комплект (например, один рабочий электрод в качестве зонда), который широко применим для определения диапазона различных параметров, который не обладает одним или более недостатками известных способов, рассмотренных выше, и/или который обладает высокой чувствительностью и/или избирательностью к химического вещества или другому измеряемому параметру.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения нашли новый способ анализа изменений в локальной среде подходящим образом функционализированной поверхности электрода. Новый способ может быть осуществлен с использованием особенно простой и удобной электрохимической системы, которая включает в себя только один рабочий электрод (т.е. один зонд). Кроме того, не обязательно, чтобы рабочий электрод был функционализирован редокс-группами, и чтобы данные редокс-группы считались стабильными.
Новая методика, разработанная изобретателями, легко применима в широком спектре приложений в сфере индикации, включая, например, конкретное обнаружение целевых молекул в несущей среде (например, обнаружение диагностических биомаркеров в физиологических образцах), процедуры скрининга лекарственных препаратов, использование в гликоматричных системах, а также анализа параметров окружающей среды, таких как влажность окружающей среды, интенсивность света и температуры вблизи рабочего электрода.
Более подробно, методика, разработанная изобретателями, использует рабочий электрод, который функционализирован чувствительными элементами, электронным образом связанными с нижележащим электродом. Распределение электронов между чувствительными элементами и электродом связано с емкостным (и зарядно-динамическим) характерным признаком, который чувствительно изменяется по мере изменения локальной среды.
В способе согласно изобретению, значения измерения электрохимического импеданса получают в диапазоне приложенных потенциалов (а не на одном лежащем в основе потенциале, который прикладывают в известном способе ЭИС). Из множества значений измерений, полученных на различных потенциалах, получают значения измерения реальной и/или мнимой составляющей комплексной емкости С' и/или С'' как функции напряжения при фиксированной частоте (ω). Было обнаружено, что интегрирование измеренных значений С' и С'' по напряжению дает интегрированную величину измерения, которая в большой степени отражает и, следовательно, определяет природу локальной среды рабочего электрода.
В частности, настоящее изобретение предусматривает:
[1] Способ анализа, включающий:
(A) получение посредством электрохимической импедансной спектроскопии, проведенной в диапазоне приложенных потенциалов, множества значений измерений комплексного импеданса Z* системы, которая имеет рабочий электрод, содержащий подложку электрода, функционализированную чувствительными элементами, электрохимический отклик которых на приложенные потенциалы является чувствительным к изменению локальной среды электрода, причем чувствительные элементы имеют размер от 0,5 до 10 нм;
(B) преобразование указанного множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости С' на выбранной частоте ω и/или мнимой составляющей комплексной емкости С'' на выбранной частоте ω;
(C) интегрирование значений измерений (а) С', (b) С'' или (с) любой комбинации С' и С'' на выбранной частоте ω в зависимости от приложенного напряжения для получения интегрированной величины измерения и
(D) оценку локальной среды электрода по указанному интегрированному значению измерения.
Способ анализа согласно изобретению подходит для электрохимического анализа путем зондирования квантовой емкости функционализированного электрода. В связи с этим он может именоваться как «способ анализа на основе квантовой емкости».
Таким образом, изобретение также предлагает способ анализа на основе квантовой емкости, включающий этапы (А), (В), (С) и (D), как определено выше для способа анализа по изобретению.
[2] Устройство для использования в способе анализа, которое содержит:
- электрохимический спектрометр, содержащий рабочий электрод, противоэлектрод и потенциостат, причем рабочий электрод содержит подложку электрода, функционализированную чувствительными элементами, электрохимическая реакция которых на приложенные потенциалы является чувствительной к изменению локальной среды электрода, а чувствительные элементы имеют размер от 0,5 до 10 нм;
- приемник, выполненный с возможностью принимать от упомянутого электрохимического спектрометра входные данные, содержащие множество значений измерений комплексного импеданса Z* в диапазоне применяемых потенциалов; и
- процессор, выполненный с возможностью
(i) преобразования упомянутого множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости С' на выбранной частоте ω и/или мнимой составляющей комплексной емкости С'' на выбранной частоте ω, и
(ii) интегрирования упомянутых значений измерений (а) С', (b) С'' или (с) любую комбинацию С' и С'' на выбранной частоте ω как функцию приложенного напряжения для получения интегрированной величины измерения.
Способ анализа может представлять собой способ анализа на основе квантовой емкости, то есть устройство может быть использовано в способе анализа на основе квантовой емкости.
[3] Носитель данных, хранящий считываемый компьютером код для выполнения компьютером или сетью компьютеров, при этом код при его выполнении обусловливает реализацию компьютером или сетью компьютеров следующих этапов:
- получение из электрохимического спектрометра входных данных, содержащих множество значений измерений комплексного импеданса Z*, в диапазоне приложенных потенциалов;
- преобразование упомянутого множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости С' на выбранной частоте ω и/или мнимой составляющей комплексной емкости С'' на выбранной частоте ω; и
- интегрирование указанных значений измерений (а) С', (b) С'' или (с) любой комбинации С' и С'' на выбранной частоте ω как функции приложенного напряжения для получения интегрированной величины измерения.
Дополнительные предпочтительные признаки и варианты осуществления описаны в сопровождающем описании и прилагаемой формуле изобретения.
Краткое описание чертежей
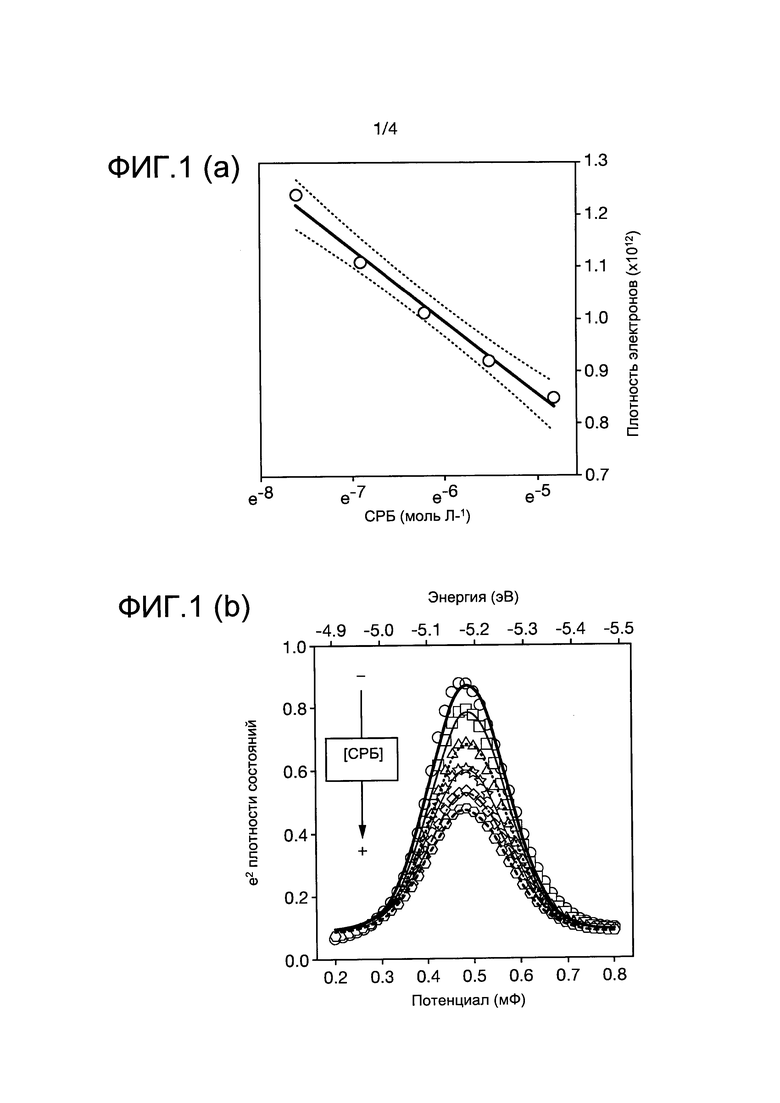
На фиг. 1 показаны аналитические кривые, построенные по данным электронной плотности и связанным с ней разбросом плотности состояний, полученным, как описано в данном примере. На фиг. 1(b) показано изменение Cq=e2 g(Е) (полученное из измерений С) в результате взаимодействия между анти-СРБ и СРБ (С-реактивный белок) в электроактивном молекулярном слое при различных концентрациях СРБ (на фигуре показана тенденция увеличения концентрации СРБ). Абсолютные значения энергии показаны на верхней оси x. Линии представляют собой корректировку экспериментальных данных (представленных точками) до ожидаемой гауссовой формы. На фиг. 1(a) показана линейная зависимость (аналитическая кривая) между натуральным логарифмом концентрации СРБ и электронной плотностью системы.
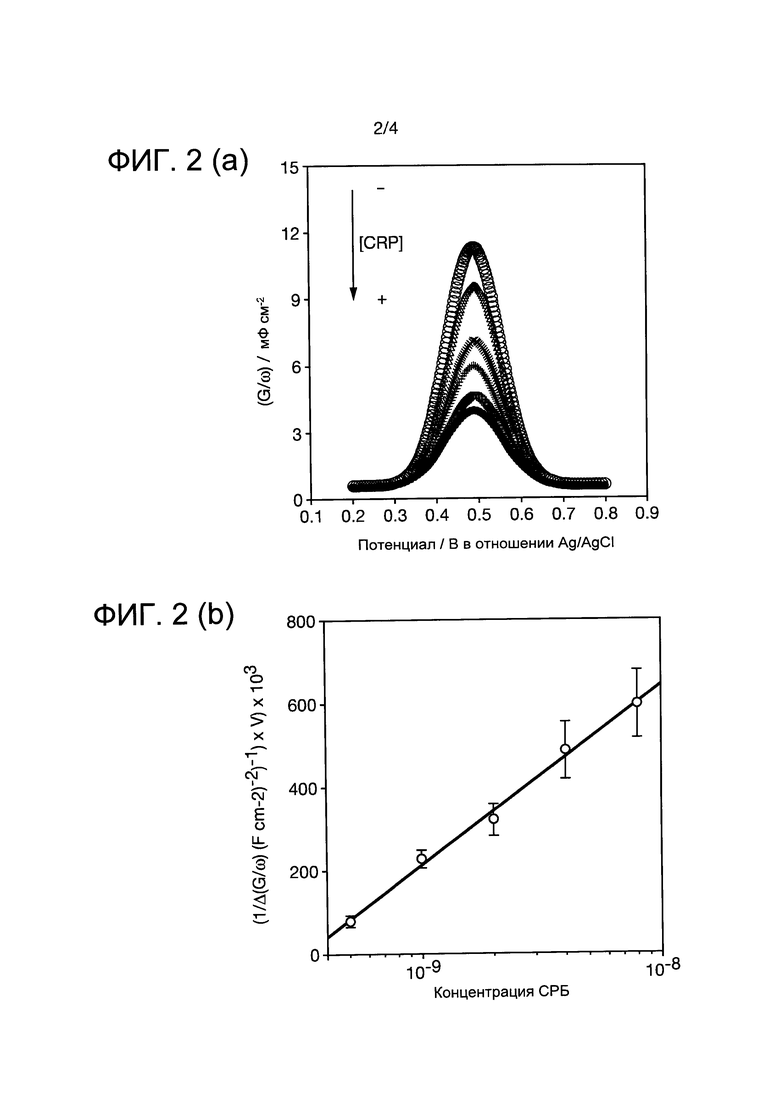
На фиг. 2 показаны изменения проводимости и связанная с ними аналитическая кривая, полученная, как описано в данном примере. На фиг. 2(а) показаны измеренные значения проводимости, связанные с изменениями концентрации электронов при различных концентрациях СРБ (на фигуре показана тенденция увеличения концентрации СРБ). На фиг. 2(б) показана аналитическая кривая, полученная на основе изменения электронной проводимости на слое в результате взаимодействия между анти-СРБ и СРБ.
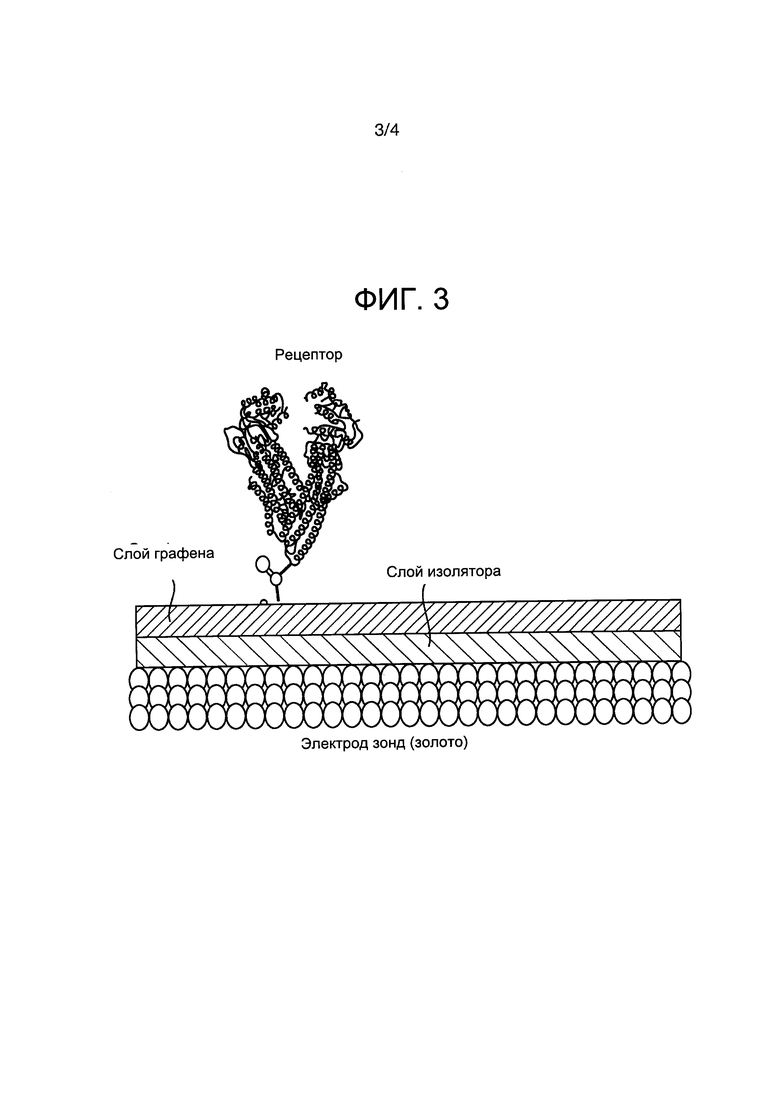
Фиг. 3 представляет собой схематическое изображение рабочего электрода (золото), функционализированного чувствительными элементами, которые электронным образом связаны с нижележащим электродом. В данном примере лист из графена размещен на электроде, а белок, служащий рецептором для целевого аналита, связан с графеном. Плотность состояний (квантовых состояний), измеренная экспериментально с помощью емкостной спектроскопии, использовали в качестве сигнала преобразователя.
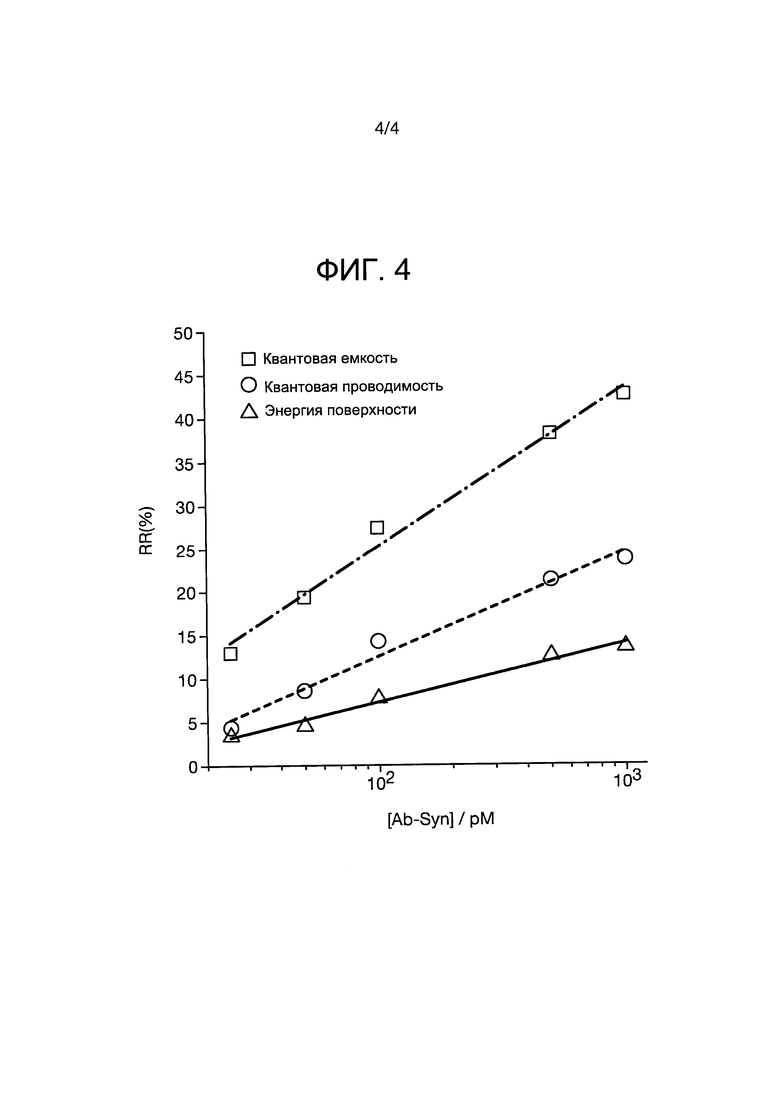
На фиг. 4 представлен график относительного отклика (RR), выраженного в процентах (ось y) для различных концентраций целевого анализируемого вещества, альфа-синуклеина (α-синуклеина) в единицах pM (ррm- частей на миллион) (ось x). На графике показаны сравнительные аналитические отклики на проводящем графеновом слое, расположенном в изоляционном слое на золотой подложке. Слой графена был модифицирован анти-α-синуклеином для обнаружения α-синуклеина. Очевидно, что как квантовая емкость, так и квантовая проводимость более чувствительны, чем энергия поверхности (как показано в уравнении 1 в примере 2). Чувствительность подтверждается наклоном линий, полученных в результате испытаний (S). Оптимальные аналитические частоты для емкости и параметра сопротивления составляют соответственно 118 и 22 Гц. Стандартное отклонение рассчитывали по трем измерениям для каждой заданной концентрации, для которых все r2>0,99.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Далее описаны дополнительные и предпочтительные признаки настоящего изобретения. Любой из признаков, описанных в данном документе, может быть объединен с любым из других признаков, описанных в данном документе, если не указано иное.
Способ анализа
Электрохимическая импедансная спектроскопия (ЭИС) представляет собой метод, известный специалистам. Обычно переменный потенциал переменного тока прикладывают на потенциал смещения (или постоянный ток) между рабочим электродом и противоэлектродом. Обычно электрохимическая импедансная спектроскопия включает в себя сканирование по диапазону частот ω переменного тока. Отношение входного сигнала (обычно переменного потенциала) к выходному сигналу (обычно переменному току) позволяет рассчитать импеданс. Обычно между входным сигналом и выходным сигналом существует разность фаз, так что импеданс можно рассматривать как комплексную функцию Z*, имеющую действительную часть (иногда называемую Z') и мнимую часть (иногда называемую Z'').
Диапазон частот переменного потенциала может составлять от 1 до 10 МГц. Амплитуда прилагаемого потенциала переменного тока, которая обычно имеет форму синусоидальной волны, может составлять от 1 мВ до 100 мВ, в некоторых случаях от 5 мВ до 50 мВ, в некоторых случаях от 5 мВ до 20 мВ, в некоторых случаях от 5 мВ до 15 мВ, в некоторых случаях от 8 мВ до 12 мВ, в некоторых случаях около 10 мВ.
При проведении ЭИС-измерения потенциал смещения (или потенциал постоянного тока) может быть установлен на любом желаемом значении. Данный потенциал постоянного тока или смещения в данном документе именуется как приложенный потенциал. Способ по настоящему изобретению включает получение множества значений измерений комплексного импеданса в диапазоне приложенных потенциалов (что обеспечивает последующее интегрирование по приложенному напряжению), то есть каждый из значений ЭИС-измерений получают при различных выбранных напряжениях. Как правило, множество значений измерений комплексного импеданса, полученных с помощью ЭИС, представляет по меньшей мере три значения измерения, предпочтительно по меньшей мере пять значений измерений, например по меньшей мере десять или даже по меньшей мере двадцать значений измерений, то есть диапазон приложенных потенциалов обычно содержит по меньшей мере три различных приложенных потенциала, предпочтительно, по меньшей мере, пять различных приложенных потенциалов, например, по меньшей мере десять или даже по меньшей мере двадцать различных приложенных потенциалов.
На этапе преобразования множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости С' используются значения измерения С' на (фиксированной/единичной) выбранной частоте ω. Как должно быть известно специалисту в данной области, С', как правило, изменяется, когда изменяется ω (т.е. С' является функцией ω). Соответствующим образом выбранная частота ω будет, конечно, зависеть от конструкции конкретного электрода и от характера применяемого способа анализа. Однако определение подходящей выбранной частоты ω является обычным делом. Квалифицированный специалист мог бы легко, например, определить величину ω, при которой полученные величины С' достаточно высоки (например, на уровне или близко к максимальной величине С' в частотном диапазоне, применяемом в обычном ЭИС-сканировании) и/или в соответствии с конкретной характеристикой локальной окружающей среды электрода, которую он хочет измерить. Аналогичные принципы применяют, когда множество значений измерений Z* преобразуются в множество значений измерений мнимой составляющей комплексной емкости С''.
Преобразование Z* на выбранной частоте ω в С' и/или С'' является стандартным и хорошо известным в данной области. В частности, в стандартном практическом анализе ЭИС функция Z*(ω) комплексного импеданса при определенном потенциале может быть преобразована с использованием фазы в комплексную емкость С*(ω) с ее вещественной и мнимой компонентами, используя уравнение С*(ω)=1/iωZ*(ω).
Интегрирование значений измерений С' и/или С'' как функции приложенного напряжения также может выполняться обычно, например, используя «способы площади под графиком», когда С', С'' или любая комбинация С' и С'' изображается в зависимости от приложенного напряжения и/или с помощью известных и стандартных компьютерных алгоритмов для интегрирования эмпирически полученных данных.
Было обнаружено, что интегрирование С' и С'' на выбранной частоте ω как функции приложенного напряжения обеспечивает «интегрированная величина измерения», которая подходит для анализа, то есть она может быть использовано для отчета о локальной среде электрода при проведении ЭИС-измерений. В частности, интегрированная величина измерения, полученная в результате обработки С', связана с плотностью состояний (ПС) системы, то есть отражает квантовую емкость (как показано на фиг. 2 данного примера).
На практике иногда может быть предпочтительным (исключительно для простоты работы) получить интегрированное измеренная величина путем интегрирования только одного из С' и С'' на выбранной частоте ω как функции приложенного напряжения. Поэтому в первом предпочтительном варианте осуществления множество значений измерений Z* преобразуют в множество значений измерений реальной составляющей комплексной емкости С' на выбранной частоте ω и эти значения измерений преобразуют как функцию приложенного напряжения для получения интегрированной величины измерения. Кроме того, во втором предпочтительном варианте осуществления множество значений измерений Z* преобразуют в множество значений измерений мнимой составляющей комплексной емкости С'' на выбранной частоте ω и эти значения измерения преобразуют как функцию приложенного напряжения для получения интегрированной величины измерения.
Однако поскольку могут использоваться как С', так и С'', специалисту должно быть очевидно, что интегрированная величина измерения может быть получено путем интегрирования любой комбинации С' и С'' на выбранной частоте ω как функции приложенного напряжения. Например, может быть использована любая сумма величин С' и С'' (где С' и/или С'', возможно, взвешивают с любыми отрицательными или положительными константами) или любое кратное или частное величин С' и С''.
Поэтому следует понимать, что термин «способ анализа на основе квантовой емкости», используемый в данном документе, охватывает способы, в которых интегрированную измеренную величину получают путем интегрирования только С'' на выбранной частоте ω как функции приложенного напряжения, так что интегрированная величина измерения отражает электропроводимость системы, а не квантовую емкость, а также способы, в которых интегрированную величину измерения получают путем интегрирования только С' или путем интегрирования любой комбинации С' и С'', как раскрыто выше.
Этап оценки локальной среды рабочего электрода обычно выполняют путем сравнения интегрированной величины измерения с одним или более эталонными значениями. Эталонная величина(ы) может быть получена путем получения одной или более соответствующих интегрированных величин измерений при условиях, когда локальное окружение электрода уже известно. Другими словами, эталонную величину(ы) используют для калибровки интегрированной величины измерений, полученной при выполнении способа в условиях испытаний с ожидаемыми величинами, которые были бы получены в конкретных известных условиях. Оценка локальной среды может быть как качественной, так и количественной. Калибровка устройства для использования в приложениях в сфере измерений хорошо известна и является стандартной в данной области техники, в том числе в способах, основанных на электрохимической импедансной спектроскопии.
Конструкция рабочего электрода
Рабочий электрод содержит подложку электрода, функционализированную чувствительными элементами.
Подложка электрода может содержать любой электропроводящий материал Подложка может содержать металл или углерод. Металл может представлять собой металл в элементарной форме или сплав металла. В некоторых случаях, вся подложка содержит металл или углерод. Подложка может содержать металл переходной группы. Подложка может содержать металл переходной группы, выбранный из любой из групп 9-11 Периодической таблицы. Подложка может содержать металл, выбранный, без ограничения, из рения, иридия, палладия, платины, меди, индия, рубидия, серебра и золота. Подложка может содержать металл, выбранный из золота, серебра и платины. Подложка может содержать углеродсодержащий материал, который может быть выбран из пиролитического графита с краевой плоскостью, пиролитического графита с базальной плоскостью, стеклообразного углерода, легированного бором алмаза, высокоупорядоченного пиролитического графита, углеродного порошка и углеродных нанотрубок. В предпочтительном варианте осуществления подложка содержит золото, например, подложка является золотой подложкой.
Поверхность электрода (то есть поверхность подложки) может быть плоской, имеющей в основном плоскую поверхность, например, без углублений, выступов и пор. Такие поверхности подложки могут быть легко получены с помощью таких методов, как полировка мелкодисперсными частицами, например распылением мелкодисперсных частиц, в некоторых случаях последовательностью этапов, когда размер мелких частиц уменьшается на каждом этапе полировки. Мелкие частицы могут, например, содержать материал на основе углерода, например, алмаз, и/или могут иметь частицы диаметром 10 мкм или менее, в некоторых случаях 5 мкм или менее, в некоторых случаях 3 мкм или менее, в некоторых случаях 1 мкм или менее, в некоторых случаях 0,5 мкм или менее, в некоторых случаях 0,1 мкм или менее. После полировки поверхность подложки можно промывать, например, ультразвуком, в некоторых случаях в подходящей жидкой среде, такой как вода, например, в течение периода времени, по меньшей мере, 1 минуты, например, примерно от 1 минуты до 10 минут. В некоторых случаях, поверхность подложки можно промывать абразивным, например кислым раствором, например, после полировки и этапов ультразвуковой промывки, если она используется. Абразивный раствор может содержать неорганическую кислоту, например, H2SO4 и/или пероксид, например, Н2О2 в подходящей жидкой среде, например воде. В некоторых случаях подложки можно подвергать электрохимической полировке, которая может следовать за любыми этапами, включающими в себя одну или более операций полировки мелкодисперсными частицами, промывку, например, ультразвуком и/или с использованием абразивного раствора. Электрохимическая полировка может включать в себя циклические импульсы между верхним и нижним потенциалами до достижения устойчивого пика восстановления, например, верхнего потенциала 0,5В или более, в некоторых случаях 1В или более, в некоторых случаях 1,25В или более, и меньший потенциал 0,5В или менее, в некоторых случаях 0,25В или менее, в некоторых случаях 0,1В или менее.
Подложка электрода функционализирована чувствительными элементами. Чувствительные элементы ограничены поверхностью электрода. В сочетании с подложкой электрода чувствительные элементы способны генерировать электрохимический отклик при проведении электрохимической импедансной спектроскопии. Кроме того, электрохимический отклик на приложенные потенциалы является чувствительным к изменению локальной среды электрода.
Данные свойства электрода могут быть достигнуты за счет того, что чувствительные элементы электронно связаны с поверхностью электрода. Под «электронно связанными» подразумевается, что электроны способны перераспределяться между поверхностью электрода и чувствительными элементами. Таким образом, когда электрод создают путем функционализации поверхности электрода при помощи чувствительных элементов, происходит перераспределение электронов между поверхностью электрода и чувствительными элементами. Аналогичным образом, перераспределение электронов между поверхностью электрода и чувствительными элементами происходит, когда происходит изменение локальной среды электрода, в частности изменение, соответствующее подложке или параметру окружающей среды, который определяется.
В общем случае чувствительный элемент может быть образован любым химическим соединением с другим химическим потенциалом электронов, чем потенциал электрода. Электрод и данное химическое соединение должны быть разделены очень коротким расстоянием, то есть в пределах наноразмера, например, менее 10 нм, например, менее 2 нм. Такое короткое расстояние определяет квантованный характер сигнала преобразователя. На самом деле, оно соединяет два энергетических состояния (состояния электродного зонда и самого химического соединения) посредством области рассеяния в пределах наноразмерной длины.
Следовательно, каждый из чувствительных элементов обычно имеет размер 10 нм или менее, например от 0,5 до 10 нм, предпочтительно от 1 до 5 нм, например от 1 до 3 нм. Указанный размер обычно является наибольшим размером, который проходит в виде прямой линии от конца чувствительного элемента, который прикреплен к поверхности электрода, к концу чувствительного элемента, который не прикреплен к поверхности электрода. Обычно все размеры (т.е. все измеряемые размеры) каждого из чувствительных элементов составляют 10 нм или менее, например от 0,5 до 10 нм, предпочтительно от 1 до 5 нм, например от 1 до 3 нм.
Чувствительный элемент может состоять из химического соединения с химическим потенциалом электронов, отличающимся от потенциала электрода, который соединен с поверхностью электрода посредством короткого химического линкера, при условии, что чувствительный элемент (то есть указанное химическое соединение и указанный линкер) имеет размер более 10 нм или менее, например от 0,5 до 10 нм, предпочтительно от 1 до 5 нм, например от 1 до 3 нм.
Обычно чувствительные элементы имеют конечную и ограниченную плотность электронных состояний ("ПС"), в отличие от подложки нижележащего электрода, которую можно считать имеющей по существу бесконечную плотность состояний. Таким образом, чувствительные элементы обычно отличаются от подложки электрода, то есть они не являются проводящей металлической или углеродной подложкой. Примеры подходящих чувствительных элементов включают редокс-активные вещества, молекулярную пленку, наночастицы, графен, углеродные нанотрубки и квантовые точки. Функционализация подложек электрода такими материалами хорошо известна в данной области техники и может быть достигнута с использованием обычных методов.
Типичными примерами подходящих редокс-активных веществ являются редокс-системы на основе осмия, ферроценов, хинонов и порфиринов, включая их производные. Производные хинина включают п-бензохинон и гидрохинон. Предпочтительно редокс-активным веществом является ферроцен или его производное, например алкил (например, C1-6алкил) или его ацилопроизводное. Наиболее предпочтительно редокс-активным веществом является ферроцен.
Важно отметить, что несмотря на то, что чувствительные элементы могут содержать редокс-активные вещества, не важно, что чувствительные элементы являются редокс-активными. Таким образом, в одном варианте осуществления настоящего изобретения рабочий электрод функционализирован при помощи чувствительных элементов, но рабочий электрод не функционализирован какими-либо редокс-активными веществами. Например, чувствительные элементы в данном варианте осуществления могут быть выбраны из молекулярной пленки, наночастиц, графена, углеродных нанотрубок и квантовых точек. Например, чувствительные элементы не содержат редокс-активных веществ.
В одном предпочтительном варианте осуществления чувствительные элементы содержат графен. Часто, например, подложка электрода содержит золото (например, подложка может быть золотой подложкой), а чувствительные элементы содержат графен. Графен может присутствовать в окисленной форме, то есть в виде оксида графена.
Рабочий электрод может дополнительно содержать промежуточный слой, расположенный между подложкой электрода и чувствительными элементами. Промежуточный слой может быть самособирающимся монослоем конкретного соединения, например цистеина. Указанное соединение может именоваться как изолятор.
В одном варианте осуществления подложка электрода содержит золото, рабочий электрод дополнительно содержит промежуточный слой, расположенный на подложке электрода, и чувствительные элементы, расположенные на промежуточном слое, содержат графен. Графен может присутствовать в окисленной форме, то есть в виде оксида графена. Промежуточный слой обычно содержит цистеин.
Термин «чувствительные элементы» может быть взаимозаменяемо использован с термином «наномерные объекты», что также описывает природу материала, функционализированного на поверхности электрода.
Области применения способа анализа
Принципы настоящего изобретения могут иметь широкое применение. В частности, можно выполнять анализа либо физического вещества, либо параметра окружающей среды, не являющейся физическим веществом. По существу, можно выполнять анализа любого вещества или параметра окружающей среды при условии, что изменение количества этого вещества или параметра приводит к изменению локальной среды рабочего электрода и, следовательно, изменению распределения электронов между чувствительными элементами и подложкой электрода. Поэтому рабочий электрод может быть сконструирован с учетом предполагаемого способа анализа, для которого он будет использоваться.
Анализа физических веществ
В одном варианте осуществления способ представляет собой способ анализа химического вещества, то есть химического соединения или группы химических соединений. В данном варианте осуществления на этапе (А) рабочий электрод находится в контакте с несущей средой, которая может содержать вещество, и электрохимический отклик чувствительных элементов на приложенные потенциалы является чувствительным к присутствию указанного вещества. Если несущая среда содержит вещество, то будет получено конкретная интегрированная величина измерения. Интегрированная величина измерения будет другой, если несущая среда не содержит это вещество. Аналогичным образом, по мере изменения концентрации вещества в несущей среде будут появляться изменения интегрированной величины измерения.
Несущая среда предпочтительно находится в жидкой форме, хотя возможна и газообразная среда. Несущей жидкостью (или газом) может быть любая жидкость (или газ), в которой вещество может быть суспендирована или растворена (или диспергирована). В одном варианте осуществления несущая жидкость содержит воду. В одном варианте осуществления несущая жидкость содержит биологическую жидкость. Биологическая жидкость может быть жидкостью, полученной от субъекта, который может быть человеком или животным. В одном варианте осуществления несущая жидкость содержит неразбавленную биологическую жидкость. Неразбавленная биологическая жидкость в данном контексте представляет собой биологическую жидкость, полученную от субъекта, например человека или животного, которая не разбавлена другой жидкостью. Биологическая жидкость может быть выбрана из крови, мочи, слез, слюны, пота и спинномозговой жидкости. В некоторых случаях, несущая среда содержит биологическую жидкость, полученную от субъекта, например человека или животного, и разбавителя. Разбавитель может быть добавлен к биологической жидкости после того, как она была получена от субъекта. Разбавитель может включать жидкую среду, например жидкую среду, выбранную из воды и спирта, например, этилового спирта. Несущая среда может дополнительно содержать буферный раствор. Буферный раствор может содержать фосфат.
В предпочтительном аспекте данного способа изобретения рабочий электрод содержит рецепторные агенты, способные связываться с указанным веществом, и электрохимический отклик чувствительных элементов на приложенные потенциалы является чувствительным к связыванию указанного вещества с рецепторными агентами. Предпочтительно рецепторные агенты способны специфически связываться с веществом. «Способность специфически связываться с веществом» обычно означает наличие константы связывания с веществом по меньшей мере в 50 раз превышающей константу связывания с любым другим веществом (веществами), присутствующим в несущей среде, предпочтительно по меньшей мере в 100 раз больше, и еще более предпочтительно по меньшей мере в 200 раз больше.
Рецепторные агенты могут быть включены в сами чувствительные элементы, или, в качестве альтернативы, подложка электрода может быть функционализирована как чувствительными элементами, так и рецепторными агентами, отличающимися от чувствительных элементов.
Примеры рецепторных агентов включают в себя антитела, фрагменты антител, нуклеиновые кислоты, аптамеры, олигосахариды, пептиды и белки. Предпочтительно, рецепторные агенты выбирают из антител, нуклеиновых кислот и пептидов. Наиболее предпочтительно рецепторные агенты представляют собой антитела.
Антитело или фрагмент антитела могут быть выбраны из одного или более классов IgA, IgD, IgE, IgG и IgM. В предпочтительном варианте осуществления антитело или фрагмент антитела относится к типу IgG. Антитело избирательно связывается с представляющей интерес веществом. Антитело или фрагмент антитела могут быть получены из млекопитающего, включая, но не ограничиваясь, человека, мышь, крысу, кролика, козу, овцу и лошадь. Аптамер может быть выбран из пептидного аптамера, ДНК-аптамера и РНК-аптамера.
Антитело может быть, например, антителом анти-альфа-синуклеина (анти α-синуклеином).
Очевидно, что выбор рецепторных агентов для данного электрода определяется назначением интересующего вещества, т.е. «целью», представляющей интерес.
Например, цель может представлять собой альфа-синуклеин (α-синуклеин), и в этом случае рецепторные агенты обычно содержат или состоят из анти-α-синуклеина.
В одном варианте рабочий электрод содержит рецепторные агенты; чувствительные элементы содержат графен; и подложка электрода содержит золото. Рецепторные агенты могут быть такими же, как определено выше, например, они могут содержать или состоять из анти-α-синуклеина. Графен может присутствовать в окисленной форме, то есть в виде оксида графена, поскольку это может облегчить присоединение рецепторных агентов.
Рабочий электрод может дополнительно содержать промежуточный слой, расположенный на подложке электрода, между подложкой электрода и чувствительными элементами. Промежуточный слой обычно содержит цистеин.
Обнаружение целевых молекул, например, для диагностики
Вещество может быть целевыми молекулами, то есть молекулами, которые могут присутствовать или не присутствовать в несущей среде, в некоторых случаях вместе с одной или более другими нецелевыми молекулами, и которые пользователи хотят обнаружить/индицировать. В большинстве случаев способ является способом определения концентрации указанных целевых молекул в указанной несущей среде.
Хотя данный способ может быть использован для обнаружения ряда целевых молекул, одним из особенно полезных аспектов является обнаружение веществ, представляющий интерес для диагностики. Индикативное обнаружение биомаркеров в физиологических образцах порождает все возрастающий интерес к диагностике. Способы по настоящему изобретению могут быть использованы чтобы индикативно и выборочно обнаруживать (и определять концентрацию) конкретные биомаркеры, в частности путем обеспечения подложки электрода, функционализированного рецепторными агентами, которые способны специфически связываться с представляющим интерес биомаркером.
Примеры целевых молекул включают в себя вещества, выбранные из группы, состоящей из СРБ-белка, инсулина и маркера одного или более из нейродегенерации, рака, инфаркта миокарда, диабета и общей травмы.
В более общем плане, подходящие целевые молекул для обнаружения в соответствии со способами по изобретению включают в себя белки, полипептиды, антитела, наночастицы, лекарственные препараты, токсины, вредные газы, опасные химические вещества, взрывчатые вещества, вирусные частицы, клетки, многоклеточные организмы, цитокины и хемокины, гаметоцит, органеллы, липиды, последовательности нуклеиновых кислот, олигосахариды, химические интермедиаты метаболических путей и макромолекулы. В предпочтительных вариантах осуществления целевые молекулы включают в себя, по существу, биологическую молекулу или состоящую из нее более подходящую биологическую макромолекулу, наиболее подходит полипептид. Биомаркер является одним примером биологической молекулы, представляющей особый интерес.
Если целевые молекулы содержат или являются белком, белок может быть выбран, без ограничения, из нативных белков, денатурированных белков, фрагментов белка и прокариотически или эукариотически экспрессированных белков. Белок может иметь обычный смысл в данной области, но наиболее предпочтительно термин «белок» относится к молекуле полипептида. Такой полипептид может содержать модификации, такие как гликозилированные, фосфорилированные или другие подобные модификации.
Если целевые молекулы являются антителом, антитело может быть выбрано из одного или более классов IgA, IgD, IgE, IgG и IgM.
Если целевые молекулы являются наночастицей, наночастица может быть выбрана (без ограничения) из одной или нескольких изолирующих, металлических или полупроводниковых наночастиц.
Если целевые молекулы являются наркотическим средством, наркотическое средство может быть выбрано (без ограничения) из спирта (например, этилового спирта), амфетамина, амилнитрата, героина, кетамина, анаболических стероидов, ЛСД, растворителей, каннабиса, кокаина (например, гидрохлорида кокаина или «кокса»), табака, транквилизаторов, крэка (т.е. свободного от кокаина основания), экстази и/или гаммогидроксибутирата (GHB). Альтернативно, в некоторых вариантах осуществления наркотическое средство может быть лекарственным веществом.
Целевыми молекулами могут быть средства возможного наркотического применения, например химический или биологический объект, который может быть протестирован или проверен на конкретную активность или свойства с использованием настоящего изобретения.
Если целевые молекулы являются токсином, токсин может быть выбран (без ограничения) из одного или более токсинов, выделяемых из животных, растений или бактерий.
Если целевые молекулы является вирусной частицей, вирусная частица может быть выбрана (без ограничения) из одной или нескольких вирусных частиц с геномом и без него.
Если целевые молекулы являются клеткой, клетка может быть выбрана (без ограничения) из одной или нескольких плюрипотентных клеток-предшественниц, клеток человека (например, В-клеток, Т-клеток, мастоцитных клеток, фагоцитов, нейтрофилов, эозинофилов, макрофагов, эндотелиальных клеток), раковых клеток (например, тех, которые выделяют из рака печени, цервикальной кости, поджелудочной железы, колоректальных, предстательной железы, эпидермальных, головного мозга, молочной железы, легких, яичек, почек, мочевого пузыря), одноклеточных организмов нечеловеческого происхождения, грибов, бактерий, растительных клеток, яиц паразитов, плазмодии и микоплазмы.
Если целевые молекулы являются органеллой, органелла может быть выбрана (без ограничения) из одного или более ядер, митохондрий, аппарата Гольджи, эндоплазматического ретикулума, лизосомы, фагосомы, внутриклеточных мембран, внеклеточных мембран, цитоскелета, ядерной мембраны, хроматина, ядерной матрицы и хлоропластов.
Если целевые молекулы является липидом, липид может быть выбран (без ограничения) из одного или более сигнальных липидов структурных липидов, фосфолипидов, гликолипидов и жирных кислот.
Если целевые молекулы являются последовательностью нуклеиновой кислоты, последовательность нуклеиновой кислоты может быть выбрана (без ограничения) из одной или более ДНК, кДНК, РНК, рРНК, мРНК, микроРНК и тРНК.
Если целевые молекулы являются олигосахаридом, олигосахарид может быть выбран (без ограничения) из одного или более олигосахаридов человеческого, животного, растительного, грибкового или бактериального происхождения.
Целевые молекулы могут быть любым антигеном или аналитом, который указывает на конкретное заболевание. Цель может быть выбрана, например, из С-реактивного белка (СРБ), конвертирующего фермента ангиотензина I (пептидилдипептидазы А) 1; адипонектина; расширенного рецептора конечного продукта гликозилирования; альфа-2-НS-гликопротеина; ангиогенина, рибонуклеазы, рибонуклеазы 5 семейства А; аполипопротеина  ; аполипопротеина В (включая антиген Аg(х)); аполипопротеина Е; BCL-2-ассоциированного Х-белка; В-клеточной CLL/лимфомы 2; комплемента С3; хемокина (С-С мотив) лиганда 2; растворимого CD 14, растворимого CD 40; связанного с пентаксином Cdk5; катепсина В; дипептидилпептидазы IV; усиливающего рост эпидермального вещества; эндоглина; синтазы жирных кислот Fas; фибриногена; ферритина; гормона роста 1; аланинаминотрансферазы; усиливающего рост гепатоцита; гаптоглобина; белка 1В теплового шока 70 кДа белка; молекулы 1 межклеточной адгезии; инсулиноподобного вещества 1, усиливающего рост (соматомедина С); инсулиноподобного рецептора 1, усиливающего рост; инсулиноподобного связывающего белка 1, усиливающего рост; инсулиноподобного связывающего белка 2, усиливающего рост; инсулиноподобного связывающего белка 3, усиливающего рост; интерлейкина 18; альфа-рецептора интерлейкина-2; бета рецептора интерлейкина-2; интерлейкина 6 (бета-интерферона 2); рецептора интерлейкина-6; переносчика сигнала интерлейкина 6 (рецептора онкостатина М, gр130); интерлейкина 8; активина А; лептина (гомолога тучности, мышь); активатора плазминогена, ткань; проопиомеланокортина (адренокортикотропин/бета-липотропина/альфа-меланоцит-стимулирующего гормона/бета-меланоцит-стимулирующего гормона/бета-эндорфина); проинсулина; резистина; селектина Е (молекулы адгезии эндотелия 1); селектина Р (антигена CD62 белка гранулированной мембраны 140 кДа,); ингибитора серпиновой пептидазы, клада Е (нексина, ингибитора активатора плазминогена типа 1), элемент 1; сывороточной/глюкокортикоидной регулируемой киназы; глобулина, связывающего полового гормон; трансформирующего фактора роста, бета 1 (болезнь Камурати-Энгельмана); тканевого ингибитора металлопептидазы TIMP 2; элемента 1В надсемейства рецепторов фактора опухолевого некроза,; молекулы адгезии сосудистых клеток 1 (VCAM-1); фактора роста эндотелия сосудов; Фактора II, фактора V, фактора VIII, фактора IX, фактора XI, фактора XII, продуктов разложения F/фибрина, комплекса тромбин-антитромбина III, фибриногена, плазминогена, протромбина и фактора фон Виллебранда и тому подобного. Маркеры, полезные для диабета, включают в себя, например, С-реактивный белок; глюкозу; инсулин; TRIG; GPT; HSPA1В; IGFBP2; LEP; ADIPOQ; CCL2; ENG; HP; IL2RA; SCp; SHBG; И TIMP2. В настоящее время предпочтительные целевые вещества включают в себя целевые вещества, выбранные из группы, состоящей из СРБ, инсулина и маркера одного или более из нейродегенерации, рака, инфаркта миокарда, диабета и общей травмы.
; аполипопротеина В (включая антиген Аg(х)); аполипопротеина Е; BCL-2-ассоциированного Х-белка; В-клеточной CLL/лимфомы 2; комплемента С3; хемокина (С-С мотив) лиганда 2; растворимого CD 14, растворимого CD 40; связанного с пентаксином Cdk5; катепсина В; дипептидилпептидазы IV; усиливающего рост эпидермального вещества; эндоглина; синтазы жирных кислот Fas; фибриногена; ферритина; гормона роста 1; аланинаминотрансферазы; усиливающего рост гепатоцита; гаптоглобина; белка 1В теплового шока 70 кДа белка; молекулы 1 межклеточной адгезии; инсулиноподобного вещества 1, усиливающего рост (соматомедина С); инсулиноподобного рецептора 1, усиливающего рост; инсулиноподобного связывающего белка 1, усиливающего рост; инсулиноподобного связывающего белка 2, усиливающего рост; инсулиноподобного связывающего белка 3, усиливающего рост; интерлейкина 18; альфа-рецептора интерлейкина-2; бета рецептора интерлейкина-2; интерлейкина 6 (бета-интерферона 2); рецептора интерлейкина-6; переносчика сигнала интерлейкина 6 (рецептора онкостатина М, gр130); интерлейкина 8; активина А; лептина (гомолога тучности, мышь); активатора плазминогена, ткань; проопиомеланокортина (адренокортикотропин/бета-липотропина/альфа-меланоцит-стимулирующего гормона/бета-меланоцит-стимулирующего гормона/бета-эндорфина); проинсулина; резистина; селектина Е (молекулы адгезии эндотелия 1); селектина Р (антигена CD62 белка гранулированной мембраны 140 кДа,); ингибитора серпиновой пептидазы, клада Е (нексина, ингибитора активатора плазминогена типа 1), элемент 1; сывороточной/глюкокортикоидной регулируемой киназы; глобулина, связывающего полового гормон; трансформирующего фактора роста, бета 1 (болезнь Камурати-Энгельмана); тканевого ингибитора металлопептидазы TIMP 2; элемента 1В надсемейства рецепторов фактора опухолевого некроза,; молекулы адгезии сосудистых клеток 1 (VCAM-1); фактора роста эндотелия сосудов; Фактора II, фактора V, фактора VIII, фактора IX, фактора XI, фактора XII, продуктов разложения F/фибрина, комплекса тромбин-антитромбина III, фибриногена, плазминогена, протромбина и фактора фон Виллебранда и тому подобного. Маркеры, полезные для диабета, включают в себя, например, С-реактивный белок; глюкозу; инсулин; TRIG; GPT; HSPA1В; IGFBP2; LEP; ADIPOQ; CCL2; ENG; HP; IL2RA; SCp; SHBG; И TIMP2. В настоящее время предпочтительные целевые вещества включают в себя целевые вещества, выбранные из группы, состоящей из СРБ, инсулина и маркера одного или более из нейродегенерации, рака, инфаркта миокарда, диабета и общей травмы.
Целевые молекулы могут, например, содержать или состоять из альфа-синуклеина (α-синуклеина). Если целевое вещество является или содержит α-синуклеин, рецепторные агенты могут содержать или состоять из антител α-синуклеина.
Целевые молекулы могут быть объектом, связанным с контролем диабета. В одном варианте осуществления объект может быть выбран из глюкозы, инсулина, альфа-рецептора интерлейкина-2 (IL2-RA), С-реактивного белка (СРБ) и гликогемоглобина  . Если целевым веществом является глюкоза, рецепторные агенты могут быть выбраны, например, из элемента молекулярного распознавания GDH-FAD-анализа (анализа глюкозодегидрогеназы-флавин-адениндинуклеотида) или белка, связывающего глюкозу/галактозу («GGBP») (Scholle, и др., Mol. Gen. Genet 208:247-253 (1987)). Если объектом является IL-2RA, рецепторные агенты могут содержать или состоять из моноклонального антитела, специфичного для IL-2RA. Если целевой молекулой является С-реактивный белок или содержащее его вещество, предпочтительно это С-реактивный белок человека. Если целевой молекулой является С-реактивный белок, рецепторные агенты могут содержать или состоять из анти-СРБ. Если целевой молекулой является инсулин или веществом, содержащим инсулин, рецепторные агенты могут состоять из инсулинового антитела.
. Если целевым веществом является глюкоза, рецепторные агенты могут быть выбраны, например, из элемента молекулярного распознавания GDH-FAD-анализа (анализа глюкозодегидрогеназы-флавин-адениндинуклеотида) или белка, связывающего глюкозу/галактозу («GGBP») (Scholle, и др., Mol. Gen. Genet 208:247-253 (1987)). Если объектом является IL-2RA, рецепторные агенты могут содержать или состоять из моноклонального антитела, специфичного для IL-2RA. Если целевой молекулой является С-реактивный белок или содержащее его вещество, предпочтительно это С-реактивный белок человека. Если целевой молекулой является С-реактивный белок, рецепторные агенты могут содержать или состоять из анти-СРБ. Если целевой молекулой является инсулин или веществом, содержащим инсулин, рецепторные агенты могут состоять из инсулинового антитела.
Способы на основе гликоматрицы
Способы по изобретению также могут использоваться в приложениях, которые включают в себя гликоматрицы. Гликоматрица представляет собой матрицу, в которой каждая единица матрицы содержит конкретные углеводные агенты (которые отличаются от углеводных агентов в других единичных элементах матрицы). В контексте настоящего изобретения матрица содержит множество отдельно адресуемых электрохимических систем, рабочий электрод каждой из которых функционализирован рецепторными агентами, которые представляют собой углеводные агенты. Например, матрица углеводных агентов может составлять гликом или часть гликома организма, например, человека.
Таким образом, в варианте осуществления способа по изобретению вещество (которое исследуют) выбирается из белка лектина, гликоэнзима и углеводсвязывающего антитела, тогда как рецепторные агенты представляют собой углеводные агенты. Кроме того, в данном способе анализа рабочий электрод может образовывать часть гликоматрицы, содержащей множество рабочих электродов, каждый из которых функционализирован различными углеводными агентами. Таким образом, способ может включать в себя выполнение этапов (А)-(D) способа на каждом из рабочих электродов, содержащихся в гликоматрице.
Скрининг/обнаружение лекарственных препаратов
Другое применение способов изобретения относится к области скрининга и обнаружения лекарственных препаратов. В известных системах на основе матриц для скрининга лекарственного препарата каждая единица матрицы содержит доступные рецепторные агенты, привязка к которым потенциального лекарственного препарата будет прежде всего указывать на то, что потенциальный лекарственный препарат может представлять терапевтический интерес. Например, известны методы скрининга, основанные на таксол-тубулиновой модели. В данной модели активность взаимодействия известного противоракового лекарственного таксола с протуцином тубулина используется в качестве эталона, с которым сравнивают новые потенциальные лекарственные препараты.
В частности, в способе по изобретению вещество (исследуемое) может быть потенциальным лекарственным препаратом, а рецепторные агенты могут представлять собой агенты, которые способны связываться с известным эталонным лекарственным препаратом. Таким образом, анализа связывания потенциального лекарственного препарата с рецепторными агентами имел бы корреляцию с потенциальным лекарственным препаратом, который ведет себя аналогично известному эталонному лекарственному препарату (и, следовательно, заслуживает дальнейшего изучения). В отличие от этого, неспособность к связыванию может привести к отказу от потенциального лекарственного препарата.
Следует понимать, что в данном способе анализа рабочий электрод может формировать часть матрицы, содержащей множество рабочих электродов, каждый из которых функционализован указанными рецепторными агентами, причем матрица подходит для одновременного скрининга множества потенциальных лекарственных препаратов. Такая настройка матрицы обеспечивает высокую пропускную способность скрининга многих потенциальных лекарственных препаратов за один раз.
Анализа параметров окружающей среды
В еще одном дополнительном варианте осуществления способ представляет собой способ анализа изменения параметров окружающей среды в локальной среде электрода. Примерами таких параметров окружающей среды является температура локальной среды, интенсивность света в локальной среде (например, интенсивность видимого света или, альтернативно или дополнительно, интенсивность УФ-излучения) и количество влаги в локальной среде.
В таких способах взаимодействие света, температуры или окружающей/поверхностной воды влияет на измеренную плотность состояний или плотность электронов (полученную из интегрированной плотности состояний) на чувствительных элементах. Соответствующее изменение электрохимического отклика является измеримым и может быть легко откалибровано для последующего применения.
Устройство
Настоящее изобретение также предусматривает устройство для использования в способе анализа, в основном, способе анализа по настоящему изобретению. Данное устройство содержит электрохимический спектрометр, рабочий электрод, функционализованный чувствительными элементами, то есть электрохимический спектрометр, который специально приспособлен для осуществления способа по настоящему изобретению. Рабочий электрод является таким, как описано в данном документе.
Устройство дополнительно содержит:
(а) приемник, выполненный с возможностью приема от упомянутого электрохимического спектрометра входных данных, содержащих множество значений измерений комплексного импеданса Z* в диапазоне приложенных потенциалов; и
(b) процессор, выполненный с возможностью (i) преобразования упомянутого множества значений измерений Z* в множество значений измерений реального и/или мнимого компонента комплексной емкости С' и/или С'' на выбранной частоте ω, и (ii) интегрирования упомянутых значений измерений С', С'' или комбинации С' и С'' на выбранной частоте ω как функции приложенного напряжения для получения интегрированной величины измерения. Приемник и процессор могут быть частью компьютера. Функциональность приемника и процессора может быть достигнута путем программирования компьютера для приема входных данных способа согласно изобретению и для обработки этих данных для получения интегрированной величины измерения, как описано в данном документе.
Приемник может принимать входные данные либо непосредственно из спектрометра, либо косвенно, например, путем считывания данных из файла данных, созданного спектрометром.
Под «программированием» подразумевается, что компьютер снабжен компьютерочитаемым программным кодом, обеспечивающим команды для выполнения этапов приема входных данных, преобразования в реальные и/или мнимые части комплексной емкости C' и/или С'' и интегрирования для получения интегрированной величины измерения в автоматическом режиме, например без вмешательства пользователя. Компьютер может, например, включать в себя физический компьютер, снабженный соответствующей компьютерной программой. Данная программа может, например, предоставляться на носителе данных для выполнения компьютером или в сети компьютеров. Среда хранения данных может быть неотъемлемой частью самого компьютера, например, жестким диском или съемным носителем данных, таким как оптический диск или портативное запоминающее устройство, например, USB-устройство флэш-памяти.
Таким образом, для осуществления способа по настоящему изобретению может быть использовано устройство, посредством которого оператор выполняет необходимые ЭИС-измерения на этапе (А) способа согласно изобретению с использованием электрохимического спектрометра, и в котором последующие этапы затем выполняются автоматически для завершения способа анализа.
Компьютер может быть дополнительно запрограммирован для вывода данных, генерируемых из указанного интегрированной величины измерения. Этот вывод может выполняться на устройство отображения и/или в компьютерный файл и/или в виде потока данных на другое устройство. Эти данные могут содержать простые числовые данные, соответствующие самой интегрированной величине измерения. В качестве альтернативы данные могут содержать указание о наличии, отсутствии или концентрации измеряемого вещества или качественные или количественные показатели обнаруженного параметра окружающей среды в исследуемой системе. Как будет очевидно специалисту в данной области техники, компьютер может быть запрограммирован для предоставления таких данных путем его дополнительного программирования с калибровочными (эталонными) значениями, относящимися к интегрированной величине измерения.
Кроме того, изобретение предусматривает носитель данных, хранящий считываемый компьютером код. При реализации, данный код способен давать команду приемнику и процессору, описанным в данном документе (то есть, в качестве компьютера, как описано выше) выполнять этапы, связанные с приемником и процессором в устройстве по настоящему изобретению.
Пример 1
Рабочий электрод готовили следующим образом. Смешанные самособирающиеся монослои (ССМ) были сформированы на золотой подложке электрода путем выдерживания в растворе пентадекантиола и 11-ферроценил-ундеканоата. Рецептивные поверхности были получены путем их погружения в анти-СРБ.
Аликвоты С-реактивного белка (СРБ) добавляли на границу раздела с концентрациями от 0 нмоль/л до 8,0 нмоль/л в фосфатно-солевом растворе (в частности, измерения проводились при концентрациях 0, 0,5, 1,0, 2,0, 4,0 и 8,0 нмоль/л). Электрохимические измерения проводились с помощью потенциостата с использованием трехэлектродной конфигурации с 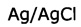 в качестве эталона, платины в качестве счетчика и вышеописанного рабочего электрода. Все эксперименты проводились за три раза и измеренные значения, представленные на фигурах, представляют собой соответствующим образом усредненные средние значения.
в качестве эталона, платины в качестве счетчика и вышеописанного рабочего электрода. Все эксперименты проводились за три раза и измеренные значения, представленные на фигурах, представляют собой соответствующим образом усредненные средние значения.
Измерения электрохимической импедансной спектроскопии проводились в диапазоне потенциалов от +0,2В до +0,8В в отношении 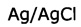 с шагом потенциала 15 мВ и постоянной частотой 20 МГц.
с шагом потенциала 15 мВ и постоянной частотой 20 МГц.
Плотности состояний на фиг. 1 и 2 были получены таким образом. Формы на фиг. 1 (б) были построены непосредственно на основе реальной части комплексной емкости на частоте 20 МГц. В частности, форма плотности состояний отражает форму квантовой емкости, т.е. е2 плотности состояний. Линии представляют собой экспериментальные данные (представленные точками) для гауссианы, включая эффекты термического уширения. Таким образом, плотность электронов N (с термическим уширением) представлена интегралом данной гауссианы в виде
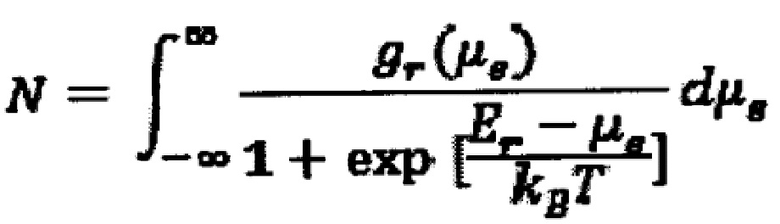
где:
gr(μe) - функция плотности состояний (гауссиана как функция потенциала показана на фиг 1b),
Еr - окислительно-восстановительный потенциал редокс-веществ, связанных с электродом,
kB - постоянная Больцмана,
T - абсолютная температура и
μе - химический потенциал электронов электрода, связанный с потенциалом зависимостью μе=-cV.
Затем учитывали N как функцию концентрации СРБ, как показано на фиг 1(a). В частности, плотность электронов рассчитывали путем интегрирования кривых на фиг. 1(б), нормализированных по объему молекулярного слоя (для молекулярного слоя 11-ферроценил-ундекантиола использовали длину волны 3,5 нм).
Фиг. 2 была построена на основе выражения мнимой емкости комплексной емкости на частоте 20 мГц; она учитывает проводимость редокс-пленки (см. фиг. 2(а)). Интеграл проводимости также определяет плотность электронов. Данная плотность электронов также обеспечивает средство измерения событий связывания на молекулярной пленке (см. аналитическую кривую, показанную на фиг. 2(b)).
Пример 2
Изобретатели продемонстрировали, что, используя методику емкостной спектроскопии, можно экспериментально получить доступ к молекулярным квантованным состояниям и их заполнению (квантовая емкость) и использовать данный сигнал в качестве преобразователя для приложений биосенсора; это может быть сделано, поскольку измеренная емкость очень чувствительна к любым изменениям (электростатическим или химическим) окружающей среды. Кроме того, изобретатели продемонстрировали, что как квантовая емкость системы, так и квантованное сопротивление, связывающие квантовые молекулярные доступные состояния с электродом/зондом, могут использоваться в качестве сигналов преобразователя. Изобретатели также поняли, что в соответствии с функциональной теорией плотности (методология квантовой механики) функция плотности электронов 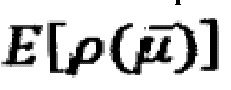 тесно связана с емкостной спектроскопией следующим образом
тесно связана с емкостной спектроскопией следующим образом
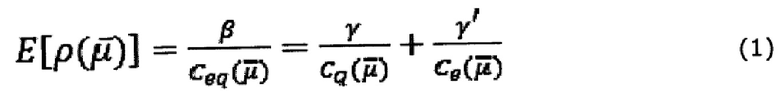
где
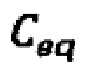 - электрохимическая емкость, которая содержит две составляющие,
- электрохимическая емкость, которая содержит две составляющие, 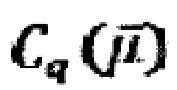 (квантовую) и
(квантовую) и 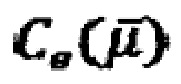 (электростатическую).
(электростатическую).
Из этого следует, что любое миниатюрное устройство, связанное с электродом, содержащее ограниченные электронные состояния или нанодиапазонные размеры, потенциально может использоваться в сенсорном формате в том случае, если квантовомеханические состояния, содержащиеся в 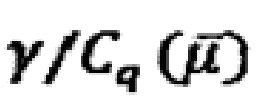 , изменяются при каком-либо внешнем событии (например, связывании белка). Изобретатели в данном документе показывают, что в случае установки листа графена над зондом рабочего электрода система может быть очень чувствительной к таким изменениям, когда связанный с ним белок служит в качестве рецептора аналита (целевого белка), как показано на фиг. 3. В такой системе энергия квантовомеханических состояний, емкость и сопротивление (связанные с соединением между электронными состояниями графена и состояниями золота/зонда электрода) могут быть использованы в качестве сигналов преобразователя. Это показано на фиг. 4.
, изменяются при каком-либо внешнем событии (например, связывании белка). Изобретатели в данном документе показывают, что в случае установки листа графена над зондом рабочего электрода система может быть очень чувствительной к таким изменениям, когда связанный с ним белок служит в качестве рецептора аналита (целевого белка), как показано на фиг. 3. В такой системе энергия квантовомеханических состояний, емкость и сопротивление (связанные с соединением между электронными состояниями графена и состояниями золота/зонда электрода) могут быть использованы в качестве сигналов преобразователя. Это показано на фиг. 4.
Устройства были изготовлены путем осаждения оксида графена на золотом электроде (механически и электрохимически полированном) через промежуточный самособирающийся монослой (изоляционный слой на фиг. 3, изготовленный из цистеина) путем погружения дисперсии графена в воду с периодом выдерживания в течение 8 часов. Рецепторы присоединяли после того, как СВМА, цвиттер-ионный мономер, был наложен при помощи электростатической сборки (на отрицательно заряженном конце графенового оксида) на электрод для создания поверхности с низким загрязнением. Перед наложением рецептивного вещества (анти-α-синуклеина) поверхностно-модифицированные электроды промывали H2O и сушили в потоке газообразного азота. Затем концевые карбоксильные группы активировали 1-этил-3-(3-диметиламинопропил) карбодиимидом (EDC) (0,4 М) и N-гидроксисукцинимидом (NHS) (0,1 М) в деионизированной воде в течение 40 мин и затем подвергали взаимодействию 1 мкМ соответствующей рецепторной молекулы в фосфатно-солевом растворе PBS в течение 1 часа при комнатной температуре. Поверхности раздела погружали в 1 М этаноламин (pH около 8,5) для дезактивации любых непрореагировавших активированных карбоксильных групп и промывали фосфатно-солевым раствором перед измерениями (схематически показано на фиг. 3).
Отклик (R), полученный для каждого параметра (по фиг. 4), т.е. квантовой емкости 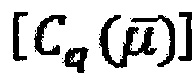 , квантовой проводимости
, квантовой проводимости 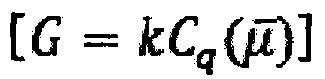 и поверхностной энергии (Е[ρ]) (см. также выражение (1)), оценивались в диапазоне целевой концентрации (α-синуклеина). Для нормализации сигнала преобразователя для каждого из этих параметров использовали относительный отклик. Относительный отклик (RR), для различных концентраций целевого вещества на резонансной частоте, т.е. где k-G/Cq максимизируется, вычисляли по следующей формуле
и поверхностной энергии (Е[ρ]) (см. также выражение (1)), оценивались в диапазоне целевой концентрации (α-синуклеина). Для нормализации сигнала преобразователя для каждого из этих параметров использовали относительный отклик. Относительный отклик (RR), для различных концентраций целевого вещества на резонансной частоте, т.е. где k-G/Cq максимизируется, вычисляли по следующей формуле
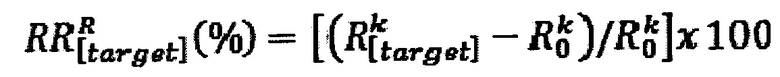
где
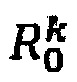 представляет собой начальную величину параметров в случае отсутствия аналита (чистое измерение) и
представляет собой начальную величину параметров в случае отсутствия аналита (чистое измерение) и
 является величиной параметра после экспозиции функционализированного рецепторами электрода соответствующей целевой концентрацией на той же частоте k.
является величиной параметра после экспозиции функционализированного рецепторами электрода соответствующей целевой концентрацией на той же частоте k.
Собирая RR в диапазоне целевых концентраций можно построить аналитические кривые для каждого параметра, как показано на фиг 4.
Использование: для электрохимического анализа. Сущность изобретения заключается в том, что способ анализа для анализа химического вещества включает: (A) получение посредством электрохимической импедансной спектроскопии, проведенной в диапазоне приложенных потенциалов, множества значений измерений комплексного импеданса Z* системы, которая имеет рабочий электрод, который находится в контакте с несущей средой, которая может содержать указанное вещество, причем рабочий электрод содержит рецепторные агенты, способные связываться с указанным веществом, где рабочий электрод содержит подложку электрода, функционализированную чувствительными элементами, электрохимический отклик которых на приложенные потенциалы является чувствительным к связыванию указанного вещества с указанными рецепторными агентами, и чувствительные элементы имеют размер от 0,5 до 10 нм; (B) преобразование упомянутого множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости C’ на выбранной частоте 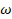 и/или мнимой составляющей комплексной емкости C" на выбранной частоте
и/или мнимой составляющей комплексной емкости C" на выбранной частоте 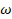 ; (C) интегрирование значений измерений (a) C’, (b) C" или (c) любой комбинации C’ и C" на выбранной частоте
; (C) интегрирование значений измерений (a) C’, (b) C" или (c) любой комбинации C’ и C" на выбранной частоте 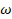 как функции приложенного напряжения для получения интегрированной величины измерения и (D) определение того, присутствует ли химическое вещество в несущей среде исходя из упомянутой интегрированной величины измерения. Технический результат: обеспечение возможности высокой чувствительности, избирательности. 2 н. и 13 з.п. ф-лы, 4 ил.
как функции приложенного напряжения для получения интегрированной величины измерения и (D) определение того, присутствует ли химическое вещество в несущей среде исходя из упомянутой интегрированной величины измерения. Технический результат: обеспечение возможности высокой чувствительности, избирательности. 2 н. и 13 з.п. ф-лы, 4 ил.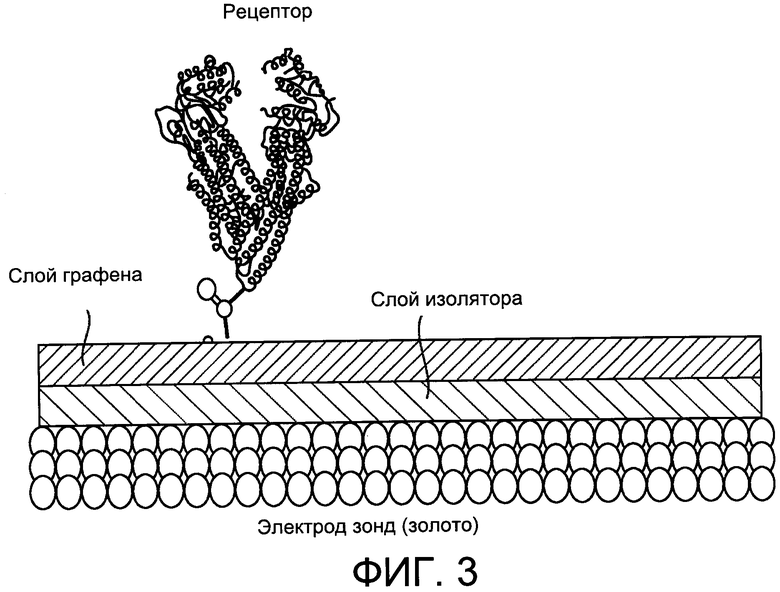
1. Способ анализа для анализа химического вещества, включающий: (A) получение посредством электрохимической импедансной спектроскопии, проведенной в диапазоне приложенных потенциалов, множества значений измерений комплексного импеданса Z* системы, которая имеет рабочий электрод, который находится в контакте с несущей средой, которая может содержать указанное вещество, причем рабочий электрод содержит рецепторные агенты, способные связываться с указанным веществом, где рабочий электрод содержит подложку электрода, функционализированную чувствительными элементами, электрохимический отклик которых на приложенные потенциалы является чувствительным к связыванию указанного вещества с указанными рецепторными агентами, и чувствительные элементы имеют размер от 0,5 до 10 нм; (B) преобразование упомянутого множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости C’ на выбранной частоте 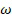 и/или мнимой составляющей комплексной емкости C" на выбранной частоте
и/или мнимой составляющей комплексной емкости C" на выбранной частоте 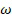 ; (C) интегрирование значений измерений (a) C’, (b) C" или (c) любой комбинации C’ и C" на выбранной частоте
; (C) интегрирование значений измерений (a) C’, (b) C" или (c) любой комбинации C’ и C" на выбранной частоте 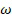 как функции приложенного напряжения для получения интегрированной величины измерения и (D) определение того, присутствует ли химическое вещество в несущей среде исходя из упомянутой интегрированной величины измерения.
как функции приложенного напряжения для получения интегрированной величины измерения и (D) определение того, присутствует ли химическое вещество в несущей среде исходя из упомянутой интегрированной величины измерения.
2. Способ анализа по п.1, в котором на этапе (А) упомянутое получение посредством электрохимической импедансной спектроскопии, проведенной в диапазоне приложенных потенциалов, множества значений измерений комплексного импеданса включает в себя получение по меньшей мере пяти значений измерений комплексного импеданса при различных приложенных потенциалах.
3. Способ анализа по п.1 или 2, в котором упомянутое определение на этапе (D) выполняют путем сравнения упомянутой интегрированной величины измерения с одним или более эталонными значениями, полученными путем выполнения этапов (A), (B) и (C) в условиях, когда известна локальная среда электрода.
4. Способ анализа по п.1, в котором указанное вещество представляет собой целевую молекулу, с которой указанные рецепторные агенты способны специфически связываться, и при этом указанный способ представляет собой способ определения концентрации указанных целевых молекул в указанной несущей среде.
5. Способ анализа по п.4, в котором указанные целевые молекулы выбраны из группы, состоящей из белка СРБ, инсулина и маркера одного или более из нейродегенерации, рака, инфаркта миокарда, диабета и общей травмы.
6. Способ анализа по п.1, в котором указанное вещество выбрано из белка лектина, гликоэнзима и углеводсвязывающего антитела, и в котором указанные рецепторные агенты представляют собой углеводные агенты.
7. Способ анализа по п.1, в котором рабочий электрод образует часть гликоматрицы, содержащей множество рабочих электродов, каждый из которых функционализирован различными углеводными агентами.
8. Способ анализа по п.1, в котором указанное вещество является потенциальным лекарственным препаратом, а указанные рецепторные агенты представляют собой агенты, которые способны связываться с эталонным лекарственным препаратом.
9. Способ анализа по п.8, в котором упомянутый рабочий электрод образует часть матрицы, содержащей множество рабочих электродов, каждый из которых функционализован указанными рецепторными агентами, благодаря чему указанная матрица подходит для использования при одновременном скрининге множества потенциальных лекарственных препаратов.
10. Способ анализа по любому из предшествующих пунктов, в котором упомянутые чувствительные элементы содержат одно или более из редокс-активных веществ, молекулярной пленки, наночастиц, графена, углеродных нанотрубок или квантовых точек.
11. Способ анализа по любому из предшествующих пунктов, в котором упомянутый рабочий электрод не функционализирован редокс-активными веществами.
12. Способ анализа по любому из пп.1-11, в котором указанные рецепторные агенты, способные связываться с указанным веществом, содержат антитело или фрагмент антитела.
13. Способ анализа по любому из предшествующих пунктов, в котором упомянутые чувствительные элементы содержат графен.
14. Устройство для применения в способе анализа для анализа химического вещества, которое содержит: - электрохимический спектрометр, который содержит рабочий электрод, противоэлектрод и потенциостат, причем указанный рабочий электрод содержит рецепторные агенты, способные связываться с указанным веществом, при этом указанный рабочий электрод содержит подложку электрода, функционализированную чувствительными элементами, электрохимический отклик которых на приложенные потенциалы чувствителен к связыванию указанного вещества с указанными рецепторными агентами, а чувствительные элементы имеют размер от 0,5 до 10 нм; - приемник, выполненный с возможностью приема от упомянутого электрохимического спектрометра входных данных, содержащих множество значений измерений комплексного импеданса Z* в диапазоне приложенных потенциалов; и - процессор, выполненный с возможностью (i) преобразования упомянутого множества значений измерений Z* в множество значений измерений реальной составляющей комплексной емкости C’ на выбранной частоте 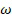 и/или мнимой составляющей комплексной емкости C" на выбранной частоте
и/или мнимой составляющей комплексной емкости C" на выбранной частоте 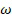 и (ii) интегрирования упомянутых значений измерений (a) C', (b) C" или (c) любой комбинации C’ и C" на выбранной частоте
и (ii) интегрирования упомянутых значений измерений (a) C', (b) C" или (c) любой комбинации C’ и C" на выбранной частоте 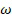 как функции приложенного напряжения для получения интегрированной величины измерения; и - блок вывода, выполненный с возможностью вывода данных, генерируемых из упомянутой интегрированной величины измерения, причем указанные выводимые данные содержат указание о наличии, отсутствии или концентрации анализируемого вещества.
как функции приложенного напряжения для получения интегрированной величины измерения; и - блок вывода, выполненный с возможностью вывода данных, генерируемых из упомянутой интегрированной величины измерения, причем указанные выводимые данные содержат указание о наличии, отсутствии или концентрации анализируемого вещества.
15. Способ анализа по любому из пп.1-13 или устройство по п.14, в котором упомянутый способ анализа представляет собой способ анализа на основе квантовой емкости.
| WO 2003062786 A2, 31.07.2003 | |||
| US 20030211637 A1, 13.11.2003 | |||
| US 20140342442 A1, 20.11.2014 | |||
| US 20150219579 A1, 06.08.2015 | |||
| US 20080009002 A1, 10.01.2008 | |||
| US 20130319880 A1, 05.12.2013. |
Авторы
Даты
2019-10-01—Публикация
2016-01-26—Подача