Изобретение относится к пищевой промышленности, объединяющей предприятия по выработке из молока различных молочных продуктов, и может быть использовано для селективного количественного детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях на фермерских хозяйствах, разводящих крупный рогатый скот.
Пищевые продукты могут загрязняться остатками различных лекарственных веществ, в том числе и антибиотиками, применяемыми для лечения животных, ускорения их роста, улучшения качества и сохранности кормов. Некоторые лекарственные вещества достаточно долго сохраняются в продуктах животноводства и могут с этими продуктами попадать в организм человека. При этом антибиотики могут вызывать различные аллергические реакции, подавлять активность ферментов, изменять микрофлору организма, способствовать распространению устойчивых видов микрофлоры, вызывать дисбактериоз. Высокое содержание антибиотиков в пищевых продуктах обусловлено их широким применением в промышленном животноводстве, птицеводстве и рыболовстве. Антибиотики стимулируют отдельные биохимические процессы в организме животных, что приводит к улучшению их общего состояния, ускорению роста, повышению продуктивности, активизации защитных реакций. Поэтому их используют не только для лечения, но и стимулирования роста, откорма животных, повышения их продуктивности.
Антибиотики применяют также при консервировании овощей, фруктов, молока, рыбы, мяса, птицы, кормов для животных. Антибиотики дают животным с питьевой водой непосредственно перед убоем либо вводят путем инъекции. Это позволяет увеличить срок хранения свежего мяса на 2–3 сут и улучшить его внешний вид, запах, цвет. Эффективна также обработка мясных туш растворами антибиотиков. Добавка антибиотика увеличивает срок хранения мясного фарша, свежей рыбы. При этом рыбу опускают в раствор антибиотика (50 мг/л), либо хранят во льду с антибиотиком (5 мг/кг).
Антибиотики негативно влияют на микробиологические процессы кисломолочного производства, вследствие чего возможно изготовление опасной продукции. Основной причиной этого является тот факт, что их применяют в ветеринарной практике для лечения заболеваний микробиального, в том числе вирусного происхождения. Следствие этих заболеваний – наличие в молоке больных животных токсинов, попадание которых в организм человека крайне нежелательно. Исследование динамики ферментации кисломолочных продуктов, таких как сметана, кефир, позволило выявить замедление или полное отсутствие процесса сквашивания в образцах молока, которые содержали остаточные количества антибиотиков. Молоко от одной коровы, пролеченной антибиотиками, способно сделать непригодным для переработки тонну молока.
Антибиотики входят в группу ингибирующих веществ наряду с химическими ингибиторами микробиологических процессов. Развитие методов контроля ингибирующих веществ тесно связано с их применением для установления фальсификации пищевых продуктов. Методы определения содержания ингибирующих веществ разделяют на микробиологические, иммунологические, химические и физико-химические.
Для определения антибиотиков в молочной промышленности известны иммунологические и микробиологические тесты производства датской компании «Христиан Хансен»: «Beta Star®», «Tetra Star®», «Beta Star® Combo», «Copan Test®».
«Beta Star®» – экспресс-тест, основанный на анализе специфических рецепторов бета–лактамов: белков, связанных с частицами золота. Для проведения одного определения требуется 5 мин, тест чувствителен к антибиотикам группы бета–лактамов. Чувствительность определения в зависимости от вида антибиотика составляет в основном от 2 до 20 мкг/кг.
«Tetra Star®» – экспресс–тест, основанный на анализе специфического рецептора тетрациклиновой группы, имеет высокую чувствительность к антибиотикам группы тетрациклина. Чувствительность составляет 60-80 мкг/кг.
«Beta Star® Combo» – экспресс–тест, обладающий чувствительностью к антибиотикам двух групп: бета–лактамов и тетрациклинов. Чувствительность теста – от 2 до 50 мкг/кг.
Экспресс-тесты удобны и просты в применении, не требуют дополнительного оборудования или считывающего устройства, позволяют проводить анализ в полевых условиях. Тестовые полоски с результатами анализа долго сохраняются и могут быть использованы для сравнительной оценки определений достаточно длительный срок. Широкое применение в производстве нашли также микробиологические методы, основанные на непосредственном биологическом действии антибиотиков на чувствительные штаммы микроорганизмов. Содержание антибиотиков выявляют при их диффузии в агар по величине торможения роста различных тест–культур, внесенных в питательные среды.
Микробиологический тест «Copan Test®» включает споры Bacillus stearothermophilus calidolactis, с высокой чувствительностью определяет антибиотики группы бета–лактамов, тетрациклинов, аминогликозидов, макролидов и других антибиотиков. Возможность определения полного спектра антибиотиков в молоке, сравнительно невысокая стоимость, большой срок хранения и простота в использовании обеспечили тесту широкое применение на предприятиях молочной промышленности, а также в ветеринарных лабораториях, выдающих ветсвидетельства и осуществляющих государственный контроль заготавливаемого молока. Тест, включающий микроорганизмы вида Streptocoecus thermophilus предложен для определения пенициллина, стрептомицина и тетрациклина в молоке. Минимально определяемая концентрация составляет 0,05 мкг/мл. Основными недостатками метода являются низкая избирательность, продолжительность (термостатирование образцов проводят в течение 18-24 ч) и трудоемкость определения.
Для быстрого определения в молоке беталактамных антибиотиков (пенициллина, ампициллина и др.) применяется также ферментативный колориметрический тест Penzym–100. Тест содержит энзим DD-карбоксилазу, которая гидролизует синтетические субстраты типа R–D–Ala–D–Ala, и которая в то же время быстро реагирует с антибиотиками беталактамного типа с образованием окрашенного комплекса. Предел обнаружения составляет 0,008 UС/мл. С помощью биосенсора проводят определение пенициллина в молоке, основанное на образовании устойчивого комплекса между белком рецептора и антибиотиком, что приводит к ингибированию ферментативной активности белка. Предел обнаружения пенициллина G составляет 2,6 мг/кг молочного продукта. Предложена методика определения антибактериального препарата хлорамфеникола методом поляризационного флуоресцентного иммуноанализа.
Выбраны оптимальные пары антител и антигена, меченого флуоресцеином, и определены аналитические характеристики методики. Оптимизирована экспрессная методика подготовки проб молока с использованием насыщенного раствора сульфата аммония. Общее время пробоподготовки и определения хлорамфеникола в молоке не превышает 10 мин. Пределы обнаружения в воде и молоке составили 10 нг/мл и 20 мкг/кг соответственно. Разработанная методика апробирована на модельных и реальных образцах молока.
Показано, что некоторые образцы молока содержат хлорамфеникол в концентрациях 38-41 мкг/кг, что в несколько раз превышает ПДК (10 мкг/кг). Новый вариант иммуноферментного анализа с помощью амперометрического иммуносенсора предложен для определения аминогликозидного антибиотика гентамицина. Биочувствительная часть иммуноферментного сенсора включает совместно иммобилизованные фермент холинэстеразу и антитела против гентамицина. Нижняя граница концентрации антибиотика, определяемая данным методом, составляет 1·10–9 мг/мл, время определения 20 мин. Наибольшее количество гентамицина обнаружено в образцах молока, предназначенного для перевозки и реализации в течение достаточно длительного времени (2 мес.), например, молоко «Домик в деревне» содержит 7,5 мг/мл гентамицина, а «Милая мила» – 5,8 мг/мл. Диапазон рабочих концентраций гентамицина 10-200 мкг/кг, время анализа 10 мин. Для определения остаточных количеств антибиотиков стрептомицина и дигидрострептомицина в пробах цельного молока, меде, почках и мясе свиней применен оптический иммунологический метод, основанный на ингибировании эффекта поверхностного резонанса. Пределы обнаружения в молоке, меде, почках и мясе свинины составляют 30, 15, 50 и 70 мкг/л соответственно.
Определению антибиотиков в пищевых продуктах посвящено большое число исследований, основанных на использовании сенсибилизированной люминесценции ионов Eu (III) и Tb (III). Эти работы относятся, в основном, к антибиотикам тетрациклинового и хинолонового ряда, которые наиболее широко применяются в животноводстве. Обладая высокими значениями молярных коэффициентов поглощения, органические лиганды в том числе и антибиотики, эффективно поглощают энергию возбуждения. Если при этом энергия триплетного состояния лиганда больше энергии резонансного уровня иона лантанида, то она может передаваться ему. Ион переходит в возбужденное состояние, а затем высвечивает, выделяя кванты света. Антибиотики тетрациклинового и фторхинолонового ряда образуют с ионами лантанидов комплексные соединения, в которых ионы Eu (III) и Tb (III) обнаруживают интенсивную люминесценцию при λ=615 нм (переход 5D0 →7F2) и при λ=545 нм (переход 5D4 →7F5) соответственно. Для снижения предела обнаружения при люминесцентном определении антибиотиков в качестве аналитических форм часто используют разнолигандные комплексы, в которых в качестве второго лиганда вводятся органические основания, донорно-активные или поверхностно–активные вещества. Увеличение интенсивности люминесценции в данном случае является следствием возрастания микроупорядоченности и жесткости структуры образующихся соединений, а также вытеснения молекул воды из внутренней среды комплекса и снижения безызлучательных потерь энергии возбуждения. Так, для определения ветеринарных антибиотиков энрофлоксацина и ципрофлоксацина в мышечных тканях животных и рыб использована сенсибилизированная антибиотиками люминесценция ионов тербия в мицеллярной среде – в присутствии лаурилсульфата натрия. Интенсивность люминесценции ионов Tb (III) при этом значительно возрастает, что является результатом не только вхождением анионного ПАВ во внутреннюю сферу комплекса и вытеснения молекул воды, но и защитного действия мицелл от процессов дезактивации ионов Tb(III). Метод предполагает экстракцию антибиотиков из пробы молока в CH2Cl2, выпаривание экстракта и добавление к аликвотной части полученного водного раствора ионов Tb(III), лаурилсульфата натрия и ацетатного буферного раствора с рН 6,0. Градуировочный график линеен в интервале концентрации антибиотиков 5–50 мкг/мл. Предел обнаружения составляет 3,5 мкг/кг. В качестве второго лиганда также могут быть применены 1,10–фенантролин, триоктилфосфиноксид (ТОФО), ß–дикетоны, ЭДТА, ß–циклодекстрин, оксикарбоновые кислоты и другие лиганды. Так, методика определения окситетрациклина в молоке основана на регистрации Iлюм Eu (III) в комплексе Eu (III) – окситетрациклин – цитрат-ион. Методика разработана на модельных растворах, предусматривает предварительное отделение белковых компонентов молока. Предел обнаружения – 5 нг/мл. Для определения окситетрациклина в молоке предложена сенсибилизированная люминесценция Eu (III) в присутствии β–циклодекстрина. Предел обнаружения составляет 6,7·10–9 моль/л.
Сочетание разнолигандного комплексообразования с использованием мицеллярных сред позволяет в ряде случаев снизить пределы обнаружения антибиотиков. Применение ТОФО в качестве второго лиганда и мицеллярных сред использовано при определении хлортетрациклина по люминесценции иона Eu (III) в пищевых продуктах, биологических жидкостях человека, в том числе и грудном молоке. Пределы обнаружения хлортетрациклина составляют 2,0·10–9 моль/л и 9,8·10–9 моль/л. Использование кинетической спектрофлуориметрии и разрешенной во времени люминесценции дает возможность существенно повысить избирательность определения. Методика кинетического флуоресцентного определения антибиотиков с использованием Eu (III) – тетрациклин (ампициллин) – теноилтрифторацетон в присутствии тритона Х–100, позволяет определять ампициллин и тетрациклин в молоке с пределом обнаружения 0,04 и 0,125 мкг/мл соответственно без предварительного разделения. В некоторых исследованиях в качестве аналитического сигнала используют собственную молекулярную люминесценцию антибиотиков тетрациклинового и хинолонового ряда. В работе предложена мембрана для предварительного концентрирования и фосфориметрического определения флюмехина в молоке. Мембрана имеет кольцевую зону, закрепленную на поверхности полимембранной ленты на основе сложных полиэфиров, которая представляет собой область предварительного концентрирования. Интенсивность фосфоресценции флюмехина регистрируется непосредственно на твердой фазе при λвозб = 358 нм и λизлуч = 459 нм. Градуировочный график линеен в интервале концентраций 0,1 – 2,0 мг/л, предел обнаружения – 0,03 мг. Описано определение налидиксовой кислоты в грудном молоке с применением фосфориметрического сенсора при λвозб = 332 нм, λизлуч = 412нм, градуировочный график линеен в интервале 0,06–1,5 мкг/мл, с пределом обнаружения 0,02 мкг/мл. Разработана экстракционно-флуориметрическая методика косвенного определения пятнадцати аминогликозидных антибиотиков в биологических жидкостях (кровь, молоко, моча), основанная на образовании трехкомпонентных комплексов антибиотиков с паразеодимом и флуоресцеинкомплексоном в водном растворе при рН 5,8–6,2, экстракции этих нефлуоресцирующих комплексов смесью (1:1) изоамилового спирта с бензолом, реэкстракции флуоресцеинком – плексона раствором фторида натрия и измерении интенсивности свечения красителя. Предел обнаружения от 0,01 до 10 мкг антибиотиков.
Известны методики электрохимического определения антибиотиков тетрациклинового ряда (окситетрациклина, метациклина и тетрациклина) в молоке с использованием амперометрического титрования и ионометрии. При этом в качестве электродно-активного вещества мембран ионселективных электродов использованы ионные ассоциаты антибиотиков тетрациклинового ряда с гетерополианионами структуры Кеггина. В случае амперометрического определения в качестве титранта применяют 12-молибдофосфорную кислоту. Методики отличаются высокой чувствительностью, простотой и селективностью. Предложены ионселективные электроды с мембраной на основе электродно-активных соединений из аниообменников, азосоединений и фталоцианатов металлов для определения антибиотиков. Дана сравнительная оценка электрохимических и эксплуатационных характеристик датчиков. Определены пределы обнаружения для бензпенициллина – 1,0·10–5 моль/л,ампициллина – 3,1·10–5 моль/л и оксалина натриевой соли – 8,0·10–6 моль/л. Разработаны методики вольтамперометрического определения стрептомицина и азитромицина в лекарственных препаратах и стрептомицина в молоке на уровне наноконцентраций. Метод капиллярного электрофореза со спектрофотометрическим – детектированием предложен для одновременного определения спарфлоксацина, ципрофлоксацина, энрофлоксацина и флумехина в молоке. Предел обнаружения составляет 19,8, 15,2, 13,3 и 15,9 мг/кг соответственно. Методика одновременного определения оксалиниевой кислоты и флумехина методом капиллярного электрофореза с использованием диодноматричного детектора. Аналит экстрагируют дихлорметаном и гидроксидом натрия и проводят предварительное концентрирование с помощью твердофазной экстракции. Предел обнаружения составляет 15 мкг/кг и 10 мкг/кг для оксалиниевой кислоты и флумехина соответственно. Методика позволяет определять антибиотики ниже предела, установленного Европейским Союзом. Метод капиллярного электрофореза является альтернативным по пределу обнаружения методу жидкостной хроматографии при определении антибиотиков в пищевых продуктах животного происхождения.
Анализ известных из уровня техники решений показывает, что на предприятиях молочной промышленности нашли применение, в основном, иммунологические и микробиологические тесты импортного производства. Поскольку остаточные количества антибиотиков в молоке, как правило, имеют низкие значения ПДК, то методы их определения должны быть селективными, экспрессными и высокочувствительными и к тому же работать в режиме реального времени online, требуют дорогостоящего лабораторного оборудования, что не позволяет потребителю в режиме online определить «чистоту» молока на наличие антибиотиков. Наиболее перспективными методами для online анализа являются электрохимические. Основным сдерживающим фактором, в настоящее время, является отсутствие подходящих каталитических систем, поскольку электрохимический отклик антибиотиков тетрациклинового, пенициллинового ряда, стрептомицина и левомицетина, содержащихся в молоке на «стандартных» электродах не позволяет проводить как качественный, так и количественный анализ. Таким образом, разработка приборов, подходов и новых материалов, обладающих высокой электрокаталитической активностью и избирательностью при определении антибиотиков тетрациклинового, пенициллинового ряда, стрептомицина и левомицетина непосредственно в молоке актуальная задача.
Наиболее близким к заявленному изобретению является способ качественного и количественного определения антибиотиков тетрациклинового и пенициллинового ряда в молоке и молочных изделиях Способ включает использование потенциостата и модифицированного диоксидом рутения рабочего электрода. Рабочий электрод обеспечивает селективное связывание с антибиотиками тетрациклинового и пенициллинового ряда в молоке и молочных изделиях без предварительного их выделения. При этом воспроизводимый электрохимический отклик регистрируют в течение 1÷2 с при потенциале процесса –1,05 В относительно насыщенного хлорсеребряного электрода, скорости развертки потенциала 100÷200 мВ/с, концентрации антибиотиков тетрациклинового и пенициллинового ряда в диапазоне 10-8–10-4 моль/л (RU2739074, МПК G01N 27/26, G01N 27/48, A23C 9/158, опубл. 21.12.2020).
Известное решение обеспечивает селективное количественное детектирование антибиотиков тетрациклинового и пенициллинового ряда. Недостатком является ограниченность в классе определяемых антибиотиков, а также неавтоматичность процесса определения.
Таким образом, в связи с тем, что молоко и молочные продукты являются основой рациона питания россиян, поэтому систематический контроль молока по показателям безопасности чрезвычайно важен для обеспечения здоровья населения. Однако очень часто, для профилактики, а также для лечения животных используют различные ветеринарные препараты, прежде всего антибиотики, чаще всего тетрациклинового, пенициллинового ряда, стрептомицина и левомицетина. При несоблюдении требуемых мер, остатки ветеринарных препаратов могут попадать в молоко, предназначенное для употребления в пищу человеком. Контроль по содержанию опасных антибиотиков в молоке важная, социально значимая задача.
Технический результат, при использовании заявленного изобретения, заключается в разработке автоматизированного электрохимического способа качественного и количественного детектирования четырех типов антибиотиков (антибиотиков тетрациклинового, пенициллинового ряда, стрептомицина и левомицетина) в молоке и молочных изделиях в режиме online без предварительного их выделения за счет получения селективного редокс-отклика от детектируемого антибиотика на рабочем электроде, состоящего из графита с нанесенным на его поверхность нанослоем редокс-катализаторов.
Сущность изобретения заключается в том, что способ качественного и количественного детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях заключается в использовании автоматического режима электрохимического детектирования с использованием программируемого потенциостата в режиме мультиизмерений и модифицированного наноразмерными катализаторами, на основе комплексов рутения и меди, рабочего электрода, которые способны к селективному связыванию с антибиотиками тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях (за счет образования систем гость-хозяин) без предварительного их выделения. В емкость (ячейку) помещают 5 мл молока или молочного изделия, затем в нее опускают модифицированный рабочий электрод, в течение 2 с при потенциале процессов от +0.5 В до -1 В проводят измерения и регистрируют значение тока. Далее по калибровочной прямой определяют концентрацию антибиотиков, при этом концентрация антибиотиков может варьироваться в диапазоне 10-8–10-4 моль/л.
На фиг. 1 показаны дифрактограммы полученных фаз; на фиг. 2 показана диаграмма процентного соотношения фаз в кристаллической структуре пленки RuO, где 1 – фаза RuO, 2 – фаза RuO2, 3 – фаза RuO4, 4 – фаза RuO2; на фиг. 3 представлены рентгенограммы пленки полученной с использованием метода атомно-слоевого осаждения; на фиг. 4 показана структура среза пленки, полученной при использовании атомно слоевого осаждения методом растровой электронной микроскопии (РЭМ); на фиг. 5 представлены фотографии СЗМ, полученные при процесса 400 °С 10 циклов; на фиг. 6 – рентгенограммы полученной пленки (после отжига в аргоне при 800 °С); на фиг. 7 – рентгенограммы пленки RuO2 полученной с использованием метода атомно-слоевого осаждения (после отжига в аргоне при 800 °С); на фиг. 8 показана структура среза, пленки RuO2 по профилю толщины слоя, полученной методом растровой электронной микроскопии РЭМ; на фиг. 9 – зависимость толщины от количества циклов процесса АСО при получении пленки RuO2; на фиг. 10 – схема потенциостата для регистрации сигналов с модифицированного слоя электродов, созданная в DipTrace; на фиг. 11 – схема потенциостата для регистрации сигналов с модифицированного слоя электродов, созданная в DipTrace; на фиг. 12 представлено расположение элементов после их расстановки; на фиг. 13 показана печатная плата потенциостата, слой 1; на фиг. 14 – принципиальная схема.
Способ осуществляется следующим образом.
В емкость (ячейку) помещают 5 мл молока или молочного изделия, затем в нее опускают модифицированный рабочий электрод (РЭ), модифицирование которых производится различными катализаторами, природа которых зависит от типа определяемого антибиотика, например соединениями рутения и меди. Затем в течение 2 с при потенциале процессов от +0.5 В до -1 В проводят измерения и регистрируют значение тока, далее по калибровочной прямой определяют концентрацию антибиотиков, при этом концентрация антибиотиков может варьироваться в диапазоне 10-8–10-4 моль/л.
Принцип получения электрохимического отклика имеет электрокатлитическую природу, при адсорбции детектируемые молекулы антибиотиков на модифицированную поверхность РЭ, происходит образование π-комплексов с переносом заряда и нем самым возникновением «уникальных», для каждого типа антибиотиков, электронных уровней для селективного детектирования молекул антибиотиков. Сформированные энергетические суперпозиции являются уникальными, для конкретного антибиотика, что позволяет его детектировать в условиях электрохимического воздействия.
Модифицирующей добавкой для РЭ служили соединения рутения и меди. После проведения эксперимента, для оценки соотношения элементов (массовая доля) в пленке, был проведен рентгенофлуоресцентный анализ полученных пленок, результаты которого приведены в табл. 1.
Анализ результатов показал, что процентное соотношение элементов RuO не соответствует рассчитанному теоретическому значению (теоретическое соотношение RuO2 равно 1,75). Практическое соотношение равно 5,35.
Столь высокое соотношение указывает на возможность образования помимо RuO2 других соединений, содержащих рутений. Данное предположении подтвердилось при изучении полученной пленки методом рентгенофазового анализа (см. ниже).
В соответствии с первым пунктом алгоритма, приведенного выше, увеличили время подачи прекурсора ТМФ в реакционную камеру. Результаты ряда экспериментов приведены в табл. 2.
Таким образом, варьирование условий позволило уменьшить соотношение Ru:O в пленке лишь до значения 3,2, которое сильно превышает теоретическое, что подтверждает предположение о низкой реакционной способности ТМФ. Так, установили оптимальное время подачи ТМФ - 2 сек.
Получаемая в условиях процесса атомно-слоевого осаждения пленка, является рентгено-аморфной, то есть для дальнейшего определения полученных фаз, необходимо перевести аморфное состояние в кристаллическую структуру. Для этого подложки отжигали при 500 °С, поскольку по вышеописанным данным следует, что при температурах выше 500 °С структурный тип оливин трансформируется в другие отличные фазы. После отжига образец был исследован с использованием метода рентгенофазового анализа. Полученные дифрактограммы представлены на фиг. 1.
Анализ полученной дифрактограммы (фиг. 1) в сопоставлении с эталонными дифрактограммами показывает образование четырех фаз: LiFe5O8.
По данным полуколичественного анализа, используя для расчета метод корундовых чисел, процентное содержание целевой фазы RuO2 составило 13 % (фиг. 2).
Образование фазы RuO в условиях отжига вероятно связано с его низким значением стандартной энтальпии образования 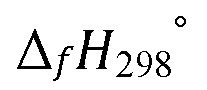 -2095 кДж·моль–1, что делает данную фазу наиболее энергетически выгодной при отжиге аморфной пленки. Также это обуславливает ее химическую стабильность и низкую реакционную способность.
-2095 кДж·моль–1, что делает данную фазу наиболее энергетически выгодной при отжиге аморфной пленки. Также это обуславливает ее химическую стабильность и низкую реакционную способность.
Таким образом, сформированная при использовании ALD-технологии пленка не позволяет получать монофазный состав, поскольку при отжиге протекают много параллельных реакций, контролировать которые отдельная трудоемкая задача, над решением которой в настоящее время заявителем ведется работу.
Как установлено ранее, что использование метода атомно-слоевого осаждения позволяет получать тонкие пленки, в состав которых входит RuO2. Однако, помимо основного компонента в пленку, по данным метода рентгенофазового анализа входят дополнительно три соединения. Полученные дифрактограммы представлены на фиг. 3.
С целью получения целевой пленки, состоящей из RuO2, варьировались следующие условия: температура и время напуска прекурсора. Увеличение температуры реактора до 400 °С при сохранении исходных параметров по напуску прекурсоров не позволил заметно увеличить количество LiFePO4 в образующийся пленке. Однако, по данным растровой электронной микроскопии РЭМ, увеличение температуры положительно сказалось на плотности пленки (фиг. 4).
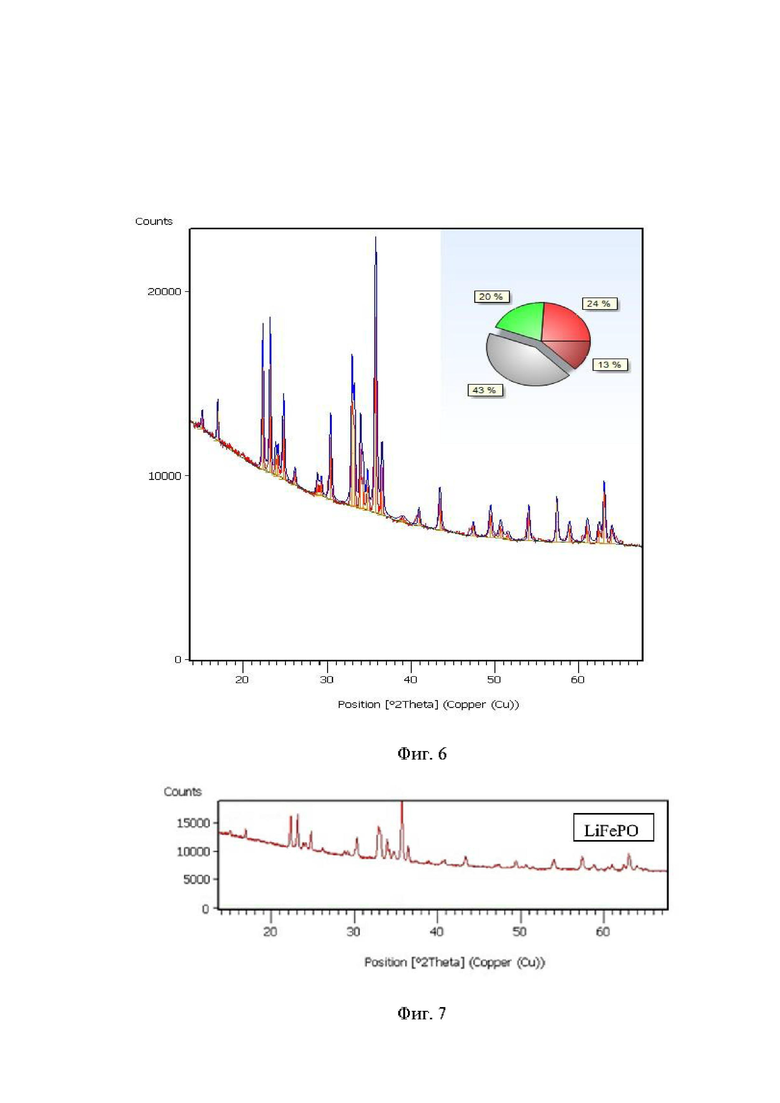
Как видно из фиг. 5 формируется плотная пленка, имеющая практически одинаковую толщину по всему контуру. Следующим этапом было увеличение времени напуска прекурсоров в реактор. Как известно, рост пленки в методе атомно-слоевого осаждения осуществляется за счет хемосорбции прекурсора с поверхностью подложки, то есть протекает химическое взаимодействие прекурсора с самой подложкой или активными группами на ее поверхности. Поэтому в случае создания трехкомпонентных систем важное значение имеет создание (зарождение) первых слоев пленки. Неэффективное зарождение пленки, т.е. получение островковых точек роста приведет к формированию дефектной пленки. В этой связи огромное значение имеет реакционная способность используемых прекурсоров по отношению как к функциональным группам, содержащимся на поверхности подложки, так и к друг другу. Вероятной причиной этого является не оптимальное время напуска прекурсоров в реактор. Действительно, увеличение времени напуска всех прекурсоров до 2 с привело к образованию более однородной пленки (уже на начальных этапах фиг. 6) и уже с преобладанием нужного целевого соединения RuO2 (фиг. 6), в состав которой (после отжига при 800 °С) по данным полуколичественного анализа, используя для расчета метод корундовых чисел, процентное содержание целевой фазы RuO2 составило 43 % (фиг. 6).
Дальнейшее увеличение времени напуска прекурсоров до 4 сек. привело к получению пленки состоящий исключительно из целевого соединения RuO2 (фиг. 7).
Интересные данные были получены при исследовании элементного состава образующейся пленки RuO2 по профилю толщины слоя (фиг 7).
Как видно из фиг. 8, на начальном этапе формировании пленки до 10 нм наблюдается завышенное, относительно других элементов, содержание фосфора. Интересно отметить, что содержание кислорода при этом не коррелирует с содержанием фосфора, что может указывать на формирование на этапе зарождения пленок неких полимерных RuхO - фрагментов. Затем к 15 нм профили всех элементов выравниваются и слабо меняются по всей толщине слоя, что указывает на формирование пленки с заданной очередностью слоев.
Следующим этапом работы было нахождение корреляция толщины роста пленки за один цикл процесса. Один цикл процесса формирования пленки RuO2 включает в себя 7 этапов.
Измерение толщины образующихся слоев проводили методом растровой электронной микроскопии, путем измерения толщины пленки при срезе. Были приготовлены 7 образцов пленок: 100, 300, 500, 700, 900, 1 100 и 1 300 циклов (фиг. 9).
Далее была разработана и получена принципиальна схема для потенциостата, способного в режиме онлайн к детектированию четырех типов антибиотиков. Принцип работы данной схемы заключается в том, что РЭ изменяет свое состояние и реагирует на те вещества, на которые он и должен реагировать, то есть на антибиотики в молоке и молочных изделиях, с помощью модифицированных электродов. Во время реакции создается ток, пропорцианальный концентрации искомых веществ, то есть антибиотиков в молоке и молочных изделиях. Далее ток поступает на вспомогательный электрод, этот электрод также используется для поддержания установленного значения напряжения на РЭ.
Потенциалы РЭ и электрода сравнения должны быть одинаковыми.
Все электроды имеют связь между собой, но не через провода, а через электролит. А следовательно электролит можно представить как резистор, а также каждую пару электродов как конденсаторы. Электроды содержат в себе сопротивления, оно учитывается вместе с сопротивлением электролита.
Структурная схема потенциостата изображена на фиг 10. На ней отмечены элементы, из которых собранная данная плата. Потенциостат представляет собой настраиваемый высокоустойчивый усилитель мощности по постоянному току.
Блок регистрации тока может быть построен не только по схеме измерения изменения напряжения на эквивалентном резисторе, но и по другим вариантам. Далее измерение тока может осуществляться не в цепи РЭ, а в цепи вспомогательного электрода.
В качестве измерителей значений тока и потенциалов обычно используется операционный усилитель на полевом транзисторе с входным током в пикоамперах или меньше. Однако эти чипы очень чувствительны к электростатическому разряду и могут быть легко пробиты. В потенциометрах используются различные схемы защиты, но нет необходимости снова проверять их прочность и без всякой причины прикасаться к потенциальным клеммам прибора. В данной схеме используются операционные усилители LM358P.
Разработка структурной схемы будет происходить в программе DipTrace версии 4.1 (табл. 3, фиг. 11).
Микросхемы разных производителей могут иметь различные параметры.
Ведущим узлом потенциометра является суммирующий усилитель. Обычно это довольно высокоточный и скоростной операционный усилитель, работающий в инвертирующем режиме. Его инвертирующий вход обеспечивает сигнал обратной связи и сигнал уставки. Большинство качественных параметров потенциостата определяется именно этим узлом. Он определяет точность удерживающего потенциала или тока, стабильность и скорость работы устройства, а также дрейф большинства параметров во времени.
Для разработки электрической схемы необходимо воспользоваться программой DipTrace PCB. Для того что бы это сделать, необходимо из программы Dip Trace Schematic перейти по пути “Файл / Преобразовать в плату”. И далее автоматически произойдет расположение элементов на поверхности платы, но в хаотическом расположении. Расположение элементов изображено на фиг. 12.
Далее необходимо произвести расстановку элементов в соответствии с тем, что бы они не создавали друг на друга помех, а также что бы было как можно меньше пересечений линий трасс. В итоге получается схема изображенная на фиг. 13.
Далее необходимо провести трассировку. Это можно сделать пройдя по пути Трассировка / Запуск. В итоге получаются двухсторонняя плата, со слоями 1 и 2, которые показаны на фиг. 14 соответственно.
Общая принципиальная схема
Операционный усилитель U2 выводит ток на вспомогательный электрод, чтобы сбалансировать ток, необходимый для РЭ. Операционный усилитель U2 должен иметь очень низкое или нулевое напряжение смещения. Когда источник питания подается на цепь потенциостата, jfet-транзистор VT1 работает в режиме истощения, входя в высокоимпедансное состояние между источником (источниками) и стоком (стоком), а U2 генерирует ток, который обеспечивает РЭ тем же потенциалом, что и электрод сравнения. Инвертирующий вход операционного усилителя IC2 подключен к электроду сравнения и не должен потреблять большое количество тока от этого электрода. В качестве U1 и U2 используют LM358P.
Как преобразователь тока в напряжение, напряжение смещения операционного усилителя U1 не так важно, как U2. LM358P или что-то подобное является подходящим выбором для U1.
Методика проведения измерений и испытаний
Для проведения процесса моделирования необходимо воспользоватся программой Multisim.
1. Необходимо собрать схему в программе Multisim.
2. Далее необходимо подключить источник питания и подключить мультиметр к выводам схемы, а также эквивалентное сопротивление в выводам потенциостата.
3. Теперь необходимо замерить напряжение, которое показывает мультиметр.
4. Далее необходимо подключить собранный прибор к питанию и подождать его прогрева.
5. Далее так же необходимо подключить к выводам потенциостата мультиметр и эквивалентное сопротивление.
6. Замерить полученные данные и сравнить с данными полученными эксперементально. Компоновка компонентов данного электронного устройства - одна из важнейших задач проектирования, суть которого заключается в том, чтобы найти наиболее правильную форму и размер всего устройства, а также найти наилучшее расположение внутренних блоков и частей устройства. Показателем успешного решения этой задачи достигается во многом от таких характеристик, как Эксплуатация, технология, а также ее ремонтопригодность и надежность.
Условия эксплуатации: закрытое отапливаемое помещение, с влажностью воздуха не более 80 %, нормальном атмосферном давлении, и температуре окружающего воздуха 25±10 °С.
Материалом для изготовления печатной платы был выбран стеклотектолит, так как он обладает необходимыми характеристиками.
Крепление печатной платы было осуществлено саморезами через диэлектрические проставки из резины, для исключения замыкания токопроводящих дорожек между собой.
В процессе проектирования конструкции устройства должны быть выполнены основные требования:
а) не должно быть значительных паразитных электрических связей между блоками и узлами; тепловые и механические воздействия элементов конструкции не должны существенно ухудшать их технические характеристики;
б) компоновка элементов и их сочетание друг с другом должны обеспечивать монтаж элементов на печатной плате;
в) расположение пульта управления должно обеспечивать максимальное удобство;
г) размер и вес изделия должны быть минимальными.
Печатная плата устройства потенциостата для регистрации сигналов с модифицированного слоя электродов помещена в корпус из ударопрочного полистирола.
Масса - не более 0,5 кг.
Корпус состоит из двух частей: основания и крышки. Разъемы предусмотрены на боковой стенке основания. Крышка соединена с основанием пластиковыми петлями, что не обеспечивает хорошую устойчивость к изгибным деформациям, но так как это устройство не предусматривает постоянные открывания и закрывания крышки, то данное решение можно использовать в данном устройстве. Высокую влагозащиту всего устройства можно достигнуть за счет установки резинового уплотнения по контуру крышки и нижнего основания, позволяя использовать его в более суровых условиях.
В соответствии с техническими характеристиками устройства разработана печатная плата (печатная плата) изделия и размещены на ней все узлы устройства наилучшим образом. Рассмотрение существующего схемотехнического решения и понимание принципа действия устройства позволяет обосновать оптимизацию выбранного решения.
Прочность соединения печатной платы и основания определяет надежность и качество печатной платы. Это устройство, работает в реальных условиях в большом диапазоне температур. Именно поэтому в качестве основного материала выбран стеклопластик, из-за низкой термостойкости и относительно дешевых гетинаков специальных тепловых слоев.
Низкая плотность монтажа на односторонних печатных платах. Поэтому в качестве основного материала выбрана стекловолоконную фольгу СФ-1-35гост10316-78 толщиной 3,5 мм.
По точности конструктивных элементов ПП делится на пять категорий. Классы точности 1 и 2 просты в реализации, относительно недороги, но имеют достаточно высокую погрешность при нанесении токопроводящего элемента. Категории 4 и 5 требуют использования высококачественных материалов, инструментов и оборудования, а потому имеют очень высокую стоимость. Третий тип точности занимает промежуточное положение между первой и второй группами. Из-за низкой плотности установки выбран второй тип точности для печатной платы.
Проводящая схема печатной платы, разработанная в результате трассировки, должна отвечать следующим требованиям: соответствовать условиям работы и простоте сборки и конфигурации схемы, всем конструкторским, техническим и электрическим требованиям; обеспечивать простоту сборки схемы и конфигурации схемы, всем конструкторским, техническим и электрическим требованиям; обеспечивать простоту сборки схемы и конфигурации схемы, всем конструкторским, техническим и электрическим требованиям.
Центры отверстий для выводов многовыходных шарнирных элементов (микросхем, реле, в силу конструктивных особенностей элементов они не попадают в узлы координатной сетки) должны соответствовать размерам, указанным в нормативных документах этих элементов.
В соответствии с конструктивными и схематическими характеристиками устройства элементы размещаются на печатной плате. Это делается с помощью автоматизированной системы проектирования diptrace4.1
Исходные данные: печатная плата двухсторонняя; способ нанесения-фотохимия;подложка-стекло-фольгированное покрытие СФ-1-35, резистивное покрытие-олово-свинец, расстояние между сетками-1 мм, плотность печатной установки-II категория, номинальная толщина ПП-1,5 ммь. Определяют диаметры монтажных и переходных металлизированных отверстий по формуле:
 (1)
(1)
где dЭ - максимальное значение диаметра вывода навесного элемента, устанавливаемого на ПП;
r' - разность между минимальным значением диаметра отверстия и максимальным значением диаметра вывода устанавливаемого элемента;
 d'НО - нижнее предельное отклонение номинального значения диаметра отверстия.
d'НО - нижнее предельное отклонение номинального значения диаметра отверстия.
В данном устройстве используются элементы со следующими диаметрами выводов 0,8 мм - конденсаторы, микросхемы, резисторы, разъемы и транзисторы;
 d'НО для ПП второго класса точности составляет 0,1 мм,а r' выбирается в пределах 0,1-0,4 мм.
d'НО для ПП второго класса точности составляет 0,1 мм,а r' выбирается в пределах 0,1-0,4 мм.
 (2)
(2)
Минимальное номинальное значение диаметра контактной площадки выбранного отверстия рассчитывается по формуле:
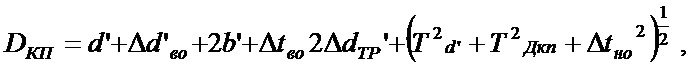 (3)
(3)
где 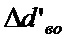 - верхнее предельное отклонение диаметра отверстия;
- верхнее предельное отклонение диаметра отверстия;
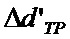 - глубина протравливания диэлектрика в отверстии, равная для ОПП - нулю;
- глубина протравливания диэлектрика в отверстии, равная для ОПП - нулю;
 - позиционный допуск расположения оси отверстия;
- позиционный допуск расположения оси отверстия;
 - позиционный допуск расположения центра контактной площадки;
- позиционный допуск расположения центра контактной площадки;
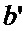 - гарантийный поясок;
- гарантийный поясок;
 - верхнее предельное отклонение диаметра контактной площадки.
- верхнее предельное отклонение диаметра контактной площадки.
 - нижнее предельное отклонение диаметра контактной площадки.
- нижнее предельное отклонение диаметра контактной площадки.
Для найденных значений диаметров монтажных отверстий диаметр контактной площадки будет:
 (4)
(4)
Ширина печатного проводника зависит от токовой нагрузки. Допустимую токовую нагрузку на элементы проводящего рисунка выбирают для фольги от 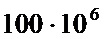 до
до  (от
(от 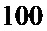 до
до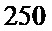
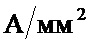 ).
).
Наименьшее значение ширины проводника рассчитывается по формуле:
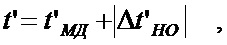 (5)
(5)
где 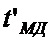 - минимально допустимая ширина проводника;
- минимально допустимая ширина проводника;
• - нижнее предельное отклонение ширины проводника.
• Для ОПП второго класса точности:

 , (6)
, (6)
Тогда ширина проводников равна:
 (7)
(7)
Ширину печатных проводников шин питания и «земли»выбираем толщиной 1,25 мм.
Номинальное значение расстояния между соседними элементами проводящего рисунка определяется по формуле:
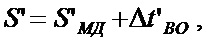 (8)
(8)
где  - максимально допустимое расстояние между соседними элементами проводящего рисунка;
- максимально допустимое расстояние между соседними элементами проводящего рисунка;
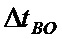 - верхнее предельное отклонение ширины проводника.
- верхнее предельное отклонение ширины проводника.
Максимальный допуск расстояния между элементами проводящего рисунка  выбирается по справочнику из расчета обеспечения электрической прочности изоляции в соответствии с ГОСТ 23751-86.
выбирается по справочнику из расчета обеспечения электрической прочности изоляции в соответствии с ГОСТ 23751-86.
Для ОПП второго класса точности и напряжений не более 2500 ВS’=5 мм а ∆t=1,5 мм
Тогда номинальное значение расстояния между соседними элементами проводящего рисунка: S=5+1,5=6,5.
Интенсивность отказов i-го элемента находится по формуле:
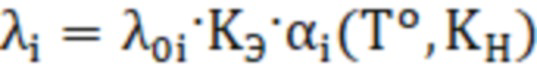 (9)
(9)
где 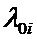 – интенсивность отказов;
– интенсивность отказов;
KЭ – обобщенный эксплуатационный коэффициент, который включает в себя поправочные коэффициенты:
- K1, K2 в зависимости от воздействия механических факторов,
- K3 в зависимости от воздействия влажности,
- K4 в зависимости от давления воздуха,
 в зависимости от температуры поверхности элемента
в зависимости от температуры поверхности элемента 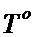 и коэффициентов нагрузки Kн.
и коэффициентов нагрузки Kн.
На основе ГОСТ Р27.301-2011 инженерная надежность (ССНТ). Управление надежностью. Технология безотказного анализа. Основные положения. Для стационарного оборудования, работающего на открытом воздухе, КЭ имеет обобщенный рабочий коэффициент 2,5. В табл. 4 приведены значения частоты отказов, коэффициента загрузки компонентов и количества компонентов.
Результаты расчета интенсивности отказов i-го элемента приведены в табл. 6. Где VT – транзисторы, XS – клеммники, VD – диоды, C – конденсаторы, R – резисторы, KV – реле, DA – микросхемы, HL – светодиоды, Е – электрические параметры.
Рассчитать интенсивность отказов изделия
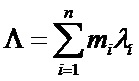 (10)
(10)
где mi – число ИЭТ с интенсивностью отказов λi; n – число видов ИЭТ.
Результат расчета интенсивности отказов групп элементов в рабочем режиме представлены в табл. 6.
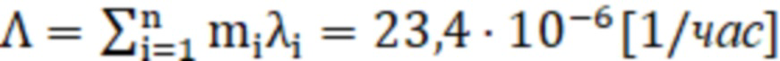 (11)
(11)
Рассчитывается среднее время наработки до отказа изделия
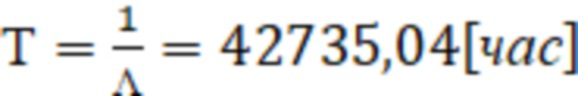 (12)
(12)
Рассчитывается вероятность безотказной работы в течение заданной наработки (0, tp) и в течение суток:
 (13)
(13)
В результате расчета времени работы видно, что разработанное устройство может проработать в течение 63 мес при непрерывном использовании, что является весьма высоким значением надежности.
Далее с использованием разработанного потенциостата были проведены электрохимические эксперименты по определению антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина на модифицированном электроде. Как показано, для каждого антибиотика наблюдается возникновение по оной волен при различных потенциалах.
Таким образом, электрохимические данные показывают, что иммобилизованные на углеродном носителе – РЭ нанокатализаторы, могут действовать как эффективные каталитические системы, что позволяет детектировать антибиотики тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в области следующего редокс отклика:
– Антибиотики тетрациклиновой группы 0: –1.05 В,
– Антибиотики пенициллиновой группы 0: –1.1 В.
– Стрептомицина 0: 0.5 В,
– Левомицетина 0: 0.3 В.
Определение корреляции концентрации антибиотиков от значения тока в диапазоне 10-4 – 10-8 моль/л.
Редокс активность антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина связана с наличием в их структуре функциональных групп способных участвовать в электрохимических процессах. Градуировку проводили для каждого типа антибиотиков готовя растворы с заданной концентрацией в диапазоне концентраций 10-4 – 10-8 моль/л в присутствии РЭ, модифицированных катализатором.
Разработка устройства для детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке.
РЭ – планарные электроды подвергшиеся модификации катализатором, производимые методом трафаретной печати. РЭ имеет диаметр 125 мкм, состоит из углеродной графитизированной пасты и покрыт наноструктурированным катализатором – диоксидом рутения. Изготовлены электродные материалы из углеродного материала марки Vulcan имеет следующие характеристики: удельная электропроводимость от 2*102 до 5*104 см/м, соотношение sp2/sp3 1.75. Электроды после прессования имеют черный цвет и следующие габаритные характеристики длина, ширина, высота (глубина) (ГОСТ 2.321-84) 2 мм×30 мм×1 мм.
Произведено модифицирование РЭ путем иммобилизации на них нанослоев катализатора с заданной структурой и геометрией.
Процесс детектирования антибиотиков осуществляется следующим образом: в емкость (ячейку) помещаем 10 мл молока, затем в нее опускаем модифицированный РЭ. Затем в течение 2 с при потенциале процессов проводи измерения и регистрируют значение тока. Далее, по калибровочной прямой определяем концентрацию антибиотиков в молоке.
По сравнению с известным решением заявленное изобретение позволяет одновременно в режиме онлайн быстро, качественно и количественно детектировать антибиотики тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке, без предварительного их выделения. Способ может быть применен для контроля качества сырья пищевых продуктов: молока, молочных смесей, творога и т.п.
Источники информации
1. Lewis NS, Nocera DG (2007) Powering the planet: chemical challenges in solar energy utilization. Proc Natl Acad Sci USA 103:15729–15735.
2. Turner JA (2004) Sustainable hydrogen production. Science 305:972–974.
3. Walte MG, Warren EL, McKone JR, Boettcher SW, Qixi M, Santori EA, Lewis NS (2010) Solar water splitting cells. Chem Rev 110:6446–6473.
4. Conway BE, Tilak BV (2002) Interfacial processes involving electrocatalytic evolution and oxidation of H2, and the role of chemisorbed. Electrochim Acta 47: 3571–3594.
5. Subbaraman R, Tripkovic D, Strmcnik, Chang K, Uchimura M, Paulikas AP, Stamenkovic V, Markovic NM (2010) Enhancing hydrogen evolution activity in water splitting by tailoring Li þ -Ni(OH)2-Pt interfaces. Science 334:1256–1260.
6. Goff A, Artero V, Jousselme B, Guillet, Métayé R, Fihri A, Palacin S, Fontecave M (2009) From hydrogenases to noble metal-free catalytic nanomaterials for H2 production and uptake. Science 326:1384–1387.
7. Zhuo J, Wang T, Zhang G, Liu L, Gan L, Li M (2013) Salts of C60(OH)8 electrodeposited onto a glassy carbon electrode: surprising catalytic performance in the hydrogen evolution reaction. Angew Chem Int.Ed 52:10867–10870.
8. Cook T, Dogutan DK, Reece SY, Surendranath Y, Teets TS, Nocera DG (2010) Solar energy supply and storage for the legacy and nonlegacy worlds. Chem Rev 110:6474–6502.
9. Artero V, Chavarot-Kerlidou M, Fontecave M Splitting water with cobalt. Angew Chem Int.Ed 50:7238–7266.
10. DuBois MR, DuBois DL (2009) The roles of the first and second coordination spheres in the design of molecular catalysts for H2 production and oxidation. Chem Soc Rev 38:62–72.
11. Cobo S, Heidkamp J, Jacques P, Fize J, Guetaz L, Jousselme B, Ivanova V, Dau H, Palacin S, Fontecave M, Artero V (2012) A Janus cobalt-based catalytic material for electro-splitting of water. Nat Mater 11: 802–807.
12. Du P, Eisenberg R (2012) Catalysts made of earth-abundant elements (Co, Ni, Fe) for water splitting: recent progress and future challenges. Energy Environ Sci 5: 6012–6021.
13. Popczun E, McKone JR, Read CG, Biacchi AJ, Wiltrout AM, Lewis NS, Schaak RE (2013) Nanostructured nickel phosphide as an electrocatalyst for the hydrogen evolution reaction. J Am Chem Soc 135:9267–9270.
14. Jaramillo, T. F. et al. (2007) Identification of active edge sites for electrochemical H2 evolution from MoS2 nanocatalysts. Science 317:100–102.
15. Kibsgaard J, Chen Z, Reinecke BN, Jaramillo (2012) TF Engineering the surface structure of MoS2 to preferentially expose active edge sites for electrocatalysis. Nat Mater 11:963–969.
16. Voiry D, Yamaguchi H, Li J, Silva R, Alves DCB, Fujita T, Mingwei M, Asefa T, Shenoy VB, Ed G, Chhowalla M (2013) Enhanced catalytic activity in strained chemically exfoliated WS2 nanosheets for hydrogen evolution. Nat Mater 12:850–855.
17. Najmaei S, Liu Z, Zhou W, Zou X, Shi G, Lei S, Yakobson BI, Idrobo J-C, Ajayan PM Lou J (2013) Vapour phase growth and grain boundary structure of molybdenum disulphide atomic layers. Nat Mater 12:754–759.
18. Laursen AB, Kegnæs S, Dahla S, Chorkendorff I (2012) Molybdenum sulfides – efficient and viable materials for electro- and photoelectrocatalytic hydrogen evolution. Energy Environ Sci 5:5577–5591.
19. Merki D, Hu X (2011) Recent developments of molybdenum and tungsten sulfides as hydrogen evolution catalysts. Energy Environ Sci 4:3878–3888.
20. Gong K, Du F, Xia Z., Durstock M, Dai L (2009) Nitrogen-doped carbon nanotube arrays with high electrocatalytic activity for oxygen reduction. Science 323:760–764.
21. Mirzakulova E, Khatmullin R, Walpita J, Corrigan T, Vargas-Barbosa NM, Vyas, Oottikkal S, Manzer SF, Hadad HM, Glusac KD (2012) Electrode-assisted catalytic water oxidation by a flavin derivative. Nat Chem 4:794–801.
22. Zhao Y, Nakamura R, Kamiya K, Nakanishi S, Hashimoto K (2013) Nitrogendoped carbon nanomaterials as non-metal electrocatalysts for water oxidation. Nat Commun 4:2390-2393.
23. Voloshin YZ, Chornenka NV, Varzatskii OA. Belov AS. Grigoriev SA, ,Pushkarev AS, Kalinichenko VN, Millet P, Belaya IG, Bugaenko MG, Dedov AG (2018) Immobilization of functionalized iron(II) clathrochelates with terminal (poly)aromatic group(s) on carbonaceous materials and their detailed cyclic voltammetry study. Electrochim Acta 269:590-609.
24. P Serp, J.L. Figueiredo, Carbon Materials for Catalysis, (Hoboken. New Jersey: Wiley 2009) p. 579.
Таблица 1
Результаты рентгенофлуоресцентного анализа
Таблица 2
Результаты рентгенофлуоресцентного анализа после
оптимизации подачи прекурсора ТМФ
Таблица 3
Технические характеристики операционного усилителя
Таблица 4
Значения интенсивности отказов и коэффициенты нагрузки
 10-6 [1/час]
10-6 [1/час]
нагрузки
Таблица 5
Результаты расчетов интенсивности отказов i-го элемента
Таблица 6
Результат расчета интенсивности отказов групп элементов
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ качественного и количественного определения антибиотиков тетрациклинового и пенициллинового ряда в молоке и молочных изделиях | 2020 |
|
RU2739074C1 |
| Способ определения антибиотиков в сыром молоке | 2021 |
|
RU2757226C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЛЕВОМИЦЕТИНА В ПИЩЕВЫХ ПРОДУКТАХ И ФАРМПРЕПАРАТАХ | 2000 |
|
RU2180748C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АМИНОГЛИКОЗИТНЫХ АНТИБИОТИКОВ В ЛЕКАРСТВЕННЫХ И БИОЛОГИЧЕСКИХ СРЕДАХ | 2003 |
|
RU2235995C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНГИБИРУЮЩИХ ВЕЩЕСТВ В МОЛОКЕ | 1992 |
|
RU2063030C1 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНТИБИОТИКОВ В МОЛОКЕ И МОЛОЧНЫХ ПРОДУКТАХ | 2009 |
|
RU2406090C2 |
| АНТИБАКТЕРИАЛЬНЫЙ ПРЕПАРАТ "ТИПОТЕЛИН" И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2089184C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СТРЕПТОМИЦИНА МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ | 2005 |
|
RU2276354C1 |
| Способ цветометрического и тест-определения тетрациклина и доксициклина в молоке и молочных продуктах | 2016 |
|
RU2673822C2 |
| Электрохимический сенсор для определения доксорубицина и способ его изготовления | 2024 |
|
RU2838339C1 |







Изобретение относится к пищевой промышленности и может быть использовано для селективного количественного детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях. Способ качественного и количественного детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях заключается в использовании автоматического режима электрохимического детектирования с использованием программируемого потенциостата в режиме мультиизмерений и модифицированного наноразмерными катализаторами, на основе комплексов рутения и меди, рабочего электрода, которые способны к селективному связыванию с антибиотиками тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях без предварительного их выделения, причем в емкость помещают 5 мл молока или молочного изделия, затем в нее опускают модифицированный рабочий электрод, в течение 2 с при потенциале процессов от +0.5 В до -1 В проводят измерения и регистрируют значение тока, далее по калибровочной прямой определяют концентрацию антибиотиков, при этом концентрация антибиотиков может варьироваться в диапазоне 10-8–10-4 моль/л. Техническим результатом является разработка автоматизированного электрохимического способа качественного и количественного детектирования четырех типов антибиотиков (антибиотиков тетрациклинового, пенициллинового ряда, стрептомицина и левомицетина) в молоке и молочных изделиях в режиме реального времени без предварительного их выделения. 14 ил., 6 табл.
Способ качественного и количественного детектирования антибиотиков тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях, заключающийся в использовании автоматического режима электрохимического детектирования с использованием программируемого потенциостата в режиме мультиизмерений и модифицированного наноразмерными катализаторами, на основе комплексов рутения и меди, рабочего электрода, которые способны к селективному связыванию с антибиотиками тетрациклинового и пенициллинового ряда, стрептомицина и левомицетина в молоке и молочных изделиях без предварительного их выделения, причем в емкость помещают 5 мл молока или молочного изделия, затем в нее опускают модифицированный рабочий электрод, в течение 2 с при потенциале процессов от +0.5 В до -1 В проводят измерения и регистрируют значение тока, далее по калибровочной прямой определяют концентрацию антибиотиков, при этом концентрация антибиотиков может варьироваться в диапазоне 10-8–10-4 моль/л.
| Способ качественного и количественного определения антибиотиков тетрациклинового и пенициллинового ряда в молоке и молочных изделиях | 2020 |
|
RU2739074C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЛЕВОМИЦЕТИНА В ПИЩЕВЫХ ПРОДУКТАХ И ФАРМПРЕПАРАТАХ | 2000 |
|
RU2180748C1 |
| CN 106248894 A, 21.12.2016 | |||
| Способ цветометрического и тест-определения тетрациклина и доксициклина в молоке и молочных продуктах | 2016 |
|
RU2673822C2 |
Авторы
Даты
2022-08-01—Публикация
2021-11-16—Подача