ПЕРЕКРЕСТНАЯ ССЫЛКА
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США № 61/431786, поданной 11 января 2011, указанная заявка включена в настоящее описание в виде ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
Разработка платформ для чувствительного и простого измерения уровней белков в клинических образцах является важной целью, которая может способствовать более широкому применению биомаркеров в диагностике заболеваний. Чтобы дать полезную информацию, схемы детекции должны иметь высокие уровни специфичности, низкие пределы обнаружения и высокую эффективность в случае биологических жидкостей, подобных крови и сыворотке. С учетом проявления признаков множества белков в случае злокачественной опухоли и других заболеваний, мультиплексирование также является важной характеристикой. При включении внутренних и внешних контролей и калибровочных маркеров - важных для разработки точных диагностических анализов - также требуется мультиплексирование.
Разрабатывается множество высокоэффективных платформ для детекции белков, и в случае многих наиболее специфичных и чувствительных платформ используют микро- и наноматериалы для схем индикации. Наночастицы со штрихкодом, нанопроволочные транзисторы, меченные ферментами шарики и микрожидкостные иммуноанализы, используемые с выдачей электрохимических данных, являются перспективными для разработки анализаторов биомаркеров. Однако остаются проблемы, относящиеся к разработке простых систем анализа, которые являются рентабельными и достаточно надежными для клинического применения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются системы детекции для электрохимического выявления белкового аналита. В одном аспекте системы детекции включают в себя электрод, содержащий линкер на своей поверхности, при этом линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом. В других вариантах линкер содержит функциональную аминогруппу. В других вариантах линкер содержит функциональную группу карбоновой кислоты. В следующих вариантах линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В следующих вариантах линкер присоединен к антителу или его фрагменту через второй линкер. В некоторых случаях вторым линкером является глутаральдегид или формальдегид. В дополнительных вариантах линкер связан с несколькими копиями антитела или его фрагмента.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
В некоторых вариантах систем согласно настоящему изобретению редокс-репортер с электродом способен генерировать электрохимический сигнал в случае приложения потенциала. В других вариантах редокс-репортер генерирует фарадеевский ток. В других вариантах редокс-репортер способен к переносу электронов через границу раздела. В следующих вариантах редокс-репортер представляет собой феррицианид/ферроцианид или ферроцен. В следующих вариантах редокс-репортером является гексахлориридат(IV)/гексахлориридат(III).
В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод сделан из благородного металла. В других вариантах электрод является углеродным. В других вариантах электрод сделан из оксида индия и олова. В следующих вариантах электрод сделан из золота, палладия или платины.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод представляет собой микроэлектрод. В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод представляет собой наноструктурированный микроэлектрод. В некоторых вариантах электрод имеет размер меньше чем примерно 500 микрон. В других вариантах электрод имеет размер меньше чем примерно 250 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 100 микрон. В других вариантах электрод имеет размер примерно от 5 до примерно 50 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 10 микрон. В дополнительных вариантах электрод находится на чипе, изготовленном микротехнологическими способами. В следующих вариантах присутствует множество электродов, расположенных в определенном порядке на подложке.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90, или их части, варианта или фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
В настоящем изобретении также предлагаются способы электрохимической детекции белкового аналита. В одном аспекте способы включают в себя осуществление контакта электрода, содержащего линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит, с образцом и редокс-репортером; измерение электрохимического сигнала, генерируемого меченным антителом электродом и редокс-репортером в случае прикладывания потенциала; и сравнение электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита; где изменение регистрируемого сигнала по сравнению с сигналом контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом. В других вариантах линкер содержит функциональную аминогруппу. В других вариантах линкер содержит функциональную группу карбоновой кислоты. В следующих вариантах линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В следующих вариантах линкер присоединен к антителу или его фрагменту через второй линкер. В некоторых случаях вторым линкером является глутаральдегид или формальдегид. В дополнительных вариантах линкер связан с множеством копий антитела или его фрагмента.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
В некоторых вариантах систем согласно изобретению редокс-репортер генерирует фарадеевский ток. В других вариантах редокс-репортер способен к переносу электронов через границу раздела. В следующих вариантах редокс-репортером является феррицианид/ферроцианид или ферроцен. В следующих вариантах редокс-репортером является гексахлориридат(IV)/гексахлориридат(III).
В некоторых вариантах способов, предлагаемых в настоящем изобретении, электрод сделан из благородного металла. В других вариантах электрод является углеродным. В других вариантах электрод сделан из оксида индия и олова. В следующих вариантах электрод сделан из золота, палладия или платины.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, электрод представляет собой наноструктурированный микроэлектрод. В других вариантах электрод имеет размер меньше чем примерно 100 микрон. В еще других вариантах электрод имеет размер примерно от 5 до примерно 50 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 10 микрон. В дополнительных вариантах электрод находится на чипе, изготовленном микротехнологическими способами.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2 микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90 или их части, варианта или фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
Также в настоящем изобретении предлагаются способы мультиплексной электрохимической детекции множества белковых аналитов. В одном аспекте способы включают в себя осуществление контакта первого электрода, содержащего линкер на своей поверхности, где линкер связан с первым антителом или его фрагментом, способным связывать белковый аналит, с образцом и редокс-репортером; измерение первого электрохимического сигнала, генерируемого первым меченным антителом электродом и редокс-репортером в случае приложения потенциала; осуществление контакта второго электрода, содержащего линкер на своей поверхности, где линкер связан со вторым антителом или его фрагментом, способным связывать белковый аналит, с образцом и редокс-репортером; измерение второго электрохимического сигнала, генерируемого вторым меченным антителом электродом и редокс-репортером в случае приложения потенциала; и сравнение первого и второго электрохимических сигналов с соответствующими сигналами, генерируемыми первым и вторым меченным антителом электродом в контрольном образце, не содержащем белкового аналита; где изменение первого и второго регистрируемых электрохимических сигналов по сравнению с соответствующими сигналами контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, первый и второй электроды находятся на чипе, изготовленном микротехнологическими способами. В других вариантах первый и второй электроды находятся на разных чипах, изготовленных микротехнологическими способами.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, второй меченный антителом электрод является эталонным контролем для первого меченного антителом электрода. В других вариантах второй меченный антителом электрод регистрирует наиболее часто встречающийся белок сыворотки.
В настоящем изобретении также предлагаются способы мониторинга прогрессирования или ответа субъекта, имеющего злокачественную опухоль. В одном аспекте способы включают получение биологического образца от субъекта; осуществление контакта электрода, содержащего линкер на своей поверхности, при этом линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит, с образцом и редокс-репортером, при этом антитело или его фрагмент связывает белковый аналит; измерение электрохимического сигнала, генерируемого меченным антителом электродом и редокс-репортером в случае приложения потенциала; и сравнение электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита; где изменение регистрируемого сигнала по сравнению с сигналом контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90 или их части, варианта или его фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
В настоящем изобретении также предлагаются наборы для электрохимической детекции белкового аналита. В одном аспекте наборы содержат электрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер, способный генерировать электрохимический сигнал при взаимодействии с электродом в случае приложения потенциала.
ВКЛЮЧЕНИЕ В ВИДЕ ССЫЛКИ
Все публикации, патенты и заявки на выдачу патентов, упоминаемые в настоящем описании, включены в настоящую публикацию в виде ссылки в той же степени, как и в случае, когда отдельная публикация, патент или заявка на выдачу патента специально и по отдельности включена в виде ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Новые отличительные признаки изобретения конкретно указаны в прилагаемой формуле изобретения. Лучше понять отличительные признаки и преимущества настоящего изобретения можно будет при обращении к следующему подробному описанию, где приведены иллюстративные варианты, в которых использованы принципы изобретения, и к сопровождающим чертежам, на которых:
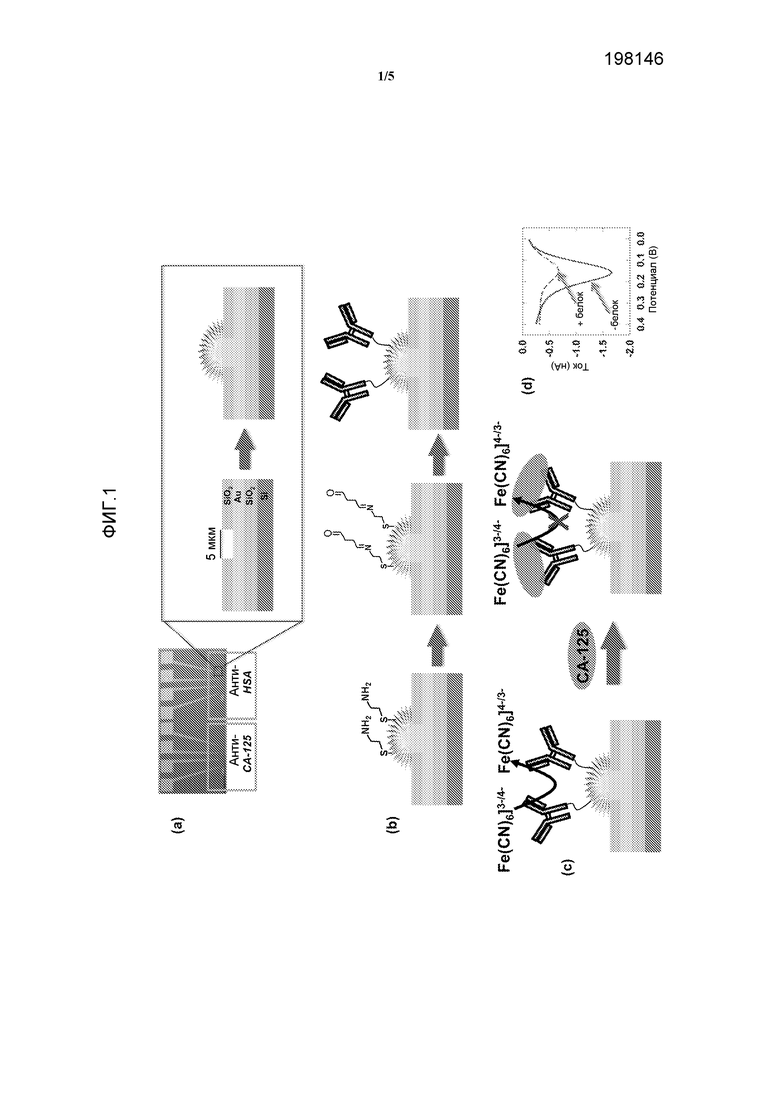
Фиг.1a. Фотография (слева) сенсорного чипа для мультиплексного анализа, показывающая изготовленный микротехнологическими способами чип, который характеризуется отверстиями размером 5 мкм для электрохимического отложения электродов, и иллюстрация (в середине) выемки. Определенную картину наносят золотом (Au) посредством осаждения на силиконовую пластину, используя обычную фотолитографию, и затем покрывают слоем SiO2; затем вытравливают отверстия размером 5 мкм через этот верхний слой, чтобы обнажить круглый участок Au. Схематичная иллюстрация создания Au-электродов посредством электроосаждения Au (справа).
Фиг.1b. Схематичная функционализация электрода; (слева) линкер из цистамина образуют на Au-структуре; (в середине) взаимодействие с бифункциональным линкером глутаральдегидом для введения альдегидных групп на поверхность сенсора; (справа) добавление анти-CA-125-антитела или антитела против сывороточного альбумина человека (HSA) для получения модифицированных антителом электродных сенсоров.
Фиг.1c. Схема электрохимической детекции антигена CA-125. Связывание антиген-антитело препятствует реакции переноса электронов через границу раздела [Fe(CN)6]3-/4-.
Фиг.1d. Дифференциальная импульсная вольтамперометрия (DPV), показывающая снижение сигнала после инкубации CA-125 (10 ед./мл в сыворотке) в течение 40 минут.
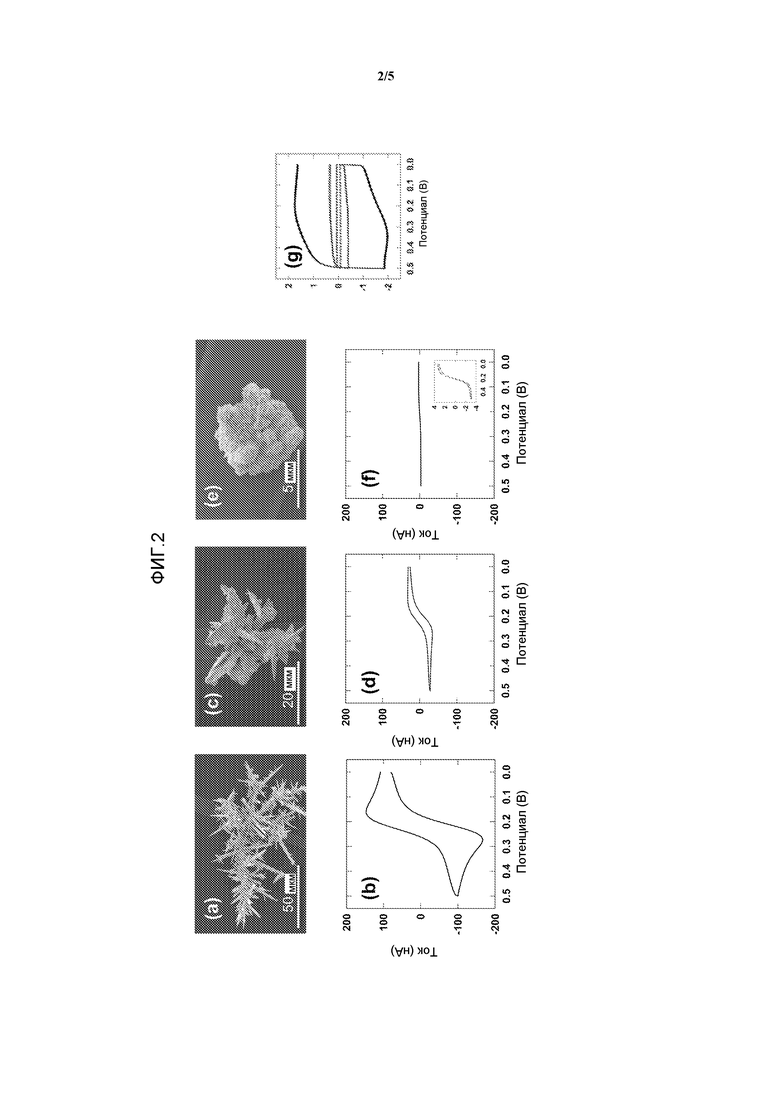
Фиг.2. СЭМ-изображения и характеристические циклические вольтаммограммы для трех сенсорных Au-электродов разного размера. СЭМ-изображения: (a) 100-микронного сенсора. Такая структура была изготовлена с использованием постояннотоковой вольтамперометрии в случае приложенного потенциала 0 мВ в течение 200 секунд, (c) 30-микронного сенсора. Такая структура была изготовлена с использованием постояннотоковой вольтамперометрии в случае приложенного потенциала 150 мВ в течение 200 секунд, и (e) 8-микронного сенсора. Такая структура была изготовлена с использованием хронопотенциометрии в случае прилагаемого тока 30 нА в течение 50 секунд. Характеристические циклические вольтаммограммы трех сенсоров получали в 10 мМ растворе фосфатного буфера, содержащем 2,5 мМ [Fe(CN)6]3-/4- и 0,1 М KCl, со скоростью сканирования 100 мВ/сек в случае сенсоров размером (b) 100 микрон, (d) 30 микрон и (f) 8 микрон. Вставка на фиг.2(f) показывает увеличенное изображение циклической вольтаммограммы. (g) Емкостный ток в случае трех сенсоров, отражающий площадь поверхности для каждого размера сенсора. Циклические вольтаммограммы получали в 10 мМ растворе фосфатного буфера, содержащем 0,1 М KCl, со скоростью сканирования 100 мВ/сек для сенсоров размером (внешняя кривая) 100 микрон, (средняя кривая) 30 микрон и (внутренняя кривая) 8 микрон.
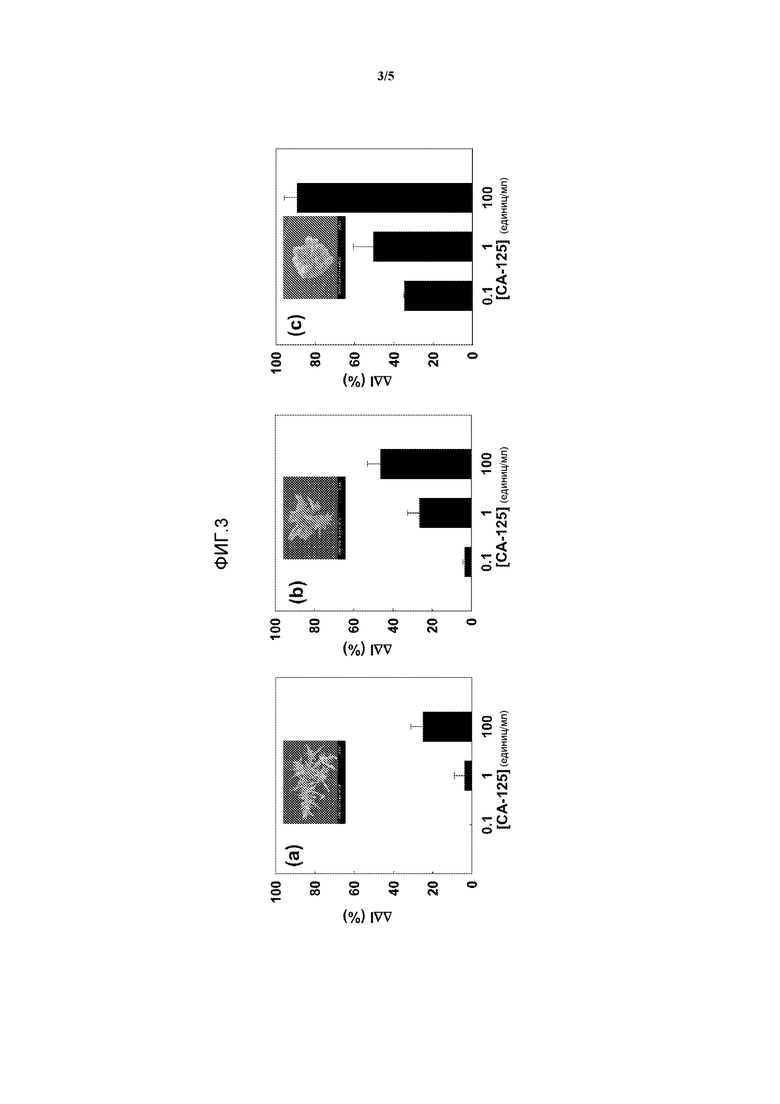
Фиг.3. Сравнение чувствительности и пределы обнаружения иммуносенсоров, созданных с использованием трех Au-структур разного размера. ΔΔ(I%) с изменением концентрации CA-125 в PBS получали с использованием (a) 100-микронного сенсора, (b) 30-микронного сенсора и (c) 8-микронного сенсора.
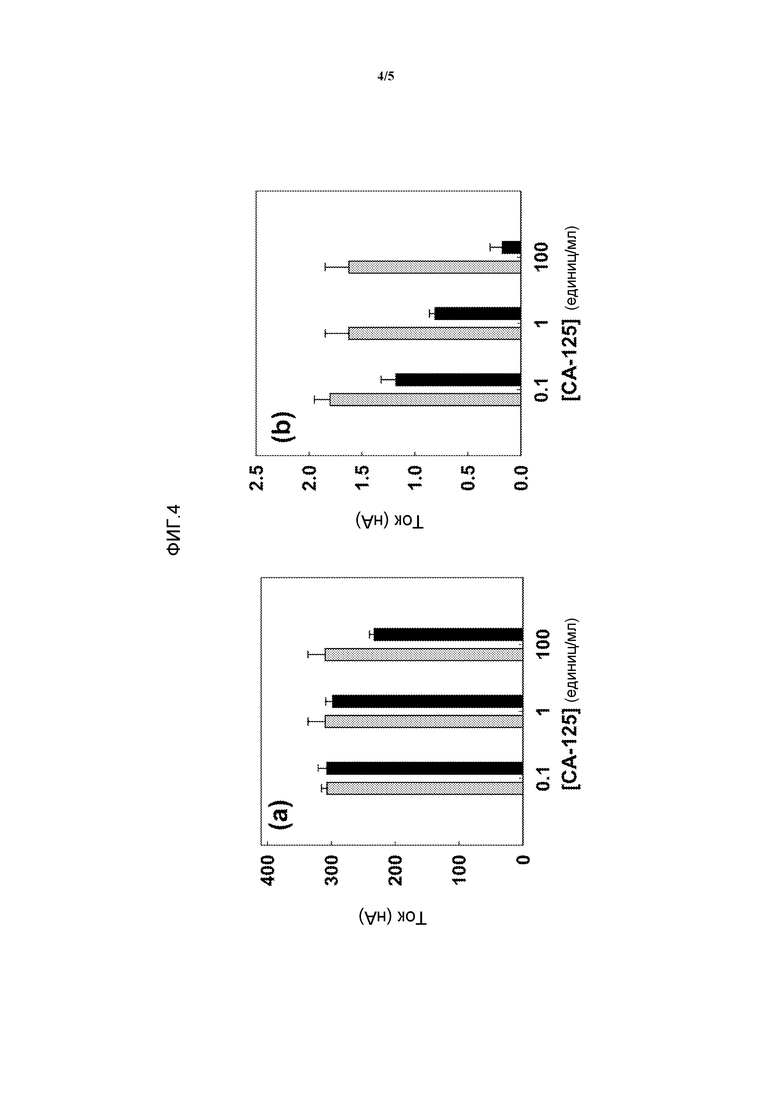
Фиг.4. Изменение тока сенсоров с размером (a) 100 микрон и (b) 8 микрон до (серый столбик) и после (черный столбик) инкубации с разными концентрациями CA-125 в PBS.
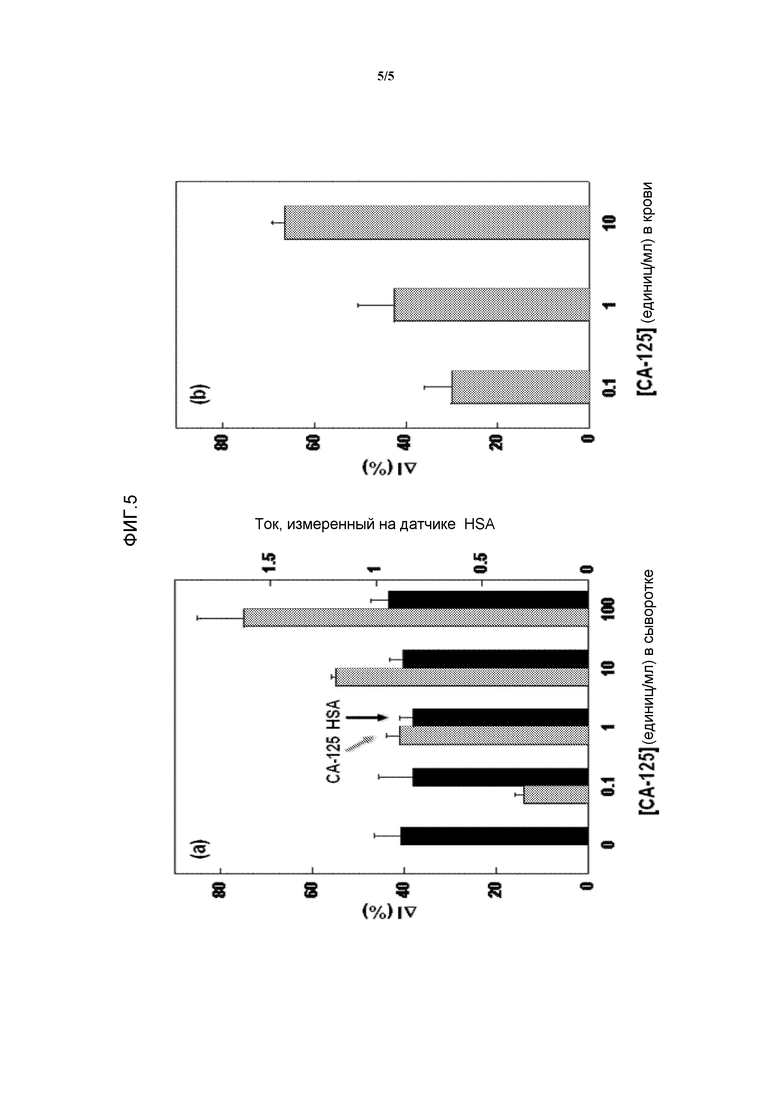
Фиг.5. Детекция CA-125 в сыворотке и цельной крови. (a) Одновременная детекция CA-125 и HSA в образцах сыворотки, в которые вносили аналит. Образец содержал неразбавленную сыворотку. Данные получали с использованием только сыворотки и сыворотки, в которую вносили разные концентрации CA-125. Серыми столбиками показаны данные, полученные в случае модифицированных анти-CA-125-антителом иммуносенсоров, и черные столбики представляют данные, полученные в случае модифицированных анти-HSA-антителом иммуносенсоров. Размер сенсора составлял 8 микрон. (b) Детекция CA-125 в цельной крови. Образцы содержали неразбавленную необработанную кровь, и концентрации CA-125 указаны.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Системы и способы электрохимической детекции
В настоящем изобретении предлагаются системы и способы электрохимической детекции аналита-мишени в образце. Присутствие аналита выявляют по изменению электрокаталитического сигнала. Использование такого считывания электрических сигналов обеспечивает способ, который является недорогим, чрезвычайно чувствительным, простым с точки зрения миниатюризации и удобным для автоматизации.
В одном аспекте систем и способов детекции, описанных в настоящей публикации, предлагается электрод, где электрод содержит линкер и где линкер присоединен к антителу или его фрагменту. Антитело или его фрагмент способны связываться с аналитом-мишенью, таким как белок. Электрод находится в присутствии редокс-репортера.
Редокс-репортеры, подходящие для применения в системах и способах, описанных в настоящей публикации, способны генерировать электрический сигнал (например, фарадеевский ток) при взаимодействии с электродом в случае приложения потенциала. Можно использовать любой редокс-репортер, который генерирует фарадеевский ток или способен к переносу электронов через границу раздела в присутствии электрода. Неограничивающие редокс-репортеры включают без ограничения небольшие активные в окислительно-восстановительных реакциях группы, такие как феррицианид/ферроцианид, ферроцен и гексахлориридат(IV)/гексахлориридат(III). В системах детекции используют редокс-репортеры для генерации электрических сигналов исходного уровня при взаимодействии с электродом. Когда присутствует аналит-мишень, который связывается с антителом или его фрагментом, электрический сигнал ослабляется. Предполагают, что ослабление сигнала является следствием того, что аналит-мишень блокирует эффективный доступ редокс-репортера к поверхности электрода. Другими словами, связывание антитело-аналит препятствует переносу электронов через границу раздела. Смотри, только в качестве примера, фиг.1c и 1d.
В одном аспекте изменения сигнала, соответствующие связыванию аналита-мишени с антителом, вычисляют в виде изменения фарадеевского тока в процентах:
ΔI%={(средний I0)-(средний Ic)}/средний I0 × 100
где средний I0 = средний ток при нулевой концентрации мишени, средний Ic = средний ток при любой концентрации мишени). В некоторых вариантах изменение сигнала составляет, по меньшей мере, примерно 10%, по меньшей мере, примерно 15%, примерно 25%, примерно 30%, примерно 40%, примерно 50%, примерно 65%, примерно 75%, примерно 85%, примерно 90%, примерно 95%, больше чем примерно 100%, примерно в два раза, примерно в десять раз, примерно в пятьдесят раз или больше. В некоторых случаях изменение сигнала показывает, что аналит связан с антителом. В случае изменения фарадеевского тока системы регистрации и способы, описанные в настоящей публикации, применяют в одном аспекте для определения присутствия аналита-мишени.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, применяют для определения концентрации аналита-мишени в образце. В некоторых вариантах определение осуществляют посредством калибровки системы детекции с использованием стандартов с известной концентрацией аналита-мишени. Например, ряд положительных контрольных образцов, каждый из которых имеет конкретную концентрацию аналита, используют для определения изменения фарадеевского тока в процентах с целью определения неизвестного количества аналита в тестируемом образце. Диапазоны детекции в случае систем и способы детекции зависят от антитела, аналита и их связывающей способности, а также используемого редокс-репортера. В некоторых вариантах системы и способы детекции, описанные в настоящей публикации, выявляют концентрации аналита примерно 500 фемтомолярные (фМ) или примерно 100 пг/мл или ниже.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, являются мультиплексными для обнаружения и/или определения концентрации множества аналитов-мишеней. В некоторых вариантах мультиплексные системы и способы включают в себя, по меньшей мере, два электрода, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. В некоторых случаях в мультиплексной системе используют два, три, четыре, пять, шесть, семь, восемь, девять или десять электродов, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. В некоторых вариантах в мультиплексной системе используют, по меньшей мере, три, по меньшей мере, пять, по меньшей мере, десять, по меньшей мере, пятнадцать, по меньшей мере, двадцать, по меньшей мере, тридцать, по меньшей мере, сорок или, по меньшей мере, пятьдесят или больше электродов, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. Альтернативно, более одного электрода могут содержать одно и то же антитело или класс антител; например, можно использовать повторы четырех электродов, при этом группа содержит одно из трех отдельных антител, в содержащей двенадцать электродов мультиплексной системе. Кроме того, электрод может содержать больше одного антитела или класса антител; например, на отдельном электроде можно сочетать больше одного антитела, при этом каждое антитело узнает конкретную область белка или аналита. В некоторых случаях, детекция может происходить только тогда, когда белок или аналит связывается со всеми антителами, связанными с электродом. В некоторых случаях детекция будет происходить, только когда белок или аналит связывает, по меньшей мере, одну из групп антител, связанных с электродом.
Мультиплексирование позволяет одновременно выявлять большое разнообразие аналитов, таким образом создавая «панель аналитов». Примерные панели аналитов могут содержать аналиты, связанные с расстройством, заболеванием или состоянием, например биомаркеры, связанные с определенной злокачественной опухолью. Мультиплексирование также обеспечивает более высокую чувствительность к аналиту, например разные антитела, которые связываются с одним и тем же аналитом-мишенью через одни и те же или разные эпитопы. Использование разных антител, такое как, например, использование поликлонального и моноклонального антител, мишенью которых является один и тот же аналит, позволяет сделать систему детекции более надежной и чувствительной, чем одноплексная система, в которой используют только один тип антитела для обнаружения аналита. Кроме того, мультиплексирование обеспечивает возможность внутренней калибровки системы с целью уменьшения ложно-положительных и отрицательных результатов. Например, анализ аналита-мишени можно осуществлять параллельно с анализом аналита, который, как известно, является стабильным, таким как широко представленный в сыворотке белок.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, применяют для выявления и диагностики расстройства, заболевания или состояния или для мониторинга прогрессирования или ответа расстройства, заболевания или состояния. В некоторых вариантах получают образец от пациента или субъекта и применяют системы и способы детекции для выявления присутствия и/или определения концентрации аналита-мишени, ассоциированного с расстройством, заболеванием или состоянием. Примеры расстройств, заболеваний или состояний включают злокачественные опухоли (например, злокачественные опухоли молочной железы, яичника, предстательной железы, поджелудочной железы, прямой и ободочной кишки, мочевого пузыря и тому подобные), инфекционные болезни (например, инфекции бактериями Staphylococcus или Streptococcus, MRSA, VISA, вирусные инфекции, грибковые инфекции и тому подобные), аутоиммунные заболевания (например, диффузный токсический зоб, волчанку, артрит, синдром Гудпасчера и тому подобные), метаболические заболевания и расстройства (например, метаболический синдром, резистентность к инсулину, диабет типа I и II, болезнь Крона, синдром раздраженной кишки и тому подобные), ВИЧ/СПИД, генетические заболевания и состояния, ассоциированные с терапевтическими лекарственными средствами или токсикологическими материалами. В некоторых вариантах определяют тяжесть или стадии расстройства, заболевания или состояния благодаря определению концентрации аналита-мишени, при этом разные концентрации свидетельствуют о тяжести или стадии. Подобным образом в других вариантах определяют прогрессирование или ответ расстройства, заболевания или состояния благодаря определению концентрации аналита-мишени в разных временных точках. Терапевтически эффективное фармакологическое лечение, терапия или схема в некоторых вариантах также могут быть определены в результате выявления концентрации аналита-мишени в разных временных точках.
II. Электроды
Электроды для систем и способов детекции, описанных в настоящей публикации, представляют собой любые электропроводящие материалы, обладающие свойствами, обеспечивающими возможность присутствия линкеров на поверхности электродов. Электроды обладают способностью к переносу электронов к редокс-репортеру или от него и обычно соединены с устройством электронного управления и детекции. В общем, благородные металлы, такие как Ag, Au, Ir, Os, Pd, Pt, Rh, Ru и другие представители такого семейства являются подходящими материалами для электродов. Благородные металлы обладают подходящими свойствами, включая стабильность и устойчивость к окислению, могут быть обработаны разными способами, такими как электроосаждение, и связываются с молекулами, содержащими тиолы и дисульфиды, таким образом обеспечивая возможность связывания указанных молекул. Также могут быть использованы другие материалы, такие как азотсодержащие проводящие соединения (например, WN, TiN, TaN) или материалы на основе силикона/диоксида кремния, такие как силан или силоксан. В некоторых вариантах электрод состоит из золота, палладия или платины. В других вариантах электрод является углеродным. В следующих вариантах электрод состоит из оксида индия и олова.
В некоторых вариантах электрод является микроэлектродом. В других вариантах микроэлектрод представляет собой наноструктурированный микроэлектрод («NME»). NME представляют собой микроэлектроды, характерной особенностью которых являются наноструктурированные поверхности. Нанотекстурирование поверхности или наноструктуры увеличивают площадь поверхности электрода, обеспечивая более высокую чувствительность, в частности, в случае применения биосенсоров. Производство NME может быть осуществлено с использованием электроосаждения. Варьируя параметры, такие как время осаждения, напряжение осаждения, тип фонового электролита и источники ионов металлов, можно создать NME различного размера, строения и состава. В некоторых случаях NME имеют дендритную структуру. Сложность дендритной структуры достигается за счет варьирования вышеуказанных параметров электроосаждения. Примеры NME для применения в системах и способах, описанных в настоящей публикации, приведены в международной заявке на выдачу патента с регистрационным № PCT/CA2009/001212 (опубликованной с номером WO/2010/025547), которая включена в виде ссылки в полном объеме.
Другие структуры электродов также можно использовать в системах и способах детекции, описанных в настоящей публикации, включая плоские поверхности, проволоки, трубки, конусы и частицы. Коммерчески доступные макро- и микроэлектроды также подходят для вариантов осуществления изобретения, описанных в настоящей публикации.
Электроды имеют размеры, например, примерно от 0,0001 до примерно 5000 микрон в длину или в диаметре; примерно от 0,0001 до примерно 2000 микрон в длину или в диаметре; примерно от 0,001 до примерно 250 микрон; примерно от 0,01 до примерно 200 микрон; примерно от 0,1 до примерно 100 микрон; примерно от 1 до примерно 50 микрон; примерно от 10 до примерно 30 микрон в длину, или меньше, чем примерно 10 микрон в длину или в диаметре. В некоторых вариантах электроды имеют размеры примерно 100 микрон, примерно 30 микрон, примерно 10 микрон или примерно 5 микрон в длину или в диаметре. В следующих вариантах электроды имеют размеры примерно 8 микрон.
В некоторых вариантах системы и способы детекции, описанные в настоящей публикации, содержат один электрод для детекции. В других вариантах используют множество электродов. В некоторых вариантах применение множества электродов можно использовать параллельно для обнаружения аналита-мишени посредством одного типа антитела, связанного с каждым электродом. Альтернативно в других вариантах используют множество электродов для мультиплексирования, как описано ранее. Множество электродов можно компоновать в виде матриц с высокой или низкой плотностью. Пример 8-электродной матрицы на изготовленном микротехнологическими способами чипе для мультиплексного применения изображен на фиг.1a.
В следующих вариантах электрод расположен на подложке. Подложка может содержать широкий диапазон материалов: биологических, небиологических, органических, неорганических, либо любое их сочетание. Например, подложка может представлять собой полимеризованную пленку Лангмюра-Блоджета, функционализированное стекло, Si, Ge, GaAs, GaP, SiO2, SiN4, модифицированный силикон или любой из широкого множества гелей или полимеров, таких как (поли)тетрафторэтилен, (поли)винилидендифторид, полистирол, поперечно сшитый полистирол, полиакриловая, полимолочная кислота, полигликолевая кислота, сополимер(лактид-гликолид), полиангидриды, поли(метилметакрилат), сополимер (этилен-винилацетат), полисилоксаны, полимерный диоксид кремния, латексы, полимеры декстрана, эпоксиды, поликарбонаты или их сочетания.
Подложки могут представлять собой плоские кристаллические подложки, такие как подложки на основе диоксида кремния (например, стекло, кварц и или тому подобные), или кристаллические подложки, используемые, например, в производстве полупроводников и микропроцессоров, такие как силикон, арсенид галлия, GaN, допированный индием, и тому подобные. Аэрогели на основе диоксида кремния также можно использовать в качестве подложек и могут быть получены любыми известными способами. Подложки на основе аэрогелей можно использовать в виде отдельно стоящих подложек или в виде покрытия поверхности подложки из другого материала.
Подложка может принимать любую форму и обычно представляет собой пластину, предметное стекло, шарик, гранулу, диск, частицу, микрочастицу, наночастицу, нить, осадок, необязательно пористый гель, листы, трубку, сферу, контейнер, капилляр, площадку, тонкий слой, пленку, чип, многолуночный планшет или чашку, оптическое волокно и т.д. Подложка может быть любой формы, которая является жесткой или полужесткой. Подложка может содержать повышенные или пониженные области, на которых располагается компонент анализа. Поверхность подложки может быть вытравлена с использованием хорошо известных способов для получения требуемых характеристик поверхности, например желобки, v-бороздки, мезаструктуры или тому подобные. Подложка может принимать форму фотодиода, оптоэлектронного датчика, такого как оптоэлектронный полупроводниковый чип или оптоэлектронный тонкопленочный полупроводник, или биочипа. Положение(положения) электрода(ов) на подложке может быть адресным; адресация может быть осуществлена в формах с высокой плотностью, и положение(положения) может быть микроадресным или наноадресным. В некоторых вариантах электрод(ы) находится на полученном посредством микропроизводства чипе.
Поверхности на подложке могут состоять из того же материала, что и подложка, или могут быть сделаны из другого материала и могут быть связаны с подложкой химическим или физическим способом. Такие связанные поверхности могут состоять из любого из широкого множества материалов, например из полимеров, пластиков, смол, полисахаридов, диоксида кремния или материалов на основе диоксида кремния, угля, металлов, неорганических стекол, мембран или любого из перечисленных выше материалов подложки.
Подложка и/или ее поверхность обычно устойчивы или обработаны так, чтобы они были устойчивыми к условиям, которые на них действуют при применении, и необязательно могут быть обработаны так, чтобы удалить любой устойчивый материал после воздействия таких условий.
III. Линкеры
В одном аспекте электрод содержит линкер на поверхности электрода. Линкеры в некоторых вариантах могут образоваться в случае абсорбции молекул линкера и оказываются организованными в виде слоя молекул на поверхности. Линкеры, подходящие для применения в случае электродов, раскрытых в настоящем описании, имеют «группу головки», которая прочно хемосорбируется на металлах (например, тиолы и дисульфиды), и хвост с функциональной группой (например, -OH, -NH2, -COOH, -CO, -OCH3, -NHNH2, -биотином, -NHS (активный по отношению к аминам N-гидроксисукцинимид)). Примеры линкеров включают одноцепочечные или имеющие разветвленные цепи алкилтиолы с функциональной группой. Другие линкерные молекулы включают ароматические тиолы, такие как тиофенол с функциональной группой. Подходящие линкерные молекулы включают любую молекулу с функциональной группой, которая может прямо или опосредованно спариваться с антителом. Примеры линкерных молекул включают без ограничения цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В некоторых вариантах линкером является цистамин.
Линкеры образуются на поверхности электрода, когда электрод погружают в раствор линкерной молекулы. Обычные концентрации составляют примерно 0,01 мМ, 0,05 мМ, 0,1 мМ, 0,5 мМ, 1 мМ, примерно 2 мМ, примерно 5 мМ, примерно 10 мМ, примерно 20 мМ или примерно 50 мМ или больше линкерной молекулы в водном или этанольном растворе. Погружение осуществляют в течение периода времени в диапазоне от нескольких часов до нескольких суток. В некоторых вариантах погружение продолжается примерно 4 часа, примерно 8 часов, примерно 16 часов, примерно 24 часа, примерно 2 суток, примерно 5 суток или примерно 7 суток. В некоторых вариантах погружение осуществляют при комнатной температуре. В других вариантах погружение осуществляют при температуре выше комнатной температуры. В следующих вариантах погружение осуществляют при температуре ниже, чем комнатная температура.
Линкеры могут быть прямо или опосредованно спарены с антителом любым известным способом. Прямое спаривание в некоторых вариантах может быть осуществлено через функциональные группы линкерных молекул, такие как функциональные группы -CO, которые могут взаимодействовать и связываться с антителами. Альтернативно в других вариантах второй линкер или спейсер может быть конъюгирован с функциональной группой, посредством которой второй линкер или спейсер может связываться с антителом. Например, линкерные молекулы с функциональными группами -NH могут взаимодействовать с таким линкером, как глутаральдегид или формальдегид, которые в свою очередь могут связываться с антителами. В следующих вариантах антитело может быть дериватизовано таким образом, чтобы взаимодействовать с функциональной группой. Например, меченное авидином антитело может связываться с биотиновой функциональной группой линкера. Указанные и другие примеры прямого и опосредованного связывания входят в объем вариантов осуществления изобретения, описанных в настоящей публикации.
IV. Антитела
В одном аспекте антитело используют для определения количества и/или концентрации аналита-мишени. Антитела, относящиеся к семейству белков плазмы, называемых иммуноглобулинами, основной строительный блок которых, укладка или домен иммуноглобулина, используется в различных формах во многих молекулах иммунной системы и других системах биологического распознавания. Типичный иммуноглобулин имеет четыре полипептидных цепи, содержащих антигенсвязывающую область, известную как вариабельная область, и невариабельную область, известную как константная область. Антитело, которое подходит для использования в вариантах осуществления изобретения, описанных в настоящей публикации, может быть в любой из множества форм, включая сыворотку, полный иммуноглобулин, фрагмент антитела, такой как Fv, Fab и сходные фрагменты, одноцепочечное антитело, которое включает в себя определяющие комплементарность области (CDR) вариабельного домена, и тому подобные формы, которые подпадают под широкий термин «антитело» в используемом в настоящем описании смысле. Варианты осуществления изобретения, раскрытые в настоящем описании, предполагают использованием антитела с любой специфичностью, поликлонального или моноклонального, и не ограничены антителами, которые узнают и иммунологически взаимодействуют с конкретным антигеном. В некоторых вариантах, раскрытых в настоящем описании, в контексте как способов терапии, так и способов скрининга используют антитело или его фрагмент, который является иммуноспецифичным по отношению к аналиту-мишени.
Термин «моноклональное антитело» в используемом в настоящем описании смысле относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфичными, будучи направленными против одного антигенного участка. Кроме того, в отличие от обычных препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Моноклональные антитела согласно изобретению, в частности, включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида, или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи(цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность. Смотри патент США № 4816567 и публикацию Morrison с соавторами Proc. Natl. Acad. Sci. USA 81, 6851-6855 (1984).
Термин «фрагмент антитела» относится к части полноразмерного антитела, обычно к антигенсвязывающей или вариабельной области. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых Fab-фрагментами, каждый из которых имеет один антигенсвязывающий участок, и оставшийся «Fc»-фрагмент, называемый так по его способности легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который имеет два антигенсвязывающих фрагмента, которые способны перекрестно связывать антиген, и другой остаточный фрагмент (который называют pFc'). Дополнительные фрагменты могут включать диантитела, линейные антитела, молекулы одноцепочечных антител и полиспецифичные антитела, образованные из фрагментов антител. В используемом в настоящем описании смысле «функциональный фрагмент» в отношении антител относится к фрагментам Fv, F(ab) и F(ab')2.
Фрагменты антител сохраняют некоторую способность избирательно связываться со своим антигеном или рецептором и их определяют следующим образом.
(1) Fab представляет собой фрагмент, который содержит моновалентный антигенсвязывающий фрагмент молекулы антитела. Fab-фрагмент может быть получен расщеплением полного антитела ферментом папаином с получением интактной легкой цепи и части одной тяжелой цепи.
(2) Fab' представляет собой фрагмент молекулы антитела, который может быть получен обработкой полного антитела пепсином с последующим восстановлением с получением интактной легкой цепи и части тяжелой цепи. Получают два Fab'-фрагмента на молекулу антитела. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела.
(3) F(ab')2 представляет собой фрагмент антитела, который может быть получен обработкой полного антитела ферментом пепсином без последующего восстановления. F(ab')2 является димером двух Fab'-фрагментов, удерживаемых вместе двумя дисульфидными связями.
(4) Fv представляет собой минимальный фрагмент антитела, который содержит полный участок узнавания и связывания антигена. Такая область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в тесной нековалентной ассоциации (димер VH VL). Область находится в такой конфигурации, что три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий участок на поверхности димера VH VL. Вместе шесть CDR придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные по отношению к антигену) обладает способностью узнавать и связывать антиген, хотя и с более низкой аффинностью, чем полный участок связывания.
(5) Одноцепочечное антитело («SCA») определяют как генетически сконструированную молекулу, содержащую вариабельную область легкой цепи, вариабельную область тяжелой цепи, связанные подходящим полипептидным линкером в виде генетически слитой одноцепочечной молекулы. Такие одноцепочечные антитела также называют «одноцепочечным Fv» или «sFv»-фрагментом антитела. В общем, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает возможность образования структуры sFv, требуемой для связывания антигена. Обзор данных о sFv смотри в публикации Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, N.Y., pp. 269 315 (1994).
Термин «диантитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, и такие фрагменты содержат вариабельный фрагмент тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH VL). При использовании линкера, который является слишком коротким, чтобы обеспечить возможность спаривания между двумя доменами одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи, и при этом образуются два антигенсвязывающих участка. Диантитела более полно описаны, например, в EP 404097, WO 93/11161 и в публикации Hollinger с соавторами, Proc. Natl. Acad Sci. USA 90: 6444 6448 (1993).
Другой формой фрагмента антитела является пептид, кодирующий одну определяющую комплементарность область (CDR). CDR-пептиды («минимальные единицы узнавания») могут быть получены благодаря конструированию генов, кодирующих CDR представляющего интерес антитела. Такие гены получают, например, используя полимеразную цепную реакцию для синтеза вариабельной области с РНК из продуцирующих антитела клеток. Смотри, например, Larrick с соавторами, Methods: a Companion to Methods in Enzymology, Vol. 2, p. 106 (1991).
Создание и получение антител осуществляют любым известным способом. Смотри, например, публикации Green с соавторами, Production of Polyclonal Antisera в: Immunochemical Protocols (Manson, ed.), p. 15 (Humana Press); Coligan с соавторами, Production of Polyclonal Antisera in Rabbits, Rats Mice and Hamsters, в: Current Protocols in Immunology, раздел 2.4.1 (1992), которые таким образом включены в виде ссылки, в отношении создания и получения поликлональных антител; Kohler and Milstein, Nature, 256:495 (1975); Coligan с соавторами, разделы 2.5.1 2.6.7; и Harlow с соавторами в: Antibodies: A Laboratory Manual, p. 726 (Cold Spring Harbor Pub. (1988)), которые таким образом включены в виде ссылки, в отношении создания и получения моноклональных антител. Способы создания фрагментов антител могут быть осуществлены в соответствии с протоколами, описанными, например, в публикации Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, (1988).
Антитела связывают с линкером любым известным способом. В некоторых вариантах антитело может быть связано непосредственно с выбранной функциональной группой на линкере. Альтернативно в других вариантах антитела могут быть связаны с линкером опосредованно через второй линкер или спейсер.
V. Выявляемые аналиты/биомаркеры и патологические состояния/применения
В одном аспекте аналитом-мишенью является белок. Существует большое количество возможных белковых аналитов-мишеней, которые можно выявлять с использованием вариантов осуществления изобретения, раскрытых в настоящем описании. Под «белком» или грамматическими эквивалентами данного термина в настоящем описании подразумевают белки, олигопептиды и пептиды, производные и аналоги, включая белки, содержащие не встречающиеся в природе аминокислоты и аналоги аминокислот, и структуры пептидомиметиков. Боковые цепи могут быть либо в (R)-, либо в (S)-конфигурации. В некоторых вариантах аминокислоты находятся в (S)- или L-конфигурации.
Подходящие белковые аналиты включает без ограничения (1) иммуноглобулины, в частности IgE, IgG и IgM, и, в частности, терапевтически или диагностически значимые антитела, включая без ограничения, например антитела к альбумину человека, аполипопротеидам (включая аполипопротеид E), хорионическому гонадотропину человека, кортизолу, α-фетопротеину, тироксину, тиреостимулирующему гормону (TSH), антитромбину, антитела к фармацевтическим средствам (включая противоэпилептические лекарственные средства (фенотоин, примидон, карбамазепин, этосуксимид, вальпроевую кислоту и фенобарбитол), кардиоактивные лекарственные средства (дигоксин, лидокаин, прокаинамид и дизопирамид), бронхорасширяющие средства (теофиллин), антибиотики (хлорамфеникол, сульфонамиды), антидепрессанты, иммунодепрессанты, наркотические средства (амфетамин, метамфетамин, каннабиноиды, кокаин и опиаты) и антитела к любым вирусам (включая ортомиксовирусы (например, вирус гриппа), парамиксовирусы (например, респираторно-синцитиальный вирус, вирус эпидемического паротита, вирус кори), аденовирусы, риновирусы, коронавирусы, реовирусы, тогавирусы (например, вирус краснухи), парвовирусы, поксвирусы (например, вирус натуральной оспы, вирус вакцинии), энтеровирусы (например, вирус полиомиелита, вирус Коксаки), вирусы гепатита (включая A, B и C), вирусы герпеса (например, вирус простого герпеса, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барра), ротавирусы, вирусы Норволк, хантавирус, аренавирус, рабдавирус (например, вирус бешенства), ретровирусы (включая ВИЧ, HTLV-I и -II), паповавирусы (например, вирус папилломы), вирусы полиомиелита и пикорнавирусы и тому подобные), и бактериям (включая широкое многообразие представляющих интерес патогенных и непатогенных прокариот, включая Bacillus; Vibrio, например V. cholerae; Escherichia, например энтеротоксигенная E. coli, Shigella, например S. dysenteriae; Salmonella, например S. typhi, Mycobacterium, например M. tuberculosis, M. leprae; Clostridium, например C. botulinum, C. tetani, C. difficile, C. perfringens; Cornyebacterium, например C. diphtheriae; Streptococcus, S. pyogenes, S. pneumoniae, Staphylococcus, например S. aureus; Haemophilus, например, H. influenzae; Neisseria, например N. meningitidis, N. gonorrhoeae; Yersinia, например G. lamblia, Y. pestis, Pseudomonas, например P. aeruginosa, P. putida; Chlamydia, например C. trachomatis; Bordetella, например B. pertussis; Treponema, например T. palladium; и тому подобные); (2) ферменты (и другие белки), включая без ограничения, ферменты, используемые в качестве индикаторов или средства лечения заболевания сердца, включая креатинкиназу, лактатдегидрогеназу, аспартатаминотрансферазу, тропонин T, миоглобин, фибриноген, холестерин, триглицериды, тромбин, тканевой активатор плазминогена (tPA); индикаторы заболевания поджелудочной железы, включая амилазу, липазу, химотрипсин и трипсин; ферменты и белки, являющиеся показателями функции печени, включая холинэстеразу, билирубин и щелочную фосфатазу; альдолазу, простатическую кислую фосфатазу, терминальную дезоксинуклеотидилтрансферазу, и бактериальные и вирусные ферменты, такие как протеаза ВИЧ; (3) гормоны и цитокины (многие из которых служат в качестве лигандов для клеточных рецепторов), такие как эритропоэтин (EPO), тромбопоэтин (TPO), интерлейкины (включая IL-1-IL-17), инсулин, инсулиноподобные факторы роста (включая IGF-1 и -2), эпидермальный фактор роста (EGF), трансформирующие факторы роста (включая TGF-α и TGF-β), гормон роста человека, трансферрин, эпидермальный фактор роста (EGF), липопротеид низкой плотности, липопротеид высокой плотности, лептин, VEGF, PDGF, цилиарный нейротрофический фактор, пролактин, адренокортикотропный гормон (ACTH), кальцитонин, хорионический гонадотропин человека, кортизол, эстрадиол, фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH), лютеинизирующий гормон (LH), прогестерон, тестостерон; и (4) другие белки (включая α-фетопротеин, карциноэмбриональный антиген CEA).
В некоторых вариантах белковый аналит является биомаркером заболевания, расстройства или состояния. Примеры биомаркеров включают без ограничения, например, PSA, BRCA1, BRCA1, Her2/neu, AFP (α-фетопротеин), B2M (β-2-микроглобулин), BTA (антиген опухоли мочевого пузыря), CA 15-3 (раковый антиген 15-3), CA 19-9 (раковый антиген 19-9), hCG (хорионический гонадотропин человека), CA 72-4 (раковый антиген 72-4), CA-125 (раковый антиген 125), кальцитонин, CEA (карциноэмбриональный антиген), EGFR (Her-1), рецепторы эстрогена, рецепторы прогестерона, моноклональные иммуноглобулины, NSE (нейрон-специфичную енолазу), NMP22, тиреоглобулин, моноклональные иммуноглобулины, NSE (нейрон-специфичную енолазу), рецепторы прогестерона, PSA (специфический антиген предстательной железы), общий и свободный, простатический специфический мембранный антиген (PSMA), простатическую кислую фосфатазу (PAP), S-100 и TA-90, или их часть или вариант или фрагмент. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В других случаях биомаркер является биомаркером бактериальных инфекций. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
VI. Образцы
Образцы для систем и способов детекции, описанных в настоящей публикации, могут представлять собой любой материал, предположительно содержащий аналит. В некоторых вариантах образец может представлять собой любой источник биологического материала, который содержит белки, который может быть получен из живого организма прямо или опосредованно, включая клетки, ткань или жидкость, и отложения, оставляемые таким организмом, включая вирусы, микоплазму и органические остатки. Обычно образец получают в виде водной среды или диспергированным в преимущественно водной среде. Неограничивающие примеры образца включают кровь, мочу, сперму, молоко, слюну, слизь, буккальный мазок, вагинальный мазок, ректальный мазок, аспират, пункционную биопсию, срез ткани, полученный, например, при хирургической операции или аутопсии, плазму, сыворотку, спинномозговую жидкость, лимфу, продукты экзокринной секреции кожи, дыхательных путей, кишечника и мочеполового тракта, слезы, слюну, опухоли, органы, образцы компонентов культуры клеток in vitro (включая без ограничения кондиционированную среду, полученную в результате роста клеток в среде для культивирования клеток, предположительно инфицированные вирусом клетки, рекомбинантные клетки и клеточные компоненты), и рекомбинантную библиотеку, содержащую белки, пептиды и тому подобное.
Образец может представлять собой положительный контрольный образец, который, как известно, содержит аналит-мишень. Также можно использовать отрицательный контрольный образец, который, как ожидается, хотя и не содержит аналита, предположительно может содержать его (из-за примеси одного или нескольких реагентов) или содержать другой компонент, способный давать ложноположительный результат, и такой образец тестируют, чтобы подтвердить отсутствие примеси аналита-мишени в реагентах, используемых в данном анализе, а также определить, не дает ли данный набор условий анализа ложноположительные результаты (позитивный сигнал даже в отсутствие аналита-мишени в образце).
Образец может быть разбавлен, растворен, суспендирован, экстрагирован или иным образом обработан для солюбилизации и/или очистки любого присутствующего аналита-мишени или для того, чтобы сделать его доступным для реагентов, которые используют в схеме амплификации, или для реагентов при детекции. Когда образец содержит клетки, клетки могут быть лизированы или пермеабилизованы для высвобождения полинуклеотидов из клеток. Можно использовать буферы для одностадийной пермеабилизации, чтобы лизировать клетки, что даст возможность осуществлять дальнейшие стадии сразу после лизиса, например, полимеразную цепную реакцию.
VII. Устройства для применения, трехэлектродные системы, способы сканирования
Перенос электронов обычно инициируют электронно, прилагая, по меньшей мере, первый электрический потенциал к системе, содержащей электрод и редокс-репортер. Точный контроль и варьирование прилагаемого потенциала можно осуществлять, используя потенциостат и либо систему, содержащую три электрода (один эталонный, один для образца (или рабочий) и один противоэлектрод), либо систему, содержащую два электрода (один для образца и один противоэлектрод). В некоторых вариантах потенциостат с системой, содержащей три электрода, используют с эталонным Ag/AgCl-электродом и вспомогательным электродом из платиновой проволоки. Электрические сигналы можно измерять, используя либо циклическую вольтамперометрию, либо дифференциальную импульсную вольтамперометрию. В некоторых случаях электрические сигналы измеряют, используя циклическую вольтамперометрию со скоростью сканирования примерно 50 мВ/сек, примерно 80 мВ/сек, примерно 100 мВ/сек, примерно 120 мВ/сек или примерно 150 мВ/сек. В других случаях электрические сигналы измеряют, используя дифференциальную импульсную вольтамперометрию с шагом потенциала примерно 1-5 мВ или примерно 2-10 мВ, амплитудой импульса примерно 25-50 мВ или примерно 40-75 мВ, импульсом примерно 25-50 мсек или примерно 40-75 мсек и периодом импульсов примерно 10-100 мсек или примерно 25-150 мсек или примерно 50-200 мсек.
В других случаях можно использовать другие способы детекции электрохимических потенциалов, включая без ограничения потенциометрические, амперометрические способы, импульсную вольтамперометрию, циклическую вольтамперометрию, способы на основе широкополосного частотного отклика, импедансные или другие электрохимические способы для преобразования выходных сигналов от электрохимически модифицированных электродов в системах и способах, описанных в настоящей публикации.
VIII. Наборы
Также предлагаются наборы, содержащие компоненты для описанных систем и для осуществления описанных способов. В некоторых вариантах набор содержит один или несколько из следующих компонентов, включая электрод, реагенты для образования линкера на поверхности электрода, одно или несколько антител и редокс-репортер. Компоненты набора могут храниться в футляре. Инструкции по применению набора для осуществления описанного способа могут прилагаться в футляре и могут быть представлены в любой фиксированной среде. Инструкции могут находиться в футляре или вне футляра и могут быть отпечатаны на внутренней или внешней поверхности футляра, что делает инструкции удобочитаемыми. Набор может быть в мультиплексной форме для детекции одного или нескольких разных аналитов-мишеней.
Примеры
Пример 1: Получение электродов и линкеров
Чипы очищали обработкой ультразвуком в ацетоне в течение 5 минут, промывали изопропиловым спиртом и деионизованной водой в течение 30 секунд и сушили в потоке воздуха. Электроосаждение осуществляют при комнатной температуре; выемки размером 5 мкм на изготовленных электродах используют в качестве рабочих электродов и подвергают контакту с использованием экспонированных контактных площадок. Сенсоры из золота (Au) изготавливают, используя раствор для осаждения, содержащий 20 мМ раствор HAuCl4 и 0,5 М HCl. Au-сенсоры формируют, используя постояннотоковую вольтамперометрию примерно при 0-250 мВ в течение примерно 100-300 секунд. Альтернативно Au-структуры также могут быть образованы с использованием хронопотенциометрии, например, примерно при 15-40 нА в течение примерно 25-60 секунд.
Пример 2: Связывание антител с линкерами
Водный раствор, содержащий 1-50 мМ 4-аминотиофенола или меркаптопропионовой кислоты, наносят на 10-20 часов при комнатной температуре на Au-сенсоры. Затем сенсоры промывают деионизованной водой 2-3 раза по 2-4 минуты. Обработанным сенсорам дают возможность взаимодействовать при комнатной температуре с 1,5-3,0% глутаральдегидом в воде в течение 1 часа с последующей промывкой деионизованной водой 2-3 раза по 2-4 минуты. Функционализированные сенсоры затем подвергают взаимодействию с PBS, содержащим 5-25 мкг/мл антитела, при комнатной температуре в течение 1-2 часов. Сенсоры промывают PBS 2-3 раза по 3-6 минут. Не вступившие в реакцию альдегидные группы блокируют PBS, содержащим 1% (масс./об.) бычьего сывороточного альбумина (БСА), в течение 1-2 часов при комнатной температуре. Затем сенсоры промывают 3-4 раза в PBS в течение 4-7 минут.
Пример 3: Детекция биомаркера злокачественной опухоли CA-125
Разработка платформ для чувствительного и простого измерения уровней белков в клинических образцах является важной целью, которая будет способствовать более широкому применению белковых биомаркеров в диагностике заболеваний. Чтобы дать полезную информацию, схемы детекции должны иметь высокие уровни специфичности, низкие пределы обнаружения и высокую эффективность в случае биологических жидкостей, подобных крови и сыворотке. С учетом проявления признаков множества белков в случае злокачественной опухоли и других заболеваний мультиплексирование также является важной характеристикой. При включении внутренних и внешних контролей и калибровочных маркеров также требуется мультиплексирование.
CA-125 является эпителиальным антигеном, который использовали в качестве маркера для выявления рака яичника. Было разработано несколько анализов для выявления CA-125, но большинство из них не были идеальными либо вследствие отсутствия чувствительности, либо вследствие сложности способа детекции. Коммерчески доступный иммуноанализ CA-125 имеет предел обнаружения 15 единиц/мл, что достаточно для выявления уровней CA-125, которые коррелируют с наличием заболевания (35 единиц/мл), но не позволяет точно исследовать значимость существенно более низких уровней.
Система детекции белков, раскрытая в настоящем описании, была адаптирована для электрохимического обнаружения биомаркера злокачественной опухоли CA-125, обычно присутствующего в злокачественных опухолях яичника, посредством конструирования микроэлектродного сенсора на чипе. Сенсорные чипы позволяют осуществлять сравнение электродных сенсоров разного размера, а также определение имеющегося предела обнаружения вплоть до 0,1 единицы/мл. Регистрацию данных осуществляли в одну стадию, которая включала в себя введение нековалентно связываемой группы редокс-репортера. Описанная система детекции была специфичной в случае анализа CA-125 в сыворотке человека. Мультиплексирование системы позволяло осуществлять анализ биомаркера параллельно с анализом широко представленного в сыворотке белка, сывороточного альбумина человека (HSA), для внутренней калибровки.
Материалы. CA-125 антиген и сыворотку человека от AB-доноров, антитело против сывороточного альбумина человека (HSA), раствор HAuCl4, феррицианид калия (K3[Fe(CN)6]), тригидрат ферроцианида калия (K2[Fe(CN)6⋅3H2O), 50% (масс./масс.) глутаральдегид и цистамин приобретали из Sigma-Aldrich. Анти-CA-125-антитело получали из KalGene Pharmaceuticals Inc., Canada. Ацетон степени чистоты, соответствующей стандарту ACS, и изопропиловый спирт (IPA) получали из EMD (USA); 6 N хлористоводородную кислоту приобретали из VWR (USA). Фосфатно-солевой буфер (PBS, pH 7,4, 1X) получали из Invitrogen. Цельную кровь человека получали из Bioreclaimation (Westbury, NY).
Изготовление чипа и электрода: чипы изготавливали в Canadian Photonics Fabrication Center. Вкратце, пластины из оксида кремния размером три дюйма (7,5 см) пассивировали, используя тонкий слой термически выращенного диоксида кремния. Слой золота толщиной 350 нм осаждали на чип, используя выпаривание золота под действием электронного пучка. На пленку золота наносят рисунок с использованием стандартной фотолитографии и взрывной литографии. Слой изолирующего диоксида кремния толщиной 500 нм осаждают, используя химическое осаждение из паровой фазы; выемки размером 5 мкм отпечатывают на электродах, используя стандартную фотолитографию, и экспонируют контактные площадки размером 2 мм × 2 мм, используя стандартную фотолитографию. На фиг.1a изображена фотография примерного сенсорного чипа (слева) и типичные слои (справа).
Чипы очищали обработкой ультразвуком в ацетоне в течение 5 минут, промывали изопропиловым спиртом и деионизованной водой в течение 30 секунд и сушили в потоке воздуха. Электроосаждение осуществляли при комнатной температуре; выемки размером 5 мкм на изготовленных электродных сенсорах использовали в качестве рабочего электрода и подвергали контакту, используя экспонированные контактные площадки. Получали три разных сенсора на основе золотых электродов, используя раствор для осаждения, содержащий 20 мМ раствор HAuCl4 и 0,5 М HCl, применяя способ, подобный способу, который описан в международной заявке с регистрационным № PCT/CA2009/001212 (опубликованной с номером WO 2010/025547).
Структуры золотых электродов размером 100 микрон и 30 микрон получали, используя постояннотоковую вольтамперометрию при 0 мВ в течение 200 секунд и 150 мВ в течение 200 секунд соответственно; и структуры золотых электродов размером 8 микрон получали, используя хронопотенциометрию при 30 нА в течение 50 секунд. На фиг.2a, 2c и 2e представлены СЭМ-изображения структур золотых электродов размером 100 микрон, 30 микрон и 8 микрон соответственно.
Определение площади поверхности сенсоров. Площадь поверхности Au-сенсоров вычисляли, интегрируя площадь пика восстановления оксида Au, полученного на циклической вольтаммограмме в 50 мМ H2SO4. При прямом сканировании образуется монослой хемосорбированного кислорода, и затем он восстанавливается при обратном сканировании. Экспериментально определили заряд восстановления в расчете на единицу микроскопической площади, составляющий 500 мкКл/см2. Площадь поверхности вычисляли посредством интегрирования пика восстановления (приблизительно 0,812 В - Ag/AgCl) с получением заряда восстановления и посредством деления полученного результата на 500 см2.
Модификация электродов антителом: водный раствор, содержащий 10 мМ цистамин, наносили на 16 часов при комнатной температуре на сенсоры на основе золотых электродов, чтобы образовался однородный линкер на поверхности электродов. Затем электроды промывали деионизованной водой два раза по 2 минуты. Линкеру давали возможность взаимодействовать при комнатной температуре с 2,5% глутаральдегидом в воде в течение 1 часа с последующей промывкой деионизованной водой в течение 2 минут. Затем функционализированные электроды подвергали взаимодействию с PBS, содержащим 10 мкг/мл анти-CA-125-антитела или антитела против сывороточного альбумина человека (HSA) при комнатной температуре в течение 1 часа. Электроды промывали PBS два раза в течение 5 минут. Не вступившие в реакцию альдегидные группы блокировали PBS, содержащим 1% (масс./об.) бычьего сывороточного альбумина (БСА). Затем электроды промывали три раза в PBS в течение 5 минут. Растворы, содержащие разные концентрации CA-125 в PBS или сыворотке, наносили на модифицированный антителом электрод на 40 минут при 37°C. Электроды промывали PBS перед регистрацией электрохимических данных.
Электрохимический анализ и сканирующая электронная микроскопия (СЭМ): Электрохимические эксперименты осуществляли, используя потенциостат Bioanalytical Systems Epsilon и трехэлектродную систему, отличительной особенностью которой является эталонный электрод Ag/AgCl и вспомогательный электрод из платиновой проволоки. Электрохимические сигналы измеряли в 10 мМ растворе фосфатного буфера (pH 7), содержащем 2,5 мМ K3[Fe(CN)6], 2,5 мМ K2[Fe(CN)6] и 0,1 М KCl. Циклическую вольтамперометрию (CV) осуществляли, используя скорость сканирования 100 мВ/сек и сигналы дифференциальной импульсной вольтамперометрии (DPV) получали с использованием шага потенциала 5 мВ, амплитуды импульса 50 мВ, импульса 50 мсек и периода импульса 100 мсек. Изменения сигнала, соответствующие связыванию белка-мишени с антителом, вычисляли следующим образом: ΔI%={(средний I0)-(средний Ic)}/средний I0 Ч 100 (где средний I0 = средний ток при нулевой концентрации мишени, средний Ic = средний ток при любой концентрации мишени). СЭМ-изображения получали, используя СЭМ Hitachi S-3400.
Изготавливали три разных структуры на чипах с использованием разных электрохимических способов и условий. Сенсоры размером 100 микрон (фигура 2a), 30 микрон (фигура 2c) и 8 микрон (фигура 2e) создавали, варьируя условия электроосаждения. Площади поверхности сенсоров измеряли посредством сканирования в серной кислоте и измерения количества образованного оксида и снятого с поверхности, и получили площади, составляющие приблизительно 4×10-6 см2 (8-микронный сенсор), 31×0-5 см2 (30-микронный сенсор) и 1×10-4 см2 (100-микронный сенсор). Емкостные токи, измеряемые в буферном растворе (фигура 2g), соответствовали таким значениям. Перед тестированием сенсоров в отношении детекции белков получали циклические вольтаммограммы для каждой структуры в растворе, содержащем ферроцианид и феррицианид (фиг.2b, 2d и 2f). В случае 100-микронного сенсора наблюдали диффузионно-ограниченные токи и в случае 8- и 30-микронных сенсоров наблюдали токи в виде плато, что согласуется с токами, ожидаемыми для микроэлектродов.
Пределы обнаружения для иммуносенсоров, образованных на трех сенсорах разного размера, оценивали с использованием измерения дифференциальных импульсных вольтаммограмм (DPV) растворов [Fe(CN)6]3-/4- до и после инкубации с CA-125 в течение 40 минут. В случае самых больших сенсоров (фигура 3a) требовались концентрации 10 единиц/мл для регистрируемых изменений сигнала. В случае сенсоров промежуточного размера 30 микрон предел обнаружения достигал 1 единицы/мл (фигура 3b). В случае сенсора наименьшего размера 8 микрон можно было выявлять 0,1 единицы/мл CA-125 (фигура 3c). 0,1 единицы/мл антигена CA-125 эквивалентны ~500 фМ CA-125 или 100 пг/мл.
Чтобы оценить иллюстративную систему регистрации с использованием биологических жидкостей, осуществляли детекцию образцов CA-125 в сыворотке человека. Сыворотка является очень сложной биологической жидкостью, содержащей большие количества белков и других молекул. Сывороточный альбумин человека (HSA) был выбран в качестве внутреннего стандарта в связи с постоянными и высокими концентрациями HSA в сыворотке человека. На мультиплексном сенсорном чипе получали иммуносенсоры для CA-125 и HSA за счет образования слоя анти-CA-125-антитела и анти-HSA-антитела соответственно (фигура 1a). Сыворотку человека, в которую вносили разные концентрации CA-125, наносили на мульплексный иммуносенсор и регистрировали DPV в смешанном растворе ферроцианида и феррицианида. На фиг.5a показаны значения ΔI% (по отношению к сыворотке с 0 единиц/мл CA-125), полученные для сыворотки человека, в которую вносили разные концентрации CA-125. ΔI% в случае сенсоров, модифицированных анти-CA-125-антителом, возрастала с увеличением концентраций CA-125, тогда как значение ΔI% для HSA было по существу постоянным в случае иммуносенсоров, модифицированных анти-HSA-антителом. Детекция CA-125 параллельно с сывороточным белком является удобным способом получения абсолютных измерений биомаркера злокачественной опухоли.
Эффективность такой сенсорной системы также исследовали на цельной необработанной крови. В образцы крови вносили CA-125 и анализ осуществляли таким же образом, как в исследованиях сыворотки и буфера. Интересно, что получили такой же предел обнаружения, при этом 0,1 ед./мл отчетливо выявляли по сравнению с фоновыми уровнями, как показано на фиг.5b. Такой уровень чувствительности, достигаемый с использованием необработанного образца крови, показывает, что такой простой, не вызывающий трудностей анализ на основе электрохимической детекции белков также является удивительно надежным.
В следующей таблице показан приблизительный предел обнаружения CA-125 для электродов разного размера:
ССЫЛКИ
Rosi, N. L.; Mirkin, C. A. Chem. Rev. 2005, 105, 1547-1562.
Acharya, G.; Chang, C.-L.; Doomeweerd, D. D.; Vlashi, E.; Henne, W. A.; Hartmann, L. C; Low, P. S.; Savran, C. A. J. Am. Chem. Soc. 2007, 129, 15824-15829.
Nam, J.-M.; Thaxton, C. S.; Mirkin, C. A. Science 2003, 301, 1884-1886.
Das, J.; Aziz, M. A.; Yang, H. J. Am. Chem. Soc. 2006, 128, 16022-16023.
Ho, J.-a. A.; Chang, H.-C; Shih, N.-Y.; Wu, L.-C; Chang, Y.-F.; Chen, C.-C; Chou, C. Anal. Chem. 2010, 82, 5944-5950.
Fang, Z.; Kelley, S. O. Anal. Chem. 2009, 81, 612-617.
Pampalakis, G.; Kelley, S. O. Analyst 2009, 134, 447-449.
Roberts, M. A.; Kelley, S. O. J. Am. Chem. Soc. 2007, 129, 11356-11357.
Gasparac, R.; Taft, B. J.; Lapierre-Devlin, M. A.; Lazareck, A. D.; Xu, J. M.; Kelley, S. O. J. Am. Chem. Soc. 2004, 126, 12270-12271.
Lapierre-Devlin, M. A.; Asher, C. L.; Taft, B. J.; Gasparac, R.; Roberts, M. A.; Kelley, S. O. Nano. Lett. 2005, 5, 1051-1055.
Stoeva, S. I.; Lee, J.-S.; Smith, J. E.; Rosen, S. T.; Mirkin, C. A. J. Am. Chem. Soc. 2006, 128, 8378-8379.
Mcalpine, M. C; Ahmad, H.; Wang, D.; Heath, J. R. Nat. Mat. 2007, 6, 379-384.
Gao, X. P. A.; Zheng, G.; Lieber, C. M. Nano Lett. 2010, 10, 547-552.
Rissin, D. M.; Kan, C. W.; Campbell, T. G.; Howes, S. C; Fournier, D. R.; Song, L.; Piech, T.; Patel, P. P.; Chang, L.; Rivnak, A. J.; Ferrell, E. P.; Randall, J. D.; Provuncher, G. K; Walt, D. R.; Duffy, D. C. Nat. Biotech. 2010, 28, 595-600.
Rusling, J. F.; Sotzing, G.; Papadimitrakopoulos, F. Bioelectrochemistry 2009, 76, 189-194.
Gunawardana, C. G.; Kuk, C; Smith, C. R.; Batruch, I.; Soosaipillai, A.; Diamandis, E. P. J. Proteome. Res. 2009, 8, 4705-4713.
Sok, D.; Clarizia, L.-J. A.; Farris, L. R.; McDonald, M. J. Anal. Bioanal. Chem. 2009, 393, 1521-1523.
Kamp, G. J. V.; Verstraeten, A. A.; Kenemans, P. Eur. J. Obstet. Gynecol. Reprod. Biol. 1993, 49, 99-103.
Tang, D.; Yuan, R.; Chai, Y. Anal. Chim. Acta 2006, 564, 158-165.
He, Z.; Gao, N.; Jin, W. Anal. Chim. Acta 2003, 497, 75-81.
Mongia, S. K; Rawlins, M. L; Owen, W. E.; Roberts, W. L. Am. J. Clin. Pathol. 2006, 125, 921-927.
Mouffouk, F.; Chishti, Y.; Jin, Q.; Rosa, M. E.; Rivera, M; Dasa, S.; Chen, L. Anal. Biochem. 2008, 372, 140-147.
Chen, S.; Yuan, R.; Chai, Y.; Xu, Y.; Min, L; Li, Na. Sens. Actuators B 2008, 135, 236-244.
Wang, J.; Ren, J. Electrophoresis 2005, 26, 2402-2408.
Fu, X.-H. Electroanalysis 2007, 19, 1831-1839.
Tang, D.; Su, B.; Tang, J.; Ren, J.; Chen, G. Anal. Chem. 2010, 82, 1527-1534.
Wu, J.; Yan, Y.; Yan, F.; Xu, H. Anal. Chem. 2008, 80, 6072-6077.
Liu, FL; Fu, Z.; Yang, Z.; Yan, F.; Xu, H. Anal. Chem. 2008, 80, 5654-5659.
Soleymani, L.; Fang, Z.; Sargent, E. H.; Kelley, S. O. Nat. Nanotech. 2009, 4, 844-848.
Soleymani, L.; Fang, Z.; Sun, X.; Yang, H.; Taft, B. J.; Sargent, E. H.; Kelley, S. O. Angew. Chem. Int. Ed. 2009, 48, 8457-8460.
Yang, H.; Hui, A.; Pampalakis, G.; Soleymani, L.; Liu, F.-F.; Sargent, E. H.; Kelley, S. O. Angew. Chem. Int. Ed. 2009, 48, 8461-8464.
Fang, Z.; Soleymani, L.; Pampalakis, G.; Yoshimoto, M.; Squire, J. A.; Sargent, E. H.; Kelley, S. O. Acs Nano 2009, 3, 3207-3213.
Rand, D. A. J.; Woods, R. J. Electroanal. Chem. 1971, 31, 29.
Хотя в настоящей публикации показаны и описаны предпочтительные варианты осуществления настоящего изобретения, для специалистов в данной области будет очевидно, что такие варианты осуществления представлены только в качестве примера. Специалисты в данной области могут осуществить многочисленные варианты, изменения и замены, не выходя за рамки объема изобретения. Следует понимать, что различные альтернативы вариантам осуществления изобретения, описанным в настоящей публикации, могут быть использованы при практическом осуществлении изобретения. Подразумевается, что следующая далее формула изобретения определяет объем изобретения, и что способы и структуры входят в объем приведенной формулы изобретения, и при этом формула охватывает их эквиваленты.
Группа изобретений относится к медицине и касается системы детекции для электрохимического выявления белкового аналита, включающей наноструктурированный микроэлектрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер, способный к переносу электронов с указанным наноструктурированным микроэлектродом, где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом. Группа изобретений также касается способа электрохимической детекции белкового аналита; способа электрохимической детекции множества белковых аналитов; способа мониторинга прогрессирования или ответа у субъекта, имеющего злокачественную опухоль; набора для электрохимической детекции белкового аналита. Группа изобретений обеспечивает создание простого и надежного анализа белков на основе электрохимической детекции. 5 н. и 65 з.п. ф-лы, 3 пр., 5 ил., 1 табл.
1. Система детекции для электрохимического выявления белкового аналита, включающая: наноструктурированный микроэлектрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер, способный к переносу электронов с указанным наноструктурированным микроэлектродом, где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом.
2. Система по п. 1, в которой линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом.
3. Система по п. 1, в которой линкер содержит функциональную аминогруппу.
4. Система по п. 1, в которой линкер содержит функциональную группу карбоновой кислоты.
5. Система по п. 1, в которой линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол.
6. Система по п. 1, в которой линкер присоединен к антителу или его фрагменту через второй линкер.
7. Система по п. 6, в которой второй линкер представляет собой глутаральдегид или формальдегид.
8. Система по п. 1, в которой линкер связан с множественными копиями антитела или его фрагмента.
9. Система по п. 1, в которой антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
10. Система по п. 1, в которой редокс-репортер способен генерировать электрохимический сигнал с электродом в случае приложения потенциала.
11. Система по п. 1, в которой редокс-репортер генерирует фарадеевский ток.
12. Система по п. 1, в которой редокс-репортер способен к переносу электронов через границу раздела.
13. Система по п. 1, в которой редокс-репортер представляет собой феррицианид/ферроцианид или ферроцен.
14. Система по п. 1, в которой редокс-репортер представляет собой гексахлориридат(IV)/гексахлориридат(III).
15. Система по п. 1, в которой наноструктурированный микроэлектрод изготовлен из благородного металла.
16. Система по п. 1, в которой наноструктурированный микроэлектрод является угольным.
17. Система по п. 1, в которой наноструктурированный микроэлектрод изготовлен из оксида индия и олова.
18. Система по п. 1, в которой наноструктурированный микроэлектрод изготовлен из золота, палладия или платины.
19. Система по п. 1, в которой наноструктурированный микроэлектрод имеет размер меньше чем примерно 150 микрон.
20. Система по п. 1, в которой наноструктурированный микроэлектрод имеет размер примерно от 5 до примерно 50 микрон.
21. Система по п. 1, в которой наноструктурированный микроэлектрод имеет размер меньше чем примерно 10 микрон.
22. Система по п. 1, в которой наноструктурированный микроэлектрод находится на чипе, изготовленном микротехнологическими способами.
23. Система по п. 1, в которой белковый аналит представляет собой биомаркер заболевания, расстройства или состояния.
24. Система по п. 23, в которой биомаркер представляет собой биомаркер злокачественной опухоли.
25. Система по п. 23, в которой биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (СА-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и ТА-90 или их части, варианта или фрагмента.
26. Система по п. 23, в которой биомаркер представляет собой биомаркер инфекции, вызванной бактериями Staphylococcus или Streptococcus.
27. Способ электрохимической детекции белкового аналита, включающий:
приведение первого наноструктурированного микроэлектрода, содержащего линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит, в контакт с образцом и редокс-репортером, способными к переносу электронов с указанным наноструктурированным микроэлектродом, где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом;
измерение первого электрохимического сигнала, генерируемого первым меченным антителом наноструктурированным микроэлектродом и редокс-репортером в случае приложения потенциала; и
сравнение первого электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита;
где изменение выявляемого первого электрохимического сигнала относительно первого сигнала контрольного образца, не содержащего белкового аналита, является показателем присутствия первого белкового аналита в образце.
28. Способ по п. 27, в котором линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом.
29. Способ по п. 27, в котором линкер содержит функциональную аминогруппу.
30. Способ по п. 27, в котором линкер содержит функциональную группу карбоновой кислоты.
31. Способ по п. 27, в котором линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол.
32. Способ по п. 27, в котором линкер присоединен к антителу или его фрагменту через второй линкер.
33. Способ по п. 32, в котором второй линкер представляет собой глутаральдегид или формальдегид.
34. Способ по п. 27, в котором наноструктурированный микроэлектрод является меченным множеством копий антитела или его фрагмента.
35. Способ по п. 27, в котором антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
36. Способ по п. 27, в котором редокс-репортер генерирует фарадеевский ток.
37. Способ по п. 27, в котором редокс-репортер способен к переносу электронов через границу раздела.
38. Способ по п. 27, в котором редокс-репортер представляет собой феррицианид/ферроцианид или ферроцен.
39. Способ по п. 27, в котором редокс-репортер представляет собой гексахлориридат(IV)/гексахлориридат(III).
40. Способ по п. 27, в котором наноструктурированный микроэлектрод изготовлен из благородного металла.
41. Способ по п. 27, в котором наноструктурированный микроэлектрод является угольным.
42. Способ по п. 27, в котором наноструктурированный микроэлектрод изготовлен из оксида индия и олова.
43. Способ по п. 27, в котором наноструктурированный микроэлектрод изготовлен из золота, палладия или платины.
44. Способ по п. 27, в котором наноструктурированный микроэлектрод имеет размер меньше чем примерно 100 микрон.
45. Способ по п. 27, в котором наноструктурированный микроэлектрод имеет размер примерно от 5 до примерно 50 микрон.
46. Способ по п. 27, в котором наноструктурированный микроэлектрод имеет размер меньше чем примерно 10 микрон.
47. Способ по п. 27, в котором наноструктурированный микроэлектрод находится на чипе, изготовленном микротехнологическими способами.
48. Способ по п. 27, в котором белковый аналит представляет собой биомаркер заболевания, расстройства или состояния.
49. Способ по п. 48, в котором биомаркер представляет собой биомаркер злокачественной опухоли.
50. Способ по п. 48, в котором биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (СА-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и ТА-90 или их части, варианта или фрагмента.
51. Способ по п. 48, в котором биомаркер представляет собой биомаркер инфекции, вызванной бактериями Staphylococcus или Streptococcus.
52. Способ по п. 27, в котором стадию измерения осуществляют, используя вольтамперометрию.
53. Способ по п. 52, в котором вольтамперометрия представляет собой циклическую вольтамперометрию или дифференциальную импульсную вольтамперометрию.
54. Способ по п. 27, в котором указанное изменение включает понижение величины сигнала выявляемого первого электрохимического сигнала относительно первого сигнала контрольного образца.
55. Способ электрохимической детекции множества белковых аналитов, включающий:
приведение первого наноструктурированного микроэлектрода, содержащего линкер на своей поверхности, где линкер присоединен к первому антителу или его фрагменту, способным связывать белковый аналит, в контакт с образцом и редокс-репортером, способными к переносу электронов с указанным наноструктурированным микроэлектродом, где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом;
измерение первого электрохимического сигнала, генерируемого первым меченным антителом наноструктурированным микроэлектродом и редокс-репортером в случае приложения потенциала;
сравнение первого электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита;
где изменение первого электрохимического сигнала, выявляемое относительно соответствующего сигнала контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
56. Способ по п. 55, в котором линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом.
57. Способ по п. 55, в котором наноструктурированный микроэлектрод является меченным множеством копий антитела или его фрагмента.
58. Способ по п. 55, в котором редокс-репортер способен к переносу электронов через границу раздела.
59. Способ по п. 55, в котором наноструктурированный микроэлектрод имеет размер меньше чем примерно 100 микрон.
60. Способ по п. 55, дополнительно включающий:
приведение второго наноструктурированного микроэлектрода, содержащего второй линкер на своей поверхности, в контакт с образцом и редокс-репортером, где указанный второй линкер присоединен ко второму антителу или его фрагменту, способным связывать второй белковый аналит;
измерение второго электрохимического сигнала, генерируемого вторым меченным антителом наноструктурированным микроэлектродом и редокс-репортером в случае приложения потенциала; и
сравнение второго электрохимического сигнала со вторым сигналом, генерируемым вторым меченным антителом наноструктурированным микроэлектродом в контрольном образце, не содержащем белкового аналита;
где изменение второго электрохимического сигнала, выявляемое относительно второго сигнала контрольного образца, не содержащего белкового аналита, является показателем присутствия второго белкового аналита в образце.
61. Способ по п. 55, в котором и первый, и второй наноструктурированные микроэлектроды находятся на чипе, изготовленном микротехнологическими способами.
62. Способ по п. 55, в котором и первый, и второй наноструктурированные микроэлектроды находятся на разных чипах, изготовленных микротехнологическими способами.
63. Способ по п. 55, в котором второй меченный антителом наноструктурированный микроэлектрод является эталонным контролем для первого меченного антителом наноструктурированного микроэлектрода.
64. Способ по п. 55, в котором второй меченный антителом наноструктурированный микроэлектрод выявляет широко распространенный в сыворотке белок.
65. Способ мониторинга прогрессирования или ответа у субъекта, имеющего злокачественную опухоль, включающий:
получение биологического образца от субъекта;
приведение наноструктурированного микроэлектрода, содержащего линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать указанный белковый аналит, в контакт с образцом и редокс-репортером, способными к переносу электронов с указанным наноструктурированным микроэлектродом, где антитело или его фрагмент связываются с белковым аналитом, и где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом;
измерение электрохимического сигнала, генерируемого меченным антителом наноструктурированным микроэлектродом и редокс-репортером в случае приложения потенциала; сравнение электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита;
где изменение сигнала, выявляемое относительно сигнала контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце;
и
оценку прогрессирования или ответа на основании изменения сигнала.
66. Способ по п. 65, в котором белковый аналит представляет собой биомаркер злокачественной опухоли.
67. Способ по п. 65, в котором белковый аналит представляет собой биомаркер, выбранный из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (СА-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и ТА-90 или их части, варианта или фрагмента.
68. Способ по п. 65, в котором указанное изменение включает понижение величины сигнала выявляемого первого электрохимического сигнала относительно первого сигнала контрольного образца.
69. Способ по п. 65, в котором наноструктурированный микроэлектрод имеет размер меньше чем примерно 100 микрон.
70. Набор для электрохимической детекции белкового аналита, включающий:
наноструктурированный микроэлектрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и
редокс-репортер, способный к переносу электронов с указанным наноструктурированным микроэлектродом и генерированию электрохимического сигнала с указанным наноструктурированным микроэлектродом в случае приложения потенциала, и где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ESTEVA FJ., et al., Clinical utility of serum HER2/neu in monitoring and prediction of progression-free survival in metastatic breast cancer patients treated with trastuzumab-based therapies | |||
| Breast Cancer Res | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ZENG G., et al., Nanostructures and molecular force bases of a highly sensitive capacitive immunosensor | |||
| Proteomics | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2017-01-10—Публикация
2012-01-11—Подача