Изобретение относится к области медицины и предназначено для лечения фиброза печени лабораторных животных (мышей).
Фиброз печени, предшествует развитию цирроза и является результатом избыточного отложения белков внеклеточного матрикса. Одним из основных механизмов в развитии фиброза печени является активация перисинусоидаотных клеток печени Ито. Активация этих клеток приводит к трансформации их в миофибробласты. Образовавшиеся миофибробласты обладают высокой пролиферативной активностью, в них увеличивается экспрессия белка α- SMA (Alpha-smooth muscle actin), эти клетки также характеризуются повышенным синтезом коллагена.
Мультипотентные мезенхимальные стромальные клетки способны ингибировать развитие фиброза за счет снижения активности клеток иммунной системы (Т-лимфоцитов, В-лимфоцитов, дендритных клеток, NK -клеток), путем ингибирования образовавшихся из клеток печени Ито миофибробластов, а также вступая на путь трансдифференцировки в гепатоциты. (Young Woo Eom, Kwang Yong Shim, and Soon Koo Baik / Mesenchymal stem cell therapy for liver fibrosis // Korean Journal of Internal Med icine. - Vol 30. - 2015. - P. 580-589. DOI: https://doi.org/10.3904/kjim.2015.30.5.580).
Известен способ лечения фиброза печени лабораторных животных путем трансплантации 1×105 (17 доз; общая дозировка 17×105) клеток / мышь. (Akihiro Seki, Yoshio Sakai, Takuya Komura, Alessandro Nasti, Keiko Yoshida, Mami Higashimoto, Masao Honda, Soichiro Usui, Masayuki Takamura, Toshinari Takamura, Takahiro Ochiya, Kengo Furuichi, Takashi Wada, Shuichi Kaneko / Adipose tissue-derived stem cells as a regenerative therapy for a mouse steatohepatitis-induced cirrhosis model // Hepatology. - Vol. 58. - 2013. - P. 1133-1142. https://doi.org/10.1002/hep.26470)
Недостатком данного способа является их высокая концентрация, что может вызвать нарушения гемостаза (Ефименко А.Ю., Калинина Н.И., Макаревич П.И. Методические рекомендации по проведению доклинических исследований биомедицинских клеточных продуктов. - Москва, 2017. - С. 303.).
Наиболее близким техническим решением к заявляемому является способ лечения фиброза печени проведением аллогенной трансплантации ММСК, выделенных из костного мозга (Xianyao Wang, Huizhen Wang, Junhou Lu, Zhanhui Feng, Zhongshan Liu, Hailiang Song, Heng Wang, Yanhua Zhou, Jianwei Xu / Erythropoietin-Modified Mesenchymal Stem Cells Enhance Antifibrosis Efficacy in Mouse Liver Fibrosis Model // Tissue Eng Regen Med (2020) 17(5):683-693; DOI: 10.1007/s13770-020-00276-2). Клетки культивировали в модифицированной среде Eagle's с низким содержанием Dulbecco (L-DMEM, Gibco) с добавлением 10% FBS (Gibco) и пенициллин-стрептомицин (100 Ед/мл; Gibco). Для снятия клеток с культуральной поверхности использовали 0,25% раствор трипсин-ЭДТА. Для трансплантации использовали клетки 3-10 пассажа. Введение ММСК осуществлялось в хвостовую вену в количестве 1×106 клеток/мышь. Учитывая, что в прототипе вес животного 18-20 г, то количество введенных клеток составит 55,6-55×106 клеток/кг.
Недостатком данного способа является их высокая концентрация, что может вызвать нарушения гемостаза (Ефименко А.Ю., Калинина Н.И., Макаревич П.И. Методические рекомендации по проведению доклинических исследований биомедицинских клеточных продуктов. - Москва, 2017. - С. 303.).
Технический результат, который будет получен от использования изобретения, заключается в восстановлении содержания соединительной ткани в печени после фиброза путем проведения меньшего количества ММСК.
Технический результат достигается тем, что в способе лечения фиброза печени аллогенной трансплантацией мультипотентными мезенхимальными стромальными клетками (ММСК) лабораторных животных, путем их введения внутривенно, где клетки выделяют из хориона плаценты и вводят в печеночную артерию однократно в количестве 1 млн. клеток/кг.
Выделение клеток из хориона плаценты позволяет получить клетки неоперативным путем, которые характеризуются большим пролиферативным потенциалом и большей пролиферативной активностью, чем ММСК, выделенные из костного мозга.
Введение плацентарных ММСК в печеночную артерию обуславливает увеличение направленной миграции клеток в печень.
Введение плацентарных ММСК в количестве 1 млн. клеток/кг подобрано экспериментально-опытным путем и способствует регрессу фиброзных изменений в печени.
Учитывая способность ММСК к выработке фактора роста стволовой клетки (SCF), который через увеличение количества звездчатых клеток печени Ито, обеспечивает увеличение количества гепатоцитов, а также способность ММСК к выработке противовоспалительных цитокинов (ИЛ-10, трансформирующий фактор роста - β), представляется перспективным применение активации регенерации печени после ее повреждения с использованием данного вида клеток.
Изобретение осуществляется следующим образом.
Эксперименты выполнены на 20 зрелых лабораторных мышах в возрасте 6 месяцев. Животные содержались в стандартных условиях лабораторного вивария при естественном освещении и сбалансированном рационе.
Лабораторные животные были разделены на две группы: опытную и контрольную. Лабораторным животным опытной группы внутривенно вводились ММСК в дозе 1 млн. клеток/кг, суспендированные в 0,2 мл раствора PBS (Phosphate-buffered saline; рН 7,4). Животным контрольной подгруппы вводили 0,2 мл раствора PBS. Забой лабораторных животных осуществлялся через 8 недель после трансплантации клеток.
Культура ММСК.
С целью получения первичной культуры ММСК осуществлялся пассаж мононуклеарной фракции клеток, выделенной из ткани плаценты, в специализированной среде для культивирования ММСК в чашки Петри в концентрации 1×106 клеток на 1 см2. Культивирование ММСК проводилось в условиях СО2- инкубатора при температуре 37°С с содержанием углекислого газа 5% и влажностью 90%. Через 24-48 часов инкубации не прикрепленные к дну чашки Петри клетки аспирировали. Среду для культивирования ММСК добавляли к прикрепленным к пластику клеткам. Замена среды проводилась каждые 3-4 сутки до достижения клетками 70-80% конфлюэнтности. При формировании соответствующего монослоя осуществлялся пересев клеток.
При трансплантации лабораторным животным была использована культура ММСК третьего пассажа.
Иммуноцитохимия.
Для подтверждения принадлежности культуры к ММСК производилась окраска клеток с помощью набора антител
MesenchymalStemCellCharacterizationKit (Millipore, США), содержащего позитивные (антитела к integrin β1, CD 54, collagentypel и fibronectin) и негативные маркеры (антитела к CD 14, CD 45).
Производилась дифференцировка полученной культуры в адипоцитарном и остеогенном направлениях. Состав среды, индуцирующей дифференцировку:МезепСик™ Osteogenic Stimulatory Supplement («StemCell Technologies», Канада) / MesenCult™ Adipogenic Stimulatory Supplement («StemCell Technologies», Канада) и MesenCult™ MSC Basal Medium (Mouse) («StemCellT echnologies», Канада) в соотношении 1:4, 2 ммоль раствора L-глутамина («StemCell Technologies», Канада). Факт остеогенной дифференцировки подтвержден гистохимическим методом регистрации увеличения экспрессии щелочной фосфатазы, а также с помощью окраски vonKossa, выявляющей наличие минерализованного фосфата кальция. Способность клеток дифференцироваться в адипоцитарном направлении подтверждена гистохимическим методом регистрации липидных вакуолей, окрашивающихся красителем Oil RedO (J.J. Minguelletal., 2004).
Моделирование цирроза печени.
Фиброз печени моделировали путем внутрибрюшинного введения CCl4 в количестве 2 мкл/г веса животного в растворе оливкового масла (1:4). Инъекции проводили в течение пяти недель дважды в неделю. Через шесть недель после первого введения лабораторные животные были выведены из эксперимента. Трансплантация ММСК.
Трансплантацию плацентарных ММСК осуществляли в печеночную артерию в количестве 1×106 клеток / кг.
Подсчет и определение жизнеспособности клеток.
Жизнеспособность клеток была определена с помощью суправитальной окраски раствором трипанового синего. Подсчет клеток производился в 5 больших квадратах камеры Горяева (или ≥ 100 клеток). Жизнеспособность выделенных клеток перед трансплантацией составляла 95-97%.
Иммуногистохимическое окрашивание.
Для оценки α- SMA положительных клеток в гистологическом препарате использованы первичные антитела Recombinant Anti-alpha smooth muscle Actin antibody (разведение 1:1000; Abeam; инкубирование при +4°C, в течение ночи), вторичные антитела Goat Anti-Rabbit IgG H&L (HRP) (разведение 1:1000; Abeam; время инкубирования 1 час), DAB Substrate Kit (Abcam).
Количественный анализ области фиброза.
Количественый анализ содержания коллагена в печени проводили с использованием набора Picro Sirius Red Stain Kit (Abeam, UK). Было проанализировано 3 области площадью по 1 мм2 (×10 объектив микроскопа). Распространенность фиброза была выражена в процентах и определена как отношение окрашенной области к общей площади анализируемого препарата.
Итоговое значение выраженности в 3-х областях.
Исследования проведены с использованием микроскопа Axio Scope.А1 и камеры Axiocam 208 color (Zeiss). Для анализа микрофотографий использована морфометрическая программа SIAMS (ООО «Сиамс»).
Морфометрические исследования.
Для проведения количественной оценки степени развития фиброза проводили морфометрический анализ гистологических препаратов с использованием морфометрической программы SIAMS (Россия).
Достоверность отличий в сравниваемых выборках проведено с применением непараметрического (рангового) метода Манна-Уитни. Статистическая обработка данных проведена с помощью программного пакета SPSS Statistics (версия 17,0).
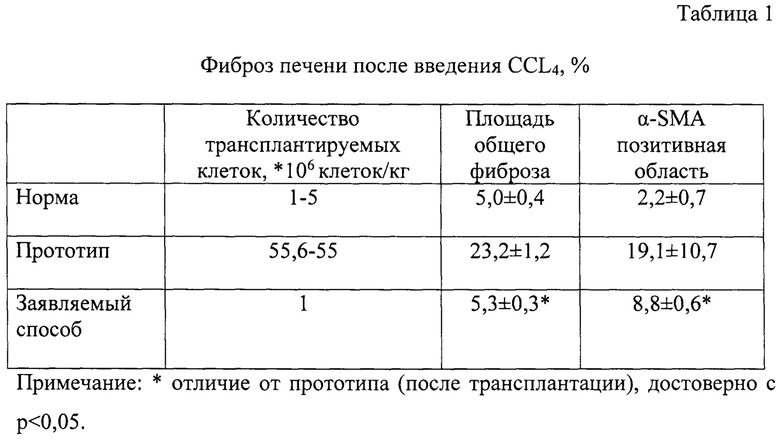
Как видно из таблицы №1, по заявляемому способу площадь общего фиброза и площадь фиброза в печени после трансплантации ММСК была существенно меньше, чем в прототипе. Также следует отметить, что область α-SMA положительных клеток, клеток ответственных за избыточное образование соединительной ткани, было достоверно меньше, чем в прототипе. Анализ полученных данных позволяет сделать вывод, что трансплантация плацентарных ММСК способствует регрессу фиброзных изменений в большей степени, чем введение эритропоэтин-модифицированных ММСК.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВОССТАНОВЛЕНИЯ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ С ТОКСИЧЕСКИМ ГЕПАТИТОМ | 2020 |
|
RU2739855C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ С ЦИРРОЗОМ ПЕЧЕНИ | 2019 |
|
RU2729931C1 |
| Способ активации эритропоэза лабораторных животных после лучевой нагрузки | 2017 |
|
RU2654228C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ЛИМФОИДНОЙ ТКАНИ СЕЛЕЗЕНКИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2016 |
|
RU2639404C1 |
| СПОСОБ АКТИВАЦИИ РЕГЕНЕРАЦИИ МИЕЛОИДНОЙ ТКАНИ СТАРЫХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2013 |
|
RU2523574C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ЭПИТЕЛИЯ ТОЩЕЙ КИШКИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ ПОСЛЕ ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ | 2009 |
|
RU2415476C2 |
| Способ коррекции печеночной недостаточности в эксперименте | 2017 |
|
RU2650209C1 |
| Применение суммарной рибонуклеиновой кислоты (РНК) из мультипотентных мезенхимальных стромальных клеток костного мозга млекопитающего в качестве средства для коррекции печеночной недостаточности | 2017 |
|
RU2655761C1 |
| СПОСОБ ПОВЫШЕНИЯ РЕГЕНЕРАТОРНОЙ АКТИВНОСТИ ЭПИТЕЛИЯ КИШЕЧНИКА КРЫС ПОСЛЕ ЛУЧЕВОЙ НАГРУЗКИ | 2013 |
|
RU2524804C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2017 |
|
RU2655528C1 |
Изобретение относится к области клеточной биологии и медицины и предназначено для лечения фиброза печени лабораторных животных. Для осуществления способа лечения фиброза печени аллогенной трансплантацией мультипотентными мезенхимальными стромальными клетками (ММСК) лабораторных животных внутривенно однократно вводят в печеночную артерию 1 млн клеток/кг, выделенных из хориона плаценты. Изобретение позволяет сократить площадь общего фиброза и площадь фиброза в печени, а также способствует восстановлению соединительной ткани в печени после фиброза. 1 табл.
Способ лечения фиброза печени аллогенной трансплантацией мультипотентными мезенхимальными стромальными клетками (ММСК) лабораторных животных, путем их введения внутривенно, отличающийся тем, что клетки выделяют из хориона плаценты и вводят в печеночную артерию однократно в количестве 1 млн клеток/кг.
| СПОСОБ ВОССТАНОВЛЕНИЯ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ С ЦИРРОЗОМ ПЕЧЕНИ | 2019 |
|
RU2729931C1 |
| МАКЛАКОВА И.Ю | |||
| и др | |||
| Влияние сочетанной трансплантации мультипотентных мезенхимальных стромальных клеток и звездчатых клеток печени на ее морфофункциональное состояние после частичной гепатэктомии / Уральский медицинский журнал, 2021, т | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| МАКЛАКОВА И.Ю | |||
| и др | |||
| Изучение хоуминга ММСК после резекции | |||
Авторы
Даты
2023-08-30—Публикация
2022-11-07—Подача