Изобретение относится к биотехнологии, в частности к получению биологически активных веществ и может быть использовано для получения природных фитотоксических соединений: гербарумина I и стагонолида А.
Многие фитопатогенные грибы способны образовывать фитотоксические соединения, которые являются факторами их вирулентности. Фитотоксины, которые обладают минимальным эффектом в отношении нецелевых организмов (теплокровных, насекомых, микроорганизмов и проч.), могут рассматриваться как природные гербициды или прототипы синтетических гербицидов (Берестецкий, 2008 [1], 2017 [2]).
Среди грибных фитотоксинов особо можно выделить гербарумин I и стагонолид А из группы 10-членных лактонов (рисунок 1). Гербарумин I проявил более сильное токсическое действие (ЛД50 в отношении проростков щирицы печальной около 0 05 mM), чем гербицид 2,4-Д (Rivero-Cruz et al., 2000 [3]) Стагонолид А достоверно ингибировал рост корней проростков бодяка полевого с ЛД50 около 0.005 mM. Было показано также, что стагонолид А фитотоксичен и для листьев ряда сорных растений (Yuzikhin et al., 2007 [4]). Среди других фитотоксинов из группы 10-членных лактонов он проявил наиболее высокую токсичность в отношении листьев бодяка полевого и осота полевого (Berestetskiy et al., 2008 [5]). Эти вещества рекомендовались как гербицидные соединения природного происхождения (Rivero-Cruz et al., 2000 [3]; Yuzikhin et al., 2007 [4]).
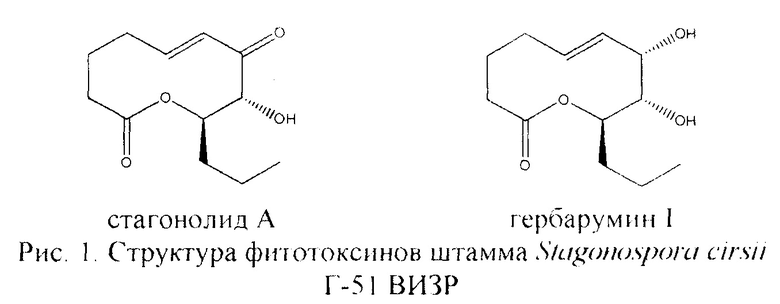
Известный из литературы продуцент гербарумина I гриб Phoma herbarum ТОХ-01020 был выделен из пораженных листьев кукурузы (Zea mays) в 1998 году. Гриб культивировали на модифицированной среде М-D-I на орбитальных качалках при температуре 28°С и скорости вращения орбитальной качалки 120 об/мин в течение 15 дней Метаболиты гриба извлекали из культуральной жидкости и мицелия этилацетатом. Объединенный экстракт (4 г) фракционировали при помощи колоночной хроматографии на силикагеле в системе дихлорметан-изопропанол при градиентном режиме элюирования с содержанием изопропанола от 0 до 100%. Из фракции FIV-3 при помощи препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) был выделен гербарумин I с выходом 0.320 мг/л (Rivero-Cruz et al., 2000 [3])
Продуцентом стагонолида А является гриб Stagonospora cirsii С-163 (депонирован в коллекции ВИЗР как штамм VIZR 1.41). Гриб культивировали 2 недели на модифицированной среде Чапека без перемешивания, экстракцию метаболитов производили этилацетатом. Стагонолид А был выявлен в среднеполярной фракции при фракционировании экстракта на силикагеле системой растворителей гексан-диэтиловый эфир с выходом 40 мг/л среды (Yuzikhin et al., 2007 [4]).
Для практического применения, углубленного изучения гербарумина I и стагонолида А (например, изучения механизмов действия, синтеза производных, определения селективности) необходимо получение этих биологически активных соединений в достаточных (от нескольких сот миллиграммов до нескольких граммов) количествах. Недостатком штамма-прототипа P. herbarum ТОХ-01020 является крайне низкий выход гербарумина I. Продуктивность штамма гриба Stagonospora cirsii VIZR 1.41 по стагонолиду А также невысока. Поэтому перспективы использования этих штаммов как продуцентов стагонолида А и гербарумина I были ограничены.
Задачей изобретения является получение универсального штамма-продуцента, способного образовывать гербарумин I и стагонолид А с высокой продуктивностью, превосходящей прототипы P. herbarum ТОХ-01020 и Stagonspora cirsii VIZR 1.41, соответственно.
Поставленная задача была решена получением высокопродуктивного штамма гриба S. cirsii Г-51 ВИЗР, способного продуцировать как гербарумин I, так и стагонолид А.
Штамм Г-51 ВИЗР был отобран в результате сравнения фитотоксической активности экстрактов различных штаммов S. cirsii, различного географического происхождения и выделенных с разных растений-хозяев, включая один из прототипов - штамм С-163 (таблица 1). Идентификация грибов была проведена по данным J.J. Davis (Davis, 1919 [6]).
Для получения экстрактов различные штаммы S. cirsii культивировали на модифицированной среде Чапека следующего состава: 45 г/л сахарозы, 3г/л NaNO3, 1 г/л KH2PO4, 0.5 г/л MgSO4, 0.5 г/л KCl, витамины тиамин - (100 мкг) и биотин (5 мкг), рН=6 Инокуляцию сред осуществляли агаровым блоком, вырезанным из края недельной колонии гриба на стандартном картофельно-глюкозном агаре (Благовещенская, 2017 [7]). Выращивание культур S. cirsii проводили в 500-мл конических колбах с 100 мл среды в 4-х повторностях. Инкубацию культур вели в течение 14 суток при температуре 24°С без встряхивания.
Жидкостную экстракцию метаболитов грибов проводили этилацетатом в 500-мл делительных воронках. В воронку заливали 100 мл культурального фильтрата и 100 мл органического растворителя и энергично встряхивали в течение 1 минуты Нижнюю водную фазу отбрасывали, верхнюю органическую фазу фильтровали через безводный сульфат натрия Na2SO4 и упаривали на роторном испарителе при 40°С досуха.
Для оценки фитотоксического действия экстрактов использовали метод листовых дисков (Берестецкий и др., 2010 [8]). Исследуемые фракции растворяли сначала в небольшом количестве этанола, затем доводили водой до заданной концентрации (5 мг/мл для экстрактов). Конечная концентрация этанола в растворе составляла 5% (по объему), что является нетоксичным для растений. Из листьев среднего яруса 3-5-недельных растений осота пробочным сверлом вырезали диски 1 см в диаметре. Высечки помещали во влажную камеру. Каждую высечку в центре надкалывали препаровальной иглой и наносили в область надкола 10 мкл исследуемого раствора. Учет симптомов (площадь некроза) проводили через 48 ч инкубации при температуре 24°С и переменном искусственном освещении (12 ч в день).
Максимальную фитотоксическую активность в отношении листовых дисков осота продемонстрировал экстракт из жидкой культуры штамма Г-51 ВИЗР. При концентрации экстракта 2 мг/мл площадь некрозов листовых дисков осота превышала 90% при использовании экстракта из культуральной жидкости штамма Г-51 ВИЗР, что было в 1.5 раза выше, чем при использовании экстракта из культуральной жидкости штамма-прототипа С-163 (таблица 2)

1 доля пораженной площади по отношению к общей площади листового диска, %; концентрация экстракта 2 мг/мл
Характеристика продуцента
Систематическое положение. Вид Stagonospora cirsii J.J. Davis относится к отделу Ascomycota, подотделу Pezizomycotina, классу Dothideomycetes, подклассу Pleosporomycetidae, порядку Pleosporales, семейству Massarinaceae
По морфологии спороношения штамм S. cirsii Г-51 ВИЗР был практически идентичен изоляту S. cirsii VIZR 1.41 (С-163) - продуценту стагонолида A (Yuzikhin et al., 2007 [4]), выделенному из больных листьев бодяка полевого (Cirsium arvense). Штамм S. cirsii Г-51 обладает быстрым ростом на стандартных агаризованных питательных средах (картофельно-глюкозном агаре (КГА), овсяном агаре (OA), мальтозном агаре (МА) и агаре Чапека с витаминами (ЧА)) в темноте при 24°С. Диаметр двухнедельных колоний S. cirsii Г-51 на всех агаризованных средах составлял свыше 90 мм. Гриб образует на КГА колонии темно-серого цвета, с клочковато-войлочной текстурой. Цвет реверса темно-серый. На среде OA гриб образует темно-серые колонии с мелкими белыми ватообразными мицелиальными скоплениями. На среде МА колонии S. cirsii Г-51 ВИЗР светло-серые, войлочно-бархатистые. Цвет реверса от светло-бурого до темно-бурого. На среде ЧА гриб образует бархатистые колонии дымчато-серого цвета Край колоний на всех агаризованных средах неровный, древовидно-лопастной
Хранение штамма S. cirsii Г-51 ВИЗР осуществляется в пробирках на скошенном картофельно-глюкозном агаре в бытовом холодильнике при температуре 5°С, а также при -80°С в 10%-ном стерильном растворе глицерина.
Пример 1. Глубинное культивирование штамма S. cirsii Г-51 ВИЗР
Для глубинного культивирования S. cirsii Г-51 ВИЗР использовали модифицированную жидкую питательную среду Чапека с витаминами (ЧАВ) в следующей модификации: глюкоза - 45 г, NaNO3 - 3 г, К2НРО4 - 1 г, MgSO4×7H2O - 0,5 г, KCl - 0.5 г, FeSO4×7H2O - 0.01 г, тиамин - 100 мкг, биотин - 5 мкг, 10 г подсолнечного рафинированного масла в качестве пеногасителя, вода дистиллированная до 1 л, рН 6 Культивирование гриба проводили в биореакторе с рабочим объемом 1.5 л фирмы Applikon Biotechnology (Голландия) с системой управления процессами ez-Control и программным обеспечением BioXpert. Система была оснащена сенсорами рН, температуры, концентрации растворенного кислорода и пены Ферментационную среду (1.4 л) инокулировали 100 мл 7-суточной культуры, полученной на среде ЧАВ без масла по вышеописанной методике Параметры ферментации: скорость подачи воздуха 1.5 л/мин, температура 24°С, скорость перемешивания 200 об/мин в течение 2 суток и 400 об/мин - до завершения процесса ферментации, уровень рН не поддерживали. Пеногаситель - растительное масло (1% от объема среды) вводили в среду до посева гриба. Культивировали 7 дней, ежедневно отбирая пробы по 30 мл. До проведения анализа образцы культуральной жидкости хранили в морозильной камере при -20°С.
Количественный анализ токсинов проводили следующим образом. Твердофазную экстракцию фитотоксинов из фильтрата культуральной жидкости гриба S. cirsii Г-51 ВИЗР и их очистку проводили при помощи вакуумной установки (манифолда) и колонок с 0.5 г обращенно-фазового сорбента Chromabond С 18ес (объем резервуара 3 мл, Macherey-Nagel, Германия). Сорбент кондиционировали последовательным внесением в колонку 3 мл метанола и 3 мл воды (не допуская пересыхания). В колонку вносили 200 мкл фильтрата культуральной жидкости. Сорбент промывали 3 мл воды и 3 мл 25%-ного метанола, затем подсушивали воздухом в течение 1 минуты. Аналиты элюировали из колонки метанолом (2 мл), элюат тщательно перемешивали и хранили в морозильной камере при -20°С. Для количественного анализа фитотоксинов из полученных проб отбирали 200 мкл элюата, добавляли к нему 300 мкл воды и тщательно перемешивали. Анализ фитотоксинов проводили с использованием колонки Acquity UPLC ВЕН С 18 50×2.1 мм. В качестве подвижной фазы использовали систему метанол-вода в соотношении 50:50 (по объему), скорость подачи подвижной фазы 250 мкл/мин, температура термостата колонки 40°С. Объем вводимого образца 5 мкл. Время удерживания (tR) стагонолида А составляло 1.4 мин, гербарумина I - 1.9 мин. Погрешность tR не превышала 2%. Градуировочные характеристики, выражающие зависимость площадей пиков от концентрации стагонолида А и гербарумина I в пробах, установили методом абсолютной калибровки по пяти концентрациям веществ в диапазоне от 0.125 до 20 нг в анализируемой пробе, соответствующих содержанию фитотоксинов от 0.625 до 100 мг/л. Эксперимент повторяли трижды, приведены данные типичного из них.
Стагонолид А был обнаружен в культуральной жидкости на 4 сутки ферментации. Максимальная его концентрация (116.7 мг/л) выявлена на 5-е сутки культивирования, затем его содержание в культуральной жидкости быстро снизилось до 24 мг/мл. На 7-е сутки ферментации стагонолид А в культуральной жидкости не обнаружили. Гербарумин выявлен в 6-суточной и 7-суточной культуральной жидкости (38 мг/л и 116.5 мг/л соответственно) (таблица 3).
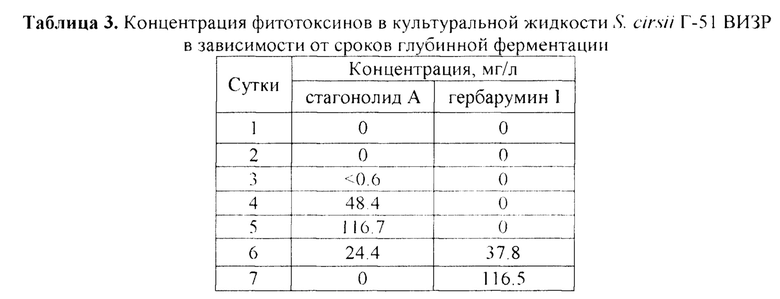
Максимальное содержание стагонолида А (116.7 мг/л) в 5-суточной культуре штамма S. cirsii Г-51 ВИЗР более чем в 2 раза превышает выход фитотоксина из культуры прототипа S. cirsii VIZR 1.41 (С-163). Максимальное содержание гербарумина I (116.5 мг/л) в 7-суточной культуре штамма S. cirsii Г-51 ВИЗР более чем в 350 раз превышает продуктивность прототипа P. herbarum ТОХ-01020.
Пример 2. Получение стагонолида А и гербарумина I при помощи глубинного культивирования S. cirsii Г-51 ВИЗР
Для верификации данных о содержании фитотоксинов в культуральном фильтрате S. cirsii Г-51 ВИЗР, полученных методом количественного анализа с применением ВЭЖХ (таблица 3), было проведено препаративное выделение стагонолида А и гербарумина I из культурального фильтрата стандартными методами жидкость-жидкостной экстракции и колоночной хроматографии (Sterner, 2012 [9]).
Культивирование S. cirsii Г-51 ВИЗР в биореакторе останавливали на 6-е сутки ферментации при описанных в Примере 1 условиях. После отделения биомассы экстракцию метаболитов из фильтрата культуральной жидкости проводили хлористым метиленом. Грубое разделение экстракта (масса около 500 мг) проводили в стеклянной колонке (длина 40 см, диаметр 2.5 см) на силикагеле (50 г, диаметр частиц 70-200 мкм, Merck, Германия) в ступенчатом градиенте: гексан (элюент 1), гексан-этилацетат (8:2 по объему, элюент 2), гексан-этилацетат (6:4, элюент 3), гексан-этилацетат (4:6, элюент 4), этилацетат (элюент 5), этилацетат-метанол (8:2, элюент 6), все по 200 мл (4 порции по 50 мл) Предварительный контроль состава фракций осуществляли при помощи ТСХ (пластины Silica gel 60 F254, Merck, Германия) в системе гексан-этилацетат 8:2. Вещества визуализировали в УФ-свете (254 нм) и обработкой пластин реактивом на основе серной кислоты и анисового альдегида с последующим нагревом при температуре 105°С. Стагонолид А хорошо визуализируется при 254 нм и окрашивается реактивом в коричневый цвет (Rf 0.35). Гербарумин I при 254 нм не выявляется, реактивом окрашивается в синий цвет (Rf 0.15). По данным ТСХ и СВЭЖХ/ДМД фракция 3 (50 мг) содержала преимущественно стагонолид А, фракция 5 (150 мг) - гербарумин I с примесями.
Дальнейшую очистку гербарумина I проводили на обращенно-фазовой (ОФ) колонке Puriflash PF-15C18HP/20G (20 г, диаметр частиц сорбента 15 мкм, Interchim, Франция) при помощи системы препаративной хроматографии среднего давления Sepacore ( , Швейцария) с УФ/ВИД-детектором Образец фракции 5 адсорбировали на 2 г ОФ сорбента (Silica gel 60 silanazied, диаметр частиц 63-200 мкм, Merck, Германия) и вносили в предколонку для сухой загрузки объемом 6 мл. Элюирование метаболитов осуществляли при комнатной температуре с использованием системы растворителей 0.1%-ная муравьиная кислота - ацетонитрил: 15% ацетонитрила в течение 1 мин, градиент от 15 до 100% ацетонитрила в течение 11 мин, ацетонитрил в течение 4 мин. Скорость потока элюента 24 мл/мин, детекция на длине волны 200 нм. Время удерживания (tR) гербарумина I составило 4.5 мин.
, Швейцария) с УФ/ВИД-детектором Образец фракции 5 адсорбировали на 2 г ОФ сорбента (Silica gel 60 silanazied, диаметр частиц 63-200 мкм, Merck, Германия) и вносили в предколонку для сухой загрузки объемом 6 мл. Элюирование метаболитов осуществляли при комнатной температуре с использованием системы растворителей 0.1%-ная муравьиная кислота - ацетонитрил: 15% ацетонитрила в течение 1 мин, градиент от 15 до 100% ацетонитрила в течение 11 мин, ацетонитрил в течение 4 мин. Скорость потока элюента 24 мл/мин, детекция на длине волны 200 нм. Время удерживания (tR) гербарумина I составило 4.5 мин.
Финальную очистку фитотоксинов проводили при помощи препаративной ВЭЖХ на колонке XBridge Prep С18 250×19 мм с диаметром частиц 5 мкм (Waters, США) Химия частиц этой колонки аналогична сорбенту аналитической колонки Acquity UPLC ВЕН С18 Хроматографирование проводили при комнатной температуре и скорости подачи элюента (вода-ацетонитрил 30:70) 24 мл/мин. Объем вводимой пробы 1 мл (примерно 50 мг сухого образца растворяли в 300 мкл ацетонитрила и добавляли 700 мкл воды). Метаболиты детектировали на длинах волн УФ-детектора 200 и 234 нм. В этих условиях tR гербарумина I - 9 мин, tR стагонолида А - 12 мин. Контроль содержания этих фитотоксинов в хроматографических фракциях осуществляли вышеописанным методом СВЭЖХ/ДМД.
Выход стагонолида А составил около 30 мг/л, гербарумина I - 50 мг/л, что соответствует данным, приведенным в таблице I для 6-суточной культуры S. cirsii Г-51 ВИЗР.
Пример 3. Получение гербарумина I при помощи твердофазного культивирования S. cirsii Г-51 ВИЗР
В качестве твердого субстрата была использована автоклавированная пшенная крупа Для приготовления субстрата 150 г крупы помещали в 1500-мл микробиологические матрасы и добавляли 100 мл деионизированной воды. Субстрат стерилизовали автоклавированием при температуре 121°С в течение 15 мин. В качестве посевного материала для твердофазного культивирования использовали двухнедельные колонии S. cirsii Г-51 ВИЗР, полученные на картофельно-глюкозном агаре (КГА) Штамм культивировали в течение 3 недель в комнатных условиях. Матрасы с растущей твердофазной культурой S. cirsii Г-51 ВИЗР встряхивали каждые 3 дня для предотвращения комкования субстрата
Колонизированный грибом твердый субстрат высушивали в ламинарном боксе потоком стерильного воздуха. Полученный материал измельчали и двукратно экстрагировали 50%-ным водным ацетоном (по объему) по 10 минут в ультразвуковой ванне. Полученный экстракт фильтровали через бумажный фильтр, ацетон отгоняли при помощи ротационного испарителя при температуре водяной бани 40°С. Метаболиты S. cirsii Г-51 ВИЗР переэкстрагировали из оставшейся после выпаривания ацетона водной вытяжки хлористым метиленом Хлористометиленовый экстракт обезвоживали с помощью безводного Na2SO4, после чего растворитель отгоняли при помощи ротационного испарителя при температуре водяной бани 40°С. Сухой остаток взвешивали, масса хлористометиленового экстракта составила 3.2 г.
Далее проводили первичное разделение экстракта при помощи колоночной хроматографии на силикагеле Silica gel 60 (Merck, Германия) с размером частиц 63-200 мкм. Элюирование осуществляли по методу ступенчатого градиента системами с содержанием этилацетатата от 0 до 100% (по объему). По результатам разделения получили 7 фракций ХМ_А - ХМ_G. Элюаты упаривали при помощи ротационного вакуумного испарителя при температуре водяной бани 40°С. В результате разделения фракции ХМ_В (1 г) методом препаративной ВЭЖХ на колонке С18 XBridge Prep C 18 19×250 мм (Waters, США), как описано в предыдущем примере, был получен гербарумин I (672 мг).
Выход гербарумина I составил 462.4 мг/кг субстрата. Сравнить полученный выходе продуктивностью штамма-прототипа P. herbarum ТОХ-01020 не представляется возможным, так как твердофазное культивирование этого штамма не проводилось. Стагонолид А в культуре штамма S. cirsii Г-51 ВИЗР при таком способе культивирования не обнаружен.
Пример 4. Идентификация и спектр биологической активности стагонолида А и гербарумина I
Для подтверждения структуры выделенных соединений использовали ВЭЖХ-МС/МС и анализ протонных и углеродных спектров ЯМР. Для получения масс-спектров использовалась хроматографическая система TSQ Quantum Access™ (Thermo Scientific, США), снабженная диодно-матричным быстросканирующим и масс-спектрометрическим (тройной квадруполь) детекторами. Условия хроматографирования. колонка Zorbax CB-C18 (Agilent Tech., США), зернение 1.8 мкм, размеры колонки 2.1×150 мм, градиент 10-100% ацетонитрила в 0,1% муравьиной кислоте, скорость потока элюента 250 мкл/мин, температура колонки 35°С, диапазон сканирования диодно-матричного детектора 200-800 нм, тип ионизации HESI, диапазон сканирования 50-1000 m/z. Для растворения образцов веществ использовался метанол. Для записи спектров ЯМР использовали прибор Avance III Ultra-Shield Plus (Bruker, Германия) Для растворения образцов веществ использовался дейтерированый хлороформ Протонные спектры записывали при частоте 400 МГц, углеродные - при 100 МГц.
В масс-спектре полученного нами образца стагонолида А присутствовали пики m/z 227.11 [М+Н, 100%]+ и 209.12 [М+Н-H2O, 25%]+, в масс-спектре гербарумина I - m/z 229.11 [М+Н, 10%]+ и 211.12 [М+Н-H2O, 100%]+, 193.15 [М+Н -2H2O, 25%]+. Масс-спектры демонстрируют наличие одной гидроксильной группы у стагонолида А и двух у гербарумина I. Протонный и углеродный спектры ЯМР стагонолида А и гербарумина I были идентичны опубликованным (Rivero-Cruz et al., 2000 [3]; Yuzikhin et al., 2007 [4]). В полученных углеродных спектрах DEPT обоих веществ присутствовали сигналы пяти СН2-групп (3 сигнала лактонного кольца и 2 сигнала n-пропильной группы).
Для оценки фитотоксического действия экстрактов и индивидуальных соединений использовали метод надколотых листовых дисков осота полевого (Берестецкий и др., 2010 [8]). Анализируемый образец растворяли сначала в небольшом количестве этанола, затем доводили водой до концентрации 5 мг/мл. Конечная концентрация этанола в растворе составляла 5% (по объему). Из листьев среднего яруса 3-5-недельных растений осота пробочным сверлом вырезали диски I см в диаметре. Диски помещали во влажную камеру, надкалывали в центре препаровальной иглой и наносили в область надкола 10 мкл раствора. Диаметр некроза на листовых дисках осота учитывали через 48 ч инкубации при температуре 24°С и переменном искусственном освещении (12 ч в день). Стагонолид А и гербарумин I оказались примерно в равной степени токсичны в отношении осота полевого и бодяка полевого. Гербарумин I проявил более высокую фитотоксическую активность в отношении пырея ползучего, чем стагонолид А на 5 сутки после обработки (таблица 4)
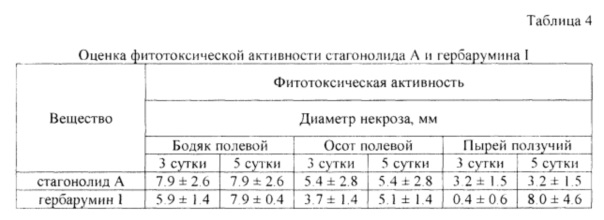
Данные представлены в виде «среднее значение ± стандартное отклонение»
Таким образом, штамм гриба S. cirsii Г-51 ВИЗР предложен как продуцент гербарумина I и стагонолида А. Продуктивность штамма позволяет получить гербарумин I в количестве 116 мг/л при культивировании в течение 7 суток на жидкой питательной среде в ферментере, что более чем в 150 раз превышает продуктивность прототипа - штамма Phoma herbarum ТОХ-01020. Кроме того, S. cirsii Г-51 ВИЗР образует гербарумин I при культивировании на твердой питательной среде с выходом 460 мг/кг субстрата. При глубинном культивировании в течение 5-ти суток этот гриб образует также стагонолид А с выходом более 100 мг/л, что более чем в 2 раза превышает выход этого вещества при использовании прототипа - штамма S. cirsii VIZR 1.41 (С-163)
Литература
1. Берестецкий А.О. Фитотоксины грибов: от фундаментальных исследований - к практическому использованию (Обзор) // Прикладная биохимия и микробиология. 2008. т. 44, N 5, с. 501-514.
2. Берестецкий А.О. Перспективы разработки биологических и биорациональных гербицидов // Вестник защиты растений 2017. Т. 91, N 1. С. 5-12.
3. Rivero-Cruz J.F., Garcia-Aguirre G., Cerda-Garcia-Rojas C.M., Mata R. Conformational Behavior and Absolute Stereostructure of Two Phytotoxic Nonenolides from the Fungus Phoma herbarum // Tetrahedron. - 2000. - V. 56. - P. 5337-5344.
4 Yuzikhin О., Mitina G., and Berestetskiy A. Herbicidal potential of stagonolide, a new phytotoxic nonenolide from Stagonospora cirsii // J. Agric. Food Chem. 2007. Vol. 55. N 19. 7707-7711.
5. Berestetskiy A., Dmitriev A., Mitina G., Lisker I., Andolfi A., Evidente A. Nonenolides and cytochalasins with phytotoxic activity against Cirsium arvense and Sonchus arvensis: A structure-activity relationships study // Phytochemistry 69 (2008) 953-960.
6 Davis J.J. 1919. Notes on parasitic fungi in Wisconsin. V. Transactions of the Wisconsin Academy of Science. 19(2):690-704.
7 Благовещенская Е.Ю. Микологические исследования: основы лабораторной техники. М.: Ленанд, 2017. 96 с.
8 Берестецкий, А.О., Юзихин О.С., Каткова А.С., Добродумов А.В., Сивогривов Д.Е., Коломбет Л.В. Выделение, идентификация и характеристика фитотоксина, образуемого грибом Alternaria cirsinoxia // Прикладная биохимия и микробиология. - 2010. - Т. 41, №1. - С. 84-88.
9. Sterner О. Isolation of microbial natural products. In: Natural Products Isolation. Sarker S.D., Nahar L. (Eds.) Methods in Molecular Biology, vol. 864, Springer Science + Business Media, LLC. 2012. P. 393-413.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГРИБА Stagonospora cirsii Davis, ОБЛАДАЮЩИЙ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ БОДЯКА ПОЛЕВОГО | 2013 |
|
RU2515899C1 |
| ШТАММ Paraphoma sp. - ПРОДУЦЕНТ ФЕОСФЕРИДА А | 2015 |
|
RU2596928C1 |
| СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНОЙ ТРАВЯНИСТОЙ РАСТИТЕЛЬНОСТЬЮ КЛАССА DICOTYLEDONES | 2013 |
|
RU2543665C2 |
| ШТАММ ГРИБА Phoma ligulicola var.inoxydabilis Boerema, ОБЛАДАЮЩИЙ МИКОГЕРБИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ ПОЛЫНИ ОБЫКНОВЕННОЙ | 2015 |
|
RU2588470C1 |
| КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТЬЮ КЛАССА DICOTYLEDONES | 2016 |
|
RU2610692C1 |
| Штамм гриба Alternaria sonchi Г-52 ВИЗР, обладающий гербицидной активностью против осота полевого (Sonchus arvensis L.) | 2018 |
|
RU2701957C1 |
| ШТАММ ГРИБА Phoma complanata (Tode) Desm. 1.40 (ВИЗР), ОБЛАДАЮЩИЙ МИКОГЕРБИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ БОРЩЕВИКА СОСНОВСКОГО | 2010 |
|
RU2439141C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОСТАВА С ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2619300C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТАРТРАТА ЭПОКСИАГРОКЛАВИНА-I И ХИНОЦИТРИНИНОВ | 2008 |
|
RU2386692C1 |
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, ОБЛАДАЮЩИЙ ФУНГИЦИДНОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2603281C1 |
Изобретение относится к биотехнологии. Предложен штамм гриба Stagonospora cirsii, являющийся продуцентом гербарумина I и стагонолида А. Штамм гриба депонирован в Государственной коллекции микроорганизмов ВИЗР под номером Г-51 ВИЗР. Изобретение обеспечивает высокую продукцию гербарумина I и стагонолида А. 4 табл., 4 пр.
Штамм гриба Stagonospora cirsii Г-51 ВИЗР - продуцент гербарумина I и стагонолида А.
| САБАШУК Ю.А | |||
| И ДР | |||
| Изучение влияния условий глубинного культивирования на выход фитотоксических экзометаболитов, образуемых Stagonospora cirsii S-47 | |||
| Материалы научной конференции "Традиции и Инновации", посвященной 189-й годовщине образования Санкт-Петербургского государственного технологического института (технического университета) | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| ДВОЙНОЙ ГАЕЧНЫЙ КЛЮЧ | 1920 |
|
SU288A1 |
| RIVERO-CRUZ J.F | |||
| ET AL | |||
| Conformational Behavior and Absolute Stereostructure of Two Phytotoxic Nonenolides from the Fungus Phoma herbarum | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Приспособление для подачи гильз к раскручивающему прибору в гильзовых машинах | 1925 |
|
SU5337A1 |
| ШТАММ ГРИБА Stagonospora cirsii Davis, ОБЛАДАЮЩИЙ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ БОДЯКА ПОЛЕВОГО | 2013 |
|
RU2515899C1 |
| Берестецкий А.О | |||
| Фитотоксины грибов: от фундаментальных исследований - к практическому использованию (обзор) | |||
| Прикладная биохимия и микробиология, 2008, том 44, номер 5, с | |||
| Приспособление для получения кинематографических снимков или для проектирования их на экран при помощи фотографического аппарата или волшебного фонаря | 1914 |
|
SU501A1 |
Авторы
Даты
2019-10-01—Публикация
2018-12-28—Подача