Изобретение относится к биотехнологии и касается нового бактериального штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, обладающего способностью высвобождать фосфаты из нерастворимого минерального сырья и подавлять рост фитопатогенных грибов, а также бактерий-возбудителей болезней человека, животных и растений. Штамм может быть использован для создания на его основе биофосфорного удобрения с фунгицидными и бактерицидными свойствами, а также для разработки антимикробных препаратов против бактериальных патогенов человека и животных.
Проблема фосфорного питания растений остается одной из самых острых в земледелии, что объясняется двумя основными причинами: ограниченным запасом фосфатных руд и быстрым связыванием этого элемента в почве при внесении с удобрениями. Только 5-25% вносимого с химическими удобрениями фосфора ассимилируется растениями (Sample Е.С., Soper R.J., Racz G.J. Reactions of phosphate fertilizers in soils // The role of phosphorus in agriculture. / Ed. Khasawneh F.E, Sample E.C, Kamprath E.J. Madison, WI: American Society of Agronomy, 1980. P. 263-310; Муромцев Г.С., Маршунова Т.Н., Павлова В.Ф., Зольникова Н.В. Роль почвенных микроорганизмов в почвенном питании растений // Успехи микробиол. 1985. Т. 20. С. 174-198). Остальная часть фосфатов вымывается или переходит в почве в нерастворимую форму и становится недоступной для растений. При этом производство фосфорсодержащих химических удобрений является энергоемким и дорогостоящим процессом, чрезвычайно загрязняющим окружающую среду. Увеличение норм внесения удобрений нарушает баланс питания растений, снижает качество продукции и нарушает экосистему почв, грунтовых вод и водоемов. В связи с этим в настоящее время во многих странах ведутся интенсивные исследования возможности замены промышленного химического производства фосфорных удобрений микробиологическим (Н. Antoun. Beneficial microorganisms for the sustainable use of phosphates in agriculture // Procedia Engineering. 2012. Vol. 46, pp. 62-67; P. Jain, D.S. Khichi. Phosphate solubilizing microorganism (PSM): an ecorriendly biofertilizer and pollution manager // J. of Dynamics in Agricultural Research. 2014. - Vol. 1 (4), pp. 23-28).
В то же время в современном зернопроизводстве очень актуальна проблема борьбы с поражениями посевов хлебных злаков и продуктов их урожая фузариозными гнилями (Соколов М.С., Коломбет Л.В. Агротехногенные факторы минимизации вредоносности фузариоза колоса пшеницы // Агрохимия. 2007. - №12. - С. 63-80). Возбудителями фузариозов зерновых являются в основном грибы рода Fusarium.
Кроме того, одной из наиболее распространенных и вредоносных болезней озимых зерновых культур является так называемая снежная плесень (В.Ф. Пересыпкин, С.Л. Тютерев, Т.С. Баталова. Болезни зерновых культур при интенсивных технологиях их возделывания. - М.: Агропромиздат, 1991. - 272 с.; S. Chakraborty, А.С. Newton. Climate change, plant diseases and food security: an overview // Plant Pathology. 2011. - №60. - Pp. 2-14). Основными возбудителями болезни являются грибы Microdochium nivale, а также рода Fusarium: F. culmorum (W.G. Sm.) Sacc., F. avenaceum (Fr.) и другие (Т.И. Ишкова, Л.И. Берестецкая, Е.Л. Гасич. Диагностика основных грибных болезней хлебных злаков. - СПб.: ВИЗР. - 2002. - 76 с.; B.C. Горьковенко, Л.А. Оберюхтина, Е.А. Куркина. Вредоносность гриба Microdochium nivale в агроценозе озимой пшеницы // Защита и карантин растений. 2009, №1, с. 34-36). Снежная плесень развивается ранней весной сразу после таяния снега и даже под снегом. Поражение посевов озимой пшеницы в отдельные годы достигает 100%, что приводит к полной потере урожая. Для борьбы с возбудителями снежной плесени необходимо использовать психрофильные микроорганизмы, способные проявлять антагонистическую активность при пониженных температурах.
Хотя грибы-фитопатогены занимают первое место по нанесению ущерба в растениеводстве среди других возбудителей, бактерии-фитопатогены также приводят к значительному снижению урожая и его дальнейшей порче при хранении. Болезни растений вызывают бактерии родов Erwinia, Xantomonas и др.
Если в качестве микроорганизмов, растворяющих фосфатную руду в полевых условиях, будут использованы антагонисты патогенов сельскохозяйственных культур, это позволит значительно снизить применение химических пестицидов, повысит экологическую безопасность и безопасность продовольствия. Создание комплексного биофосфорного удобрения с фунгицидными и бактерицидными свойствами позволит дополнительно повысить экологическую безопасность, в том числе и за счет снижения загрязнения окружающей среды, сопровождающее производство и применение традиционных химических фосфорных удобрений.
В настоящее время известны фосфатрастворяющие микроорганизмы (например, патент США №5026417; Y.P. Chen, P.D. Rekha, А.В. Arum, F.T. Shen, W. - A. Lai, C.C. Young. Phophate solubilising bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities // Applied Soil Ecology. - 2006. - V. 34. - P. 34-41) и микроорганизмы, на основе которых созданы препараты для борьбы с болезнями растений (например, патенты РФ №1805849, №2019966, №2099947, №2213774; В.А. Павлюшин, С.Л. Тютерев, Э.В. Попова, И.И. Новикова, Г.А. Быкова, Н.С Домнина. Новые комплексные биопрепараты для защиты овощных культур от грибных и бактериальных болезней // Биотехнология. - 2010. - №4. - С. 69-80).
Известен штамм Pseudomonas aureofaciens ВКМ В-2390, предназначенный для защиты растений от грибных патогенов, для очистки почв от мышьяка и растворяющий фосфаты (Патент РФ №2323967). Штамм имеет узкий спектр антагонистического действия, и его фосфатрастворяющая активность характеризуется только качественно по наличию зоны просветления в агаре, содержащем нерастворимое фосфатное сырье. Известно, что результаты определения растворения фосфатов микроорганизмами, полученные на плотных и жидких средах, часто не совпадают, и для количественной оценки фосфатрастворяющей активности необходимы исследования в жидкой среде (Gupta R., Singal R., Shankar A., Kuhad R.C., Saxena R.K. A modified plate assay for screening phosphate solubilizing microorganisms // J. Gen. Appl. Microbiol. 1994. V. 40. P. 255-260; Deubel A., Fankem H., Nwaga D., Antoun Y., Merbach W. In vitro mobilization of calcium, iron and aluminum phosphate by rhizosphere bacteria of African oil palm // Proceedings of 3rd International Symposium on Phosphorus Dynamics in the Soil-Plant Continuum. / Ed. Alves V.M.C. et al. Uberlandia, Brazil: Embrapa Milho e Sorgo. 2006. P. 232-233).
Известен штамм Pseudomonas sp. NJ-101, который давал зоны ингибирования до 1,8 мм с культурами фитопатогенов, таких как Fusarium oxysporum, F. solani и F. udum, и переводил в раствор до 74,6 мкг/мл фосфата из Са3(РO4)2 (Bano N., Musarrat J. Characterization of a novel carbofuran degrading Pseudomonas sp. with collateral biocontrol and plant growth promoting potential // FEMS Microbiol. Lett. 2004. Vol. 231. pp. 13-17). Этот штамм также имеет узкий спектр действия, активность его низка и его влияние на повышение урожайности не подтверждено.
Известен штамм Pseudomonas sp., проявляющий антагонистическую активность против фитопатогенных грибов и бактерий и растворяющий фосфаты (WO 2010037072 А1). Однако его фосфатрастворяющая способность охарактеризована только качественно по диаметру зоны просветления в агаре, содержащем Са3(РO4)2, и снижению величины рН в среде. Известно, однако, что снижение рН в среде культивирования микроорганизма с нерастворимым фосфатом хоть и указывает на способность к переводу фосфата в раствор, но не связано с этой способностью прямой пропорциональной зависимостью ( Н., Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion // Biotechnol. Adv. 1999. Vol.17, pp.319-339). Кроме того, не подтверждена активность штамма при пониженных температурах против Microdochium nivale.
Н., Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion // Biotechnol. Adv. 1999. Vol.17, pp.319-339). Кроме того, не подтверждена активность штамма при пониженных температурах против Microdochium nivale.
Наиболее близким к заявляемому изобретению является выделенный нами ранее фосфатрастворяющий штамм Pseudomonas species 181а с фунгицидными свойствами (Патент РФ 2451069). Штамм обладает высокими фосфатрастворяющими свойствами: переводит в раствор до 2620 мкг/мл фосфата и проявляет антагонистическую активность в отношении грибных фитопатогенов рода Fusarium: для F. graminearum зона угнетения составляет 1,0 мм, для F. culmorum - 1,5 мм, а для F. oxysporum - 2,5 мм. Однако штамм имеет узкий спектр действия, плохо развивается при пониженных температурах и не активен против Microdochium nivale.
Техническим результатом является получение нового штамма, обладающего высокой фосфатрастворяющей активностью, ростстимулирующими свойствами и способностью к подавлению фитопатогенных грибов и бактерий, в том числе к подавлению Microdochium nivale при пониженных температурах, для борьбы с болезнями растений и повышения урожайности, а также для разработки препаратов против возбудителей болезней человека и животных.
Технический результат достигается тем, что предлагается штамм Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, выделенный из ризосферной почвы на территории завода по производству фосфорных удобрений г. Воскресенск (Московская обл.) в 2005 году с использованием селективной минимальной минеральной среды, содержащей нерастворимый фосфат кальция (Са3(РO4)2). Основными критериями отбора служили степень растворения Са3(РO4)2, подавление роста фитопатогенных грибов и бактерий, стимуляция роста растений и безвредность для теплокровных.
Предлагаемый штамм Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 обладает способностью растворять фосфаты, подавляет рост фитопатогенных грибов, в том числе Microdochium nivale при пониженных температурах, и бактериальных патогенов, стимулирует рост растений, повышает урожайность.
Предлагаемый штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» (п. Оболенск Серпуховского р-на Московской обл.) под номером В-7427.
Штамм бактерий Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 характеризуется следующими свойствами.
Культурально-морфологические признаки
Клетки подвижные, грамотрицательные, короткие овальные палочки, спор не образуют. Размер клеток 1-1,5 × 1,5-2,5 мкм, наблюдается клеточный полиморфизм.
При росте на агаре, содержащем гидролизат рыбной муки (ГРМ-агар) (ФБУН ГНЦПМБ, п. Оболенск), через 24 часа культивирования при 28°С вырастают колонии со светло-желтой пигментацией, диаметром 1-2 мм. Колонии круглые, с ровными краями, плоские, прозрачные.
Штамм хорошо растет на следующих средах: гидролизат рыбной муки (ГРМ)-бульон (ФБУН ГНЦПМБ, п. Оболенск) + 2% глюкозы, на минимальной синтетической среде состава (г/л): K2HРО4 - 1,5; KН2РО4 - 3,0; NH4Cl - 0,5; глюкоза - 20,0; дрожжевой экстракт -2,0; MgSO4 - 0,4; NaCl - 3,0, раствор микроэлементов - 10 мл/л (состав раствора микроэлементов, %: сульфат железа (FeSO4×7H2O) - 0,01; сульфат меди (CuSO4×5H2O) - 0,1; сульфат марганца (MnSO4×2H2O) - 0,1; сульфат цинка (ZnSO4×7H2O) - 0,01).
Физиолого-биохимические признаки
Облигатный аэроб, температурный оптимум роста 20-30°С, растет при 4°С и не растет при 41°С; растет в пределах рН среды от 3,0 до 8,5.
В дополнительных факторах роста не нуждается (прототроф). Метаболизм глюкозы окислительный. Молекулярный азот не фиксирует. Крахмал гидролизует. Клетчатку не разлагает. Штамм гидролизует аргинин, с помощью глюкозидаз и галактозидаз расщепляют некоторые олигосахариды, но не раффинозу и сорбозу. Ферментирует маннит, сахарозу, глицерин, мальтозу, салицин, мелибиозу, не обладает уреазной активностью. Окситест положительный. Оксидазная реакция положительная.
Усваивает ацетоин, галактозу, глюкозу, глицерин, инозитол, ксилозу, крахмал, малонат, мальтозу, маннитол, меллибиозу, рамнозу, сахарозу, трегалозу, фруктозу, цитрат Симмонса.
Использует аммиачные и нитратные соли в качестве единственного источника азота.
Сапрофит. Штамм не обладает фитопатогенной активностью, о чем свидетельствует отсутствие мацерации на ломтиках картофеля при нанесении на них уколом живых клеток штамма.
Штамм не патогенен для теплокровных: не вызывает гибели мышей линии СВА при подкожном введении 108 КОЕ.
Устойчивость к антибиотикам: устойчив к карбенициллину, цефалексину, кларитромицину, фузидину, амоксициллину, фурагину, цефаклору, рокситромицину, итраконазолу, цефалотину, бензилпенициллину, стрептомицину, фуразолидону, фурадонину, флуконазолу, цефтибутену, цефазолину, эритромицину, азитромицину, цефуроксиму, ванкомицину.
Штамм бактерий Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 хранят на чашках или косяках с ГРМ-агаром при 4-8°С. Пересевы на свежие среды - один раз в месяц. Долгосрочное хранение в лиофильно высушенном состоянии в лактозно-полиглюкиновой защитной среде. Хранить при температуре 4-8°С, перезакладка через 5 лет.
У штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 отсутствует фитотоксичность. Показатели фитотоксичности штамма имеют отрицательные значения (таблица 1), свидетельствующие о наличии стимулирующего рост растений эффекта.
Возможность осуществления изобретения иллюстрируется приведенными ниже примерами, но не ограничивается ими.
Пример 1. Получение культуры бактерий Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3
Культуру клеток штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 для испытаний готовят следующим образом: в колбу объемом 750 мл наливают 150 мл стерильной среды ГРМ-бульон, добавляют 6 мл стерильного 50%-раствора глюкозы и вносят 1-2 мл стационарной культуры штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3. Культивирование проводят с аэрацией (160-250 об/мин) при 28°С в течение 17-20 ч до титра культуральной жидкости 5-10×109 КОЕ/мл.
Пример 2. Получение сухого препарата на основе штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 для полевых испытаний
Полученную по примеру 1 культуральную жидкость смешивают с защитной средой, содержащей 2% полиглюкина и 7% лактозы, и высушивают на лиофилизаторе Virtis ВТ-4к (США). В результате получают сухой порошок с содержанием 1-25×109 КОЕ/г.
Пример 3. Демонстрация отсутствия фитотоксичности у штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3
Из культуральной жидкости, полученной по примеру 1, готовят 1% (v/v) суспензию клеток в стерильной дистиллированной воде (0,5-1,0×108 КОЕ/мл). В полученной суспензии замачивают семена пшеницы сорта "Московская-56" в течение 2 ч. В контрольном опыте семена замачивают в дистиллированной воде. По 50 семян каждого варианта раскладывают на увлажненную дистиллированной водой фильтровальную бумагу, которую помещают в чашки Петри, и выдерживают в термостате при 28°С в течение 4 суток, постоянно увлажняя. Через сутки оценивают всхожесть семян (таблица 1), а через 4 суток проростки морфометрируют, измеряя длину всех корней и стебля.
Фитотоксическую активность штамма рассчитывают по формуле
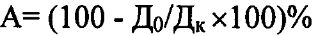 ,
,
где А - показатель фитотоксичности;
Дo - средний показатель параметра в опыте;
Дк - средний показатель параметра в контроле.
Отрицательные значения показателя А свидетельствуют о стимулирующем эффекте.

Пример 4. Демонстрация фосфатрастворяющей активности штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3
Для определения фосфатрастворяющей активности в колбы вместимостью 750 мл вносят 100 мл стерильной минеральной среды следующего состава (г/л): NH4Cl 0,16; MgSO4×7H2O 0,2; Са3(РO4)2×2Н2О 5,0; глюкоза 10. В среду вносят 2-3 мл культуры Pseudomonas chlororaphis ssp chlororaphis, выращенной по примеру 1. Инкубирование ведут на качалке New Brunswick при 160-180 об/мин при 28°С.
Для определения количества фосфата, перешедшего в раствор, используют одностадийный метод, основанный на измерении интенсивности окраски его молибденового комплекса с Твином 80 при 350 нм (Пупышев, А.Б. Стабильный реактив для одностадийного определения неорганического фосфата // Лабораторное дело. - 1991. - №9. - С. 12-16). Измерение фосфата в растворе проводят в трех повторностях.
В результате инкубации культуры Pseudomonas chlororaphis ssp chlororaphis наблюдается снижение рН в среде с 7,2 до 4,6, а концентрация фосфата в растворе составляет 2580±190 мкг/мл, что указывает на высокие фосфатрастворяющие свойства штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 на уровне прототипа Pseudomonas species 181a.
Пример 5. Демонстрация антагонизма штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 в отношении грибов и бактерий
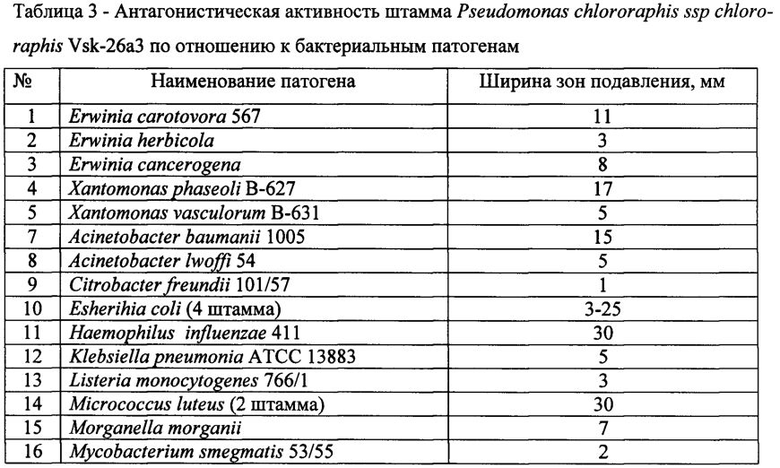
Для определения супрессивных свойств используют метод лунок. Суспензии фитопатогенных грибов (105 КОЕ/мл) готовят, смывая мицелиальную и споровую массу с газонов грибов на картофельно-глюкозном агаре (КГА), а суспензии бактерий (108 КОЕ/мл) - с газонов бактерий на ГРМ-агаре (Егоров Н.С. Руководство к практическим занятиям по микробиологии. - М.: Изд-во МГУ, 1995. - 217 с.) стерильным раствором 0,9% хлористого натрия. Полученные суспензии в количестве 0,1 мл засевают на поверхность КГА (в случае грибов) и ГРМ-агара (в случае бактерий) в чашках Петри и растирают шпателем. В центре засеянных патогенами чашек Петри с агаром делают лунки диаметром 5 мм, в которые вносят 0,1 мл культуральной жидкости Pseudomonas chlororaphis ssp chlororaphis Vsk-26а3, полученной по примеру 1. Чашки инкубируют при 28°С в течение 2-4-х суток. В случае исследования антагонизма в отношении грибов Microdochium nivale (снежная плесень) чашки инкубируют в холодильнике при температуре 4-8°С в течение 7-10 суток. Результаты представлены в таблицах 2-3.
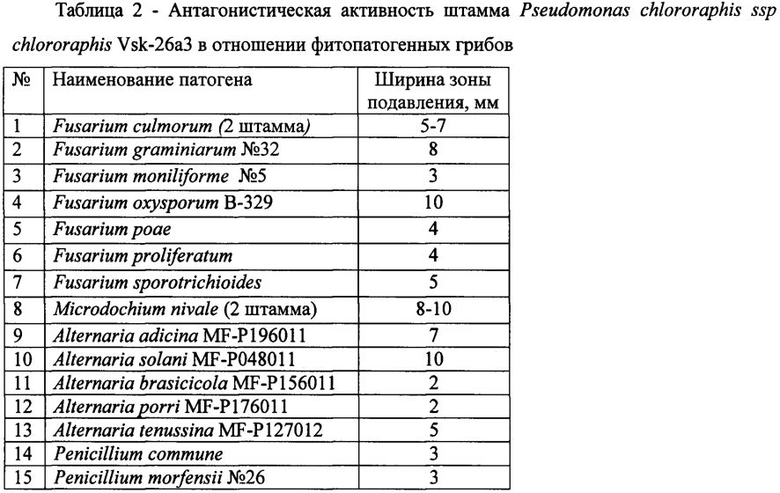

Данные таблицы 2 демонстрируют подавление заявляемым штаммом 15 видов фитопатогенных грибов, в том числе двух штаммов Microdochium nivale при пониженных температурах (4-8°С).
Данные таблицы 3 подтверждают антагонистическую активность заявляемого штамма в отношении как фитопатогенных бактерий, так и бактериальных патогенов человека и животных.
Пример 6. Демонстрация повышения урожайности сои в результате применения штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 при естественном инфекционном фоне
В качестве тест-культуры используют сою сорта Касатка.
Закладку опыта осуществляют на темно-серой лесной тяжелосуглинистой почве со следующими агрохимическими показателями: pH солевой вытяжки 5,3; содержание гумуса в слое 0-40 см (по Тюрину) - содержание гумуса (по Тюрину) - 5,3%. Содержание подвижного фосфора (по Кирсанову) - 34,0 мг/100 г почвы, содержание подвижного калия (по Кирсанову) - 19,2 мг/100 г почвы. Дополнительно удобрений не вносят.
В экспериментах используют основные методики и схемы, общепринятые в селекционных, научно-исследовательских учреждениях и Государственном сортоиспытании.
Посев осуществляют в оптимальные для агрозоны сроки по технологии, рекомендованной для возделывания сои, с учетом погодных условий.
Используют сухой препарат на основе штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, приготовленный по примеру 2, с титром 1×109. Способ внесения препарата: обработка семян перед посевом. Семена сои первоначально смачивают водой (из расчета 2% от веса семян), затем опудривают необходимым количеством сухого препарата и тщательно перемешивают.
Инфекционный фон - естественный. Повторность в опытах 4-кратная, площадь делянки 25,6 м2, учетная площадь делянки - 16,3 м2. Результаты приведены в таблице 4.
При использовании штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 урожайность сои достоверно повысилась на 15,8%.

Пример 7. Демонстрация повышения урожайности озимой пшеницы в результате применения штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 при искусственном инфекционном фоне
Тест-культура: озимая мягкая пшеница сорта Виола.
Закладку опыта осуществляют в селекционном севообороте на серой лесной тяжелосуглинистой почве со следующими агрохимическими показателями: рН солевой вытяжки - 5,13; содержание гумуса в слое 0-20 см (по Тюрину) - 3,1%, подвижного фосфора (по Кирсанову) - 139 мг/кг почвы, подвижного калия - 162 мг/кг почвы. Дополнительно удобрений не вносят. В эксперименте используют основные методики и схемы, общепринятые в селекционных, научно-исследовательских учреждениях и Государственном сортоиспытании.
Посев осуществляют в оптимальные для агрозоны сроки по технологии, рекомендованной для возделывания озимой пшеницы, с учетом погодных условий. Учетная площадь делянки 5 м2, повторность трехкратная.
Используют сухой препарат на основе штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, приготовленный по примеру 2, с титром 1,2×1010. Способ внесения препарата: обработка семян перед посевом, а также обработка растений в фазе кущения. За 2 ч до посева увлажненные дистиллированной водой семена опудривают сухим препаратом на основе штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 в дозе 0,25 кг/т. Обработка растений в фазе кущения проводится с помощью ручного опрыскивателя водной суспензией сухого препарата на основе штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26а3 в дозе 1,5 кг/га при норме расхода 200 л/га.
Инфекционный фон: искусственный. Для приготовления инокулюма с целью создания инфекционного фона зерно пшеницы помещают в колбы и увлажняют водой при соотношении вода:зерно (1:1). Далее колбы помещают в автоклав и стерилизуют при давление 1 атм в течение 40 мин. После автоклавирования инфицирование колб с зерном проводят по отдельности двумя штаммами Microdochium nivale, один из которых выделен с листьев пораженных растений озимой пшеницы в Рязанской области, а другой получен из РГАУ-МСХА имени К.А. Тимирязева. Засеянные колбы помещают в холодильную камеру на 3 месяца, поддерживая температуру не выше 10°С. В процессе выращивания патогена колбы периодически встряхивают. Для инфицирования готовый инокулюм вносят на делянки по 30 г зараженного зерна на 1 м2.
Результаты испытаний приведены в таблице 5.

Как следует из таблицы 5, инфицирование возбудителями снежной плесени достоверно снизило урожай по сравнению с неинфицированным контролем на 22,1%. При использовании штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 урожайность озимой пшеницы повысилась более чем в два раза по сравнению с инфицированным контролем. В варианте с применением штамма Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 также отмечают лучшую перезимовку растений озимой мягкой пшеницы, большую высоту растений и большее число зерен с колоса по сравнению с инфицированным и неинфицированным контролями.
Таким образом, штамм Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3 обладает высокой способностью высвобождать фосфаты из нерастворимого минерального сырья. Штамм имеет широкий спектр действия против патогенных грибов и бактерий, подавляет 15 видов фитопатогенных грибов, в том числе Microdochium nivale при пониженных температурах. Предлагаемый штамм стимулирует рост растений, повышает урожайность. Штамм не токсичен для растений и животных и может быть использован для создания на его основе биофосфорного удобрения с фунгицидными и бактерицидными свойствами, а также для разработки антимикробных препаратов против грибных и бактериальных патогенов человека и животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Bacillus mojavensis Lhv-97, обладающий фунгицидной и бактерицидной активностью | 2017 |
|
RU2648163C1 |
| Штамм бактерий Pantoea agglomerans Ф19 для повышения урожайности зерновых культур | 2021 |
|
RU2757123C1 |
| ФОСФАТМОБИЛИЗУЮЩИЙ ШТАММ ПОЧВЕННЫХ БАКТЕРИЙ LELLIOTTIA NIMIPRESSURALIS CCM 32-3 И БИОПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ОПТИМИЗАЦИИ МИНЕРАЛЬНОГО ПИТАНИЯ РАСТЕНИЙ, СТИМУЛЯЦИИ ИХ РОСТА И ПОВЫШЕНИЯ УРОЖАЙНОСТИ | 2018 |
|
RU2676926C1 |
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ PSEUDOMONAS SPECIES 181a С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451069C1 |
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ ACINETOBACTER SPECIES С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451068C1 |
| УСКОРИТЕЛЬ РОСТА КОРНЕВОЙ СИСТЕМЫ РАСТЕНИЙ (ВАРИАНТЫ) | 2022 |
|
RU2800257C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS FLUORESCENS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ И БАКТЕРИЙ И СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ | 2016 |
|
RU2646160C2 |
| КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С БОЛЕЗНЯМИ РАСТЕНИЙ | 1995 |
|
RU2143199C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS CHLORORAPHIS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ И БАКТЕРИЙ И СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ | 2015 |
|
RU2588473C1 |
| ШТАММ БАКТЕРИЙ BACILLUS AMYLOLIQUEFACIENS, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ, И БИОЛОГИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ЗАЩИТЫ ЗЕРНОВЫХ РАСТЕНИЙ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ ГРИБАМИ | 2013 |
|
RU2528058C1 |
Изобретение относится к биотехнологии и может быть использовано для производства бифосфорного удобрения. Штамм Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, обладающий фунгицидной и бактерицидной активностью для защиты растений от болезней, вызываемых грибами и бактериями, депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером В-7427. Изобретение обеспечивает повышение урожайности сельскохозяйственных растений. 5 табл., 7 пр.
Фосфатрастворяющий штамм бактерий Pseudomonas chlororaphis ssp chlororaphis Vsk-26a3, обладающий фунгицидной и бактерицидной активностью, для защиты растений от болезней, вызываемых грибами и бактериями, депонированный в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером В-7427.
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ PSEUDOMONAS SPECIES 181a С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451069C1 |
| US 5900236 A, 04.05.1999 | |||
| ШТАММ БАКТЕРИЙ PSEUDOMONAS AUREOFACIENS ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА ПРОТИВ ЗАБОЛЕВАНИЙ ПШЕНИЦЫ, ВЫЗЫВАЕМЫХ ГРИБНЫМИ ФИТОПАТОГЕНАМИ | 2001 |
|
RU2203945C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS SPECIES ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА, ИСПОЛЬЗУЕМОГО ДЛЯ СТИМУЛЯЦИИ РОСТА И ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 1997 |
|
RU2130261C1 |
| МАСЛЕНКО Л.В., КУРИЛОВА Д.А., Разработка микробиологического метода снижения вредоносности фузариоза на сое.// Масличные культуры, научно-технический бюллетень ВНИИ масличных культур, 2012, вып.2, с.151-152. | |||
Авторы
Даты
2016-11-27—Публикация
2015-12-09—Подача