Область техники, к которой относится изобретение
Настоящее изобретение касается способа получения вакцинных антигенов, содержащих мембранный белок, а также вакцинных антигенов, вакцин и их применения.
Настоящее изобретение имеет промышленное применение в медицинской области, в частности, в области получения вакцин.
В приведенном ниже описании ссылки в скобках ([ ]) относятся к списку литературы, приведенному в конце текста.
УРОВЕНЬ ТЕХНИКИ
Вакцинация заключается в иммунизации человека или животного от инфекционного заболевания, как правило, путем введения вакцины человеку или животному. Вакцины, которые стимулируют иммунную систему, защищают человека или животное от инфекции или заболевания.
Установлено, что вакцинация человека дает таким образом возможность бороться и ликвидировать потенциально смертельные инфекционные заболевания, при этом, по оценкам, предотвращается более чем 2-3 миллиона смертей в год. Это одна из самых прибыльных инвестиций в сфере здравоохранения.
Вакцина представляет собой антигенный препарат, который дает возможность индуцировать у вакцинированного человека или животного иммунный ответ, специфичный к возбудителю заболевания и способный защитить их от естественной инфекции или смягчить её последствия.
Грипп – распространенная вирусная респираторная инфекция, которая наблюдается во всем мире и проявляется в виде эпидемических вспышек зимой в зоне умеренного климата из-за вирусов гриппа. Всемирная организация здравоохранения (ВОЗ) считает, что они вызывают от 3 до 5 миллионов серьезных случаев и от 250 000 до 500 000 смертей в год по всему миру (http://www.pasteur.fr/fr/institut-pasteur/presse/fiches-info/grippe#sthash.PwUNmJ10.dpuf). Вирусы гриппа, ответственные за заболевания у людей, представлены вирусами гриппа типа A и B. В то время, как вирусы гриппа типа B циркулируют в виде линий, вирусы гриппа типа A разбиваются на подтипы вируса по антигенным свойствам двух основных поверхностных гликопротеинов, гемагглютинина (HA) и нейраминидазы (NA). Вирусы гриппа содержат от 300 до 800 гликопротеинов на своей поверхности при таком соотношении NA/HA, которое может варьироваться от одного до десяти.
Вирусы, циркулирующие у людей и ответственные за сезонные эпидемии, представлены вирусами A (H1N1) и A (H3N2). Поскольку основным резервуаром вирусов гриппа являются животные (птицы и свиньи), то вирусы животных могут пересекать видовой барьер и заражать людей. Такие вирусы, как вирус птичьего гриппа A (H5N1) и пандемический вирус A (H1N1), могут вызывать серьезные проблемы в здравоохранении.
Фактически на данный момент единственным эффективным средством защиты населения от вирусов гриппа является вакцинация. “Сезонная” вакцина дает возможность приобрести иммунитет от сезонных циркулирующих вирусов A типа (H1N1) и (H3N2) и различных линий вируса B. Она определяется каждый год на основе штаммов-прототипов предыдущего года и содержит антигены сезонных вирусов типа A и типа B. Иммунный ответ организма в основном относится к гуморальному типу с экспрессией нейтрализующих антител, направленных против белков HA и NA у вирусов.
Из-за значительного сдвига антигенов у этих двух белков состав вакцины необходимо ежегодно пересматривать.
Традиционный процесс получения вакцин основывается, во-первых, на получении, посредством генетической рекомбинации между штаммом A/PR8/34 (H1N1) и сезонными штаммами вируса, посевного материала вакцины на яйцах для каждого из ежегодных штаммов прототипа A, определяемых ВОЗ. Большинство производителей вакцин обычно используют эти реассортантные вирусы, происходящие главным образом из исходного вируса A/PR/8/34. Таким образом, посевной материал каждой вакцины происходит из процесса генетического реассортмента между прототипичным штаммом A и вирусом A/PR8/34 (H1N1), который обладает оптимальной способностью к репликации в яйцах. Получение этого вируса типа B осуществляется непосредственно на яйцах без реассортмента с PR8.
Вирусные частицы содержат восемь отдельных генных сегментов, состоящих из одноцепочечной РНК, соединенной с нуклеопротеидами и связанной с полимеразным комплексом, причем каждый из генов кодирует от одного до трех данных белков вируса: HA, NA, M1, M2, NP, NS1 , NEP, PB1, PB1F2, PB1N40, PB2 и PA. Поэтому длительный процесс отбора дает возможность получить реассортмент вакцин, содержащих по крайней мере сегменты гена, кодирующие HA и NA прототипичного штамма на генетическом фоне вируса PR8 (состав «6+2»). Затем 2 реассортанта вакцины, полученные в результате генетического реассортмента между двумя прототипичными штаммами и исходным штаммом A/PR/8/34, размножают на яйцах. Из аллантоисной продукции экстрагируют антигены HA и NA и необязательно объединяют их с адъювантами для получения доз вакцины.
Этот промышленный способ получения доз вакцины является длительным (от 4 до 6 месяцев). Однако, при производстве препандемических вакцин, в частности, против человеческого гриппа, по оценкам ВОЗ, придется вакцинировать примерно 1 миллиард людей, чтобы реализовать план борьбы с пандемией гриппа. Фактически такой план борьбы будет частично зависеть от эффективности массового и быстрого производства вакцин.
Чтобы справиться с все возрастающим спросом на вакцины против сезонных циркулирующих штаммов, а также спросом, который трудно предсказать – на вакцины против одного (или нескольких) потенциально пандемических возникающих штаммов, лимитирующим фактором может оказаться наличие яиц, тем более, что сохраняется риск пандемии птичьего гриппа в животноводстве. Однако существует постоянная трудность получения хорошего выхода штаммов B в яйцах, а также некоторых реассортантов типа A, у которых не 6+2, а 5+3 или 4+4.
Так, чтобы сократить время между выбором циркулирующих штаммов прототипа и получением доз вакцины, были разработаны альтернативные стратегии. Вирусы гриппа можно продуцировать и в клеточных системах (Barrett PN, Portsmouth D, Ehrlich HJ. Developing cell culture-derived pandemic vaccines. Curr Opin Mol Ther. 2010 Feb; 12(1):21-30 ([1]); Le Ru A, Jacob D, Transfiguracion J, Ansorge S, Henry O, Kamen AA. Scalable production of influenza virus in HEK-293 cells for efficient vaccine manufacturing. Vaccine 2010 May 7; 28(21):3661-71 ([2])). Производство вакцинных штаммов, а также их размножение может осуществляться на клетках с использованием промышленных биореакторов. Действительно, использование клеточных линий для размножения вакцинных штаммов дает возможность, среди прочего, больше не зависеть от “яичной” системы (недостаточное количество яиц и выход продукции, чтобы справиться с пандемией), уменьшает регулярно наблюдаемые модификации поверхностных антигенов при аллантоисном получении и не вызывает аллергии. Эта стратегия дает возможность более легко удовлетворить потребности в вакцинах при появлении пандемического вируса гриппа (например, A H1N1).
Тем не менее, эти системы, в частности, зарегистрированные клеточные линии (MDCK, Vero, PERC6, EB66 и др.) не способствуют оптимальной репликации вирусов гриппа, что является главным ограничительным фактором с точки зрения производства посевного материала вакцин. Продуктивность в клеточных системах по-прежнему ниже, чем в аллантоисной системе. Поэтому в настоящее время лишь немногие производители выбрали этот новый метод производства, поскольку промышленный процесс далеко не столь эффективен, как яйца в данный момент.
Для того чтобы как можно больше сократить время производства доз вакцины и с целью получения эквивалентного выхода с точки зрения количества доз, получение посевного материала вакцин может осуществляться методами обратной генетики, что дает возможность более быстро получать реассортантов для вакцин состава “6+2”, тем самым устраняя все стадии отбора. Получение рекомбинированных вирусов методами обратной генетики обеспечивает наиболее реальную альтернативу для эффективного удовлетворения потребности в вакцинах. Во-вторых, получение рекомбинированных вирусов методами обратной генетики дает возможность получать “оптимизированный” вирус PR8, что позволяет, при использовании его в процессе генетического реассортмента с прототипичными штаммами, получать реассортанты для вакцин с оптимизированными характеристиками вируса для производства доз вакцины в яйцах или в клетках. Такой способ может применяться и для производства в клетках.
Другая стратегия оптимизации производства вакцин в аллантоисных и клеточных системах направлена на повышение выхода вирусной продукции на основе генетических модификаций посевного материала вакцин и/или с помощью специальных небольших химических молекул, направленных на клетки хозяина. Такие способы проходят оценку (FR 10/55716 ([3]), WO 2012007380 ([4]), FR 10/59132 ([5]), WO 2012059696 ([6])).
Другая стратегия заключается в повышении эффективности вакцинных антигенов добавлением адъювантов, что дает возможность получать больше доз вакцины при одном и том же ограниченном количестве яиц и одном и том же количестве произведенных гликопротеинов (Ellebedy AH, Webby RJ. Influenza vaccines. Vaccine 2009 Nov 5; 27 Suppl 4:D65-8 ([7])). Этот способ больше подходит для людей с недостаточностью иммунной системы. Более того, общественное мнение довольно плохо относится к применению адъювантов.
Наконец, еще одна стратегия заключается в оптимизации стадии экстрагирования вакцинных антигенов (“расщепления”) дальше по ходу производственного процесса: целью является получение лучшей и большей экстракции вакцинных антигенов при более эффективном сохранении их конформационной структуры и тем самым их антигенных свойств, от которых непосредственно зависит защитная сила вакцины.
В частности, вирусная продукция, полученная с помощью инфицированных содержащих эмбрионы куриных яиц (сбор аллантоисной жидкости) или с использованием культуры инфицированных клеток в биореакторе (сбор культуральной среды), проходит очистку на градиенте сахарозы, а затем инактивируется путем химической обработки (предпочтительно формалином, чтобы в соответствии с инструкциями титр вируса упал на 15 log-единиц). После этого способ включает применение детергента, который должен разрушить/фрагментировать (“разрушение/фрагментация”) вирусные частицы (“расщепление вирионов”), и очистку вакцинных антигенов посредством диафильтрации.
Фрагментация или расщепление вируса сочетается с частичной или полной солюбилизацией вирусных белков, при этом изменяется (инфекционная) целостность и функция вирусов. Фрагментация также составляет способ инактивации, дополняющий химический метод, при этом применяется термин ортогональная инактивация.
Фрагментация может осуществляться путем обработки очищенных вирусов различными детергентами, в частности, неионными и ионными (напр., катионными) ПАВ (поверхностно-активными веществами), такими как: алкилгликозиды, алкилтиогликозиды, ацилсахариды, сульфобетаины, бетаины, полиоксиметиленалкиловые эфиры, N,N-диалкилглюкамиды, hecameg, алкилфенокси-полиэтоксиэтанолы, четвертичные аммониевые соединения, саркозил, CTABs (цетилтриметиламмония бромиды), три-N-бутилфосфат, цетавлон, миристилтриметиламмониевые соли, липофектин, липофектамин, DOT-MA (додецилтриметиламмония бромид), октил- или нонилфеноксиполиоксиэтанолы (напр., Triton X-100 или Triton NI 01), эфиры полиоксиметиленсорбитана (детергенты Tween), полиоксиэтиленовые эфиры, этиловый эфир, полисорбат 80, дезоксихолат, Tergitol® NP9 и др.
В этом отношении известны разнообразные методы фрагментации (расщепления) вирусов гриппа. В документе WO 02/28422 ([8]) описан, к примеру, способ фрагментации с помощью фрагментирующего реагента из числа лаурета 9, NaDOC, саркозиловой группы, Tween 80™ и Triton X100. В документе WO 02/067983 ([9]), с другой стороны, описан способ фрагментации с помощью дезоксихолата натрия.
Поверхностно-активные вещества (или детергенты) представляют собой амфифильные молекулы, состоящие из очень различных полярных и неполярных доменов и обладающие заметной растворимостью в воде. За пределами точной концентрации, называемой критической концентрацией мицеллообразования (CMC), феномен мицеллообразования определяется гидрофобным эффектом (M. Rosen, “Surfactants and Interfacial Phenomena”, 3rd Ed., Hoboken: John Wiley & Sons, Inc., 2004 ([10])).
На химические свойства мономеров ПАВ и их самосборку в водных растворах (CMC, степень агрегации, размер и характер геометрической формы агрегатов) влияет природа гидрофобного хвоста, его длина, степень ненасыщенности и ветвления, наличие или отсутствие ароматических ядер и количество цепей. Характер гидрофильной группы (нейтральная или заряженная, небольшая или объемная) оказывает сильное влияние на свойства ПАВ и их биологическое применение.
Поверхностно-активные вещества подразделяются на три основных семейства в зависимости от природы гидрофильной части (A.M. Schwartz, J.W. Perry, J. Berch, “Surface Active Agents and Detergents”, vol II, R. Krieger Pub. Co., New York, 1977 ([11])): ионные (катионные или анионные) ПАВ, цвиттерионные (или амфотерные) ПАВ и нейтральные ПАВ. Они часто приводятся как мягкие либо жесткие. Детергенты можно расположить по порядку от самых жестких до самых мягких в следующем порядке: ионные > амфотерные > нейтральные. Ионные детергенты типа CTAB обычно являются денатурирующими. Они разрушают внутримолекулярные кулоновские взаимодействия в белках и тем самым дезорганизуют их трехмерную конформацию.
Цвиттерионные ПАВ (сульфобетаины, бетаины) содержат в своей гидрофильной части и положительный заряд, и отрицательный заряд, поэтому они электрически нейтральны.
Нейтральные ПАВ, в особенности алкилглюкозиды и полиоксиметиленалкиловые эфиры, характеризуются незаряженными гидрофильными головками. Они представляют собой мягкие и не денатурирующие ПАВ, которые, однако, нарушают белок-липидные
и липид-липидные взаимодействия, но не оказывают влияния на внутримолекулярные кулоновские взаимодействия в белках.
В биохимии обычно применяются детергенты, содержащие гидрофильную часть типа полиэтиленгликоля (Triton X100, Brij®, Tween и др.). Их недостаток состоит в том, что эти молекулы считаются химически гетерогенными с переменной степенью полимеризации n по группам ПЭГ (полиэтиленгликоля). Следовательно, эти представители коммерческих детергентов не являются такими, которые химически хорошо определены в растворе, что может привести к изменчивости их физико-химических свойств.
В нынешнем контексте возникновения пандемического патогенного вируса заражение, к примеру, заражение гриппом может привести к 1,3-2 млн. госпитализаций и от 280 000 до 650 000 смертей в одних лишь промышленно развитых странах (данные ВОЗ).
Таким образом, одной из главных экономических задач является способность уменьшить издержки при производстве доз вакцин (больше доз при производстве и/или сокращение времени на получение такого же количества доз).
В этом контексте и с экономической точки зрения закономерным является поиск
и разработка новых оптимизированных способов получения посевного материала для вакцин, в частности, в плане (i) повышения выхода продукции, (ii) сокращения времени и/или затрат, (iii) получения более иммуногенных антигенов.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является именно удовлетворение этих потребностей путем обеспечения такого способа получения вакцинного антигена, который дает возможность качественно и количественно оптимизировать стадию экстракции вакцинных антигенов, к примеру, антигенов вакцины против гриппа, в процессе промышленного производства, в частности, в клеточной или аллантоисной системе.
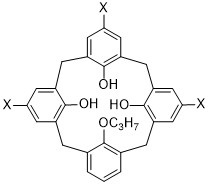
Так, заявитель показал, неожиданно и непредвиденно, что для фрагментации (расщепления) вируса может применяться каликсарен формулы (I), а предпочтительно каликсарен формулы (II), либо их фармацевтически приемлемые соли, в частности, взамен детергентов, которые обычно применяются для фрагментации мембран, например, Triton X100 или Tween 80.
Способ по изобретению, в частности, имеет преимущество в том, что он лучше сохраняет конформацию мембранных гликопротеинов типа поверхностных вакцинных антигенов. Настоящее изобретение, вне ожидания, позволяет лучше сохранять конформацию антигенов на стадии фрагментации, в частности, “расщепления” вирусов, чем по известным методикам.
В этом контексте его применение дает возможность получать такие вакцинные антигены, которые намного более эффективны с точки зрения иммуногенности, и тем самым уменьшать необходимое количество антигена в партиях вакцин для идентичной или сопоставимой защиты.
Кроме того, такие более эффективные антигены лучше сохраняются, что преимущественно дает возможность им служить полной или частичной альтернативой известным адъювантам. С другой стороны, каликсарены могут применяться в качестве адъювантов и/или эксципиентов в составе вакцины для улучшения свойств вакцинных антигенов.
В частности, изобретение дает возможность повысить качество и/или количество получаемых вакцинных антигенов по сравнению с традиционным применением молекул детергента Triton X100.
Применение изобретения можно адаптировать к различным существующим способам получения (яйца, т.е. аллантоисные системы, и клетки), а также и к другим вспомогательным способам оптимизации производства (приведенным выше), а также к разрабатываемым способам получения типа способов, включающих табачные листья, простейших, причем этот список не является ограничительным.
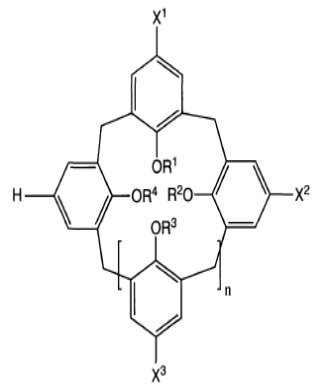
Так, в контексте настоящего изобретения описан способ получения вакцинного антигена, включающий стадию фрагментирования биологической мембраны, связанной с данным вакцинным антигеном, путем приведения данной биологической мембраны в контакт по меньшей мере с одним каликсареном формулы (I):
 (I)
(I)
где: n – целое число, равное 1, 3, 5 или 6;
R1, R2, R3 и R4 независимо друг от друга означают атом водорода; линейный или разветвленный (C1-C18)-алкил, необязательно замещенный одним или несколькими гетероатомами, выбранными из числа атомов О, S, N и P; линейный или разветвленный (C1-C18)-алкил, необязательно замещенный группой -COOR, где R означает линейный или разветвленный (C1-C4)-алкил; арил, содержащий от 6 до 20 атомов углерода;
X1, X2 and X3 независимо друг от друга означают группу -(CH2)m-COOR′ или -SO3 или -(CH2)mPO(OH)O или -(CH2)m-NR′3, где m – целое число от 0 до 20, а R′ означает атом водорода либо линейный или разветвленный (C1-C4)-алкил;
или с его фармацевтически приемлемой солью,
причем вакцинным антигеном не является антиген ВИЧ (вируса иммунодефицита человека) или антиген CMV (цитомегаловируса).
В целях настоящего изобретения термин “вакцинный антиген” служит для обозначения любых препаратов, содержащих по меньшей мере один мембранный белок, способный экспрессироваться вирусом. Вакцинный антиген также может содержать фрагмент биологической мембраны. При этом с биологической мембраной может быть связан мембранный белок. Под вакцинными антигенами также понимаются фрагменты биологических мембран, на которых сидят вакцинные антигены, например, на внутренней и/или внешней стороне биологической мембраны.
Вакцинный антиген преимущественно позволяет стимулировать иммунный ответ того человека или животного, которому он вводится, против вируса, экспрессирующего этот антиген, в частности, против мембранного белка. Вакцинный антиген может преимущественно способствовать полной или частичной иммунизации индивида против антигена, в частности, против мембранного белка.
В целях настоящего изобретения термин “мембранный белок” служит для обозначения белков, связанных с биологической мембраной, то есть либо закрепленных, либо встроенных, но не свободно диффундирующих в водных средах и нестабильных в этих средах. Среди мембранных белков можно упомянуть, к примеру, белки плазматической мембраны и белки внутриклеточных мембран (например, белки митохондриальных мембран, белки ретикулума, белки аппарата Гольджи, лизосомальные белки, причем этот список не является ограничивающим). Мембранные белки могут быть политопными или монотопными. Термин “политопные белки” служит для обозначения таких белков, которые пересекают мембрану один или несколько раз. Термин “монотопные белки” служит для обозначения таких белков, которые взаимодействуют только с одной стороной мембраны. Мембранные белки также могут быть интегральными или периферическими. Термин “интегральные белки” служит для обозначения таких монотопных или политопных белков, которые сильно взаимодействуют с мембраной, в частности, посредством гидрофобных взаимодействий. Эти белки также называют “внутренними белками”. Термин “периферические белки” служит для обозначения таких монотопных белков, которые слабо взаимодействуют с мембраной, то есть либо посредством электростатических связей, либо при помощи других мембранных белков. Эти белки также называют “внешними белками”.
Мембранный белок может представлять собой антигенный белок, экспрессируемый возбудителем инфекции, против которого желательна вакцинация. Это может быть белок вирусного или микробиологического происхождения. Иными словами, мембранный белок может представлять собой белок, кодируемый геномом возбудителя инфекции. В этом отношении возбудителем инфекции может быть вирус, в частности, оболочечный вирус. А если это вирус, то им может быть вирус дикого типа или рекомбинантный вирус любого типа штаммов, выбранных из группы, включающей:
– вирусы семейства Orthomyxoviridae, включая, в частности, вирусы гриппа, как-то вирусы гриппа млекопитающих, в частности, вирусы гриппа человека, вирусы гриппа свиней, вирусы гриппа лошадей, вирусы гриппа кошек, вирусы птичьего гриппа, как-то вирус гриппа лебедей;
– вирусы семейства Paramyxoviridae, включая респировирусы (Сендай, вирус парагриппа крупного рогатого скота 3, парагриппа 1 и 3 человека), рубулавирусы (парагриппа человека 2, 4, 4а, 4b, вирус свинки человека, парагриппа типа 5), авулавирусы (вирус болезни Ньюкасл (NDV)), пневмовирусы (респираторно-синцитиальные вирусы человека и крупного рогатого скота), метапневмовирусы (метапневмовирусы животных и человека), морбиливирусы (вирус кори, вирус чумки и вирус чумы крупного рогатого скота) и хенипавирусы (вирус Хендра, вирус нипа и др.);
– вирусы семейства Coronaviridae, включая, в частности, коронавирусы человека
(в частности, NL63, SARS-CoV, MERS-CoV) и коронавирусы животных (коронавирусы собак, свиней, коров и коронавирус инфекционного бронхита птиц),
– вирусы семейства Flaviviridae, включая, в частности, арбовирусы (вирус клещевого энцефалита), флавивирусы (вирус денге, вирус желтой лихорадки, вирус энцефалита Сент-Луис, вирус японского энцефалита, вирус Западного Нила, включая подтип Кунджин, вирус долины Муррей, вирус Rocio, вирус Ilhéus, вирус клещевого менингоэнцефалита), гепацивирусы (вирус гепатита C, вирус гепатита A, вирус гепатита B) и пестивирусы (вирус пограничной болезни, вирус диареи крупного рогатого скота, вирус лихорадки лебедей);
– вирусы семейства Rhabdoviridae, включая, в частности, везикуловирусы (вирус везикулярного стоматита), лиссавирусы (австралийский, европейский вирус летучих мышей, Лагос, вирус бешенства), эфемеровирусы (вирус эфемерной лихорадки крупного рогатого скота), новирабдовирусы (вирус змееголовых рыб, вирус геморрагической септицемии и вирус гематопоэтического некроза);
– вирусы семейства Togaviridae, включая, в частности, рубивирусы (вирус краснухи), альфавирусы (в частности, вирус Синдбис, вирус леса Семлики, вирус О'ньоньонга, вирус Чикунгунья, вирус Майаро, вирус реки Росса, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, вирус венесуэльского энцефалита лошадей);
– вирусы семейства Herpesviridae, включая, в частности, герпесвирусы человека (HSV-1, HSV-2, вирус ветряной оспы, вирус Эпштейна-Барра, цитомегаловирус, розеоловирус, HHV-7 и KSHV);
– вирусы семейства Poxviridae, включая, в частности, ортопоксвирусы (как-то, в частности, вирусы оспы верблюдов, коровьей оспы, оспы, вакцинии), карпипоксвирусы (включая, в частности, вирус оспы овец), авипоксвирусы (включая, в частности, вирус птичьей оспы), парапоксвирусы (включая, в частности, вирус бычьего папулезного стоматита) и лепорипоксвирусы (включая, в частности, вирус миксоматоза);
– вирусы семейства Retroviridae, включая, в частности, лентивирусы (включая, в частности, вирусы 1 и 2 иммунодефицита человека, кошек и обезьян, вирус козьего энцефалита или вирус болезни маеди-висна) и ретровирусы (включая, в частности, вирус саркомы Рауса, лимфотрофические вирусы 1, 2 и 3 человека);
причем этот список не является ограничительным. Это также может быть модифицированный, реассортантный или прототипичный вирус, получаемый в клеточной системе методами обратной генетики.
В частности, это может быть вирусный гликопротеин, такой как нейраминидаза или гемагглютинин, или мембранные белки M1 и M2, нуклеопротеин, неструктурный белок вируса гриппа (NS1) или, к примеру, белок слияния F парамиксовирусов или же любой другой вирусный белок, в частности, любой белок, связанный с мембраной приведенных выше вирусов. Это также может быть модифицированный вирусный белок, к примеру, мутантный белок слияния F, как описано в WO 2010/058100 ([26]) или WO 2010/058099 ([27]).
Если мембранный белок происходит из прокариотического возбудителя инфекции, то это может быть, к примеру, антиген из числа наружного поверхностного мембранного антигена пертактина из Salmonella и антигена пертактина Bordetella pertussis, причем этот список не является ограничительным.
В целях настоящего изобретения термин “биологическая мембрана” служит для обозначения любой сборки молекул типа двойного листа, отделяющего клетку от её окружения, состоящей из бислоя амфифильных липидов, в частности фосфолипидов, причем каждый мембранный липид состоит из гидрофильной полярной головки, направленной наружу от мембраны, и гидрофобного хвоста, направленного внутрь. Это может быть мембрана прокариотической клетки, эукариотической, животной или растительной клетки или вируса.
Например, это может быть везикулярная мембрана, к примеру, мембрана VLP (вирусоподобной частицы), как описано, к примеру, в документах WO 2007/132790 ([29]), WO 1999/036085 ([30]), WO 2005/058357 ([31]) или WO 2008/092153 ([32]), мембрана лизосом, экзосом или протеолипосом, мембрана эндоплазматического ретикулума или мембрана аппарата Гольджи, причем этот список не является ограничительным.
В случае мембран эукариотических клеток это может быть везикулярная мембрана, мембрана шероховатого эндоплазматического ретикулума, мембрана аппарата Гольджи, мембрана гладкого эндоплазматического ретикулума или плазматическая мембрана, причем этот список не является ограничительным. Это могут быть выделенные трансгенные клетки хозяина, происходящие из клеточной линии, в которой экспрессируется один или несколько вакцинных антигенов, к примеру, методами генной инженерии типа рекомбинантной ДНК или РНК или путем инфицирования клеток вирусным вектором, экспрессирующим один или несколько нужных вакцинных антигенов. Можно использовать любые методы генной инженерии, известные специалистам в данной области, которые дают возможность экспрессировать трансгены в клетках. Они могут включать методы, включающие экспрессию ДНК или РНК, к примеру, синтетической кодирующей мРНК, введенной в клетки посредством трансдукции, например, посредством электропорации, микроинъекции, ультразвука, инфекции или трансфекции. Экспрессия может быть, к примеру, краткосрочной и/или индуцируемой и/или конститутивной, по меньшей мере одного представляющего интерес антигена, к примеру, описанного в документе WO 02090533 ([33]). Клетки могут представлять собой любые клетки, в частности, за исключением эмбриональных стволовых клеток человека, к примеру, выделенные клетки человека – за исключением, к примеру, эмбриональных стволовых клеток человека, или же выделенные клетки другого животного или растения. Выделенные клетки могут происходить из клеточной линии, выбранной из числа Vero (ATCC No. CCL-81) типа Vero 76 (ATCC No. CRL-1587), CHO типа CHO-Kl (CCL-61, ATCC), BHK типа BHK-21 [C-13] (ATCC® CCL-10™), HELA, perC6® (Crucell), HEK293 (ATCC® CRL-1573™), Sf9 (ATCC, CRL-1711), EBx® (Valneva/Vivalis, описана в документе WO 2008/129058 ([12])), MDCK, к примеру, MDCK (NBL-2) (ATCC® CCL-34™), причем этот список не является ограничительным. В случае клеток, выделенных из клеточной линии, способ может включать следующие стадии:
– выделенные клетки инокулируют жидкостью, содержащей вирус,
– вирус размножается в клетках,
– размноженный при этом вирус собирают в супернатанте клеточной культуры,
– необязательно собранный при этом вирус подвергают инактивации,
– вирусную мембрану подвергают фрагментации.
С другой стороны, в случае клеток, выделенных из клеточной линии, способ по изобретению может включать следующие стадии:
– выделенные клетки инокулируют жидкостью, содержащей вирус,
– вирус размножается в клетках,
– собирают клетки, экспрессирующие антиген(ы) на своей поверхности,
– из клеток выделяют мембрану, к примеру, плазматическую мембрану, при помощи метода фракционирования мембран, например, путем разрушения клеток и последующего центрифугирования,
– мембрану подвергают фрагментации.
Или же:
– экспрессируют антиген(ы) в выделенных клетках при помощи метода генной инженерии,
– амплифицируют клетки, экспрессирующие антиген(ы),
– собирают клетки, экспрессирующие антиген(ы) на своей поверхности,
– из клеток выделяют мембрану, к примеру, плазматическую мембрану, при помощи метода фракционирования мембран, например, путем разрушения клеток и последующего центрифугирования,
– мембрану подвергают фрагментации.
С другой стороны, клетки могут происходить из содержащей эмбрионы аллантоисной системы. При этом такая содержащая эмбрионы система может происходить из любого вида животных, например, куриных яиц, или из аллантоисной системы любых других животных, в частности, птиц, которые пермиссивны для вирусов. Например, для получения содержащих эмбрионы куриных яиц, вырабатывающих мембранный белок, как определено выше, стадии могут быть следующими:
– вирус, к примеру, 200 мкл при концентрации 10-3 б.о.е./мл, инокулируют в аллантоисную жидкость яиц с 11-дневными эмбрионами от кур, выращенных в стерильной камере,
– эти яйца затем инкубируют два-три дня примерно при 33°C, за это время вирус накапливается в аллантоисной жидкости,
– яйца срезают и отсасывают аллантоисную жидкость, в которой концентрация возбудителей инфекции многократно возросла.
В случае вирусной мембраны это может быть оболочка, возникшая при почковании цитоплазматической или плазматической мембраны инфицированной клетки хозяина, в зависимости от вируса и/или вирусного происхождения экспрессируемых вакцинных антигенов. В этом случае оболочка представляет собой мембрану цитоплазматического или плазматического происхождения от инфицированной клетки, модифицированную экспрессией вирусных гликопротеинов, ассоциированных с этими мембранами во время почкования вируса, а липиды оболочки сами имеют клеточное происхождение. В этом случае это может быть мембрана того вируса, против которого желательна вакцинация и/или иммунизация.
В целях настоящего изобретения термин “каликсарен” служит для обозначения супрамолекулярного ПАВ семейства каликсарена. При этом каликсарены, используемые в изобретении, могут быть синтезированы любым способом, известным специалистам в данной области. Например, это может включать способ, описанный в документе WO 2009/144419 ([28]).
В целях настоящего изобретения термин “алкил” служит для обозначения насыщенного или ненасыщенного, линейного, разветвленного или циклического, необязательно замещенного радикала на углеродной основе, содержащего от 1 до 12 атомов углерода. Для примера можно привести радикалы метил, этил, пропил, бутил, изобутил, пентил, гексил, октил, нонил, децил, ундецил и додеканил и их разветвленные изомеры. Алкильная группа необязательно может быть замещена одним или несколькими гетероатомами из числа O, S, N и P.
Термин “арил” обычно обозначает циклический ароматический заместитель, содержащий от 6 до 20 атомов углерода. В контексте изобретения арильная группа может быть моноциклической или полициклической, которая необязательно замещена. В этом отношении можно упомянуть бензил или фенил.
В контексте настоящего изобретения термин “фармацевтически приемлемые соли” включает соли, полученные с нетоксичными кислотами или основаниями, в зависимости от заместителей, присутствующих в соединениях. Когда соединения по изобретению содержат кислотные функции, соответствующие соли могут быть получены добавлением органического или неорганического основания к соединению в нейтрализованном виде, необязательно в присутствии растворителя, который предпочтительно является инертным. Примерами солей с основаниями могут служить соли натрия, калия, кальция, аммония, аминов (органических) или магния. Когда соединения по изобретению содержат основные функции, соответствующие соли могут быть получены добавлением органической или неорганической кислоты, необязательно в растворителе, который предпочтительно является инертным. Примерами солей с неорганическими кислотами могут служить соли соляной кислоты, бромистоводородной кислоты, азотной кислоты, угольной кислоты, однозамещенной угольной кислоты, фосфорной кислоты, однозамещенной фосфорной кислоты, двузамещенной фосфорной кислоты, серной кислоты, однозамещенной серной кислоты или йодистоводородной кислоты. Примерами солей с органическими кислотами могут служить соли уксусной кислоты, пропионовой кислоты, изомасляной кислоты, малеиновой кислоты, малоновой кислоты, бензойной кислоты, янтарной кислоты, субериновой кислоты, фумаровой кислоты, молочной кислоты, миндальной кислоты, фталевой кислоты, бензолсульфоновой кислоты, пара-толуолсульфоновой кислоты, лимонной кислоты, винной кислоты или метансульфоновой кислоты.
В одном предпочтительном воплощении стадия фрагментации может проводиться с помощью по меньшей мере одного каликсарена формулы (I), в которой:
n – целое число, равное 1;
R1, R2, R3 и R4 независимо друг от друга означают атом водорода; либо линейный или разветвленный (C1-C18)-алкил;
X1, X2 and X3 независимо друг от друга означают группу -(CH2)m-COOR′ или -SO3Y или -(CH2)mPO(OH)OY или -(CH2)m-NR′3, где m – целое число от 0 до 20, а R′ означает атом водорода;
или его фармацевтически приемлемой соли.
Способ получения вакцинного антигена включает стадию фрагментирования биологической мембраны, связанной с данным вакцинным антигеном, путем приведения данной биологической мембраны в контакт по меньшей мере с одним каликсареном формулы (III):
OR4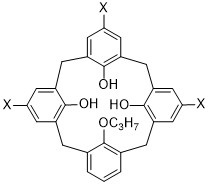 (III)
(III)
где: X означает группу -(CH2)o-CO2Y;
o – целое число от 1 до 3;
R4 означает линейный или разветвленный (C1-C4)-алкил; и
Y означает щелочной металл;
или с его фармацевтически приемлемой солью,
причем данный получаемый вакцинный антиген также включает фрагмент биологической мембраны, причем данный фрагмент связан с этим антигеном.
Предметом изобретения является способ получения вакцинного антигена, включающий стадию фрагментирования биологической мембраны, связанной с данным вакцинным антигеном, путем приведения данной биологической мембраны в контакт по меньшей мере с одним каликсареном формулы (II):
 (II)
(II)
где: X означает группу -(CH2)o-CO2Y;
o – целое число от 1 до 3; а
Y означает щелочной металл;
или с его фармацевтически приемлемой солью,
причем полученный вакцинный антиген также включает фрагмент биологической мембраны, причем данный фрагмент связан с этим антигеном, по которому проводится стадия фрагментирования.
В соответствии с одним предпочтительным воплощением изобретения o равно 1. В соответствии с этим предметом изобретения каликсарен называется CALX133ACE. В данном конкретном случае, когда каликсарен представляет собой CALX133ACE, способ изобретения и его применения могут включать, наряду с фрагментацией вышеописанных вакцинных антигенов, фрагментацию CMV и ВИЧ. В одном альтернативном воплощении вакцинным антигеном не является антиген ВИЧ (вируса иммунодефицита человека) или антиген CMV (цитомегаловируса).
Преимущественно применение в способе каликсаренов, в частности, каликсаренов формулы (III), в особенности CALX133ACE, обеспечивает оптимальную сохранность конформации вакцинного антигена, например, путем сохранения вакцинного антигена в своей конформации во фрагментируемой вирусной мембране. Преимущественно тот факт, что вакцинный антиген, получаемый способом по изобретению, содержит фрагмент биологической мембраны, причем данный фрагмент связан с вакцинным антигеном, способствует оптимальному сохранению конформации вакцинного антигена. Преимущественно сохранение конформации вирусного антигена по изобретению способствует большей эффективности, в частности, эффективности в качестве вакцины, вирусного антигена, фрагментированного способом по изобретению, по сравнению со способами фрагментирования предшествующего уровня техники, в частности, с помощью детергентов.
В целях настоящего изобретения термин “щелочной металл” служит для обозначения любых щелочных металлов, к примеру, из числа натриевых солей, калиевых солей, аммониевых солей, солей (органических) аминов или солей магния.
В одном предпочтительном воплощении o равно 1 и/или Y означает натрий.
Преимущественно каликсарены, используемые в настоящем изобретении, обеспечивают лучшую сохранность конформации мембранных гликопротеинов типа вакцинных поверхностных антигенов по сравнению с другими поверхностно-активными веществами, в частности, Triton X100 и дезоксихолатом. При этом их применение дает возможность особенно выгодно получать такие вакцинные антигены, которые намного более эффективны с точки зрения иммуногенности и тем самым снижать количество антигенов, необходимых для идентичной защиты в сериях вакцин. Кроме того, эти антигены, которые более эффективны, так как они лучше сохраняются, могли бы, в одном предпочтительном воплощении изобретения, оказаться полной или частичной альтернативой адъювантам.
В целях настоящего изобретения термин “фрагментация биологической мембраны” служит для обозначения любой декомплексификации всей мембраны на мембранные фрагменты. Преимущественно фрагментация (которая также называется расщеплением) биологической мембраны дает возможность получить фрагменты биологической мембраны, содержащие мембранные белки. Преимущественно сохранение мембранных белков способом изобретения во фрагментах биологической мембраны, иными словами, в мембранном окружении, дает возможность сохранять конформацию мембранных белков и получать вакцинные антигены, которые намного более эффективны с точки зрения иммуногенности, чем способами предшествующего уровня техники.
Стадия контактирования может проводиться при рН от 5,5 до 10, предпочтительно от 6 до 9, к примеру, примерно 7,95. Стадия фрагментирования может проводиться при температуре от 0 до 100°C, предпочтительно от 4 до 25°C, в частности, при 4°C. На стадии фрагментации можно использовать концентрации каликсарена, к примеру, CALX133ACE, в пределах от 10-6 до 10-2 М.
Стадия фрагментирования может проводиться с каликсаренами в растворе или с каликсаренами в виде коллоидных агрегатов из-за их поверхностно-активных свойств. В целях настоящего изобретения термин “коллоидный агрегат” служит для обозначения агрегатов от нескольких десятков до нескольких сотен молекул каликсарена, которые организуются в соответствии с силами отталкивания в отношении растворителя. С учетом их природы каликсарены, к примеру, CALX133ACE, способны образовывать агрегаты в соответствующей среде, к примеру, в воде, водном растворе, в изотонической среде или в биологической среде.
Агрегаты предпочтительно находятся в виде мицелл. Термин “мицеллы” обозначает сфероидальные агрегаты молекул каликсарена формулы (I), которые организуются в зависимости от используемого растворителя. Например, в воде или водном растворителе липофильные концы обращены внутрь мицеллы, а гидрофильные концы образуют границу раздела мицеллы с растворителем. В органическом растворителе, например, в масле, компоновка меняется на обратную. Термин “липосомы” обозначает небольшие пузырьки искусственного происхождения, состоящие, в частности, из полосок фосфолипидов, отделенных друг от друга водными компартментами. Они могут иметь структуру, очень близкую к структуре клеточных мембран. В контексте настоящего изобретения термин “наночастицы” означает совокупность от нескольких сотен до нескольких тысяч молекул каликсарена формулы (I), в результате чего получается объект, у которого по меньшей мере один из размеров измеряется нанометрами, к примеру, от 1 до 300 нм. В способе по изобретению стадия приведения водной суспензии, содержащей экстрагируемый мембранный белок, в контакт с каликсареном формулы (I), необязательно может осуществляться в присутствии по меньшей мере еще одного растворенного вещества, выбранного из группы, включающей:
i) органические и неорганические соли, выбранные из группы, включающей фармацевтически приемлемые соли;
ii) небольшие биоактивные молекулы, выбранные из группы аминокислот, витаминов, липидов, стероидов, углеводов или метаболитов;
iii) олигомерные биоактивные молекулы, выбранные из группы пептидов, олигонуклеотидов и олигосахаридов;
iv) полимерные биологические молекулы, выбранные из группы белков, полинуклеотидов и полисахаридов.
В соответствии с одним воплощением изобретения, стадии контактирования может предшествовать стадия, на которой:
– экстрагируемый мембранный белок или содержащую его мембранную фракцию растворяют в буферном растворе и
– добавляют каликсарен формулы (I) в соответствии с условиями температуры, pH и концентрации, описанными выше.
В соответствии с одним воплощением изобретения, за стадией контактирования может следовать стадия центрифугирования, дающая возможность отделить мембранные белки в комплексе с каликсаренами формулы (I) от некомплексированных мембранных белков.
Мембранные белки в комплексе с каликсаренами формулы (I) можно отделить от некомплексированных мембранных белков центрифугированием, к примеру, в течение 1 ч при 4°C со скоростью 100 000 g. Условия центрифугирования будут зависеть от природы белка. Специалистам должно быть известно, как выбрать оптимальные условия центрифугирования, например, описанные в Lenoir G., Menguy T., Corre F., Montigny C., Pedersen P.A., Thinès D., le Maire M., and Falson P. (2002) Overproduction in yeast and rapid and efficient purification of the rabbit SERCAIa Ca2+-ATPase. Biochim. Biophys. Acta 1560, 67-83 ([13]).
Целесообразно, чтобы стадии фрагментирования предшествовала и/или за нею следовала стадия инактивации любым способом, известным в данной области, например, с помощью формальдегида, бета-пропионолактона, облучением ультрафиолетом или инактивацией формалином, необязательно с последующей или предшествующей стадией частичной очистки, к примеру, ультрацентрифугированием, как описано в документах US 2009/0060950 ([14]) и US 6 048 537 ([15]).
Способ по изобретению может подпадать под любые традиционные промышленные процессы производства вакцинных антигенов, например, процессы, описанные в документах WO 2011/051235 ([16]), US 2011/0014230 ([17]), WO 2002/028426 ([18]), US 2009/0060950 ([14]), WO 02/067983 ([9]), US 4 206 014 ([19]), WO 2009/115917 ([20]) или WO 2005/113756 ([21]), путем замены соединения, используемого для фрагментирования (расщепления), каликсаренами формулы (I) или их солями.
В соответствии с одним воплощением, может проводиться стадия диафильтрации. Преимущественно это дает возможность удалить ПАВ или другие примеси. Эта стадия может выполняться любым способом, известным в данной области. Например, это может быть метод, выбранный из диализа, разбавления, замены буфера на колонке, энзиматического действия, применения полимеров, к примеру, Biobeads, в частности SM2 или Dowex, осаждения или метода, описанного Ollivon et al. (Ollivon M1, Lesieur S, Grabielle-Madelmont C, Paternostre M. Vesicle reconstitution from lipid-detergent mixed micelles. Biochim Biophys Acta 2000 Nov 23; 1508(1-2):34-50 ([25])); причем этот список не является исчерпывающим.
Предпочтительно может проводиться стадия стерилизации фильтрованием. Преимущественно эта стадия позволяет удалить еще больше примесей. Эта стадия может осуществляться любым способом, известным в данной области. Например, это может быть фильтрование, к примеру, через фильтрующую мембрану с порами размером менее 0,22 мкм.
В одном воплощении способ по изобретению также может включать стадию диализа указанного вакцинного антигена. Преимущественно эта стадия позволяет удалить еще больше примесей. Эта стадия может осуществляться любым способом, известным в данной области. Например, это может быть диализ через мембрану с пористостью менее 14000 дальтон.
В одном воплощении способ также может включать стадию концентрирования мембранного белка. Эта стадия может осуществляться любым способом, известным в данной области. Например, это может быть осаждение, к примеру, с помощью ПЭГ (полиэтиленгликоля) или сульфата аммония, выпаривание, применение концентраторов, к примеру, типа Amicon®, к примеру, Centricon® или Centriprep® (Merck Millipore).
Способ по изобретению также может включать любую стадию, известную в данной области при приготовлении вакцин, например, описанную в способах из документов WO 2011/051235 ([16]), US 2011/0014230 ([17]), WO 2002/028426 ([18]), US 2009/0060950 ([14]), WO 02/067983 ([9]), US 4 206 014 ([19]), WO 2009/115917 ([20]) или WO 2005/113756 ([21]).
Также описаны вакцинные антигены, которые могут быть получены при осуществлении описанного выше способа, например, при этом вакцинным антигеном не является антиген ВИЧ или антиген CMV.
Также описаны вакцины, содержащие вакцинные антигены, как описано выше, например, при этом вакцинным антигеном не является антиген ВИЧ или антиген CMV.
Вакцина может вводиться любым известным способом, подходящим для требуемой вакцинации, например, инъекцией, в частности подкожно, внутрикожно, внутримышечно, перорально, интраназально, транэпителиально, трансдермально, при помощи пластыря, мукоадгезивных таблеток, ректально, к примеру, при помощи свечей.
Вакцина может представлять собой вакцину с адъювантом типа Pandemrix® (GSK), Focetria® (Novartis) или Humenza® (Sanofi Pasteur) или же без адъюванта, типа трехвалентной Fluviral (GSK) или четырехвалентной Fluarix (GSK), Celvapan® (Baxter) или Vaxigrip® (Sanofi Pasteur), причем этот список не является ограничивающим. В этих примерах вирус заменяется вакцинным антигеном по изобретению. В случае вакцины с адъювантом таким адъювантом может быть любой адъювант, известный в данной области, который дает возможность усилить иммунный ответ, например, соли алюминия, лизолецитин, минеральные гели, гидроксид алюминия, микроэмульсии, липидные частицы или олигонуклеотиды.
Вакцина может содержать любой фармацевтически приемлемый носитель типа содержащихся в приведенных выше вакцинах или же стабилизирующие соли, растворители, осморегуляторы, загустители, окислительно-восстановительные соединения для поддержания физиологического окислительно-восстановительного потенциала, причем этот список не является ограничивающим.
Доза вакцины, предназначенная для человека, к примеру, может соответствовать объему 0,5 мл для инъекции.
Вакцина также может содержать каликсарен формулы (I), в частности, в виде эксципиента. В настоящем изобретении термин “эксципиент” служит для обозначения вещества, служащего для получения признанного эффекта. Он может выгодно придавать заданную конформацию или другие конкретные физические характеристики конечному продукту и в то же время предотвращать любые нежелательные взаимодействия, особенно химические взаимодействия, с активным ингредиентом. При этом количество каликсарена, который может присутствовать в вакцине, может составлять от 0,1 до 1000 мкг, к примеру, от 0,5 до 700 мкг или от 1 до 600 мкг или же от 5 до 500 мкг.
Другим предметом изобретения является применение каликсарена формулы (II) для получения вакцины или вакцинного антигена, как описано выше, например, при этом вакцинным антигеном не является вирусный антиген, как описано выше, за исключением антигенов ВИЧ или антигенов CMV. Также описано применение каликсарена формулы (I).
Другим предметом изобретения является вакцинный антиген или вакцина, как определено выше, для их применения в качестве лекарственного средства при лечении или профилактике инфекционного заболевания, например, при этом вакцинным антигеном не является антиген ВИЧ или антиген CMV. Инфекционное заболевание, к примеру, может представлять собой заболевание, вызванное одним или несколькими вирусами, выбранными из:
– вирусов семейства Orthomyxoviridae, включая, в частности, вирусы гриппа, как-то вирусы гриппа млекопитающих, в частности, вирусы гриппа человека, вирусы гриппа свиней, вирусы гриппа лошадей, вирусы гриппа кошек, вирусы птичьего гриппа, как-то вирус гриппа лебедей;
– вирусов семейства Paramyxoviridae, включая респировирусы (Сендай, вирус парагриппа крупного рогатого скота 3, парагриппа 1 и 3 человека), рубулавирусы (парагриппа человека 2, 4, 4а, 4b, вирус свинки человека, парагриппа типа 5), авулавирусы (вирус болезни Ньюкасл (NDV)), пневмовирусы (респираторно-синцитиальные вирусы человека и крупного рогатого скота), метапневмовирусы (метапневмовирусы животных и человека), морбиливирусы (вирус кори, вирус чумки и вирус чумы крупного рогатого скота) и хенипавирусы (вирус Хендра, вирус нипа и др.);
– вирусов семейства Coronaviridae, включая, в частности, коронавирусы человека
(в частности, NL63, SARS-CoV, MERS-CoV) и коронавирусы животных (коронавирусы собак, свиней, коров и коронавирус инфекционного бронхита птиц),
– вирусов семейства Flaviviridae, включая, в частности, арбовирусы (вирус клещевого энцефалита), флавивирусы (вирус денге, вирус желтой лихорадки, вирус энцефалита Сент-Луис, вирус японского энцефалита, вирус Западного Нила, включая подтип Кунджин, вирус долины Муррей, вирус Rocio, вирус Ilhéus, вирус клещевого менингоэнцефалита), гепацивирусы (вирус гепатита C, вирус гепатита A, вирус гепатита B) и пестивирусы (вирус пограничной болезни, вирус диареи крупного рогатого скота, вирус лихорадки лебедей);
– вирусов семейства Rhabdoviridae, включая, в частности, везикуловирусы (вирус везикулярного стоматита), лиссавирусы (австралийский, европейский вирус летучих мышей, Лагос, вирус бешенства), эфемеровирусы (вирус эфемерной лихорадки крупного рогатого скота), новирабдовирусы (вирус змееголовых рыб, вирус геморрагической септицемии и вирус гематопоэтического некроза);
– вирусов семейства Togaviridae, включая, в частности, рубивирусы (вирус краснухи), альфавирусы (в частности, вирус Синдбис, вирус леса Семлики, вирус О'ньоньонга, вирус Чикунгунья, вирус Майаро, вирус реки Росса, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, вирус венесуэльского энцефалита лошадей);
– вирусов семейства Herpesviridae, включая, в частности, герпесвирусы человека (HSV-1, HSV-2, вирус ветряной оспы, вирус Эпштейна-Барра, цитомегаловирус, розеоловирус, HHV-7 и KSHV);
– вирусов семейства Poxviridae, включая, в частности, ортопоксвирусы (как-то, в частности, вирусы оспы верблюдов, коровьей оспы, оспы, вакцинии), карпипоксвирусы (включая, в частности, вирус оспы овец), авипоксвирусы (включая, в частности, вирус птичьей оспы), парапоксвирусы (включая, в частности, вирус бычьего папулезного стоматита) и лепорипоксвирусы (включая, в частности, вирус миксоматоза);
– вирусов семейства Retroviridae, включая, в частности, лентивирусы (включая, в частности, вирусы 1 и 2 иммунодефицита человека, кошек и обезьян, вирус козьего энцефалита или вирус болезни маеди-висна) и ретровирусы (включая, в частности, вирус саркомы Рауса, лимфотрофические вирусы 1, 2 и 3 человека);
причем этот список не является ограничительным.
Например, в случае вируса гриппа вакцина может содержать один или несколько подтипов вируса гриппа A, выбранных из подтипов H1N1, H2N2, H3N2, H5N1, H7N7, H7N9, H1N2, H9N2, H7N2, H7N3 и H10N7 вируса человека, подтипов H1N1, H1N2, H3N1 и H3N2 вируса свиного гриппа, подтипов H7N7 и H3N8 вируса собачьего гриппа и гриппа лошадей или подтипов H5N1, H7N2, H1N7, H7N3, H13N6, H5N9, H11N6, H3N8, H9N2, H5N2, H4N8, H10N7, H2N2, H8N4, H14N5, H6N5 и H12N5 птичьего гриппа или любых других реассортантов вирусов человека и/или животных. С другой стороны, в случае вируса гриппа вакцина может содержать один или несколько выбранных подтипов вируса гриппа B человека, к примеру, линии, выбранной из линии Victoria и линии Yamagata. В случае вируса гриппа B имеются в виду, в частности, вакцинные штаммы B/Massachussetts/2/2012 или B/Brisbane/33/2008.
Другим предметом изобретения является применение каликсарена, как определено выше, в качестве адъюванта в вакцинах.
Каликсарены, определенные выше, могут применяться для их иммунологической активности, более предпочтительно иммуномодулирующей активности. В зависимости от субъекта, дозы, антигена и времени их введения они могут вызывать иммуностимуляцию.
В целях настоящего изобретения термин “адъювант” служит для обозначения вещества, которое при введении (проглатывании, вдыхании, инъекции и т.д.) вместе с антигеном стимулирует, активирует, продлевает, усиливает или модулирует иммунную систему, даже если это вещество само по себе не обладает антигенными свойствами.
В этом отношении количество каликсарена, который может присутствовать в вакцине, может составлять от 0,1 до 1000 мкг, к примеру, от 0,5 до 700 мкг или от 1 до 600 мкг или же от 5 до 500 мкг в общей массе вакцины.
В одном предпочтительном воплощении адъювант может добавляться в любые вакцины, к примеру, инактивированные или аттенуированные вакцины или во фрагментированные вакцины, независимо от используемого способа получения.
Другие преимущества могут стать очевидными специалистам в данной области при чтении приведенных ниже примеров, иллюстрируемых прилагаемыми фигурами, которые приводятся для иллюстрации.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена методика иммунизации CALX133ACE при введении мышам в D-42 (за 42 дня до заражения), D-21 (за 21 день до заражения), D0 (в день заражения и взятия образца крови), D4 (через 4 дня после заражения) и D14 (через 14 дней после заражения).
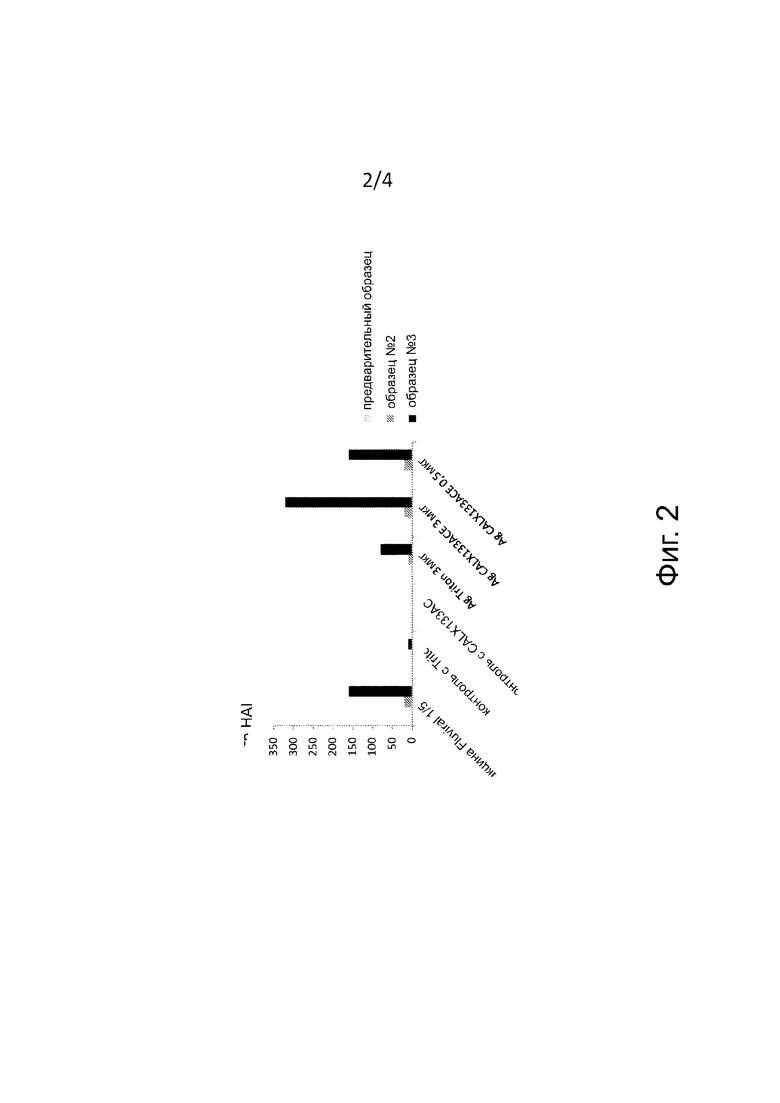
На фиг. 2 представлено измерение титра HAI (ингибирование гемагглютинации) в D-42 (“предварительный”), D-21 (“образец № 2”) и D0 (“образец № 3”) у мышей, инфицированных H1N1 pdm (103) и необязательно иммунизированных (слева направо): вакциной Fluviral® 1/5, отрицательный контроль с Triton X100, отрицательный контроль с CALX133ACE, 3 мкг антигена с Triton X100, 3 мкг антигена и 1 доза Triton X100, 3 мкг антигена с CALX133ACE и 0,5 мкг антигена с CALX133ACE.
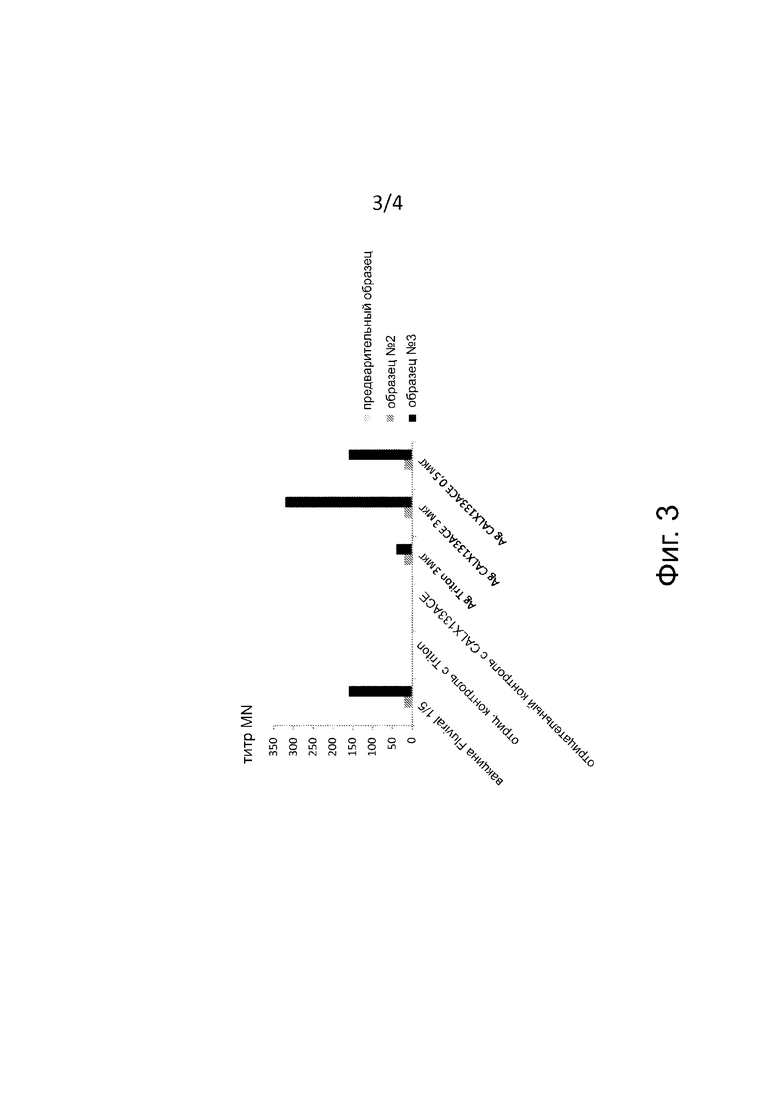
На фиг. 3 представлено измерение титра MN (микронейтрализация) в D-42 (“предварительный”), D-21 (“образец № 2”) и D0 (“образец № 3”) у мышей, инфицированных H1N1 pdm (103) и необязательно иммунизированных (слева направо): вакциной Fluviral® 1/5, отрицательный контроль с Triton X100, отрицательный контроль с CALX133ACE, 3 мкг антигена с Triton X100, 3 мкг антигена и 1 доза Triton X100, 3 мкг антигена с CALX133ACE и 0,5 мкг антигена с CALX133ACE.
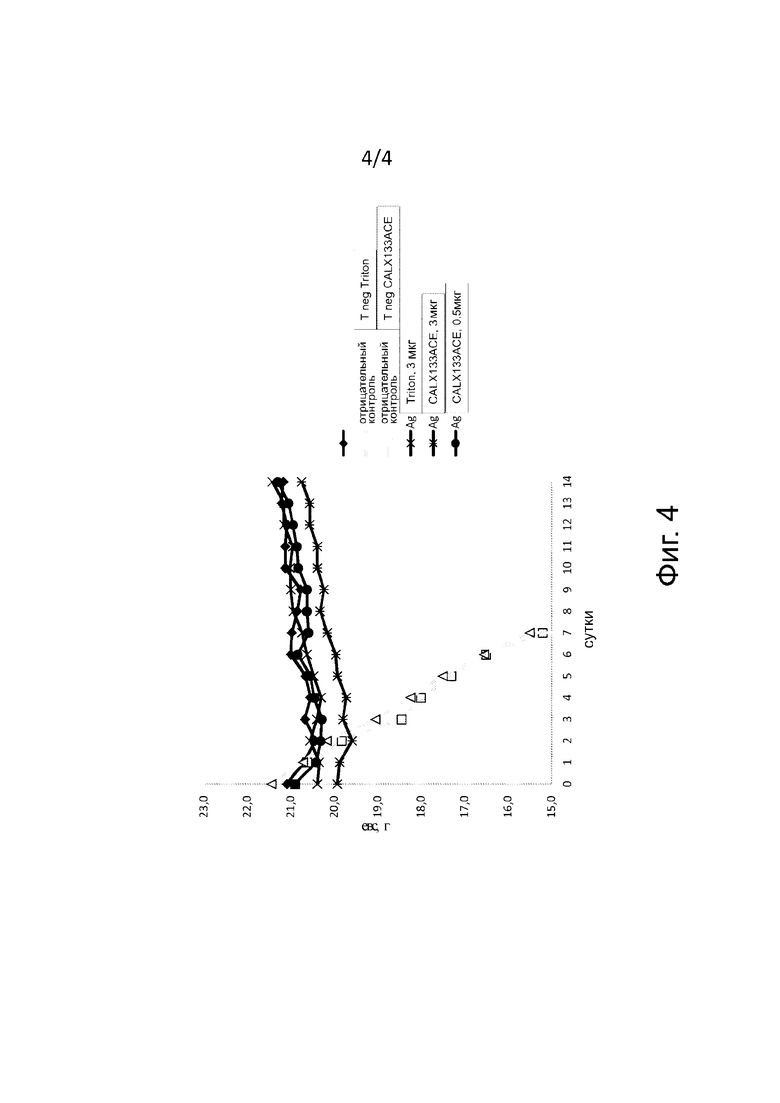
На фиг. 4 представлено измерение веса (в г) у мышей, иммунизированных и инфицированных H1N1 pdm (103 МЕ), от D0 до D14, для мышей, которым вводили: вакцину Fluviral®, доза 1/5 (ромбики), отрицательный контроль с Triton X100 (квадратики), отрицательный контроль с CALX133ACE (треугольнички), 3 мкг антигена, экстрагированного Triton X100 (крестики), 3 мкг антигена, экстрагированного CALX133ACE (звездочки), и 0,5 мкг антигена, экстрагированного CALX133ACE (кружочки).
Примеры
Пример 1. Методика экстрагирования вакцинных антигенов вируса гриппа с помощью молекул CALX133ACE и CALX1103ACE
Проводили оценку молекул CALX133ACE и CALX1103ACE (CALX1103ACE – это каликсарен, у которого R4 означает C10-алкил) на их способность экстрагировать вакцинные антигены вируса гриппа (полученного при производстве посевного материала вакцины X-179a, пандемический H1N1 2009 г.) и сравнивали их с детергентом, который используют производители вакцин (Triton X100), и двумя коммерческими детергентами (FC12 и C12E8). Проверяли несколько условий концентрации, рН и температуры при экстракции.
Количественную и качественную оценку экстракции вакцинных антигенов проводили с использованием стандартных промышленных тестов для измерения гемагглютинирующей активности (тест на гемагглютинацию: Hirst G.K. 1942. The quantitative determination of influenza virus and antibodies by means of red cell agglutination. J. Exp. Med. 75:47-64 ([22]) и Salk J.E. 1944. Simplified procedure for titrating hemagglutinating capacity of influenza virus and the corresponding antibody. J. Immunol. 49:87-98 ([23])) и количественного определения (SRID; A quantitative, single-radial-diffusion test for immunological studies with influenza virus. Schild GC, Henry-Aymard M, Pereira HG. J Gen Virol. 1972 Aug; 16(2):231-6 ([24])) экстрагированных антигенов.
Исследуемые условия представлены в табл. I.
Таблица I
соединение
PO4-буфера
После экстракции проводили диализ фрагментированных антигенов (супернатант SN и осадок после экстракции) против 1×PBS в традиционном процессе промышленного производства (к примеру [9], [18]), чтобы уменьшить концентрацию соли и детергента в продуктах экстракции. Каждую партию подвергали диализу таким же образом. Было установлено, что Triton X100 не полностью удаляется во время диализа. Однако оказалось, что молекула CALX133ACE хорошо диализуется, свидетельствуя о том, что она может присутствовать только в следовых количествах в возможном рыночном вакцинном продукте.
После диализа продукты экстракции разделяли на порции и титровали на предмет их гемагглютинирующей активности (HA). Данные представлены ниже в табл. II.
Таблица II
соединение
PO4-буфера
Результаты показали значительные титры гемагглютинации (HA) (512 и 1024, соответственно) для фрагментированных антигенов (SN), полученных после экстракции с помощью молекул CALX133ACE и CALX1103ACE в концентрации 1% в условиях при 4°C и pH = 7,95. Эти титры значительно выше, чем полученные для антигенов (SN), экстрагированных по традиционной методике с помощью Triton X100.
Эти результаты тем более значительны, поскольку: (i) полученные титры гемагглютинации зависят от используемой концентрации молекул CALX133ACE (0,1% против 1%) и (ii) титр HA у остатка неэкстрагированных антигенов (осадок) обратно пропорционален и меньше, чем с Triton X100. Важным параметром оказалась температура экстракции; температура 4°C оказалась оптимальной для экстракции вакцинных антигенов с помощью молекул CALX133ACE и CALX1103ACE.
Эти первые результаты четко показали, что молекулы CALX133ACE подходят для экстракции вакцинных антигенов гриппа из партий вируса, полученных в аллантоисной системе продукции, используемой производителями вакцин. Эти молекулы CALX133ACE и CALX1103ACE позволяют проводить экстракцию более эффективно, чем по стандартной методике с помощью Triton X100 с точки зрения качества (большее количество экстрагированных антигенов, более высокая активность гемагглютинации, естественный профиль олигомеризации антигенов).
Пример 2. Оптимизация фрагментации вакцинных антигенов и их количественное определение для проведения теста на эффективность на мышиной модели
Получение вируса проводили путем инокуляции содержащих 11-дневные эмбрионы куриных яиц вирусным инокулятом (посевным материалом) с последующим концентрированием и очисткой. Фрагментацию проводили в соответствии с традиционным промышленным методом с помощью Triton X100 (4%) в сравнении с использованием молекул CALX133ACE.
Качественное определение экстрагированных вакцинных антигенов проводили с помощью стандартного промышленного теста, который представляет собой измерение гемагглютинирующей активности данных вакцинных антигенов (активность главного антигена, гемагглютинина, т.е. титр, приведенный в UHA/50 мл). Количественное определение проводили по стандартной промышленной методике, которая также применяется органами по контролю за лекарственными средствами для проверки и выдачи разрешений на продажу партий вакцины: простая радиальная иммунодиффузия (SRID, величина HA в мг/мл). Наконец, количественное определение HA методом масс-спектрометрии iTRAQ дает возможность получить относительную количественную оценку между различными образцами, подлежащими сравнению при испытании на животных (величина HA в мг/мл).
Для фрагментации были выбраны следующие молекулы и условия:
– Triton X100 при 4% в течение 1 ч при 37°C,
– молекула CALX133ACE при 1% в течение 2 ч при 4°C.
Молекулы CALX133ACE не вызывают гемолиза эритроцитов в отсутствие антигенов гриппа во время теста на гемагглютинацию. Кроме того, эти молекулы поддаются диализу, а это означает, что CALX133ACE в образцах будет ограничиваться следовыми количествами.
Пример 3. Эксперименты на животных
В первом эксперименте получали несколько партий антигенов при оптимальных условиях получения, описанных выше, используя в качестве фрагментирующего реагента Triton X100 или молекулы CALX133ACE. Ниже в табл. III представлена сводка по фрагментированным материалам, использовавшимся для тестирования на животных.
Таблица III
по SRID
по iTRAQ
(мкл)
фрагменты от CALX133ACE,
C = 1,43
4% Triton X100
супернатант от CALX133ACE,
C = 0,93
1% CALX133ACE
В этом первом эксперименте планировалось проверить два количества антигенов HA для мембранных фрагментов (0,5 и 2,5 мкг) и только одно для супернатантов, полученных ультрацентрифугированием фрагментов. Для каждого условия иммунизировали по 12 мышей Balb/c дважды (в D0, а затем в D21) внутримышечно (в общем 100 мкл). У животных брали несколько проб крови в D0, D21, D42 и D63 (сердечные пункции и эвтаназия). После каждой серии проб крови собирали сыворотку из одной и той же группы и смешивали с тем, чтобы иметь достаточно материала для проведения теста на ингибирование гемагглютинации (HAI) в двух повторах, а также для теста на микронейтрализацию в двух повторах.
Полученные результаты приведены ниже в табл. IV.
Таблица IV
фрагменты, Triton X100,
0,5 мкг Ag
фрагменты, Triton X100,
2,5 мкг Ag
фрагменты, CALX133ACE, 0,5 мкг Ag
фрагменты, CALX133ACE, 2,5 мкг Ag
супернатант, Triton X100,
2,5 мкг Ag
супернатант, CALX133ACE, 2,5 мкг Ag
Эксперимент с антигенами, полученными при фрагментации с CALX133ACE, оправдал себя (хорошая переносимость у мышей, качество и количество полученных сывороток, надежность результатов HAI с достоверными (+) и (-) контролями).
Результаты по HAI и микронейтрализации согласуются друг с другом и показывают, что антиген во фрагментах, полученных при фрагментации с CALX133ACE, индуцирует значительный антительный ответ (образец № 3 и сердечная пункция), в отличие от антигенов, полученных при ультрацентрифугировании мембранных фрагментов (обозначаемых как “супернатант” в табл. III и IV), так как эти очищенные антигены больше не находятся в мембранном окружении, тем самым подтверждается правильность способа получения и фрагментации вакцинных антигенов с помощью молекул CALX133ACE в качественном и количественном отношении.
Кроме того, проявляется существенное отличие в пользу способа CALX133ACE в сравнении со способом Triton X100 в отношении вводимой дозы в 0,5 мкг (образец № 3 и сердечная пункция). Такая же тенденция проявляется и при дозе 2,5 мкг, но отличие по HAI не является значимым (образец № 3 и сердечная пункция).
Более того, оказалось, что антительный ответ, индуцированный при дозе 0,5 мкг антигенов, полученных способом CALX133ACE, аналогичен тому, который индуцируют 2,5 мкг антигенов, полученных способом Triton X100 (образец 3 и сердечная пункция). Последний результат важен для изобретения, поскольку он подчеркивает возможность получения антительного ответа при 5-кратно меньшем количестве антигенов, когда они получены с помощью молекул CALX133ACE.
Пример 4. Иммунизация мышей препаратами CALX133ACE: оценка защитной способности полученных вакцинных антигенов на мышах
Во втором эксперименте получали несколько партий антигенов при оптимальных условиях получения, описанных выше, используя в качестве фрагментирующего реагента Triton X100 или молекулы CALX133ACE. Ниже в табл. V представлена сводка по фрагментированным материалам, использовавшимся для этого второго эксперимента на животных. Планировалось дважды иммунизировать мышей Balb/c антигенными препаратами CALX133ACE или Triton X100, а затем инфицировать их штаммом A/H1N1 California/7/2009 (H1N1 pdm09) для проверки степени защиты у животных.
Группа 1: 12 мышей (положительный контроль), иммунизированных в/м (внутримышечно) 1/5 дозы Fluviral® (что соответствует 3 мкг антигена HA).
Группа 2: 12 мышей отрицательного контроля (“Ctrl”), иммунизированных в/м по методике Triton X100 без антигена (6 мышей) или по методике CALX133ACE без антигена (6 мышей).
Группа 3: 12 мышей, иммунизированных в/м с помощью 3 мкг препарата HA с Triton X100.
Группа 4: 12 мышей, иммунизированных в/м с помощью 3 мкг препарата НА с CALX133ACE.
Группа 5: 12 мышей, иммунизированных в/м с помощью 0,5 мкг препарата НА с CALX133ACE.
Методика иммунизации представлена на фиг. 1.
Ниже в табл. V представлена сводка по фрагментированным материалам, использовавшимся для этого тестирования.
Таблица V
по iTRAQ
по iTRAQ (мкг/мл)
на 1 мышь
(мкл)
или
0,022
T = 0,61
Мышей забивали в день D+4 (пик репликации вируса) и измеряли легочный титр вируса.
Легочные титры вируса у мышей, иммунизированных и инфицированных H1N1 pdm09 (103 МЕ), которые измеряли после эвтаназии в день D+4, представлены ниже в табл. VI.
Таблица VI
Triton X100
3 мкг Ag
3 мкг Ag
0,5 мкг Ag
* Только 1 иммунизация
У мышей Balb/c после интраназального инфицирования вирусом гриппа A H1N1 pdm09 (пандемический) по 103 МЕ/мышь отслеживали вес, который представлен на фиг. 4.
Измерение степени защиты по HAI
Тестировали следующие группы мышей:
– мыши, иммунизированные вакциной Fluviral® 1/5,
– мыши, иммунизированные только Triton X100,
– мыши, иммунизированные CALX133ACE,
– мыши, иммунизированные вирусным антигеном, полученным с помощью Triton X100, 3 мкг,
– мыши, иммунизированные вакцинным антигеном, экстрагированным с помощью CALX133ACE, 3 мкг,
– мыши, иммунизированные вакцинным антигеном, экстрагированным с помощью CALX133ACE, 0,5 мкг.
Этих мышей инфицировали H1N1 pdm (103).
Результаты определения HAI в сыворотках мышей, иммунизированных и инфицированных H1N1 pdm (103), приведены в табл. VII.
Таблица VII
Кол-во мышей
3 мкг Ag
3 мкг Ag
0,5 мкг Ag
Измерение степени защиты по HAI представлено на фиг. 2.
Измерение степени защиты по MN (микронейтрализация)
Тестировали следующие группы мышей:
– мыши, иммунизированные вакциной Fluviral® 1/5,
– мыши, иммунизированные только Triton X100,
– мыши, иммунизированные CALX133ACE,
– мыши, иммунизированные вирусным антигеном, полученным с помощью Triton X100, 3 мкг,
– мыши, иммунизированные вакцинным антигеном, экстрагированным с помощью CALX133ACE, 3 мкг,
– мыши, иммунизированные вакцинным антигеном, экстрагированным с помощью CALX133ACE, 0,5 мкг.
Этих мышей инфицировали H1N1 pdm (103).
Данные по определению MN в сыворотках мышей, иммунизированных и инфицированных H1N1 pdm (103), приведены ниже в табл. VIII.
Таблица VIII
Кол-во мышей
3 мкг Ag
3 мкг Ag
0,5 мкг Ag
Измерение степени защиты по MN представлено на фиг. 3.
Защищенность мышей
На фиг. 5 представлено измерение веса у мышей, иммунизированных и инфицированных H1N1 pdm (103 МЕ).
Во всех иммунизированных группах (Fluviral, Triton X100 и CALX133ACE) не отмечалось потери веса или смертности.
Погибли только мыши из 2 групп отрицательного контроля.
Выводы
Тесты на HAI и MN
Иммунизация столь же эффективна при 0,5 мкг антигена, обработанного CALX133ACE, как и при 3 мкг Fluviral®.
Иммунизация более эффективна при 3 мкг антигена, обработанного CALX133ACE, чем при 3 мкг антигена, обработанного Triton X100.
Степень защиты
Защита столь же эффективна при 0,5 мкг антигена, обработанного CALX133ACE, как и при 3 мкг Fluviral или 3 мкг антигена, обработанного Triton X100.
Библиография
1. Barrett PN, Portsmouth D, Ehrlich HJ. Developing cell culture-derived pandemic vaccines. Curr Opin Mol Ther. 2010 Feb; 12(1):21-30.
2. Le Ru A, Jacob D, Transfiguracion J, Ansorge S, Henry O, Kamen AA. Scalable production of influenza virus in HEK-293 cells for efficient vaccine manufacturing. Vaccine 2010 May 7; 28(21):3661-71.
3. FR 10/55716.
4. WO 2012/007380.
5. FR 10/59132.
6. WO 2012/059696.
7. Ellebedy AH, Webby RJ. Influenza vaccines. Vaccine 2009 Nov 5; 27 Suppl 4:D65-8.
8. WO 02/28422.
9. WO 02/067983.
10. M. Rosen. Surfactants and Interfacial Phenomena, 3rd Ed., Hoboken: John Wiley & Sons, Inc., 2004.
11. A.M. Schwartz, J.W. Perry, J. Berch. Surface Active Agents and Detergents, vol II, R. Krieger Pub. Co., New York, 197.
12. WO 2008/129058.
13. Lenoir, G., Menguy, T., Corre, F., Montigny, C , Pedersen, P. A.,Thinès, D., le Maire, M., and Falson, P. (2002) Overproduction in yeast and rapid and efficient purification of the rabbit SERCAIa Ca2+-ATPase. Biochim. Biophys. Acta 1560, 67-83.
14. US 2009/0060950.
15. US 6 048 537.
16. WO 2011/051235.
17. US 2011/0014230.
18. WO 2002/028426.
19. US 4 206 014.
20. WO 2009/115917.
21. WO 2005/113756.
22. Hirst, G.K. The quantitative determination of influenza virus and antibodies by means of red cell agglutination. J. Exp. Med. 75:47-64. 1942.
23. Salk, J.E. Simplified procedure for titrating hemagglutinating capacity of influenza virus and the corresponding antibody. J. Immunol. 49:87-98. 1944.
24. Schild GC, Henry-Aymard M, Pereira HG. SRID: A quantitative, single-radial-diffusion test for immunological studies with influenza virus. J Gen Virol. 1972 Aug; 16(2):231-6.
25. Ollivon M1, Lesieur S, Grabielle-Madelmont C, Paternostre M. Vesicle reconstitution from lipid-detergent mixed micelles. Biochim Biophys Acta 2000 Nov 23; 1508(1-2):34-50.
26. WO 2010/058100.
27. WO 2010/058099.
28. WO 2009/144419.
29. WO 2007/132790.
30. WO 1999/036085.
31. WO 2005/058357.
32. WO 2008/092153.
33. WO 02/090533.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕКТОР ДЛЯ ПЕРЕНОСА И ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 2007 |
|
RU2453603C2 |
| УЛУЧШЕННАЯ ВАКЦИНАЦИЯ ПРОТИВ ГРИППА | 2013 |
|
RU2599496C2 |
| ПРОТИВОГРИППОЗНАЯ ВАКЦИНА | 2011 |
|
RU2583297C2 |
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА ДЛЯ ВВЕДЕНИЯ ЧЕРЕЗ СЛИЗИСТУЮ И СПОСОБ ПРЕДОТВРАЩЕНИЯ ГРИППА | 2004 |
|
RU2390351C2 |
| БАКУЛОВИРУСНЫЙ ВЕКТОР И ЕГО ПРИМЕНЕНИЕ | 2007 |
|
RU2588464C2 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2523614C1 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2655627C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ПОПУЛЯЦИЯХ СУБЪЕКТОВ С ОСЛАБЛЕННЫМ ИММУНИТЕТОМ | 2013 |
|
RU2661408C2 |

Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения вакцинного антигена вируса гриппа, включающий стадию фрагментирования биологической мембраны, связанной с данным вакцинным антигеном путем приведения данной биологической мембраны в контакт по меньшей мере с одним каликсареном, где вирус гриппа выбран из вирусов гриппа A и вирусов гриппа B, дополнительно включающий стадию диализа вакцинного антигена; вакцину против вируса гриппа, включающую эффективное количество вакцинного антигена вируса гриппа, полученного способом, по любому из пп. 1-4, каликсарен формулы (II) в виде эксципиента в количестве от 0,1 до 1000 мкг от общей массы вакцины и фармацевтически приемлемый носитель; применение каликсарена формулы. Изобретение позволяет расширить спектр средств для получения вакцинных антигенов. 3 н. и 5 з.п. ф-лы, 4 ил., 8 табл., 5 пр.
1. Способ получения вакцинного антигена вируса гриппа, включающий стадию фрагментирования биологической мембраны, связанной с данным вакцинным антигеном путем приведения данной биологической мембраны в контакт по меньшей мере с одним каликсареном формулы (II):
 (II)
(II)
где:
X означает группу -(CH2)-CO2Y и
Y означает щелочной металл,
или с его фармацевтически приемлемой солью,
где полученный вакцинный антиген также включает фрагмент биологической мембраны, причем данный фрагмент связан с данным антигеном.
2. Способ по п. 1, где Y означает натрий.
3. Способ по п. 1, где вирус гриппа выбран из вирусов гриппа A и вирусов гриппа B.
4. Способ по любому из предшествующих пунктов, дополнительно включающий стадию диализа вакцинного антигена.
5. Вакцина против вируса гриппа, включающая эффективное количество вакцинного антигена вируса гриппа, полученного способом, по любому из пп. 1-4, каликсарен формулы (II) в виде эксципиента в количестве от 0,1 до 1000 мкг от общей массы вакцины и фармацевтически приемлемый носитель.
6. Вакцина по п. 5 для применения в качестве лекарственного средства при лечении или профилактике гриппа.
7. Применение каликсарена формулы (II):
 (II)
(II)
где:
X означает группу -(CH2)-CO2Y и
Y означает щелочной металл,
или с его фармацевтически приемлемой солью,
для получения вакцинного антигена вируса гриппа.
8. Применение по п. 7, где Y означает натрий.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| CORRADA GERACI ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Федорова О | |||
| А | |||
| "Супрамолекулярная химия", РХТУ им | |||
| Д | |||
| И | |||
| Менделеева, 2010 | |||
| Ротационный фильтр-пресс для отжатия торфяной массы, подвергшейся коагулированию, и т.п. работ | 1924 |
|
SU204A1 |
| Валитова и др.: "Влияние сульфонатных производных каликсаренов на физиологическое состояние корней пшеницы", Ученые записки Казанского университета, 2008, т.150, кн | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ударно-вращательная врубовая машина | 1922 |
|
SU126A1 |
Авторы
Даты
2019-10-15—Публикация
2015-08-28—Подача