Изобретение относится к иммунологии, медицине, фармакологии и может быть использовано для производства инактивированных гриппозных вакцин, которые могут применяться для вакцинации населения против гриппа.
В настоящее время для вакцинации против гриппа используется 2 типа вакцин: инактивированные вакцины и «живые» вакцины. В свою очередь инактивированные вакцины подразделяются на цельновирионные, расщепленные, субъединичные и виросомальные. Значительную часть на мировом рынке инактивированных вакцин занимают расщепленные вакцины. Это обусловлено тем, что эти вакцины обладают высокой иммуногенностью, как и цельновирионные вакцины, однако их реактогенность существенно ниже цельновирионных вакцин. Субъединичные вакцины обладают очень низкой реактогенностью, однако их иммуногенность уступает иммуногенности расщепленных гриппозных вакцин.
В настоящее время известны различные способы производства инактивированных вакцин против вируса гриппа.
Известен способ получения вируссодержащей субстанции путем культивирования вакцинных штаммов вируса гриппа в культуре клеток MDCK на питательной среде, очистку вирусной субстанции от балластных примесей, введение в очищенную субстанцию стабилизирующих добавок и сушку готовой формы вакцины (патент RU 2330885, опубл. 10.08.2008). Недостатком этого способа является невозможность получения антигена для создания вакцины в промышленном масштабе.
Известен способ получения антигенов для вакцины против вируса гриппа посредством получения неочищенного вирусного концентрата, очистку вирусного концентрата проводят методом гельфильтрации на носителе ДИОЛ-500, далее вирусный концентрат расщепляют детергентом β-октилглюкозидом, а выделение вакцинных антигенов проводят методом гель-фильтрации на носителе Сефадекс G-50 (патент RU 2283139, опубл. 10.09.2006). Недостатком указанного способа является недостаточная степень очистки антигена от овальбумина.
Наиболее близким аналогом заявленного изобретения является способ получения антигенов вируса гриппа, включающий заражение куриных эмбрионов вирусом гриппа, инкубацию эмбрионов, охлаждение эмбрионов, сбор вируссодержащей аллантоисной жидкости (ВАЖ), обработку ВАЖ с целью дезагрегации и последующей инактивации, микрофильтрацию ВАЖ, ультрафильтрацию ВАЖ и очистку вирусного концентрата (патент RU 2584594, опубл. 20.05.2016). Недостатком способа-прототипа является недостаточно полная очистка полученного антигена от яичного альбумина.
Задача, на решение которой направлено настоящее изобретение, заключается в разработке новой технологии получения антигена и\или антигенов вируса гриппа для производства российской инактивированной вакцины, которая позволит производить в нашей стране вакцину с мировым уровнем качества, требуемой степени очистки.
Технический результат предлагаемого изобретения заключается в разработке промышленного способа получения антигена и\или антигенов вируса гриппа высокой степени очистки для производства российской инактивированной вакцины, которую можно будет использовать для массовой вакцинации населения. Это достигается тем, что в предлагаемом способе дезагрегацию вирусов при обработке ВАЖ мы проводим хлористым натрием в конечной концентрации 0,23-0,30 Моля, инактивацию вирусной активности с использованием β-пропиолактона, очистку ВАЖ проводим методами микрофильтрации с использованием каскада из трех фильтров с диаметром пор 10 мкм, 1 мкм, 0,6 мкм и ультрафильтрации с пределом отсечения 300 кДа, последующее очищение - путем двойного ультрацентрифугирования в градиенте плотности сахарозы, последующую очистку антигена или антигенов проводим на хроматографическом носителе, а стабилизацию полученного антигена или антигенов или готовой лекарственной форме проводим с использованием детергента Тритон Х-100 в концентрации 100-200 мкг/мл.
Указанные условия определены как оптимальные в результате многолетних экспериментов, проведенных авторами этого изобретения.
Таким образом, для решения поставленной задачи мы предлагаем способ получения антигена или антигенов вируса гриппа, включающий получение куриных эмбрионов (КЭ), их дезинфекцию, предварительную инкубацию, заражение рабочим раствором посевного вируса, инкубацию зараженных КЭ, охлаждение после инкубации, сбор вируссодержащей аллантоисной жидкости, дезагрегацию выделенных вирусов путем добавления раствора NaCl до конечной концентрации 0,23-0,30 М, инактивацию их добавлением β-пропиолактона до конечной концентрации 0,1% и очистку ВАЖ методами микрофильтрации с использованием каскада из трех фильтров с диаметром пор 10 мкм, 1 мкм, 0,6 мкм и ультрафильтрации с пределом отсечения 300 кДа, затем проводят концентрирование осветленной вируссодержащей аллантоисной жидкости не более чем в 20 раз, концентрат очищают путем двойного ультрацентрифугирования в градиенте плотности сахарозы, после чего осуществляют расщепление инактивированного вирусного концентрата с использованием детергента n-октил-β-D-глюкопиранозида (октилглюкозида) или тетрадецилтриметиламмония бромида (ТДТАБ), удаление недоразрушенных вирионов и комплексов рибонуклеопротеидов с мембранным белком методом центрифугирования, микро- и ультрафильтрацию, хроматографическую очистку и стерилизующую фильтрацию полученного антигена или антигенов, а стабилизацию антигена или антигенов проводят с использованием детергента Тритон Х-100 в концентрации 100-200 мкг/мл.
В частном случае предлагается противогриппозная вакцина, содержащая антиген или антигены, полученные вышеописанным способом, причем она может содержать 1, 3 или 4 антигена.
Сущность изобретения
Заявляемый способ получения состоит из нескольких технологических этапов:
Первый этап заключается в получении ВАЖ и состоит из нескольких стадий: получение куриных эмбрионов (КЭ), их дезинфекция предварительная инкубация, заражение рабочим раствором посевного вируса, инкубация зараженных КЭ, охлаждение после инкубации, сбор ВАЖ и очистка ВАЖ.
Яйца куриные инкубационные получают только от клинически здоровой птицы из благополучных в эпизоотологическом отношении птицеводческих хозяйств, благополучных по инфекционным и инвазивным заболеваниям. Качество поставляемых яиц подтверждают ветеринарным свидетельством. После проведения входного контроля яйцо оплодотворенное закладывают в инкубатор для инкубирования. Дезинфекцию КЭ проводят методом распыления дезинфицирующего раствора 0,5% Р3-оксония актив 150 или другого разрешенного к применению средства. Процесс заражения 9-11 суточных КЭ проводится в асептических условиях. Емкость с рабочим раствором посевного вируса подсоединяется к инокулятору, производства фирмы Rame-Hart, США или аналогичному оборудованию. Обработку скорлупы КЭ и игл во время процесса заражения проводят этиловым спиртом. Далее пластиковые лотки передвигаются по конвейеру, проходя дезинфекцию этиловым спиртом, а после чего происходит заражение. В каждый КЭ вводят по (0,20±0,02) мл рабочего разведения посевного вируса. Иглы плат заражения автоматически проходят дезинфекцию 70% этиловым спиртом после каждого прокола скорлупы КЭ. После выхода лотков с зараженными КЭ проводится их визуальный выборочный контроль. Проконтролированные КЭ передают на стадию инкубации зараженных КЭ. Куриные эмбрионы, зараженные вирусом гриппа, инкубируют в технологическом режиме (температура, относительная влажность) в соответствии с режимами, указанными в паспортах на штамм или подобранными в результате исследований. Для вирусов гриппа типа А продолжительность инкубации, как правило, составляет от 35 до 50 ч, а для вирусов типа В - от 50 до 65 ч, а относительная влажности от 55 до 65%. Охлаждение КЭ осуществляется в холодильной камере в течение от 12 до 20 ч при температурном режиме (5±3)°С. Сбор ВАЖ осуществляется с помощью автоматической линии для сбора аллантоисной жидкости (харвестер) производства фирмы «Rame-Hart», США. На этой линии в автоматическом режиме осуществляют декапитацию КЭ, их визуальную отбраковку (погибшие КЭ, инкубационный брак, бой) и сбор ВАЖ в асептических условиях. Собранную ВАЖ с помощью насосов перекачивают в реактор. Перед началом сбора ВАЖ реактор охлаждают с использованием воды и охлаждающего устройства до конечной температуры в реакторе (6±2)°С. По окончанию сбора ВАЖ с помощью насоса добавляют стерильный раствор 2,5 М NaCl до конечной концентрации 0,23-0,3 М для предотвращения агрегации и β-пропиолактон до конечной концентрации 0,1% для инактивации вируса. Содержимое перемешивают в течении 1-2 часов. После перемешивания мешалку отключают и содержимое реактора отстаивают в течение не менее 6 часов. Выбранное время должно обеспечивать инактивацию вируса гриппа и посторонних агентов патогенных для человека.
2 этап заключается в очистке ВАЖ методами микро- и ультрафильтрации и очистке полученного концентрата ВАЖ методом ультрацентрифугирования в градиенте плотности сахарозы.
Очистку и концентрирование ВАЖ микро- и ультрафильтрацией проводят на совмещенной установке микро- и ультрафильтрации с соблюдением правил асептики в зоне ламинарного потока. После обработки и инактивации ВАЖ из реактора с помощью насоса подают на установку микрофильтрации и пропускают через каскад глубинных фильтров с диаметром пор 10 мкм, 1 мкм, 0,6 мкм в стерильную емкость. Полученную в результате микрофильтрации осветленную ВАЖ с помощью насоса подают на установку ультрафильтрации с кассетными модулями Pellicon 2 Biomax-300 или аналогичными с пределом отсечения 300 кДа, для дальнейшей очистки и концентрирования ВАЖ. Концентрирование осветленной ВАЖ осуществляют не более, чем в 20 раз.
Очистку и концентрирование вируса гриппа в градиенте плотности сахарозы проводят с использованием проточной ультрацентрифуги следующим образом: в ротор загружают стерильный трис-буфер (рН=7,4±0,2) и 60% раствор сахарозы при температуре (5±3)°С. После разгона до g=(85000±5000) м/с2 в ротор с помощью насоса со скоростью (10±1) л/час подают концентрат ВАЖ. По окончанию прохождения всего объема концентрированной ВАЖ в ротор центрифуги подают трис-буфер и проводят изоплотностное центрифугирование в течение (2,0±0,5) ч. Растворы используются охлажденными до температуры (5±3)°С. После окончания изоплотностного центрифугирования ультрацентрифугу останавливают и производят разгрузку полученных фракций инактивированного вирусного концентрата (ВК) в стерильном боксе. Собирают 20 фракций содержащегося в роторе градиента плотности сахарозы: первые две фракции, объемом по 200 мл, последующие - по 100 мл. Из каждого флакона отбирают пробу для контроля гемагглютинирующей активности (титра ГА) и % содержания сахарозы. После взятия пробы каждый флакон закрывают силиконовой пробкой и помещают в холодильник на хранение при температуре (5±3)°С до 3 сут. Для дальнейшей обработки используются фракции инактивированного ВК, обладающие титром ГА не менее 1:8000 и содержащие (28-51)% сахарозы.
Для повышения качества очистки проводят повторное центрифугирование. Для дальнейшей обработки используются фракции инактивированного вирусного гриппа (концентрированный очищенный вирус гриппа, инактивированный ВК, вторичные фракции ВК), обладающие титром гемагглютинирующей активности не менее 1:16000 и содержащие (19-50)% сахарозы. В отобранные фракции ВК добавляют по 80 мл глицерина, перемешивают флаконы, закрывают силиконовыми пробками и передают на хранение в морозильник при температуре от минус 9 до минус 15°С на срок не более 6 месяцев. Допускается хранение фракций при температуре (5±3)°С без добавления глицерина до 3 суток.
Повторное центрифугирование существенно увеличивает степень чистоты инактивированного ВК при минимальных потерях гемагглютинина (ГА) это наблюдается по снижению соотношения общего белка к ГА и снижению соотношения овальбумина к ГА (Таблица 1) и по хроматограммам (Фиг. 1 - Электрофореграмма образцов первичных фракций, полученных после концентрирования в градиенте плотности сахарозы на примере штамма A/Michigan/45/2015 (H1N1), где 1 - маркеры молекулярных масс, 2 - объединенные фракции №3+4, 3 - объединенные фракции №5+6, 4 - объединенные фракции №7+8, 5 - объединенные фракции №9+10, 6 - объединенные фракции №11+12, 7 - объединенные фракции №13+14, 8 - объединенные фракции №15+16, 9 - объединенные фракции №17+18, 10 - объединенные фракции №19+20. Выделенной областью определены границы выбранных фракций и Фиг. 2 - Электрофореграмма образцов фракций, полученных после концентрирования в градиенте плотности сахарозы при повторном центрифугировании на примере штамма A/Michigan/45/2015 (H1N1), где 1 - объединенные фракции №3+4, 2 - объединенные фракции №5+6, 3 - объединенные фракции №7+8, 4 - объединенные фракции №9+10, 5 - объединенные фракции №11+12, 6 - объединенные фракции №13+14, 7 - объединенные фракции №15+16, 8 - объединенные фракции №17+18, 9 - объединенные фракции №19+20, 1 - маркеры молекулярных масс. Выделенной областью определены границы выбранных фракций). 
3 этап включает в себя расщепление инактивированных вирусных частиц из полученных концентратов, осаждение недоразрушенных вирионов и комплексов рибонуклеопротеидов с мембранным белком методом ультрацентрифугирования, микро- и ультрафильтрацию, хроматографическую очистку и стерилизующую фильтрацию антигенов (моновакцин).
Расщепление вирусных частиц проводят с использованием детергента октилглюкозида или ТДТАБ.
Детергенты, в силу механизма своего действия, вполне могут быть фактором частичной денатурации конформационных эпитопов гемагглютинина. В результате длительных анализов и технологических экспериментов был сделан вывод, что для каждого серотипа вируса гриппа существует свой оптимальный детергент, который позволяет выделять поверхностные антигены из вирионов данного серотипа с максимальным сохранением их исходной иммуногенности и протективной активности.
Выбор детергента осуществляют на основании результатов определения специфической активности в изученных образцах. В случае, когда на максимальных отношениях белок/детергент при применении одного из детергентов наблюдается снижение специфической активности, по сравнению с более низкими отношениями (феномен «сгорание» антигена), то в качестве единственного для данного серотипа выбирается детергент, который такого феномена не дает. На Фиг. 3 - Морфологический анализ колец преципитации в реакции одиночной радиальной иммунодиффузии (ОРИД), образцов серотипа B/Phuket/3073/2013, полученных с использованием различных детергентов представлены результаты определения специфической активности образцов серотипа B/Phuket/3073/2013, из которых следует, что образец, полученный с использованием детергента октилглюкозид образует хорошо окрашенные кольца четко очерченной формы (ряды №1 и №4), которые по морфологии ничем не отличаются от колец преципитации международного стандартного антигена, производства NIBSC, Великобритания (ряды №3 и №6). Образец, полученный с использованием детергента ТДТАБ образует слабо окрашенные кольца преципитации с нечетко очерченными границами (ряды №2 и №5), которые существенно отличаются по морфологии от колец преципитации международного стандартного антигена, производства NIBSC, Великобритания (ряды №3 и №6).
После выбора детергента проводят подбор соотношения белок/детергент, при котором выход специфической активности был в пределах максимального значения, с учетом результатов оценки полипептидного состава исследуемых образцов.
Определение оптимального детергента и соотношения белок/детергент проводят для каждого серотипа отдельно при смене производственного штамма, так как они могут иметь чувствительность к тому или иному детергенту или при смене партии детергента, так как вследствие штаммовых различий и колебаний свойств детергента от партии к партии, оптимальное соотношение белок/детергента может варьироваться.
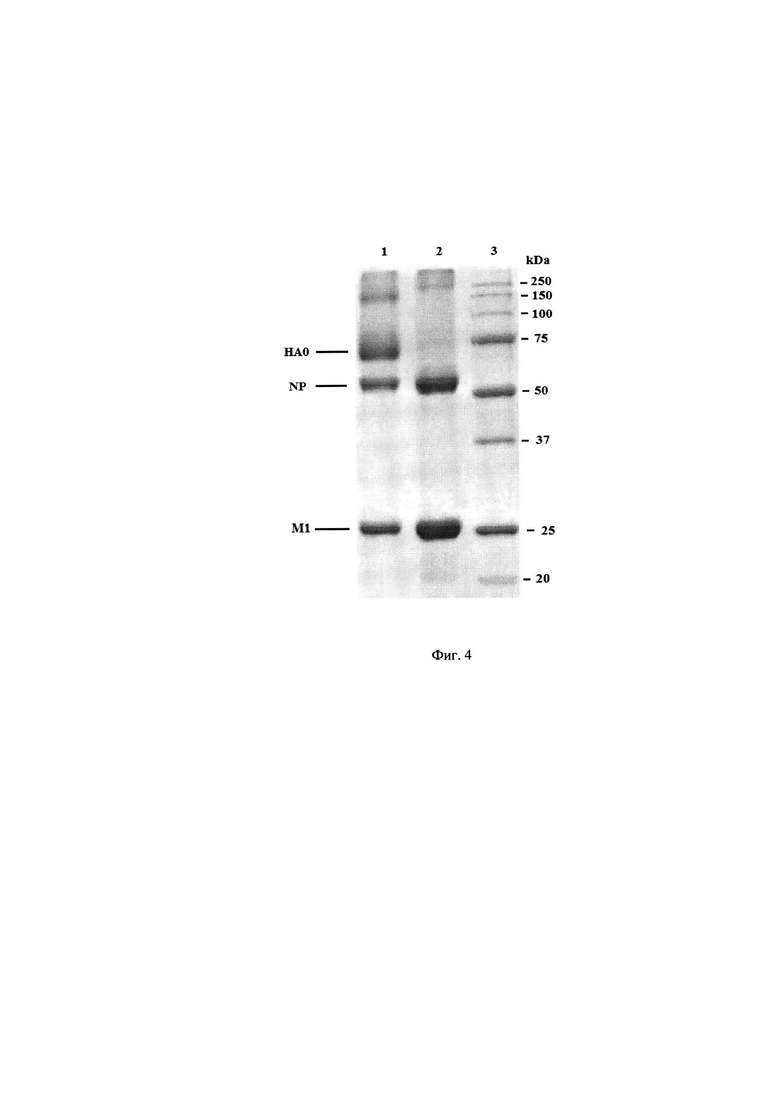
Осаждение кор-структур (недоразрушенных вирионов и комплексов рибонуклеопротеидов с мембранным белком) и агрегированных вирионов из полученного вирусного лизата проводят методом центрифугирования (Фиг. 4 - Электрофореграмма осадка с ротора центрифуги и вирусного концентрата на примере штамма A/Michigan/45/2015 (H1N1), где 1 - вирусный концентрат, 2 - осадок с ротора центрифуги, 3 - маркеры молекулярных масс).
С помощью насоса в ротор центрифуги подают трис-буфер, далее расщепленный ВК при скорости протока 4-6 л/ч при скорости вращения насоса от 16000 до 20000 об/мин (g=(13040-34774) м/с2) при температуре от 2 до 8°С. Расщепленный ВК центрифугируют в замкнутом цикле. На Фиг. 4 отражена эффективность использования центрифугирования для удаления непротективных белков вируса гриппа.
Затем полученный супернатант вируса гриппа с помощью перистальтического насоса пропускают в стерильную стеклянную емкость через глубинные фильтры, диаметр пор которых равен 0,6 и 0,2 мкм соответственно при давлении не более 0,5 бар. Профильтрованный супернатант, с помощью перистальтического насоса, пропускают через ультрафильтрационную установку с мембранными кассетами с пределом отсечения 30 кДа для концентрирования материала.
Для очистки сконцентрированного супернатанта используют хроматографический носитель для гельфильтрации Work Beads 40/100/sec компании Bio Works Company Ltd. (Швеция) или аналогичный. Гельфильтрацию проводят на производственной колонке из боросиликатного стекла. На колонку объемом 16-19 л носителя с помощью перистальтического насоса наносят сконцентрированный супернатант в объеме 2,0-2,5 л. Хроматографию ведут со скоростью потока не более 300 мл/мин и при давлении не более 1,0. Сбор материала осуществляют по показателям UV-детектора 200, KNAUER, Германия или аналогичного. Регистрацию данных проводят на персональном компьютере с системой МультиХром. После того, когда значение на детекторе достигает 10 mV начинают собирать материал. Сбор материала останавливают после падения оптической плотности от 10 до 20% от пикового значения. На Фиг. 5 представлена типичная хроматограмма удаления остатков примесей технологического процесса с использованием хроматографической очистки, где 1 - Антиген, 2 - Овальбумин, 3 - Сахароза, 4 - Октилглюкозид.
После проведения хроматографической очистки материал передают на стерилизующую фильтрацию. В заранее подготовленный к работе реактор заливают очищенный супернатант, добавляют ФБР до концентрации гемагглютинина не менее 100 мкг/мл, также возможно добавление Тритона Х-100 до конечной концентрации 100-200 мкг/мл и перемешивают со скоростью 200-220 об/мин в течение 15-20 мин при комнатной температуре.
Далее полученный антиген (моновакцину) вируса гриппа фильтруют с использованием стерильной стерилизующей капсулы с размерами пор 0,22 мкм (или менее), материал мембраны - полиэфирсульфон в стерильный одноразовый полимерный контейнер. Полученную стерильную моновакцину транспортируют в фармацевтические холодильники и хранят при температуре (5±3)°С не более года.
Этап 4 - включает в себя сведение компонентов вакцины, стерилизующую фильтрацию вакцины, розлив препарата в ампулы или флаконы, маркировку и упаковку.
Процесс получения трехвалентной гриппозной вакцины включает в себя сведение антигенов (моновакцин) 3-х типов вируса гриппа A(H1N1), A(H3N2) и В, с 1% раствором детергента Тритон Х-100, 1% раствором тиомерсала (для препаратов, содержащих консервант) и ФБР в реакторе.
Процесс получения четырехвалентной гриппозной вакцины включает в себя сведение антигенов (моновакцин) 4-х типов вируса гриппа A(H1N1), A(H3N2), B/Yamagata lineage и B/Victoria lineage, с 1% раствором детергента Тритон Х-100, 1% раствором тиомерсала (для препаратов, содержащих консервант) и ФБР в реакторе вместимостью 200 л.
Полуфабрикаты антигенов (моновакцин) вируса гриппа, прошедшие все контроли, из стерильных одноразовых контейнеров в асептических условиях загружают в реактор. Далее в реактор добавляют расчетные количества ФБР, 1% раствор тиомерсала до конечной концентрации (85-115) мкг/мл (для препарата, содержащего консервант) и 1% раствор детергента Тритона Х-100 до конечной концентрации 100-200 мкг/мл. Содержимое реактора перемешивают при скорости вращения мешалки 400 об/мин в течение 15 мин. Далее отключают мешалку и отстаивают полуфабрикат в течение 10 мин. После отстаивания отбирают пробу на контроль полуфабриката вакцины. Далее проводят стерилизующую фильтрацию перемешанного раствора через одноразовый фильтрующий элемент типа Sartobran 0,22 мкм, площадь фильтрации 0,45 м2. Из заполненного стерильного мешка в асептических условиях отбирают пробу для контроля полупродукта гриппозной вакцины в соответствии с требованиями Государственной Фармакопеи РФ.
Розлив препарата в ампулы или флаконы осуществляют в асептических условиях. Проводят контроль стерильности процесса и извлекаемого объема (дозы заполнения) препарата.
Далее все ампулы или флаконы с препаратом контролируют на герметичность и механические включения.
Затем препарат передают на склад карантинного хранения и хранят при температуре от 2 до 8°С.
Со склада карантинного хранения отбираются ампулы или флаконы с готовой лекарственной формой препарата и осуществляют контроль в соответствии с требованиями Государственной Фармакопеи РФ по следующим показателям качества гриппозных вакцин: описание, подлинность, рН, общий белок, стерильность, бактериальные эндотоксины, аномальная токсичность, специфическая безопасность, специфическая активность гемагглютинина, тиомерсал (для препарата, содержащего консервант), овальбумин, Тритон Х-100, иммуногенность и реактогенность.
Осуществление изобретения
Пример 1. Получение антигена (моновакцины) вируса гриппа серотипа H3N2
Для заражения КЭ в качестве рабочего раствора был использован 5 пассажный уровень реассортантного вируса A/Singapore/INFIMH-16-0019/2016-like/(IVR-186)/H3N2. Реассортантный штамм для производства инактивированных гриппозных вакцин был получен от ВОЗ. 60061 штук одиннадцати суточных КЭ были инфицированы дозой рабочего раствора посевного вируса, имеющей инфекционный титр 103,66 ЭИД50 в 0,2 мл. Инкубация после заражения проводилась при температуре 35°С и относительной влажности 60% в течение 45-48 ч. Охлаждение после инкубации проводилось в холодной камере при температуре (5±3)°С в течении 12-15 часов. После охлаждения ВАЖ была собрана в реактор в объеме 550 л. Далее в реактор с собранной ВАЖ было добавлено 50-70 л 2,5 М раствора NaCl, с последующим перемешиванием, после чего добавили 0,55 л β-пропиолактона. Инактивация проходила при температуре (6±2)°С в течении 10 часов. Далее после очистки и концентрирования ВАЖ микро- и ультрафильтрацией было получено 40 л концентрата ВАЖ, которые были переданы для очистки в градиенте плотности сахарозы методом ультрацентрифугирования. Из градиента были отобраны 700 мл (7 фракций) с оптимальной концентрацией сахарозы и титром гемагглютинина (ГА). В этом объеме вирусного концентрата (ВК) содержалось 13,2 г белка (определение проводили методом Бредфорда) и 6,0 г ГА (определение проводили методом ОРИД). Все количество объединенного ВК (700 мл) было использовано для приготовления одной серии моновакцины. Для проведения разрушения было использовано 198 г детергента октилглюкозида, производства фирмы Carbosynh Limited, Великобритания. Объем лизата после расщепления составил 12 л. Далее была проведена очистка от кор-структур методом ультрацентрифугирования при скорости протока 4-6 л/ч при скорости вращения насоса от 16000 до 20000 об/мин (g=(13040-34774) м/с2) при температуре от 2 до 8°С. Далее промыли ротор 5 л трис-буфера со скоростью протока жидкости от 14 до 16 л/ч. Общий объем материала составил 17 л. После чего материал был профильтрован на установке микрофильтрации. Супернатант был сконцентрирован с использованием кассет с пределом отсечения 30 кДа до 2,0 л, хроматография проводилась при комнатной температуре. По оптической плотности был собран пик объемом 2,9 л, в нем был определен белок методом Бредфорда. Общее количество белка в пике составило 7,0 г. Далее материал был разведен до конечной концентрации по белку до 300 мкг/мл буфером ФБР. Полученную смесь тщательно перемешали, в течении 15 мин. Полуфабрикат профильтровали через одноразовый фильтрующий элемент 0,22 мкм. Полученный антиген (моновакцину) объемом 23,0 л переносим в фармацевтический холодильник и храним при температуре (5±3)°С в течении не более 12 месяцев. В полученном антигене (моновакцине) вируса гриппа определено 4,05 г гемагглютинина, тогда как в объединенном ВК было 6,00 г гемагглютинина. Таким образом, эффективность технологии по выходу гемагглютинина составляет 67,5%.
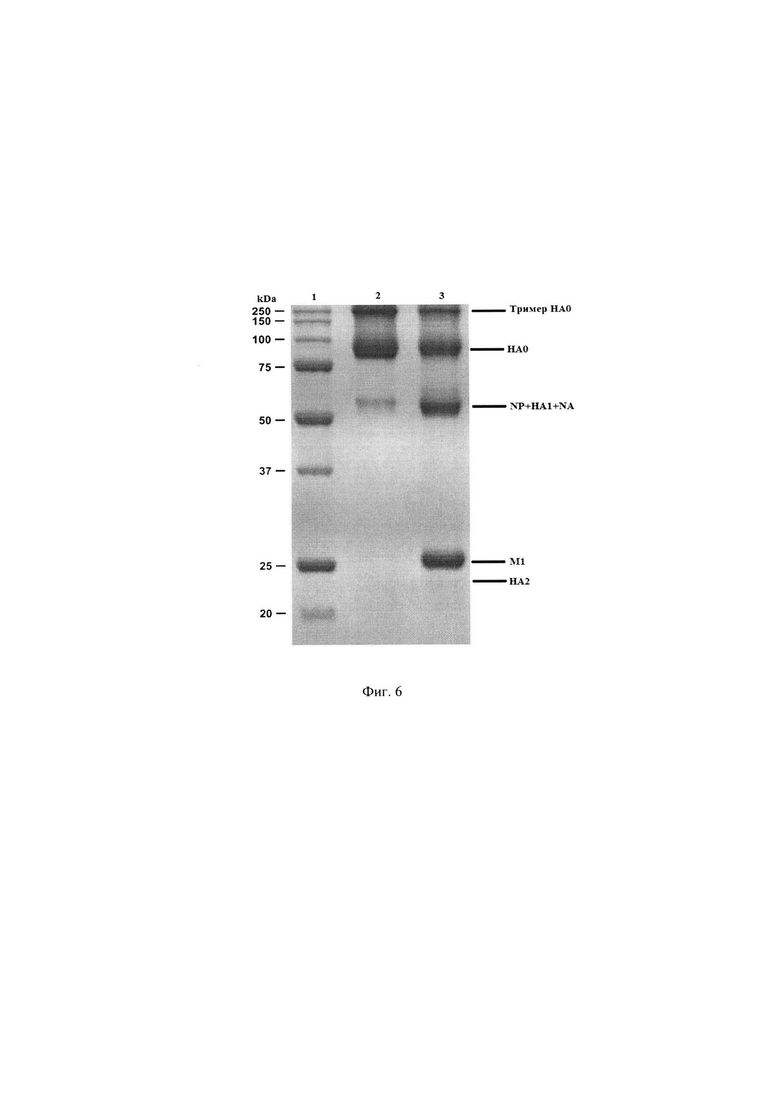
Был проведен сравнительный анализ полипептидного состава, объединенного ВК и полученного из него антигена (моновакцины) вируса гриппа A/Singapore/INFIMH-16-0019/2016-like/(IVR-186)/H3N2 методом электрофореза в ПААГ в нередуцирующих условиях. Результаты представлены на Фиг. 6 - Электрофореграмма антигена (моновакцины) вируса гриппа A/Singapore/INFIMH-16-0019/2016-like/H3N2, где 1 - маркеры молекулярных масс, 2 - антиген (моновакцина) вируса гриппа A/Singapore/INFIMH-16-0019/2016-like/H3N2, 3 - объединенный вирусный концентрат (ВК).
Из представленных результатов следует, что в полученном антигене (моновакцине) присутствуют тримеры гемагглютинина, нерасщепленный гемагглютинин (НА0), тяжелая цепь гемагглютинина (НА1) и некоторое количество белка нуклеокапсида (NP) и нейраминидазы (NA). В исходном объединенном ВК, из которого был произведен этот антиген (моновакцина) вируса гриппа присутствуют также полипептид M1 (мембранный белок) и существенные количества белка NP. Это свидетельствует, что полученный препарат является высокоочищенным и не содержит нерасщепленных вирусных частиц.
Пример 2. Получение антигена (моновакцины) вируса гриппа типа B/Yamagata lineage
Для получения объединенного ВК были проведены такие же процедуры, как и в примере 1. Отличия состояли в следующем: для заражения применяли 3 пассажный уровень реассортантного вируса B/California/2/2015/BX-69B-like (B/Phuket/3073/2013). 70704 штук одиннадцатисуточных КЭ были инфицированы дозой рабочего раствора посевного вируса, имеющей инфекционный титр 103,66 ЭИД50 в 0,2 мл. Инкубация после заражения проводилась при температуре 32,5°С и относительной влажности 60% в течении 60-64 часов. Было собрано 720 л ВАЖ, которые сконцентрировали до 40 л. После второго ультрацентрифугирования из градиента были отобраны 700 мл (7 фракций) с оптимальной концентрацией сахарозы и титром ГА. В этом объеме ВК содержалось 21,0 г белка и 7,9 г ГА. После проведения разрушения, ультрацентрифугирования, микро- и ультрафильтрации, хроматографии и стерилизующей фильтрации, как указано в примере 1, было получено 25,0 л моновакцины. В этом объеме содержалось 12,63 г общего белка и 5,43 г ГА. Таким образом эффективность технологии по выходу ГА составила 68,7%.
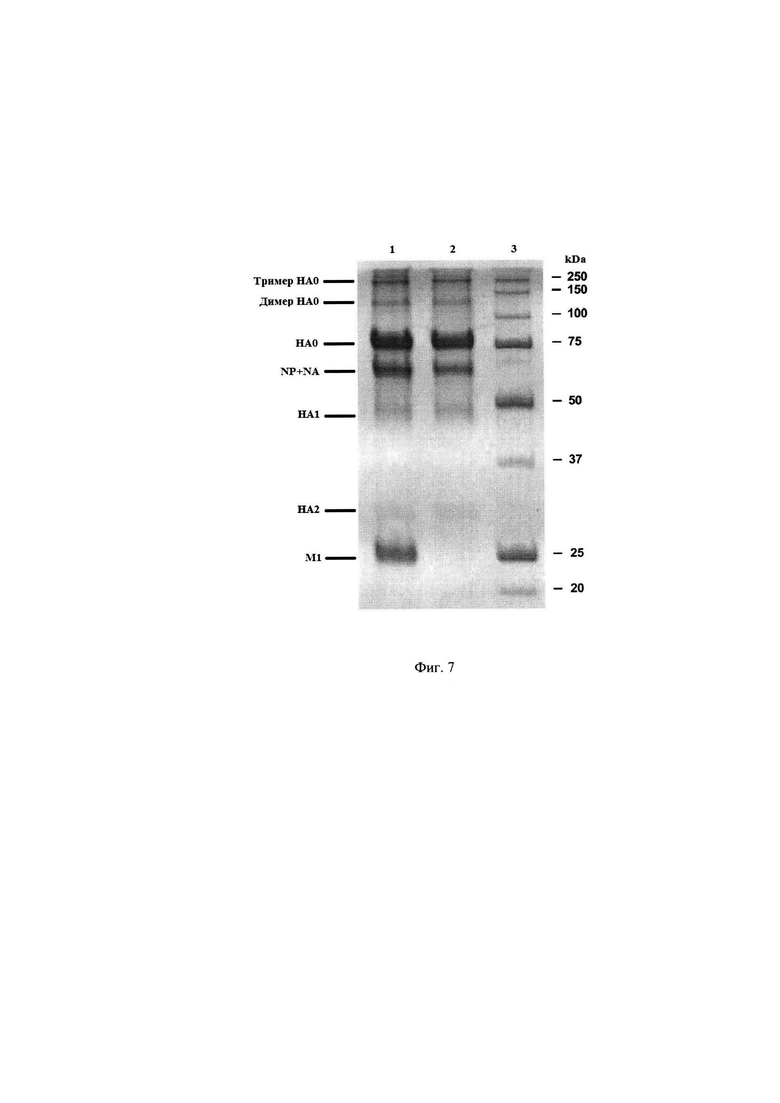
Был проведен сравнительный анализ полипептидного состава, объединенного ВК и полученного из него антигена (моновакцины) вируса гриппа B/California/2/2015-like методом электрофореза в ПААГ в нередуцирующих условиях. Результаты представлены на Фиг. 7 Электрофореграмма антигена (моновакцины) вируса гриппа B/California/2/2015-like, где 1 - объединенный ВК, 2 - антиген (моновакцина) вируса гриппа B/California/2/2015- like, 3 - маркеры молекулярных масс.
Из представленных результатов следует, что в полученном антигене (моновакцине) вируса гриппа присутствуют тримеры и димеры гемагглютинина, нерасщепленный гемагглютинин (НА0), тяжелая и легкая цепь гемагглютинина (НА1 и НА2) и некоторое количество белка нуклеокапсида (NP) и нейраминидазы (NA). В исходном объединенном ВК, из которого был произведен этот антиген (моновакцина) вируса гриппа присутствуют также полипептид Ml (мембранный белок) и существенные количества белка NP. Это свидетельствует, что полученный препарат является высокоочищенным и не содержит нерасщепленных вирусных частиц.
Пример 3. Получение антигена (моновакцины) вируса гриппа типа B/Victoria lineage
Для получения объединенного ВК были проведены такие же процедуры, как и в примере №1 и №2. Отличия состояли в следующем: для заражения применяли 5 пассажный уровень производственного штамма вируса B/Maryland/15/2016-like/BX-69A (B/Colorado/06/2017-like virus). 101101 штук одиннадцатисуточных КЭ были инфицированы дозой рабочего раствора посевного вируса, имеющей инфекционный титр 104,0 ИД в 0,2 мл. Инкубация после заражения проводилась при температуре 32,5°С и относительной влажности 60% в течении 60-64 часов. Было в 2 реактора собрано 965 л ВАЖ, которые сконцентрировали до 70 л. После второго ультрацентрифугирования в градиенте плотности сахарозы были отобраны 800 мл (8 фракций) с оптимальной концентрацией сахарозы и титром ГА. В этом объеме ВК содержалось 23,6 г белка и 7,4 г ГА. После проведения разрушения, ультрацентрифугирования, микро- и ультрафильтрации, хроматографии и стерилизующей фильтрации, как указано в примере 1, как указано в примере 1, было получено 34,0 л моновакцины. В этом объеме содержалось 15,27 г общего белка и 4,49 г.Таким образом эффективность технологии по выходу ГА составила 60,7%.
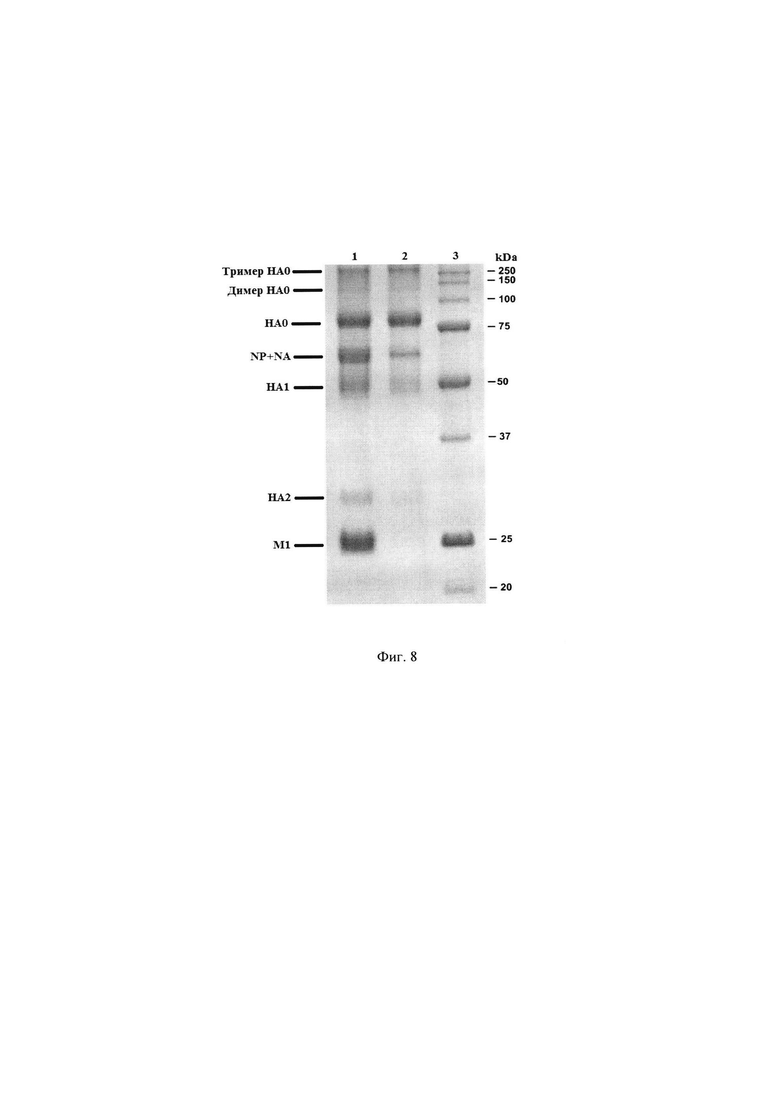
Был проведен сравнительный анализ полипептидного состава, объединенного ВК и полученного из него антигена (моновакцины) вируса гриппа B/Maryland/15/2016-like методом электрофореза в ПААГ в нередуцирующих условиях. Результаты представлены на Фиг. 8 - Электрофореграмма антигена (моновакцины) вируса гриппа В/Магу land/15/2016-like, где 1 - объединенный ВК, 2 - антиген (моновакцина) вируса гриппа B/Maryland/15/2016-like, 3 - маркеры молекулярных масс.
Из представленных результатов следует, что в полученном антигене (моновакцине) вируса гриппа присутствуют тримеры и димеры гемагглютинина, нерасщепленный гемагглютинин (НА0), тяжелая и легкая цепь гемагглютинина (НА1 и НА2) и некоторое количество белка нуклеокапсида (NP) и нейраминидазы (NA). В исходном объединенном ВК, из которого был произведен этот антиген (моновакцина) вируса гриппа присутствуют также полипептид M1 (мембранный белок) и существенные количества белка NP. Это свидетельствует, что полученный препарат является высокоочищенным и не содержит нерасщепленных вирусных частиц.
Пример 4. Получение антигена (моновакцины) вируса гриппа серотипа H1N1
Все технологические стадии соответствовали таковым в примерах №1, №2 и №3. Отличия состояли в следующем: для заражения применяли 7 пассажный уровень вируса A/Michigan/45/2015/NYMC-275A/H1N1. 106749 штук одиннадцатисуточных КЭ были инфицированы дозой рабочего раствора посевного вируса, имеющей инфекционный титр 103,66 ИД в 0,2 мл. Инкубация после заражения проводилась при температуре 35°С и относительной влажности 60% в течении 44-48 часов. Было в два реактора собрано 1085 л ВАЖ, которые сконцентрировали до 70 л. После второго ультрацентрифугирования в градиенте плотности сахарозы были отобраны 700 мл (7 фракций) с оптимальной концентрацией сахарозы и титром ГА. В этом объеме ВК содержалось 16,8 г белка и 6,8 г ГА. После проведения разрушения, ультрацентрифугирования, микро- и ультрафильтрации, хроматографии и стерилизующей фильтрации, как указано в примере 1, как указано в примере 1, было получено 20,0 л моновакцины. В этом объеме содержалось 7,66 г общего белка и 4,32 г ГА. Таким образом эффективность технологии по выходу ГА составила 63,9%.
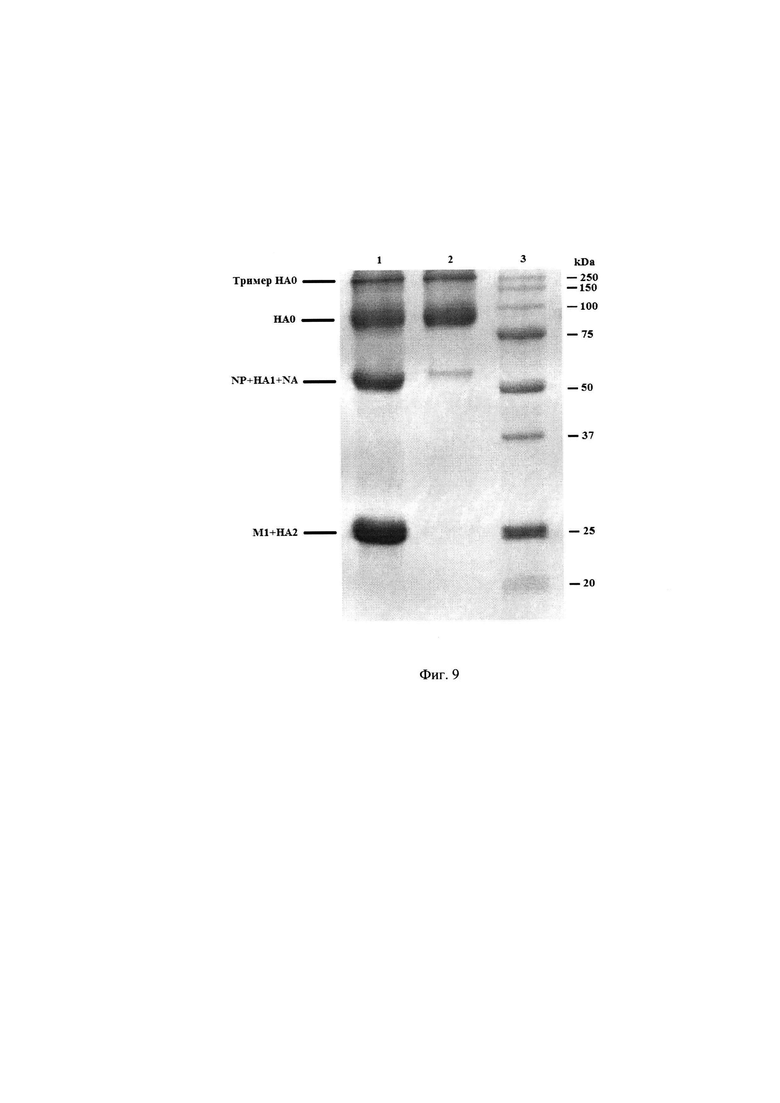
Был проведен сравнительный анализ полипептидного состава, объединенного ВК и полученного из него антигена (моновакцины) вируса гриппа A/Michigan/45/2015/H1N1 методом электрофореза в ПААГ в нередуцирующих условиях. Результаты представлены на Фиг. 9 - Электрофореграмма антигена (моновакцины) вируса гриппа A/Michigan/45/2015/H1N1, где 1 - объединенный ВК, 2 - антиген (моновакцина) вируса гриппа A/Michigan/45/2015/H1N1, 3 - маркеры молекулярных масс.
Из представленных результатов следует, что в полученном антигене (моновакцине) вируса гриппа присутствуют тримеры гемагглютинина, нерасщепленный гемагглютинин (НА0), тяжелая цепь гемагглютинина (НА1) и некоторое количество белка нуклеокапсида (NP) и нейраминидазы (NA). В исходном объединенном ВК, из которого был произведен этот антиген (моновакцина) вируса гриппа присутствуют также полипептид M1 (мембранный белок) и существенные количества белка NP. Это свидетельствует, что полученный препарат является высокоочищенным и не содержит нерасщепленных вирусных частиц.
Пример 5. Приготовление лекарственной формы трехвалентной вакцины
Для приготовления серии трехвалентной вакцины были отобраны стерильные растворы полученных антигенов (моновакцин) серотипов A(H1N1), A(H3N2) и В и в асептических условиях их добавили в реактор в количестве 7,4 л, 9,1 ли 7,4 л соответственно. Далее к ним был добавлен ФБР М в количестве 25,2 л и 0,9 л 1% раствора Тритона Х-100 таким образом, чтобы в конечном растворе была концентрация ГА для всех серотипов равная 16 мкг/доза. Далее содержимое реактора перемешали в течение 15 мин со скоростью 400 об/мин, отключили мешалку, отстаивали полуфабрикат в течение 10 мин и фильтровали через одноразовую стерильную фильтрующую капсулу с диаметром пор 0,22 мкм в стерильный пластиковый контейнер. Объем полуфабриката после добавления всех компонентов соответствовал 50 л.
После стерилизующей фильтрации был получен объем стерильной трехвалетной вакцины равный 49 л. После получения удовлетворительных результатов по всем необходимым показателям качества гриппозных вакцин контейнер с тривакциной передали для розлива в ампулы. Препарат был разлит в ампулы вместимостью 1 мл по 0,6 мл трехвалентной вакцины в каждую ампулу. После розлива было получено 80000 ампул, которые были проконтролированы на наличие механических включений. В результате по этому показателю было отбраковано 800 ампул. Остальные ампулы были отправлены на склад временного хранения с температурой (6±2)°С. Часть ампул была отобрана для проведения контролей согласно нормативной документации.
Пример 6. Приготовление лекарственной формы четырехвалентной вакцины
Для приготовления серии четырехвалентной вакцины были отобраны стерильные растворы полученных антигенов (моновакцин) серотипов A(H1N1), A(H3N2), B/Yamagata lineage и B/Victoria lineage и в асептических условиях их добавили в реактор в количестве 7,4 л, 9,1 л, 12,1 ли 7,4 л соответственно. Далее к ним был добавлен ФБР М в количестве 13,1 л и 0,9 л 1% раствора Тритона X-100 таким образом, чтобы в конечном растворе была концентрация ГА для всех серотипов равная 16 мкг/доза. Далее, содержимое реактора перемешали в течении 15 мин со скоростью 400 об/мин, отключили мешалку, отстаивали полуфабрикат в течение 10 мин и фильтровали через одноразовую стерильную фильтрующую капсулу с диаметром пор 0,22 мкм в стерильный пластиковый контейнер. Объем полуфабриката после добавления всех компонентов соответствовал 50 л.
После стерилизующей фильтрации был получен объем стерильной четырехвалетной вакцины равный 49 л. После получения удовлетворительных результатов по всем необходимым показателям качества гриппозных вакцин контейнер с вакциной передали для розлива в ампулы. Препарат был разлит в ампулы вместимостью 1 мл по 0,6 мл четырехвалентной вакцины в каждую ампулу. После розлива было получено 80000 ампул, которые были проконтролированы на наличие механических включений. В результате по этому показателю было отбраковано 800 ампул. Остальные ампулы были отправлены на склад временного хранения с температурой (6±2)°С. Часть ампул была отобрана для проведения контролей согласно нормативной документации.
Пример 7. Сравнение результатов показателей качества предлагаемой вакцины и вакцин других производителей
Полученные стабилизированные лекарственные формы предлагаемых вакцин (трехвалентная и четырехвалентная) была проанализирована по некоторым биохимическим показателям качества гриппозных вакцин в сравнении с вакциной Ваксигрипп® (инактивированная сплит-вакцина для профилактики гриппа - Санофи Пастер С.А., Франция), Ультрикс® (вакцина гриппозная инактивированная расщепленная - ООО «ФОРТ», Россия), Гриппол® квадривалент (вакцина гриппозная четырехвалентная инактивированная субъединичная адъювантная - ООО «НПО Петровакс Фарм», Россия). Полученные результаты представлены в таблице №2.
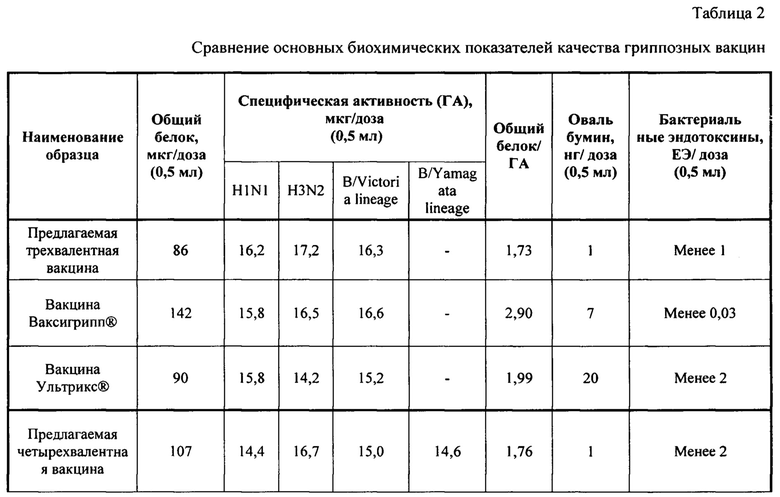
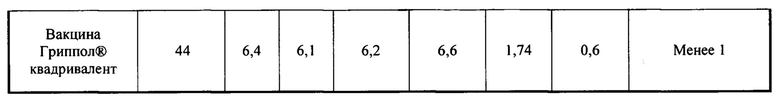
По представленным результатам можно сделать выводы, что полученные стабилизированные лекарственные формы предлагаемых вакцин (трехвалентная и четырехвалентная) не уступают по качеству другим зарегистрированным в России инактивированным гриппозным вакцинам. По некоторым показателям качества, таким как содержание овальбумина или соотношение общего белка к гемагглютинину, даже превосходят другие гриппозные вакцины как российского производства, так и зарубежного.
Маркером присутствия в антигенах (моновакцинах) вируса гриппа компонентов организма-продуцента является белок овальбумин, содержащийся в аллантоисной жидкости КЭ. Данная примесь является важным показателем качества любой вакцины, антиген которой был получен культивированием вакцинного штамма в КЭ. Кроме того, что содержание этого белка может интерпретироваться как интегральный показатель способности технологии очистить препарат от высокомолекулярных примесей, овальбумин требует особого контроля в связи с его реактогенностью. Так, антигены вируса гриппа, которые потенциально могут содержать овальбумин и другие белки куриного эмбриона, строго противопоказаны лицам с подтвержденной анафилактической гиперчувствительностью, а вакцинация лиц, имеющих в анамнезе аллергические реакции на куриные белки, должна проводится с особой осторожностью. Так как среди существующих на рынке противогриппозных препаратов присутствуют вакцины с различными нормами содержания овальбумина, лицам с аллергией на куриный белок рекомендуется подбирать препараты, спецификация которых допускает наименьший порог допустимой концентрации овальбумина.
Пример 8. Изучение антигенной активности полученных трехвалентной и четырехвалентной вакцин
Исследование иммуногенности предложенной четырехвалентной вакцины было проведено при двукратном внутримышечном введении вакцины мышам Balb/c самкам (6-8 недель, весом (17,08±0,03) г) в дозах, соответствующих 1 (группа 1) и 1/2 прививочной дозе для человека (группа 2). Третьей группе мышей вводили вакцину сравнения 1 Гриппол® Квадривалент двукратно внутримышечно в 1 дозе для человека. Вакцину сравнения 2 - трехвалентную предлагаемую вакцину вводили мышам группы 4 двукратно внутримышечно в 1 дозе для человека. Контрольной группе мышей (группа 5) внутримышечно вводили 0,5 мл 0,9% раствора хлорида натрия. Количество мышей в каждой группе - 10. Кровь у мышей опытных и контрольных групп забирали на 14-е и 28-е сутки исследования.
Поскольку считается, что мыши не подвержены гриппозной инфекции и являются «наивными» по гриппозным антигенам, однократного введения гриппозной вакцины недостаточно для выработки полноценного иммунного ответа. Поэтому для выработки полноценного иммунного ответа исследуемый препарат и препараты сравнения вводили мышам линии Balb/c внутримышечно (путь, который предназначен для клинического применения исследуемого препарата) двукратно с интервалом 14 дней.
Оценку антиген-специфического гуморального иммунитета проводили в реакции торможения гемагглютинации (РТГА) и реакции микронейтрализации (РМН) в культуре клеток MDCK со штаммами вируса гриппа A(H1N1); A(H3N2); В (Victoria lineage) и В (Yamagata lineage).
Постановку реакций осуществляли согласно методикам, рекомендованным ВОЗ.
Результаты представлены в таблицах 3-6.
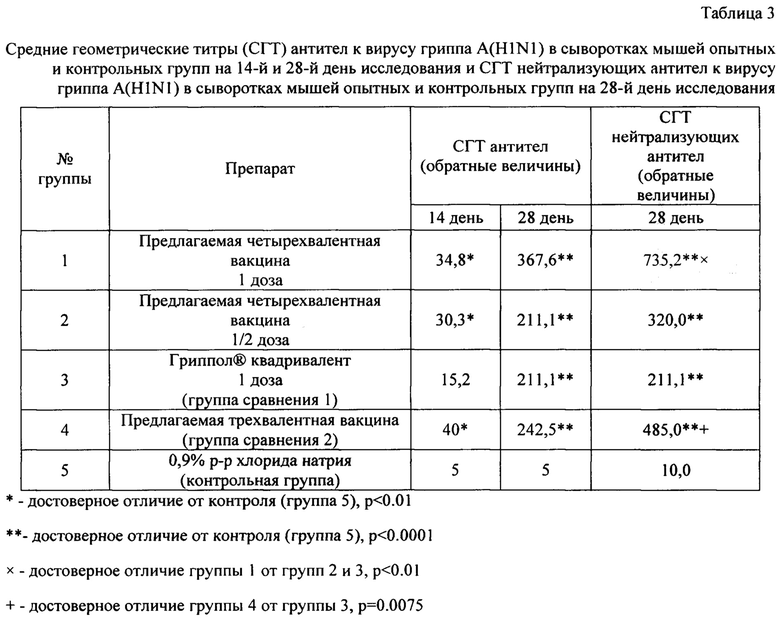

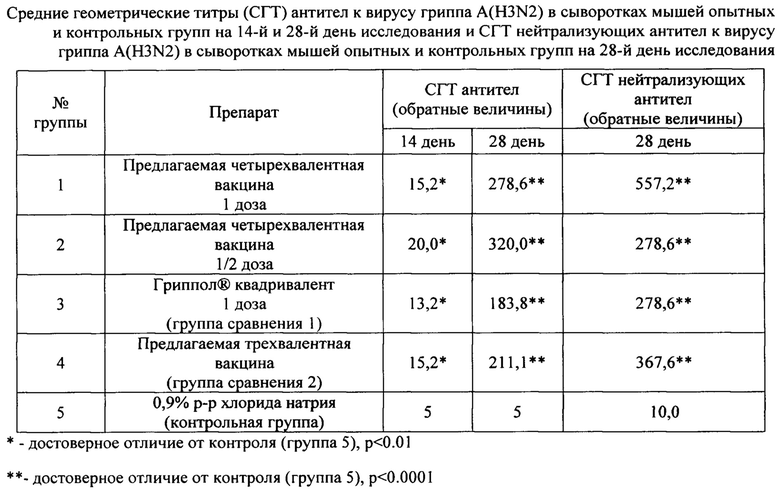
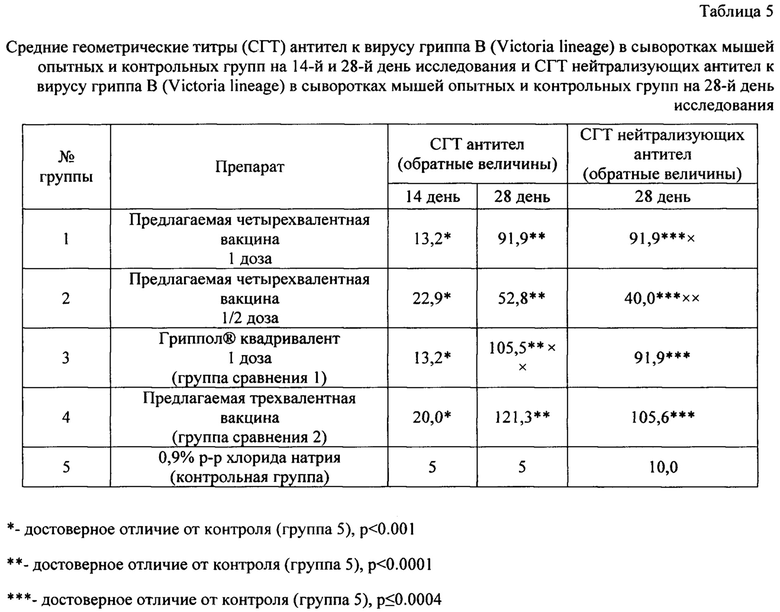

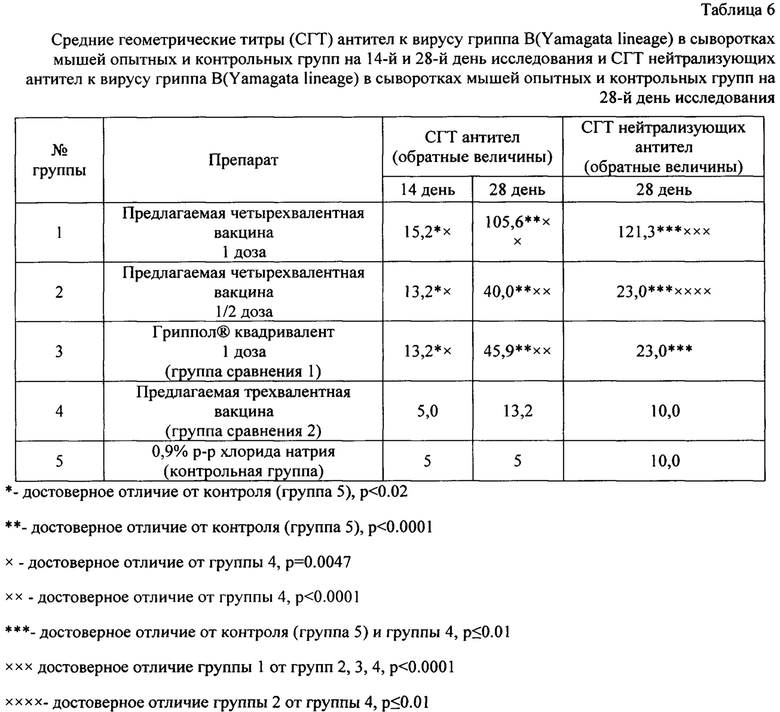
Результаты по доклиническому изучению иммуногенности предложенных вакцин свидетельствуют о том, что предлагаемые вакцины обладают выраженной специфической активностью по отношению ко всем штаммам вируса гриппа, входящим в ее состав.
Пример 8. Изучение сравнительной иммуногенности полученной трехвалентной вакцины и вакцины Ваксигрипп® в ходе клинического исследования на добровольцах
Было проведено двойное слепое сравнительное рандомизированное многоцентровое исследование предлагаемой вакцины. В качестве препарата сравнении использовали инактивированную вакцину для гриппа Ваксигрипп®, производства «Санофи Пастер», Франция. Вакцины вводили однократно внутримышечно 400 добровольцам в возрасте от 18 до 60 лет. В исследование было включено 222 женщины (55,5%) и 178 мужчин (44,8%), средний возраст добровольцев составил 33,6±0,6 лет. Прививка предлагаемой вакциной проведена 200 добровольцам, вакциной Ваксигрипп® - 200 добровольцам.
Оценку показателей иммуногенности, исследуемых вакцин, проводили по критериям эффективности развития иммунного ответа ВОЗ:
1. Кратность нарастания титра антител после вакцинации: >2,5 у лиц в возрасте от 18 до 60 лет;
2. Уровень сероконверсии (увеличение титра антител к ГА не менее, чем в 4 раза): >40% для лиц в возрасте от 18 до 60 лет;
3. Уровень серопротекции (число лиц с защитным титром ≥40): >70% для лиц в возрасте от 18 до 60 лет.
Результаты исследований (Таблица 7-9) статистически обработаны с использованием t-критерия Стьюдента и при отсутствии признаков нормального распределения - с помощью непараметрических критериев (Вилкоксона и Мана-Уитни). Различия считали достоверными при р<0,05. 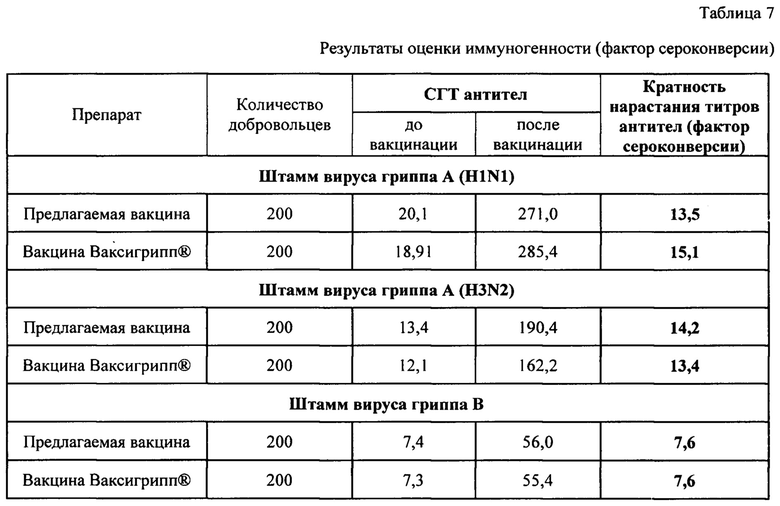
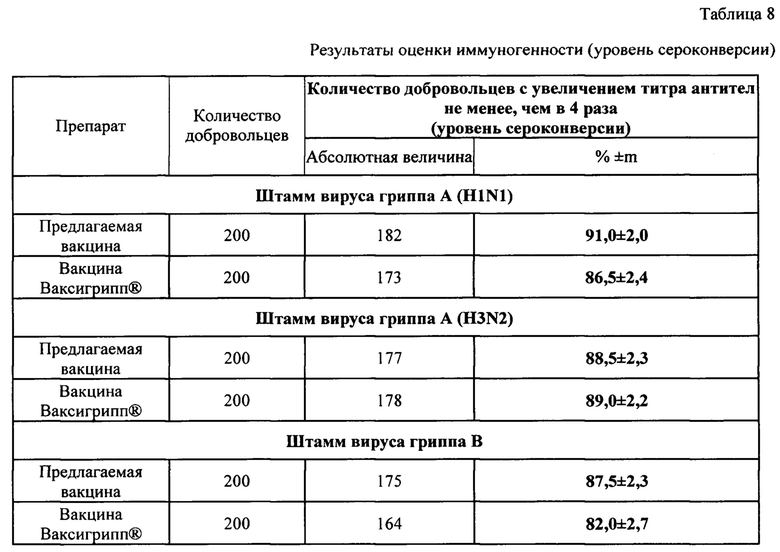
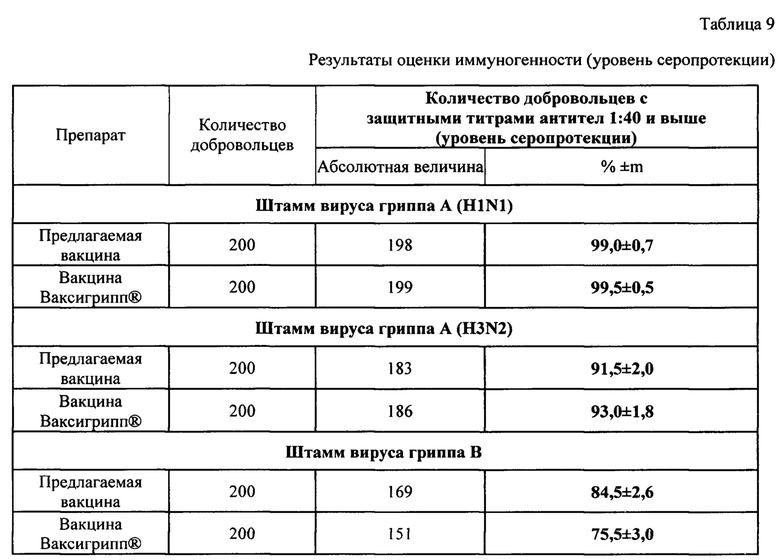
Оценка иммуногенности предлагаемой вакцины в сравнении с вакциной Ваксигрипп® при однократном введении добровольцам в возрасте 18-60 лет выявила высокую иммуногенную активность ко всем штаммам вируса гриппа (А (H1N1), A(H3N2) и B).
Достоверных различий по показателям «уровень серопротекции», «уровень сероконверсии» и «фактор сероконверсии» при введении предлагаемой вакцины и вакцины Ваксигрипп® не выявлено (р>0,05).
Пример 9. Изучение безопасности полученных трехвалентной и четырехвалентной вакцин
Исследования безопасности трехвалентной и четырехвалентной вакцин включали в себя изучение острой и субхронической, репродуктивной токсичности, оценку фармакологической безопасности, местно-раздражающего действия, иммунотоксичности, аллергенности, пирогенности и проводились по дизайну, представленному в таблице 10.

В ходе проведенных исследований установлено, что предлагаемые трехвалентная и четырехвалентная вакцины являются безопасными и характеризуются хорошей переносимостью. На фоне применения вакцин гибель животных не наблюдали, ухудшение их состояния, потеря массы тела, повышение температуры не установлены, негативного влияния на репродуктивную, иммунную систему не отмечали. Стоит отметить, что предлагаемые вакцины вызывали некоторую аллергическую реакцию при введении их морским свинкам, однако эти эффекты наблюдали при введении 10-кратной дозы и кроме того, проявления аллергических реакций допустимо для иммунобиологических препаратов.
Пример 10. Изучение безопасности полученной трехвалентной вакцины в ходе клинического исследования на добровольцах
В рамках I фазы было проведено простое слепое плацебо-контролируемое одноцентровое проспективное исследование, в котором приняли участие 45 добровольцев, 33,3% мужчины, 66,7% женщины, средний возраст - 31,4 года. 15 добровольцев получали трехвалентную вакцину с консервантом, 15 - без консерванта, 15 - плацебо. Контрольные точки исследования: скрининговый визит, 3, 7, 21-е сутки после вакцинации. Проведенные обследования: физикальные (температура. АД, ЧСС, ЧДД), обследование терапевтом, сбор данных по сопутствующей терапии, контроль за нежелательными явлениями и серьезными нежелательными явлениями, также у добровольцев были взяты кровь, моча. Результаты оценки частоты поствакцинальных реакций среди добровольцев представлены в таблице 11.
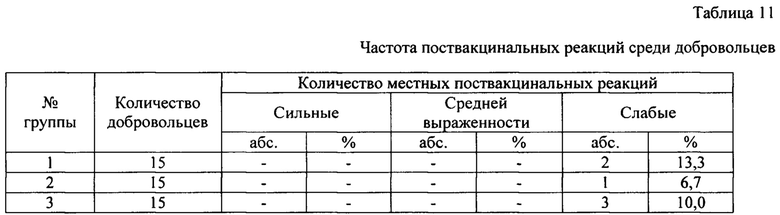
За весь период поствакцинального наблюдения субъективно с 7 по 21 сутки местных и системных реакций выявлено и зарегистрировано не было.
Каких-либо отклонений от нормальных значений по регистрируемым показателям (температура. АД, ЧСС, ЧДД и др.) выявлено и зарегистрировано не было.
Аллергические свойства у трехвалентной вакцины оценивали по показателям общего IgE и специфического IgE к овальбумину (таблица 12).
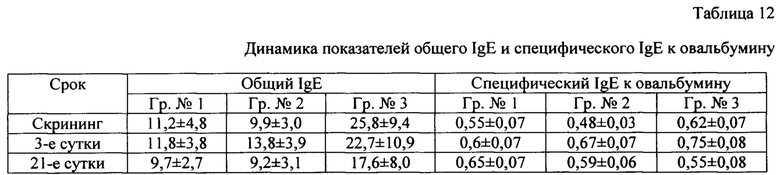
Установлено, что аллергические свойства у трехвалентной вакцины отсутствуют.
Таким образом, по результатам проведенных исследований можно заключить, что трехвалентная вакцина характеризуется слабой реактогенностью и высоким профилем безопасности.
В ходе проведения II фазы (см. пример 8), помимо иммуногенности были оценены показатели реактогенности и безопасности трехвалентной вакцины на 200 добровольцах. Полученные результаты позволили сделать вывод о том, что трехвалентная вакцина характеризуется низкой реактогенностью и высоким профилем безопасности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| СПОСОБ ПРОИЗВОДСТВА ЧЕТЫРЕХВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ВАКЦИНЫ ПРОТИВ ГРИППА БЕЗ АДЪЮВАНТОВ | 2020 |
|
RU2741003C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТА ВИРУСА ГРИППА ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ | 2023 |
|
RU2839314C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ПРОТИВОГРИППОЗНОЙ ВАКЦИНЫ | 2019 |
|
RU2740751C1 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2446824C2 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| ВАКЦИНА ПРОТИВ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2523614C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННЫХ ВИРИОННЫХ КОНЦЕНТРАТОВ | 2013 |
|
RU2535153C1 |
| Способ повышения противоопухолевой резистентности, антиоксидантного и иммуностимулирующего воздействия на организм | 2019 |
|
RU2755638C2 |




Группа изобретений относится к иммунологии, медицине, фармакологии, и может быть использована для производства инактивированных гриппозных вакцин. Предлагаемый способ получения антигена или антигенов вируса гриппа включает получение куриных эмбрионов (КЭ), их дезинфекцию, предварительную инкубацию, заражение рабочим раствором посевного вируса, инкубацию зараженных КЭ, охлаждение после инкубации, сбор вируссодержащей аллантоисной жидкости, дезагрегацию выделенных вирусов путем добавления раствора NaCl до конечной концентрации 0,23-0,30 М, инактивацию их добавлением β-пропиолактона до конечной концентрации 0,1% и очистку вируссодержащей аллантоисной жидкости методами микрофильтрации с использованием каскада из трех фильтров с диаметром пор 10 мкм, 1 мкм, 0,6 мкм и ультрафильтрации с пределом отсечения 300 кДа, затем проводят концентрирование осветленной вируссодержащей аллантоисной жидкости не более чем в 20 раз, концентрат очищают путем двойного ультрацентрифугирования в градиенте плотности сахарозы, после чего осуществляют расщепление инактивированного вирусного концентрата с использованием детергента n-октил-β-D-глюкопиранозида (октилглюкозида) или тетрадецилтриметиламмония бромида (ТДТАБ), удаление недоразрушенных вирионов и комплексов рибонуклеопротеидов с мембранным белком методом центрифугирования, микро- и ультрафильтрацию, хроматографическую очистку и стерилизующую фильтрацию полученного антигена или антигенов, а стабилизацию антигена или антигенов проводят с использованием детергента Тритон Х-100 в концентрации 100-200 мкг/мл. Предлагается также противогриппозная вакцина, содержащая антиген или антигены, полученные вышеуказанным способом. Технический результат: разработка промышленного способа получения антигена и/или антигенов вируса высокой степени очистки для производства инактивированной вакцины, которую можно использовать для массовой вакцинации населения. 2 н. и 1 з.п. ф-лы, 9 ил., 12 табл., 10 пр.
1. Способ получения антигена или антигенов вируса гриппа, включающий получение куриных эмбрионов (КЭ), их дезинфекцию, предварительную инкубацию, заражение рабочим раствором посевного вируса, инкубацию зараженных КЭ, охлаждение после инкубации, сбор вируссодержащей аллантоисной жидкости, дезагрегацию выделенных вирусов путем добавления раствора NaCl до конечной концентрации 0,23-0,30 М, инактивацию их добавлением β-пропиолактона до конечной концентрации 0,1% и очистку вируссодержащей аллантоисной жидкости методами микрофильтрации с использованием каскада из трех фильтров с диаметром пор 10 мкм, 1 мкм, 0,6 мкм и ультрафильтрации с пределом отсечения 300 кДа, затем проводят концентрирование осветленной вируссодержащей аллантоисной жидкости не более чем в 20 раз, концентрат очищают путем двойного ультрацентрифугирования в градиенте плотности сахарозы, после чего осуществляют расщепление инактивированного вирусного концентрата с использованием детергента n-октил-β-D-глюкопиранозида (октилглюкозида) или тетрадецилтриметиламмония бромида (ТДТАБ), удаление недоразрушенных вирионов и комплексов рибонуклеопротеидов с мембранным белком методом центрифугирования, микро- и ультрафильтрацию, хроматографическую очистку и стерилизующую фильтрацию полученного антигена или антигенов, а стабилизацию антигена или антигенов проводят с использованием детергента Тритон Х-100 в концентрации 100-200 мкг/мл.
2. Противогриппозная вакцина, содержащая антиген или антигены, полученные способом по п. 1.
3. Вакцина по п. 2, отличающаяся тем, что она содержит 1, 3 или 4 антигена, полученные способом по п. 1.
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ПРОТИВ ГРИППА | 2009 |
|
RU2423995C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННЫХ ВИРИОННЫХ КОНЦЕНТРАТОВ | 2013 |
|
RU2535153C1 |
| СПОСОБ ОЧИСТКИ ВИРУСА ГРИППА | 2012 |
|
RU2493872C1 |
| CN 103721251 A, 16.04.2014 | |||
| CN 106668854 A, 17.05.2017 | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2019-12-25—Публикация
2019-06-14—Подача