Настоящее изобретение относится к композиции, содержащей по меньшей мере один иммуностимулирующий комплекс ISCOM и по меньшей мере один эктодомен из по меньшей мере одного домена гемагглютинина (HA) и по меньшей мере один эктодомен из по меньшей мере одного домена нейраминидазы (NA) из одного или нескольких вирусов гриппа, при эти эктодомены представляют эктодомены, выделенные из вируса гриппа. Эта композиция может быть использована в качестве иммуностимулирующего лекарственного средства, иммуномодулирующего фармацевтического средства или вакцины, например, против гриппа, для позвоночных, например, птиц и млекопитающих.
Уровень техники
Недавнее появление пандемического вируса гриппа свиного происхождения 2009 A(H1N1) придает особое значение потенциальной способности вирусов гриппа вызывать заболеваемость и смертность в человеческой популяции в глобальном масштабе. Во всем мире более 200 стран и заокеанских территорий или сообществ сообщали о подтвержденных лабораторно случаях пандемического вируса, включающих более 16000 смертей [1]. Вакцинация является первичным способом для предотвращения или снижения бремени гриппозного заболевания. Однако, как иллюстрируется опять-таки пандемией 2009 года, быстрая реакция во время ранней фазы вспышки эпидемии задерживается трудоемким используемым в настоящее время получением вакцинного штамма и способа приготовления вакцины. Это, вместе с хорошо известной способностью вирусов гриппа избегать существующего иммунитета посредством антигенной изменчивости и антигенного “дрейфа”, усиливает необходимость новых и предпочтительно более широко эффективных вакцин, которые могут быть получены быстро и в виде адаптивной реакции в отношении вновь возникающих антигенных вариантов.
Лицензированные в настоящее время противовирусные вакцины состоят из гликопротеинов вирусной оболочки, гемагглютинина (НА) и нейраминидазы (NA). Антитела, продукция которых вызывается этими двумя большими гликопротеинами, имеют различающиеся свойства в иммунитете против вируса гриппа. Антитела к НА обычно нейтрализуют инфекционность вируса, предотвращая связывание вируса с рецепторами сиаловой кислоты на клетках-мишенях или, затем, предотвращая слияние вирусной и клеточной мембраны, посредством которого вирусный геном приобретает доступ к клетке-мишени. Антитела к NA делают вирусное потомство неспособным к высвобождению из инфицированных клеток за счет ингибирования разрушающей NA-ассоциированный рецептор ферментативной активности. НА-опосредуемый гуморальный иммунитет был охарактеризован наиболее полно, и было показано, что он предотвращает вирусную инфекцию. Вклад NA-антител в предотвращение заболевания был менее хорошо исследован. Эти антитела продуцируют, по-видимому, некий тип допустимого иммунитета [2], характеризуемого уменьшением высвобождения инфекционного вируса из апикальных поверхностей инфицированного эпителия [2-8], уменьшая возможность выделения и распространения вируса в окружающую среду.
Иммунизация комбинацией HA и NA обеспечивает усиленную защиту против гриппа [5, 9, 10]. Хотя HA и NA являются эквивалентно иммуногенными [2], гуморальная иммунная реакция в отношении общепринятых инактивированных вакцин или вирусной инфекции является природно склоняющейся в направлении НА, так как НА и NA встречаются на вирусной поверхности в соотношении приблизительно 4:1 [11]. Кроме того, в интактных вирионах НА иммунологически выигрывает в отношении NA в примировании В- и Т-клеток, как показано в мышах [12]. Это конкурирование антигенов не наблюдается в случае вакцинированных животных при раздельном введении НА и NA [10, 13]. Лицензированные в настоящее время пандемические вакцины, в также сезонные трехвалентные вакцины обычно готовятся из цельных вирусов, и, следовательно, смещены в сторону содержания большего количества антигена НА, чем антигена NA. Адаптирование соотношения НА-NA в вакцинных препаратах в пользу NA может обеспечивать более сбалансированную гуморальную иммунную реакцию, приводящую к более высоким уровням антитела NA и увеличенной защите против заболевания [3, 14].
Поскольку существующие вакцины на основе инактивированных вирусов гриппа стандартизованы только в отношении количества НА, содержание NA является вариабельным, так же как, следовательно, частота и уровень сероконверсии в NA, которая часто является довольно слабой [28, 29].
Что является типичным для вирусов гриппа типа А, антигенные варианты НА и NA в определенном подтипе вируса, способном ускользать от существующих механизмов иммунологического надзора, постепенно отбираются в популяции людей. Этот процесс антигенной изменчивости (дрейфа) требует почти ежегодной корректировки композиции сезонной вакцины в ответ на возникающие вновь варианты. Ввиду угрозы будущих пандемий гриппа, вызываемых, например, вирусом птиц H5N1, существует потребность в вакцинах, индуцирующих широкий защитный иммунитет.
Сущность изобретения
Настоящее изобретение относится к композиции, содержащей по меньшей мере один иммуностимулирующий комплекс ISCOM и по меньшей мере один эктодомен из по меньшей мере одного домена гемагглютинина (HA) и по меньшей мере один эктодомен из по меньшей мере одного домена нейраминидазы (NA) из одного или нескольких вирусов гриппа, причем эти эктодомены представляют эктодомены, выделенные из вируса гриппа, и к набору.
Композиции, содержащие адъювант ISCOM и его фрагменты НА или NA, известны, например, из WO 2008157419 и [5, 9, 10]. Однако ранее не было описано использование эктодоменов из как НА, так и NA вместе с адъювантом ISCOM.
В настоящее время обнаружено, что вакцинация эктодоменами как из NA, так и НА вместе с ISCOM или ISCOM matrix в качестве адъювантов, уменьшала репликацию вируса - например, снижением легочных титров, - и уменьшала клинические эффекты инфекции, такие как потеря массы тела и патология легких.
Мультимерные эктодомены НА и NA имеют высокий вакцинный потенциал, так как они могут быть легко, быстро, гибко и безопасно получены в высоких количествах. Включение NA в противогриппозные вакцины, в высокой степени и специфически способствуют защите посредством НА. По-видимому, его включение в вакцину уменьшает требующуюся дозу НА и расширяет защитный иммунитет.
Описание фигур
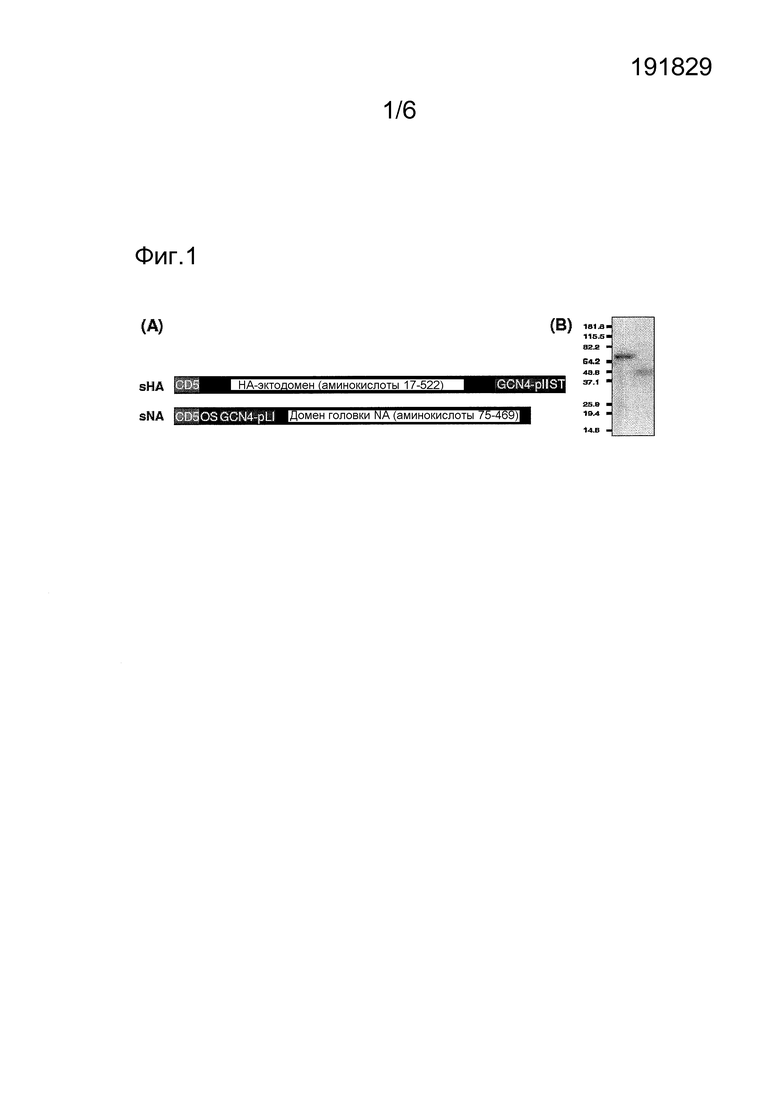
Фиг. 1
Конструирование и экспрессия растворимых, мультимерных белков НА (sHA) и NA (sNA) вируса гриппа 2009 А(H1N1). А) Схематическое представление рекомбинантно экспрессированных белковых конструктов sHA и sNA. sHA: эктодомен НА (аминокислоты 17-522) экспрессируется с N-концевым сигнальным пептидом CD5 и С-концевым доменом GCN4-pll тримеризации (GCN4-pll) и Strep-Tag (ST), соответственно, sNA: домен головки NA (аминокислоты 75-469) экспрессируется с N-концевым сигнальным пептидом CD5, пептидом OneSTrEP (OS) и доменом тетрамеризации GCN4 (GCN4-pLl). В) Окрашенный Кумасси синим восстанавливающий электрофорез в ДСН-ПААГ аффинно очищенных белков sHA и sNA.
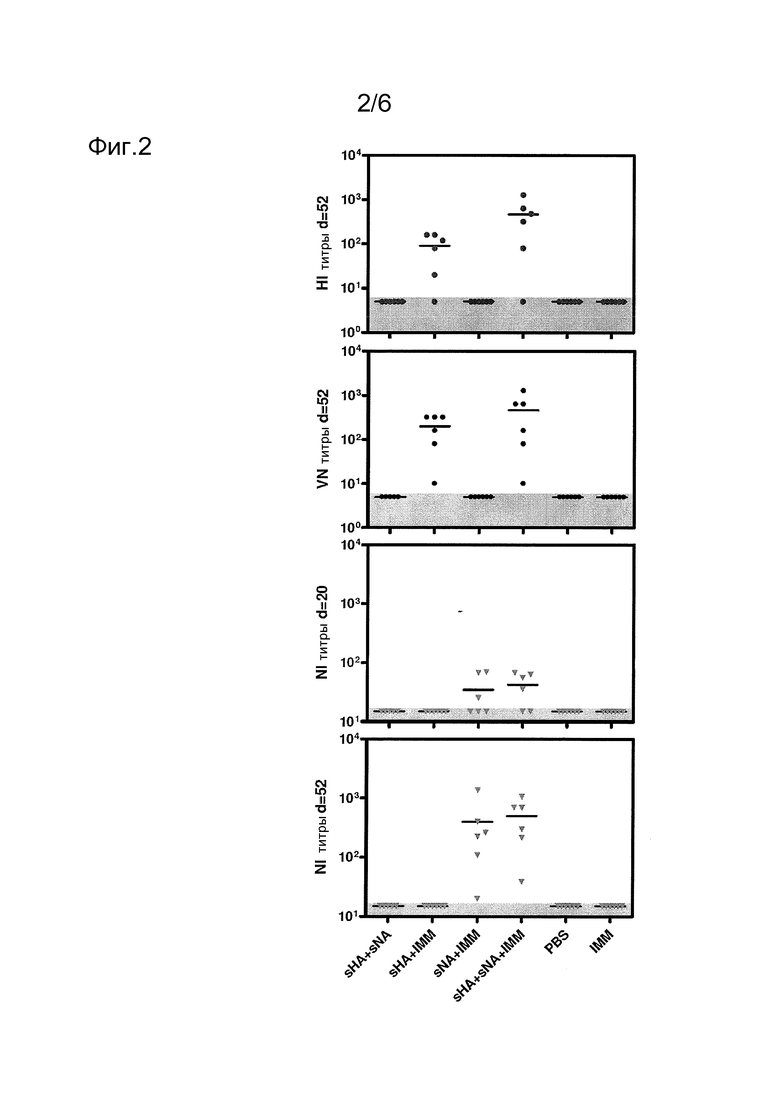
Фиг. 2
Реакция антител на вакцинацию мультимерными антигенами НА и NA вируса гриппа 2009 А(H1N1). Хорьков иммунизировали в день 0 и день 20: 3,75 мкг sHA3+3,75 мкг sNA4 (sHA+sNA); 3,75 мкг sHA3 в адъюванте (ISCOM Matrix M [IMM]; sHA+IMM); 3,75 мкг sNA4 в адъюванте (sNA+IMM); 3,75 мкг sHA3+3,75 мкг sNA4 в адъюванте (sHA+sNA+IMM), PBS (ЗФР) или IMM, как указано. Реакцию антител на вирус гриппа 2009 A(H1N1) оценивали анализами ингибирования гемагглютинина (HI; верхняя панель), нейтрализации вируса (VN; вторая панель от верхней) и ингибирования нейраминидазы (NI) (нижние панели). Каждая точка представляет результат одного хорька. Горизонтальные линии обозначают средние значения. Горизонтальная серая полоса указывает предел детектирования этого анализа.
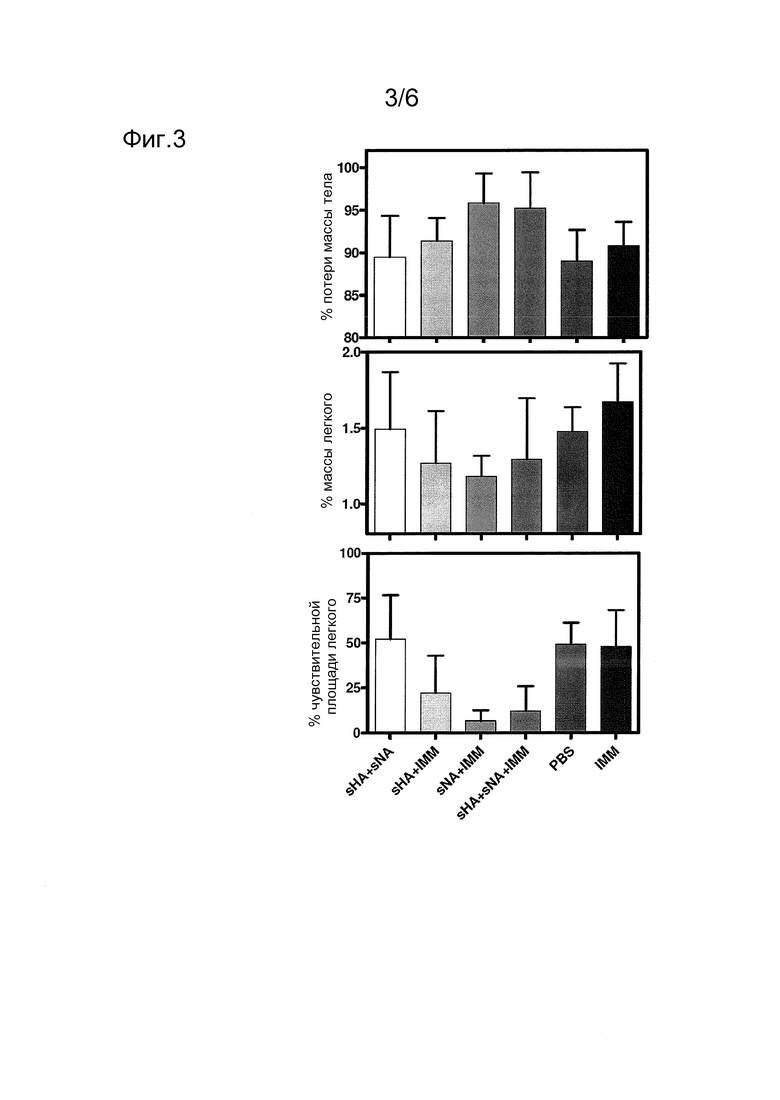
Фиг. 3
Клинические эффекты после заражающей инокуляции вирусом гриппа 2009 А(H1N1). Хорьков, иммунизированных, как описано в подписи к Фиг. 2, инокулировали внутритрахеально в день 52 106 TCID50 вируса. Потери масс тела выражены в виде процента массы тела перед инфекцией (верхняя панель). Массы легких выражены в виде процента массы тела в качестве индикатора уплотнения легких (средняя панель). Легкие наблюдали макроскопически и оценивали в баллах в отношении процента площади легкого, проявляющей уплотненные зоны (нижняя панель). Представлены средние величины; стержни ошибки показывают стандартное отклонение. Горизонтальная серая полоса указывает предел детектирования этого анализа.
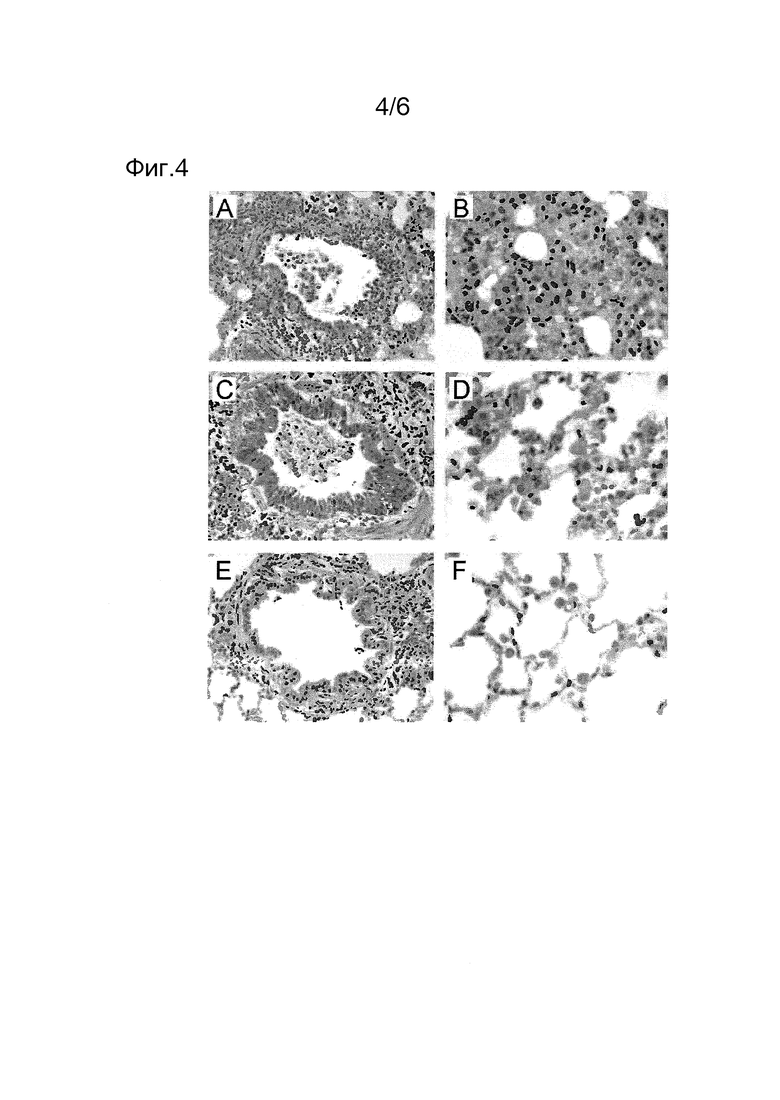
Фиг. 4
Примеры гистопатологических показателей в легких хорьков после инокуляции. А) Воспалительные инфильтраты и потеря эпителиальных клеток в бронхиолярных стенках и клеточные остатки в бронхиолярном просвете, наблюдаемые в легких незащищенных хорьков, псевдовакцинированных PBS (ЗФР) или только адъювантом (IMM) или вакцинированных sHA3+sNA4 без адъюванта. В) Белковая жидкость (отек) и инфильтрат воспалительных клеток в альвеолах легких хорьков, псевдовакцинированных ЗФР или только адъювантом (IMM), или вакцинированных sHA3+sNA4 без адъюванта. С) Перибронхиолярный инфильтрат и остатки клеток в бронхиоле хорька, вакцинированного sHA+IMM. D) воспалительный инфильтрат в альвеолярных перегородках и гипертрофия и гиперплазия пневмоцитов типа II в легких хорьков, вакцинированных sHA+IMM. Е) Перибронхиолярный инфильтрат, наблюдаемый в легких хорьков, групп sNA+IMM и sHA+sNA+IMM. F) Отсутствие воспалительных клеток и гиперплазии пневмоцитов типа II в альвеолах легких хорьков групп sNA+IMM и sHA+sNA+IMM. H&E-окрашивание; увеличение 20х (бронхиолы) и 40х (альвеолы).
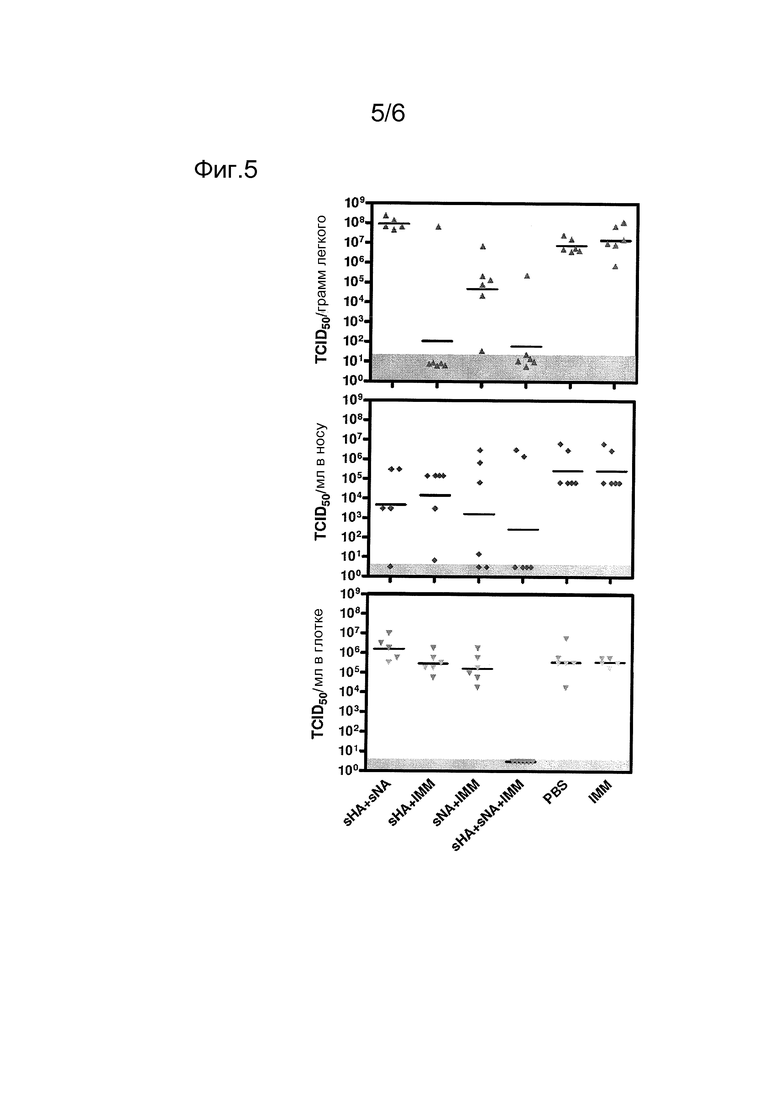
Фиг. 5
Вирусные титры в легких, в носу и в глотке инокулированных для заражения животных. Репликацию вируса в хорьках, иммунизированных и зараженных, как описано в подписи к Фиг. 3, анализировали спустя 4 дня после инокуляции. Титры вируса определяли в гомогенатах легких (верхняя панель), мазках из носа (средняя панель) и мазках из глотки (нижняя панель). Титры определяли конечным титрованием в клетках MDCK. Каждая точка представляет результат одного хорька. Горизонтальные линии представляет средние значения. Горизонтальная серая полоса указывает предел детектирования этого анализа.
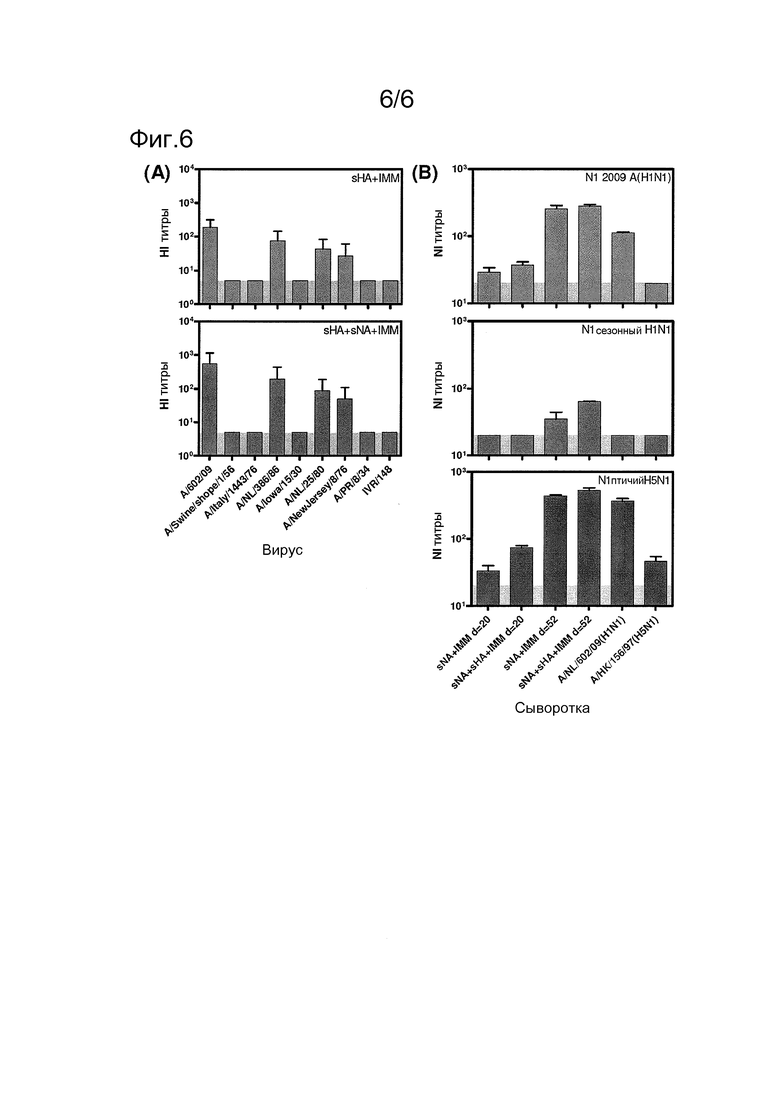
Фиг. 6
Индуцирование перекрестно-нейтрализующих антител вакцинацией мультимерными антигенами sHA3 и sNA4 вируса гриппа 2009 А(H1N1). (А) Сыворотки хорьков, иммунизированных дважды sHA3 или sHA3+sNA4, в обоих случаях в адъюванте, как описано в подписи к Фиг. 2, тестировали в анализе HI, на активность в отношении различных вирусов гриппа, включающих в себя Al/wine/shope/1/56, A/italy/1443/76, A/NL/386/86, A/Iowa/15/30, A/NL/25/80, A/NewJersey/8/76, A/PR/8/34 и IVR/148 гриппа H1N1. Показаны средние титры; стержни ошибок показывают стандартное отклонение. (В) Сыворотки хорьков, иммунизированных один раз или два раза sHA4 или sHA3+sNA4, в обоих случаях в адъюванте, объединяли и тестировали в анализе HI, на активность против вируса гриппа sNA4 А/Kentucky/UR06-0258/2007(H1N1) и A/turkey/Turkey/1/2005(H5N1). NA A/California/04/2009(H1N1) тестировали вместе в качестве положительного контроля. Сыворотки положительного контроля, специфические в отношении вируса гриппа A/NL/602/09(H1N1) или A/turkey/Turkey/1/2005(H5N1), получали из хорька, инфицированного этими вирусами. Показаны средние титры двух повторностей; стержни ошибок показывают стандартные отклонения. Горизонтальная серая полоса указывает предел детектирования этого анализа.
Подробное описание
Это изобретение относится к композиции, содержащей по меньшей мере один иммуностимулирующий комплекс ISCOM и по меньшей мере один эктодомен из по меньшей мере одного домена HA и по меньшей мере один эктодомен из по меньшей мере одного домена NA, причем эти эктодомены представляют эктодомены, выделенные из вируса гриппа.
Этот эктодомен является доменом мембранного белка, который простирается во внеклеточное пространство. Эктодомены обычно являются частью белка, который инициирует контакт с поверхностью, который приводит к трансдукции сигнала. В этой композиции он может действовать в качестве антигена, и эта композиция может быть использована в качестве вакцины.
“Выделенный” означает, что этот эктодомен по существу отделен от других белков и от остатка белков NA и НА, соответственно, вируса гриппа. Могут присутствовать минорные аминокислотные остатки. Этот эктодомен может быть полным эктодоменом или его частью, имеющей ту же самую ферментативную и/или антигенную активность. Согласно одному варианту осуществления, эта часть эктодомена может быть доменом его головки. Такие эктодомены, являющиеся полным эктодоменом или его частью, имеющей ту же самую ферментативную и/или антигенную активность, могут быть выделены из вируса гриппа или получены синтетически. Они могут быть представлены отделенными друг от друга или связанными вместе.
Согласно одному варианту осуществления, этот эктодомен является растворимым эктодоменом или растворимым доменом головки.
Один или несколько эктодоменов из по меньшей мере одного домена гемагглютинина и один или несколько эктодоменов из по меньшей мере одного домена нейраминидазы из одного и того же или отличающихся видов или штаммов вируса могут быть представлены в виде гибридных белков, которые могут быть рекомбинантными.
Рекомбинантно полученные антигены НА и NA делают возможным развитие вакцин, в которых могут легко контролироваться относительные количества обоих антигенов. Эукариотические системы экспрессии, как млекопитающих, так и насекомых, являются предпочтительными платформами для продуцирования таких гликопротеинов ввиду их лучшего сохранения природной антигенной структуры этих белков. Гибридные белки могут быть получены, как описано в Примере 1 и в соответствии с Genscript http:/www.genscript.com/gene_synthesis.html.
Этот вирус гриппа может быть выбран из субсеротипов гриппа, например, из HxNy, где х обозначает 1-16 и y обозначает 1-9. Таким образом, х может быть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16 и y может быть 1, 2, 3, 4, 5, 6, 7, 8, 9. Этот вирус гриппа может быть выбран из любых видов, таких как человек, птица, крупный рогатый скот, например, виды семейства коровьих, свиней, овец, коз. Могут быть использованы вирус гриппа птиц, например, Н1-6 N1-9, или вирус гриппа человека Н1-3 N1-2 или любая комбинация эктодоменов из их NA и HA. Эти эктодомены NA и/или эктодомены HA могут быть из различных видов вируса гриппа, например, вируса гриппа человека и птицы. Таким образом, один или несколько эктодоменов NA человека или птицы могут быть комбинированы с одним или несколькими эктодоменами НА человека и птицы, посредством чего эти NA и HA могут быть различными типами HxNy.
Согласно одному варианту осуществления, этим вирусом гриппа является грипп А, такой как вирус N1 H1, например, выбранный из вируса гриппа 1918 H1N1 (A/South Carolina/1/18) и/или вируса 2004 H5N1 A/Vietnam/1203/04)H1N1, A/California/07/2009, и/или A/California/04/2009, и/или A/California/09/2009, и/или A/Kentucky/UR06-0258/2007(H1N1), и/или A/turkey/Turkey/1/2005(H5N1).
Могут быть использованы один или несколько эктодоменов (мультимеров) из NA и из HA. Эта композиция может содержать 1-5 эктодоменов по меньшей мере из одного домена гемагглютинина и 1-5 доменов головок по меньшей мере из одного домена нейраминидазы.
Согласно одному варианту осуществления, этот по меньшей мере один эктодомен гемагглютинина выбран из трехмерного эктодомена НА (аминокислоты 17-522) A/California/09/2009.
Согласно одному варианту осуществления этот по меньшей мере один домен головки нейраминидазы выбран из тетрамерного домена головки NA (аминокислоты 75-469) вируса A/California/09/2009. Последовательность этого белка A/California/09/2009 известна в данной области, например, из http://www.ncbi.nim.nih.gov./protein/227809830 и http://www.ncbi.nim.nih.gov/protein/227809834.
Эти комплексы ISCOM могут быть использованы в качестве адъювантов и иммуномодулирующих агентов. Они могут быть комплексами ISCOM и/или комплексами ISCOM matrix.
Комплекс ISCOM matrix и/или комплекс ISCOM могут использоваться вместе с одним или несколькими антигенами, предназначенными для вызывания иммунной реакции в отношении инфекции гриппа. Эти антигены и комплекс ISCOM matrix или комплекс ISCOM могут вводиться в смеси или по отдельности.
Один комплекс ISCOM matrix содержит по меньшей мере один гликозид и по меньшей мере один липид. Этот гликозид имеет адъювантное действие и является предпочтительно сапонином, в частности, из Quillaja saponaria Molina (Quil A). Этот липид является по меньшей мере одним стерином, таким как холестерин, и необязательно также фосфолипидом. Эти комплексы ISCOM matrix могут также содержать один или несколько других иммуномодуляторных (адъювант-активных) веществ, необязательно гликозид, и могут быть получены, как описано в ЕР 0436620 В1.
Один комплекс ISCOM содержит по меньшей мере один гликозид, по меньшей мере один липид и по меньшей мере один тип антигенного вещества или эпитопа. Эти антигенные вещества могут быть веществами разного рода, такими как белки и пептиды, гликопротеины и гликопептиды, углеводы и т.д. Эти гликозиды имеют адъювантное действие и являются предпочтительно сапонином, в частности, из Quillaja saponaria Molina (Quil A). Эти комплексы усиливают иммуногенность включенных антигенов и могут также содержать один или несколько других иммуномодуляторных (адъювант-активных) веществ. ISCOM могут быть получены, как описано в ЕР 0109942 В1, ЕР 0242380 В1 и ЕР 180546 В1. Кроме того, может быть использован транспортный антиген и/или антиген-пассажир, описанные в ЕР 9600647-3 (PST/SE97/00289).
Антигены-эктодомены могут быть смешаны с комплексом ISCOM matrix и/или комплексом ISCOM, ассоциированы или конъюгированы на комплексе ISCOM matrix или смешаны с ISCOM или быть связаны на комплексах ISCOM. Полученный комплекс ISCOM может содержать один или несколько других антигенов, чем эти антигены эктодоменов. Согласно одному варианту осуществления, один или несколько антигенов эктодоменов могут быть использованы, будучи интегрированными в комплекс ISCOM. Затем такой комплекс ISCOM может быть смешан с одним или несколькими антигенами эктодоменов. Могут быть использованы один или несколько антигенов и могут быть использованы транспортный антиген и антиген-пассажир, описанные в ЕР 9600647-3 (PST/SE97/00289).
Для интеграции в частицы ISCOM эти антигены должны иметь некоторую гидрофобную часть или быть электростатически прикрепленными к ISCOM Matrix. Антигены, которые не имеют гидрофобных частей, могут быть связаны с такими молекулами. Гидрофобные молекулы и способы связывания описаны в ЕР 180564.
Липид, содержащийся в этом иммуногеном комплексе, является по меньшей мере стерином, таким как холестерин, и необязательно также фосфолипидом. Эти используемые липид (липиды) являются, в частности, липидами, описанными в Патенте заявителей этого изобретения ЕР 0109942 В1, в частности, на странице 3, и в Патенте ЕР 0436620 В1 на строчках 7-24 страницы 7. Особенно применимы стерины, такие как холестерин, и фосфолипиды, такие как фосфатидилэтаноламин и фосфатидилхолин.
Могут быть использованы липидсодержащие рецепторы, которые связываются с клеточно-связывающимися компонентами, такими как гликолипиды, в том числе рецептор холерного токсина, который представляет собой ганглиозид GM1, и фукозный антиген группы крови. Затем эти связывающиеся с клеткой компоненты могут функционировать в качестве нацеливающей на слизь молекулы и быть связаны с липидсодержащими веществами посредством простого смешивания их с комплексами, которые их содержат. Комплексы ISCOM, содержащие рецепторы, описаны, например, в WO 97/30728.
В одном варианте осуществления этого изобретения, гликозид в этом иммуногеном комплексе для применения в вакцинации против гриппа, является фракцией сапонина из Quillaja saponaria Molina.
Могут быть также использованы любые субфрагменты сапонинов Quillaja saponaria Molina. Кроме того, может быть использована любая комбинация субфрагментов Quillaja saponaria Molina. Так, каждый из двух или более субфрагментов может быть интегрирован в комплекс ISCOM или комплекс ISCOM matrix.
Термин “фракция сапонина из Quillaja saponaria Molina” используется на протяжении этого описания и в формуле данного изобретения в качестве общего описания полуочищенной или определенной фракции сапонина Quillaja saponaria Molina или по существу чистой фракции. Важно, что эта фракция не содержит такого количества любой другой фракции, которое негативно влияет на хорошие результаты, которые получают при использовании смесей комплексов ISCOM или комплексов ISCOM matrix, содержащих по существу одну фракцию.
Согласно одному варианту осуществления, обеспечен иммуногенный комплекс для применения в соответствии с этим изобретением, дополнительно содержащий, в виде части этого иммуногенного комплекса или в смеси с ним, по меньшей мере один дополнительный адъювант, другой, чем фракция сапонина из Quillaja saponaria Molina, или по меньшей мере один другой гликозид или сапонин, чем один или несколько из них, интегрированные в комплекс ISCOM matrix или ISCOM. Примерами используемых несапониновых адъювантов являются различные масла и Al(OH)3.
Примерами дополнительных адъювантов, которые могут быть включены в комплекс ISCOM и комплекс ISCOM matrix, соответственно, или смешаны с ними, являются любой адъювант, природный или синтетический, с желаемым иммуномодуляторным действием, например, природно-встречающийся адъювант или его производные, синтетические или полусинтетические молекулы сапонина, произведенные из неочищенного экстракта сапонина Quillaja saponaria Molina; например, сапонины и фракции сапонинов из Quil A, скелет клеточных стенок, блоксополимеры, например, гидрофильные блоксополимеры, например, CRL-1005, TDM (димуколат трегалозы), липопептиды, LPS и LPS-производные, Липид А из различных бактериальных видов и их производные, (например, монофосфориллипид А, мурамилди- или трипептид или мурамилдипептид), MDP-производные, (например, производные жирных кислот), замещенные MDP, треониланалоги MDP (и их производные), CpG-варианты, CpGODN-варианты, эндогенные иммуномодуляторы человека и животных, (например, GM-CSF), IL-2, адъювантные активные бактериальные токсинов, нативные или модифицированные токсины, (например, холерный токсин СТ и его субкомпоненты СТВ и СТА1), термолабильный токсин (LT) E. coli, токсин Bordetella pertussis (BP) и нитеобразный гемагглютинин BP, DDA, полианионы, такие как декстрансульфат, и липополисахариды, такие как сапонины (другие, чем Quil A), см. (“Future prospects for vaccine adjuvants”, Warren H.S. (1988) CRS Crit. Rev. Immunol. 8:2, 83-101; “Characterisation of non-toxic monophosphoryl lipid A”, (1987) Johnson A.G. et al., Rev. Infect. Dis. 9:5, 5512-5516; “Developmental status of synthetic immunomodulators”, Berendt, M.J. et al (1985, Year Immunol. 193-201; “Immunopotentiating conjugates”, Stewart-Tull D.E., Vaccine, 85, 3:1, 40-44), все из которых включены здесь посредством ссылки.
Частица ISCOM может быть комплексом ISCOM или комплексом ISCOM matrix, изготовленным из любого сапонина. Адъювантная фракция А и другой по меньшей мере один адъювант может быть также связан на различных или одних и тех же частицах ISCOM или частицах ISCOM matrix, или один или несколько адъювантов могут быть смешаны с частицами ISCOM.
Для интеграции в частицы ISCOM эти адъюванты должны иметь некоторую гидрофобную молекулу. Адъюванты, которые не имеют гидрофобных частей, могут быть связаны с такими молекулами. Гидрофобные молекулы и способы связывания описаны в ЕР 180564. Предпочтительно эти адъюванты интегрируются в различные частицы ISCOM.
В другом варианте этого изобретения адъювантная фракция А Quil A интегрирована в частицы ISCOM, тогда как другой по меньшей мере один адъювант не интегрирован в частицы ISCOM и используется в свободном виде в этой композиции.
В другом предпочтительном варианте осуществления этого изобретения адъювантная фракция А Quil A интегрирована в частицы ISCOM или в частицы ISCOM matrix, тогда как другие адъюванты не интегрированы в частицы ISCOM или частицы ISCOM matrix и используются в свободном виде в этой композиции.
В другом особенно предпочтительном варианте осуществления эта композиция содержит фракцию А Quil A, интегрированную в частицы ISCOM или в частицы ISCOM matrix и по меньшей мере один другой адъювант, который не интегрирован в частицы ISCOM или частицы ISCOM matrix.
В другом предпочтительном варианте осуществления этот по меньшей мере один другой адъювант является MPL или холерным токсином СТ. Этот MPL или холерный токсин может быть интегрирован в ту же самую частицу ISCOM или частицу ISCOM matrix или в каждую отличающуюся частицу ISCOM или в частицу ISCOM matrix. Предпочтительно, эти MPL или холерные токсины находятся в свободной форме.
Фракция сапонина из Quillaja saponaria Molina для использования в комплексе ISCOM matrix, комплексе ISCOM и/или по меньшей мере в одном дополнительном адъюванте может быть выбрана из фракции А, фракции В, фракции С Quillaja saponaria Molina, неочищенной фракции Quillaja saponaria Molina, QA 1-21. Однако, с использованием современных эффективных способов разделения сообщены и описаны более 60 различных структур (Bankefors et al., J Chrom B Analyt Technol Biomed Life Sci in press; Bankefors et al., Rapid Commun Mass Spectrom 22:3851; Broberg et al., J Mass Spectrom 39:691; Nyberg et al., Anal Chem 75:268; Guo and Kenne Phytochemistry 55:419; Norl and Kene Carbohydr Res 329:817; Guo and Kenne Phytochemistry 54:615; Guo et al., Phytochemistry 53:861; Nyberg et al., Carbohyd. Res. 323:87; Nord and Kenne Carbohyd. Res 320:70; Guo et al., Phytochemistry 48:175).
При получении, как описано здесь, фракции А, В и С Quillaja saponaria Molina, каждая, представляют группы или семейства химически близкородственных молекул с определяемыми свойствами. Хроматографические условия, при которых их получают, являются такими, что воспроизводимость от партии к партии в профиле элюции и биологической активности являются высоко согласующимися.
Термин “фракция одного сапонина из Quillaja saponaria Molina” используется на протяжении этого описания и в формуле изобретения как общее описание полуочищенной или определенной фракции сапонина Quillaja saponaria или по существу чистой фракции. Важно, что эта фракция не содержит так много любой другой фракции, чтобы негативно влиять на хорошие результаты, которые получают при использовании смесей ISCOM или ISCOM matrix, содержащих по существу одну фракцию. Этот препарат сапонина может, если желательно, включать в себя минорные количества, например, до 40 мас.%, например, до 30 мас.%, до 20 мас.%, до 15 мас.%, до 10 мас.%, до 7 мас.%, до 5 мас.%, до 2 мас.%, до 1 мас.%, до 0,5 мас.%, до 0,1 мас.% других соединений, таких как другие сапонины или другие адъювантные материалы.
Фракции сапонина А, В и С, согласно данному изобретению, являются такими, как описанные в WO 96/11711, фракции В3, В4 и B4b являются такими, как описанные в ЕР 0 436 620; фракции QA1-21 являются такими, как описанные в ЕР 0 3652 279 В2. Могут быть использованы фракции QA-1-2-3-4-5-6-7-8-9-10-11-12-13-14-15-16-17-18-19-20 и 21 ЕР 0 3632 279 В2, в частности, QA-7, 17-18. Их получают, как описано в ЕР 0 362 279 В2, в частности, на странице 6, и в Примере 1 на страницах 8 и 9.
Может быть использован любой тип неочищенных или полуочищенных фракций сапонинов из Quillaja saponaria Molina. Одна неочищенная фракция Quillaja saponaria Molina, используемая для цели этого патента, является любой композицией сапонина, несколько очищенной от других липофильных несапониновых компонентов. Она может быть любой фракцией сапонинов, которая является очищенным, но не фракционированным препаратом неочищенной фракции Quillaja saponaria Molina, где эти сапонины не отделены друг от друга, и может быть получена или доставлена, например, из Desert King Chile (www.desertkingchile.cl), Sigma-Aldrich (www.sigmaaldrich.com), Berghausen (www.berghausen.com), Brenntag Biosector (www.brenntag-biosector.com).
Фракции А, В и С, описанные в WO 96/11711, получают из липофильной фракции, полученной при хроматографическом разделении неочищенного водного экстракта Quillaja saponaria Molina и элюции 70% ацетонитрилом в воде для отделения липофильной фракции. Затем эту липофильную фракцию разделяют полупрепаративной HPLC с элюцией с использованием градиента от 25% до 60% ацетонитрила в подкисленной воде. Эта фракция, называемая здесь “Фракцией А” или “QH-A”, является фракцией или соответствует фракции, которая элюируется при приблизительно 39% ацетонитрила. Фракция, называемая здесь “Фракцией В” или “QH-В”, является фракцией или соответствует фракции, которая элюируется при приблизительно 47% ацетонитрила. Фракция, называемая здесь “Фракцией С” или “QH-С”, является фракцией или соответствует фракции, которая элюируется при приблизительно 49% ацетонитрила.
В одном варианте осуществления используется неочищенная фракция сапонинов.
Согласно другому варианту осуществления неочищенная фракция сапонинов может быть использована вместе с любой другой очищенной фракцией сапонинов, например, различными вышеупомянутыми фракциями сапонинов.
Согласно одному варианту этого изобретения, эту фракцию сапонина из Quillaja saponaria Molina, которая интегрирована в комплекс ISCOM или в комплекс ISCOM matrix, или по меньшей мере один дополнительный адъювант, который также интегрирован в комплекс ISCOM или ISCOM matrix или смешан с ними, выбирают из фракции А, фракции В, фракции С Quillaja saponaria Molina, полуочищенного препарата Quillaja saponaria Molina, очищенного препарата Quillaja saponaria Molina или любой очищенной субфракции, например, QA 1-21.
Могут быть использованы комплексы ISCOM matrix и/или ISCOM, содержащие, соответственно, по меньшей мере две фракции сапонина Quillaja saponaria. Могут быть использованы любые комбинации масс.% различных фракций сапонинов. Может быть использована любая комбинация масс.% любых двух фракций, например, любые масс.% фракции А и любые масс.% другой фракции, например, любой фракции неочищенного сапонина или фракции С Quillaja saponaria Molina, соответственно. Комплексы ISCOM matrix и/или ISCOM могут содержать от 0,1 до 99,9 мас.%, 5-95 мас.%, 10-90 мас.%, 15-85 мас.%, 20-80 мас.%, 25-75 мас.%, 30-70 мас.%, 35-65 мас.%, 40-60 мас.%, 45-55 мас.%, 40-60 мас.%, 50-50 мас.%, 55-45 мас.%, 60-40 мас.%, 65-35 мас.%, 70-30 мас.%, 75-25 мас.%, 80-20 мас.%, 85-15 мас.%, 90-10 мас.%, 95-05 мас.%, 50-99 мас.%, 60-90 мас.%, 70-90 мас.%, 75-85 мас.%, фракции одного сапонина, например, фракции А Quillaja saponaria Molina, и остаток до 100% в каждом случае интервала другого сапонина, например, любой другой неочищенной фракции или любой другой фракции, например, фракции С Quillaja saponaria Molina, в расчете на сумму этих масс этих фракций сапонинов, Quillaja saponaria Molina в комплексах ISCOM matrix и/или ISCOM.
Согласно одному варианту осуществления, обеспечен комплекс ISCOM matrix и/или ISCOM для применения в соответствии с этим изобретением, содержащий 5-99 мас.% одной фракции, например, фракции А Quillaja saponaria Molina, и остаток до 100 мас.% другой фракции, например, фракции неочищенного сапонина или фракции С Quillaja saponaria Molina, в расчете на массу фракции А и фракции С.
Согласно другому варианту осуществления, обеспечен комплекс ISCOM matrix и/или ISCOM для применения в соответствии с этим изобретением, содержащий 40-99 мас.% одной фракции, например, фракции А Quillaja saponaria Molina, и 1-60 мас.% другой фракции, например, фракции неочищенного сапонина или фракции С Quillaja saponaria Molina, в расчете на массу фракции А и фракции С.
Согласно еще одному варианту осуществления, обеспечен комплекс ISCOM matrix и/или ISCOM для применения в соответствии с этим изобретением, содержащий 70-95 мас.% одной фракции, например, фракции А Quillaja saponaria Molina, и 30-5 мас.% другой фракции, например, фракции неочищенного сапонина или фракции С Quillaja saponaria Molina, в расчете на массу фракции А и фракции С.
В одном варианте осуществления, обеспечен комплекс ISCOM matrix и/или ISCOM для применения в соответствии с этим изобретением, где фракция сапонина из Quillaja saponaria Molina выбрана из любой из QA 1-21.
Согласно одному аспекту этого изобретения, обеспечена композиция, например, вакцина, содержащая по меньшей мере один комплекс ISCOM matrix и/или ISCOM по этому изобретению вместе с одним или несколькими антигенами эктодоменов и один или несколько фармацевтически приемлемых эксципиентов-носителей и/или разбавителей и/или дополнительно адъювантов, для применения в вакцинации против гриппа.
Такая композиция может содержать один или несколько различных типов частиц комплексов ISCOM matrix и/или один или несколько различных типов частиц комплексов ISCOM, причем каждая из частиц комплексов индивидуального типа содержит фракцию одного сапонина из Quillaja saponaria Molina, где эта фракция сапонина в одном комплексе является отличающейся от фракции сапонина в частицах другого комплекса. Эта композиция может содержать несколько частиц. Однако, согласно одному эксперименту, одна частица может содержать только один единственный тип фракции Quillaja saponaria Molina.
Таким образом, один тип по существу чистой фракции сапонина или фракции неочищенного сапонина может быть интегрирован в один комплекс или частицу ISCOM matrix и другой тип по существу чистой фракции сапонина или фракции неочищенного сапонина может быть интегрирован в другой комплекс или частицу ISCOM matrix. Композиция или вакцина может содержать по меньшей мере два типа комплексов или частиц каждого типа, имеющих один тип сапонинов, интегрированных в физически различные частицы.
В этих композициях, могут быть использованы смеси частиц комплекса ISCOM matrix и/или частиц комплекса ISCOM, в которых фракция одного сапонина Quillaja saponaria Molina и фракция другого сапонина Quillaja saponaria Molina по отдельности включены в различные частицы комплекса ISCOM matrix и/или частицы комплекса ISCOM. Могут быть использованы любые комбинации масс.% различных комплексов ISCOM на основе их содержания фракции одного сапонина и любой другой фракции сапонина, например, фракции А и другой фракции, например, любой фракции неочищенного сапонина или фракции С Quillaja saponaria Molina, соответственно. Эти % могут быть такими же, что и упомянутые выше в отношении возможных смесей фракций сапонинов в одной и той же частице комплекса ISCOM matrix и/или частице комплекса ISCOM, но теперь в отдельных частицах комплекса ISCOM matrix и/или частицах комплекса ISCOM.
Еще в одном варианте осуществления, фракцию А Quil А включают в частицу ISCOM или частицу ISCOM matrix и по меньшей мере один другой адъювант включают в каждую отличающуюся частицу ISCOM или частицу ISCOM matrix, или одну или несколько других фракций Quil А или один или более других адъювантов включают в одну и ту же частицу ISCOM или ISCOM matrix, но отличающуюся от частицы, в которую была включена фракция А Quil A, или другой по меньшей мере один адъювант находится в свободной форме.
В этой композиции фракция А может быть комбинирована по меньшей мере с одной из фракций С и фракцией неочищенного сапонина из Quillaja saponaria Molina, например, фракцией Q, в одних и тех же или различных комплексах ISCOM и/или комплексах ISCOM matrix.
Комбинированием комплексов ISCOM matrix, содержащих различные фракции Quillaja saponaria Molina, можно получать композиции, которые являются менее токсичными для животных. Таким образом, в одном варианте осуществления, эта композиция для применения согласно этому изобретению содержит фракцию А в комбинации по меньшей мере с одной из фракций С и Q, в одних и тех же или в различных комплексах ISCOM и/или комплексах ISCOM matrix.
Эта композиция может дополнительно содержать один или несколько приемлемых эксципиентов, носителей и/или разбавителей и дополнительных адъювантов.
Эта композиция может содержать по меньшей мере один другой адъювант, чем сапонин, интегрированный в частицу комплекса ISCOM или частицу комплекса ISCOM matrix. Этим дополнительным адъювантом может быть фракция сапонина из Quillaja saponaria Molina, которая может быть связана или может быть смешана с иммуногенной частицей комплекса ISCOM matrix или частицей комплекса ISCOM. Он может быть также другим типом сапонина или другим типом адъюванта, который может быть интегрирован в иммуногенную частицу комплекса ISCOM matrix или частицу комплекса ISCOM, связан или смешан с иммуногенной частицей комплекса ISCOM matrix или частицей комплекса ISCOM.
Эта композиция может быть вакциной.
Термин “вакцина” относится здесь к материалу, способному вызывать иммунную реакцию. Вакцина по этому изобретению должна вызывать иммунитет против гриппа.
Эти композиции могут быть использованы профилактически для предотвращения возникновения инфекции или могут быть терапевтическими для лечения уже существующих инфекций или могут быть использованы для приготовления иммунологических реагентов.
Другие антигены, чем антигены из эктодоменов из вируса гриппа, могут быть интегрированы в комплекс ISCOM, связаны с комплексом ISCOM или с комплексом ISCOM matrix или смешаны с комплексом ISCOM или комплексом ISCOM matrix. Это изобретение рассматривает также комбинированные вакцины или комбинированные лекарственные средства, применяемые в ветеринарии для лечения.
Приготовление композиций согласно этому изобретению хорошо известно квалифицированному в данной области специалисту. Подходящие фармацевтически приемлемые носители и/или разбавители включают в себя любые и все общепринятые растворители, диспергирующие материалы, наполнители, твердые носители, водные растворы, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие асбсорбцию агенты, и т.п. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области и описано, например, в Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Company, Pennsylvania, USA. За исключением того случая, когда какая-либо общепринятая среда или какой-либо общепринятый агент являются несовместимыми с активным ингредиентом, обсуждается применение их в фармацевтических композициях данного изобретения. В эти композиции могут быть также включены вспомогательные активные ингредиенты.
Согласно одному другому аспекту этого изобретения эта композиция может быть использована в качестве иммуностимулирующего лекарственного средства, иммуномодулирующего фармацевтического средства или вакцины, например, против гриппа, для человека, животных-компаньонов, таких как кошки, собаки, лошади, птицы, такие как попугаи, экономически важных видов, таких как крупный рогатый скот, например, семейства бычьих, свиньи, овцы, козы, или хорьков, норок.
Это изобретение рассматривает также набор, содержащий по меньшей мере два компартмента, где один компартмент содержит композицию, содержащую по меньшей мере один комплекс ISCOM и по меньшей мере один эктодомен из по меньшей мере одного домена гемагглютинина и по меньшей мере один эктодомен из по меньшей мере одного домена нейраминидазы из одного или нескольких вирусов гриппа, а другой компартмент содержит инструкции для применения.
Согласно другому аспекту, это изобретение относится к набору, содержащему по меньшей мере два компартмента, где один компартмент содержит комплекс ISCOM и/или комплекс ISCOM matrix, и где этот другой компартмент содержит по меньшей мере один эктодомен из по меньшей мере одного домена гемагглютинина и по меньшей мере один эктодомен из по меньшей мере одного домена нейраминидазы.
Данное изобретение особенно нацелено на эффективность рекомбинантно получаемых субъединиц НА и NA вируса гриппа 2009 А(H1N1) в качестве вакцин против гомотипичного вируса гриппа в модели хорьков, с особым вниманием в отношении вклада антигена NA. Растворимые, мультимерные формы антигенов HA и NA пандемического вируса H1N1 экспрессировали в системе экспрессии млекопитающих. Эти гликопротеины очищали одноступенчатой аффинной хроматографией и затем хорьков иммунизировали одним или обоими антигенами и с ISCOM matrix М или без ISCOM matrix М в качестве адъюванта. Эти животные отвечали серологически на оба антигена, но только при введении с этим адъювантом.
Интересно, что включение NA в эту вакцину увеличивало уровни HA-антител и нейтрализующую вируса активность. Значительную защиту, оцениваемую по разительно уменьшенным титрам вируса в легких (5log10-единиц), наблюдали после гомологичного заражения в животных, иммунизированных НА-содержащими вакцинами в комбинации с ISCOM matrix М. Интересно, что препараты с ISCOM matrix М в качестве адъюванта, содержащие NA, явно уменьшали клинические эффекты этой инфекции.
Все публикации, упоминаемые здесь, включены здесь в качестве ссылки, до наивысшей степени, разрешенной законом.
Это изобретение дополнительно описывается следующими неограничивающими примерами.
Примеры
Пример 1. Получение антигенов HA и NA
Материалы и способы
Вирус гриппа А для контрольного заражения
Вирус гриппа А/Netherlands/602/2009 выделяли из первого случая лабораторно подтвержденной инфекции 2009 A(H1N1) в Нидерландах инокуляцией 11-дневных содержащих эмбрион куриных яиц [15]. Вирусные штаммы вируса гриппа А/Netherlands/602/2009(H1N1) получали инфицированием конфлюэнтных клеток почки собаки Madin-Darby (MCCK). После завершения цитопатологических изменений, культуральные супернатанты осветляли центрифугированием при низкой скорости и хранили при -70°С. Инфекционные титры вируса определяли в клетках МССК, как описано ранее [16]. Все эксперименты с этими вирусами выполняли в условиях безопасности Bio Safety Level (BSL)-3.
Получение антигенов HA и NA
Синтезировали последовательности с оптимизированными кодонами человека, кодирующие растворимый эктодомен гемагглютинина (sHA; аминокислоты 17-522) и домен головки нейраминидазы (sNA; аминокислоты 75-469) вируса гриппа A/California/04/2009(H1N1) (GenScript) и клонировали в производное экспрессионной плазмиды pS1-Ig [17] для экспрессии в клетках HEK293T. Гену НА предшествовала последовательность, кодирующая N-концевой сигнальный пептид, с последующими последовательностями, кодирующими С-концевой искусственный домен тримеризации GCN4 (GCN4-pll) [18], и Strep-метку для аффинной очистки (IBA GmbH), как описано недавно [19, 20]. Гену NA предшествовали последовательности, последовательно кодирующие N-концевой сигнальный пептид CD5, двойную Strep-метку (OneSTrEP; IBA GmbH) и искусственный домен тетрамеризации (GCN4-pLl) [18].
Получение антигенов sHA3 и sNA4
Конструировали конструкты для экспрессии тримерного эктодомена НА (аминокислоты 17-522) и тетрамерного домена головки NA (аминокислоты 75-469) вируса гриппа A(H1N1), изображенные на Фиг. 1А. Белки sHA3 и sNA4 получали экспрессией в клетках HEK293T и очищали из культуральной среды аффинной хроматографией, дающей гликопротеины ожидаемого размера (Фиг. 1В). Гель-фильтрационный анализ показал тримерную и тетрамерную олигомерную природу субъединиц НА и NA (данные не показаны). Эти мультимерные комплексы были также биологически активными, дополнительно подтверждающими их нативное состояние, как оценивалось по их связыванию с сиаловой кислотой (sHA3; рукопись в стадии подготовки) и нейраминидазной активности (sNA4; ниже).
Пример 2. Экспрессия и очистка белка
Клетки HEK293T трансфицировали экспрессионными плазмидами sHA и sNA с использованием полиэтиленимина (PEI) в соотношении 1:5 (мкг ДНК: мкг PEI). После 6-часового инкубационного периода среду для трансфекции заменяли средой для экспрессии SFM II (Invitrogen), дополненной бикарбонатом натрия (3,7 г/литр), глюкозой (2,0 г/литр), Primatone RL-UF (3,0 г/литр), пенициллином (100 единиц/мл), стрептомицином (100 мкг/мл), glutaMAX (Gibco) и 1,5% DMSO. Супернатанты культуры ткани собирали спустя 5-6 дней после трансфекции и белки sHA и sNA очищали из культуральной среды с использованием Strep-Tactin-хроматографии (IBA GmbH). Экспрессию и очистку белков sHA и sNA подтверждали Вестерн-блоттингом с использованием конъюгата Strep-Tactin-HRP (IBA GmbH; данные не показаны) и анализа электрофорезом в ДСН-ПААГ. Олигомеризацию этих белков определяли гель-фильтрационной хроматографией и blue-native-электрофорезом в ПААГ. Определение количеств белков выполняли с использованием БСА в качестве ссылки.
Пример 3. Иммунизации и инфицирования
Хорьки
Здоровых молодых подвергнутых аутбридингу самок хорьков (Mustela putorius furo; в возрасте 6-12 лет) покупали у коммерческого селекционера. Этих животных проверяли на отсутствие антител против циркулирующих вирусов гриппа A(H1N1) и A(H3N2) и против вируса гриппа, происходящего из свиней, А/NL/602/09 при помощи анализа ингибирования гемагглютинации. Независимый комитет по этике в отношении животных одобрил экспериментальный протокол перед началом этого эксперимента.
Адъювант ISCOM matrix М готовили, как описано в WO 2004/004762. 75 микрограммов композиции, содержащей 85% Matrix F и 15% Matrix С в PBS (ЗФР), добавляли к этим антигенам.
Иммунизации и инфицирования
Тридцать шесть серонегативных хорьков делили на шесть групп из 6 хорьков, каждая, и вакцинировали следующими препаратами: 3,75 мкг sHA3+3,75 мкг sNA4 в забуференном фосфатом солевом растворе (ЗФР) (группа 1); 3,75 мкг sHA3 в ISCOM-Matrix М (IMM, Isconova, Uppsala, Sweden) (группа 2); 3,75 мкг sNA4 в IMM (группа 3); 3,75 мкг sNA3+3,75 мкг sNA4 в IMM (группа 4); ЗФР (группа 5); IMM (группа 6). Вакцинации выполняли с интервалом 20 дней после анестезии кетамином в четырехглавых мышцах задней ноги в общем объеме 1 мл. Хорьков содержали в группах, и они получали корм и воду ad libitum. При 32 днях после последней вакцинации этих животных анестезировали кетамином/медетомидином (инвертированным атипамезолом), взвешивали и затем заражали интратрахеально 1×106 TCID50 гриппа A/NL/602/09(H1N1) в объеме 3 мл ЗФР [21, 22]. Затем хорьков подвергали мониторингу три раза в день в отношении клинических признаков. Перед инфицированием и при двух и четырех днях после инфицирования собирали мазки из носа и из глотки при анестезировании хорьков кетамином. Спустя четыре дня после инокуляции животных взвешивали и затем эвтанизировали обескровливанием при анестезии кетамином и медетомидином. Аутопсии выполняли в соответствии со стандартными процедурами. Один хорек из группы 1 умер между первой и второй вакцинациями по причинам, не относящимся к этому эксперименту.
Серология
Пробы сыворотки собирали перед вакцинацией, в день второй вакцинации (день 20) и в день заражения (день 52). Сыворотки хранили при -20°С до использования. Сыворотки тестировали на присутствие анти-HA-антител с использованием анализа ингибирования гемагглютинина (HI-анализа) с 1% эритроцитами индейки и на присутствие нейтрализующих вирус антител с использованием микроанализа нейтрализации вируса (VN-анализа), как описано ранее [23, 24]. Сыворотки тестировали на присутствие антител, реактивных с гриппом A/NL/602/09(H1N1). Для этой цели, получали вирусы реверсивной генетики (позиционного клонирования). Титры, полученные с этими вирусами, сравнивали с титрами против штаммов дикого типа (данные не показаны). Сыворотку положительного контроля, специфическую в отношении гриппа A/NL/602/09(H1N1), получали из хорька, инфицированного этим вирусом [15]. Другими вирусами гриппа (H1N1), используемыми в HI-анализе, были А/Netherlands/386/86 (NL/86), А/Netherlands/25/80 (NL/80), A/New Jersey/8/76 (NJ/76), A/Swine/shope/1/56 (Sw/56), A/Itali/1443/76 (It/76), A/Iowa/15/30 (Io/30), A/Puerto Rico/8/34 (Pr/34) и A/Brisbane/59/07 (вакцинный штамм IVR-148; IVR/148). Пробы сывороток хорьков, инфицированных этими вирусами, использовали в качестве положительного контроля в этом анализе [25].
Сыворотки тестировали также на присутствие ингибирующих нейраминидазу (NI) антител с использованием описанного ранее анализа на основе фетуина [26]. Вкратце, 96-луночные планшеты Nunc MaxiSorp покрывали в течение ночи при 4°С 100 мкл 5 мкг/мл фетуина. Объемы шестьдесят мкл серийно разведенных проб сыворотки инкубировали в течение 30 минут при 37°С с равным объемом содержащего sNA4 культурального супернатанта (предварительно разведенного в ЗФР-Ca/Mg [0,901 мМ/0,493 мМ] с получением полимаксимального OD450 1,5), после чего добавляли 100 мкл этой смеси в покрытые фетуином лунки. После одного часа инкубации при 37°С, эти планшеты промывали и затем нейраминидазную активность измеряли добавлением меченого пероксидазой агглютинина земляного ореха (арахиса) (2,5 мкг/мл; Sigma), инкубированием в течение 1 часа при комнатной температуре, промыванием этих планшетов и добавлением 100 мкл субстрата пероксидазы (TMB) в каждую лунку. После 5 мин эту реакцию останавливали добавлением 100 мкл 0,3 М фосфорной кислоты и OD-величины измеряли при 450 нм с использованием планшет-ридера ELISA (EL-808 [BioTEK]). Для тестирования этих сывороток на перекрестно-реактивные NI-антитела, sNA4-конструкты экспрессии, сходные с конструктами, описанными выше для A/California/04/2009(H1N1), получали также для доменов головок вируса гриппа A/Kentucky/UR06-0258/2007(H1N1) (аминокислоты 75-470) и A/turkey/Turkey/1/2005(H5N1) (аминокислоты 55-449). Сыворотки, специфические для гриппа А/NL/602/09(H1N1) и A/turkey/Turkey/1/2005(H5N1), полученные из хорька, инфицированного этими вирусами, использовали в качестве положительного контроля.
Репликация вируса в верхних и нижних дыхательных путях
Пробы всех долей правого легкого и дополнительной доли собирали из инфицированных хорьков, немедленно замораживали на сухом льду с этанолом и хранили при -70°С до дальнейшей обработки. Пробы легких взвешивали и затем гомогенизировали при помощи FastPrep-24 (MP Biomedicals, Eindhoven, The Netherlands) в сбалансированном растворе Хенка, содержащем 0,5% лактальбумин, 10% глицерин, 200 Е/мл пенициллин, 200 мкг/мл стрептомицин, 100 Е/мл сульфат полимиксина В, 250 мкг/мл гентамицин и 50 Е/мл нистатин (ISN Parmaceutical, Zoetermeer, The Netherlands) и центрифугировали в течение короткого времени. Мазки из носа и глотки хранили непосредственно при -70°С в той же самой среде, которую использовали для гомогенизации проб легких. Четыре повторности 10-кратных серийных разведений проб из глотки, носа и легких использовали для инфицирования клеток MDCK, как описано ранее [16]. Активность НА культуральных супернатантов, собранных спустя 5 дней после инокуляции, использовали в качестве индикатора инфекции. Титры рассчитывали в соответствии со способом Spearman-Karber и выражали в log TCID50 на грамм для легочной ткани или на мл для мазков [27].
Гистопатология
Спустя четыре дня после инокуляции (дпи) гриппом A/NL/602/09 хорьков эвтанизировали и легкие наблюдали макроскопически и взвешивали перед сбором проб из правых легких для определения вирусных титров. Затем левые доли легких раздували 10% нейтрально забуференным формалином. Затем доли левых легких погружали в парафин, делали срезы легких при 4 мкм и срезы тканей испытывали окрашиванием гематоксилином и эозином (HE).
Статистический анализ
Значимость среди групп животных анализировали однофакторным дисперсионным анализом (Anova) и тестом Тьюки после Anova. Различия считали значимыми при Р<0,05.
Результаты
Реакции в виде антител, индуцируемые иммунизацией sHA3 и sNA4
Гликопротеины тестировали на их способность индуцировать защитный иммунитет против гомологичного вирусного заражения. Хорьков иммунизировали в дни 0 и 20 sHA3+sNA4 без адъюванта (sHA+sNA), sHA3+sNA4 с адъювантом ISCOM matrix М (IMM; sHA+sNA+IMM) или с подобным образом получавшими адъювант sHA3 (sHA+IMM) или sNA4 (sNA+IMM). Сыворотки собирали в день второй иммунизации и перед заражением (дни 20 и 52) и реакции антител измеряли анализами HI и VN против гомологичного вируса и анализом NI (Фиг. 2). С любым из этих анализов не наблюдали реакций в контрольных животных, вакцинированных ЗФР или только адъювантом, но также в животных, иммунизированных sHA3 и sNA4 в смеси с адъювантом. В отличие от этого, иммунизации sHA3 с адъювантом (sHA+IMM) индуцировали высокие титры HI с титром геометрического среднего 91 в день заражения. Интересно, что дополнительное включение sNA4 (sHA+sNA+IMM) значимо увеличивало средние титры HI до 468 (р<0,05; однофакторный Анова и тест Тьюки). Титрования NI также выявили адъювант-зависимую индукцию NA-антител, которые были низкими после одной (Фиг. 2), но сильно увеличивались после двух иммунизаций (Фиг. 2). Однако в этом случае не наблюдали явного увеличения этих титров вследствие совместного введения sHA3. В соответствии с наблюдаемыми HI-титрами, высокие титры VN обнаруживали в вакцинированных sHA+IMM и sHA+sNA+IMM животных (Фиг. 2). Здесь также совместное введение антигена sHA4 с вакциной sHA+sNA+IMM приводило к увеличению средней величины титра VN, причем средние величины находились в диапазоне от 1:202 до 1:468 в группах sHA+IMM и sHA+sNA+IMM, соответственно.
Защита против клинических признаков после инфицирования вирусом гриппа 2009 А(HtNt)
Вакцинированных хорьков заражали 106 TCID50 2009 A(H1N1) спустя 5 недель после второй вакцинации. От дня 2 после инокуляции далее, в инокулированных хорьках наблюдали клинические признаки, которые включали в себя затруднения в дыхании, летаргию, пониженный аппетит и потерю массы. Обычно только слабые клинические признаки наблюдали в хорьках групп 2, 3 и 4, тогда как более тяжелые симптомы наблюдали в хорьках групп 1, 5 и 6. Потери массы тела становились явными в ЗФР- и IMM-вакцинированных контрольных группах, а также в не содержащей адъюванта вакцинной группе sHA+sNA (Фиг. 3). Интересно, что животные, иммунизированные sHA+IMM, обнаруживали почти сходные потери массы, тогда как массы тел не изменялись значимо после вакцинации обоими содержащими sNA4 препаратами (группы sHA+IMM и sHA+sNA+IMM). Более или менее согласованно, массы легких хорьков, определяемые post mortem, обнаруживали соответствующую тенденцию вакцинированных sHA4 с адъювантом животных, имеющих наименьшее связанное с болезнью увеличение вследствие уплотнения легких (Фиг. 3).
Макроскопические патологические и гистопатологические признаки в легких хорьков
Спустя 4 дня после инокуляции вирусом гриппа 2009 A(H1N1), легкие этих хорьков испытывали макроскопически и взвешивали перед взятием проб для оценивания репликации вирусов и гистопатологических изменений. Темно-красные и твердые уплотненные зоны наблюдали макроскопически в легких инокулированных хорьков. Процент измененной ткани легких приближенно оценивали, и он варьировался между группами. Средние проценты измененных зон в легких приблизительно 50% наблюдали в хорьках групп 1, 5 и 6, тогда как степень уплотнения была менее выраженной в хорьках групп 2, 3 и 4, которые обнаруживали менее 25% измененной зоны легкого (Фиг. 3). Относительная масса легкого была более низкой в этих группах в сравнении с массой легкого в хорьках групп 1, 5 и 6 (Фиг. 3).
Гистопатологические изменения, наблюдаемые в день 4 после инокуляции в легких хорьков, псевдовакцинированных ЗФР или только адъювантом (IMM) или вакцинированных не содержащими адъюванта sHA3+sNA4, были характерными для умеренной или тяжелой некротической бронхо-интерсцитиальной пневмонии. Мультифокально, многие нейтрофилы и макрофаги и вариабельные количества эритроцитов, жидкость отека и фибрин присутствовали в альвеолах легких этих хорьков. Кроме того, воспалительные инфильтраты присутствовали в альвеолярных перегородках, в бронхиолах, в бронхах и в стенках бронхов и бронхиол. Разительное уменьшение в гистопатологических изменениях наблюдали в животных, вакцинированных sNA4 с адъювантом (группах sNA+IMM и sHA+sNA+IMM), тогда как хорьки, иммунизированные sHA+IMM, были частично защищены от развития патологии (Фиг. 4).
Защита против репликации вируса в верхних и нижних дыхательных путях
Для измерения действия вакцинации на репликацию вируса в дыхательных путях титры вируса определяли в легких, в глотке и в носу спустя 4 дня после инокуляции. Как показано на Фиг. 5, вирус, используемый для заражения, реплицировался эффективно в легких контрольных хорьков (группы PBS и IMM) и в животных, иммунизированных смесью без адъюванта sHA3 и sNA4 (группа sHA+sNA), со средними вирусными титрами приблизительно 107-108 TCID50/грамм ткани. Эти вирусные зараженности уменьшались на приблизительно 5 log10-единиц в животных, иммунизированных белком sHA3 в адъюванте (группа sHA+IMM), и в животных, иммунизированных совместно sHA3 и sNA4 в адъюванте (группа sHA+sNA+IMM). Средние вирусные зараженности уменьшались на 2-3 log10-единиц в животных, иммунизированных антигеном sNA4 с адъювантом (группа sNA+IMM).
Высокие вирусные зараженности в носу наблюдали в контрольных животных (группах PBS и IMM; Фиг. 5) в день 4 после заражения. Хотя и статистически незначимые вследствие больших вариаций в титрах в пределах групп, эти вирусные зараженности были, по-видимому, несколько более низкими в животных, иммунизированных sHA3 с адъювантом, или sNA4 с адъювантом или комбинацией sHA3+sNA4 без адъюванта. Наибольшее уменьшение вирусных титров в носу было обнаружено в животных, иммунизированных содержащей адъювант комбинацией антигенов sHA3 и sNA4. Вирусные титры в глотке были обычно высокими, и на них не влияла вакцинация, за исключением случая с животными, вакцинированными содержащей адъювант комбинацией sHA3 и sNA4. Эти хорьки не имели детектируемых титров в глотке.
Реакции перекрестнореагирующих антител, индуцированных иммунизацией sHA3 и sNA4
Для исследования, могли ли антитела, индуцированные антигенами sHA3 и sNA4, перекрестно реагировать с другими вирусами гриппа H1N1, авторы изобретения выполняли дополнительные HI- и NI-анализы с сыворотками после вакцинации. Как и ожидалось, наивысшие HI-титры измеряли против гомологичного вируса, тогда как различные степени перекрестной реактивности наблюдали с некоторым диапазоном других H1-штаммов (Фиг. 6А). Таким образом, перекрестную реактивность не детектировали для A/Swine/shope/1/56, A/Italy/1443/76, A/Iowa/15/30, A/PR/8/34 и IVR/148, тогда как значимую перекрестную реактивность измеряли против A/NL/25/80 и A/NewJersey/8/76 и, конкретно, против A/NL/386/86, в соответствии с более или менее совпадающими сходствами последовательностей их антигенных доменов (см. таблицу 1).
Гомология последовательностей антигенных районов в НА различных штаммов H1N1
Это имело место с сыворотками как из вакцинированных sHA3+IMM, так и с вакцинированными sHA3+sNA4+IMM животными. В соответствии с наблюдаемыми ранее различиями в HI-активности против гомологичного вируса (Фиг. 2), уровни перекрестной реактивности были заметно более высокими с сыворотками из хорьков, иммунизированных sHA3+sNA4+IMM, чем сыворотки из иммунизированных sHA3+IMM животных, подтверждая опять усиливающее действие антигена sNA4. HI-титры против каждого штамма детектировали в контрольных сыворотках хорьков, инфицированных гомологичным вирусом гриппа A/H1N1 (данные не показаны).
Для исследования перекрестной реактивности антител NA авторы этого изобретения получали комплексы гликопротеина sNA4 двух других вирусов гриппа N1, штамма H1N1 человека A/Kentucky/UR06-0258/2007 и штамма H5N1 птиц A/turkey/Turkey/1/2005. При тестировании в NI-анализе авторов изобретения имелась сильная ингибирующая нейраминидазу активность с иммунизированными объединенными сыворотками sNA4+IMM и sHA3+sNA4+IMM животными против белка птичьего вируса H5N1, тогда как наблюдали лишь некоторое ингибирование белка sNA4 сезонного вируса H1N1 (Фиг. 6B). Примечательно, что контрольная сыворотка, полученная из кур, инфицированных вирусом H5N1, тестировалась негативно против белков sNA4 вируса H1N1 человека.


| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИВАЛЕНТНАЯ ВАКЦИНА ПРОТИВ ГРИППА НА ОСНОВЕ НАНОЧАСТИЦ | 2019 |
|
RU2805552C2 |
| ВАКЦИННЫЕ КОМПОЗИЦИИ, ХАРАКТЕРИЗУЮЩИЕСЯ УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ И ИММУНОГЕННОСТЬЮ | 2016 |
|
RU2730625C2 |
| НОВЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2510280C2 |
| АТТЕНУИРОВАННЫЙ ГРИППОЗНЫЙ ВЕКТОР И МУКОЗАЛЬНАЯ УНИВЕРСАЛЬНАЯ ГРИППОЗНАЯ ВАКЦИНА НА ЕГО ОСНОВЕ | 2016 |
|
RU2660562C2 |
| ПРОТИВОГРИППОЗНАЯ ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ ПТИЧЬЕГО ГРИППА А НА ОСНОВЕ ЭКТОДОМЕНА БЕЛКА М2 | 2014 |
|
RU2571944C1 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ НЕИММУНИЗИРОВАННЫХ ИНДИВИДУУМОВ | 2013 |
|
RU2661407C2 |
| ОПТИМИЗИРОВАННЫЕ С ПОМОЩЬЮ ВЫЧИСЛИТЕЛЬНЫХ СРЕДСТВ АНТИГЕНЫ С ШИРОКИМ СПЕКТРОМ РЕАКТИВНОСТИ ДЛЯ ВИРУСОВ ГРИППА H5N1 И H1N1 | 2013 |
|
RU2639551C2 |
| АНТИГЕНЫ ВИРУСА ГРИППА H1N1 С ШИРОКИМ СПЕКТРОМ АКТИВНОСТИ, ОПТИМИЗИРОВАННЫЕ С ПРИМЕНЕНИЕМ ВЫЧИСЛИТЕЛЬНЫХ СРЕДСТВ | 2012 |
|
RU2612900C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ПОПУЛЯЦИЯХ СУБЪЕКТОВ С ОСЛАБЛЕННЫМ ИММУНИТЕТОМ | 2013 |
|
RU2661408C2 |
| СПОСОБ СТИМУЛИРОВАНИЯ ГУМОРАЛЬНОГО И КЛЕТОЧНОГО ИММУННОГО ОТВЕТА НА ЦЕЛЕВОЙ АНТИГЕН | 1996 |
|
RU2127605C1 |
Настоящее изобретение относится к биотехнологии. Предложены вакцинная композиция для вакцинации против инфекции гриппа и набор для вакцинации против инфекции гриппа, содержащий вакцинную композицию. Вакцинная композиция содержит эффективное количество по меньшей мере одного комплекса ISCOM matrix и эффективное количество по меньшей мере одного эктодомена из домена гемагглютинина и по меньшей мере одного эктодомена из домена нейраминидазы. При этом эктодомены являются эктодоменами, выделенными из вируса гриппа. Предложенная вакцинная композиция и набор могут быть использованы в медицине в качестве альтернативного варианта существующим вакцинам против вируса гриппа, поскольку обеспечивают улучшение иммунного ответа за счет применения комплекса ISCOM matrix. 3 н. и 11 з.п. ф-лы, 6 ил., 1 табл., 3 пр.
1. Вакцинная композиция для вакцинации против инфекции гриппа, содержащая эффективное количество по меньшей мере одного комплекса ISCOM matrix и эффективное количество по меньшей мере одного эктодомена из по меньшей мере одного домена гемагглютинина, и по меньшей мере одного эктодомена из по меньшей мере одного домена нейраминидазы из одного или нескольких вирусов гриппа, причем эти эктодомены представляют собой эктодомены, выделенные из вируса гриппа.
2. Композиция по п. 1, где один или несколько эктодоменов из по меньшей мере одного домена гемагглютинина и один или несколько эктодоменов из по меньшей мере одного домена нейраминидазы представляют собой гибридные белки.
3. Композиция по п. 2, где эти гибридные белки являются рекомбинантными.
4. Композиция по п. 1, где один или несколько эктодоменов из по меньшей мере одного домена гемагглютинина и один или несколько эктодоменов из по меньшей мере одного домена нейраминидазы являются доменами головки.
5. Композиция по п. 1, где вирус гриппа выбран из субсеротипов гриппа, например из HxNy, где х обозначает 1-16 и у обозначает 1-9.
6. Композиция по п. 5, где вирусом гриппа является вирус, например, выбранный из вируса гриппа 1918 H1N1 (A/South Carolina/1/18) и/или вируса 2004 H5N1 (A/Vietnam/1203/04), вируса H1N1 A/California/07/2009, и/или A/California/04/2009, и/или A/California/09/2009, и/или A/Kentucky/UR06-0258/2007(H1N1) и/или A/turkey/Turkey/1/2005(H5N1).
7. Композиция по п. 1, где композиция содержит 1-5 эктодоменов из по меньшей мере одного домена гемагглютинина и 1-5 доменов головки из по меньшей мере одного домена нейраминидазы.
8. Композиция по п. 7, где по меньшей мере один эктодомен гемагглютинина выбран из трехмерного эктодомена НА (аминокислоты 17-522) A/California/09/2009.
9. Композиция по п. 7, где по меньшей мере один домен головки нейраминидазы выбран из тетрамерного домена головки NA (аминокислоты 75-469) вируса A/California/09/2009.
10. Композиция по п. 1, где комплекс ISCOM matrix содержит по меньшей мере один сапонин и по меньшей мере один липид.
11. Композиция по п. 1, дополнительно содержащая добавки, эксципиенты, дополнительные адъюванты.
12. Применение композиции по п. 1 в качестве вакцины, например против гриппа, для позвоночных, например птиц и млекопитающих.
13. Применение по п. 12, где млекопитающим является человек, животные-компаньоны, такие как кошки, собаки, лошади, птицы, такие как попугаи, экономически важные виды, такие как крупный рогатый скот, например виды семейства бычьих, свиньи, овцы, козы или хорьки, норки.
14. Набор для вакцинации против инфекции гриппа, содержащий по меньшей мере два компартмента, где один компартмент содержит композицию, содержащую эффективное количество по меньшей мере одного комплекса ISCOM matrix и эффективное количество по меньшей мере одного эктодомена из по меньшей мере одного домена гемагглютинина, и по меньшей мере одного эктодомена из по меньшей мере одного домена нейраминидазы из одного или нескольких вирусов гриппа, а другой компартмент содержит инструкции для применения.
| LОVGREN K ET AL | |||
| An experimental influenza subunit vaccine (iscom): induction of protective immunity to challenge infection in mice after intranasal or subcutaneous administration | |||
| CLINICAL AND EXPERIMENTAL IMMUNOLOGY | |||
| Vol | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| P | |||
| Способ получения твердых неплавких и нерастворимых продуктов уплотнения формальдегида с фонолами | 1925 |
|
SU435A1 |
| DE WIT E | |||
| ET AL | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2016-05-10—Публикация
2011-07-25—Подача