Предполагаемое изобретение относится к медицине, в частности, к экспериментальной хирургии, к способам моделирования асептических и гнойных ран мягких тканей в условиях эксперимента на лабораторных животных.
Предлагаемый «Способ моделирования экспериментальной раны мягких тканей» может найти применение в экспериментальной медицине, а также в ветеринарии для моделирования ран мягких тканей у лабораторных животных на этапах доклинических исследований различных изделий медицинского назначения, лекарственных препаратов, тактики лечения.
Модели ран у экспериментальных животных служат для изучения процесса заживления, его особенностей под воздействием различных системных, локальных факторов, медикаментов и физических воздействий.
Актуальность разработки новых способов экспериментального моделирования данной патологии обусловлена отсутствием оптимального способа моделирования ран мягких тканей, соответствующего всем необходимым критериям, а также необходимостью поиска наиболее эффективных способов лечения ран и ухода за ними в соответствии с фазами течения раневого процесса [1].
Известны способы моделирования асептических ран путем нанесения линейной раны с последующим проведением имплантации шовного материала в полость раны, либо одномоментным ушиванием раны И.А. Сыченникова, 1974 [2] и Ю.А. Фурманова, 1985 [3].
Недостатками данных способов являются возможность моделирования лишь небольших асептических линейных ран, не осложненных гнойно-воспалительным процессом; неконтролируемая площадь раны - за счет отсутствия фиксации ее краев, что свидетельствует об отсутствии универсальности способов, невозможности создания модели, приближенной к реальным условиям течения раневого процесса.
Известны способы моделирования инфицированных и асептических ран при помощи механического воздействия на них. Так в своих исследованиях В.П. Петров 1989 [4] на лабораторном животном наносил размозженные кожно-мышечные раны с последующим заражением золотистым стафилококком (Staphylococcus aureus) и ушивал рану. А.В. Воленко, 1998, [5] напротив, после травмирования кровоостанавливающим зажимом в рану вводил кусочек шелковой лигатуры и участок размятой клетчатки.
В указанных выше способах моделирования хирургических ран в эксперименте имеются определенные недостатки, влияющие на точность оценки полученных результатов, особенно при качественном и количественном контроле микробной нагрузки на раны. Кроме того, воспроизводя одну из важнейших составляющих хирургической раны - механическую травму, практически невозможно определить в каждом конкретном случае силу травмирующего воздействия, создаваемую в ходе эксперимента руками исследователя, на ткани путем их размозжения или травмирования кровоостанавливающими зажимами.
Известно изобретение С.А. Лепеховой, которое заключается в следующем: экспериментальному животному иссекают кожный лоскут, края раны подшивают, через 3-е суток иссекают струп и некротизированные ткани, санируют, после чего устанавливают полупроницаемую мембрану для мембранно-сорбирующих дренажных комплексов, вводят бактериальную суспензию, содержащую 0,5 мл Е. coli 109 и 0,5 мл Ps. aeraginosa 109 [6].
Во всех вышеперечисленных моделях гнойной раны речь идет о формировании модели только поверхностной раны, в модели С.А. Лепеховой не исключено развитие мацерации под мембраной, под повязкой создаются анаэробные условия, метод трудоемкий и достаточно травматичен для животного.
За ближайший аналог принят способ моделирования гнойной раны по общеизвестной методике П.И. Толстых, 1976 [7], который проводят путем полнослойной эксцизии участка кожи, края и дно ран раздавливают зажимом Кохера для девитализации тканей, после чего в рану вносят 1 мл взвеси штамма золотистого стафилококка. Для этого на спине на выбритом от шерсти и обработанном антисептиком участке иссекают кожу с подкожной клетчаткой размером 1×1 см, затем в рану вводят марлевый тампон, содержащий 1010 микробных тел суточной культуры Staphylococcus aureus 592. Для стандартизации условий лечения, предупреждения деформации раны, а также для предупреждения высыхания, загрязнения раневой поверхности и укусов другими животными на рану помещают марлевую повязку с полиэтиленовой прокладкой для создания «парникового» эффекта. На 3 сутки рана представляет собой поверхность, покрытую сгустками крови, фибрином, гноем, наблюдается отек тканей в ране и по ее периметру.
Однако, при данном способе формируется поверхностная рана с возможной мацерацией под полиэтиленовой пленкой. Другим недостатком является возможность моделирования условий развития только анаэробной инфекции под газо- и водонепроницаемой прокладкой, следовательно, предложенный способ не универсален и не подходит для оценки клинической картины аэробной раневой инфекции. Способ трудоемкий, плохо поддается стандартизации под конкретные условия эксперимента. Объем марлевого тампона может изменятся в зависимости от способа его размещения в ране, так как его форма нестабильна и практически жестких границ не имеет. Следовательно, данная модель не может быть использована для изучения возможностей профилактики и лечения такого рода поражений, как раны мягких тканей различного генеза.
Таким образом, анализ существующих моделей гнойной раны указал на следующие их недостатки:
- невозможность получения «стандартизованной» раны с заданными геометрическими параметрами у всех экспериментальных животных;
- не исключена возможность смены микробного пейзажа раны в ходе эксперимента за счет превалирования анаэробной микрофлоры вследствие создания анаэробных условий под пленкой;
- неконтролируемая глубина поражения, за счет выполнения насечек дна раны лезвием;
- неконтролируемая площадь раны, за счет отсутствия фиксации краев раны;
- требуется дополнительное оборудование, и выполнение трудоемких манипуляций;
- неравномерное распределение введенной суспензии с микробной нагрузкой под полупроницаемой мембраной по дну создаваемой раны;
- ранняя некрэктомия, объем выполнения, которой во многом зависит от предпочтений экспериментатора, нарушает естественное течение фаз раневого процесса, что снижает объективизацию полученных результатов.
Задачи: Разработка способа моделирования раны мягких тканей в эксперименте на животных с возможностью создания задаваемых параметров этой раны и их контроля по глубине, площади повреждения, степени бактериальной нагрузки, степени выраженности воспалительной реакции; снижение трудоемкости процесса моделирования раны; снижение уровня интраоперационной агрессии (травматичности) при создании модели раны.
Сущностью изобретения является способ моделирования экспериментальной раны мягких тканей у крыс для разработки тактики лечения, включающий создание раневой полости путем введения импланта в мягкие ткани, сроком на 6-7 суток, отличающийся тем, что осуществляют послойный разрез мягких тканей на требуемую глубину: кожа, подкожно-жировая клетчатка, поверхностная фасция и мышечная ткань и для создания модели экспериментальной асептической раны, вводят гидрофильный полимерный имплант шаровидной формы, а для создания гнойной раны вводят пористый полимерный имплант также шаровидной формы, предварительно насыщенный взвесью бактериального возбудителя в концентрации 105-1012 микробных клеток исследуемого возбудителя на 1 мл взвеси. Затем рану послойно ушивают для формирования соответствующей полости (модели). Имплант через указанный срок удаляют хирургическим путем, площадь поверхности (S) и объем (V) которого рассчитывают по формулам: S=4πr2, V=4/3πr3, r - радиус импланта, π - 3,14.
Новизной является: введение в экспериментальную рану у лабораторных животных на требуемую глубину: кожа, подкожно-жировая клетчатка, поверхностная фасция и мышечная ткань полимерного материала, что позволяет контролировать глубину, площадь повреждения и объем полости раны за счет возможности в зависимости от изменения экспозиции полимерного материала в заданном растворе варьировать диаметр импланта.
Способ осуществляют следующим образом:
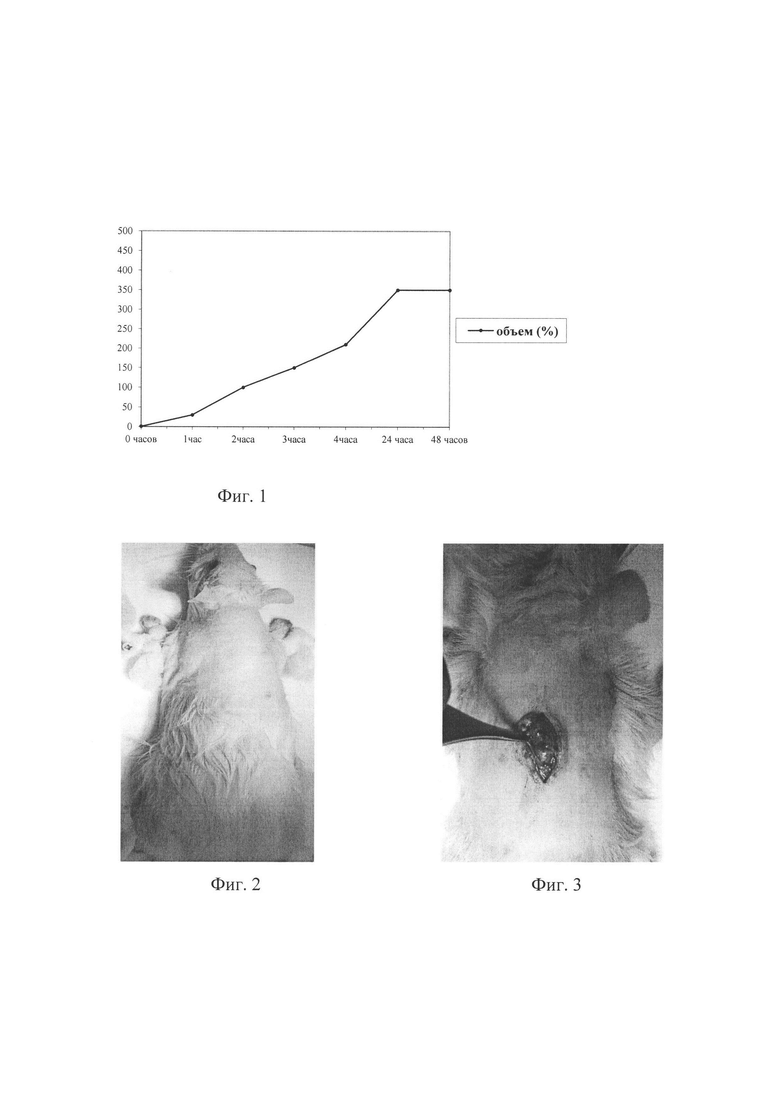
а) формируют имплант необходимого размера путем экспозиции гидрофильного полимерного материала в растворе антисептика (хлоргексидина биглюконат 0,05%). Полимер способен сорбировать низкомолекулярные органические и неорганические вещества, эта способность полимера была использована и нашла применение в предполагаемом изобретении. Установлена количественная связь между экспозицией импланта в растворе и геометрическими параметрами используемого материала за счет сорбции веществ из фармакологического раствора, в который он был предварительно помещен (Приложение Фиг. 1. Зависимость объема гидрофильного импланта от экспозиции в антисептическом растворе (в % от первоначального объема)).
После наркотизации животного (в рассматриваемом случае - лабораторные крысы), подготовки операционного поля проводят хирургическое вмешательство следующим образом: в асептических условиях по паравертебральной линии скальпелем производят линейный разрез длиной 1,0-1,5 см путем послойного рассечения тканей на необходимую глубину (в зависимости от задач исследования имплант может помещаться в межмышечное пространство, под поверхностную фасцию мышц или над ней, в подкожно-жировую клетчатку). После чего имплант размещают в созданном раневом дефекте, затем рану послойно ушивают.
В послеоперационном периоде животное находится под наблюдением шесть - семь суток, в течение которых происходит формирование соединительнотканной капсулы вокруг импланта для последующего создания экспериментальной асептической раны. На седьмые сутки, в установленном порядке с соблюдением требований гуманного обращения с животными под общей анестезией (путем введения 0,1 мл «Телазола» в/м) оперативным путем линейным разрезом предлежащих тканей длиной 1,0-1,5 см, имплант извлекают. Экспериментальная рана сформирована.
Исследование проводили на 50 белых лабораторных нелинейных крысах-самцах пятимесячного возраста с массой тела 300-350 г. (Приложение Фиг. 2. Подготовка операционного поля). Животных содержали в условиях вивария при свободном доступе к воде и пище, что соответствует ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики» (утвержден Приказом Федерального агентства по тех. регулированию и метрологии №1700-ст от 20 ноября 2014), вступил в силу 1 августа 2015 г.
Опыты на животных выполняли в соответствии с правилами гуманного обращения с животными, регламентированными «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных». Все оперативные вмешательства проводили в стерильных условиях под общим обезболиванием.
Крысы были разделены на две условные группы, по 35 животных в каждой. Первой группе животных внутрь раны помещали гидрофильный имплант в форме шарика, массой 0,65-0,7 г и диаметром 5-6 мм, экспозиция которого совершалась в течение 4 часов в водном растворе «Хлоргексидина биглюконата 0,05% - ЮжФарм» для формирования модели асептической раны.
б) Второй группе вводили полимерный пористый имплант аналогичного объема с бактериальной суспензией, содержащей 0,4 мл монокультуры P. aeruginosa в 109 КОЕ/мл.
При апробации метода выявлено, что оптимальным диапазоном концентрации бактериальной культуры для формирования модели гнойной раны является диапазон 105- 1012 КОЕ/мл. Это было установлено при введении в экспериментальную рану следующих возбудителей: Е. coli от 105 до 1012 КОЕ/мл, P. aeruginosa от 105 до 1012 КОЕ/мл, S. aureus от 105 до 1012 КОЕ/мл, S. pyogenes от 105 до 1012 КОЕ/мл и K. pneumoniae от 105 до 1012 КОЕ/мл. В частности, опытным путем было определено, что оптимальной концентрацией для создания требуемой модели гнойной раны у крыс массой 300-350 гр., при использовании возбудителя P. aeruginosa явилась концентрация 109 КОЕ/мл, которая и использовалась в эксперименте.
В асептических условиях и под общей анестезией (путем введения 0,1 мл «Телазола» в/м) животное фиксировали на столике А.И. Сеченова в положении на животе. После подготовки операционного поля (бритье участка кожи в лопаточной области размером 6,0×4,0 см и его трехкратной обработки йодопироном 5%, однократно - раствором хлоргексидина биглюконата 3%), по паравертебральной линии крысам скальпелем наносили линейную кожную рану длиной 1,0-1,5 см путем послойного рассечения на требуемую глубину: кожи, подкожно-жировой клетчатки, поверхностной фасции мышц и мышечной ткани, в заданный слой помещали имплант.
Экспериментальную рану мягких тканей с погруженным в нее имплантом послойно ушивали узловым швом (в количестве двух на каждый слой) (атравматикой «Пролен» (Prolene) 3/0 - кожа с подкожной жировой клетчаткой, атравматикой «Пролен» (Prolene) 4/0 - мышечный слой с подлежащей поверхностной фасцией).
На 7-е сутки у животных из каждой группы производили повторное хирургическое вмешательство в асептических условиях, под общей анестезией извлекали имплант (Приложение Фиг. 3. Извлечение гидрофильного импланта), визуально оценивали степень формирования стандартизированной полости (Приложение Фиг. 4. Сформированная асептическая полость), после чего иссекали сформированную капсулу с окружающими тканями для гистологического исследования.
Отправной точкой эксперимента по суткам во всех группах было принято время введения импланта.
У всех животных изучали объем сформированной полости V=4/3πr3, площадь раневой поверхности S=4πr2, микрофлору ран, морфологические изменения в ране на 7-е сутки. При гистологическом исследовании электронно-микроскопическим методом (Приложение Фиг. 5. Участок капсулы, отграничивающей асептическую полость), фиксировали, что стенка капсулы представлена грануляционной тканью, содержащей большое количество тонкостенных полнокровных сосудов. Клеточный инфильтрат образован преимущественно нейтрофильными гранулоцитами с небольшой примесью лимфо-макрофагального клеточного инфильтрата, фибробластов. Отмечали инфильтрацию окружающих тканей фибрином.
Пример 1. Моделирование экспериментальной асептической раны мягких тканей провели на лабораторной нелинейной крысе - самце пятимесячного возраста с массой тела 335 г. (Протокол эксперимента №17 от 09.09.2017 г.). Формировали имплант путем экспозиции гидрофильного полимерного материала в растворе антисептика (хлоргексидина биглюконат 0,05%- ЮжФарм) в течение 4х часов. Сформированный имплант имел массу 0,68 г и диаметр 6 мм.
В асептических условиях и под общей анестезией (путем введения 0,1 мл «Телазола» в/м) животное фиксировали на столике А.И. Сеченова в положении на животе. После подготовки операционного поля (бритье участка кожи в лопаточной области размером 6,0×4,0 см и его трехкратной обработки йодопироном 5%, однократно - раствором хлоргексидина биглюконата 3%), по паравертебральной линии скальпелем нанесли линейную кожную рану длиной 1,0 см путем послойного рассечения кожи, подкожно-жировой клетчатки, поверхностной фасции мышц и мышечной ткани в которую поместили имплант. Рану послойно ушили узловым швом (в количестве двух на каждый слой) (атравматическая нить «Пролен» (Prolene) 3/0 - кожа с подкожной жировой клетчаткой, атравматическая нить «Пролен» (Prolene) 4/0 - мышечный слой с подлежащей поверхностной фасцией). В течение шести суток послеоперационного периода животное находилось под наблюдением с свободным доступом к воде и пище.
На седьмые сутки, в установленном порядке с соблюдением требований гуманного обращения с животными под общей анестезией (путем введения 0,1 мл «Телазола» в/м) оперативным путем линейным разрезом предлежащих тканей длиной 1,2 см, имплант извлекли. По стандартным формулам: S=4πr2, V=4/3πr3, r - радиус импланта, π - 3,14 рассчитали площадь поверхности (S) и объем (V) сформированной раны, которые соответственно были равны 113 мм2 и 113 мм3. Участок капсулы, отграничивающей полость, иссекли скальпелем и провели гистологическое исследование. Установили, что стенка капсулы представлена грануляционной тканью, содержащей большое количество тонкостенных полнокровных сосудов. Клеточный инфильтрат образован лимфо-макрофагальным пулом, фибробластами. Отмечали умеренную инфильтрацию окружающих тканей фибрином. Толщина стенки сформированной полости составила 0,8 мм.
Пример 2. Моделирование экспериментальной асептической раны мягких тканей проводили на лабораторной нелинейной крысе - самце пятимесячного возраста с массой тела 340 г. (Протокол эксперимента №35 от 19.09.2017 г.). Формировали имплант путем введения в полимерный пористый имплант бактериальной суспензии (содержащей 0,4 мл Ps. aeraginosa 109 КОЕ/мл). Сформированный имплант имел массу 0,53 г и диаметр 5,8 мм.
В асептических условиях и под общей анестезией (путем введения 0,1 мл «Телазола» в/м) животное фиксировали на столике А.И. Сеченова в положении на животе. После подготовки операционного поля (бритье участка кожи в лопаточной области размером 6,0×4,0 см и его трехкратной обработки йодопироном 5%, однократно - раствором хлоргексидина биглюконата 3%), по паравертебральной линии скальпелем нанеси линейную кожную рану длиной 1,4 см путем послойного рассечения кожи, подкожно-жировой клетчатки, поверхностной фасции мышц и мышечной ткани в которую поместили имплант. Рану послойно ушили узловым швом (в количестве двух на каждый слой) (атравматическая нить «Пролен» (Prolene) 3/0 - кожа с подкожной жировой клетчаткой, атравматическая нить «Пролен» (Prolene) 4/0 - мышечный слой с подлежащей поверхностной фасцией). В течение шести суток послеоперационного периода животное находилось под наблюдением со свободным доступом к воде и пище.
На седьмые сутки, в установленном порядке с соблюдением требований гуманного обращения с животными под общей анестезией (путем введения 0,1 мл «Телазола» в/м) оперативным путем линейным разрезом предлежащих тканей длиной 1,5 см, имплант извлекли. По стандартным формулам: S=4πr2, V=4/3πr3, r - радиус импланта, π - 3,14 рассчитали площадь поверхности (S) и объем (V) сформированной раны, которые соответственно были равны 106 мм2 и 102 мм3. Участок капсулы, отграничивающей полость, иссекли скальпелем и провели гистологическое исследование. Установили, что стенка капсулы представлена грануляционной тканью, содержащей большое количество тонкостенных полнокровных сосудов. Клеточный инфильтрат образован преимущественно нейтрофильными гранулоцитами с небольшой примесью лимфо-макрофагального клеточного инфильтрата, фибробластов. Отмечали инфильтрацию окружающих тканей фибрином, а также наличие клеток возбудителя, предварительно введенного в имплант, на внутренней поверхности капсулы. Толщина стенки сформированной полости составила 1,2 мм.
Преимущество предлагаемого способа заключается в том, что предложенный способ моделирования не требует дополнительного оборудования, позволяет получить асептические и гнойные (в случае сочетания с бактериальной обсемененностью) кожно-подкожные раны и кожно-подкожно-мышечные с контролируемыми: глубиной, площадью повреждения и возможностью получения стандартизированной полости за счет формирования импланта с варьируемым диаметром в зависимости от экспозиции в растворе антисептика, кроме того, имплант способствует равномерному распределению по полости бактериальной суспензии, сохраняет свойства при сильных перепадах температуры или повышенной влажности, обладает биоинертностью, химической инертностью, что позволяет проследить за динамикой раневого процесса в условиях максимально приближенным к клиническим, на экспериментальной модели раны мягких тканей. Предлагаемая модель подтвердила свою эффективность:
- у всех экспериментальных животных удалось сформировать одинаковые модели раны, стандартизированные как по геометрическим показателям, так и по типу раневого процесса в зависимости от бактериальной нагрузки и экспозиции импланта мягких тканей;
- технология формирования модели раны проста в использовании, занимает мало времени, малотравматична для самого животного.
Литература:
1. Раны и раневая инфекция: Руководство для врачей / ред. Кузина М.И., Костюченка Б.М. - Москва: Медицина, 1990. - 591 с.
2. Сыченников И.А. //Моделирование, методы изучения и экспериментальная терапия патологических процессов. М., 1974. - С. 69-73.
3. Фурманов Ю.А., Горшевикова Э.В., Адамян А.А., Винокурова Т.И., Цетлин Б.Л., Власов А.В., Силькис Е.М., Мошковский Г.Ю. Разработка и испытания хирургических шовных материалов. Клиническая хирургия 1985, 3, с. 25-28.
4. Житнюк И.Д. Лечение инфицированных ран порошкообразной смесью. Вестник хирургии 1967, 12, с. 69-74/.
5. Воленко А.В. Перспективы и возможности профилактического промывания хирургических ран пульсирующими струями жидкости под давлением. Хирургия 1998, 4, с. 45-50.
6. Лепехова С.А., Коваль Е.В., Григорьев Г.Е., Гольдберг О.А., Зарицкая Л.В. Патент RU 2431890, G09B 23/28 - в медицине - Способ моделирования инфицированной кожной раны.
7. Вестник новых медицинских технологий. Лечение гнойных ран с применением раневых покрытий «биатравм» и «ресорб» Лазаренко В.А., Бежин А.И., Гусейнов А.З., Чердаков А.В., Иванов А.В., Жуковский В.А., Том XVII №3 2010 - с. 200.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ КОЖНОЙ РАНЫ У СВИНЕЙ В ЭКСПЕРИМЕНТЕ | 2019 |
|
RU2726600C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВЗРЫВНОЙ ТРАВМЫ МЯГКИХ ТКАНЕЙ КОНЕЧНОСТИ, ОТЯГОЩЁННОЙ КРОВОПОТЕРЕЙ | 2020 |
|
RU2748248C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВЗРЫВНОЙ ТРАВМЫ МЯГКИХ ТКАНЕЙ КОНЕЧНОСТИ С ПЕРЕЛОМОМ БЕДРЕННОЙ КОСТИ | 2020 |
|
RU2748384C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВЗРЫВНОЙ ТРАВМЫ МЯГКИХ ТКАНЕЙ КОНЕЧНОСТИ | 2020 |
|
RU2741238C1 |
| Способ коррекции возрастных изменений гравитационного характера мягких тканей лица и шеи | 2023 |
|
RU2819212C1 |
| СПОСОБ ГИПОКСИЧЕСКОЙ ТРЕНИРОВКИ ДОНОРСКОЙ ОБЛАСТИ ПРИ СВОБОДНОЙ КОЖНОЙ ПЛАСТИКЕ ХРОНИЧЕСКИХ РАН | 2018 |
|
RU2698981C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИНФИЦИРОВАННОЙ РАНЫ МЯГКИХ ТКАНЕЙ | 2006 |
|
RU2321898C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРОФИЧЕСКОЙ РАНЫ В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2510083C1 |
| Способ моделирования трофических гнойных ран в эксперименте | 2021 |
|
RU2753955C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ЛЕЧЕНИЯ ОСТРОГО ТКАНЕВОГО ГИПЕРТЕНЗИОННОГО СИНДРОМА ПРИ ФЛЕГМОНЕ ЯГОДИЧНОЙ ОБЛАСТИ | 2015 |
|
RU2581821C1 |

Изобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано для моделирования экспериментальной раны мягких тканей у крыс для разработки тактики лечения. Создают раневую полость путем введения импланта в мягкие ткани сроком на 6-7 суток. Осуществляют послойный разрез мягких тканей на требуемую глубину: кожи, подкожно-жировой клетчатки, поверхностной фасции и мышечной ткани. Для создания модели экспериментальной асептической раны вводят гидрофильный полимерный имплант шаровидной формы. Для создания гнойной раны вводят пористый полимерный имплант также шаровидной формы, предварительно насыщенный взвесью бактериального возбудителя в концентрации 105-1012 микробных клеток исследуемого возбудителя на 1 мл взвеси. Затем рану послойно ушивают для формирования соответствующей модели раневой полости. Имплант через указанный срок удаляют хирургическим путем, площадь поверхности (S) и объем (V) которого рассчитывают по формулам: S=4πr2, V=4/3πr3, где r - радиус импланта, π - 3,14. Способ обеспечивает моделирование раны мягких тканей в эксперименте на животных с возможностью создания задаваемых параметров этой раны в результате введения в экспериментальную рану на требуемую глубину полимерного материала, который позволяет в зависимости от изменения его экспозиции в заданном растворе варьировать диаметр импланта. 5 ил., 2 пр.
Способ моделирования экспериментальной раны мягких тканей у крыс для разработки тактики лечения, включающий создание раневой полости путем введения импланта в мягкие ткани сроком на 6-7 суток, отличающийся тем, что осуществляют послойный разрез мягких тканей на требуемую глубину: кожи, подкожно-жировой клетчатки, поверхностной фасции и мышечной ткани и для создания модели экспериментальной асептической раны вводят гидрофильный полимерный имплант шаровидной формы, а для создания гнойной раны вводят пористый полимерный имплант также шаровидной формы, предварительно насыщенный взвесью бактериального возбудителя в концентрации 105-1012 микробных клеток исследуемого возбудителя на 1 мл взвеси, затем рану послойно ушивают для формирования соответствующей модели раневой полости, имплант через указанный срок удаляют хирургическим путем, площадь поверхности (S) и объем (V) которого рассчитывают по формулам: S=4πr2, V=4/3πr3, где r - радиус импланта, π - 3,14.
| СПОСОБ МОДЕЛИРОВАНИЯ ИНФИЦИРОВАННОЙ РАНЫ МЯГКИХ ТКАНЕЙ | 2006 |
|
RU2321898C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО МОДЕЛИРОВАНИЯ ОКИСЛИТЕЛЬНОГО СТРЕССА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2011 |
|
RU2455703C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОМИЕЛИТА | 2014 |
|
RU2578818C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АБСЦЕССА МЯГКИХ ТКАНЕЙ | 2015 |
|
RU2601378C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИНФИЦИРОВАННОЙ КОЖНОЙ РАНЫ | 2010 |
|
RU2431890C1 |
| RU 2195709 C1, 27.12.2002 | |||
| СПОСОБ МОДЕЛИРОВАНИЯ ТРОФИЧЕСКОЙ РАНЫ В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2510083C1 |
| КОНТРОЛЬНЫЙ ВИСЯЧИЙ ЗАМОК | 1928 |
|
SU19083A1 |
| DAI T | |||
| et al | |||
| Animal models of external traumatic wound infections | |||
| Virulence | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| TRUJILLO A.N | |||
| et al | |||
| Demonstration of the rat ischemic skin wound model | |||
| J Vis Exp., 2015, 98, e52637, doi:10.3791/52637. | |||
Авторы
Даты
2019-10-21—Публикация
2018-08-23—Подача