Изобретение относится к области медицины, биотехнологии, молекулярной биологии и может быть использовано для лабораторной диагностики туляремии, как в практическом здравоохранении, так и для научных исследований в области микробиологии, эпидемиологии и патогенеза туляремии.
Туляремия - зоонозная природно-очаговая инфекция, этиологическим агентом которой является Francisella tularensis, грамотрицательная внутриклеточная бактерия, регулярно вызывающая эпидемические вспышки, как среди животных, так и людей.
Вид F. tularensis имеет четыре подвида: holarctica, mediasiatica, novicida и tularensis. Особую опасность представляет F. tularensis subsp. tularensis. Установлено, что вдыхание 10 бактерий способно вызвать заболевание у человека (McCrumb F.R. 1961. Aerosol infection of man with Pasteurella tularensis. Bacteriological Reviews 25:262-267). Из-за высокой инфекционности при аэрогенном пути заражения F. tularensis классифицируется как биоагент 1 уровня опасности (категория А).
Несмотря на то, что «золотым» стандартом» для диагностирования туляремии все еще является культивирование микроорганизма, обычно оно не проводится из-за невысокой чувствительности и требовательности к условиям работы. Для обнаружения и идентификации F. tularensis испробованы такие методы, как биосенсоры, культивирование, иммунохроматографический анализ, ПЦР, биочипы на жидкой или твердой основе, методы аналитической химии (газовая хроматография, масс-спектрометрия и т.д.). Среди этих методов для обнаружения F. tularensis доминирующим является ПЦР. При мониторинге природных очагов туляремии и лабораторном исследовании материала на наличие F. tularensis только с использованием ПЦР возможно выявление единичных бактерий возбудителя туляремии (высокочувствительный и высокоспецифичный nested-вариант) (Татарников С.А., Мазепа А.В., Балахонов С.В. Оптимизация Nested-варианта полимеразной цепной реакции для мониторинга природных очагов туляремии. Инфекция и иммунитет. 2013. Т. 3. №2. С. 175).
Существующие коммерческие тест-системы и экспериментальные образцы диагностических препаратов позволяют охарактеризовать штаммы на наличие генетических детерминант, специфичных для вида F. tularensis, различных подвидов (гены chilf, RD1 и др.), штаммов разной вирулентности (pdpA, pdpD) и т.д. (Лабораторная диагностика опасных инфекционных болезней: Практическое руководство. Под редакцией Г.Г. Онищенко, В.В. Кутырева. - М.: ЗАО «Шико», 2013. - 560 с., Татарников С.А., Мазепа А.В., Дубровина В.И., Войткова В.В. Идентификация геномных областей pdpD и pdpA у туляремийного микроба разных подвидов. В книге «Биологическая безопасность в современном мире». 2009. С. 69-71).
Исследования молекулярно-генетической амплификационной технологии - loop-mediated isothermal amplification (LAMP) - показали высокую специфичность и амплификационную эффективность, которая достигается при изотермальных условиях реакции (Kaneko H., Kawana Т., Fukushima Е., Suzutani Т. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. J. Biochem. Biophys. Methods. 2007. 70(3):499-501; Soto E., Hawke J.P., Fernandez D., Morales J.A. Francisella sp., an emerging pathogen of tilapia, Oreochromis niloticus (L.), in Costa Rica. J Fish Dis. 2009; 32(8):713-22). В LAMP используется 4 праймера, которые гомологичны шести участкам гена-мишени. Реакция протекает при постоянной температуре с использованием фермента, который катализирует реакцию синтеза новых цепей со смещением старых. Амплификацию и детектирование гена можно осуществить за одну стадию путем инкубации смеси образцов, праймеров, ДНК-полимеразы с функцией вытеснения цепей и субстратов при постоянной температуре (около 65°С). Эффективность амплификации очень высока, в течение 15-60 минут ДНК амплифицируется 109-1010 раз. Из-за высокой специфичности присутствие амплифицированного продукта однозначно указывает на присутствие гена-мишени.
Известно об использовании подобного метода для выявления присутствия Francisella piscicida, этиологического агента франциселлеза атлантической трески (Gadus morhua) (Caipang С.М., Kulkarni A., Brinchmann M.F., Korsnes K., Kiron V. Detection of Francisella piscicida in Atlantic cod (Gadus morhua L) by the loop-mediated isothermal amplification (LAMP) reaction. Vet J 2010; 184(3): 357-61). Для детекции гена GroEL возбудителя был разработан набор праймеров (два внешних и два внутренних). Подбор условий LAMP показал оптимальную температуру реакции 63°С в течение 1 ч с использованием бактериальной геномной ДНК в качестве матрицы. Продукты реакции визуализировали в ультрафиолетовом свете и анализировали с помощью электрофореза в агарозном геле. Метод оказался высоко специфичен для обнаружения F. piscicida и в 100 раз более чувствителен, чем обычная ПЦР. Применение LAMP-анализа возможно не только для ДНК штаммов, но и для суспензий органов атлантической трески. Однако для патогенных для человека видов F. tularensis информации о разработанных праймерах и (или) диагностических LAMP-тестах в открытых источниках не обнаружено.
Известен фермент для проведения петлевой изотермической амплификации - Bst-полимераза, выделенная из Bacillus stearothermophilus (Nagamine K., Watanabe K., Ohtsuka K., Hase Т., Notomi Т., 2001. Loop-mediated isothermal amplification reaction using a non-denatured template. Clin. Chem., 47: 1742-1743). Bst-полимераза активна при температуре до 66°С, но оптимальной для нее является температура 60°С. Успех изотермической амплификации зависит от активности ферментов по вытеснению цепи и от их способности проходить такие сложные области ДНК, как шпильки.
Однако, в научных публикациях есть сообщения о появлении ложно-положительных сигналов при работе с Bst-полимеразой.
Проведенный поиск по патентным базам и научно-техническим источникам информации показал отсутствие сведений об отечественных наборах, предназначенных для выявления F. tularensis методом петлевой изотермической амплификации. Поэтому, существует необходимость создания такого диагностикума для быстрой, чувствительной и специфичной детекции ДНК туляремийного микроба.
Техническим результатом предлагаемого изобретения является разработка высокоспецифичных олигонуклеотидных праймеров для быстрого, специфичного и чувствительного способа выявлении бактерий вида F. tularensis в биологических образцах, основанного на петлевой изотермической амплификации фрагмента гена-мишени.
Технический результат достигается тем, что предложен набор оригинальных праймеров SEQ ID №: 2 (прямой внешний праймер acpFt101-F3 F. tularensis);
SEQ ID №: 3 (обратный внешний праймер acpFt101-B3 F. tularensis);
SEQ ID №: 4 (прямой внутренний праймер acpFt101-FIP F. tularensis);
SEQ ID №: 5 (обратный внутренний праймер acpFt101-BIP F. tularensis) для способа детекции туляремийного микроба, при котором используется фермент SD-полимераза (Ignatov K.В., Barsova E.V., Fradkov A.F., Blagodatskich K.A., Kramarova T.V., Kramarov V.M. A strong strand displacement activity of thermostable DNA polymerase markedly improves the results of DNA amplification. BioTechniques. 2014; 57:81-7) в реакции петлевой изотермической амплификации в следующих условиях : предварительный прогрев смеси 92°С - 2 мин, амплификация 60°С - 60 мин, детекция продукта амплификации осуществляется при помощи электрофореза в агарозном геле по характерной электрофореграмме (вариант 1) или окрашивания продуктов реакции амплификации с помощью интеркалирующего красителя SYBR Green I (вариант 2)
Технический результат также достигается благодаря использованию в качестве целевой мишени гена асрА, кодирующего кислую фосфатазу А.
Обоснование выбора олигонуклеотидных праймеров и ДНК-мишени.
В геноме туляремийного микроба обнаружены последовательности шести кислых фосфатаз (асрА, асрВ, асрС acpD, hapA, и hapB). Они ингибируют окислительный взрыв в фагосомах инфицированного макрофага и тем самым способствуют выживанию микроба в клетках хозяина. Дефекты генов или их потеря снижает вирулентные свойства микроба (Felts R.L., Reilly T.J., Tanner J.J. Crystallization of AcpA, a respiratory burst-inhibiting acid phosphatase from Francisella tularensis. Biochim. Biophys. Acta. 2005. Aug 31;1752(1):107-10). Выбранный ген асрА, кодирующий кислую фосфатазу А, присутствует в геноме вирулентных для человека подвидов F. tularensis. Последовательность SEQ ID №1 (ген-мишень асрА) для подбора праймеров с целью детекции ДНК возбудителя туляремии методом петлевой изотермической амплификации была получена из базы GenBank NCBI (National Center for Biotechnology Information, США).
В качестве положительного контроля в экспериментах использовали штамм F. tularensis subsp. holarctica 15 НИИЭГ, используя для выделения ДНК обеззараженные суспензии микроорганизма в концентрациях от 1×106 м.к./мл до 1×101 м.к./мл. Апробация праймеров была осуществлена на наборе штаммов возбудителей туляремии Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск».
Чувствительность реакции амплификации с праймерами оценивалась при исследовании проб ДНК, выделенных из десятикратных разведений штамма F. tularensis subsp. holarctica 15 НИИЭГ.
Изобретение иллюстрируется следующими графическими материалами (табл. 1, фиг. 1-4) и примерами (1-3).
Таблица 1. Характеристика подобранных олигонуклеотидных праймеров для детекции возбудителя туляремии.
Фиг. 1. Последовательность SEQ ID №1 - нуклеотидная последовательность гена асрА из генома штамма Francisella tularensis subsp. tularensis SCHU S4. Серыми прямоугольниками выделены участки отжига праймеров и комплементарные им последовательности.
Фиг 2. Определение специфичности LAMP-праймеров SEQ ID №2; SEQ ID №3, SEQ ID №4; SEQ ID №5 для детекции F. tularensis с помощью SD-полимеразы. Обозначения: 1 - ДНК F. tularensis subsp. holarctica 15 НИИЭГ; 2 - ДНК F. tularensis subsp. holarctica 503; 3 - ДНК F. tularensis subsp. tularensis Schu S4; 4 - ДНК F. tularensis subsp. mediasiatica 120; 5 - ДНК F. tularensis subsp. mediasiatica A678; 6 - F. tularensis subsp. mediasiatica A198; 7 - ДНК В. anthracis СТИ-1; 8 - ДНК Y. pestis subsp. pestis bv. antiqua И3449; 9 - ДНК Y. pseudotuberculosis C79; 10 - ДНК V. cholerae Eltor M878; 11 - ДНК Escherichia coli JM83; 12 - ДНК В. suis 1330; 13 - ДНК В. abortus 19, 14 - ДНК В. melitensis 16-М, 15 - ДНК L. pneumophila subsp. pneumophila, серогруппа 1, АТСС 33152; 16 - ДНК L. pneumophila subsp. pneumophila, серогруппа 6, АТСС 33215; 17 - отрицательный контроль LAMP (вода); 18 - маркер молекулярного веса (100-1000 п. н.).
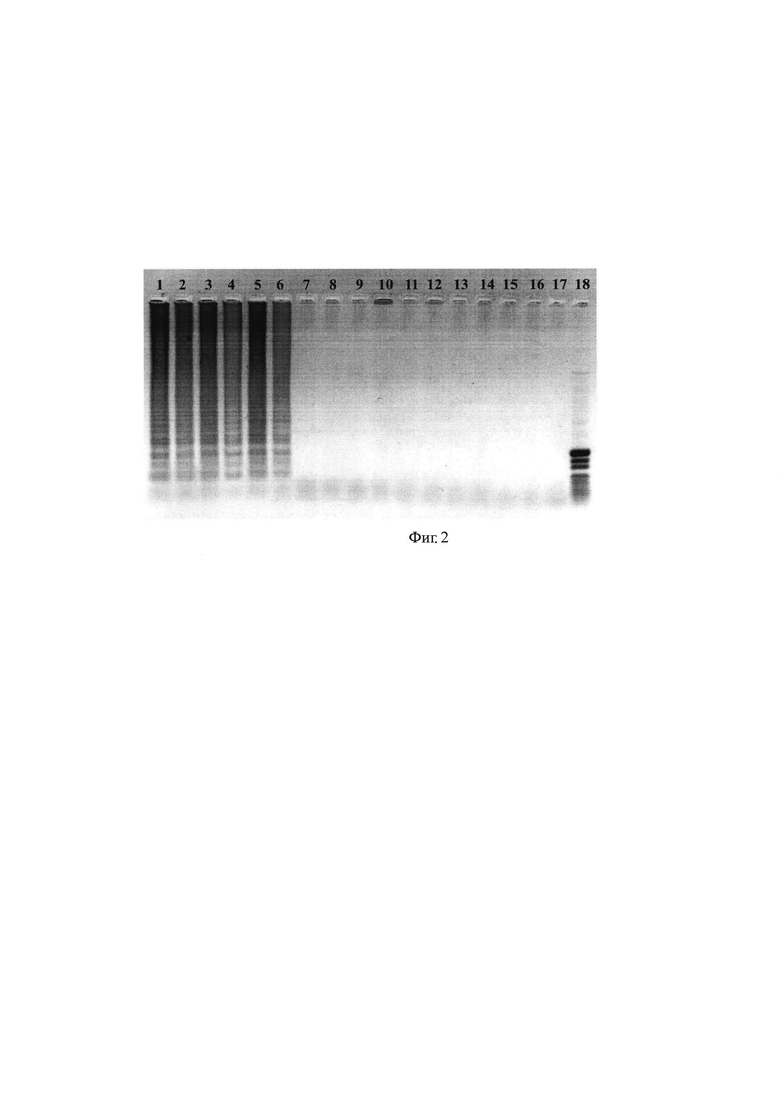
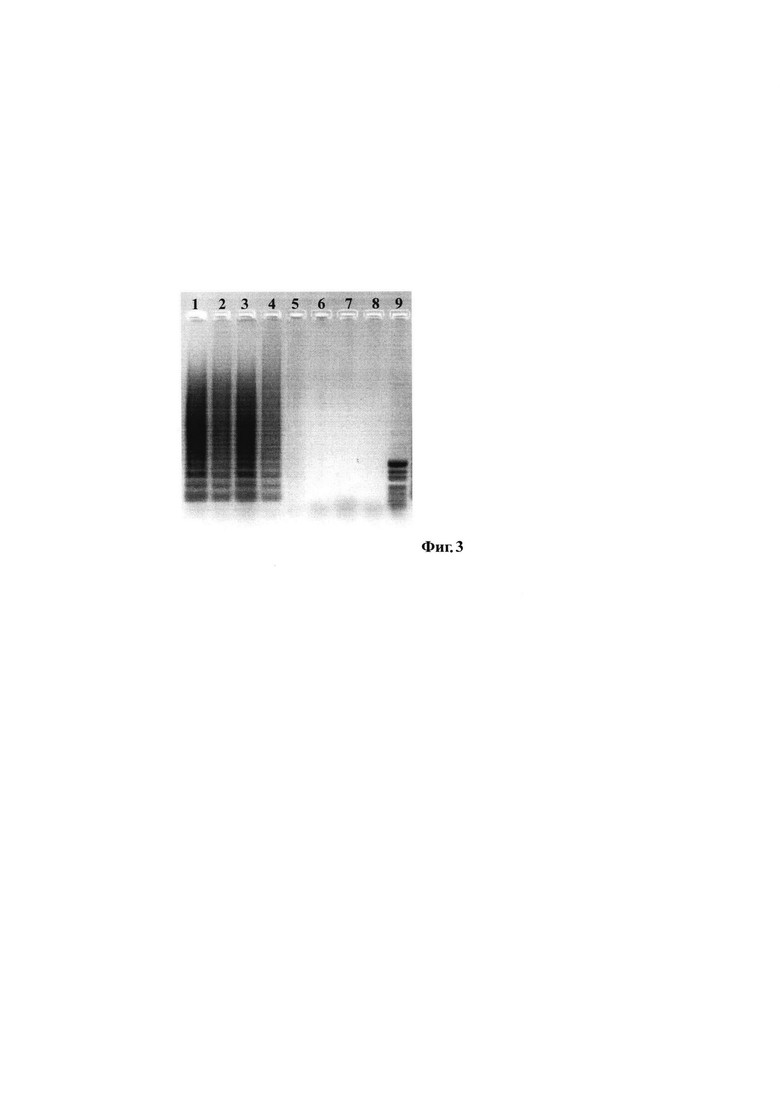
Фиг 3 Результаты определения чувствительности набора LAMP-праймеров SEQ ID №2; SEQ ID №3, SEQ ID №4; SEQ ID №5 с помощью SD-полимеразы. Использована ДНК из вакцинного штамма F. tularensis subsp. holarctica 15 НИИЭГ.
Обозначения: 1 - ДНК из 1×106 м.к. 2 - ДНК из 1×105 м.к.; 3 - ДНК из 1×104 м.к. 4 - ДНК из 1×103 м.к. 5 - ДНК из 1×102 м.к.; 6 - ДНК из 1×101 м.к.; 7 - ДНК из 1 м.к.; 8 - отрицательный контроль ПЦР (вода); 9 - маркер молекулярного веса (100-1000 п. н.).
Фиг. 4. Результаты определения чувствительности набора LAMP-праймеров SEQ ID №2; SEQ ID №3, SEQ ID №4; SEQ ID №5 с помощью SD-полимеразы и окрашивания продуктов реакции SYBR Green I. Использована ДНК из вакцинного штамма F. tularensis subsp. holarctica 15 НИИЭГ.
Обозначения: 1 - ДНК из 1×106 м.к. 2 - ДНК из 1×105 м.к.; 3 - ДНК из 1×104 м.к. 4 - ДНК из 1×103 м.к. 5 - ДНК из 1×102 м.к.; 6 - ДНК из 1×101 м.к.; 7 - ДНК из 1 м.к.; 8 - отрицательный контроль ПЦР (вода).
Примеры конкретного выполнения.
Пример 1. Методика конструирования олигонуклеотидных праймеров для детекции ДНК возбудителей туляремии методом петлевой изотермической амплификации.
На основе анализа in silico нуклеотидных последовательностей возбудителя туляремии, присутствующих в базе данных Genbank, для конструирования прямого и обратного внешних праймеров F3 и В3, прямого и обратного внутренних праймеров FTP и BIP был выбран участок генома F. tularensis размером 1545 п.н. (GenBank NCBI, GenelD: 3192410). кодирующий кислую фосфатазу А. К участку гена SEQ ID №1 (фиг. 1) подобраны праймеры SEQ ID №2; SEQ ID №3, SEQ ID №4; SEQ ID №5. Расчетная длина предполагаемого ампликона, фланкируемого праймерами SEQ ID №4; SEQ ID №5, составила 154 п.н. (табл. 1). На Фиг. 1 показаны участки отжига праймеров и комплементарные им последовательности, которые выделены прямоугольниками серого цвета.
При выборе олигонуклеотидных праймеров использовали программу для расчета праймеров он-лайн Primer Explorer 5 (http://primerexplorer.jp/lampv5e/index.html). При подборе праймеров руководствовались требованиями к олигонуклеотидам, используемым в LAMP. Анализ формирования вторичных структур (димеров, шпилек) выбранными праймерами проводили с помощью компьютерной программы mfold (http://unafold.rna.albany.edu/?q=mfold/DNA-Folding-Form). Структуры всех
олигонуклеотидов сравнивались с помощью информационного ресурса NCBI BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) с последовательностями ДНК, размещенными в базе данных GenBank. При проведении этого анализа олигонуклеотиды с существенной гомологией с ДНК каких-либо других организмов исключали. Для определения специфичности праймеров моделировали ПЦР in silico в отношении секвенированных геномов микроорганизмов с помощью In silico PCR amplification (http://insilico.ehu.es/PCR/). Показана теоретическая пригодность праймеров для успешной инициации реакции амплификации и гибридизации.
Пример 2. Амплификация специфических фрагментов ДНК с помощью разработанных праймеров для детекции возбудителя туляремии методом петлевой изотермической амплификации.
Реакционная смесь объемом 50 мкл содержала 1× SD-буфер (РусЭнзим, Россия), 40 ед. SD-полимеразы (РусЭнзим, Россия), 3,5 мМ MgCl2, 0,5 мМ каждого дНТФ, 4 праймера: 0,2 мкМ SEQ ID №2 (acpFt101F3), 0,2 мкМ SEQ ID №3 (acpFt101B3), 0,8 мкМ SEQ ID №4 (acpFt101BIP), 0,8 мкМ SEQ ID №5 (acpFt101FIP), 5 мкл матрицы. Реакцию проводили при температуре 60°С в течение 60 мин с предварительным прогревом при температуре 92°С в течение 2 мин на амплификаторе Терцик (ДНК-Технология). Детекцию продуктов LAMP проводили с помощью электрофореза в 1,2% агарозном геле в ТАЕ-буфере. (Вариант 1.) Или детекцию продуктов LAMP проводили с помощью окрашивания амплификатов интеркалирующим красителем SYBR Green I. Покраска образцов проводилась непосредственно после проведения реакции путем добавления красителя в реакцию до конечной концентрации 10×. (Вариант 2). В обоих вариантах детекции визуализацию осуществляли на УФ-трансиллюминаторе при длине волны 312 нм.
Результат амплификации каждого штамма F. tularensis считался положительным в случае появления полос в виде лестницы (вариант 1) или по появлению ярко-зеленого окрашивания после добавления SYBR Green I к амплификатам (вариант 2). Фиг 2 отображает электрофореграмму, полученную при амплификации ДНК штаммов возбудителя туляремии с набором праймеров, подобранных к последовательности SEQ ID №1.
Пример 3. Определение чувствительности и специфичности реакции амплификации с помощью разработанных олигонуклеотидных праймеров к последовательности SEQ ID №1 для идентификации ДНК возбудителя туляремии.
Чувствительность реакции амплификации с разработанными специфичными праймерами SEQ ID №2, SEQ ID №3, SEQ ID №4, SEQ ID №5 оценивалась при исследовании проб ДНК, выделенных из бактериальных взвесей клеток F. tularensis. Штаммы франциселл выращивали на чашках Петри с «FT-агаром» с добавлением полимиксина В (100 мкг/мл) в течение 48 ч при температуре (37+1)°С. Готовили бактериальные взвеси клеток в 2 мл 0,9% стерильного раствора натрия хлорида по отраслевому стандартному образцу мутности 10 единиц ГИСК им. Л.А. Тарасевича (ОСО 42-28-59-85 П), что соответствует 5×109 м.к./мл для туляремийного микроба. Затем разводили в 0,9% стерильном растворе натрия хлорида таким образом, чтобы концентрация возбудителей туляремии составляла от 1×106 до 1×101 м.к./мл. Выделение ДНК из чистых культур туляремии и гетерологичных микроорганизмов проводили путем нуклеосорбции и лизиса клеток гуанидинтиоцианатом с помощью набора «ДНК-сорб-В» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора) в соответствии с инструкцией по применению.
Учитывая, что возбудитель туляремии относится к агентам I группы патогенности, пробоподготовку и обеззараживание материала для проведения ПЦР осуществляли согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» и МУ 3.1.2007-05 «Эпидемиологический надзор за туляремией».
Специфичность разработанных праймеров оценена на коллекции из 18 штаммов, из которых 6 штаммов Francisella tularensis и 12 штаммов гетерологичных микроорганизмов (4 штамма L. pneumophila и по 1 штамму Yersinia pestis, Y. pseudotuberculosis, Bacillus anthracis, V. cholerae, Escherichia coli, B. suis, B. abortus, B. melitensis). Оценка специфичности показала отсутствие продуктов амплификации с ДНК гетерологичных штаммов. Фиг. 2 отображает результат оценки специфичности олигонуклеотидных праймеров.
Чувствительность праймеров оценивали с помощью проб ДНК, выделенных из десятикратных разведений штамма F. tularensis subsp. holarctica 15 НИИЭГ. Анализ результатов показал, что чувствительность разработанных праймеров составила 1×103 м.к. в пробе. Фиг 3 и фиг 4. отображают результат определения чувствительности олигонуклеотидных праймеров.
Таким образом, разработанные праймеры могут быть использованы для обнаружения ДНК возбудителя туляремии и позволяют в короткий срок с высокой чувствительностью и специфичностью детектировать возбудителя туляремии в пробах чистых культур. В результате проведенной оценки установлено, что выбранные праймеры для детекции возбудителей туляремии методом петлевой изотермической реакции обладают 100% специфичностью и чувствительностью - 1×103 м.к. в пробе.
Набор олигонуклеотидных праймеров Ft 101 и способ определения бактерий Francisella tularensis (Варианты) 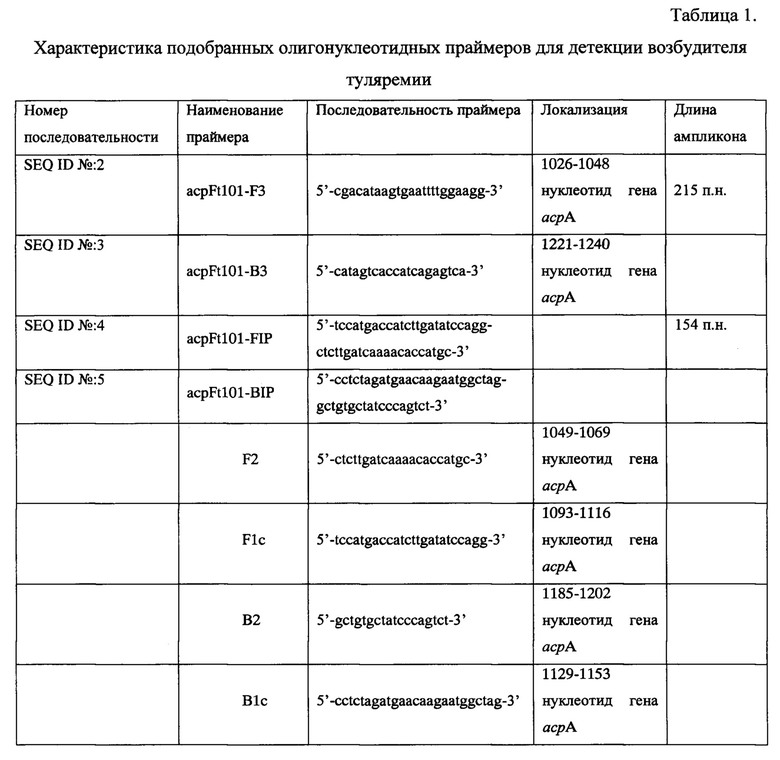
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор олигонуклеотидных праймеров Ft 182 и способ определения бактерий Francisella tularensis (Варианты) | 2019 |
|
RU2706564C1 |
| Набор олигонуклеотидных праймеров Ft 40 и способ определения бактерий Francisella tularensis (Варианты) | 2019 |
|
RU2706570C1 |
| НАБОР РЕАГЕНТОВ И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВОЗБУДИТЕЛЕЙ ЧУМЫ, СИБИРСКОЙ ЯЗВЫ И ТУЛЯРЕМИИ МЕТОДОМ ПЦР С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНЫМ УЧЕТОМ РЕЗУЛЬТАТОВ | 2013 |
|
RU2542395C1 |
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов и способ выявления ДНК возбудителя бруцеллеза | 2022 |
|
RU2795987C1 |
| Способ детекции чумного микроба и набор реагентов для его осуществления | 2022 |
|
RU2796820C1 |
| Способ идентификации подвидов возбудителя туляремии Francisella tularensis subsp. tularensis, Francisella tularensis subsp. mediasiatica и Francisella tularensis subsp. holarctica | 2015 |
|
RU2612137C1 |
| Набор реагентов и способ детекции возбудителя малярии Plasmodium falciparum | 2024 |
|
RU2839159C1 |
| НАБОР ШТАММОВ БАКТЕРИЙ ВИДА FRANCISELLA TULARENSIS ДЛЯ ПОЛУЧЕНИЯ КОМПЛЕКТА КОНТРОЛЬНЫХ ДНК ПРЕПАРАТОВ, КОМПЛЕКТ ДНК ПРЕПАРАТОВ ДЛЯ ГЕННО-ДИАГНОСТИЧЕСКИХ ИССЛЕДОВАНИЙ | 2010 |
|
RU2443772C1 |
| Способ определения подвидов Francisella tularensis методом мультипраймерной ПЦР | 2021 |
|
RU2765495C1 |
| СПОСОБ ДИФФЕРЕНЦИРОВАНИЯ ПОДВИДОВ ТУЛЯРЕМИЙНОГО МИКРОБА | 2011 |
|
RU2478717C1 |


Изобретение относится к областям биотехнологии, молекулярной биологии и медицинской микробиологии. Разработан набор олигонуклеотидных праймеров для реакции петлевой изотермической амплификации (LAMP), который позволяет амплифицировать специфические для бактерий вида Francisella tularensis фрагменты ДНК из целевого гена, имеющего нуклеотидную последовательность SEQ ID №:1. Для амплификации специфических фрагментов ДНК Francisella tularensis в реакции петлевой изотермической амплификации предложен набор олигонуклеотидных праймеров, включающий: праймер FIP - «acpFt101-F3», имеющий нуклеотидную последовательность SEQ ID №:2, праймер BIP - «acpFt101-В3», имеющий нуклеотидную последовательность SEQ ID №:3, праймер F3 - «acpFt101-FIP», имеющий нуклеотидную последовательность SEQ ID №:4, праймер В3 - «acpFt101-BIP», имеющий нуклеотидную последовательность SEQ ID №:5. Заявленное изобретение позволяет в течение 1-2 часов с высокой специфичностью детектировать наличие возбудителя туляремии - Francisella tularensis в пробах чистых культур в концентрациях от 10 до 1000 м.к. в мл (в зависимости от штаммов). 3 н.п. ф-лы, 4 ил., 1 табл., 3 пр.
1. Набор олигонуклеотидных праймеров Ft 101 для определения бактерий вида Francisella tularensis методом петлевой изотермической амплификации, содержащий олигонуклеотиды SEQ ID №2; SEQ ID №3, SEQ ID №4; SEQ ID №5, комплементарные к гену-мишени асрА бактерий вида Francisella tularensis, кодируемому нуклеотидной последовательностью SEQ ID NO: 1.
2. Способ определения бактерий Francisella tularensis методом петлевой изотермической амплификации (LAMP), отличающийся тем, что в реакции амплификации участка последовательности целевого гена-мишени асрА бактерий вида Francisella tularensis используют набор олигонуклеотидных праймеров по п. 1, причем синтез и накопление в одной пробирке фрагментов гена-мишени происходит при 60°С в течение максимум 60 мин, а определение целевого гена-мишени проводят с помощью электрофореза в агарозном геле по характерной электрофореграмме.
3. Способ определения бактерий Francisella tularensis методом петлевой изотермической амплификации (LAMP), отличающийся тем, что в реакции амплификации участка последовательности целевого гена-мишени асрА бактерий вида Francisella tularensis используют набор олигонуклеотидных праймеров по п. 1, причем синтез и накопление в одной пробирке фрагментов гена-мишени происходит при 60°С в течение максимум 60 мин, а определение целевого гена-мишени проводят с помощью окрашивания продуктов реакции амплификации интеркалирующим красителем SYBRGreenI, а результат амплификации каждого штамма F. tularensis считают положительным в случае появления ярко-зеленого окрашивания.
| КУЛИКАЛОВА Е.С | |||
| и др | |||
| Использование реакции петлевой изотермической амплификации (LAMP) для выявления ДНК вирулентных штаммов Francisella tularensis, Инфекция и иммунитет, том 6, N3, 2016, с.54 | |||
| ШЕВЯКИН А.Г | |||
| и др | |||
| Петлевая изотермическая амплификация и иммуномагнитная сепарация в диагностике микробной контаминации, Биотехнология и общество в XXI веке, Сборник статей Международной научно-практической конференции, Барнаул, 15-18 сентября 2015 г., с.93-96. |
Авторы
Даты
2019-10-22—Публикация
2019-02-14—Подача