Изобретение относится к области медицины, биотехнологии, молекулярной биологии и может быть использовано для детекции возбудителя бруцеллеза бактерий рода Brucella методом комбинированной ПЦР-LAMP с детекцией продукта в режиме реального времени, как в практическом здравоохранении, так и для научных исследований в области микробиологии, эпидемиологии и патогенеза бруцеллеза.
Бруцеллез - инфекционное зоонозное заболевание, протекающее с поражением опорно-двигательной, нервной, половой и других систем. Возбудители - грамотрицательные бактерии рода Brucella: Brucella melitensis, Brucella abortus, Brucella suis и Brucella canis. Заражение происходит в основном при контакте с инфицированным скотом и потреблении непастеризованных молочных продуктов. Наибольшую опасность представляют сырое молоко и молочные продукты (брынза, сливки, сметана, кумыс и др.). Аэрогенный путь заражения человека бруцеллезом возможен при производственных процессах, связанных с уходом за больными животными, или при обработке продуктов и сырья, полученных от них, а также в бактериологических лабораториях во время манипуляций при работе с чистыми культурами (пересевы, центрифугирование и др.), когда образуются бактериальные аэрозоли. Представители данного рода могут быть использованы в качестве биологического оружия [Pappas G., Panagopoulou P., Christou L., Akritidis N. Brucella as a biological weapon. Cell. Mol. Life Sci. 2006. Vol. 63, N 19-20. P. 2229-2236]. Так как возбудитель способен передаваться воздушно-капельным путем, вызывать изнуряющую хроническую форму заболевания со смазанными клиническими симптомами, которые не поддаются быстрой диагностике, то патоген является привлекательным для биотерроризма.
Ежегодно в Российской Федерации регистрируются заболевания бруцеллезом среди сельскохозяйственных животных, что приводит к формированию неблагополучных пунктов по бруцеллезу. Наибольшее число заболевших бруцеллезом животных приходится на субъекты Северо-Кавказского, Сибирского и Южного федеральных округов (до 90% всех регистрируемых случаев заболеваний). Ежегодно в стране регистрируется от 300 до 500 больных с впервые диагностированным бруцеллезом. Несмотря на невысокий уровень официально регистрируемой заболеваемости людей бруцеллезом на протяжении последних 10-15 лет в Российской Федерации (0,3-0,4, не выше 0,5 на 100 тыс. населения), истинные показатели гораздо выше. При этом, регистрируют только впервые диагностированные (свежие) случаи, в то время как учет хронических форм не ведется. Соответственно, отсутствуют данные об истинной распространенности бруцеллеза среди населения России. Неполная информация о заболеваемости связана и с несовершенством лабораторной диагностики бруцеллеза.
Диагноз устанавливают с помощью выделения культуры из крови, костного мозга или спинномозговой жидкости и серологического исследования в острый период и в период выздоровления. Золотым стандартом диагностики бруцеллеза остается бактериологический метод. Однако выделение бруцелл занимает 3-5 дней, требует соблюдения очень строгих правил биобезопасности и высококвалифицированного персонала для работы с инфицированным материалом и живыми бактериями из-за высокого риска внутрилабораторного заражения. Одним из основных методов диагностики бруцеллеза у людей служит серологический метод (реакция агглютинации в пробирках или реакция Райта). Но реакция агглютинации не обеспечивает высокой специфичности, антитела могут перекрестно реагировать с антигенами Yersinia enterocolitica серотипа O:9, E. coli O:116, Pasteurella multocida, Salmonella, Francicella tularensis. В диагностических целях также выполняются кожная проба Брюне, проба Кумбса, ПЦР-диагностика. Для выявления бруцеллеза ПЦР используется реже культурального или серологического методов, отчасти из-за низкой чувствительности. Методы, основанные на амплификации нуклеиновых кислот, становятся все более популярными, в повышении чувствительности, специфичности и технической простоты амплификационных методов был достигнут значительный прогресс. На сегодняшний день опубликовано не менее 400 публикаций, посвященных различным методам выявления бруцеллеза на основе ПЦР. Кроме того, существующие бактериологические и иммунологические методы идентификации бруцелл недостаточно эффективны для экспресс-диагностики.
Расширение диагностического арсенала за счет новых методов иммуно- и генодиагностики позволит получить новые сведения об особенностях инфекционного и вакцинального процессов при бруцеллезе. Из-за недостатков существующих методов диагностики потребность в специфическом, чувствительном и надежном анализе, который может заменить обычно используемые серологические тесты, очень высока.
В качестве альтернативного метода для упрощения и удешевления молекулярной диагностики бруцеллеза может рассматриваться петлевая изотермическая амплификация ДНК (loop-mediated isothermal amplification - LAMP) - амплификация ДНК, которая протекает при постоянной температуре с замещением цепи. LAMP разработан Notomi и соавт. [Notomi T., Okayama H., Masubuchi H., Yonekawa T., Watanabe K., Amino N., Hase T. (2000). Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28 (12): E63], он не требует больших затрат времени и является более дешевой альтернативой для экспресс-диагностики различных инфекций. LAMP показала высокую специфичность и эффективность, которая достигается при изотермальных условиях реакции. В реакции используются 4 праймера, которые гомологичны шести участкам гена-мишени. Дополнительное введение 2 петлевых праймеров позволяет заметно сократить время реакции. Синтез продукта протекает при постоянной температуре с использованием фермента, который катализирует реакцию синтеза новых цепей со смещением старых. Амплификацию и детектирование гена можно осуществить за одну стадию путем инкубации смеси образцов, праймеров, ДНК-полимеразы с функцией вытеснения цепей и субстратов при постоянной температуре (около 60-65°С). Эффективность амплификации очень высока, в течение 15-60 минут ДНК амплифицируется 109-1010 раз.
LAMP зарекомендовал себя как высокочувствительный метод при обнаружении ДНК бруцелл в зараженном молоке и органах инфицированных мышей. Было отмечено, что чувствительность изотермической амплификации в 100 раз превосходила чувствительность ПЦР. Таким образом, LAMP оказался пригоден для обнаружения бактерий в окружающей среде, клинических образцах и продуктах питания [Ohtsuki R., Kawamoto K., Kato Y., Shah M.M., Ezaki T., Makino S-I. Rapid detection of Brucella spp. by the loop-mediated isothermal amplification method. Journal of Applied Microbiology 2008. V. 104: 1815-1823].
К недостаткам LAMP можно отнести появление ложно-положительных результатов вследствие синтеза неспецифических продуктов амплификации - образования димеров праймеров/шпилек и достраивания их последовательностей ферментом, который синтезирует новую цепь со смещением старой. Непрямые методы детекции ампликона (применение красителей, турбидиметрия, электрофорез продукта амплификации) не позволяют отличить положительный результат от ложно-положительного.
Известен фермент для проведения петлевой изотермической амплификации - Bst-полимераза, выделенная из Bacillus stearothermophilus [Nagamine K., Watanabe K., Ohtsuka K., Hase T., Notomi T., 2001. Loop-mediated isothermal amplification reaction using a non-denatured template. Clin. Chem., 47: 1742-1743]. Bst-полимераза активна при температуре до 66°С, но оптимальной для нее является температура 60°С. Успех изотермической амплификации зависит от активности ферментов по вытеснению цепи и от их способности проходить такие сложные области ДНК, как шпильки. Однако, в научных публикациях есть сообщения о появлении ложно-положительных сигналов при работе с Bst-полимеразой.
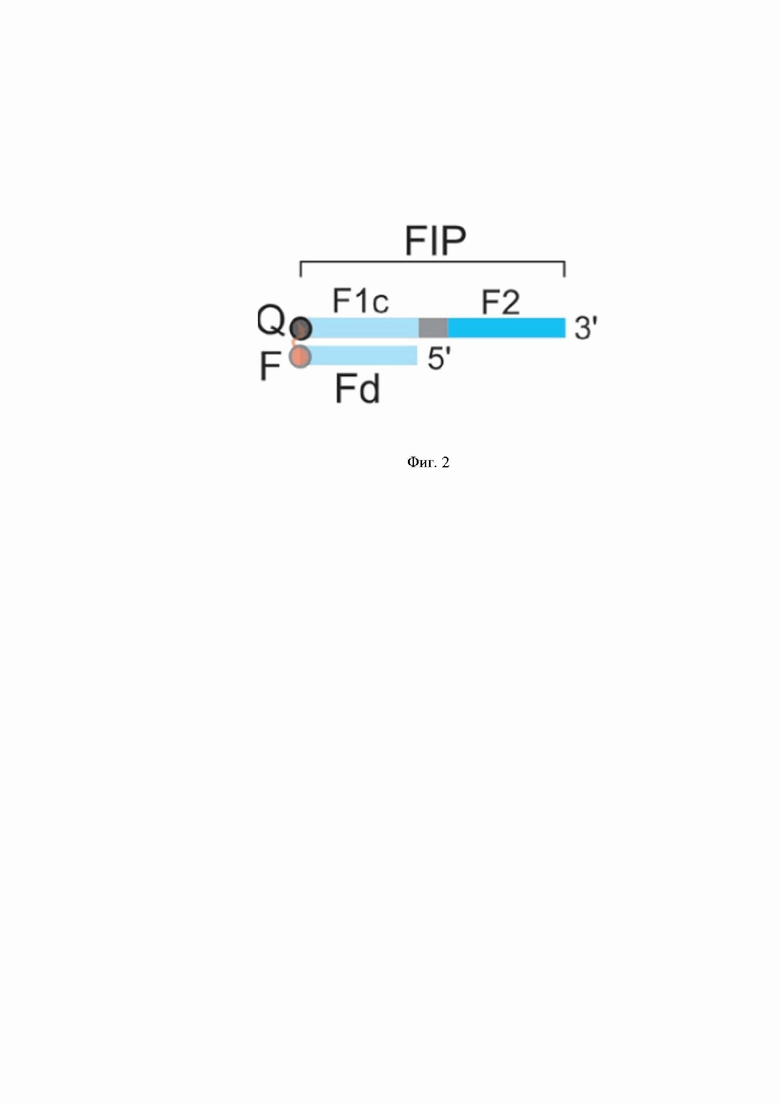
Был разработан способ специфической детекции LAMP-продукта, в котором используется DARQ-зонд - конструкция, включающая модифицированный FIP или BIP праймер с гасителем флуоресценции на 5'-конце (QFIP или QBIP) и олигонуклеотид с флуорофором на 3'-конце (Fd). Олигонуклеотид Fd комплементарен последовательности F1c праймера FIP или последовательности B1c праймера BIP. В процессе синтеза полимераза будет вытеснять Fd-олигонуклеотид из комплекса QFIP/QBIP+Fd, вызывая флуоресценцию ампликона. Наличие положительного сигнала оценивается по накоплению флуоресценции в режиме реального времени. Конструирование комплекса QFIP/QBIP+Fd возможно для любого набора LAMP-праймеров.
Известно о применении DARQ-зонда к последовательностям гена omp28 B. melitensis. Продукт реакции был выявлен в течение 40 мин, чувствительность анализа была в 10 раз выше, чем при проведении ПЦР в режиме реального времени с использованием TaqMan-зонда. Разработанный DARQ-зонд позволил выявить B. melitensis в лабораторных и клинических образцах. Предложенный авторами DARQ-зонд и был специфичным и не направлял синтез с ДНК гетерологичных штаммов микроорганизмов [Tanner N.A., Zhang Y., Evans T.C. Jr. Simultaneous multiple target detection in real-time loop-mediated isothermal amplification. Biotechniques. 2012 Aug;53(2):81-9.].
Есть сообщение о применении комбинированного метода амплификации, сочетающего ПЦР и LAMP с использованием термостабильного фермента SD-полимеразы с функцией смещения цепи. Гибридный метод амплификации продемонстрировал более высокую чувствительность, чем ПЦР или LAMP, время достижения результата значительно уменьшилось. Авторы разработанного метода предполагают, что его использование ускорит детекцию вирусов и послужит основой новых диагностических наборов для детекции патогенов [Varlamov D.A., Blagodatskikh K.A., Smirnova E.V., Kramarov V.M., Ignatov K.B. Combinations of PCR and Isothermal Amplification Techniques Are Suitable for Fast and Sensitive Detection of SARS-CoV-2 Viral RNA. Frontiers in Bioengineering and Biotechnology. 2020. V. 8. https://www.frontiersin.org/articles/10.3389/fbioe.2020.604793].
Проведенный поиск по патентным базам и научно-техническим источникам информации показал, что наиболее близким аналогом являются специфичные праймеры на основе фрагментов гена omp25 [https://patents.google.com/patent/CN103276061A/en]. Анализ осуществляется в 2 этапа: сначала проводится реакция петлевой изотермической амплификации, затем продукт наносится на диагностические полоски, в случае появления двух окрашенных зон результат считается положительным. Для проведения LAMP-реакции использована Bst-полимераза.
Разработка отечественного теста в формате LAMP для выявления возбудителя бруцеллеза имеет высокий приоритет. Быстрая и точная диагностика бруцеллеза позволит снизить уровень заболеваемости у животных и предотвратить риск передачи инфекции человеку.
Техническим результатом предлагаемого изобретения является разработка высокоспецифичных олигонуклеотидных праймеров и флуоресцентно-меченого DARQ-зонда для быстрого, специфичного и чувствительного способа детекции ДНК бактерий рода Brucella, основанного на комбинированной реакции ПЦР и LAMP гена-мишени.
Технический результат достигается тем, что предложен набор оригинальных праймеров:
SEQ ID №:2 (прямой внешний праймер - Bru-ompF3);
SEQ ID №:3 (обратный внешний праймер - Bru-ompB3);
SEQ ID №:4 (прямой внутренний праймер - Bru-ompFIP);
SEQ ID №:5 (прямой внутренний праймер - Bru-ompBIP);
SEQ ID №:6 (петлевой праймер - Bru-ompLB4);
DARQ-зонд, состоящий из двух последовательностей:
SEQ ID №:7 (модифицированный обратный внутренний праймер с флуоресцентной меткой - Bru-ompQFIP);
SEQ ID №:8 (олигонуклеотид с гаситетем флуоресценции- Bru-ompFd),
Технический результат также достигается тем, что предложен способ выявления ДНК возбудителя бруцеллеза путем комбинированной ПЦР-LAMP с детекцией продукта в режиме реального времени с помощью фермента SD-полимеразы и с использованием праймеров из набора:
SEQ ID №:2 (прямой внешний праймер - Bru-ompF3);
SEQ ID №:3 (обратный внешний праймер - Bru-ompB3);
SEQ ID №:4 (прямой внутренний праймер - Bru-ompFIP);
SEQ ID №:5 (прямой внутренний праймер - Bru-ompBIP);
SEQ ID №:6 (петлевой праймер - Bru-ompLB4);
DARQ-зонд, состоящий из двух последовательностей:
SEQ ID №:7 (модифицированный обратный внутренний праймер с флуоресцентной меткой - Bru-ompQFIP);
SEQ ID №:8 (олигонуклеотид с гаситетем флуоресценции- Bru-ompFd), которые направляют синтез и накопление в одной пробирке фрагментов гена-мишени omp25 бактерий бактерий рода Brucella в следующих условиях: предварительный прогрев смеси 92°C - 1 мин 45 сек, затем 4 цикла денатурции при 92°C - 15 сек и амплификации-элонгации при 66°C - 1 мин, затем амплификация 66°C - 20 мин, детекция продукта амплификации с ДНК патогенных видов Brucella осуществляется при регистрации флуоресцентного сигнала от метки FAM.
Технический результат также достигается благодаря использованию в качестве целевой мишени гена osp25, кодирующего белок внешней мембраны.
Обоснование выбора олигонуклеотидных праймеров и ДНК-мишени.
Белок внешней мембраны бруцелл omp25 играет важную роль в патогенезе бруцелл при инвазии клетки-хозяина, а также является одним из факторов вирулентности бактерии. Анализ гена omp25 показал его высокую консервативность у видов биоваров и штаммов патогенных бруцелл. Последовательность SEQ ID №1 (ген-мишень omp25) для подбора праймеров с целью детекции ДНК возбудителя бруцеллеза методом ПЦР-LAMP были получены из базы GenBank NCBI (National Center for Biotechnology Information, США).
Апробация праймеров была осуществлена на 16 штаммах Brucella abortus: B. abortus 19 ВА, B. abortus 554, B. abortus 1552, B. abortus 59Э, B. abortus Tulya, B. abortus 86/8159, B. abortus 870, B. abortus C-68, B. abortus 63-75, B. abortus B-3196, B. abortus C-548, B. abortus C-549, B. abortus C-550, B. abortus C-497, B. abortus C-551, B. abortus C-499; 4 штаммах Brucella melitensis: B. melitensis 16-М, B. melitensis 63/9, B. melitensis 548, B. melitensis С-554, и 1 штамме Brucella suis 1330 из Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» (табл. 1).
Чувствительность реакции амплификации с праймерами оценивалась при исследовании проб ДНК, выделенных из десятикратных разведений B. abortus 19 ВА, используя для выделения ДНК обеззараженные суспензии микроорганизмов в концентрациях от 1×107 м.к./мл до 1×101 м.к./мл.
Изобретение иллюстрируется следующими графическими материалами (табл. 2, фиг. 1-3) и примерами (1-3).
Таблица 1. Проверка специфичности олигонуклеотидных праймеров и DARQ-зонда для детекции Brucella spp с помощью комбинированной реакции ПЦР и LAMP.
Таблица 2. Характеристика подобранных олигонуклеотидных праймеров и последовательностей DARQ-зонда для детекции возбудителя бруцеллеза.
Фиг. 1. Последовательность SEQ ID №1 - нуклеотидная последовательность гена omp25 B. abortus.
Фиг 2. Схематическое изображение DARQ-зонда. Праймер FIP (последовательность F1c + F2) с гасителем флуоресценции Q на 5'-конце отжигается с олигонуклеотидом Fd (комплементарным последовательности F1c) с флуоресцентной меткой на 3'-конце.
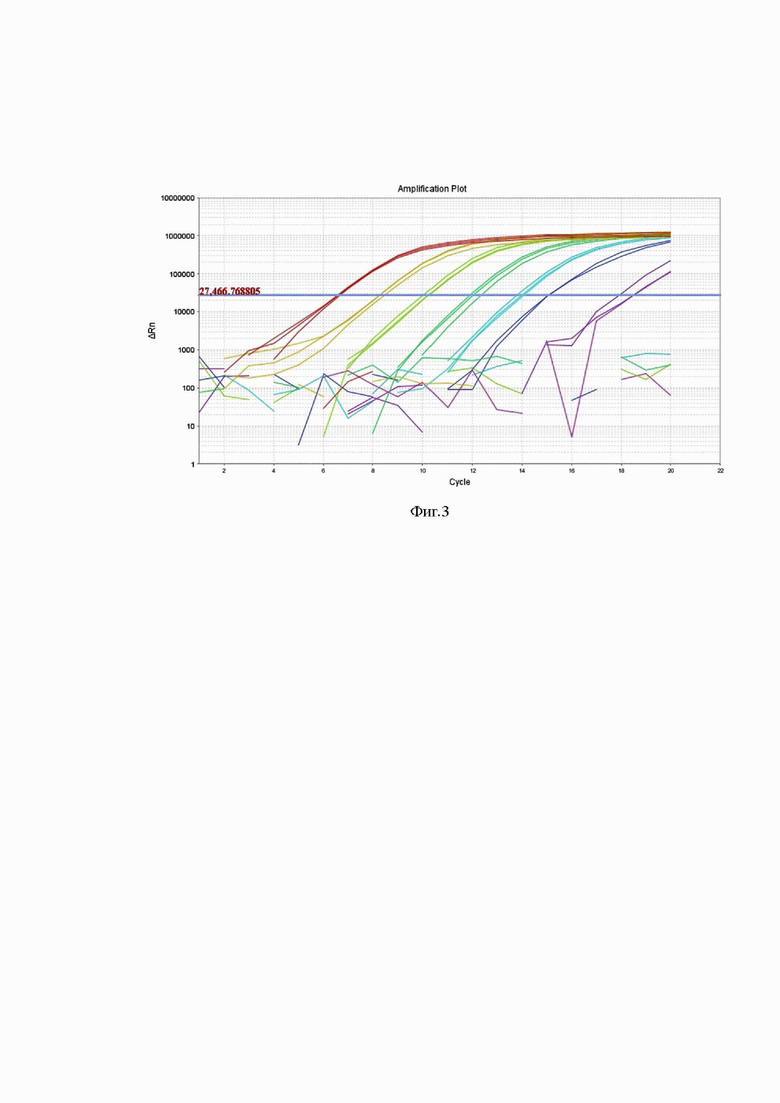
Фиг 3. Результаты определения чувствительности набора праймеров SEQ ID №2; SEQ ID №3; SEQ ID №4; SEQ ID №5; SEQ ID №6 и DARQ-зонда SEQ ID №7 и SEQ ID №8.
Графики амплификации с ДНК B. abortus 16 BA с детекций продукта по каналу FAM. Использована ДНК из 1 - 1×107 м.к./мл; 2 - ДНК из 1×106 м.к./мл; 3 - ДНК из 1×105 м.к./мл; 4 - ДНК из 1×104 м.к./мл; 5 - ДНК из 1×103 м.к./мл; 6 - ДНК из 1×102 м.к./мл; 7 - ДНК из 1×101 м.к./мл штамма B. abortus 16 BA.
Примеры конкретного выполнения.
Пример 1. Методика конструирования олигонуклеотидных праймеров для детекции ДНК возбудителей бруцеллеза методом петлевой изотермической амплификации.
На основе анализа in silico нуклеотидных последовательностей возбудителя бруцеллеза, присутствующих в базе данных Genbank, для конструирования прямого и обратного внешних праймеров F3 и B3, прямого и обратного внутренних праймеров FIP и BIP, петлевого праймера LB был выбран участок генома B. abortus размером 917 п.н. (GenBank: X79284.1), кодирующий белок внешней мембраны. К участку гена SEQ ID №1 (фиг. 1) были подобраны праймеры SEQ ID №2, SEQ ID №3, SEQ ID №4, SEQ ID №5 и SEQ ID №6. Расчетная длина предполагаемого фрагмента, фланкируемого праймерами SEQ ID №2 и SEQ ID №3, составила 213 п.н., а длина фрагмента, фланкируемого праймерами SEQ ID №4 и SEQ ID №5, составила 169 п.н. (табл.2). Для DARQ-зонда сконструированы последовательности SEQ ID №6 и SEQ ID №7.
При выборе олигонуклеотидных праймеров использовали программу для расчета праймеров он-лайн Primer Explorer 5 (http://primerexplorer.jp/lampv5e/index.html). При подборе праймеров руководствовались требованиями к олигонуклеотидам, используемым в LAMP. Анализ формирования вторичных структур (димеров, шпилек) выбранными праймерами проводили с помощью компьютерной программы mfold (http://unafold.rna.albany.edu/?q=mfold/DNA-Folding-Form). Структуры всех олигонуклеотидов сравнивались с помощью информационного ресурса NCBI BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) с последовательностями ДНК, размещенными в базе данных GenBank. При проведении этого анализа олигонуклеотиды с существенной гомологией с ДНК каких-либо других организмов исключали. Для определения специфичности праймеров моделировали ПЦР in silico в отношении секвенированных геномов микроорганизмов с помощью In silico PCR amplification (http://insilico.ehu.es/PCR/). Показана теоретическая пригодность праймеров для успешной инициации реакции амплификации и гибридизации.
Пример 2. Амплификация специфических фрагментов ДНК с помощью разработанных праймеров для детекции возбудителя бруцеллеза методом комбинированной ПЦР-LAMP.
В работе использовали программируемый термоциклер (амплификатор) для проведения ПЦР с детекцией результата в режиме реального времени 7500 Real Time PCR System (Applied Biosystems).
Реакционная смесь объемом 25 мкл содержала 1х SD-буфер (РусЭнзим, Россия), 40 ед. SD-полимеразы (РусЭнзим, Россия), 3,5 мМ MgCl2, 0,5 мМ каждого дНТФ, 5 праймеров: 0,2 мкМ SEQ ID №2 (Bru-ompF3), 0,2 мкМ SEQ ID №3 (Bru-ompB3), 0,8 мкМ SEQ ID №4 (Bru-ompFIP), 0,8 мкМ SEQ ID №5 (Bru-ompBIP), 0,4 мкМ SEQ ID №6 (Bru-ompLB), 0,2 мкМ DARQ-зонда (SEQ ID №7+SEQ ID №8), 2 мкл матрицы. Для получения DARQ-зонда смешали 55 мМ SEQ ID №7 и 45 мМ SEQ ID №8, нагрели смесь до 95°C и охладили до комнатной температуры. Реакцию проводили по следующей программе: предварительный прогрев смеси 92°C - 1 мин 45 сек, затем 4 цикл денатурции при 92°C - 15 сек и амплификации-элонгации при 66°C - 1 мин, затем амплификация при температуре 66°С в течение 20 мин, детекцию продукта амплификации с ДНК B. abortus осуществляли в реальном времени при регистрации флуоресцентного сигнала от метки FAM каждую мин в течение 20 мин.
Детекцию специфических фрагментов ДНК патогенов осуществляли с использованием DARQ-зонда, который представляют собой предварительно отожженные олигонуклеотиды SEQ ID №7 и SEQ ID №8. Последовательность SEQ ID №7 содержит гаситель флуоресценции на 5'-конце (QFIP), последовательность SEQ ID №8 имеет флуоресцентную метку на 3'-конце (Fd) и комплементарна участку F1c праймера FIP. Гаситель поглощает испускаемое флуоресцентной меткой излучение. В присутствии матрицы DARQ-зонд гибридизуется с участком ДНК. Во время стадии амплификации SD-полимераза синтезирует новую цепь с помощью праймера BIP и смещает олигонуклеотид Fd с флуорофором, в результате чего флуоресцентная метка отделяется от гасителя и ее свечение измеряет устройство, связанное с термоциклером. Сигнал накапливается в реальном времени.
Результат амплификации считали положительными при наличии флуоресцентного сигнала, пересекающего пороговую линию. Фиг 3 отображает графики амплификации с ДНК штаммов возбудителя бруцеллеза с набором праймеров и DARQ-зонда, подобранных к последовательностям SEQ ID №1.
Пример 3. Определение специфичности и чувствительности разработанных олигонуклеотидных праймеров и DARQ-зонда к последовательности SEQ ID №1 для идентификации ДНК возбудителя бруцеллеза.
Специфичность разработанных праймеров оценена на коллекции из 29 штаммов, из которых 16 штаммов B. abortus, 4 штамма B. melitensis, 1 штамм B. suis и 8 штаммов гетерологичных микроорганизмов (по 1 штамму B. anthracis, F. tularensis, Y. pestis, Y. enterocolitica, V. cholerae, L. pneumophila, P. aeruginosa, E. coli). Оценка специфичности показала, что праймеры SEQ ID №2, SEQ ID №3, SEQ ID №4, SEQ ID №5, SEQ ID №6 и SEQ ID №7+SEQ ID №8 направляли синтез только с ДНК штаммов Brucella, продукты амплификации с ДНК гетерологичных штаммов отсутствовали. Таблица 1 отображает результат оценки специфичности соответствующих олигонуклеотидных праймеров и зонда при детекции ДНК возбудителя бруцеллеза.
Чувствительность реакции амплификации с разработанными специфичными олигонуклеотидами SEQ ID №2, SEQ ID №3, SEQ ID №4, SEQ ID №5, SEQ ID №6 и SEQ ID №7+SEQ ID №8 оценивали при исследовании проб ДНК, выделенных из бактериальных взвесей клеток B. abortus 19 ВА.
Штаммы бруцелл выращивали на чашках Петри с бруцеллагаром в течение 48-72 ч при температуре (37±1)°С. Для культивирования гетерологичных микроорганизмов использовали общепринятые питательные среды для соответствующих видов («FT-агар» - для F. tularensis; бульон Хоттингера и агар Хоттингера - для B. anthracis, Y. pestis, Y. enterocolitica и E. coli; легионелбакагар - для легионелл). Инкубацию посевов культур проводили при 37°С и при 28°С - для Y. pestis.
Бактериальные взвеси клеток готовили в 2 мл 0,9% стерильного раствора натрия хлорида по отраслевому стандартному образцу мутности 10 единиц ГИСК им. Л.А. Тарасевича (ОСО 42-28-59-85 П), что соответствует 1×108 м.к./мл для B. anthracis. 1×109 м.к./мл для Y. pestis, Y. enterocolitica, Brucella, Legionella и E. coli, 5×1010 м.к./мл для F. tularensis. Затем бактериальные взвеси клеток разводили в 0,9% стерильном растворе натрия хлорида таким образом, чтобы концентрация возбудителей бруцеллеза составляла от 1×107 до 1×101 м.к./мл. Суспензии с гетерологичными микроорганизмами разводили до концентрации 1×107 м.к./мл.
Выделение ДНК из чистых культур бруцелл и гетерологичных микроорганизмов проводили путем нуклеосорбции и лизиса клеток гуанидинтиоцианатом с помощью набора «ДНК-сорб-В» (ИнтерЛабСервис) в соответствии с инструкцией по применению.
Учитывая, что возбудитель бруцеллеза относится к агентам II группы патогенности, пробоподготовку и обеззараживание материала для проведения комбинированной ПЦР-LAMP осуществляли согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» Анализ результатов показал, что чувствительность разработанных праймеров составила 1×101 м.к./мл. Фиг 3 отображает результат определения чувствительности олигонуклеотидных праймеров. Образцы тестировали в трех повторах.
Таким образом, разработанные праймеры и DARQ-зонд могут быть использованы для обнаружения ДНК возбудителя бруцеллеза и позволяют в короткий срок с высокой чувствительностью и специфичностью детектировать возбудителя бруцеллеза в пробах чистых культур. В результате проведенной оценки установлено, что выбранные праймеры и DARQ-зонд для детекции возбудителя бруцеллеза методом комбинированной ПЦР-LAMP c детекцией продукта в режиме реального времени обладают 100% специфичностью и чувствительностью - 1×101 м.к./мл.
5'→3'
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ ВОЗБУДИТЕЛЯ БРУЦЕЛЛЕЗА МЕТОДОМ ПЦР С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНЫМ УЧЕТОМ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2016 |
|
RU2621864C1 |
| НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ДНК ВОЗБУДИТЕЛЕЙ БРУЦЕЛЛЕЗА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕАЛЬНОМ ВРЕМЕНИ "ОМ-СКРИН-БРУЦЕЛЛЕЗ-РВ" | 2018 |
|
RU2715333C1 |
| Набор реагентов и способ детекции возбудителя малярии Plasmodium falciparum | 2024 |
|
RU2839159C1 |
| Набор олигонуклеотидных праймеров Ft 182 и способ определения бактерий Francisella tularensis (Варианты) | 2019 |
|
RU2706564C1 |
| Набор олигонуклеотидных праймеров Ft 101 и способ определения бактерий Francisella tularensis (варианты) | 2019 |
|
RU2703803C1 |
| Способ детекции чумного микроба и набор реагентов для его осуществления | 2022 |
|
RU2796820C1 |
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов и способ выявления ДНК возбудителей сапа и мелиоидоза методом ПЦР с детекцией продукта в режиме реального времени | 2019 |
|
RU2738358C1 |
| СПОСОБ ГЕНЕТИЧЕСКОГО INDEL-ТИПИРОВАНИЯ ШТАММОВ BRUCELLA MELITENSIS | 2019 |
|
RU2732425C1 |
| Набор олигонуклеотидных праймеров Ft 40 и способ определения бактерий Francisella tularensis (Варианты) | 2019 |
|
RU2706570C1 |
| Набор олигонуклеотидных праймеров и зондов для идентификации РНК вируса лихорадки Рифт-Валли методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2023 |
|
RU2813519C1 |

Изобретение относится к биотехнологии, в частности, предложен набор олигонуклеотидных праймеров и DARQ-зонд, которые позволяют детектировать специфические для патогенных бруцелл фрагменты ДНК целевого гена. Для выявления ДНК патогенных бруцелл проводят реакцию комбинированной ПЦР-LAMP с детекцией продукта в режиме реального времени. Заявленное изобретение позволяет в течение 20 мин с высокой специфичностью детектировать наличие возбудителя бруцеллеза в пробах чистых культур в концентрации 1×101 м.к./мл. 2 н.п. ф-лы, 3 ил., 2 табл., 3 пр.
1. Набор олигонуклеотидных праймеров, содержащий олигонуклеотиды SEQ ID №: 2, SEQ ID №: 3, SEQ ID №: 4, SEQ ID №: 5 и SEQ ID №: 6, и DARQ-зонд, содержащий олигонуклеотиды SEQ ID №: 7 и SEQ ID №: 8, для выявления ДНК возбудителя бруцеллеза методом комбинированной ПЦР-LAMP с детекцией продукта в режиме реального времени, комплементарные к гену-мишени omp25 патогенных бактерий рода Brucella, кодируемому нуклеотидной последовательностью SEQ ID №: 1.
2. Способ выявления ДНК возбудителя бруцеллеза методом комбинированной ПЦР-LAMP с детекцией продукта в режиме реального времени, отличающийся тем, что используют праймеры из набора по п.1, которые направляют синтез и накопление в одной пробирке фрагментов гена-мишени omp25 бактерий рода Brucella с помощью фермента SD-полимеразы в следующих условиях: предварительный прогрев смеси 92°C – 1 мин 45 сек, затем 4 цикла денатурции при 92°C – 15 сек и амплификации-элонгации при 66°C –1 мин, затем амплификация 66°C – 20 мин, детекция продукта амплификации с ДНК патогенных видов Brucella осуществляется при регистрации флуоресцентного сигнала от метки FAM.
| Jamil T | |||
| et al | |||
| Serological and molecular detection of bovine brucellosis at institutional livestock farms in Punjab, Pakistan //International journal of environmental research and public health | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| - Т | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| - No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| - С | |||
| Регенератор | 1925 |
|
SU1412A1 |
| Gwida M | |||
| M | |||
| et al | |||
| Comparison of diagnostic tests for the detection of Brucella spp | |||
| in camel sera //BMC research | |||
Авторы
Даты
2023-05-16—Публикация
2022-11-14—Подача