ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической композиции для лечения ракового заболевания, которая содержит соединение, обладающее противораковой активностью, а именно 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил или его фармацевтически приемлемую соль и/или сольват в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Задача изобретения состояла в том, чтобы найти новые фармацевтические композиции, обладающие ценными свойствами, в частности такие, которые могут быть использованы для получения лекарственных средств.
Кроме того, целью настоящего изобретения являются новые композиции для предотвращения и лечения злокачественных опухолевых образований, включая, но не ограничиваясь только ними, солидные злокачественные опухоли, онкологические заболевания лимфатической и кровеносной системы.
Было обнаружено, что фармацевтические композиции в соответствии с изобретением и их фармацевтически приемлемые соли и/или сольваты обладают очень ценными фармакологическими свойствами и хорошей переносимостью.
Большинство селективных таргетных терапевтических средств при применении в монотерапии являются эффективными только у сильно зависимой субпопуляции пациентов. Посредством сочетания селективных таргетных терапевтических средств с другими таргетными средствами противоопухолевый эффект может быть усилен за счет вмешательства в перекрестные помехи между сигнальными путями, одновременного блокирования различных опухолеспецифических путей или ингибирования одного и того же опухолеспецифического пути на разных уровнях для предотвращения или снижения риска прогрессии.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил был описан в WO 2009/006959 А1.
3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил гидрат гидрохлорида был описан в WO 2009/007074 А1.
Амид 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты
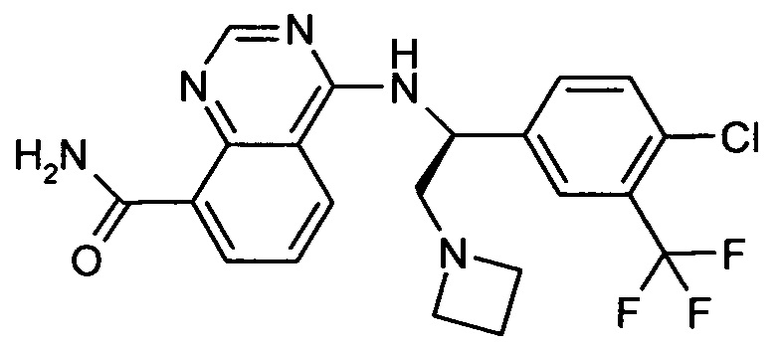
представляет собой ингибитор p70S6K, ингибитор, который также нацелен на АКТ и описан в WO 2012/069146. Соединение применимо в лечении гиперпролиферативных заболеваний, таких как рак.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к фармацевтической композиции 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к фармацевтической композиции гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к фармацевтической композиции 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты для применения в лечении заболеваний, выбранных из группы, включающей рак головы, шеи, глаз, рта, горла, пищевода, бронхов, гортани, глотки, грудной клетки, костей, легких, толстой кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, груди, яичников, яичек или других репродуктивных органов, кожи, щитовидной железы, крови, лимфатических узлов, почек, печени, поджелудочной железы, головного мозга, центральной нервной системы, солидных опухолей и переносимых кровью опухолей.
Кроме того, изобретение относится к фармацевтической композиции гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты для применения в лечении рака, выбранного из группы мелкоклеточного рака легких (МКРЛ), немелкоклеточного рака легких (НМКРЛ), плоскоклеточного рака головы и шеи (ПРГШ).
Кроме того, изобретение относится к 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрилу или его фармацевтически приемлемой соли и/или сольвату для применения в лечении рака, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата для изготовления лекарственного средства для лечения рака, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению гидрата гидрохлорида 3-(1-{3-[5-(1-метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению гидрата гидрохлорида 3-(1-{3-[5-(1-метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака, выбранного из группы, включающей колоректальный рак, рак легких, груди, почек и глиобластомы, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению гидрата гидрохлорида 3-(1-{3-[5-(1-метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака легких, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению гидрата гидрохлорида 3-(1-{3-[5-(1-метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака, выбранного из группы, включающей мелкоклеточный рак легких (МКРЛ), немелкоклеточного рака легких (НМКРЛ), плоскоклеточного рака головы и шеи (ПРГШ), причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
Кроме того, изобретение относится к применению, описанному выше, причем 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил или его фармацевтически приемлемую соль и/или сольват или 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил гидрат гидрохлорида вводят пациенту в количестве от 250 мг до 12500 мг в неделю, предпочтительно в количестве от 800 мг до 8000 мг в неделю, особенно предпочтительно в количестве от 500 мг до 2000 мг в неделю.
В соответствии с настоящим изобретением терапевтически активные композиции также могут быть предоставлены с помощью фармацевтического набора, включающего в себя упаковку, содержащую 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил или его фармацевтически приемлемую соль и/или сольват, и 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты амид, в отдельных упаковках или в разделенных емкостях.
Терапия этими комбинациями по выбору может включать дополнительное лечение с помощью лучевой терапии. Кроме того, изобретение относится к новой форме терапии, включающей начало введения 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата перед лучевой терапией.
В этой новой форме терапии, включающей начало введения 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата перед лучевой терапией, преимущественным признаком является то, что 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил или его фармацевтически приемлемую соль и/или сольват вводят до и/или во время введения амида 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты, предпочтительно по меньшей мере во время значительной части схемы лечения. В данном контексте, в соответствии с настоящим изобретением, облучение или лучевую терапию предпочтительно следует понимать в качестве совместного терапевтического средства для лечения рака.
Также изобретение относится к оптически активным формам (стереоизомерам), энантиомерам, рацематам, диастереомерам и гидратам и сольватам этих соединений.
Также изобретение относится к сольватам солей соединений, таким как моно- или дигидрат гидрохлорида.
Термин сольваты соединений следует понимать как аддукции молекул инертного растворителя на соединениях, которые образуются вследствие силы их взаимного притяжения. Сольватами являются, например, моно- или дигидраты или алкоголяты.
Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или терапевтическую ответную реакцию, которую предполагает или желает получить, например, исследователь или лечащий врач.
Помимо этого, выражение "терапевтически эффективное количество" обозначает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества:
улучшенное лечение, излечение, предотвращение или устранение заболевания, синдрома, состояния, жалобы, расстройства или побочных действий, или также уменьшение прогрессирования заболевания, жалобы или расстройства.
Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для повышения нормальной физиологической функции.
Фармацевтические соли и другие формы
Указанные соединения в соответствии с изобретением могут быть применены в их конечной несолевой форме. С другой стороны, настоящее изобретение также охватывает применение этих соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые солевые формы соединений в соответствии с изобретением получают, главным образом, при использовании традиционных способов. В случае если соединение в соответствии с изобретением содержит карбоксильную группу, то его приемлемая соль может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Такими основаниями являются, например, гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочноземельных металлов, такие, как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например, этилат калия и пропилат натрия; а также различные органические основания, такие, как пиперидин, диэтаноламин и N-метилглутамин. Равным образом включены соли алюминия соединений в соответствии с изобретением. В случае некоторых соединений в соответствии с изобретением соли присоединения кислоты могут быть образованы путем обработки этих соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например, галогенидами водорода, такими, как хлористый водород, бромистый водород или йодистый водород, другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат или фосфат и т.п., и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат и другими органическими кислотами и их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и т.п. Следовательно, фармацевтически приемлемые соли присоединения кислоты соединений включают следующие: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, формиат, галактерат (из муциновой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изетионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат, фталат, но не ограничиваются только ними.
Кроме того,  соли соединений в соответствии с изобретением включают, но не ограничиваются только ними, соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка. Среди перечисленных выше солей предпочтение отдают солям аммония; солям щелочных металлов - натрия и калия; и солям щелочноземельных металлов - кальция и магния. Соли соединений, которые получают из фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваются только ними, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например, аргинин, бетаин, кофеин, хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглюмин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин).
соли соединений в соответствии с изобретением включают, но не ограничиваются только ними, соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка. Среди перечисленных выше солей предпочтение отдают солям аммония; солям щелочных металлов - натрия и калия; и солям щелочноземельных металлов - кальция и магния. Соли соединений, которые получают из фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваются только ними, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например, аргинин, бетаин, кофеин, хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглюмин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин).
Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как (С1-С4-алкилгалогениды, например, метил-, этил-, изопропил- и трет-бутилхлорид, бромид и йодид; ди-(С1-С4)-алкилсульфаты, например, диметил-, диэтил- и диамилсульфат; (С10-С18)-алкилгалогениды, например, децил-, додецил-, лаурил-, миристил- и стеарилхлорид, бромид и йодид; и арил-(С1-С4)-алкилгалогениды, например, бензилхлорид и фенэтилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением.
Предпочтительные указанные выше фармацевтические соли включают, но не ограничиваются только ними, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изетионат, манделат, меглюмин, нитрат, олеат, фосфонат, пивалат, фосфат натрия, стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин.
Особое предпочтение отдают гидрохлориду, дигидрохлориду, гидробромиду, малеату, мезилату, фосфату, сульфату и сукцинату.
Соли присоединения кислот основных соединений формулы I получают путем введения в контакт формы свободных оснований с достаточным количеством целевой кислоты с получением соли традиционным способом. Свободное основание можно регенерировать путем введения в контакт солевой формы с основанием и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от их соответствующих солевых форм своими определенными физическими свойствами, такими, как растворимость в полярных растворителях; тем не менее, для целей настоящего изобретения во всем остальном соли являются эквивалентными своим соответствующим формам свободных оснований.
Как уже было указано, фармацевтически приемлемые соли присоединения основания соединений образуют с металлами или аминами, такими, как щелочные металлы и щелочноземельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин.
Соли присоединения основания кислых соединений в соответствии с изобретением получают путем введения в контакт формы свободной кислоты с достаточным количеством целевого основания для получения соли традиционным способом. Форма свободной кислоты может быть регенерирована путем введения в контакт солевой формы с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих солевых форм определенными физическими свойствами, такими, как растворимость в полярных растворителях, тем не менее, для целей настоящего изобретения во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот.
Если соединение в соответствии с изобретением содержит более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных солевых форм включают, но не ограничиваются только ними, битартрат, диацетат, дифумарат, димеглюмин, дифосфат, динатрий и тригидрохлорид.
В свете описанного выше можно понять, что выражение "фармацевтически приемлемая соль" в контексте данной заявки предназначено для обозначения активного компонента, который включает соединение в соответствии с изобретением в форме одной из его солей, особенно в том случае, если указанная солевая форма обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или любой другой солевой формой указанного активного компонента, которые использовались ранее. Фармацевтически приемлемая солевая форма активного компонента изначально может также придавать указанному активному компоненту желаемое фармакокинетическое свойство, которым он ранее не обладал, а также может даже оказывать положительное влияние на фармакодинамику данного активного компонента в отношении его терапевтической активности в организме.
Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение и/или его фармацевтически приемлемые соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях, и по выбору наполнители и/или вспомогательные вещества.
Фармацевтические составы можно вводить в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 мг до 700 мг, более предпочтительно от 5 мг до 100 мг, соединения в соответствии с изобретением, в зависимости от состояния, которое подлежит лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические составы можно вводить в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными составами дозированных единиц являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую ей порцию активного компонента. Фармацевтические составы этого типа также могут быть получены способом, который хорошо известен в области фармацевтики.
Фармацевтические составы могут быть приспособлены для введения при помощи любого приемлемого способа, например, путем перорального (включая буккальное или подъязычное), ректального, назального, местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие составы могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например, путем объединения активного компонента с наполнителем(ями) или вспомогательным(ыми) веществом(ами).
Фармацевтические составы, предназначенные для перорального введения, можно вводить в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; съедобных пен или пенящихся пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле.
Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до необходимого малого размера и смешивания его с фармацевтическим наполнителем, измельченным аналогичным способом, таким как, например, пищевой углевод, такой как, например, крахмал или маннит. Равным образом могут присутствовать ароматизатор, консервант, диспергирующее вещество и краситель.
Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполнения нею формованных желатиновых капсул. Перед заполнением капсул к порошковой смеси можно добавлять придающие скользкость и смазывающие вещества, такие как, например, высокодисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия.
Кроме того, при желании или необходимости в смесь также можно добавлять пригодные связующие вещества, смазывающие вещества, дезинтеграторы, а также красители. Пригодные связующие вещества включают крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза, подсластители, полученные из кукурузы, природные и синтетические смолы, такие как, например, аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые можно применять в таких дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваются только ними, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного приемлемым образом, с разбавителем или основанием, как описано выше, и необязательно со связующим веществом, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин, усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или фосфат дикальция. Порошковую смесь можно гранулировать путем смачивания связующим веществом, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции, порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового герметизирующего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозированными единицами.
Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозированных единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульгаторы, такие как, например, этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло перечной мяты, или натуральные заменители сахара или сахарин, или другие искусственные подсластители и т.п.
При желании составы для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы. Также состав может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или введения вещества в виде частиц в полимеры, воск и т.п.
Соединения и их соли, сольваты, таутомеры и стереоизомеры также можно вводить в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы из различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины.
Соединения формулы и их соли, сольваты, таутомеры и стереоизомеры также могут быть доставлены путем применения моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве таргетных носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксидполилизин, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей.
Фармацевтические составы, предназначенные для трансдермального введения, можно вводить в виде независимых пластырей для пролонгированного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может быть доставлен из пластыря путем ионофореза, как в общих чертах описано в Pharmaceutical Research, 3 (6), 318 (1986).
Фармацевтические соединения, предназначенные для местного применения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел.
Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются составы в виде мази или крема для локального нанесения. Для приготовления состава в виде мази, активный компонент может быть использован или с парафиновой, или смешиваемой с водой кремовой основой. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле.
Фармацевтические составы, предназначенные для местного применения для глаз, включают глазные капли, в которых активный компонент растворен или суспендирован в приемлемом носителе, в частности в водном растворителе.
Фармацевтические составы, предназначенные для местного введения в полость рта, включают леденцы, пастилки и жидкости для полоскания рта.
Фармацевтические составы, предназначенные для ректального введения, можно вводить в виде суппозиториев или клизм.
Фармацевтические составы, предназначенные для назального введения, в которых носитель представляет собой твердое вещество, включают крупнозернистый порошок, имеющий размер частичек, например, в пределах 20-500 микрон, который вводят путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Пригодные составы для введения в виде назального спрея или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле.
Фармацевтические составы, предназначенные для введения путем ингаляции, включают тонкоизмельченные частички в виде тонкого порошка или аэрозоля, которые могут быть получены с помощью различных диспергирующих устройств под давлением при помощи аэрозолей, распылителей или инсуффляторов.
Фармацевтические составы, предназначенные для вагинального введения, можно вводить в виде маточных колец, тампонов, кремов, гелей, паст, пен или составов для распыления.
Фармацевтические составы, предназначенные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых состав поддерживается изотоническим по отношению к крови реципиента, которого лечат; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Составы могут быть введены с помощью емкостей для однократного или многократного введения, например, запечатанных ампул и флаконов, и их можно хранить в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например, воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток.
Само собой разумеется, что дополнительно к предпочтительным описанным выше составляющим, составы также могут содержать другие вещества, которые используют в данной области техники для конкретных типов составов; например, составы, пригодные для перорального введения, могут содержать ароматизаторы.
Терапевтически эффективное количество соединения зависит от многих факторов, включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конечном счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением, как правило, находится в пределах от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в пределах от 1 до 10 мг/кг веса тела в сутки. Таким образом, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в сутки или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в сутки, так что общая суточная доза является такой же самой. Эффективное количество его соли, сольвата, таутомера или стереоизомера может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить, что аналогичные дозы пригодны для лечения других состояний, описанных выше.
Комбинированное лечение этого типа можно осуществлять с помощью одновременного, последовательного или раздельного дозирования индивидуальных компонентов лечения. В комбинированных продуктах такого типа применяют соединения в соответствии с изобретением.
Определенное в настоящей заявке противораковое лечение может быть применено в качестве монотерапии или может включать, помимо композиции в соответствии с изобретением обычное оперативное вмешательство или лучевую терапию.
Термин "лечение", используемый в настоящей заявке, обозначает облегчение, полностью или частичное, симптомов, связанных с нарушением или заболеванием, или замедление, или остановку дальнейшего прогрессирования или ухудшения этих симптомов, или предотвращение или профилактику заболевания или нарушения у субъекта, имеющего риск развития такого заболевания или нарушения.
Термин "эффективное количество" применительно к соединению может обозначать количество, способное облегчать, полностью или частично, симптомы, связанные с нарушением или заболеванием, или замедлять или останавливать дальнейшее прогрессирование или ухудшение этих симптомов, или предотвращать или обеспечивать профилактику заболевания или нарушения у субъекта, имеющего заболевание или с риском развития заболевания, описанного в настоящей заявке, такого как рак.
Термин "терапевтически эффективное" или "терапевтически эффективное количество" относится к количеству лекарственного средства, эффективного для лечения заболевания или нарушения у млекопитающего. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е., в определенной степени замедлять и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е., в определенной степени замедлять и предпочтительно останавливать) метастазирование опухоли; ингибировать, в определенной степени замедлять, рост опухоли; и/или в некоторой степени облегчить один или более симптомов, связанных с раком.
Предпочтительно, соединения вводят один раз в неделю, предпочтительно внутривенно как инфузию. Предпочтительно начальная доза составляет от 100 до 1000 мг на м2 поверхности тела, в особенности предпочтительно между 200 и 600 мг на м2 поверхности тела. Последующие дозы составляют от 50 до 600 мг на м2 поверхности тела, в особенности предпочтительно между 100 и 400 мг на м2 поверхности тела.
ПРИМЕНЕНИЕ
Данные соединения пригодны в качестве фармацевтических активных веществ для млекопитающих, в особенности для людей, в лечении заболеваний, вызванных иммуномодулирующей и киназной стрессовой реакцией. К этим заболеваниям относят неопластические злокачественные образования, включая, но не ограничиваясь только ними, солидные злокачественные опухоли, онкологические заболевания лимфатической и кровеносной системы, пролиферацию опухолевых клеток, патологическую неоваскуляризацию (или ангиогенез), которая ускоряет рост солидных опухолей, нейродегенеративыне заболевания (болезнь Альцгеймера, демиелинизирующие основные нарушения, рассеянный склероз и т.п.), нарушения, связанные с иммунной системой, такие как артрит, псориаз, волчанка или другие аутоиммунные заболевания, а также хронические инфекции.
Настоящее изобретение относится к применению соединений и/или их физиологически приемлемых солей и сольватов для получения лекарственного средства для лечения или профилактики рака. Преимущественно формы рака для лечения происходят из группы рака головного мозга, рака мочеполовых путей, рака лимфатической системы, рака желудка, рака гортани и рака легких. Еще одна группа преимущественных форм рака представляет собой моноцитарный лейкоз, аденокарциному легких, мелкоклеточный рак легких, рак поджелудочной железы, глиобластому, меланому и рак груди. Еще одна группа преимущественных форм рака включает, но не ограничивается ими, рак шейки матки, нейробластому, рак яичка, макроглобулинемию и саркомы.
Настоящее изобретение в особенности относится к соединениям и их фармацевтически приемлемым солям, сольватам, таутомерам и стереоизомерам, включая их смеси во всех соотношениях, для применения в лечении злокачественных опухолевых образований (солидные злокачественные опухоли, онкологические заболевания лимфатической и кровеносной системы и т.п.), нейродегенеративных заболеваний, нарушений, связанных с иммунной системой, таких как, артрит, псориаз, красная волчанка, рассеянный склероз или других аутоиммунных заболеваний, а также хронических инфекций.
Особое предпочтение отдают применению в лечении заболевания, где заболевание представляет собой злокачественные опухолевые образования.
Злокачественные опухолевые образования предпочтительно выбраны из группы опухолей легких, плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, мозга, простаты, мочеполовых путей, лимфатической системы, желудка и/или гортани.
Еще более предпочтительно злокачественные опухолевые образования выбирают из группы, включающей аденокарциному легких, мелкоклеточный рак легких, рак поджелудочной железы, глиобластому, рак толстой кишки и рак груди.
Предпочтение также отдают применению для лечения злокачественных опухолевых образований кровеносной и иммунной системы, предпочтительно для лечения опухолей, выбранных из группы, включающей острый миелоидный лейкоз, хронический миелолейкоз, острый лимфобластный лейкоз и/или хронический лимфолейкоз.
Типичные виды рака, для лечения или профилактики которых пригодны соединения, включают, но не ограничиваются только ними, рак головы, шеи, глаз, рта, горла, пищевода, бронхов, гортани, глотки, грудной клетки, костей, легких, толстой кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, груди, яичников, яичек или других репродуктивных органов, кожи, щитовидной железы, крови, лимфатических узлов, почек, печени, поджелудочной железы, головного мозга, центральной нервной системы, солидных опухолей и переносимых кровью опухолей.
Кроме того, настоящее изобретение в особенности относится к соединениям для применения в лечении и/или предупреждении рака,
где подлежащее лечению раковое заболевание представляет собой солидную опухоль или опухоль кровеносной и иммунной системы.
Кроме того, настоящее изобретение в особенности относится к соединениям, для применения в лечении и/или предупреждении рака, при этом опухоль относится к группе, включающей острый миелоидный лейкоз, хронический миелолейкоз, острый лимфобластный лейкоз и/или хронический лимфолейкоз.
Кроме того, настоящее изобретение в особенности относится к соединениям для применения в лечении и/или предупреждении рака, где солидная опухоль относится к группе, включающей опухоли эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, мозга, предстательной железы, мочеполовых путей, лимфатической системы, желудка, гортани, костей, в том числе хондросаркомы и саркомы Юинга, зародышевых клеток, в том числе эмбриональных опухолей тканей и/или легких, из группы моноцитарного лейкоза, аденокарциномы легких, мелкоклеточного рака легких, поджелудочной железы, глиобластомы, нейрофибромы, ангиосаркомы, рака груди и/или злокачественной меланомы.
Описанные соединения могут быть введены в комбинации с другими известными терапевтическими средствами, в том числе противоопухолевыми средствами. Как используют в настоящей заявке термин "противораковое средство" относится к любому средству, которое вводят пациенту с раковым заболеванием с целью лечения ракового заболевания.
Подтверждение того, что посредством сочетания гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты усиливается противоопухолевая активность наиболее активного отдельного средства. Эта усиленная активность комбинированного лечения может быть подтверждена в человеческих ксенотрансплантатных моделях и моделях опухолей, полученных от пациентов. Модели ксенотрансплантата показывают более высокую эффективность по сравнению с монотерапиями без увеличения побочных эффектов, связанных с лечением. Усиленная эффективность в группе с комбинированным лечением наблюдали без увеличения токсичности, о чем свидетельствует отсутствие значительной потери веса или смерти животных по сравнению с монотерапиями.
Комбинация гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила и амида 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты в человеческой ксенотрансплантатной модели U87-МГ:
Предпосылки: Модель человеческой глиобластомы U87-MG представляет собой аутокринную экспрессирующую опухоль модель HGF/c-Met с активированным c-Met путем передачи. Эта модель несет мутацию PTEN, отрицательный регулятор передачи сигналов PI3K.
Способ: Самкам бестимусных мышей CD-1 (в возрасте 6-8 недель) подкожно впрыскивали человеческие опухолевые клетки U87-MG и разделяли на обработанные группы (8 животных на группу) после того, как опухоль прижилась. Соответствующим группам перорально вводили гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила (100 мг/кг) или амид 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты (30 мг/кг) ежедневно в монотерапии или в комбинации до тех пор, пока опухоли прогрессировали или до периода лечения в 65 дней. На 12 день, день прекращения участия группы, получающей носитель, подсчитывали изменение среднего объема опухоли (TV) в %. Статистический анализ осуществляли посредством двойственных RM ANOVA. Среднее время до прогрессии опухоли при лечении подсчитывали в конце исследования. Прогрессию опухоли определяют как изменение объема опухоли >73%.
Результаты: Гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила проявил сильную противоопухолевую активность, выраженную в регрессии опухоли (изменение TV в -71%, p<0.0001). При длительном лечении в течение до 65 дней, опухоль становилась устойчивой и прогрессировала (среднее время в 58 дней). Амид 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты в качестве единственного средства приводил к стазу опухоли (изменение TV в 51%, p<0.0001) и это выражалось в среднем времени в 14 дней до прогрессии опухоли. Комбинация обоих агентов не имела статистически значимой усиленной противоопухолевой активности по сравнению с лучшими отдельным средством гидрат гидрохлорида 3-(1-{3-[5-(1-метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила на 12 день (среднее изменение TV в -83%), но препятствовала тому, чтобы опухоли становились устойчивыми к гидрату гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила при непрерывном лечении до 65 дней. Комбинированное лечение не приводило к усилению побочных эффектов по сравнению с монотерапиями.
Комбинация гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила и амида 4-[(S)-2-Азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты в человеческой ксенотрансплантатной модели легких NCI-H441:
Предпосылки: Человеческая модель легких NCI-H441 представляет собой с-Met сверхэкспрессирующую модель опухоли с активированным c-Met путем передачи. Эта модель несет мутацию kras. Данные из литературных источников показали, что в этой модели опухоли присутствует фосфорилирование S6K.
Способ: Самкам бестимусных мышей CD-1 (в возрасте 6-8 недель) подкожно впрыскивали человеческие опухолевые клетки NCI-H441 и разделяли на обработанные группы (8 животных на группу) после того, как опухоль прижилась. Соответствующим группам перорально вводили гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила (100 мг/кг) или 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты амид (30 мг/кг) ежедневно в монотерапии или в комбинации до тех пор, пока опухоль прогрессировала или в течение периода лечения в 78 дней. На 21 день, день прекращения участия группы, получающей носитель, подсчитывали среднее изменение объема опухоли в %. Статистический анализ осуществляли посредством двойственных RM ANOVA. Среднее время до прогрессии опухоли при лечении подсчитывали в конце исследования. Прогрессию опухоли определяют как изменение объема опухоли >73%.
Результаты: Гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила проявил сильную противоопухолевую активность, выраженную в виде стаза опухоли (изменение TV -1%, p<0.0001). При длительном лечении в течение до 78 дней, опухоль становилась устойчивой и прогрессировала (среднее время в 67 дней). Опухоли, обработанные при помощи амида 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты, прогрессировали, что выражалось в среднем изменении TV в 138% и среднем периоде времени в 14 дней до прогрессии опухоли. Комбинация из обоих средств не имела статистически значимой усиленной противоопухолевой активности по сравнению с лучшими единственным средством гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила на 21 день (среднее изменение TV в -16%), но предотвращала опухоли от приобретения устойчивости к гидрату гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила при непрерывном лечении в течение до 78 дней. Комбинированное лечение не приводило усиленным побочным эффектам по сравнению с монотерапиями.
Комбинация из гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила и амида 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты в человеческой, зависимой от HGF ксенотрансплантатной модели легкого Н596:
Предпосылки: Человеческая Н596 модель легкого представляет собой c-Met экспрессирующую паракринную HGF/c-Met опухолевую модель, которая является околомембранной (JM) доменной мутацией c-Met, приводящей к пролонгированной c-Met активации после связывания лигандов HGF. Модель выражает For с активированным c-Met путем. Эта модель несет мутацию PI3KCA (данные из литературных источников).
Способ: Самок гуманизированных HGF SCID мышей (в возрасте 8-10 недель) подкожно впрыскивали человеческие Н596 опухолевые клетки и разделяли на обработанные группы (8 животных на группу) после того, как опухоль прижилась. Соответствующим группам вводили перорально 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил гидрат гидрохлорида (100 мг/кг) или 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты амид (30 мг/кг, с 12 дня - 20 мг/кг) ежедневно в монотерапии или в комбинации пока опухоли прогрессировали или до периода лечения в течение 66 дней. На 14 день, день, когда все еще присутствовали все животные из группы, которой давали лекарственную основу, подсчитывали изменение среднего объема опухоли в %. Статистический анализ осуществляли посредством двойственных RM ANOVA. Среднее время до прогрессии опухоли во время лечения подсчитывали в конце исследования. Прогрессию опухоли определяют как изменение объема опухоли >73%.
Результаты: Оба отдельных средства гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила и амид 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты ингибировали рост опухоли, что выражалось как стаз опухоли на 14 день со средним изменением TV в 35% (p<0.05) и 36% (ns), соответственно. Комбинация из обоих средств обеспечивала усиленную статистически значимую противоопухолевую активность, которая выражалась в регрессии опухоли со средним изменением TV в -50% (p<0.0001) по сравнению с лучшей монотерапией. При монотерапии в течение длительного лечения опухоли прогрессировали, что выражалось в среднем времени до прогрессии опухоли в 24 дня для обеих групп, которых подвергали монотерапии. Комбинированная терапия показала сильную задержку до прогрессии опухоли со средним временем в 66 дней. Комбинированное лечение не приводило к усилению побочных эффектов по сравнению с монотерапиями.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИЯ ПРОИЗВОДНОГО 6-ОКСО-1,6-ДИГИДРО-ПИРИДАЗИНА, ИМЕЮЩЕГО ПРОТИВОРАКОВУЮ АКТИВНОСТЬ, С МЕК ИНГИБИТОРОМ | 2013 |
|
RU2684407C2 |
| ПРОИЗВОДНОЕ 6-ОКСО-1,6-ДИГИДРОПИРИДАЗИНА ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ГЕПАТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫ (ГЦК) | 2013 |
|
RU2650679C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2020 |
|
RU2822063C2 |
| СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ Н4-ГИСТАМИНОВЫХ РЕЦЕПТОРОВ ДЛЯ ЛЕЧЕНИЯ ВЕСТИБУЛЯРНЫХ НАРУШЕНИЙ | 2009 |
|
RU2589846C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНОНА И ПИРИДАЗИНОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПОЛИ(ADP-РИБОЗА) ПОЛИМЕРАЗЫ (PARP) | 2007 |
|
RU2472782C2 |
| ПРОИЗВОДНОЕ ДИГИДРОПИРИДАЗИН-3,5-ДИОНА | 2014 |
|
RU2662832C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ СОЕДИНЕНИЙ ПИРИМИДИНА И ПИРИДИНА С BTK ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2765154C2 |
| ПРОИЗВОДНЫЕ 1-[М-КАРБОКСАМИДО(ГЕТЕРО)АРИЛ-МЕТИЛ]-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДА | 2013 |
|
RU2644761C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2003 |
|
RU2296757C2 |
| 2,5,7-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ОКСАЗОЛПИРИМИДИНА | 2011 |
|
RU2557246C2 |
Описана фармацевтическая комбинация 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата вместе с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты. Комбинация указанных лекарственных средств применяется в лечении рака. Комбинация указанных лекарственных средств обеспечивает усиленную противоопухолевую эффективность без увеличения токсичности. 2 н. и 6 з.п. ф-лы.
1. Фармацевтическая комбинация 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты для применения в лечении заболеваний, выбранных из группы, включающей рак головы, шеи, глаз, рта, горла, пищевода, бронхов, гортани, глотки, грудной клетки, костей, легких, толстой кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, груди, яичников, яичек или других репродуктивных органов, кожи, щитовидной железы, крови, лимфатических узлов, почек, печени, поджелудочной железы, головного мозга, центральной нервной системы, солидных опухолей и переносимых кровью опухолей.
2. Фармацевтическая комбинация по п. 1 гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
3. Фармацевтическая комбинация по п. 1 гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты для применения в лечении рака, выбранного из группы мелкоклеточного рака легких (МКРЛ), немелкоклеточного рака легких (НМКРЛ), плоскоклеточного рака головы и шеи (ПРГШ).
4. Применение 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила или его фармацевтически приемлемой соли и/или сольвата для изготовления лекарственного средства для лечения рака, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
5. Применение по п. 4 гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
6. Применение по п. 4 или 5 гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила для изготовления лекарственного средства для лечения рака, выбранного из группы, включающей колоректальный рак, рак легких, груди, почек и глиобластом, причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
7. Применение по пп. 4, 5 или 6 гидрата гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил для изготовления лекарственного средства для лечения рака, выбранного из группы мелкоклеточного рака легких (МКРЛ), немелкоклеточного рака легких (НМКРЛ), плоскоклеточного рака головы и шеи (ПРГШ), причем лекарственное средство применяют в комбинации с амидом 4-[(S)-2-азетидин-1-ил-1-(4-хлор-3-трифторметил-фенил)-этиламино]-хиназолин-8-карбоновой кислоты.
8. Применение по пп. 4, 5, 6 или 7, причем 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрил или его фармацевтически приемлемую соль и/или сольват или гидрат гидрохлорида 3-(1-{3-[5-(1-Метил-пиперидин-4-илметокси)-пиримидин-2-ил]-бензил}-6-оксо-1,6-дигидро-пиридазин-3-ил)-бензонитрила вводят пациенту в количестве от 250 мг до 12500 мг в неделю.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2019-10-24—Публикация
2015-11-12—Подача